TAREA QUÍMICA
I Período II Tarea



CTP Fernando Volio Jiménez

Alumnos:
Ian Josue Méndez Rojas
Fabiola Sofia Abarca Solano

y
Profesor:
Lic. Emiliano Murillo Murillo
Sección: 12-4
Costa Rica, Cartago 2024
Introducción.
Sustancias Puras. Mezclas.
Características Disol.
Características Grose.
Propiedades Coloides.
Código QR.
Conclusiones.
Introducción
La clasificación de la materia se basa en su composición y propiedades. Se divide en elementos, compuestos y mezclas.
Sustancias Puras
Las sustancias puras son materiales que tienen una composición química uniforme y constante, lo que significa que están formadas por un solo tipo de átomos o moléculas. Esto se traduce en propiedades físicas y químicas específicas y consistentes. Ejemplos
comunes incluyen elementos como el oro y el oxígeno, así como compuestos químicos como el agua y el dióxido de carbono.
Elementos
Son sustancias constituidas por una sola clase de átomo. Algunos ejemplos:
Oxígeno Oro
Hierro

Compuestos
Son sustancias constituidas por diferentes elementos. Algunos ejemplos:
Agua (H²O)
Hidróxido de Carbono (COH²)
Glucosa (C⁶H¹²O⁶)
Mezclas

Una mezcla es una sustancia que está formada por varios componentes (dos o más), que no pierden sus propiedades y características por el hecho de mezclarse ya que no se produce una reacción química entre ellos. Se caracterizan por no poseer una composición química estable, su composición puede variar dependiendo de la cantidad de sustancias que tenga, así como también sus propiedades físicas y qúímicas. Las mezclas se clasifican en homogéneas (disoluciones o soluciones) y mezclas groseras (mecánicas, suspensiones y coloides).

zclas mogéneas
Son aquellas en donde dos o más sustancias mantienen una composición y propiedades uniformes en toda la mezcla apreciando una sola fase.

Algunas caracterísiticas:
No se sedimentan con facilidad.

Se pueden separar por medios químicos, como destilación. cristalización, otras. Presentan una distribución variable de sus propiedades físicas y químicas, ya que dependen de las cantidades de sustancias.
Las disoluciones (Sólido en Líquido), es de las más utilizadas, pues se disuelven por lo general pequeñas cantidades de sustancias sólidas en grandes cantidades líquidas.
Todas las disoluciones tienen dos componentes:
Soluto: Es el componente que están en menor proporción. Con frecuencia cambia de estado. Una disolución puede contender varios solutos.
Disolvente: Es el componente que está en mayor proporción. Este componente no cambia de estado.
Tipos de mezclas
Según su estado de agregación: pueden ser sólidas, líquidas o gaseosas:

Sólido en sólido:
Aleaciones de metales como, por ejempl atón (zinc en estaño), bronce (cobre con hierro) y acero (hierro con carbono).
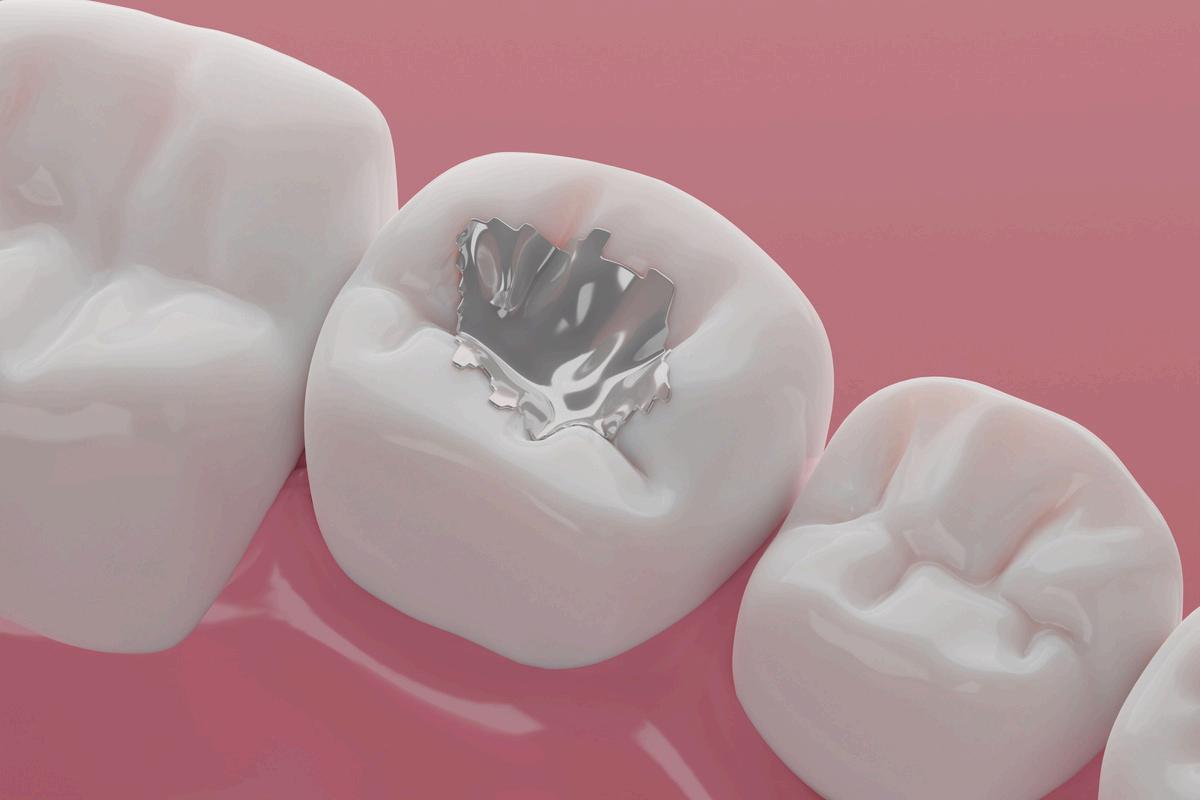
Líquido en sólido:
Amalgama dental (mercurio en plata), mezcla de detergente en polvo y agua, agua con azúcar.

Líquido en líquido:
Alcohol en agua, desinfectante, cloro en agua.

Gas en líquido:
Refresco gaseoso y vapor de agua en el aire.

Gas en gas:
Oxígeno en nitrógeno (aire).

Mezclas Heterogéneas
Es un material compuesto por la unión de dos o más sustancias no vinculadas químicamente. Su característica fundamental es que sus componentes suelen distinguirse fácilmente entre sí. Este tipo de mezcla no es producto de una reacción química, aunque la mezcla en sí misma luego puede dar lugar a algún tipo de reacción.
Se clasifican de acuerdo con el estado en el que se encuentre sus componentes:

Mezclas Groseras
(Sólido-Sólido), ejemplos: gallo pint ensaladas, arroz con pollo, entre otros.

Suspensiones Coloides
(Sólido-Líquido), por ejemplo: agua con tierra, concreto, fresco de frutas, entre otros.

Sustancias intermedias entre las disoluciones y suspensiones constituidos por dos fases: la dispersa y la dispersante. Las partículas coloidales son tan pequeñas que no pueden observarse en el microscopio ordinario y representan una transición entre las disoluciones y las suspensiones. Las partículas que constituyen las dispersiones coloidales se denominan micelas.
Ejemplos: Espuma de afeitar, arcilla en agua, la plata colloidal, la sangre, El queso, etc.
Propiedades de los Coloides
Efecto Tyndall:
Fenómeno que se manifiesta en los coloides que son capaces de dispersar la luz y así se diferencian de una disolución. Ejemplos: Cuando los faros de un carro se usan en la niebla. La luz con menor longitud de onda se dispersa mejor, por lo que el color de la luz esparcida tiene un tono azulado.
Movimiento Browniano:
Es el movimiento aleatorio que se observa en algunas partículas coloidales que se hallan en un medio fluido, debido a su movimiento propio, las moléculas del fluido chocan aleatoriamente con las partículas suspendidas y hacen que estas se muevan.
Código QR
Escaneando este código, podrás ver un video explicativo en el cual nos indagan más con todo el tema de la Clasificación de la Materia:

Conclusiones

03
Es importante conocer la manera en la que la materia se relaciona cotidianamente en nuestras vidas, para poder entender todos estos temas.
Es curioso ver como aspectos como las mezclas, lo hacemos inconscientemente en nuestro día a día, por tal razón deberíamos de conocer de qué manera estas se disuelven y todos sus componentes junto con sus respectivas características.
La Clasificación de la Materia
deja una gran enseñanza, para comprender todo lo que son las Sustancias Puras y Mezclas, así como para tener un margen por el cual guiarnos cuando hablemos científicamente.
¡Muchas gracias!


