bachelor in de agro- en
Inleiding en opbouw van de cursus
Toegepast biologie focust zich voornamelijk op de in vitro teelt van planten. In vitro teelt is een techniek die een belangrijke bijdrage levert aan de moderne tuinbouw. Het in vitro vermeerderen van planten gaat veelal sneller dan via de gewone ‘klassieke’ vermeerderingsmethoden, maar vraagt wel de nodige expertise. Voorts is het ook een belangrijke techniek in de ‘vernieuwing’ van producten. Aan de hand van in vitro technieken kunnen nieuwe rassen gemaakt worden die via de klassieke weg niet mogelijk zijn. Vooral in de interspecifieke hybridisatie van planten is deze techniek van enorm belang, maar ook bv. in de creatie van haploïden, genetische manipulatie van planten en in het kader van protoplastfusies is deze techniek onontbeerlijk.
In vitro cultuur van planten is ook een belangrijke onderzoekstechniek. Vooral de invloed van hormonen op de organogenese van de plant is een belangrijk item waar veelvuldig onderzoek op gedaan wordt.
Het is in de eerste plaats de bedoeling van deze cursus om de student praktisch vertrouwd te maken met de basisprincipes van de in vitro teelt, en de potentiële toepassingen ervan. Hierop wordt in het tweede jaar verder gewerkt.
Daarnaast wordt in deze cursus ook een basis aangeleerd van de meest typische in vivo vermeerderingstechnieken zoals zaaien, stekken en enten. De principes die hier worden gehanteerd zijn veelal vrij gelijkaardig als de technieken die in vitro gebruikt worden.
Wat is in vitro teelt?
In vitro teelt: algemene begrippen en doelstellingen
LEERDOELEN
✓ Algemene begrippen zoals totipotentie en (de)differentiatie kunnen verklaren
✓ De verschillende doeleinden van de in vitro teelt toelichten
✓ De redenen aangeven waarom een kweker voor in vitro cultuur zou opteren
✓ De verschillende fasen van de in vitro cultuur toelichten
1 Wat is in vitro teelt?
• In vivo ↔ in vitro
In vivo = “in het leven”, niet steriel, in volle grond, in serres, op substraten
In vitro = “in glas”, weefselteelt, meristeemcultuur, microvermeerdering Planten telen in steriele en gecontroleerde omstandigheden (bokalen, proefbuizen, kweekkamer).
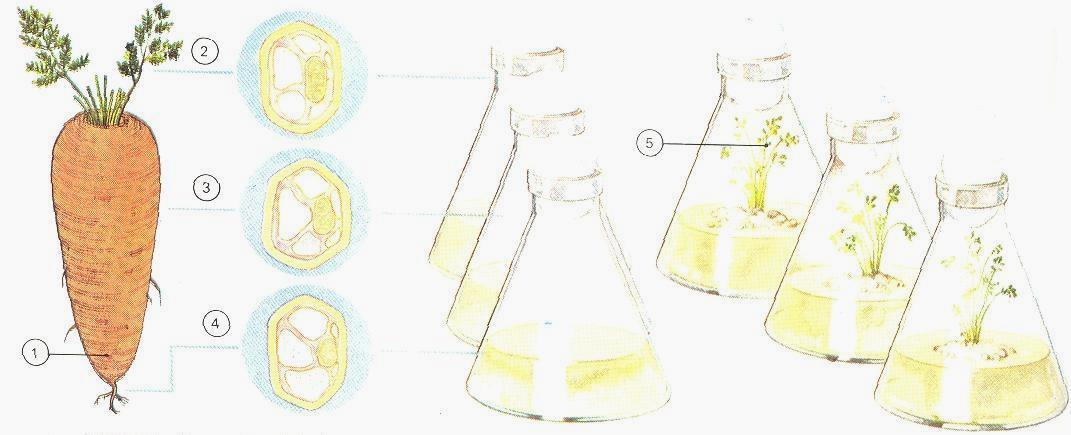
• Gebaseerd op totipotentie: elke cel (i.h.b. een somatische cel) bevat alle informatie opdat er een nieuwe plant uit zou kunnen ontwikkelen (Figuur 1).
Totipotent betekent dat een cel moet kunnen de-differentiëren van een gedifferentieerde cel (i.e. die vorm en functie heeft aangenomen) naar een meristematische (i.e. delende) cel, om vervolgens opnieuw te differentiëren naar een celtype anders dan de oorspronkelijke cel. Een stuk blad of wortel in vitro kan zich volledig gaan herstructureren (callusvorming) zodanig dat hieruit nieuwe organen of volledige plantjes worden gevormd.
2 Doelstellingen van in vitro plantenteelt
Een plant in vitro telen wordt alleen toegepast als daar een bijzonder voordeel aan verbonden is. Wanneer de in vivo teelt alle verlangens kan inwilligen qua reproductievermogen en veredeling, is het niet verantwoord een plant in vitro te brengen. Het domein waar in vitro cultuur van planten economisch de grootste weerklank kent is de vlugge klonale vermenigvuldiging of micropropagatie van planten, al dan niet gecombineerd met het saneren. Om als alternatief voor conventionele vermenigvuldigingstechnieken te dienen, zijn enkele voorwaarden noodzakelijk:
• De culturen moeten op continue wijze tot stand komen uitgaande van een welbepaald en gemakkelijk te verkrijgen plantendeel.
• De culturen kunnen planten voortbrengen onder gedefinieerde omstandigheden.
• De plantjes kunnen gemakkelijk uitgeplant worden in kas of openlucht.
• De cultuur kan ook georganiseerde groei manifesteren na herhaalde subculturen.
• De bekomen planten gelijken op de ouderplant, ook na herhaalde subcultuur.
• De productiviteit van het systeem is vergelijkbaar of beter dan deze van conventionele methodes.
• Het systeem is werkzaam voor verschillende cultivars zonder drastische modificaties.
• De transfer- en manipulatie-arbeid per plant zijn niet overdreven duur.
• De culturen kunnen in stand gehouden worden zonder al te grote zorgen.
Uiteindelijk zal de kostprijs per plant de doorslaggevende factor zijn.
Een aantal redenen die een teler of kweker ertoe kunnen bewegen om het gebruik van in vitro cultuur te overwegen zijn:
• Het aanhouden van de moederplanten in vivo is te duur.
• Vegetatief vermenigvuldigen is in vivo te traag, zoals bij bepaalde boomsoorten
• Nieuwigheden wenst men steeds zo vlug mogelijk op de markt te brengen om maximaal profijt te bekomen. Een nieuwe hybride cultivar kan
ontstaan zijn uit selecties of uit een geluksmutatie. Snelle vermenigvuldiging is dan nodig.
• Fytopathologische problemen (meristeemcultuur, zie verder)
• De behoefte aan grote partijen uniform uitgangsmateriaal.
3 Mogelijkheden en moeilijkheden van de plantenweefselteelt
Globaal genomen zijn er twee types van toepassingen: deze die gebruik maken van de ontwikkeling van voorgevormde organen (axillaire knopontwikkeling; embryocultuur) en andere die gebaseerd zijn op de nieuwvorming van organen (organogenese):
• caulogenese = nieuwvorming van knoppen of adventief knopvorming
• callogenese = vorming van callus
• rhizogenese = nieuwvorming van wortels
• embryogenese = nieuwvorming van embryos (vb somatische embryogenese) In sommige gevallen is er een andere toepassing die enkel gebruik maakt van de cel, zonder dat er orgaanvorming aan te pas komt zoals bij de productie van secundaire metabolieten.
De verschillende doeleinden zijn:
• Micropropagatie: klonale vermenigvuldiging, hoofdzakelijk gebruik makende van axillaire knopontwikkeling of organogenese (nieuwvorming van organen).
• Het saneren van planten: meristeemcultuur (teelt van uiterste groeipunt van plant, dit gaat meestal over 1 mm) kan helpen bij het elimineren van bepaalde virussen.
• Fundamenteel onderzoek: studie plantengroeiregulatoren, correlaties bij de ontwikkeling van organen of fysische invloeden (licht, temperatuur, …) op orgaanvorming en –ontwikkeling.
• Plantenveredeling:
1. embryocultuur: meestal geassocieerd met “embryo rescue”
2. het bekomen van haploïden (halvering van chromosomen) of polyploiden
3. genetic engineering zoals protoplastfusies
4. Cryopreservatie (bewaren van germplasma)
Ondanks deze ruime waaier aan onderzoeksmogelijkheden, mag een resultaat uit in vitro kweek nooit zomaar aanvaard worden voor in vivo planten. De kunstmatige omstandigheden kunnen plantcellen namelijk ingrijpend wijzigen.
Bij weefselteelttechnologie kunnen ook heel wat problemen optreden:
• Contaminaties
• Acclimatisatie
• Bruinverkleuring
• Gasfase
• Fysiologische toestand
• Genetische afwijkingen
Deze worden verder uitvoerig besproken.
4 De verschillende fasen
In vitro FASE 0 Voorbereiding in vivo
Deze fase slaat op de in vivo groei van het uitgangsmateriaal (dat men in vitro wenst te vermeerderen).
Van belang hierbij is
• starten met materiaal dat vrij van zichtbare contaminatie (= besmetting) zoals bv. een schimmelziekte (bv. meeldauw)
• moederplant verkiezen zonder deficiëntieverschijnselen
• watergift: op de grond (nooit op plant)
• snoei toepassen om jonge scheuten te laten uitlopen om in vitro te gebruiken. Zeker bij boomsoorten is het belangrijk om met zo jong mogelijk plantenmateriaal te starten
• de voorbereiding van het plantenmateriaal: lage vochtigheid en relatief hoge temperatuur, gecontroleerde groei in serre is verkieslijk
Het in vivo startmateriaal kan zijn: apexen (= stengel- of wortelgroeitip), slapende knoppen uit bladoksels, zaden of embryo’s, stengel, blad, bloemblad, bolrokken, wortelknollen,…
In vitro FASE 1 Sterilisatie van het uitgangsmateriaal
Deze fase omvat de sterilisatie van het materiaal en groei in vitro zonder contaminatie, m a w de inititatie (= het opstarten) van een aseptische cultuur. Een herhaalbare start met een succespercentage van 20% (d.w.z. 1 op 5 explantaten is gezond en kan aseptisch groeien) is lang niet slecht!
In vitro FASE 2 In vitro vermeerdering
Behoort tot fase 2:
• productie van zoveel mogelijk nieuwe scheuten/planten
• productie van vermenigvuldigingseenheden als knoppen en embryo’s (somatische embryogenese)
• inductie van meristematische centra (adventief of axillair) en hun snelle vermenigvuldiging.
Deze fase gebeurt steeds onder steriele omstandigheden in een laminar flow. Er bestaan verschillende laminar flows (LAF). Bij de horizontale flows wordt de steriele lucht –gesteriliseerd door een HEPA filter- horizontaal over het werkoppervlak geblazen. Dit komt uiteindelijk terecht in de vrije atmosfeer en zodoende ook in het gezicht van de persoon die de behandeling uitvoert. Deze flows mogen dus enkel gebruikt worden wanneer er gewerkt wordt met ongevaarlijke micro-organismen. Bij het gebruik van planten zijn de voorkomende organismen gewoonlijks ongevaarlijk. Bij vertikale flows zit de persoon beschermd achter een schuifglasraam en hebben enkel armen en handen toegang tot het werkoppervlak. De steriele lucht stroomt van boven tot onder aan het werkoppervlak waar de lucht dan weer vooraan en achteraan wordt afgezogen. Deze manier is geschikt voor het werken met meer gevaarlijkere micro-organismen en weefselkweek van dierlijke of menselijke cellen. Bij het gebruik van heel gevaarlijke micro-organismen zoals bv. ebola dient men gebruik te maken van een volledig afgesloten laminar flow waarbij speciale grijparmen voorzien zijn om de voorwerpen vast te nemen.
In vitro FASE 3 Voorbereiding afharding
Kan o a. omvatten:
• scheutstrekking gevolgd door wortelvorming
• verdere in vitro scheutvorming inperken (meestal cytokinine concentratie verlagen)
• in vitro bewortelen of de beworteling op gang trekken (bv door gebruik van auxines die adventiefwortelvorming stimuleren)
In vitro FASE 4 Afharding
Overbrengen van in vitro planten naar in vivo omstandigheden:
• verwijderen van agar, luchtvochtigheidsveranderingen, substraatwijziging (potgrond?). Belangrijk is te beseffen dat een in vitro plantje onder enorm vochtige omstandigheden groeit, er kan dus niet meteen geplant worden onder kameromstandigheden. Er dient een geleidelijke verlaging van luchtvochtigheid te gebeuren bv. in mini-serres.
• Gevaar voor temperatuurschommelingen.
Bereidenvanmedia
LEERDOELEN
✓ Een MS medium (of afgeleiden) correct bereiden vanuit opgegeven stock oplossingen
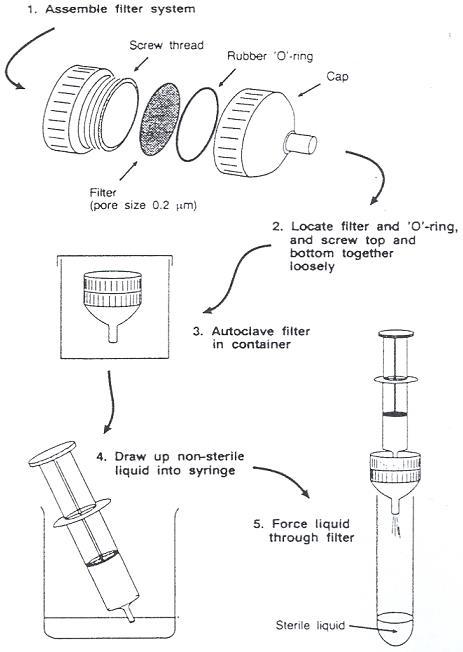
✓ Algemene begrippen als hittelabiel en filtersterilisatie verklaren
✓ Macro- en micro elementen uit een MS medium opsommen
✓ De begrippen EC, zwakke en sterke elektrolyten kunnen uitleggen
✓ Zouten correct in ionen splitsen
✓ Verband tussen concentratie en aard van de ionen en EC uitleggen
✓ Verband tussen de temperatuur en EC uitleggen
✓ De theoretische en praktische EC van voedingsoplossingen berekenen, startende met asgehalte verhoudingen of de samenstelling van een voedingsoplossing.
1 Algemeen schema
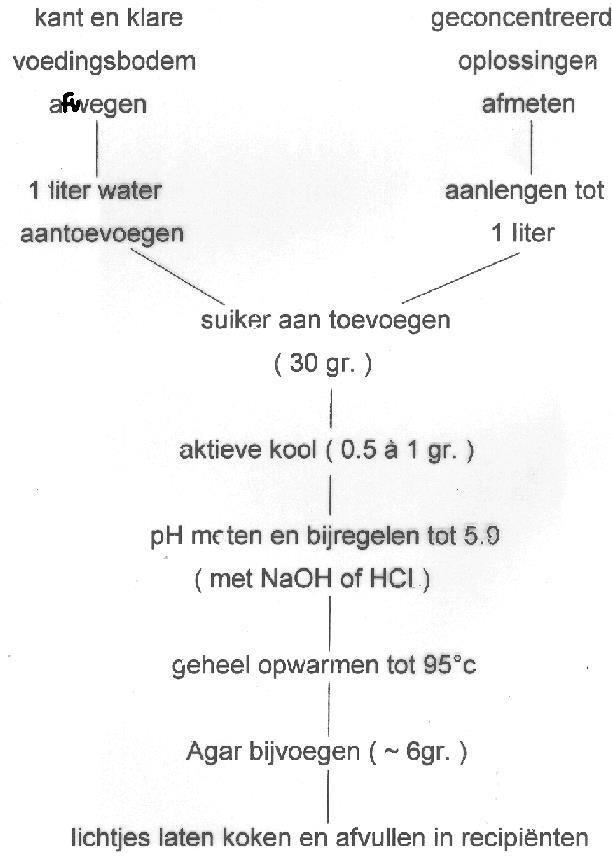
Vervolgens AUTOCLAVEREN om alles te steriliseren. Wanneer hittelabiele componenten aan het medium toegevoegd worden, dan moet dit achteraf gebeuren aan de hand van filtersterilisatie (Figuur 2, Tabel 1).
Tabel 1: Overzicht van hittelabiele mediumbestanddelen. Compound
Heat degradation Reference
ABA Some Sigma catalogue
Adenine sulphate Liau & Boll (1970)
L-ascorbic acid Sigma catalogue
L-Asparagine Liau & Boll (1970)
Ca-panthotenate high Dodds & Roberts (1982); Sigma catalogue
Trans-cinnamic acid Sigma catalogue
Cystine Butenko (1964)
Benzyladenine riboside Sigma catalogue
Choline chloride Liau & Boll (1970)
Folic acid Liau & Boll (1970)
Fructose Inhibitory substances Stehsel & Caplin (1964)
Gibberillic acid Slight Butenko (1964), Watson & Halperin (1984)
L-Glutamine High Liau & Boll (1970), Thompson et al. (1977)
IAA 40% loss in 20 min autoclave Nissen & Sutter (1988); Sigma catalogue
IAA-L-alanine Slight Pence & Caruso (1984); Sigma catalogue
IAA-L-asparagine Marked Pence & Caruso (1984); Sigma catalogue
IAA-glycine Slight Pence & Caruso (1984); Sigma catalogue
IAA-L-phenylalanine Slight Pence & Caruso (1984); Sigma catalogue
IBA 20% loss in 20 min autoclave Nissen & Sutter (1988); Sigma catalogue
Kinetin Some Sigma catalogue
Mail extract Inhibitory substances Solomon (1950)
Nicotinamide Liau & Boll (1970)
Nicotinic acid Liau & Boll (1970)
N,N diphenylurea Activity lost after autoclave Schmitz & Skoog (1970)
Panthotenic acid See Ca-panthotenate
PBA Slight Sigma catalogue
Phloridzin Krikorian et al. (1982)
Pyridoxine Slight Singh & Krikorian (1982)
Riboflavin Liau & Boll (1970), Sigma catalogue
2-iP Some Sigma catalogue
2-iP-ribose Sigma catalogue
Thiamine-HCl (vit.B1) High above pH 5,5 Linsmayer & Skoog (1965), Liau & Boll (1970)
L-tryptophan Butenko (1964), Sigma catalogue
Urea Liau & Boll (1970), Peters & Mayne (1974)
Zeatin Some Sigma catalogue
2 Samenstelling Murashige and Skoog medium
Een van de belangrijkste in vitro media is het Murashige en Skoog (MS) medium. De exacte samenstelling van de zouten bestaat uit:
Macro-elementen (in mg/l):
CaCl2: 332
KH2PO4: 170
KNO3: 1900
MgSO4: 180,54
NH4NO3: 1650
Micro-elementen (in mg/l):
CoCl2.6H2O: 0,025
CuSO4.5H2O: 0,025
FeNaEDTA: 36,70
H3BO3: 6,2
KI: 0,83
MnSO4.H2O: 16,9
Na2MoO4.2H2O: 0,25
ZnSO4.7H2O: 8,6
Het medium is commercieel als een gedehydrateerd poeder beschikbaar (kant en klaar of K.E.K medium) Om bovenstaande concentraties te bereiken dient men ongeveer 4,4 gram op te lossen in 1l demi water. In vele gevallen wordt slechts 1/2 of 1/3 MS gebruikt. Hier wordt slechts 1/2 of 1/3 van bovenstaande concentraties opgelost wat overeenkomt met ongeveer 2,2 of 1,5 gram poeder.
Na toevoegen van suiker en agar en het instellen van de pH kan het medium geautoclaveerd worden. Bepaalde specifieke componenten als hormonen of celcyclusinhibitoren kunnen voor of na autoclaveren nog aan het medium worden toegevoegd, afhankelijk van de hittelabiliteit van de componenten. Tegenwoordig zijn vele commerciële media beschikbaar met variatie in hun samenstelling (vb. Gamborg medium, Anderson medium, Knudson medium, Woody plant medium, …). De juiste keuze van het beste medium is plantafhankelijk.
Het grote nadeel van het gebruik van deze poeders is dat niet gevarieerd kan worden met de exacte samenstelling van de afzonderlijke componenten. In veel gevallen wil men bv. een medium met 1/2 MS macro elementen en de volledige concentratie (1x) micro elementen. Voor bepaalde toepassingen als meristeemculturen of haploiden
Aanleggen van geconcentreerde stockoplossingen voor MS-medium
wordt veelal de hoeveelheid NH4NO3 sterk gereduceerd (1/4 van de MS concentraties). In deze gevallen moet men met geconcentreerde stockflessen tewerk gaan. Via de stockflessen kan men het medium volledig zelf samenstellen en met de afzonderlijk componenten gaan variëren.
3 Aanleggen van geconcentreerde stockoplossingen voor MS-medium
3.1 Stock fles I: zouten met N, K, S en Mg (10x)
Voor de bereiding van één liter van deze stockfles los je volgende hoeveelheden op in 1 liter
• 19g KNO3
• 16,5g NH4NO3
• 3,7g MgSO4.7H2O
Een normaal MS medium bevat per liter slechts één tiende van elke component uit deze fles. Vandaar dat uit deze fles 100 ml dient genomen te worden en verder aangelengd tot 1000 ml om een 10-voudige verdunning te verkrijgen in het uiteindelijk medium.
3.2 Stock fles II: zout met Ca (10x)
Voor de bereiding van één liter van deze stockfles los je volgende hoeveelheden op in 1 liter
• 4,4g CaCl2.2H2O
Vergelijk met de MS samenstelling: via het moleculair gewicht kun je zelf omrekenen dat 4,4g CaCl2.2H2O overeenkomt met 3,32g CaCl2.
3.3 Stock fles III: zout met K en P (10x)
Voor de bereiding van één liter van deze stockfles los je volgende hoeveelheden op in 1 liter
• 1,7g KH2PO4
3.4 Stock fles IV: chelaat met Fe (20x)
Voor de bereiding van één liter van deze stockfles los je volgende hoeveelheden op in 1 liter
• 0,73g FeNaEDTA
3.5 Stock fles V: spoorelementen Co, Cu, B, I, Mo, Zn, Mn (1000x)
Voor de bereiding van één liter van deze stockfles los je volgende hoeveelheden op in 1 liter
• 0,025g CoCl2.6H2O
• 0,025g CuSO4.5H2O
• 6,2g H3BO3
• 0,83g KI
• 0,25g Na2MoO4.2H
• 8,6g ZnSO
• 16,9g MnSO
Merk op dat fles I tot III de macro elementen zijn, fles IV en V de micro elementen.
3.6 Vitamine Stock (frigo) (100x)
In het practicum zal gewerkt worden met een vitamine oplossing die iets anders is qua samenstelling vergeleken met de traditionele MS vitamines. Hiervoor worden in een flesje van 250 ml de volgende hoeveelheden opgelost:
• 12,5mg thiamine.HCl
• 25mg glycine
• 2,5g myo-inositol
• 125mg nicotinezuur
• 12,5mg pyridoxine.HCl
Deze fles is een 100x geconcentreerde oplossing van de vitamine concentraties die in het practicum gebruikt worden. Er zal dus 10ml hiervan in 1 liter verdund worden.
3.7 HormonenStock (frigo) (100x)
Alle hormonenstocks in het labo bezitten een concentratie van 0.5mg/ml
Aanleggen van geconcentreerde stockoplossingen voor MS-medium
3.8 Aanmaak van MS-medium vanuit stockflessen
Voor de aanmaak van een MS bodem dienen van volgende stock oplossingen de gepaste hoeveelheden worden samengebracht in 1 liter:
• Macro-elementen (fles 1, 2, 3): 100 ml
• Fe-bron (fles 4): 50 ml
• Spoor-elementen (Fles 5): 1 ml
• Vitaminen: 10 ml
• Indien nodig: Groeiregulatoren
❖ Alles in maatcilinder naar 1000 ml
❖ Suiker 15-30 g
❖ Indien nodig: Actieve kool 0,5 g
❖ Alles goed oplossen en aanlengen tot 1L
❖ pH – meten en naar 5,8 brengen met NaOH 0,1mol/l
❖ Agar toevoegen ( opgelet voor klontervorming)
❖ Opkoken tot volledig opgelost
❖ Naar buizen,buisjes, bokalen of flessen via dispensor of gieten
❖ Naar autoclaaf ( verwarmingselement onder demi-water )
❖ 121° voor 21 minuten
3.9 Bereiden van plantspecifieke media
Tabel 2 geeft een overzicht van enkele plantspecifieke media die kunnen gebruikt worden in de practica.
Tabel 2: overzicht van enkele plantspecifieke media. Eenheden worden uitgedrukt per liter
1: aan te maken uit verschillende stockflessen (I tot III)
2: aan te maken uit de stockfles van spoorelementen (V) en fles IV
3.10 Type voorbeeld examenvraag
Hoe bereid je 2 liter van onderstaand medium (Bijlage I) vanuit de stockflessen waarvan je de inhoud vindt in bijlage II? Merk op dat de macrozouten slechts op 1/3 MS (Murashige and Skoog) sterkte zijn; de microzouten (of ook sporenelementen) op volle MS sterkte. De specifieke samenstelling van een MS medium staat beschreven in bijlage III. Werk voor elke stockfles duidelijk uit hoeveel ml ik nodig heb om in mijn finaal medium met een volume van 2 liter de goede concentraties te bereiken.
Let op: doordat mijn stockfles CaCl2 leeg is, dien ik een nieuwe fles aan te vullen. Hoeveel gram dien ik op te lossen om een stockfles te bekomen die 20x geconcentreerd is, en hoeveel ml dien ik hiervan over te brengen naar mijn finaal medium?
Bijlage I: samenstelling medium
Bijlage II: Stockflessen
Gegevens per fles van één liter
Stock fles I: zouten met N, K, S en Mg
• 9,5g KNO
• 8,25g NH
• 0,9g MgSO
Stock fles II: zout met Ca
• CaCl2: maak zelf een 20x oplossing aan.
Stock fles III: zout met K en P
• 4,25g KH
Stock fles IV: chelaat met Fe
• 1,46g FeNaEDTA
Stock fles V: spoorelementen Co, Cu, B, I, Mo, Zn, Mn • 0,025g CoCl
0,025g
Stock Vitamines
• 1g thiamine.HCl
• 2g glycine
• 200g myo-inositol
• 10g nicotinezuur
• 1g pyridoxine.HCl
Stock Extra vitamines
• 0,25g Foliumzuur
• 0,025g Biotine
Stock hormonen
• 0.2g 2-ip
• 0.2g BAP
Bijlage III: MS zouten
Macro-elementen (in mg/L):
CaCl2: 332
KH2PO4: 170
KNO3: 1900
MgSO4: 180,54
NH4NO3: 1650
Micro-elementen (in mg/L):
CoCl2.6H2O: 0,025
CuSO4.5H2O: 0,025
FeNaEDTA: 36,70
H3BO3: 6,2
KI: 0,83
MnSO4.H2O: 16,9
Na2MoO4.2H2O: 0,25
ZnSO4.7H2O: 8,6
Oplossing:
Fles I (5x) = 133ml
Fles II (20x of 6,64g/l) = 33ml
Fles III (25x) = 27ml
Fles IV (40x) = 50ml
Fles V (1000x) = 2ml
Vitamines (2000x) = 1ml
Extra vitamines (250x) = 8ml
Hormonen (400x) = 5ml
4 De EC-waarde als maat voor de ionenconcentratie
4.1 Het begrip ‘elektrisch geleidingsvermogen’
Het elektrisch geleidingsvermogen van een oplossing is een maat voor het vermogen van een oplossing om elektrische stroom te geleiden. Het wordt gewoonlijk afgekort als EC, wat is afgeleid van het Engels Electrical Conductivity.
Geleiding is het tegengestelde van weerstand.
De eenheid voor weerstand is Ohm (Ω)
De eenheid voor EC is 1/ohm, of kortweg Siemens (S)
De geleiding van elektrische stroom in een lichaam is evenredig met het kwadraat van de diameter van de doorsnede en omgekeerd evenredig met de lengte
Het geleidingsvermogen van oplossingen wordt vaak gedefinieerd over een kolom met een doorsnede van 1 cm² en een lengte van 1 cm. Het wordt daarom uitgedrukt in S/cm. De eenheid S is vaak te groot en daarom wordt als regel 10-3 S of 10-6 S gebruikt, wat respectievelijk geschreven wordt als mS en µS.
4.2 Elektrolyt oplossingen en EC
Zuiver H2O geleidt geen elektrische stroom. Indien in het H2O echter stoffen worden opgelost die dissociëren in ionen wordt de elektrische stroom wel geleid. Dergelijke stoffen worden elektrolyten genoemd.
Sommige verbindingen splitsen (dissociëren) volledig in ionen en worden sterke elektrolyten genoemd. Keukenzout (NaCl) is zo een verbinding die bij oplossen in water volledig gesplitst is in Na+ en in Cl ionen. De dissociatie van deze sterke elektrolyten verloopt als volgt : NaCl → Na+
Ook zuren en basen zijn elektrolyten. De dissociatie verloopt hierbij als volgt : HNO
Bij zwakke elektrolyten zijn eerder weinig opgeloste moleculen gedissocieerd. De dissociatie wordt gekenmerkt door een evenwicht, aangegeven door " " of
Voorbeelden:
◼ sterke elektrolyten
1. de sterke zuren: HCl, HBr, HI, H2SO4, HNO3, HClO4;
2. de sterke basen: NaOH, KOH, Ba (OH)2 , Ca (OH)2;
3. de zouten: nagenoeg alle zouten zijn sterke elektrolyten, ook de weinig oplosbare zouten kunnen vrij sterke elektrolyten zijn; het gedeelte dat oplost is volledig in ionen gesplitst.
◼ zwakke elektrolyten
1. de zwakke zuren: H2CO3, H3PO4, HCN, HF, HNO2, H2S, CH3COOH (azijnzuur);
2. de zwakke basen: NH3.
Dit betekent dus dat salpeterzuur in water als volgt reageert:
HNO3 + H2O → H3O+ + NO3
terwijl salpeterigzuur hoofdzakelijk onder niet-gedissocieerde vorm in water voorkomt:
HNO2 + H2O H3O+ + NO2
De geleiding van de elektrische stroom vindt als het ware plaats via de elektrisch geladen deeltjes (ionen) die bij de dissociatie ontstaan De deeltjes die wel oplossen, maar geen lading hebben, nemen dus niet deel aan de geleiding en beïnvloeden dus niet het geleidingsvermogen van de oplossing. Dit is bijvoorbeeld het geval met ureum ((NH2)2CO) dat wel goed in H2O oplost, maar niet dissociëert. Hetzelfde is het geval met suikers, eiwitten, agar en tal van andere organische stoffen.
OPDRACHT: SPLITS VOLGENDE MESTSTOFFEN IN IONEN
Voedingszout (meststof) en naam
Ca(NO3)2
MgSO4
KH2PO4
KNO3

K2 SO4
Voorkomen als ionen in oplossing
Mg(NO3)2
NH4NO3
NH4H2PO4
NaH2PO4
NaNO3
KCl
NH4Cl
MgCl2
4.3 Determinanten voor het geleidingsvermogen van een elektrolytenoplossing
4.3.1 Concentratie van de ionen in de elektrolytenoplossing
4.3.2 Aard van de ionen in de elektrolytenoplossing
Illustratie: De invloed van natrium, kalium en calcium, in stijgende concentratie, op de EC.
BESLUIT:
Concentratie van de ionen:
Aard van de ionen:
4.3.3 Temperatuur van de elektrolytenoplossing
De temperatuur van een oplossing heeft invloed op de EC.
Bij elke graad Celcius dat de temperatuur lager of hoger is dan 25°C wordt het geleidingsvermogen of de EC respectievelijk 2% lager of hoger.
Bij 20°C wordt dus maar 90% gemeten van de waarde bij 25°C en bij 30°C wordt 110% gemeten. De meeste moderne EC-meters hebben echter een termistor ingebouwd. De afwijking van de temperatuur wordt hierdoor automatisch gecorrigeerd en uitgedrukt bij een referentie temperatuur. In Nederland wordt hiervoor 25°C aangehouden. In andere Europese landen worden ook wel 18 of 20 °C gehanteerd als referentie.
In voedingsoplossingen wordt de EC opgebouwd uit een aantal verschillende kationen en anionen. Het ene ion beïnvloedt het geleidingsvermogen meer dan het andere, maar het geringere effect van het ene ion zal worden gecompenseerd door een sterker effect van het ander ion. Op deze wijze ontstaat een min of meer gemiddeld effect Tussen de som van de ionen en de EC is daarom een redelijk nauw verband aanwezig. Bij het vaststellen van de som worden de 2-waardige ionen dubbel geteld door hun grotere effect op de EC. Het is daarbij voldoende of de som van de anionen (A-) of de som van de kationen (K+) op te tellen.
De anionen en kationen moeten gelijk zijn en dezelfde relatie hebben met de EC.
In Figuur 3 is de relatie tussen kationen en de EC uitgezet voor een aantal voedingsoplossingen uit steenwolmatten. Globaal kan worden gesteld, dat de kationensom en de anionensom 10x zo groot is als de EC.
TE ONTHOUDEN
De EC geeft de totale zoutconcentratie weer:
hogere EC = meer zouten (ionisch opgelost) aanwezig
Het verband tussen ionenconcentratie en EC is nagenoeg LINEAIR, hierbij geldt als algemene regel:
SOM [ANIONEN] = SOM [KATIONEN] = 10 x ECtheoretisch

[ANIONEN] = concentratie aan anionen (negatieve ionen)
[KATIONEN] = concentratie aan kationen (positieve ionen)
met de concentratie in millimol per liter [mmol/l]
en de EC in millisiemens per centimeter [mS/cm] (bij 25°C)
4.4 EC en gewasontwikkeling
Voor een goede ontwikkeling van het gewas dienen bepaalde hoeveelheden voedingszouten in de voedingsoplossing in het wortelmilieu aanwezig te zijn, waardoor deze oplossing dus een bepaalde EC-waarde zal verkrijgen.
Wordt de EC een beetje opgevoerd boven wat voor de voeding van de plant noodzakelijk is, dan wordt de groei veelal niet beïnvloed. Bij verder toenemen van de EC zal blijken dat na een bepaald niveau de groei gaat afnemen en steeds verder afneemt bij stijging van de EC.
De maximale waarde van de EC (in mS/cm) in het wortelmilieu waarbij nog geen groeiremming optreedt wordt drempelwaarde ECdr genoemd (eenheid van ECdr = mS/cm).
Het percentage waarmee de opbrengst afneemt voor elke eenheid van de EC-waarde (in mS/cm) boven de drempelwaarde, wordt opbrengst afname percentage (OAP) genoemd (eenheid van OAP = % per mS/cm)
Voorbeeld:
Roos versus biet. Roos is zoutgevoelig, biet is zouttolerant.
ECdr (roos) = 1-2 mS/cm ECdr (biet) = 4 mS/cm
OAP (roos) = 10% OAP (biet) = 5%
Duid op Figuur 4 aan hoe je deze ECdr en OAP voor beide gewassen afleest. Noteer ‘zoutgevoelig’ en ‘zouttolerant’ bij de passende curven.
Tussen gewassen bestaan grote verschillen in zoutgevoeligheid.
Een zoutgevoelig gewas heeft een lage ECdr en een hoog OAP
Naarmate de ECdr hoger en het OAP lager wordt bij een bepaald gewas, wordt dit minder zoutgevoelig genoemd.
4.5 Optimale EC

De optimale EC voor veel gewassen ligt tussen 1,5 mS/cm en 2,5 mS/cm
Lage waarden brengen het risico met zich mee dat het niveau van bepaalde voedingselementen te laag wordt, waardoor gebreksziekten ontstaan.
Hoge waarden brengen het risico van groeiremming en opbrengstvermindering met zich mee. Vooral gewassen met een grote voedingsopname, zoals de groentevruchtgewassen verlangen een wat hogere waarde; tussen 2,0 en 2,5 mS/cm.
4.6 Oefeningen op het maken van anionen-kationenbalansen
4.6.1 Aanwijzingen
Je hebt telkens de asgehalte verhoudingen gegeven. Dat is de relatieve aanwezigheid van de belangrijkste elementen zoals ze voorkomen voor een bepaalde plant in vivo.
Aan de hand van deze verhoudingen moet dan gewerkt worden naar een overeenkomstige voeding in het substraat in vivo (bv. hydrocultuur, substraatteelt) of in vitro door gebruik van kunstmeststoffen (anorganische oplosbare zouten): linkerdeel van de ionenbalanstabel.
Om de asgehalte verhoudingen te herleiden naar een concentratie in millimol per liter [mmol/l] moet je weten dat de macro-elementen voorkomen in een beschikbare concentratie van 1 tot 15 mmol per liter vloeibaar voedingsmedium (hydroteelt of in vitro kweekbodem).
Invullen van de ionenbalanstabel gaat door systematisch een deel van het element in de meststoffentabel in te vullen als anion of kation, met in achtname van enkele “regels”.
4.6.2 Opstellen van ionenbalansen
• Start met Ca: alleen Ca(NO3)2 is oplosbaar (als je geen Cl mag gebruiken) en wordt doorgaans gebruikt
• Indien een anionwaarde wordt aangevuld, dan direct de bijbehorende kationwaarde aanvullen en omgekeerd
• Mg gaat enkel via sulfaat of nitraat (als je geen Cl mag gebruiken): kijken wat het best past in de opgave, doorgaans beter via sulfaat toedienen, en best redelijk in het begin van je balansopstelling
• Zoveel mogelijk vanaf de kleinst benodigde waarde de tabel aanvullen
• KNO3 levert N en K, die doorgaans veel nodig zijn; KNO3 houd je best tot ver op het einde van de balansopmaak, het zal je ontbrekende N en K in orde kunnen brengen
• Naar het einde toe: controleren welke elementen nog nodig zijn, je kan nooit een zout gebruiken waarvan bv. alleen het kation mag aanwezig zijn en niet het anion
• Denk bij onjuist uitkomen in eerste plaats aan telfout: correct met de indices rekening houden!
4.6.3 Voorbeeldoefening
Voorbeeldoefening
OPDRACHT: LOS VOLGENDE OEFENINGEN OP VIA EEN IONENTABEL
4.6.4 Oefening A
Asgehalte verhoudingen:
N (anionisch) 105, P 15, S 20, N (kationisch) 5, K 70, Ca 32,5, Mg 10
Voedingszouten (meststoffen): K
4.6.5 Oefening B
Asgehalte verhoudingen:
N (anionisch) 105, P 15, S 22,5, N (kationisch) 5, K 70, Ca 37,5, Mg 7,5
Voedingszouten (meststoffen): MgSO4, Mg(NO3)2, KNO3,
4.6.6 Oefening C
Asgehalte verhoudingen:
N (anionisch) 105, P 15, S 25, N (kationisch) 5, K 70, Ca 37,5, Mg 10
Voedingszouten (meststoffen): zelf kiezen
EC(theor) = EC(prakt) =
4.6.7 Oefening D

Asgehalte verhoudingen:
N (anionisch) 105, P 25, S 17,5, Cl 12,5, N (kationisch) 22,5, K 75, Ca 22,5, Mg 17,5
Voedingszouten (meststoffen): zelf kiezen
EC(theor) = EC(prakt) =
