8 minute read
Hau(p)tsache gut verträglich
Neue Medikamente machen eine vollständige Ausheilung der Hautsymptome bei Psoriasis zunehmend realistisch
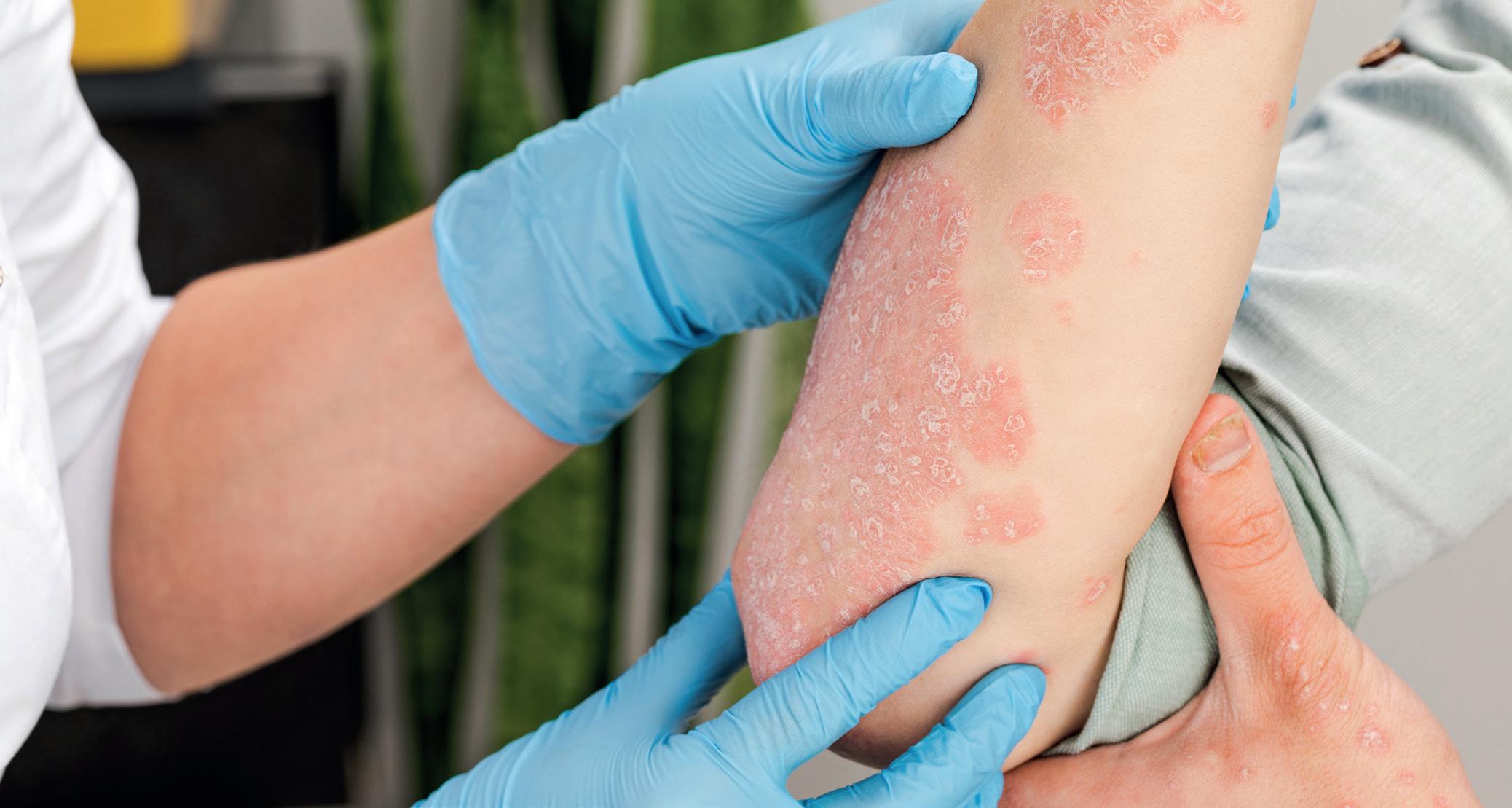
Die Psoriasis ist eine entzündliche Autoimmunerkrankung, die durch T-Zellen vermittelt und durch Zytokine angetrieben wird. Sie geht mit lebenslangen Krankheitsverläufen und einem erhöhten Risiko einher, weitere systemische Erkrankungen wie Diabetes, Hypertonie, ein Metabolisches Syndrom, chronisch entzündliche Darmerkrankungen (CED) sowie kardiovaskuläre Erkrankungen samt ihren Komplikationen zu entwickeln. Eine frühzeitige systemische Therapie lindert nicht nur die Hautsymptome, sondern sie mildert auch die systemischen Entzündungen. Folglich lässt sich damit ebenso die Progression von Komorbiditäten aufhalten. In den pharmakologischen Behandlungsstrategien gilt es, sowohl Wirksamkeit, Sicherheit und Verträglichkeit auf die individuellen Bedürfnisse der Patientinnen und Patienten abzustimmen als auch pathophysiologische Zusammenhänge und Begleiterkrankungen der Psoriasis zu berücksichtigen.
Konventionelle Therapien im Überblick
Eine systemische Behandlung ist bei mittelschwerer bis schwerer Ausprägung der Psoriasis und bei Lokalisation an besonders belastenden Arealen, etwa im Gesicht, an den Händen, im Genitalbereich, sowie bei Beteiligung der Gelenke indiziert. Im klinischen Alltag werden häufig beispielsweise die Immunsuppressiva Methotrexat (MTX) und Ciclosporin verordnet. Methotrexat gehört zur Wirkstoffklasse der Zytostatika: In hohen Dosierungen wird es als Chemotherapeutikum bei malignen Erkrankungen sowie – deutlich niedriger dosiert – als Basistherapeutikum bei Psoriasis eingesetzt. Seine Wirkung erstreckt sich nicht allein auf Entzündungs- und Tumorzellen, sondern sie betrifft alle Körperzellen – insbesondere die sich schnell teilenden Gewebe des Körpers wie Knochenmark und Schleimhäute. Durch Folsäuresubstitution am Folgetag der MTX-Gabe kann das Auftreten von gastrointestinalen Nebenwirkungen und von Hepatotoxizität reduziert werden. Der
Mit einer frühzeitigen Calcineurin-Inhibitor Ciclosporin zeigt unter anderem in der Rescue-Medikatisystemischen Therapie lässt on ein schnelles und gutes Ansprechen. sich auch die Progression von Komorbiditäten aufhalten. Die Nephrotoxizität mit nachfolgender arterieller Hypertonie und multiplen Medikamenteninteraktionen erlaubt jedoch keine langfristige Nutzung. Auch Fumarsäurederivate sind antipsoriatisch wirksam. Gastrointestinale Beschwerden – vor allem Durchfall und erhöhte Stuhlhäufigkeit, die bei bis zu 60 % der Patienten auftreten können – sowie Flush-Symptome stellen die häufigsten Nebenwirkungen dar. >
SCHAMLOSE FREIHEIT 2#,7
ERSCHEINUNGSFREIE HAUT 3*
EFFEKTIV BEI GELENKBESCHWERDEN 1
ANHALTENDE SICHERHEIT & WIRKUNG


4,5 4,6
www.tremfya.at Tremfya® – Freiheit ohne Kompromisse 6*, 4**
RE1
Der erste reine IL-23 Inhibitor mit PSO & PSA-Zulassung9 und Erstattung10
# Tremfya® verbessert nachweislich sowohl den DLQI und den SF-36 MCS (Ref 7) welche neben der Disease Burden mit der Hautscham (skin shame) korrelieren (Ref 2). * VOYAGE 1; komprimärer Endpunkt in Woche 16: PASI 90-Ansprechen im IGA-Score von 0/1 im Vergleich zu Placebo (73,3% vs. 2,9% bzw. 85,1 % vs. 6,9%; jeweils p<0,001). ** DISCOVER-2: 75% der Patienten unter TREMFYA® q8w erreichten ACR20 zu Woche 52 und 74% zu Woche 100 (NRI)4,8 . 1. Mease PJ et al. Lancet 2020;395:1126-1136. 2. Homayoon et al., Relationship Between Skin Shame, Psychological Distress and Quality of Life in Patients with PsO: A Pilot Study. 3. Blauvelt A et al. J Am Acad Dermatol 2017;76:405-417. 4. McInnes IB et al. Efficacy and Safety of Guselkumab, a Monoclonal Antibody Specific to the p19-Subunit of Interleukin-23, Through 2 Years: Results from a Phase 3, Randomized, Double-blind, Placebo-controlled Study Conducted in Biologic-naïve Patients with Active Psoriatic Arthritis , POS1027, EULAR 2021. 5. Griffiths CEM et al. Maintenance of Response Through 5 Years of Continuous Guselkumab Treatment: Results From the Phase 3 VOYAGE 1 Trial. Präsentiert auf dem 16th Annual Coastal Dermatology Symposium. 15.–16. Oktober 2020. 6. Reich K et al. 5-year maintenance of clinical response of clinical response and improvements in health-related quality of life in patients with moderate-to-severe psoriasis treated with guselkumab: results from VOYAGE 1 and VOYAGE 2; BJD 2021. 7. Reich K et al., AAD 2019, P10. 8. McInnes IB et al. Arthritis Rheumatol 2021;73:604-616. (incl. Supplementary). 9. Tremfya® aktuelle Fachinformation, Stand 01/22. 10. 202. Änderung des Erstattungskodex - 28.07.2021 FACHKURZINFORMATION TREMFYA®: Bezeichnung des Arzneimittels: TREMFYA® 100 mg Injektionslösung in einer Fertigspritze, TREMFYA® 100 mg Injektionslösung in einem Fertigpen. Qualitative und quantitative Zusammensetzung: Jede Fertigspritze enthält 100 mg Guselkumab in 1 ml Lösung. Jeder Fertigpen enthält 100 mg Guselkumab in 1 ml Lösung. Guselkumab ist ein rein humaner monoklonaler Immunglobulin G1-Lambda(IgG1λ)-Antikörper (mAk) gegen das Interleukin(IL) 23-Protein, hergestellt durch rekombinante DNATechnologie in einer CHO-Zelllinie (Chinese-Hamster-Ovary). Sonstige Bestandteile: Histidin, Histidinmonohydrochlorid-Monohydrat, Polysorbat 80, Saccharose, Wasser für Injektionszwecke. Anwendungsgebiete: Plaque-Psoriasis: TREMFYA® ist für die Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis indiziert, die für eine systemische Therapie in Frage kommen. Psoriasis-Arthritis: TREMFYA®, als Monotherapie oder in Kombination mit Methotrexat (MTX), ist für die Behandlung der aktiven PsoriasisArthritis bei erwachsenen Patienten indiziert, die auf eine vorangegangene krankheitsmodifizierende antirheumatische (disease-modifying antirheumatic drug, DMARD) Therapie unzureichend angesprochen oder diese nicht vertragen haben. Gegenanzeigen: Schwerwiegende Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Klinisch relevante aktive Infektionen (z. B. aktive Tuberkulose). Inhaber der Zulassung: Janssen-Cilag International NV, Turnhoutseweg 30, B-2340 Beerse, Belgien. Vertrieb für Österreich: Janssen-Cilag Pharma GmbH, Vorgartenstraße 206B, A-1020 Wien. Verschreibungspflicht/ Apothekenpflicht: Rezept und apothekenpflichtig; wiederholte Abgabe verboten. ATC-Code: L04AC16. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit sowie Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. AT_CP-189016_23Feb2022
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Es ist daher wichtig, jeden Verdachtsfall einer Nebenwirkung in Bezug auf „TREMFYA®“ zu melden.

Zytokine und Biologika
An der Pathophysiologie der Psoriasis sind T-Lymphozyten, dendritische Zellen, Makrophagen, neutrophile Granulozyten sowie Keratinozyten beteiligt. Proentzündliche Botenstoffe verändern die Biologie der Keratinozyten und lösen eine fehlerhafte sowie überstürzte Reifung der Epidermiszellen aus. Konsekutiv treten die typischen schuppenden rötlichen Psoriasisläsionen auf. Eine Schlüsselfunktion im Krankheitsgeschehen haben TNF-α und die Zytokine IL-17 und IL-23. Durch Biologika können Zytokine gezielt neutralisiert werden. Von diesen biotechnisch hergestellten Arzneimitteln befinden sich zurzeit elf Präparate zur Behandlung der Psoriasis auf dem Markt, die teilweise auch für die Therapie der Psoriasisarthritis zugelassen sind. Sie unterscheiden sich insbesondere in ihrem Wirkmechanismus und der Darreichung. Zu den Risiken, die grundsätzlich mit Biologika verbunden sind, zählen unerwünschte Arzneimittelwirkungen, hämatologische Störungen, die Entwicklung von Neoplasien (z. B. von nichtmelanomatösem Hautkrebs) sowie ein erhöhtes Infektionsrisiko. Vor allem bei den TNF-α-Blockern besteht die Möglichkeit der Reaktivierung von Infektionskrankheiten, sodass vor Therapiebeginn eine latente Tuberkulose ausgeschlossen werden muss. Ebenso sollte ein Screening auf Hepatitis B und C erfolgen. Psoriasispatienten, die mit IL-17-Inhibitoren behandelt werden, haben außerdem ein erhöhtes Risiko, Candida-Infektionen zu erleiden.
Pathogenese: IL-23 ist Masterzytokin
Neuesten Forschungsergebnissen zufolge spielt vor allem Interleukin 23 als Aktivator der TH17-Zellen eine Schlüsselrolle in der Pathogenese der Psoriasis. Es gibt zwei Untergruppen von TH17-Zellen: einerseits pathogene TH17-Zellen, die Gewebeentzündungen hervorrufen, andererseits nichtpathogene TH17-Zellen, die für die Barrierefunktion im Darmtrakt von Bedeutung sind. Pathogene TH17Zellen sind von IL-23 abhängig und produzieren neben IL-17 auch IL-22, wodurch wiederum die Keratinozyten zur Vermehrung angeregt werden. Zum Beispiel mit dem monoklonalen Antikörper Guselkumab, der als selektiver Interleukin-23-Antagonist früh ins immunologische Geschehen eingreift, steht Menschen mit einer moderaten oder schweren Psoriasis eine neue Therapieoption zur Verfügung.
Hohe Ansprechrate
Die Wirksamkeit und Sicherheit von Guselkumab wurde in drei randomisierten, doppelblinden, aktiv kontrollierten Phase-III-Studien beurteilt: An ihnen nahmen erwachsene Patientinnen und Patienten mit mittelschwerer bis schwerer Plaquepsoriasis teil, die für eine Phototherapie oder systemische Therapie in Frage kamen. Für zwei Studien (VOYAGE 1 und VOYAGE 2) wurden 1.829 Personen untersucht – sowohl placebokontrolliert als auch im Vergleich mit Adalimumab. Insgesamt zeigten unter Guselkumab im Vergleich mit Adalimumab signifikant mehr Patienten ein PASI-90-Ansprechen. Nach einer 24-wöchigen Therapie waren die Vergleichswerte 80,2 % versus 53 %. In beiden Studien fand sich nicht nur eine starke und schnelle, sondern auch eine stabile Wirksamkeit. Bis zur Woche 100 lag die PASI90-Ansprechrate bei 82,1 %. Die Daten zeigen außerdem, dass bei mehr als 50 % der Erwachsenen mit aktiver Psoriasis eine vollständige Ausheilung der Hautsymptome (PASI 100) erzielt wurde. Die Wirksamkeit und die Sicherheit des Wirkstoffs wurden zudem im Rahmen einer doppelblinden Studie (ECLIPSE) im Vergleich zu Secukinumab untersucht. Die Studie schloss 1.048 Personen ein, die entweder Guselkumab (534 Personen) oder Secukinumab (514 Personen) erhielten. 84 % der Patienten mit Guselkumab und 70 % der Patienten mit Secukinumab erreichten nach 48 Wochen einen PASI-90. Insgesamt zeigte Guselkumab ein gutes Verträglichkeitsprofil. Die häufigsten Nebenwirkungen waren Nasopharyngitis, Infektionen der oberen Atemwege und Kopfschmerzen. Spezifische Nebenwirkungssignale wurden bislang nicht beobachtet. Keine der behandelten Personen entwickelte eine anaphylaktische Reaktion oder eine aktive Tuberkulose. Auch konnte kein vermehrtes Auftreten von Candida-Infektionen, Neutropenien und Morbus Crohn dokumentiert werden.
INFO
Psoriasis Area Severity Index (PASI) – Indikator für Krankheitslast und Therapieerfolg
Das Auftreten und der Verlauf einer Psoriasis differieren nicht nur von Patient:in zu Patient:in, sondern auch von Schub zu Schub. Eine gängige Methode, die Schwere der Schuppenflechte mit einem Score-Wert objektiv darzustellen, ist der „Psoriasis Area and Severity Index“ (PASI), der zwischen 0 und 72 liegen kann. Dieser wird gleichermaßen aus der Intensität der Hautläsionen (Induration, Schuppung, Rötung) sowie aus dem Ausmaß der betroffenen Körperoberfläche ermittelt.
Zur Messung des Behandlungserfolgs wird ebenfalls der PASI-Score herangezogen. PASI 75/90/100 ist definiert als Verbesserung des PASI-Scores um mindestens 75/90/100 Prozent gegenüber dem Ausgangswert. Genügte bis vor einigen Jahren noch ein PASI 75, sprich eine 75%ige Besserung des Hautzustands, so ist jetzt ein PASI 90 oder sogar ein PASI 100 – eine vollständige Ausheilung der Hautsymptome – das Therapieziel.
Mag.a Sylvia Neubauer
Literatur: Nast A et al., Deutsche S3-Leitlinie zur Therapie der
Psoriasis vulgaris, adaptiert von EuroGuiDerm –
Teil 1: Therapieziele und Therapieempfehlungen. (2021) J Dtsch Dermatol Ges (in Print). Nast A et al., Deutsche S3-Leitlinie zur Therapie der
Psoriasis vulgaris, adaptiert von EuroGuiDerm – Teil 2:
Therapiemonitoring, besondere klinische Situationen und Komorbidität. (2021). Blauvelt A et al., Journal of Dermatological Treatment, 2021. DOI: 10.1080/09546634.2021.1959504. Reich K et al., Lancet. August 2019. DOI: 10.1016/S01406736(19)31773-8. Reich K et al., British Journal of Dermatology (2021) 185, pp1146–1159. Korman NJ, Br J Dermatol 2020; 182(4): 840-8. Lockwood SJ et al., Karger Kompass Dermatol 2017;5:195-199.





