

ESPECIAL PATOLOGÍA 2024
Nº10 | Abril 2024
6/13
¿QUÉ SABEMOS DE NUEVO SOBRE
STREPTOCOCCUS SUIS? - UNA VISIÓN ACTUALIZADA DE SU SITUACIÓN EPIDEMIOLÓGICA EN ESPAÑA
Máximo Petrocchi Rilo, Óscar Mencía-Ares, César B. Gutiérrez Martín, Alba González Fernández, Rubén Miguélez Pérez, Elena Herencia y Sonia Martínez Martínez Grupo BACRESPI. Departamento de Sanidad Animal, Universidad de León
A través de un análisis detallado de aislados de S. suis de diversas regiones de España, desentrañamos los secretos de esta bacteria comensal convertida en patógeno.
14/22
NUEVAS PERSPECTIVAS SOBRE LA ENFERMEDAD DE LOS EDEMAS EN CERDOS
Panagiotis Tassis
Clínica de Animales de Granja, Facultad de Veterinaria, Universidad Aristóteles de Tesalónica, Tesalónica, Grecia
Avances en el entendimiento de la enfermedad de los edemas que ofrecen nuevas perspectivas sobre su patogénesis, diagnóstico, tratamiento y prevención.
24/33
USO RESPONSABLE DE ANTIPARASITARIOS EN CERDOS
Leyre Sánchez Sánchez de Rojas1, Carolina Rodríguez Sanz2, Luis Agote Casado3 y Raúl Belmar Liberato3 1Técnica superior. Evaluación de preclínica y clínica. Departamento de Medicamentos Veterinarios. AEMPS. 2Evaluadora de preclínica y clínica. Departamento de Medicamentos Veterinarios. AEMPS.
3Jefe de Servicio de preclínica y clínica. Departamento de Medicamentos Veterinarios. AEMPS.
Los antiparasitarios y anticoccidiósicos deben utilizarse cumpliendo las recomendaciones sobre su uso prudente para maximizar su eficacia.
34/43
NOROVIRUS PORCINO: DE PATÓGENO EN EL OLVIDO A POTENCIAL AGENTE ZOONÓTICO
Sofia Lázaro Gaspar, Desirée Martín, Celia Martínez Saz y Alfredo A. Benito EXOPOL S.L.
Primer reporte de la identificación molecular de Norovirus porcino en casos clínicos de procesos digestivos en España.
44/56
COMPLEJO RESPIRATORIO PORCINO: INTERACCIÓN DE LA VACUNACIÓN
FRENTE A PCV2, PRRS Y MYCOPLASMA HYOPNEUMONIAE
Chanhee Chae
Departamento de Patología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional de Seúl, República de Corea
Esta revisión se centra, por un lado, en las interacciones entre PCV2, PRRSV y M. hyopneumoniae y, por otro, en las interacciones entre las vacunas y estos tres patógenos respiratorios.
58/67
ÚLTIMOS AVANCES EN VACUNAS
FRENTE A LA NEUMONÍA ENZOÓTICA PORCINA
César B. Gutiérrez Martín1, Óscar Mencía Ares2 y Sonia Martínez Martínez3
1Catedrático del Departamento de Sanidad Animal de la Universidad de León
2Profesor Ayudante Doctor del Departamento de Sanidad Animal de la Universidad de León
3Profesora Titular del Departamento de Sanidad Animal de la Universidad de León

Revisión sobre las últimas vacunas elaboradas para la prevención de la neumonía enzoótica porcina y su eficacia.
68/74
¿ESTAMOS INMUNIZANDO
ADECUADAMENTE FRENTE A PCV2?
M. Jiménez, M. Marcos y R. Menjón
Servicio Técnico de MSD Animal Health
76/86
FAUNET: UN OBSERVATORIO DE LAS POBLACIONES DE JABALÍ PARA SUSTENTAR POLÍTICAS
PREVENTIVAS FRENTE A LA PESTE PORCINA AFRICANA
Joaquín Vicente1, Mizar Torrijo1, Marta Monfort1, Lorena Fernández-Mercado1, Davide Carniato1, Azahara Gómez-Molina1, Mario Sebastián-Pardo1, Carmen Ruiz-Rodríguez1, José Antonio Blanco1, Javier Fernández-López1, Sonia Illanas1, Vidal Montoro1, Jesús Barba1, Pablo Bernardos2, Daniel Toro2, Mencía Serrano2, Oskar Berdión3 , Carme Rosell4, Joana Colomer4, Carmen Gómez-Peris5 , Juan Miguel Burgui6 , Fernando Escribano7, Carlos Martínez-Carrasco8 , Alberto Fernández-Arias9, Francisco Carro10, Ramón Soriguer10, Pablo Palencia11 y Pelayo Acevedo1
1Instituto de Investigación en Recursos
Cinegéticos, IREC (UCLM-CSIC-JCCM), Ciudad Real
2Subdirección General Adjunto de Producciones Ganaderas y Cinegéticas, Dirección General de,Producciones y Mercados Agrarios, Ministerio de Agricultura, Pesca y Alimentación, Madrid
3ARABA Cazadores Gestión, Elkarteko teknikaria/Técnico de la Asociación, VitoriaGasteiz
4Minuartia, Barcelona
5Servicio de Caza y Pesca, Dirección General de Medio Natural y Evaluación Ambiental, Conselleria de Agricultura, Desarrollo Rural, Emergencia Climática y Transición Ecológica, Valencia
6Assistències Tècniques i Serveis (Caça i Pesca Continental), VAERSA - Departament d'Obres i Projectes, Valencia
7CRFS El Valle, ORTHEM, Murcia
8Departamento de Sanidad Animal (Facultad de Veterinaria), Universidad de Murcia, Murcia
9Servicio de Caza y Pesca de Aragón, Dirección General de Caza y Pesca, Departamento de Agricultura, Ganadería y Alimentación, Zaragoza
10Estación Biológica de Doñana, Consejo Superior de Investigaciones Científicas (CSIC), Sevilla
11instituto Mixto de Investigación en Biodiversidad, Universidad de Oviedo, CSIC, Mieres
El Proyecto FAUNET tiene como objetivo proporcionar datos precisos sobre la densidad de jabalíes en diferentes áreas de estudio en toda España.
87/91
92/96
VACUNAS DE ADN CON NANOPARTÍCULAS LIPÍDICAS:
AVANCES EN EL DESARROLLO DE VACUNAS DE USO VETERINARIO
Hiep Vu
DVM, MSc. PhD Virólogo experto en enfermedades respiratorias, Universidad de Nebraska – Lincoln
Las nanopartículas lipídicas (LNP) han demostrado ser transportadores eficaces para el desarrollo de vacunas basadas en el ADN.
DESENMASCARANDO AL LINAJE PANDÉMICO DEL VIRUS DE LA INFLUENZA PORCINA EN DOS GRANJAS CON DIFERENTE MANIFESTACIÓN CLÍNICA
Salvador Oliver1, Antonio Martínez2, Ana del Valle1 y David Espigares1
1CEVA Salud Animal, Barcelona
2Grupo Vall Companys, Lleida

Agradecemos a nuestros anunciantes por hacer posible la publicación de esta revista: Ceva Salud Animal, Elanco, MSD Animal Health, Vetoquinol y Zoetis.
REDUCE RIESGOS Y MAXIMIZA LA DETECCIÓN DE CELOS


EL ÚNICO SPRAY CON LAS TRES FEROMONAS SEXUALES DEL VERRACO
www.boarbetter.com/es
BOARBETTER® Provee feromonas de verraco para estimular el comportamiento sexual de cerdas en celo. COMPOSICIÓN: Feromonas de porcino BSA*, Quinolina, Androstenona, Androstenol. 0,0020%; ingredientes inertes c.s.p. .100%. *Boar Saliva Analog (BSA- Análogo de Saliva de Verraco). Este producto puede estar protegido por una o varias patentes, o solicitudes de patentes en trámite. INDICACIONES: BOARBETTER® puede usarse solo, sin verraco, o en combinación con un verraco recela para potenciar la exposición a las feromonas. Para obtener buenos resultados, aplicar BOARBETTER® desde el comienzo del celo, generalmente en los días 3-4 después del destete. Aplicar 4 ml de BOARBETTER® en el hocico de la hembra (dirigiéndolo hacia las fosas nasales) antes de comprobar si está en celo • Comprobar el reflejo de inmovilidad aplicando presión sobre el lomo. Si se utiliza inseminación artificial convencional inseminar a la cerda, si está en celo, siguiendo los protocolos específicos de la granja. • Si se utiliza IAPC (inseminación artificial poscervical), esperar 30-60 minutos y siempre de acuerdo a los protocolos IAPC específicos de la granja • Si la hembra no está en celo, repetir la administración del producto hasta que aparezcan signos de celo, siguiendo los protocolos de detección de celo de la granja. Manejo: Usar guantes protectores, ropa protectora, protección ocular y facial. Lavarse las manos después de cada uso. EN CASO DE CONTACTO CON LA PIEL (o el pelo): quítese inmediatamente toda la ropa manchada. Lávese la piel con agua o dúchese. Almacenamiento: Mantener a temperatura ambiente lejos del calor y de la luz. No congelar. Consulte https://www.vetoquinol.com/boarbetter/ip para detalles y estatutos.

EDITORIAL

AVANCES CIENTÍFICOS Y COLABORACIÓN
MULTIDISCIPLINAR
A LA VANGUARDIA EN LA LUCHA CONTRA LAS ENFERMEDADES PORCINAS
¡En el vasto campo de la sanidad porcina, el constante avance de la ciencia emerge como nuestra mejor aliada para superar obstáculos y garantizar la salud y el bienestar animal!
En esta edición especial de porciSapiens sobre Patología, nos embarcamos en un fascinante viaje a través de los avances científicos más recientes, donde el ingenio y la colaboración multidisciplinar convergen para salvaguardar la salud animal y humana, guiándonos hacia un futuro más saludable y próspero para la industria porcina.
Desde el desarrollo de vacunas de ADN con nanopartículas lipídicas hasta los últimos avances en la lucha contra la neumonía enzoótica porcina, el panorama de la investigación veterinaria está repleto de esperanza y optimismo.
La rápida evolución de los virus exige soluciones innovadoras y la aplicación de tecnologías de vanguardia promete revolucionar la forma en la que abordamos las enfermedades virales en el sector porcino.
Pero no solo se trata de afrontar los desafíos presentes, sino también de anticiparse a los que están por venir.
La vigilancia activa de patógenos emergentes, como el norovirus porcino, nos recuerda la importancia de adoptar un enfoque integral de "Una Salud", donde la colaboración entre científicos, veterinarios y autoridades de salud pública se convierte en la clave para proteger la salud animal y humana.
La interacción entre vacunas y patógenos respiratorios nos muestra que el camino hacia la salud porcina óptima no es lineal, pero con una comprensión profunda de estas complejas dinámicas, estamos mejor equipados para tomar decisiones informadas que beneficien a toda la industria.
Por otro lado, no podemos pasar por alto la importancia de la vigilancia y el manejo responsable patógenos como Streptococcus suis y E. coli.
La adopción de prácticas de bioseguridad adecuadas y la aplicación de vacunas efectivas son pilares fundamentales en la protección de nuestro ganado porcino.
Mientras exploramos las complejas interacciones entre patógenos y hospedadores, nos enfrentamos a la realidad de un mundo microbiano en constante cambio. Sin embargo, es en esta complejidad donde encontramos oportunidades para la innovación y la colaboración, reconociendo que nuestro progreso depende de nuestra capacidad para adaptarnos y trabajar juntos en armonía.
Desde el Proyecto FAUNET hasta las perspectivas actualizadas sobre S. suis, nuestra comprensión de las enfermedades porcinas está siendo impulsada por la investigación rigurosa y la colaboración interdisciplinar. Estos esfuerzos colectivos no solo nos ayudan a comprender mejor las enfermedades, sino que también nos brindan las herramientas necesarias para prevenirlas y controlarlas de manera efectiva.
Esta edición especial es un testimonio del espíritu de colaboración y la pasión compartida que impulsa nuestra búsqueda de un futuro más saludable para el sector porcino. A medida que continuamos avanzando, recordemos siempre que nuestro mayor poder reside en nuestra capacidad para unirnos en la búsqueda de un objetivo común: LA SALUD, BIENESTAR Y PRODUCTIVIDAD DE NUESTROS CERDOS.
EDITOR
GRUPO DE COMUNICACIÓN AGRINEWS S.L.
PUBLICIDAD
Laura Muñoz +34 629 42 25 52 laura@mediatarsis.com
Luis Carrasco +34 605 09 05 13 lc@agrinews.es
REDACCIÓN
Daniela Morales
Osmayra Cabrera F.X. Mora
ADMINISTRACIÓN
Mercè Soler
Barcelona
España
Tel: +34 93 115 44 15
info@agrinews.es www.porcinews.com
www.porcinews.com/revista-porcisapiens/
Precio de suscripción anual: España 45 €
Extranjero 120 €
ISSN (Revista impresa) 2696-8142
ISSN (Revista digital) 2696-8151
DIRIGIDA A VETERINARIOS DE PORCINO
Depósito Legal PorciSapiens B 7620-2021
Revista Cuatrimestral
¿QUÉ SABEMOS DE NUEVO
SOBRE STREPTOCOCCUS SUIS?
UNA VISIÓN ACTUALIZADA DE SU SITUACIÓN
EPIDEMIOLÓGICA EN ESPAÑA





Máximo Petrocchi Rilo, Óscar Mencía-Ares, César B. Gutiérrez Martín, Alba González Fernández, Rubén Miguélez Pérez, Elena Herencia y Sonia Martínez Martínez
Grupo BACRESPI.
Departamento de Sanidad
Animal, Universidad de León


Descarga el PDF

SStreptococcus suis, una bacteria aparentemente inofensiva que se encuentra entre los residentes habituales en el ganado porcino, ha adquirido un papel cada vez más preocupante en la salud de estos animales, así como en la salud pública en general. En esta exploración actualizada, nos sumergimos en la situación epidemiológica de S. suis en España, revelando sus múltiples facetas, desde su diversidad genética hasta su problemática relación con los antibióticos. A través de un análisis detallado de 302 aislados provenientes de diversas regiones del país y con distintos estados sanitarios, desentrañamos los secretos de esta bacteria comensal convertida en patógeno.
STREPTOCOCCUS SUIS, ESE COMENSAL PROBLEMÁTICO
Streptococcus suis es una bacteria Gram positiva que forma parte de la microbiota normal de los cerdos, habitando de forma comensal en el tracto respiratorio, intestino, piel y genitales. Esta colonización se produce normalmente por la transmisión de este microorganismo desde la cerda a los lechones en el periparto.
El estrés, desencadenado por diversos factores, como un manejo inadecuado y unas malas condiciones ambientales, favorece que S. suis pueda traspasar las barreras mucosas de los cerdos, accediendo a la circulación sanguínea, donde es capaz de evadir la respuesta inmunitaria del animal. De esta manera, puede diseminarse por el cuerpo, provocando alteraciones graves, como:
Artritis
Endocarditis
Meningitis
Neumonía
Septicemia
Muerte súbita

Comensal en tracto respiratorio, intestino, piel y genitales




Artritis

Circulación





Transmisión vertical de cerda a lechones en el periparto




Endocarditis
Meningitis
Neumonía

Septicemia y muerte súbita
AÚN NO SE CONOCE DEL TODO CÓMO ESTA BACTERIA PUEDE PASAR DE SER UN MERO COMENSAL A CONVERTIRSE EN UNOS DE LOS PATÓGENOS
QUE MÁS PÉRDIDAS ECONÓMICAS PUEDE LLEGAR A PROVOCAR EN LA PRODUCCIÓN PORCINA ESPAÑOLA
ESTRÉS
DIVERSIDAD GENÉTICA
Una de las principales limitaciones para el establecimiento de unas medidas de prevención de las infecciones ocasionadas por S. suis es su gran diversidad genética.
A través de la identificación de diferentes serotipos (variantes) , podemos conocer la situación epidemiológica de los brotes de estreptococia en las granjas y cuáles son los serotipos más peligrosos.
El serotipo 2 es el más predominante a nivel mundial.
El serotipo 9 parece tener también un papel destacado
Su gran diversidad genética explica que, hasta la fecha, no exista una vacuna comercial que proteja eficazmente frente a todos los S. suis.
Esto, sumado a una colonización temprana de los lechones, hace que a menudo sea complicado el control de este patógeno, obligando al uso tratamientos antibióticos, práctica que ha contribuido a su uso excesivo en la producción porcina, especialmente en el periodo postdestete, lo que ha resultado en niveles preocupantes de resistencia a los antibióticos en aislados patógenos de S. suis.
RESISTENCIA ANTIMICROBIANA
S. SUIS ES UN IMPORTANTE RESERVORIO DE GENES DE RESISTENCIA A ANTIBIÓTICOS POTENCIALMENTE TRANSFERIBLES
Los genes que confieren resistencia a los antibióticos son potencialmente movilizables, lo que puede facilitar su transmisión, no solo entre cepas de S. suis, sino a bacterias de otros géneros más alejados, lo que puede complicar aún más el tratamiento de las infecciones bacterianas en cerdos, con el consecuente riesgo para la salud pública.
Dada la problemática que supone S. suis en las granjas españolas y los cambios legislativos sobre el uso de antibióticos en la producción animal, es crucial realizar una investigación actualizada sobre la diversidad genética de S. suis y su resistencia a los antibióticos.
En este artículo presentamos una revisión de 302 aislados de S. suis procedentes de granjas españolas entre 2020 y 2022, analizando tanto su serotipo como su perfil de resistencia a antibióticos.
PRESENTACIÓN DE LOS AISLADOS DE
STREPTOCOCCUS
SUIS RECUPERADOS
DE GRANJAS ESPAÑOLAS
Los 302 aislados incluidos en el estudio proceden de cerdos en periodo postdestete (3-6 semanas de edad) con sintomatología compatible con estreptococia porcina.
LOCALIZACIÓN GEOGRÁFICA DE LOS AISLADOS
La mayor parte de los aislados procedieron de explotaciones ubicadas en Castilla y León (41,4%), dada la localización geográfica de la Universidad de León.
Sin embargo, obtuvimos una muestra representativa de hasta un total de nueve Comunidades Autónomas, que representan el censo mayoritario de la producción porcina de España (Figura 1) destacando el número de aislados procedentes de las granjas de Andalucía (15,6%), Cataluña (14,9%) y Murcia (10,9%).



FIGURA 1
Distribución de los 302 aislados de S. suis en función de la Comunidad Autónoma de origen.

En cuanto a su localización anatómica:
La amplia mayoría (42,4%) fueron recuperados de muestras del sistema nervioso central (SNC) de animales con sintomatología compatible con meningitis estreptocócica.
Fueron frecuentes los aislados procedentes de muestra de pulmón (32,8%) y articulaciones (19,9%) asociadas a casos de neumonía y artritis, respectivamente.
Se obtuvieron algunos aislados de regiones anatómicas mucho menos frecuentes, como el intestino (4,0%), el hígado (0,7%) o el bazo (0,3%).



42,2%
Meningitis estreptocócica
32,2% 19,9%
Neumonía Artritis
¿CUÁLES SON LOS SEROTIPOS
DE STREPTOCOCCUS
SUIS MÁS FRECUENTES EN ESPAÑA?

FIGURA 2 Frecuencia de los serotipos de 302 aislados de S. suis recuperados de granjas porcinas españolas. NT: no tipificado.
Nuestro estudio ha identificado el serotipo 9 de S. suis como el más común en España, representando el 21,2% de los aislados, seguido de cerca por los serotipos 1 (16,2%) y 2 (15,6%).
Estos tres serotipos juntos constituyen más de la mitad de los aislados analizados en este estudio, lo que refleja tendencias similares observadas en otros estudios europeos durante las últimas dos décadas.
ESTA SIMILITUD SUGIERE QUE NUESTRA
Una distribución detallada de los serotipos de S. suis aislados de granjas porcinas españolas está disponible en la Figura 2
SEROTIPO 9
El serotipo 9 es considerado endémico en la producción porcina española y, aunque es considerado menos virulento que el serotipo 2, se está encontrando de forma cada vez más frecuente en cerdos con sintomatología compatible con estreptococia, con evidencia documentada de transmisión a humanos mediante la exposición a productos cárnicos frescos.
Un desafío notable en la investigación ha sido la dificultad para distinguir entre los serotipos 1 y 14 y los serotipos 2 y 1/2, debido a su gran similitud genética. Gracias a la aplicación de una técnica de PCR múltiplex y la posterior secuenciación de los fragmentos, pudimos discernir entre ellos.
Este estudio revela que la abrumadora mayoría de los aislados encuadrados dentro de estos grupos genéticos pertenecían a los serotipos 1 (96,4%) y 2 (78,3%), subrayando la eficacia de nuestra metodología.
ESTE HALLAZGO DEMUESTRA LA SENSIBILIDAD Y ESPECIFICIDAD DE LA TÉCNICA, EVIDENCIANDO SU UTILIDAD PARA SU IMPLEMENTACIÓN EN TÉCNICAS DE DIAGNÓSTICO RUTINARIAS
EL PROBLEMA DE LAS RESISTENCIAS A LOS ANTIBIÓTICOS EN STREPTOCOCCUS SUIS
Nuestra investigación profundizó en el perfil de resistencia a los antibióticos de los aislados de S. suis utilizando la técnica de microdilución en placa de 96 pocillos frente a una selección de 18 antibióticos frecuentemente utilizados en producción porcina.
LOS RESULTADOS REVELARON UNA
RESISTENCIA PREOCUPANTE A VARIOS TIPOS DE ANTIBIÓTICOS
SEROTIPO 2
El serotipo 2 es considerado el más virulento y frecuente en infecciones en cerdos y humanos, si bien en España su prevalencia parece ser menor.


RESISTENCIA
Los aislados de S. suis eran particularmente resistentes a:
Sulfamidas (sulfametoxazol, con un 94,4% de resistencia).
Tetraciclinas (incluyendo oxitetraciclina y clortetraciclina, con un 89% de resistencia).
Lincosamidas (clindamicina, 88,4% de resistencia).
Macrólidos (tulatromicina, tilmicosina y tilosina, 82% de resistencia).
SENSIBILIDAD
En el otro extremo, se identificaron antibióticos que mantienen una eficacia notable frente a infecciones por S. suis:
Ampicilina (7% de resistencia).
Gentamicina (8,9% de resistencia).
Ceftiofur (9,3% de resistencia).
Es especialmente destacable que en la mitad de los antibióticos testados se observaron resistencias superiores al 50%, y hasta el 80% de los aislados fueran resistentes a más de seis antibióticos diferentes.
Un desglose detallado de los antibióticos evaluados está disponible en la Figura 3
Ampicilina
Gentamicina
Ceftiofur
Florfenicol
Espectinomicina
Tiamulina
Penicilina
Trimetoprim - Sulfametoxazol
Enrofloxacino
Danofloxacino
Neomicina
Tulatromicina
Tilmicosina
Tartrato tilosina
FIGURA 3
Distribución de las resistencias a los antibióticos detectadas en los antibiogramas frente a S. suis, expresadas en porcentajes.
Clindamicina
Oxitetraciclina
Clortetraciclina
Sulfadimetoxina
De acuerdo con la clasificación actual de la Agencia Europea del Medicamento (EMA), únicamente tres antibióticos catalogados en la categoría D -uso con prudencia- (ampicilina, espectinomicina y penicilina), demostraron ser altamente efectivos contra los aislados de S. suis en este estudio.
Cabe destacar que, a pesar del uso generalizado de amoxicilina, ampicilina o penicilina) con fines profilácticos durante más de cinco décadas, la mayoría de los aislados clínicos de siendo sensibles a estos antibióticos.
Esto contrasta con la resistencia observada en otros patógenos porcinos, como E. coli enterotoxigénico (ETEC), y sugiere que las infecciones por S. suis todavía pueden ser controladas con antibióticos convencionales, evitando la necesidad de recurrir a opciones de tratamiento de último recurso.
ES CRUCIAL
CONFIRMAR ESTA SENSIBILIDAD ANTES DE PRESCRIBIR LOS ANTIBIÓTICOS EN LAS GRANJAS PORCINAS, GARANTIZANDO UN USO RESPONSABLE DE LOS ANTIBIÓTICOS Y PREVENIR
LA PROPAGACIÓN DE ESTAS RESISTENCIAS
IMPORTANCIA DE LA
Este estudio permite actualizar la situación epidemiológica de S. suis en las granjas porcinas españolas gracias a la caracterización de los serotipos y el estudio de sus perfiles de resistencia a antibióticos.
Aquí, se demuestra que la gran diversidad genética de S. suis obliga a realizar una monitorización activa de los casos compatibles con una infección por este patógeno, de manera que se puedan establecer unas adecuadas medidas terapéuticas, de prevención y control.
TODO ELLO DESTINADO A UN USO RESPONSABLE DE LOS ANTIBIÓTICOS Y A UNA
MEJORA
DE LA SANIDAD EN LAS EXPLOTACIONES PORCINAS, GARANTIZANDO ASÍ UNA MEJORA DE LA SALUD PÚBLICA
Artículo adaptado de Petrocchi Rilo et al. Streptococcus suis Research Update: Serotype Prevalence and Antimicrobial Resistance Distribution in Swine Isolates Recovered in Spain from 2020 to 2022 (2024). https://doi.org/10.3390/vetsci11010040


BIBLIOGRAFÍA
EMA. (2019). Categorisation of antibiotics in the European Union. EMA/CVMP/CHMP/682198/2017. Amsterdam. Retrieved from https://www.ema.europa.eu/en/ documents/report/categorisation-antibiotics-europeanunion-answer-request-european-commission-updatingscientific_en.pdf
Kerdsin, A.; Hatrongjit, R.; Gottschalk, M.; Takeuchi, D.; Hamada, S.; Akeda, Y.; Oishi, K. (2017). Emergence of Streptococcus suis serotype 9 infection in humans. J. Microbiol. Immunol. Infect. 50, 545–546. https://doi. org/10.1016/j.jmii.2015.06.011.
Segura, M. (2020). Streptococcus suis Research: Progress and Challenges. Pathog. 9, 707, https://doi.org/10.3390/ pathogens9090707.
Vötsch, D.; Willenborg, M.; Weldearegay, Y.B.; ValentinWeigand, P. (2018). Streptococcus suis-The «Two Faces» of a Pathobiont in the Porcine Respiratory Tract. Front. Microbiol. 9, 480. https://doi.org/10.3389/ fmicb.2018.00480.
Zheng, H.; Du, P.; Qiu, X.; Kerdsin, A.; Roy, D.; Bai, X.; Xu, J.; Vela, A.I.; Gottschalk, M. (2018). Genomic comparisons of Streptococcus suis serotype 9 strains recovered from diseased pigs in Spain and Canada. Vet. Res. 49, 1. https://doi.org/10.1186/s13567-017-0498-2.
NUEVAS PERSPECTIVAS SOBRE LA ENFERMEDAD DE LOS EDEMAS EN CERDOS

Panagiotis Tassis

Clínica de Animales de Granja, Facultad de Veterinaria, Universidad Aristóteles de Tesalónica, Tesalónica, Grecia
Descarga el PDF

E


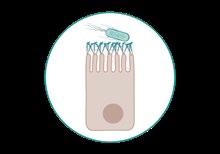
La Enfermedad de los Edemas se diagnostica en granjas porcinas de todo el mundo y suele ocurrir durante el periodo de crecimiento de los lechones7, observándose con mayor frecuencia durante las 2 primeras semanas tras el destete8 debido, principalmente, a la reducción de los anticuerpos maternales durante la transición (disminución de la protección pasiva lactogénica).
Las alteraciones del microbioma y los cambios en la estructura intestinal probablemente aumentan la susceptibilidad de los lechones destetados a las infecciones intestinales y a la Enfermedad de los Edemas. Sin embargo, cabe destacar que esta patología también puede observarse en cerdos jóvenes en fase de engorde7

VT2e
Fimbrias F18 o F4 (K88)
FIGURA 1.
Las cepas de E. coli productoras de toxina Shiga 2e (Stx2e) o verotoxina 2e (VT2e) presentan fimbrias F18 o F4 (K88), designándose comúnmente como E. coli de la enfermedad de los edemas (EDEC) (Creado con BioRender.com).
PATOGÉNESIS DE LA ENFERMEDAD DE LOS EDEMAS
1 2
COLONIZACIÓN
La patogénesis de la enfermedad se inicia con la multiplicación de las bacterias en el tracto digestivo del lechón tras la ingestión oral y la colonización de la mucosa del intestino delgado a través de las fimbrias F18 (raramente F4) que se adhieren al glicocálix de los enterocitos porcinos mediante una interacción adhesina-receptor específica9-12
PRODUCCIÓN DE TOXINAS
Seguidamente, la VT2e producida por las cepas EDEC pasa al torrente sanguíneo induciendo una microangiopatía en las paredes de los vasos sanguíneos, lo que permite la salida de fluidos (la presión sanguínea venosa aumenta hasta 20 mmHg), provocando edemas en distintos órganos.

Además, la α-hemolisina y las enterotoxinas producidas por estas cepas EDEC contribuyen a la patogénesis de la enfermedad13-16, pudiendo generar un cuadro clínico mixto de DPD y Enfermedad de los Edemas en la explotación cuando las cepas de E. coli responsables producen tanto VT2e como enterotoxinas8,17



2. Producción de toxinas
La α-hemolisina y las enterotoxinas estimulan la secreción masiva de fluido hacia la luz intestinal.

1. Colonización
Adhesión de las fimbrias F18 E. coli al glucocálix de los enterocitos (interacción adhesina-receptor).
Edemas

Paso de VT2e a la circulación sanguínea, ocasionando microangiopatía de las paredes de los vasos sanguíneos y edemas en los

FIGURA 2.
E. coli EDEC coloniza la mucosa intestinal del lechón mediante la unión de la fimbria F18 al glucocálix de los enterocitos. La verotoxina 2e (VT2e) producida por la bacteria pasa a la circulación sanguínea, ocasionando una microangiopatía de los vasos sanguíneos y la formación de edemas en distintos órganos. En el caso de la producción simultanea de α-hemolisina y enterotoxinas, el proceso se exacerba con un cuadro de diarrea postdestete (Creado con BioRender.com).
Durante mucho tiempo se ha sugerido que los casos de Enfermedad de los Edemas al inicio de la fase de destete están relacionados con el aumento de los niveles de proteína bruta en los piensos, siendo generalmente los lechones más pesados del grupo los primeros afectados, ya que la mayoría de los que mueren por esta enfermedad se encuentran en buenas condiciones.
En este sentido, según el estudio de de Lange et al.18, los niveles bajos de proteínas son beneficiosos para la salud intestinal de los lechones, ya que el aumento de los niveles de proteínas no digeridas en la luz intestinal (como ocurre con los niveles elevados de proteínas en la dieta) permite la proliferación de bacterias patógenas y la colonización del epitelio intestinal, favoreciendo la producción de toxinas que afectan a la integridad de la barrera intestinal.
Las alteraciones de la barrera intestinal están relacionadas con la producción acelerada de enterocitos que, al ser inmaduros, tienen una función exudativa más que absorbente y permiten un mayor paso a través de la barrera celular de toxinas bacterianas como la VT2e en el caso de la Enfermedad de los Edemas19
CUADRO CLÍNICO Y DIAGNÓSTICOS DE LA
ENFERMEDAD DE LOS EDEMAS
SIGNOS CLÍNICOS
SIGNOS CLÍNICOS
Los signos clínicos agudos de la Enfermedad de los Edemas incluyen:
Muerte súbita y edema subcutáneo en el cuello y la cabeza, más prominente en párpados y frente (Imagen 1)
Vocalizaciones alteradas.
Respiración caracterizada por ronquidos y disnea causada por edema en el sistema respiratorio.
Signos neurológicos que incluyen ataxia, movimientos en círculo, temblor, movimientos de remo en decúbito lateral y estupor debido al edema en el sistema nervioso central15
El curso de la enfermedad en condiciones de campo varía de 4 a 14 días, siendo frecuencia su recurrencia en la misma explotación:
La forma subclínica se describe en cerdos clínicamente normales con lesiones vasculares y disminución de la tasa de crecimiento.
La forma crónica aparece esporádicamente en animales recuperados de casos agudos, lo que se manifiesta con una reducción del crecimiento y signos neurológicos7
Puede resultar en mortalidad debido al edema cerebral en pocas horas, lo que pone de manifiesto el carácter urgente de esta situación clínica, así como la dificultad de las intervenciones terapéuticas y el mal pronóstico de los animales muy afectados con síntomas neurológicos8
Cabe destacar las importantes pérdidas económicas ocasionadas por la Enfermedad de los Edemas.
LA ELEVADA LETALIDAD
(50-90%
EN LOS
CASOS AGUDOS)10 Y LOS COSTES DE LOS ANTIMICROBIANOS UTILIZADOS PARA LA METAFILAXIS DE LA ENFERMEDAD AUMENTAN SUS REPERCUSIONES ECONÓMICAS

IMAGEN 1. Edema de los párpados en un caso agudo de Enfermedad de los Edemas en un cerdo de 70 días de vida.
IMAGEN 2. Edema de mesocolon en un caso agudo de Enfermedad de los Edemas en un cerdo de 70 días de vida.
HALLAZGOS DE NECROPSIA E HISTOPATOLÓGICOS
HALLAZGOS DE NECROPSIA E HISTOPATOLÓGICOS
Los hallazgos de necropsia incluyen: Edema en varios órganos internos, como el estómago (afectando principalmente a la submucosa de la curvatura mayor del estómago) y el mesocolon (Imagen 2).
Hidropericardio.

Necrosis fibrinoide que se desarrolla como consecuencia del daño endotelial que favorece el depósito de fibrina y proteínas séricas en las paredes de los vasos.

La angiopatía degenerativa que afecta a pequeñas arterias y arteriolas, junto con edema asociado de los tejidos circundantes, son los hallazgos microscópicos predominantes en los casos de la Enfermedad de los Edemas7
DIAGNÓSTICO
DIAGNÓSTICO
El diagnóstico de la Enfermedad de los Edemas se basa en:
Los hallazgos clínicos y el historial sanitario de la explotación.
El aislamiento microbiológico: agar sangre de oveja en combinación con medios selectivos (agar MacConkey, Drigalski, Gassner y Hektoen).
Detección molecular de los principales genes de virulencia de la EDEC en los aislados sospechosos: PCR para la identificación de los genes que codifican para las fimbrias VT2e y F18.
UN MUESTREO ADECUADO ES FUNDAMENTAL PARA UN DIAGNÓSTICO PRECISO
Para el diagnóstico de la Enfermedad de los Edemas, el envío de aproximadamente 6 secciones de intestino delgado es significativo, ya que las cepas EDEC no son sistémicas, sino que se distribuyen de forma desigual en el intestino7
Las muestras fecales (por ejemplo, hisopos) y el contenido luminal del intestino delgado distal (por ejemplo, después de la eutanasia) también son matrices de diagnóstico significativas. Además, las muestras ambientales del suelo obtenidas con calzas también se pueden utilizar para el aislamiento bacteriano, mientras que los fluidos orales también sirven para la detección de VT2e por PCR8
Se recomienda remitir muestras de animales infectados de forma aguda que no hayan recibido terapia antimicrobiana.
En cuanto a la forma subaguda o crónica, la identificación de lesiones específicas es crítica, especialmente la arteriopatía subaguda a crónica y posiblemente las lesiones de encefalomalacia focal7 .
Encefalomalacia focal
Fluidos
Orales Contenido intestinal

Arteriopatia
6 secciones

Muestreo de animales con signos agudos y que no hayan recibido tratamiento antibiótico
FIGURA 3.
Muestras de intestino delgado
Muestras ambientales (calzas) Muestras fecales

Cultivo microbiológico

Detección molecular de genes de virulencia
Muestreo para el aislamiento microbiológico de ECED y detección de genes de virulencia (Creado con BioRender.com)
TRATAMIENTO Y PREVENCIÓN DE LA ENFERMEDAD DE LOS EDEMAS
El tratamiento de la Enfermedad de los Edemas se basa en la retirada inmediata del pienso para reducir la colonización bacteriana, junto con medicación en el pienso o en el agua seleccionada en función de las pruebas de sensibilidad de las cepas de EDEC aisladas.
El manejo adecuado y las intervenciones de bioseguridad, así como la vacunación de los animales con vacunas toxoides producidas en base a la toxina VT2e modificada a los 4 días de vida parecen ser el núcleo de un programa de prevención de la Enfermedad de los Edemas en las explotaciones porcinas.
Entre las prácticas de manejo que deben mejorarse se incluyen7,8:
La optimización de las condiciones de alojamiento y ambientales (aproximadamente 29,5°C para los lechones recién destetados).
La mejora de los procedimientos de limpieza y desinfección.
El suministro de agua y espacio para la alimentación suficientes.
El aumento de la fibra bruta y la reducción del contenido de proteína bruta en la alimentación de los lechones al inicio del destete.
La reducción del estrés en el periodo de transición (por ejemplo, evitar la mezcla innecesaria de camadas, la refrigeración y el transporte).
Los resultados de los estudios sobre la vacunación frente a la Enfermedad de los Edemas en las últimas tres décadas han proporcionado hallazgos positivos significativos.
Un extenso metaanálisis reciente (12 estudios que contenían 31 ensayos) realizado por Lee et al.20 destacó los principales hallazgos de los estudios con el uso de vacuna toxoide, antisuero, vacuna de ADN basada en plásmidos o vacuna toxoide recombinante frente a la Enfermedad

La vacuna antisuero actúa como un anticuerpo, bloqueando la movilidad y actividad patógena de las bacterias extracelulares.
Las vacunas toxoide o toxoide recombinante inducen una respuesta de anticuerpos frente a la toxina VT2e, por lo que su actividad se basa en la respuesta inmunitaria humoral.
Las vacunas de ADN basadas en plásmidos generan una respuesta eficaz de anticuerpos frente a los antígenos diana administrados por los vectores, por lo que pueden inducir una defensa frente a la virulencia de las bacterias extracelulares.
Las vías de administración de las vacunas mencionadas fueron oral o subcutánea (2 estudios en total) o, predominantemente, intramuscular.
Los análisis mostraron que los cerdos vacunados presentaban un GMD significativamente mayor y tenían menos probabilidades de morir por la Enfermedad de los Edemas que los animales no vacunados. Además, se observó una reducción significativa de los signos clínicos en los cerdos vacunados en comparación con los no vacunados.
La excreción fecal de vacunados en comparación con los no vacunados. Sin embargo, las observaciones sobre la excreción fecal de EDEC no pudieron confirmarse plenamente debido al número insuficiente de estudios pertinentes.
La comparación entre los diferentes tipos de vacunas demostró que todos los tipos de vacunas habían sido eficaces en la prevención de la Enfermedad de los Edemas, aunque plásmidos demostró ser la más eficaz en la reducción de los signos clínicos y la mortalidad,
EL DESARROLLO DE UNA VACUNA COMERCIAL FRENTE A LA ENFERMEDAD DE LOS EDEMAS BASADA EN PLÁSMIDOS DE ADN PARECE
UN OBJETIVO PROMETEDOR PARA FUTURAS INVESTIGACIONES
PERSPECTIVAS DE FUTURO
FRENTE A DE LOS EDEMAS
Como hallazgo significativo, cabe destacar el de los casos clínicos de la Enfermedad de los Edemas hacia fases de producción más tardías
Como se ha sugerido anteriormente, los casos clínicos se detectan más allá de la fase de destete, afectando a los primeros cerdos de engorde.
En estudios realizados en explotaciones porcinas de EE.UU., se constató que más del 60% de los cerdos experimentaron una infección por EDEC durante el periodo de engorde
Lo más probable es que la reducción del uso de antimicrobianos en las primeras etapas del engorde, la escasa aplicación de medidas de bioseguridad en esa etapa, junto con infecciones intestinales concurrentes por otros patógenos, favorezcan la colonización del intestino por cepas de EDEC.
Tal y como se ha observado en granjas griegas, unos métodos de desinfección inadecuados aumentan significativamente la posible prevalencia de la Enfermedad de los Edemas (datos no publicados). Además, el papel de los productos alternativos a los antibióticos, cambios en la microbiota intestinal podrían afectar a la enfermedad, estos factores.

Otra cuestión que requiere más investigación es el alcance de los daños producidos por los casos subclínicos de Enfermedad de los Edemas.
Estudios anteriores han demostrado que la forma subclínica puede considerarse una situación patológica importante que afecta al crecimiento de los cerdos. Por ejemplo, el daño vascular subclínico puede reducir la GMD de los lechones destetados (8-30 kg de peso corporal)23,24
Hallazgos recientes en granjas griegas han demostrado una prevalencia significativa de cepas de EDEC junto con casos de posible aparición de Enfermedad de los edemas subclínica (datos no publicados).
En las condiciones actuales de aumento de casos de resistencia antimicrobiana de E. coli25 y las restricciones de uso de ZnO, es probable que la relevancia de esta forma subclínica "silenciosa" sea mayor de lo esperado, especialmente si se tienen en cuenta los fenómenos de disbiosis intestinal que podrían producirse tras la colonización intestinal por cepas de EDEC.
ES IMPORTANTE AMPLIAR EN EL FUTURO LA
INVESTIGACIÓN DE
LA PREVALENCIA DE LA ENFERMEDAD DE LOS EDEMAS SUBCLÍNICA Y SUS CARACTERÍSTICAS EN UN MAYOR NÚMERO DE EXPLOTACIONES
BIBLIOGRAFÍA
1. Adewole DI, Kim IH, Nyachoti CM. Gut Health of Pigs: Challenge Models and Response Criteria with a Critical Analysis of the Effectiveness of Selected Feed Additives - A Review. Asian-Australas J Anim Sci. 2016 Jul;29(7):909-24. doi: 10.5713/ajas.15.0795.
2. Szabó C, Kachungwa Lugata J, Ortega ADSV. Gut Health and Influencing Factors in Pigs. Animals (Basel). 2023 Apr 14;13(8):1350. doi: 10.3390/ani13081350.
3. Gresse R., Chaucheyras-Durand F., Fleury M.A., Van de Wiele T., Forano E., Blanquet-Diot S. Gut Microbiota Dysbiosis in Post-weaning Piglets: Understanding the Keys to Health. Trends Microbiol. 2017;25:851–873. doi: 10.1016/j. tim.2017.05.004.
4. Nataro JP, Kaper JB. Diarrheagenic Escherichia coli . Clin Microbiol Rev (1998) 11:142–201. doi: 10.1128/ CMR.11.1.142.
5. Fairbrother JM, Nadeau E, Gyles CL. Escherichia coli in postweaning diarrhea in pigs: an update on bacterial types, pathogenesis, and prevention strategies. Anim Health Res Rev. 2005 Jun;6(1):17-39. doi: 10.1079/ahr2005105.
6. Nagy B and Fekete PZ (1999). Enterotoxigenic Escherichia coli (ETEC) in farm animals. Veterinary Research 130: 259–284.
7. Zimmerman JJ, Karriker LA, Ramirez A, Schwartz KJ, Stevenson GW, Zhang Diseases of swine. 11th ed. Hoboken: Wiley; 2019.
8. Berger PI, Hermanns S, Kerner K, Schmelz F, Schüler V, Ewers C, Bauerfeind R, Doherr MG. Cross-sectional study: prevalence of oedema disease Escherichia coli (EDEC) in weaned piglets in Germany at pen and farm levels. Porcine Health Manag. 2023 Oct 26;9(1):49. doi: 10.1186/s40813023-00343-9.
9. Imberechts H, De Greve H, Lintermans P. The pathogenesis of edema disease in pigs. A review. Vet Microbiol. 1992 Jun 1;31(2-3):221-33. doi: 10.1016/0378-1135(92)90080-d.
10. Casanova NA, Redondo LM, Dailoff GC, Arenas D,
Fernández Miyakawa ME. Overview of the role of Shiga toxins in porcine edema disease pathogenesis. Toxicon. 2018;148:149–54
11. Nagy B, Whipp SC, Imberechts H, Bertschinger HU, Dean-Nystrom EA, Casey TA, et al. Biological relationship between F18ab and F18ac fimbriae of enterotoxigenic and verotoxigenic Escherichia coli from weaned pigs with oedema disease or diarrhoea. Microb Pathog. 1997;22(1):1–11.
12. Coddens A, Diswall M, Angström J, Breimer ME, Goddeeris B, Cox E, et al. Recognition of blood group ABH type 1 determinants by the FedF adhesin of F18-fimbriated Escherichia coli. J Biol Chem. 2009;284(15):9713–26.
13. Moxley RA. Edema disease. Vet Clin North Am Food Anim Pract. 2000;16(1):175–85.
14. Müthing J, Meisen I, Zhang W, Bielaszewska M, Mormann M, Bauerfeind R, et al. Promiscuous Shiga toxin 2e and its intimate relationship to Forssman. Glycobiology. 2012;22(6):849–62.
15. Cornick NA, Matise I, Samuel JE, Bosworth BT, Moon HW. Shiga toxin-producing Escherichia coli infection: temporal and quantitative relationships among colonization, toxin production, and systemic disease. J Infect Dis. 2000;181:242–51.
16. Carr J, Chen SP, Connor JF, Kirkwood R, and Segales J. Pig health. 1st ed. Boca Raton, FL: CRC Press (2018). p. 240. doi: 10.4324/9781315157061
17. Barth S, Tscholshiew A, Menge C, Weiss R, Baljer G, Bauerfeind R. Virulence and fitness gene patterns of Shiga toxin-encoding Escherichia coli isolated from pigs with edema disease or diarrhea in Germany. Berl Munch Tierarztl Wochenschr. 2007;120(7–8):307–16.
18. de Lange C.F.M., Pluske J., Gong J., Nyachoti C.M. Strategic use of feed ingredients and feed additives to

Son esperanzadores los posibles avances en la selección de cerdos con una mayor presencia de loci de resistencia a F18 y F4. Este enfoque parece atractivo para prevenir la Enfermedad de los Edemas, aunque hay que tener cuidado, ya que la selección de cerdos resistentes a F18 y F4 podría conllevar la aparición de otros tipos de fimbrias adhesivas o de nuevas variantes de los tipos conocidos que podrían unirse a receptores aún no identificados7
stimulate gut health and development in young pigs. Livest. Sci. 2010;134:124–134. doi: 10.1016/j.livsci.2010.06.117.
19. Marchetti R, Faeti V, Gallo M, Pindo M, Bochicchio D, Buttazzoni L, Della Casa G. Protein Content in the Diet Influences Growth and Diarrhea in Weaning Piglets. Animals (Basel). 2023 Feb 22;13(5):795. doi: 10.3390/ani13050795.
20. Lee SI, Ntakiyisumba E, Won G. Systematic review and network meta-analysis to compare vaccine effectiveness against porcine edema disease caused by Shiga toxin-producing Escherichia coli. Sci Rep. 2022 Apr 19;12(1):6460. doi: 10.1038/s41598-022-10439-x.
21. Cha W, Fratamico PM, Ruth LE, Bowman AS, Nolting JM, Manning SD, et al. Prevalence and characteristics of Shiga toxin-producing Escherichia coli in finishing pigs: Implications on public health. Int J Food Microbiol. 2018;264:8–15.
22. Tseng M, Fratamico PM, Bagi L, Manzinger D, Funk JA. Shiga toxin-producing E. coli (STEC) in swine: prevalence over the finishing period and characteristics of the STEC isolates. Epidemiol Infect. 2015;143(3):505–14.
23. Kausche FM, Dean EA, Arp LH, Samuel JE, Moon HW. An experimental model for subclinical edema disease (Escherichia coli enterotoxemia) manifest as vascular necrosis in pigs. Am J Vet Res. 1992;53(3):281–7.
24. Leneveu P, Collet J, Sévin J, Durand A, Solignac T, Jardin A, Creac’h P, Amenna N, Turci S, Moalic P, Schüler V. Investigation of subacute edema disease in France. Impact on swine performance. In: Abstract book, 11th European symposium of porcine health management, Utrecht/Netherlands; 2019. p. 201.
25. Rhouma M, Beaudry F, Thériault W, Letellier A. Colistin in pig production: chemistry, mechanism of antibacterial action, microbial resistance emergence, and one health perspectives. Front Microbiol. 2016;7:1789.


USO RESPONSABLE DE ANTIPARASITARIOS EN CERDOS
Descarga el PDF





Leyre Sánchez Sánchez de Rojas, Técnica superior. Evaluación de preclínica y clínica. Departamento de Medicamentos Veterinarios. AEMPS.
Carolina Rodríguez Sanz, Evaluadora de preclínica y clínica. Departamento de Medicamentos Veterinarios. AEMPS.
Luis Agote Casado, Jefe de Servicio de preclínica y clínica. Departamento de Medicamentos Veterinarios. AEMPS.
Raúl Belmar Liberato, Jefe de Servicio de preclínica y clínica. Departamento de Medicamentos Veterinarios. AEMPS.
LLA
a presencia de parásitos (tanto internos como externos) en las granjas es uno de los principales problemas de la producción porcina, existiendo una gran cantidad que pueden afectar a los cerdos, provocando problemas de sanidad y bienestar animal, salud pública y perjuicios económicos. Para luchar contra ellos, se utilizan diferentes estrategias, entre las que destaca la administración de medicamentos veterinarios frente a los parásitos. La elección de estos medicamentos se hace teniendo en cuenta distintos factores, siendo uno de los principales la clase de parásito de que se trate.

APARÁSITOS QUE AFECTAN AL GANADO PORCINO
Las principales clases de parásitos que afectan al ganado porcino son:
Protozoos, entre los que destacan los coccidios, y dentro de éstos, los géneros Eimeria y Cystoisospora.
Nematodos (gusanos redondos), siendo las principales familias (y especies) que afectan a los cerdos:
Ascáridos (Ascaris suum).
Tricúridos (Trichuris suis).
Estrongiloides (Strongyloides ransomi).
Metastróngilos (Metastrongylus spp.).
Ancylostomas.
Triquinelas (Trichinella spirallis).
Cestodos (gusanos planos), entre los que destacan los géneros Taenia y Echinococcus.
Ectoparásitos localizados sobre la piel o superficie externa del animal, incluyendo, por ejemplo, la sarna sarcóptica (Sarcoptes scabiei) o los piojos del género Haematopinus.
Las parasitosis pueden clasificarse también dependiendo de los siguientes factores:
Localización anatómica del parásito:
Parásitos que se encuentran en el estómago, como los géneros Trichostrongylus o Hyostrongylus.
Parásitos del intestino delgado, por ejemplo, los coccidios o nematodos de los géneros Ascaris o Strongyloides.
Parásitos del intestino grueso, tales como los géneros Trichuris o Oesophagostomum.
Parásitos que se localizan en el riñón, como el género Stephanurus.
Parásitos que se encuentran en el pulmón, como Metastrongylus.
Parásitos de la piel, como los ácaros del género Sarcoptes o los piojos del género Haematopinus.
Edad de los animales:
En lechones recién nacidos o lactantes nos encontramos sobre todo Cystoisospora suis, Strongyloides y Sarcoptes scabiei.
En lechones de cebo existe mayor prevalencia de nematodos como Ascaris suum o Trichuris suis.
En reproductores es común encontrar Oesophagostomum spp. o Hyostrongylus rubidus.
Sistema de manejo de los animales:
En explotaciones en intensivo, las medidas de higiene son habitualmente más estrictas, por lo que hay menor acceso de los animales a las heces y se reduce la presencia de hospedadores intermedios. Son frecuentes las coccidiosis producidas por Cystoisospora suis, infecciones producidas por Ascaris suum y sarna sarcóptica (Sarcoptes scabiei).
En caso de explotaciones en extensivo, los animales tienen acceso a la tierra y al pasto donde existe una mayor presencia de hospedadores intermediarios. Son frecuentes las infecciones por Hyostrongylus rubidus, Ascaris suum, Trichuris suis y Metastrongylus, así como ectoparasitosis causadas por Sarcoptes scabiei y Haematopinus suis.

Un factor importante en relación a las parasitosis porcinas es que algunas de ellas son enfermedades zoonósicas, es decir, que pueden transmitirse a las personas.
Entre ellas, destacan la triquinelosis (producida por Trichinella spiralis), la hidatidosis (producida por Echinococcus granulosus), la toxoplasmosis (producida por el protozoo Toxoplasma gondii) y la cisticercosis (causada por Taenia solium).
Entre las principales consecuencias negativas que tienen las parasitosis en las explotaciones porcinas se encuentran la producción de enfermedad clínica en los animales, la alteración del apetito y reducción de la absorción de nutrientes, provocando retraso en el desarrollo y reducción de los parámetros productivos, lo que conlleva notables pérdidas económicas. Además, suponen un reto desde el punto de vista del manejo y mantenimiento de buenas condiciones de sanidad y bienestar animal en las explotaciones (muchos parásitos son muy difíciles de eliminar de las granjas), y un potencial problema de salud pública, debido al carácter zoonósico de muchas parasitosis.
Taenia spp.
Eimeria spp.


Echinococcus spp.

Sarcoptes scabiei
FIGURA 1
Principales parásitos que afectan al ganado porcino y clasificación general de las parasitosis en función de su localización anatómica, el sistema de manejo, la edad de los animales y su carácter zoonótico (Creado con BioRender.com).

Cystoisospora spp.

Producción intensiva (Cystoisospora suis, Ascaris suum y Sarcoptes scabiei)

Producción extensiva (Hyostrongylus rubidus, Ascaris suum, Trichuris suis, Metastrongylus, Sarcoptes scabiei y Haematopinus suis)
Piel (Sarcoptes y Haematopinus)
Ascáridos (Ascaris suum)
Pulmón (Metastrongylus)

Tricúridos (Trichuris suis)
CESTODOS NEMATODOS

PRINCIPALES PARÁSITOS QUE AFECTAN AL GANADO PORCINO PROTOZOOS
ECTOPARÁSITOS



Estrongiloides (Strongyloides ransomi)
Estómago (Trichostrongylus e Hyostrongylus) Riñón (Stephanurus)


SISTEMA DE MANEJO
Lactación
Cystoisospora suis, Sarcoptes scabiei
Haematopinus spp.

Ancylostomas
Metastróngilos (Metastrongylus spp.) (Trichinella spirallis)
Intestino grueso (Trichuris y Oesophagostomum)
Intestino delgado (Coccidios, Ascaris y Strongyloides)

Triquinelosis (Trichinella spiralis)
CLASIFICACIÓN DE LAS PARASITOSIS PORCINAS
LOCALIZACIÓN ANATÓMICA EDAD DE LOS ANIMALES
Cebo


ZOONOSIS


Ascaris suum y Oesophagostomum spp. y Hyostrongylus rubidus
Hidatidosis (Echinococcus granulosus)
Toxoplasmosis (Toxoplasma gondii)
Cisticercosis (Taenia solium)
MEDICAMENTOS ANTIPARASITARIOS
AUTORIZADOS
PARA CERDOS
En España, los medicamentos antiparasitarios autorizados en porcino se clasifican en dos grandes grupos:
Antihelmínticos.
Ectoparasiticidas.
ANTIHELMÍNTICOS
Entre los antihelmínticos disponibles se encuentran benzimidazoles (fenbendazol, flubendazol, oxibendazol), imidazoles (levamisol) y lactonas macrocíclinas (ivermectina, doramectina), todos ellos en diversas formas farmacéuticas.
BENZIMIDAZOLES
BENZIMIDAZOLES
Los benzimidazoles (fenbendazol, flubendazol, oxibendazol) se unen a la tubulina del nematodo (proteína necesaria para la formación y viabilidad de los microtúbulos) en las células intestinales absorbentes del parásito. La ausencia de microtúbulos impide la absorción de nutrientes, conduciendo a la muerte por inanición.
Existen diferencias estructurales entre la tubulina de los mamíferos y de los helmintos, por lo que la toxicidad de estos compuestos para los mamíferos es mucho menor que para los parásitos.
LEVAMISOL
LEVAMISOL
El levamisol es un antihelmíntico sintético perteneciente al grupo de los imidazoles que ejerce su acción sobre el sistema neuromuscular del parásito, inhibiendo la acetilcolinesterasa, lo que provoca una contracción muscular sostenida, seguida de relajación y parálisis irreversible del parásito, bloqueando también el metabolismo de los glúcidos del parásito.
LACTONAS MACROCÍCLICAS
LACTONAS MACROCÍCLICAS
Las lactonas macrocíclicas (ivermectina, doramectina) actúan inhibiendo los impulsos nerviosos del parásito al unirse selectivamente y con alta afinidad a los canales de cloro dependientes de glutamato presentes en los nervios y en las células musculares de los invertebrados. Esta unión da lugar a un incremento de la permeabilidad de la membrana celular a los iones cloruro, produciendo la hiperpolarización del nervio o de la célula muscular, ocasionando la parálisis y muerte del parásito.

El efecto selectivo hacia los invertebrados se debe a que los mamíferos no poseen canales de cloro asociados a glutamato.

TABLA 1
Antihelmínticos autorizados para porcino en España.
LAS LACTONAS MACROCÍCLICAS TAMBIÉN SON ECTOPARASITICIDAS, CONSIDERÁNDOSE ESTOS FÁRMACOS COMO ENDECTOCIDAS
Familia de antihelmínticos Compuesto Mecanismo de acción
BENZIMIDAZOLES
Fenbendazol Flubendazol Oxibendazol
IMIDAZOLES Levamisol
LACTONAS MACROCÍCLICAS Ivermectina Doramectina
Unión a tubulina, impidiendo la formación de microtúbulos y la absorción de nutrientes.
Inhibición de la colinesterasa, conduciendo a parálisis irreversible.
Unión selectiva a canales de cloro dependientes de glutamato, conduciendo a parálisis y muerte.
Por último, habría que considerar los medicamentos anticoccidiósicos. Al tratarse de fármacos antiprotozoarios, estos fármacos están incluidos dentro de los antimicrobianos y no de los antiparasitarios, de acuerdo con la definición del Reglamento 2019/6.
Dentro de este grupo, la única sustancia activa autorizada para cerdos es el toltrazurilo, que actúa contra todos los estadios de desarrollo intracelular del coccidio, tanto la fase asexuada como la sexuada.
USO DE MEDICAMENTOS
ANTIPARASITARIOS
EN CERDOS
El Reglamento 2019/6 establece que los medicamentos veterinarios se utilizarán según los términos de la autorización de comercialización.
USO PRUDENTE DE LOS ANTIPARASITARIOS
Tradicionalmente, el uso de los medicamentos veterinarios antiparasitarios se ha basado en el tratamiento sistemático en masa o en aplicaciones preventivas. Si bien pueden considerarse apropiadas en ciertas situaciones, actualmente estas prácticas deben reconsiderarse debido a los desafíos emergentes, como:
Riesgos medioambientales.
Reducción de la inmunidad antiparasitaria.
Desarrollo y diseminación de resistencias antiparasitarias.
EL DESARROLLO DE RESISTENCIAS PUEDE MITIGARSE OPTIMIZANDO LA EXPOSICIÓN A LOS MEDICAMENTOS ANTIPARASITARIOS, CON PAUTAS POSOLÓGICAS MÁS RACIONALES Y APLICANDO PRÁCTICAS ORIENTADAS HACIA LOS TRATAMIENTOS DIRIGIDOS Y MECANISMOS DE CONTROL INTEGRADOS
La frecuencia de administración y la repetición de los tratamientos deben estar basados en las necesidades médicas y/o epidemiológicas, evitando la administración sistemática de los antiparasitarios, su administración en grupos numerosos de animales, durante periodos determinados del año o su uso rutinario o a largo plazo.
De esta forma, la información del medicamento proporcionada a los veterinarios y los usuarios finales es muy importante para llevar a cabo un uso apropiado y racional de los antiparasitarios, incluyendo detalles lo más específicos posible para cada medicamento, tales como:
Vía de administración.
Formulación.
Parásitos de destino.
Indicaciones terapéuticas.
Desde la Agencia Europea del Medicamento (EMA), se han impulsado una serie de recomendaciones de uso prudente que se deben incluir en la ficha técnica de los medicamentos antiparasitarios.
USO PRUDENTE DE ANTIPARASITARIOS
USO PRUEDENTE DE ANTIPARASITARIOS
De acuerdo con estas recomendaciones, los antiparasitarios solo deben utilizarse cuando sean necesarios desde un punto de vista médico y/o epidemiológico, basándose en un diagnóstico parasitológico y en la evaluación de ciertos factores, como el medioambiente en el que estén los animales y el modo de vida de los mismos. Por ello, la información de estos medicamentos incluye recomendaciones de uso prudente, como:
La necesidad de llevar a cabo una identificación apropiada de las especies parasitarias relevantes (según la disponibilidad de los test diagnósticos).
La evaluación del estado del rebaño, determinando qué animales o subgrupo de animales necesitan ser tratados según su carga parasitaria o su estado fisiológico o clínico.

PREVENCIÓN DE LA REINFECCIÓN Y DISMINUCIÓN DE LA NECESIDAD DE ANTIPARASITARIOS
PREVENCIÓN DE LA REINFECCIÓN Y DISMINUCIÓN DE LA NECESIDAD DE ANTIPARASITARIOS
Se deben tener en cuenta todas las medidas complementarias que se puedan tomar para evitar la reinfección de los animales o que ayuden a reducir el uso de los antiparasitarios, como:
tratamiento de las fases parasitarias en el medio ambiente en el que se encuentren los animales.
medidas de higiene o métodos no químicos para reducir la carga parasitaria.
Medidas específicas de manejo de los animales.
Cuando existan datos disponibles, la información del medicamento incluirá datos actualizados sobre la prevalencia de resistencia al principio activo en el/los parásito/s relevante/s, especialmente a nivel
En algunos casos, puede incluirse también información sobre métodos de detección de resistencia a los antiparasitarios, si bien esto normalmente se establece caso por caso.
PAUTAS POSOLÓGICAS
PAUTAS POSOLÓGICAS
Un punto fundamental para garantizar el uso prudente de los antiparasitarios es establecer unas pautas posológicas apropiadas, , que es uno de los principales factores que selección de resistencia.
Asimismo, es importante que los medicamentos tengan unas pautas
número de administraciones
necesario entre administraciones para asegurar la eficacia frente a los parásitos
La necesidad de llevar a cabo

Estas decisiones deben estar basadas en los datos disponibles y deben tener en cuenta la situación epidemiológica local y las circunstancias concretas de los animales en la explotación.
USO DE COMBINACIONES DE PRINCIPIOS ACTIVOS
USO DE COMBINACIONES DE PRINCIPIOS ACTIVOS
En caso de medicamentos que contengan 2 o más principios activos, su uso solo podrá aceptarse cuando el diagnóstico etiológico muestre que son necesarios ambos principios activos simultáneamente debido a la presencia de todos los parásitos de destino en el animal.
USO PRUDENTE DE ANTICOCCIDIÓSICOS
Aunque, como hemos comentado anteriormente, los anticoccidiósicos se consideran antimicrobianos de acuerdo con la legislación actual, su uso prudente se menciona a continuación, ya que los mecanismos de resistencia de los coccidios presentan más similitudes con los de los parásitos. La mayoría de los medicamentos anticoccidiósicos autorizados en España tienen como indicación la prevención de la aparición de signos clínicos en granjas con historia previa de coccidiosis.
ESTOS MEDICAMENTOS CON UNA INDICACIÓN
DE PROFILAXIS SE DEBEN ADMINISTRAR EN EL PERIODO PREPATENTE DE LA ENFERMEDAD, ES
DECIR, ANTES DE QUE APAREZCAN LOS SIGNOS CLÍNICOS (FUNDAMENTALMENTE DIARREA)
Esto se debe a la baja eficacia que muestran los tratamientos cuando se administran una vez que los signos clínicos han aparecido.
La elevada persistencia de los ooquistes en el medio ambiente, la rápida diseminación de la enfermedad en el grupo y la aparición casi simultánea de los signos clínicos en todos los animales hacen que la administración preventiva sea más eficaz para controlar las coccidiosis. No obstante, este uso debe llevarse a cabo de acuerdo con las restricciones establecidas en la nueva legislación de medicamentos veterinarios (Reglamento 2019/6).
El Reglamento 2019/6 es mucho más restrictivo cuando se refiere a antimicrobianos y establece que éstos no se utilizarán con fines profilácticos salvo en casos excepcionales, administrados en un animal determinado o un número limitado de animales, cuando el riesgo de infección o de enfermedad sea muy elevado y las consecuencias puedan ser graves.
En este sentido, el uso de los anticoccidiósicos para la prevención de la aparición de signos clínicos en las condiciones de uso que se mencionaron anteriormente se considera un uso profiláctico. Generalmente, este uso podría aceptarse siempre que se cumplan las condiciones establecidas en el Reglamento:
QUE EL RIESGO DE INFECCIÓN EN LA EXPLOTACIÓN SE CONSIDERE ALTO Y LAS CONSECUENCIAS SEAN GRAVES

Entonces se consideraría un caso excepcional, siempre que el tratamiento esté restringido a un número limitado de animales (por ejemplo, lechones neonatos, que es lo habitual para este tipo de tratamientos, ya que son los animales más susceptibles a la infección).
Al igual que en el caso de los antiparasitarios, la EMA ha publicado una serie de recomendaciones de uso prudente dirigidas a incluirse en la ficha técnica de los antimicrobianos autorizados en la Unión Europea. La ficha técnica también debería incluir la necesidad de medidas de higiene y las recomendaciones de manejo.

FASE I
AUTORIZACIÓN DE MEDICAMENTOS VETERINARIOS ANTIPARASITARIOS
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) se encarga de la autorización de los medicamentos a nivel nacional, así como de las actividades de farmacovigilancia de los medicamentos ya autorizados.
Cabe destacar una serie de particularidades en la autorización de nuevos medicamentos antiparasitarios, de acuerdo al Reglamento 2019/6.
RESISTENCIAS Y RIESGOS PARA PERSONAS Y ANIMALES
Entre los requisitos de la documentación técnica, se exige abordar la aparición de resistencia y riesgo, tanto para las personas como para los animales:
Se presentarán datos sobre la resistencia actual y la posible aparición de resistencias o de determinantes de resistencia de interés clínico para la indicación relevante en la especie animal de destino.
En caso de que se hayan identificado resistencias antiparasitarias o exista riesgo de que se desarrollen, la información del medicamento incluirá medidas para limitar o mitigar su aparición.
EVALUACIÓN DE RIESGOS MEDIOAMBIENTALES
Tiene también especial trascendencia la evaluación del riesgo para el medioambiente que se encarga de identificar posibles efectos nocivos del uso del medicamento veterinario en el entorno.
Esta evaluación consta de dos fases:
FASE II

La primera fase es obligatoria en todos los casos y consiste en analizar la exposición del medioambiente al medicamento y el riesgo asociado con tal exposición teniendo en cuenta factores como:
Las especies de destino y el sistema de explotación de los animales tratados.
El grado de incorporación del producto al ecosistema.
El grado de persistencia de dicho medicamento en las excretas.
La segunda fase solo es necesaria en determinadas ocasiones y en ella se investiga de manera específica el destino y los efectos del medicamento en ecosistemas particulares.
Tanto los ectoparasiticidas como los endoparasiticidas deberán completar esta segunda fase dado su impacto en el medioambiente.
Fruto de esta evaluación, se establecen una serie de medidas de mitigación del riesgo que serán comunicadas a través de la ficha técnica del medicamento.
Una vez autorizado el medicamento veterinario, es la farmacovigilancia la que se encarga de:
El seguimiento de los posibles acontecimientos adversos en animales, personas o medioambiente.
Evaluar, de forma continua, el balance beneficio-riesgo del medicamento.
Esta nueva legislación europea introduce importantes cambios en esta materia:
Ampliando las sospechas de acontecimientos adversos que se deben notificar.
Modificando el sistema de notificación a seguir dentro de la Unión Europea.
Otorgando mayores responsabilidades al titular de autorización de comercialización.
LA LEGISLACIÓN NACIONAL ACENTÚA
LAS OBLIGACIONES DE NOTIFICACIÓN Y LAS EXTIENDE A COMUNIDADES AUTÓNOMAS Y A PROFESIONALES SANITARIOS
El proceso de autorización, así como las actuaciones posteriores a la misma, velan porque cada medicamento cumpla las garantías de calidad, seguridad y eficacia, resultando en un balance beneficio riesgo positivo. Sin embargo, es la notificación de acontecimientos adversos por parte de todos, la herramienta clave para mantener en el mercado medicamentos seguros y eficaces.
CONCLUSIÓN
Los medicamentos antiparasitarios y los anticoccidiósicos son importantes para mantener a los animales en un estado óptimo de salud y evitar los problemas causados por las infecciones/infestaciones parasitarias en la explotación.
Estos medicamentos deben utilizarse de acuerdo con las condiciones establecidas en su autorización y cumpliendo todas las recomendaciones establecidas sobre su uso prudente para maximizar su eficacia y reducir el riesgo de aparición y diseminación de resistencias en los parásitos diana.
ES IMPORTANTE COMBINAR LA ADMINISTRACIÓN DE LOS MEDICAMENTOS QUE SEAN NECESARIOS CON LA PRÁCTICA

VETERINARIA APROPIADA, APLICANDO MEDIDAS DE HIGIENE Y OTRAS MEDIDAS PREVENTIVAS COMPLEMENTARIAS PARA TRATAR DE REDUCIR EN LO POSIBLE EL USO DE LOS MEDICAMENTOS
NOROVIRUS PORCINO: DE PATÓGENO EN EL OLVIDO A POTENCIAL AGENTE ZOONÓTICO
N
Descarga el PDF
os Norovirus son un género de la familia Caliciciviridae que se caracterizan por tener un RNA no segmentado y un virión carente de envoltura. Este patógeno es la principal causa de gastroenteritis aguda de origen no bacteriano en humanos a nivel mundial, y se les describe infectando también a un gran número de especies de animales domésticos y silvestres1.





Sofia Lázaro Gaspar, Desirée Martín, Celia Martínez Saz y Alfredo A. Benito*
EXOPOL S.L. Pol. Rio Gallego D/14. San Mateo de Gállego. Zaragoza. email: abenito@exopol.com
NLa primera descripción de este virus fue en 1972 por Kapikian y col., quienes por microscopia electrónica identificaron partículas virales en muestras procedentes de un brote de gastroenteritis aguda en humanos en Norwalk (Estados Unidos), ciudad que daría lugar al nombre del agente2.
EN EL PORCINO EL PRIMER REPORTE DE NOROVIRUS LO DIERON SUGIEDA Y COL. EN 1997, QUIENES IDENTIFICAN ESTE VIRUS EN HECES DE ANIMALES ORIGINARIOS DE JAPÓN3
Aunque la presencia de norovirus se describe también en perros, gatos, ovinos y bovinos, es en el ganado porcino donde genera especial interés, por la estrecha relación genética entre las cepas circulantes en esta especie animal y las que afectan al humano.
Desde una perspectiva One Health, el estudio de las infecciones por norovirus porcino adquiere relevancia, dada la posibilidad de esta especie para constituirse en reservorio de cepas con potencial zoonótico.

DIVERSIDAD GENÉTICA DE LOS
NOROVIRUS
El genoma de los norovirus posee tres marcos abiertos de lectura (Open Reading Frames, ORFs).
El ORF1 codifica para proteínas no estructurales.
El ORF2 codifica para la proteína estructural VP1.
El ORF3 codifica para la proteína estructural VP2.
LA VP1 ES LA PRINCIPAL PROTEÍNA DE LA CÁPSIDE Y DE PARTICULAR IMPORTANCIA PARA CLASIFICAR LA DIVERSIDAD ANTIGÉNICA DE LOS MIEMBROS DE ESTA FAMILIA VIRAL1
Los estudios moleculares han demostrado la gran diversidad genómica de los norovirus, indicando que esta alta variabilidad se debe, además de las mutaciones puntuales en su genoma, a procesos de recombinación intragenómica entre el ORF1 y el ORF2.
Inicialmente, los norovirus fueron clasificados en genogrupos y genotipos en base a las secuencias nucleotídicas del gen RdRp, una polimerasa codificada en el ORF1.
Posteriormente, la secuenciación del gen VP1 demostró ser más fiable para clasificar los genotipos.

FIGURA 1
Esquema de la estructura general de los norovirus, sus ORF y las proteínas que codifican. La secuencia del gen RdRP permite determinar el Grupo-P, mientras que la secuencia del gen VP1 define el Genogrupo/Genotipo viral (Adaptado de Campillay-Véliz CP y col., 2020).
Norovirus en humanos
Actualmente, se ha propuesto un sistema de clasificación dual, en el que:
La secuencia del gen RdRP define el grupo-P.
La secuencia del gen VP1 define el genogrupo y el genotipo viral4

Determinación de GRUPO-P
Determinación de GENOGRUPO/GENOTIPO
En humanos, el genogrupo GII se ha considerado el más patogénico, con un total de 27 genotipos diferentes según su VP1, siendo el genotipo GII.4 el más prevalente y el que tiene mayores tasas de evolución y mutación5.
Proteínas no estructurales
ORF-3


genotipos distintos de norovirus, observándose que estos pueden infectar diferentes especies animales dependiendo del genogrupo:
GI, GII, GIV, GVII, GVIII y GIX en humanos.
GIV en felinos.
GIV, GVI y GVII en caninos.
GIII en bovinos.
GII en porcinos.
Norovirus en porcinos
En el caso del porcino, los estudios indican que los genotipos GII.11, GII.18 y GII.19 son específicos de esta especie animal.
Sin embargo, en el año 2007 una cepa humana GII.4 fue descrita en muestras de porcinos en Canadá y posteriormente en Japón en 2010 y en Taiwán en 2012, generando la preocupación sobre el rol de esta especie como reservorio de norovirus zoonóticos1.
ESTUDIOS SOBRE EL NOROVIRUS PORCINO
La gran diversidad genética y el hecho de no poder ser cultivados in vitro han limitado el estudio de los norovirus durante mucho tiempo.
Aunque la información sobre este agente en humanos ha incrementado considerablemente en los últimos años, sobre todo a nivel molecular, las investigaciones en el porcino son aún escasas, describiéndose recientemente que, hasta el año 2022, solo 47 artículos a nivel global evaluaban la presencia de norovirus en esta especie animal1
Tras la primera descripción del Norovirus porcino en Japón, este agente se ha descrito en países de los cinco continentes.
Si bien resulta complicado comparar las prevalencias entre países o regiones por las diferentes metodologías de identificación y muestreo utilizadas, los estudios describen frecuencias de detección del 4,5% y 5,9% de media en Europa y Asia respectivamente, mientras que en Norteamérica es ligeramente superior con un 9,4% de media1
Además de los genotipos de norovirus específicos del porcino GII.11, GII.18 y GII.19, y del genotipo humano GII.4 descrito previamente, estudios recientes han identificado la circulación de forma puntual en el porcino de otros genotipos humanos como:
GII.1 en Etiopía.
GII.3 y GII.13 en Japón.
GII.21 y GII.23 en Corea.
GII.2 en Alemania.


Estos hallazgos han dado forma a la hipótesis de que los norovirus no están necesariamente restringidos a infectar un solo tipo de hospedador y que podrían ser capaces de saltar la barrera entre especies1,6
La presencia de Norovirus porcino se ha descrito en animales sanos y enfermos pertenecientes a diferentes categorías productivas. En estos estudios, los signos clínicos fueron inespecíficos y podrían estar ocasionados por otros agentes, no siendo posible establecer su correlación con la presencia de norovirus en casos de infección natural.
No obstante, dos estudios experimentales usando aislados de norovirus porcino han demostrado que este agente puede ocasionar diarrea ligera-moderada con un periodo relativamente prolongado de excreción viral1,7


IDENTIFICACIÓN Y CARACTERIZACIÓN
MOLECULAR DE NOROVIRUS PORCINO EN ESPAÑA
En Europa, solo algunos países han evaluado la presencia de Norovirus porcino en su población ganadera, habiéndose identificado este agente en estudios realizados en Italia, Holanda, Alemania, Eslovenia, Hungría y Bélgica.
En España, solo se ha descrito un estudio (Halalei y col., 2010) en el que evaluaron la presencia de Rotavirus y Calicivirus en 221 muestras fecales de porcino de diferentes granjas en la comunidad autónoma de Aragón. En este caso, aunque detectaron Rotavirus, no lograron identificar casos positivos a norovirus1,8
Con el fin de mejorar la información epidemiológica sobre Norovirus en el sector porcino español, se realizó un estudio para identificar y caracterizar molecularmente a este agente en un total de 480 muestras clínicas de procesos digestivos recibidos en nuestro laboratorio (Exopol S.L., Zaragoza) durante el periodo 2020 al 2022.
MUESTREO
Las muestras consistían en:
Hisopados de órganos digestivos (55%).
Heces (30%).
Tejido intestinal (15%).
Fueron analizadas en pools (67%) o de forma individual (33%).
El origen de las muestras clínicas abarcaba 38 provincias, representando a 13 de las 17 comunidades autónomas del territorio español.
Adicionalmente, procedían de dos sistemas de producción diferentes:
El 81% (390/480) de las muestras eran de cerdo blanco.
El 15% (74/480) de las muestras eran de cerdo ibérico.
En el restante 4% de muestras no se indicaba la raza de los animales.
ANÁLISIS LABORATORIAL
Para la identificación de Norovirus porcino se evaluaron dos ensayos de transcripción reversa con PCR en tiempo real (RT-qPCR) como diana una región muy conservada entre el ORF1 y el ORF2:
Uno era un ensayo previamente descrito por
El otro fue un ensayo de diseño propio.
La caracterización molecular
Sanger utilizando diversos protocolos previamente descritos para la amplificación de los genes de diseño propio.
RESULTADOS
IDENTIFICACIÓN MOLECULAR DE NOROVIRUS IDENTIFICACIÓN MOLECULAR DE NOROVIRUS
En una evaluación inicial de de RT-qPCR, el ensayo de 5% (4/74) de las muestras, 14% (10/74) de positivos.
Adicionalmente, se observó que diseño tenían un ciclo de cuantificación (Cq) ligeramente inferior el ensayo de Da Silva y col. detección en el resto de muestras clínicas.
El análisis posterior del panel total de que el 11% (52/480) resultaron positivas a Norovirus porcino RT-qPCR, con rangos de Cq entre 25 y 38.
Cabe señalar que un 56% (29/52) de las muestras tenían un Cq mayor de 33, lo que implica una muy de las muestras.
EL NOROVIRUS SE IDENTIFICÓ
EN
MUESTRAS DE HECES (14%), PERO TAMBIÉN EN TEJIDO INTESTINAL (12%) E HISOPOS (9%)
La frecuencia de infección por norovirus en nuestro estudio fue muy similar a la de un estudio reciente en granjas de porcino en la región del Véneto en Italia (11%) y a otro estudio realizado por un laboratorio en Bélgica (11%) en el año 2007

Porcentaje de positivos

INFLUENCIA DEL SISTEMA PRODUCTIVO
INFLUENCIA DEL SISTEMA PRODUCTIVO
Al analizar la presencia de Norovirus porcino en función del tipo de sistema productivo en España, este agente se identificó en el 7% (29/390) de las muestras de cerdo blanco y en el 31% (23/74) de las de cerdo ibérico, obteniéndose diferencias estadísticas significativas entre ambos tipos de sistema productivo.
La alta frecuencia de interacción con animales silvestres como jabalíes, tal como se describe para otros patógenos, podría explicar la mayor detección de norovirus en este tipo de animales.
INFLUENCIA DE LA FASE PRODUCTIVA
INFLUENCIA DE LA FASE PRODUCTIVA
CERDO BLANCO
El análisis de la infección por norovirus según la fase del ciclo productivo demostró que, en el caso de cerdo blanco la mayoría de animales positivos pertenecían a la fase de cebo o engorde (Gráfica 1).
Estos resultados son concordantes con estudios previos indicando que, en sistemas de producción intensiva, la mayor frecuencia de infección por norovirus se observa en estas etapas1,13
CERDO IBÉRICO
En el caso del cerdo ibérico, la frecuencia de positivos en las fases de destete, transición y cebo no presentaron diferencia estadística significativa (Gráfica 1) y no se pudo identificar a este agente en animales lactantes ni adultos.
Porcentaje de positivos
(n=200) Adultos (n=53)
GRÁFICA 1
Detección de Norovirus porcino en función de la fase productiva, en cerdo blanco (A) y cerdo ibérico (B). Se muestra la frecuencia relativa de positivos respecto al total de casos clínicos evaluados.
Norovirus porcino fue identificado en la mayoría de las regiones evaluadas.
La mayor frecuencia de detección se observó en la autónoma de Extremadura
Comunidad foral de Navarra con 22% (2/9), Andalucía con 10% (2/21), Comunidad Valencia con 8% (2/26), Aragón con 7% (16/214), Castilla y León con 7% (3/44) y Cataluña con 6% (4/68).
Es interesante resaltar que, en más de la mitad de las a norovirus (27/52), este agente estuvo en patógenos digestivos, Lawsonia intracellularis. positivas, Norovirus porcino fue el único agente identificado.
ESTOS HALLAZGOS SUBRAYAN LA NECESIDAD DE REALIZAR ESTUDIOS ADICIONALES PARA
DETERMINAR EL VERDADERO ROL DE ESTE AGENTE EN LOS PROBLEMAS DIGESTIVOS DEL PORCINO
CARACTERIZACIÓN MOLECULAR Y
A pesar del uso de distintos protocolos de secuenciación, solo fue posible obtener secuencias parciales de la región de unión del gen RdRP y VP1 en un total de siete muestras procedentes de cinco provincias distintas.
El uso de la herramienta bioinformática permitió el genotipado de las cepas como pudo ser asignada como GII.P18.
Ambos genotipos se describen como específicos del porcino, pero a nuestro conocimiento este es el primer estudio que determina su circulación en la ganadería porcina en España.
En el análisis filogenético de las secuencias de norovirus de este estudio se incluyeron secuencias de referencia de:
Los genotipos GII.11, GII.18 y GII.19.
Genotipos de norovirus humanos identificados de forma puntual en porcinos (GII.1, GII.2, GII.3, GII.21 y GII.31).
El genotipo humano GII.4.

FIGURA 2
Los resultados del análisis filogenético distinguieron dos grupos bien diferenciados (Figura 2).
CLADO
A
El clado A contenía las secuencias de:
Los distintos genotipos de norovirus humano.
Un subgrupo con las secuencias de norovirus porcino GII.18.
Dentro de los genotipos específicos del porcino, el GII.18 se describe como el más relacionado genéticamente con los norovirus humanos, generando preocupación por su potencial peligro para la salud humana1.
CLADO
B
En el clado B se observaron dos subgrupos:
Subgrupo con las secuencias de referencia y las cepas españolas de norovirus porcino genotipo GII.11.
Subgrupo con la secuencia del genotipo GII.19.
Cabe resaltar que el análisis filogenético de las cepas de nuestro estudio confirmó la inclusión de estas muestras como GII.18 y GII.11, validando la identificación previa de estas secuencias mediante la herramienta online de genotipado.
15_X76716_Norovirus_human/1993/UK_GIL_4
16_MN854082_Norovirus_human/2019/Spain_GIl_4_P31 20_LC209464_Norovirus_human/2004/Japan/GIl_2_P2
Clado A
Clado B
21_AY682549_Norovirus_human/2004/France/GIl_21_P21
18_KJ194504_Norovirus_human/1994/Netherlands_GIL3_P3
17_AB112310_Norovirus_human/2001/Japan_GIL1
19_MT492049_Norovirus_human/2020/Spain_GIL 13_P16
2_Zaragoza1_Norovirus_swine/2021/Spain_GIL18_P18
3_Salamanca_Norovirus_swine/2022/Spain_GIL18_P18
7_AY823304_Norovirus_Swine/2003/USA_GIL18
14_AY823306_Norovirus_swine/2003/USA_GIL19
1_Navarra_Norovirus_swine/2021/Spain_GIL11
4_Huesca1_Norovirus_swine/2021/Spain_Gll_11
5_Zaragoza2_Norovirus_swine/2021/Spain_GIl_11
8_HQ392821_Norovirus_Swine/2009/China_GIL11
9_LC509011_Norovirus_Swine/Gil/2018/Japan_GIL,11
11_AB 126320_Norovirus_swine/2003/Japan_GIL_11
6_Huesca2_Norovirus_swine/2022/Spain_GIL11
13_HM346627_Norovirus_Swine/2007/Korea _GIl_11
12 _AY823303_Norovirus_swine/2002/JSA_GIL11
10_EU448331_Norovirus_swine/2005/Canada_GIL_11
Análisis filogenético de las secuencias de Norovirus porcino obtenidas en el estudio. Se utilizó el método de Neighbor-Joining con un bootstrap de 1.000. En gris se muestran las secuencias de este estudio identificadas como GII.11, en verde las GII.18 y en negro secuencias de referencia de otros norovirus humanos y porcinos obtenidas de la base de datos GenBank.
Las cepas de norovirus de este estudio presentaron una identidad nucleotídica mayor al 93% con varias secuencias de norovirus porcino depositadas en el GenBank. Sin embargo, entre ellas el porcentaje de identidad nucleotídica estuvo entre un 79% y 98%, reflejando la diferencia entre los dos genotipos de norovirus porcino identificados.
LA IDENTIDAD NUCLEOTÍDICA ENTRE LAS CEPAS GII.11 ESTUVO ENTRE UN 93% Y 97%, MIENTRAS
QUE ENTRE LAS DOS GII.18 FUE DEL 98%
CONCLUSIÓN
Este estudio es el primer reporte de la identificación molecular de Norovirus porcino en casos clínicos de procesos digestivos en nuestro país. Asimismo, se describe la circulación de los genotipos GII.11 y GII.18 en varias provincias del país. Aunque no fue posible identificar genotipos de norovirus potencialmente zoonótico, es importante continuar la investigación sobre este agente, tanto por su impacto clínico en la especie porcina como desde la perspectiva One Health, con el fin de minimizar los riesgos que puede suponer para el ser humano.
BIBLIOGRAFÍA
1. Cavicchio L y col. Swine Norovirus: Past, Present, and Future. Viruses. 2022 Mar 5;14(3):537
2. Lucero Y, Matson DO, Ashkenazi S, George S, O’Ryan M. Norovirus: Facts and Reflections from Past, Present, and Future. Viruses. 2021 Nov 30;13(12):2399
3. Sugieda M y col. Detection of Norwalk-like virus genes in the caecum contents of pigs. Arch Virol. 1998;143(6):1215-21.
4. Chhabra P y col. Updated classification of norovirus genogroups and genotypes. J Gen Virol. 2019 Oct;100(10):1393-1406.
5. Koo ES, Jeong YS. Comparative study of the geographical spread of genogroup II porcine norovirus and human norovirus. J Microbiol. 2021 Jul; 59(7):644650
6. Villabruna N, Koopmans MPG, de Graaf M. Animals as Reservoir for Human Norovirus. Viruses. 2019 May 25;11(5):478
7. Wang QH y col. Porcine noroviruses related to human noroviruses. Emerg Infect Dis. 2005 Dec;11(12):1874-81
8. Halaihel N y col. Enteric calicivirus and rotavirus infections in domestic pigs. Epidemiol Infect. 2010 Apr;138(4):542-8
9. da Silva AK y col. Evaluation of removal of

noroviruses during wastewater treatment, using realtime reverse transcription-PCR: different behaviors of genogroups I and II. Appl Environ Microbiol. 2007 Dec;73(24):7891-7
10. Wollants E y col. A decade of norovirus genetic diversity in Belgium. Infect Genet Evol. 2015 Mar; 30:37-44
11. Andrade JSR y col. Detection and molecular characterization of emergent GII.P17/GII.17 Norovirus in Brazil, 2015. Infect Genet Evol. 2017 Jul; 51:28-32
12. Kabue JP y col. Genetic characterisation of Norovirus strains in outpatient children from rural communities of Vhembe district/South Africa, 20142015. J Clin Virol. 2017 Sep; 94:100-106
13. Cavicchio L y col. Unrevealed genetic diversity of GII Norovirus in the swine population of Northeast Italy. Sci Rep. 2020 Jun 8;10(1):9217
14. Mauroy A y col. Noroviruses and sapoviruses in pigs in Belgium. Arch Virol. 2008;153(10):1927-31
15. Campillay-Véliz CP, Carvajal JJ, Avellaneda AM, Escobar D, Covián C, Kalergis AM and Lay MK (2020) Human Norovirus Proteins: Implications in the Replicative Cycle, Pathogenesis, and the Host Immune Response. Front. Immunol. 11:961. doi: 10.3389/ fimmu.2020.00961
COMPLEJO RESPIRATORIO
PORCINO: INTERACCIÓN
DE
LA VACUNACIÓN FRENTE A
PCV2, PRRS Y MYCOPLASMA
HYOPNEUMONIAE
V
Descarga el PDF
l Complejo Respiratorio Porcino (CRP) es un proceso multifactorial y complejo provocado por una combinación de patógenos infecciosos, factores de estrés ambiental, diferencias en los sistemas de producción y diversas prácticas de gestión. El Circovirus Porcino tipo 2 (PCV2), el virus del Síndrome Respiratorio y Reproductivo Porcino (PRRSV) y Mycoplasma hyopneumoniae se consideran los patógenos más importantes causantes del CRP. Aunque las interacciones entre estos agentes patógenos respiratorios están bien documentadas, también es necesario comprender la interacción entre ellos y las vacunas. Esta revisión se centra, por un lado, en las interacciones entre PCV2, PRRSV y M. hyopneumoniae y, por otro, en las interacciones entre las vacunas y estos tres patógenos respiratorios.
 Chanhee Chae Departamento de Patología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional
Chanhee Chae Departamento de Patología Veterinaria, Facultad de Medicina Veterinaria, Universidad Nacional
de Seúl, República de Corea
VLa enfermedad respiratoria porcina es multifactorial y compleja y está causada por una combinación de:
Patógenos infecciosos víricos o bacterianos.
Factores de estrés ambiental.
Diferencias en los sistemas de producción.
Diversas prácticas de gestión.
El término CRP ha sido ampliamente utilizado para describir un complejo caracterizado por signos respiratorios y un crecimiento deficiente en cerdos en las fases de crecimiento y de engorde.
Las prácticas de producción de cerdos han cambiado rápidamente en las dos últimas décadas, con una disminución del número total de granjas y la percepción de un aumento de la carga ganadera en todo el mundo. En consecuencia, el CRP ha aumentado en la cabaña porcina mundial, provocando enormes pérdidas económicas debido al retraso en el crecimiento, el aumento del uso de antimicrobianos y los costes adicionales de las medidas de control, como la vacunación.

EL CRP SIGUE SIENDO UN IMPORTANTE OBSTÁCULO PARA LA RENTABILIDAD PORQUE SE PRODUCE MAYORITARIAMENTE EN CERDOS EN CRECIMIENTO-ENGORDE
De ahí que se utilice el nombre de “Complejo Respiratorio Porcino” (CRP o PRDC, por sus siglas en inglés, Porcine Respiratory Disease Complex) (Thacker, 2001; Hansen et al., 2010).
El PCV2, el PRRSV y M. hyopneumoniae son considerados los patógenos clínicamente más relevantes del CRP, por lo que tienen un gran impacto en la producción porcina mundial (Kim et al., 2002, 2003; Pallarés et al., 2002).
En los últimos años, las vacunas se han utilizado cada vez más de forma estratégica, especialmente en el contexto del uso limitado de antibióticos, para controlar el CRP y evitar el aumento del riesgo de resistencia a los antimicrobianos y de residuos en las canales (Vicca et al., 2004).
Dado que el CRP rara vez está causado por un único agente, es necesario comprender la interacción entre las vacunas y los tres principales patógenos respiratorios porque los modelos de infección dual (infección por PCV2/PRRSV e infección por PCV2/M. hyopneumoniae) no siempre se correlacionan con los resultados de los modelos de desafío dual por vacunación (vacunación frente a PRRSV + infección de PCV2/ PRRSV y vacunación frente a M. hyopneumoniae + infección de PCV2/M. hyopneumoniae). 1 2
LA VACUNACIÓN SIGUE SIENDO EL MÉTODO MÁS RENTABLE PARA
CONTROLAR EL CRP
Esta revisión se centra en: Las interacciones entre PCV2, PRRSV y M. hyopneumoniae.
La interacción entre las vacunas y PCV2, PRRSV y M. hyopneumoniae.
FIGURA 1
Diagrama simplificado de la interacción entre PCV2 y PRRSV en cerdos no vacunados (A) y vacunados (B-D) con doble desafío (Park et al., 2013) (A) El PRRSV aumenta los niveles de viremia y lesiones linfoides asociados al PCV2 (PCV2↑), pero el PCV2 no afecta a la replicación del PRRSV ni a las lesiones pulmonares que ocasiona (PRRSV≈). (B) La vacunación frente al PRRSV aumenta por sí sola los niveles de viremia y lesiones linfoides por PCV2 (PCV2↑), pero no afecta a la replicación del PRRSV ni a las lesiones pulmonares (PRRSV≈). (C) La vacunación frente al PCV2 reduce por sí sola los niveles de viremia de PCV2 y las lesiones linfoides (PCV2↓), pero no afecta a la replicación del PRRSV ni a las lesiones pulmonares (PRRSV≈). (D) La vacunación frente a PCV2 y PRRSV reduce los niveles de viremia y lesiones linfoides asociados a PCV2 (PCV2↓), así como los niveles de viremia y lesiones pulmonares asociadas a PRRSV (PRRSV↓).
INTERACCIÓN ENTRE
PCV2 Y PRRSV
COINFECCIÓN DE PCV2 Y PRRSV
Varios estudios han demostrado la relación entre PCV2 y PRRSV (Allan et al., 2000a; Harms et al., 2001; Rovira et al., 2002; Opriessnig et al., 2008a).
El PRRSV potencia las lesiones asociadas al PCV2 (Harms et al., 2001) y aumenta la carga de ADN de PCV2 en el suero de los cerdos coinfectados (Rovira et al., 2002; Opriessnig et al., 2008a) y los niveles de antígenos de PCV2 en los tejidos (Allan et al., 2000a), lo que resulta en lesiones asociadas a PCV2 más graves (Harms et al., 2001).
En cambio, el PCV2 no afecta a la replicación ni a las lesiones asociadas al PRRSV (Park et al., 2013).
Independientemente del genotipo de PCV2 (PCV2a o 2b), la coinfección con el PRRSV tipo 2 aumenta significativamente la viremia de PCV2 y aumenta la gravedad de las lesiones asociadas a PCV2 en comparación con el PRRSV tipo 1 en un modelo de doble infección PCV2-PRRSV (Park et al., 2014a) (Figura 1A).
Esto sugiere que el PRRSV tipo 2 es un factor importante que contribuye a la manifestación clínica completa del CRP en condiciones de campo.
EFECTO DE LA VACUNACIÓN FRENTE
A PCV2 O PRRSV EN CERDOS COINFECTADOS
PCV2 y PRRSV están muy extendidos en la población porcina, por lo que es probable que la mayoría de las explotaciones porcinas en las que se esté vacunando frente al PCV2 (o PRRSV) tengan una doble infección por PCV2/PRRSV.
VACUNACIÓN FRENTE A PRRSV
VACUNACIÓN FRENTE A PRRSV
Teóricamente, una forma de minimizar el efecto potenciador de la replicación del PCV2 asociado al PRRSV podría ser vacunar a los lechones frente al PRRSV antes del destete en estas explotaciones con doble infección PCV2/ PRRSV. Sin embargo, los resultados de algunos estudios señalan que:
La vacunación frente al PRRSV aumenta la replicación del PCV2, lo que se podría atribuir al fracaso de la vacuna frente al PRRSV en cerdos vacunados e infectados simultáneamente en comparación con los cerdos no vacunados e infectados simultáneamente (Park et al., 2013).
La vacunación frente al PRRSV induce el aumento de la replicación del PCV2 al utilizar una vacuna viva atenuada e idéntica a una coinfección PRRSV/PCV2 en condiciones experimentales (Park et al., 2013) (Figura 1B).
El aumento de la viremia por PCV2 tras la vacunación con PRRSV vivo modificado en cerdos coinfectados se atribuye a la menor eficacia de la vacuna frente a PRRSV en condiciones experimentales (Opriessnig et al., 2006b).
La vacunación frente al PRRSV induce la activación de linfocitos (Ferrari et al., 2013), lo que potencia la replicación de PCV2 (Lin et al., 2008).

Por ello, la menor eficacia vacunal frente al PRRSV en cerdos con doble infección pone de manifiesto la necesidad de determinar el estado de infección por PCV2 en los cerdos antes de la vacunación frente al PRRSV para controlar la infección por este virus en las explotaciones porcinas.
VACUNACIÓN FRENTE A PCV2
VACUNACIÓN FRENTE A PPCV2
A diferencia de la vacunación frente al PRRSV, la eficacia de la vacunación frente al PCV2 no se ve afectada por la infección por el PRRSV (Sinha et al., 2010). Esto es clínicamente significativo para los profesionales y productores que a menudo creen que el fracaso de la vacuna frente al PCV2 se debe a la infección por PRRSV.
La vacunación frente al PCV2 es capaz de reducir los niveles de viremia por PCV2 y las lesiones linfoides asociadas en cerdos independientemente del estado de infección por PRRSV (Park et al., 2013) (Figura 1C).
La vacunación frente a PCV2 es efectiva en condiciones de campo donde PCV2 y PRRSV están extendidos en la población porcina. Esto es importante porque es probable que la mayoría de las explotaciones porcinas en las que se están utilizando vacunas frente al PCV2 estén infectadas con PRRSV (Fachinger et al., 2008).



VACUNACIÓN FRENTE A PRRSV Y PCV2
VACUNACIÓN FRENTE A PRRSV Y PCV2
La vacunación simultánea frente al PRRSV y PCV2 reduce significativamente los niveles de viremia de PRRSV, incluso en los cerdos doblemente infectados, en comparación con la vacunación única frente al PRRSV (Park et al., 2013) (Figura 1D).
EL MODELO VACUNACIÓN-DESAFÍO DUAL SUGIERE QUE EL CONTROL DE LAS INFECCIONES POR PCV2 MEDIANTE LA VACUNACIÓN FRENTE
A PCV2 PUEDE AFECTAR POSITIVAMENTE A LA EFICACIA DE LA VACUNA FRENTE AL PRRSV EN CERDOS
CON INFECCIÓN DUAL
INTERACCIÓN ENTRE PCV2 Y M. HYOPNEUMONIAE
COINFECCIÓN DE PCV2 Y M. HYOPNEUMONIAE
Se han realizado varios estudios basados en la infección dual experimental para comprender mejor la interacción entre PCV2 y M. hyopneumoniae (Opriessnig et al., 2004; Zhang et al., 2011; Sibila et al., 2012).
En un modelo de infección secuencial, M. hyopneumoniae potenció la gravedad de las lesiones pulmonares y linfoides asociadas a PCV2 y aumentó la incidencia de PCVAD (Enfermedad Asociada al Circovirus Porcino) en cerdos que fueron inoculados primero con M. hyopneumoniae y luego inoculados con PCV2 2 semanas después (Opriessnig et al., 2004).
M. hyopneumoniae aumentó los niveles de viremia por PCV2 en cerdos doblemente infectados en comparación con cerdos infectados solo con PCV2, mientras que PCV2 no aumentó los niveles de excreción nasal de M. hyopneumoniae en cerdos doblemente infectados en comparación con cerdos infectados solo con M. hyopneumoniae en condiciones experimentales (Seo et al., 2014) (Figura 2A).
En un modelo de infección concurrente, los cerdos inoculados con M. hyopneumoniae y PCV2 a las 6 semanas de edad no mostraron resultados clínicos sinérgicos como los observados en el modelo de desafío secuencial (Sibila et al., 2012).

No obstante, en condiciones de campo, la infección por M. hyopneumoniae suele producirse ligeramente antes o próxima a la infección por PCV2 (Larochelle et al., 2003; Fachinger et al., 2008; Chae, 2012), por lo que el modelo de infección secuencial en lugar del modelo de infección concurrente imita mejor las condiciones de campo.
Desafío
Vacunación 3 5 1 7 11
Fin del estudio (semanas de vida)

A
B
C
D
FIGURA 2
Diagrama simplificado de la interacción entre PCV2 y M. hyopneumoniae (Mhp) en cerdos no vacunados (A) y vacunados (B-D) desafiados doblemente (Seo et al., 2014) (A) Mhp aumenta los niveles de viremia y lesiones linfoides de PCV2 (PCV2↑), pero PCV2 no afecta a la replicación de Mhp ni a las lesiones pulmonares (Mhp≈). (B) La vacuna Mhp sola reduce los niveles de excreción nasal de Mhp y las lesiones pulmonares (Mhp↓), pero no afecta a la replicación de PCV2 ni a las lesiones linfoides (PCV2≈). (C) La vacuna PCV2 sola reduce los niveles de viremia PCV2 y las lesiones linfoides (PCV2↓), pero no afecta a la replicación de Mhp ni a las lesiones pulmonares (Mhp≈). (D) La vacunación de Mhp y PCV2 reduce los niveles de excreción nasal de Mhp y las lesiones pulmonares (Mhp↓), así como los niveles de viremia de PCV2 y las lesiones linfoides (PCV2↓).
EFECTO DE LA VACUNACIÓN FRENTE A M. HYOPNEUMONIAE
EN LA INCIDENCIA DE PCVAD
La interacción entre la vacunación frente a M. hyopneumoniae y la incidencia de PCVAD es clínicamente relevante porque el CRP es una de las manifestaciones clínicas importantes de la PCVAD (Chae, 2005).
Se sabe que la infección primaria por M. hyopneumoniae aumenta la replicación de PCV2, potencia las lesiones asociadas a PCV2 y provoca un aumento de la incidencia de PCVAD (Opriessnig et al., 2004). Por tanto, la vacunación frente al micoplasma por sí sola debería reducir la potenciación de PCVAD asociada a M. hyopneumoniae.
Sin embargo, la vacunación frente a M. hyopneumoniae por sí sola ha demostrado aumentar la incidencia de PCVAD en condiciones experimentales y de campo (Allan et al., 2002; Kyriakis et al., 2002).
De hecho, se ha demostrado que la estimulación inmunitaria inducida por la vacunación frente a M. hyopneumoniae potencia la replicación del PCV2 y aumenta la gravedad de las lesiones asociadas al este virus (Allan et al., 2000b, 2002; Kyriakis et al., 2002; Opriessnig et al., 2003).

Dado que el momento de la vacunación frente a M. hyopneumoniae puede ser crítico para minimizar los efectos de la potenciación de la PCVAD inducida por la vacuna (Opriessnig et al., 2006a), lo más apropiado sería ajustar el momento de la vacunación en lugar de eliminar las vacunas frente a M. hyopneumoniae y arriesgarse a la reaparición de CRP asociado a M. hyopneumoniae.

EFECTOS DE LA VACUNACIÓN FRENTE A M. HYOPNEUMONIAE O PCV2
EN CERDOS
COINFECTADOS
VACUNACIÓN FRENTE A M. HYOPNEUMONIAE
VACUNACIÓN FRENTE A M. HYOPNEUMONIAE
En cerdos coinfectados con M. hyopneumoniae y PCV2, M. hyopneumoniae exacerba la enfermedad respiratoria al aumentar la gravedad de las lesiones asociadas a PCV2 (Opriessnig et al., 2004).
La vacunación frente a M. hyopneumoniae no reduce la replicación de PCV2 en cerdos vacunados e infectados conjuntamente, en comparación con cerdos no vacunados e infectados conjuntamente.
La vacunación frente a M. hyopneumoniae por sí sola no reduce la viremia de PCV2 o las lesiones pulmonares y linfoides asociadas a PCV2 en cerdos doblemente infectados (Seo et al., 2014) (Figura 2B).
No obstante, independientemente de la infección por PCV2, la vacunación frente a M. hyopneumoniae por sí sola es capaz de reducir la excreción nasal y las lesiones pulmonares inducidas por el micoplasma en cerdos coinfectados (Seo et al., 2014) (Figura 2B).
VACUNACIÓN FRENTE A PCV2
VACUNACIÓN FRENTE A PCV2
La vacunación frente a PCV2 por sí sola es capaz de reducir la viremia por PCV2 y sus lesiones pulmonares y linfoides asociadas, pero es incapaz de reducir las lesiones pulmonares inducidas por M. hyopneumoniae en cerdos coinfectados en condiciones experimentales (Seo et al., 2014) (Figura. 2C).
Esta relación independiente pone de relieve la necesidad de establecer un régimen de vacunación adecuado, siendo necesario vacunar a los cerdos frente a ambos patógenos (Figura 2D).
INTERACCIÓN ENTRE PRRSV Y
M. HYOPNEUMONIAE
COINFECCIÓN DE PRRSV Y M. HYOPNEUMONIAE
M. hyopneumoniae potencia la neumonía inducida por PRRSV, mientras que el PRRSV no potencia la neumonía inducida por M. hyopneumoniae (Van Alstine et al., 1996; Thacker et al., 1999, 2000). Además, M. hyopneumoniae aumenta los niveles de viremia por PRRSV en cerdos coinfectados en comparación con cerdos únicamente infectados por PRRSV.
En cambio, el PRRSV no aumenta los niveles de excreción nasal del micoplasma en cerdos coinfectados en comparación con cerdos únicamente infectados por M. hyopneumoniae en condiciones experimentales (Park et al., 2014b) (Figura 3A).
FIGURA 3
Diagrama simplificado de la interacción entre PRRSV y M. hyopneumoniae (Mhp) en cerdos no vacunados (A) y vacunados (B-D) doblemente desafiados (Park et al., 2014b). (A) Mhp aumenta los niveles de viremia y lesiones pulmonares por PRRSV (PRRSV↑), pero PRRSV no afecta a la replicación de Mhp ni a las lesiones pulmonares (Mhp≈). (B) La vacuna Mhp por sí sola puede reducir los niveles de excreción nasal de Mhp y las lesiones pulmonares (Mhp↓), así como los niveles de viremia del PRRSV y las lesiones pulmonares (PRRSV↓). (C) La vacuna frente al PRRSV por sí sola no afecta a la replicación del PRRSV y a las lesiones pulmonares (PRRSV≈), así como a la replicación de Mhp y a las lesiones pulmonares (Mhp≈). (D) La vacunación frente a Mhp y PRRSV reduce los niveles de excreción nasal y lesiones pulmonares de Mhp (Mhp↓), así como los niveles de viremia y lesiones pulmonares de PRRSV (PRRSV↓).
(semanas de vida)

EFECTO DE LA VACUNACIÓN
FRENTE A
M. HYOPNEUMONIAE O PRRSV EN CERDOS COINFECTADOS
VACUNACIÓN FRENTE A M. HYOPNEUMONIAE

VACUNACIÓN FRENTE A M. HYOPNEUMONIAE
La relación de la coinfección de M. hyopneumoniae y PRRSV se corresponde con el resultado del modelo de vacunación-desafío dual (vacunación frente a M. hyopneumoniae-infección frente a PRRSV/M. hyopneumoniae).
M. hyopneumoniae exacerba la neumonía inducida por PRRSV en cerdos coinfectados y la viremia por PRRSV se mantiene en un nivel inferior en comparación con los cerdos coinfectados no vacunados (Thacker et al., 2000; Park et al., 2014b).
La vacunación frente a M. hyopneumoniae puede atenuar la enfermedad respiratoria inducida por PRRSV (Park et al., 2014b) (Figura 3B).
Estos resultados están respaldados por un estudio de campo previo en el que la vacunación frente a M. hyopneumoniae mejoró el crecimiento en condiciones de coinfección de PRRSV y M. hyopneumoniae (Moreau et al., 2004).
LA VACUNACIÓN
FRENTE A M. HYOPNEUMONIAE
ES CLAVE PARA CONTROLAR EFICAZMENTE LA INFECCIÓN POR PRRSV EN EXPLOTACIONES CON COINFECCIÓN DE PRRSV Y M. HYOPNEUMONIAE

Dada esta relación, una forma de reducir la neumonía en granjas con coinfecciones de PRRSV y M. hyopneumoniae es vacunar a los lechones frente a M. hyopneumoniae antes del destete. Como sería de esperar, la vacuna frente al micoplasma reduce la replicación del PRRSV en cerdos coinfectados vacunados en comparación con cerdos coinfectados no vacunados.

VACUNACIÓN FRENTE A PRRSV
VACUNACIÓN FRENTE A PRRSV
La eficacia de la vacuna frente al PRRSV se ve afectada por la infección por M. hyopneumoniae.
Mientras que la vacunación frente al PRRSV por sí sola reduce la viremia y lesiones pulmonares en cerdos infectados por el PRRSV, apenas reduce el nivel de viremia y lesiones pulmonares inducidas por el virus en cerdos coinfectados con PRRSV y M. hyopneumoniae (Park et al., 2014b) (Figura 3C).

Estos resultados sugieren que la infección por M. hyopneumoniae interfiere con la inmunidad protectora inducida por la vacuna frente al PRRSV.

Se ha señalado que M. hyopneumoniae modula la eficacia de la respuesta inmunitaria frente al PRRSV, en particular reduciendo los niveles de interferón IFN-γ en cerdos coinfectados sin vacunación (Thanawongnuwech y Thacker, 2003).
Las células secretoras de IFN-γ específicas del PRRSV desempeñan un papel clave en la inmunidad celular protectora contra la infección por PRRSV (Meier et al., 2003; Zuckermann et al., 2007) y se sabe que el IFN-γ inhibe la replicación del PRRSV (Bautista y Molitor, 1999; Rowland et al., 2001).
Cuando las vacunas frente a M. hyopneumoniae y PRRSV se utilizan en combinación, hay niveles significativamente más bajos de viremia que cuando la vacuna PRRSV se utiliza sola en cerdos coinfectados en condiciones experimentales (Park et al., 2014b) (Figura
Esta información es significativa porque la infección por M. hyopneumoniae podría ser uno de los factores que contribuyen al fracaso vacunal frente al PRRSV.
En el campo, se debería evaluar el estado de infección por M. hyopneumoniae de los cerdos antes de utilizar las vacunas frente al PRRSV para controlar las infecciones por este virus en las explotaciones porcinas. En este sentido, el control de las infecciones por M. hyopneumoniae mediante la vacunación podría afectar positivamente a la inducción completa de la inmunidad vacunal frente al PRRSV en granjas que sufren una coinfección de M. hyopneumoniae y PRRSV.
VACUNACIÓN FRENTE A M. HYOPNEUMONIAE Y PRRSV
VACUNACIÓN FRENTE A M. HYOPNEUMONIAE Y PRRSV
El efecto de la vacunación frente a PRRSV sobre la eficacia de la vacuna M. hyopneumoniae es controvertido.
La eficacia de dos dosis de una vacuna frente a M. hyopneumoniae no se vio disminuida por la administración previa de la vacuna frente a PRRSV cuando ésta se administró antes de las dos dosis (vacunación frente a PRRSV seguida de dos dosis de vacuna frente M. hyopneumoniae) (Boettcher et al., 2002), mientras que sí que disminuyó al administrar la vacuna frente al PRRSV entre ambas dosis (primera dosis frente a M. hyopneumoniae seguida de la vacunación contra el PRRSV y, a continuación, la segunda dosis M. hyopneumoniae) (Thacker et al., 2000).
LAS AMENAZAS SE ADAPTAN...



Escanee el QR para acceder a la Ficha Técnica. En caso de duda, consulte a su veterinario.
... TU PROTECCIÓN TAMBIÉN DEBERÍA
El PCV2 evoluciona rápidamente 1. Protege a tus lechones con la primera y única vacuna en Europa con dos genotipos.
COBERTURA * ANTIGÉNICA MÁS AMPLIA
frente a múltiples genotipos de PCV2 y Mycoplasma hyponeumoniae
LA MÁS LARGA DURACIÓN DE INMUNIDAD DE LAS VACUNAS RTU **
Duración de la inmunidad de 23 semanas frente a PCV2 y frente a Mycoplasma hyopneumoniae
FORMULACIÓN AVANZADA
Dos genotipos PCV2 y una fracción única de M. hyopneumoniae formulada con MetaStim® para generar una potente y completa respuesta inmunitaria
DOSIS ÚNICA
Lista para usar, a partir de las 3 semanas de edad
COBERTURA* MÁS AMPLIA Y DURADERA
Las diferencias en los resultados sugieren que el momento de la vacunación frente M. hyopneumoniae en relación con la vacunación frente al PRRSV podría ser un factor importante a tener en cuenta a la hora de establecer programas de vacunación exitosos. Sin embargo, es probable que una vacuna única frente a M. hyopneumoniae se vuelva más popular entre los productores de cerdos de todo el mundo debido a la menor necesidad de mano de obra y a la reducción del estrés de los animales.
En el caso de una vacuna de una dosis, la eficacia no disminuye por la administración previa de la vacuna contra el PRRSV (Park et al., 2014b), lo que resulta importante al eliminar las complicaciones observadas con la vacuna de dos dosis.
CONCLUSIONES
Las interacciones entre las vacunas y los patógenos pueden depender de las cepas patógenas utilizadas, del tipo de cerdos y de las vacunas empleadas. No obstante, es necesario comprender estas interacciones para poder tratar eficazmente el CRP.
Si una granja está coinfectada con PCV2 y PRRSV, la vacunación de los cerdos frente al PCV2 es prioritaria porque este virus reduce la eficacia de la vacuna frente a PRRSV.
Si una granja está coinfectada con PCV2 y M. hyopneumoniae, es necesario vacunar frente a PCV2 y M. hyopneumoniae debido a la interacción independiente entre vacunas y patógenos.
Si una granja está coinfectada con PRRSV y M. hyopneumoniae, la vacunación frente a M. hyopneumoniae es prioritaria porque la vacuna frente a PRRSV por sí sola no será suficiente para proteger a los cerdos frente a la infección por PRRSV.
Artículo adaptado de Chae, C. (2016) ‘Porcine respiratory disease complex: Interaction of vaccination and porcine circovirus type 2, porcine reproductive and respiratory syndrome virus, and Mycoplasma hyopneumoniae’, The Veterinary Journal, 212, pp. 1–6. doi:10.1016/j.tvjl.2015.10.030
LEER ARTÍCULO
BIBLIOGRAFÍA
Allan, G.M., McNeilly, F., Ellis, J.A., Krakowka, S., Meehan, B., McNair, I., Walker, I., Kennedy, S., 2000a. Experimental infection of colostrum deprived piglets with porcine circovirus 2 (PCV2) and porcine reproductive and respiratory syndrome virus (PRRSV) potentiates PCV2 replication. Archives of Virology 145, 2421–2429.
Allan, G.M., McNeilly, F., Ellis, J.A., Krakowka, S., 2002. Neonatal vaccination for Mycoplasma hyopneumoniae and postweaning multisystemic wasting syndrome: A field trial. Pig Journal 48, 34–41.
Allan, G.M., McNeilly, F., Kennedy, S., Meehan, B., Ellis, J., Krakowka, S., 2000b. Immunostimulation, PCV-2 and PMWS. The Veterinary Journal 147, 170–171.
Bautista, E.M., Molitor, T.W., 1999. IFN gamma inhibits porcine reproductive and respiratory syndrome virus replication in macrophages. Archives of Virology 144, 1191–1200.
Boettcher, T.B., Thacker, B.J., Halbur, P.G.,Waters,W.R., Nutsch, R., Thacker, E.L., 2002. Vaccine efficacy and immune response to Mycoplasma hyopneumoniae challenge in pigs vaccinated against porcine reproductive and respiratory syndrome virus and M. hyopneumoniae. Journal of Swine Health and Production 10, 259–264.
Chae, C., 2005. A review of porcine circovirus 2-associated syndromes and diseases. The Veterinary Journal 169, 326–336.
Chae, C., 2012. Porcine circovirus type 2 and its associated disease in Korea. Virus Research 164, 107–113.
Fachinger, V., Bischoff, R., Jedidia, S.B., Saalmuller, A., Elbers, K., 2008. The effect of vaccination against porcine circovirus type 2 in pigs suffering from porcine respiratory disease complex. Vaccine 26, 1488–1499.
Ferrari, L., Martelli, P., Saleri, R., De Angelis, E., Cavalli, V., Bresaola, M., Benetti, M., Borghetti, P., 2013. Lymphocyte activation as cytokine gene expression and secretion is related to the porcine reproductive and respiratory syndrome virus (PRRSV) isolate after in vitro homologous and heterologous recall of peripheral blood mononuclear cells (PBMC) from pigs vaccinated and exposed to natural infection. Veterinary Immunology and Immunopathology 151, 193–206.
Hansen, M.S., Pors, S.E., Jensen, H.E., Bille-Hansen, V., Bisgaard, M., Flachs, E.M., Nielsen, O.L., 2010. An investigation of the pathology and pathogens associated with porcine respiratory disease complex in Denmark. Journal of Comparative Pathology 143, 120–131.
Harms, P.A., Sorden, S.D., Halbur, P.G., Bolin, S.R., Larger, K.M., Morozov, I., Paul, P.S., 2001. Experimental reproduction of severe disease in CD/ CD pigs concurrently infected with type 2 porcine
circovirus and porcine reproductive and respiratory syndrome virus. Veterinary Pathology 38, 528–539.
Kim, J., Chung, H.-K., Jung, T., Cho, W.-S., Choi, C., Chae, C., 2002. Postweaning multisystemic wasting syndrome of pigs in Korea: Prevalence, microscopic lesions and coexisting microorganisms. Journal of Veterinary Medical Science 64, 57–62.
Kim, J., Chung, H.-K., Chae, C., 2003. Association of porcine circovirus 2 with porcine respiratory disease complex. The Veterinary Journal 166, 251–256.
Kyriakis, S.C., Saoulidis, K., Lekkas, S., Miliotis, C.C., Papoutsis, P.A., Kennedy, S., 2002. The effect of immune-modulation on the clinical and pathological expression of postweaning multisystemic wasting syndrome. Journal of Comparative Pathology 126, 38–46.
Larochelle, R., Magar, R., D’Allaire, S., 2003. Comparative serologic and virologic study of commercial swine herds with and without postweaning multisystemic wasting syndrome. Canadian Journal of Veterinary Research 67, 114–120.
Lin, C.-M., Jeng, C.-R., Chang, H.-W., Guo, I.-C., Huang, Y.-L., Tsai, Y.-C., Chia, M.-Y., Pang, V.F., 2008. Characterization of porcine circovirus type 2 (PCV2) infection in swine lymphocytes using mitogenstimulated peripheral blood lymphocytes from healthy PCV2-carrier pigs. Veterinary Immunology and Immunopathology 124, 355–366.
Meier, W.A., Galeota, J., Osorio, F.A., Husmann, R.J., Schnitzlein, W.M., Zuckermann, F.A., 2003. Gradual development of the interferon-gamma response of swine to porcine reproductive and respiratory syndrome virus infection or vaccination. Virology 309, 18–31.
Moreau, I.A., Miller, G.Y., Bahnson, P.B., 2004. Effects of Mycoplasma hyopneumoniae vaccine on pigs naturally infected with M. hyopneumoniae and porcine reproductive and respiratory syndrome virus. Vaccine 22, 2328–2333.
Opriessnig, T., Yu, S., Gallup, J.M., Evans, R.B., Fenaux, M., Pallares, F., Thacker, E.L., Brockus, C.W., Ackermann, M.R., Thomas, P., et al., 2003. Effect of vaccination with selective bacterins on conventional pigs infected with type 2 porcine circovirus. Veterinary Pathology 40, 521–529.
Opriessnig, T., Thackers, E.L., Yu, S., Fennaux, M., Meng, X.-J., Halbur, P.G., 2004. Experimental reproduction of postweaning multisystemic wasting syndrome in pigs by dual infection with Mycoplasma hyopneumoniae and porcine circovirus type 2. Veterinary Pathology 41, 624–640.
Opriessnig, T., Halbur, P.G., Yu, S., Thacker, E.L., Fenaux, M., Meng, X.J., 2006a. Effects of the timing of the administration of Mycoplasma hyopneumoniae bacterin on the development of lesions associated with porcine circovirus type 2. The Veterinary Journal 158, 149–154.
Opriessnig, T., McKeown, N.E., Harmon, K.L., Meng, X.J., Halbur, P.G., 2006b. Porcine circovirus type 2 infection decreases the efficacy of a modified live porcine reproductive and respiratory syndrome virus vaccine. Clinical and Vaccine Immunology 13, 923–929.
Opriessnig, T., Madson, D.M., Prickett, J.R., Kuhar, D., Lunney, J.K., Elsener, J., Halbur, P.G., 2008a. Effect of porcine circovirus type 2 (PCV2) vaccination on porcine reproductive and respiratory syndrome virus (PRRSV) and PCV2 coinfection. Veterinary Microbiology 131, 103–114.
Pallarés, F.J., Halbur, P.G., Opriessnig, T., Sorden, S.D., Villar, D., Janke, B.H., Yaeger, M.J., Larson, D.J., Schwartz, K.J., Yoon, K.J., et al., 2002. Porcine circovirus type 2 (PCV-2) coinfections in US field cases of postweaning multisystemic wasting syndrome (PMWS). Journal of Veterinary Diagnostic Investigation 14, 515– 519.
Park, C., Oh, Y., Seo, H.W., Han, K., Chae, C., 2013. Comparative effects of vaccination against porcine circovirus type 2 (PCV2) and porcine reproductive and respiratory syndrome virus (PRRSV) in a PCV2-PRRSV challenge model. Clinical and Vaccine Immunology 20, 369–376.
Park, C., Seo, H.W., Park, S.-J., Han, K., Chae, C., 2014a. Comparison of porcine circovirus type 2 (PCV2)associated lesions produced by co-infection between two genotypes of PCV2 and two genotypes of porcine reproductive and respiratory syndrome virus. Journal of General Virology 95, 2486–2494.
Park, S.-J., Seo, H.W., Park, C., Chae, C., 2014b. Interaction between single-dose Mycoplasma hyopneumoniae and porcine reproductive and respiratory syndrome virus vaccines on dually infected pigs. Research in Veterinary Science 96, 516–522.
Rovira, A., Balasch, M., Segalés, J., García, L., Plana-Durán, J., Rosell, C., Ellerbrok, H., Mankertz, A., Domingo, M., 2002. Experimental inoculation of conventional pigs with porcine reproductive and respiratory syndrome virus and porcine circovirus 2. Journal of Virology 76, 3232–3239.
Rowland, R.R.R., Robinson, B., Stefanick, J., Kim, T.S., Guanghua, L., Lawson, S.R., Benfield, D.A., 2001. Inhibition of porcine reproductive and respiratory syndrome virus by interferon-gamma and recovery
Seo, H.W., Park, S.-J., Park, C., Chae, C., 2014. Interaction of porcine circovirus type 2 and Mycoplasma hyopneumoniae vaccines on dually infected pigs. Vaccine 32, 2480–2486.
Sibila, M., Fort, M., Nofrarias, M., Perez de Rozas, A., Galindo-Cardiel, I., Mateu, E., Segalés, J., 2012. Simultaneous porcine circovirus type 2 and Mycoplasma hyopneumoniae co-inoculation does not potentiate disease in conventional pigs. Journal of Comparative Pathology 147, 285–295.
Sinha, A., Shen, H.G., Schalk, S., Beach, N.M., Huang, Y.W., Halbur, P.G., Meng, X.J., Opriessnig, T., 2010. Porcine reproductive and respiratory syndrome virus infection at the time of porcine circovirus type 2 vaccination has no impact on vaccine efficacy. Clinical and Vaccine Immunology 17, 1940–1945.
Thacker, E.L., Halbur, P.G., Ross, R.F., Thanawongnuwech, R., Thacker, B.J., 1999. Mycoplasma hyopneumoniae potentiation of porcine reproductive and respiratory syndrome virus-induced pneumonia. Journal of Clinical Microbiology 37, 620–627.
Thacker, E.L., Thacker, B.J., Young, T.F., Halbur, P.G., 2000. Effect of vaccination on the potentiation of porcine reproductive and respiratory syndrome (PRRSV)-induced pneumonia by Mycoplasma hyopneumoniae. Vaccine 18, 1244–1252.
Thanawongnuwech, R., Thacker, E.L., 2003. Interleukin-10, interleukin-12, and interferon-levels in the respiratory tract following Mycoplasma hyopneumoniae and PRRSV infection in pigs. Viral Immunology 16, 357–367.
Van Alstine, W.G., Stevenson, G.W., Kanitz, C.L., 1996. Porcine reproductive and respiratory syndrome virus does not exacerbate Mycoplasma hyopneumoniae infection in young pigs. Veterinary Microbiology 49, 297–303.
Vicca, J., Stakenborg, T., Maes, D., Butaye, P., Peeters, J., de Kruif, A., Haesebrouck, F., 2004. vitro susceptibilities of Mycoplasma hyopneumoniae field isolates. Antimicrobial Agents and Chemotherapy 48, 4470–4472.
Zhang, H., Lunney, J.K., Baker, R.B., Opriessnig, T., 2011. Cytokine and chemokine mRNA expression profiles in tracheobronchial lymph nodes from pigs singularly infected or coinfected with porcine circovirus type 2 (PCV2) and Mycoplasma hyopneumoniae (MHYO). Veterinary Immunology and Immunopathology 140, 152–158.
Zuckermann, F.A., Garcia, E.A., Luque, I.D., Christopher-Hennings, J., Doster, A., Brito, M., Osorio, F., 2007. Assessment of the efficacy of commercial porcine reproductive and respiratory syndrome virus (PRRSV) vaccines based on measurement of serologic response, frequency of gamma-IFN-producing cells and virological parameters of protection upon challenge. Veterinary Microbiology 123, 69–85.

V ÚLTIMOS AVANCES EN VACUNAS FRENTE A LA NEUMONÍA ENZOÓTICA PORCINA
el PDF


César B. Gutiérrez Martín1, Óscar Mencía Ares2 y Sonia Martínez Martínez3

1Catedrático del Departamento de Sanidad Animal de la Universidad de León
2Profesor Ayudante
Doctor del Departamento de Sanidad Animal de la Universidad de León

3Profesora Titular del Departamento de Sanidad Animal de la Universidad de León
lo largo de este artículo se efectúa una revisión sobre las últimas vacunas elaboradas para la prevención de la neumonía enzoótica porcina y se comenta su eficacia, después de una breve descripción de la enfermedad y su agente etiológico, y de un repaso a las vacunas tradicionales.

VLA ENFERMEDAD Y SU AGENTE ETIOLÓGICO

El Complejo Respiratorio Porcino (CRP) constituye una entidad multifactorial frecuente en la porcinocultura mundial que provoca pérdidas económicas cuantiosas derivadas de la conversión ineficaz del alimento, de la utilización de antibióticos en los tratamientos y de vacunas en la prevención.
No se trata de una zoonosis por lo que su transcendencia se ciñe a lo meramente pecuniario, con las únicas excepciones de algunas cepas de Pasteurella multocida, que pueden transmitirse raramente a través de las mordeduras o de secreciones nasales porcinas, o de Streptococcus suis, que podría ocasionar esporádicamente meningitis o septicemias humanas (Díez de los Ríos y cols., 2021).
CRP – LOS SOSPECHOSOS HABITUALES
PATÓGENOS PRIMARIOS
Entre los patógenos primarios asociados al CRP se encuentran aquellos que ocasionan inmunosupresión, como el Virus del Síndrome Respiratorio y Reproductor Porcino (PRRSV), el Virus de la Influenza Porcina, el Virus de la Enfermedad de Aujeszky, Coronavirus, Circovirus y Mycoplasma hyopneumoniae, o que atacan a los fagocitos porcinos, como Actinobacillus pleuropneumoniae.
PATÓGENOS SECUNDARIOS
Entre los patógenos secundarios u oportunistas figuran Bordetella bronchiseptica, Pasteurella multocida, Glaesserella parasuis o Streptococcus suis, que se aprovechan de la acción de los patógenos primarios (Assavacheep y Thanawongnuwech, 2022).

Si la enfermedad ocurre únicamente por efecto de los agentes primarios, los animales mueren o, alternativamente, el proceso remite en un tiempo razonable. Sin embargo, cuando se complica con los agentes oportunistas, el cuadro respiratorio se alarga, lo que origina unas pérdidas económicas de mayor envergadura (Gutiérrez Martín, 2014).
MYCOPLASMA HYOPNEUMONIAE – ALLANANDO EL TERRENO PARA LOS OPORTUNISTAS
Mycoplasma hyopneumoniae es responsable de la Neumonía Enzoótica Porcina, una enfermedad crónica que ocasiona considerables pérdidas económicas.
Como cualquier micoplasma, carece de pared bacteriana, pero puede fijarse al epitelio ciliado de la tráquea, bronquios y bronquiolos, ocasionando daños de consideración y facilitando el asentamiento de otras bacterias, principalmente A. pleuropneumoniae y P. multocida


Fijación de M. hyopneumoniae al epitelio ciliado traqueal, bronquial y bronquiolar con generación de lesiones.

Asentamiento de bacterias oportunistas.
De distribución mundial, como factores predisponentes en las explotaciones intensivas cabe destacar:
La ventilación insuficiente.
Las fluctuaciones térmicas.
La sobrepoblación porcina.
IMAGEN 1
Consolidación pulmonar de los lóbulos apical y cardiaco.

PATOGENIA Y SIGNOS CLÍNICOS
PATOGENIA Y SIGNOS CLÍNICOS
En su patogénesis resulta fundamental la acción sobre los macrófagos alveolares, que repercute en la reducción de su capacidad fagocítica, a lo que se suman la estimulación linfocitaria y de las citocinas proinflamatorias (Haesebrouck y cols., 2004; Gutiérrez Martín, 2014).
Resultan susceptibles los cerdos de todas las edades, y, como en cualquier proceso crónico, su mortalidad es escasa. Sin embargo, tiene una morbilidad elevada asociada a:
Tos improductiva.
Asma.
Anorexia y/o reducción de la ganancia de peso de los animales de cebo.
ASPECTO MACROSCÓPICO
Su principal lesión macroscópica consiste en una consolidación pulmonar de los lóbulos apical y cardiaco, que suelen presentar una tonalidad púrpura-grisácea (Imagen 1). También puede resultar afectados los lóbulos intermedios y la parte anterior de los diafragmáticos (Maes y cols., 2008; Gutiérrez Martín, 2014; Quinn y cols., 2018).
ASPECTO MICROSCÓPICO
Microscópicamente, se desarrolla una hiperplasia linforreticular peribroquial y perivascular como consecuencia de la respuesta inmunitaria (Haesebrouck y cols., 2004).
DIAGNÓSTICO DE LA NEUMONÍA ENZOÓTICA
DIAGNÓSTICO DE LA NEUMONÍA ENZOÓTICA
El diagnóstico clásico de la neumonía enzoótica se basa en el aislamiento e identificación del patógeno, lo que resulta difícil como todos los del género Mycoplasma. Por ello, se han diseñado otras alternativas más sensibles y eficaces, como la inmunofluorescencia a partir de las muestras pulmonares, o las técnicas de PCR.
LA DEMOSTRACIÓN DEFINITIVA EN LAS
GRANJAS PORCINAS SUELE RESOLVERSE
MEDIANTE UNA TÉCNICA ELISA
TRATAMIENTO Y PREVENCIÓN
TRATAMIENTO Y PREVENCIÓN
Como antibióticos eficaces se han señalado la tilosina, la lincomicina o la tiamulina, aunque se han descrito resistencias frente a la primera, así como también frente a las fluoroquinolonas.
Como método de prevención alternativo a las vacunas (de resultados dispares), debe procurarse el establecimiento de explotaciones libres de estos patógenos (Quinn y cols., 2018).
VACUNAS Y VACUNACIÓN
FRENTE
A LA NEUMONÍA ENZOÓTICA
La vacunación con formulaciones inactivadas comerciales representa una herramienta destacada en el control de la Neumonía Enzoótica, observándose una disminución parcial de las lesiones macroscópicas, así como una reducción de la carga de micoplasmas en el aparato respiratorio (Meyns y cols., 2006).
SE CALCULA QUE EN MUCHOS PAÍSES SE APLICAN VACUNAS EN MÁS DEL 70% DE LAS
EXPLOTACIONES (Maes y cols., 2008)
No se conoce el mecanismo concreto de protección, pero se cita la inducción de inmunidad humoral en las mucosas y de inmunidad celular, alcanzándose la máxima eficacia varios meses después de su aplicación, no de modo inmediato (Haesebrouck y cols., 2004).
La ganancia diaria de peso asociada a la vacunación frente a este patógeno oscila entre el 2% y el 8%, con un índice de conversión del 2-5%, a lo que hay que añadir una disminución de la mortalidad y de los síntomas y lesiones.
No obstante, por lo general, esta protección no evita la colonización por M. hyopneumoniae cuyas cepas se han descrito variaciones genéticas y antigénicas destacadas, lo que complica el establecimiento de una protección vacunal óptima.

Para obtener resultados aceptables, la vacunación debe practicarse junto con otros factores de manejo (Haesebrouck y cols., 2004; Chae, 2011; Villarreal y cols., 2011).
Se han aplicado diferentes esquemas de vacunación, según la explotación y el patrón de infección.
La vacunación de las madres al final de la gestación reduce la transmisión de los micoplasmas a la descendencia y protege a los lechones (Maes y cols., 2008).
En las unidades de partos y recién nacidos se suele practicar una vacunación doble, especialmente cuando los micoplasmas aparecen en los estadios iniciales de la producción.
Aunque no se ha podido demostrar con claridad el efecto negativo de los anticuerpos maternos en la respuesta a la vacunación, se prefiere una aplicación posterior, en torno a los dos meses y medio, si el riesgo aparece durante el periodo de finalización.
No se aconseja la vacunación en aquellos lotes en los que exista una presión de infección elevada o cuando resulte probable la infección de los cerdos a edades tempranas, como puede suceder en los sistemas de producción continua (Haesebrouck y cols., 2004).
En cualquier caso, el protocolo vacunal estará condicionado también por la presencia de otras enfermedades concurrentes o por el estrés (hacinamiento en el transporte, especialmente, a temperaturas elevadas, cambios en el manejo o la alimentación, etc.).
A PESAR DE QUE ESTA CUESTIÓN HA SIDO MOTIVO DE DISCUSIÓN ENTRE LOS
ESPECIALISTAS, SE HA SUGERIDO LA VACUNACIÓN TRES DÍAS ANTES DEL DESTETE
COMO MOMENTO MÁS ADECUADO (Pieters y Sibila,
2017)
VACUNAS TRADICIONALES
Entre 2010 y 2017 se estudiaron diecinueve bacterinas que, en su mayoría, contenían la cepa J de M. hyopneumoniae, cepa tipo (Maes y cols., 2021) y, en menor número, se probaron también las cepas P, P-5722-3, BQ14 y DJ-166, concluyendo que las bacterinas no inducían niveles suficientes de anticuerpos protectores (Fish y cols., 2016).
A pesar de ello, la mayoría de ellas ha conseguido disminuir las lesiones neumónicas, aunque algunas ni eso, como la adyuvantada con un carbómero que, inoculada en cerdos por vía intramuscular, desarrolló el mismo grado de lesiones que el grupo control (Kristensen y cols., 2014).

Más recientemente, Matthijs y cols. (2019) ensayaron por vía intramuscular tres bacterinas basadas en la cepa F7.2C:
Bacterina con un liposoma catiónico con el ligando del receptor de la lectina inducible por macrófagos.
Bacterina con una emulsión de escualeno en agua con los ligandos de cinco receptores tipo Toll (TLR1/2, TLR7/8 y TlR9).
Bacterina con micropartículas de ácido láctico-coglucólico con los mismos ligandos de los TLRs anteriores.
Todas estimularon una respuesta celular y redujeron los síntomas y lesiones, así como la presencia de ADN de M. hyopneumoniae en el pulmón.
Kim y cols. (2021) evaluaron en cerdos la cepa 2940 inactivada potenciada con la endotoxina de la cepa J5 de E. coli inoculada en una única dosis por vía intramuscular.
La medición del IFN-γ permitió validar una respuesta celular potente, junto con una disminución de las lesiones pulmonares y de la eliminación nasal de micoplasmas, por lo que se consideraron aceptables sus resultados.

El estudio de la expresión de las citoquinas en cerdos vacunados con una bacterina adyuvantada con una saponina puso de manifiesto la sobreexpresión de las relacionadas con una respuesta Th1 (IL-2, IL-12 -interferón), lo que demostró la importancia de la inmunidad celular en la prevención de la neumonía enzoótica (Rodríguez y cols., 2023).
Entre 2015 y 2017, se valoraron siete vacunas formuladas con dos cepas atenuadas, la 168 y la RM48 (Tao y cols., 2019).
Shen y cols. (2017) comprobaron que la vacuna atenuada que habían estudiado no favorecía una respuesta celular suficiente, al no estimular la síntesis de determinadas citoquinas.
Años antes, Feng y cols. (2010) consiguieron una formulación atenuada con la cepa virulenta 168, aislada a partir de un cerdo enfermo, cuya virulencia había sido reducida mediante pases alternativos en el medio de Friis modificado y en el hospedador natural. Algo después, Feng y cols. (2013) incorporaron un mutante termosensible de la cepa LKR de M. hyopneumoniae en la formulación de una vacuna atenuada aplicada intranasalmente.
Con carácter general, se admite que estas vacunas atenuadas garantizan únicamente una protección parcial, en el mejor de los casos. Además, siempre existe el problema de la virulencia residual y/o de la reversión de la cepa (Feng y cols., 2013).

VACUNAS DE NUEVA GENERACIÓN

ANTÍGENO P97 ANTÍGENO P97
La mayor parte de las investigaciones se refieren al antígeno P97, solo o en combinación con otras adhesinas, ya que es la principal proteína de membrana que se fija a los cilios del aparato respiratorio porcino. Se han realizado 16 estudios, entre ellos:
Shimoji y cols. (2003) inocularon intranasalmente la cepa atenuada de Erysipelothrix rhusiopathiae YS-19 como vector de recombinación, encontrando un número menor de lesiones, pero sin poder detectar anticuerpos séricos específicos ni una respuesta celular.
Okamba y cols. (2007) indujeron una respuesta inmunitaria considerable cuando inocularon intramuscular e intranasalmente ratones con un adenovirus con la porción terminal carbohidratada de P97.
Barate y cols. (2014) desarrollaron una vacuna recombinante de subunidades, adyuvantada con la subunidad B de la enterotoxina termolábil de Escherichia coli y con un aceite comercial, que probaron por vía intramuscular en ratón.
Su eficacia fue aceptable, puesto que la región R1 de la adhesina inducía una respuesta Th1, en tanto que su fragmento R2 generó una respuesta Th2.
La vacuna formulada con parálogos recombinantes de las adhesinas ciliares P97/P102, potenciada con sendos adyuvantes comerciales (uno acuoso y otro oleoso) no rindió la eficacia pretendida por Woolley y cols. (2014), puesto que ni indujo inmunidad de mucosas ni pudo regularse la secreción de citoquinas proinflamatorias.
Como único resultado positivo, se desarrolló una respuesta inmunitaria sistémica aceptable.
El estudio más reciente relacionado con P97 y otras proteínas inmunógenas (MHP418, MHP372, MHP199 y MHP0461) consistió en la construcción de tres proteínas quiméricas mediante métodos bioinformáticos que Indujeron una respuesta humoral de calidad en ratones, al tiempo que estimularon la secreción de TNF-α e IL-6.
Naturalmente, estos buenos resultados deben ser corroborados en cerdos (Rebouças Santos y cols., 2024).

ANTÍGENO P46
ANTÍGENO P46
Se han realizado cinco experimentos en ratón relacionados con P46, antígeno de la superficie de la membrana, siempre combinado con al menos otras dos adhesinas.
Destacamos el de de Oliveira y cols. (2017), quienes idearon una vacuna de ADN potenciada con una nanoemulsión comercial y observaron que P46 era reconocida por los sueros de los cerdos convalecientes.
Liu y cols. (2023) construyeron una quimera multiantigénica denominada L9m6 (con P97R1, mhp390 y P46) y la probaron intramuscularmente en ratones.
Consiguieron una gran respuesta celular y una producción considerable de IgG e IgM. Todo ello sugirió el potencial vacunal de esta quimera que debería ser ratificado en el hospedador natural.
ANTÍGENO P36
ANTÍGENO P36
La investigación de Zou y cols. (2011) es una de las tres que utiliza la adhesina P36 (localizada en el citosol) en un modelo ratón. Concretamente, este grupo recurrió al vector recombinante A. pleuropneumoniae SLW36 atenuado. Inoculada intramuscularmente, se generó una respuesta protectora frente a M. hyopneumoniae y A. pleuropneumoniae.
ANTÍGENOS P95 y P46
ANTÍGENOS P95 Y P46
La adhesina P95 fue incorporada en formulaciones vacunales de ADN y de subunidades por Galli y cols. (2012). Recurrieron al plásmido pcADN3 como vector de clonación y al hidróxido de aluminio como adyuvante, en un modelo murino.
Combinada con los antígenos P42 y P46 indujo resultados aceptables.
Jorge y cols. (2014) prefirieron la proteína de choque térmico P42, que representa una parte de la proteína de 65 kDa expresada ante condiciones de estrés bacteriano. La adyuvantaron con un aceite comercial y fue inoculada por vía intramuscular a cerdos.
Desencadenó las dos ramas de la respuesta inmunitaria, humoral y celular, concluyéndose que P42 constituía un candidato antigénico prometedor para el desarrollo de vacunas.
Chen y cols. (2003) también observaron una respuesta inmunitaria adecuada en ratones y cerdos cuando trabajaron con vacunas de ADN, concretamente, con el gen que expresaba esta misma proteína P42.

VÍAS DE ADMINISTRACIÓN INNOVADORAS VÍAS DE ADMINISTRACIÓN INNOVADORAS
Hay vacunas cuya vía de administración no ha sido la habitual.
La de Lin y cols. (2003) se basó en la administración oral de microesferas porosas de sílica con la cepa PRT-5 de M. hyopneumoniae, preparadas mediante un proceso de secado por pulverización conjunta.
Su efecto consistió fundamentalmente en la reducción de las lesiones neumónicas.
Uno de los últimos experimentos recurrió al sondaje oral de lechones, a los que se les aplicaba una concentración proteica procedente de un lisado bacteriano sonicado de la cepa patógena 232 después de su autoclavado y ultracentrifugación.
Se logró una reducción de las lesiones pulmonares, así como la presencia de anticuerpos a la semana de la vacunación, que también protegían la mucosa respiratoria. Esta preparación ofreció resultados alentadores, aunque se precisan más estudios para concluir con seguridad su protección eficaz en producción porcina (Ferreira y cols., 2023).
Mechler-Dreibi y cols. (2021) diseñaron una vacuna constituida por diversas proteínas encapsuladas por un material innovador, en forma de un complejo inmunógeno administrado por vía digestiva. Esta sustancia, denominada SBA-15, estaba formada por mesosporas de sílice de unos 10 nm de diámetro.
Preservaba los inmunógenos proteicos del pH ácido gástrico, pero se disolvía con el pH alcalino intestinal, lo que garantizaba la absorción de los inmunógenos vacunales en esta localización, sin haber sido dañados por las secreciones gástricas. Una vez más, esta formulación disminuyó las lesiones neumónicas y estimuló una inmunidad humoral aceptable de la mucosa digestiva, pero, como en otros estudios, estos resultados deben ser refrendados en un mayor número de animales.
Canelli y cols. (2023) idearon un inmunógeno inactivado, potenciado con nanoesferas de quitosano, en forma de nanopartículas liofilizadas.
Se desarrolló una buena respuesta en la mucosa nasal a partir de la semana de la vacunación intranasal, así como la síntesis de gran cantidad de IgGs e IgAs y una secreción abundante de γ-interferón. Parecía convertirse de nuevo en otra opción de futuro alternativa a las vacunas parenterales convencionales.

VACUNAS MIXTAS
La inmunodepresión que suele surgir después de la neumonía enzoótica favorece la infección por agentes secundarios como el PCV2 o el PRRSV.
M. HYOPNEUMONIAE + PRRSV
M. HYOPNEUMONIAE + PRRSV
Una vacuna que combinó el PRRSV con M. hyopneumoniae es la de Drexler y cols. (2010), basada en el tipo europeo (atenuado) del PRRSV y en una bacterina de M. hyopneumoniae, que generó una protección aceptable frente a ambos microorganismos. A conclusiones similares llegaron Stricker y cols. (2013) y Bourry y cols. (2015).
M. HYOPNEUMONIAE + PCV2
M. HYOPNEUMONIAE + PCV2
Herbich y cols. (2013) verificaron que la vacunación frente a M. hyopneumoniae y PCV2 resultaba tan eficaz como su inoculación por separado.
Otro experimento llevado a cabo con estos dos mismos agentes ofreció buenos resultados en función de la ganancia diaria de peso, la viremia causada por el PCV2 y la gravedad de las lesiones (Kaalberg y cols. 2017)
M. HYOPNEUMONIAE + PCV2 + PRRSV
M. HYOPNEUMONIAE + PCV2 + PRRSV
La eficacia obtenida por Sipos y Sipos (2022) después de la administración de dos vacunas mixtas bivalentes que contenían PCV2 y PRRSV, una intramuscular y la otra intradérmicamente con un dispositivo sin aguja, fue más cuestionable, al conseguirse tan solo una estabilización de las lesiones pulmonares.
Sin embargo, del análisis de otras vacunas bivalentes comerciales integradas por estos dos mismos virus se obtuvieron resultados más alentadores (Yang y cols., 2021), como también del estudio de alguna trivalente que, junto con una cepa de M. hyopneumoniae, incluía los genotipos 2a y 2b del PCV (Um y cols., 2022; Yang y cols., 2022).
Oh y cols. (2019) valoraron otra vacuna trivalente (PRRSV, PCV2 y M. hyopneumoniae). Aunque los resultados fueron buenos en términos de protección frente a estos tres agentes, su eficacia se resintió respecto a la aplicación por separado de las correspondientes vacunas monovalentes.
La vacunación simultánea con la glucoproteína GP5 del PRRSV, la Cap del PCV2b y la adhesina P97 de M. hyopneumoniae también generaba una respuesta humoral aceptable en ratones (Roques y cols., 2013).
M. HYOPNEUMONIAE + B. BRONCHISEPTICA
M. HYOPNEUMONIAE + B. BRONCHISEPTICA
Como representación de una vacuna formulada por dos bacterias, podemos aludir a la que incorporó B. bronchiseptica y M. hyopneumoniae.
Yim y cols. (2017) comprobaron que la primera bacteria potenciaba en ratones la síntesis de IgGs específicas de la segunda.
Como epílogo, se puede afirmar que la vacunación es utilizada en todo el mundo y las formulaciones más frecuentes han sido y siguen siendo las bacterinas intramusculares potenciadas con diferentes adyuvantes.
A pesar de los intentos de mejora explorados durante la última década, la eficacia vacunal continúa considerándose irregular debido a la gran variabilidad antigénica de las cepas circulantes, a los diferentes grados en la presión o a otros aspectos indeterminados de la respuesta inmunitaria, además de a diversos aspectos técnicos, como las condiciones inadecuadas de almacenamiento y/o administración o la falta de programas de vacunación.

ACCEDER A BIBLIOGRAFÍA

La inoculación intranasal de determinadas formulaciones ha producido resultados prometedores, que podrían convertirse en alternativas esperanzadoras, pero es aún largo el “camino experimental por recorrer”.
¿ESTAMOS INMUNIZANDO ADECUADAMENTE FRENTE A PCV2?
P
Descarga el PDF
l Circovirus porcino tipo 2 (PCV2) es uno de los agentes infecciosos más relevantes de la industria porcina de las últimas décadas. Su aparición hace ya más de 25 años, con consecuencias absolutamente devastadoras, supuso un punto de inflexión a nivel sanitario y productivo. Sin embargo, del mismo modo fue también revolucionaria la aparición de su medida de control más extendida a nivel mundial: la vacunación.
 M. Jiménez, M. Marcos y R. Menjón
Servicio Técnico MSD Animal Health
M. Jiménez, M. Marcos y R. Menjón
Servicio Técnico MSD Animal Health
PA día de hoy, casi 20 años después del lanzamiento de las primeras vacunas comerciales, no hay ningún otro producto en el mercado que genere más unanimidad sobre su eficacia. La vacunación frente a PCV2 está considerada mundialmente como la herramienta más eficaz, si no la única disponible, para el control de la circovirosis porcina, tanto en sus presentaciones clínicas como, más importante todavía, en sus presentaciones subclínicas.
Este hecho ha situado a la vacuna frente a PCV2 como el producto comercial destinado al ganado porcino más vendido en todos los países con producción, alcanzando tasas de vacunación cercanas al 100% en los cerdos en crecimiento.
EL ÉXITO DE LA VACUNACIÓN RADICA
EN SU CAPACIDAD DE
REDUCIR LA VIREMIA
INDUCIDA TRAS
LA INFECCIÓN Y LA SINTOMATOLOGÍA
CLÍNICA ASOCIADA
HASTA VALORES
MUY BAJOS O PRÁCTICAMENTE
INDETECTABLES
Los valores de viremia se han relacionado directamente con la clínica asociada a la infección, de modo que, controlando la viremia, se controla totalmente el impacto negativo de la infección.
El control de la viremia y de la sintomatología clínica ha sido demostrado, en mayor o menor grado, por todas las vacunas comerciales disponibles. Ahora bien, se han observado diferencias en la capacidad de control de la viremia y, por tanto, en su eficacia1,2,3 en función del producto comercial empleado, ya sea por:
Su composición antigénica.
Su adyuvante.
La combinación de ambos factores.
La razón exacta por la que se observan estas diferencias no se conoce, pero en nuestra opinión, es muy probable que la respuesta inmunitaria conferida por las diferentes vacunas tenga algo que ver.
¿QUÉ TIPO DE RESPUESTA INMUNITARIA
NECESITAMOS PARA
INDUCIR UNA BUENA PROTECCIÓN?
Varios estudios han demostrado que el éxito de la vacunación frente a PCV2 se basa en generar una adecuada respuesta inmunitaria de tipo humoral (anticuerpos totales y virus-neutralizantes) y celular.
Respuesta humoral
Se ha demostrado que los anticuerpos neutralizantes (AN) se correlacionan con menor replicación vírica y, por tanto, menor grado de enfermedad.
Respuesta celular
Varios estudios han demostrado la importancia de la respuesta celular en el control de la viremia, ya que las células secretoras de IFN-γ son un componente clave en el desarrollo de la respuesta celular adaptativa anti-PCV24,5
Sin embargo, a nivel práctico, ni la medición de los niveles de AN postvacunación ni la respuesta de células secretoras de IFN-γ son técnicas sencillas que se puedan hacer de manera rutinaria en cualquier laboratorio de diagnóstico, por lo que el conocimiento de la respuesta que generan las diferentes vacunas en términos de AN e inmunidad celular queda restringido a los estudios experimentales publicados.

Afortunadamente, la respuesta inmunitaria humoral y celular inducida por algunas vacunas está muy bien documentada, como es el caso de Porcilis® PCV, Porcilis® PCV M Hyo y Porcilis® PCV ID.
Numerosos estudios experimentales y de campo evidencian que las vacunas descritas generan una fuerte respuesta humoral de anticuerpos neutralizantes frente a la proteína de la cápside del PCV2 (base antigénica de las vacunas descritas) que se complementa con elevada respuesta de tipo celular, observándose tanto en animales vacunados con o sin desafío posterior5,6,7,8
¿TODAS LAS VACUNAS GENERAN
LA MISMA
RESPUESTA INMUNITARIA?
Existen varias vacunas comerciales disponibles y, entre ellas, existen diferencias en cuanto al tipo de antígeno y su concentración, así como que contienen.
La formulación elegida determina factores tan importantes como:
La capacidad de generar respuesta inmunitaria incluso en presencia de inmunidad maternal.
La calidad, cantidad y duración de la respuesta postvacunación.
DURACIÓN DE LA RESPUESTA INMUTARIA
Algunas de estas diferencias son fáciles de evidenciar, como la duración de la inmunidad, ya que, simplemente revisando las Fichas Técnicas de los productos comerciales, podremos observar grandes diferencias
Mientras que hay productos cuya duración de inmunidad se limita a 17 semanas, otros llegan hasta 26 semanas postvacunación, cubriendo ampliamente toda la fase de cebo9
CALIDAD Y CANTIDAD DE LA RESPUESTA INMUNITARIA
Las diferencias referentes a la calidad y cantidad de la respuesta inmunitaria generada no son tan sencillas de detectar y requieren de estudios experimentales que las evidencien.
se observa la respuesta humoral y celular frente a PCV2 de dos vacunas comerciales y un grupo control no vacunado.
Inmunidad celular (células secretoras de IFN-γ)
Células secretoras de IFN-γ específicas de PCV2
Edad (semanas)
Mientras que la vacuna B (Porcilis® PCV M Hyo) induce una respuesta muy marcada, la vacuna A induce una respuesta muy inferior, o incluso indetectable7, evidenciando de nuevo que la formulación elegida tiene una importancia clave en la calidad de la respuesta inmunitaria inducida.
La generación de una respuesta inmunitaria potente es compleja, habiéndose demostrado que puede verse afectada por la forma en la que se presenta el antígeno al sistema inmunitario.
Los antígenos que mantienen su conformación original son más inmunogénicos que los que pierden su estructura tridimensional, hecho conocido como “estabilidad conformacional” del antígeno.
VACUNAS CON LA MISMA BASE ANTIGÉNICA PUEDEN COMPORTARSE DE DIFERENTE MANERA SI NO TIENEN LA MISMA ESTABILIDAD CONFORMACIONAL
Las vacunas frente a PCV2 de MSD Animal Health están diseñadas con tecnología basada en la utilización de VLP (Virus-Like Particles) que permiten:
Mantener la conformación física original de las proteínas antigénicas, imitando su estructura tridimensional.
Expresar la conformación física original en la región inmunodominante mayor (Major Immunedominant Region –MRI).
ELISA PCV2 (título)
Edad (semanas)
GRÁFICA 1
Respuesta inmunitaria humoral y celular de cerdos vacunados.
A: Vacunas monovalentes de PCV y Mhyo registradas para uso simultaneo.
B: Porcilis® PCV M Hyo. C: Control sin vacunar.
Ello permite el establecimiento de respuestas muy potentes y eficaces, tanto de tipo humoral Th2 como celular Th110
¿PUEDE AFECTAR LA VÍA DE ADMINISTRACIÓN A LA RESPUESTA INMUNITARIA?
La vía de administración también puede afectar a la respuesta inmunitaria inducida por una vacuna.
Desde hace años se está generalizando el uso de vacunas intradérmicas, con numerosas ventajas frente a la administración intramuscular de las mismas, entre ellas la generación de una respuesta celular mayor y más temprana7
En la Gráfica 2 se muestra cómo la respuesta inmunitaria generada por Porcilis® PCV ID, tanto humoral como celular, es más robusta y temprana que la generada por el mismo antígeno, pero administrado intramuscularmente.
Ac totales frente a PCV2 (ELISA)
Células secretoras de IFNIFN-γ específicas de PCV2/10 6 PBMC
Semanas postvacunación


Células secretoras de IFN-γ específicas de PCV2
Semanas postvacunación
GRÁFICA 2
Respuesta humoral (Ac totales) y celular postvacunación vía intramuscular e intradérmica, vs. control sin vacunar.

¿CÓMO PODEMOS MEDIR LA RESPUESTA INMUNITARIA A NIVEL PRÁCTICO?
Como hemos comentado previamente, no es posible saber de manera rápida y sencilla si un animal está bien protegido postvacunación, pues no podemos medir de manera rutinaria los niveles de AN ni los niveles de inmunidad celular inducidos por la vacunación.
Sin embargo, sí podemos realizar de manera fácil, sencilla y económica técnicas serológicas basadas en la medición de anticuerpos totales que, aunque no son suficientes por sí mismos para predecir la protección, tienen cierta utilidad, como veremos a continuación.
SEROLOGÍA PARA EVALUAR LA INMUNIDAD
La serología frente a PCV2 puede ser muy útil para:
Determinar dinámicas de infección (sobre todo en animales no vacunados).
Evaluar los niveles de inmunidad maternal.
Decidir el programa vacunal.
En algunas ocasiones, determinar si nos encontramos frente a una correcta respuesta humoral postvacunación.
Este último punto es especialmente interesante, pues nos permite evaluar si se ha producido una correcta aplicación de la vacuna, hecho especialmente relevante en el contexto actual en el que la vacuna se usa en prácticamente todos los animales en crecimiento y representa, por tanto, una elevada inversión económica.
DINÁMICA DE RESPUESTA INMUNITARIA
Para poder utilizar la serología como herramienta de monitorización de la correcta vacunación, es necesario conocer la dinámica de respuesta inmunitaria de la vacuna que estamos empleando, puesto que no todas las vacunas ofrecen una seroconversión clara y homogénea.
LAS VACUNAS DE MSD ANIMAL HEALTH,
Porcilis® PCV,
Porcilis® PCV M Hyo y
Porcilis® PCV ID HAN
DEMOSTRADO UNA CLARA
Esta seroconversión postvacunal se observa siempre y cuando la vacuna se aplique a partir de las 3 semanas de vida, incluso en presencia de niveles elevados de inmunidad maternal11,12
Este hecho, observado claramente en los productos descritos, no es tan evidente en el caso de otras vacunas, como demuestran varias experiencias comparativas:
La Gráfica 1 evidencia la diferencia en respuesta humoral entre Porcilis® PCV M Hyo y otra vacuna comercial, también de aplicación intramuscular7
RESPUESTA DE ANTICUERPOS
TOTALES DETECTABLE 6
SEMANAS POSTVACUNACIÓN
MEDIANTE KITS
COMERCIALES HABITUALES
Título de Ac totales frente a PCVv (Log 2 )
En el caso de la vacunación intradérmica también se observan estas diferencias, como se muestra en la Gráfica 313 en la que se comparan los niveles de Ac totales entre dos vacunas de PCV aplicadas vía intradérmica.
Porcilis® PCV ID
Vacuna M
Edad (semanas)
GRÁFICA 3
Evolución temporal de los títulos de anticuerpos frente a PCV2 (expresados en valores Log2) en lechones vacunados vía ID a las 3 semanas de vida.

BIBLIOGRAFÍA
1. Opriessnig T, et al (2009). Vaccine 27 1002-1007
2. Reindl, M, et al (2010). IPVS ,Vancouver
3. Kaalberg et al (2017). Porcine Health Management 3:23
4. Krekarainen T, et al (2010). Veterinary immunology and immunopathology; 136 (3-4):185-93
5. Fort M et al (2009). Vaccine; 27 4031-4037
6. Catella et al (2017). ESPHM, Praga
El hecho de poder comprobar la correcta vacunación de los animales es especialmente relevante, debido a la gran inversión económica que implica, pero sobre todo a la posibilidad de implementar medidas correctivas de manera precoz en el caso de que sea necesario, sin necesidad de esperar a tener sintomatología clínica que nos haga sospechar de un posible fallo vacunal.
Adicionalmente, y teniendo en cuenta que actualmente es muy frecuente aplicar la vacuna frente a PCV2 en combinación con otras vacunas, la seroconversión frente a PCV2 es una herramienta de control indirecta de la aplicación de otros antígenos que no presentan una seroconversión tan clara y homogénea, y que, por tanto, no permiten su control de manera directa.
Como conclusión, para conseguir una óptima eficacia vacunal es imprescindible inducir una potente y homogénea respuesta inmunitaria, tanto de tipo humoral como celular, pues se ha demostrado su relación directa con la protección, y por tanto la eficacia.
La respuesta inmunitaria se ve influenciada por diferentes factores, entre ellos las características propias de la vacuna, por lo que la elección de uno u otro producto es clave para asegurar la máxima eficacia posible.
ES INTERESANTE CONTAR CON LA POSIBILIDAD DE PODER REALIZAR ESTUDIOS DE SEROCONVERSIÓN
POSTVACUNAL PARA MONITORIZAR SU CORRECTA APLICACIÓN Y PODER TOMAR MEDIDAS
CORRECTIVAS PRECOCES EN CASO DE SER NECESARIO
7. Canelli et al (2017). ESPHM, Praga
8. Martelli et al (2011).Veterinary Microbiology 149 339–351
9. CIMAVET. Fichas técnicas de CircoFlex y Porcilis PCV ID
10. Fariñas, F. SUIS nº 165. Marzo 2020.
11. Jiménez et al (2010). IPVS Vancouver
12. Martin-Valls et al (2023). Porcine Health and Management 9:40
13. Jiménez et al (2022). ESPHM, Budapest


FAUNET: UN OBSERVATORIO
DE
LAS POBLACIONES DE JABALÍ PARA SUSTENTAR POLÍTICAS PREVENTIVAS
FRENTE
A LA PESTE
PORCINA AFRICANA
Joaquín Vicente1*, Mizar Torrijo1, Marta Monfort1, Lorena Fernández-Mercado1, Davide Carniato1, Azahara Gómez-Molina1, Mario Sebastián-Pardo1, Carmen Ruiz-Rodríguez1, José Antonio Blanco1, Javier Fernández-López1, Sonia Illanas1, Vidal Montoro1, Jesús Barba1, Pablo Bernardos2, Daniel Toro2, Mencía Serrano2, Oskar Berdión3, Carme Rosell4, Joana Colomer4, Carmen Gómez-Peris5, Juan Miguel Burgui6, Fernando Escribano7, Carlos Martínez-Carrasco8, Alberto Fernández-Arias9, Francisco Carro10, Ramón Soriguer10, Pablo Palencia11 y Pelayo Acevedo1
1Instituto de Investigación en Recursos Cinegéticos, IREC (UCLM-CSIC-JCCM), Ciudad Real,2Subdirección General Adjunto de Producciones Ganaderas y Cinegéticas, Dirección General de,Producciones y Mercados Agrarios, Ministerio de Agricultura, Pesca y Alimentación, Madrid,3ARABA Cazadores Gestión, Elkarteko teknikaria/Técnico de la Asociación, VitoriaGasteiz,4Minuartia, Barcelona,5Servicio de Caza y Pesca, Dirección General de Medio Natural y Evaluación Ambiental, Conselleria de Agricultura, Desarrollo Rural, Emergencia Climática y Transición Ecológica, Valencia ,6Assistències Tècniques i Serveis (Caça i Pesca Continental), VAERSADepartament d'Obres i Projectes, Valencia ,7CRFS El Valle, ORTHEM, Murcia,8Departamento de Sanidad Animal (Facultad de Veterinaria), Universidad de Murcia, Murcia,9Servicio de Caza y Pesca de Aragón, Dirección General de Caza y Pesca, Departamento de Agricultura, Ganadería y Alimentación, Zaragoza,10Estación Biológica de Doñana, Consejo Superior de Investigaciones Científicas (CSIC), Sevilla,11instituto Mixto de Investigación en Biodiversidad, Universidad de Oviedo, CSIC, Mieres
*Email: joaquin.vicente@uclm.es

LLE
a expansión de la Peste Porcina Africana (PPA) por Europa supone una de las preocupaciones más significativas para el sector porcino, particularmente debido a la propagación del virus entre jabalíes y cerdos domésticos. Ante esta amenaza, se está llevando a cabo un estudio pionero, el Proyecto FAUNET, que tiene como objetivo proporcionar datos precisos sobre la densidad de jabalíes en diferentes áreas de estudio en toda España. Estos datos se utilizarán para ajustar las predicciones de los modelos de distribución de abundancia de jabalí, lo que permitirá a las autoridades tomar medidas preventivas y controlar la enfermedad de manera más eficaz.



EL JABALÍ Y LA AMENAZA
DE LA PESTE PORCINA
AFRICANA PARA EL SECTOR PORCINO EN EUROPA
Las enfermedades compartidas son las que pueden afectar a varias especies, incluyendo animales salvajes, ganado y a veces humanos. Un ejemplo es la Peste Porcina Africana (PPA), una enfermedad infecciosa causada por un virus muy virulento (familia Asfarviridae, género Asfivirus).

EN EUROPA, EL VIRUS DE LA PESTE PORCINA AFRICANA (VPPA) AFECTA A LOS JABALÍES Y A LOS CERDOS DOMÉSTICOS Y CASI TODOS LOS ANIMALES INFECTADOS MUEREN
La presencia del VPPA en los jabalíes es una gran amenaza y tiene serias consecuencias económicas para la industria porcina y sectores relacionados, incluyendo costes indirectos debido a restricciones comerciales.
2007
En 2007, se registraron brotes de PPA en Georgia y la enfermedad se propagó a los países vecinos, afectando a cerdos domésticos y jabalíes.
2014
En 2014, se notificaron los primeros brotes en la Unión Europea, que afectaron a jabalíes procedentes de los Estados bálticos y Polonia.

Desde entonces, la enfermedad se ha propagado a otros países de la UE y a países vecinos no pertenecientes a la UE. A pesar de los esfuerzos de investigación, aún no existe una vacuna comercial ni una cura.
Aunque la República Checa y Bélgica lograron eliminar la PPA en los jabalíes con una intervención rápida, el virus sigue propagándose y hay riesgo de que vuelva a aparecer en estos países, así como en otros países de la UE que no han sido afectados, como sucedió en Italia continental en enero de 2022.
EXISTEN AÚN MUCHAS INCÓGNITAS SOBRE EL RIESGO DE INTRODUCCIÓN, MANTENIMIENTO Y PROPAGACIÓN DE LA PPA EN POBLACIONES SUSCEPTIBLES, TANTO EN CERDOS DOMÉSTICOS COMO DE JABALÍES, SIENDO NECESARIO
INVESTIGAR MÁS SOBRE LOS FACTORES DE RIESGO INVOLUCRADOS EN LA INTRODUCCIÓN DE LA PPA EN NUEVOS TERRITORIOS, SU PROPAGACIÓN Y PERSISTENCIA PARA PODER
MEJORAR LAS POLÍTICAS DE PREVENCIÓN Y CONTROL
ESPACIALES DE LAS POBLACIONES DE JABALÍ?
Es crucial tener información precisa sobre el número de jabalíes que habitan una determina zona para gestionar sus poblaciones y controlar enfermedades como la PPA.
La PPA se propaga más allá de las fronteras de los países y ecosistemas, y los recientes cambios en las poblaciones de jabalíes, en constante crecimiento y expansión, han llevado a una mayor interacción con el porcino doméstico.
La industria porcina debe adoptar un enfoque multidisciplinario, conocido como 'Una Salud Única' o 'One Health', para entender las conexiones, causas y consecuencias de todos los factores que afectan la salud animal. Este entendimiento nos permitirá gestionar mejor el riesgo de la PPA.
La Comisión Europea, junto con todos los Estados Miembros, ha desarrollado una estrategia para controlar y erradicar la PPA en la UE. Esta estrategia incluye varias medidas para:
1 2
Prevenir la introducción de la enfermedad en áreas libres de ella.
Controlar y erradicar la enfermedad en las áreas afectadas.
Una de estas medidas consiste en que todos los Estados Miembros desarrollen un Plan de Acción para gestionar las poblaciones de jabalíes a largo plazo y reducir el riesgo de entrada y/o propagación del virus de la PPA. Nuestro plan nacional indica que:

Se promoverá la investigación de nuevos métodos para monitorear la especie.
Se desarrollarán puntos piloto de monitoreo para ajustar la estimación de la población basada en las bolsas de caza.
ANÁLISIS DE RIESGOS ANÁLISIS DE RIESGOS
Para luchar contra las enfermedades en animales salvajes, como la PPA en los jabalíes, es esencial realizar un análisis de riesgos (Figura 1).
Este análisis ayuda a identificar y medir los factores que pueden contribuir a la propagación de enfermedades entre diferentes especies. Con esta información, podemos prever cómo se propagaría la PPA y cuáles serían las consecuencias.
El análisis de riesgos debe adaptarse a cada situación y objetivo específico, lo que conlleva:
Considerar la cantidad de jabalíes en un área.
Identificar dónde y cómo interactúan con los cerdos (ya sea directa o indirectamente).
Entender cómo nuestras acciones afectan a estas interacciones.
MONITOREAR LAS POBLACIONES DE JABALÍES ES VITAL PARA EL ANÁLISIS DE RIESGOS DE LA PPA Y PARA DESARROLLAR POLÍTICAS PREVENTIVAS
QUE SEAN REALISTAS Y EFECTIVAS
DINÁMICA DEMOGRÁFICA


ZONAS DE INTERACCIÓN





PRÁCTICAS DE MANEJO



Monitorización poblaciones silvestres
Reducir amenazas de aparición y popagación de enfemedades compartidas

ANÁLISIS DE RIESGOS
Identificación y cuantificación de PELIGROS
FIGURA 1



Adaptado a circunstancias y objetivos específicos Predicción de la propagación de patógenos y sus CONSECUENCIAS


Monitorizar las poblaciones de jabalí (arriba) es fundamental para el subsecuente análisis de riesgos frente a la PPA en la interfaz jabalí/cerdo (abajo) y adoptar medidas preventivas adecuadas en cada contexto.
DISTRIBUCIÓN ESPACIAL Y TEMPORAL DE LAS POBLACIONES DE JABALÍES
Es importante monitorizar los jabalíes para entender cómo cambian sus poblaciones con el tiempo. Para hacer esto, usamos diferentes tipos de datos:
Estimaciones de densidad.
Dónde se encuentran (uso de diferentes hábitats).
Cómo se distribuyen.
Las estadísticas de caza son una fuente de información muy valiosa que puede ayudar al seguimiento de las poblaciones de jabalí a lo largo del tiempo y son especialmente útiles para grandes áreas. Sin embargo, pueden ser difíciles de usar porque están influenciadas por diferentes normativas, formas de recolección, tradiciones locales de caza y las características físicas de los lugares de caza.
Estas diferencias hacen que sea complicado comparar datos de caza entre diferentes países o regiones, siendo necesario determinar la densidad de la población de manera más fiable.
Para obtener una imagen más precisa, necesitamos determinar de manera fiable la densidad de jabalíes en un número representativo de poblaciones. Un buen complemento a esta información sería desarrollar puntos de referencia para monitorear la densidad de jabalíes usando métodos confiables.

A través de esta red de puntos se podrán ajustar las estimaciones de población basadas en datos de caza y nos darían una idea más precisa de cuántos jabalíes hay en diferentes áreas.
FAUNET: UNA RED DE PUNTOS DE OBSERVACIÓN
PARA MONITORIZAR LA ABUNDANCIA DEL JABALÍ EN ESPAÑA
Necesitamos más información para monitorizar a los jabalíes de manera efectiva. Por ello, se está llevando a cabo el proyecto FAUNET.
Financiado por la Subdirección General de Producciones Ganaderas y Cinegéticas del Ministerio de Agricultura Pesca y Alimentación, el proyecto determinará de manera fiable la densidad de jabalíes en un número representativo de poblaciones (Figura 2), complementando y aumentando en número otros puntos de seguimiento de las poblaciones de jabalí que ya habían sido establecidos por la Subdirección General.
EL OBJETIVO PRINCIPAL DE FAUNET ES OBTENER DATOS FIABLES SOBRE LA DENSIDAD DE JABALÍES EN VARIAS ÁREAS DE ESTUDIO EN TODO EL PAÍS



Estos datos de densidad se usarán para ajustar las predicciones de los modelos de distribución de abundancia de jabalí basados en estadísticas de caza. De esta manera, podremos obtener valores más precisos sobre la densidad de jabalíes a nivel nacional y así:
Utilizar el conocimiento de la densidad de los jabalíes, no solo para conocer su abundancia, sino también para aplicarlo a la gestión de sus poblaciones y al análisis de los factores de riesgo de transmisión de la PPA. Es decir, conocer el número de jabalíes “SI” importa de cara a su gestión y al desarrollo de políticas de lucha frente a la PPA.
Conocer los factores que determinan la abundancia poblacional del jabalí para poder actuar eficazmente sobre las causas.
Evaluar si los manejos implementados para controlar las poblaciones de jabalí son eficaces y en qué grado, y testar nuevos métodos para ello.

Evaluar la distribución de la abundancia y conectividad de las poblaciones de jabalí como base para actuar preventivamente o, en caso de emergencia confirmada de PPA, responder y minimizar los contactos entre las poblaciones conectadas de jabalí, reduciendo el riesgo de transmisión del patógeno y su transmisión al ganado porcino, e incrementando las posibilidades de éxito del control de la PPA.
OBJETIVOS DE FAUNET 1 2 3 4 5 6 7
Los objetivos específicos de FAUNET consisten en:
Generar información científica independiente, aportando tendencias temporales y patrones espaciales de la abundancia del jabalí representativas para el territorio nacional.
Desarrollar una red activa para el seguimiento de la fauna, incorporando diferentes actores, como administraciones regionales y nacionales, sector cinegético, áreas protegidas, instituciones de investigación y profesionales.
Proporcionar una guía sobre métodos y protocolos para el seguimiento poblacional del jabalí, difícil de censar, en estrecha colaboración con las instituciones nacionales y autonómicas, y profesionales de la gestión de fauna, haciendo transferencia de los conocimientos adquiridos.
Apoyar a los puntos de observación establecidos por las administraciones y profesionales, proporcionando formación y facilitando el diseño de campo, el procesamiento y el análisis de datos para obtener densidades de jabalí. Se pretende que este seguimiento a largo plazo constituya un observatorio capaz de estimar las tendencias poblacionales de cada momento.
Aunque el objeto principal del estudio sea el jabalí y la PPA, las técnicas para determinar densidades se extenderán a otras especies y variables epidemiológicas, de manera que otros sectores puedan también beneficiarse de las metodologías que se desarrollen.
Un ejemplo sería el seguimiento de rumiantes silvestres que puedan constituir reservorios de enfermedades, como la brucelosis o la tuberculosis, para sus homólogos domésticos.
Mejorar los protocolos de determinación de abundancia poblacional del jabalí, calibrando métodos, incorporando nuevas tecnologías de la información y la ciencia ciudadana.
Identificar áreas de estudio, aportando base científica para progresar en el seguimiento armonizado del jabalí en España, particularmente en las áreas menos estudiadas.



FIGURA 2
Distribución de la selección inicial de las áreas de estudio de FAUNET, que vienen incrementándose en número continuamente gracias a la transferencia de metodología y la participación de administraciones y profesionales de la gestión del jabalí.
IDENTIFICACIÓN DE LA INTERFAZ ENTRE JABALÍES Y CERDOS
Conocer las densidades de jabalíes en distintas zonas de España ayudará a identificar y delimitar mejor las áreas donde los jabalíes y los cerdos pueden encontrarse en el espacio y tiempo.
Este punto de encuentro, llamado interfaz, es importante para el estudio de enfermedades porque es donde diferentes grupos y especies pueden interactuar y potencialmente transmitir enfermedades.
La interfaz incluye:
CONTACTOS DIRECTOS
Los jabalíes y los cerdos usan el mismo espacio al mismo tiempo.
CONTACTOS INDIRECTOS
Pueden ocurrir a través de elementos del ecosistema, personas que trabajan en granjas de cerdos o que no están relacionadas con ellas, así como a través de vectores como los insectos.
LAS INTERACCIONES EN LA INTERFAZ
PUEDEN CONLLEVAR A LA TRANSMISIÓN DE ENFERMEDADES
El riesgo de transmisión depende de:
Cómo se comportan y se manejan los jabalíes.
Cómo se lleva a cabo la producción de cerdos (por ejemplo, si es una granja extensiva o intensiva, si los cerdos están al aire libre en alguna etapa de la producción).
El nivel de las medidas de bioseguridad implementadas en las granjas.
IMPLEMENTACIÓN DE UN MÉTODO DE TRABAJO NACIONAL Y UNIFICADO
FAUNET es un proyecto a largo plazo que se implementará gradualmente (Figura 3). Su principal meta es ser útil para aquellos que se encargan de supervisar y gestionar las poblaciones de jabalíes, así como de manejar los riesgos en las áreas donde se crían cerdos
1Implemententación de una red piloto nacional con protocolos armonizados para determinar densidad poblacional mediante foto-trampeo.
Inclusión inicial de áreas de estudio representando a todas las C.C.A.A
3
Tendencias poblacionales de la fauna silvestre (mamíferos terrestres con especial al jabalí). Los resultados de la monitorización quedan disponibles abiertamente.
2

Mejora de la red El diseño de FAUNET (nº y distribución de poblaciones) se refinará para generar tendencias poblacionales representativas a escala nacional.
4
Monitorización integrada El seguimiento poblacional de la fauna se integrará con otros taxones y variables sanitarias.

FIGURA 3
FAUNET pretende desarrollar una red activa a largo plazo para el seguimiento del jabalí representativa del territorio nacional, incorporando diferentes actores, enfocado hacia el jabalí, pero buscando integrar otros taxones y variables epidemiológicas y ecológicas de forma progresiva.
Para empezar, es fundamental establecer una red de trabajo a nivel nacional y aplicar un método unificado para determinar la cantidad de jabalíes, utilizando cámaras de foto-trampeo para capturar imágenes de estos animales en su hábitat natural.
A LARGO PLAZO, EL OBJETIVO ES EVALUAR CÓMO CAMBIAN LAS
POBLACIONES DE JABALÍES CON EL TIEMPO, SIENDO ESTA INFORMACIÓN MUY
VALIOSA PARA LOS INVESTIGADORES Y PARA QUIENES
TOMAN DECISIONES SOBRE POLÍTICAS
MEDIOAMBIENTALES Y DE SALUD
MONITORIZACIÓN
POBLACIONAL DEL JABALÍ PARA UNA GESTIÓN EFICAZ CON BASE CIENTÍFICA
El proyecto FAUNET utiliza una metodología que se mejora constantemente según los nuevos conocimientos adquiridos con el fin último de proponer las decisiones más efectivas (Figura 4).
La monitorización del jabalí es un proceso clave en este proyecto e implica recoger datos para identificar tendencias y patrones en las poblaciones de esta especie. Estos datos se utilizan para evaluar constantemente nuestros objetivos y la eficacia de las medidas implementadas.
Este enfoque se conoce como "manejo adaptativo" que, en este caso, se aplica para prevenir la PPA.
En el manejo adaptativo de las poblaciones de jabalí y los conflictos asociados, es esencial monitorizar constantemente estas poblaciones. Este proceso se mejora continuamente con la información que se recoge.
Los sectores que se ven afectados por los conflictos con los jabalíes, como el sector ganadero, necesitan y deben promover que el control de estas poblaciones se base en una monitorización con fundamentos científicos. Esto permitirá tomar las mejores decisiones de manera informada.
ENFERMEDADES COMPARTIDAS




ADAPTATIVA FAUNA SILVESTRE SEGUIMIENTO FAUNA SILVESTRE 1 2 3 4 5 6

FIGURA 4






Establecer objetivos
Gestión por objetivos
Monitorizar cumplimiento objetivos
Uso y evaluación de los datos
Objetivos alcanzados
Modificar objetivos o gestión
Pasos a seguir para la implementación y el mantenimiento de un esquema adaptativo de monitorización y manejo de las poblaciones de jabalí (derecha). La monitorización consiste en recolectar datos que luego se utilizan para describir tendencias, patrones poblacionales y evaluar continuamente tanto objetivos de monitoreo y gestión, como la adecuación de la gestión implementada, en concreto, la gestión de enfermedades compartidas, como la PPA, entra fauna silvestre y ganado (izquierda).

PROTOCOLO DE FOTO-TRAMPEO VALIDADO
Para determinar la densidad de las poblaciones de jabalíes, se utiliza un método que implica el uso de cámaras de foto-trampeo. Estas cámaras capturan imágenes de los jabalíes, que luego se analizan utilizando un modelo llamado "modelo de encuentro aleatorio" (REM, de sus siglas en inglés).
Este método se basa en reescalar la tasa de contacto obtenida con las cámaras a un valor de densidad a través de la determinación del movimiento de los animales y la zona de detección de las cámaras.
Este método se ha estado implementando previamente en el Observatorio Europeo de Fauna Silvestre (EOW) desde 2022, financiado por la Autoridad Europea de Seguridad Alimentaria (EFSA, ver enlace al protocolo de campo en la Figura 4).
El trabajo de campo se realiza durante el final del verano y el otoño (Figura 5)
Las cámaras de foto-trampeo se colocan en una cuadrícula con una distribución uniforme, con un mínimo de 35-40 ubicaciones y una separación de aproximadamente 1-1,5 km.
Las cámaras se montan a una altura de 40-50 cm del suelo y se orientan al norte y en plano horizontal.
Las cámaras se configuran para que funcionen las 24 horas del día para capturar la mayor cantidad posible de imágenes cuando los jabalíes pasan frente a ellas.
Después de aproximadamente 1,5 meses en el campo, se retiran los equipos.
Para procesar y analizar la información recopilada, se utiliza la plataforma web AGOUTI (Figura 4)
Esta plataforma utiliza herramientas de inteligencia artificial para reconocer especies, contar individuos y localizar a los individuos dentro del campo de visión de las cámaras. Esto nos permite determinar los parámetros de movimiento necesarios para convertir las tasas de contacto en un valor de densidad poblacional.
ACCEDER A EOW
ACCEDER A WEB AGOUTI


FIGURA 5
El protocolo aplicado por FAUNET está disponible online. Se muestra el escritorio de trabajo de la aplicación web AGOUTI desde la que se procesa y analiza la información generada por las cámaras de foto-trampeo.


FIGURA 6

Ejemplo de ubicación de la malla de cámaras foto-trampeo en una zona de estudio de FAUNET (arriba). Colocación de cámaras en campo por el equipo de FAUNET (abajo).
ACCEDER AL Protocolo de Instrucciones para la colocación de cámaras de foto-trampeo y cálculo de densidad de mamíferos medianos y grandes




FIGURA 7
Ejemplo de imágenes de foto-trampeo de jabalí obtenidas por FAUNET.
UNA APROXIMACIÓN
COLABORATIVA EN
CONTINUO CRECIMIENTO
FAUNET es una iniciativa colaborativa que busca ser sostenible a largo plazo. Está conformada por administraciones regionales, profesionales de la gestión de la fauna silvestre y expertos en el manejo del riesgo sanitario entre la fauna y el ganado.
FAUNET está abierto a profesionales, investigadores, administraciones y sectores ganaderos que puedan proporcionar al menos un punto de observación.
FAUNET ofrece a sus colaboradores:
Formación sobre cómo determinar la densidad poblacional de los jabalíes y otras especies de fauna silvestre.
Protocolos prácticos para calcular la densidad basados en el uso de cámaras de foto-trampeo.
Asistencia continua en el diseño del estudio, implementación en campo, procesamiento y análisis de datos.
Herramientas online para el procesamiento y gestión de imágenes, incluyendo el uso de inteligencia artificial.
Oportunidades para participar en redes de trabajo, conferencias y webinarios.
Hasta 2027, las actividades de FAUNET incluirán:
Generar valores de densidad en un número creciente de poblaciones de jabalíes mediante el uso de cámaras de fototrampeo.
Calibrar un modelo de distribución y abundancia de jabalíes para obtener un mapa nacional de las densidades de la especie.
Transferir de manera colaborativa protocolos prácticos para calcular la densidad de jabalíes basados en foto-trampeo a los sectores involucrados.


ACCEDER A PÓSTER
INFORMATIVO SOBRE FAUNET
Agradecimientos: Quisiéramos agradecer a los diferentes servicios regionales de caza, medioambiente y sanidad animal, respectivamente, así como a los responsables de diversos espacios protegidos, reservas nacionales de caza y acotados gestionados por las C.C.A.A. (Galicia, Castilla y León, Cantabria, Navarra, La Rioja, Aragón, Catalunya, Comunitat Valenciana, Región de Murcia, Castilla-La Mancha, Andalucía) involucradas en esta primera selección de puntos piloto, no olvidando la colaboración prestada por las sociedades de cazadores (Galicia), el O.A. P. N. (Quintos de Mora, Parque Nacional de Doñana) y la Estación Biológica de Doñana. Es una iniciativa financiada mediante una encomienda de gestión por la Subdirección General de Producciones Ganaderas y Cinegéticas del Ministerio de Agricultura Pesca y Alimentación.
LA INFORMACIÓN GENERADA SOBRE LA ABUNDANCIA DE JABALÍES SERÁ ESENCIAL PARA GESTIONAR Y CONTROLAR SUS POBLACIONES, ASÍ COMO PARA EVALUAR
VACUNAS DE ADN CON NANOPARTÍCULAS LIPÍDICAS: AVANCES EN EL DESARROLLO DE VACUNAS DE USO
VETERINARIO
LLV

Descarga el PDF
os virus son una clase especial de microorganismos que deben entrar en las células del hospedador para replicarse. La mayoría de los virus solo utilizan una o unas pocas proteínas víricas para adherirse y entrar en las células y los anticuerpos dirigidos a estas proteínas de fijación viral (VAP, del inglés "viral attachment proteins") pueden bloquear su adhesión y evitar la infección. Por ello, las VAP son objetivos ideales para el desarrollo de vacunas.
 Hiep Vu DVM, MSc. PhD
Hiep Vu DVM, MSc. PhD
Virólogo experto en enfermedades respiratorias, Universidad de Nebraska –Lincoln
COMPITIENDO EN LA CARRERA DE LA EVOLUCIÓN VÍRICA
Un reto importante en el desarrollo de vacunas frente a virus, especialmente los que tienen un genoma de ARN, es la rápida evolución de los genomas virales. Por tanto, las vacunas contra estos virus requieren de actualizaciones periódicas para adaptarse a las cepas virales prevalentes en el campo.
Sin embargo, debido al coste y tiempo necesarios para el proceso de autorización de las vacunas, las de uso veterinario no se suelen actualizar con la rapidez suficiente para seguir el ritmo de la evolución constante de los virus en el campo.
Para acelerar la actualización de los antígenos vacunales, el Centro de Biológicos Veterinarios (CVB) del USDA publicó un memorándum que ofrece orientación para la concesión de licencias de vacunas veterinarias biológicas no replicantes y no viables (Memorándum 800.213, firmado el 03/12/2018).
Según este Memorándum, una vez que se ha establecido una plataforma de producción de vacunas no replicantes no viables y se ha autorizado el producto inicial, se puede agilizar la autorización de nuevos productos que contengan variantes de secuencia de los mismos antígenos vacunales, siempre que no haya cambios en el proceso de fabricación.
ESTAS NUEVAS NORMATIVAS HAN GENERADO INTERÉS EN EL DESARROLLO DE NUEVAS
PLATAFORMAS DE VACUNAS NO REPLICANTES E INVIABLES PARA EL DESARROLLO DE VACUNAS
DE USO VETERINARIO
LA MIRADA PUESTA EN LAS VACUNAS DE ADN
Los plásmidos de ADN se consideran no infecciosos y seguros para su uso, tanto en humanos como en animales, pero, aunque las vacunas de ADN se han evaluado en múltiples estudios, la inmunización con un plásmido de ADN desnudo suele generar respuestas inmunitarias subóptimas debido a una captación celular ineficaz.
Para mejorar la administración de plásmidos de ADN se han ideado varios métodos, como:
Administración sin aguja ("gene gun administration")

Electroporación in vivo

A pesar de estos avances, la eficacia de las vacunas de ADN no suele estar a la altura de las expectativas.
UNA NUEVA ESPERANZA –NANOPARTÍCULAS LIPÍDICAS
Las nanopartículas lipídicas (LNP) han demostrado ser transportadores eficaces para el desarrollo de vacunas basadas en el ADN, ya que:
Protegen el ADN de la degradación.
Favorecen su fijación y captación por las células diana.
LAS LNP CONTRIBUYEN A AUMENTAR LA EXPRESIÓN DEL ANTÍGENO DE LA VACUNA EN EL HOSPEDADOR, POTENCIANDO ASÍ SU RESPUESTA INMUNITARIA


LA BÚSQUEDA DE UNA VACUNA

AMPLIAMENTE PROTECTORA FRENTE AL SIV
Nuestro laboratorio se ha centrado recientemente en el desarrollo de una formulación de LNP adaptada para uso en cerdos, utilizando el virus de la Influenza Porcina (SIV) como patógeno modelo para optimizar la formulación.
El virus de la Influenza Porcina es un importante patógeno respiratorio, causante de cuantiosas pérdidas económicas al sector porcino.
Más allá de su impacto en la industria porcina, este virus plantea considerables problemas de salud pública debido a su potencial zoonótico.
Los Influenzavirus se clasifican en subtipos en función de las dos proteínas de superficie:
Neuraminidasa (HA)

Hemaglutinina (HA)
Hay tres subtipos principales de SIV que circulan en las granjas porcinas:
H1N1
H1N2
H3N2
Estos subtipos se subdividen a su vez en clados y la distancia genética entre dos clados puede alcanzar el 20%.
LA GRAN DIVERSIDAD GENÉTICA Y LA CONTINUA

APARICIÓN DE NUEVAS VARIANTES DEL SIV EN LAS CABAÑAS PORCINAS PLANTEAN RETOS

CONSIDERABLES PARA EL DESARROLLO DE UNA
VACUNA AMPLIAMENTE PROTECTORA
La proteína HA del SIV desempeña un papel crucial en la adhesión del virus a los receptores celulares.
Para dirigirnos a este componente vírico esencial, clonamos el gen HA en un plásmido de ADN.

Posteriormente, desarrollamos una formulación de nanopartículas lipídicas para encapsular el plásmido de ADN, generando la denominada vacuna LNP-ADN.
Cuando se evaluó en cerdos, la vacuna LNP-ADN indujo una respuesta inmunitaria robusta, con la detección de títulos elevados de anticuerpos entre los 7 y 14 días después de la vacunación.
Obtención de muestras de cerdos infectados con SIV


Aplicación de la vacuna LNP-ADN en la granja

Secuenciación del gen HA


Síntesis y clonación del gen
Encapsulación del gen HA en nanopartícula lipídica
FIGURA 1.
Esquema del proceso de obtención de la vacuna LNP-ADN. Tras la obtención de muestras del SIV en la granja, se procede a la secuenciación de genoma viral para poder sintetizar, clonar y encapsular el gen HA en nanopartículas lipídicas, obteniendo así la vacuna LNP-ADN para su aplicación en la granja.
ES SIGNIFICATIVO QUE LOS CERDOS VACUNADOS
CON UNA SOLA DOSIS DE LA VACUNA
ESTUVIERAN COMPLETAMENTE PROTEGIDOS
CONTRA LA INFECCIÓN CON UNA CEPA
VIRULENTA DEL SIV
Los resultados se han publicado en la revista científica "Vaccines" (Nguyen et al., 2023).
CONCLUSIÓN
La vacuna LNP-ADN ha demostrado una eficacia extraordinaria en cerdos. Este innovador enfoque vacunal es muy prometedor para combatir enfermedades víricas, especialmente las causadas por virus ARN como el SIV.
Con los avances en las tecnologías de secuenciación, los productores están secuenciando con frecuencia el genoma de los virus que afectan a sus granjas.
Si se identifican nuevas variantes virales, sus genes VAP podrían sintetizarse rápidamente y encapsularse en LNP para producir una nueva vacuna que corresponda a la nueva variante.
ESTAS INNOVADORAS PLATAFORMAS DE VACUNAS CONTRIBUYEN A ACELERAR NUESTRA RESPUESTA A LAS NUEVAS VARIANTES VÍRICAS EMERGENTES
Aunque solo hemos demostrado la eficacia de la vacuna LNP-ADN con el SIV, el sistema podría adaptarse para el desarrollo de vacunas frente a diversos patógenos porcinos endémicos y emergentes, como los Circovirus Porcinos o los Pestivirus Porcinos Atípicos.
Resumen del artículo: Nguyen, T.N., Kumari, S., Sillman, S., Chaudhari, J., Lai, D.C., Vu, H.L.X., 2023. A Single-Dose Intramuscular Immunization of Pigs with Lipid Nanoparticle DNA Vaccines Based on the Hemagglutinin Antigen Confers Complete Protection against Challenge Infection with the Homologous Influenza Virus Strain. Vaccines (Basel) 11.
LEER ARTÍCULO
DESENMASCARANDO AL LINAJE PANDÉMICO DEL VIRUS DE LA
INFLUENZA PORCINA EN DOS
GRANJAS CON DIFERENTE
MANIFESTACIÓN CLÍNICA
E
Descarga el PDF
l virus de la influenza porcina tipo A o Swine Influenza A Virus (swIAV) es un agente que suele detectarse frecuentemente en los brotes de enfermedades respiratorias en las explotaciones porcinas españolas (Sosa Portugal et al., 2020). Este virus es considerado un agente primario (Loeffen et al., 1999) y juega un papel importante dentro del Complejo Respiratorio Porcino (CRP).

Salvador Oliver1, Antonio Martínez2 , Ana del Valle1 y David Espigares1
1CEVA Salud
Animal, Barcelona, España
2Grupo Vall Companys, Lleida, España
ELos subtipos H1N1, H1N2 y H3N2 han sido tradicionalmente los más extendidos en Europa, aunque en los últimos años la detección del linaje H1N1 pandémico (H1panN1) es cada vez más frecuente.
EN
ESPAÑA, MÁS DEL 90% DE LAS
GRANJAS
SON SEROPOSITIVAS A sw IAV, ENCONTRÁNDOSE EN MUCHOS CASOS GRANJAS SEROPOSITIVAS A MÁS DE UN SUBTIPO (SIMON-GRIFÉ ET AL., 2011)
El objetivo de este estudio fue comparar la dinámica de infección de los subtipos de swIAV en dos granjas con diferente presentación clínica.
DINÁMICA
DE INFECCIÓN DE swIAV EN GRANJAS PORCINAS
MATERIALES Y MÉTODOS 1 2 3
El estudio se llevó a cabo en dos orígenes diferentes (granjas A y B) dentro de la misma pirámide de producción.

La granja A presentaba signos clínicos recurrentes compatibles con la infección por swIAV a las 9 semanas de edad.
La granja B no mostraba signos clínicos aparentes durante este periodo.
Las nulíparas de ambas granjas se vacunaban de forma rutinaria frente a los subtipos clásicos (H3N2, H1N2 y H1N1) de swIAV.
A las 3 semanas de edad, se seleccionaron al azar 60 lechones de la granja A (3 por corral) y 48 de la granja B (6 por corral) que fueron identificados individualmente con crotal numerado y muestreados mediante raspados traqueobronquiales. Cuando estos animales alcanzaron las 9 semanas de vida, se repitió el mismo muestreo (Tabla 1).
Los hisopos traqueobronquiales se procesaron mediante PCR de swIAV en pools de 3 (mismo corral).
Todos los pools positivos se subtiparon mediante PCR.
Se registró la tos de todos los lechones del corral (Tabla 1), puntuándose como:
Ausencia (0).
Baja incidencia (+).
Incidencia moderada/alta (++).

EPIDEMIOLOGÍA

TABLA 1
Diseño del estudio.

(60 lechones)
Grupo B (48 lechones)
Muestreo con hisopo traqueobronquial a las 3 y 9 semanas de edad
Evaluación de la tos a las 3 y 9 semanas de edad
GRANJA A 60 lechones (3 por corral) Todos los lechones del corral
GRANJA B 48 lechones (6 por corral) Todos los lechones del corral

3 semanas de edad
1er muestreo + evaluación de tos

9 semanas de edad
2o muestreo + evaluación de tos

Análisis de muestras traqueobronquiales por PCR

RESULTADOS
TABLA 2
Resultados de la granja A.
Detección de muestras positivas
Subtipado de muestras positivas
Los resultados de la detección de swIAV y de la incidencia de tos en las explotaciones A y B se muestran en las Tablas 2 y 3, respectivamente.
GRANJA A 3 semanas de vida 9 semanas de vida
Pools PCR positivos a swIAV* 18/20 (90%) 8/20 (40%)
Detección del linaje pandémico en los pools PCR positivos a swIAV* 3/18 (16,7%) 8/8 (100%)
Incidencia de tos (0, +, ++) 0 ++
*Los hisopos traqueobronquiales se procesaron en pools de 3 (mismo corral).
GRANJA B 3 semanas de vida 9 semanas de vida
Pools PCR positivos a swIAV* 16/16 (100%)
Detección del linaje pandémico en los pools PCR positivos a swIAV*
Incidencia de tos (0, +, ++)
0/16 (0%)
*Los hisopos traqueobronquiales se procesaron en pools de 3 (mismo corral).
0/16 (0%)
0/0 (0%)
3
Resultados de la granja B.
3 semanas de vida
A nivel laboratorial, se detectó swIAV en el 90% y 100% de los pools a 3 semanas de vida en las granjas A y B, respectivamente.
CUADRO CLÍNICO
CUADRO CLÍNICO
A nivel clínico, únicamente se observaron toses en los lechones de la granja A a las 9 semanas de edad.
ANÁLISIS LABORATORIAL
ANÁLISIS LABORATORIAL
9 semanas de vida
A las 9 semanas de vida, se obtuvieron un 40% y un 0% de pools positivos a swIAV en las granjas A y B, respectivamente.
EL LINAJE PANDÉMICO DE sw IAV SOLO SE DETECTÓ EN LA GRANJA A
Concretamente, H1pdm09 fue detectado en el 16,7% y 100% de las muestras positivas a swIAV a 3 y 9 semanas de edad, respectivamente.
Adicionalmente, las muestras tomadas en presencia de toses (Granja A a las 9 semanas de vida) también se procesaron por PCR para la detección de Mesomycoplasma hyopneumoniae, obteniendo un resultado negativo en todas las muestras.
 TABLA
TABLA

DISCUSIÓN Y CONCLUSIONES
En ambas granjas se detectó swIAV en la mayor parte de muestras tomadas a 3 semanas de vida. No obstante, a esta edad no había clínica compatible, muy probablemente debido a la inmunidad maternal que poseían los lechones.
La única diferencia entre estas dos granjas al inicio del estudio fue el porcentaje de lechones que llegaron infectados con el linaje pandémico del sitio 1 de la granja A.
Este H1pdm09 con toda probabilidad se fue transmitiendo posteriormente de forma horizontal a más lechones durante la fase de transición de la granja A, desencadenando los signos clínicos observados a 9 semanas de vida.
Este hecho pone de relieve el papel de las cerdas en el control de la influenza porcina, incluso en las manifestaciones clínicas que se pueden observar al final del periodo de transición de los lechones, que pueden estar derivadas de la infección de una pequeña parte de los animales del lote, que posteriormente se disemina de forma horizontal durante el periodo de transición.
Este estudio también remarca la importancia de un buen diagnóstico de cara a la elección del protocolo vacunal más apropiado, ya que la mayor prevalencia de unos subtipos puede enmascarar la presencia de otros que, a la postre, pueden ser los causantes de los signos clínicos.
BIBLIOGRAFÍA
Loeffen WL, Kamp EM, Stockhofe-Zurwieden N, van Nieuwstadt AP, Bongers JH, Hunneman WA, Elbers AR, Baars J, Nell T, van Zijderveld FG. Survey of infectious agents involved in acute respiratory disease in finishing pigs. Vet Rec. 1999 Jul 31;145(5):123-9. doi: 10.1136/vr.145.5.123. PMID: 10466829.
Simon-Grifé M, Martín-Valls GE, Vilar MJ, García-Bocanegra I, Mora M, Martín M, Mateu E, Casal J. Seroprevalence and risk factors of swine influenza in Spain. Vet Microbiol. 2011 Apr 21;149(1-2):56-63. doi: 10.1016/j.vetmic.2010.10.015. Epub 2010 Nov 4. PMID: 21112702.
Sosa Portugal S, Cortey M, Tello M, Casanovas C, Mesonero-Escuredo S, Barrabés S, Pineda P, Wacheck S, Martín-Valls G, Mateu E. Diversity of influenza A viruses retrieved from respiratory disease outbreaks and subclinically infected herds in Spain (2017-2019). Transbound Emerg Dis. 2021 Mar;68(2):519-530.

A LA INFLUENZA

Protección frente los subtipos H1N1, H3N2, H1N2 y H1N1 pandémico
Reducción de signos clínicos y carga vírica pulmonar


ROTA al der irus


