






Ne extindem echipa AIS Clinics & Hospital și căutăm colegi noi, profesioniști, orientați spre calitate și colaborare, pentru a completa o echipă medicală multidisciplinară!
Ce oferim:
• Clinici moderne și aparatură de ultimă generație;
• Pachet financiar motivant;
• Oportunități de dezvoltare profesională.


Posturi disponibile:
• Registrator medical
• Asistent medical generalist
• Asistent medical – stomatologie
• Asistent balneofiziokinetoterapie
• Tehnician maseur / specialist drenaj limfatic
• Asistent radiologie
• Asistent farmacie
• Farmacist
• Tehnician IT
• Biochimist specialist
• Biolog specialist – imunologie
• Biolog specialist – hematologie

MONTARE HOLTER EKG 24H/36H/48H
MONTARE HOLTER TENSIUNE ARTERIALĂ 24H/48H
ÎNGRIJIREA TUBULUI/TUBURILOR DE DREN


CONSULTAȚII MEDICALE CU PLATĂ**
INJECȚII
DEZINFECTARE, TRATARE, PANSARE ESCARE ÎNGRIJIREA STOMELOR
MONTARE SONDĂ URINARĂ (FEMEI)
ADMINISTRARE TRATAMENT PERFUZABIL SUPRIMARE FIRE
ADMINISTRARE TRATAMENT INTRAVENOS/ INTRAMUSCULAR/SUBCUTANAT/ INTRADERMIC
RECOLTAREA PROBE BIOLOGICE
MONTARE BRANULĂ
*Serviciile vor fi oferite pe baza unei recomandări medicale, în limita bugetului disponibil **În funcție de starea de sănătate a fiecărui pacient, serviciile medicale pot necesita prezența medicului


În contexul diabetului zaharat, osteoporoza reprezintă o provocare diagnostică și terapeutică majoră

Conform ultimelor date comunicate de Federația Internațională de Diabet, diabetul zaharat a ajuns o pandemie globală, afectând aproximativ 537 milioane de adulți la nivel mondial în 2021, dintre care peste 95% sunt cazuri de diabet zaharat tip 2; din nefericire, se estimează că, până în 2030, cifra va atinge 643 de milioane. În paralel, osteoporoza - caracterizată prin risc crescut de fracturi - afectează aproximativ 21% dintre femeile de peste 50 de ani și 6% dintre bărbați. Există o prevalență de 27.7% a osteoporozei în rândul pacienților cu diabet zaharat tip 2, pe baza a peste 11600 de cazuri, cu variație a prevalenței între 7.29 % și 53.71%, diferențe explicate parțial de heterogenitatea criteriilor de diagnostic (localizare DEXA), particularități geografice și etnice (cu prevalențe mai mari în Asia), dar și de variabile demografice precum vârsta, sexul, durata diabetului zaharat și prezența complicațiilor cronice. Aceste date ridică semnale îngrijorătoare: diabetul zaharat nu doar crește în prevalență, ci aduce în prim-plan fragilitatea osoasă - o complicație adesea subdiagnosticată, atrăgând atenția cadrelor medicale asupra evaluării acelor pacienți care prezintă o densitate minerală osoasă (DMO) aparent normală sau chiar crescută, dar care au totuși un risc semnificativ crescut de fracturi, în special de șold. Această discrepanță între valorile DMO și riscul real de fractură face ca osteoporoza în contexul diabetului zaharat să reprezinte o provocare diagnostică și terapeutică majoră. Într-un context în care complicațiile silențioase ale diabetului generează costuri enorme pentru sistemele de sănătate, implementarea strategiilor de screening precoce pentru osteoporoză devine o intervenție nu doar clinic necesară, ci și economic justificabilă.
Copierea fără acordul scris al editurii a oricăror elemente de grafică sau conținut editorial apărute în revistele editurii sunt considerate furt de proprietate intelectuală și intră sub incidența legii. As. Univ. Dr. Ana Corlan – UMF „Victor Babeș” din Timișoara

Coordonator medical: Dr. Aurora Bulbuc, medic primar Medicină de familie
Editor: Fin Watch
Calea Rahovei, nr. 266-268, Sector 5, Bucureşti,* Electromagnetica
redactie@finwatch.ro
Aderența medicamentoasă (AM) reprezintă gradul în care comportamentul unui pacient se conformează recomandărilor terapeutice prescrise de medic, incluzând inițierea, implementarea și persistența tratamentului în afecțiunile cronice. Non-aderența afectează aproximativ 50% dintre pacienții cu boli cronice, iar aproximativ 30% dintre ei nici nu își inițiază tratamentul de la prima prescripție, generând costuri anuale globale estimate la peste 100 de miliarde de dolari, datorate spitalizărilor evitabile și a complicațiilor. În România, prevalența non-aderenței variază între 3095% în afecțiuni cronice precum hipertensiunea arterială, cancer sau diabetul zaharat, influențată de factori socio-economici, acces limitat la educație sanitară și complexitatea polimedicației.

Metode de măsurare a aderenței medicamentoase
Evaluarea aderenței combină metode obiective și subiective, pentru a captura nuanțele comportamentului pacientului. Metodele obiective, bazate pe date empirice, oferă robustețe, dar pot subestima aspecte psihoso ciale, în timp ce cele subiective sunt accesibile, dar predispuse la biasuri de raportare.
Printre metodele obiective se numără raportul dintre zilele cu medicamente disponibile și perioada de observație (PDC). Această metodă este preferată în cazul polimedicației, deoarece evită supraestimarea aderenței prin ajustare pentru suprapunerile de prescripții. În studii românești, PDC a fost utilizată pentru evaluarea aderenței la antineoplazice orale, relevând valori medii de 92%. O altă me-
todă, calculează numărul de zile de tratament furnizate împărțit la intervalul dintre reumpleri (MPR), fiind adaptabilă pentru analize retrospective din baze de date farmaceutice. Totuși, MPR poate fi influențată de discontinuități temporare, motiv pentru care variante hibride, precum MPR ajustat pentru spitalizări, sunt recomandate în afecțiuni cronice.

Metodele bazate pe monitorizare electronica (MEMS), care înregistrează deschiderea flacoanelor, oferă date precise privind respectarea zilnică a tratamentu-
lui prescris. Astfel de tehnologii sunt emergente, integrate de cele mai multe ori în studii pilot. Metodele subiective de evaluare a aderenței (MMAS) se bazează pe auto-raportare, utilizând chestionare validate pentru a surprinde percepțiile pacientului. Acestea permit aprecierea și urmărirea uitării, intenției și persistenței față de tratament, iar nivelurile ridicate de aderență au fost asociate cu rezultate clinice superioare. În România, MMAS a fost adaptată în cercetări dedicate insuficienței venoase cronice, indicând că aproximativ 40% dintre pacienți manifestă un grad redus de aderență. Strategii de îmbunătățire a aderenței prin servicii farmaceutice
Îmbunătățirea aderenței necesită intervenții multifactoriale, care să țintească barierele pacientului, ale sistemului sanitar și ale interacțiunilor terapeutice. Au fost identificate intervenții educaționale, comportamentale și mixte, cu eficacitate demonstrată în creșterea AM cu 10-30%.
O suprafață oculară sănătoasă este o componentă vitală a unui ochi care funcționează bine. Corneea și conjunctiva, pleoapele, glandele exocrine și inervația lor formează o entitate integrată, care reglează producția de film lacrimal. Filmul lacrimal stabil joacă un rol esențial în hrănirea și protejarea suprafeței oculare împotriva amenințărilor externe, cum ar fi poluarea, uscarea, rănile, alergenii și agenții patogeni.
Prof. Univ.
Dr. Adriana Stănilă, Facultatea de Medicină, Universitatea „Lucian Blaga”, Sibiu


Asist. Univ. Dr. Dan Mircea Stănilă, Facultatea de Medicină, Universitatea „Lucian Blaga”, Sibiu

Factorii clinici
care afectează sănătatea suprafeței oculare
• utilizarea lentilelor de contact;
• chirurgia oculară;
• boli ale suprafeței oculare;
• tratamente topice;
• diferențe de vârstă, sex, etnie;
• bolile sistemice și medicația acestora, precum și stilul de viață;
• factori de mediu.
Toți acești factori afectează suprafața oculară și sănătatea acesteia.
Suprafața oculară este singura structură a ochiului expusă zilnic contactului cu mediul extern.
Structura filmului lacrimal are 3 straturi: lipidic, apos și mucinic.
Stratul lipidic este stratul extern și are funcția primară de prevenirea evaporării lacrimilor.
Stratul apos asigură nutrienți și oxigen pentru cornee și îndepărtează produșii metabolici, hidratează și asigură o suprafață optică netedă.
Stratul mucinic este stratul intern, în contact cu corneea, ce transformă suprafața hidrofobă a corneei într-una hidrofilă și asigură o suprafață corneană netedă. Ochiul uscat este o afecţiune multifactorială a lacrimilor și suprafeţei oculare ce determină simptome de disconfort ocular, afectarea vederii și instabilitatea filmului lacrimal, cu potenţial distructiv asupra suprafeţei oculare. Este însoţită de creșterea osmolarităţii filmului lacrimal și inflamaţia suprafeţei oculare.
Tratamentul ochiului uscat urmărește:
• Eliminarea factorilor exogeni, fum, praf;
• Modificări ambientale: umidifiante, poluanţi, curenţi aer;
• Hidratare adecvată 50mg/ Kg.corp;
• Clipirea intenţionată;
• Monitor cu 10°-20° sub nivelul ochilor;
• Rame mari la ochelari pentru persoanele în vârstă;
• Baza terapiei: Lacrimi artificiale lubrifiante.
Tratamentul medicamentos
Lacrimile artificiale au proprietăți antimicrobiene, hrănitoare, mecanice și optice. Acestea conțin componente precum factori de creștere, fibronectină și vitamine pentru a sprijini proliferarea, migrarea și diferențierea epiteliului corneean și conjunctival. Folosim, aproape în toate cazurile, lacrimi artificiale de 4-5 ori pe zi, sau la nevoie.
Serul autolog este componenta fluidă a sângelui plin care rămâne după coagulare. Este neconservat, non-antigenic, are proprietăți biomecanice și biochimice asemănătoare cu lacrimile naturale. Serul autolog conține factori epiteliotrofici/ modulatori și promovează creșterea și migrarea celulelor epiteliale de suprafață oculară. Utilizarea serului autolog sub formă de picături pentru ochi poate fi un tratament pentru tulburările severe ale suprafeței oculare. Folosim ser autolog 50% diluat, de 3-5/zi în toate cazurile. Terapia cu lipozomi poate

Lentilele HOYA VisuPro cu focalizare avansată
Experiență vizuală revitalizantă și confor t pentru tinerii prezbiți
completa și regenera stratul lipidic. Acțiunea este în aproximativ 10 minute, aplicarea sa cu ochii închiși.
Se pot folosi forme spray cu o creștere rapidă a stratului lipidic sau picături.
Bioprotecția suprafeței oculare oferită de trehaloză, care este un bioprotector natural, este o inovație în tratamentul ochiului uscat. Bioprotecția permite supraviețuirea celulelor în condiții nefavorabile.
Hialuronatul de sodiu asigură lubrifierea suprafeței oculare, iar trehaloza asigură bioprotecția și regenerarea. Combinația îl face o alegere ideală pentru o protecție eficientă a suprafeței oculare.
Picături de antibiotice. Se pot folosi pe suprafața oculară doar după antibiograma sau de la început în cazuri severe până la obținerea antibiogramei, sau dacă este necesar. Nu folosim antibiotice pe suprafața oculară fără indicații țintite.
Corticosteroizi (betametazonă, dexametazonă, fluorometalonă, acetat de hidrocortizon, prednisolon). Corticosteroizii sunt agenți antiinflamatori extrem de eficienți. Beneficiile utilizării steroizilor pentru tratarea ulcerului corneean includ reducerea inflamației, cicatrizarea corneei și neovascularizarea.
Dezavantajele includ riscul ridicat de infecții, ulcere indolente, ulcere recurente, perforații, endoftalmită și reepitelizare afectată, uneori presiune intraoculară crescută.
Ciclosporina locală reprezintă un nou tratament bine tolerat pentru tulburările cronice ale suprafeței oculare severe și corticodependente. În monoterapie sau în asociere cu o corticoterapie, ciclosporina topică poate fi eficientă în orice boală a suprafeței oculare care implică inflamație bazată pe sistemul imunitar.
Picături antiinflamatoare nesteroidiene, cum ar fi diclofenac,
ketorolac, flurbiprofen sodic, nepafenac. Agenții antiinflamatori nesteroidieni oftalmici sunt produse concepute pentru a fi aplicate în ochi, pentru a reduce durerea sau pentru a trata inflamația. Utilizare - inflamație postoperatorie în operația de cataractă (de exemplu, edem macular), durere după traumatisme corneene accidentale sau chirurgicale. Diclofenacul are, de asemenea, un rol în conjunctivita alergică sezonieră. Acțiunea inhibă sinteza prostaglandinelor, tromboxanilor și leucotrienelor.
Agenții antiinflamatori oftalmici sunt produse formulate pentru a fi aplicate în ochi, pentru a reduce durerea sau pentru a trata inflamația. Agenții antiinflamatori acționează împotriva unuia sau mai multor mediatori care provoacă inflamație și reduc iritația și umflarea ochilor. Picăturile pentru ochi antiinflamatorii sunt folosite după operație pentru a calma durerea.
Ochiul uscat este una dintre cele mai frecvente cauze de disconfort ocular în prezent. Ne afectează indiferent de vârstă și, de multe ori, apare pe fondul stilului de viață modern: multe ore în fața ecranelor, aer condiționat, încăperi uscate, dar și purtarea lentilelor de contact. În esență, vorbim despre o problemă a filmului lacrimal, cel care menține suprafața oculară hidratată și protejată.
Medic primar oftalmolog
Clinica de oftalmologie
Ama Optimex din București
www.amaoptimex.ro
www.scapadeochelari.ro
www.cataracta.ro

Ce este ochiul uscat?
Lacrimile au o compoziție complexă și formează un film protector în trei straturi: uleios, apos și mucos. Orice dezechilibru al acestor straturi poate afecta stabilitatea filmului lacrimal și poate duce la uscarea ochilor. Sindromul de ochi uscat apare fie atunci când lacrimile sunt produse în cantitate prea mică și/sau când se evaporă prea repede. Cum se manifestă?
Simptomele pot fi variate: senzație de nisip în ochi sau arsură, usturime, înțepături, ochi roșii, senzație de corp străin, mâncărimi la nivelul pleoapelor, fotofobie (sensibilitate la lumină), vedere încețoșată care se ameliorează după clipit, dificultate la purtarea lentilelor de contact, disconfort la condusul pe timp de noapte. Dacă inflamația se accentuează, pot apărea eroziuni corneene sau chiar ulcerații care necesită îngrijire medicală. De aceea, orice simptom persistent merită evaluat în cadrul unui consult oftalmologic. Cum se pune diagnosticul?
Diagnosticul se stabilește prin examen la biomicroscop,
medicul analizează în detaliu suprafața oculară, pleoapele și glanda lacrimală. Poate recomanda teste specifice prin care se măsoară cantitatea de lacrimi sau se evaluează stabilitatea filmului lacrimal. Toate acestea ajută la identificarea tipului de ochi uscat și la alegerea tratamentului potrivit fiecărui pacient. Soluții de tratament
Tratamentul urmărește restabilirea hidratării oculare, reducerea inflamației și prevenirea complicațiilor.
Lacrimi artificiale
Sunt prima recomandare în majoritatea cazurilor. Picăturile sau spray-urile pentru pleoape suplinesc filmul lacrimal și sunt ușor de utilizat. Cele moderne sunt fără conservanți, bine tolerate și pot fi folosite ori de câte ori este nevoie pentru a reduce disconfortul.
Dopurile lacrimale
Pentru pacienții cu uscăciune severă sau cu simptome persistente, dopurile lacrimale pot aduce un beneficiu major. Medicul aplică un mic ocluzor de silicon biocompatibil în punctele lacrimale, reducând astfel drenajul lacrimilor și menținându-le mai mult pe suprafața ochiului. Procedura este neinvazivă, nedureroasă și durează doar câteva minute.
Îngrijirea glandelor Meibomius
Disfuncția acestor glande poate duce la evaporarea prea rapidă a lacrimilor. Medicul poate recomanda suplimente pentru fluidificarea secreției sau măsuri locale care să prevină colmatarea glandelor și inflamația ce poate apărea la nivelul pleoapelor.
În cazurile mai complexe, medicul oftalmolog vă poate recomanda, în plus, un tratament antiinflamator sau un tratament care să stimuleze producția de lacrimi. Cum putem preveni uscarea ochilor?
Prevenția are un rol important, mai ales pentru persoanele care petrec mult timp în fața ecranelor sau în medii cu aer uscat: pauze regulate la fiecare 5–10 minute de la ecrane, cu schimbarea focalizării și clipit voluntar; evitarea mediilor cu praf, vânt, curenți de aer sau aer condiționat puternic; folosirea unui umidificator în încăperi; alternarea lentilelor de contact cu ochelarii; evitarea produselor cosmetice excesive la nivelul pleoapelor.
Dacă apar simptome recurente, consultul oftalmologic este esențial. Tratamentul corect instituit poate preveni inflamația și complicațiile care afectează în timp vederea.


Somnolența din timpul zilei este un simptom cardinal care poate compromite sănătatea, calitatea vieții și siguranța în trafic și este adesea ignorată de pacienți și subdiagnosticată de medici. Aplicarea de chestionare autoadministrate este o soluție simplă în depistarea somnolenței diurne excesive. Aplicarea noului Chestionar BOSS în depistarea somnolenței la volan poate fi o uneltă importantă în managementul pacientului.

Somnolența, deși nu are o definiție exactă, o interpretăm ca și tendința crescută de a adormi în timpul zilei, involuntar și chiar în situații nepotrivite.
Atunci când această stare persistă mai mult de trei luni și interferează cu funcționarea socială, profesională sau cu siguranța personală, vorbim despre SDE.
Aceasta poate avea trei dimensiuni:
• Introspectivă: măsurată prin chestionare auto-raportate.
• Psihologică: evaluată prin teste clinice
• Manifestă: asociată cu semne comportamentale și testate. Prevalența și Cauzele SDE
Studiile estimează o prevalență a SDE de 5–20% în populația generală. Printre cele mai frecvente cauze se regăsesc:
• Sindromul de apnee în somn (SASO)
• Hipersomnia idiopatică (necesitate excesivă de somn,
atât în timpul nopții, cât și al zilei)
• Narcolepsia (tulburare neurologică cronică caracterizată prin atacuri bruște de somn necontrolat)
• Somnul insuficient determinat comportamental
• Afecțiuni metabolice sau endocrine (anemie, hipotiroidism)
• Tulburări psihiatrice (depresie, anxietate)
• Tulburări de igienă a somnului
Evaluarea Somnolenței
– Metode Subiective și Obiective
1. Chestionare Subiective
• Scala Epworth (ESS): cea mai utilizată, evaluează probabilitatea de a adormi în 8 situații cotidiene. Scorurile peste 10 indică prezența SDE.
• Stanford Sleepiness Scale (SSS): măsoară starea de somnolență din momentul completării.
• Karolinska Sleepiness Scale (KSS): auto-evaluare simplă pe o scară de la 1 la 9.
• SWIFT, POMS, Scala Figurativă: utile în populații specifice (copii, pacienți cu deficiențe cognitive).
• Scala BOSS (Bordeaux Sleepiness Scale): axată pe riscul
de accident rutier asociat somnolenței – combină kilometri parcurși cu frecvența somnolenței la volan.
2. Metode Obiective
• MSLT (Testul de Latență Multiplă a Somnului): standardul de aur în evaluarea narcolepsiei.
• MWT (Testul de Menținere a Vigilenței): indicat pentru evaluarea capacității de a rămâne treaz, mai ales la profesii critice.
• Pupilografie: analizează modificările diametrului pupilar.
• EEG: măsoară activitatea cerebrală, util în corelare cu MSLT.
• Testele de vigilență (PVT, OSLER): teste rapide, utile în screening.
• Testul de echilibru postural: corelează oboseala cu instabilitatea fizică.
Scala BOSS – Un nou instrument pentru evaluarea somnolenței la volan
Scala de Somnolență Bordeaux (BOSS) a fost concepută pentru a acoperi o lacună importantă: evaluarea riscului de șofat legat de somnolență. În studiul publicat în The








Bordeaux Sleepiness Scale (BOSS): a new questionnaire to measure sleep-related driving risk | Journal of Clinical Sleep Medicine, 2023, s-a creat un nou chestionar de somnolență, adresat în principal șoferilor. Date clinice Somnolog
O analiză retrospectivă realizată pe 248 de pacienți care s-au prezentat în clinică pentru probleme de somn, și cărora li s-a aplicat ESS (Epworth Sleepiness Scale) a arătat că:
• 57% au avut scoruri normale ESS (0–6).
• 43% au prezentat SDE în grade variabile:
o 12,5% – somnolență limită
o 20,5% – SDE ușoară
o 7,3% – SDE moderată
o 2% – SDE severă
Aceste date justifică includerea ESS în screeningul inițial al pacienților cu tulburări de somn și indică un procent crescut al pacienților ce prezintă SDE.
Dar în timp ce ESS depistează gradul de SDE al pacienților, acesta nu oferă date privind somnolența la volan al acestora, de aceea se dorește aplicarea suplimentară a Chestionarului BOSS pentru acei pacienți care șofează și mai ales pentru pacienții care sunt șoferi profesioniști.
Impactul Somnolenței asupra Siguranței la Volan
SDE este asociată cu un risc crescut de accidente rutiere. Datele arată că:
• Șoferii somnolenți sunt de 7 ori mai predispuși la accidente.
• După 24 de ore fără somn, reflexele devin similare cu cele ale unei persoane în stare de ebrietate.
• 10–20% dintre șoferii profesioniști recunosc că au adormit la volan.
• Un accident din trei pe autostradă este asociat cu oboseala sau somnolența.
Microsomnul la volan –adormirea de câteva secunde –este extrem de periculos. La 80 km/h, într-un microsomn de 4 secunde, o mașină parcurge distanța unui teren de fotbal.
Reglementări și Siguranța Rutieră În România, există reglementări specifice privind aptitudinile medicale ale șoferilor cu tulburări de somn:
• OUG 195/2002 și Ordinul 1255/2015 – stabilesc obligația medicilor de familie de a trimite spre evaluare pacienții cu suspiciune de apnee în somn.
• Eliberarea permisului este condiționată de controlul bolii și evaluare periodică:
o Grupa 1 (șoferi amatori): control medical la 3 ani.
o Grupa 2 (șoferi profesioniști): anual.
Concluzii
Somnolența diurnă excesivă este mai mult decât o simplă stare de oboseală – este un simptom clinic cu potențial letal, în special în contextul condusului auto. Evaluarea și recunoașterea precoce prin metode validate (ESS, BOSS) pot salva vieți. Aplicarea noului chestionar BOSS acoperă o lacună a evaluării din punctul de vedere al somnolenței la volan.

Domnul Dr. Taira Shigeru medic specialist cardiolog
Am fost contactați de două persoane care au
folosit Oyama Agaricus
Bio Active GR.
Doamna D.C. din județul Brașov, chist ovarian de 4 mm depistat la un control de rutină. Recomandarea medicului a fost să îl țină sub observație, fără un tratament asociat. Doamna a decis să consume Oyama Agaricus Bio Active GR, câte 1 pliculeț/zi, iar după 3 luni a făcut o nouă investigație. S-a observat că dimensiunea chistului era de doar 1 mm. Doamna a decis să con tinue administrarea produsului și să revină la investigații peste alte 3 luni. Am rugat-o să ne informeze periodic cu starea dumneaei de sănătate.
Domnul B.I. din județul Cluj, depistat cu cancer la colon. Postoperator, medicul i-a recomandat chimioterapie, dar analizele indicau o stare precară a pacientului, care nu per mitea începerea tratamentului. Astfel, domnul a decis să consume Oyama Agaricus Bio Active GR, câte 1 pliculeț/zi, timp de 2 luni. La investigațiile ulterioare, parametrii analizați s-au îmbunătățit, astfel că în acest moment poate urma tratamentul cu chimioterapie prescris.
www.apoteca-farmacie.ro
0748156367 Gara -tel/fax 0213189941
0748157004 Duca -tel/fax 0212603061 0748158062 Crangasi -tel/fax 0212238363

De ce Bio Active GR?
• Deoarece sănătatea este mai bună decât toate și meriţi să ai parte de ea!
• Deoarece conţine pulbere de ciuperca Agaricus Blazei Murill, denumită „Ciuperca lui Dumnezeu”, cunoscută
pentru acţiunea anti-tumorală puternică.
• Deoarece ciuperca este cultivată în mediu natural, nu în seră, fără îngrășăminte chimice.
• Deoarece Bio Active GR îţi
Notă: Bio Active GR este un supliment alimentar și nu înlocuiește tratamentul recomandat de medic sau un regim alimentar variat. Rezultatele diferă în funcţie de organismul fiecărei persoane, dar este întru totul natural și ajută la buna funcţionare a organismului. De asemenea, are un bogat conţinut de Beta-D-Glucan. Vă recomandăm să îl achiziţionaţi din punctele autorizate de pe site-ul nostru, pentru a beneficia de sfat autorizat de administrare.
Recomandăm achiziționarea din punctele de distribuție menționate pe site-ul nostru (farmacii sau magazine naturiste) și verificarea compatibilității produsului cu tratamentul dat de medicul curant
Distribuitor, Importator: Euro Japan Trading

oferă garanţia calităţii japoneze, prin mărcile primite de la asociaţii de Medicină Alternativă și Complementară din Japonia.
• Deoarece îl achiziţionezi din farmacie sau plafar, cu indicaţii de administrare personalizate.
• Deoarece vezi minime
îmbunătăţiri ale stării de sănătate în 10-12 ZILE!
• Deoarece sănătatea este mai bună decat toate și meriţi să ai parte de ea!
• Conţine 120 de elemente necesare organismului (minerale, aminoacizi, oligoelemente) și este ușor de înghiţit și ușor de asimilat!

Așa a început misiunea farmacistului Cosmina Bengescu și a Farmaciei Crisia Farm, o farmacie cu laborator modern de tip cameră curată, un standard firesc în țările europene, dar încă rar în România. După ani de formare, studiu și experiențe în laboratoare din Europa, Cosmina a înteles că medicina personalizată este o necesitate pentru mii de oameni. A adus acasă ceea ce a văzut că funcționează impecabil în străinătate: un spațiu construit
Fiecare pacient merită un loc unde vocea lui contează, unde povestea sa primește atenție, iar tratamentul respectă nevoile specifice. Fie că vorbim despre un copil care nu poate înghiți un medicament, despre o persoană cu alergii la excipienți, despre un pacient cronic sau cineva care traversează o perioadă vulnerabilă, nevoile reale sunt adesea dincolo de ceea ce oferă piața farmaceutică clasică. În spatele unui tratament se află o poveste: uneori una de speranță, alteori una de luptă sau de neputință. Și tocmai în aceste povești diferite, fragile și profund umane apare necesitatea unui loc unde soluțiile se construiesc în jurul pacientului, nu în jurul limitărilor.

după reguli stricte, unde fiecare detaliu contează și fiecare tratament este gândit special pentru persoana care îl primește.
Construirea unei echipe de profesioniști
Cosmina Bengescu a construit o comunitate de profesioniști: farmaciști care s-au pregatit în centre internaționale, oameni care împărtășesc aceeași viziune: pacientul este în centrul tuturor deciziilor. Îi vezi concentrați, responsabili, atenți la fiecare detaliu, pentru
că profesia de farmacist presupune rigurozitate, nu ca o opțiune, ci ca o datorie morală.
vieți
Dincolo de inovație și proceduri, există poveștile pe care doar un tratament magistral le poate schimba: un copil care doarme liniștit pentru că are formula potrivită, un pacient vârstnic care poate continua un tratament altfel indisponibil, oameni cu boli rare care primesc exact acea doză pe care

corpul lor o poate tolera. Toate aceste povești au în comun același lucru: o soluție acolo unde părea că nu mai există niciuna.
Pentru farmacistul Cosmina Bengescu, fiecare rețetă este o promisiune că medicina poate fi și personală, și sigură. Ani de muncă, nopți de studiu, călătorii în laboratoare din lume, toate au prins formă într-un loc unde grija și știința lucrează împreună.
Și poate că cel mai emoționant lucru este că în fiecare preparat există o parte din drumul ei. O parte din efort, din disciplină, din vocație și din convingerea că pacienții din România merită același nivel de excelență pe care farmacitul l-a văzut în călătoriile sale profesionale.
Astăzi, pacienții care trec pragul celor două farmacii Crisia Farm intră într-un univers construit pentru oameni, extras din tipare. Aici se găsește un laborator unde tratamentele
„Pentru noi, fiecare preparat este o responsabilitate profund umană. Știu că într-un flacon mic poate sta liniștea unei familii, șansa unui copil, continuitatea unui tratament sau speranța unui pacient care nu a găsit altă soluție. De aceea am construit Crisia Farm un loc unde știința, siguranța și grija merg mână în mână pentru fiecare pacient.” — Farmacist Cosmina Bengescu. sunt create cu responsabilitate, inovația se îmbină cu empatia și fiecare detaliu este controlat, verificat și respectat. Aici se prepară speranțe, excelența este normalitate, iar pentru pacienți, înseamnă siguranță, încredere, continuitate și șansa la o viață mai bună.
Melanomul malign (MM), cunoscut și sub denumirea de nevocarcinom, reprezintă cea mai agresivă formă de cancer cutanat, având origine în sistemul melanocitar, cel mai frecvent la nivelul unui nev pigmentar (aluniță). Deși localizarea cutanată predomină în peste 90% dintre cazuri, MM poate apărea și la nivelul altor structuri care conțin melanocite, precum mucoasa bucală și genitală, fosele nazale, faringele, esofagul, globul ocular, meningele și sistemul nervos central.
Șef Lucrări Dr. Farmacist
Antonia Blendea, Specialist Dermato-cosmetologie, Departamentul de Botanică Farmaceutică, UMF, Craiova

L.E. Bejenaru 2 , G.D. Mogoșanu 2 , A. Biță 2 , Cornelia Bejenaru 1
1 Departamentul de Botanică Farmaceutică, Universitatea de Medicină și Farmacie, Craiova
2 Departmentul de Farmacognozie și Fitoterapie, Universitatea de Medicină și Farmacie, Craiova
La nivel global, în anul 2022, s-au înregistrat aproximativ 331.722 de cazuri noi de melanom și 58.667 de decese asociate acestei afecțiuni. În Europa, incidența anuală depășește 150.000 de cazuri, cu peste 25.000 de decese, evidențiind o creștere rapidă a incidenței comparativ cu alte tipuri de cancer.
În România, conform estimărilor din 2022, au fost diagnosticate 2.247 de cazuri noi de melanom cutanat. Cu toate acestea, datele sugerează că incidența reală ar putea fi subestimată, în special în zonele rurale, unde accesul limitat la servicii medicale poate duce la subdiagnosticare sau la identificarea tardivă a leziunilor.
Diagnosticul clinic al MM este, în general, facil, datorită aspectului său caracteristic: culoare brun-negricioasă, contur neregulat, dezvoltare rapidă, heterocromie și, frecvent, un halou inflamator periferic. Totuși, formele acrome de melanom pot fi complet lipsite de semne cutanate sugestive, cu excepția ritmului accelerat de creștere tumorală, ceea ce face ca recunoașterea precoce să fie extrem de dificilă.
Cu toate acestea, diagnosticul clinic nu poate oferi informații certe privind comportamentul biologic al tumorii sau prognosticul pacientului. Examenul histopatologic, completat atunci când este necesar, de investigații imunohistochimice, rămâne standardul de aur pentru confirmarea diagnosticului. Acesta permite evaluarea parametrilor prognostici esențiali, precum nivelul de invazie, grosimea tumorală și indicele mitotic, fundamentali pentru stadializarea precisă și alegerea conduitei terapeutice adecvate.
Așadar, MM continuă să reprezinte o provocare majoră pentru sistemele de sănătate publică, impunând necesitatea unor strategii eficiente de prevenție, diagnostic precoce și tra-
tament adecvat, adaptate la realitățile epidemiologice actuale. Material și metode
Am considerat interesant să prezentăm cazul unui pacient de sex masculin, în vârstă de 73 de ani, provenit din mediul rural, cu antecedente de expunere cronică și neprotejată la radiația solară (agricultor), acuzând apariția unei formațiuni tumorale proeminente, localizată la nivelul peretelui lateral al cavităţii bucale), cu un diametru de aproximativ 2,5 cm, culoare roșu-închis, telangiectazii (acumularea de sange in zona pielii) și o evoluție rapidă (1–1,5 luni).
Formațiunea tumorală a fost excizată chirurgical, cu respectarea marginilor de siguranță oncologică, și a fost trimisă către Laboratorul de Anatomie Patologică al unității pentru examen histopatologic. La examenul histopatologic epidermul era în general atrofic și prezenta zone ulcerate date de o proliferare celulară malignă ce ocupa dermul în totalitate.
Examenul imunohistochimic a evidenţiat faptul că celulele tumorale au fost negative pentru markerii epiteliali, cei ai mușchiului neted dar și pentru markerul vascular și cel fibrohistiocitar. În schimb, celulele tumorale au fost intens și difuz




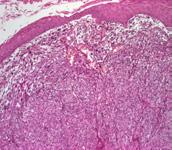
a b c
a. epiderm atrofic, subiacent proliferare celulară malignă ce ocupă dermul în totalitate, col HE x40
b. epiderm ulcerat, subiacent proliferare celulară malignă dispusă în fascicule, col HE x40
c. celule tumorale alungite cu limite indistincte și pleiomorfism moderat, col HE x100
lizarea judicioasă a markerilor imunohistochimici. În lipsa acestor elemente, riscul de subdiagnosticare sau de diagnostic eronat este semnificativ. Concluzii

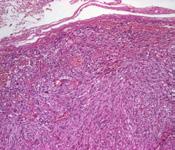
a b
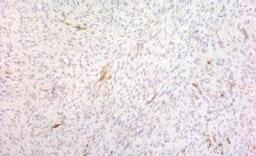
a. imunomarcaj pentru citokeratina AE1-AE3, negativ în celulele tumorale, pozitiv în epiderm, x40
b. imunomarcaj pentru actina mușchiului neted, negativ în celulele tumorale, pozitiv în vasele sanguine, x40
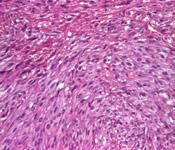
a b

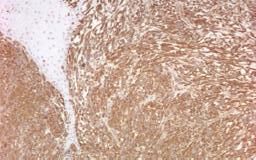
a. imunomarcaj pentru vimentină, pozitiv în celulele tumorale, negativ în epiderm, x40
b. imunomarcaj pentru proteina S100, pozitiv în celulele tumorale, x40
pozitive la markerii melanocitari. Markerul de proliferare celulară a evidenţiat o activitate proliferativă foarte crescută a celulelor tumorale (peste 80%).
Corelând aspectele microscopice s-a stabilit diagnosticul de MM acrom desmoplazic.
Rezultatul imunohistochimic a evidențiat o pozitivitate clară pentru markerii melanocitari și negativitate pentru ceilalți markeri analizați.
Diagnosticul MM acrom rămâne o provocare majoră în practica dermatologică și oncologică, întrucât absența pigmentului melanic elimină unul dintre cele mai importante semne clinice de alarmă. Leziunile pot fi eritematoase, roz-pa-
lide sau chiar de culoarea tegumentului normal, imitând alte entități benigne sau maligne (keratoze, carcinom bazocelular, sarcoame, hemangioame). Această lipsă de specificitate determină frecvent întârzieri diagnostice considerabile.
Pe plan histopatologic, MM acrom, în special în formele desmoplazice, poate mima tumori mezenchimale sau sarcomatoide, necesitând frecvent investigații imunohistochimice extinse. De aceea, recunoașterea acestor forme clinico-patologice atipice presupune o colaborare strânsă între dermatolog, chirurg și anatomopatolog, precum și o abordare metodică, bazată pe experiență și uti-
MM desmoplazic acrom reprezintă o entitate clinică și morfologică rară, dar extrem de agresivă, al cărei diagnostic impune o atenție deosebită din partea clinicianului și a anatomopatologului. Absența pigmentului melanic, atât la nivel clinic cât și microscopic, face ca această formă de melanom să fie adesea confundată cu alte tumori maligne cutanate de origine mezenchimală (țesut conjunctiv embrionar) sau epitelială (celule care acoperă tegumentul, țesut care îndeplinește funcții esențiale precum protecția, absorbția, filtrarea, secreția și recepția senzorială). Importanța diagnosticului diferențial este majoră în contextul unor aspecte histologice nespecifice, iar imunohistochimia devine indispensabilă pentru identificarea fenotipului melanocitar, în absența expresiei markerilor epiteliali, musculari sau vasculari. În cazul nostru, corelarea datelor clinico-morfologice și imunohistochimice a permis stabilirea unui diagnostic de certitudine. Cazul prezentat evidențiază dificultățile diagnostice specifice acestui tip de MM și relevanța unei abordări multidisciplinare în evaluarea formațiunilor cutanate atipice, în special în rândul pacienților expuși la factori de risc precum radiația UV necontrolată. În acest sens, educația populației privind prevenția și consultul dermatologic periodic rămân esențiale.
Antrenamentele intense sunt o necesitate în sportul de înaltă performanță, însă atunci când nu sunt însoțite de o recuperare adecvată, pot duce la apariția sindromului de supraantrenament. Această afecțiune nu este doar un rezultat al efortului fizic excesiv, ci o expresie a unei suprasolicitări generale psihice, fiziologice și emoționale, care afectează multiple dimensiuni ale sănătății sportivului.

Evoluția și manifestările OTS
OTS se dezvoltă pe un continuum care pornește de la suprasolicitarea funcțională (FOR), trece prin suprasolici tarea nefuncțională (NFOR) și în absența intervenției, poate duce la sindromul propriu-zis. Simptomele includ scăderea performanței, lipsa motivației, tulburări ale somnului, oboseală cronică, frecvența crescută a infecțiilor și chiar modificări hormonale și neurologice. Mai mult, sportivii pot prezenta și simptome de natură psihiatrică, cum ar fi depresia, anxietatea sau tulburările de alimentație. Factori cauzali și mecanisme fiziopatologice
inflamație sistemică și dereglări hormonale. Mai multe ipoteze – serotonină, glicogen, inflamație, stres oxidativ – explică parțial mecanismele biologice implicate în scăderea performanței și a capacității de recuperare.
mune – apatie, tulburări de somn, lipsa energiei, scăderea performanței și pot contribui reciproc la agravarea stării generale a sportivului. De asemenea, conceptul de Unexplained Underperformance Syndrome (UUPS) a fost propus pentru a reflecta o abordare mai largă și interdisciplinară a acestor probleme.
Tratament și prevenție Strategia centrală în tratarea OTS constă în reducerea temporară sau chiar întreruperea antrenamentelor, concomitent cu intervenții psihologice. În formele incipiente, câteva zile de recuperare pot fi suficiente, însă în cazurile severe sunt necesare luni de pauză și sprijin psihoterapeutic. Educația sportivilor și antrenorilor, utilizarea instrumentelor de screening și monitorizarea încărcăturii antrenamentelor sunt esențiale în prevenirea recurenței.

Legătura cu tulburările mintale și sindromul de epuizare
Dezvoltarea OTS este legată de o multitudine de factori: dezechilibre energetice (ex. deficit caloric), stres psihologic, calitate slabă a somnului,
Există o suprapunere considerabilă între OTS și tulburări precum depresia sau sindromul de burnout. Acestea împărtășesc trăsături co-
Concluzie
Sindromul de supraantrenament este o provocare majoră pentru Medicina Sportivă modernă. Deși greu de diagnosticat, efectele sale asupra sănătății și carierei sportivilor pot fi profunde. Recunoașterea timpurie a simptomelor, abordarea multidisciplinară și echilibrul între efort și recuperare sunt elemente cheie în protejarea sănătății și performanței pe termen lung.
Rolul farmacistului în managementul pacienților cu simptome de reflux gastro-esofagianutilizarea inhibitorilor de pompă de protoni
Unele dintre cele mai frecvente simptome pentru care pacienții se prezintă în farmacie sunt simptomele de reflux gastro-esofagian. De obicei, acestea sunt descrise ca o senzație de arsură care se dezvoltă în spatele sternului și iradiază spre gât, însoțită uneori de regurgitare (acid sau alimente). Aceste simptome apar cel mai frecvent după mese, în timpul exercițiilor fizice sau în timp ce stau în decubit dorsal.



Farmacist
Clementina Ohîi
Farmacist specialist
Laborator farmaceutic, Universitatea
„Ovidius“ din Constanța
Rolul farmacistului
în stabilirea corectă a diagnosticului
Uneori, interpretând informații din surse diverse, cum ar fi rețelele sociale, pacienții își stabilesc un autodiagnostic. Cu atât mai mult în acest caz, consilierea farmacistului este importantă pentru a spori acuratețea clinică a autodiagnosticu-
lui și a optimiza medicația. Farmacistul are responsabilitatea de a îndruma persoanele cu simptome alarmante pentru evaluări medicale suplimentare, de a oferi sfaturi cu privire la stilul de viață și principiile de autoîngrijire, de a selecta și recomanda adecvat medicamentele ce se pot elibera fără prescripție medicală, precum și de a consilia pacientul dacă acesta revine cu o prescripție medicală.
Pentru început, pacientul este intervievat în legătură cu frecvența, natura și severitatea episoadelor de reflux Caracteristicile de alarmă care ar putea fi identificate în farmacie pe baza răspunsurilor pacientului includ simptome sugestive pentru dureri toracice de tip cardiac, dificultăți sau durere
la înghițire, tuse bronșică recurentă, răgușeală, semne/simptome de sângerare gastrointestinală și pierdere progresivă neintenționată în greutate. Se cunoaște faptul că, anumite medicamente pot predispune pacienții la reflux și pot precipita sau exacerba simptomele de reflux. Putem enumera aici majoritatea antiinflamatoarelor nesteroidiene, antibiotice, statine, bifosfonați, vitamina C, potasiu, fier, clomipramină, chinidină, anticolinergice, antidepresive triciclice, corticosteroizi (orali și inhalatori), nitroglicerine, aminofilină, benzodiazepine, warfarină, ciproteronă, etinilestradiol și blocante ale canalelor de calciu. Suspiciunea unei cauze medicamentoase a simptomelor de reflux ar trebui să fie un motiv pentru consultarea medicului prescriptor.
cu privire la dietă și
stil de viață
Farmacistul oferă nu numai sfaturi privind administrarea medicației, ci și sfaturi referitoare la modificarea dietei și a stilului de viață, pentru eliminarea simptomelor digestive descrise. Se recomandă consumul de alimente în cantitate mică, cu evitarea alimentelor bogate în grăsimi sau gătite prin prăjire, evitarea alcoolului, a alimentelor picante sau a ciocolatei, consumul de lichide între mese și evitarea consumului de alimente înainte de exerciții fizice sau de sumn și renunțarea la fumat. Nu în ultimul rând, este recomandată pierderea în greutate la persoanele supraponderale sau obeze.
și a modului de administrare
Simptomele descrise anterior pot fi gestionate cu medicamente, unele fără prescripție medicală, pe care farmacistul le poate recomanda.
Pentru reducerea rapidă și pe termen scurt a simptomelor pot fi recomandate antiacide (bicarbonat de sodiu, carbonat de calciu sau de magneziu, hidroxid de aluminiu sau de magneziu) sau alginați (alginatul de sodiu), frecvent formulat în combinații cu antiacide. Antagoniștii receptorilor histaminici H2 (famotidina, cimetidina, nizatidina) inhibă atât secreția acidă bazală, cât și pe cea stimulată. În țara noas-
tră, ca și la nivelul UE, aceste medicamente necesită o prescripție medicală, în timp ce Food and Drug Administration, a U.S (FDA) a aprobat utilizarea fără prescripție medicală a cimetidinei și famotidinei pentru tratamentul arsurilor la stomac.
Inhibitorii pompei de protoni (IPP) inactivează ireversibil forma activă a pompei de protoni, suprimând secreția acidă bazală. În țara noastră, sunt autorizate ca medicamente OTC forme de pantoprazol 20 mg și omeprazol 20 mg. Farmaciștii pot juca un rol esențial în a-i ajuta pe pacienții care caută IPP fără prescripție medicală, punând întrebări deschise, cum ar fi ce alte medicamente eliberate pe bază de prescripție medicală sau OTC utilizează în prezent; cine le va utiliza (pentru a evalua vârsta și/sau sexul pacienților); ce simptome prezintă și de cât timp sau dacă au încercat și alte medicamente.
Comparativ cu antihistaminicele H2, IPP sunt mai eficiente pentru tratamentul pe termen scurt al simptomelor de reflux gastroesofagian, efectul clinic al IPP pe termen scurt durând până la 10 săptămâni. IPP produc o reducere a acidității mai puternică și mai durabilă (24 de ore față de 3-15 ore). În timp ce antiacidele sunt eficiente doar pentru ameliorarea simptomelor și necesită doze zilnice multiple, IPP au o administrare convenabilă, de obicei o doză zilnic, ceea ce asigură aderența la tratament și complianța pacienților. Se
administrează înaintea mesei. Ameliorarea simptomelor cu IPP este rapidă (debutul acțiunii este de ~1,5 ore după administrare, și este semnificativ clinic după 1-3 zile).
Metabolismul IPP și interacțiunile medicamentoase
IPP sunt metabolizate rapid în ficat. IPP prezintă, de asemenea, excreție renală și biliară. Insuficiența hepatică crește semnificativ timpul de înjumătățire al IPP și poate necesita monitorizare suplimentară. Riscurile potențiale asociate cu utilizarea pe termen lung a IPP includ boli renale, demență, fracturi osoase, infarct miocardic, infecții enterice, deficit de micronutrienți și malignitate gastrointestinală.
Ținând cont de acestea, IPP pot fi administrați fără prescripție medicală pentru tratamentul pe termen scurt al simptomelor bolii de reflux doar la adulţi, iar tratamentul nu trebuie să depășească 4 săptămâni fără recomandarea unui medic.
Farmaciștii pot ghida pacientul pentru gestionarea simptomelor de reflux gastro-esofagian prin confirmarea diagnosticului, selectarea tratamentului optim fără prescripție medicală, îndrumarea pacienților cu simptome de alarmă către medic și educarea pacienților cu privire la stilul de viață și utilizarea corectă a medicamentelor.
Responsabilitatea penală și civilă a persoanelor cu tulburări psihice este o problemă complexă care implică echilibrul între protecția drepturilor individuale ale persoanelor și nevoia de a asigura responsabilitatea față de fapte comise. Persoanele cu tulburări psihice pot fi responsabile penal și civil, dar în anumite condiții, capacitatea lor de a înțelege și controla faptele lor este influențată de starea lor de sănătate mintală

Responsabilitatea penală
Persoanele cu tulburări psihice pot fi considerate responsabile penal, dar doar dacă au capacitatea de a înțelege caracterul ilegal al faptei lor și de a o controla, conform articolul 48 din Codul penal. Dacă, din cauza unei tulburări psihice, persoana nu are această capacitate, poate fi declarată nevinovată (în sensul că nu este considerată vinovată penal), dacă instanța consideră că fapta a fost comisă într-o stare de incapacitate de a înțelege ce face sau de a își controla comportamentul.
Iresponsabilitatea, potrivit art.28 din noul Cod penal, este reglementată astfel: “Nu este imputabilă fapta prevazută de legea penală săvâșită de persoana care, în momentul comiterii acesteia, nu putea să-și dea seama de acțiunile sau inacțiunile
sale ori nu putea să le controleze, fie din cauza unei boli psihice, fie din alte cauze”. Lipsa capacității psihice privește atât zona intelectuală (cognitivă) cât și facultățile volitive.
Instanțele de judecată pot solicita expertize psihiatrice medico - legale pentru a stabili dacă persoana avea discernământ la momentul comiterii faptei.
Responsabilitatea penală și civilă a persoanelor cu tulburări psihice depinde în mare măsură de gradul lor de discernământ. Conceptul de discernământ diminuat reprezintă responsabilitate cu circumstanțe atenuante (boli psihice, maturizare insuficientă din cauza carențelor educaționale sau alte condiții patologice). Deși această diminuare afectează gradul de responsabilitate a individului, ea nu o elimină complet. Astfel, persoana cu discernamânt diminuat poate fi considerată responsabilă penal, însă acest aspect poate fi luat în considerare ca circumstanță atenuantă. Noțiunea de responsabilitate atenuată, în dreptul penal, se referă la o re-
ducere parțială a capacității de răspundere penală a unei persoane, din cauza unor tulburări psihice sau emoționale, care afectează discernământul.
În ceea ce privește responsabilitatea civilă, reglementările diferă ușor de responsabilitatea penală. În general, o persoană cu tulburări psihice poate fi responsabilă civil pentru prejudiciile cauzate altora, dar această responsabilitate este influențată de gradul de discernământ al persoanei respective:
Capacitatea de a înțelege și de a controla comportamentele este un element esențial în determinarea responsabilității civile. Persoanele care suferă de tulburări psihice pot fi totuși obligate să compenseze prejudiciile, dar există posibilitatea ca răspunderea să fie distribuită asupra unei persoane sau instituții care are obligația de a supraveghea și îngriji acea persoană (de exemplu, tutorele legal sau spitalul).
Helicobacter pylori, bacterie capabilă să supraviețuiască mediului gastric acid, rămâne un important factor de risc pentru afecțiuni severe. Este implicată în apariția adenocarcinomului gastric noncardic, a limfomului MALT, a anemiei feriprive și a purpurei trombocitopenice, unde eradicarea îmbunătățește parametrii biologici. Alte posibile asocieri includ deficitul de vitamina B12 și boli cardiovasculare. Diagnosticul se bazează pe teste neinvazive—test respirator cu uree, antigen fecal, anticorpi serici—sau pe metode invazive prin endoscopie cu biopsie.

Infecția cu H. pylori este cel mai puternic factor de risc cunoscut pentru adenocarcinomul gastric noncardic, aproximativ 89% dintre astfel de cazuri fiind atribuite bacteriei. Patogenia urmează cascada de modificări histologice secvențiale: gastrită cronică → gastrită atrofică → metaplazie intestinală → displazie → adenocarcinom.
Limfomul de țesut limfoid asociat mucoasei gastrice este puternic asociat cu infecția cu H. pylori, bacteria fiind detectată în aproximativ 90% din cazuri.
Anemia feriprivă (nivel scăzut de fier) are o asociere bine stabilită cu infecția cu H. pylori, analizele demonstrând niveluri îmbunătățite ale hemoglobinei și starea de fier după terapia de eradicare. Mecanismele includ pierderea
de sânge ocult din gastrita erozivă, absorbția redusă a fierului și utilizarea bacteriană a fierului.
Purpura trombocitopenică (prin care organismul distruge trombocitele, acele celule care ajută la coagularea sângelui, ducând la apariția excesivă a vânătăilor și sângerărilor-echimoze) demonstrează, de asemenea, o relație semnificativă cu H. pylori, cu îmbunătățiri ale numărului de trombocite observate la 5075% dintre pacienții infectați în urma terapiei de eradicare. Alte afecțiuni cu asocieri sugerate, dar mai puțin concludente includ deficiența de vitamina B12, tulburările neurodegenerative, boala cardiacă ischemică și sindromul metabolic.
Infecția cu Helicobacter pylori (H. pylori) poate fi diagnosticată prin metode de testare neinvazive și invazive. Opțiunile non-invazive includ testul de respirație cu uree, care detectează capacitatea
bacteriilor de a transforma ureea în dioxid de carbon; teste de antigen de scaun, care identifică proteinele H. pylori din probele fecale; și teste de anticorpi din sânge, care detectează răspunsurile imune la infecție. Aceste metode sunt convenabile, dar variază ca sensibilitate și specificitate.
Tehnicile de diagnostic invazive presupun efectuarea endoscopiei digestive superioare și se bazează pe analiza fragmentelor gastrice biopsiate.
Alegerea metodei de diagnostic depinde de contextul clinic, disponibilitatea locală, considerentele de cost și dacă este necesară testarea sensibilității antimicrobiene. Orientările actuale recomandă strategia de „testare și tratare” cu metode non-invazive pentru pacienții mai tineri fără simptome de alarmă, în timp ce diagnosticul bazat pe endoscopie este preferat pentru pacienții mai în vârstă, cei cu simptome alarmante (cum ar fi scăderea în greutate, disfagie, sângerare) sau indivizii din regiuni cu prevalență mare a cancerului gastric.
Inteligența artificială (IA) a devenit un instrument tot mai frecvent utilizat în medicina modernă,inclusiv în domeniul endocrinologiei. Astfel, IA propune utilizarea algoritmilor avansați și a modelelor de învățare profundă („deep learning”), facilitează integrarea și analiza simultană a unor seturi complexe de date clinice, paraclinice și imagistice, contribuie la extragerea rapidă de informații relevante referitoare la pacient. IA ajută la identificarea unor tipare care ar putea trece neobservate, îmbunătățind procesul de diagnosticare.
Dr. Dana-Mihaela Tilici, Medic Specialist
Endocrinologie, Spitalul Universitar de Urgență București, Școala Doctorală a UMF „Carol Davila”, București

Dr. Ana-Maria Arnăutu, Spitalul Universitar de Urgență, București

Prof. Univ. Dr. Diana-Loreta Păun, UMF „Carol Davila”, București

Diagnosticul automatizat al acromegaliei
Acromegalia este o afecțiune determinată de hipersecreția hormonului de creștere, debutată la vârstă adultă, cu multiple complicaţii sistemice, care netratată scurtează durata de viaţă a pacienţilor. Un semn caracteristic al acestei afecțiuni este faciesul acromegaloid, caracterizat prin modificări faciale distinctive.
Diagnosticul precoce al acromegaliei este esențial pentru prevenirea complicațiilor cardiovasculare, metabolice și articulare asociate. În acest sens, IA oferă identificarea timpurie a semnelor faciale caracteristice.
A fost descris un model de inteligență artificială bazat pe rețele neuronale convoluționale (CNN) pentru detectarea acromegaliei pe baza imaginilor faciale. Studiul a plecat de la trei arhitecturi avansate de rețele neuronale, iar modelul hibrid rezultat a demonstrat o acuratețe de 99,7%, superioară metodelor convenționale de diagnostic.
Evaluarea aspectului ecografic al formațiunilor tiroidiene
IA îmbunătățește diagnosticarea nodulilor tiroidieni prin utilizarea algoritmilor de învățare automată, care analizează imagini ecografice și evidențiază trăsături subtile ale
nodulilor (formă, contur/margini, pattern-ul vascular). Un exemplu notabil este modelul IA care utilizează rețele neuronale convoluționale, pentru a evidenția diferențe notabile între nodulii benigni și maligni.
Inteligența artificială, prin fuziunea datelor imagistice și clinice, facilitează stratificarea riscului de malignitate în cazul formațiunilor nodulare tiroidiene, susținând procesul decizional medical prin standardizarea interpretării și creșterea performanței diagnostice.
Osteoporoza este o afecțiune osoasă sistemică a scheletului, caracterizată prin masă osoasă scăzută și dezorganizare microarhitecturală, având drept consecință creșterea fragilității osoase și implicit a riscului de fractură.
Inteligența artificială joacă un rol din ce în ce mai important în diagnosticul și gestionarea osteoporozei, oferind
instrumente eficiente și precise în identificarea și evaluarea riscului de fractură. Modelele generate de IA pot identifica pacienții cu risc ridicat, analizând densitatea minerală osoasă, parametrii biochimici și istoricul medical. Modelele de învățare automată aplicate pe imagini CT permit clasificarea automată a osteoporozei, îmbunătățind acuratețea diagnosticării și oferind posibilitatea unei monitorizări precise a progresiei bolii. Click or tap here to enter text.
În ceea ce privește riscul de fracturi, IA ajută la evaluarea acestuia prin integrarea diverselor date: istoricul medical al pacientului, caracteristicile imagistice și alte elemente medicale predispozante. Algoritmii permit identificarea pacienților cu risc înalt de fracturi, ghidând astfel deciziile terapeutice; IA a reușit analiza de radiografii dentare, pentru a depista semnele de osteoporoză, chiar și în stadiile incipiente. Click or tap here to enter text.
Diabetul zaharat reprezintă una dintre cele mai răspândite afecțiuni metabolice la nivel global. IA a fost utilizată pentru a îmbunătăți screening-ul, diagnosticul și gestionarea diabetului. IA este utilizată pentru analiza datelor din monitorizarea glicemică continuă, permi-
avea un copil cu greutate mare pentru vârsta gestațională la femeile cu diabet gestațional.
de creștere

țând ajustarea tratamentului în timp real.
În plus, IA contribuie la personalizarea tratamentului osteoporozei, optimizând terapiile potrivite fiecărui pacient. Modelele predictive pot monitoriza răspunsul la tratament și pot ajusta planurile terapeutice în funcție de evoluția densității minerale osoase, îmbunătățind astfel rezultatele pe termen lung și reducând riscul de fractură de fragilitate.
De asemenea, algoritmii de învățare automată au fost utilizați pentru a prezice riscul de a
Inteligența artificială joacă un rol mai important în diagnosticarea și gestionarea tulburărilor de creștere la copii. Aceste afecțiuni pot fi cauzate de o varietate de factori, inclusiv dezechilibre hormonale, malnutriție sau tulburări genetice, iar diagnosticarea corectă poate fi complexă. IA ajută la identificarea unor tipare subtile în datele clinice, cum ar fi ritmul de creștere, markerii hormonali și istoricul medical. De exemplu, algoritmii de învățare pot analiza datele din graficele de creștere pentru a detecta devieri de la dezvoltarea normală, iar modelele predictive pot ajuta la prognoza evoluției acestei afecțiuni. În plus, IA permite personalizarea tratamentelor, ajustându-le în funcție de răspunsul fiecărui copil, cum ar fi tratamentele cu hormoni de creștere sau terapiile pentru corectarea disfuncțiilor hormonale.
În ciuda beneficiilor evidente, utilizarea IA în endocrinologie
prezintă și provocări. Calitatea și cantitatea datelor disponibile influențează performanța algoritmilor, iar problemele legate de confidențialitatea și securitatea datelor rămân preocupări majore. De asemenea, este esențială o colaborare strânsă între medicii clinicieni și specialiștii IA pentru a asigura implementarea eficientă și etică a acestor noi tehnologii.
Obezitatea este recunoscută în prezent ca o boală cronică multifactorială, ce afectează o mare parte a populației globului. OMS estimează o prevalență de 39-49% a obezității sau supraponderii. Peste un miliard de oameni din lume trăiesc cu obezitate, aproape 880 de milioane de adulți și 159 de milioane de copii și adolescenți. Complexitatea acestei afectări metabolice, atrage dupa sine o patologie complexă, de la boli cardiovasculare, până la diverse forme de cancer, sau tulburări neurologice. De aceea, evaluarea persoanelor cu probleme de greutate este absolut necesară, aducând date importante privind afecțiunile asociate, de cele mai multe ori diagnosticate tarziu.


Obezitatea
Asist. Univ. Dr. Gabriel Panculescu, Universitatea
„Ovidius”, Constanța
și insulinorezistența
în diabetul de tip 2
Există o corelație bidirectională între obezitate și diabet, persoanele cu diabet sunt în mare parte obeze (80-85%), iar persoanele cu obezitate au risc cardiometabolic important. Din păcate, obezitatea a crescut mult în rândul persoanelor tinere, care pot dezvolta diabet la vârste mici, în copilarie sau adolescență și risc cardiovascular, ce poate fi îmbunătățit prin scadere în greutate și modificare a stilului de viață. Persoanele supraponderale sau obeze intră în categoria de risc înalt pentru dezvoltarea afecțiunilor
metabolice și de aceea screeningul este necesar la cei cu vârsta de peste 45 de ani și probleme cu greutate.
Defectul central ce leagă obezitatea de diabet este insulinorezistența.
Creșterea circumferinței abdominale este un predictor pentru prezența insulinorezistenței, mult mai eficient decât indicele de masă corporală. Când capacitatea de stocare a țesutului adipos la nivel subcutanat este depășită, se produce o creștere a fluxului de lipide către ficat, mușchi scheletici și pancreas. Încărcarea grasă pancreatică determină scăderea insulinosensibilității. Alterarea distribuirii țesutului adipos este cauza apariției inflamației sistemice, promotoarea fenomenului de ateroscleroză, prin apariția unor produși de degradare a lipidelor, cu efecte toxice sistemice. Modificarea profilului lipidic, în special trigliceridele și acizii grași liberi, cresc insulinorezistența și statusul proinflamator. Acumularea
ectopică (anormală) de lipide determină alterarea funcției organelor țintă, iar la nivelul pancreasului determină scăderea funcției betacelulare. Insulinodeficiența și insulinorezistența sunt cele doua mecanisme ce domină patofiziologia diabetului zaharat tip 2.
Persoanele cu obezitate, chiar în absența diabetului, au un profil lipidic caracteristic, cu scăderea HDL colesterolului, creșterea nivelului trigliceridelor și LDL cholesterolului, cu modificări de structură, particule mici și dense ce penetrează peretele vascular și inițiaza procesul de ateroscleroză. Mai sunt și alte mecanisme ce cresc nivele sanghine de lipide. Ficatul joacă un rol important prin creșterea lipogenezei și a trigliceridelor bogate în lipoproteine.
Scăderea în greutate determină o ameliorare a profilului lipidic, cu scăderea nivelului de trigliceride și creșterea HDL colesterolului, ca urmare a restabilirii sensibilității la insulină.
Microbiomul intestinal joacă un rol esențial în sănătatea generală a organismului, influențând nu doar digestia și metabolismul, ci și sănătatea mentală. Legătura dintre intestin și creier, cunoscută sub numele de axa intestin-creier, este un domeniu de cercetare în plină expansiune, cu implicații majore în practica.
Conf. Univ.
Dr. Grațiela Grădișteanu, Facultatea de Biologie, Dept. Botanică și Microbiologie, Universitatea București

Axa intestin-creier reprezintă un sistem bidirecțional de comunicare între microbiomul intestinal și sistemul nervos central (SNC), implicând căi neuroendocrine, imunologice și metabolice. Principalele mecanisme includ neurotransmițătorii microbieni, răspunsul inflamator sistemic și diverși metaboliți bacterieni. Anumite bacterii intestinale contribuie la producerea neurotransmițătorilor esențiali, precum serotonina, dopamina și acidul gama-aminobutiric (GABA), care influențează starea de spirit și răspunsul la stres. De exemplu, Lactobacillus rhamnosus poate modula nivelurile de GABA, contribuind astfel la reducerea anxietății. Disbioza intestinală poate duce la inflamație cronică, afectând sănătatea mentală și favorizând apariția unor tulburări precum depresia și anxietatea. Bacteroides fragilis este implicată în reglarea inflamației prin producția de polizaharide antiinflamatorii.
Produșii metabolici ai microbiotei, precum acizii grași cu lanț scurt, influențează funcționarea barierelor intestinale și hematoencefalice, având un rol protector asupra SNC. Faecalibacterium prausnitzii este un producător important de butirat, cu efecte antiinflamatorii și neuroprotectoare, contribuind la menținerea homeostaziei organismului. Studii recente sugerează că modificările microbiomului intestinal sunt asociate cu diverse tulburări neuropsihiatrice, inclusiv depresia și anxietatea, tulburările din spectrul autist (TSA) și bolile neurodegenerative precum Alzheimer și Parkinson. Pacienții cu aceste afecțiuni prezintă adesea dezechilibre microbiene, cu o scădere a speciilor benefice (Lactobacillus, Bifidobacterium) și o creștere a bacteriilor proinflamatorii (Enterobacteriaceae, Sutterella). Bifidobacterium longum este cunoscută pentru efectele sale benefice asupra reducerii stresului și îmbunătățirii funcției cognitive. Cercetările indică o legătură clară între disbioza intestinală și manifestările neurocomportamentale ale TSA, unde specii precum Prevotella
și Coprococcus joacă roluri importante în modularea metabolismului cerebral. Inflamația indusă de microbiom poate contribui la neurodegenerare, accelerând apariția acestor boli, iar Akkermansia muciniphila a fost asociată cu protecția barierei intestinale și reducerea neuroinflamației, având un potențial terapeutic promițător. Având în vedere aceste aspecte, includerea strategiilor de modulare a microbiomului în practica medicală devine tot mai importantă. Printre opțiunile disponibile se numără probioticele și prebioticele, dieta personalizată și transplantul fecal (FMT). Suplimentarea cu tulpini benefice, cum ar fi Lactobacillus rhamnosus sau Bifidobacterium longum, a demonstrat efecte pozitive asupra simptomelor de anxietate și depresie. Lactobacillus helveticus a fost asociat cu reducerea nivelului de cortizol și îmbunătățirea calității somnului. Consumul de alimente bogate în fibre, polifenoli și acizi grași omega-3 susține sănătatea microbiomului și reduce inflamația, iar intervențiile nutriționale personalizate câștigă tot mai multă atenție pentru potențialul lor de a optimiza funcționarea axei intestin-creier.
Interacțiunea dintre somn și sistemul digestiv este reglată de mecanisme complexe, care implică sistemul nervos central, sistemul endocrin și microbiota intestinală. Ritmul circadian, ceasul biologic intern, ciclu biologic de aproximativ 24 de ore care reglează procese precum somnul și veghea, temperatura corpului și secreția de hormoni, joacă un rol crucial în coordonarea acestor procese. Atunci când ritmul circadian este perturbat, pot apărea dezechilibre care afectează atât somnul, cât și digestia. Sistemul nervos central controlează atât somnul, cât și funcțiile digestive. Axul creier-intestin permite interacțiunea dintre aceste două sisteme. Stresul, anxietatea și depresia, care pot afecta somnul, pot avea, de asemenea, un impact negativ asupra sistemului digestiv, ducând la simptome precum dureri abdominale, balonare și modificări ale tranzitului intestinal.

Hormonii joacă un rol esențial în reglarea somnului și a digestiei. Melatonina, un hormon secretat în timpul nopții, reglează ritmul circadian și are, de asemenea, efecte antiinflamatorii asupra sistemului digestiv. Cortizolul, hormonul stresului, poate perturba somnul și poate afecta motilitatea gastrointestinală. Grelina și leptina, hormonii care reglează apetitul, pot fi afectați de privarea de somn, ducând la modificări ale obiceiurilor alimentare și la agravarea simptomelor digestive.
și disconfort abdominal. De asemenea, s-a observat o creștere a permeabilității intestinale, facilitând translocarea bacteriană și inflamația.
Un alt aspect important este reprezentat de modificările microbiotei intestinale. S-a constatat că tulburările de
cări ale obiceiurilor alimentare și la agravarea simptomelor digestive.
Având în vedere interacțiunea complexă dintre somn și sistemul digestiv, intervențiile terapeutice ar trebui să vizeze atât îmbunătățirea calității somnului, cât și gestionarea simptomelor digestive. Această abordare ar trebui să includă evaluarea amănunțită a istoricului medical pentru a identifica factorii de risc și a stabili un diagnostic precis, investigații paraclinice pentru a evalua funcția digestivă și calitatea somnului.

În ceea ce privește impactul tulburărilor de somn asupra sistemului digestiv, se pare că privarea cronică de somn poate perturba ritmul circadian, având consecințe asupra motilității gastrointestinale. Restricția de somn poate încetini tranzitul intestinal, ducând la constipație
somn pot reduce diversitatea bacteriană și pot favoriza dezvoltarea unor tulpini proinflamatorii. În plus, privarea de somn poate afecta secreția de grelină și leptină, hormoni implicați în reglarea apetitului, ceea ce poate duce la modifi-
Dintre recomandări pentru pacienți, menționăm în primul rând necesitatea adoptării unei igiene riguroase a somnului, cu respectarea unui program regulat de somn și crearea unui mediu propice odihnei, gestionarea dietei prin identificarea și evitarea alimentelor care exacerbează simptomele digestive. În ultima perioadă se recomandă consiliere psihologică pentru a gestiona stresul, anxietatea și depresia, inclusiv utilizarea tehnicilor de relaxare, cum ar fi meditația sau yoga.






• Reduce roșeața în 4 săptămâni
• Reduce leziunile inflamatorii (papule și pustule)
• Îmbunătățește microcirculația cutanată
• Hidratează și calmează
p<0.0001
Durată (săptămâni)
Reducerea leziunilor inflamatorii după 12 săptămâni*:
METRORUBORIL® A.Z
A.Z vs METRONIDAZOL 0.75%
METRONIDAZOL 0.75%
Distribuția severității eritemului în cele două grupuri:
A.Z
Îmbunătățire semnificativ mai mare în grupul METRORUBORIL® A .Z
*p=0.0021
După 12 săptămâni: METRORUBORIL® A.Z grup: 76% dintre pacienți au ajuns la stadiul ușor.
0.75 grup: 22% au ajuns la stadiul ușor, în timp ce majoritatea pacienților (78%) prezentau în continuare forme moderate sau severe.

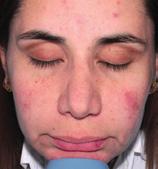

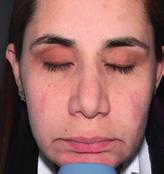
pacient din grupul
METRORUBORIL® A.Z
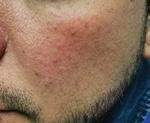

de subiecți cu rozacee papulo-pustuloasă. Durata: 12 săptămâni. Studiu comparativ randomizat, dublu-orb. 3 grupuri paralele (2 aplicări pe zi) > Grupul 1: Metroruboril® A.Z
Grupul 2: Metronidazol 0,75% (formulat în vehiculul pentru Metroruboril® A.Z) Grupul 3: Doar vehiculul (placebo). Evaluare clinică: numărul de leziuni, intensitatea roșeții, toleranța (eritem, prurit și uscăciune).