10 minute read
Sección MSD
from Suis 180
by Grupo Asís
Rut Menjón, Marcial Marcos, Marta Jiménez
Servicio Técnico MSD Animal Health
Advertisement
Control y erradicación de patologías clásicas que se están convirtiendo en re-emergentes
En estos últimos años, la aparición de nuevos desafíos sanitarios (PCV2, DEP, Rotavirus, etc.) ha hecho cambiar el foco de atención hacia ciertos patógenos considerados clásicos. Pero no debe olvidarse el hecho de que muchas de las enfermedades que eran importantes mucho antes, todavía siguen estando presentes en las granjas y están reemergiendo, volviendo a generar importantes pérdidas productivas y económicas.
Una de las causas de esta re-emergencia es que el consumo de antibióticos se ha reducido considerablemente en España en los últimos años, ligado a la problemática mundial de las resistencias microbianas. Esta reducción ha hecho que patologías que estaban bajo control, pero que seguían presentes en las granjas, hayan emergido tomando otra vez un papel relevante dentro de la sanidad porcina, como pueden ser la pleuroneumonía porcina, la leptospirosis, las estreptococias, la ileítis o la rinitis atrófica. La rinitis atrófica es una enfermedad que lleva décadas conviviendo con los cerdos de todo el mundo. La primera vacuna apareció en 1985, pero hoy en día países como España aún no han erradicado la enfermedad. No existen apenas datos de prevalencia en el mundo, siendo Holanda uno de los países europeos con más baja prevalencia (5 %) de Pasteurella multocida toxigénica (PMT) (De Jong. 2011), gracias a sus programas de certificación de granjas libres a PMT. En España no existen datos publicados de prevalencia, solo podemos estimar el porcentaje de cerdas vacunadas que sería alrededor del 40 % en el 2020 (basado en datos de CEESA).
LA ENFERMEDAD
En los animales enfermos de rinitis atrófica, los primeros síntomas clínicos son estornudos, respiración dificultosa y secreciones oculares, que dan lugar a manchas oscuras en el lagrimal, comúnmente llamadas “anteojos”, seguidas por secreciones nasales de serosas a mucopurulentas. En algunos casos, los cerdos pueden mostrar epistaxis. La atrofia de los cornetes (hueso conchal) y la desviación septal pueden dar lugar al acortamiento o deformación de la jeta y, en los casos graves, mayor susceptibilidad a cuadros neumónicos y a dificultad para comer, lo que conlleva perdidas de crecimiento. La rinitis atrófica, cuya etiología involucra a dos bacterias diferentes, se puede presentar de dos formas distintas: ■ Rinitis atrófica no progresiva. Provoca atrofia de los cornetes de leve a moderada, pero sin cambios significativos en la jeta. En esta forma de la enfermedad, el principal patógeno involucrado es la bacteria Bordetella bronchiseptica (Bb) y la infección ocurre durante un corto periodo de tiempo, con poco daño en el tracto respiratorio del cerdo. La importancia de esta forma no progresiva es que Bb puede predisponer al cerdo a la forma progresiva de la enfermedad. ■ Rinitis atrófica progresiva. Es mucho más grave y en ella están implicadas cepas de Pasteurella multocida productoras de toxinas (PMT). El aumento de la gravedad se asocia con el hacinamiento, el manejo inadecuado y las condiciones de alojamiento y medioambientales subóptimas. PMT produce una toxina (dermonecrotoxinaDNT) que causa una inflamación continua y progresiva de los tejidos en las cavidades nasales. Esta lesión puede progresar y afectar al tejido óseo de los cornetes y otros huesos de la nariz, de modo que se produce una atrofia nasal. En el cerdo sano, los cornetes hacen que el aire entrante genere turbulencias, de modo que cualquier partícula o microorganismo pueda ser arrojada contra el revestimiento de la mucosa en esta parte de las vías respiratorias altas, donde entran en contacto con el moco y otros componentes del sistema de defensa nasal, que eliminarán eficazmente a estos agentes extraños.
Bordetella bronchiseptica (Bb): la doble importancia en su control
Bb merece una mención especial, ya que es una bacteria ampliamente distribuida a nivel mundial y con elevada prevalencia en las granjas europeas.
Su control adquiere una relevancia especial, no solo por su implicación en la rinitis atrófica, sino porque la coinfección con otros patógenos del tracto respiratorio afecta a la gravedad de la enfermedad. Se ha demostrado que Bb exacerba y predispone infecciones por bacterias secundarias. Por otro lado, Bb es citotóxica para los macrófagos alveolares porcinos, lo que podría dar como resultado un descenso de su actividad fagocítica, facilitando así el acceso de las bacterias al pulmón. En diferentes ensayos se describe de forma consistente un aumento de la colonización nasal por Glasserela parasuis cuando existe una infección previa por Bb. Tomando referencias de estudios previos, parece que Bb es capaz de incrementar la colonización del tracto respiratorio superior por varios patógenos, tales como P. multocida y S. suis, y puede tener un papel importante en el complejo respiratorio porcino (Brockmeier. 2015), por lo que los autores sugieren que esta bacteria debe tenerse muy en cuenta dentro del plan de control en los brotes respiratorios (OIE, 2008).
EL DIAGNÓSTICO
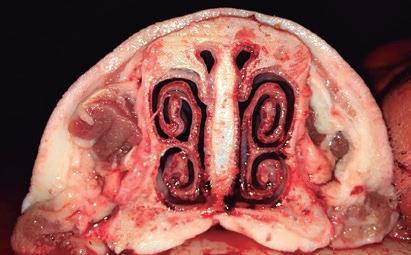
Además del diagnóstico ligado a la aparición de signos clínicos compatibles, también se debe incluir exámenes post mortem del hocico y el aislamiento e identificación de las bacterias causantes. La atrofia de los cornetes en los animales sospechosos podrá verse tras el sacrificio, cuando se examinan secciones de la jeta entre el primer y el segundo premolar (figuras 1 y 2). El diagnostico más sencillo y utilizado hoy en día es el laboratorial. Los hisopos tonsilares o las biopsias proporcionarán los índices de aislamiento más elevados, ya que P. multocida coloniza preferentemente las amígdalas. Para el aislamiento de Bb se recomiendan los hisopos nasales. Aunque lo más práctico será utilizar la técnica de PCR para detectar ambas bacterias, siendo más rápida y sensible la detección. Actualmente no hay pruebas serológicas satisfactorias en las que se pueda confiar para detectar aquellos animales infectados por PMT.
CONTROL Y ERRADICACIÓN
La mortalidad no es un problema importante en esta patología, pero los efectos económicos asociados con la perdida de crecimiento son significativos. Se ha demostrado que existe una correlación entre el grado de daño de los cornetes y el rendimiento productivo del animal. El daño causado a los cornetes es permanente y el tratamiento con antibióticos tiene un valor limitado, sin embargo, existe una manera eficaz de controlar la rinitis atrófica: vacunar a la cerda para que transfiera la protección a sus lechones a través del calostro. La infección en los lechones que da lugar a la rinitis atrófica progresiva (RAP) se produce en las primeras semanas de vida. Sorensen, en 1990, describió la relación entre títulos altos de anticuerpos frente a la toxina de PMT y la ausencia de atrofia de cornetes. Este nivel de protección y control de la enfermedad, podemos conseguirlo con un protocolo vacunal que provea títulos de anticuerpos altos y uniformes no solo frente a las toxinas, sino también frente a las bacterias implicadas en el proceso. Porcilis® AR-T DF (MSD Animal Health) consigue este objetivo. Esta vacuna contiene la proteína dO, que se deriva de la toxina de PMT, que al no contener determinados aminoácidos relacionados con la virulencia se ha vuelto incapaz de entrar en las células y causar enfermedad. Por otro lado, la vacuna también contiene B. bronchiseptica inactivada y Diluvac Forte como adyuvante, para proveerle una potente inmunidad. La vacuna induce títulos altos de anticuerpos en la cerda, que a su vez transfiere anticuerpos maternos protectores a los lechones. Esta inmunidad maternal se prolonga hasta las fases de crecimiento del animal, pudiendo llegar al entorno de las 14 semanas de vida.
¿Se puede llegar a erradicar la rinitis atrófica?
La respuesta es sí, y la justificación para embarcarse en un proyecto de erradicación se encuentra en la mejora de la competitividad sanitaria y productiva, que nos puede igualar a otros países europeos que están trabajando en la vía de la erradicación, como son Holanda, Dinamarca o Austria. Hay multitud de datos que avalan las mejoras productivas que se derivan de la erradicación de la rinitis en las granjas. No obstante, hay ciertos factores que no debe-
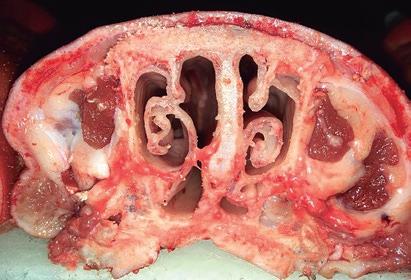
Figura 1: Cornetes nasales sin daños en un animal sano.
Figura 2: Cornetes nasales dañados en animal afectado por rinitis atrófica.
Figura 3: Hisopado nasal para el muestreo de control.
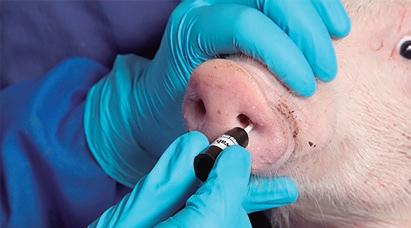
mos olvidar para no fracasar en estas estrategias de erradicación, como son: estar seguros de que la renovación de machos y de cerditas de reposición se hace de granjas libres, seguir de forma firme y continuada los programas de vacunación, y tener un manejo y una bioseguridad interna adecuada. Es muy importante combinar la vacunación intensiva con un sistema de muestreo a partir de hisopados nasales y tonsilares, que detectarán directamente la presencia de la toxina específica de PMT y de Bb por PCR (figura 3). Esto podemos llegar a conseguirlo gracias a que la vacunación, además de controlar los signos clínicos, es capaz de disminuir la colonización de Bb y de PMT de la cavidad nasal (Riising. 2002) (figura 4). En nuestro país también existen experiencias de erradicación de rinitis, como la que se detalla a continuación (Fernandez et al. 2019). El programa se implementó en una granja con producción en varios sitios: ■ Sitio 1. Con 2.900 cerdas productivas, que recibía hembras de reemplazo (RAP negativo) con 2 meses de edad, que se criaban en la granja de cerdas pero en edificios separados. ■ Sitio 2. Ubicado a 500 metros de distancia, era un flujo continuo (6 a 20 kg). ■ Sitio 3. Ubicado a 1 km de distancia, era un sistema de engorde con TD/TF (de 20 a 110 kg). El diagnóstico de RAP se realizó mediante signos clínicos, lesiones, PCR de PMT (hisopos nasales) y control de cornetes nasales en matadero. El programa de control (iniciado en septiembre de 2010) incluyó la vacunación de reemplazos con dos dosis de Porcilis® AR-T DF a los 5 y 6 meses de edad, y dos dosis adicionales a todas las cerdas gestantes (7 y 3 semanas antes del parto) durante 2 años. Después de ese periodo, solo se mantuvo una dosis en cerdas multíparas (antes del parto) y tres dosis para las primerizas (la última también 3 semanas antes del parto). Además, se implementaron medidas de bioseguridad internas y externas. Cinco años después del inicio del programa se detuvo la vacunación. Desde entonces ya no se encontraron signos clínicos, ni PCR positiva a PMT (se hicieron 3 muestreos, separados 3 meses cada uno, de 30 lechones de 9 semanas de edad), ni lesiones en los cornetes durante el control del sacrificio. La granja incluida en este estudio se mantiene aún negativa.
Figura 4. Control de la colonización de Pasteurella multocida tras la vacunación (Riising, 2002).
30 25 20 15 10 5 0 Reaislamiento de Pasteurella multocida en lechones de cerdas vacunadas y no vacunadas.
3 14 28 42 70
■ Vacunado ■ No vacunado Días de aislamiento bacteriológico positivo de PMT
CONCLUSIONES
No nos debemos conformar con el estatus sanitario que tenemos si queremos ser competitivos en el mercado mundial. Hemos visto como con la vacunación somos capaces de erradicar esta enfermedad de las granjas. La reducción del uso de antibióticos pone otra vez a muchas enfermedades bacterianas en el punto de mira tras la aparición de problemas respiratorios, y por tanto, debemos incluirlas en los planes de control y prevención de las granjas. Bordetella bronchiseptica, además de ser uno de los dos patógenos implicados en la rinitis atrófica progresiva, ha demostrado que exacerba y predispone a la implicación de otros patógenos del tracto respiratorio. Por último, hemos comprobado en países como Holanda, que la utilización de Porcilis® AR-T DF como herramienta de vacunación intensiva ha sido una pieza clave para llegar a casi el 100 % de granjas libres a PMT en ese país.
BIBLIOGRAFÍA
Zimmerman J.J. (2012). Diseases of Swine 10th Edition. H.J. Riising et al. (2002). The Veterinary Record. A. Eggen y M. Martens. Porcilis® AR-T: uniformity of titers optimizing passive protection against Atrophic Rhinitis. IPVS 2010. International Pig Topics. Volume 26 Number 6 13 (2011). Using a modern vaccine to counter the economic impact of atrophic rinitis. Brockmeier S. (2015). Bordetella bronchiseptica incrementa la colonización nasal por Haemophilus parasuis. Zhanqin Z. The occurrence of Bordetella bronchiseptica in pigs with clinical respiratory disease. The Veterinary Journal, 2011. Manual de la OIE sobre animales terrestres 2008. Capítulo 2.8.2. Fernandez J. et al. Eradication program for Progressive Atrophic Rhinitis (PAR) in a Spanish farm. ESPHM 2019.







