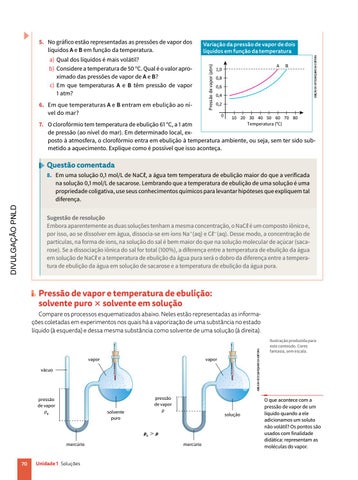
6. Em que temperaturas A e B entram em ebulição ao nível do mar?
A
1,0
B
0,8 0,6 0,4
EDIÇÃO DE ARTE/ARQUIVO DA EDITORA
a) Qual dos líquidos é mais volátil? b) Considere a temperatura de 50 °C. Qual é o valor aproximado das pressões de vapor de A e B? c) Em que temperaturas A e B têm pressão de vapor 1 atm?
Variação da pressão de vapor de dois líquidos em função da temperatura Pressão de vapor (atm)
5. No gráfico estão representadas as pressões de vapor dos líquidos A e B em função da temperatura.
0,2 0
10 20 30 40 50 60 70 80
Temperatura (°C) 7. O clorofórmio tem temperatura de ebulição 61 °C, a 1 atm de pressão (ao nível do mar). Em determinado local, exposto à atmosfera, o clorofórmio entra em ebulição à temperatura ambiente, ou seja, sem ter sido submetido a aquecimento. Explique como é possível que isso aconteça.
Questão comentada
DIVULGAÇÃO PNLD
8. Em uma solução 0,1 mol/L de NaCℓ, a água tem temperatura de ebulição maior do que a verificada na solução 0,1 mol/L de sacarose. Lembrando que a temperatura de ebulição de uma solução é uma propriedade coligativa, use seus conhecimentos químicos para levantar hipóteses que expliquem tal diferença. Sugestão de resolução Embora aparentemente as duas soluções tenham a mesma concentração, o NaCℓ é um composto iônico e, por isso, ao se dissolver em água, dissocia-se em íons Na1(aq) e Cℓ2(aq). Desse modo, a concentração de partículas, na forma de íons, na solução do sal é bem maior do que na solução molecular de açúcar (sacarose). Se a dissociação iônica do sal for total (100%), a diferença entre a temperatura de ebulição da água em solução de NaCℓ e a temperatura de ebulição da água pura será o dobro da diferença entre a temperatura de ebulição da água em solução de sacarose e a temperatura de ebulição da água pura.
Pressão de vapor e temperatura de ebulição: solvente puro 3 solvente em solução
vapor
ADILSON SECCO/ARQUIVO DA EDITORA
Compare os processos esquematizados abaixo. Neles estão representadas as informações coletadas em experimentos nos quais há a vaporização de uma substância no estado líquido (à esquerda) e dessa mesma substância como solvente de uma solução (à direita).
vapor
vácuo
pressão de vapor p0
solvente puro
pressão de vapor p
solução
p0 . p mercúrio
70
mercúrio
Ilustração produzida para este conteúdo. Cores fantasia, sem escala.
O que acontece com a pressão de vapor de um líquido quando a ele adicionamos um soluto não volátil? Os pontos são usados com finalidade didática: representam as moléculas do vapor.
Unidade 1 Soluções
EME18_VIVA_QU2_U1C4_062A077.indd 70
10/06/16 13:06