





Disponible aquí:








COMITÉ EDITORIAL REVIEW OF OPHTHALMOLOGY ESPAÑOL 2025
Eduardo Viteri Coronel, MD.
Editor Clínico Jefe
Laura Malkin-Stuart Editora en Jefe
Mauricio Uribe, MD. Editor Fundador, Colombia
M. Bowes Hamill, MD.
Profesor Asociado, Cullen Eye Institute Baylor College Of Medicine.
José Manuel Rojas Z., MD. Profesor Asociado, Universidad de Costa Rica. San José de Costa Rica, Costa Rica.
Héctor Forero, MD. Director de la Clínica de ojos Forero Bogotá, Colombia.
Magda Gil O., MD.
Sub-Especialista en Glaucoma. Jefe de Glaucoma Hospital de San José, Bogotá, Colombia.
Andrés Cárdenas H., MD. Cirujano Oculoplástico. San Salvador, El Salvador.
Fernando Colombo R., M.D. Sub-Especialista en Cirugía de Párpados, Órbita y Vías Lagrimales. Centro Médico Docente la Trinidad. Caracas, Venezuela.
Andrés Rosas., MD. Cirujano Refractivo Director Científico de Exilaser Bogotá, Colombia
El consejo editorial de Review Of Ophthalmology México en Español invita a nuestros lectores a escribir al correo lmalkinstuart@clatinmedia.com y eolguin@clatinmedia.com sus casos clínicos o experiencias científicas que consideren de interés para compartir con nosotros. Por favor indicarnos, lugar de contacto, número telefónico y correo electrónico
Impresión El Tiempo Casa Editorial.

Estimados colegas,
Eduardo Viteri Coronel, MD
Editor Clínico Jefe
Review of Ophthalmology en Español eviteri@humanavision.com
Hace algunos años, durante mi formación como especialista en oftalmología, el panorama de la miopía era muy distinto al que enfrentamos hoy. Las opciones para reducir su progresión eran prácticamente inexistentes, el uso del láser para corregirla era solo una visión futurista, y su prevalencia, aunque preocupante, no alcanzaba los niveles alarmantes que observamos actualmente. Este cambio nos recuerda la importancia de mantenernos actualizados en los avances científicos y clínicos, y es precisamente con ese propósito que presentamos esta edición especial, dedicada al manejo actual de la miopía.
La miopía se ha convertido en una preocupación mundial debido a su creciente prevalencia y sus implicaciones en la salud visual, como lo destaca el artículo “Miopía: una preocupación mundial” de la Dra. Karla Moreno Muñoz y colaboradores. Según el Instituto Internacional de Miopía (IMI), mientras que en el año 2020 el 30 % de la población mundial presentaba esta condición, se estima que para 2050 esta cifra alcanzará el 50 %, con un 10 % afectado por miopía elevada. Además, el riesgo de desarrollar complicaciones graves, como degeneración macular miópica y desprendimiento de retina, se incrementa significativamente con cada dioptría adicional, lo que refuerza la importancia de implementar estrategias de manejo y control basadas en evidencia para frenar esta alarmante tendencia.
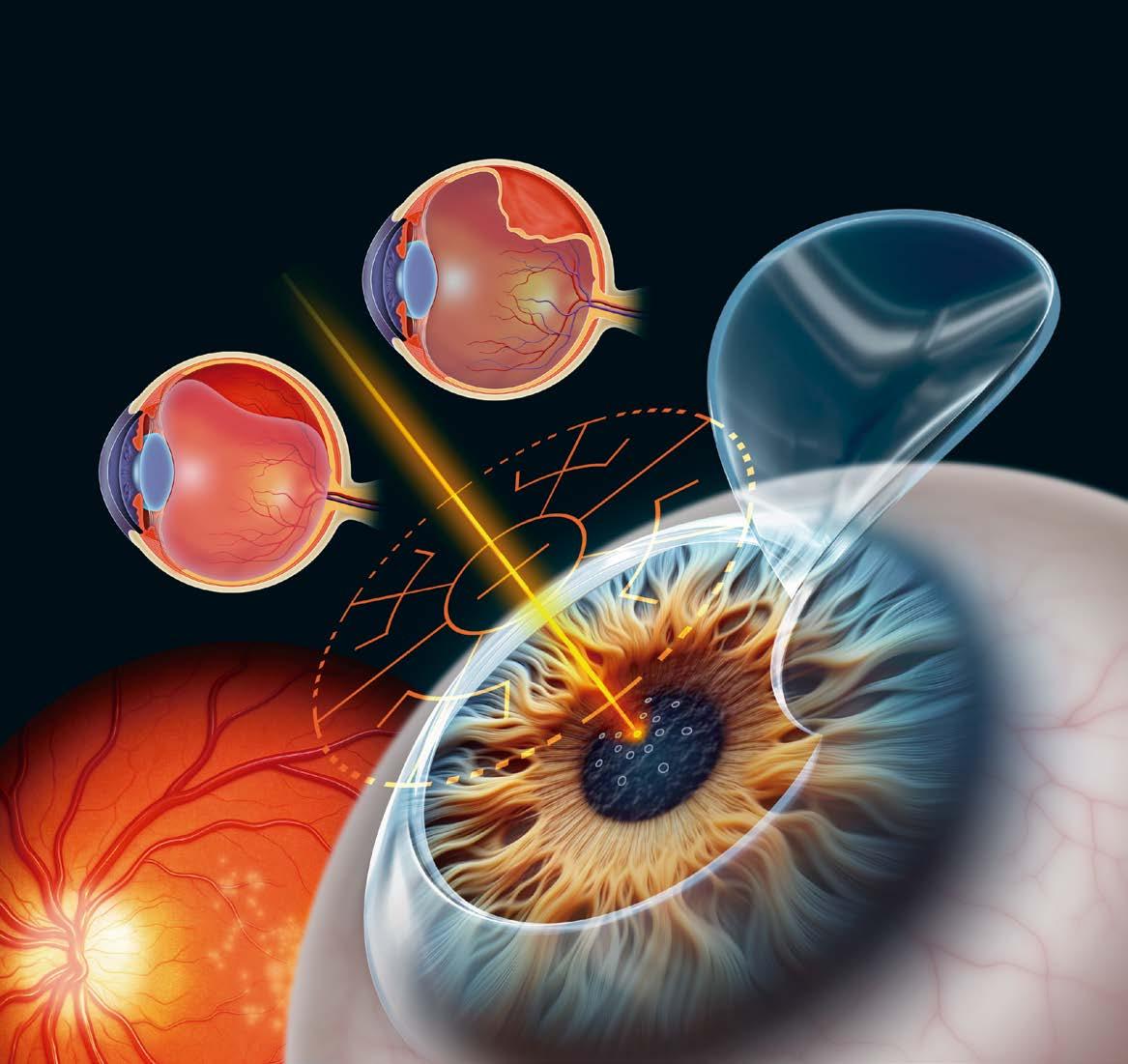
El artículo “Riesgos retinianos en la miopía y la cirugía LASIK”, escrito por Liz Hunter, aborda la relación entre la miopía y las degeneraciones retinianas periféricas, así como los posibles riesgos asociados a la cirugía refractiva con láser. Este texto destaca la importancia de realizar un examen oftalmológico completo previo a la intervención, incluyendo la evaluación de la retina periférica mediante técnicas como la dilatación pupilar y oftalmoscopía indirecta. Según los expertos citados, los pacientes con miopía moderada o alta presentan un mayor riesgo de desarrollar degeneración reticular, agujeros, desgarros o incluso desprendimientos retinianos.
Por otro lado, el estudio “Comparar el dolor post quirúrgico post cirugía PRK vs TransPRK”, liderado por la Dra. Alejandra Fernández Vidal compara el dolor postoperatorio y los resultados refractivos entre PRK y TransPRK en pacientes con córneas delgadas. Ambos métodos ofrecen buenos resultados visuales y tolerancia al dolor a largo plazo, aunque la PRK presenta menor dolor inmediato y la TransPRK reduce el tiempo quirúrgico, lo que orienta la elección según el caso clínico.
El artículo “Glaucoma y miopía alta: diagnóstico diferencial en un caso”, liderado por el Dr. Fernando Gómez Goyeneche, aborda los desafíos para diferenciar entre miopía alta y glaucoma, destacando la importancia de un enfoque diagnóstico multimodal. A través de un caso clínico, se analizan alteraciones estructurales y funcionales, y se enfatiza el valor de herramientas como la OCT ajustada por longitud axial y la fotografía de fondo de ojo para un manejo preciso y eficaz.
Este conjunto de artículos ofrece una perspectiva integral sobre los desafíos y avances en el manejo de la miopía, la cirugía refractiva y el glaucoma. Invitamos a los lectores a reflexionar sobre las implicaciones clínicas discutidas y a compartir sus experiencias y comentarios, enriqueciendo el diálogo científico en torno a estas condiciones oculares. ¡Tu opinión es clave para seguir construyendo conocimiento!

Estimados lectores,
Laura Malkin-Stuart
Editora en Jefe
Review of Ophthalmology en Español
Con esta cuarta edición, alcanzamos la mitad de nuestro recorrido, guiados siempre por el propósito de contribuir al desarrollo de la oftalmología en Latinoamérica. En esta ocasión, quiero expresar mi agradecimiento al comité organizador del XXXVI Congreso Panamericano de Oftalmología y a la Sociedad Colombiana de Oftalmología por haber hecho posible unos días clave para el avance de la especialidad en la región, del 30 de mayo al 2 de junio en el Centro de Convenciones Ágora, en Bogotá. Las palabras del Dr. Paulo Dantas, presidente de la PAAO, al inicio del congreso, capturaron a la perfección el sentir de todos los asistentes: “recibimos a todos con el corazón abierto a un congreso que fue preparado con mucho cariño”.
A su vez, las palabras del Dr. Eduardo Viteri, nuestro editor clínico y coordinador de Educación en la PAAO, reflejaron con precisión el sentir de nuestro equipo editorial tras unos días intensos de cobertura: “han sido unos días agotadores a veces, pero siempre con ganas de ver más”.
Agradecemos de manera muy especial a la Sra. Faizully Rojas Bendeck, gerente general de la Sociedad Colombiana de Oftalmología, y a su asistente Jeniffer, por su excelente labor de coordinación con Kelly Triana, ejecutiva de Review of Ophthalmology y @oftalmologoaldia. Gracias a este trabajo conjunto, logramos realizar, a través de todos nuestros medios de comunicación, una cobertura editorial a la altura del congreso. Desde Review of Ophthalmology felicitamos a la Dra. Carol Karp, nueva presidenta de la PAAO, así como al nuevo comité ejecutivo (2025–2027). Esperamos con entusiasmo el próximo Congreso Panamericano, que se celebrará en Lima, Perú, en 2027.
El pasado 2 de julio, nuestro equipo editorial colaboró con PanCornea (Sociedad Panamericana de Córnea) en la producción del segundo episodio de la tercera temporada del webinar Grand Rounds, Terapias de Sillón, coordinado por el Dr. Jaime Martínez. Como es habitual, participaron destacados expertos: el Dr. Luis Izquierdo y el Dr. Nicolás Pereira, quienes compartieron sus conocimientos y experiencias en un espacio enriquecedor. La sesión fue moderada por el Dr. Harry Levine y la Dra. Clara Bonel, quienes guiaron la discusión de forma dinámica y profesional.
Para revivir el webinar, puede visitar la página pancornea.com o acceder a nuestra plataforma interactiva en ateneavision.com, en la sección Webinars. Grand Rounds, Terapias de Sillón, una iniciativa de PanCornea ideada por el Dr. Jaime Martínez, es un brillante ejemplo de cómo las nuevas generaciones están aprovechando la tecnología para educar y colaborar en torno a casos complejos en oftalmología.
Finalmente, quiero agradecer a todos nuestros lectores que nos acompañan tanto en Review of Ophthalmology como en nuestra comunidad virtual de @oftalmologoaldia. Nuestra próxima edición estará dedicada a un especial sobre retina, y desde estas páginas extiendo una cordial invitación a quienes deseen enviarnos un artículo o caso clínico para ser considerado para publicació.

Editora en Jefe: Laura Malkin-Stuart
Editor Clínico en Jefe (En Español): Dr. Eduardo Viteri
Editores (En Español): Juan Pablo Chajin
Editor Clínico en Jefe (México): Dr. Raúl Suárez
Editora en jefe (México): Elizabeth Olguín
Editor Europa: Nicholas Plotnicoff
Editor Europa: Laura Mercado
Editor Brasil / Universo Visual: Dr. Marcos Ávila
Jefe de Producción: Alejandro Bernal
Diseñadora Gráfica: Nathalia A. López
Ilustración Portada: Walter Muñoz
Ilustración basada en el artículo:
Riesgos retinianos en la miopía y la cirugía LASIK
Profesional Logística: Ximena Ortega Bernal
Diseñador Gráfico Medios Digitales: Cristian Puentes G. Fotógrafo de eventos: Jacobo Plotnicoff
Producida / Editada / Diseñada / Distribuida por: 3 Touch Media S.A.S.
Director Ejecutivo (CEO): Juan Carlos Plotnicoff
Director de Operaciones (COO): Sergio Plotnicoff
Director Comercial: Héctor Serna
Directora de Comunicaciones: Laura Malkin-Stuart
Directora Administrativa y financiera: Luisa Fda. Vargas

Glaucoma y miopía alta: diagnóstico diferencial en un caso
Autores: Dr. Fernando Gómez Goyeneche, Dra. Laura Zarate Pinzón, Dra. Natalia Guarnizo, Dra. MaríaAlejandraVillamilForero 06
Miopía: una preocupación mundial
Autores: Dra. Karla Moreno Muñoz, Dra. Silvia Ruelas Reyes, Dra. Fabiola Herrera López y Dr. Juan Carlos Serna Ojeda 11
Creative Latin Media LLC
2901 Clint Moore Rd, P.M.B 117
Boca Raton, FL 33496
USA
Tel: +57 310 304-8820 e-mail: suscripciones@clatinmedia.com
Las traducciones y el contenido editorial de Review of Ophthalmology En Español, no pueden ser reproducidos sin el permiso de Creative Latin Media™.
México: Carlos Cerezo, Cel: +52 (1) 5611748192, ccerezo@clatinmedia.com
Andina y Centroam◙érica: Kelly Triana, Cel: +57 320 9454400, ktriana@clatinmedia.com USA, Europa y Brasil: Héctor Serna, Cel: +1 561 4437192 ventas1@clatinmedia.com
Proyectos Especiales: Cel: +57 (320) 945-4382,
USA: 2901 Clint Moore Rd, P.M.B 117 Boca Raton, FL 33496, Tel: +1 (561) 716 271 Colombia: Carrera 7 No. 106 - 73 Of. 301 Bogotá, Colombia, Tel: +57 (310) 304-8820
México: Río Mississippi 49, piso 14, int. 1402. Colonia Cuauhtémoc, Alcaldía Cuauhtémoc, Ciudad de México, CP. 06500, Tel: 5552084148.
Review of Ophthalmology (ISSN 1088-9507) es una revista publicada por Creative Latin Media, LLC bajo licencia de Jobson Publishing LLC. Su distribución es gratuita a todos los profesionales de la Salud Visual que cumplan con los requisitos requeridos para recibir la revista en América Latina. Tarifas de suscripción anual, seis ediciones. Colombia US$60, México US$60, Latinoamérica (paises de habla hispana) US$120, Brasil US$180, USA y Canada US$220, Europa y Asia US$260. Para suscripciones comuniquese a suscripciones@clatinmedia.com
Otros productos de Creative Latin Media son: 20/20 En Español y 20/20 México
Riesgos retinianos en la miopía y la cirugía LASIK Por Liz Hunter, editora sénior 14
Comparar el dolor post quirúrgico post cirugía
PRK vs. TransPRK
Autores: Dra. Alejandra FernándezVidal, Dr. Ticiano Giobellina, Dr. Andrés Giobellina. 17
Rosácea ocular como entidad inflamatoria crónica: Revisión integral desde la fisiopatología hasta la intervención clínica
Autores: Dr. Arturo Ramírez Miranda, Dra.Angélica Hernández Solis, Dr. Gustavo Ortiz Morales, Dr. GuillermoVera Duarte, Dr.Alejandro Navas, Dr.Enrique Graue Hernández 23
Nuevas Perspectivas en el Diagnóstico y Tratamiento del Ojo Secoor 28


Autores: Dr. Fernando Gómez Goyeneche, Dra. Laura Zarate Pinzón, Dra. Natalia Guarnizo, Dra. María Alejandra Villamil Forero




Correspondencia del autor:
Dr. Fernando Gómez Goyeneche
Oftalmólogo glaucomatólogo
Diagnóstico Ocular del Country
Email: hfgomezgol@gmail.com
Número de teléfono: +57 315 3213460
Dirección: Cra. 16 #82-95 Consultorio 703, Bogotá
La miopía es un defecto refractivo caracterizado por la incapacidad de visualizar objetos distantes (1). Su prevalencia ha aumentado en las últimas décadas, y se estima que para el año 2050 afectará aproximadamente al 50 % de la población mundial, representando un desafío para la salud pública (2,3). Adicionalmente, se asocia a complicaciones que pueden derivar en ceguera irreversible, como la degeneración macular, el desprendimiento de retina y el glaucoma (3,4).
Esta condición constituye un factor de riesgo independiente para el desarrollo de glaucoma primario de ángulo abierto, con un aumento estimado del 20 % en el riesgo por cada dioptría adicional (2). Diferenciar entre las modificaciones pro-
pias de la miopía y los signos tempranos de glaucoma puede ser complejo, ya que ambas entidades comparten hallazgos como inclinación, torsión u ovalización del disco óptico, mayor excavación y atrofia peripapilar (3,5–7), evidentes en la fotografía de fondo de ojo (8).
Adicionalmente, se ha reportado que hasta el 63 % de los pacientes miopes presentan defectos en el campo visual computarizado (CVC), los cuales se correlacionan con alteraciones estructurales en la lámina cribosa (9), así como con cambios en la tomografía de coherencia óptica (OCT), como el adelgazamiento macular del complejo de células ganglionares (CCG) (5).
La elongación axial genera cambios estructurales, como deformación de la lámina cribosa, mayor tensión escleral y adelgazamiento del tejido, que incrementan la susceptibilidad al daño glaucomatoso (5). En este contexto, el uso de bases normativas ajustadas por longitud axial, integradas en los equipos RS-3000 Advance 2 y RS-1, ha demostrado mejorar la precisión diagnóstica y reducir la tasa de falsos positivos en ojos miopes (10,11).
La combinación de estas herramientas imagenológicas con una evaluación clínica minuciosa es esencial para establecer un diagnóstico diferencial preciso entre miopía y glaucoma (12). A continuación, se presenta el caso de una paciente con miopía patológica remitida por sospecha de glaucoma, en quien la correlación estructural y funcional fue determinante para la realización de un diagnóstico diferencial adecuado.
Paciente femenina de 62 años con diagnóstico de miopía patológica, con refracción de OD: -22.00 -1.50 x 30 y OI: -22.50 -1.00 x 109, paquimetrías de 396/392 μm y longitudes axiales de 31.32/30.53 mm. Antecedentes: OD con desprendimiento de retina y AO con membrana neovascular tratada con agentes antiangiogénicos, además de cirugía de facoemulsificación con implante de lente intraocular.
Consultó por primera vez a nuestro servicio en 2016 por sospecha de glaucoma. Se registró una agudeza visual corregida con corrección (AVCC) de 20/40 en OD y 20/30 en OI. La biomicroscopía anterior no mostró alteraciones, con presión intraocular (PIO) en ambos ojos (AO) de 18 mmHg. En el examen de fondo de ojo AO se observaron discos ópticos inclinados con excavaciones de 0.1, estafiloma posterior tipo 1 según la clasificación de Curtin (13), de mayor extensión en OD, así como signos de maculopatía miópica con componente atrófico grado 3, sin evidencia de tracción ni de neovascularización activa (14). Sin embargo, en OD se identificaron dos áreas de atrofia coriorretiniana en relación con membrana neovascular antigua, mientras que en OI no hubo evidencia de cicatrices (Figura 1).

Figura 1: seguimiento fotográfico del fondo de ojo. Medios claros. Discos ópticos inclinados con excavaciones de 0.1 en ambos ojos (AO). Se observa estafiloma posterior tipo 1, de mayor extensión en OD, así como maculopatía miópica con componente atrófico grado 3, sin evidencia de tracción vitreorretiniana ni de neovascularización activa. En OD se identifican dos áreas de atrofia coriorretiniana en relación con membrana neovascular antigua. Se documenta progresión del componente atrófico hacia la región macular en ambos ojos. a) 2016; b) 2019; c) 2025.

Figura 2. Tomografía de coherencia óptica de nervio óptico y capa de células ganglionares. OCT obtenido con el equipo NIDEK RS-3000 Advance 2, ajustado a la base normativa de longitud axial, que muestra adelgazamiento en la capa de células ganglionares y en la capa de fibras nerviosas. Los hallazgos fueron considerados no concluyentes debido a la morfología del disco óptico, errores en la segmentación y numerosos artefactos periféricos debido a que la longitud axial excede los valores de la compensación de la base normativa que viene para 26 a 29 mm. a) mapa circulo de disco, b) mapa de disco, c) mapa macular.

Figura 3. Campimetría visual computarizada 24-2C. Se evidencia una disminución generalizada de la sensibilidad retiniana, con deterioro campimétrico y aumento de defectos peripapilares, centrales y paracentrales en ambos ojos (AO). a) 2016; b) 2019; c) 2025.
Con el fin de descartar daño glaucomatoso, se solicitó OCT de nervio óptico y CCG, así como CVC 24-2C. El OCT, realizado con el equipo NIDEK RS-3000 Advance 2 ajustado a la base normativa de longitud axial, evidenció en ambos ojos (AO) adelgazamiento de la CCG y de la capa de fibras nerviosas (Figura 2). En el CVC de OD se evidenció la presencia de defectos peripapilares, mientras que en OI se observaron hallazgos inespecíficos, sin cumplir criterios diagnósticos de neuropatía óptica glaucomatosa (Figura 3).
En 2019, la paciente presentó un nuevo episodio en AO de neovascularización coroidea, tratado con inyecciones intravítreas de antiangiogénicos. En 2023, se evidenció AO hipertensión ocular, con PIO de 22/24 mmHg; por lo que, se inició tratamiento tópico con dorzolamida 2% y timolol 0.5%, cada 12 horas. En 2024, se realizó AO trabeculoplastia selectiva con láser para optimizar el control de PIO y se continuo con tratamiento hipotensor.
En el seguimiento de 2025, nueve años después de su primera valoración. Paciente con AVcc OD 20/100 y OI 20/30, AO sin alteraciones en biomicroscopia y con PIO 15/15 mmHg. En el examen de fondo de ojo AO, se observó progresión de la maculopatía miópica por extensión del componente atrófico, áreas de atrofia coriorretiniana y coroidosis miópica, sin evidencia de progresión estructural del nervio óptico ni signos compatibles con neuropatía óptica glaucomatosa (Figura 1). El CVC 24-2C evidenció en OD defectos peripapilares y paracentrales superiores, y en OI defecto inespecífico, atribuibles a la patología miópica (Figura 2). La paciente permanece en seguimiento semestral.
Los pacientes con miopía, especialmente aquellos con miopía alta, requieren un enfoque clínico integral orientado a prevenir la progresión de la enfermedad, la aparición de complicaciones y la pérdida de agudeza visual (15). Para ello, es fundamental realizar un abordaje integral que incluya una evaluación clínica completa y el uso de herramientas diagnósticas como la tonometría, fotografía de fondo de ojo, CVC, OCT de nervio óptico y CCG, así como angio-OCT (OCT-A) (5).
La miopía alta, definida como un equivalente esférico ≤–6 dioptrías o una longitud axial ≥26.5 mm, se reconoce como un factor de riesgo para el desarrollo y la progresión del glaucoma de ángulo abierto (2,5). Los cambios estructurales inducidos por la elongación axial, como la inclinación y la ovalización del disco óptico, pueden imitar signos típicos de la neuropatía óptica glaucomatosa, lo que dificulta su diagnóstico diferencial (16).
Presentamos el caso de una paciente con miopía alta, referida por sospecha de glaucoma. El examen clínico reveló un disco óptico notablemente inclinado y ovalado, con excavación
mínima, presencia de estafiloma posterior y antecedentes de desprendimiento de retina y neovascularización coroidea. Estos hallazgos orientaron el diagnóstico hacia una miopía patológica como la principal causa de las alteraciones estructurales observadas.
El uso de bases normativas ajustadas por longitud axial en la OCT ha demostrado disminuir la tasa de falsos positivos en el diagnóstico de glaucoma en pacientes con miopía (10,11). No obstante, en este caso específico se evidenció un adelgazamiento de la capa de fibras nerviosas y de la CCG, hallazgo que no puede considerarse confiable debido a la marcada inclinación del disco óptico. Además, la longitud axial de la paciente excede los valores contemplados en la base normativa, lo que puede generar artefactos y errores en la segmentación (17). Esta limitación obligó a complementar la evaluación con otras herramientas diagnósticas, como la fotografía de fondo de ojo, el CVC y las paquimetrías.
La fotografía de fondo de ojo se ha consolidado como una herramienta útil, accesible y costo-efectiva para el seguimiento estructural del nervio óptico y la capa de fibras nerviosas en pacientes con miopía (8). Su aplicación se ha extendido al desarrollo de algoritmos de inteligencia artificial, alcanzando sensibilidades y especificidades superiores al 90% para la detección de glaucoma (18–20). En este contexto, resulta fundamental diferenciar los hallazgos estructurales propios de la miopía de aquellos característicos de la neuropatía óptica glaucomatosa.
En el glaucoma, los hallazgos típicos incluyen defectos en cuña de la capa de fibras nerviosas, comúnmente localizados en los sectores ínfero o superotemporales del nervio óptico, respetando la región central hasta estadios avanzados. También son frecuentes la nasalización de los vasos centrales, la configuración en bayoneta de los vasos y la profundización de la excavación (5,16). En contraste, en la miopía alta suelen observarse alteraciones en la región papilomacular, acompañadas de torsión e inclinación del disco óptico (5,16,21). En el caso presentado, se observó una marcada inclinación y ovalización del disco óptico, con excavación leve y presencia de estafiloma posterior, hallazgos que orientan el diagnóstico hacia una miopía patológica.
El CVC también representa un reto en estos pacientes, ya que la miopía puede simular patrones glaucomatosos, como escalones nasales, defectos paracentrales y arqueados (8,22). En el glaucoma, predominan los escotomas paracentrales, los defectos en cuña y, en etapas tardías, la visión en túnel (16). En cambio, los pacientes miopes presentan, con mayor frecuencia, depresiones generalizadas, ampliación de la mancha ciega y defectos centrales o paracentrales, que pueden progresar con el tiempo (23). En el caso presentado, los CVC mostraron defectos generalizados y paracentrales inespecíficos, con evidencia de progresión e indicios compatibles con miopía patológica.
La medición del grosor corneal central es esencial en la evaluación del glaucoma, ya que influye directamente en la precisión de las mediciones de la presión intraocular (PIO) (24). Las córneas gruesas tienden a sobrestimar la PIO, mientras que las córneas delgadas la subestiman (25). Los pacientes miopes suelen presentar córneas más delgadas (24), lo que se asocia a una menor rigidez ocular y, por ende, a una deformación aumentada que podría contribuir a una mayor susceptibilidad al daño glaucomatoso (26). Por ello, la realización de paquimetría es fundamental para ajustar correctamente los valores de PIO.
En el presente caso, la paciente presentó córneas delgadas y, tras desarrollar hipertensión ocular, fue tratada mediante trabeculoplastia láser selectiva y medicación tópica, logrando un control efectivo de la presión intraocular (PIO) durante el primer año de seguimiento. Se continuará el seguimiento con controles oftalmológicos semestrales que incluyan medición de PIO, fotografía de fondo de ojo y campimetría visual computarizada (CVC).
Este caso resalta las dificultades diagnósticas en la evaluación del glaucoma en pacientes con miopía alta. Ante la limitada confiabilidad de algunas pruebas debido a las alteraciones morfológicas del globo ocular, es fundamental adoptar un enfoque diagnóstico multimodal que combine evaluación clínica, fotografía de fondo de ojo y campimetría visual. Reconocer los patrones específicos de daño estructural y funcional propios de la miopía patológica es clave para evitar el sobrediagnóstico de glaucoma y orientar decisiones terapéuticas informadas y basadas en evidencia.
El Dr. Fernando Gómez Goyeneche, miembro activo y expresidente de Glaucoma Colombia, invita al Congreso Bienal que se llevará a cabo los días 26 y 27 de septiembre de 2025 en Medellín. Para más información sobre este importante evento o para unirse a la organización, visite la página: www.glaucomacolombia.org.
1. Baird PN, Saw SM, Lanca C, Guggenheim JA, Smith Iii EL, Zhou X, et al. Myopia. Nat Rev Dis Primers. el 17 de diciembre de 2020;6(1):99.
2. Ha A, Kim CY, Shim SR, Chang IB, Kim YK. Degree of Myopia and Glaucoma Risk: A Dose-Response Meta-analysis. American Journal of Ophthalmology. abril de 2022;236:107–19.
3. Holden BA, Fricke TR, Wilson DA, Jong M, Naidoo KS, Sankaridurg P, et al. Global Prevalence of Myopia and High Myopia and Temporal Trends from 2000 through 2050. Ophthalmology. mayo de 2016;123(5):1036–42.
4. Haarman AEG, Enthoven CA, Tideman JWL, Tedja MS, Verhoeven VJM, Klaver CCW. The Complications of Myopia: A Review and Meta-Analysis. Invest Ophthalmol Vis Sci. el 29 de abril de 2020;61(4):49.
5. Sun MT, Tran M, Singh K, Chang R, Wang H, Sun Y. Glaucoma and Myopia: Diagnostic Challenges. Biomolecules. el 20 de marzo de 2023;13(3):562.
6. Kita Y, Kita R, Takeyama A, Tomita G, Goldberg I. Effect of high myopia on glaucoma diagnostic parameters measured with optical coherence tomography. Clinical Exper Ophthalmology. noviembre de 2014;42(8):722–8.
7. Zhang XJ, Lai CHY, Shih KC. Beyond Spherical Equivalent and Axial Length in Myopia. JAMA Ophthalmol [Internet]. el 5 de junio de 2025 [citado el 27 de junio de 2025]; Disponible en: https://jamanetwork. com/journals/jamaophthalmology/fullarticle/2834965
8. Jiravarnsirikul A, Belghith A, Rezapour J, Bowd C, Moghimi S, Jonas JB, et al. Evaluating glaucoma in myopic eyes: Challenges and opportunities. Survey of Ophthalmology. mayo de 2025;70(3):563–82.
9. Xie S, Kamoi K, Igarashi-Yokoi T, Uramoto K, Takahashi H, Nakao N, et al. Structural Abnormalities in the Papillary and Peripapillary Areas and Corresponding Visual Field Defects in Eyes With Pathologic Myopia. Invest Ophthalmol Vis Sci. el 21 de abril de 2022;63(4):13.
10. Chen HSL, Ling XC, Lu DW, Chuang LH, Su WW, Lee YS, et al. Glaucoma diagnostic performance of macular ganglion cell complex thickness using regular and long axial length normative databases. Sci Rep. el 4 de julio de 2022;12(1):11263.
11. Chang YF, Ko YC, Hsu CC, Chen MJ, Liu CJL. Glaucoma assessment in high myopic eyes using optical coherence tomography with long axial length normative database. Journal of the Chinese Medical Association. marzo de 2020;83(3):313–7.
12. Gifford KL, Richdale K, Kang P, Aller TA, Lam CS, Liu YM, et al. IMI –Clinical Management Guidelines Report. Invest Ophthalmol Vis Sci. el 1 de febrero de 2019;60(3):M184.
13. Yoon CK, Lee EK, Bae K, Park UC. Clinical features of primary and compound forms of wide macular posterior staphyloma in high myopia. BMC Ophthalmol. el 11 de junio de 2024;24(1):246.
14. Ruiz-Medrano J, Flores-Moreno I, Ohno-Matsui K, Cheung CMG, Silva R, Ruiz-Moreno JM. CORRELATION BETWEEN ATROPHY-TRACTION-NEOVASCULARIZATION GRADE FOR MYOPIC MACULOPATHY AND CLINICAL SEVERITY. Retina. septiembre de 2021;41(9):1867–73.
15. Bullimore MA, Ritchey ER, Shah S, Leveziel N, Bourne RRA, Flitcroft DI. The Risks and Benefits of Myopia Control. Ophthalmology. noviembre de 2021;128(11):1561–79.
16. Zhang X, Jiang J, Kong K, Li F, Chen S, Wang P, et al. Optic neuropathy in high myopia: Glaucoma or high myopia or both? Progress in Retinal and Eye Research. marzo de 2024;99:101246.
17. NIDEK [Internet]. [citado el 30 de junio de 2025]. Software for NIDEK OCT series Long Axial Length Normative Database NIDEK. Disponible en: https://www.nidek.co.jp/
18. Liu H, Li L, Wormstone IM, Qiao C, Zhang C, Liu P, et al. Development and Validation of a Deep Learning System to Detect Glaucomatous Optic Neuropathy Using Fundus Photographs. JAMA Ophthalmol. el 1 de diciembre de 2019;137(12):1353.
19. Li Z, He Y, Keel S, Meng W, Chang RT, He M. Efficacy of a Deep Learning System for Detecting Glaucomatous Optic Neuropathy Based on Color Fundus Photographs. Ophthalmology. agosto de 2018;125(8):1199–206.
20. Meng J, Song Y, He W, Lu ZL, Chen Y, Wei L, et al. A Novel Artificial Intelligence-Based Classification of Highly Myopic Eyes Based on Visual Function and Fundus Features. Trans Vis Sci Tech. el 5 de septiembre de 2024;13(9):12.
21. Li Z, Guo X, Xiao O, Lee PY, Liu R, Wang D, et al. Optic Disc Features in Highly Myopic Eyes: The ZOC-BHVI High Myopia Cohort Study. Optom Vis Sci. abril de 2018;95(4):318–22.
22. Chang RT, Singh K. Myopia and glaucoma: diagnostic and therapeutic challenges. Current Opinion in Ophthalmology. marzo de 2013;24(2):96–101.
23. Lin F, Chen S, Song Y, Li F, Wang W, Zhao Z, et al. Classification of Visual Field Abnormalities in Highly Myopic Eyes without Pathologic Change. Ophthalmology. julio de 2022;129(7):803–12.
24. Agbato D, Rickford K, Laroche D. Central Corneal Thickness and Glaucoma Risk: The Importance of Corneal Pachymetry in Screening Adults Over 50 and Glaucoma Suspects. OPTH. el 15 de febrero de 2025;19:563–70.
25. Browning AC. The effect of corneal thickness on intraocular pressure measurement in patients with corneal pathology. British Journal of Ophthalmology. el 1 de noviembre de 2004;88(11):1395–9.
26. Chansangpetch S, Panpruk R, Manassakorn A, Tantisevi V, Rojanapongpun P, Hurst CP, et al. Impact of Myopia on Corneal Biomechanics in Glaucoma and Nonglaucoma Patients. Invest Ophthalmol Vis Sci. el 4 de octubre de 2017;58(12):4990.

Autores: Dra. Karla Moreno Muñoz, Dra. Silvia Ruelas Reyes, Dra. Fabiola Herrera López y Dr. Juan Carlos Serna Ojeda
Instituto Visión Láser, Aguascalientes, México.
La Organización Mundial de la Salud define a la miopía y la miopía degenerativa como una enfermedad ocular que, a nivel mundial, aumenta el riesgo de pérdida visual.
Los cambios en el estilo de vida han contribuido al aumento en la prevalencia de la miopía. Según estudios del Instituto Internacional de Miopía (IMI), para el año 2020, el 30 % de la población mundial presentaba miopía, y se estima que para el año 2050 esta cifra alcanzará el 50 %, con un 10 % de la población afectada por miopía elevada.
A medida que aumenta el nivel de miopía, el riesgo de padecer enfermedades oculares que amenacen la visión en etapas posteriores de la vida también aumenta como se muestra en la siguiente tabla:
Nivel de miopía Catarata (PSC) Desprendimiento de retina Degeneración macular miópica


Dra. Silvia Ruelas Reyes Dra. Karla Moreno

Fabiola


Para reducir este riesgo de desarrollar complicaciones graves asociadas con la miopía, las investigaciones demuestran que cada dioptría cuenta. Un aumento de 1 dioptría (D) en la miopía se asocia con un mayor riesgo de:
• Degeneración macular miópica: 57%
• Glaucoma de ángulo abierto: 20%
• Catarata subcapsular posterior: 21%
• Desprendimiento de retina: 30%
Además de las dioptrías, la longitud axial se relaciona con un mayor riesgo de discapacidad visual; por lo que es necesaria la vigilancia de este parámetro durante la infancia y la adolescencia. En la siguiente tabla se describe la longitud axial promedio por edad y sexo.
EDAD
6 AÑOS
15
AUMENTO ANUAL 0,24 0,23
Debido al impacto que la miopía tiene en aspectos educativos, económicos y en la calidad de vida, el Instituto Internacional de Miopía (IMI) busca generar conciencia y lograr un consenso global sobre su manejo y control, mediante reuniones de expertos y la publicación de informes basados en evidencia.
La miopía se ve influenciada por factores de riesgo no modificables, entre ellos la etnia, la herencia y la refracción, así como por factores modificables tales como el tiempo dedicado a actividades al aire libre y el trabajo de visión cercana como en pantallas y dispositivos móviles. El género, la edad, los patrones de sueño y la ubicación geográfica se consideran factores de carácter especulativo.
Las opciones de tratamiento más efectivas, para controlar la miopía, retardar su progresión y evitar la elongación del globo ocular son:
• Lentes aéreas: Cuentan con una zona central clara para la visión lejana con corrección completa y una zona de tratamiento que contiene puntos difusores para crear un desenfoque miópico y reducir el contraste en la retina con una eficacia mayor al 60%.

Existen otros diseños de lentes aéreos para el control de miopía, como lo son: lentes progresivas, bifocales y de desenfoque periférico, sin embargo por su eficacia limitada menor al 30%, no se recomiendan de primera instancia.
• Lentes de contacto (LC): Suelen basarse en la teoría del desenfoque periférico, para ralentizar la progresión de la miopía con una efectividad de hasta el 50%. Además ofrecen beneficios como independecia, seguridad, participación en el deporte y mejor apego a tratamiento.

Otras variaciones de diseños de LC son los lentes multifocales y los de profundidad de enfoque extendida, los cuales se basan en las teorías de desenfoque periférico y desenfoque simultáneo del control de la miopía. Estos tienen diferentes potencias en toda la lente, lo que crea una gama de visión nítida a distintas distancias con una tasa de efectividad menor al 35%.


• Ortoqueratología: Este tipo de LC tienen un rendimiento muy similar a LC blando para retardar la elongación axial en niños miopes y la independencia de uso de lentes durante el día.
Algunos estudios demuestran que el uso de ciclopléjicos como la atropina en concentración baja (al 0,01 %) puede ser útil para enlentecer la progresión de la miopía y ofrece beneficios adicionales al combinarse con otros tratamientos ópticos.
Es importante considerar que suspender la atropina de forma súbita puede generar un efecto rebote por lo que se recomienda una reducción gradual de la dosis. En caso de suspender el tratamiento de la miopía antes de la edad adulta, se requiere un seguimiento estrecho y continuo para controlar el efecto rebote.
La terapia con luz roja de bajo nivel repetida (RLRL) ha surgido recientemente como una nueva estrategia de tratamiento para el control de la miopía. Un estudio intervencional de 2 años mostró una reducción de la elongación axial y la progresión refractiva en más del 50%.
Existen algunas preocupaciones con la terapia RLRL:
• Se observó un gran efecto rebote en los niños que interrumpieron la terapia RLRL después de un año.
• El mecanismo de acción de RLRL aún no se comprende completamente.
• Un informe de caso de 2023 describió un ejemplo de posible daño a la retina debido a la terapia RLRL.
• Se ha publicado evidencia limitada sobre la terapia RLRL.
Se necesita más investigación para evaluar la seguridad y eficacia a largo plazo de la terapia RLRL en niños, incluidos los de otros grupos étnicos y con un seguimiento mayor.
Los criterios más importantes a considerar para elegir el tratamiento de control de la miopía son:
• Miopía primaria.
• Longitud axial.
• Edad de aparición.
• Refracción.
¿Cuándo finalizar el tratamiento de control miopía? La miopía suele progresar hasta mediados de la adolescencia, aunque algunos pacientes continúan progresando hasta los 20 años. A menudo es mejor continuar con el control hasta principios de la edad adulta para cubrir los años de posible progresión.
Se puede considerar volver a usar lentes monofocales si la progresión es estable en los últimos dos años, o si el paciente tiene 18 años o más con progresión lenta o nula.
1. Bullimore MA, Brennan NA. Control de la miopía: por qué importa cada dioptría. Optometría y Ciencias de la Visión. 1 de junio de 2019;96(6):463-5.
2. Bullimore MA, Ritchey ER, Shah S, Leveziel N, Bourne RR, Flitcroft DI. Los riesgos y beneficios del control de la miopía. Oftalmología. 1 de noviembre de 2021; 128 (11): 1561-79.
3. Manejo y control de la miopía. Un niño a la vez. Langis Michaud, Remmy Marcotte,.©2022
4. Liu H, Yang Y, Guo J, Peng J, Zhao P. Daño retiniano tras exposición repetida a láser rojo de baja intensidad. JAMA Ophthalmology. 25 de mayo de 2023.
5. Jiang Y, Zhu Z, Tan X, Kong X, Zhong H, Zhang J, Xiong R, Yuan Y, Zeng J, Morgan IG, He M. Efecto de la terapia repetida con luz roja de baja intensidad para el control de la miopía en niños: un ensayo controlado aleatorizado multicéntrico. Oftalmología. 1 de mayo de 2022;129(5):509-19.

(Este artículo fue traducido, adaptado e impreso con autorización exclusiva del grupo de revistas de Review de Jobson Medical Information. Su reproducción está prohibida).
Por Liz Hunter, editora sénior
Las personas miopes también son más propensas a sufrir un desprendimiento vítreo posterior, y a una edad más temprana
La literatura científica ha demostrado la relación entre la miopía y las degeneraciones en la retina periférica, incluyendo la degeneración en rejilla, la degeneración en forma de caracol, los desgarros/agujeros retinianos, etc.1 Las personas miopes también son más propensas a sufrir un desprendimiento vítreo posterior, y a una edad más temprana.2 La cirugía refractiva con láser, como el LASIK, puede poner a esta población de pacientes en riesgo de sufrir cambios en el vítreo, la retina y la mácula, incluso en el LASIK con femtosegundo,1 y aunque la mayoría de los cirujanos refractivos coinciden en que un examen de retina con dilatación es una parte integral del cribado previo a la intervención, no existe una norma en cuanto al cribado y la profilaxis de las degeneraciones retinianas.
Aquí, los cirujanos refractivos comparten su experiencia personal y cómo abordarían estos casos.
Un examen oftalmológico completo es fundamental para evaluar a cualquier candidato a cirugía refractiva. Según el Dr. Kevin M. Miller, titular de la cátedra Kolokotrones de Oftalmología en el Instituto Oftalmológico Stein de UCLA, es crucial prestar especial atención a la refracción. “No se puede realizar una cirugía refractiva sin una refracción precisa y confiable; eso es, en realidad, lo más importante que hacemos”, señala el especialista.
La Dra. Amy Lin, profesora asociada del Moran Eye Center de la Universidad de Utah, explica que también realiza una evaluación exhaustiva que incluye examen con lámpara de hendidura, topografía corneal y análisis con Pentacam. “Si considero que el paciente es un posible candidato para cirugía refractiva, siempre programo una segunda visita de evaluación”, comenta. “En esa consulta repetimos la revisión de la agudeza visual, realizamos nuevamente la refracción, dilatamos los ojos, llevamos a cabo una refracción ciclopléjica y completamos un examen ocular detallado con dilatación”.
Aunque existen tecnologías avanzadas como la fotografía de fondo de ojo de campo ultra amplio y la tomografía de coherencia óptica (OCT), su uso no siempre es imprescindible en la evaluación de candidatos refractivos de rutina.
“En el examen de retina, utilizamos una lente indirecta de 20 dioptrías para evaluar cuidadosamente la periferia retiniana”, explica el Dr. Miller. “Si el paciente presenta una buena refracción, es decir, logra una agudeza visual de 20/20 o incluso 20/15 con gafas o lentes de contacto, y obtenemos una refracción confiable, no es necesario realizar una tomografía de coherencia óptica (OCT) macular para detectar alteraciones sutiles. Incluso si se detectara alguna anomalía, generalmente no modificaría nuestra decisión de proceder con la cirugía refractiva. Por eso, no tiene sentido realizar pruebas adicionales si es poco probable que cambien nuestro enfoque quirúrgico”.
El Dr. Miller señala que, durante la evaluación de la retina periférica, presta especial atención a la presencia de degeneración reticular, una alteración que, según comenta, es relativamente común. “Cuando identificamos este tipo de degeneración, no nos sorprende demasiado, ya que es algo que prácticamente anticipamos encontrar”, afirma.
“La mayoría de los pacientes que atendemos para cirugía refractiva son miopes, y aquellos con miopía moderada o alta presentan un mayor riesgo de desarrollar degeneración reticular en la retina, así como agujeros, desgarros o incluso desprendimientos retinianos”, explica la Dr. Lin.
La verdadera preocupación, señala el Dr. Miller, surge cuando se detectan desgarros o agujeros retinianos, ya que estos sí ameritan una derivación inmediata a un especialista en retina.
“En al menos una ocasión, detecté un desprendimiento de retina en un paciente completamente asintomático”, recuerda la Dr. Lin. “Lo descubrí durante su examen ocular con dilatación de pupila e inmediatamente lo envié a uno de mis colegas especialistas en retina para que lo tratara antes de proceder a la cirugía refractiva”.
“Además, incluso en ausencia de agujeros o desgarros, considero fundamental identificar la degeneración reticular antes

de realizar una cirugía refractiva”, añade la Dr. Lin. “Siempre informo al paciente que esta condición implica un mayor riesgo de desprendimiento de retina, independientemente de que se someta o no al procedimiento. De este modo, si llegara a presentarse un evento retiniano, como un desgarro o desprendimiento posterior a la cirugía, el paciente entiende que no está relacionado directamente con la intervención, ya que se trata de un riesgo preexistente del cual hablamos claramente desde el inicio”.
Existen otros hallazgos oculares benignos, como el nevus coroideo, que no representan una contraindicación para la cirugía refractiva, aclara la Dr. Lin. “Le informo al paciente que presenta una peca en la retina, pero que no tiene implicaciones clínicas relevantes”, explica. “Menciono este hallazgo para que, en caso de que otro oftalmólogo lo observe en un examen futuro con dilatación pupilar, el paciente pueda referir que ya había sido identificado y documentado previamente”.
El especialista en retina determinará si es necesario un tratamiento; la recomendación suele ser la fotocoagulación profiláctica con láser.3 Después del láser, suele haber un intervalo mínimo de siete días antes de realizar la cirugía refractiva.1
En el caso del paciente con desprendimiento de retina asintomático, el Dr. Lin decidió derivarlo a un especialista en retina y posponer la cirugía refractiva. “Permito que el especialista evalúe si la retina está lo suficientemente estable para proceder con el procedimiento”, explica. “Procuro que el paciente sea atendido por el retinólogo a la mayor brevedad posible y, mientras espera la cita, le recomiendo que nos contacte inmediatamente ante la aparición de síntomas como destellos, condensaciones vítreas o visión en cortina, para poder agilizar su derivación y garantizar una atención oportuna”.
Después de la cirugía refractiva, el Dr. Lin comenta que, en general, no suele realizar una nueva dilatación ocular ante quejas del paciente. “No obstante, si el paciente presenta destellos, visión de cortina o cualquier molestia debe acudir a la clínica lo antes posible”, explica. “En caso de sospecha de desgarro o desprendimiento de retina, se realizará la derivación inmediata a un especialista en retina”.
El desprendimiento vítreo posterior tras LASIK se ha documentado ya a los dos días postoperatorios en el 16% de los casos y hasta en el 85% en el plazo de un mes.4,5 Algunas publicaciones sugieren que el seguimiento a largo plazo puede estar justificado en pacientes miopes debido a su riesgo de complicaciones maculares con el paso del tiempo.1
Los doctores Lin y Miller declaran no tener conflictos de interés relevantes.
Bibliografía:
1. Venkatesh R, James E, Jayadev C. Cribado y profilaxis de las degeneraciones de la retina antes de la cirugía refractiva. Indian J Ophthalmol 2020;68:12:2895-2898.
2. Yonemoto J, Ideta H, Sasaki K, Tanaka S, Hirose A, Oka C. Edad de inicio del desprendimiento de vítreo posterior. Graefes, Arch, Clin, Exp, Ophthalmol, Albrecht Von Graefes, Arch, Klin, Exp, Ophthalmol, 1994; 232:67–70.
3. Wilkinson CP. Intervenciones para las roturas de retina asintomáticas y la degeneración reticular para prevenir el desprendimiento de retina. Sistema de la Base de Datos Cochrane Rev 2014; 5:2014:9:CD003170.
4. Wang TT, Wang Y, Zhao SZ. Comparación del desprendimiento de vítreo posterior después de la queratomileusis in situ con láser de femtosegundo y lase in situ asistida por microqueratomo. Zhonghua Yan Ke Za Zhi 2013;49:4:309-14.
5. Gavrilov JC, Gaujoux T, Sellam M, Laroche L, Borderie V. Ocurrencia de desprendimiento de vítreo posterior después de la queratomileusis in situ con láser de femtosegundo: evaluación ecográfica. J Cirugía de refractación de cataratas 2011;37:7:1300-4.
Edición n°4. Volumen 130 17
Este estudio comparativo analizó el dolor postoperatorio y los resultados refractivos de PRK y TransPRK en pacientes con córneas delgadas.
Autores: Dra. Alejandra Fernández Vidal, Dr. Ticiano Giobellina, Dr. Andrés Giobellina.
Clínica de Ojos Reyes- Giobellina, Córdoba, Argentina.
Introducción: Las ablaciones de superficie (PRK y TransPRK) se utilizan para tratar ametropías en pacientes con córneas delgadas. El dolor postoperatorio es uno de los principales efectos adversos de ambas técnicas.
Objetivo: Comparar el dolor postoperartorio entre las técnicas PRK y TransPRK en un mismo paciente, resultados refractivos, tiempo de recuperación de síntomas y complicaciones postoperatorias.
Material y métodos: Se realizó un estudio comparativo, prospectivo de una serie de casos donde se estudiaron 15 individuos (30 ojos) mayores de 21 años, sin antecedentes oftalmológicos ni sistémicos. Se les realizó en ojo derecho la técnica de PRK (15 ojos) y en ojo izquierdo la técnica de TransPRK (15 ojos) en el mismo paciente y se compararon ambas técnicas.
Resultados: No se obtuvieron diferencias entre ambos procedimientos, en cuanto agudeza visual postoperatoria. La mayor diferencia en cuanto al dolor se produjo durante el postoperatorio inmediato (>24 horas) siendo menor en la PRK. En el postoperatorio tardío (< 24 horas) no hubo diferencias significativas de dolor entre ambas técnicas.
Conclusión: Este estudio refleja que ambas técnicas quirúrgicas, PRK y TransPRK, realizadas en pacientes candidatos a cirugía refractiva han demostrado excelentes resultados tanto en estabilidad refractiva como tolerancia al dolor a largo plazo. La PRK ofrece mayor ventaja al paciente en cuanto a menor dolor en el postoperatorio inmediato.
Introducción
La queratectomía fotorrefractiva (PRK) fue descrita por primera vez en 1983 por Trokel y colaboradores en ojos de vacas1. Pero fue en el año 1987 cuando pudo realizarse de forma segura en humanos con una recuperación relativamente normal2 La queratectomía fotorrefractiva transepitelial (transPRK) se describió en los años 90 como alternativa a la PRK convencional3



Las ablaciones de superficie (PRK y transPRK) se mantienen vigentes como prácticas frecuentes del cirujano refractivo, ya que permiten tratar con seguridad córneas delgadas4 El dolor postoperatorio es una de las complicaciones postoperatorias más frecuentes al utilizar estas dos técnicas. Ya sea a causa de la desepitelización o del uso de lentes de contacto, los pacientes manifiestan grados variables de dolor5. Por esta razón, se decidió comparar el dolor y el resultado refractivo postoperatorio en pacientes intervenidos de PRK y trans PRK. Para ello se seleccionaron pacientes con miopías puras de hasta 3 dioptrías.
Se realizó un estudio comparativo, prospectivo de una serie de casos. Los pacientes incluidos no presentaban antecedentes oftalmológicos patológicos, edad entre 19 y 42 años, con miopías puras de hasta 3.00D, anisometropías menores a 1,75D y paquimetrías entre 480 y 500 micras. Estos pacientes fueron evaluados en el Servicio de Córnea y Cirugía Refractiva de la Clínica de Ojos Reyes-Giobellina de la provincia de Córdoba – Argentina, durante los meses de mayo de 2024 a octubre de 2024.
A todos los pacientes se les explicó el procedimiento que se les realizaría, la colaboración requerida y el tiempo estimado de tratamiento, así como también la medicación necesaria en el postoperatorio. Además, debieron firmar el consentimiento informado de manera obligatoria. Antes de realizar la cirugía, se controla que la consola láser esté previamente calibrada y programada. Parámetros como homogeneidad del spot, profundidad de pulso y alineamiento se testearon con los filtros y sensores apropiados. También el control del medio ambiente (humedad y frío) se controlaron con aparatos deshumidificadores y refrigerantes respectivamente.
Como medicación preoperatoria se utilizó clonazepam SL (Diazepam®) 0,5
mg, administrado unos 20 minutos antes del comienzo de la cirugía. Una vez que el paciente ingresó a la sala de cirugía, se lo recostó en la plataforma de láser excimer, se colocó el campo estéril previa asepsia con iodopovidona al 50 %, y se colocó el blefaróstato. Luego, se instiló una gota de proparacaína (Anestalcon®) 10 segundos antes de comenzar la cirugía.
En el ojo derecho se realizó la técnica de PRK. Para la remoción del epitelio, se utilizó un anillo marcador de la zona óptica de 8 mm, el cual se centró en el ápex corneal. Se colocó alcohol etílico diluido al 50 % durante 15 segundos. Luego, se debridó el epitelio corneal con una espátula roma. Posteriormente, se aplicó el láser Excímero Technolas Teneo 317 de Bausch & Lomb con el perfil de ablación fijado. Luego, se colocó mitomicina C al 0,02 %, durante 10 segundos por dioptría ablacionada, seguida por la instilación de una gota de antibiótico con esteroide tópico y, finalmente, se aplicó una lente de contacto terapéutica por 4 días.
En el ojo izquierdo se realizó la técnica de Trans PRK, donde el epitelio y el estroma se ablacionaron en un solo paso con el nomograma del Láser Excímer Technolas Teneo 317 de Bausch & Lomb. Este, basado en un perfil de ablación asférica, automáticamente considera el volumen de ablación del epitelio y toma en cuenta la diferencia de ablación entre el centro y la periferia dando diferentes energías de ablación al epitelio y estroma. Posteriormente, se colocó Mitomicina C al 0,02%, 10 segundos por dioptría ablacionada, seguido por instilación de 1 gota de antibiótico con esteroide tópico y finalmente se aplicó una lente de contacto terapéutica por 4 días. En ambos grupos la zona óptica fue de 6,5 mm. El tratamiento se centró en el ápex corneal. El tiempo quirúrgico fue registrado y se utilizó la escala de dolor para graduarlo desde 0 (ausencia de dolor) a 10 (dolor insoportable).
El seguimiento se realizó al primer día postoperatorio, tercero y finalmente a los quince días. La medicación utilizada fue 48 horas previas a la cirugía, dexametasona fosfato sódico inyectable, 24 horas previas comenzaron con moxifloxacina y dexametasona tópica cada 4 horas por 15 días más diclofenaco una gota cada 4 horas por 3 días. Si había mucho dolor se administraba un comprimido de ibuprofeno 600 mg cada 8 horas. Se retiró la lente de contacto al tercer día postoperatorio, continuando en tratamiento tópico.
De los 30 ojos evaluados, a 15 se les realizó PRK convencional y a los otros 15, Trans PRK. No se presentaron diferencias estadísticamente significativas en la AV postoperatoria entre ambos grupos (p= 0,19).
La escala de dolor promedio al 1º, 3º y 15º días, se observó que en el primer día tuvo gran significancia estadística (p= 0,02) donde hubo mayor dolor con la técnica Trans-PRK en relación con PRK convencional. No obstante, no se observaron diferencias significativas en el dolor en PRK y Trans-PRK entre 3º (p= 0,07) y 15º día (p=0,2) lo que indicaría que ambas técnicas tendrían efectos equivalentes sobre el dolor a largo plazo.
No se encontraron efectos adversos hasta el momento, tanto en PRK como en Trans-PRK, como haze, infecciones, regresión, astigmatismo irregular o retraso en la reepitelización.
Los resultados refractivos de ambas técnicas quirúrgicas fueron satisfactorios. No se obtuvieron diferencias entre ambos procedimientos, en cuanto a la AV postoperatoria, lo que evidencia la eficacia de ambas en el tratamiento de ametropías leves y moderadas.
En el caso de la PRK convencional, la ablación láser se realiza de forma directa y única en el estroma corneal, una vez que se ha retirado de forma química (alcohol al 50%) el epitelio corneal, lo que brinda una mayor seguridad en términos de exactitud del tejido estromal removido y su relación exacta con la cantidad de dioptrías a tratar, si lo comparamos con el procedimiento de la Trans-PRK, teniendo en cuenta que en este procedimiento se produce una doble ablación: primero, al epitelio corneal, y después, al estroma corneal. En la trans-PRK, el perfil de ablación se obtiene a partir de un valor de grosor epitelial de referencia, tomado como estándar para la población. El grosor del epitelio corneal de una córnea normal oscila entre 55 y 65 μm en los 4 mm centrales. En el actual estudio tomamos 55 μm de grosor, el valor de referencia para la realización de los tratamientos. Este hecho puede resultar controver-


sial, teniendo en cuenta que todos los pacientes no tienen el mismo grosor epitelial, por lo que en pacientes con epitelios delgados se puede ablacionar más estroma que el programado. Por otra parte, en pacientes con epitelios gruesos, la ablación con fines refractivos comenzaría con presencia de epitelio en la superficie y, por tanto, los pacientes podrían quedar ligeramente hipo o hipercorregidos.
Diferentes autores se han pronunciado respecto a las diferencias de grosor epitelial a lo largo de la superficie corneal. Reinstein, et al.6 obtienen que la ubicación del epitelio más delgado se encuentra algo desplazado temporalmente (0.33 mm) y hacia la córnea superior (0.90 mm), muestran un grosor epitelial medio de 53.4 ± 4.6 μm en el vértice corneal utilizando ecografía digital de muy alta frecuencia. Además, en su análisis de mapas de grosor epitelial obtuvieron mayor grosor del epitelio en la córnea inferior comparada con la córnea superior, y en la córnea nasal comparada con la temporal.
Kanellopoulos, et al.7 y Sin, et al.8 han seguido esta línea de investigación con el empleo de tomografía de coherencia óptica del segmento anterior de dominio espectral. El grosor epitelial obtenido en el centro pupilar fue de 53.28 ± 3.34 μm, en la córnea inferior, de 53.81 ± 3.44 μ m y en córnea
superior, de 51.86 ± 3.78 μm, por lo que concluyen que no se puede aseverar que el mapa de grosor del epitelio es rotacionalmente simétrico.
Diferentes publicaciones coinciden en la alta variabilidad interindividual del grosor epitelial central y mapas epiteliales tridimensionales9-4. Teniendo en cuenta los aspectos teóricos mencionados anteriormente, pudiera pensarse en el deterioro de los resultados refractivos en la trans-PRK si tomamos como estándar un valor de grosor epitelial único para la realización del procedimiento. Sin embargo, en la práctica, no se han logrado constatar resultados visuales insatisfactorios de esta técnica comparada con la PRK convencional.
Un factor determinante en los óptimos resultados refractivos de la trans-PRK es la presencia de un perfil de ablación libre de aberración esférica. Además, el sistema láser se ajusta para compensar la diferencia entre la tasa fotoablativa del estroma y del epitelio corneal (20% superior). El epitelio es removido con un perfil de corte de caras paralelas, es decir, se remueve en la misma proporción en toda la extensión en que se está retirando el epitelio hasta llegar a la zona de transición, donde paulatinamente deja de remover tejido. Por lo tanto, esta remoción no genera ningún efecto correctivo12-10
Desde la utilización de la trans-PRK, varios estudios mostraron los resultados preliminares. Luger, et al.9 realizaron un estudio donde en el mismo paciente se operaba un ojo con trans-PRK y el ojo contralateral con PRK convencional, con el láser Amaris (Schwind), en 33 pacientes con 1 año de seguimiento. No se obtuvieron diferencias significativas entre ambas técnicas en términos de agudeza visual sin corrección. Igualmente, con la plataforma Amaris, Fadlallah, et al.4 obtuvieron parámetros de agudeza visual similares en ambas técnicas quirúrgicas. Aslanides, et al.11 realizaron un estudio en 30 pacientes utilizando una técnica en cada ojo, y obtuvieron valores similares de agudeza visual en ambos procedimientos. Kaluzny, et al.12 realizaron un estudio en 148 pacientes donde utilizan una versión más moderna de transPRK (plataforma Amaris, versión 750 S, sexta generación), comparada con los estudios citados anteriormente. No obtuvo diferencias estadísticamente significativas entre el grupo de trans-PRK y el grupo PRK convencional en términos de AVSC, 3 meses después de la cirugía. Aslanides, et al.11 no reportaron diferencias significativas en la refracción final alcanzada en ambas técnicas quirúrgicas con equivalencia en seguridad. Ortueta, et al.13, en un estudio más actual, concluyeron que la trans-PRK tiene resultados refractivos similares a las técnicas intraestromales, con menor posibilidad de complicaciones.
Fadlallah, et al.4 exponen una tendencia a la sobrecorrección que pudiera estar explicada por la deshidratación corneal durante el procedimiento. Adib-Moghaddam, et al. 14-15 indican que la trans-PRK de un solo paso con modo libre de aberración mejora la agudeza visual y la refracción en los ojos miopes altos, así mismo se obtienen mejores resultados
de calidad de visión comparado con otras técnicas refractivas. La plataforma de un solo paso de trans-PRK utiliza un perfil poblacional de grosor corneal para calcular la cantidad de energía entregada a diferentes partes de la córnea, lo cual evita el suministro de cantidades desiguales de energía a la córnea central en comparación con la córnea periférica. Esta diferencia podría explicar una mejor calidad de los resultados de visión de trans-PRK en la miopía alta16-17
El tiempo de duración de la cirugía es otra de las variables ampliamente estudiadas, teniendo en cuenta su valor en la eficacia del tiempo de utilización del quirófano, la utilidad de los parámetros del láser y la comodidad del paciente durante el procedimiento. Constituye una ventaja de la trans-PRK la reducción del tiempo de cirugía. Kaluzny, et al.12 obtienen una reducción (35%) del tiempo quirúrgico en la trans-PRK comparado con PRK convencional. Luger, et al.9 plantean que la trans-PRK es más rápida de realizar.
Relacionado con la variable tiempo se encuentra el dolor postoperatorio. El tema del dolor postoperatorio en técnicas refractivas de superficie ha sido estudiado por diferentes
autores. Fadlallah, et al.4 y Aslanides, et al.11 informaron de una disminución del dolor postoperatorio después de la PRK transepitelial. Kanitkar, et al.18 obtuvieron menor dolor en la PRK convencional comparado con la PRK precedida de queratectomía fototerapéutica para eliminar el epitelio corneal. Luger, et al.9 refieren menor dolor postoperatorio en pacientes intervenidos por trans-PRK comparado con PRK convencional, además reportaron mayor confort del paciente durante la cirugía. Aslanides, et al.11, sin embargo, no obtienen diferencias significativas entre ambos grupos el primer día de postoperatorio, pero, reportan menor dolor en el grupo de trans-PRK al tercer día del procedimiento.
En nuestro estudio, la mayor diferencia en cuanto a dolor referido por el paciente se produjo en el postoperatorio inmediato donde obtuvimos mayor valor promedio de dolor en pacientes intervenidos con transPRK. En los días consecutivos no hubo diferencias significativas de dolor referido por el paciente, entre ambas técnicas de estudio. El dolor en los días sucesivos tiene mayor relación con el efecto fotoablativo, los mediadores inflamatorios, el proceso de reepitelización corneal, comunes a ambas técnicas quirúrgicas.


SPECTRALIS con technología SHIFT permite elegir entre tres velocidades de escaneo OCT para encontrar el equilibrio ideal entre calidad de imagen y rapidez del examen.

ANTERION combina biometría, topografía y OCT del segmento anterior en una plataforma integral diseñada para un análisis completo del segmento anterior.

Conclusión
Este estudio refleja que ambas técnicas quirúrgicas, PRK y TransPRK, realizadas en pacientes candidatos a cirugía refractiva han demostrado excelentes resultados tanto en estabilidad refractiva como tolerancia al dolor a largo plazo. La PRK convencional ofrece mayor ventaja al paciente en cuanto a menor dolor en el postoperatorio inmediato.
Oftalmo Córdoba 2025 se llevará a cabo los días 10 y 11 de octubre en el Hotel Quinto Centenario, en Córdoba, Argentina. Para más detalles, visite la página oficial: oftalmocordoba.com.ar.
1. Trokel SL, Srinivasan R, Braren B. Excimer laser surgery of the cornea. Am J Ophthalmol 1983; 96: 710-5.
2. Mc Donald MB et al. Central photorefractive keratectomy for myopia: partially sighted and normally sighted eyes. Ophthalmology 1991; 98: 1327-37.
3. Clinch TE, Moshirfar M, Weis JR, Ahn CS, Hutchinson CB, Jeffrey JH. Comparison of mechanical and transepithelial debridement during photorefractive keratectomy. Ophthalmology 1999; 106: 483-9.
4. Fadlallah A et al. Transepithelial photorefractive keratectomy: clinical results. J Cataract Refract Surg 2011; 37: 1852-7.
5. American Academy of Ophthalmology. Refractive errors and refractive surgery. San Francisco: American Academy of Ophthalmology, 2012 (Preferred practice pattern guidelines).
6. Reinstein DZ, Archer TJ, Gobbe M, Silverman RH, Coleman DJ. Epithelial thickness in the normal cornea:three-dimensional display with Artemis very high-frequency digital ultrasound. J Refract Surg. 2008;24:571-81.
7. Kanellopoulos AJ, Asimellis G. In vivo three-dimensional corneal epithelium imaging in normal eyes by anterior-segment optical coherence tomography:a clinical reference study. Cornea. 2013;32:1493-8.
8. Sin S, Simpson TL. The repeatability of corneal and corneal epithelial thickness measurements using optical coherence tomography. Optom Vis Sci. 2006;83:360-5.
9. Luger MH, Ewering T, Arba-Mosquera S. Consecutive myopia correction with transepithelial versus alcohol-assisted photorefractive keratectomy in contralateral eyes:one-year results. J Cataract Refract Surg. 2012;38:1414-23.
10. Arba Mosquera S, Awwad ST. Theoretical analyses of the refractive implications of transepithelial PRK ablations. Br J Ophthalmol. 2013;97:905-11.
11. Aslanides IM, Padroni S, Arba Mosquera S, Ioannides A, Mukherjee A. Comparison of single-step reverse transepithelial all-surface laser ablation (ASLA) to alcohol-assisted photorefractive keratectomy. Clin Ophthalmol. 2012;6:973-80.
12. Kaluzny BJ, Szkulmowski M, Bukowska DM, Wojtkowski M. Spectral OCT with speckle contrast reduction for evaluation of the healing process after PRK and transepithelial PRK. Biomed Opt Express. 2014;5:1089-98.
13. Ortueta D, von Rüden D. Transepithelial photorefractive keratectomy:Results and clinical experiences. Ophthalmologe. 2019;116(6):534-41.
14. Adib-Moghaddam S, Haydar AA, Razi-Khosroshahi M, Soleyman-Jahi S, Tefagh G, Grentzelos MA, et al. Predictors of visual acuity improvement and supernormal vision after refined single-step transepithelial photorefractive keratectomy. J Refract Surg. 2019;35(12):771-80.
15. Adib-Moghaddam S, Arba-Mosquera S, Walter-Fincke R, Soleyman-Jahi S, Adili-Aghdam F. Transepithelial photorefractive keratectomy for hyperopia:a 12-month bicentral study. J Refract Surg. 2016;32(3):172-80
16. Shetty N, Dadachanji Z, Narasimhan R, Kundu G, Khamar P, Ahuja P, et al. Status of residual refractive error, ocular aberrations, and accommodation after myopic LASIK, SMILE, and TransPRK. J Refract Surg. 2019;35(10):624-31.
17. Aslanides IM, Kymionis GD. Trans advanced surface laser ablation (TransPRK) outcomes using Smart Pulse Technology. Cont Lens Anterior Eye. 2017;40(1):42-6.
18. Kanitkar KD, Camp J, Humble H, Shen DJ, Wang MX. Pain after epithelial removal by ethanol-assisted mechanical versus transepithelial excimer laser debridement. J Refract Surg. 2000;16:519-22.
Edición n°4. Volumen 130
Autores: Dr. Arturo Ramírez Miranda, Dra. Angélica Hernández Solis, Dr. Gustavo Ortiz Morales, Dr. Guillermo Vera Duarte, Dr. Alejandro Navas, Dr. Enrique Graue Hernández
Departamento de Córnea y Cirugía Refractiva, Instituto de Oftalmología “Conde de Valenciana”, Ciudad de México.
La rosácea es una enfermedad inflamatoria crónica de la piel con etiología multifactorial. Se asocia con una desregulación tanto del sistema inmunitario innato como del sistema neurovascular, manifestándose como eritema persistente, telangiectasias, rubor, piel sensible y síntomas oculares.
La rosácea ocular se manifiesta como inflamación de los tejidos de la superficie ocular; se presenta con blefaritis, enrojecimiento ocular, sensación de cuerpo extraño, sequedad, fotofobia y conjuntivitis, conduciendo a complicaciones como neovascularización, queratitis, cicatrices corneales o perforación. A pesar de su prevalencia, su diagnóstico sigue siendo un reto clínico, lo que conduce a retrasos en el tratamiento y a complicaciones visuales graves. El objetivo de esta revisión es analizar los aspectos más relevantes de la enfermedad, su fisiopatología, manifestaciones clínicas, tratamiento y proyecciones futuras en el contexto del manejo de la rosácea ocular en adultos y población pediátrica.
A pesar de su alta prevalencia global del 5,5% (10-50% de los pacientes con rosácea cutánea), la rosácea ocular sigue siendo subdiagnosticada. Su aparición suele darse entre los 25 y 55 años de edad, con una distribución similar entre hombres y mujeres. Esta afección es más común en personas con piel clara (Fitzpatrick I-II). La enfermedad puede manifestarse incluso en ausencia de signos cutáneos evidentes, lo que complica su detección temprana.
Fisiopatología
La patogenia de la rosácea ocular implica una compleja interacción entre alteraciones inmunes innatas y adaptativas, disfunción neurovascular y desequilibrio del microbioma ocular. Se ha observado una activación excesiva de los receptores tipo Toll (TLR) y del complemento, lo que favorece la liberación de citocinas proinflamatorias (IL-1β, TNF-, MMPs) y quimiocinas que estimulan la migración y activación de células inflamatorias en la superficie ocular en conjunto con los linfocitos T, lo que establece un estado de inflamación crónica. El estrés oxidativo contribuye al daño celular, inflamación persistente y alteración vascular, favoreciendo vasodilatación, permeabilidad aumentada y síntomas neurosensoriales (fotofobia e irritación), en conjunto con disbiosis en la microbiota ocular, proliferación de Demodex folliculorum y presencia de Bacillus oleronius, lo cual activa respuestas inmunitarias exacerbadas que perpetúan la inflamación ocular.


La genética influye significativamente mediante polimorfismos en genes inmunológicos y del sistema HLA asociados a un mayor riesgo, presentes en hasta el 50% de los casos. Estas variantes pueden modificar la respuesta inflamatoria, función vascular y gravedad clínica, requiriendo enfoques terapéuticos más personalizados.
La rosácea ocular se relaciona con una mayor expresión del factor de crecimiento endotelial vascular (VEGF) y sus receptores, favoreciendo la neovascularización corneal e hiperreactividad vascular, proceso intensificado por citocinas (IL-1 y TNF-), que promueven la extravasación leucocitaria e infiltración inflamatoria. Asimismo, péptidos como la koebnerisina, regulados por células TH1 y TH17, inducen la producción de MMP-9, VEGF e interleucinas proinflamatorias (IL-6, IL-8 y TNF-), manteniendo un ciclo inflamatorio crónico. La sobreexpresión y procesamiento anómalo de catelicidinas, también potencia los mecanismos inflamatorios y angiogénicos característicos de la enfermedad.
La rosácea ocular (subtipo IV) presenta una gama variada de signos y síntomas, y su diagnóstico se basa principalmente en la evaluación clínica. De acuerdo con el Comité Nacional de Expertos en Rosácea se presenta con al menos uno de los siguientes hallazgos: enrojecimiento ocular, aspecto acuoso o inyectado en sangre, sensación de cuerpo extraño, ardor, escozor, sequedad, picazón, fotofobia, visión borrosa, telangiectasias en la conjuntiva o en el borde palpebral, y eritema palpebral o periocular. Además, son frecuentes la blefaritis, conjuntivitis, bordes palpebrales irregulares, chalaziones y orzuelos recurrentes. En muchos casos, los síntomas oculares pueden presentarse de forma aislada, lo que complica su detección temprana. Es frecuente que la gravedad de los síntomas oculares no se relacione directamente con las manifestaciones cutáneas.
Las alteraciones en las glándulas de Meibomio son comunes y conducen a una película lagrimal inestable, favoreciendo el ojo seco. En formas avanzadas, puede haber afectación corneal con infiltrados, neovascularización, cicatrización e incluso perforación. La presentación clínica en un 53% predominan las manifestaciones cutáneas, 27% coexisten síntomas cutáneos y oculares, y 20% la afectación ocular es el único indicio clínico. Dado que no existen criterios diagnósticos universales, una historia clínica detallada y un examen oftalmológico minucioso son esenciales para establecer el diagnóstico y evitar complicaciones severas ya que, sin un correcto diagnóstico, la rosácea ocular puede no responder adecuadamente al tratamiento tópico.
El diagnóstico diferencial incluye ojo seco, blefaritis bacteriana, conjuntivitis alérgica, queratitis herpética, lupus y síndrome de Sjögren, epiescleritis, alergias, infecciones crónicas, entre otros. La rosácea ocular debe considerarse en casos de enrojecimiento ocular crónico y cuadros recurrentes de
blefaritis-conjuntivitis, particularmente en adultos mayores. El consenso internacional ROSCO (2019) recomienda un enfoque diagnóstico integral basado en el fenotipo clínico, que incluye la evaluación con lámpara de hendidura, el examen de párpados y glándulas de Meibomio, la película lagrimal y la córnea. Este método resulta especialmente valioso en pacientes con piel oscura, donde los signos cutáneos pueden ser menos evidentes. Además, se proponen criterios para evaluar la gravedad de las manifestaciones oculares, como la presencia de telangiectasias, DGM e inflamación ocular. Herramientas como el “Rastreador de Rosácea” facilitan el seguimiento clínico y la personalización del tratamiento. En casos complejos o refractarios, es esencial una evaluación conjunta entre dermatólogos y oftalmólogos para lograr una identificación precisa y establecer un plan terapéutico adecuado.
La rosácea ocular requiere un enfoque terapéutico por etapas, determinado por la gravedad de la enfermedad y la respuesta clínica. El manejo se estructura en torno a cuatro pilares: higiene palpebral y medidas de estilo de vida, tratamiento tópico, terapia sistémica y manejo de complicaciones.
• Casos leves: se recomiendan medidas de higiene palpebral con productos no irritantes, compresas tibias, uso de gafas con filtro UV, evitar factores desencadenantes (exposición solar, climas extremos, alimentos picantes o consumo de alcohol) y protección cutánea. El uso de lágrimas artificiales y suplementos orales de ácidos grasos omega-3 ha demostrado mejorar la estabilidad de la película lagrimal y reducir la inflamación.
• Casos moderados: además de las medidas anteriores, se emplean lubricantes sin conservantes y fármacos tópicos antiinflamatorios. La azitromicina, ciclosporina y tacrolimus tópicos han demostrado ser eficaces y seguros a largo plazo, así como, lifitegrast, en casos con DGM. Los corticosteroides deben reservarse para inflamaciones severas y transitorias, debido a sus efectos adversos.
• Casos graves: se requiere tratamiento sistémico, siendo la doxiciclina la primera elección, con esquemas ajustables según la tolerancia del paciente. La minociclina, azitromicina son alternativas válidas, al igual que la eritromicina y metronidazol en pacientes pediátricos. En casos refractarios, puede considerarse la inmunosupresión con ciclosporina oral. Agentes tópicos como el metronidazol o la ivermectina, pueden complementar el tratamiento.
Como estrategias complementarias, se incluyen la luz pulsada intensa (IPL), pulsación térmica palpebral y tratamientos antiangiogénicos. En casos de cicatrización corneal que compromete el eje visual, la queratoplastia lamelar anterior profunda es preferible a la penetrante por su menor tasa de complicaciones. Lentes esclerales y cirugías reparadoras también son consideradas en casos avanzados con perforación o daño estructural corneal.
Entre las principales complicaciones se incluyen: queratitis, cicatrices corneales, neovascularización y úlceras corneales recurrentes. Si estas lesiones no se controlan adecuadamente, existe riesgo de perforación corneal, lo que puede requerir trasplante. Además, el uso prolongado de corticosteroides puede inducir hipertensión ocular, glaucoma y formación de cataratas.


El pronóstico de la rosácea ocular varía según el momento del diagnóstico, el control de la inflamación y la adherencia al tratamiento. Aunque es una enfermedad crónica y recidivante, muchos pacientes alcanzan estabilidad clínica y conservan buena agudeza visual con un manejo adecuado. El uso prolongado de corticosteroides, aunque útil en fases activas, puede generar efectos adversos como hipertensión ocular, glaucoma y cataratas, lo que exige un seguimiento oftalmológico estrecho. Con un enfoque terapéutico individualizado, el pronóstico visual a largo plazo suele ser favorable. Fig.1 Manifestaciones clínicas de rosácea ocular. 1, 2) Hiperemia conjuntival difusa e inyección ciliar localizada. 3) Telangiectasias con obstrucción de las glándulas de Meibomio y meibum engrosado.

El índice Tomográfico Biomecánico, o TBI, proporciona una combinación única de los datos obtenidos con el Corvis® ST y el Pentacam ®. Esto permite evaluar el riesgo de ectasia corneal con una fiabilidad nunca vista. El TBI le ayuda a seleccionar un tratamiento óptimo basándose en fundamentos sólidos.
¡Más segur idad para usted y sus pacientes!
www.oculus.de
1

La rosácea ocular pediátrica se caracteriza por inflamación crónica y recurrente de la superficie ocular en niños y adolescentes, con alto riesgo de compromiso visual si no se diagnostica y trata oportunamente. Se manifiesta con blefaritis persistente, DGM, conjuntivitis y afectación corneal progresivo. Se estima que hasta el 81% de los ojos afectados pueden desarrollar alteraciones irreversibles como leucomas, astigmatismo irregular, aberraciones de orden superior, degradación estromal y perforación corneal, resultando en ceguera o ambliopía.
Epidemiología: Representa el 12-15% de las consultas oftalmológicas pediátricas. La mayoría de los casos se diagnostican entre los 3 y 9 años, con una edad media de 1 a 14 años. Afecta a ambos sexos, con ligero predominio femenino en algunos estudios. Factores de riesgo incluyen mala higiene, dermatitis seborreica, antecedentes de atopia, infestación por Demodex y colonización del meibum por Cutibacterium acnes.
Diagnóstico: El Grupo de Estudio de PBKC establece el diagnóstico cuando se presenta al menos uno de los síntomas sugestivos (fotofobia, ojo rojo, chalazión recurrente, visión borrosa, lagrimeo, sensación de cuerpo extraño, irritación ocular, ardor y molestias crónicas) acompañado de al menos un signo en el borde palpebral (meibomitis, inflamación, chalazión, DGM, eritema y orzuelo), conjuntiva (hiperemia, flicténulas y conjuntivitis) y córnea (queratitis punteada superficial, infiltrados, flicténulas, vascularización, adelgazamiento, cicatrización, pannus y úlcera). Las manifestaciones cutáneas como rubor facial, eritema facial, pústulas, pápulas o telangiectasias pueden estar presentes.
La enfermedad suele presentarse de manera bilateral, en caso de asimetría marcada, un ojo muestra afectación corneal importante y el otro solo signos leves en el borde palpebral. Las alteraciones más comunes del margen palpebral son los collaretes, caspa, meibomitis, costras, chalaziones y DGM. La hiperemia conjuntival es uno de los signos más frecuentes, y la queratitis punteada representa la primera manifestación corneal detectable, con capacidad de progresar a cicatrices y disminución de la agudeza visual.
Diagnóstico diferencial: Incluye queratoconjuntivitis flictenular (PKC), conjuntivitis alérgica, queratoconjuntivitis adenoviral, queratitis herpética y queratitis punteada superficial de Thygeson. La PKC es una respuesta de hipersensibilidad tipo IV a proteínas putativas y antígenos bacterianos, sus lesiones suelen localizarse en la conjuntiva limbar sin afectar significativamente la córnea periférica. En cambio, la PBKC produce flicténulas en córnea paracentral o central, con vas-
cularización y deterioro visual notable. La queratitis herpética, típicamente unilateral, provoca infiltración del estroma corneal, cicatrización y vascularización y no se acompaña de inflamación palpebral, chalaziones ni meibomitis, lo que ayuda a diferenciarla.
Manejo terapéutico: El tratamiento se basa en un enfoque escalonado, iniciando con higiene palpebral diaria con compresas tibias y expresión de glándulas de Meibomio, se recomienda el uso de lubricantes oculares para controlar el ojo seco y reducir la inflamación. En casos persistentes, se indican antibióticos tópicos o sistémicos, siendo los macrólidos los más utilizados por su doble acción antiinflamatoria y antimicrobiana. Los corticosteroides tópicos se emplean en fases agudas para controlar la inflamación y prevenir neovascularización y cicatrización. En pacientes refractarios o con formas graves, los inmunomoduladores y esteroides ahorradores tópicos pueden ser beneficiosos.
Bibliografía:
La rosácea ocular representa un reto diagnóstico y terapéutico debido a su naturaleza crónica, multifactorial y frecuentemente subdiagnosticada. El reconocimiento temprano, incluso en ausencia de signos cutáneos evidentes, resulta fundamental para prevenir complicaciones graves como queratitis, cicatrices corneales y pérdida visual irreversible. La implementación de estrategias de manejo escalonado, adaptadas al fenotipo clínico y la severidad de la enfermedad, optimiza el control de los síntomas y mejora el pronóstico visual. En la población pediátrica, la detección y tratamiento oportunos de la blefaroqueratoconjuntivitis son determinantes para preservar la función visual en etapas críticas del desarrollo. Finalmente, el abordaje integral, continuo y multidisciplinario constituye la base para un manejo exitoso de esta enfermedad inflamatoria ocular crónica.
1. Mohamed-Noriega K, Loya-Garcia D, Vera-Duarte GR, Morales-Wong F, Ortiz-Morales G, Navas A, et al. Ocular Rosacea: An Updated Review. Cornea. 2025 Apr 1;44(4):525–37.


El ojo seco es una condición multifactorial de creciente prevalencia que afecta significativamente la calidad de vida de los pacientes. En el reciente simposio organizado por Lumibird Medical, el Dr. Rolando Toyos y Dr. Juan Carlos Serna compartieron sus experiencias clínicas y hallazgos científicos sobre nuevas tecnologías diagnósticas como C.DIAG y terapias innovadoras como la luz pulsada intensa (IPL) C.STIM. Esta revisión resume los principales conceptos expuestos, centrados en un enfoque personalizado y basado en evidencia.
El síndrome de ojo seco ha dejado de ser considerado una simple deficiencia lagrimal para ser entendido como una enfermedad compleja, inflamatoria, y en la mayoría de los casos, asociada a disfunción de las glándulas de Meibomio. “El 90% de los pacientes que llegan a nuestra clínica tienen ojo seco evaporativo por disfunción meibomiana” comenta el Dr. Toyos.
Durante el simposio, se presentaron herramientas clínicas que permiten diagnosticar con precisión y tratar de forma temprana a estos pacientes, cambiando el paradigma del manejo convencional.
Una de las tecnologías centrales presentadas fue el C.DIAG, una plataforma de diagnóstico integral que permite analizar el parpadeo, la calidad de la lágrima, el menisco lagrimal y la estructura de las glándulas. “Si no tienes herramientas diagnósticas, no puedes entender en qué etapa está el paciente. Y si no sabes esto, probablemente estás repitiendo gotas y tratamientos que no funcionan”, comenta el Dr. Serna. “El gran problema es que muchas veces vemos a los pacientes en etapas finales, con atrofia o cambios epiteliales, cuando ya el daño está hecho”.
El Dr. Serna compartió su experiencia como usuario del C.DIAG: “Yo ya lo estaba usando de forma subjetiva, guiándome por los síntomas. Ahora sé que puedo tener una imagen objetiva que respalda mi diagnóstico y que ayude a educar al paciente”.
Para el Dr. Toyos, el abordaje debe comenzar fuera del ojo. “Esto no es una enfermedad del ojo, es una enfermedad de piel y glándulas. Si entiendes eso, cambias por completo la forma de tratar”. Esta afirmación se basa en la observación de que muchas patologías dermatológicas —como rosácea o acné— presentan alta correlación con disfunción meibomiana.
Esta perspectiva implica que el abordaje terapéutico debe empezar con una evaluación dermatológica periorbital. “Lo primero que observo no es el ojo, sino la piel y los párpados” comenta el Dr. Toyos. “Las telangiectasias, la blefaritis, la pérdida de pestañas, dan información crítica sobre la calidad lagrimal”.
Este enfoque fue respaldado por el Dr. Serna, quien enfatizó que “tratar el ojo seco desde la base implica educar al paciente, modificar factores de riesgo, atender su piel, y dejar de rotarlo por cinco tipos de lágrimas artificiales antes de escalar el tratamiento”.
Una de las principales herramientas diagnósticas presentadas fue el C.DIAG, una plataforma que combina interferometría, meibografía, análisis del parpadeo y video de párpado. “Necesitamos diagnósticos rápidos y delegables, que nos den en cinco minutos la información suficiente para explicar el problema al paciente” comenta el Dr. Toyos.
La utilidad del C.DIAG fue demostrada al correlacionar parámetros como:
• Ruptura de la película lagrimal
• Calidad y cantida menisco lagrimal
• Alteraciones estructurales en glándulas de Meibomio
• Patrones de parpadeo anómalos asociados al uso excesivo de pantallas
El Dr. Toyos enfatizó la importancia del diagnóstico visual: “Con una imagen infrarroja puedo mostrar al paciente sus glándulas atrofiadas. Ellos no tienen que imaginarlo; lo ven”.

La IPL(Intense Pulsed Light) surgió del ámbito dermatológico, pero su impacto en la oftalmología ha sido transformador. El Dr. Toyos relató su experiencia: “Cuando empecé a usar IPL para rosácea, noté que los pacientes mejoraban del ojo seco. Me tomó seis años crear un protocolo para usarla en la superficie ocular”.
Hoy, la IPL se considera una herramienta validada para el tratamiento del ojo seco evaporativo. El Dr. Serna, promotor de esta tecnología, afirmó: “Soy el doctor Ojo Seco en redes so-
ciales porque esta terapia cambió mi práctica. La uso todos los días y me ha permitido ayudar a pacientes que ya no respondían a tratamientos convencionales”.
La IPL tiene múltiples indicaciones: disfunción de glándulas de Meibomio, rosácea ocular, chalazión recurrente, usuarios de lentes de contacto, pacientes con glaucoma en tratamiento crónico, y cirugía refractiva o de catarata. “¿A cuántos no nos ha llegado un paciente con catarata operada que se queja de ojo seco?” pregunta el Dr. Serna. “Probablemente no se trató antes de la cirugía, y ahí está el problema”.



El protocolo sugerido consta de tres sesiones cada 15 días. “En algunos casos se puede agregar una cuarta sesión según la respuesta clínica”, explicó el Dr. Serna, y añadió que “en pacientes mayores o con daño glandular avanzado, el tratamiento puede requerir ciclos de mantenimiento cada 3 meses”.


La personalización del tratamiento es clave. “Una persona de 20 años puede mejorar con dos sesiones.” Comenta el Dr. Toyos. “Una persona de 80 años, probablemente requiera cinco o seis”.
“Yo reviso al paciente al mes de terminar el tratamiento. Si hay síntomas residuales, puedo indicar una cuarta sesión. Y si el paciente es mayor o con enfermedad severa, probablemente necesitará ciclos cada tres meses” comenta el Dr. Serna. Además, enfatizó la importancia de la expresión glandular posterior al tratamiento: “La IPL es poderosa, pero si no haces expresión de glándulas después, estás dejando trabajo sin completar”.
Una de las principales preocupaciones comunes es la seguridad. “Llevo más de dos años usando esta tecnología y nunca he tenido una quemadura o complicación. Gracias a su tren de pulsos, es segura, eficiente y altamente delegable” confirma el Dr. Serna.

Además, su uso en adolescentes fue discutido. “Veo muchos jóvenes con ojo seco por uso excesivo de pantallas o por tratamientos dermatológicos” comenta el Dr. Serna. “En pacientes jóvenes, basta con una sola pasada de IPL y responde bien. No hay razón para esperar a que el daño sea irreversible”.
El dolor neuropático fue abordado como una complicación frecuente en pacientes con ojo seco crónico. Para estos casos, la IPL y el plasma rico en plaquetas (PRP) se han convertido en opciones efectivas.
“Cuando el paciente tiene la superficie ocular regenerada, pero sigue con dolor, hay que pensar en los nervios” dice el Dr. Toyos. “El PRP aporta factores de crecimiento que son muy útiles en estos casos”.
El Dr. Serna complementó: “También podemos utilizar naltrexona en dosis bajas o valorar tratamientos como gabapentina. Es importante identificar si el dolor es periférico o central antes de decidir el protocolo”.
integral y educación del paciente
Uno de los mensajes clave del Dr. Serna fue la necesidad de cambiar la mentalidad: “Tenemos que dejar de pensar que el ojo seco se trata con gotas y ya. Hay que entender la enfermedad, conectar con el paciente, usar la tecnología a nuestro favor y generar tratamientos que realmente vayan a la causa”.
También hizo énfasis en el seguimiento continuo: “Muchos pacientes se sienten abandonados cuando el médico los cita cada dos meses. Yo prefiero verlos al mes, mostrarles avances y mantenerlos motivados”.
La evidencia y experiencia compartida en el simposio reafirman que el tratamiento del ojo seco debe migrar de una visión reduccionista a un abordaje integral, personalizado y tecnológicamente respaldado. El Dr. Serna resumió el enfoque moderno de forma contundente: “El futuro del tratamiento del ojo seco está en actuar temprano, con evidencia y con empatía. No tratamos lágrimas, tratamos pacientes”.
La luz pulsada intensa C.STIM se consolida como una herramienta terapéutica segura y eficaz, con impacto demostrado en parámetros objetivos y subjetivos de la enfermedad. Su combinación con diagnóstico C.DIAG de alta precisión y terapias regenerativas como el PRP representan el futuro del manejo del ojo seco.
Como bien concluyó el Dr. Toyos, “la enfermedad del ojo seco no se trata con gotas, se trata con ciencia, tecnología y humanidad”.

TOWARDPI
/p. 19
Mexico
Eyeco
Eduardo Reyes Maldonado (55) 5545 5254
e.reyes@eyeco.com.mx eyeco.com.mx
HEIDELBERG ENGINEERING
/p. 21
MEX
ARFAMEX
Tel.: +52 55 5135 6646 • 6648 E-mail: sales@arfamex.com
QUANTEL MEDICAL INC.
/p. 29
USA
Tel.: (1) 888 660 6726 / (1) 888 660 6726
Fax: (1) 406 522 2005 / (1) 406 522 2005 contact@quantel-medical.fr www.quantel-medical.com
OCULUS, INC.
/p. 275
Mexico
Cyan Medica SA de CV customer.service@cyanmedica.com +52(55) 8250-7750
Colombia, Guatelmala, Nicaragua, Belize, Honduras, El Salvador, Panama, Dominican Republic ANDREC Corporation sandrap@andrec.com.co 0057-1-212 1911
Costa Rica
Medical Vision anpo31@gmail.com +50640001691
Jamaica, Haiti, The Bahamas Optimetrics, Inc. sales@optimetrics.com (305) 863-4144
Venezuela
ACM Venezuela, C.A. info@acm-venezuela.com +58 (212) 977-3020
Ecuador Oftalmoandrec camilor@andrec.com.co 593-22443229
Peru
Medinet SAC medinet@medinetperu.com 0051 1475 0328
Bolivia
IMPROSUR Ltda gerencia@improsur.net 00591-2-2795688
Chile
Ivens Oftalmología SpA cesar@ivensoftalmo.cl 0056-2-23608000
Argentina
Omni S.R.L. info@omnisrl.com.ar 0054-11-4866 4441
Uruguay
Spectrum Uruguay spectrum@spectrum.com.uy (+598) 2600 0980
Brazil
OCULUS Brasil Ltda. info@oculus.com.br +55-11-2533-2533

