Biologisk og medisinsk psykologi
Anne Marita Milde, Janne Grønli og Magne Arve Flaten (red.)Anne Marita Milde, Janne Grønli og Magne Arve Flaten (red.)

Anne Marita Milde, Janne Grønli og Magne Arve Flaten (red.)
© H. Aschehoug & Co. (W. Nygaard) AS ved Universitetsforlaget 2024
ISBN 978-82-15-03591-8
Materialet i denne publikasjonen er omfattet av åndsverklovens bestemmelser. Uten særskilt avtale med rettighetshaverne er enhver eksemplarfremstilling og tilgjengeliggjøring bare tillatt i den utstrekning det er hjemlet i lov eller tillatt gjennom avtale med Kopinor, interesseorgan for rettighetshavere til åndsverk. Utnyttelse i strid med lov eller avtale kan medføre erstatningsansvar og inndragning og kan straffes med bøter eller fengsel.
Henvendelser om denne utgivelsen kan rettes til:
Universitetsforlaget
Postboks 508 Sentrum 0105 Oslo
Boken er utgitt med støtte fra Kunnskapsdepartementet ved Lærebokutvalget for høyere utdanning.
Figurene i denne boken er i hovedsak laget av professor
Per A. Brodal (Sentralnervesystemet, 5. utg. 2012), Magnolia design as og Alf Inge Hellevik – www.hellevikstudio.no. Kilden står oppgitt under hver figur.
www.universitetsforlaget.no
Omslag: Cecilie Mohr
Sats: ottaBOK
Trykk: Aksell AS
Innbinding: Bokbinderiet Johnsen
Boken er satt med: Minion Pro 10,5/14 pkt
Papir: 100 g Arctic Silk
Robert Murison, professor emeritus, Universitetet i Bergen og
J. Bruce Overmier, professor emeritus, University of Minneapolis
Spørsmålet om forholdet mellom sinn og kropp er blitt diskutert så langt tilbake som de greske filosofene (f.eks. Aristoteles), men i det syttende århundre ble de skarpt spaltet av kartesisk dualisme. Dette førte til utviklingen i løpet av de neste tre århundrene av de to forskjellige og relativt uavhengige feltene medisin og psykologi. Det var først i det tjuende århundre at en prosess med reparasjon av dette bruddet begynte. Denne prosessen var nødvendig, fordi vi nå er fullstendig klar over at mentale funksjoner og kroppsfunksjoner ikke er virkelig separerbare, noe som skaper et behov for å introdusere studenter til et mer moderne felt innen biologisk og medisinsk psykologi. Dette tok Holger Ursin og Odd Harald Zahl-Begnum opp i deres norske lærebok Biologisk psykologi (1984, 1993). Holger Ursin var en pioner innen biologisk psykologi og ble professor i dette feltet ved Universitetet i Bergen, selv om han hadde sin bakgrunn fra medisin. Det skal bemerkes at Bergen allerede hadde en lang historie innen nevrovitenskap og fysiologi, som går tilbake til Fridtjof Nansens arbeid i 1880-årene. Ursin var med på å etablere profesjonsutdanningen i psykologi i Bergen og hadde bred nasjonal og internasjonal innflytelse. Han var kjent som en engasjerende underviser, foredragsholder, veileder og mentor. Men både psykologi og medisin og dets samspill har utviklet seg sterkt de senere årene.
Redaktørene av denne boken har tatt på seg en formidabel oppgave med å samle et norskspråklig bind som kan brukes som samtidsinnledning og kursmateriale i biologisk og medisinsk psykologi, med kapittel skrevet av eksperter på sine felt. I likhet med det opprinnelige Ursin og Zahl-Begnum-bindet, er dette nye verket ment å være av interesse for en bred leserkrets, samt være kurslitteratur for studieretninger innen medisin, biologi, psykologi og sykepleie.
Dette bindet er ikke en oppdatering av Ursin og Zahl-Begnum-boken, men er i stedet en unik samling kapittel med state-of-the-art-beretninger av norske forskere innen biologisk og medisinsk psykologi. Når den brukes som tekst, er boken ment som kursmateriell for studenter på bachelor- og masternivå i psykologi og andre relaterte helsefag spesielt for studenter på profesjonsstudiene. Behovet for en slik bok er blitt tydeligere i løpet av de siste årene, og dette bindet har en struktur og et innhold for å møte en etterspørsel. Innholdet spenner fra hjernens anatomi og fysiologi til smerte, søvn og mage-tarmsystemet til spørsmål om følelser, avhengighet og helseadferd. Noen av temaene som ble dekket, var lite kjent, i hvert fall for psykologer, på tidspunktet for Ursin og Zahl-Begnums bok, for eksempel epigenetikk. Redaktørene skal gratuleres med å rekruttere slike fremstående forskere og undervisere som forfattere.
Redaktørene har sin bakgrunn fra Bergen og har utvilsomt vært påvirket, enten direkte eller indirekte, av Ursins lange og fremragende karriere. Imidlertid ville det være galt å ignorere innflytelsen fra andre enn Ursin i å bygge opp feltet biologisk og medisinsk psykologi i Bergen og Norge. Spesielt var Reidun Ursin sentral i etableringen av søvnforskning og var hovedmentor for en av dagens redaktører – Janne Grønli. Andre sentrale personer i Bergen var Håkan Sundberg, Bolek Srebro, Kjell Hole og Finn Jellestad. Internasjonale nettverk og enkeltpersoner har også vært avgjørende for utviklingen av biologisk og medisinsk psykologi i videste forstand i Bergen. Disse har inkludert Robert og Caroline Blanchard, Seymour («Gig») Levine, Jonathan Wisor, Dirk Hellhammer og Bruce Overmier, for å nevne noen. Selv om det ikke er direkte omtalt i denne boken, har psykofysiologi og bildediagnostikk en sentral rolle i Bergen, representert ved arbeidene til Arne Øhman
og senere Kenneth Hugdahl. Til tross for utviklingen av hjerneavbildning er den essensielle betydningen av basale og kliniske aspekt ved biologisk psykologi sentrale komponenter i utdanning og opplæring. Biologisk og medisinsk psykologi er av natur tverrfaglig og er avhengig av samarbeid med andre institutter, fakulteter og institusjoner. Dette fagfeltet går nå over tradisjonelle universitets- og organisasjonsgrenser og overlapper med biomedisinsk vitenskap så vel som samfunnsvitenskap. En slik tverrfaglig tilnærming gjenspeiles i innholdet i boken.
Vi gratulerer Anne Marita Milde, Janne Grønli og Magne Arve Flaten med å samle fagtema i et slikt verk. Vi forventer at studenter, undervisere og forskere vil dra nytte av det store spekteret av emner som presenteres, og vil kunne følge opp sine spesielle interesser ved hjelp av de omfattende bibliografiene. Studentene vil med sikkerhet få utbytte av boken, de vil kunne bli bedre klinikere og utøvere av sitt fag gjennom introduksjon til den rikdom av biologisk og medisinsk psykologi som er inkludert her.
Anne Marita Milde, Janne Grønli og Magne Arve Flaten
Dette er en fagbok for studenter og faglærere i temaet biologisk og medisinsk psykologi. Formålet er å binde sammen store fagområder hvor en vitenskapelig bakgrunn er fremhevet, men hvor også et klinisk fokus er ivaretatt.
Som undervisere over mange år i biologisk og medisinsk psykologi kjenner vi på gleden når studentene blir engasjerte, nysgjerrige og vil vite enda mer. Som forskere er vi inne i en kjempespennende tid. Tilgang til moderne teknologi og utstyr gjør at det blir publisert ny kunnskap hver dag. Men det ligger år med arbeid bak de fleste oppdagelsene, så vitenskap handler om utholdenhet og det å stille spørsmål. Filosofer og vitenskapsmenn har til alle tider stilt viktige spørsmål, og teoriene gjenspeiler som oftest nåtid. La oss ta søvn som et eksempel. I mange århundrer var søvn sett på som en passiv tilstand av ubevissthet. På 1600-tallet, da blodomløpet først ble vist, ja da var søvn beskrevet som en periode med mindre blodtilførsel til hjernen. Da kunnskap om individuelle nevroner i hjernen ble lansert, kom teorien om at søvn var den perioden hvor forgreiningene mellom nervecellene trakk seg vekk fra hverandre. I århundrer tok vi feil. Det å ikke ha kunnskap om den faktisk aktive delen av livet som skjer under søvn, kan være én årsak til at søvnvansker er et undervurdert folkehelseproblem (kapittel 9).
Det å undersøke og prøve å forstå fagfeltet ‘biologisk psykologi’ er ett av de mest fascinerende – og det mest kompliserte i verden. Vi tør å si det, selv om det er liten tvil om at mange andre tenker det samme om sine egne fagfelt. Det som kjennetegner biologisk psykologi, er tilegnelsen av kunnskap om «det store bildet». Man må stille spørsmål om biologi, kjemi, fysikk, genetikk,
evolusjon, fysiologi, hjernemekanismer, hormoner, immunforsvar, adferd, tanker, følelser, sosiale interaksjoner og kultur – for å nevne noe. Ikke minst, det er enda ikke én teknologi eller metode som gir ett rett svar på et slikt stort bilde av menneskets mentale helse. Det å kunne forklare og formidle oppdagelser innen biologisk psykologi er ikke alltid like enkelt. Her prøver vi å hjelpe leseren med å forstå faget gjennom å kombinere kunnskap om fysiologi og utviklingsmekanismer, om adferd og erfaringer, tanker og emosjoner (kapittel 11). Kunnskapen forteller mye om oss mennesker og den verden vi lever i. Selve termen «biologisk psykologi» forteller at boken gir en biologisk tilnærming for bedre å kunne forstå adferd og mentale prosesser (som er psykologi). Boken har som overordnet mål å:
– Stimulere til kritisk og vitenskapelig tenkning om biologisk psykologi ved å gi et historisk perspektiv sammen med nåtidens kunnskap
– Bidra til etisk bevissthet om menneskets kompleksitet og mangfoldighet
– Integrere fagkunnskap på tvers av emner i de forskjellige kapitlene for lettere å kunne se og oppdage sammenhenger mellom de forskjellige emnene
Vi erkjenner at det å gå inn i biologisk psykologi som fagfelt kan være utfordrende, og kanskje spesielt om man ikke har så mye bakgrunnskunnskap innen nevrovitenskap. For å gjøre læringsprosessen noe enklere har vi fått anledning til å bruke Per Brodals figurer fra boken Sentralnervesystemet (Brodal, 2013). Figurene er oppdaterte og formidler den kunnskapen vi har i dag om nervesystemets grunnleggende oppbygning og funksjon. Bruk gjerne disse figurene samt kapittel 2 om hjernens anatomi og fysiologi som et oppslagsverk for kapitler som kommer senere i boken, og som beskriver adferd og mentale prosesser relatert til hjer-
nefunksjon. I tillegg kan man bruke boken aktivt gjennom disse hjelperessursene:
– Formidling. Boken har som mål å formidle faget på en lett og tilgjengelig måte. Vi bruker fortrinnsvis norske fagord, men noen ganger brukes også latinske og engelske uttrykk rett og slett fordi fagordet da er «hverdagsspråket» mellom forskere og undervisere. Vi prøver å fremme læring ved å bruke eksempler og metaforer for lettere å kunne «se for seg» det som skjer.
– Læringsmål. Hvert kapittel begynner med tydelige læringsmål som oppsummerer innholdet. Læringsmålene kan være eksamensrelevante.
– Stikkord. Boken har et stikkordregister med de mest sentrale ord og begrep for hvert kapittel, organisert i alfabetisk rekkefølge med sidetall.
– Kobling av de forskjellige kapitlene. For å kombinere kunnskap på tvers av temaene, henviser bidragsyterne flere steder til de øvrige kapitlene.
– Eksamensrelevante spørsmål. På slutten av hvert kapittel står noen spørsmål som leseren kan bruke for å teste egen kunnskap. Noen ganger er det et klart svar, andre ganger kan de være mer til refleksjon og drøfting. Spørsmålene kan anvendes til bruk i gruppediskusjoner og oppgaveløsning.
– Anbefalt litteratur. Noen kapitler har i tillegg anbefalt litteratur som kan brukes til å utdype kunnskapen om de ulike temaene som boken dekker.
En grunnleggende idé for denne boken er at det er sammenhenger mellom tanker og følelser på den ene siden, og fysiske reaksjoner og tilstander på den andre siden. Dette er kjernen i den biopsykososiale modellen for (mental) helse, som sier at for å forstå en persons helsemessige tilstand er det ikke bare biologiske faktorer som må tas hensyn til, men også psykologiske og sosiale/miljømessige faktorer. Mange lidelser har et biologisk opphav, men tankene, følelsene og adferden vår påvirker helsen. Sosiale faktorer, som sosioøkonomisk status, familieforhold, arbeidsforhold og opplevd sosial støtte, har også en betydning.
Paradigmet som boken bygger på, er basert på den biopsykososiale modellen (se figur 1.1) for helse som først ble lansert av den amerikanske psykiateren Geor-
ge Libman Engel i 1977 (Engel, 1977), men hvor selve begrepet først ble introdusert på 1950-tallet av Roy Richard Grinker (1900–1993).
Grinker var en amerikansk nevrolog og psykiater som gikk i psykoanalyse hos Sigmund Freud, og som senere tilsluttet seg nettverket rundt Franz Gabriel Alexander (1891–1964), en ungarsk-amerikansk psykoanalytiker og lege kjent som en av Freuds tidligere studenter. Alexander sies å være en av grunnleggerne av psykosomatisk medisin og psykoanalytisk kriminologi. Man kan si at Engel tok pallplassen foran både Grinker og Alexander når det gjelder kreditering og publisitet. Selv om den biopsykososiale modellen er relativt velkjent og utbredt i internasjonal litteratur, er det ikke dermed sagt at den representerer en fasit eller innehar svar hvor forskere på tvers av land og fagdisipliner er enige. Men den gir en god beskrivelse av hvordan moderne psykiatri har tatt til seg en mer humanistisk tilnærming for å forstå menneskets mentale helse. Alle tiltak som er ment å skulle behandle en lidelse eller en sykdom, bør kunne inkludere biologiske, psykologiske og sosiale elementer. Selv en medikamentell behandling inkluderer disse tre elementene med kunnskap om pasienters nevrokjemiske respons på medikamentet, om hen er motivert for å følge behandlingen og i stand til å betale det den koster.
Andre begrep, som holisme i motsetning til reduksjonisme, pragmatisme og anti-dogmatisme, er knyttet til modellen hvor det utover på 1980-tallet var en nedadgående interesse for freudiansk psykoanalyse parallelt med utvikling av diagnostiske verktøy som DSM-III (American Psychiatric Association, 1980) og inntreden av psykofarmakologi også for lettere og moderate psykiske lidelser (kapittel 13). Det ble dermed rom for andre perspektiv, som det bio-psyko-sosiale (Skårderud et al., 2018).
Dette stod i kontrast til bruk av metoder som nå tilhører fortiden, hvor behandling av psykiatriske pasienter oftere var preget av tvang, isolasjon, tunge nevroleptika og kirurgi for å gjøre pasientene rolige (se trepanasjon eller trepanering – «trepanatio» (latin), avledet fra det greske ordet «trypanon», som betyr bor). Eksperimentell behandling i mellom- og etterkrigstiden med lobotomi (fra gresk «lapp») var utbredt i norske psykiatriske sykehus helt frem til 1974. Som en motvekt til den biomedisinske tilnærmingen i behandling bidro Engel med formidling av eklektisime
Immunologisk respons Genetisk sårbarhet
Stressrespons
Hormoner Nevrokjemi
Kultur
Skole Arbeid
Kosthold/ livsstil
Fysisk helse Medikamentrespons Metabolisme Komorbiditet
Gruppetilhørighet Interpersonlige relasjoner
Hjernens belønningssystem
Mental helse
Traumatiske hendelser
Sosial støtte
Sorg
Familieforhold
Sosioøkonomisk status
Temperament
Sosiale/ miljømessige Psykologiske
Selvfølelse
Emosjoner Holdninger/tro
Mestringsforventninger Sosiale ferdigheter Persepsjon
Figur 1.1: Den biopsykososiale modellen for mental helse Modellen er en tverrfaglig modell som inkluderer de tre hovedelementene biologi, psykologi og sosiale forhold, og at samspillet er grunnleggende for en bredere forståelse av helse- og sykdomsatferd, og for menneskets utvikling. Nærmere forklart er helse- og sykdomsatferd et produkt av biologiske karakteristikker (som gener), atferdsmessige faktorer (som livsstil og stress), og sosiale forhold (som kulturpåvirkning, familieforhold og sosial støtte). Den ble først introdusert av George L. Engel i 1977 og brukes som et alternativ til den biomedisinske tradisjonen som har dominert helsebehandling over tiår.
Biologiske og genetiske determinanter for helse kan være mer relevant for noen populasjoner enn andre (arvelighet, kjønn, alder, fysikk). Dersom en enegget tvilling utvikler schizofreni er det stor sannsynlighet for at den andre tvillingen også vil få denne lidelsen. Psykologiske faktorer (kognisjon, emosjoner, atferd som inkluderer psykologisk stress, frykt og unngåelse, samt tidligere mestringserfaringer) påvirker beslutninger og valg (som hva man spiser og drikker, om man følger opp behandling), og sosiale faktorer kan være avgjørende for tilgang til helsetjenester, grad av sosial stigmatisering rundt helse, og for hvilke gruppenormer som gjelder i et samfunn (kroppspress, skjønnhetsideal som for noen medfører helserisiko). Overlapp av de ulike forholdene i modellen illustrerer hvordan disse samspiller med hverandre.
Helsefremming må ifølge modellen adressere alle de tre hovedelementene. En voksende mengde empirisk litteratur understøtter en slik antagelse om at det er kombinasjonen av helsestatus, oppfatninger av egen helse, og sosiokulturelle barrierer som påvirker sannsynligheten for å engasjere seg i helsefremmende atferd, som det å ta medisiner, velge riktig kosthold, og være fysisk aktiv.
(valg av flere element, perspektiv fra ulike tradisjoner eller teorier), som etter hvert fikk et stort publikum, og hvor vi i dag kan finne kunnskap og perspektiv fra flere forskningsområder som anvendes i praksis.
Noe av kritikken til modellen baserer seg på fraværet av et presist og konsist teoretisk rammeverk som tar hensyn til både modellens innhold og funksjon. Den lar seg med andre ord vanskelig etterprøve. I tillegg svarer ikke modellen på spørsmål som omhandler hvordan de tre faktorene interagerer med hverandre, relatert til hvordan sykdom eller lidelse kommer til ut-
trykk. Her må man basere seg på forskning som ofte innehar en mer begrenset bruk av dimensjonene, hvor design og metode er avgjørende for resultatene. Design med avhengige og uavhengige variabler kan for eksempel undersøke betydningen av seksuelle overgrep for utvikling av alvorlige spiseforstyrrelser, eller betydningen av serotoninnivå i blod eller celler for det å utvikle alvorlig depresjon. Studier som inkluderer en stor mengde variabler på tvers av dimensjonene, gir som regel signifikante funn når det gjelder risikofaktorer for sykdom eller prediksjon, men den treffsikre verdien for mindre pasientpopulasjoner og for den enkelte pasient er liten.
Engel var i hovedsak interessert i medisinske og ikke-psykiatriske tilstander, noe som kanskje virker overraskende sett ut ifra hans motstand mot å fremhe-
ve «bio» foran «psyko» og «sosial», men det var likevel denne interessen som skapte disse tre dimensjonene for å prøve å forstå både forløp og symptomalogi ved somatiske sykdommer som rammet mage-tarmsystemet eller hjerteregionen. Kan for eksempel hjertemuskelbetennelse (myokarditt) forverres ved psykologisk stress (engelsk: distress, eller negativt stress)? Kan man få en raskere tilheling av magesår ved bedre søvn og endret kosthold? I dag er slike spørsmål mer rutinemessige og selvsagte i klinikk enn for 30–40 år siden.
Men er det alltid formålstjenlig å inkludere alt man kommer på som kan være relevant for helse? Her er vi opptatt av at leseren utviser sunn skepsis og kritisk refleksjon til tross for at boken fremmer denne modellen som en overbygning. For når skal man velge det ene foran det andre i en klinisk sammenheng? Hvilke medisinske eller psykologiske spørsmål er mer viktige enn andre i en kartleggingsfase, hvor det hersker usikkerhet om pasienten har en alvorlig underliggende sykdom? Fra medisinsk allmennpraksis er det ofte med noe humoristisk vri at man kan si «om du ikke er sikker på hva det handler om, så er det alltid lurt å be pasienten om noen blodprøver først». Det er nok sikkert klokt, men ikke et tilrådelig førstevalg om pasienten sliter med aktive selvmordstanker og kan være i risiko for selvmord. Modellen har dermed sine begrensninger i form av fravær av retningslinjer for hva som er riktig å fokusere på når, og overfor hvem. Klinisk skjønn og intuisjon er viktige redskaper i praksis, men kanskje ikke de mest omtalte temaene spesielt innen akademia. Vi oppfordrer derfor leseren til å supplere alle kapitlene i denne boken med mer inngående forskningslitteratur fra for eksempel kognitiv psykologi, litteratur som beskriver og eksemplifiserer klinisk skjønn, og som retter seg mer direkte mot pasientpopulasjoner hvor evidensbasert praksis er beskrevet (Berge et al., 2023). Selv innen akuttmedisin er klinisk skjønn godt integrert med faglig skjønn, kompetanse og erfaring. En operasjonssykepleier eller kirurg bedømmer raskt og handler deretter. En slik handlingskompetanse krever imidlertid tilstedeværelse (aksjonsorientert) samt aktiv bruk og vedlikehold av det man har lært.
Det primære budskapet med å presentere en biopsykososial forståelse eller modell som en overbygning er at uavhengig av sykdomsbilde, prognose, symptomer eller sykdomstegn, så er pasienten først og fremst et helt menneske. Om man ikke kan behandle, kan man
gi støtte og omsorg, om man ikke selv innehar den rette kompetansen, kan man bistå med å skaffe den. Med et slikt utgangspunkt vil humanismen innen medisin og psykiatri vinne over reduksjonismen og fortrenge en dikotomisering mellom vitenskap og pluralisme.
Et fagemne som bruker et humanistisk perspektiv på helse, er helsepsykologi, som fremhever sammenhengen mellom psykologiske og miljømessige faktorer og somatisk helse. Herunder finner man kunnskaps- og forskningsområder innen helsefremmende arbeid, forebyggende tiltak og behandling av sykdom. Innen helsepsykologi fremheves adferd som det primære, hvor endringer i tillærte vaner (eller uvaner) og livsstilsendringer undersøkes i sammenheng med tilhørighet i ulike grupper basert på for eksempel utdanning, sosial klasse, yrke, etnisisitet eller andre forhold av forskningsmessig og klinisk betydning (kapittel 10). Større folkehelsekampanjer er som regel kampanjer for å fremme global folkehelse, det vil si fokus på folkehelseutfordringer som rammer regioner, land eller verdens befolkning. Verdens helseorganisasjon har en årlig markering for sin grunnleggelse, som er 7. april (1950), hvor blant annet mattrygghet, depresjon og tilgang til universell helsedekning har vært hovedtema.
I noen sammenhenger blir helsepsykologi og adferdsmedisin sidestilt med hverandre, avhengig av tradisjon og akademisk tilhørighet. Adferdsmedisin er vitenskapen hvor psykisk og fysisk helse møtes. Her er samspill igjen et nøkkelord, vist ved integrering av kunnskap i biologiske, adferdsmessige, psykologiske og samfunnsvitenskapelige vitenskaper relevante for forståelse av helse og sykdom. Det er etablert en Norsk forening for adferdsmedisin og helsepsykologi (NAMH) som en del av The International Society of Behavioral Medicine (ISBM), hvor de som er interessert i adferdsmedisinsk forskning og tematikk, kan møtes på tvers. Forsknings- og undervisningstema kan være innen arbeid og velferd, sosial ulikhet, psykisk helse blant helsepersonell og samspillet mellom psykologiske, biologiske og sosiale faktorer hos pasienter med akutte og kroniske somatiske sykdommer eller smertetilstander (kapittel 4).
Helse og adferd er sterkt forbundet med hverandre, hvor de psykologiske og sosiale faktorene kan spille en større eller mindre rolle.
Psykosomatikk (også kjent som psykofysiologi) kan brukes i forbindelse med en rekke helseplager eller tilstander hvor symptomer ikke kan kategoriseres i biologiske, psykologiske eller sosiale faktorer alene. Dette er også et fagemne som integrerer medisin og psykologi, hvor man studerer tilstander og lidelser som gir seg utslag i kroppslige (somatiske) symptomer med psykiske årsaker. Psykosomatiske lidelser opptar en betydelig del av utredning og behandling i allmennpraksis, men også i spesialisthelsetjenesten. De betegnes også som funksjonelle somatiske symptomer eller tilstander og sammensatte symptomtilstander. De vanligste lidelsene der man ikke finner en klar biologisk markør, er kronisk utmattelsessyndrom (myalgisk encefalomyelitt (ME)), fibromyalgi (tidligere fibrositt) og irritabel tarmsyndrom (irritable bowel syndrome (IBS)) (kapittel 7). En biologisk markør er et biologisk funn i for eksempel en blodprøve (eller i urin, vev) som sterkt antyder at en person har en sykdom. Under et hjerteinfarkt vil muskelceller skades, og proteiner som befinner seg inne i muskelen, slippes ut i blodbanen og kan dermed bli målt i en blodprøve. Slik kan man raskt avgjøre om pasienten har hatt et infarkt eller ikke, noe som har stor betydning for videre behandling og utfall.
Ofte er psykosomatiske lidelser relatert til belastende livshendelser eller tidlige negative livshendelser, psykologisk stress, angst og depresjon, men også somatisk sykdom knyttet til infeksjoner og skader kan være underliggende årsaker. Intense, langvarige eller tilbakevendende stressorer kan forårsake en vedvarende ugunstig aktivitet i kroppens stressreguleringssystemer som kan gi økt risiko for utvikling av slike symptomer som vi her har nevnt (kapittel 6). Symptombilder kan opptre svært ulikt avhengig av alder, kjønn, livssituasjon, kultur, religion og livssyn. I tillegg kan påvirkning gjennom mediene og sosiale medier være en faktor som vi kanskje i de senere årene er mer oppmerksomme på, spesielt når det gjelder fenomenet sosial overførbarhet (eller smitteeffekt).
Det er imidlertid stor forskjell i betydningen modellen har for ulike helsetilstander. For eksempel for alvorlige kreftformer kan sosioøkonomisk status ha en stor betydning for muligheten til å kjøpe optimal behandling. Det å leve under trygge miljømessige for-
hold er helsefremmende for mennesker selv med en alvorlig kreftsykdom sammenlignet med å leve i en krigssone. Psykoonkologi er et relativt nytt fagomåde hvor psykologiske reaksjoner på å få en kreftdiagnose og tilpasning til sykdommen er i fokus, og hvor barnekreft har fått mye oppmerksomhet. Trygge forhold kan lindre ubehag og kanskje smertene som følger med sykdom generelt. Et annet eksempel er magesår, som ble antatt å komme av kronisk forhøyet stressnivå. Da man fant at de fleste magesår kunne behandles med antibiotika som eliminerte bakterien helicobacter pylori i magesekken, falt denne teorien. Det er likevel fakta at noen som utvikler magesår, ikke har bakterien i magesekken, mens andre, som har bakterien, ikke utvikler magesår. Stress kan dermed opptre som en medierende eller delvis medierende faktor, men også være en modererende variabel, som er relevant for alle fagemner i denne boken.
Ved psykosomatiske lidelser avdekker ikke medisinsk utredning eller undersøkelser sikre biologiske funn. Det er ikke ensbetydende med at underliggende somatiske årsaker ikke er aktuelle, men disse kan være vanskelige å oppdage. Det kan handle om manglende tilgang til moderne teknologi og utstyr, faglig kompetanse og ekspertise, mer sjeldne medisinske tilfeller som krever utvidede og kanskje avanserte undersøkelser, eller andre årsaker. Noen har sammensatte tilstander med flere symptomuttrykk, andre har varierende grad av smertetrykk og symptombilde generelt. For at et symptom skal klassifiseres som psykosomatisk, må det også vedvare over tid og føre til hemming av funksjon i arbeid og/eller i dagliglivet.
Hvordan dette påvirker den enkeltes livskvalitet og daglige fungering, er individuelt. Man har nå gått bort fra betegnelsen «uforklarte medisinske tilstander», da dette bidrar til stigmatisering og holdninger som ikke gagner de pasientene som opplever funksjonsfall og lidelse. Men begrepet kan fremdeles dukke opp på nettsider eller i mer populærvitenskapelig litteratur.
Det finnes ulike diagnosesystem for å klassifisere sykdom, og i Norge er International Classification of Diseases and Related Health Problems (ICD-11) utbredt (World Health Organization, 2019). Kriterier for både somatiske sykdommer og mentale lidelser inngår i
ICD-11. For mange sykdommer er det en klar sammenheng mellom sykdom og tegn. Hjerte-karsykdommer har ofte karakteristiske og dermed gjenkjennbare og målbare tegn som kan registreres (kortpustethet, svimmelhet eller synkope (besvimelse), puls- og blodtrykksendringer). Det som pasienten registrerer, er ikke alltid målbart for andre eller objektivt, for eksempel smerte. Smerte defineres som symptom. For noen av de lidelsene som beskrives i denne boken, er det imidlertid ikke alltid klart hva som er tegn, og hva som er symptomer, men nyere teknologi bidrar til at tilstander man før ikke hadde mye kunnskap om, nå er objektivt registrerbare, som søvn og våkenhet (kapittel 9). Det kan være utfordrende å si hva som er årsak og virkning (årsakssammenheng eller kausalitet) når det gjelder psykiske lidelser, men basert på omfattende vurderinger og bruk av nedfelte symptomkriterier kan kvalifisert helsepersonell stille en eller flere diagnoser. Flere diagnoser (komorbiditet) kan for eksempel være aktuelt for pasienter med både rusavhengighet og psykisk lidelse.
Det kan være nyttig å reflektere over det som har vært et stridsspørsmål innen medisin, psykologi og samfunnsvitenskap i mange år. Er mentale lidelser og psykosomatiske symptomer sykdommer i vanlig forstand, som betyr at det finnes et underliggende biologisk avvik som forklarer symptomene, uten at man ennå har klart å finne dette avviket? Eller er det samfunnsmessige og psykologiske prosesser som ligger til grunn og forklarer symptomene, og at det ikke finnes noen underliggende sykdom? Dette er viktige spørsmål for all klinisk praksis som innebærer helbreding av mennesker, men også for avdekking av kunnskapshull hvor forskning (både basalforskning og klinisk forskning) kan være avgjørende for utvikling av nye behandlingsmetoder.
Begrepet «helse» er sentralt i denne boken, men er så generelt at det har fått flere ulike definisjoner, og det oppfattes også ulikt av ulike individer. Verdens helseorganisasjon (WHO) har imidlertid gitt en mye brukt definisjon som ofte refereres: «Helse er en tilstand av fullstendig fysisk, mentalt og sosialt velvære, og ikke bare fravær av sykdom eller svakheter» (WHO, 1948 i Sartorius, 2006 ). Senere har WHO lagt til følgende:
«Helse er en ressurs for hverdagen, ikke målet med å leve. Helse er et positivt begrep som legger vekt på sosiale og personlige ressurser, så vel som fysiske ressurser» (The Constitution of the World Health Organization). Helse er således en ressurs som støtter individets funksjon i samfunnet, og ikke et mål i seg selv. Andre har definert helse som evnen til å tilpasse seg trusler og utfordringer. Denne definisjonen har bakgrunn i at moderne vitenskap har gjort betydelige fremskritt i forståelsen av sykdommer ved å forstå mekanismene, oppdage nye måter å behandle eller lindre sykdom på, og erkjenne at fravær av sykdom antakelig ikke er mulig. Begrepet «uhelse» har bredt om seg de senere årene, selv om det ikke er et tradisjonelt medisinsk begrep (engelsk: ill-health, på norsk også kjent som vanhelse). Uhelse kan man si er det motsatte av helse, som da innebærer sykelighet eller funksjonssvikt. Det er rom for å bruke både helse og uhelse i vårt språk som to ulike samlebegreper.
Dersom man spør ulike mennesker om sin helse, vil mange si at det har de, selv om de kan ha en alvorlig sykdom. «Helse» relateres av mange til at de kan gjøre de gjøremålene de ønsker. Denne forståelsen av helse stemmer godt med nyere definisjoner av helse, som de to siste definisjonene i forrige avsnitt. Medisin, helse og psykologi er felt som flettes sammen, og hvor kunnskapen er til nytte i klinisk praksis.
Kunnskap om hvordan ulike faktorer påvirker hverandre, er også innlemmet i den biopsykososiale modellen. Det kan være en årsakssammenheng fra psykologiske og sosiale forhold til fysisk og mental helse. For å fastslå slike årsaksforhold er det nødvendig med gode, velkontrollerte studier. Det er korrelasjon mellom en rekke lidelser og tanker og følelser, men dette betyr ikke at det er årsakssammenhenger, slik som den biopsykososiale modellen postulerer. Mange som får hjerte-karlidelser som angina pectoris eller infarkt, opplever angst og depresjon, men dette kan være et resultat av den fysiske lidelsen og ikke en årsak. Så finnes det forskning som antyder at angst og depresjon kan være en årsak til hjerte-karproblemer, så det er ikke et enkelt bilde som tegnes når man skal forstå forskningen på området. Man kan beskrive dette perspektivet eller denne måten å forstå sykdom og helse på som et-
hvert utfall av behandling påvirkes av et vidt spekter av stimuli, enten de er eksterne eller interne. Slike stimuli kan være av biologisk karakter, som gener, hormoner og nevrotransmittere; av psykologisk karakter som tankesett eller tidligere erfaringer, og av sosial karakter som betydningen av sosialt nettverk og relasjoner til andre mennesker. Miljømessige faktorer er i tillegg relevant, hvor det i dag er økt oppmerksomhet på fysisk utforming av skoler, sykehus og institusjoner, tilgang til fysiske aktiviteter og fellesareal, lyssetting og fargevalg.
Helsemessige problemer har sjelden bare én årsak. De aller fleste lidelser er multifaktorielle, som betyr at flere faktorer virker sammen for å skape helseproblemer. Kosthold, røyking, søvn og aktivitetsnivå vil kunne virke sammen for å øke eller senke sannsynligheten for at helsemessige problemer oppstår. I tillegg kan genetiske faktorer disponere for utvikling av en rekke lidelser. Dette beskrives av den såkalt diatese – stress, eller sårbarhet – stressmodellen. Dette er en generell modell som sier at man kan ha ulike predisponeringer for ulike lidelser, og at den samme påvirkningen kan ha ulik effekt avhengig av om man er predisponert eller ikke. Hjerte-karlidelser er ett eksempel, der høye kolesterolnivå kan predisponere for hjerteinfarkt, som sammen med et usunt kosthold kan gi mange og sammensatte tegn og symptom.
Hvordan kan tanker og følelser påvirke helse og omvendt? Når det gjelder mental helse, så er jo nettopp uhensiktsmessige og irrasjonelle tanker og følelser nettopp det som er problemet, og denne boken handler i mindre grad om mental helse, selv om det også kan være relevant. Medisinsk psykologi handler i større grad om hvordan tanker og følelser kan påvirke fysisk helse. Bakgrunnen for denne sammenhengen er at tanker (kognisjon) og emosjoner også er tilstander i hjernen.
Bildedanningsteknikker for å studere blant annet hjernen har siden ca. 1990-tallet tillatt forskere å undersøke hjernens funksjon og struktur under ulike betingelser. Dette har revolusjonert vår viten om sammenhengen mellom adferd, mentale prosesser og hjernens prosesser hos mennesker. Ved studier av andre
dyrearter har man hatt andre og mer inngripende (invasiv, som betyr at noe føres inn i kroppen) teknikker tilgjengelige, som har gjort at man har hatt langt bedre kunnskap om disse sammenhengene. For eksempel har man siden midten av 1950-tallet hatt kunnskap om områder i hjernen hos andre dyrearter enn mennesket, områder som er sentrale for å forstå virkningen av rusmidler og mekanismene bak farmakologisk avhengighet (kapittel 12). Dyrestudier har også kartlagt områder og prosesser i hjerne og ryggmarg som er sentrale for modulering av smerte, dvs. områder der smerte kan hemmes eller økes. Studier som har nyttet bildedanningsteknikker i mennesker, har i stor grad bekreftet at disse områdene også er viktige for å forstå farmakologisk avhengighet og smertemodulering også hos mennesker.
Denne typen studier viser at subjektive tilstander som tanker og følelser korrelerer med tilstander i hjernen, og forklarer dermed delvis hvorfor mentale prosesser kan ha betydning for fysisk helse. Det er likevel en rekke momenter som ikke er kjent, spesielt hos mennesker. Bildedanningsteknikker kan ganske presist lokalisere områder i hjernen som er involvert i en psykologisk prosess. Det er imidlertid vanskeligere å definere hvilke nevrotransmittere som er involvert, selv om noen metoder kan si noe om dette. Prosesser i hjernen kan skje veldig fort, på et millisekund eller mindre, mens bildedanning av hjernen tar flere sekunder. Det kan derfor være vanskelig å fange opp enkelte av de fysiologiske prosessene.
Det foregående avsnittet forklarer hvorfor det er så viktig å forstå nervesystemet for tilegnelse av kunnskap om hvordan dette henger sammen med mentale prosesser og helse. Kapittel 2 gir en grundig innføring i sentralnervesystemet og det autonome nervesystemet. Det er i storhjernen og spesielt i hjernebarken at subjektive tilstander som tanker og følelser reguleres. Disse kan igjen påvirke det autonome nervesystemet, som kontrollerer en rekke av de livsviktige funksjonene i kroppen, som hjerterytme og hjertekontraksjoner, åndedrett, mage-tarmfunksjonen og utskilling av en rekke livsviktige hormoner. William Lovallos (2015) bok Stress and Health. Biological and Psychological Interactions sammenfatter elegant hvordan de ulike nivåene i nervesystemet, fra kortex via sub-korticale områder via det autonome nervesystemet til enkle reflekser, kan påvirkes av tilstander i sentralnervesystemet og
således forklare at kontroll over indre organer kan påvirkes av mentale tilstander. Videre kan dette bidra til å forklare en del sykdommer eller symptomer som er beskrevet i denne boken.
For å forstå sammenhengen mellom psykologi og biologi er «stress» sentralt, og begrepet har fått et eget kapittel i boken. Stress innbefatter tanker og følelser som påvirker kroppen slik at de kan ha helsemessige konsekvenser. Den samme påkjenningen eller «stressoren» gir ofte opphav til ulike responser hos ulike personer. Dette har sitt grunnlag i at vi alle har ulik historikk, og de erfaringene vi har, gjør at vi reagerer ulikt. Genetiske forskjeller gjør også at vi reagerer ulikt på like påkjenninger, slik sårbarhets–stressmodellen beskriver. Betydningen av gener er inngående beskrevet i boken sammen med epigenetikk, som er studiet av hvordan adferd og miljø kan påvirke hvordan genene våre fungerer (kapittel 3). Genene spiller en viktig rolle for helse og for hvilke egenskaper vi utvikler, men miljøet vi lever i, og hvordan vi lever, er med på å bestemme hvordan kroppen utvikler seg og fungerer.
Den biopsykososiale modellen forklarer ikke bare utvikling av sykdom og lidelser, men også hva som fremmer god helse. Fokus i dagens helsevesen har dreid seg fra behandling av lidelser som har oppstått, til forebygging for å redusere sykdom og lidelser, og helsefremming. Indre motivasjon og positivitet kan ligge til grunn for adferdsendringer som fremmer helse og forebygger sykdom. Myndighetenes råd om kosthold og aktivitetsnivå er en del av dette.
Områder vi har valgt å fremheve i boken, er alle under stadig utvikling og vekst, og forfatterne av kapit-
lene er alle aktive forskere og eksperter i sine fagfelt. Det innebærer at viten i dag kan være oppdatert i morgen. Kunnskap er som byggesteiner, det ene følger det andre, hvor nye problemstillinger og gjennombrudd skapes. Boken innehar både nylige gjennombrudd og stiller spørsmål som er relevante for de ulike fagområdene som boken inneholder.
American Psychiatric Association. (1980). Diagnostic and statistical manual of mental disorders (3. utg.) (DSM-III). American Psychiatric Association, Washington DC. American Psychiatric Association. (2022). Diagnostic and statistical manual of mental disorders (5. utg.). https://doi. org/10.1176/appi.books.9780890425787
Berge, T., Bull-Hansen, B. & Fjerstad, E. (2023). Irritabel tarm – mentale verktøy og strategier som reduserer symptomer og øker livskvaliteten. Aschehoug.
Brodal, P. (2013). Sentralnervesystemet (5. utg.). Universitetsforlaget.
Constitution of the World Health Organization. I: World Health Organization: Basic documents. 45th ed. World Health Organization; 2005.
Engel, G. L. (1977). The need for a new medical model: a challenge for biomedicine. Science, 196, s. 129–136.
Lovallo, W. R. (2015). Stress and health. Biological and psychological interactions (3. utg.). Sage Publications.
Sartorius, N. (2006). The meanings of health and its promotion. Croatian Medical Journal, 47, s. 662–664.
Skårderud, F., Haugsgjerd, S. & Stänicke, E. (2018). Psykiatriboken. Sinn-kropp-samfunn (2. utg.). Gyldendal.
World Health Organization. (2019). International statistical classification of diseases and related health problems (11. utg.). https://icd.who.int/
Læringsmål for kapittelet:
• Beskrive støtteceller i nervesystemet og nevronets generelle oppbygging
• Beskrive grunnlaget for signalering i nervesystemet og hva som skjer under aksjonspotensialet
• Beskrive kjemisk signaloverføring og viktige signalstoffer som benyttes i hjernen
• Beskrive nervesystemets utvikling og funksjonelle grovinndeling
• Beskrive anatomiske hovedtrekk ved sentralnervesystemet og deres viktigste funksjoner: ryggmarg, hjernestammen og lillehjernen, storhjernen med sine hjernehemisfærer, lapper og dypere hjernestrukturer
I kapittelet gis det en innføring i menneskehjernens anatomi og dens ulike funksjoner. Først beskrives de viktigste cellene vi finner i nervesystemet, og hvordan hjernenervecellene er bygget opp. Deretter forklares grunnlaget for signalering i nervesystemet og hvordan signalering foregår i og mellom hjernenerveceller. Her kommer jeg også inn på noen av de ulike signalstoffene som benyttes i hjernen, og hvordan informasjon kodes og lagres i nervesystemet. I neste del skisserer jeg hvordan nervesystemet utvikler seg fra unnfangelse til funksjonell grovinndeling når den er ferdigutviklet. I kapittelets siste del beskrives hovedtrekk i hjernens anatomi og funksjonelle spesialiseringer.
Men ought to know that from nothing else but the brain come joys, delights, laughter and sports, and sorrows, griefs, despondency, and lamentations. And by this, in an especial manner, we acquire wisdom and knowledge, and see and hear and know what are foul and what are fair, what are bad and what are good, what are sweet and what are unsavory […] And by the same organ we become mad and delirious, and fears and terrors assail us […] All these things we endure from the brain when it is not healthy […] In these ways I am of the opinion that the brain exercises the greatest power in the man.
Hippokrates, On the Sacred Disease (400 f.Kr.)
Cellene i nervesystemet –et komplekst nettverk av spesialiserte celler
Menneskets (Homo sapiens sapiens) hjerne har ikke endret seg stort de siste 200 000 årene. Den består av cirka 86 milliarder nevroner samt like mange støtteceller, kalt gliaceller. Nevronene er den grunnleggende signalerende enheten i nervesystemet. Dette er spesialiserte celler som mottar signaler fra kroppens sansesystemer, muskler og organer, prosesserer disse signalene, og videreformidler signaler til andre nevroner, muskler eller organer. Nevronene er koblet sammen i komplekse nettverk av forbindelser. Mønster av aktivitet i hjernens nevrale nettverk er grunnlaget for tanker, bevissthet, emosjoner og atferd. Gliacellene hjelper til under nervesystemets oppkobling og utvikling, ivaretar en rekke spesifikke hjelpefunksjoner i det ferdig utviklete nervesystemet og kan også være involvert i signalering i nervesystemet.
Faktaboks 2.1: Den utrolige hjernen
Den voksne hjernen veier mellom 1,3–1,4 kg og er i gjennomsnitt litt større hos menn enn hos kvinner. Hjernen blir to-tre ganger større i løpet av første leveår, men er ikke ferdig utviklet før i 25-års alder og består da av cirka 60 % fett. Det er en myte at man kun bruker 10 % av hjernen. Man bruker hele, og hjernen er alltid aktiv, selv under søvn. Av kroppens totale oksygen- og kaloriforbruk står hjernen for 20 %.
Det finnes en rekke apper og eksterne ressurser som både er artige og gjør det lettere å tilegne seg stoffet.
Nevroner
Nevronene som inngår i de ulike delene av nervesystemet har forskjellige spesialiseringer og har derfor også noe ulik oppbygging. Nevronene vi finner i ryggmargen kan grovt klassifiseres som 1) sensoriske nevroner som mottar sansesignaler. Disse kalles afferente fordi de formidler signaler til sentralnervesystemet), 2) motoriske nevroner, som formidler signaler fra sentralnervesystemet til muskler, organer og kjertler. Disse kalles efferente fordi de formidler signaler fra sentralnervesystemet, og 3) internevroner som utgjør forbindelsene mellom sensoriske og motoriske nevroner. Nevronene i hjernen kan ikke klassifiseres på samme enkle måte. Nevroner, som er lokalisert sammen og har gjensidige forbindelser, utgjør hjernestrukturer eller nevrale nettverk med én eller flere spesialiserte funksjoner. Slike nettverk vil også ha forbindelser til andre, mer fjerntliggende hjerneområder, og sammen med disse utgjøre større og komplekse nevrale systemer.
Variasjonen i oppbyggingen av hjernens nevroner er nært knyttet til funksjonen de har. I tillegg til den funksjonelle inndelingen i sensoriske nevroner, motoriske nevroner og internevroner kan nevroner inndeles i ulike hovedtyper ut fra antall utløpere fra cellelegemet. Oppbyggingen av nevroner er likevel lik nok til at vi kan si det består av fire deler: 1) cellelegemet, soma, 2) dendritter, 3) aksonet og 4) presynaptiske terminaler, nevronets kontaktpunkter.
Cellelegemet – soma
Nevronet består av cellelegemet, som inneholder cellekjernen og flere andre strukturer, inkludert celleskjelettet som gir cellen struktur (figur 2.1). Inne i nevronet finner vi også mitokondriene, som er cellens kraftstasjon, og strukturene endoplasmatisk retikulum og golgiapparatet, som er involvert i fremstilling av proteiner; byggesteiner for hjernens og kroppens celler. En membran bestående av lipider (fettstoffer) og proteiner omslutter hele nevronet. Membranen inneholder blant annet proteinstrukturer som er viktige under signalering i og mellom nevroner, og som aktivt eller passivt transporterer ioner (ladde molekyler) gjennom cellemembranen (se avsnittet om membranpotensialet). Nevronet er fylt med en ioneholdig væske som primært inneholder kalium-, natrium-, klorid- og kalsiumioner samt proteinmolekyler. De samme typene ioner finner vi ekstracellulært i væsken som omgir nevronet.
Dendritter
Fra cellelegemet har nevronene utløpere kalt dendritter (figur 2.1). Dendrittene er kontaktpunktet for signaler fra andre nevroner og fungerer som mottaker eller antenne for disse signalene. Dendrittene har en trelignende struktur (fra gresk dendron, som betyr tre), og har ofte mange forgreninger. Størrelsen på dendritt-treet gir informasjon om antall kontaktpunkter til andre nevroner, som kan variere fra noen tusen til 200 000. På de fleste dendritter finnes det små utvekster, kalt spinae (figur 2.1). Disse utgjør selve kontaktpunktet hvor signalene fra andre nevroner mottas. Spinaer er plastiske; de kan endre form, volum og antall. Slik plastisitet, og derved endring av effektiviteten til signaloverføringen mellom nevroner, er grunnlaget for læring og hukommelse (se avsnittet «Den plastiske hjernen – læring og hukommelse» og faktaboks 2.7).
Akson
Fra cellelegemet går det i tillegg til dendrittene ut en annen forgrening, kalt aksonet eller nervefiberen. Nevroner har kun ett akson, men dette kan forgrene seg i kollateraler nær enden og ha flere tusen kontaktpunkter med andre nevroner (figur 2.1). Når nevronet er aktivt, sendes signalet ned aksonet og frem til nevronets kontaktpunkter med andre nevroner, muskler eller organer. Dette signalet kalles aksjonspotensialet. Aksjonspotensialer utgjør selve sansesignalet som formidles til hjernen. Tilsvaren-
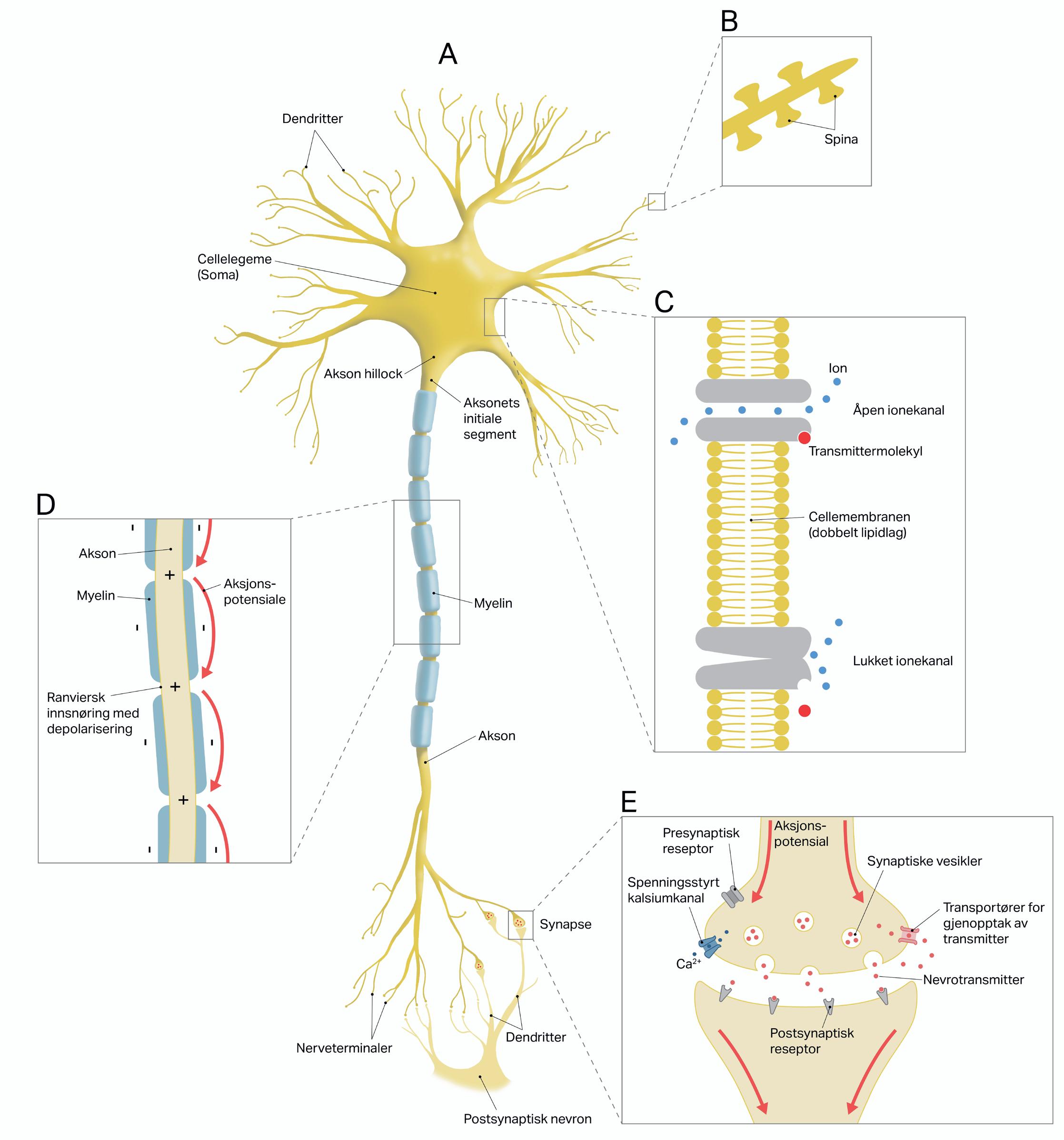
Figur 2.1: Nevronet består av cellelegeme, dendritter og aksonet (A). Dendrittene med sine spinae (B) mottar signaler fra andre nevroner. Cellemembranen i nevronet (C) inneholder ionekanaler som tillater ioner å passere gjennom membranen. Ionekanalene kan åpne eller lukke seg avhengig av spenningen over cellemembranen eller ved at nevrotransmittere binder seg til dem. Ut fra cellelegemet løper aksonet som formidler nervesignalet (aksjonspotensialet) til andre nevroner. Myelinlaget på aksonet beskytter og øker hastigheten på aksjonspotensialet som «hopper» fra Ranviersk innsnøring til innsnøring (D). Aksjonspotensialet starter i det initiale segment og løper frem til nerveterminalene der det fører til frisetting av nevrotransmittere som diffunderer over den væskefylte synaptiske spalten (E) og binder seg til reseptorer på det postsynaptiske nevronet. Gjengitt med tillatelse av Brodal: Sentralnervesystemet, 5. utg. 2012, og bearbeidet av Hellevik Studio.
de utgjør aksjonspotensialer også signaler fra hjernen til muskler om bevegelse (se avsnittene «Hvordan nevroner kommuniserer – signalering i nervesystemet» og «Aksjonspotensialet»). Lengden på et nevrons akson kan variere fra å være under én millimeter på det korteste til cirka én meter på det lengste, som går fra stortåa og inn til ryggmargen. De fleste aksonene har et fettholdig myelinlag (se avsnittet om oligodendrocytter) som isolerer aksonet, beskytter nervesignalet og øker ledningshastigheten (figur 2.1). Ledningshastigheten avhenger ikke bare av myelinisering, men også av aksonets tykkelse: jo tykkere akson, desto raskere signal. Aksoner er tykke og myeliniserte i nevroner der signalene må formidles raskt. Forskjeller i ledningshastighet kan oppleves ved skade. Først kommer den skarpe smerten som vi kjenner nøyaktig hvor kommer fra. Denne formidles av aksoner med rask ledningshastighet. Deretter kommer den dumpe smerten med en mer diffus og utbredt lokalisasjon som formidles av aksoner med tregere ledningshastighet (se kapittel 4). Eksempelet illustrerer ikke kun ulik ledningshastighet, men også generelt hvordan aksjonspotensialer i nevroner utgjør en del av selve sansesignalet til hjernen, som gir opphav til, og er en forutsetning for, ulike sanseopplevelser. Skader på aksoner som formidler sansesignaler til hjernen eller motoriske signaler fra hjernen fører til bortfall av sanseinntrykk eller tap av muskelkontroll eller lammelser (f.eks. ved ryggmargsskade der aksoner til/fra hjernen er kuttet over).
Faktaboks 2.2: Aksoner og ledningshastighet
Hos en 20-åring inneholder hjernen et sted mellom 150 000–180 000 km med myeliniserte aksoner, tilsvarende en lengde på opptil 4,5 ganger rundt jordkloden (!). Tykke, myeliniserte aksoner leder signaler med en fart på 70–120 m/s (opptil ca. 400 km/t), mens ledningshastigheten i tynne, umyeliniserte aksoner bare er 0,5–2 m/s (ca. 7 km/t).
Nerveterminal og synapse
Aksonet med sine endeforgreninger danner kontaktpunktene til andre nevroner. Disse endepunktene kalles nerveterminalen (eller boutoner, av fransk for
knapp), og som navnet tilsier, er de små oppsvulminger i enden av aksonet. Nerveterminalen ligger lokalisert nesten inntil membranen på nevronet det har kontakt med (figur 2.1). Det er imidlertid et lite, væskefylt mellomrom mellom dem som kalles den synaptiske spalten. Dette kontaktstedet mellom nevronene kalles synapsen, og det er her nervesignalet overføres. I sentralnervesystemet er det vanligst å finne synapsen på mottakernevronets dendritter, akso-dendrittiske synapser, eller cellelegemet, akso-somatiske synapser. Når vi skal beskrive avsender og mottaker i signalgangen mellom to nevroner, tar vi utgangspunkt i synapsen. Presynaptisk (avsender) betyr der signalet kommer fra, postsynaptisk (mottaker) betegner der signalet sendes til. Nerveterminalene finner vi derfor presynaptisk, mens det postsynaptiske kontaktpunktet kan være plassert ulike steder på nevronet, for eksempel på dendritter, cellelegemet eller aksonet. De fleste nevronene er både presynaptiske og postsynaptiske fordi de inngår i nettverk med mange tusen forbindelser til andre nevroner.
Støtteceller i nervesystemet – gliaceller
Ordet glia kommer fra det greske ordet lim og gjenspeiler at man tidligere trodde disse cellenes oppgave kun var å holde nevronene på plass i hjernen. Mens nevroner er celler spesialisert for signalering i nervesystemet, er gliaceller annerledes enn nevroner både i oppbygging og funksjon, og de kan inndeles i astrocytter, oligodendrocytter og mikroglia. Gliacellene har en avgjørende betydning for normal hjernefunksjon. Dette understrekes av den lange rekken sykdommer knyttet til gliacellene, for eksempel Alzheimers sykdom, Parkinsons sykdom og multippel sklerose (MS) (se faktaboks 2.3).
Astrocytter
Astrocytter, eller astroglia, er stjerneformete celler (astro = stjerne) med flere viktige oppgaver i nervesystemet. Astrocytter fungerer som et slags stillas for nevroner og aksoner under hjernens utvikling og oppkobling. Astrocyttenes mange utløpere har kontakt med både nevroner, kapillærene (hjernens minste blodårer) og med annen overflate i hjernen inkludert væskefylte hulrom som inneholder cerebrospinalvæske (se avsnittet om sentralnervesystemet). Gjennom å
kunne utveksle stoffer mellom nevronene, kapillærene og cerebrospinalvæsken kan astrocyttene kontrollere væskemiljøet som omgir nevronene. I astrocyttene blir glukose tatt opp fra blodbanen, gjort om til laktat og overført til nevronene. Laktat er den viktigste energikilden til nevronene i hjernen. Astrocyttene omslutter og beskytter som oftest synapsen, kontaktpunktene mellom nevroner (se avsnittet om nerveterminal og synapse og figur 2.1), og er viktige når det gjelder å fjerne signalmolekyler frisatt fra nevronene og derved opprettholde normal signalering i nervesystemet. Astrocyttene har også en viktig funksjon i blod-hjernebarrieren som beskytter hjernen for påvirkning eller skade fra ulike kjemiske stoffer. Astrocyttene stimulerer celler i kapillærene til å danne en tettvevd sil som stenger kjemiske stoffer ute (se avsnittet om sentralnervesystemet). De har også en viktig funksjon ved fjerning av avfallsstoffer i hjernen under søvn (se avsnittet om sentralnervesystemet og kapittel 9).
Oligodendrocytter
Oligodendrocytter er avgjørende for normal signalering i sentralnervesystemet (se faktaboks 2.3). De fleste aksonene er dekket med et isolerende lag som kalles myelin, som hovedsakelig består av lipider. Myelinlaget isolerer nervesignalet i aksonet fra forstyrrelser og sørger for at det går raskere (som i en elektrisk ledning). I sentralnervesystemet dannes myelinlaget av oligodendrocytter, mens det i resten av nervesystemet dannes av såkalte Schwann-celler. Oligodendrocyttene og Schwann-cellene vikler seg rundt aksonet i segmenter nedover dets lengde (figur 2.1). Mellomrommene mellom segmentene kalles Ranvierske innsnøringer Under signalering i nevronet «hopper» nervesignalet fra innsnøring til innsnøring nedover aksonets lengde (figur 2.1 og se avsnittet om aksjonspotensialet).
Mikroglia
Mikroglia er små celler (derav navnet) som finnes i alle deler av nervesystemet. De dannes i beinmargen under fosterlivet og vandrer deretter inn i nervesystemet og blir en del av dette. Mikroglia er en del av immunforsvaret som beskytter hjernens friske nevroner. De har evne til fagocytose; de «spiser» og fjerner ødelagte eller døde celler og fremmed materiale. En annen viktig funksjon til mikroglia er å regulere og opprettholde et stabilt fysiologisk miljø i hjernen. Nylige studier
har vist at mikroglia også er involvert i en rekke andre funksjoner og prosesser inkludert sosial atferd og læring. Mikroglia har i tillegg betydning for smerte gjennom å regulere smertesignalet (se kapittel 4) og bidrar i regulering av søvn (se kapittel 9). Mikroglia har en rolle i autoimmun-sykdommer, slik som for eksempel multippel sklerose (MS), hvor immunsystemet angriper og ødelegger egne, friske celler i nervesystemet (se faktaboks 2.3), og i andre sykdommer som Alzheimers sykdom og Parkinsons sykdom.
Faktaboks 2.3: Multippel sklerose (MS) Betydningen av myelin for normal signaloverføring illustreres av de alvorlige symptomene som observeres ved demyeliniserende sykdommer slik som multippel sklerose. Symptomer ved MS inkluderer blant annet lammelser eller bevegelsesvansker, nummenhet og sansetap. MS er en autoimmun sykdom hvor immunforsvaret angriper og skader kroppens egne celler. årsakene til MS er ikke kjent, men det antas at både genetiske og miljømessige faktorer spiller inn. Studier antyder at astrocytter og mikroglia gjennom forstyrrelser av blod-hjernebarrieren og immunresponsen kan være involvert i ødeleggelse av myelinlaget dannet av oligodendrocyttene.
Hvordan nevroner kommuniserer – signalering i
Et eksempel på signalering i nervesystemet er kneskjellrefleksen, patellarrefleksen, som kan utløses av et lett slag på senen for den rette lårmuskelen. Slaget gir en kortvarig strekk som oppfattes av strekksensitive reseptorer til sansenevroner i muskelen, og som aktiverer sansenevronet til å sende signaler (aksjonspotensialer) ned dets akson og inn til ryggmargen. I ryggmargen kontakter sansenevronet et motorisk nevron og aktiverer dette til å sende signal tilbake muskelen om sammentrekning. Samtidig sendes et inhibitorisk motorisk signal til muskelen på motsatt side av låret, slik at denne muskelen slapper av og beinet kan strekkes ut.
Signalering i hjernen er selvsagt mer kompleks enn dette eksempelet, men all signalering i nervesystemet er organisert på samme grunnleggende måte og kan inndeles i fire trinn nært knyttet til nevronets ulike deler beskrevet i 2.1: 1) input – graderte påvirkninger på et nevrons dendritter, cellelegeme eller sansereseptorer, 2) summering/integrering av påvirkningene, 3) signalledning ned nevronets akson analogt til en liten elektrisk strøm, aksjonspotensialet, og 4) output – signaloverføring fra det aktive nevronet til nevronene det har kontakt med, eller til muskler og kjertler. Denne signaloverføringen foregår som regel ved hjelp av kjemiske signalsubstanser, kalt nevrotransmittere. Først forklares grunnlaget for signalering innad i nevronet, membranpotensialet. Deretter beskrives hva som skjer under signalering ned nevronets akson, aksjonspotensialet, og til sist forklares signaloverføring mellom nevroner.
Elektrisk signal innad i nevronet
Nevronet kan sammenlignes med et lite batteri. I et batteri er det er en spenningsforskjell over polene (+/–, f.eks. 1,5 V). Om vi kobler en ledning mellom polene, vil det strømme elektroner gjennom ledningen drevet av den kjemiske energien lagret i batteriet. I et nevron er det en spenningsforskjell over cellemembranen som er skapt av litt høyere konsentrasjon av negative ioner på innsiden enn på utsiden av cellen. Denne spenningsforskjellen kalles membranpotensialet og er drivkraften for det elektriske signalet innad i nevronet, der ioner beveger seg gjennom åpninger i cellemembranen nedover aksonet som en liten elektrisk strøm.
Membranpotensialet
Inne i nevronet og utenfor cellemembranen finnes det væske, og i denne væsken flyter det ulike typer ioner og ladde molekyler. De viktigste ionene for membranpotensialet er natrium-, kalium- og klorioner samt negativt ladde proteiner (kjemiske symboler er henholdsvis Na+, K+, Cl-, og A-). Cellemembranen sørger for at ioner ikke kan passere inn i cellen unntatt gjennom spesialiserte åpninger gjennom membranen, kalt ionekanaler (figur 2.1). Ionekanaler er selektive for hvilke ioner de lar passere gjennom membranen. Noen slike ionekanaler er åpne og lar ioner strømme fritt gjennom, mens i andre ionekanaler styres åpning eller lukking enten
Faktaboks 2.4: Ionepumpen forflytter kun positive ioner
Hvorfor er innsiden av nevronet mer negativ enn utsiden? Ionepumpen forflytter jo bare positive ioner inn og ut av cellen; 3 Na+ ut for 2 K+ inn. Spenningsforskjellen som skapes skyldes at konsentrasjonsgradienten til K+ driver noe K+ ut av cellen gjennom de åpne kaliumkanalene. Derved blir innsiden mer negativ enn utsiden. Konsentrasjonsgradienten og spenningsgradienten for K+ virker mot hverandre. Konsentrasjonsgradienten dytter K+ ut av cellen, mens spenningsgradienten dytter K+ inn i cellen. Når disse to kreftene er i likevekt, kalles det likevektspotensialet for K+. Likevektspotensialet for K+ er rundt minus 75-90 mV, det vil si litt større enn hvilepotensialet i cellen, som er rundt -65 mV. Differansen skyldes lekkasjen av Na+ inn i cellen, som gjør spenningen over membranen mindre.
av spenningen over cellemembranen (spenningsstyrte ionekanaler), av spesielle signalmolekyler som binder seg til reseptorer på ionekanalen (transmitterstyrte), eller av ulike stimuli som for eksempel berøring, lys og temperaturendringer, som i sansenevronene. Slike ionekanaler gjør at permeabiliteten, gjennomtrengeligheten til membranen, for ulike typer ioner kan endres. Når ionekanaler åpnes, kan ioner slippe gjennom som en liten elektrisk strøm.
To uavhengige krefter bidrar til den elektriske spenningen over cellemembranen kalt membranpotensialet. Konsentrasjonsgradienten beskriver kraften som driver like molekyler fra områder med høy konsentrasjon mot områder med lav konsentrasjon. Selve bevegelsen av molekyler mot områder med lavere konsentrasjon kalles diffusjon eller at molekylene diffunderer, det vil si sprer seg utover. Et eksempel på diffusjon er hvordan rød saft konsentrert i bunnen av et glass med vann etter hvert sprer seg utover og farger alt vannet rødt. Spenningsgradienten er kraften som skyver like ladninger fra hverandre og trekker ulike ladninger mot hverandre.
I hviletilstand er de fleste ionekanalene i nevronet lukket. Unntaket er kaliumkanalene, som tillater kaliumioner (K+) å strømme fritt inn og ut av cellen. Ionepumper i cellemembranen bruker energi i form av adenosintrifosfat (ATP) på å pumpe K+ inn i cellen og natriumioner (Na+) ut av cellen (se faktaboks 2.4-2.6). Dette fører til ulike konsentrasjoner av ioner på innsiden og utsiden av membranen. Innsiden av membranen har en høyere konsentrasjon av K+ og negativt ladde molekyler (A-), mens det på utsiden er en høyere konsentrasjon av Na+ og kloridioner (Cl-). I sum er det flere negative ioner på innsiden enn utsiden av membranen. Dette skaper en spenning over membranen –membranpotensialet. I hviletilstand, når nevronet ikke er påvirket av andre nevroner, kalles membranpotensialet for cellens hvilepotensial. Hvilepotensialet varierer noe avhengig av type nevron, men ligger rundt –65 millivolt (mV). Vi setter et minustegn foran fordi vi tar utgangspunkt i innsiden, som er mer negativ enn utsiden. Denne spenningen innebærer at krefter vil drive ioner gjennom ionekanalene i membranen dersom kanalene åpner seg (figur 2.1 og 2.2).
Hva igangsetter aktivitet i et nevron?
Flere nevroner har en viss spontan aktivitet (aksjonspotensialer) selv uten påvirkning fra andre nevroner. Noen har rytmiske pacemaker-egenskaper, viktige både for eksempelvis hjerteslag, søvn eller bevegelse. Andre inngår i små eller større nevrale nettverk som opprettholder aktivitet over tid. Spontan bakgrunnsaktivitet kan også være funksjonell ved at nevronet både kan øke og redusere aktiviteten (f.eks. dopaminsignaler, se avsnittet «Transmitterbinding til reseptorer som indirekte åpner ionekanaler»). Derved øker antall signalmuligheter i nervesystemet.
I sanseapparatets sensoriske nevroner igangsettes aktiviteten av fysiske stimuli, for eksempel lys, lyd og berøring. I de fleste nevroner startes imidlertid aksjonspotensialet av påvirkning fra andre nevroner. Når et nevron signaliserer til et annet, skjer det i hovedsak ved hjelp av kjemiske signalstoffer kalt nevrotransmittere som frisettes i synapsen mellom nevronene. Frisatt nevrotransmitter diffunderer over den væskefylte synaptiske spalten og binder seg til reseptorer på det postsynaptiske nevronet. Reseptorbinding fører enten
er
eksitatoriske (EPSP: Eksita-
postsynaptisk potensial) og
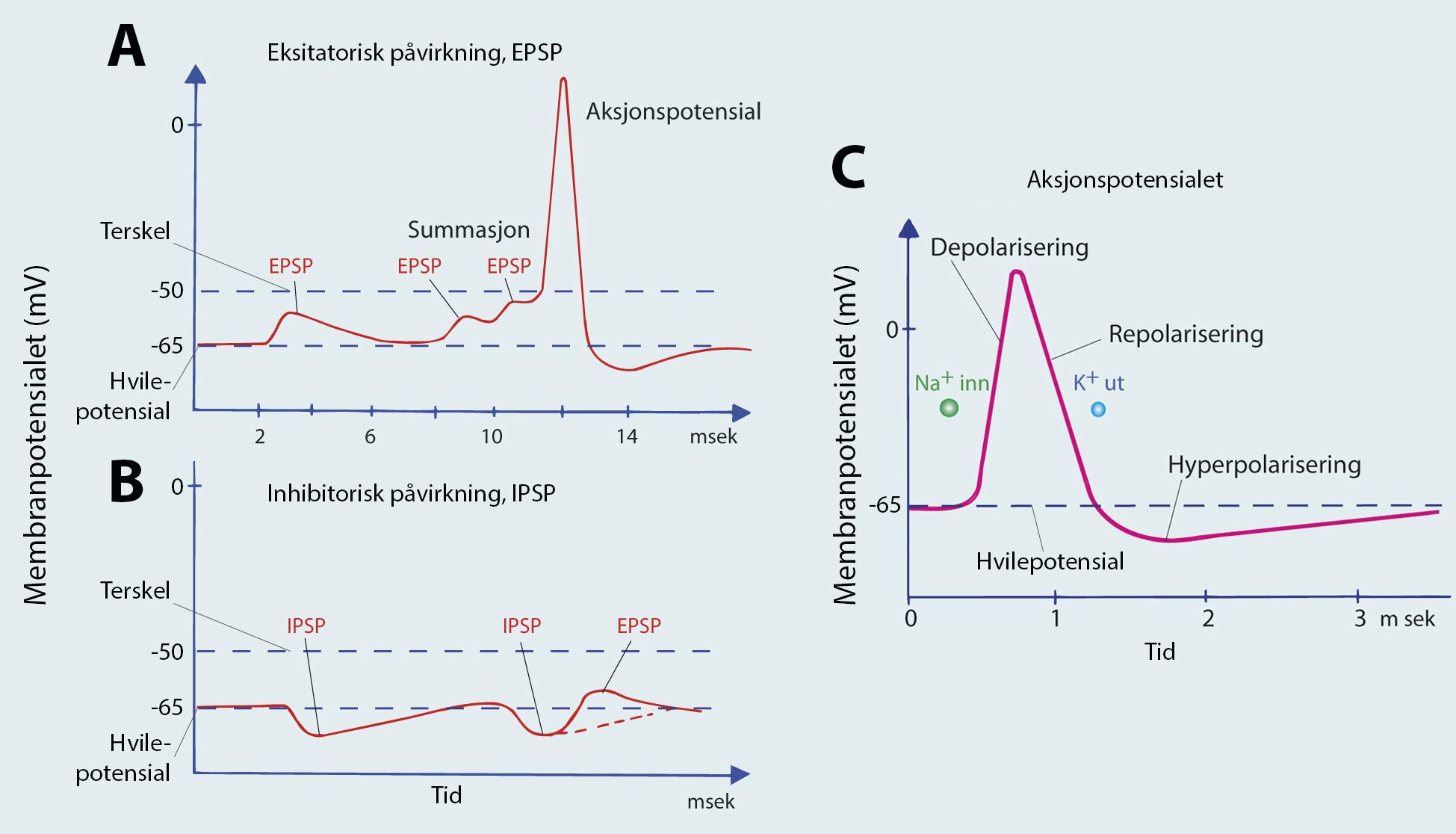
Inhibitorisk postsynaptisk potensial) påvirkninger på nevronet. EPSP bringer membranpotensialet nærmere terskelverdien for å danne et aksjonspotensial («gass»), mens IPSP bringer membranpotensialet lenger unna («brems»). Figur C viser hvordan natriumioner og kaliumioner strømmer inn og ut gjennom cellemembranen under aksjonspotensialet og derved endrer membranpotensialet de millisekundene et aksjonspotensial varer. Gjengitt med tillatelse av Brodal: Sentralnervesystemet, 5. utg. 2012, og bearbeidet av Magnolia Design.
direkte eller indirekte til at ionekanaler i den postsynaptiske membranen åpnes slik at ioner strømmer gjennom cellemembranen og endrer spenningen over membranen.
Påvirkningen kan virke som «gass» og øke sjansen for dannelse av et aksjonspotensial. Dette kalles et eksitatorisk postsynaptisk potensial (EPSP) og skjer når frisatt nevrotransmitter åpner ionekanaler som slipper inn positive ioner og gjør innsiden mindre negativ enn i upåvirket hviletilstand. Dette innebærer at nevronet depolariseres; membranpotensialet går fra -65 mV i retning 0 (depolariseres = mindre spenning over membranen). Motsatt kan påvirkningen også virke som en «brems» som reduserer sjansen for dannelse av et aksjonspotensial. Dette kalles et inhibitorisk postsynaptisk potensial (IPSP) og skapes når frisatt nevrotransmitter åpner ionekanaler som slipper inn negative ioner og gjør nevronet mer negativt på innsiden enn i hviletilstand; nevronet hyperpolariseres, og membranpotensialet blir mer negativt enn -65 mV, for eksempel -75 mV. Påvirkningen fra andre nevroner er gradert og varierer avhengig av hvor mange ioner som slippes gjennom den postsynaptiske membranen (figur 2.2).
Aksjonspotensialet
Påvirkning fra andre nevroner fører til åpning av ionekanaler og innstrømming av positive eller negative ioner. Ionene vil passivt diffundere videre innover i nevronet og frem til området i overgangen mellom cellekroppen og aksonet, kalt akson hillock (figur 2.1). Det er her, i akson hillock, den totale påvirkningen på nevronet summeres i form av de positive og negative ionenes samlede innvirkning på membranpotensialet Om nevronet depolariseres og membranpotensialet i akson hillock når en viss terskelverdi, vil et aksjonspotensial trigges i området som danner begynnelsen av aksonet, kalt det initiale segment (figur 2.1).
Cellemembranen i det initiale segment har mange spenningsstyrte natriumkanaler. Natriumkanaler finnes også nedover aksonet i de Ranvierske innsnøringene – mellomrommene der aksonet ikke er myelinisert (se avsnittet om oligodendrocytter og figur 2.1). Åpningstilstanden til disse ionekanalene (om de er åpne eller lukket) styres av spenningen over membranen. De spenningsstyrte natriumkanalene er lukket når membranpotensialet er -65 mV og nevronet er i hviletilstand, men åpnes om de eksitatoriske presynap-
tiske påvirkningene er store nok til å redusere membranpotensialet i det initiale segment til rundt -50 mV (terskelverdien). Da strømmer Na+ inn gjennom membranen i det initiale segment og depolariserer nevro-
Faktaboks 2.5: Klargjøring av nevronet for en ny nerveimpuls – repolarisering Etter depolarisering må nevronet repolariseres for å kunne danne nye nerveimpulser. Rundt ett millisekund etter åpning av de spenningsstyrte natriumkanalene åpnes spenningsstyrte kaliumkanaler, og K+ strømmer ut av cellen grunnet den mye større konsentrasjonen av K+ inne i cellen under hvilepotensialet (se avsnittet om membranpotensialet og figur 2.2). Rett etter stenger natriumkanalene mens kaliumkanalene forblir åpne. De åpne kaliumkanalene og utstrømmingen av K+ fører til repolarisering av nevronet ved å drive membranpotensialet mot likevektspotensialet for kalium, som er -80 mV (figur 2.2). Nevronet vil i en kort periode hyperpolariseres og bli enda mer negative på innsiden av membranen enn i hviletilstand (-80 mV versus -65 mV). Denne fasen kalles den absolutte refraktærperioden. Nå kan hverken spenningsstyrte Na+-kanaler åpnes eller nye aksjonspotensialer dannes. Denne fasen følges av den relative refraktærperioden, der nevronet kan danne aksjonspotensialer, men hvor større eksitatorisk postsynaptiske potensialer er nødvendig. Refraktærperioden varer kun noen millisekunder, men har to viktige konsekvenser: 1) den begrenser fyringshastigheten til nevronet til cirka 200 aksjonspotensialer per sekund, og 2) diffusjon av ioner som har strømmet gjennom membranen kan ikke åpne ionekanaler på aksonet der aksjonspotensialet allerede «har vært». Dette betyr at aksjonspotensialet kun kan gå én vei: nedover aksonet mot nerveterminalen. I neste fase stenges kaliumkanalene, og ionepumpen vil sørge for repolarisering av nevronet og gjøre det klart for et nytt aksjonspotensial. Hele prosessen beskrevet her er svært rask og skjer i løpet av noen få millisekunder (figur 2.2).
net. Dette utgjør den første delen av aksjonspotensialet (figur 2.2). I en kort periode strømmer så mye Na+ inn i nevronet at innsiden av membranen blir mer positiv enn utsiden (ca. +40 mV), motsatt av hva som er tilfelle i hviletilstand. Innstrømmet Na+ diffunderer videre ned i aksonet og fører til ny depolarisering og åpning av nye spenningsstyrte natriumionekanaler lenger ned på aksonet. Dette skjer i rekkefølge ned langs aksonet i en prosess som gjentar seg hele veien frem til nerveterminalene. Denne kaskade-effekten nedover aksonet er aksjonspotensialet – signaleringen innad i nevronet. Myelinisering av aksonet gjør at aksjonspotensialet lettere ledes ned aksonet. Aksjonspotensialet «hopper» fra mellomrom til mellomrom i myelinlaget som omgir aksonet (Ranviersk innsnøring), og gjør at signalet går betydelig raskere. Når aksjonspotensialet kommer frem til nerveterminalen, åpnes spenningsstyrte kalsiumkanaler (Ca2+), og videre vil små membrankledde blærer med nevrotransmitter, kalt synaptiske vesikler, smelte sammen med cellemembranen og tømme nevrotransmitteren ut i synapsen (figur 2.1).
Faktaboks 2.6: Sentrale egenskaper ved aksjonspotensialet
Aksjonspotensialet består av en tidsmessig strengt organisert sekvens av hendelser. En analogi til en rekke dominobrikker ivaretar flere av aksjonspotensialets viktigste egenskaper:
• Nevronet kan motta eksitatoriske og inhibitoriske påvirkninger som summeres som spenningen over membranen ved akson hillock. Om spenningen her overskrider en terskelverdi, åpnes spenningsstyrte ionekanaler, og aksjonspotensialet starter.
o Det kan være en viss påvirkning på den første dominobrikken uten at den faller, men når den tipper over balansepunktet, så velter den og tar med seg hele rekken. Det kan også være (inhibitoriske) påvirkninger som vipper den første brikken vekk fra de andre brikkene og reduserer sjansen for at rekken av brikker velter.
• Aksjonspotensialet er en alt-eller-ingenting-prosess. Enten så går det, eller så går det ikke.
o Velter den første dominobrikken, så velter alle, det er ingen mellomting –alle eller ingen.
• Aksjonspotensialet nydannes langs hele aksonet. Det er like sterkt hele veien.
o Når én dominobrikke faller, faller neste med like stor kraft som forrige. Fallet gjentas på nytt og på nytt med hver brikke som faller, og er like sterkt hele veien.
• Aksjonspotensialet går kun én vei nedover aksonet fordi membranen en kort tid er hyperpolarisert etter depolarisering og ikke kan depolariseres på nytt.
o Dominobrikkene velter også kun én vei, veltede brikker velter ikke tilbake.
• Myelinisering av aksonet gjør at aksjonspotensialet lettere og raskere ledes ned aksonet ved at aksjonspotensialet hopper fra Ranviersk innsnøring til innsnøring.
o På dette siste punktet kommer dominoanalogien til kort. Signalering mellom nevroner Når aksjonspotensialet kommer frem til nerveterminalen og kontaktpunktene med andre nevroner, muskler eller kjertler, overføres signalene til mottakernevronet enten kjemisk eller elektrisk. De fleste nevroner i nervesystemet vårt benytter kjemiske signalstoffer som frisettes i synapsen, men vi finner også elektriske synapser i for eksempel hypothalamus. For enkelthets skyld presenteres ofte signalering mellom nevroner som enten kjemisk eller elektrisk. Nyere funn tyder imidlertid på at nevroner kan ha både elektriske og kjemiske synapser, og at normal hjerneutvikling og fungering er avhengig av et komplekst samspill mellom begge typer.
Elektriske synapser
I elektriske synapser ligger membranen til de to nevronene helt inntil hverandre med relativt store ionekanaler lokalisert direkte overfor hverandre. Derved kan ioner diffundere direkte fra det ene nevronet og inn i det andre. Når det presynaptiske nevronet depolariseres, vil ionene strømme videre gjennom kanalene mellom nevronene og depolarisere også det andre nevronet til å danne et aksjonspotensial. Åpne kanaler i membranen mellom nevronene betyr også at signalet kan gå begge veier. Den direkte signaloverføringen i elektriske synapser er raskere enn i kjemiske synapser. Elektriske synapser finner vi derfor i deler av nervesystemet der hastighet er viktig. Eksempel på dette er defensive reflekser og fluktresponser, eller der nevronaktivitet skal synkroniseres, som i hypothalamus ved hormonutskillelse (se avsnittet «Mellomhjernen – diencephalon»). Elektriske synapser er antatt å være mindre modifiserbare enn kjemisk synapser, men har likevel en viktig rolle ved visse typer læring (se avsnittet «Den plastiske hjernen – læring og hukommelse»).
Kjemiske synapser
Når aksjonspotensialet kommer frem til nerveterminalen, skjer den kjemiske signaloverføringen ved hjelp av nevrotransmittere som frisettes og diffunderer over den synaptiske spalten, binder seg til reseptorer postsynaptisk og åpner ionekanaler (figur 2.1). Under aksjonspotensialet depolariseres nevronet langsmed aksonet helt ned til nerveterminalen. Membranen i nerveterminalen inneholder spenningsstyrte kalsiumkanaler (Ca2+). Her finnes det også små membrankledde blærer med nevrotransmitter, kalt synaptiske vesikler. Når aksjonspotensialet kommer frem til nerveterminalen, blir cellen depolarisert, de spenningsstyrte kalsiumkanalene åpnes, og Ca2+ strømmer inn. Økningen av kalsiumkonsentrasjonen i nerveterminalen fører til at synaptiske vesikler med nevrotransmitter ledes ned mot den presynaptiske membranen og smelter sammen med den. Vesikkelinnholdet tømmes ut i den synaptiske spalten rett overfor reseptorer lokalisert på det postsynaptiske nevronet. Uttømmingen kalles eksocytose, og skjer cirka 1 millisekund etter at aksjonspotensialet har kommet frem til nerveterminalen. Brukte vesikler blir resirkulert ved at vesikkelmembranen frigjøres fra synapsemembranen, fraktes inn i nerveterminalen og fylles med nevrotransmitter.
Nevroner kan danne opptil flere hundre aksjonspotensialer per sekund, så fjerning av nevrotransmitter fra synapsen er viktig for at aksjonspotensialer kan skilles fra hverandre. Nevrotransmitter frisatt i synapsen gjenopptas for gjenbruk av spesialiserte transportproteiner, også kalt transportører. Disse er lokalisert på det presynaptiske nevronet eller på en omkringliggende gliacelle og kontrollerer varigheten av nevrotransmittersignalet. Frisatt nevrotransmitter blir også fjernet av enzymer i den synaptiske væsken eller diffunderer vekk fra synapsen. I tillegg til å binde seg til postsynaptiske reseptorer binder frisatt nevrotransmitter seg også til presynaptiske reseptorer kalt autoreseptorer. Disse er lokalisert i membranen til det presynaptiske nevronet og har som funksjon å overvåke og regulere mengde nevrotransmitter i synapsen gjennom feedbacksignaler til det presynaptiske nevronet (figur 2.1).
Effekt på mottakernevronet
Reseptorer er transmitterspesifikke ved at kun én type nevrotransmitter kan binde seg til dem. Imidlertid finnes det for hver transmittertype vanligvis flere undertyper av reseptorer de kan virke på, og som kan ha vidt forskjellige egenskaper. Den postsynaptiske effekten av en nevrotransmitter avhenger derfor av reseptorens egenskaper og hvilke prosesser som igangsettes postsynaptisk, og ikke av nevrotransmitteren i seg selv.
Transmitterbinding til reseptorer som direkte åpner ionekanaler
Ionotrope reseptorer (også kalt transmitterstyrte eller ligandstyrte) er en del av en ionekanal. Frisatt nevrotransmitter virker derfor direkte på ionekanalen. Ved nevrotransmitterbinding åpnes kanalen for én type ioner og fører enten til en eksitatorisk eller en inhibitorisk postsynaptisk effekt. Ionotrope reseptorer er raske og formidler kortvarig, eksplisitt informasjon fra ett nevron til et annet. Det finnes flere typer nevrotransmittere som har ionotrope reseptorer, og ett enkelt nevron kan bruke eller gjenkjenne flere transmittere.
Glutamat er den viktigste eksitatoriske nevrotransmitteren i nervesystemet. Over 90 % av hjernens nevroner benytter glutamat. Dette inkluderer alle sansesystemene unntatt nevronene som formidler smerte. Glutamat benyttes også av mange av de tallrike forbindelsene mellom nevroner i hjernen som danner
nettverk for hukommelse og språk. Det finnes to typer ionotrope glutamatreseptorer. AMPA-reseptorene åpner ionekanaler som slipper inn Na+ og depolariserer cellen (eksitatorisk postsynaptisk effekt (EPSP)). NMDA-reseptorene åpner også ionekanaler, men disse kanalene slipper i større grad inn kalsiumioner (Ca2+) enn natriumioner. Ca2+ fungerer som et intracellulært signalstoff slik at aktivering av NMDA-reseptorer fører til depolarisering av nevronet og samtidig igangsetter prosesser inne i nevronet.
Gamma-amino-smørsyre (GABA) er den viktigste inhibitoriske nevrotransmitteren i nervesystemet. Rundt 20 % av nevronene i hjernen benytter GABA. De fleste av disse er internevroner med funksjon å dempe eller avbryte eksitatorisk påvirkning fra andre nevroner. En annen inhibitorisk transmitter er glysin, som vi finner i ryggmargen og hjernestammen. Både GABA og glysin virker på klorkanaler som ved åpning slipper inn kloridioner, Cl-, og hyperpolariserer cellen. Den høye andelen av GABA-nevroner i hjernen understreker den fine balansen det er mellom eksitasjon og inhibisjon i nervesystemet. Epilepsi er en forstyrrelse av nettopp denne balansen som gir ukontrollert aktivitet (aksjonspotensialer) i hjernens nevroner. Acetylkolin (ACh) er den viktigste nevrotransmitteren i det parasympatiske nervesystemet som kontrollerer ikke-viljestyrt muskulatur som hjertet, blodårer og kjertler (se avsnittet «Nervesystemet hos mennesket – utvikling og grovinndeling»). ACh benyttes også av motornevroner for å aktivere muskler. Botulismebakterien, som finnes i bedervet mat og gir alvorlig matforgiftning, blokkerer frisetting av ACh og kan føre til muskellammelser og død. Den samme effekten utnyttes i produkter som Botox (botulinum toxin) for å lamme muskler som skaper naturlige linjer og rynker i huden, som panne, rundt øyne og munn. Slik behandling kan også påvirke mimikk nettopp fordi behandlingen lammer muskler. ACh finner vi også i sentralnervesystemet, hvor det har en modulerende effekt og er knyttet til flere ulike funksjoner (se avsnittet «Transmitterbinding til reseptorer som indirekte åpner ionekanaler»).
Transmitterbinding til reseptorer som indirekte åpner ionekanaler
Metabotrope reseptorer virker indirekte på ionekanaler via intracellulære prosesser og sekundære budbringere
som er ulike signalmolekyler inne i cellen. Aktivering av metabotrope reseptorer fører til en tregere og mer langvarig respons enn aktivering av ionotrope reseptorer. Metabotrope reseptorer formidler derfor ikke presis informasjon, men inngår som en del av flere systemer som modulerer aktivitet i hjernen.
Det finnes ulike slike modulerende systemer i hjernen. Flere av disse har et begrenset antall nevroner med cellelegemet lokalisert i hjernestammen og aksoner som forgrener seg over store deler av hjernen. Aktivering av disse modulerende systemene fører til at nevrotransmitter frisettes og uspesifikt «dusjes» over store deler av hjernen, og slik modulerer aktiviteten i mange andre nevroner som ved våkenhet versus søvn (se kapittel 9). De modulerende systemene har betydning for en rekke funksjoner, og i det følgende omtales noen av de mest sentrale.
Dopamin frisettes fra nevroner med cellelegemer i to små kjerner i hjernestammen – substantia nigra og det ventrale tegmentale området (VTA) (figur 2.3). Dopamin er knyttet til en rekke ulike funksjoner inkludert motorikk, motivasjon, aktivering (arousal), forsterkning og belønning. Flere ulike forstyrrelser er sannsynligvis knyttet til forstyrret dopaminfunksjon, inkludert Parkinsons sykdom (tap av nevroner i substantia nigra), schizofreni, Attention-Deficit/Hyperactivity disorder (AD/HD) og avhengighet (se kapittel 12).
Noradrenalin produseres av flere kjerner i hjernen, der den største kjernen heter locus coeruleus (figur 2.3) og er del av et større system som regulerer aktivering, våkenhet og søvn. Noradrenalin har som funksjon å aktivere hjerne og kropp for handling. Aktiviteten i de noradrenerge nevronene er derfor lav under søvn, moderat under våkenhet og høy ved stress eller farefylte situasjoner og som respons på oppmerksomhetsfangende stimuli. Noradrenalin er også involvert i læring og er i tillegg knyttet til angst- og humørforstyrrelser og depresjon (se kapittel 11).
Serotonin frisettes hovedsakelig fra nevroner lokalisert i rafekjernene i hjernestammen (figur 2.3 og avsnittet om hjernestammen). Serotoninsystemet er også knyttet til en rekke funksjoner, inkludert regulering av søvn, humør, kroppstemperatur, appetitt, læring og hukommelse. I tillegg er serotonin involvert i humørforstyrrelser og depresjon. Prozac benyttes blant annet ved behandling av depresjon og er en selektiv serotoninreopptakshemmer (selective serotonin reuptake
Noradrenalinsystemet
Neokorteks
Hypothalamus
Tinninglappen
Locus coeruleus
Dopaminsystemet
Pannelappen
Serotoninsystemet
Neokorteks
Thalamus
Basalgangliene
Thalamus
Ventralt tegmentalt område
Tinninglappen
Lillehjernen
Til ryggmargen
Striatum
Substantia nigra

Til ryggmargen

Hypothalamus Rafekjernene
Acetylkolinsystemet
Neokorteks
Lillehjernen
Til ryggmargen
Thalamus

Hippocampus
Bakhodelappen
Kolinerge kjerner
Til ryggmargen
serotoninsystemet, dopaminsystemet, og acetylkolinsystemet. Fra cellelegemer lokalisert i hjernestammen har disse systemene aksoner som forgrener seg over store deler av hjernen, og som ved aktivitet fører til at nevrotransmitter «dusjes» over store deler av hjernen og modulerer aktiviteten i mange andre nevroner (som ved f.eks. våkenhet eller søvn). Gjengitt med tillatelse av Brodal: Sentralnervesystemet, 5. utg. 2012, og bearbeidet av Magnolia Design.
inhibitor (SSRI)) som øker tilgjengeligheten av frisatt serotonin i hjernen gjennom å hindre reopptak.
Acetylkolin er nevrotransmitteren som benyttes for å aktivere muskler. I hjernen fungerer acetylkolin som en nevromodulator og er involvert i aktivering, våkenhet/ søvn, oppmerksomhet, læring og hukommelse, og er i tillegg involvert ved Alzheimers sykdom (figur 2.3).
Peptider er betegnelsen på en type signalmolekyler vi finner både i sentralnervesystemet, det perifere nervesystemet og i indre organer i kroppen. Peptider er større molekyler bygget opp av kjeder av aminosyrer. Peptider som virker lik en nevrotransmitter kalles nevropeptider, mens peptider med indirekte, modulerende, langvarig, og langtrekkende virkning kalles pep-
tidhormoner. Det finnes over 100 ulike nevropeptider som innvirker på og modulerer en mengde ulike funksjoner og systemer. Nevropeptid Y er knyttet til stressmestring og motstandsdyktighet og finnes i hjernestammen, hypothalamus, og det limbiske system (se kapittel 6). Substans P og enkefalin er to andre nevropeptider som er sentrale for henholdsvis smertesignalering og smertemodulering. Sistnevnte er et eksempel på en type nevropeptider som kalles endogene opioider eller endorfiner (se kapittel 4). Oreksin (også kalt hypokretin) produseres i hypothalamus og er et nevropeptid som i tillegg til å regulere appetitt også regulerer aktivering, våkenhet og søvn (se kapittel 9). Eksempler på peptidhormoner er kortikotropin-frigjørende hormon
ISBN
Mange lidelser har et biologisk grunnlag, men også tanker, følelser og atferd kan påvirke helse. Det er dette samspillet som er den røde tråden i denne læreboken.
Boken gir innsikt i ny forskning og kunnskap om sammenhenger mellom tanker og følelser på den ene siden, og fysiske reaksjoner og tilstander på den andre siden, for å bedre forstå en persons helsemessige tilstand. I tillegg tas det hensyn til sosioøkonomiske, miljømessige og kulturelle faktorer som familieforhold, arbeidsforhold og økonomi.
Forfatterne tilstreber å pirre nysgjerrigheten og redegjøre for en rekke fenomen, begreper og faguttrykk. Studenten bør ha en grunnforståelse av faget fra årsstudium/ grunnstudier. De fleste av kapitlene har beskrevet læringsmål som passer for flere helseprofesjoner i sin grunnutdannelse.
Målgruppen er studenter innen psykologi, medisin, biologi, og utdanninger som sykepleie, fysioterapi, ernæringsfysiologi og ernæringsbiologi.
ANNE MARITA MILDE er førsteamanuensis ved Institutt for biologisk og medisinsk psykologi, Universitetet i Bergen, psykologspesialist og forsker II ved NORCE, Bergen.
JANNE GRØNLI er somnolog og professor i biologisk psykologi ved Det psykologiske fakultet, Universitetet i Bergen.
MAGNE ARVE FLATEN er professor i biologisk psykologi og instituttleder ved Institutt for Psykologi ved NTNU.
De øvrige bidragsyterne presenteres i boken: Per Aslaksen, Jørgen G. Bramness, Espen Borgå Johansen, Rasmus Goll, Peter Holger Johnsen, Anita Hansen, Jan Haavik, Olga Therese Ousdal, Robert Murison, Espen Molden, Vigdis Solhaug og Silje Steinsbekk.