GENIE



Via www.diddit.be heb je toegang tot het onlineleerplatform bij GENIE Activeer je account aan de hand van de onderstaande code en accepteer de gebruiksvoorwaarden. Kies je ervoor om je aan te melden met je Smartschool-account, controleer dan zeker dat je e-mailadres aan dat account gekoppeld is. Zo kunnen we je optimaal ondersteunen.
LET OP: ACTIVEER DEZE LICENTIE PAS VANAF 1 SEPTEMBER; DE LICENTIEPERIODE START VANAF ACTIVATIE EN IS 365 DAGEN GELDIG.
!Fotokopieerapparaten zijn algemeen verspreid en vele mensen maken er haast onnadenkend gebruik van voor allerlei doeleinden. Jammer genoeg ontstaan boeken niet met hetzelfde gemak als kopieën. Boeken samenstellen kost veel inzet, tijd en geld. De vergoeding van de auteurs en van iedereen die bij het maken en verhandelen van boeken betrokken is, komt voort uit de verkoop van die boeken.
In België beschermt de auteurswet de rechten van deze mensen. Wanneer u van boeken of van gedeelten eruit zonder toestemming kopieën maakt, buiten de uitdrukkelijk bij wet bepaalde uitzonderingen, ontneemt u hen dus een stuk van die vergoeding. Daarom vragen auteurs en uitgevers u beschermde teksten niet zonder schriftelijke toestemming te kopiëren buiten de uitdrukkelijk bij wet bepaalde uitzonderingen. Verdere informatie over kopieerrechten en de wetgeving met betrekking tot reproductie vindt u op www.reprobel.be.
Ook voor het digitale lesmateriaal gelden deze voorwaarden. De licentie die toegang verleent tot dat materiaal is persoonlijk. Bij vermoeden van misbruik kan die gedeactiveerd worden. Meer informatie over de gebruiksvoorwaarden leest u op www.diddit.be.
© Uitgeverij VAN IN, Wommelgem, 2024
De uitgever heeft ernaar gestreefd de relevante auteursrechten te regelen volgens de wettelijke bepalingen. Wie desondanks meent zekere rechten te kunnen doen gelden, wordt verzocht zich tot de uitgever te wenden.
Credits
p. 98 elektronenmicroscoop © VUB, p. 111 elektrostatica © Imageselect, p. 177 handen © Alamy/Imageselect, p. 200 Atomium, © 2021 – www.atomium.be – SOFAM, p. 210 applet energievormen © CC BY PhET Interactive Simulations, University of Colorado Boulder, https://phet.colorado.edu, p. 217 applet coëfficiënten in reactievergelijking © CC BY PhET Interactive Simulations, University of Colorado Boulder, https://phet.colorado.edu, p. 218 reactie tussen waterstofgas en zuurstofgas © JavaLab.org, p. 233 Jeremias Richter © Alamy/Imageselect, p. 202 eigenschappen van metalen © www.metaalzoekworkshop.nl
Eerste druk, vierde bijdruk 2024
ISBN 978-90-306-9942-2
Vormgeving en ontwerp cover: Shtick
Tekeningen: Geert Verlinde, Tim Boers (Studio B) D/2021/0078/69
Zetwerk: Vrijdag Grafis, Barbara Vermeersch Art. 597489/05 NUR 126
1
` HOOFDSTUK 1: Wat zijn groepen en perioden in het periodiek systeem?
` HOOFDSTUK 2: Wat leren we uit de plaats van een element in het PSE?
1 De a-groepen en hun naam
2 Waarom lijken atomen graag op een edelgas?
3 Zijn er naast de massa en elektronenconfiguratie nog andere indelingen in het PSE?
` VERDIEPING: Welk belang en voorkomen hebben enkelvoudige stoffen?
` HOOFDSTUK 1: Zijn deeltjes in een verbinding altijd op eenzelfde manier gebonden?
1 Wat is het verschil tussen een binding en een verbinding?
2 Welke soorten bindingen bestaan er?
` HOOFDSTUK 2: Hoe wordt een ionbinding gevormd?
1 De ionbinding
2 De formule-eenheid van ionverbindingen
3 De neutraliteitsregel
` HOOFDSTUK 3: Hoe wordt een atoombinding gevormd?
1 De atoombinding
2 De molecuulformule van atoomverbindingen
` HOOFDSTUK 4: Hoe wordt een metaalbinding gevormd?
1 De metaalbinding
2 Verklaring van de eigenschappen
` HOOFDSTUK 1: Wat is een
` HOOFDSTUK 2: Hoe wordt een chemische reactie
` HOOFDSTUK 3: Welke types chemische reacties zijn er?
` HOOFDSTUK 4: Wat gebeurt er met de massa’s voor en na een chemische reactie?
` HOOFDSTUK 5: Welk nut hebben chemische reacties
LABO’S
` ONDERZOEK 1: Labotechnieken
` ONDERZOEK 2: Massadichtheid (virtueel)
` ONDERZOEK 3: Het smeltpunt van paraffine
` ONDERZOEK 4: De geleidbaarheid van stoffen
` ONDERZOEK 5: De oplosbaarheid van stoffen
` ONDERZOEK 6: Scheidingstechnieken
` ONDERZOEK 7: Scheidingsschema’s
` ONDERZOEK 8: Metalen herkennen
` ONDERZOEK 9: Chemisch of fysisch proces
` ONDERZOEK 10: Analyse en synthese
` ONDERZOEK 11: De wet van Lavoisier
` ONDERZOEK 12: Exotherm of endotherm
` ONDERZOEK 13: De reactie tussen azijn en staalwol
STEM-VAARDIGHEDEN (VADEMECUM)
METROLOGIE
• Grootheden en eenheden
• Machten van 10 en voorvoegsels
• Eenheden omzetten
• Nauwkeurig meten
• Afrondingsregels
• Formularium
STAPPENPLANNEN
• Grafieken tekenen
• NW stappenplan
OPLOSSINGSSTRATEGIE
• Formules omvormen
• Vraagstukken oplossen
• Grafieken lezen
CHEMISCHE CONVENTIES / HET PERIODIEK SYSTEEM VAN DE ELEMENTEN
• Te kennen elementen/symbolen
• Groepsnamen en periodenummers
• Index en coëfficiënt
• Reagentia en reactieproducten
LABO’S
• Labomaterialen
• Labotechnieken
• Veiligheidsvoorschriften
• H- en P-zinnen
SOORTEN BINDINGEN
SCHEIDINGSTECHNIEKEN

In de CHECK IN maak je kennis met het onderwerp van het thema. In het kadertje onderaan vind je een aantal vragen die je op het einde van het thema kunt beantwoorden.
In de verkenfase zul je merken dat je al wat kennis hebt over het onderwerp dat in het thema aan bod komt. Jouw voorkennis wordt hier geactiveerd.

Na het activeren van de voorkennis volgen een aantal hoofdstukken Een thema bestaat uit meerdere hoofdstukken. Doorheen de hoofdstukken verwerf je de nodige kennis en vaardigheden om uiteindelijk een antwoord te geven op de centrale vraag of het probleem uit de CHECK IN.
We vatten de kern van het thema voor je samen in de hoofdstuksynthese en themasynthese Vervolgens willen we graag dat je vorderingen maakt en dat je reflecteert op je taken en leert uit feedback. De checklist is een hulpmiddel om zelf zicht te krijgen of je de leerdoelen al dan niet onder de knie hebt.


In CHECK IT OUT pas je de vergaarde kennis en vaardigheden toe om terug te koppelen naar de vragen uit de CHECK IN.
In het onderdeel Aan de slag kun je verder oefenen. Je leerkracht beslist of je de oefeningen op het einde van het hoofdstuk maakt of doorheen de lessen.
` Per thema vind je op adaptieve oefenreeksen om te leerstof verder in te oefenen.
Ga zelf op onderzoek! Bij het onlinelesmateriaal staan een aantal labo’s om verder experimenten uit te voeren.
• In de linkermarge naast de theorie is er plaats om zelf notities te maken. Noteren tijdens de les helpt je om de leerstof actief te verwerken.
• Op vind je alternatieve versies van de themasynthese.
• Op vind je per themasynthese een kennisclip waarin we alles voor jou nog eens op een rijtje zetten.
In elk thema word je ondersteund met een aantal hulpmiddelen.
Kenniskader
We zetten doorheen het thema de belangrijkste zaken op een rijtje in deze rode kaders.
VEILIGHEIDSVOORSCHRIFT !
Met GENIE ga je zelf experimenteren en op onderzoek. Daarbij moet je natuurlijk een aantal veiligheidsvoorschriften respecteren. Die vind je terug in dit kader.
WEETJE
Een weetjeskader geeft extra verduidelijking of illustreert de leerstof met een extra voorbeeld.
OPDRACHT 11 DOORDENKER
Nood aan meer uitdaging? Doorheen een thema zijn er verschillende doordenkers.
Niet altijd even makkelijk om op te lossen, maar het proberen waard!
In de tipkaders vind je handige tips terug bij het uitvoeren van de onderzoeken of opdrachten.
Moeilijke woorden worden uitgelegd in een woordenlijst op . Die woorden springen extra in het oog door de stippellijn
Bij het onlinelesmateriaal vind je een vademecum Dat vademecum ̒een GENIE in STEM-vaardigheden omvat:
• stappenplannen om een grafiek te maken, opstellingen correct te bouwen, metingen uit te voeren …;
• stappenplannen om een goede onderzoeksvraag op te stellen, een hypothese te formuleren …;
• een overzicht van gevarensymbolen en P- en H-zinnen;
• een overzicht van grootheden en eenheden;
• een overzicht van labomateriaal en labotechnieken;
• …
Een e-book is de digitale versie van het leerschrift. Je kunt erin noteren, aantekeningen maken, zelf materiaal toevoegen ...

• De leerstof kun je inoefenen op jouw niveau.
• Je kunt vrij oefenen en de leerkracht kan ook voor jou oefeningen klaarzetten.
Hier vind je de opdrachten terug die de leerkracht voor jou heeft klaargezet.
Hier kan de leerkracht toetsen en taken voor jou klaarzetten.
Benieuwd hoever je al staat met oefenen en opdrachten? Hier vind je een helder overzicht van je resultaten.
Meer info over diddit vind je op https://www.vanin.diddit.be/nl/leerling.

• Hier vind je het lesmateriaal per thema.
• Alle instructiefilmpjes, kennisclips, demovideo’s en labo’s zijn ook hier verzameld.
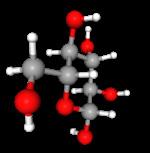
In de uitgave bieden we bovenop het beeldmateriaal verschillende 3D-beelden aan.
Denk maar aan een 3D-voorstelling van een deeltje glucose. Zo ervaar je wetenschappen op een heel nieuwe manier!
DOWNLOAD 3D-APP
fysicochemie biofysica natuurwetenschappen
biologie chemie
biochemie
De begrippen ‘chemie’ en ‘scheikunde’ worden weleens door elkaar gebruikt. In huis vind je heel wat ‘chemische’ producten. Maar wat betekent ‘chemie’ nu eigenlijk?
Wanneer je Wikipedia raadpleegt, vind je voor de term chemie de volgende definitie:
‘Scheikunde of chemie is een natuurwetenschap die zich richt op de studie van de samenstelling en bouw van stoffen, de chemische veranderingen die plaatsvinden onder bepaalde omstandigheden en de wetmatigheden die daaruit zijn af te leiden.’
Die definitie leert ons dat chemie en scheikunde eigenlijk synoniemen zijn. Al denk je bij de term scheikunde misschien eerder aan ‘de kunst van het scheiden’.
Chemie is sterk verwant met biologie en fysica. De takken van wetenschap die deze domeinen verbinden, zijn respectievelijk biochemie en fysicochemie.
• Biochemie onderzoekt onze stofwisselingsprocessen, voornamelijk bij moleculen van levende organismen.
• Fysicochemie verklaart verschillende mechanismen door onder andere de atoombouw te bestuderen.
Het is dus belangrijk dat je niet te veel in termen van aparte (school)vakken denkt, maar steeds de linken tussen wetenschappen legt. fysica
natuurwetenschappen
levende materie levenloze materie biologie chemie fysica
OPDRACHT 1
Waar denk jij aan bij het woord chemie?
Vul de mindmap aan. chemie
OPDRACHT 2
Welke van deze afbeeldingen sluit(en) het dichtst aan bij jouw beeld van chemie?
a Zet een kruisje bij de afbeelding(en).
b Bespreek je keuze daarna met je buur en tracht samen te bepalen wie gelijk heeft.












OPDRACHT 3
Scan de code en laat je meenemen in de wereld van chemie.
In het filmpje kwamen in een razendsnel tempo een aantal sectoren aan bod waarbij chemie een belangrijke rol speelt. We zetten ze even op een rijtje.
Geneeskunde
De geneesmiddelen- of farmaceutische industrie heeft een grote impact op ons dagelijks leven. Op zonnige dagen smeer je bijvoorbeeld zonnecrème om je huid te beschermen, je neemt een aspirine bij hevige hoofdpijn of je bent misschien gevaccineerd tegen COVID-19.
Landbouw en voeding
Onze voeding doorloopt heel wat processen voor ze op ons bord ligt. De opbrengst van een oogst hangt namelijk meestal voor een groot stuk af van chemische producten die de gewassen beschermen, het rijpingsproces controleren enzovoort.
Bouwsector
Iedereen wil het tijdens de koude wintermaanden lekker warm hebben binnen. En dat kan! De chemische industrie levert niet alleen brandstoffen om je huis te verwarmen, maar ontwikkelt ook isolatiematerialen om de warmte binnen te houden.
Energie
Wist je dat het zoeken naar hernieuwbare energiebronnen ook onderdeel is van chemisch onderzoek? Misschien rijden we straks met zijn allen op waterstof, geproduceerd via elektrolyse en gebruikt in brandstofcellen.




Verzorging en hygiëne
De cosmetica- en parfumindustrie genereert wereldwijd een enorme omzet. Ongetwijfeld gebruik je regelmatig shampoo, zeep, tandpasta, deodorant … Ook dat zijn creaties van de chemische sector. Met de nieuwste ‘nanotechnologie’ worden producten voortdurend verbeterd.
Textiel
Draag je een jeans of een T-shirt? De kans is groot dat je in feite kunststoffen draagt, door de mens vervaardigd uit polymeren. Polymeren zijn lange moleculen opgebouwd uit kleine bouwsteentjes. Nylon is bijvoorbeeld een polymeer en bestaat al sinds 1938. Ook het kleuren van textiel is een chemisch proces.


OPDRACHT 3 (VERVOLG)
Kunststoffen
Naast polymeren (zoals nylon of polyester) gebruiken we nog honderden andere kunststoffen voor alledaagse voorwerpen. Het recycleren van die kunststoffen is een belangrijke sector in de chemie. Vele soorten kunststoffen zijn moeilijk afbreekbaar in de natuur. Gooi flesjes en dergelijke dus nooit zomaar weg in de natuur. Bij correcte inzameling maakt de chemiesector er misschien nog een zitbank van.
Milieubeheer
Vandaag staat de chemiesector voor zijn grootste uitdaging: duurzame en hernieuwbare materialen ontwikkelen en zoeken naar alternatieve bronnen van energie. Naast hernieuwbare en niet-vervuilende energie is ook zuiver water van het grootste belang voor de toekomst.


Chemie of scheikunde bracht dankzij onderzoek en ontdekkingen doorheen de tijd veel welvaart. De homo sapiens wist al dat hij met vuur voedsel kon garen. De Egyptenaren leerden ons de kunst van het metaal bewerken. Eeuwen later zou de kunststoffenindustrie zorgen voor kwalitatieve en goedkope oplossingen, door zeldzame materialen te vervangen en materialen te maken met verbeterde eigenschappen: denk maar aan de composietmaterialen die de tandarts nu gebruikt; gouden tanden zijn niet meer van deze tijd.
Chemische bedrijven hebben soms een slechte reputatie. Toch blijven we gretig allerlei producten van de chemiesector gebruiken voor ons comfort: auto’s, tv’s, computers, huishoudapparaten, wegwerpartikelen … We willen het mooiste fruit uit alle streken van de wereld, maar hebben tegelijkertijd ook een afkeer van insecticiden en bewaarmiddelen.
We worden inderdaad geconfronteerd met grote milieuproblemen. Niet alle chemische bedrijven evolueren tot schone, duurzame ondernemingen. Maar alleen door chemie te bestuderen, zullen we deze kwesties beter begrijpen. De wetenschap kan ons helpen om onze problemen aan te pakken en welvarend te blijven leven.
Scheikunde en chemie zijn synoniemen. Chemie speelt een belangrijke rol in ons leven en onze maatschappij. Geneeskunde, landbouw en voeding, bouw, energie, verzorging en hygiëne, kunststoffen en milieubeheer zijn allemaal in mindere of meerdere mate chemische sectoren.

Wat op school gebeurt in een labo, doet de industrie op grote schaal. Ze gebruiken en stockeren chemische stoffen volgens de richtlijnen die vanuit de overheid worden opgelegd. Hoewel er heel wat veiligheidsmaatregelen zijn, loopt er toch soms iets mis. Zo ontplofte in 1976 in Italië een chemische fabriek en kwamen er giftige dampen in het nabijgelegen stadje Seveso terecht.
In de video zie je hoe de ramp kon gebeuren en welke lessen eruit getrokken werden.
De overheid houdt een overzicht bij van alle bedrijven in België die gevaarlijke stoffen produceren, behandelen of transformeren: de Sevesobedrijven.
1 Scan de QR-code en zoek via de website op welke Sevesobedrijven bij jou in de buurt liggen.
Noteer ze hier.
2 De vier grootste gevaren voor de bevolking in de directe omgeving van een Sevesobedrijf zijn vastgelegd in vier veiligheidspictogrammen. Welke van de onderstaande pictogrammen zijn dat?
Ga op zoek op de website en kruis aan.
In het labo is het ook belangrijk om op te letten tijdens het uitvoeren van een proef.
` Wie of wat moet je beschermen?
` Welke veiligheidspictogrammen kun je in een labo op school terugvinden?
` Welke veiligheidsmaatregelen moet je in een labo op school respecteren?
OPDRACHT 1
Welke gevaren loop jij bij je thuis?
Waarom wordt er in reclame over huishoudproducten vermeld dat je ze buiten het bereik van kinderen moet houden?
Waarom zijn die producten zo gevaarlijk en hoe kunnen we dat gevaar beter inschatten?

1 Je leerkracht laat vijf chemische producten zien die je ook thuis kunt terugvinden, bijvoorbeeld producten om te poetsen, om te wassen of af te wassen, te koken, te tuinieren of jezelf te verzorgen. Bekijk de producten en de etiketten aandachtig.
2 Beantwoord de vragen.
a Welke pictogrammen vind je terug op de verpakkingen? Zet telkens een kruisje onder het pictogram per keer dat je het tegenkomt op een verpakking.
andere producteigen pictogrammen
b Op het etiket lees je niet alleen de ingrediënten van het product, je vindt er ook terug wat er mis kan lopen bij fout gebruik. Geef per product één voorbeeld van wat er mis kan gaan.
1 2 3 4 5
Lees altijd goed de etiketten en veiligheidspictogrammen van een product. De producten die je in huis gebruikt, kunnen gevaarlijker zijn dan je denkt. Kijk maar wat er met de ontstopper gebeurt in de video.
Om het etiket leesbaar te houden, is het belangrijk om tijdens het gieten het etiket naar je handpalm te richten. Zo kunnen eventuele druppels niet op het etiket terechtkomen en het etiket onleesbaar maken.
c Vaak zorgen de producenten ook voor een veilige sluiting, een kinderslot genoemd. Hoeveel van de producten die je bekijkt hebben een speciale dop of deksel?

Dikwijls lees je op een verpakking ook iets over het Antigifcentrum. Dat is een dienst die je kunt bellen als er iets misgelopen is met een product. Zij kunnen je vertellen hoe je dan het best reageert.
Het gratis nummer voor het Antigifcentrum is 070 245 245. Je kunt ook steeds terecht op hun website.
LEERDOELEN
Je kunt al:

L de gevaren inschatten bij het werken met chemische producten;
L jezelf en je omgeving beschermen voor gevaren;
L bewust omgaan met stoffen en hun gevaren en zo een veilige omgeving creëren.
Je leert nu:
L de veiligheidsmaatregelen in een labo kennen en juist toepassen;
L de meest gebruikte labomaterialen benoemen en hun functie beschrijven;
L een chemisch etiket lezen en naar de betekenis handelen;
L de veiligheidspictogrammen interpreteren en bespreken;
L de werking en het nut van H- en P-zinnen interpreteren en bespreken;
L de onderdelen van een verslag begrijpen en toepassen.
OPDRACHT 4
Hoe ziet mijn labolokaal eruit?
1 Loop rond in het labolokaal en kruis aan welke materialen je ziet. Ontbreekt er iets? Vul dan gerust het lijstje aan.
EHBO-kistje
branddeken
handblusser
gaskranen
nooddouche
oogdouche
trekkast
aparte eilanden
beschermende kledij: labojas, labobril, handschoenen
brandblusser met label: A/B/C/D/E/F
waterkranen
noodstop
aangepast tafelblad
In het labo kun je heel wat extra (veiligheids)materialen of voorwerpen terugvinden die je niet in een ander klaslokaal ziet. Ze zorgen ervoor dat je kunt werken in een veilige omgeving. Raadpleeg zeker altijd het reglement vóór het uitvoeren van een labo, zodat je altijd veilig te werk kunt gaan.
OPDRACHT 4 (VERVOLG)






2 Overloop met je leerkracht de toepassingen of het gebruik van de materialen die je hebt teruggevonden.
OPDRACHT 5
Hoe blus je veilig een brand?
1 Aan welke drie voorwaarden moet voldaan zijn opdat een brand kan ontstaan? Overleg met je klasgenoten. Vul de branddriehoek aan.
OPDRACHT 5 (VERVOLG)
2 Bekijk het filmpje over de soorten brandblussers en hun toepassingen.
Vul de tabel aan.
Brandklasse Brandend materiaal Te gebruiken brandblussers





3 Welke aspecten van de branddriehoek neem je weg als je een brandblusser gebruikt?
VEILIGHEIDSVOORSCHRIFT !
Er zijn ook foute blusmethodes. Zo kan het blussen van een vetbrand met water resulteren in vuurspatten en steekvlammen.
Denk dus goed na voor je aan het blussen gaat. Een vetbrand moet je altijd blussen met een vochtige doek.
Er zijn verschillende materialen in een labolokaal, elk met hun eigen gebruiksaanwijzing. Bij twijfel over correct gebruik spreek je de leerkracht aan.
` Maak oefening 1 op p. 41.
Op een chemisch product zit een etiket, net als bij een voedingsproduct. Op een fles cola vind je bijvoorbeeld de hoeveelheid suikers of vetten. Voor een chemisch product hebben we meer specifieke informatie nodig. Het etiket geeft dan de richtlijnen weer die aangeven hoe je veilig kunt werken met de stof.
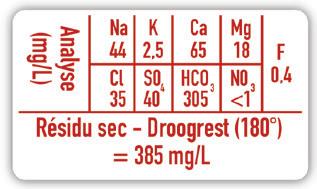
Bekijk op afbeelding 7 wat er allemaal op een chemisch etiket terug te vinden is.
Elke chemische stof heeft zowel een naam als een formule. Op het etiket kun je de beide terugvinden, evenals een referentienummer (CAS) waaronder je de stof in elke databank terugvindt.
Veiligheidspictogrammen zijn universeel, je vindt ze ook terug in andere landen. Dat kan omdat ze visueel zijn, je hoeft de taal niet te spreken om de symbolen te kunnen begrijpen.
Afb. 7 Chemisch etiket
Natriumhydroxide NaOH
CAS 1310-73-2
Gevaar
H314 veroorzaakt ernstige brandwonden en oogletsel P 280.1+3-301+330+331-305+338 Beschermende handschoenen en oogbescherming dragen. NA INSLIKKEN: de mond spoelen. GEEN braken opwekken. BIJ CONTACT MET DE OGEN: voorzichtig afspoelen met water gedurende een aantal minuten; contactlenzen verwijderen indien mogelijk; blijven spoelen.
WGK1 M r : 40
Op een etiket kun je ook de WGK-code terugvinden. Die geeft aan hoe gevaarlijk een stof is als je ze zou lozen in de gootsteen. ‘WGK’ is een Duitse afkorting die je in het Nederlands kunt vertalen met ‘watergevarenklassen’. In het labo moeten we gevaarlijke stoffen dus apart inzamelen.
Signaalwoorden geven in het kort aan wat het grootste gevaar van de stof is.
H- en P-zinnen zijn zinnen die aangeven wat de gevaren zijn van het werken met een stof, of welke voorzorgsmaatregelen je moet nemen.
OPDRACHT 6
Waarvoor staan de letters H en P op een chemisch etiket?
1 Zoek op het internet op waarvoor de letter H staat in H-zinnen.
a Noteer de Engelse term:
b Vertaal die term naar het Nederlands:
c Welke van de volgende zinnen geeft een gevaar weer en zou dus een H-zin kunnen zijn?
Kan irritatie aan de luchtwegen veroorzaken
Niet in de buurt van een vlam brengen
Op een koude plaats bewaren
2 Zoek op het internet op waarvoor de letter P staat in P-zinnen.
a Noteer de Engelse term:
b Vertaal die term naar het Nederlands:
c Welke van de volgende zinnen geeft een veiligheidsmaatregel weer en zou dus een P-zin kunnen zijn?
Kan irritatie aan de luchtwegen veroorzaken
Niet in de buurt van een vlam brengen
Op een koude plaats bewaren
3 Scan de QR-code en ontdek de betekenis van alle H- en P-zinnen.
OPDRACHT 7
Wat betekenen de chemische veiligheidspictogrammen?
Vul de tabel aan door de correcte benaming te linken aan het veiligheidspictogram en de verklaring.
Kies uit:
corrosieve of bijtende stof – giftige stof – houder onder druk – lange termijn gezondheidsgevaarlijk –ontplofbare of explosieve stof – ontvlambare stof – oxiderende of brand bevorderende stof –schadelijke stof – schadelijk voor het (aquatische) milieu
Betekenis
1
2
3
Verklaring Dit zijn explosieve stoffen. Ze kunnen op verschillende manieren tot ontploffing gebracht worden.
Betekenis
Verklaring Deze stoffen worden onder een verhoogde druk opgeslagen.
Betekenis
Verklaring Deze stoffen zijn giftig, de manier van opname kan verschillen. Zo kun je de stof via de huid binnenkrijgen, via de neus ...
4
Betekenis
Verklaring Deze stoffen bevorderen brand.
5
Betekenis
Verklaring Deze stoffen zijn schadelijk voor het milieu en moeten na gebruik op de correcte manier verwerkt worden.
Betekenis
6
Verklaring Deze bijtende stof kan ernstige brandwonden veroorzaken.
Betekenis
7
8
9
Verklaring Deze stoffen zullen in de nabijheid van een vlam snel ontbranden.
Betekenis
Verklaring Deze stof brengt een gevaar met zich mee, bekijk de H- en P-zinnen voor verduidelijking.
Betekenis
Verklaring Deze stoffen veroorzaken schade op lange termijn (kankerverwekkend, giftig, beïnvloeden de vruchtbaarheid ...).
Let op met giftige stoffen! Het gif van sommige slangen kan je binnen een paar minuten doden, andere gifstoffen hebben pas na maanden effect. Soms is het zelfs raadzaam om zeer kleine dosissen gif in te nemen; denk maar aan chemotherapie. Vandaar dat de graad van giftigheid vaak wordt aangeduid met afkortingen:
• N.E.L. No Effect Level: de dosis die eigenlijk geen effect heeft
• L.D. Lethal Dosis: de dosis die zeker dodelijk is
• T.I. Therapeutische inname: de dosis die je mag innemen op voorschrift van de arts
Het is belangrijk om een chemisch etiket te kunnen lezen. Zo kun je ook veilig omgaan met de stof.
Op het etiket kun je de volgende onderdelen terugvinden:
• naam en formule van de stof,
• veiligheidspictogrammen,
• signaalwoorden,
• H- en P-zinnen,
• WGK-code.
De gevarenpictogrammen moet je kunnen herkennen en je moet weten hoe je ernaar moet handelen.
De H- en P-zinnen moet je kunnen opzoeken en ernaar handelen.
` Maak oefening 2 en 3 op p. 41.
In het labo vind je heel wat soorten materialen die je nodig hebt om proeven uit te voeren. Het is belangrijk dat je weet over welk materiaal er gesproken wordt tijdens een labo. Daarom moet je de namen van de labomaterialen goed kennen.
OPDRACHT 8
Wat zijn de namen van de meest gebruikte labomaterialen?
1 Hieronder zie je het meestgebruikte materialen in een chemielokaal. Noteer de juiste naam van het labomateriaal bij de afbeelding.
afzuigerlenmeyer – balans – büchnertrechter – bunsenbrander – buret – draadnet – driepikkel –dubbele noot – erlenmeyer – gegradueerde pipet – horlogeglas – kookkolf – kroestang – liebigkoeler –maatbeker – maatcilinder – maatkolf – mortier en stamper – petrischaaltje – pijpaardendriehoek –pipetzuiger – pipetteerballon – proefbuis – proefbuisborstel – proefbuisklem – scheitrechter – spatel –spuitfles – statief – statiefklem – statiefring – thermometer – toestel van Hoffman – trechter –verbrandingskroes – verbrandingslepel – vigreuxkolom – volpipet – weegschuitje






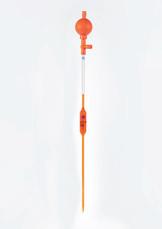


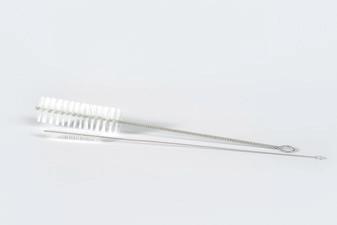













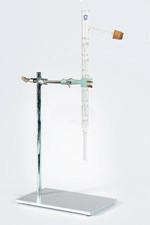















2 Ontdek via de ontdekplaat bij het onlinelesmateriaal de verschillende materialen en hun toepassing.

Een olifant weeg je niet met een keukenweegschaal, een scheutje azijn meet je niet af met een emmer. Om een zo precies mogelijke meting te doen, neem je een meetinstrument dat zo nauw mogelijk aansluit bij de hoeveelheid (kwantiteit) die je nodig hebt. Net daarom zijn er maatcilinders en maatkolven beschikbaar in verschillende groottes, die telkens zeer precies gegradueerd zijn. Om een welbepaald volume vloeistof precies te meten gebruiken we geen maatbekers of erlenmeyers, maar wel maatkolven. Maatkolven hebben slechts één maatstreepje, maar zijn het meest precieze glaswerk om één bepaald volume vloeistof af te meten. Het is aan jou om de juiste maatkolf te kiezen (100 mL, 250 mL, 500 mL, 1 L …).
Om een labo correct en veilig uit te voeren, moet je de namen en de toepassingen van labomaterialen kennen. Laat de keuze van het materiaal afhangen van de hoeveelheid stof die je nodig hebt en kies het juiste materiaal.
` Maak oefening 4 op p. 42.
Om een labo correct uit te voeren, moet je je voldoende voorbereiden voor de start. Tijdens het labo moet je alles goed noteren, nadien schrijf je een duidelijk verslag. We zetten alles op een rijtje.



1 Voor de start van het labo:
• Onderzoeksvraag formuleren
• Hypothese stellen indien mogelijk
• Nagaan of je alle materialen herkent
• Veiligheid van de chemische producten bekijken/opzoeken
• Nalezen en de werkwijze begrijpen
• Nagaan welke waarnemingen je zeker moet noteren
2 Tijdens het labo:
• Alle benodigdheden nemen
• Proefopstelling maken indien nodig
• Uitvoeren werkwijze
• Waarnemingen noteren
• Opruimen
3 Na het labo:
• Chemisch afval verwijderen volgens opgelegde richtlijnen
• Berekeningen maken
• Besluiten trekken
• Kijken of je besluit overeenstemt met je eventuele hypothese
• Reflecteren over je eigen labowerk, je resultaten en je voorbereiding
• Verslag inleveren
OPDRACHT 9
Hoe ga je veilig te werk?
1 Waarom is een laboreglement belangrijk en wat houdt het in? Bekijk het filmpje.
2 Om te werken in een labo moet je vertrekken van goede afspraken. Die maak je samen met je leerkracht in een contract. Lees het contract na. Vul aan met de schoolgebonden regels en onderteken het voor akkoord.
Als leerling verbind ik mij ertoe om de volgende regels altijd toe te passen in het labo. Bij fouten tegen deze regels weet ik dat er gevolgen zijn voor mijn veiligheid en die van anderen rondom mij.






Ik draag steeds het juiste beschermingsmateriaal op de juiste manier: labojas dichtgeknoopt, veiligheidsbril op de neus, handschoenen indien nodig.
Losse haren bind ik samen.
Mijn labotafel is altijd ordelijk.
In het labo houd ik de doorgang vrij en leg ik alle onnodige materialen, zoals mijn boekentas, op de daartoe voorziene plaats.
Ik gedraag me steeds rustig, blijf zo veel mogelijk aan mijn werkbank en speel niet in het labo.
Ik neem geen materialen of stoffen mee uit het labo.
Eten of drinken doe ik niet in een labolokaal.
Als er iets misloopt, haal ik er meteen de leerkracht bij.
Ik giet een gebruikte stof nooit terug in de fles, maar verwerk ze als afval.
Wanneer ik aan een stof ruik, doe ik dat steeds op de correcte manier, door te wuiven.
Klaar met de proef? Dan maak ik alles schoon, berg alles correct op en was mijn handen grondig.
Ik kom steeds goed voorbereid naar het practicum.
Ik ken de brandprocedure en weet hoe ik moet reageren bij brand.
Als leerling van deze klas verklaar ik me tijdens een labo altijd te houden aan de bovenstaande regels. Ik respecteer de extra maatregelen die in mijn school genomen worden.
Datum, Naam en handtekening,
LEERDOELEN
Je kunt al:

L enkele toepassingen van labomaterialen in het dagelijks leven geven; bv. een balans, een trechter , een maatkolf …
L het belang om veilig te werk te gaan in een labo begrijpen.
Je leert nu:
L correct werken met een bunsenbrander;
L correct werken met een balans;
L correct werken met een trechter en filtreerpapier;
L correct het vloeistofniveau in glaswerk aflezen.
1 De bunsenbrander
OPDRACHT 10
Welke onderdelen heeft een bunsenbrander?
In dit hoofdstuk gaan we dieper in op enkele vaak gebruikte labotechnieken. Die technieken ga je doorheen de jaren nodig hebben om proeven uit te voeren. Ben je tijdens het uitvoeren vergeten hoe je een bunsenbrander gebruikt of hoe je een filter moet plooien? Dan kun je dat hier terugvinden.
Op afbeelding 8 zie je een bunsenbrander. Noteer de verschillende onderdelen op de juiste plaats.
Kies uit:
gasregelaar – gasslang (gastoevoer) – inkomend gas – inkomende lucht – luchtinlaat – schouw – voet
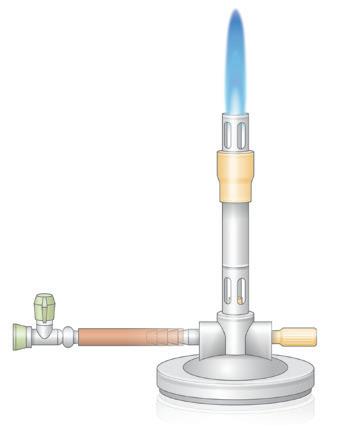
OPDRACHT 11
Hoe steek je een bunsenbrander aan?
De volgorde van het aansteken van een bunsenbrander is van groot belang voor de veiligheid.
1 Bekijk de instructievideo.
2 Rangschik de stappen in de juiste volgorde.
Lucifer aansteken en bovenaan naast de schouw houden.
Gastoevoer en luchtinlaat sluiten. Gasregelaar openen (als die aanwezig is).
AANSTEKEN BUNSENBRANDER
Hoogte van de vlam afstellen door aan de gastoevoer te draaien, of de gastoevoer volledig openzetten (volgens instructie van de leerkracht).
De lucifer voldoende hoog boven de gasmond houden, zodat hij niet wordt uitgeblazen door de gasstroom.
Gasslang aansluiten op de gastoevoer.
Gaskraan opendraaien.
Luchtinlaat opendraaien tot de gewenste vlam bekomen wordt.
OPDRACHT 12
Welke vorm en kleur heeft de vlam van een bunsenbrander?
1 In het filmpje uit opdracht 9 zie je dat de vlam uit meerdere kleurschakeringen en vormen bestaat, afhankelijk van de luchttoevoer. Teken de vlam die je kunt zien, houd rekening met de verschillende kleuren.
Luchttoevoer dicht
Hoe ziet de vlam eruit?
Luchttoevoer open
Hoe ziet de vlam eruit?
2 De ruisende vlam kun je gebruiken om stoffen te verwarmen. Wat is het warmste deel van de vlam?
Zet een kruisje op je tekening.
OPDRACHT 13 DOORDENKER
Waarom kun je een wapperende vlam het best niet gebruiken om een stof te verwarmen? Leg uit.
WEETJE
De termen ‘massa’ en ‘gewicht’ worden in het dagelijks leven door elkaar gehaald.
• Massa is een hoeveelheid stof en heeft als eenheid kilogram.
• Gewicht is een maat voor de aantrekkingskracht op een massa en heeft als eenheid newton.
Om verwarring te vermijden, gebruiken we in de wetenschap de term ‘balans’ in plaats van ‘weegschaal’.
Veilig omgaan met een bunsenbrander:
• Draag een veiligheidsbril en bind losse haren samen, zo voorkom je dat ze in de vlam terechtkomen.
• Verwarm niet onder aan een proefbuis, maar op de oppervlakte van de vloeistof. Zo kun je wegspatten voorkomen.
• Richt de opening van de proefbuis weg van jezelf of anderen, zo komen eventuele spatten niet op jezelf of je buur terecht.
• Neem het glaswerk steeds vast met een tang of klem en niet met je hand; glaswerk wordt geleidelijk warm tijdens het verwarmen.
• Ben je klaar met de proef? Opgelet, het glaswerk is nog warm!
• Laat een bunsenbrander nooit langer branden dan nodig. VEILIGHEIDSVOORSCHRIFT
Je kunt de onderdelen van een bunsenbrander benoemen. Ook weet je welke stappen je moet ondernemen om een bunsenbrander aan te steken, op welke manier je de bunsenbrander voor welke toepassing kunt gebruiken en hoe je er veilig mee moet omgaan.
Een weegschaal kent veel toepassingen. Denk maar aan de weegschaal in de badkamer om jezelf te wegen, of de weegschaal in de keuken waarmee je bloem kunt afwegen. Je kunt die weegschalen natuurlijk niet zomaar door elkaar gebruiken.
Elke weegschaal heeft een zeker meetbereik. Personenweegschalen kunnen tot op 0,1 kg meten, de keukenweegschaal kan tot wel 0,0001 kg (ofwel 0,1 g).
In de wetenschappen gebruiken we de term ‘balans’ in plaats van ‘weegschaal’. In het labo moeten we heel kleine hoeveelheden afwegen. Vaak zijn er balansen met verschillende gevoeligheden aanwezig. Je kiest de balans naargelang de massa die je nodig hebt.
Hoe gebruik je een balans?
• Kijk na of de balans volledig schoon is. Is dat niet het geval, verwijder dan eerst de resten met een borsteltje.
• Zet de balans aan.
• Neem een weegschuitje en leg het op de balans.
• Breng de geregistreerde massa op nul door het weegschuitje te tarreren.
• Breng de af te wegen stof in het weegschuitje.
• Heb je naast het schuitje gemorst? Veeg op met het borsteltje.
• Wacht tot de balans aangeeft dat de weging compleet is.
• Noteer de massa.
• Schakel de balans uit en zorg dat je ze schoon achterlaat.
Bekijk de instructievideo.
Je kunt de balans correct gebruiken.
Om te filtreren met filtreerpapier moet je de filter op een correcte manier gebruiken.
Bekijk de instructievideo.


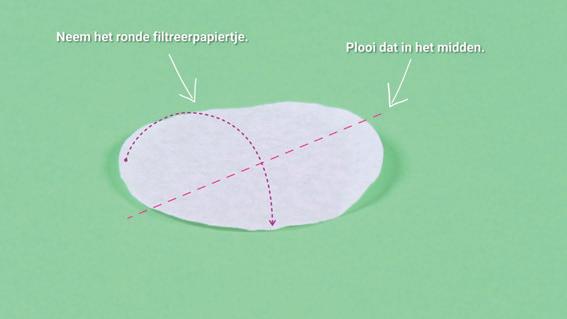




Om het papier beter te hechten aan de trechter kun je hem een beetje nat maken.
Je weet hoe je een filtreerpapier vouwt en hoe je het bevestigt in een trechter.
Het vloeistofniveau lees je af via de meniscus. Dat is de naam van het grensvlak tussen de vloeistof en de lucht. Op afbeelding 9 zie je een voorbeeld.
Het vloeistofpeil is vaak geen rechte lijn. Afhankelijk van de krachten die spelen in de vloeistof, zal het vloeistofoppervlak een kromming naar boven of beneden maken. Je moet het vloeistofniveau steeds aflezen op de bodem van het kommetje of op de top van het bolletje. Daarbij is het belangrijk om het glaswerk op ooghoogte te brengen. Doe je dat niet, dan maak je een fout bij het aflezen.
OPDRACHT 12
ONDERZOEK
hoogte
Afb. 9
Aflezen vloeistofniveau in glaswerk via de meniscus
Je kunt het vloeistofniveau in glaswerk op een correcte manier aflezen door steeds op ooghoogte te werken en rekening te houden met de meniscus.
` Maak oefening 5 op p. 42.
Ontdek nu zelf enkele labotechnieken.
Voer het labo uit. Je vindt het bij het onlinelesmateriaal.
de betekenis van H- en P-zinnen
Als leerling verbind ik mij ertoe om de volgende regels altijd toe te passen in het labo. Bij fouten tegen deze regels weet ik dat er gevolgen zijn voor mijn veiligheid en die van anderen rondom mij.
Ik draag steeds het juiste beschermingsmateriaal op de juiste manier: labojas dichtgeknoopt, veiligheidsbril op de neus, handschoenen indien nodig. Losse haren bind ik samen.
Mijn labotafel is altijd ordelijk.
In het labo houd ik de doorgang vrij en leg ik alle onnodige materialen, zoals mijn boekentas, op de daartoe voorziene plaats.
Ik gedraag me steeds rustig, blijf zo veel mogelijk aan mijn werkbank en speel niet in het labo.
Ik neem geen materialen of stoffen mee uit het labo.
Eten of drinken doe ik niet in een labolokaal.
Als er iets misloopt, haal ik er meteen de leerkracht bij.
Ik giet een gebruikte stof nooit terug in de fles, maar verwerk ze als afval.
Wanneer ik aan een stof ruik, doe ik dat steeds op de correcte manier, door te wuiven. Klaar met de proef? Dan maak ik alles schoon, berg alles correct op en was mijn handen grondig.
Ik kom steeds goed voorbereid naar het practicum.
Ik ken de brandprocedure en weet hoe ik moet reageren bij brand.
Als leerling van deze klas verklaar ik me tijdens een labo altijd te houden aan de bovenstaande regels.
Ik respecteer de extra maatregelen die in mijn school genomen worden.
Datum,
Naam en handtekening,
zie p. 32
de naam en toepassingen van het labomateriaal
TOEPASSINGEN LABOMATERIAAL
om veilig in een labo te werken ken/kan ik:
de veiligheidspictogrammen de basishandelingen

DE
het laboverloop het chemisch etiket lezen
1 Begripskennis
• Ik kan de algemene regels binnen een labo opsommen.
• Ik kan de verschillende veiligheidsmaterialen in een lokaal benoemen en de functie bespreken.
• Ik kan de verschillende onderdelen van een chemisch etiket herkennen en de informatie gebruiken om veilig te werken in een labo.
• Ik herken de veiligheidspictogrammen en weet hoe ernaar te handelen.
• Ik kan de H- en P-zinnen opzoeken, interpreteren en ernaar handelen.
• Ik weet hoe een labo verloopt.
• Ik weet dat een labo afval met zich meebrengt en verwerk dat op een correcte manier.
• Ik kan de verschillende onderdelen van een bunsenbrander benoemen.
• Ik kan de stappen om een bunsenbrander aan te steken in de juiste volgorde opsommen.
• Ik kan de verschillende vlammen van een bunsenbrander benoemen en de warmste plek aangeven.
2 Onderzoeksvaardigheden
• Ik kan een bunsenbrander aansteken.
• Ik kan een balans gebruiken.
• Ik kan werken met trechter en filtreerpapier.
• Ik kan het vloeistofniveau in glaswerk correct aflezen.
` Je kunt deze checklist ook op invullen bij je Portfolio.
JANOG OEFENEN
Bekijk de tekening en geef aan wat er misloopt in het labo. Waarom is dat gevaarlijk?

In Sevesobedrijven houdt de regering vooral toezicht op de gevaren voor de wijde omgeving: de mogelijkheid tot ontploffing en brand, het vrijkomen van giftige dampen en de gevaren voor het milieu. In het labo houden we rekening met alle veiligheidspictogrammen.
In het labo moet je niet enkel rekening houden met de wijde omgeving, maar ook met gevaren voor jezelf, je klasgenoten, de leerkracht, het klaslokaal, de school ... Het is dan ook belangrijk dat je je bewust bent van de gevaren. Door het stellen van regels en wetten, zoals de overheid doet voor Sevesobedrijven, blijven we mogelijke ongevallen een stapje voor.
Tot welke brandklassen behoren de voorbeelden van branden die in een chemisch labo kunnen ontstaan? Welke brandblusser zou je gebruiken?
Soort brand Brandklasse Brandblusser natrium
het gas dat je gebruikt om je bunsenbrander aan te steken (aardgas)
alcohol
olie in een oliebad
Geef aan of de zinnen H- of P-zinnen zijn.
Gevaar voor massa-explosie bij brand.
Beschermende kledij dragen.
In contact met water komen ontvlambare gassen vrij die spontaan kunnen ontbranden.
Schadelijk bij inslikken, bij contact met de huid en bij inademing.
Koel bewaren.
Explosieveilige elektrische/ventilatie-/verlichtings-/... apparatuur gebruiken.
Welke veiligheidspictogrammen kun je linken aan de H- en P-zinnen?
Zin
Giftig bij inslikken, bij contact met de huid en bij inademing.
Kan mogelijk de vruchtbaarheid of het ongeboren kind schaden.
Kan irritatie van de luchtwegen veroorzaken.
Giftig voor in het water levende organismen, met langdurige gevolgen.
Verwijderd houden van warmte/vonken/open vuur/ hete oppervlakken en andere ontstekingsbronnen.Niet roken.
Veroorzaakt ernstige brandwonden en oogletsels.
Bijbehorend pictogram
Welke labomaterialen zou je gebruiken om …
a te voorkomen dat je morst tijden het mengen van vloeistoffen?
b exact 10 mL van een vloeistof te nemen?
c damp te condenseren naar een vloeistof?
d vaste fosfor te verbranden boven een bunsenbrander?
e vloeistof te koken boven een bunsenbrander?
f een verbrandingskroes boven een bunsenbrander te houden?
g een proefbuis boven een bunsenbrander te houden?
Hoeveel water zit er in de maatcilinder? Bekijk de afbeelding, teken de stippellijn van de afleeshoogte en noteer het aantal mL in de maatcilinder. ` Verder oefenen? Ga naar .
Uitdaging!
Houd met deze reeks van experimentjes je ouders, broer of zus voor de gek.
WAT HEB JE NODIG?
een glas
een handvol kiezelsteentjes
een pak keukenzout
water
HOE GA JE TE WERK?
Stap 1
Neem een glas uit de kast en vul het tot aan de rand met kiezelsteentjes.
Is het glas helemaal vol? Als je die vraag stelt, krijg je als antwoord vast: ‘ja, hoor’.
Stap 2
Neem een pakje keukenzout uit de kast en probeer of je alsnog zout kunt toevoegen aan het glas.
Je zult merken dat er nog heel wat keukenzout in het glas kan toegevoegd worden. De zoutkorrels gaan de ruimte die er nog restte tussen de grotere kiezelsteentjes immers opvullen. In het glas zit nu een mengsel van keukenzout en kiezelsteentjes.
Is het glas nu helemaal vol? Opnieuw zal je publiek waarschijnlijk ‘ja’ antwoorden.
Stap 3
Probeer vervolgens om water toe te voegen aan het glas met de kiezelsteentjes en het keukenzout.
Gelukt? Dan was het glas dus toch niet vol. Een deel van het keukenzout is ook opgelost in het water. Je hebt nu het glas gevuld met verschillende soorten stoffen, een mengsel van stoffen.
Alles gelukt? Prima!
Nu komt het moeilijke werk: zou je de stoffen terug van elkaar kunnen scheiden?
Met enige kennis van mengsels en de nodige scheidingstechnieken moet dat zeker lukken.
` Welke mengsels zijn er?
` Welke scheidingstechnieken gebruiken we om de stoffen terug van elkaar te scheiden?
We zoeken het uit!
Het woord stof speelt een centrale rol in de chemie. Een chemicus maakt dan ook een duidelijk onderscheid tussen een voorwerp en een stof. Chemie houdt zich namelijk niet bezig met het bestuderen van voorwerpen, maar wel met de studie van stoffen waaruit alles wat leeft (mens, dier, plant …) en alles wat niet leeft (aarde, water, lucht …) is opgebouwd. Ken jij het verschil tussen een stof en een voorwerp nog?
OPDRACHT 1
Vul de tabel aan.
Het Van Dale-woordenboek geeft verschillende definities voor het woord ‘glas’. Is glas nu een stof of een voorwerp?
Betekenis 'glas'
Je hebt gezocht op het woord: glas. glas (het; o; meervoud: glazen; verkleinwoord: glaasje)
1 doorzichtige harde stof
2 glazen plaat = ruit: zijn eigen glazen ingooien, zijn eigen zaak bederven
3 glazen beker: een glas wijn; te diep in het glaasje kijken, zich bedrinken
stof
stof
stof
voorwerp
voorwerp
voorwerp
Het woord ‘glas’ kan dus zowel verwijzen naar het voorwerp waaruit we drinken, als naar de stof waaruit dat voorwerp is gemaakt.


Wanneer ‘glas’ duidt op een voorwerp, wordt het meestal gebruikt als een verzamelnaam van stoffen: een raam bevat niet alleen de stof glas, maar ook een aluminium kader. Voor chemici is het raam een voorwerp en zijn glas en aluminium de stoffen of de materialen waaruit het raam is opgebouwd.
OPDRACHT 2
Herken het verschil tussen een stof en een voorwerp.
Kijk eens rond in het klaslokaal en noteer enkele voorwerpen en stoffen.
Voorwerp
Stof
Een voorwerp is opgebouwd uit stoffen
De verzameling van alle stoffen in de natuur wordt materie genoemd.
OPDRACHT 3
Wat is het verschil tussen materie, voorwerp en stof?
Vul de begrippen in het schema aan.
materie – voorwerp – stof
BAKSTENEN




LEERDOELEN
Je kunt al:
L het verschil tussen materie, voorwerp en stof toelichten.
Je leert nu:
L uitleggen wat stofeigenschappen zijn (en ze onderscheiden van voorwerpeigenschappen);
L de begrippen aggregatietoestand, massadichtheid, smeltpunt, kookpunt, deeltjesgrootte, geleidbaarheid, oplosbaarheid van een stof kennen;
L stoffen onderscheiden op basis van stofeigenschappen.
Stoffen kunnen verschillende eigenschappen hebben. Zo kun je thuis een glas met azijn en een glas gevuld met water van elkaar onderscheiden door eraan te ruiken
Suiker en zout herken je misschien door de vorm en de grootte van de kristallen. In je eigen keuken kun je de stof zelfs proeven, als je zeker bent dat het om eetbare stoffen gaat.
Kortom, door je zintuigen te gebruiken, zijn er al heel wat eigenschappen op basis waarvan je informatie kunt afleiden over de identiteit van de stof.
Maar wat als je je zintuigen niet mag gebruiken? Wat als het niet gaat over eetbare stoffen? In een chemisch labo is proeven niet toegestaan! Je zou een giftige stof kunnen aanraken of inslikken. Ook ruiken gebeurt op een veilige manier. Maar zo wordt het natuurlijk moeilijker om stoffen te onderscheiden.
1 Wat betekent de term ‘stofeigenschap’?
Je kent het verschil tussen een voorwerp en een stof, maar kunnen we stoffen ook onderling onderscheiden van elkaar?
OPDRACHT 4
Vergelijk een fles olijfolie met een fles water.
Op basis van welke eigenschappen maak je hier een onderscheid tussen de fles met olijfolie en de fles met water?
•
•
Meng nu beide vloeistoffen en noteer je waarneming.
•


Je hebt al enkele eigenschappen gebruikt om stoffen van elkaar te onderscheiden. Zo kun je olijfolie van water onderscheiden op basis van kleur, stroperigheid (viscositeit), oplosbaarheid in water ... Azijn onderscheidt zich van water door zijn kenmerkende geur.
OPDRACHT 5
Onderscheid de stoffen op basis van hun eigenschappen.
1 Noteer in de tweede kolom de stoffen die je in de eerste kolom ziet. Kies uit: bloem – goud – koper – olijfolie – plastic (pvc) – suiker – water
2 Noteer in de derde kolom de eigenschappen die je tot dat besluit brachten.








Om stoffen te herkennen heb je gebruikgemaakt van eigenschappen:
• Je hebt gekeken naar de aggregatietoestand van de stof. Zo zijn sommige stoffen immers vloeibaar bij kamertemperatuur en andere stoffen vast. Lucht bestaat voornamelijk uit gasvormige stoffen bij kamertemperatuur.
• Een metaal (zoals zilver, goud) onderscheid je van glas of plastic door zijn typische glans.
Maar je hebt misschien ook gebruikgemaakt van de verdelingsgraad (de fijnheid van de korrels) van bloem ten opzichte van de verdelingsgraad van suiker om die van elkaar te onderscheiden.
We maken dan ook een onderscheid tussen twee soorten eigenschappen:
1 Eigenschappen die afhangen van het voorwerp (en dus veranderlijk zijn) = voorwerpeigenschappen
2 Eigenschappen die typisch (eigen) zijn aan een welbepaalde stof = stofeigenschappen
Voorwerpen kunnen uit een of meerdere stoffen bestaan.
Stoffen hebben eigenschappen of kenmerken die bij de stof horen en niet veranderen. Dat noemen we onveranderlijke eigenschappen of stofeigenschappen. Bv. glans, verdelingsgraad, aggregatietoestand.
OPDRACHT 6
Gaat het om voorwerp- of stofeigenschappen?
1 Zet een kruisje bij het juiste type eigenschap.
Er bestaan blauwe, groene, gele, rode, paarse … legoblokken.
Water is gasvormig boven 100 °C, vloeibaar bij kamertemperatuur en vast onder 0 °C.
Suiker lost goed op in water, maar olie blijft drijven op water.
Mijn bril heeft een ronde vorm, de zonnebril van mijn buur is eerder hoekig.
2 Kun je de stofeigenschappen uit vraag 1 ook benoemen? Som op wat je weet.
Voorwerpeigenschap Stofeigenschap
Voor een chemicus zijn het uiteraard de stofeigenschappen die van belang zijn. Je maakte in de voorbije studiejaren, bij verschillende vakken, al kennis met stofeigenschappen zoals aggregatietoestand en glans.
De stofeigenschap aggregatietoestand is de vorm waarin een stof bij een welbepaalde temperatuur voorkomt: vast, vloeibaar of gasvormig. Zo is de aggregatietoestand van water bij kamertemperatuur (21 °C) vloeibaar, maar die van goud vast.
De stofeigenschap glans geeft weer of een stof een zachte schittering heeft als er licht op invalt. Zo hebben metalen (goud, zilver, koper …) een typische glans.
We bekijken nu nog enkele andere stofeigenschappen. Sommigen daarvan zul je ook nog in het vak fysica tegenkomen, of ben je misschien al eerder tegengekomen in de lessen natuurwetenschappen of STEM.
Twee voorwerpen met hetzelfde volume hebben niet noodzakelijk dezelfde massa: een liter water weegt immers meer dan een liter lucht. Twee voorwerpen met dezelfde massa hebben ook niet noodzakelijk eenzelfde volume: 1 kg pluimen en een 1 kg lood wegen evenveel, maar het volume pluimen zal natuurlijk groter zijn.
OPDRACHT 7
Ken je deze grootheden en eenheden nog?
Net als in fysica zijn er bij chemie grootheden en eenheden die je nodig hebt om berekeningen uit te voeren. Vul de tabel aan.
Grootheid
Massa en volume zijn twee voorwerpeigenschappen: ze verschillen immers naargelang het voorwerp. Een goudstaaf heeft een grotere massa en een groter volume dan een gouden ring, hoewel het bij beide over de stof goud gaat.
Massadichtheid is niets anders dan de hoeveelheid massa per volumeeenheid. Hoe meer deeltjes in hetzelfde volume voorkomen (hoe groter de massa), hoe groter de massadichtheid (zie afbeelding 11). En dit is dan weer wél typisch voor een welbepaalde stof: het is een stofeigenschap.
kleine massadichtheid grote massadichtheid
Demonstratie van verschil in massadichtheid tussen twee voorwerpen door de massa te vergelijken voor
Deze nieuwe grootheid, massadichtheid, heeft dus ook weer haar eigen symbool en eenheid:
GrootheidSymbool - formuleSI-eenheidSymbool massadichtheid kilogram per kubieke meter
TIP t = m v kg m3
Denk aan je omzettingen! Zo is de eenheid = 10-3 en 1 liter = 1 dm3 en 1 m3 = 1 000 dm3 = 1000 L kg m3 g cm3
Wil je nog dieper ingaan op de formule? Bekijk dan de video.

OPDRACHT 8
Als je olijfolie en water samenbrengt in een proefbuis, merk je dat die stoffen niet mengen, maar twee laagjes vormen. De twee stoffen lossen immers niet op in elkaar. Maar als gevolg van een verschil in massadichtheid zal één stof gaan bovendrijven, namelijk de stof met de kleinste massadichtheid. Een mooie cocktail maken steunt volledig op de eigenschap van massadichtheid. Verschillende dranken hebben een verschillende massadichtheid en vormen dus mooie laagjes in je glas.
Vergelijk twee stoffen (bij kamertemperatuur) binnen één rij en vul de tabel aan.
Stof 1 Massadichtheid
Gevolg (schrap wat niet past)
Aluminium zinkt / drijft in water. ethanol (drankalcohol) 0,789 glazen knikker 2,2-2,6
water 1,0 olie 0,75-0,95
kwik 13,55 melk 1,03
zeewater 1,03 glycerine 1,260
OPDRACHT 9
ONDERZOEK
De knikker zinkt / drijft in alcohol.
De olielaag zit boven / onder de waterlaag.
De kwiklaag zit boven / onder de melklaag.
De laag glycerine zit boven / onder de laag zeewater.
Onderzoek nu zelf hoe je de massadichtheid van stoffen kunt bepalen.
Voer het virtueel practicum rond massadichtheid uit. Je vindt het bij het onlinelesmateriaal.
De stofeigenschap massadichtheid geeft de verhouding weer tussen de massa van een stof en het volume dat die stof inneemt bij een bepaalde temperatuur. Ook die stofeigenschap is specifiek en eigen aan de stof
Voor de drie aggregatietoestanden worden de afkortingen v (vast), vl (vloeistof) en g (gas) gebruikt. Vaak worden echter ook de Engelse afkortingen gebruikt.
Aggregatietoestand Afkorting in het Nederlands Afkorting in het Engels vast v s (solid) vloeistof vl l (liquid) gas g g (gas)
Smeltpunt en kookpunt als scheidingslijn
KOOKPUNT condenseren stollen verdampen smelten
SMELTPUNT sublimeren
OPDRACHT 10
gasvormig boven het kookpunt is een stof meestal in de gasfase. vloeibaar tussen het smeltpunt en het kookpunt is een stof meestal in de vloeibare fase. vast onder het smeltpunt is een stof meestal in de vaste fase.
Vul de tabel aan. Stof Smelt-
OPDRACHT 11
Onderzoek nu zelf het smeltpunt van paraffine.
Je vindt het labo bij het onlinelesmateriaal.
Je kunt stoffen niet alleen van elkaar onderscheiden op basis van hun massadichtheid, je kunt ook gebruikmaken van hun kookpunt en hun smeltpunt.
Aggregatietoestand bij
Aggregatietoestand bij
Het kookpunt van een stof is de temperatuur waarbij de stof overgaat van de vloeibare fase naar de gasvormige fase. Het smeltpunt van een stof is de temperatuur waarbij de stof overgaat van de vaste fase naar de vloeibare fase.

Al ooit op kamp geweest en zelf een vuurtje moeten maken? Superleuk om dan je eten in een gamel op te warmen. Maar let op: het is geen goed idee om de gamel vervolgens met je blote handen vast te nemen. Of een lekkere lasagne in de oven: oppassen met het aluminium bakje. We spreken hier over thermische geleidbaarheid, of hoe makkelijk een stof de warmte gaat doorgeven.
De thermische geleidbaarheid (of warmtegeleiding) geeft aan hoe vlot warmte wordt doorgegeven doorheen de stof. Eigenlijk komt het hier neer op de vlotheid waarmee deeltjes kunnen bewegen door de stof.
(Elektrische) geleidbaarheid is de mogelijkheid van stoffen om, in gesmolten of opgeloste toestand, de elektrische stroom te geleiden. Aangezien niet elke stof de stroom kan geleiden (en dus een lampje kan doen branden), kun je op basis van die stofeigenschap stoffen van elkaar onderscheiden.


OPDRACHT 12
ONDERZOEK
Onderzoek nu zelf de elektrische geleidbaarheid van enkele stoffen.
Voer het labo rond geleidbaarheid uit. Je vindt het bij het onlinelesmateriaal.
De elektrische geleidbaarheid geeft aan hoe gemakkelijk geladen deeltjes door de stof kunnen bewegen. Bij bepaalde stoffen gaat dat vlotter dan bij andere. Bij sommige stoffen lukt het helemaal niet. Ook die stofeigenschap is, bij kamertemperatuur, een constante en dus een mogelijke manier om een stof verder te identificeren.

OPDRACHT 13
ONDERZOEK
Water is een belangrijk oplosmiddel, zowel in het dagelijks leven als in het chemielabo. Kijk maar naar je eigen lichaam: dat bestaat voor meer dan de helft uit water. Dat betekent dan ook dat er heel veel stoffen goed oplossen in het water in de cellen van je lichaam. Maar lossen alle stoffen even goed op in water?
Oplosbaarheid in water is een belangrijke stofeigenschap: je kijkt of de stof al dan niet oplost in water. Water dient dan als oplosmiddel, en de stof die je oplost wordt de opgeloste stof genoemd. We noemen de combinatie van opgeloste stof in een oplosmiddel een oplossing
Onderzoek nu zelf de oplosbaarheid van enkele stoffen.
Voer het labo rond oplosbaarheid uit. Je vindt het bij het onlinelesmateriaal.
Je kunt ondertussen stoffen al van elkaar onderscheiden op basis van verschillende stofeigenschappen. Zo leerde je over aggregatietoestand, glans, massadichtheid, kook- en smeltpunt, geleidbaarheid en oplosbaarheid (in water). Er zijn echter nog enkele andere stofeigenschappen die je zou kunnen gebruiken:
• geur
• smaak
• giftigheid
• brandbaarheid
• magnetische eigenschappen
Let op: geur, smaak en giftigheid van onbekende stoffen testen in een chemielabo op school of thuis, is uiteraard geen optie. Maar brandbaarheid en magnetische eigenschappen van stoffen ga je zeker nog tegenkomen in de lessen chemie en fysica.
Wanneer een stof oplost in een oplosmiddel, spreken we van de oplosbaarheid van die opgeloste stof. Niet alle stoffen lossen even goed op in water, hoewel het het meest gebruikte oplosmiddel is (zeker in een labo).
` Maak oefening 1 en 2 op p. 57.
Maak een mindmap over dit hoofdstuk.
We komen aan het einde van dit hoofdstuk, dus wordt het tijd dat je even samenvat wat je daaruit moet kennen. Om je op weg te helpen, noteerden we alvast het basisbegrip uit dit thema: stofeigenschap.
Probeer nu zelf een mindmap rond dat begrip te maken.
In de tabel vind je in elk vak twee stoffen. Geef voor elk duo:
• een stofeigenschap die ze gemeenschappelijk hebben;
• een stofeigenschap die verschillend is voor beide stoffen.
glas en diamant
- gemeenschappelijk:
- verschillend:
bloemsuiker en kristalsuiker
- gemeenschappelijk:
- verschillend:
goud en koper
- gemeenschappelijk:
- verschillend:
water en ether
- gemeenschappelijk:
- verschillend:
Stel: je hebt een voorwerp dat gemaakt is van een voor jou onbekende stof. Je onderzoekt het voorwerp en stelt de volgende eigenschappen vast:
a Het voorwerp zinkt in water.
b Het voorwerp wordt niet aangetrokken door een magneet.
c Het voorwerp is 12 cm lang.
d De massa van het voorwerp is 150 g.
e Het voorwerp geleidt de stroom.
Beantwoord nu de vragen.
1 Welke gegevens bieden geen nuttige informatie als je wilt weten uit welke stof het voorwerp is vervaardigd?
2 Welke gegevens zijn stofeigenschappen?
3 Welke belangrijke stofeigenschap zouden we kunnen afleiden als we in plaats van de lengte van het voorwerp het volume hadden bepaald?
` Verder oefenen? Ga naar .
LEERDOELEN
Je kunt al:

L stoffen van elkaar onderscheiden op basis van stofeigenschappen.
Je leert nu:
L een definitie geven voor het begrip zuivere stof;
L een definitie geven voor het begrip mengsel;
L zuivere stoffen en mengsels van elkaar onderscheiden;
L het onderscheid maken tussen homogene en heterogene mengsels;
L mengsels classificeren als homogeen of heterogeen mengsel;
L mengsels onderverdelen in rook, nevel, oplossing, schuim, suspensie of emulsie.
OPDRACHT 14
Markeer wat volgens een chemicus een zuivere stof is.
goud ijzer leidingwater lucht zuurstofgas
We hebben het in het vorige hoofdstuk gehad over stofeigenschappen en hoe je dus stoffen van elkaar kunt onderscheiden. Maar eigenlijk hadden we het daar steeds over hoe je zuivere stoffen van elkaar kunt onderscheiden. In dit hoofdstuk gaan we nu ook mengsels van stoffen bekijken.
Sommige van die mengsels hebben een specifieke naam, en heb je vast al horen waaien: ‘rook’, ‘schuim’ … We onderzoeken eerst het onderscheid tussen zuivere stoffen en mengsels en bekijken vervolgens elk type mengsel eens van dichterbij.
Lucht bestaat eigenlijk uit een verzameling van stoffen, zoals N2 (stikstofgas), O2 (zuurstofgas), CO2 (koolstofdioxide), waterdamp, roetdeeltjes … Ook in het leidingwater dat wij drinken, zit meer dan alleen maar (zuiver) water. Net zoals in flessenwater trouwens: kijk maar eens op het etiket (afbeelding 14). Als we het in de lessen chemie over water hebben, bedoelen we dus de zuivere stof water!
WEETJE
Is het je al opgevallen dat je leerkracht tijdens een proef geen leidingwater, maar gedemineraliseerd water gebruikt? Zoals de term al aangeeft, zijn verschillende mineralen uit het water verwijderd, waardoor de graad van zuiverheid verhoogt. Op die manier verkleint je leerkracht het risico dat andere stoffen in het water een invloed hebben op de reactie.
Je leerkracht kan ook kiezen voor gedestilleerd water. Dat water is nog zuiverder; dankzij de scheidingstechniek destillatie zijn nog meer onzuiverheden uit het water verwijderd. Het wordt vaak gebruikt in het dagelijks leven, bv. voor het navullen van loodaccu’s of in strijkijzers om kalkvrij stoom te produceren (alhoewel dat met gedemineraliseerd water ook prima werkt).
Wil je meer weten over het verschil tussen zuiver water en kraantjeswater? Bekijk dan de video.
Zoals je hebt geleerd in de eerste graad, wordt een verzameling van verschillende stoffen een mengsel genoemd. Een mengsel bevat dus twee of meer stoffen, die we bestanddelen of componenten noemen.
Een (zuivere) stof wordt gekenmerkt door welbepaalde waarden voor een hele reeks stofeigenschappen (smeltpunt, kookpunt, massadichtheid …) Bij een zuivere stof zijn die waarden constant en karakteristiek (typisch voor de stof).
Bij een mengsel van zuivere stoffen zullen de eigenschappen zoals kookpunt, smeltpunt, massadichtheid ... afhankelijk zijn van de samenstelling van het mengsel.
` Maak oefening 1 op p. 66.
WEETJE
Kookpunt versus kooktraject
Een zuivere stof heeft een constant, vast kookpunt: tijdens het koken blijft de temperatuur constant.
Een mengsel wordt gekenmerkt door een kooktraject: tijdens het koken verandert de temperatuur.
temperatuur (°C) kookpunt
tijd (s) vl vl+ g g
zuivere stof (bv. demiwater)
Grafiek 1 Zuivere stof met vaste kooktemperatuur
temperatuur (°C) kooktraject
tijd (s) vl vl+ g g
mengsel (bv. zout + water)
Grafiek 2 Mengsel met kooktraject
Kook- of smeltpunt verhogen of verlagen?
Van een witte kerst kunnen we in België niet elk jaar genieten, maar een sneeuwbui tijdens het jaar komt weleens voor. Om dan veilig naar school te komen, wordt er op de wegen zout gestrooid. Daardoor verlaagt het smeltpunt van het ijs-zoutmengsel, waardoor de sneeuw en het ijs zelfs bij vriestemperaturen (= temperatuur onder 0 °C) zullen smelten. Meer weten over het verlagen van het smeltpunt? Bekijk dan de video.

Soms zie je aan een mengsel dat het bestaat uit meerdere componenten: we spreken dan over een heterogeen mengsel. Soms kun je de componenten niet meer onderscheiden: we spreken dan over een homogeen mengsel.
2.1 Homogeen versus heterogeen
OPDRACHT 15
DEMO
Welke soorten mengsels worden gevormd?
Je leerkracht plaatst vier erlenmeyers op tafel. In elke erlenmeyer zit 20 mL zuiver water.
Aan erlenmeyer 1 wordt zand toegevoegd, aan erlenmeyer 2 zout, aan erlenmeyer 3 olijfolie en aan erlenmeyer 4 alcohol. De twee stoffen worden lichtjes gemengd, waarna ze op de tafel geplaatst worden.
1 Noteer je waarnemingen. Schrap wat niet past.
Erlenmeyer 1: water + zand
Lost op / Lost niet op Ik kan de twee stoffen onderscheiden: Ja / Nee
Erlenmeyer 3: water + olijfolie
Lost op / Lost niet op
Ik kan de twee stoffen onderscheiden: Ja / Nee
2 Breng de vier mengsels onder in de juiste groep.
Voorbeeld
Erlenmeyer 2: water + zout
Lost op / Lost niet op Ik kan de twee stoffen onderscheiden: Ja / Nee
Erlenmeyer 4: water + alcohol
Lost op / Lost niet op Ik kan de twee stoffen onderscheiden: Ja / Nee
Homogeen mengsel Heterogeen mengsel
Uit opdracht 15 kunnen we besluiten dat je na het mengen soms nog steeds de verschillende componenten van het mengsel ziet, maar soms ook niet.
Op basis van je waarnemingen kun je de mengsels in twee groepen indelen: homogene mengsels: slechts één soort component te zien; heterogene mengsels: verschillende soorten componenten te zien.
OPDRACHT 16
Geef enkele voorbeelden van homogene mengsels
Vul de tabel aan.
Homogene mengsels kunnen onderverdeeld worden naar de aggregatietoestand van hun componenten.
Probeer van elke combinatie een voorbeeld te geven.
Aggregatietoestand component 1
Aggregatietoestand component 2
Voorbeeld
v v brons (een mengsel van koper en tin)
v vl
vl vl vl g g g
Een ander woord voor homogene mengsels is oplossingen (waarbij nog het onderscheid vaste, vloeibare en gasvormige oplossingen wordt gemaakt).
Een homogeen mengsel van twee metalen heeft nog een specifiekere naam: dat noemen we een legering
Homogene mengsels of oplossingen zijn mengsels waarin je de verschillende componenten niet meer van elkaar kunt onderscheiden met het blote oog. Een homogeen mengsel van twee vaste metalen wordt een legering genoemd.
OPDRACHT 17
Vul de tabel aan.
Specifieke naam van het heterogene mengsel
Heterogene mengsels zijn mengsels waarin je de verschillende componenten met het blote oog kunt onderscheiden. In tegenstelling tot homogene mengsels, hebben de heterogene mengsels allemaal een specifieke naam. Bij die naamgeving hangt de indeling samen met de aggregatietoestand van de opgeloste stof in het oplosmiddel (= stof die overheerst).
Voorbeeld





Aggregatietoestand opgeloste stof
Aggregatietoestand oplosmiddel (= stof die overheerst)
In opdracht 17 merk je dat verschillende soorten heterogene mengsels bestaan die we in een volgend schema kunnen weergeven:
Opgeloste stof Oplosmiddel
Heterogene mengsels zijn mengsels waarin je de verschillende componenten kunt onderscheiden met het blote oog.
• Rook is een heterogeen mengsel dat ontstaat bij verbranding. Rook bestaat uit vaste deeltjes, verdeeld in een oplosmiddel in de gasfase.
• Nevel is de specifieke naam voor een heterogeen mengsel van vloeistofdeeltjes in een gasfase. Net als bij rook is de gasfase hier het oplosmiddel.
• Schuim is de naam voor een heterogeen mengsel van gasdeeltjes in een vloeistoffase. We zien hier het tegenovergestelde van een nevel: bij schuim is de vloeistoffase het oplosmiddel, terwijl bij een nevel de gasfase het oplosmiddel is.
• Je spreekt van een suspensie als vaste deeltjes te onderscheiden zijn in een vloeistof.
• Een emulsie ten slotte, is een combinatie van twee te onderscheiden vloeistoffen.
` Maak oefening 2 t/m 5 op p. 66, 67 en 68.
Om een mengsel van vloeistoffen (die moeilijk in elkaar oplossen) om te zetten in een meer homogeen geheel, wordt een emulgator toegevoegd. Zonder emulgator gaat het mengsel spontaan ontmengen. Zo wordt bijvoorbeeld eigeel toegevoegd als emulgator voor de bereiding van mayonaise (water in olie).

Meer weten over emulsies? Bekijk dan de video.

OPDRACHT 18 DOORDENKER
Nu wordt het moeilijker: je hebt vast al weleens het woord aerosol horen vallen. Was je als kind vaak verkouden of moest je vaak hoesten? Dan zou het kunnen dat je ‘aan de aerosol’ moest. Ook mensen met astma moeten vaak hun puffer bovenhalen.
Een aerosol is een heterogeen mengsel waarin de opgeloste fase een vaste stof, vloeistof of combinatie van beide is en het oplosmiddel een gas (meestal lucht).
Markeer wat onder de noemer ‘aerosol’ valt.
Opgeloste stof Oplosmiddel
rook
nevel
vl g schuim
suspensie
emulsie
Smog in India en het effect van de maatregelen tegen COVID-19 in maart 2020

Door de grote hoeveelheid voertuigen (die vaak nog erg vervuilend zijn) in India, zitten er ongelooflijk veel microscopisch kleine deeltjes fijn stof in de lucht. Men noemt dat ‘smog’ (smoke + fog), wat voor ons valt onder de noemer ‘rook’ (vaste deeltjes of vloeistofdeeltjes in een gasfase als resultaat van verbrandingsreacties). Dat is niet alleen heel vervelend als je de monumenten in New Delhi wilt bekijken, maar vooral erg schadelijk voor de gezondheid. De stofdeeltjes kunnen zich immers in de longen en andere organen nestelen en schade toebrengen.

De maatregelen die India in maart 2020 invoerde om de verspreiding van het coronavirus tegen te gaan (sluiten van markten, fabrieken en winkels; stilleggen van het openbaar vervoer), hadden een enorme positieve impact op de luchtkwaliteit van het land. Uit metingen bleek dat de hoeveelheid fijn stof in de lucht met maar liefst 71 % was gedaald.
Het begrip aerosol is een verzamelnaam voor heterogene mengsels van vaste stoffen of vloeistoffen in een gas. De begrippen rook en nevel zijn dus beide voorbeelden van aerosols.
HOOFDSTUKSYNTHESE
Maak een mindmap over dit hoofdstuk.
Om je op weg te helpen, noteerden we alvast enkele begrippen uit dit thema. Probeer nu zelf een mindmap rond die begrippen aan te vullen.
ZUIVERE STOF
Gaat het hier om mengsels of zuivere stoffen?
a brons:
b goud:
c zandstorm:
d zuurstofgas:
e gefilterd zeewater:
f gedestilleerd water:
g Zn + water:
Bekijk de voorstellingen van stoffen of mengsels. Omcirkel het juiste antwoord.
a Welke voorstelling stelt een homogeen mengsel voor?
1 - 2 - 3 - 4
b Welke voorstelling stelt een heterogeen mengsel voor?
1 - 2 - 3 - 4
c Welke voorstelling stelt een zuivere stof voor?
1 - 2 - 3 - 4
d Welke overgang stelt het oplossen van zout in water voor? 3 + 4 1 3 + 4 2
e Welke overgang stelt het mengen van zand in water voor? 3 + 4 1 3 + 4 2
Koppel het juiste mengsel aan de juiste naam. Vul de tabel aan.

antibioticumoplossing: het antibioticumpoeder wordt gemengd met het water

zeepbellen: lucht gevangen in zeepoplossing
nevel legering schuim suspensie

een bronzen beeld: een mengsel van tin en koper

de stoom die ontstaat in een sauna als je water over hete stenen giet
Schrap in de tabel wat niet past en vul aan.
Mengsel
1

graffitispray: vloeibare verfdeeltjes in gas onder druk

Homogeen of heterogeen?
Aggregatietoestand overheersende stof
Aggregatietoestand verdeelde stof Specifieke naam
homogeen heterogeen vast vloeistof gas vast vloeistof gas 2
schuimkraag op een frisse pint bier

homogeen heterogeen vast vloeistof gas vast vloeistof gas 3
homogeen heterogeen vast vloeistof gas vast vloeistof gas
een goed glas wijn: de combinatie van water en drankalcohol
Markeer de vreemde eend in de bijt en verklaar bondig.
• geldmunt – zilver – halsketting – oorring – bankbiljet
• kwik – schroef – goud – koolstof – zink
• volume – massa – vorm – kookpunt – grootte
• geleidbaarheid – kookpunt – aggregatietoestand – massadichtheid – massa
• zout – zink – zuurstofgas – brons – heliumgas
• suikerwater – messing – mayonaise – vinaigrette – ethanol
• CO2-gas in water – leidingwater – modder – wijn – gedestilleerd water
• suikerwater – soep – sangria – champagne – vinaigrette
• zoutwater – water en alcohol – brons – lucht – mayonaise
` Verder oefenen? Ga naar .
LEERDOELEN
Je kunt al:

L mengsels onderscheiden van zuivere stoffen;
L mengsels onderverdelen in heterogeen/homogeen;
L een verdere onderverdeling maken binnen de homogene en heterogene mengsels.
Je leert nu:
L voor een mengsel een geschikte scheidingstechniek voorstellen;
L voor de geschikte scheidingstechniek verklaren op welke eigenschap de scheiding gebaseerd is;
L een scheidingsschema voorstellen voor een mengsel;
L uitleggen wat een scheidingstechniek is;
L uitleggen op welke stofeigenschap de scheidingstechniek gebaseerd is;
L de principes zeven, filtreren, decanteren, centrifugeren, indampen en destilleren beschrijven;
L een geschikte scheidingstechniek kiezen om twee stoffen van elkaar te scheiden;
L een geschikt scheidingsschema opstellen om een mengsel te scheiden.

Het vak dat je nu volgt is chemie, of in een oudere benaming: scheikunde. Dat betekent letterlijk: ‘de kunst om te scheiden’. De leerstof voor dit vak omvat uiteraard veel meer, maar we beginnen met inzoomen op het scheiden. We bekijken welke scheidingstechnieken er zijn, waarop ze gebaseerd zijn en wanneer je ze kunt toepassen. We eindigen dit hoofdstuk met het opstellen van scheidingsschema’s voor mengsels van meer dan twee stoffen.
Elk soort mengsel heeft een eigen scheidingstechniek. Als je thuis pasta hebt gekookt en die afgiet door een vergiet, dan ben je aan het scheiden: via het vergiet scheid je de pasta van het water.
Scheiden is het tegenovergestelde van mengen. De methodes die we gebruiken om mengsels te scheiden in hun afzonderlijke componenten steunen op verschillen in stofeigenschappen
We gaan dieper in op enkele scheidingstechnieken: sorteren, zeven, filtreren, decanteren, indampen, destilleren, centrifugeren en extraheren. Uiteraard bestaan er nog meer scheidingstechnieken, die mogelijk tijdens een ander labo met je leerkracht verder aan bod komen.
OPDRACHT 19
ONDERZOEK
Voer het labo rond scheidingstechnieken uit. Je vindt het bij het onlinelesmateriaal.

Even terug naar je prille jeugdjaren! Je hebt als kind vermoedelijk wel met zand en water gespeeld. Zonder dat je het besefte, was je als toekomstig scheikundige mengsels aan het scheiden op het strand. Je gebruikte eenvoudige methodes die de stoffen niet veranderden.
Allereerst liet je het emmertje even staan; op die manier zonken het zand en de schelpen naar de bodem en kon je het water al grotendeels afgieten. Je liet het zand en de schelpen dus bezinken De schelpjes uit het zand halen kon je met je handen. Je kon ze opzij leggen en sorteren per soort, door het verschillend uitzicht. De schelpjes waren ook merkelijk groter dan de rest en je maakte gebruik van dat verschil in deeltjesgrootte om ze er makkelijk uit te pikken.
Maar eens je alle schelpjes eruit gehaald had, merkte je ongetwijfeld dat er nog onzuiverheden in het zand zaten. Omdat het verschil in deeltjesgrootte tussen de componenten van je mengsel nu kleiner was, was het niet meer zo eenvoudig om die kleine dingetjes met de hand van het zand te scheiden. Je speelgoedsetje zorgde waarschijnlijk voor de oplossing: door het mengsel te zeven was je in staat om uiteindelijk zand in je emmertje te verkrijgen.
Zeven is een eenvoudige techniek om een heterogeen mengsel te scheiden. Die techniek steunt op een verschil in deeltjesgrootte tussen de twee componenten. De grotere korrels kunnen niet door de zeef, maar de kleinere component(en) wel.
Meer weten over grote zeven in de industrie? Bekijk dan de video.
WEETJE
In de lessen aardrijkskunde heb je het vast al gehad over verschillende soorten bodems: kleibodems, zandbodems, leembodems, of een combinatie daarvan. Om de bodemsamenstelling te bepalen, maakt een bodemkundige onder andere gebruik van een set zeven met een verschillende zeefopening. Zo zijn kleikorrels kleiner dan 2 µm, leem zit tussen 2 en 50 µm en zandkorrels zijn groter dan 50 µm
In veel gevallen moeten we echter componenten scheiden met een nog veel kleiner verschil in deeltjesgrootte. We kiezen dan voor de techniek van filtreren. Een goed gekozen filter heeft net de juiste structuur om de ene component, het filtraat, wel door te laten en de andere component, het residu, tegen te houden.
mengsel van een vaste stof en een vloeistof
staaf
filtreerpapier
trechter residu
filtraat
Afb. 17
Filtreren
Filtreren of filtratie is een eenvoudige scheidingstechniek om een heterogeen mengsel te scheiden. Die techniek steunt op het verschil in deeltjesgrootte: vaste korrels zijn immers groter dan vloeistof- of gasdeeltjes. De vaste korrels kunnen niet door de poriën van de filter, maar de vloeistof of het gas wel. De vaste deeltjes die achterblijven, worden het residu genoemd. Wat door de filter gaat, is het filtraat
Filtreren met mondmaskers (vl-g)
Filtreren of filtreren gebeurt met vaste stoffen en vloeistoffen, maar ook met gassen. Denk maar aan het dragen van mondmaskers om vochtdeeltjes die mogelijke virussen meedragen, te scheiden van de ingeademde lucht. Tegen het zeer besmettelijke coronavirus beschermden mensen overal ter wereld zich met een dergelijk ‘filtermasker’.

Ook het regelmatig reinigen van bv. de filters in je huis (dampkap, droogkast, ventilatiesysteem ...) is uiteraard erg belangrijk; zo blijven de filters hun werk doen en ongewenste deeltjes scheiden van de rest.

Meer weten over filtratie in de industrie? Bekijk dan de video.

Als de deeltjes in je suspensie erg fijn verdeeld zijn, merk je dat het filtreren al snel moeizamer gaat: het filtreerpapier wordt bedekt met een laagje van het residu (een filterkoek). In dat geval maakt men gebruik van een büchnertrechter. Die trechter wordt aangesloten op een waterstraalpomp, waardoor een vacuüm gecreëerd wordt in de afzuigerlenmeyer.
Wil je weten hoe dat werkt? Bekijk dan de video.

Tijdens een filtratie bekom je zowel de vloeistof als de vaste stof uit het heterogene mengsel. Een variant daarop is het decanteren (of afschenken). Bij die techniek gebruik je geen filter. Door de vloeistof voorzichtig af te gieten, worden beide fasen van elkaar gescheiden. Dat er twee (of meer) lagen gevormd worden, die je van elkaar kunt scheiden door af te gieten, komt door het verschil in massadichtheid van de componenten.
De afzonderlijke componenten (of fasen) zullen niet even zuiver zijn als bij een filtratie, maar misschien volstaat het resultaat wel voor jou. Een extra filtratie achteraf is nog altijd een mogelijkheid.
Misschien heb je al van deze techniek gehoord bij het schenken van rode wijn? De vaste deeltjes zinken naar de bodem en door de wijn voorzichtig te schenken (decanteren) blijven de vaste deeltjes achter in de wijnfles.
Decanteren is een scheidingstechniek om een heterogeen mengsel (vast-vloeibaar of vloeibaar-vloeibaar) te scheiden. De techniek steunt op het feit dat elke stof zijn eigen massadichtheid heeft en daardoor afzonderlijke lagen zal vormen (eventueel na verloop van tijd). Die lagen kunnen, min of meer, van elkaar gescheiden worden door het afgieten van de bovenste laag.
Wanneer men twee vloeistoffen met een verschillende massadichtheid van elkaar wil scheiden (in een heterogeen mengsel), maakt men gebruik van een scheitrechter. Door tijdig het kraantje te sluiten na het doorlopen van een van de vloeistoffen van het heterogene mengsel, kun je betere resultaten verkrijgen dan door gewoon afgieten of decanteren.
Wil je weten hoe dat werkt? Bekijk dan de video.


Decanteren hangt onder andere af van de handigheid van de gebruiker (snel genoeg de kraan van de scheitrechter dichtdraaien, de fles rode wijn niet te snel uitgieten en onder de juiste hoek ...). Maar ook het geduld van de wetenschapper wordt soms op de proef gesteld: je mengsel moet immers lang genoeg in rust blijven om voldoende scheiding van de verschillende componenten te krijgen. De zwaartekracht moet zijn werk kunnen doen.
Het is daarom soms interessant om de scheiding van de componenten te versnellen. We helpen de zwaartekracht dan een beetje door het mengsel snelle cirkelvormige bewegingen te laten maken. Bij een slazwierder scheiden we zo de sla van het waswater. Ook de droogkast bij je thuis gaat de inhoud van de machine zeer snel ronddraaien, zodat het linnen wordt gedroogd doordat het water uit je kleren wordt gezwierd.
Die speciale techniek om componenten te scheiden op basis van massadichtheid noemen we centrifugeren. De deeltjes met de grootste massadichtheid worden bij de draaibeweging naar de bodem geduwd. Met speciale apparaten, centrifuges, kan men zo in een labo componenten met een gering verschil in dichtheid scheiden. Die techniek wordt onder andere gebruikt om bloedcellen en bloedplasma van elkaar te scheiden.

WEETJE
Wil je meer weten over deze scheidingstechniek in de industrie? Bekijk dan de video.
Centrifugeren of centrifugatie is een scheidingstechniek om een heterogeen mengsel (vast-vloeibaar of vloeibaar-vloeibaar) te scheiden (net zoals decanteren).
Ze steunt op het feit dat elke stof zijn eigen massadichtheid heeft en er daardoor afzonderlijke lagen gevormd zullen worden. Met behulp van machines (die het effect van de zwaartekracht versterken) zullen die lagen beter en sneller van elkaar gescheiden kunnen worden dan via decanteren alleen.
Het is mogelijk dat je door filtreren of decanteren een helder filtraat bekomt. Hoewel het lijkt alsof dat een zuivere stof is, kan dat filtraat nog steeds andere opgeloste stoffen bevatten. Het filtraat kan immers zelf nog een oplossing zijn (= homogeen mengsel van een vaste en vloeibare fase of twee vloeibare fasen). Als de opgeloste stof en het oplosmiddel een voldoende groot verschil in kookpunt hebben, is dat echter geen probleem. Door op te warmen tot de temperatuur van de fase met het laagste kookpunt (‘de meest vluchtige stof’), kun je beide fasen van elkaar scheiden. Zo verdampt water veel sneller dan keukenzout. Door een zoutoplossing op te warmen tot 100 °C, zal enkel het water verdampen en het zout (als kristallen) achterblijven. Op die manier kunnen oplossingen dus ook gescheiden worden in de opgeloste stof en het oplosmiddel.

De techniek van indampen wordt onder meer gebruikt voor het scheiden van zout uit zeewater. Daardoor ontstaan de bekende zoutbanken, die je vaak ziet in de Vendée-streek aan de Franse kust, of in Bolivia.
Wil je de indamping van zout (NaCl) zien gebeuren onder een microscoop? Bekijk dan de video.
Indampen is een scheidingstechniek die gebruikt wordt om een mengsel (vast-vloeistof of vloeistof-vloeistof) te scheiden. Door het opwarmen van het mengsel en het verschil in kookpunt, verdampt de vloeistof (met het laagste kookpunt) en blijven enkel de vaste deeltjes of de vloeistof met het hogere kookpunt over.
OPDRACHT 20
Wijn destilleren
De techniek van indampen maakt gebruik van het verschil in kookpunt tussen de componenten om een oplossing te scheiden. De ene stof is veel vluchtiger dan de andere omdat ze een groot verschil in kookpunt hebben. Dat is bijvoorbeeld het geval bij een zoutoplossing in water. Bovendien focus je bij indampen slechts op een van beide componenten. Bij het indampen van zoutoplossing in water, houd je alleen de zoutoplossing over. Daarnaast geldt een groot verschil in kookpunt niet voor alle oplossingen. Als de kookpunten van de componenten dichter bij elkaar liggen, maar ook als je beide componenten later apart wilt gebruiken, gaan we onze techniek moeten verfijnen. We maken opnieuw gebruik van het verschil in kookpunt van de componenten, maar gaan nu destilleren Destilleren is het mengsel verhitten tot boven het kookpunt van een van de componenten, maar we blijven onder het kookpunt van de andere component. Het component dat uit het mengsel gekookt wordt en apart wordt opgevangen, wordt het destillaat genoemd.
Wijn is een mengsel van vele componenten. Om het niet te moeilijk te maken, houden we het nu even op een mengsel van water (druivensap) en drinkalcohol (ethanol C2H5OH). Je leerkracht bouwt de proefopstelling zoals op de tekening. De wijn wordt verwarmd tot ongeveer 80 °C. Dat is net boven het kookpunt van ethanol (78 °C), maar onder het kookpunt van water (100 °C). De liebigkoeler wordt continu gekoeld met kraantjeswater.
Wat neem je waar?
thermometer liebigkoeler klem uitlaat koelwater inlaat koelwater
destilleerkolf met mengsel vigreuxkolom
bunsenbrander
erlenmeyer met destillaat
Besluit
Uit de wijn verdampt enkel de alcohol, die vervolgens condenseert omdat het koude stromende water in de liebigkoeler de alcoholdampen afkoelt. De verkregen heldere vloeistof die we opnieuw opvangen, noemen we het destillaat
Destilleren is een scheidingstechniek die gebruikt wordt om homogene mengsels van vloeistoffen of vloeistof en vaste stof, van elkaar te scheiden. Daarbij wordt gebruikgemaakt van het verschil in kookpunt tussen de aanwezige stoffen. Wanneer het mengsel aan de kook wordt gebracht, zal de component met het laagste kookpunt eerst verdampen. De gassen die zo ontstaan worden door een liebigkoeler geleid, zodat ze terug condenseren. Zo verkrijg je het destillaat.
OPDRACHT 21 DOORDENKER
Gefractioneerde destillatie van aardolie: wat is dat precies?
1 Bekijk de video over gefractioneerde destillatie van aardolie.
2 Aardolie wordt ook wel het ‘zwarte goud’ genoemd.
Het is een mengsel dat bestaat uit vele componenten, die allemaal een nuttige toepassing hebben.
De meeste componenten gebruiken we als brandstoffen. Na de destillatie worden verschillende ‘fracties’ gevormd.
3 Waarom spreken we hier van fracties?
4 Vul de tekst aan. Schrap wat niet past.
De ruwe aardolie wordt verhit tot ongeveer 400 °C, zodat een groot gedeelte .
dalende dichtheid en kookpunt
oplopende dichtheid en kookpunt ruwe olie
kerosine voor vliegtuigen paraffine voor verlichting en verwarming 170 °C petroleum voor auto’s 120 °C chemicaliën 70 °C
smeerolie, glansen boenproducten diesel 270 °C
brandstof voor schepen, industrie en centrale verwarming 600 °C asfaltfractie voor wegen
De dampen stijgen op in de toren, koelen daarbij geleidelijk af en opnieuw.
Fracties met een laag / hoog kookpunt worden al snel gasvormig en stijgen hoog in de toren op alvorens te condenseren. Fracties met een laag / hoog kookpunt condenseren al onderaan in de toren. Om de verschillende fracties op te vangen, zijn op verschillende hoogten in de toren borrelkappen aangebracht. De bouw ervan zorgt ervoor dat opstijgende dampen door de openingen kunnen en de neerstromende vloeistof opgevangen wordt. Op verschillende plaatsen in de toren kan men dan de gewenste fracties aftappen.
Hoe lager / hoger een fractie in de toren wordt afgetapt, hoe lager het kookpunt van de verbindingen is en hoe korter / langer de koolstofketens zijn. Hoe lager / hoger in de toren afgetapt, hoe hoger het kookpunt van de verbindingen is en hoe korter / langer de koolstofketens zijn.
Wil je meer weten over de destillatie van aardolie en het principe van gefractioneerde destillatie? Bekijk dan de video.

OPDRACHT 22
Een andere veelgebruikte scheidingstechniek is extraheren of extractie: geur-, kleur- en smaakstoffen (het extract) kunnen worden onttrokken (geëxtraheerd) met behulp van een oplosmiddel (het extractiemiddel) waarin ze beter oplossen. We maken gebruik van het verschil in oplosbaarheid in verschillende oplosmiddelen.
Je hebt vast en zeker al op het etiket van een yoghurt- of frisdrankverpakking of andere voedingswaren deze zin gelezen: ‘met natuurlijke extracten’.
De producent heeft dan een natuurlijke kleur-, geur- of smaakstof aan het product toegevoegd.
Maar hoe krijgt bv. Fanta die mooie oranje kleur? De producent voegt caroteen als kleurstof toe. Caroteen is een oranje kleurstof die in veel natuurlijke producten voorkomt, zoals in wortelen. Kunnen we dergelijke kleurstoffen dan uit die producten halen? Zeker en vast!
Extraheer de geur- en kleurstoffen uit een sinaasappel.
1 Neem de schil van een sinaasappel en snijd ze in stukjes in een mortier.
2 Voeg nog wat sap van de sinaasappel toe en stamp alles verder fijn met de vijzel.
3 Voeg nu de alcohol toe die je destilleerde uit wijn in de vorige opdracht.
Wat neem je waar?
Door extractie met alcohol van de geur-, smaak en kleurstoffen uit de sinaasappel heb je nu een basis voor likeur gemaakt.
Ook bij het koffiezetten worden op die manier met behulp van heet water geur, kleur en smaak uit de koffiebonen in je koffie gebracht. Je past hier dus twee scheidingstechnieken tegelijkertijd toe: extractie en filtratie.

Geur-, kleur- en smaakstoffen (het extract) kunnen worden onttrokken (geëxtraheerd) met behulp van een oplosmiddel (het extractiemiddel) waarin ze beter oplossen. We maken gebruik van het verschil in oplosbaarheid in verschillende oplosmiddelen.
` Maak oefening 1 t/m 6 op p. 83 en 84.
De techniek van extractie wordt vaak ook gebruikt in de parfumindustrie, waarbij de geur van bloemen zoals rozen als extract wordt toegevoegd aan het parfum. Let op! Niet alle kleurstoffen zijn van natuurlijke oorsprong. Waar Fanta bijvoorbeeld wel met het natuurlijke caroteen wordt gekleurd, is dat voor Coca-Cola niet het geval. Cola dankt zijn zwarte kleur aan karamellisatie. De gebruikte kleurstof wordt bij voedingsmiddelen aangegeven op het etiket met een zogenaamde E-code. Op het etiket van een fles Fanta zul je zo E160a terugvinden, de code voor caroteen.

Je hebt nu meerdere scheidingstechnieken leren kennen, en misschien zelfs enkele technieken uitgeprobeerd. De componenten werden gescheiden op basis van verschillende stofeigenschappen, maar de componenten zelf bleven onveranderd. We maakten gebruik van verschillen in fysische eigenschappen van de stoffen en spreken over fysische scheidingstechnieken
OPDRACHT 23
Herhaal even.
1 Vul de tekst aan.
Een eerste scheidingstechniek die we zagen, was zeven. Die techniek is gebaseerd op een verschil in . Een voorbeeld is schelpjes en zand scheiden. Een tweede scheidingstechniek, ook gebaseerd op het verschil in , is
Zo kun je bijvoorbeeld kalk uit kalkwater halen met behulp van Daarnaast is er ook , gebaseerd op een verschil in massadichtheid.
Op die manier kun je olie van water scheiden. Indampen steunt dan weer op het verschil in , waardoor je bijvoorbeeld zout uit zeewater haalt. Het water zelf verdampt uiteraard. Wil je toch beide componenten behouden, dan maak je gebruik van de scheidingstechniek . Op die manier kun je uit wijn halen. Ten slotte weet je nu ook wat is: het onttrekken van geur-, en smaakstoffen met behulp van een waarin ze goed oplossen. Die techniek steunt dus op het verschil in in verschillende oplosmiddelen.
Zo kun je bijvoorbeeld olie uit pindanoten halen, vetten uit chips of de lekkere geur uit bloemen.
2 Welke scheidingstechniek kun je gebruiken voor welk soort mengsel en hoe doen ze dat in de industrie?
Ontdek het via de ontdekplaat bij het onlinelesmateriaal.
Uiteraard zijn er nog veel meer scheidingstechnieken. Zo is er adsorptie. Met die techniek kunnen bv. de blauwe inktmoleculen uit water gehaald worden, doordat ze beter hechten aan de actieve kool (het adsorptiemiddel) dan watermoleculen. Bij die scheidingstechniek maken we gebruik van het verschil in hechting aan een oppervlak
WEETJE
Gasmaskers bestaan al sinds het einde van de negentiende eeuw.
Ze sturen de ingeademde lucht eerst door een filter met actieve koolstof, die de giftige stoffen adsorbeert. Tijdens de Eerste
Wereldoorlog gebruikten het Duitse leger en de geallieerden mosterdgas, een giftig chloorgas dat door verontreinigingen in het mengsel de kleur en geur van mosterd kreeg. Dat gas was ook bekend onder de naam yperiet (naar de stad Ieper). Gasmaskers redden toen de levens van duizenden soldaten.
moleculen

Let op! Verwar de termen adsorptie en absorptie niet met elkaar. Absorptie is het opnemen van een stof in een andere stof. Zo kun je gemorst water opkuisen met een spons. De spons kan heel wat water absorberen.
adsorptie absorptie
We vermelden ook nog chromatografie, waarbij we ons baseren op het verschil in adsorptiesnelheid van componenten van een adsorptiemiddel enerzijds en anderzijds het verschil in oplosbaarheid in het oplosmiddel. Chromatografie wordt heel vaak toegepast in de industrie. De douane en politie kan met de techniek drugs zoals cocaïne en heroïne opsporen. Voedingsanalisten kunnen met die techniek dan weer de samenstelling van voedingswaren analyseren.

OPDRACHT 24
Je hebt nu kennisgemaakt met enkele belangrijke scheidingstechnieken. In de industrie, maar ook in het dagelijkse leven, worden vaak meerdere scheidingstechnieken tegelijkertijd of na elkaar uitgevoerd.
Scheid het mengsel olie – water – krijt met behulp van een scheidingsschema.
1 Beantwoord de vragen.
a Welk soort mengsel ontstaat als je olie, water en krijt bij elkaar voegt en roert?
b Wat gebeurt er met het krijt?
c Wat gebeurt er met het water en de olie?
d Welke scheidingstechniek zou je (op school) toepassen om de volgende mengsels te scheiden:
• olie en water:
• krijt en water:
2 Stel het scheidingsschema op.
OPDRACHT 25
ONDERZOEK
We proberen eerst theoretisch een scheidingsschema op te stellen, waarna we het schema uittesten in een labo. Je kunt kiezen uit deze scheidingstechnieken: zeven – filtreren – decanteren – indampen – destilleren.
Voer het labo rond scheidingsschema's uit. Je vindt het bij het onlinelesmateriaal.
Maak een mindmap over dit hoofdstuk.
Om je op weg te helpen, noteerden we alvast het basisbegrip uit dit thema: scheidingstechniek.
Probeer nu zelf een mindmap rond dat begrip te maken.
` Maak oefening 7 op p. 84.
Scheidingstechniek
Op welke stofeigenschap steunen de volgende scheidingstechnieken?
a destillatie:
b filtratie:
Noteer een gepaste scheidingstechniek om de bestanddelen van deze mengsels te isoleren.
a olie en azijn:
b bezinksel in wijn:
c goud en zand:
d bier (alcohol en water):
In het schema zie je verschillende soorten mengsels. Geef voor elk mengsel één voorbeeld.
Geef daarnaast ook weer met welke algemene scheidingsmethode de afzonderlijke componenten bekomen kunnen worden.
Vermeld in de laatste kolom aan de hand van welk kenmerk die scheiding gebeurt.
Type mengsel
Voorbeeld
ScheidingsmethodeSteunt op verschil in … heterogeen vast-vloeibaar homogeen vast-vloeibaar homogeen vloeibaar-vloeibaar
Met welke scheidingsmethodes kunnen homogene en heterogene mengsels gescheiden worden?
Plaats telkens een kruisje in de juiste kolom.
Scheidingsmethode
Soort mengsel Homogeen
Heterogeen filtratie destillatie
Markeer de juiste scheidingstechniek. Welke techniek gebruik je om de volgende mengsels te scheiden?
Kies telkens voor de meest eenvoudige techniek.
Mengsel
Een mengsel van stof A (smeltpunt –10 °C; kookpunt 80 °C) en stof B (smeltpunt 420 °C; kookpunt 1 280 °C).
Stof B is goed oplosbaar in stof A. Je wilt stof B verder onderzoeken.
Een oplossing van kopersulfaat (smeltpunt: 200 °C; kookpunt: 650 °C) in ethanol (smeltpunt: –117 °C ; kookpunt 78 °C). Beide vloeistoffen heb je nodig voor verder onderzoek.
Een mengsel van looddichloride (smeltpunt: 501 °C; kookpunt: 950 °C) en water. Looddichloride lost niet op in water.
Scheidingstechniek (markeer)
zeven – filtreren –decanteren – centrifugeren –indampen – destilleren
zeven – filtreren –decanteren – centrifugeren –indampen – destilleren
zeven – filtreren –decanteren – centrifugeren –indampen – destilleren
Met welke methodes zijn de volgende mengsels te scheiden in hun bestanddelen? azijn en water – jenever – kleideeltjes die zweven in water – zand en water
a filtratie:
b destillatie:
Stel een logisch scheidingsschema op voor deze heterogene mengsels, zodat je de samenstellende componenten overhoudt. Water moet je bekomen als een vloeistof! Vermeld bij elke techniek die je gebruikt het kenmerk (bv. deeltjesgrootte) dat gebruikt wordt om de bestanddelen te scheiden.
a een mengsel van water, zand, benzine en zout
b een mengsel van water, een witte vaste stof en een groene vaste stof (geen van beide stoffen lost op in water en enkel de witte stof lost op in olie)
` Verder oefenen? Ga naar
LEERDOELEN
Je kunt al:

L het verschil tussen materie, voorwerp en stof toelichten;
L aggregatietoestanden toelichten met behulp van het deeltjesmodel;
L het onderscheid maken tussen een zuivere stof (of kortweg stof) en een mengsel;
L mengsels onderverdelen in homogene en heterogene mengsels.
Je leert nu:
L zuivere stoffen verder onderverdelen in enkelvoudige en samengestelde stoffen.
Vorig jaar leerde je het onderscheid tussen een voorwerp en stof definiëren. Je weet dus dat een voorwerp is opgebouwd uit stoffen. Bovendien is er een verschil tussen een zuivere stof en een mengsel. Mengsels hebben we ondertussen verder leren onderverdelen in homogene en heterogene mengsels. Vervolgens hebben we geleerd hoe mengsels in zuivere stoffen kunnen gescheiden worden. Kunnen we ook de zuivere stoffen verder onderverdelen?
STOF
MENGSEL
HOMOGEEN ? HETEROGEEN ?
We zoeken het uit aan de hand van een experiment.
OPDRACHT 26
Ontleding van water (H2O)
1 Onderzoeksvraag
Is water nog verder te ontleden in andere stoffen?
2 Hypothese
Ik denk dat water wel / niet verder ontleed kan worden in andere stoffen, want ...
3 Benodigdheden
toestel van Hofmann + gelijkstroombron
kraantjeswater
twee proefbuizen
lucifers
houtspaander (of satéstokje)
vloeistoftrechter
4 Werkwijze Waarnemingen
1 Je leerkracht vult het toestel van Hofmann met water met behulp van de vloeistoftrechter.
2 Er wordt gedurende enkele minuten een gelijkstroom door de vloeistof gestuurd.
3 Aan beide polen wordt gas gevormd, maar hoe zit het met de hoeveelheid gas?
positieve pool negatieve pool
Afb. 29 Opstelling proef van Hofmann
4 Je leerkracht vangt het gevormde gas aan de positieve pool op in een proefbuis.
5 Hij/zij brengt een gloeiende houtspaander in die proefbuis.
6 Wat neem je waar?
Het gas ter hoogte van de positieve pool:
7 Je leerkracht vangt nu het gas aan de negatieve pool op in een proefbuis.
9 Hij/zij brengt een brandende lucifer in die proefbuis.
10 Wat neem je waar?
Het gas ter hoogte van de negatieve pool:
5 Verwerking
Het gas dat aan de positieve pool gevormd wordt, is zuurstofgas. Zuurstofgas bevordert de verbranding en kan op die manier geïdentificeerd worden. Een smeulende houtspaander begint terug te branden als je er zuurstofgas aan toevoegt.
Het gas dat aan de negatieve pool gevormd wordt, is waterstofgas. In combinatie met zuurstofgas en een brandende lucifer geeft dat een luide knal. Vandaar dat waterstofgas ook wel knalgas genoemd wordt. Er wordt water gevormd.
6 Besluit
Formuleer een antwoord op de onderzoeksvraag.
Stoffen die nog verder ontleed kunnen worden, noemen we samengestelde stoffen. Water is dus een voorbeeld van een samengestelde stof. Wetenschappelijk onderzoek heeft aangetoond dat waterstofgas en zuurstofgas niet meer verder ontleed kunnen worden. Stoffen die niet meer verder ontleed kunnen worden, noemen we enkelvoudige stoffen. Een enkelvoudige stof bestaat uit één atoomsoort of element. Een reactie waarbij een samengestelde stof wordt omgezet in meer eenvoudige (al dan niet enkelvoudige) stoffen, heet een ontleding of analyse. In opdracht 26 heb je gebruikgemaakt van elektrische energie om water te splitsen in waterstofgas en zuurstofgas. Dat proces wordt elektrolyse genoemd (elektro: elektriciteit; lysis: stukmaken). Ook voor andere energiebronnen bestaan specifieke termen.
• warmte: thermolyse (stukmaken met warmte)
• licht: fotolyse (stukmaken met licht)
Stoffen kunnen dus (naar analogie van homogene en heterogene mengsels) verder opgedeeld worden in enkelvoudige en samengestelde stoffen.
Om het verhaal volledig te maken: waterstofgas en zuurstofgas zijn niet meer te ontleden (omdat het enkelvoudige stoffen zijn), maar het is wel mogelijk om waterstofgas en zuurstofgas te combineren en zo opnieuw water te bekomen. Daardoor heeft zich waterdamp in de proefbuis gevormd na de knal bij het aansteken van het waterstofgas. Die chemische reactie waarbij stoffen zich met elkaar verbinden tot een (complexere) samengestelde stof, noemen we een synthese. Analyse en synthese zijn tegengestelde chemische reacties. In thema 6 gaan we verder in op de analyse en synthese van stoffen.
ENKELVOUDIG
STOF MENGSEL
HOMOGEEN
• Stoffen die nog verder ontleed kunnen worden, noemen we samengestelde stoffen
HETEROGEEN
• Stoffen die niet meer verder ontleed kunnen worden, noemen we enkelvoudige stoffen
• Een reactie waarbij een samengestelde stof wordt omgezet in meer eenvoudige (al dan niet enkelvoudige) stoffen, heet een ontleding of analyse
• Een ontleding met behulp van elektrische energie, wordt een elektrolyse genoemd.
• Een ontleding met warmte heeft de specifieke naam thermolyse, terwijl fotolyse een ontleding met behulp van licht is.
` Maak oefening 1, 2 en 3 op p. 89.
Duid aan: enkelvoudige stof of samengestelde stof.
waterstofgas (H2)
enkelvoudige stof
samengestelde stof zuiver water
Bij de verbranding van suiker wordt koolstof, water en CO2 gevormd. Suiker is een …
Na een kampvuur blijft er van de houtblokken enkel nog as (koolstof) over. Koolstof is een …
Plaats in de juiste kolom:
enkelvoudige stof
samengestelde stof
enkelvoudige stof
samengestelde stof
enkelvoudige stof
samengestelde stof
gedestilleerd water – kraantjeswater – koolstof – waterstofgas – zuurstofgas – wijn –zand in een glas water – zout in een glas water
Enkelvoudige stofSamengestelde stofHomogeen mengselHeterogeen mengsel
Bij de elektrolyse van water, heb je ontdekt dat water een samengestelde stof is, terwijl waterstofgas en zuurstofgas enkelvoudige stoffen zijn. Hieronder zie je de symbolische en visuele voorstelling van deze stoffen.
Naam
Symbolische voorstelling
Visuele voorstelling
a Het valt op dat een samengestelde stof bestaat uit één soort / meerdere soorten deeltjes, terwijl een enkelvoudige stof bestaat uit één soort / meerdere soorten deeltjes (schrap wat niet past).
b Vul nu de tabel verder aan.
CH4 of methaangas is het gas in de scheetjes van koeien en mensen. Omdat dat gas zorgt voor opwarming van de aarde, wordt er al eens inventief mee omgegaan. Zo vangen
Nederlandse boeren het gas van de koeien op om later de stallen mee te verwarmen.

Jaarlijks sterven honderd Belgen aan CO-vergiftiging
Chloorgas of Cl2 is een geel gas dat tijdens de Eerste Wereldoorlog werd ingezet als giftig wapen: het tastte de slijmvliezen aan, waardoor verstikking optrad. Omdat het zwaarder is dan lucht, bleef het in de loopgraven hangen.

Zwavel (S8) herken je aan zijn specifieke geur. Je treft het vooral aan in actieve vulkanische gebieden.
Als je graag een ballon laat zweven op je verjaardagsfeestje, vul je hem best met helium (He).
` Verder oefenen? Ga naar .

samengestelde stof
enkelvoudige stof
samengestelde stof
enkelvoudige stof
samengestelde stof
enkelvoudige stof
samengestelde stof
enkelvoudige stof
samengestelde stof
enkelvoudige stof
samengestelde stof
enkelvoudige stof
samengestelde stof
enkelvoudige stof
Kernbegrippen
Kernvragen
HOOFDSTUK 1: Hoe onderscheiden we stoffen van elkaar?
Notities
Eigenschappen, die specifiek zijn voor een stof en waarmee je stoffen van elkaar kunt onderscheiden, noemt men stofeigenschappen.
Soorten stofeigenschappen:
- massadichtheid
- kookpunt
- smeltpunt
- geleidbaarheid
- oplosbaarheid
- massadichtheid: geeft de verhouding weer tussen de massa van een stof en het volume dat die stof inneemt bij een bepaalde temperatuur. Als gevolg van een verschil in massadichtheid zal één stof gaan bovendrijven.
- kookpunt van een vloeistof: de temperatuur waarbij een vloeistof overgaat van de vloeibare fase naar de gasvormige fase
- smeltpunt van een vaste stof: de temperatuur waarbij de stof overgaat van de vaste fase naar de vloeibare fase
- (elektrische) geleidbaarheid: de mogelijkheid van stoffen om, in gesmolten of opgeloste toestand, de elektrische stroom te geleiden.
- thermische geleidbaarheid: de mogelijkheid van stoffen om warmte te transporteren
- oplosbaarheid: je kijkt of de stof al dan niet oplost in water. Water dient dan als oplosmiddel en de stof die je oplost wordt de opgeloste stof genoemd. Samen vormen ze dan een oplossing.
HOOFDSTUK 2: Is het een zuivere stof of een mengsel?
(zuivere) stof
mengsel van zuivere stoffen
homogene mengsels
heterogene mengsels
- Een zuivere stof wordt gekenmerkt door welbepaalde waarden voor een hele reeks stofeigenschappen (smeltpunt, kookpunt, massadichtheid …). Die waarden zijn constant en karakteristiek (typisch voor de stof).
- Een mengsel van stoffen bevat meerdere stoffen. Als we naar kookpunt enz. kijken, zijn de waarden voor die grootheden afhankelijk van de samenstelling van het mengsel.
- Homogene mengsels = mengsels waarin je de verschillende componenten met het blote oog niet meer van elkaar kunt onderscheiden (oplossingen).
- Heterogene mengsels = mengsels waarin je ten minste een van de componenten kunt onderscheiden
Kernbegrippen
Kernvragen
ZUIVERE
Notities
HOOFDSTUK 2: Is het een zuivere stof of een mengsel?
Op basis van de aggregatietoestand van de twee componenten krijgen sommige heterogene mengsels nog een specifieke naam:
- rook - nevel - schuim - suspensie
- emulsie
aerosol
vast in gasfase = rook vloeistof in gasfase = nevel gas in vloeistoffase = schuim vast in vloeistoffase = suspensie vloeistof in vloeistoffase = emulsie
vast of vloeistof in gasfase = aerosol (bv. rook, nevel)
HOOFDSTUK 3: Hoe kunnen we een mengsel van stoffen scheiden?
Scheidingstechnieken op basis van:
- verschil in deeltjesgrootte zeven
filtreren - filtratie filtraat, residu
- verschil in massadichtheid decanteren
Zeven: scheiding op basis van deeltjesgrootte
De grotere korrels kunnen niet door de zeef, maar de kleinere component(en) wel.
Gebruikt voor: heterogene mengsels (v + v, v + vl)
Filtreren, filtratie: scheiding op basis van deeltjesgrootte
Vaste korrels zijn groter dan vloeistof- of gasdeeltjes. De vaste korrels kunnen niet door de poriën van de filter, maar de vloeistof of het gas wel. De vaste deeltjes die achterblijven, worden het residu genoemd. Wat door de filter gaat, is het filtraat.
Gebruikt voor: heterogene mengsels (v + vl, vl + g, v + g)
Decanteren: scheiding op basis van verschil in massadichtheid
Elke stof heeft zijn eigen massadichtheid, waardoor zich afzonderlijke lagen zullen vormen (eventueel na verloop van tijd). Die lagen kunnen, min of meer, van elkaar gescheiden worden door het afgieten van de bovenste laag. Decanteren kan ook met behulp van een scheitrechter.
Gebruikt voor: heterogene mengsels (v + vl, vl + vl)
centrifugeren - centrifugatie
- verschil in kookpunt indampen
Centrifugeren: scheiding op basis van verschil in massadichtheid
Met behulp van machines (die het effect van de zwaartekracht versterken) zullen die lagen beter van elkaar gescheiden kunnen worden dan via decanteren.
Gebruikt voor: heterogene mengsels (v + vl, vl + vl)
Indampen: scheiding op basis van verschil in kookpunt
Door het opwarmen van het mengsel en het verschil in kookpunt, verdampt de vloeistof en blijven enkel de vaste deeltjes (of de vloeistof met het hogere kookpunt) over.
Gebruikt voor: homogene mengsels (v + vl, vl + vl)
Kernbegrippen
Kernvragen
Notities
HOOFDSTUK 3: Hoe kunnen we een mengsel van stoffen scheiden?
destilleren - destillatie destillaat
extraheren - extractie extract en extractiemiddel
Destilleren: scheiding op basis van verschil in kookpunt
Wanneer het mengsel aan de kook wordt gebracht, zal de component met het laagste kookpunt eerst verdampen. De gassen die zo ontstaan worden door een liebigkoeler geleid, zodat ze terug condenseren. Zo verkrijg je een destillaat. In tegenstelling tot indampen, worden beide componenten opgevangen.
Gebruikt voor: homogene mengsels (v + vl, vl + vl)
Extraheren scheiding op basis van verschil in oplosbaarheid
Geur-, kleur- en/of smaakstoffen kunnen onttrokken worden aan een stof omdat ze beter oplossen in een ander oplosmiddel.
Gebruikt voor: homogene mengsels (v + vl, vl + vl)
HOOFDSTUK 4: Kunnen we zuivere stoffen nog verder indelen?
analyse of ontleding elektrolyse thermolyse fotolyse
enkelvoudige stof samengestelde stof
ontleding of analyse = chemische reactie waarbij een complexe stof wordt omgezet in eenvoudigere stoffen
- met elektrische energie = elektrolyse
- met warmte = thermolyse
- met licht = fotolyse
Zuivere stoffen worden verder onderverdeeld in:
- enkelvoudige stoffen kunnen niet meer verder ontleed worden;
- samengestelde stoffen kunnen verder ontleed worden.
1 Begripskennis
Ik kan de volgende begrippen uitleggen:
• voorwerp
• stof
• stofeigenschap
• homogeen mengsel
• heterogeen mengsel
• zuivere stof
• kookpunt
• smeltpunt
• massadichtheid
• scheidingstechniek
• zeven
• filtreren
• decanteren
• centrifugeren
• indampen
• destilleren
• oplossing
• rook
• nevel
• schuim
• suspensie
• emulsie
• aerosol
• analyse
• enkelvoudige stoffen
• samengestelde stoffen
2 Onderzoeksvaardigheden
• Ik kan stoffen onderscheiden op basis van stofeigenschappen.
• Ik kan zuivere stoffen onderscheiden van mengsels op basis van het aantal soorten deeltjes.
• Ik kan typische voorbeelden van homogene en heterogene mengsels herkennen en benoemen als oplossing, emulsie of suspensie.
• Ik kan specifieke soorten mengsels benoemen zoals rook, nevel, schuim, aerosol ...
• Ik kan voor een mengsel een geschikte scheidingstechniek voorstellen.
• Ik kan voor de geschikte scheidingstechniek verklaren op welke eigenschap de scheiding gebaseerd is.
• Ik kan een scheidingsschema voorstellen voor een mengsel.
• Ik kan zuivere stoffen onderverdelen in enkelvoudige of samengestelde stoffen.
JANOG OEFENEN
` Je kunt deze checklist ook op invullen bij je Portfolio.
Je maakte tijdens de CHECK IN een mengsel van kiezelsteentjes, zout en water. Je hebt in de CHECK IN weliswaar niet echt getoverd, maar wel gebruikgemaakt van chemische mengsels en scheidingstechnieken.
1 Benoem de mengsels. Schrap wat niet past.
• Het mengsel kiezelsteentjes-zout is een homogeen / heterogeen mengsel.
• Het mengsel kiezelsteentjes-water is een homogeen/ heterogeen mengsel.
• Het mengsel zout-water is een homogeen/ heterogeen mengsel. We noemen dat ook een oplossing.
2 Bovendien ben je nu ook in staat om dit mengsel te scheiden in zijn afzonderlijke (zuivere) stoffen volgens het juiste scheidingsschema. Vul het scheidingsschema verder aan. Misschien vind je meer dan een oplossing?

KIEZELSTENEN + ZOUT + WATER
Op basis van:
Scheidingstechniek:
Op basis van:
Scheidingstechniek:
Er zijn homogene en heterogene mengsels. We gebruiken verschillende scheidingstechnieken om de stoffen terug van elkaar te scheiden: zeven, filtreren, decanteren, centrifugeren, indampen en destilleren.
De wetenschap is continu op zoek naar een ruimer beeld van het heelal.
Sinds 2018 wordt ‘de planetenjager’ TESS (Transiting Exoplanet Survey Satellite) gebruikt om op zoek te gaan naar leven en bewoonbare planeten buiten ons zonnestelsel. Het is de krachtigste telescoop tot nog toe. In januari 2020 werd voor het eerst een bewoonbare planeet ontdekt buiten ons zonnestelsel. De planeet kreeg voorlopig de naam ‘TOI700d’ en is meer dan 100 lichtjaar van onze aarde verwijderd.

Met preciezere apparatuur slagen wetenschappers er ook in om steeds kleinere deeltjes te bekijken. In de lessen natuurwetenschappen heb je vast al gehoord of gebruikgemaakt van een microscoop.



Atomen zijn voor de mens niet zichtbaar met het blote oog, maar ondertussen zijn we in staat steeds kleinere deeltjes te bekijken. Organismen, onderdelen van planten … die je normaal niet kunt zien met het blote oog, worden plots zichtbaar.
In 1931 werd de eerste elektronenmicroscoop gebouwd. We zijn daardoor nu in staat om kleine cellulaire onderdelen tot een paar miljoen keer of meer groter te zien.
Afb. 33 De elektronenmicroscoop bij de Vrije Universiteit Brussel
` Hoever hebben we stoffen al kunnen ontleden?
` Zijn we al beland bij het kleinste deeltje?
We zoeken het uit!
OPDRACHT 1
Bekijk enkele voorstellingen van zuivere stoffen en mengsels in de tabel.
1 Kruis bij elke voorstelling aan of het gaat om een zuivere stof of om een mengsel.
mengsel zuivere stof
mengsel zuivere stof
mengsel zuivere stof
2 Leg in je eigen woorden het verschil uit tussen een zuivere stof en een mengsel.
mengsel zuivere stof
OPDRACHT 2
Maak bij zuivere stoffen het onderscheid tussen enkelvoudige en samengestelde stoffen.
1 Kruis bij elke voorstelling aan of het gaat om een enkelvoudige of een samengestelde stof.
enkelvoudige stof samengestelde stof
enkelvoudige stof samengestelde stof
enkelvoudige stof samengestelde stof
2 Leg in je eigen woorden het verschil uit tussen een enkelvoudige stof en een samengestelde stof.
3 Een deeltje water bestaat uit waterstof en zuurstof. Teken zelf een voorstelling van de stof water.
4 Teken twee voorstellingen die je buurman of buurvrouw maakte.
5 Wat stel je vast op basis van de antwoorden bij vraag 3 en 4?
6 Staan er in de onderstaande figuur deeltjes waarvan jij misschien al gehoord hebt en waarvan je denkt dat ze in een atoom aanwezig zijn? Schrap de deeltjes waarvan je denkt dat ze niet in een atoom voorkomen.
chips
molecule virus
quarks ozon neutrino
proton elektron zout
aerosol hemoglobine neten
hadronen neutron stuifmeel
Je hebt nu eigenlijk al kleinere deeltjes getekend dan dat je met de microscoop kunt waarnemen. Vanuit je algemene kennis heb je een molecule water getekend, zuurstofatomen en waterstofatomen. Gaandeweg zullen we de betekenis van al die deeltjes verduidelijken en op zoek gaan naar nog kleinere deeltjes.
LEERDOELEN
Je kunt al:
L toelichten dat mengsels gescheiden kunnen worden in zuivere stoffen;
L zuivere stoffen indelen in enkelvoudige en samengestelde stoffen;
L toelichten dat een enkelvoudige stof bestaat uit één atoomsoort of element.
Je leert nu:

1
L de namen en de symbolen van veelvoorkomende elementen.
Tenzij je hebt samengewerkt met je buurman of buurvrouw, zijn er verschillen in jullie voorstellingen van de stof water bij opdracht 2. Dat maakt het natuurlijk een beetje moeilijk: hoe kan iemand anders jouw voorstellingen probleemloos interpreteren? Daar moeten we dus afspraken over maken. Wetenschappers over de hele wereld moeten namelijk met elkaar communiceren op een eenduidige, ondubbelzinnige manier.
OPDRACHT 3
Vergelijk de webpagina’s.
1 Bekijk deze webpagina’s voor ‘koolstof’

Naam: koolstof / carbonium
Symbool: C
Atoomnummer: 6
Groep: koolstofgroep
Periode: periode 2
Blok: p-blok
Reeks: niet-metaal
Kleur: kleurloos of zwart
Generale
Nome: carbonio
Symbolo: C
Numero: 6
Serie: non metalli
Durezza: 0,5 (grafite), 10 (diamante)
Blocco: p
Serie: non metalli

Colore: / diamante grafite




Yleinen
Nimi: hiili
Tunnus: C
Järjestysluku: 6
Luokka: epämetalli
Lohko: p
Jakso: 2
Ryhmä: 14
Kovuus: 0,5 (grafiitti), 10,0 (timantti)
Väri: musta (grafiitti), väritön (timantti)
2 Wat valt je op als je de drie pagina’s vergelijkt?
Het symbool voor een element is in de hele wereld identiek. Het uniforme gebruik van dezelfde symbolen voor eenzelfde element maakt uitwisseling van informatie makkelijker.
Nederlands Frans Engels Duits Spaans Latijn koolstof carbon carbon kohlenstoff carbono carbonium
Nederlands Frans Engels Duits Spaans Latijn chloor chlore chlorine chlor cloro chlorum Afb. 37a Afb. 37b
Een element is een type of een atoomsoort. Een atoom is een deeltje van dat type. Elk element (of elke atoomsoort) heeft een naam en een symbool. Die symbolen zijn in alle talen hetzelfde. De naam van het element verschilt volgens de taal, maar is meestal afgeleid van de oorspronkelijke Latijnse benaming.
Bekijk afbeelding 37a en 37b in de tabel. Je ziet dat:
• sommige elementen één hoofdletter als symbool hebben;
• sommige elementen twee letters als symbool hebben.
In het tweede geval, hier op afbeelding 37b, bestaat het symbool uit een hoofdletter gevolgd door een kleine letter.
• Een element is synoniem voor een atoomsoort. Het is de verzamelnaam voor alle atomen die dezelfde chemische eigenschappen hebben.
• Een atoom is het kleinste deeltje van een element dat nog steeds alle eigenschappen van het element heeft.
WEETJE
Sommige elementen zijn genoemd naar een land (polonium, francium), een stad (dubnium: Dubna in Rusland; strontium: Strontian in Schotland), een wetenschapper (einsteinium: Albert Einstein; curium: Marie Curie), Romeinse goden (neptunium, plutonium) of een eigenschap (broom: Gr. bromos = stank; chloor: Gr. chloros = groen).
Meer weten? Bekijk het overzicht via de QR-code. NAAMGEVING ELEMENTEN
De onderstaande tabel bevat de voor ons belangrijkste elementen en hun symbolen. Voor een goed begrip van de rest van de leerstof chemie is het belangrijk dat je de namen en symbolische voorstelling van deze elementen onthoudt en kunt toepassen.
SymboolNaamSymboolNaamSymboolNaam HwaterstofSisiliciumHgkwik HeheliumPfosfor Pb lood LilithiumSzwavel Co cobalt Beberyllium Cl chloorIjood BboorArargonNinikkel CkoolstofKkalium Pt platina Nstikstof Ca calcium Cd cadmium
Ozuurstof Fe ijzerUuraan Ffluor Cu koperSntin
Neneon Zn zink Cr chroom NanatriumBrbroom Mnmangaan MgmagnesiumAgzilver Asarseen AlaluminiumAugoud Babarium
` Maak oefening 1 op p. 104.
Met elk nieuw element dat ontdekt werd, begonnen wetenschappers te beseffen dat er verbanden waren tussen de elementen. Zo kwam het idee om ze allemaal in een tabel te plaatsen (de tabel van Mendelejev). Welke verbanden dat precies zijn, kom je te weten in thema 4.
OPDRACHT 4
Oefen je kennis van de symbolen.
Oefen met behulp van flashcards de namen van de elementen en hun symbolen.
OEFEN MET FLASHCARDS
TIP
Je kunt ook ezelsbruggetjes maken om de elementen te onthouden, bv. ‘Au’ hoor je in ‘goud’. Verzin er zelf nog een paar!
Vul de tabel aan met de juiste naam of het juiste symbool voor elk element.
` Verder oefenen? Ga naar
LEERDOELEN
Je kunt al:
L begrijpen dat wetenschappelijke kennis het resultaat is van voortdurend onderzoek.
Je leert nu:

L de historische evolutie van de atoommodellen van Dalton tot en met Bohr begrijpen en de evolutie chronologisch weergeven;
L de bouw van een atoom (volgens het gecombineerde atoommodel van Bohr-Rutherford) toelichten;
L het atoommodel met een tekening weergeven.
Net als wij willen wetenschappers steeds kleinere deeltjes ontleden. De kennis die we vandaag hebben, is te danken aan eeuwen van voortbouwend onderzoek en wetenschappelijke proeven. Een ontdekking is vaak het werk van één wetenschapper of één team, maar een wetenschappelijke theorie is het resultaat van vele bijdragen.
Elk mengsel bestaat uit een of meerdere soorten stoffen. In het voorbeeld van spuitwater (afbeelding 38) zien we dat stoffen – of materie – bestaan uit nog kleinere verbindingen. En ook die verbindingen kunnen nog verder opgedeeld worden tot we uiteindelijk bij atomen uitkomen.
spuitwater
zuivere stof mengsel
Afb. 38 Spuitwater
atomen verbindingen
We maken een onderscheid tussen een voorwerp, materie, stof, verbinding en elementen.
Een voorwerp is opgebouwd uit een bepaalde materie. Materie is opgebouwd uit stoffen.
Stoffen zijn verbindingen van deeltjes of atomen. Atoomsoorten of elementen zijn de verschillende atomen waaruit een verbinding bestaat.
OPDRACHT 5
Bekijk de afbeeldingen en vul de tabel aan.

Begrip Afbeelding 39

Afbeelding 40 voorwerp materie stoffen
verbindingen van onder meer … C12H22O11 atoomsoorten of elementen
OPDRACHT 6
Er bestaan dus verschillende soorten elementen. Van een handvol daarvan ken je intussen het symbool en de naam. Elke verbinding is opgebouwd uit bouwstenen: de atomen. Maar hoe is zo’n atoom zelf opgebouwd?
Teken hoe jij denkt dat een atoom eruitziet en beschrijf aan je buur.


Onze wetenschappelijke kennis is er in de loop der tijd sterk op vooruitgegaan. Nieuwe technologieën zorgden ervoor dat onze inzichten in de bouw van het atoom veranderden doorheen de eeuwen. Bijgevolg moesten de modellen die we gebruiken om een atoom voor te stellen, aangepast worden. Er is ondertussen al een hele weg afgelegd, waarbij wetenschappers steeds verder bouwden op de kennis van hun voorgangers.
Bekijk de chemische tijdlijn waarbij de belangrijkste mijlpalen in de evolutie van het atoommodel worden aangestipt. Maar denk eraan: met nieuwe technieken komen nieuwe inzichten. Deze tijdlijn kan dus in de toekomst (of in komende schooljaren) nog verder aangevuld worden. Scan de QR-code voor een meer uitgebreide versie van de tijdlijn.
De Griekse filosofen Democritus en Leucippus formuleren de grondbeginselen van het atomisme, de leer die stelt dat alle stoffen zijn opgebouwd uit ontelbare minuscule en ondeelbare blokjes: atomen (Grieks: atomos = ondeelbaar).

De Engelsman John Dalton stelt in navolging van de filosofen uit de Oudheid dat een stof bestaat uit kleine ‘bollen’. Deze bollen, die nog alle eigenschappen van de stof bezitten, noemt ook hij atomen.

De Engelsman William Prout stelt dat waterstof het lichtste element is en dat de massa van alle andere elementen een veelvoud van de massa van waterstof is. Hij stelt dat waterstof het elementaire deeltje is en geeft het de naam ‘protyle’ mee.
De Rus Dimitri Mendelejev rangschikt de elementen in groepen met soortgelijke eigenschappen. Op basis van die gegevens plaatste hij de elementen onder elkaar: het periodiek systeem der elementen.
De Belg Jean-Servais Stas, steunend op het werk van Prout, ontdekt dat de atoommassa van koolstof twaalfmaal groter is dan de atoommassa van waterstof.

In navolging van de Engelsman Crookes gebruikt de Duitser Eugen Goldstein fluorescerende lampen om negatief geladen en positief geladen deeltjes te onderscheiden. Met de Crookes-buis bewijst hij dat de positief geladen deeltjes vastzitten in een kern, terwijl de negatief geladen deeltjes vrij kunnen bewegen.
Pierre en Marie Curie zetten het werk van Becquerel verder. Ze bestuderen uranium en ontdekken polonium en radium. Bovendien stellen ze vast dat dergelijke zware atomen in staat zijn om positieve deeltjes uit de kern weg te zenden als straling.

1902
Joseph John Thomson is de eerste om het elektron te ‘meten’. De Brit beschrijft een atoom als een licht positief geladen bol met binnenin zeer kleine elektronen. Voortbouwend op de experimenten van Crookes en Goldstein heeft hij het over vrij bewegende elektronen.

De Fransman Antoine
Henri Becquerel ontdekt dat sommige elementen een zeer sterke straling afgeven en spontaan vervallen in andere elementen. Hij is een pionier in het onderzoeksdomein radioactiviteit. Tot op vandaag is de SI-eenheid voor radioactiviteit nog steeds de ‘becquerel’.

De Deen Niels Bohr stelt dat elektronen niet willekeurig rond de positieve kern bewegen, maar dat ze zich op zogenaamde elektronenschillen bevinden, die groter worden naarmate ze verder van de kern verwijderd zijn. En hoe verder van de kern, hoe meer elektronen de schil kan bevatten. Het aantal elektronen op de buitenste schil bepaalt de eigenschappen van het atoom.
Een schematische voorstelling van het atoommodel van Bohr
De Nieuw-Zeelander
Ernest Rutherford verenigt alle voorgaande theorieën in het idee dat een atoom bestaat uit een centrale positief geladen kern, omgeven door een elektronenmantel met negatief geladen elektronen. Hij komt tot dat besluit aan de hand van het beroemde bladergoudexperiment.
1932
Sir James Chadwick ontdekt het neutron, een elementair deeltje zonder elektrische lading dat zich in de kernen van alle atomen bevindt (uitgezonderd waterstof). De massa van een neutron is ongeveer gelijk aan de massa van een proton. In tegenstelling tot een proton, is een neutron echter ongeladen.



Zoals je ziet in de tijdlijn, komen wetenschappers steeds tot een besluit op basis van waarnemingen. Met behulp van proeven en opzoekwerk krijgen ze inzicht in hun onderzoeksvragen en hypotheses, om zo een denkbeeld of model te vormen. Een model is een voorstelling van de werkelijkheid, gebaseerd op wetenschappelijke waarnemingen. Het is geen letterlijke weergave van de werkelijkheid. Zolang experimenten verklaard kunnen worden met het bestaande model, blijft dat model gelden. Maar omdat er steeds nieuwe inzichten ontstaan (en meer nauwkeurige meetapparatuur), worden de bestaande modellen voortdurend aangepast en verfijnd. Modellen zijn dan ook dynamisch
In de wetenschappen gebruiken we modellen die een voorstelling van de werkelijkheid bieden op basis van wetenschappelijke waarnemingen. Een atoommodel is op die manier een voorstelling van een atoom, op basis van de wetenschappelijke waarnemingen van dat moment. Omdat de wetenschappelijke kennis toeneemt, is er steeds nood aan nieuwe modellen. Het atoommodel is dus dynamisch: het wordt aangepast aan nieuwe inzichten.
Laten we nu enkele belangrijke waarnemingen en experimenten nader bekijken. Die waarnemingen zorgden er immers voor dat eerst Thomson, dan Rutherford en ten slotte Bohr met een nieuwe voorstelling van het atoommodel kwamen.
OPDRACHT 7 DEMO
Bekijk de proeven die tot de huidige voorstelling van het atoommodel hebben geleid.
Proef 1 – Elektrostatica
1 Je leerkracht neemt een pvc-buis en brengt ze in de buurt van enkele materialen. Noteer wat je waarneemt in de tabel.
PapierKersenpit aan een touw
Waterstraal pvc-buis
2 Je leerkracht wrijft vervolgens snel met de pvc-buis over een wollen lap en brengt de buis opnieuw in de buurt van de materialen. Noteer opnieuw wat je waarneemt.
PapierKersenpit aan een touw
pvc-buis na wrijven
Besluit
Waterstraal

Op deze manier toon je zoals Thomson aan dat het atoommodel van Dalton moest aangepast worden. Je kunt neutrale atomen immers opeens toch positief of negatief geladen maken: er komen deeltjes vrij uit de atomen. Met andere woorden: atomen zijn deelbaar. Die deeltjes die makkelijk vrijkomen, kregen de naam elektronen. Thomson herdefinieert zo het atoommodel:
1 Atomen zijn massief en elektrisch neutraal.
2 Aan de buitenzijde van het atoom bevinden zich negatief geladen elektronen
3 Het atoom bevat een positieve, geleiachtige massa die het hele atoom omvat.
Proef 2 – Goudfolie-experiment van Rutherford
1 Bekijk het filmpje met de uitleg in verband met het goudfolie-experiment van Rutherford.
2 Beantwoord de vragen.
a Wat verwachtte Rutherford op basis van het atoommodel van Thomson dat er met de stralen ging gebeuren?
OPDRACHT 7 (VERVOLG) DEMO
b Waarom ketsen sommige stralen af en keren ze zelfs terug?
c Bekijk nu de applet. De atoommodellen van Thomson en Rutherford worden daar vergeleken.
d Pas eventueel je antwoorden bij vraag a en b aan. Je kunt de aanpassingen hier noteren.
Besluit
Rutherford toonde aan dat de geleiachtige positieve massa waarover Thomson het had, eigenlijk een centrale positieve, massieve kern was met daarrond een grote ijle ruimte (waarin de elektronen vrij rondzweefden).
Proef 3 – Vlamproeven van Bohr
1 Je leerkracht brengt enkele zouten (in poedervorm) aan op een ijzeren nagel en houdt ze in de vlam van de bunsenbrander.
2 Noteer je waarnemingen in de tabel.
vlamkleur
Besluit
De vlam voegt aan de atomen extra energie toe waardoor de elektronen naar een hoger energieniveau springen. Wanneer ze terugvallen naar hun oorspronkelijk energieniveau, sturen de elektronen lichtstralen (energie) uit met een welbepaalde kleur. Door het waarnemen van verschillende kleuren, en dus verschillende energieniveaus, kon Bohr besluiten dat elektronen zich op welbepaalde energieniveaus bevinden.

Je ontdekt hier, net zoals Bohr, dat die kleur specifiek is voor een welbepaalde stof. Daaruit besloot Bohr dat elektronen niet zomaar willekeurig rondzweefden in de ijle ruimte rond de kern, maar op welbepaalde afstanden (energieniveaus) van de kern: de schillen
OPDRACHT 8
Vul de tabel aan op basis van de chemische tijdlijn en de drie anker-experimenten.
1 Vul in de tweede kolom aan welke kennis de wetenschapper toevoegde aan het model van zijn voorganger. Haal de gegevens eventueel uit de uitgebreide tijdlijn, die je terugvindt achter de QR-code op p. 108.
Wetenschapper
Dalton
Kennis
• Stoffen bestaan uit onzichtbaar kleine, ondeelbare deeltjes: atomen.
• Een atoom is bolvormig.
• Een atoom is massief en ondeelbaar.
• Een atoom is een element met een massa en grootte die specifiek is voor elk deeltje.
Model aanpassen omdat uit experimenten bleek dat
Model aanpassen omdat uit experimenten bleek dat
Voorstelling atoom
Model aanpassen omdat uit experimenten bleek dat
OPDRACHT 8 (VERVOLG)
Wetenschapper Kennis Voorstelling atoom Bohr
Het model van Bohr werd verder verfijnd door Chadwick, die aantoonde dat de kern van een atoom niet alleen positieve deeltjes (protonen) bevat, maar ook ongeladen deeltjes (neutronen).
Chadwick
TIP
Je kunt het gecombineerd atoommodel van Bohr-Rutherford in 3D bekijken via de app.
2 Ga naar het onlinelesmateriaal en ontdek in de ontdekplaat nog meer over de geschiedenis van het atoom.
Een atoom bevat positief geladen protonen en ongeladen neutronen in de kern, elektronen zijn verdeeld op schillen rond die kern.
` Maak oefening 1 op p. 115.
Uit welke deeltjes is een atoom opgebouwd, wat is hun lading en waar in het atoom bevinden die deeltjes zich?
Deeltje van het atoom
` Verder oefenen? Ga naar
Lading
Plaats in het atoom
LEERDOELEN
Je kunt al:
L toelichten dat wetenschappers van oudsher geïnteresseerd zijn in de samenstelling en opbouw van materie;
L uitleggen dat atomen bestaan uit protonen, neutronen en elektronen.
Je leert nu:
L de samenstelling van atomen afleiden uit het atoomnummer en het massagetal.
We gaan op zoek naar nog kleinere deeltjes en proberen het atoom zelf te ontleden. Dat kan al lang niet meer met voor ons beschikbaar materiaal, maar gelukkig zoeken wetenschappers voor ons uit hoe het zit!
Het atoom is de bouwsteen van materie. Het is niet meer deelbaar via chemische processen. Toch is een atoom opgebouwd uit nog kleinere deeltjes.
In de negentiende eeuw maakt de kennis over het atoom en zijn structuur grote sprongen. We bouwen hierbij verder op het gecombineerd atoommodel van Bohr-Rutherford.
De kern of nucleus van een atoom is opgebouwd uit protonen en neutronen. De protonen en neutronen worden samen de nucleonen genoemd:
• de protonen zijn positief geladen deeltjes;
• de neutronen hebben geen lading.
Rond de nucleus bevinden zich negatief geladen elektronen.
De elektronen bewegen zich op vaste afstanden rond de atoomkern of nucleus. Op afbeelding 42 zie je dat ze zich voortbewegen op zogenaamde schillen
Een atoom bevat trouwens evenveel elektronen rond de kern als protonen in de kern. Een atoom is bijgevolg ongeladen.
Protonen, elektronen en neutronen vormen samen een atoom. Een atoom in zijn geheel heeft geen lading.
Als een atoom ongeladen is, moet het evenveel negatieve als positieve ladingen hebben. Dat betekent dat het aantal elektronen rond de kern gelijk moet zijn aan het aantal protonen in de kern.
Om te weten hoeveel protonen er in de atoomkern zitten, kijken we naar het atoomnummer Z. Je vindt het atoomnummer Z links bovenaan bij elk element in het periodiek systeem der elementen (PSE).
Op een periodiek systeem worden alle bekende atoomsoorten weergegeven door hun symbool:
• Een element met bijvoorbeeld atoomnummer Z = 8 heeft enerzijds dus altijd 8 protonen.
• Anderzijds zijn atomen met 8 protonen in de atoomkern altijd zuurstofatomen.
• Aangezien het aantal elektronen rond de kern gelijk moet zijn aan het aantal protonen in de kern, is het aantal elektronen bijgevolg ook gelijk aan het atoomnummer Z. In ons voorbeeld heeft zuurstof dus ook 8 elektronen.
• In een periodiek systeem zijn alle bekende atoomsoorten weergegeven door hun symbool.
• Atomen met hetzelfde aantal protonen zijn atomen van hetzelfde chemische element
• Het aantal elektronen rond de kern van een atoom moet gelijk zijn aan het aantal protonen in de kern.
• Elk element heeft een uniek atoomnummer (Z). Dat getal geeft het aantal protonen weer in de kern.
• Het aantal elektronen is bijgevolg ook gelijk aan het atoomnummer Z, het getal linksboven in elk vakje van het PSE.
Hoe klein een atoom ook is, het heeft wel degelijk een massa. Om het rekenen te vergemakkelijken werd de unit gedefinieerd: 1/12 van de massa van het koolstofatoom. De eenheidsmassa of atomaire massa eenheid wordt uitgedrukt als 1 unit.
Zowel protonen als neutronen hebben een massa van 1 unit (1 u). De massa van een elektron is verwaarloosbaar klein (slechts 1/2 000 van de massa van een proton).
De massa van het atoom (massagetal A) is dus de som van het aantal protonen (Z) en van het aantal neutronen (N).
We vergelijken de totale massa van een atoom steeds met de eenheidsmassa De verhouding tussen de massa van een atoom en die eenheidsmassa noemen we de relatieve atoommassa A r, een getal zonder eenheid.
Als 1 unit gelijk is aan 1/12 van de massa van het koolstofatoom; en als het massagetal A van koolstof 12 is; dan is 1 unit gelijk aan de massa van 1 waterstofatoom of 1 proton.
We kunnen dus stellen dat:
A (massagetal) = Z (aantal protonen) + N (aantal neutronen)
Als we de formule omvormen, kunnen we ook steeds het aantal neutronen in de kern berekenen als A gekend is.
N = A – Z
Atoomdeeltjes Lading Massa protonen nucleonen � neutronen elektronen +1 0 –1 1 u 1 u verwaarloosbaar
` Maak oefening 1, 2 en 3 op p. 120.
OPDRACHT 9
Ga met het periodiek systeem aan de slag.
1 Zoek het juiste atoomnummer op voor de volgende elementen.
• broom:
• natrium:
• helium:
• magnesium:
2 Bereken het aantal neutronen in de kern van de atomen met het gegeven massagetal.
• een broomatoom met massagetal 79
• een natriumatoom met massagetal 23
• een heliumatoom met massagetal 4
• een magnesiumatoom met massagetal 24
3 Vul de zinnen aan.
a Een atoom met Z = 6 is altijd een
b Een chlooratoom heeft altijd protonen in de kern.
c Een atoom met 7 protonen is een met als symbool .
d Een atoom met 11 elektronen is een atoom van het element
Een element heeft 20 neutronen in de kern en een atoommassa van 40 u. Over welk element gaat het?
Hoeveel neutronen vind je in een lithiumkern?
Hoeveel elektronen heeft een loodatoom?
` Verder oefenen? Ga naar .
Va 15 VIa 16 VIIa 17 0 18
LEERDOELEN
Je kunt al:
L toelichten dat atomen van eenzelfde element hetzelfde aantal protonen en elektronen hebben;
L toelichten dat protonen en neutronen zich in de kern bevinden en samen zorgen voor de massa van het atoom.
Je leert nu:
L de samenstelling van atomen en hun isotopen afleiden uit het atoomnummer en het massagetal.

Dit zijn Alessandra (links) en Anouck (rechts), een vrolijke identieke tweeling. Maar zijn ze wel zo identiek? Anouck is net iets zwaarder dan Alessandra, want de wip blijft niet goed in evenwicht. Waar dat verschil in massa tussen de meisjes precies zit, weten we niet. Anouck weegt 38,9 kg, Alessandra 38,1 kg. Hun gemiddelde massa is dan 38,5 kg. Als je het massagetal bij elk element in het periodiek systeem (PSE) bekijkt, zie je dat het geen gehele getallen zijn. Hoe kunnen we dat verklaren? Zijn atomen van hetzelfde element dan ook niet allemaal even zwaar?
In opdracht 9 rekenen we met massagetal A = 79 voor broom, maar in het PSE staat een relatieve massa van 79,9 aangeduid. Hoe zit dat?
seleen broom krypton
Je berekende dat broomatomen met A = 79, in de kern 44 neutronen en 35 protonen hebben. Er bestaan echter ook broomatomen met A = 81. Die broomatomen hebben eveneens 35 protonen, maar dus 46 neutronen in hun kern (N = A – Z). Deze twee broomatomen met verschillende massa worden isotopen genoemd.
Atomen van hetzelfde chemische element, dus met hetzelfde aantal protonen, kunnen een verschillend aantal neutronen in de kern hebben. We spreken dan over isotopen
Om duidelijk te maken over welke isotoop het gaat, stelt men een atoom vaak op de volgende manier voor:
X het symbool voor het element
Z het atoomnummer dat het aantal protonen en elektronen weergeeft
Voor broom bestaan er twee veelvoorkomende isotopen:
OPDRACHT 10
Geef voor de beide isotopen van een element het aantal elementaire deeltjes.
a Vul de tabel aan voor de isotopen van broom.
Naam elementair deeltje Aantal voor 79BrAantal voor 81Br
b Vul de tabel aan voor de isotopen van chloor.
Naam elementair deeltje Aantal voor 35Cl Aantal voor 37Cl
OPDRACHT 11
Oefen het verschil tussen isotopen.
a Geef aan wat het verschil is tussen een chlooratoom met relatieve atoommassa 35 en een chlooratoom met relatieve atoommassa 37.
b Geef aan wat het verschil is tussen een broomatoom met relatieve atoommassa 79 en een broomatoom met relatieve atoommassa 81.
c Heel uitzonderlijk krijgen isotopen van hetzelfde element een andere naam. Dat is het geval voor tritium, een isotoop van waterstof met twee neutronen in de kern. Hoe zou je dat isotoop voorstellen?
Wil je meer weten over de zeldzame isotopen van waterstof? Scan dan snel de QR-code.


Om het begrip ‘gemiddelde relatieve atoommassa’ te begrijpen, maken we de vergelijking met een zak knikkers.
Als je de massa van een zak knikkers hebt, kun je ook de massa van één knikker berekenen. Dat doe je door de totale massa van de zak te delen door het aantal knikkers.
massa 1 knikker =
massa zak knikkers aantal knikkers
Wat doe je als niet alle knikkers dezelfde massa hebben? Wat als er een aantal grote, zware knikkers in de zak zitten? Je kunt dan niet zomaar de massa van één knikker bepalen door de totale massa van de zak te delen door het aantal knikkers.
massa 1 knikker ≠
massa zak knikkers aantal knikkers
OPDRACHT 12
Reken mee aan de hand van het voorbeeld met de knikkers.
Stel: je hebt een zak met ...
• 10 kleine knikkers met massa 5 g,
• 10 grote knikkers met massa 8 g.
a Wat is de totale massa van de zak knikkers?
b Hoeveel knikkers zitten er in de zak?
c Wat is de gemiddelde massa van 1 knikker?
Laat ons dat even doortrekken naar de elementaire deeltjes. Je weet dat voor eenzelfde atoomsoort het aantal neutronen kan verschillen. We spreken dan over isotopen. Heel veel elementen komen voor met verschillende isotopen. De massa van een atoom van eenzelfde element kan variëren door het verschil in aantal neutronen
Als er meerdere isotopen bestaan van eenzelfde element, kunnen we de atoommassa van een element niet zomaar gelijkstellen aan die van één bepaalde isotoop.
We moeten de atoommassa van een element dan bepalen door rekening te houden met het procentueel voorkomen van elke isotoop. We spreken dan over de gemiddelde relatieve atoommassa (symbool <A r >).
De gemiddelde relatieve atoommassa is dan het ‘gewogen gemiddelde’ van alle relatieve atoommassa’s van de voorkomende isotopen In het PSE wordt bij elk element <A r > vermeld. We ronden in berekeningen de gemiddelde relatieve atoommassa <A r > steeds af op één cijfer na de komma.
` Maak oefening 1 en 2 op p. 127.
Elk element heeft meerdere isotopen. Gelukkig komt 1 isotoop vaak uitsluitend voor en zijn de andere eerder zeldzaam. Daarom kan de gemiddelde relatieve atoommassa <A r > vaak afgerond worden naar een geheel getal. In berekeningen zullen we <A r > steeds afronden op één cijfer na de komma.
In het voorbeeld met het element broom is het voorkomen van beide isotopen bijna gelijk. De gemiddelde relatieve atoommassa van broom ligt dus mooi tussen de twee massagetallen 79 en 81, in dit geval 79,9.
PERIODIEK 1 2 3 4 5 6 IIIb 3 IVb 4 Ia 1 IIa 2
OPDRACHT 13
Oefen met behulp van het periodiek systeem op de samenstelling van een isotoop.
Vul de tabel aan.
Symbool van het element <Ar>IsotoopNaam van het element Aantal protonen
OPDRACHT 14 DOORDENKER
Wat kunnen we nog meer afleiden uit <A r >?
Beantwoord de vragen.
a Welke van de beide isotopen van chloor (35Cl en 37Cl) denk je dat het meest voorkomt? Verklaar.
b Kruis de juiste antwoorden aan.
De gemiddelde relatieve atoommassa <A r > van broom zal groter zijn dan 80.
De gemiddelde relatieve atoommassa <A r > van broom zal kleiner zijn dan 80.
De 79Br isotoop heeft 44 neutronen in de kern.
De 81Br isotoop heeft 46 elektronen rond de kern.
OPDRACHT 15 DOORDENKER
Bereken het voorkomen van elke isotoop.
Laten we nog eens kijken naar het element chloor: het atoomnummer Z leert ons dat een chlooratoom altijd 17 protonen in zijn kern heeft. De gemiddelde relatieve atoommassa is 35,5. Je zou dus kunnen denken dat er 18,5 neutronen in de kern zitten, maar halve neutronen bestaan niet.
Net zoals bij broom, bestaan er 2 isotopen van chloor:
• een isotoop met 18 neutronen in de kern (75 %),
• een isotoop met 20 neutronen in de kern (25 %).
Kun je nu zelf berekenen hoe men weet dat het voorkomen van de 37Cl isotoop slechts 25 % is?
We helpen je op weg.
Stap 1: De beide isotopen samen vormen 100 % of 1 (100 % = 100/100 = 1). Als je het voorkomen van de ene isotoop X noemt, wat is dan het voorkomen van de andere isotoop?
Stap 2: We tellen nu het voorkomen van elke isotoop samen; dan moet dat 100 % of 1 vormen.
Stap 3: Los de wiskundige vergelijking op naar X en leid nu het voorkomen van de beide isotopen af.
De drie isotopen van magnesium zijn 24Mg ,25Mg en 26Mg. Welke isotoop zul je het vaakst aantreffen als je weet dat de relatieve atoommassa van magnesium 24,305 bedraagt?
Vervolledig de tabel.
a Geef de samenstelling van de kern van een zwavelatoom (met atoomnummer 16 en massagetal 32).
b Geef de samenstelling van het kwikatoom met A = 200.
c Boor heeft van nature twee isotopen: 10B en 11B. Bereken het procentuele voorkomen van elke isotoop.
d Vul de tabel verder aan met het aantal protonen, neutronen en elektronen van de isotopen. Bereken ook de gemiddelde relatieve atoommassa van elk element.
aantal protonen
aantal neutronen
aantal elektronen
gemiddelde relatieve atoommassa
` Verder oefenen? Ga naar .
LEERDOELEN
Je kunt al:
L toelichten dat een atoom ongeladen is, het heeft evenveel elektronen als protonen;
L toelichten dat het aantal elektronen dus ook wordt gegeven door het atoomnummer Z;

L toelichten dat elektronen niet in de kern zitten, maar errond;
L toelichten dat de massa van de elektronen verwaarloosbaar klein is;
L toelichten dat elektronen een negatieve lading hebben.
Je leert nu:
L de regels voor elektronenverdeling toepassen;
L het gecombineerd atoommodel van Bohr-Rutherford tekenen;
L de elektronenconfiguratie van de eerste twintig elementen schrijven.
In hoofdstuk 4 leerde je al hoeveel elektronen een specifiek atoom heeft. Maar waar zitten die elektronen nu precies? Zit er een patroon achter, of mogen ze gaan en staan waar ze willen? Ook dat namen wetenschappers al onder de loep.
We zagen dat Niels Bohr, een Deense fysicus, de theorie van Rutherford uitdiepte door te stellen dat elektronen op cirkelvormige schillen rond de atoomkern of nucleus bewegen. Elektronen bewegen dus niet willekeurig rond de kern.
Afhankelijk van het aantal elektronen, kan een atoom tot 7 schillen bevatten. Die schillen worden aangeduid met een letter
De eerste schil, die zich dus het dichtst bij de kern bevindt, wordt aangeduid met de letter K. De tweede schil met de letter L, de derde met de letter M enzovoort.
Bohr duidde zijn eerste schil niet aan met de letter A, omdat een logische volgorde verloren zou gaan als later nog extra schillen dichter bij de kern zouden worden ontdekt. Door te beginnen met de letter K, kon hij eventuele nieuwe schillen dichter bij de kern aanduiden met J, L enzovoort, waarbij een logische volgorde van opeenvolgende letters behouden blijft. Uiteindelijk bleek dat er geen schillen dichter bij de kern bestaan.
Elektronen bevinden zich op schillen, maar het maximale aantal elektronen per schil is beperkt. Dat maximumaantal vind je in deze tabel:
Schilnummer nLetterMaximumaantal elektronen op de schil
2n2
Je kunt het aantal elektronen voor de eerste 4 schillen onthouden aan de hand van de formule 2n² (waarbij n het schilnummer is).
Elektronen verspreiden zich niet willekeurig over bepaalde schillen. De opvulling van de schillen volgt een bepaald patroon
Met de onderstaande ‘regels’ kun je de opvulling van de schillen voor heel wat elementen opstellen. Later zul je zien dat er afwijkingen of uitzonderingen op bestaan.
1 Elektronen plaatsen zich zo veel mogelijk op de schillen het dichtst bij de nucleus. Dus eerst de K-schil, pas daarna de L-schil enzovoort.
2 Op de buitenste schil bevinden zich maximaal 8 elektronen.
3 Op de voorlaatste schil bevinden zich maximaal 18 elektronen.
4 Bij de andere schillen gaan de eerste 4 elektronen zich zo ver mogelijk van elkaar plaatsen. De volgende 4 elektronen vormen steeds met een ander elektron een elektronenpaar.
schil 7, n = 7
schil 6, n = 6
schil 5, n = 5
schil 4, n = 4
schil 3, n = 3
schil 2, n =2
schil 1, n =1
Als de buitenste schil volledig is opgevuld, bevat ze twee (voor de eerste schil) of acht elektronen. Wanneer een atoom een volledig gevulde buitenste schil heeft, spreken we van de edelgasconfiguratie
OPDRACHT 16
Oefen de plaatsing van elektronen.
Teken het schillenmodel voor de eerste twintig elementen uit het PSE, oefen nog eens de juiste symbolen en vul de tekst aan.
• Element: waterstof
Symbool:
Z =
Aantal elektronen = , het elektron bevindt zich op de
• Element: helium
Symbool:
Z =
Aantal elektronen = , de elektronen bevinden zich op de . Merk op dat er een elektronenpaar gevormd wordt. Helium heeft een volledig gevulde buitenste schil: het bezit de
• Element: lithium
Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat , het derde elektron bevindt zich op de .
OPDRACHT 16 (VERVOLG)
• Element: beryllium Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat , de andere elektronen bevinden zich op de
• Element: boor Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat , de andere elektronen bevinden zich op de
• Element: koolstof Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat , de andere elektronen bevinden zich op de . Ze vormen geen paren en plaatsen zich zo ver mogelijk van elkaar (als het ware elk kwartier van een klok).
• Element: stikstof Symbool:
Z =
Stikstof heeft 5 elektronen op de L-schil. De eerste 4 elektronen plaatsen zich zo ver mogelijk van elkaar, vanaf het vijfde elektron zal er een elektronenpaar gevormd worden. Stikstof heeft nog ongepaarde elektronen.
• Element: zuurstof Symbool:
Z = Zuurstof heeft elektronen op de L-schil. De eerste 4 elektronen plaatsen zich zo ver mogelijk van elkaar, vanaf het vijfde elektron zullen er elektronenparen gevormd worden. Zuurstof heeft op de L-schil elektronenparen en nog ongepaarde elektronen.
OPDRACHT 16 (VERVOLG)
• Element: fluor Symbool:
Z = Fluor heeft elektronen op de L-schil. De eerste 4 elektronen plaatsen zich zo ver mogelijk van elkaar, vanaf het vijfde elektron zullen er elektronenparen gevormd worden. Fluor heeft nog ongepaard elektron.
• Element: neon Symbool:
Z =
Neon heeft elektronen op de L-schil. De eerste 4 elektronen plaatsen zich zo ver mogelijk van elkaar, vanaf het vijfde elektron zullen er elektronenparen gevormd worden. Neon heeft ongepaarde elektronen, enkel elektronenparen of doubletten op de L-schil. Elementen met een volledig gevulde buitenste schil bezitten .
• Element: natrium Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat 2 elektronen, ook de tweede schil is volledig en bevat 8 elektronen. Het laatste elektron bevindt zich op de
• Element: magnesium
Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat 2 elektronen, ook de tweede schil is volledig en bevat 8 elektronen. De laatste 2 elektronen bevinden zich op de , zij vormen geen elektronpaar.
• Element: aluminium
Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat 2 elektronen, ook de tweede schil is volledig en bevat 8 elektronen. De laatste 3 elektronen bevinden zich op de . Het zijn 3 ongepaarde elektronen.
OPDRACHT 16 (VERVOLG)
• Element: silicium
Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat 2 elektronen, ook de tweede schil is volledig en bevat 8 elektronen. De laatste 4 elektronen bevinden zich op de , er zijn geen elektronenparen gevormd op de buitenste schil.
• Element: fosfor
Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat 2 elektronen, ook de tweede schil is volledig en bevat 8 elektronen. De laatste 5 elektronen bevinden zich op de , er wordt nu opnieuw een elektronenpaar gevormd op de buitenste schil. Fosfor heeft nog ongepaarde elektronen.
• Element: zwavel
Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat 2 elektronen, ook de tweede schil is volledig en bevat 8 elektronen. De laatste 6 elektronen bevinden zich op de , er worden elektronenparen gevormd op de buitenste schil. Zwavel heeft nog ongepaarde elektronen.
• Element: chloor Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat 2 elektronen, ook de tweede schil is volledig en bevat 8 elektronen. De laatste 7 elektronen bevinden zich op de , er worden elektronenparen gevormd op de buitenste schil. Chloor heeft nog ongepaard elektron.
• Element: argon Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat 2 elektronen, ook de tweede schil is volledig en bevat 8 elektronen. Ook de derde schil (M) is nu volledig en bevat 8 elektronen. Argon heeft opnieuw
OPDRACHT 16 (VERVOLG)
• Element: kalium
Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat 2 elektronen, ook de tweede schil is volledig en bevat 8 elektronen. De derde schil (M) is eveneens volledig en bevat 8 elektronen. Het laatste elektron komt terecht op de . Kalium heeft ongepaard elektron.
• Element: calcium
Symbool:
Z =
Aantal elektronen = . De eerste schil (K) bevat 2 elektronen, ook de tweede schil is volledig en bevat 8 elektronen. De derde schil (M) is eveneens volledig en bevat 8 elektronen. Calcium bevat ongepaarde elektronen.
OPDRACHT 17
Bekijk de elementen van opdracht 16 opnieuw aandachtig en beantwoord de vragen.
1 In het periodiek systeem staan de elementen H, Li, Na en K onder elkaar. Ook C en Si staan onder elkaar.
a Wat stel je vast als je de verdeling van de elektronen van H-Li-Na-K met elkaar vergelijkt?
b En C en Si?
c Geldt dat ook voor N en P?
2 De elementen Li-Be-B-C-N-O-F-Ne staan naast elkaar op de tweede rij van het periodiek systeem.
a Wat stel je vast als je de verdeling van de elektronen van die elementen met elkaar vergelijkt?
b Geldt dat ook voor Na-Mg-Al-Si-P-S-Cl-Ar?
Uit opdracht 17 blijkt dat er een duidelijk verband bestaat tussen:
• de verdeling van de elektronen op de schillen,
• de plaats van de elementen in het periodiek systeem
Elementen naast elkaar in het PSE vormen een periode en hebben hetzelfde aantal schillen.
Elementen onder elkaar in het PSE vormen een groep en hebben evenveel elektronen op de buitenste schil. Dat noemen we valentie-elektronen
` Maak oefening 1 op p. 140.
14 Va 15 VIa 16 VIIa 17 0 18
Moeten we altijd een schillenmodel tekenen om de elektronenverdeling over de schillen weer te geven? Gelukkig niet. Vaak noteren we het eenvoudiger door het aantal elektronen per schil in volgorde achter het elementensymbool te zetten. We spreken dan simpelweg van de elektronenconfiguratie
Bekijk het voorbeeld van zwavel met:
• atoomnummer Z = 16,
• gemiddelde relatieve atoommassa <A r > (afgerond op één cijfer na de komma) <A r > = 32,1.
Niet vergeten: het aantal elektronen is gelijk aan het atoomnummer Z.
Een zwavelatoom heeft dus ook 16 elektronen. Als we de regels respecteren, weten we dat de elektronen als volgt verdeeld zijn over de schillen:
K-schil: 2 elektronen
L-schil: 8 elektronen
M-schil: 6 elektronen
In plaats van het schillenmodel te tekenen, noteert men de elektronenconfiguratie als volgt: 16S 2 8 6. Die notatie geeft uiteindelijk evenveel informatie als een schillenmodel.
Wil je de regels nog even opfrissen? Scan dan de QR-code.
OPVULLING SCHILLEN
OPDRACHT 18
Noteer de juiste elektronenconfiguratie.
Elektronenconfiguratie
3 Lewisstructuren
Is het altijd nodig om het uitgebreide schillenmodel of een volledige elektronenconfiguratie weer te geven, of kunnen we onszelf heel wat werk besparen?
Chemici hebben al vroeg ontdekt dat wanneer atomen zich binden met andere atomen, vooral de valentie-elektronen (de elektronen op de buitenste schil) een rol spelen. Gilbert Newton Lewis kwam zo met een verkorte schrijfwijze door enkel die elektronen in een aparte notatie op te nemen: de lewisstructuur
OPDRACHT 19
Herhaal het gecombineerd atoommodel van Bohr-Rutherford.
1 Teken de elektronen op de schillen van helium, neon en argon.
2 Markeer de elektronen die je zowel bij helium, neon als argon kunt terugvinden met groen.
3 Markeer vervolgens de elektronen die je zowel bij neon als argon, maar niet bij helium kunt terugvinden met rood.
4 Als laatste markeer je de elektronen die je enkel bij argon kunt terugvinden met geel.
Beantwoord de vragen.
5 Hoeveel elektronen per schil hebben deze elementen? Vul de tabel aan.
Element
6 Vergelijk helium en neon. Wat stel je vast?
• De -schil is gelijkend.
• De -schil wijkt af.
• De elektronen die aanwezig zijn bij zijn ook aanwezig bij , maar dat is omgekeerd niet zo.
7 Vergelijk neon en argon. Wat stel je vast?
• De -schil en de -schil zijn gelijkend
• De -schil wijkt af.
• De elektronen die aanwezig zijn bij zijn ook aanwezig bij , maar dat is omgekeerd niet zo.
OPDRACHT 20
Noteer het juiste antwoord.
We kunnen dus besluiten dat de elektronenverdeling van elementen die in een lagere periode staan, identiek blijft voor onderliggende schillen. Als het atoomnummer (en dus het aantal protonen in de kern en het aantal elektronen op de schillen) stijgt, komt er telkens een elektron bij op de buitenste schil. Deze valentie-elektronen zullen belangrijk zijn bij het vormen van bindingen tussen atomen. We kunnen daarom de afspraak maken dat we de onderliggende elektronen niet meer tekenen; we nemen enkel de elektronen van de buitenste schil in beschouwing.
1 Vul in de tabel het aantal elektronen per schil aan. Element
beryllium stikstof fluor
2 Vul de zinnen aan.
• Voor alle drie de atomen is de buitenste schil de -schil.
• De valentie-elektronen verschillen wel. Beryllium heeft er , stikstof en fluor .
3 Teken de valentie-elektronen op de buitenste schil van de atomen. Laat dus de onderliggende K-schil weg.
F N
4 Vergelijk de tekeningen nu. Wat kun je nog als overbodig beschouwen?
5 Teken de valentie-elektronen rond de elementen zonder de schillen te tekenen.
Bij stikstof en fluor zien we dat de puntjes die de elektronen voorstellen bij een elektronenpaar al snel in elkaar kunnen overlopen als we de schil zelf niet tekenen. Ook daar had Lewis een oplossing voor. Een elektronenpaar, 2 elektronen dus, wordt dan voorgesteld met een streepje of twee bolletjes naast elkaar. Dat wordt voor het voorbeeld uit opdracht 20, vraag 5 dan:
In de lewisstructuur tekenen we enkel de elektronen van de buitenste schil: de valentie-elektronen. Ongepaarde elektronen stellen we voor met een bolletje, gepaarde elektronen (elektronenparen) met een streepje.
` Maak oefening 2 en 3 op p. 140.
Teken het schillenmodel voor aluminium.
Schrijf de elektronenconfiguratie en teken ernaast de lewisstructuur voor de volgende elementen. koolstof:
magnesium:
zuurstof:
chloor:
zwavel:
fosfor: Durf je het aan om het schillenmodel en de elektronenconfiguratie te tekenen van een atoom met een hoger atoomnummer, zoals lood of kwik? Vraag tips aan je leerkracht of scan de QR-code voor meer informatie.
` Verder oefenen? Ga naar .
Kernbegrippen
Kernvragen
Notities
HOOFDSTUK 1: Welke namen en symbolen krijgen de elementen?
element = atoomsoort
atoomsoorten of elementen = de verschillende atomen of deeltjes
atoom = deeltje dat tot bepaalde atoomsoort behoort
Elk element heeft universeel eenzelfde symbool. Die universele symbolentaal zorgt ervoor dat wetenschappers over de hele wereld met elkaar kunnen communiceren.
HOOFDSTUK 2: Hoe evolueerde het atoommodel?
voorwerp: opgebouwd uit materie
materie: stof of mengsel van stoffen
stof: verbinding van deeltjes of atomen
• Historische evolutie van de atoommodellen van Dalton tot en met Bohr: elke keer weer voortbouwen op de ontdekking van de voorganger.
• Het schillenmodel van Bohr-Rutherford
elektronenschillen
atoomkern = nucleus
• bevat twee soorten elementaire deeltjes: protonen (+) en neutronen
• rond atoomkern heb je elektronen (–)
atoomnummer Z
= aantal protonen = aantal elektronen
massagetal A
= Z (aantal protonen) + N (aantal neutronen)
• Het atoom bestaat uit een atoomkern en een elektronenmantel waarin protonen en neutronen voorkomen (behalve H: enkel 1 proton).
• Protonen, elektronen en neutronen vormen samen een atoom. Een atoom in zijn geheel heeft geen lading.
• Protonen zijn positief geladen (+). Elektronen zijn negatief geladen (–). Neutronen zijn neutraal.
• Rond de kern bewegen elektronen (–) op schillen.
• Het aantal elektronen rond de kern is in een atoom gelijk aan het aantal protonen in de kern.
• Atomen met hetzelfde aantal protonen zijn atomen van hetzelfde chemische element.
• Uit het atoomnummer Z en het massagetal A kunnen we de hoeveelheid van elk van de deeltjes in een atoom berekenen.
Kernbegrippen
Kernvragen
Notities
HOOFDSTUK 4: Atomen en hun isotopen: wat is de gemiddelde relatieve atoommassa <Ar>? isotopen
gemiddelde relatieve atoommassa <A r >
XIsotopen zijn atomen met hetzelfde aantal protonen, van hetzelfde element dus, maar met een verschillend aantal neutronen.
De gemiddelde relatieve atoommassa is het gewogen gemiddelde van de massa's van de voorkomende isotopen, rekening houdend met hun procentuele voorkomen.
Daarom is de gemiddelde relatieve atoommassa zelden een geheel getal. We ronden dat getal tijdens berekeningen af op één cijfer na de komma.
HOOFDSTUK 5: Hoe zitten elektronen verdeeld in een atoom?
elektronenconfiguratie
edelgasconfiguratie lewisstructuur
• De verdeling van de elektronen op schillen gebeurt volgens een aantal regels.
• Wanneer de buitenste schil volledig bezet is, dan spreken we over de edelgasconfiguratie.
• Het schillenmodel kan eenvoudiger genoteerd worden als de elektronenconfiguratie.
• Bij de lewisstructuur vereenvoudigen we die elektronenconfiguratie nog en worden enkel de elektronen van de buitenste schil weergegeven.
1 Begripskennis
• Ik ken de kernbegrippen (element, atoom, voorwerp, materie, stof, atoomsoort, nucleonen, atoomkern, atoomnummer, massagetal, isotopen, gemiddelde relatieve atoommassa, elektronenconfiguratie, lewisstructuur) en kan ze toelichten
• Ik ken de namen en symbolen van veelvoorkomende elementen.
• Ik ken de historische evolutie van de atoommodellen van Dalton tot en met Chadwick.
• Ik ken de lewisstructuur en kan die toepassen bij de eerste 20 elementen.
2 Onderzoeksvaardigheden
• Ik kan de bouw van een atoom toelichten (volgens het gecombineerd atoommodel van Bohr-Rutherford).
• Ik kan de samenstelling van atomen (en hun isotopen) afleiden uit het atoomnummer en het massagetal.
• Ik kan de regels voor elektronenverdeling toepassen om het gecombineerd atoommodel van Bohr-Rutherford te tekenen en de elektronenconfiguratie van de eerste 20 elementen te schrijven.
• Ik kan toelichten hoe het schrijven van elektronenconfiguraties een vereenvoudigde weergave is van het schillenmodel.
` Je kunt deze checklist ook op invullen bij je Portfolio.
JANOG OEFENEN
Wat zie jij onder deze elektronenmicroscoop? Vul in.
Zou je graag nog verder inzoomen? Je bent niet alleen.
Wetenschappers uit de hele wereld doen continu fundamenteel onderzoek naar elementaire deeltjes in het CERN (Conseil Européen pour la Recherche Nucléaire, of de Europese Raad voor Kernonderzoek). Onze landgenoot François Englert kreeg in 2013 de Nobelprijs voor Natuurkunde voor zijn onderzoek naar de allerkleinste deeltjes.


Heeft dit thema jouw interesse opgewekt? Ga naar en bekijk de filmpjes over het onderzoek bij CERN.
Stilaan zijn we in staat om na te gaan of het gecombineerd atoommodel van Bohr-Rutherford overeenstemt met de realiteit. Steeds sterkere microscopen stellen ons in staat het met het blote oog te checken. We ontdekken alsmaar meer.
` HOOFDSTUK 1: Wat zijn groepen en perioden in het periodiek systeem?
` HOOFDSTUK 2: Wat leren we uit de plaats van een element in het PSE?
1 De a-groepen en hun naam
2 Waarom lijken atomen graag op een edelgas?
3 Zijn er naast de massa en elektronenconfiguratie nog andere indelingen in het PSE?
` HOOFDSTUK 3: Welk belang en voorkomen hebben enkelvoudige stoffen?

De legosorteermachine is niet te verslaan qua precisie en snelheid, al moet je natuurlijk wel eerst jouw kennis aan de machine doorgeven.
Vermoedelijk sorteerde je de blokjes eerst per kleur, tot je merkte dat er naast de kleur nog andere verschillen zijn, zoals de vorm en het aantal nopjes.
Als kind heb je misschien wel uren gespeeld met legoblokjes. Om dingen te bouwen, was het wel handig om eerst de blokjes te sorteren. Maar hoe begin je daaraan? De Australiër Daniel West ontwikkelde een oplossing: de legosorteermachine. Bekijk de video.

Na het eerste sorteerwerk moest je vaak nog op zoek naar ontbrekende stukjes, maar je kon natuurlijk al wel afleiden hoe ze eruit moesten zien. Onbewust schuilde er toen een kleine Mendelejev in jou.
In chemie ordenen we de deeltjes of ‘elementen’ in een periodiek systeem. Kijk eens rond in het labo in je school. Je vindt er vast en zeker een of meerdere exemplaren van het periodiek systeem. Op het huidige periodiek systeem staan tussen de 110 en 118 elementen, volgens een universeel systeem gerangschikt.
` Waarom is het zo belangrijk om het periodiek systeem van de elementen (kortweg PSE) in te delen?
` Hoe zijn de elementen in het PSE gerangschikt?
Meer dan 150 jaar geleden probeerde de wetenschapper Dimitri Mendelejev de gekende elementen te rangschikken volgens de oplopende atoommassa. Hij maakte kaarten van alle elementen, met daarop gegevens die hij al kende of afleidde. Hij merkte dat sommige elementen gelijkaardige eigenschappen vertoonden en groepeerde ze. Daarbij merkte hij op dat in de reeksen ontbrekende elementen waren. De eigenschappen, zoals de atoommassa, van deze nog niet ontdekte elementen kon hij voorspellen.

OPDRACHT 1
Mendelejev presenteerde zijn tabel voor het eerst in 1869. In de jaren die volgden, is telkens gebleken dat de door hem voorspelde eigenschappen van later ontdekte elementen correct waren. Het lijkt wel of hij een glazen bol had!
Noteer de betekenis van de gegevens in elk vakje van het PSE.
In een periodiek systeem worden alle bekende atoomsoorten weergegeven met hun symbool. Elk vakje bevat ook verschillende cijfers. Een aantal van die cijfers (het atoomnummer Z en de gemiddelde relatieve atoommassa <A r >) leerde je al kennen in thema 3. Je leerde ook al de namen en symbolen van verschillende elementen. Mendelejev gebruikte de atoommassa als basis voor een eerste rangschikking.
LEERDOELEN
Je kunt al:

L toelichten dat elementen worden voorgesteld met een uniek symbool;
L toelichten dat een element synoniem is voor atoomsoort;
L toelichten dat elk atoom een massa heeft, afhankelijk van het aantal neutronen en protonen;
L toelichten dat elektronen zich op schillen rond de kern bevinden;
L toelichten dat we in de lewisstructuur enkel de elektronen van de buitenste schil voorstellen.
Je leert nu:
L de opbouw van het PSE gebruiken om eigenschappen van atomen en ionen af te leiden.
OPDRACHT 2
Je hoort vaak spreken over ‘de tabel van Mendelejev’ in plaats van ‘het periodiek systeem van de elementen’. Nochtans klopt de naam ‘tabel van Mendelejev’ niet helemaal, want ook andere wetenschappers zoals Henry Mosely, Lothar Meyer, William Ramsey en Niels Bohr hebben hun steentje bijgedragen. Maar goed, ere wie ere toekomt, Mendelejev is en blijft de grondlegger van het PSE.
Wil je even opnieuw de geschiedenis induiken?
Scan dan de QR-code.
Bekijk het PSE achteraan in je leerschrift en los de vragen op.
• Hoeveel rijen tel je?
• Hoeveel kolommen met elementen tel je?
• Zijn er verschillende kleuren gebruikt in het periodiek systeem?
• Hoeveel vakjes telt het periodiek systeem?
• Hoe wijzigt het atoomnummer Z als je van links naar rechts vordert in het periodiek systeem?
BEKIJK DE TIJDLIJN
• Hoe wijzigt de gemiddelde relatieve atoommassa <Ar> als het atoomnummer Z toeneemt?
De elementen zijn gerangschikt volgens oplopende atoommassa Omdat het atoomnummer steeds toeneemt, kon Mendelejev destijds alle elementen op één lange rij plaatsen, waarbij de gemiddelde relatieve atoommassa telkens toeneemt. Toch plaatste hij de elementen op verschillende rijen. De zeven rijen die zo gevormd werden, worden perioden genoemd.
Hij had toen immers al ontdekt dat bijvoorbeeld lithium en natrium gelijkaardige chemische eigenschappen vertonen in reacties, net als bv. fluor en chloor.
Die gelijkaardige chemische eigenschappen zijn een rechtstreeks gevolg van hun elektronenconfiguratie, die je leerde kennen in thema 3. Door elementen met gelijkaardige chemische eigenschappen onder elkaar te plaatsen, werden er ook groepen gevormd: de verticale kolommen. Die elementen worden gekenmerkt door een gelijk aantal elektronen op de buitenste schil, de valentie-elektronen.
OPDRACHT 3
Vul de tabellen aan door gebruik te maken van je kennis van het atoommodel.
1 Vul de tabel aan met de elektronenverdeling per schil voor waterstof, lithium, natrium en kalium; stuk voor stuk elementen uit de eerste kolom van het PSE.
Symbool element Atoomnummer
Aantal elektronen op schil 1
Aantal elektronen op schil 2
Fris je kennis van de regels voor elektronenverdeling op.
Aantal elektronen op schil 3
Aantal elektronen op schil 4
ELEKTRONENVERDELING
Totaal aantal elektronen
2 Wat hebben deze elementen gemeen?
Merk op dat lithium onder waterstof werd geplaatst. Natrium werd ook weer op een volgende rij geplaatst, in dezelfde kolom en onder lithium. Kalium werd om dezelfde reden onder natrium geplaatst. Per periode in het PSE komt er telkens een extra schil bij.
3 Maak dezelfde oefening voor de elementen fluor en chloor, uit kolom VIIa.
Symbool element Atoomnummer
Aantal elektronen op schil 1
Aantal elektronen op schil 2
Aantal elektronen op schil 3
Aantal elektronen op schil 4
Totaal aantal elektronen
OPDRACHT 3 (VERVOLG)
4 Wat hebben deze elementen gemeen?
Chloor kwam zo onder fluor terecht.
5 Herhaal nogmaals de oefening, maar nu met elementen die in kolom IVa staan.
Symbool element
C Si
Atoomnummer
Aantal elektronen op schil 1
6 Wat hebben deze elementen gemeen?
Aantal elektronen op schil 2
Aantal elektronen op schil 3
Aantal elektronen op schil 4
Totaal aantal elektronen
7 Welk gevolg heeft dat voor de plaats van silicium in het PSE?
De rijen in het PSE worden perioden genoemd. Bij elke nieuwe periode komt er een extra schil bij de atomen. De kolommen worden groepen genoemd. Het zijn groepen elementen met hetzelfde aantal elektronen op de buitenste schil (de valentieelektronen), en daarom met dezelfde chemische eigenschappen.
Bij de rangschikking van de elementen in perioden en groepen stuitte men op een probleem na het element calcium. Tussen het element calcium (met twee elektronen in de buitenste schil) en gallium, (met drie elektronen in de buitenste schil) moesten nog tien elementen hun plaats vinden, met een atoommassa die tussen die van calcium en gallium ligt.
Ook bij de volgende perioden moest dat opgelost worden. De tabel moest dus worden opengetrokken om er telkens tien elementen tussen te plaatsen. Die groepen elementen krijgen doorgaans een Romeins cijfer met lettertje b. We noemen ze de b-groepen. De elementen uit de b-groepen kregen de verzamelnaam overgangselementen; ook de termen transitie-elementen of nevenelementen worden weleens gebruikt.
De overige elementen behoren tot de a-groepen. Er zijn dus acht a-groepen en tien b-groepen. Die indeling verwatert stilaan, tegenwoordig worden de kolommen vaak gewoon doorlopend genummerd van 1 tot en met 18.
Een gelijkaardig probleem in de rangschikking deed zich voor met de elementen na lanthaan, in periode zes, en actinium, in periode zeven.
De 28 (of 2 keer 14) afgezonderde elementen onderaan zijn de elementen die in periode zes volgen op het element lanthaan en in periode zeven op het element actinium. Zo verkregen ze de naam lanthaniden en actiniden. Samen worden ze ook wel ‘zeldzame aarden’ genoemd.
WEETJE
Men kiest er vaak voor om de zeldzame aarden onderaan de tabel te plaatsen met een verwijzing. Dat is handiger omdat het beter past in de verhoudingen van een pagina of poster.
LEERDOELEN
Je kunt al:

L toelichten dat elk element een specifieke plaats heeft in het PSE;
L toelichten dat de periode waarin het element voorkomt het aantal schillen weergeeft;
L toelichten dat de groep waarin het element staat de elektronenconfiguratie van de buitenste schil verraadt;
L toelichten dat elektronen negatief geladen zijn en protonen positief geladen;
L toelichten dat een atoom evenveel elektronen als protonen bevat en dus elektrisch neutraal is.
Je leert nu:
L een verband leggen tussen de plaats van een element in het PSE en de eigenschappen ervan;
L elementen ordenen en plaatsen op de tabel volgens metalen en niet-metalen (classificatie).
Het PSE en de plaats van de elementen bevatten heel wat nuttige informatie voor de chemicus. Heb je die kennis onder de knie, dan start je met een flinke basis om later de verbindingen tussen atomen te verklaren. Atomen binden immers tot verbindingen. Er bestaan zeer eenvoudige verbindingen, maar ook heel complexe.
1 De a-groepen en hun naam
Sommige groepen hebben een specifieke naam, andere groepen worden genoemd naar het bovenste element uit de groep.
• Ia: de alkalimetalen (Li, Na, K …)
• IIa: de aardalkalimetalen (Be, Mg, Ca …)
• IIIa: de aardmetalen (B, Al, Ga …)
• IVa: de koolstofgroep (C, Si, Ge …)
• Va: de stikstofgroep (N, P, As …)
• VIa: de zuurstofgroep (O, S, Se …)
• VIIa: de halogenen (F, Cl, Br, I …)
• VIIIa: de edelgassen (He, Ne, Ar …)
De laatste kolom, de edelgassen, wordt ook aangeduid als de nulgroep.
Er zijn nog meer verzamelnamen voor groepen elementen. Zo worden alle elementen met een atoomnummer hoger dan 92, het element uraan, ook wel de ‘transuranen’ genoemd. Dat zijn radioactieve elementen: instabiele atomen die snel vervallen. Radioactieve elementen zoals uranium worden in kerncentrales gebruikt als brandstof, maar produceren ook heel wat radioactief afval..
De verwerking van radioactief afval is en blijft een probleem waar nog geen oplossing voor gevonden werd. In Vlaanderen wordt radioactief afval van de kerncentrale in Doel in gebetonneerde vaten opgeslagen bij Belgoprocess in Dessel.
Maar ook wereldwijd blijft radioactief afval en de verwerking ervan de politieke discussie voeden. Hoewel kernenergie qua uitstoot (van bv. CO2) de ‘schoonste’ manier is om elektriciteit op te wekken, kunnen we radioactief kernafval niet eeuwig blijven produceren en stockeren. Toch zijn er nog lang niet genoeg windmolens, zonnepanelen en waterkrachtcentrales om de hoeveelheid geproduceerde elektriciteit te compenseren en zo de productie van kernafval een halt toe te roepen. Een kernuitstap zal immers opgevangen moeten worden door zogenaamde groene stroom.

OPDRACHT 4
1 Vul de tabel aan met behulp van het PSE.
Symbool Naam element Behoort tot de groep
2 Ontdek via de ontdekplaat bij het onlinelesmateriaal enkele nuttige toepassingen van elk element in het dagelijks leven.
WEETJE
Wil je op het volgende feestje uitpakken met een origineel nummer?
Scan de QR-code en ontdek de song The Elements
THE ELEMENTS
OPDRACHT 5
Bekijk de lewisstructuur en vul de tabel aan.
1 Bekijk het PSE. Boven elke kolom van de a-groepen staat de lewisstructuur van de elementen uit die kolom (groep) weergegeven.
2 Leid daaruit het antwoord af om de tabel verder aan te vullen.
Nummer en naam a-groep
Aantal elektronen in de buitenste schil
aardmetalen
stikstofgroep
(2 voor periode 1)
Niet vergeten: elk atoom is elektrisch neutraal (aantal negatief geladen elektronen = aantal positief geladen protonen).
Je merkt dat Mendelejev het belangrijk vond om elementen met hetzelfde aantal elektronen in de buitenste schil onder elkaar in groepen te plaatsen.
Atomen zijn het meest stabiel als hun buitenste schil volledig gevuld is met acht elektronen (of twee als er maar één schil is). Ze streven er dan ook naar om die buitenste schil volledig te maken, de zogenaamde edelgasconfiguratie Met uitzondering van de twee elementen van de eerste periode betekent die edelgasconfiguratie dus dat ze acht elektronen hebben op de buitenste schil. De edelgasconfiguratie wordt daarom ook wel de octetstructuur genoemd, al zou voor waterstof en helium ‘duetstructuur’ een beter gekozen term zijn.
De edelgasconfiguratie kan bekomen worden door extra elektronen aan te trekken of elektronen af te staan.
Door elektronen (negatief geladen deeltjes) op te nemen of af te staan, krijgt het atoom zelf een lading. Het atoom is niet langer elektrisch neutraal, want het aantal protonen is niet langer gelijk aan het aantal elektronen. We spreken nu niet langer over een atoom maar over een ion
Een geladen atoom wordt een ion genoemd
• Negatief geladen ionen worden anionen genoemd en bevatten meer elektronen dan protonen.
Dit anion draagt als lading 2– Afb. 50 Ladingsverhouding bij anionen
• Positief geladen ionen worden kationen genoemd en bevatten meer protonen dan elektronen.
Dit kanion draagt als lading 2+ Afb. 51 Ladingsverhouding bij kationen
Een atoom zal altijd de makkelijkste weg kiezen om de edelgasconfiguratie te bekomen, zoals het voorbeeld van natrium en chloor aantoont:
Natrium heeft één elektron in de buitenste schil en kan een octetstructuur bereiken door:
• één elektron af te staan;
• zeven elektronen op te nemen.
Het natriumatoom kiest de gemakkelijkste weg: met één elektron minder wordt de voorlaatste schil nu de buitenste schil en bereikt het atoom de edelgasconfiguratie.
Atoom Ion aantal protonen 11 11 aantal elektronen 11 10 lading neutraal positief elektronenconfiguratie 2, 8, 1 2, 8
Met dat ene elektron (negatief geladen deeltje) minder wordt tegelijkertijd het positieve natriumion gevormd: Na+
Merk op dat het natriumion, dat we nu noteren als Na+, dezelfde elektronenconfiguratie krijgt als het edelgas neon.
Na+ 2 8 1
Ne 2 8
Chloor heeft zeven elektronen in de buitenste schil, om een volledige buitenste schil te bekomen kan het:
• één elektron opnemen;
• zeven elektronen afstaan.
Ook chloor kiest voor de makkelijkste oplossing en zal één elektron (negatief geladen deeltje) opnemen.
Atoom Ion
aantal protonen 17 17
aantal elektronen 17 18
lading neutraal negatief
elektronenconfiguratie 2, 8, 7 2, 8, 8
Chloor zal daarom het negatieve chloride-ion vormen, of kortweg Cl–
Het chloride-ion, dat we nu noteren als Cl–, krijgt door de opname van een extra elektron de configuratie van het edelgas argon.
Cl– 2 8 7 8
Ar 2 8 8
Metalen zijn dus geneigd om elektronen af te staan, terwijl de niet-metalen er heel graag extra elektronen zouden bij willen. De mate waarin een atoom er naar streeft om extra elektronen op te nemen noemen we de elektronegativiteit van een element. De elektronegativiteit of EN-waarde is een getal tussen 0,7 en 4, dat we ook bij elk element op het PSE terugvinden, in de rechterbovenhoek.
atoomnummer (Z) elektronegatieve waarde (EN)
12 1,2
symbool naam
gemiddelde relatieve atoommassa <A r >
Door het streven naar een volledige buitenste schil gaat een atoom elektronen afstaan of opnemen. Het bereikt zo de configuratie van het dichtstbijzijnde edelgas in het periodiek systeem. Daarom spreken we van een edelgasconfiguratie
De mate waarin een atoom ernaar streeft om extra elektronen op te nemen, noemen we de elektronegativiteit (EN) van een element.
OPDRACHT 6
Vergelijk de EN-waarde van elk element in het PSE.
1 Hoe verandert de EN-waarde binnen één periode?
2 Hoe verandert de EN-waarde binnen één groep?
3 Waar staan dan de meest elektronegatieve elementen op het PSE?
4 Waar staan de minst elektronegatieve (of elektropositieve) elementen?
De Amerikaan Linus Carl Pauling (1901-1994) was de allereerste scheikundige die de term elektronegativiteit gebruikte. Aan het element dat het hardst elektronen naar zich toe kan trekken (fluor) kende Pauling een EN-waarde van 4,0 toe. De overige elementen werden vergeleken met fluor en kregen een overeenkomstige elektronegativiteit, tussen 0,7 en 4,0. De elektronegativiteit is dus specifiek voor elke atoomsoort.

OPDRACHT 7
Vul de juiste gegevens aan en schrap wat niet past.
Welke ionen vormen de atomen om de edelgasconfiguratie te bereiken?
• Magnesium zal elektronen opnemen / afstaan en een ion vormen.
• Stikstof zal elektronen opnemen / afstaan en een ion vormen.
• Zuurstof zal elektronen opnemen / afstaan en een ion vormen.
• Aluminium zal elektronen opnemen / afstaan en een ion vormen.
• Zwavel zal elektronen opnemen / afstaan en een ion vormen.
• Neon zal elektronen opnemen / afstaan en ion vormen.
• Lithium zal elektron opnemen / afstaan en een ion vormen.
OPDRACHT 8
Schrap wat niet past.
• In anionen is het aantal protonen kleiner / groter dan het aantal elektronen.
• In kationen is het aantal protonen kleiner / groter dan het aantal elektronen.
Denk eraan dat je het aantal elektronen in de buitenste schil van elk atoom kunt afleiden uit de plaats in het periodiek systeem.
• Elementen uit groep Ia geven 1 elektron af en vormen een ion met lading 1+.
• Elementen uit groep IIa geven 2 elektronen af en vormen een ion met lading 2+.
• Elementen uit groep IIIa geven 3 elektronen af en vormen een ion met lading 3+.
• Elementen uit groep Va nemen 3 elektronen op en vormen een ion met lading 3–.
• Elementen uit groep VIa nemen 2 elektronen op en vormen een ion met lading 2–.
• Elementen uit groep VIIa nemen 1 elektron op en vormen een ion met lading 1–.
• Elementen uit groep VIIIa vormen geen ionen, zij hebben al de edelgasconfiguratie.
Dit overzicht vormt een zeer belangrijke basis om later chemische formules te schrijven.
` Maak oefening 1 t/m 8 op p. 167 en 168.
Opgelet, er worden twee belangrijke afspraken gemaakt:
1 De overgangselementen laten we nog even links liggen, voorlopig onthouden we dat deze elementen uit de b-groepen bijna allemaal een 2+ ion gaan vormen
2 De elementen uit kolom IVa (C: koolstof, Si: silicium, Ge: germanium, Sn: tin en Pb: lood) worden ook overgeslagen. Die elementen kunnen immers twee kanten uit om tot een edelgasconfiguratie te komen: 4 elektronen opnemen en dus een 4– ion vormen, of 4 elektronen afstaan en een ion met lading 4+ vormen. Vaak zullen zij 4+ ionen vormen
3
Zijn er naast de massa en elektronenconfiguratie nog andere indelingen in het PSE?


OPDRACHT 9
Vaak maakt men in een periodiek systeem ook nog een indeling in metalen en niet-metalen door de vakjes anders in te kleuren (bij een blanco PSE is dat niet gebeurd).
Als we over metalen spreken denk je vast aan ijzer, koper … Of misschien heb je een wat duurdere smaak en denk je aan zilver, goud …
Er bestaan natuurlijk nog veel meer metalen die je regelmatig tegenkomt in het dagelijks leven, denk maar aan aluminium en chroom in je fiets, of aan de auto van je ouders.
Sorteer de metalen en de niet-metalen.
Je leerkracht heeft een aantal stoffen klaargezet.
1 Van welke stoffen denk je dat het metalen zijn? Haal ze ertussenuit.
2 Noteer waarom jij denkt dat het om een metaal gaat. Met andere woorden: van welke eigenschappen heb je gebruikgemaakt?
OPDRACHT 10
Je leerkracht onderzoekt welke stoffen stroom geleiden.
1 Werkwijze
• Verbind een testlamp met een stroombron.
• Sluit de stroomkring door de connectoren met de stof te verbinden.
Lampje brandt: stof geleidt stroom.
Lampje brandt niet: stof geleidt geen stroom.
OPDRACHT 10 (VERVOLG)
2 Wat neem je waar? Zet een kruisje in de juiste kolom.
Stof Lampje brandtLampje brandt niet ijzer (Fe) lood (Pb) octazwavel (S8) distikstof (N2, de lucht aanwezig) koper (Cu) grafiet (C)
3 Wat kun je hieruit besluiten?
OPDRACHT 11
Je leerkracht onderzoekt welke stoffen warmte geleiden door een metalen en een glazen staaf in de vlam van een bunsenbrander te houden.
DEMO metaal glas

1 Wat neem je waar?
2 Wat kun je hieruit besluiten?
OPDRACHT 12
Bekijk de tabel en los de vragen op.
StofSmeltpunt (°C)Kookpunt (°C)
ijzer
kwik –39 357 dizuurstof
1 Markeer de stoffen die bij kamertemperatuur vast zijn met rood, vloeibaar met groen en gasvormig met geel.
2 Vergelijk de verschillende stoffen in de tabel aan de hand van hun smelt- en kookpunten. Wat valt er op bij de metalen?
3 Welke aggregatietoestand hebben ze bij kamertemperatuur?
Stofeigenschappen metalenStofeigenschappen niet-metalen geleiden de elektrische stroomgeleiden de elektrische stroom niet (met uitzondering van grafiet) zacht broos
plooibaar, rekbaar, pletbaar, smeedbaar niet plooibaar, niet rekbaar, niet pletbaar, niet smeedbaar goede warmtegeleiders slechte warmtegeleiders glanzend uitzicht meestal dof uitzicht vaste stoffen op kamertemperatuur (met uitzondering van kwik, een vloeibaar metaal)
` Maak oefening 9 t/m 12 op p. 168.
meestal vloeibaar of gasvormig, maar kunnen ook vast zijn
OPDRACHT 13
Herken de metalen.
Op de Olympische Spelen kun je drie soorten medailles winnen. Uit welke metalen zijn die medailles vervaardigd?
Schrijf ook het symbool erbij, als je dat kent.
• medaille voor de winnaar:
• medaille voor de tweede:
• medaille voor de derde:
OPDRACHT 14

Opgelet, brons komt niet als zuivere stof voor in het PSE. Het is ook geen zuivere stof, maar een mengsel van verschillende metalen. Metalen worden vaak gemengd om de eigenschappen ervan te verbeteren, dat noemen we legeren van metalen.
Zoek de antwoorden op het internet.
Welke elementen worden gemengd bij deze legeringen?
• Brons is een legering van en .
• Messing is een legering van en
• Staal is een legering van en
• Roestvrij staal (RVS of inox) is een legering van , , en .

Misschien heb je zelf of samen met je team ook al ooit een medaille of trofee gewonnen. Helaas, je beker of medaille was niet vervaardigd uit echt goud of zilver, in het beste geval waren ze verguld of verzilverd. Een dun laagje van een edelmetaal bedekt dan de stalen medaille.
Naast legeren wordt er ook vaak gebruikgemaakt van adhesie, de goede hechtende eigenschappen van metaal. Een metaal wordt dan bedekt met een laagje van een ander metaal. Dat noemen we galvaniseren, een techniek om metalen meer glans te geven (verzilveren, vergulden, chromeren …) of te verhinderen dat ze roesten (verzinken van ijzer). Net als bij legeren, wordt er zo geprobeerd om de eerder nadelige eigenschappen van sommige metalen tegen te werken. Omdat een stalen medaille niet glanst, wordt ze bijvoorbeeld bedekt met een laagje goud. Zo wordt ook ijzer vaak bedekt met een laagje zink om het roesten tegen te gaan.

Metalen worden vaak gemengd tot een legering om de eigenschappen ervan te verbeteren. Dat noemen we legeren
Er staan heel veel metalen in het PSE: van de 112 elementen in het PSE dat bij dit leerschrift zit, worden er meer dan 75 % tot de metalen gerekend.
Hoewel men vaak spreekt over een gouden ring, gaat het ook hier over een legering. Puur goud is immers te zacht en wordt daarom gelegeerd met andere metalen zoals nikkel, zink, koper … Juweliers drukken het gehalte van goud uit in de eenheid karaat (1/24ste, 24 karaat is dus zuiver goud).

OPDRACHT 15
Kleur de metalen in het periodiek systeem van de elementen rood en de niet-metalen blauw.
Je leerkracht helpt je de juiste indeling te maken.
OPDRACHT 16
Beantwoord de vragen.
1 Waar bevinden zich de niet-metalen in het PSE?
2 Hadden de ionen van deze elementen een positieve of negatieve lading?
3 Waar vind je de metalen voornamelijk in het PSE?
4 Hadden de ionen van deze elementen een positieve of negatieve lading?
OPDRACHT 17 ONDERZOEK
Hoe kun je metalen herkennen? Voer het labo uit. Je vindt het bij het onlinelesmateriaal.
Elementen die elektronen afstaan om tot de edelgasconfiguratie te komen, noemen we elektropositief; ze vormen kationen. Doorgaans zijn dat metalen.
Elementen die elektronen opnemen om tot de edelgasconfiguratie te komen, noemen we elektronegatief; ze vormen anionen. Doorgaans zijn dat niet-metalen.
Vul de tabel aan.
Een 2+ geladen ion bevat nog 24 elektronen. Om welk element gaat het? 1 2 3 4 5 6
Naam element Symbool Naam groep Ionlading
Waarom vormen edelgassen geen ionen?
Vul aan.
• De overgangselementen vormen ionen met lading .
• Negatieve ionen worden ook genoemd.
• Positieve ionen worden ook genoemd.
Vul aan.
Een element dat een ion vormt met lading 2– zal altijd behoren tot .
Een element dat een ion vormt met lading 2+ zal altijd behoren tot
Een element dat een ion vormt met lading 3– zal altijd behoren tot
Een element dat een ion vormt met lading 1+ zal altijd behoren tot
Een element dat geen ionen vormt, zal altijd behoren tot .
Welk ion bezit 117 neutronen en 74 elektronen?
• 195Pt4+
• 191Pt4+
• 191W4+
• 195W4+
Beantwoord de vragen.
a Welk ion van een alkalimetaal heeft 4 schillen en 18 elektronen?
b Welk ion van een aardalkalimetaal heeft 4 schillen en 18 elektronen?
Welke van de onderstaande reeks atomen en ionen heeft een ander aantal elektronen dan de rest?
• N3–
• Al3+
• Na+
• Mg2+
• Cl–
• O2–
• Ne
• F–
Noem minstens vier stofeigenschappen van metalen.
Vul aan.
• Metalen vormen altijd positieve ionen, ze zijn .
• Niet-metalen vormen altijd negatieve ionen, ze zijn
Welke zuivere stof is geen metaal maar geleidt toch de stroom?
Wat is het enige metaal dat vloeibaar is bij kamertemperatuur?
GROEPEN EN PERIODEN IN HET PERIODIEK SYSTEEM
Het periodiek systeem van de elementen = een tabel waarin alle elementen gerangschikt zijn volgens oplopende atoommassa
kolommen: groepen
• gegroepeerd volgens hun chemische eigenschappen
• die chemische eigenschappen zijn het gevolg van het aantal elektronen in de buitenste schil
• aantal: 18
8 a-groepen
elk een naam:
Ia: alkalimetalen
IIa: aardalkalimetalen
IIIa: aardmetalen
IVa: koolstofgroep
Va: stikstofgroep
VIa: zuurstofgroep
VIIa: halogenen
VIIIa/0: edelgassen (of nulgroep)
10 b-groepen
één verzamelnaam: overgangselementen
rijen: perioden
• komen overeen met het aantal schillen in het atoommodel
• aantal: 7
WAAROM LIJKEN ATOMEN GRAAG OP EEN EDELGAS? WAT ZIJN IONEN?
elektronen opnemen
Atomen streven naar stabiele edelgasconfiguratie
–ionen:
• niet-metalen
• elektronegatief
geladen atomen = IONEN
+ionen:
• metalen
• elektropositief
• vaste stoffen bij kamertemperatuur (uitgezonderd kwik)
• specifieke eigenschappen:
- glanzen
- geleiden de stroom en de warmte
- plooibaar
- smeedbaar
- legeerbaar
afhankelijk van de elektronenconfiguratie
verschil in ionlading per groep van elementen
elektronen afstaan
ANDERE INDELINGEN IN HET PSE
We gebruiken ook verzamelnamen voor transuranen en zeldzame aarden voor bepaalde groepen van elementen. Met kleurschakeringen worden vaak ook subgroepen zoals metalen en niet-metalen in het PSE onderscheiden.
1 Begripskennis
• Ik kan toelichten hoe en waarom een atoom een ion vormt, hoe het aan zijn lading komt.
• Ik kan toelichten waarom metalen positieve ionen en niet-metalen negatieve ionen vormen.
• Ik kan een verband leggen tussen de plaats van een element in het PSE en de eigenschappen (massa, elektronenconfiguratie, EN-waarde ...) ervan.
2 Onderzoeksvaardigheden
• Ik kan het PSE gebruiken om eigenschappen van atomen en ionen af te leiden, ook op basis van atoomnummer, massagetal en lewisformule.
• Ik kan elementen ordenen en plaatsen op de tabel.
• Ik kan metalen herkennen aan de specifieke eigenschappen.
` Je kunt deze checklist ook op invullen bij je Portfolio.
JANOG OEFENEN
Sinds 2016 is het PSE vervolledigd met 118 gekende elementen. Het edelgas met atoomnummer 118 kreeg officieel de naam Oganesson en symbool Og. De naam werd afgeleid van de naam van de Russische onderzoeker. Denk nu niet dat je het element vroeg of laat in handen krijgt. De atomen Oganesson komen niet voor in de aardkorst, ze worden kunstmatig gemaakt door extra fusies van andere atomen en bestaan slechts luttele milliseconden omdat ze radioactief zijn. Naar: www.destandaard.be
1 Scan de QR-code en ontdek het volledige artikel, of bekijk het videofragment bij het onlinelesmateriaal.

2 Kun jij beter dan Mendelejev? Hoe zou jij de indeling van de elementen gemaakt hebben?
3 Prijkt jouw element in de toekomst op de tabel? Hoe zou het dan heten?
Het lijkt misschien nog verre toekomstmuziek, maar jouw kennis van wetenschap kan het begin zijn van een carrière als (wereldberoemd) kernfysicus!

Door de zeer ingenieuze rangschikking van de elementen in het PSE kun je meteen heel wat informatie afleiden uit hun plaats. Het PSE bevat eigenlijk een deels verborgen schat aan informatie. De periode geeft ons informatie over het aantal schillen, de groep geeft dan weer informatie over de elektronenconfiguratie. In de derde graad zul je ook leren dat zelfs elke dikkere lijn belang heeft.
` HOOFDSTUK 1: Zijn deeltjes in een verbinding altijd op eenzelfde manier gebonden?
1 Wat is het verschil tussen een binding en een verbinding?
2 Welke soorten bindingen bestaan er? 178
` HOOFDSTUK 2: Hoe wordt een
` HOOFDSTUK 3: Hoe wordt een atoombinding gevormd?
` HOOFDSTUK 4: Hoe wordt een metaalbinding gevormd?
1
Deze situaties schetsen telkens een probleem. Hoe kun je ervoor zorgen dat de personen alsnog in een comfortabele situatie terechtkomen?
Situatie 1

Kalvin en Fleur
Situatie 2

Jody en Jodi
Situatie 3

Ali en Alisson
Situatie 1:
Wat kan Kalvin doen zodat zowel hij als Fleur het comfortabel krijgen?
Situatie 2:
Wat moeten Jody en Jodi doen om het beiden comfortabel te krijgen?
Situatie 3:
Wat moeten Ali en Allison doen om het beiden comfortabel te krijgen?
` Is er een gelijkenis tussen deze situaties en de vorming van bepaalde chemische bindingen?
We zoeken het uit!
OPDRACHT 1
Ken je alle termen nog?
1 Vul in de tweede kolom het nummer van de juiste verklaring in.
Term Verklaring Verklaringen
atoom
edelgasconfiguratie
1 atoomsoort
2 de buitenste schil van het atoom is volledig bezet element
3 scheikundige vorm voor materie met een bepaalde chemische samenstelling negatief ion
4 kleinste deeltje van een element dat nog alle eigenschappen van het element heeft
samengestelde stof
5 ontstaat door het afstaan van elektronen positief ion
6 ontstaat door het opnemen van elektronen stof
enkelvoudige stof
2 Zet in de afbeelding de juiste letters bij de pijlen.
7 stof opgebouwd uit één element
8 stof opgebouwd uit meer dan één element
A de stof water – B het deeltje water – C een atoom waterstof – D een atoom zuurstof
OPDRACHT 2
Hoe worden ionen gevormd?
Vul de zinnen aan en schrap wat niet past.
a Metalen om de edelgasconfiguratie te bereiken.
Ze vormen zo positieve / negatieve ionen.
b Niet-metalen om de edelgasconfiguratie te bereiken.
Ze vormen zo positieve / negatieve ionen.
c Magnesium is een metaal / niet-metaal met 2 elektronen op de buitenste schil.
Dat atoom zal dus elektronen en zo het ion vormen.
d Chloor is een metaal / niet-metaal met elektronen op de buitenste schil.
Dat atoom zal dus elektron en zo het ion vormen.
e Aluminium is een metaal / niet-metaal met elektronen op de buitenste schil.
Dat atoom zal dus elektronen en zo het ion vormen.
f Zuurstof is een metaal / niet-metaal met elektronen op de buitenste schil.
Dat atoom zal dus elektronen en zo het ion vormen.
OPDRACHT 3
Onderstreep de enkelvoudige stoffen en omcirkel de samengestelde stoffen.
H2O – C (grafiet) – N2O (lachgas) – HCl (waterstofchloride) – O2 (zuurstofgas) – CH4 (methaan) – O3 (ozon) –
CO2 (koolstofdioxide) – He – C6H12O6 (glucose) – Fe (ijzer)
TIP
De elementen die enkelvoudige di-atomische stoffen vormen, kun je onthouden met het ezelsbruggetje ‘BrINClHOF’. Daarin zitten de symbolen van de elementen broom, jood, stikstof, chloor, waterstof, zuurstof en fluor. Ook elk woord van de zin ‘Claartje Fietste Naar Haar Opa In Breda’ begint met het symbool van een van die elementen. Om de polyatomische enkelvoudige stoffen S8, P4 en O3 te onthouden, zul je je geheugen moeten gebruiken.
LEERDOELEN
Je kunt al:

L het verschil tussen een element en een atoom toelichten;
L toelichten dat atomen streven naar de edelgasconfiguratie;
L begrijpen dat stoffen zijn opgebouwd uit één of meerdere atomen of elementen.
Je leert nu:
L dat de aard van de deeltjes bepaalt welke verbinding gevormd zal worden;
L wanneer een ionbinding tot stand komt;
L wanneer een atoombinding tot stand komt;
L wanneer een metaalbinding tot stand komt.
Als je om je heen kijkt, zie je allerhande voorwerpen die uit bepaalde stoffen zijn gemaakt. Een balpen uit plastic, een kast uit hout, een schrift uit papier. Ook de lucht om je heen bevat allerhande deeltjes. Al die stoffen zijn opgebouwd uit één of meerdere atoomsoorten.
Je weet al dat een stof bestaat uit kleinere deeltjes (stofdeeltjes) die nog steeds de eigenschap van de stof bezitten. Zo bestaat de stof suiker bijvoorbeeld uit allemaal kleine suikerdeeltjes.
Bij edelgassen bestaan die stofdeeltjes uit vrije, losse atomen: het zijn mono-atomische, enkelvoudige stoffen (bv. Ne). De atomen van edelgassen hebben een volledig bezette buitenste schil, waardoor ze niet reageren met andere atomen.
Atomen van andere atoomsoorten zullen de stabiele edelgasconfiguratie proberen te bereiken door met elkaar te binden. Zo ontstaan nieuwe stoffen die bestaan uit meerdere atomen of ionen: het zijn verbindingen Het kunnen polyatomische (meeratomige) enkelvoudige stoffen (bv. Cl2) of samengestelde stoffen (bv. H2O) zijn.
In thema 2 leerde je al dat enkelvoudige stoffen verbindingen zijn van atomen of ionen van eenzelfde atoomsoort; samengestelde stoffen zijn verbindingen van atomen of ionen van verschillende atoomsoorten.
De atomen of ionen in een verbinding worden samengehouden door aantrekkingskrachten, die we een (chemische) binding noemen.
Een verbinding is een stof die bestaat uit meerdere atomen of ionen. De binding is de aantrekkende kracht die de atomen of ionen in een verbinding samenhoudt.
` Maak oefening 1 op p. 180.
OPDRACHT 4
Wat is het onderscheid tussen binding en verbinding?
Bekijk afbeelding 56 en beantwoord de vragen.
a Hoeveel bindingen zie je op de afbeelding?
b Hoeveel unieke verbindingen zie je op de afbeelding?
Afb. 56
Atomen streven naar de edelgasconfiguratie. Om dat te bereiken moeten atomen (behalve de edelgassen) met elkaar binden ter vorming van een verbinding.
Naargelang de aard van de atoomsoort (metaal en/of niet-metaal) kunnen verschillende soorten bindingen en verbindingen worden gevormd:
• In een verbinding opgebouwd uit metalen en niet-metalen worden de gevormde ionen samengehouden door een ionbinding Die stof noemen we een ionverbinding.
• In een verbinding die bestaat uit één of meerdere soorten niet-metalen, worden de atomen samengehouden door een atoombinding. Een stof met enkel atoombindingen noemen we een atoomverbinding
• Als de verbinding uitsluitend is opgebouwd uit één of meerdere soorten metalen, houdt een metaalbinding de gevormde metaalionen samen. Een stof met enkel metaalbindingen noemen we een metaalverbinding.
Het soort binding dat ontstaat, hangt af van de aard van de deeltjes:
Stof is opgebouwd uitSoort verbindingSoort binding metalen en niet-metalen ionverbindingionbinding uitsluitend niet-metalen atoomverbindingatoombinding
uitsluitend metalen metaalverbindingmetaalbinding
` Maak oefening 2 t/m 6 op p. 180 en 181.
OPDRACHT 5
Op welke manier zijn de deeltjes gebonden in een verbinding?
Welk soort binding zal gevormd worden bij een verbinding die is opgebouwd uit de volgende elementen? Vul in de tabel eerst de symbolen van de elementen aan en duid daarna het soort binding aan.
Verbinding opgebouwd uit de volgende elementen Symbolen elementen
aluminium en fluor
Zijn de samenstellende elementen metalen (M) of niet-metalen (nM)?
Soort binding
ionbinding - atoombinding - metaalbinding
calcium en jood ionbinding - atoombinding - metaalbinding
jood en jood
ionbinding - atoombinding - metaalbinding
kalium en broom ionbinding - atoombinding - metaalbinding
koolstof ionbinding - atoombinding - metaalbinding
koolstof en waterstof ionbinding - atoombinding - metaalbinding
koolstof en zuurstof ionbinding - atoombinding - metaalbinding
koper en tin (samen: brons)
koper en zink (samen: messing)
ionbinding - atoombinding - metaalbinding
ionbinding - atoombinding - metaalbinding
magnesium en zuurstof ionbinding - atoombinding - metaalbinding
natrium en chloor ionbinding - atoombinding - metaalbinding
stikstof en zuurstof ionbinding - atoombinding - metaalbinding
tin en lood (samen: soldeertin)
zink
ionbinding - atoombinding - metaalbinding
ionbinding - atoombinding - metaalbinding
Vul de tabel aan om een overzicht te maken van de bouw van stoffen. Kies uit: enkelvoudig – mono-atomisch – verbinding – samengesteld – 1 / >1
Opgelet! sommige begrippen kun je meermaals gebruiken.
Aantal atomen
Stof
Aantal verschillende atomen
Stof
Welk soort binding zal gevormd worden tussen een verbinding die is opgebouwd uit de elementen in de tabel? Omcirkel het juiste antwoord.
Symbolen van de opbouwende elementen in de verbinding
K Br
C C
C H
C O
Soort binding
ionbinding - atoombinding - metaalbinding
ionbinding - atoombinding - metaalbinding
ionbinding - atoombinding - metaalbinding
ionbinding - atoombinding - metaalbinding
Cu Sn ionbinding - atoombinding - metaalbinding
Mg O ionbinding - atoombinding - metaalbinding
Na Cl ionbinding - atoombinding - metaalbinding
N O
ionbinding - atoombinding - metaalbinding
Sn Pb ionbinding - atoombinding - metaalbinding
H F ionbinding - atoombinding - metaalbinding
Zn Al Mg Cu
ionbinding - atoombinding - metaalbinding
Au Ag ionbinding - atoombinding - metaalbinding
Welke soort binding is aanwezig in de stoffen? Vul de juiste kolom aan.
KBr – Mg – Al2O3 – MgF2 – Fe – BaI2 – propaan (C3H8) – Na2S –zwaveldioxide (SO2) – Cu – N2O – S8 – H2O – Zn
Ionbinding Atoombinding Metaalbinding
Tussen welke atomen ontstaat een atoombinding?
C & H
Na & Br
C & Fe
H & O
S & Cl
Zn & Cu
Welke bindingen treffen we aan in een deeltje SO3?
atoombindingen
metaalbindingen
ionbindingen
Schrijf de formule-eenheid van de ionverbindingen.
Stof Elementen
aluminiumsulfide
magnesiumjodide
bariumoxide
lithiumbromide
kaliumsulfide
calciumbromide
natriumfluoride
lithiumjodide
magnesiumchloride
natriumoxide
` Verder oefenen? Ga naar .
LEERDOELEN
Je kunt al:
L beschrijven dat atomen verbindingen vormen omdat ze streven naar de edelgasconfiguratie;
L aanduiden dat tussen een metaal en een niet-metaal een ionbinding wordt gevormd;
L beschrijven hoe metalen en niet-metalen ionen vormen.
Je leert nu:
L hoe een ionbinding wordt gevormd;
L wat een ionbinding is;
L hoe een ionverbinding wordt voorgesteld;
L de formule-eenheid van een ionverbinding opstellen.
OPDRACHT 6
Voer de proefjes uit en noteer je waarneming.
Je hebt misschien op het etiket van sommige stoffen al formules zien staan zoals NaCl en CaCl2 of K2S. Dat zijn symbolen van elementen, waar soms een getal als subscript bij staat.
Wat betekenen die? En waarom staat bij sommige symbolen geen getal?
Al die stoffen zijn ionverbindingen, want ze zijn opgebouwd uit metalen en niet-metalen. Zoals de naam doet vermoeden, vormen de metalen en niet-metalen ionen. Maar wat houdt die ionen samen? We zoeken het uit.
1 Blaas een ballon op en houd die boven het haar van een medeleerling.
Waarneming:
2 Wrijf met de ballon over het haar van een medeleerling (bij voorkeur iemand met lang haar).
Verwijder de ballon dan langzaam van het haar.
Waarneming:
3 Wrijf de ballon nogmaals over het haar van dezelfde leerling en houd hem boven het haar van een andere leerling.
Waarneming:

Door een ballon over haren te wrijven, springen elektronen over van de haren naar de ballon. De ballon wordt zo negatief geladen en de haren positief geladen. De ballon trekt de haren aan door de aantrekkingskracht tussen tegengestelde ladingen. De haren stoten elkaar onderling af en klitten niet samen door de afstotingskracht tussen gelijke ladingen.
In het eerste en het derde deel van de proef zijn de haren of de ballon niet geladen, waardoor er geen aantrekking tussen beide is.
Wanneer een metaal met een niet-metaal een binding maakt, zal het metaal één of meerdere elektronen overdragen aan het niet-metaal. Zo ontstaan positieve en negatieve ionen. Metalen en niet-metalen werken dus samen om de edelgasconfiguratie te bereiken. Metalen kunnen het makkelijkst één of meerdere elektronen ‘missen’, de niet-metalen willen die er graag bij. Eens de ionen gevormd zijn, zorgen de elektrostatische aantrekkingskrachten tussen de tegengesteld geladen ionen voor een sterke ionbinding tussen de ionen.
Wanneer een ion gevormd wordt, krijgt een metaal het woord ion achter zijn naam: natrium wordt zo bijvoorbeeld het natriumion. Een niet-metaal krijgt de uitgang ‘ide’+ ‘ion’ achter zijn stamnaam: chloor wordt zo het chloride-ion. Bij de elementen stikstof, zuurstof en zwavel krijgt het ion een aparte naam: we spreken dan respectievellijk over het nitride-ion, het oxide-ion en het sulfide-ion.
Afb. 57
Vorming van een ionbinding tussen natrium en chloor. Natrium staat een elektron af aan chloor. Daardoor ontstaat een positief natriumion en negatief chloride-ion, die beide de edelgasconfiguratie hebben.
Bekijk de video over de ionbinding tussen een natriumion en chloride-ion.
De ionbinding houdt positieve metaalionen en negatieve nietmetaalionen bij elkaar. Ze is het gevolg van de elektrostatische aantrekking tussen tegengestelde ladingen.
We weten nu dat metalen en niet-metalen een ionbinding vormen. Maar in welke verhouding gebeurt dat en wat bepaalt die verhouding? Hoe stellen we de stof dan voor?
OPDRACHT 7
Bouw je eigen keukenzoutkristal.
Je krijgt van je leerkracht een set lego- of duploblokken in twee kleuren, die de positieve natriumionen en negatieve chloride-ionen voorstellen. Je weet inmiddels dat positieve ionen de negatieve aantrekken en dat gelijksoortige ladingen elkaar afstoten. Gebruik de stenen om samen met een klasgenoot een ‘zoutkristal’ te bouwen. De basis moet bestaan uit 3 x 4 stenen en elke laag moet volledig zijn. Er mogen geen stenen overblijven.
1 Maak hier je tekening.
2 Hoeveel stenen van elke kleur gebruikte jij?
Kleur 1: Kleur 2:
3 Bereken de verhouding van de aantallen van beide stenen.
aantal stenen kleur 1
aantal stenen kleur 2 =
4 Hoeveel stenen van elke kleur gebruikte de andere leerling?
Kleur 1: Kleur 2:
5 Bereken de verhouding van de aantallen van beide stenen.
aantal stenen kleur 1
aantal stenen kleur 2 =
6 Wat stel je vast over de verhouding van de stenen van de ene kleur ten opzichte van de andere kleur?
Proficiat, je hebt zopas je eerste ionrooster gebouwd! Als gevolg van de elektrostatische aantrekkingskracht tussen positieve en negatieve ionen, rangschikken ionen zich op een regelmatige manier. Die regelmatige rangschikking van positieve en negatieve ionen, samengehouden door ionbindingen, noemen we een ionrooster. Een zoutkristal is opgebouwd uit een ionrooster. Hoeveel positieve ionen en negatieve ionen aanwezig zijn in het ionrooster, hangt af van de grootte van het ionrooster, maar zelfs in een klein ionrooster zijn het er snel vele miljarden. De kleinste verhouding waarin de metaal- en niet-metaalionen voorkomen in het rooster, ligt echter vast. De regelmatige rangschikking van de ionen in het rooster zorgt ervoor dat het rooster gezien kan worden als een herhaling van een kleinere eenheid. Die kleinste verhouding van de ionen die zich telkens herhaalt in het rooster, noemen we de formule-eenheid of roostereenheid.

Afb. 58
Eén ionverbinding zoals keukenzout bestaat uit miljarden positieve en negatieve ionen in één keukenzoutkristal, gerangschikt in een ionrooster.
Als je het ionrooster van keukenzout of natriumchloride goed bekijkt, dan zie je dat het is opgebouwd uit steeds wederkerende eenheden die bestaan uit 1 natriumion en 1 chloride-ion.
De formule-eenheid schrijven we door de symbolen van de elementen van de ionen, vergezeld van een index (getal als subscript geschreven). De index geeft het aantal van elk van de ionen in de kleinste herhalende eenheid weer. Een index van 1 wordt evenwel niet geschreven. Voor keukenzout wordt dat dus: NaCl.
Stoffen die opgebouwd zijn uit positieve en negatieve ionen die in een ionrooster zijn gerangschikt, noemen we ionverbindingen
Ionverbindingen zijn stoffen opgebouwd uit positieve en negatieve ionen die afwisselend gerangschikt zijn in een ionrooster
De ionbinding is de kracht die de ionen samenhoudt. De kleinste herhalende eenheid in het rooster noemen we de formule-eenheid of roostereenheid.
Ze wordt voorgesteld door de symbolen van de elementen van de ionen, samen met een index. De index geeft het aantal weer van dat element in de formule-eenheid.



Keukenzout heeft als formule-eenheid NaCl en als chemische naam natriumchloride. Het wordt gewonnen door zeewater in te dampen of door ontginning uit zoutmijnen. Naast smaakversterker in de keuken kent natriumchloride veel andere toepassingen, zoals pekelen van voeding (bewaring), een bestanddeel van blusmiddelen, gebruik in geneesmiddelen (neusspray) en als strooizout dat onze wegen ijsvrij moet houden.
OPDRACHT 8
In keukenzout is het aantal positieve ionen gelijk aan het aantal negatieve ionen. Dat is echter niet in alle ionverbindingen het geval.
Bekijk de figuur van de zouten natriumjodide en kaliumsulfide.
1 Omcirkel een formule-eenheid in het rooster.
2 Schrijf de formule-eenheid van deze ionverbindingen.
Formule-eenheid 1:
Formule-eenheid 2:
Hoeveel ionen van elke soort aanwezig zijn in de formule-eenheid is afhankelijk van de lading van de ionen. De formule van een ionverbinding moet altijd neutraal zijn. We spreken daarom ook van de neutraliteitsregel: de som van alle positieve en negatieve ladingen moet gelijk zijn aan nul.
OPDRACHT 9
Natriumjodide bestaat uit natriumionen en jodide-ionen. De natriumionen dragen een lading 1+ en de jodide-ionen een lading 1–. De lading van 1 natriumion neutraliseert de lading van 1 jodide-ion, daarom is de formule-eenheid NaI. Kaliumsulfide bestaat uit kaliumionen en sulfide-ionen. De kaliumionen dragen een lading 1+. Er zijn 2 kaliumionen nodig om de lading van het sulfide-ion (2–) te ‘neutraliseren’. Daarom is de formule-eenheid K2S. Opmerking: We zouden ook kunnen redeneren dat 4 kaliumionen nodig zijn om de lading van 2 sulfide-ionen te ‘neutraliseren’, maar bij het schrijven van de formule-eenheid werken we steeds met de kleinst mogelijke verhouding.
Schrijf de formule-eenheid van een aantal ionverbindingen. Vul de tabel aan.
Stof Elementen Ionen Formule-eenheid
calciumoxide Ca O
zinksulfide Zn S
natriumbromide Na Br
kaliumoxide K O
magnesiumsulfide Mg S
aluminiumfluoride Al F
aluminiumoxide Al O
Om te bepalen welke indexen geschreven worden in een formuleeenheid gebruiken we de neutraliteitsregel: de som van de lading van de positieve ionen en negatieve ionen moet aan elkaar gelijk zijn. Die indexen worden in de kleinst mogelijke verhouding geplaatst. De index ‘1’ wordt niet geschreven.
` Maak oefening 1 op p. 188.
Plaats de juiste formule bij elke stof. Je kunt thuis online zoeken of in de klas kijken in brochures/boeken of op de etiketten van flessen of verpakkingen.
Te gebruiken
dijood
hexaan zoutzuur
ozon zwavelzuur
` Verder oefenen? Ga naar .
LEERDOELEN
Je kunt al:
L beschrijven dat atomen verbindingen vormen omdat ze streven naar de edelgasconfiguratie;
L aanduiden dat tussen twee niet-metalen atoombindingen worden gevormd;
L aangeven dat niet-metalen elektronen willen opnemen.
Je leert nu:
L hoe een atoombinding wordt gevormd;
L hoe een molecule wordt voorgesteld door een molecuulformule;
L hoe we moleculen voorstellen door een structuurformule.
Onze atmosfeer bestaat uit 78 % stikstofgas (N2), 21 % zuurstofgas (O2) en 0,03 % koolstofdioxide (CO2). Al die stoffen zijn opgebouwd uit niet-metalen. Stoffen die uitsluitend uit niet-metalen zijn opgebouwd, noemen we atoomverbindingen. Je hebt al geleerd dat niet-metalen elektronegatief zijn en de edelgasconfiguratie willen bereiken door extra elektronen op hun buitenste schil op te nemen. Maar hoe kunnen twee niet-metalen, die allebei elektronen willen opnemen, de edelgasconfiguratie bereiken?
Om te begrijpen hoe niet-metalen elkaar helpen om de edelgasconfiguratie te bereiken, kijken we even naar waterstofgas, dat opgebouwd is uit twee waterstofatomen. Beide waterstofatomen hebben 1 elektron op de eerste (en tevens enige) schil en streven naar een volledig bezetting van de buitenste schil: 2 elektronen. Beide waterstofatomen willen echter een elektron opnemen en geen van beide atomen is bereid om elektronen over te dragen. De twee waterstofatomen kunnen de edelgasconfiguratie bereiken door een gemeenschappelijk elektronenpaar te vormen. Deze twee elektronen worden gedeeld en kunnen nu bij beide atomen gerekend worden, waardoor de buitenste schil van de beide waterstofatomen volledig is gevuld.
Afb. 59
Vorming van een molecule H2: een atoombinding ontstaat door het gemeenschappelijk stellen van een elektronenpaar.
Dit gemeenschappelijk elektronenpaar wordt de atoombinding of de covalente binding genoemd. Ze wordt voorgesteld door een streepje tussen beide atomen: het bindend elektronenpaar
Deeltjes van een stof opgebouwd uit niet-metalen die door atoombindingen aan elkaar gebonden zijn, vormen samen een apart deeltje: het zijn individuele moleculen. Bij een ionverbinding spreken we niet over moleculen, omdat de ionen niet uniek aan elkaar gelinkt zijn maar een steeds herhalende eenheid in een rooster vormen.
De naam ‘covalente binding’ komt van het Latijnse ‘co’ en ‘valere’: samen van tel zijn, gelijkwaardig zijn. Het slaat dus op het feit dat de twee gemeenschappelijke elektronen de atomen stevig aan elkaar binden. In sommige boeken of bronnen gebruikt men vooral de naam ‘covalente binding’, in andere hanteert men het synoniem ‘atoombinding’. Je zorgt er dus best voor dat je ze beide goed kent.
Omdat er maar één atoombinding tussen twee atomen zit, spreken we van een enkelvoudige atoombinding. De voorstelling van de manier waarop de atomen aan elkaar gebonden zijn, noemen we de structuurformule.
Andere elementen, zoals zuurstof, streven naar een edelgasconfiguratie met 8 elektronen op de buitenste schil. De molecule zuurstofgas is opgebouwd uit 2 atomen O. Je zag al dat het element zuurstof 6 elektronen heeft op de buitenste schil, waarvan 2 ongepaarde elektronen. Je leerde al in thema 4 hoe de elektronen verdeeld worden over het symbool van het element: eerst individueel, vanaf het vijfde elektron als een paar. Om aan 8 elektronen te geraken op de buitenste schil, zal elk ongepaard elektron van een zuurstofatoom een bindend elektronenpaar vormen met een ongepaard elektron van het andere zuurstofatoom. Zo ontstaat in de structuurformule een dubbele atoombinding tussen beide atomen.
Afb. 60
De vorming van een molecule zuurstofgas
Atomen van het element stikstof beschikken over 3 ongepaarde elektronen en 1 vrij elektronenpaar op hun buitenste schil. In een molecule opgebouwd uit 2 stikstofatomen zal elk ongepaard elektron van een stikstofatoom een bindend elektronenpaar vormen met een ongepaard elektron van het andere stikstofatoom. Zo ontstaat een drievoudige atoombinding in de structuurformule.
Afb. 61
De vorming van een molecule stikstofgas N N N N NN
Koolstofdioxide (CO2), een belangrijk broeikasgas in de atmosfeer, bestaat uit twee soorten niet-metalen: 2 zuurstofatomen en 1 koolstofatoom. De zuurstofatomen hebben elk 6 elektronen op de buitenste schil, waarvan 2 ongepaard. Het koolstofatoom heeft 4 ongepaarde elektronen in de buitenste schil. Door het vormen van gemeenschappelijke bindende elektronenparen kan elk atoom ook de edelgasconfiguratie bereiken. In deze moldecule heeft elk zuurstofatoom nog 2 vrije elektronenparen.
Merk op dat we gaandeweg een elektronenpaar voorstellen door een streepje in plaats van twee bolletjes naast elkaar te tekenen.
Een stof enkel opgebouwd uit niet-metalen noemen we een atoomverbinding. De bindingen die de niet-metalen aan elkaar binden, worden atoombindingen of covalente bindingen genoemd. Een atoombinding ontstaat door de vorming van een gemeenschappelijk elektronenpaar. Tussen twee atomen kunnen enkelvoudige, dubbele of drievoudige atoombindingen voorkomen. De structuurformule geeft aan op welke manier de atomen in een molecule aan elkaar gebonden zijn.
OPDRACHT 10
Teken de structuurformule van de moleculen.
Vul in de tabel aan hoeveel atoombindingen je in elk van de moleculen aantreft.
Wil je de notatie met de lewisstructuur opfrissen? Scan de QR-code.
stof waterstofsulfide (H2S)chloorgas (Cl2) water (H2O) structuurformule
aantal atoombindingen
stof methaangas (CH4)ammoniak (NH3)waterstofchloride (HCl) structuurformule
aantal atoombindingen
OPDRACHT 11 DOORDENKER
Teken de structuurformule van de moleculen.
Vul in de tabel aan hoeveel atoombindingen je in elk van de moleculen aantreft.
stof zwavelmonoxide (SO)fosfortrichloride (PCl3) tetra (CCl4) structuurformule
aantal atoombindingen
Moleculen zijn opgebouwd uit meerdere atomen van niet-metalen die verbonden zijn door een atoombinding. Maar hoe stellen we een atoomverbinding voor met een formule?
OPDRACHT 12
Bepaal de bouw van een atoomverbinding.
Bekijk hieronder de voorstellingen van de stof mierenzuur (een kleurloze stof die zuur smaakt), glucose (een witte, vaste stof die zoet smaakt) en keukenzout. Beantwoord de vragen.
1 Welke stof of welke stoffen zijn atoomverbindingen?
2 Welke stof is een ionverbinding?
OPDRACHT 12 (VERVOLG)
3 Wat stel je vast als je de bouw van een atoomverbinding vergelijkt met een ionverbinding?
4 Vul in de tabel aan hoeveel atomen van elk element zich in een stofeenheid mierenzuur en glucose bevinden.
elementen
aantal atomen van elk element
WEETJE
Als mieren bedreigd worden, proberen ze een wondje te bijten in hun belager, waar ze dan met hun achterlijf mierenzuur in spuiten. Dat is pijnlijk, want mierenzuur is een corrosieve stof. Ook andere organismen zoals bijen, wespen, hommels en brandnetels gebruiken dat zuur ter verdediging.


De moleculen van mierenzuur en glucose zijn beide opgebouwd uit de elementen koolstof, waterstof en zuurstof, maar ze bevatten een verschillend aantal atomen. De samenstelling van een molecule wordt weergegeven door de molecuulformule. De molecuulformule geef je weer door de symbolen van de elementen te noteren, samen met een index: zo krijgt de formule een kwalitatief en een kwantitatief aspect. De index is het getal dat weergeeft hoeveel atomen van elk element aanwezig zijn in 1 molecule. Ze wordt rechts onder het symbool van het element genoteerd.
De molecuulformule van een atoomverbinding ziet er gelijkaardig uit als de formule-eenheid van een ionverbinding. De formule-eenheid geeft echter de verhouding tussen de elementen weer in het ionrooster (bv. NaCl), terwijl de moleculeformule de werkelijke samenstelling weergeeft van één molecule van de stof (bv. H2O).
Een stof waarvan een molecule bestaat uit x atomen van element A, y atomen van element B en z atomen van element C, stellen we dus voor als AxByCz.
TIP
Net zoals bij de formule-eenheid van ionverbindingen, wordt het getal 1 als index niet geschreven.
Atoomverbindingen zijn stoffen opgebouwd uit moleculen. Moleculen bestaan uit een welbepaalde combinatie van twee of meer atomen die tot verschillende atoomsoorten kunnen behoren. De molecuulformule bestaat uit de symbolen van de atoomsoorten die ze bevat, vergezeld van een index die het aantal atomen van elke atoomsoort weergeeft.
OPDRACHT 13
Schrijf de molecuulformule van atoomverbindingen.
1 Noteer de molecuulformules van de stoffen in de tabel.
Aantal atomen van verschillende atoomsoorten in de molecule Molecuulformule
8 zwavelatomen
2 waterstofatomen, 1 zwavelatoom, 4 zuurstofatomen
1 waterstofatoom, 1 stikstofatoom, 3 zuurstofatomen
6 koolstofatomen, 8 waterstofatomen, 7 zuurstofatomen
2 joodatomen
2 Schrijf met behulp van de gegeven structuren de molecuulformule van paracetamol (pijnstiller) en cafeïne (blauw = stikstof; rood = zuurstof; zwart = koolstof; wit = waterstof).
Molecuulformule:
Molecuulformule:
De moleculen van een vaste stof, zoals glucose, kunnen zich ook ordenen in een rooster. Een dergelijk rooster noemen we een molecuulrooster. Bij atoomverbindingen kunnen ook zogenaamde atoomroosters voorkomen, zoals bij koolstof. Doordat koolstof over 4 ongepaarde valentie-elektronen beschikt, kunnen miljarden koolstofatomen zich met elkaar verbinden tot twee- of driedimensionale netwerken (op elk ‘knooppunt’ van het netwerk bevindt zich dan een koolstofatoom).
Koolstof komt in de natuur als vaste, enkelvoudige stof in twee verschijningsvormen voor: grafiet en diamant. Grafiet bestaat uit een opeenstapeling van tweedimensionale netwerken, waarin elk koolstofatoom gebonden is aan 3 andere. Diamant bestaat uit een driedimensionaal netwerk waarin elk koolstofatoom gebonden is aan 4 andere.


Het verschijnsel dat van een enkelvoudige, vaste stof verschillende verschijningsvormen bestaan, noemen we allotropie. De verschijningsvormen noemen we allotropen. Zo zijn diamant en grafiet allotropen van koolstof.
Bij vaste stoffen die uit moleculen zijn opgebouwd, zijn de moleculen op een regelmatige manier gerangschikt in een molecuulrooster. Sommige elementen, zoals koolstof, vormen enkelvoudige stoffen en kunnen atoomroosters vormen. In een atoomrooster zijn een groot aantal atomen met atoombindingen verbonden tot twee- of driedimensionale netwerken
` Maak oefening 1, 2 en 3 op p. 196, 197 en 198.
Schrijf de molecuulformule van de stoffen. (grijs/zwart = C; rood = O; blauw = N; wit = H)
Vul de tabel aan met de structuurformule en geef aan hoeveel atoombindingen er in elke verbinding of molecule zitten.
stof waterstofsulfide (H2S)chloorgas (Cl2) waterstofchloride (HCl)
structuurformule
aantal atoombindingen
stof zwaveldichloride (SCl2)fosfortrichloride (PCl3)tetra (CCl4)
structuurformule
aantal atoombindingen
stof waterstoffluoride (HF)zuurstofdifluoride (OF2)methanal (H2CO)
structuurformule
aantal atoombindingen
stof azijnzuur (CH3COOH)ethyn (C2H2)
structuurformule
aantal atoombindingen
Los het kruiswoordraadsel op. Let op: gebruik ook begrippen uit de weetjes.
Horizontaal
1 In diamant en grafiet zitten atomen in een ...
4 Een voorstelling van het aantal atomen van elke soort in een atoomverbinding
7 Elektrostatische aantrekkingskracht
8 Binding tussen C en H
10 Positief ion
12 Binding tussen Na en F
15 Het hebben van een volledig bezette buitenste schil
16 Positieve en negatieve ionen zitten in een ... ionrooster
17 Het verschijnsel dat een enkelvoudige, vaste stof in meerdere verschijningstoestanden kan voorkomen
18 Negatief ion
19 Binding tussen Fe en Fe
Verticaal
2 Alle atomen van eenzelfde soort
3 Een deeltje dat bestaat uit een welbepaald aantal atomen, die met een atoombindingen aan elkaar hangen
5 Een schematische voorstelling die weergeeft welke atomen aan elkaar gebonden zijn in een molecule
6 Mengsel van twee of meer metalen
9 Vaste metalen bestaan uit positieve metaalionen die gerangschikt zitten in een ...
11 Kracht die twee atomen/ionen samenhoudt
13 Geladen atoom
14 Geladen deeltjes die vrij bewegen in een metaalrooster
LEERDOELEN
Je kunt al:

L beschrijven dat atomen streven naar de edelgasconfiguratie;
L beschrijven hoe tussen een metaal en een niet-metaal een ionbinding wordt gevormd;
L beschrijven hoe tussen twee niet-metalen atoombindingen worden gevormd;
L aangeven dat metalen elektropositief zijn.
Je leert nu:
L hoe metaalatomen in een metaal als stof gebonden zijn;
L de eigenschappen van enkele metalen te verklaren aan de hand van hun bouw.
IJzer moet je smeden als het heet is. In films zie je soms nog hoe een smid met een hamer en aambeeld een gloeiend hete staaf tot een zwaard klopt. Maar in tegenstelling tot een stuk glas, splijt het metaal niet. Hoe komt dat? En waarom draagt een smid die metaal bewerkt altijd dikke handschoenen?
Metaalatomen hebben maar een beperkt aantal elektronen op hun buitenste schil. Metalen proberen de edelgasconfiguratie te bereiken door de elektronen van hun buitenste schil af te staan. Daarom zijn metalen elektropositief. Maar hoe kunnen meerdere metaalatomen met elkaar binden, als alle atomen hun elektronen willen afstaan?
Bij kamertemperatuur hebben bijna alle metalen de vaste aggregatietoestand. In de vaste aggregatietoestand zijn metaalatomen op een regelmatige manier gerangschikt in een metaalrooster en ze geven daarbij de elektronen van hun buitenste schil af. Het metaalrooster is dus opgebouwd uit positieve metaalionen met daartussen een zee van elektronen. Die elektronen kunnen zich vrij tussen de positieve metaalionen bewegen en vormen als het ware een lijm die alles in het metaalrooster stevig bij elkaar houdt. Er zijn sterke elektrostatische krachten tussen de negatieve en positieve ladingen in het metaalrooster, de coulombkrachten, die het geheel bij elkaar houden: de metaalbinding. Die metaalbinding is een zeer sterke binding.
Vaste metalen als zuivere stof zijn opgebouwd uit miljarden ionen van eenzelfde atoomsoort. De formule van een dergelijke stof stellen we voor door het symbool van de atoomsoort


Het Atomium is een van de gekendste monumenten in Brussel. Het werd in 1958 gebouwd in het kader van de Wereldtentoonstelling in Brussel (Expo 58). De metalen constructie bestaat uit 9 bollen en stelt de herhalende eenheid van het metaalrooster van ijzer voor (weliswaar 165 miljard keer vergroot). De bollen zijn van aluminium gemaakt omdat aluminium beter bestand is tegen verwering (corrosie) dan staal. Hoewel het de bedoeling was om de constructie na zes maanden af te breken, besloot men ze te laten staan omwille van haar populariteit.
De betekenis van de naam of het symbool van een atoomsoort kan verschillen naargelang de context:
• ‘Een dakgoot is gemaakt uit zink’: hier bedoelt men de stof zinkmetaal.
• ‘Zink heeft 2 elektronen op de buitenste schil’: hier bedoelt men het element of de atoomsoort zink, namelijk alle zinkatomen.
• ‘Zink draagt twee elektronen over aan chloor’: hier bedoelt men dat 1 atoom zink 2 elektronen afstaat.
Metalen in vaste aggregatietoestand bestaan uit een metaalrooster. In een metaalrooster bevinden zich positieve metaalionen en een zee van vrij bewegende elektronen, afkomstig van de buitenste schil van de metaalatomen. De aantrekkingskrachten tussen de positieve ionen en de vrij bewegende elektronen vormen de metaalbinding. De metaalbinding is een sterke binding. De formule van een metaal als zuivere stof bestaat uit het symbool van het metaal.
Ontdek meer over de roosters en hun toepassingen via de ontdekplaat bij het onlinelesmateriaal.
Veel specifieke eigenschappen van metalen die je in thema 4 zag, kunnen nu verklaard worden op basis van hun bouw. Metalen zijn goede geleiders van elektriciteit. Elektriciteit is namelijk de beweging van geladen deeltjes, en in een metaalrooster kunnen elektronen vrij bewegen.
Nu weet je waarom een smid dikke handschoenen draagt! Bekijk de video over warmtegeleiding bij metalen.
Alle metalen zijn goede geleiders van elektriciteit, maar in elektrische leidingen gebruikt men vrijwel uitsluitend het metaal koper. Dat heeft vooral te maken met een combinatie van gunstige eigenschappen. Niet alleen geleidt koper de elektriciteit zeer goed, het kent ook een lage warmtevervorming en is vrij goed bestand tegen ongunstige omgevingsinvloeden (vocht, industriële vervuiling …). Bovendien is koper hard en tegelijkertijd plooibaar. Een gebroken of doorgesneden draad kan ook gemakkelijk hersteld worden door de uiteinden aan elkaar te solderen of smelten.

Metalen zijn goede geleiders van warmte. Wanneer een stof opwarmt, beginnen deeltjes (atomen, ionen of moleculen) harder te trillen. Door botsingen wordt de warmte-energie doorgegeven aan naburige atomen of ionen. Doordat in een metaalrooster de metaalionen zeer dicht opeen zitten, verspreidt de warmte zich snel. Maar doordat de elektronen – die ook warmteenergie kunnen opnemen – vrij kunnen bewegen tussen de metaalionen, gebeurt de warmtegeleiding sneller dan bij de meeste andere stoffen.
Een metalen staaf die in je kamer ligt, voelt koud aan als je ze vastneemt. Die metalen staaf heeft nochtans dezelfde temperatuur als de omgeving (bv. 20 °C). Maar als je ze vastneemt met de blote hand, zal ze de warmte van je huid verspreiden, waardoor je hand lokaal een beetje afkoelt.
De hoge massadichtheid (massa per volume-eenheid) van metalen is een gevolg van de zeer dichte, compacte stapeling van de metaalionen in het rooster.
De meeste metalen hebben een hoog smeltpunt en kookpunt, omdat de metaalbinding een sterke binding is. Het kost dus veel energie om de metaalbindingen in een rooster te verbreken.
Bekijk deze boeiende video over metalen.
BEKIJK DE VIDEO
Metalen zijn gemakkelijk vervormbaar omdat ze allemaal zijn opgebouwd uit positieve ionen. De positieve ionen kunnen ten opzichte van elkaar verschuiven en elkaars plaats innemen zonder dat ze elkaar afstoten, wat ervoor zou zorgen dat het rooster breekt of splijt.
Afb. 69
Metaalbindingen: metalen zijn gemakkelijk vervormbaar omdat de ionen elkaars plaats kunnen innemen.
Doordat alle metalen opgebouwd zijn uit positieve metaalionen, kunnen de metaalionen van de ene atoomsoort zich schikken in een metaalrooster van een andere atoomsoort. Zo ontstaan legeringen, zoals je al weet uit thema 2. Brons is bijvoorbeeld een legering van tin en koper. Als de atomen van de atoomsoorten niet even groot zijn, zijn de ionen minder regelmatig geordend. Daardoor is het moeilijker om lagen metaalionen te verschuiven, waardoor de legering sterker is dan de zuivere metalen (zie afbeelding 69). Legeringen worden dus gemaakt om bepaalde minder goede eigenschappen te verbeteren.
Afb. 70
Een legering is een mengsel van twee metalen. Als de ionen van de twee atoomsoorten niet even groot zijn, is de rangschikking van de ionen minder regelmatig. Zo kunnen lagen van ionen minder goed schuiven ten opzichte van elkaar.
Heel wat eigenschappen van metalen, zoals geleidbaarheid van elektriciteit en warmte, massadichtheid, hoog smelt- en kookpunt, vervormbaarheid en de vorming van legeringen, kunnen verklaard worden op basis van de bouw van metalen.
` Maak oefening 1, 2 en 3 op p. 203.
Verklaar waarom een metaal vervormbaar is als je erop slaat met een hamer, terwijl een ionrooster van een ionverbinding breekt/splijt.
In welke stof zitten deeltjes in een atoomrooster?
ijzermetaal
grafiet
diamant
CO2
CaI2
Welke formules stellen een structuurformule, molecuulformule of formule-eenheid voor?
Vul de tabel aan.
Behalve de edelgassen, zijn stoffen verbindingen van meerdere atomen die ontstaan omdat atomen of elementen streven naar de edelgasconfiguratie. In een verbinding zijn atomen of ionen gebonden door een bepaald type binding
In een stof samengesteld uit metaal en niet-metaal, staat het metaal één of meerdere elektronen af aan het niet-metaal. Zo ontstaan positieve en negatieve ionen. Door de elektrostatische aantrekkingskracht tussen tegengesteld geladen ionen ontstaat een ionbinding. Door de regelmatige rangschikking van ionen ontstaat een ionrooster dat miljarden ionen bevat. Een ionverbinding stellen we voor met de formule-eenheid: dat is de kleinste verhouding van de positieve en negatieve ionen. Het is tevens het kleinste neutrale groepje van ionen in het rooster. Om te bepalen welke indexen geschreven worden in de formule-eenheid, gebruiken we de neutraliteitsregel
Als een stof opgebouwd is uit niet-metalen zijn de atomen verbonden door gemeenschappelijke elektronenparen Die gemeenschappelijke elektronenparen vormen de atoombindingen of covalente bindingen. Tussen twee atomen van niet-metalen kan een enkelvoudige, tweevoudige of drievoudige atoombinding worden gevormd. Meestal bestaat een atoomverbinding uit moleculen: deeltjes die opgebouwd zijn uit een welbepaald aantal verbonden atomen. De molecuulformule geeft de aard en het aantal (met een index) van elke atoomsoort in de molecule weer. De structuurformule geeft weer welke atomen aan elkaar gebonden zijn. Sommige enkelvoudige stoffen, zoals grafiet en diamant, bestaan uit een groot aantal atomen die verbonden zijn in een netwerk: een atoomrooster
Een metaal in vaste aggregatietoestand is opgebouwd uit een metaalrooster van positieve metaalionen met daartussen elektronen – afkomstig van de buitenste schil van de metaalatomen – die zich vrij kunnen bewegen. De aantrekking tussen de vrij bewegende elektronen en de metaalionen vormt de metaalbinding. Heel wat typische eigenschappen van metalen, zoals geleidbaarheid van warmte, elektriciteit, massadichtheid, vervormbaarheid, hoog smeltpunt en het vormen van legeringen, zijn te verklaren aan de hand van de bouw van metaalroosters.
Maak zelf een schema.
1 Begripskennis
• Ik kan beschrijven wat het verschil is tussen een binding en een verbinding.
• Ik kan bepalen in welke gevallen een ionbinding, atoombinding of metaalbinding wordt gevormd.
• Ik kan aangeven dat een atoombinding bestaat uit een gemeenschappelijk elektronenpaar.
• Ik kan een onderscheid maken tussen enkelvoudige, dubbele of drievoudige binding.
• Ik kan beschrijven wat een ionbinding, atoombinding en metaalbinding is.
• Ik kan de bouw van een ionverbinding, atoomverbinding en metaalverbinding beschrijven.
• Ik kan de bouw van een ionverbinding, atoomverbinding en metaalverbinding met elkaar vergelijken
2 Onderzoeksvaardigheden
• Ik kan bepalen of een stof een ionverbinding, atoomverbinding of metaalverbinding is.
• Ik kan de formule-eenheid in een ionrooster aanduiden
• Ik kan de neutraliteitsregel gebruiken om de formule-eenheid van een ionverbinding te schrijven.
• Ik kan de formule-eenheid van een ionverbinding en de molecuulformule van een atoomverbinding schrijven.
` Je kunt deze checklist ook op invullen bij je Portfolio.
JANOG OEFENEN
Net zoals mensen elkaar kunnen helpen, doen atomen dat ook. Alle atomen streven een volledige bezette buitenste schil na.
Denk even terug aan de drie situaties in de CHECK IN. Over welk soort bindingen gaat het daar? Vul aan.
Situatie 1
Atomen met weinig elektronen op hun buitenste schil helpen atomen met een bijna volledige bezette buitenste schil, door elektronen naar hen over te dragen. Zo gaf in het voorbeeld op p. 174 Kalvin zijn dekentje af aan Fleur, net zoals een kalium een elektron overdraagt aan fluor.
Soort binding:
Situatie 2
Twee atomen die elk een bijna volledig bezette buitenste schil hebben, zullen elkaar helpen door elektronen met elkaar te delen. Net zoals Jody en Jodi een deken delen om het warm te krijgen, gaan twee jood-atomen elektronen delen.
Soort binding:
Situatie 3
Twee atomen met weinig elektronen op hun buitenste schil, staan beide hun elektronen af. Die elektronen bewegen vrij van het ene ion naar het andere, en het ‘spel’ van de elektronen houdt alles samen.
Soort binding:



Een metaal en een niet-metaal vormen een ionbinding, waarbij het metaal één of meer elektronen afstaat en een positief ion vormt; terwijl het niet-metaal die extra elektronen opneemt en een negatief ion vormt, zo konden ook Kalvin en Fleur elkaar helpen. Twee niet-metalen delen een elektronenpaar en gaan een atoombinding aan, net als Jodi en Jody. Metaalatomen kunnen ook onderling een metaalbinding aangaan door alle positieve metaalionen te vormen, net als Ali en Allison deden.
` HOOFDSTUK 1: Wat is een chemische reactie?
` HOOFDSTUK 2: Hoe wordt een chemische reactie genoteerd?
` HOOFDSTUK 3: Welke types chemische reacties zijn er?
` HOOFDSTUK 4: Wat gebeurt er met de massa’s voor en na een chemische reactie?
` HOOFDSTUK 5: Welk nut hebben chemische reacties als energiebron?
Als je een brood bakt, is het rijzen van het deeg belangrijk om een luchtig brood te krijgen. Maar wat gebeurt er dan eigenlijk precies? We testen welke reactie/stof ervoor zorgt dat brood rijst.
WAT HEB JE NODIG?

balans – erlenmeyer – proefbuis – ballon – maatcilinder – één koffielepel bakpoeder – 10 mL azijn
HOE GA JE TE WERK?
1 Plaats de erlenmeyer, de proefbuis en de ballon (die je eerder al eens opblies) naast elkaar op de balans.
2 Breng de balans op nul door te tarreren.
3 Breng een koffielepel bakpoeder in de erlenmeyer.
4 Breng met behulp van de maatcilinder 10 mL azijn in de proefbuis.
5 Plaats de proefbuis in de erlenmeyer.
6 Plaats de ballon zoals op afbeelding 71 op de erlenmeyer.
7 Weeg het geheel en noteer de totale massa voor de reactie in de tabel, in de kolom ‘Eigen meting’
WAT VERWACHT JE?
Schrap wat niet past.
Nadat de stoffen bij elkaar zijn gebracht, zal de gemeten massa lager / gelijk / hoger zijn.
WAT GEBEURT ER?
• Kantel de erlenmeyer, waardoor de azijn in contact komt met het bakpoeder. Je merkt dat er een chemische reactie optreedt. Weeg het geheel en noteer de totale massa na de reactie in de tabel.
• Bereken het verschil in massa voor en na de reactie.
• Verwijder de ballon en leg hem op de balans. Noteer de massa.
• Verzamel gegevens van twee andere klasgenoten in de derde en vierde kolom. Wat stel je vast?
Meting
massa voor de reactie (g) massa na de reactie (g) verschil in massa voor en na de reactie (g) massa na verwijderen ballon (g)
HOE ZIT DAT?
Eigen metingMeting klasgenoot 1Meting klasgenoot 2
Welk gas zorgt voor het rijzen van het brood? Misschien kan dit helpen: bakpoeder bevat een stof met formule
NaHCO3
Welke belangrijke wet geldt tijdens een chemische reactie en heb je nu bewezen tijdens deze proef?
• Wat gebeurt er tijdens een chemische reactie?
• Welke wetten zijn geldig tijdens een chemische reactie?
• Hoe kan een chemische reactie nuttig zijn voor ons? Wanneer vormt ze een probleem?
OPDRACHT 1
Wat weet je nog over energiebronnen uit de lessen natuurwetenschappen?
1 Welke energiebron herken je? Vul aan.
2 Komt de beschikbare energie rechtstreeks uit een chemische reactie? Kruis aan. Energiebron






komt uit een chemische reactie.
komt niet uit een chemische reactie.
komt uit een chemische reactie.
komt niet uit een chemische reactie.
komt uit een chemische reactie.
komt niet uit een chemische reactie.
komt uit een chemische reactie.
komt niet uit een chemische reactie.
komt uit een chemische reactie.
komt niet uit een chemische reactie.
komt uit een chemische reactie.
komt niet uit een chemische reactie.
3 Bekijk de applet waarin de verschillende energiebronnen eenvoudig worden voorgesteld.
OPDRACHT 2
Bekijk de energieomzettingen op de afbeeldingen.
BEKIJK DE APPLET
Duid aan welke energieomzetting er plaatsvindt bij de volgende afbeeldingen. Er zijn meerdere antwoorden mogelijk.
stralingsenergie
chemische energie thermische energie celademhaling fotosynthese
stralingsenergie chemische energie
chemische energie stralingsenergie
thermische energie chemische energie
stralingsenergie thermische energie

chemische energie elektrische energie
chemische energie kinetische energie
thermische energie chemische energie
chemische energie thermische energie
Stoffen bezitten chemische energie. Chemische energie kan omgezet worden in andere energievormen, en omgekeerd.
LEERDOELEN
Je kunt al:
L het verschil tussen een enkelvoudige en een samengestelde stof toelichten;
L de formule van zuurstofgas (O2) toelichten.
Je leert nu:
L het principe van een chemische reactie begrijpen;
L een chemische reactie duiden als een herschikking van atomen.
OPDRACHT 3
DEMO
IJzer en magnesium

Heb je met vrienden of familie al eens een kampvuur gemaakt? Misschien heb je tijdens een koude winteravond marshmallows gekaramelliseerd of chocolademelk verwarmd? Wist je toen dat je twee verschillende wetenschappen beoefende: chemie en fysica? Je hebt met andere woorden een chemisch of fysisch proces uitgevoerd.
• Tijdens een chemisch proces worden nieuwe stoffen gevormd.
• Tijdens een fysisch proces worden geen nieuwe stoffen gevormd maar veranderen stoffen eventueel van aggregatietoestand.
Je leerkracht houdt achtereenvolgens een ijzeren spijker en een stukje magnesiumlint met behulp van een klem in de vlam van een bunsenbrander.
VEILIGHEIDSVOORSCHRIFT !
Kijk niet rechtstreeks in de vlam.
1 Wat neem je waar? Noteer in de tabel.

Waarneming
ijzeren spijker
magnesiumlint
2 Is dit een chemisch of een fysisch proces? Kruis aan in de tabel.
Soort proces?
chemisch proces
fysisch proces
chemisch proces
fysisch proces
OPDRACHT 4
Beantwoord de vragen.
1 Voer je bij de volgende acties een fysisch of chemisch proces uit? Duid aan en verklaar je antwoord.
Actie Soort proces Verklaring
a hout in een kampvuur verbranden
b chocolademelk verwarmen
c marshmallows karamelliseren
chemisch proces
fysisch proces
chemisch proces
fysisch proces
chemisch proces
fysisch proces
2 Waarom is ‘marshmallows smelten’ wetenschappelijk niet correct? Leg uit.
OPDRACHT 5
ONDERZOEK
Kun je chemische en fysische processen van elkaar onderscheiden? Voer het labo uit. Je vindt het bij het onlinelesmateriaal.
WEETJE
fysica
fysicochemie biofysica natuurwetenschappen biochemie
Je leerde een chemisch proces duidelijk onderscheiden van een fysisch proces. Maar net als andere wetenschappen, hebben chemie en fysica ook verschillende raakvlakken. Zo leerde je in de vorige thema’s begrippen kennen die ook bij fysica belangrijk zijn, bv. de relatie elektronen – elektriciteit – geleidbaarheid en de coulombkracht.
biologie chemie
Ook chemie en biologie staan niet naast elkaar, maar ondersteunen elkaar. Zo is water het belangrijkste oplosmiddel in ons lichaam, waarin bv. hormonen verplaatst worden naar de organen. Dat leidt tot overkoepelende vakken in het hoger onderwijs, zoals biochemie, fysicochemie of biofysica.
Denk dus niet in vakjes, maar bundel de wetenschappen tot één geheel. Ook in de industrie werken verschillende wetenschappers samen. In het filmpje kun je zo’n samenwerking zien bij ExxonMobil. Je zult merken dat STEM-vakken een centrale rol spelen in het bedrijf.
Tijdens een chemisch proces ontstaan nieuwe stoffen
Tijdens een fysisch proces worden geen nieuwe stoffen gevormd. De aanwezige stof verandert bv. van aggregatietoestand.
De verandering die bij een chemisch proces plaatsvindt, noemen we een chemische reactie.
In opdracht 3 heb je bij magnesium een verbrandingsreactie uitgevoerd.
Een verbranding is een reactie tussen een stof en zuurstofgas (O2).
• Bij de verbranding van een enkelvoudige stof ontstaat er een binding tussen het atoom van de enkelvoudige stof en de zuurstofatomen van zuurstofgas. Die gevormde stof wordt een oxide genoemd.
• Bij de verbranding van een samengestelde stof zal met elk atoom van de samengestelde stof een oxide gevormd worden. Zo ontstaat bij de volledige verbranding van methaangas (CH4) koolstofdioxide of CO2 en water of H2O.
Een verbrandingsreactie is een reactie tussen een stof en zuurstofgas waarbij oxiden gevormd worden.
Tijdens een verbrandingsreactie van een brandstof wordt meestal koolstofdioxide (CO2) gevormd. We spreken dan van een volledige verbranding. Tijdens een onvolledige verbranding wordt er koolstofmonoxide (CO) gevormd. CO ontstaat door een tekort aan zuurstofgas (O2) in de ruimte: niet alle koolstofatomen kunnen binden met voldoende zuurstofatomen, waardoor er naast koolstofdioxide (CO2) ook koolstofmonoxide (CO) ontstaat. Een slecht functionerende schoorsteen of boiler kan aan de basis liggen van de vorming van koolstofmonoxide. In het weerbericht wordt vaak gewaarschuwd voor koolstofmonoxide- of CO-vergiftiging. Koolstofmonoxide is een geurloos gas en wordt vaak ‘de stille doder’ genoemd. Om die reden wordt het aangeraden om CO-melders aan te brengen in een woning.

Tijdens een chemische reactie, zoals een verbrandingsreactie, worden de aanwezige atomen herschikt. Er worden geen atomen extra gevormd en er verdwijnen geen atomen. Er ontstaan nieuwe stoffen met een specifieke formule.
Een chemische reactie wordt genoteerd in een reactievergelijking, waarbij een eenrichtingspijl aanduidt welke stoffen worden omgezet en welke stoffen worden gevormd. Formules van stoffen mogen niet aangepast worden in een reactievergelijking. In opdracht 6 leer je hoe je een chemische reactie noteert in een reactievergelijking.
OPDRACHT 6
Stel reactievergelijkingen op.
1 Denk nog eens terug aan de verbrandingsreactie van magnesium. Probeer stapsgewijs een reactievergelijking uit te schrijven.
a Noteer het symbool voor magnesium.
TIP
Een reactievergelijking wordt genoteerd als gebruikte stof(fen) → gevormde stof(fen) Het aantal stoffen voor en na de pijl kan natuurlijk variëren.
b Welke chemische stof voeg je toe bij een verbranding? Noteer de formule.
c Het witte poeder dat gevormd is, heeft als formule MgO. Schrijf de reactievergelijking op.
2 + → 2
2 Je leerkracht herhaalt de verbrandingsreactie van magnesium (demo-opdracht 3) en voegt water toe aan het witte poeder dat gevormd werd tijdens de verbrandingsreactie.
a Na de proef voegt je leerkracht fenolftaleïne toe aan het gevormde product. Noteer je waarneming.
b De kleur die je observeert, wijst op het ontstaan van een basisch milieu. Door het toevoegen van water is immers een nieuwe stof gevormd, magnesiumhydroxide met als formule Mg(OH)2
c Schrijf de reactievergelijking op. →
3 Noteer nog eens de twee reactievergelijkingen.
4 Wat stel je vast met betrekking tot de atomen?
5 Bij de eerste reactievergelijking waren er al cijfers gegeven in de oplossing. Wat is daarvoor de reden, denk je?
Tijdens een chemische reactie worden de aanwezige atomen herschikt om zo nieuwe stoffen met nieuwe stofeigenschappen te vormen.
Een chemische reactie wordt genoteerd in een reactievergelijking gebruikte stof(fen) → gevormde stof(fen)
` Maak oefening 1 en 2 op p. 215.
Zijn de verschijnselen fysisch of chemisch? Zet een kruisje in de juiste kolom.
Verschijnsel
ijzer laten roesten fruit laten rotten inkt verwijderen met een inktwisser potlood verwijderen met een gom ontkleuren met bleekwater linnen drogen groenten gaarkoken voedsel verteren boter smelten boter bruinen ijs smelten en water vormen een blok hout verbranden een trui laten verkleuren door langdurige blootstelling aan zonlicht ijzer smelten ijs smelten door het gebruik van strooizout koffiezetten
Zijn de modelvoorstellingen voorbeelden van fysische of chemische processen? Leg uit.
Modelvoorstelling
Verder oefenen? Ga naar
LEERDOELEN
Je kunt al:

L toelichten dat tijdens een chemische reactie atomen herschikt worden ter vorming van nieuwe stoffen;
L toelichten dat een index in een formule van een chemische stof het aantal atomen van dat element (of van de atoomgroep) in de verbinding weergeeft.
Je leert nu:
L de opbouw van een reactievergelijking begrijpen en de onderdelen aanduiden;
L een aflopende reactie herkennen;
L een onderscheid maken tussen een index en een coëfficiënt;
L een reactievergelijking in evenwicht brengen door rekening te houden met behoud van atomen.
In de toekomst zul je leren dat sommige reacties niet volledig aflopen. Je zult dan gebruikmaken van een dubbele pijl ⇄ en we spreken van een evenwichtsreactie.
In hoofdstuk 1 heb je geleerd dat de verandering die plaatsvindt tijdens een chemisch proces een chemische reactie wordt genoemd. In de opdrachten heb je telkens een bijhorende reactievergelijking genoteerd. Welke onderdelen kun je herkennen in een reactievergelijking?
In een reactievergelijking worden de gebruikte stoffen, uitgangsstoffen of reagentia (enkelvoud: reagens) omgezet en worden andere stoffen gevormd: de reactieproducten.
In een reactievergelijking wordt gebruikgemaakt van een enkele eenrichtingspijl (→) die de overgang aanduidt van de reagentia naar de reactieproducten. Zo wordt aangeduid dat zeker één reagens volledig omgezet wordt in reactieproducten: we spreken van een aflopende reactie. Dat wordt benadrukt door de pijl die enkel van links naar rechts wijst. gebruikte stof(fen) → gevormde stof(fen) reagentia reactieproducten
Let op:
Je mag als pijl niet ⇒ gebruiken. Gebruik ook niet het gelijkheidsteken (=), want de reactieproducten zijn andere stoffen dan de reagentia.
OPDRACHT 7
Bekijk opnieuw de reactievergelijkingen uit opdracht 6.
1 Omcirkel de reagentia met rood.
2 Omcirkel de reactieproducten met blauw.
2 Mg + O2 → 2 MgO MgO + H2O → Mg(OH)2
Een reactievergelijking wordt als volgt genoteerd: gebruikte stof(fen) → gevormde stof(fen) reagentia reactieproducten
2 Wet van behoud van atomen
OPDRACHT 8 DOORDENKER
Leg uit.
In een reactievergelijking staat soms een getal voor de formule van een reagens of reactieproduct, bv. 2 Al + 3 Cl2 → 2 AlCl3
Waarom? Verklaar.
Het getal dat voor een stof in een reactievergelijking geplaatst wordt, is een coëfficiënt of voorgetal. Door het toevoegen van de juiste coëfficiënten in een reactievergelijking houd je rekening met een belangrijke wet: de wet van behoud van atomen
De wet van behoud van atomen
In een reactievergelijking zijn links en rechts van de reactiepijl evenveel atomen van elke soort aanwezig. Er worden geen nieuwe atomen gecreëerd, er gaan ook geen atomen verloren.
In deze applet leer je op een eenvoudige manier waarom je coëfficiënten plaatst in een reactievergelijking, bv. door het maken van een croque-monsieur.
OPDRACHT 9
Noteer de volledige reactievergelijking van de verbranding van magnesium.
1 Pas de wet van behoud van atomen toe op de verbranding van magnesium. Wanneer we de reagentia en de reactieproducten in een reactievergelijking schrijven, krijgen we:
Mg + O2 → MgO
a In de formule van zuurstofgas staat een 2. Wat is de wetenschappelijke term voor dat getal?
b Hoeveel O-atomen komen er voor:
• bij de reagentia?
• bij de reactieproducten?
c Is de wet van behoud van atomen voor O gerespecteerd?
Ja Nee
2 Opdat een reactievergelijking zou kloppen, worden de getallen voor de formules, de coëfficiënten, aangepast. Het getal 1 wordt niet vermeld.
a Pas de coëfficiënten aan zodat voor en na de pijl evenveel O-atomen voorkomen.
Mg + O2 → MgO
b Is de wet van behoud van atomen voor Mg gerespecteerd?
Ja Nee
c Pas de coëfficiënten aan zodat voor en na de pijl evenveel Mg-atomen voorkomen.
Mg + O2 → MgO
3 Zo krijg je de finale reactievergelijking van de verbranding van magnesium.
4 Scan de QR-code. Op deze website kun je een reactie tussen waterstofgas (H2) en zuurstofgas (O2) uitvoeren. Lukt het je om water (H2O) te vormen?
BEKIJK DE WEBSITE
In een reactievergelijking worden altijd de juiste formules van een chemische stof genoteerd. Je hebt in thema 5 geleerd dat een index aangeeft hoeveel atomen van een bepaald element voorkomen in een verbinding. Een index mag je niet veranderen om het behoud van atomen toe te passen. Een formule wordt immers bepaald door het bekomen van de edelgasconfiguratie.
• Betekenis van de getallen in een chemische reactie 3 CO2
Dit getal noem je de coëfficiënt. Het geeft aan hoeveel deeltjes er gaan reageren.
Dit getal noem je de index. Het geeft aan hoeveel atomen van de voorafgaande atoomsoort per molecule of formuleenheid aanwezig zijn.
• Om de wet van behoud van atomen in orde te brengen, moet je in een chemische reactie de coëfficiënten aanpassen.
• De indices in een formule mag je niet veranderen.
OPDRACHT 10
Stel de reactievergelijking van de chemische reactie op.
Waterstofchloride (HCl) reageert met calciumhydroxide (Ca(OH)2), waarbij calciumchloride (CaCl2) en water (H2O) gevormd worden.
1 Welke stoffen zijn de reagentia?
2 Welke stoffen zijn de reactieproducten?
3 Noteer de stoffen in de reactievergelijking.
4 Vul het aantal atomen van elk element in, zowel bij de reagentia als bij de reactieproducten.
Bij de reagentiaBij de reactieproducten
Bij het plaatsen van coëfficiënten eindig je met het gelijkstellen van de O- en de H-atomen. TIP
5 Je merkt dat het behoud van Ca in orde is. Plaats coëfficiënten zodat het behoud van Cl in orde is.
6 Vul het nieuwe aantal atomen van elk element in, zowel bij de reagentia als bij de reactieproducten.
Bij de reagentiaBij de reactieproducten
OPDRACHT 10 (VERVOLG)
7 Plaats coëfficiënten zodat het behoud van O in orde is.
8 Vul het aantal atomen van elk element in, zowel bij de reagentia als bij de reactieproducten. Bij de reagentiaBij de reactieproducten
9 Wat merk je bij de H-atomen?
10 Noteer de finale reactievergelijking.
OPDRACHT 11
Lees de chemische reacties en beantwoord de vragen. Het stappenplan kan je daarbij helpen.
1 IJzer reageert met zuurstofgas, waarbij di-ijzertrioxide (Fe2O3) gevormd wordt.
a Welke stoffen zijn de reagentia?
b Welke stoffen zijn de reactieproducten?
c Noteer de stoffen in de reactievergelijking.
d Pas de wet van behoud van atomen toe.
BEKIJK HET STAPPENPLAN
2 Magnesium reageert met waterstofchloride (HCl of zoutzuur), waarbij magnesiumchloride (MgCl2) en waterstofgas (H2) gevormd worden.
a Welke stoffen zijn de reagentia?
b Welke stoffen zijn de reactieproducten?
c Noteer de stoffen in de reactievergelijking.
d Pas de wet van behoud van atomen toe.
OPDRACHT 12
Je leerkracht verbrandt methaangas. Hij of zij leidt methaangas onderaan een omgekeerde trechter binnen via een gasslangetje. Vervolgens wordt de gastoevoer gesloten en laat je leerkracht het gas ontvlammen dat bovenaan de trechter ontsnapt.
1 Wat neem je waar?
2 Welke chemische stof wordt verbruikt bij een verbrandingsreactie?
3 Er is een volledige verbranding. Geef de formule van de twee stoffen die gevormd worden (de formule van methaan is CH4).
4 Geef de reactievergelijking van de chemische reactie. Pas het behoud van atomen toe.
Je hebt in de vorige opdrachten enkele reactievergelijkingen opgesteld en de wet van behoud van atomen toegepast. Zo vond je bij opdracht 11:
4 Fe + 3 O2 → 2 Fe2O3
Die coëfficiënten moeten zo laag mogelijk zijn. De reactievergelijking
8 Fe + 6 O2 → 4 Fe2O3 is fout. Alle coëfficiënten kunnen immers gedeeld worden door 2. Het kan dus dat je op het einde alle coëfficiënten nog moet delen door een gelijke factor.
Een chemische reactie wordt voorgesteld door een reactievergelijking: reagentia → reactieproducten
De reagerende stoffen of reagentia worden voor de reactiepijl geschreven, telkens met hun correcte formule en voorafgegaan door een coëfficiënt die het aantal reagerende deeltjes van elke soort weergeeft.
De ontstane nieuwe stoffen of reactieproducten worden na de pijl genoteerd, telkens met hun correcte formule en voorafgegaan door een coëfficiënt die het aantal ontstane deeltjes van elke soort weergeeft.
Een reactievergelijking is in evenwicht wanneer links en rechts van de reactiepijl evenveel atomen van elke soort aanwezig zijn (wet van behoud van atomen). Eventueel moeten de coëfficiënten daarvoor aangepast worden. Die coëfficiënten moeten zo laag mogelijk zijn.
` Maak oefening 1 t/m 7 op p. 223 en 224.
OPDRACHT 13 DOORDENKER
Lees de chemische reacties en beantwoord de vragen.
1 Bijtende soda (NaOH) reageert met waterstofsulfaat (H2SO4 of zwavelzuur), waarbij natriumsulfaat (Na2SO4) en water (H2O) gevormd worden.
a Welke stoffen zijn de reagentia?
b Welke stoffen zijn de reactieproducten?
c Noteer de stoffen in de reactievergelijking.
d Pas de wet van behoud van atomen toe.
2 Magnesiumhydroxide (Mg(OH)2) reageert met waterstoffosfaat (H3PO4 of fosforzuur), waarbij magnesiumfosfaat (Mg3(PO4)2) en water (H2O) gevormd worden.
a Welke stoffen zijn de reagentia?
b Welke stoffen zijn de reactieproducten?
c Noteer de stoffen in de reactievergelijking.
d Pas de wet van behoud van atomen toe.
Een formule bevat vaak een geladen deel met meerdere atomen, een polyatomisch ion, zoals ‘PO43–’ in H3PO4
Als hetzelfde polyatomisch ion verschijnt in een reactieproduct, mag je het als één geheel beschouwen. Wanneer je de reactievergelijking in evenwicht stelt met betrekking tot het aantal atomen per soort voor en na de pijl, start je het best met het plaatsen van coëfficiënten bij het polyatomisch ion.
Bv. Al(OH)3 + 3 HNO3 → Al(NO3)3 + 3 H2O (plaats eerst de 3 bij HNO3) TIP
Schrijf de chemische reactie uit.
De synthese van waterstofchloride (HCl) uit diwaterstof en dichloor.
Schrijf de chemische reactie uit.
De chemische reactie tussen salpeterzuur (HNO3) en soda (NaOH), waarbij natriumnitraat (NaNO3) en water gevormd worden.
Schrijf de chemische reactie uit.
De analyse van glucose (C6H12O6) in water en koolstof (karamel).
Vul de reactievergelijkingen aan.
Al + O2 → Al2O3
Al2O3 + Na → Na2O + Al
H2S + O2 → H2O + SO2
NH3 → N2 + H2
CO2 + H2O → C6H12O6 + O2
Fe + O2 → Fe2O3
PCl5 → P + Cl2
Hg + l2 → Hgl
SnS2 → Sn + S
Pb + O2 → PbO
HCl + O2 → Cl2 + H2O
C2H4 + O2 → CO2 + H2O
Na2O + H2O → NaOH
N2 + H2 → NH3
Al + PbO2 → Al2O3 + Pb
KClO3 → KCl + O2
NH3 + HCl → NH4Cl
NH3 + O2 + → NO + H2O
Fe + S → FeS
Cr2O3 + Zn → ZnO + Cr
C12H22O11 → C + H2 + O2
C12H22O11 + O2 → CO2 + H2O
Vul de reactievergelijkingen aan en beantwoord de vragen.
a Bij een onvolledige verbranding van aardgas (bv. bij een gaskachel in een badkamer) wordt het giftige koolstofmonoxide gevormd.
CH4 + O2 → CO + H2O
b Bakpoeder reageert met azijn.
NaHCO3 + CH3COOH → CH3COONa + CO2 + H2O Hoe kun je visueel waarnemen dat het om een chemische reactie gaat?
c Met glucose kan drankalcohol (ethanol) gevormd worden. De zogenaamde ‘moonshiners’, mensen die illegaal alcohol stoken, maken gebruik van deze reactievergelijking.
C6H12O6 → C2H5OH + CO2
d In grotten worden langzaam druipstenen gevormd. Regenwater dat de grotten binnensijpelt, bevat het oplosbare Ca(HCO3)2. Door de lage concentratie aan CO2 in de grot treedt een reactie op. Naast CO2 en water wordt daarbij ook het onoplosbare CaCO3 gevormd, waaruit de druipstenen zijn opgebouwd.
Ca(HCO3)2 → CaCO3 + CO2 + H2O

Leid uit de volgende reactievergelijkingen de waarden van x, y en z af.
a C x H y + 5 O2 → 3 CO2 + 4 H2O x = y =
b 3 Ag + 4 HNO3 → 3 AgxNyOz+ NO + 2 H2O x = y = z =
c 4 FeS + 7 O2 → 2 Fe x O y + z SO2 x = y = z =
d 2 Fe + 3 Cl2 → 2 Fe x Cl y x = y =
Waarom mag je de indexen bij de formule-eenheden van stoffen niet wijzigen bij het schrijven van een reactievergelijking? ` Verder oefenen? Ga naar .
LEERDOELEN
Je kunt al:
L toelichten dat samengestelde stoffen bestaan uit meerdere atoomsoorten of elementen;
L toelichten dat je een samengestelde stof kunt ontleden in enkelvoudige stoffen;
L Toelichten wat de termen elektrolyse, thermolyse en fotolyse betekenen.
Je leert nu:
L het verschil uitleggen tussen analyse en synthese.
OPDRACHT 14
DEMO

In hoofdstuk 1 van dit thema leerde je dat er tijdens een chemische reactie nieuwe stoffen ontstaan door atomen te (her-) combineren. Daarbij kunnen stoffen onder andere ontleed of gevormd worden.
• Wanneer een stof ontleed wordt in andere stoffen, spreken we van een analyse
• Wanneer uit verschillende stoffen nieuwe stoffen gevormd worden, spreken we van een synthese
In thema 2 heb je al kennisgemaakt met deze twee reactietypes. Zo hebben we in opdracht 26 water ontbonden in waterstofgas en zuurstofgas (analyse). Wanneer het gevormde waterstofgas bij een lucifer (zuurstofgas) gebracht werd, ontstond water (synthese).
Je leerkracht verbrandt een hoeveelheid suiker.
1 Breng een kleine hoeveelheid suiker in een vuurvaste proefbuis.
2 Breng de proefbuis met behulp van een klem of tang in de vlam van een bunsenbrander.
3 Noteer je waarneming.

4 De suiker ondergaat eerst een analyse / synthese (schrap wat niet past) tot koolstof en waterstof en er wordt nadien via analyse / synthese (schrap wat niet past) koolstofdioxide en water gevormd.
Water en suiker werden telkens ontleed door gebruik te maken van een andere energiebron, respectievelijk elektriciteit en warmte.
OPDRACHT 15
Welke soorten analysereacties bestaan er? Vul de tabel verder in.
Energievorm
Soort analyse elektriciteit warmte licht
Fotolyse wordt gebruikt in analoge (niet-digitale) fotografie. Filmrolletjes bevatten zilverchloride (AgCl), een stof die onder invloed van licht ontleedt in zilver (Ag) en chloorgas (Cl2). Hierdoor ontstaan de donkerste vlekken (een negatief beeld, neerslag van Ag) op de plaatsen waar het meeste licht inviel.

De fotolyse die optreedt, ziet eruit als volgt: 2 AgCl → 2 Ag + Cl2.
Tijdens deze reactie komt ook terug zilver vrij. Een chemische reactie kan er dus ook voor zorgen dat een gegeerd edelmetaal terug beschikbaar wordt.
Zoals bij de analyse gebruiken we afhankelijk van de gebruikte energievorm een specifieke term voor de synthese:
licht → fotosynthese warmte → thermosynthese elektriciteit → elektrosynthese
Analyse en synthese zijn tegengestelde chemische reacties. We kunnen het echter niet zwart-wit voorstellen. Uit de definitie van analyse blijkt immers dat er tijdens een analyse ook nieuwe stoffen gevormd worden. De analyse van water kun je dus ook bekijken als de synthese van waterstofen zuurstofgas.
De volgende jaren zul je leren dat er naast synthese en analyse nog andere chemische reacties bestaan. Zo wordt tijdens een substitutiereactie een atoom of atoomgroep vervangen door een ander atoom of atoomgroep.
OPDRACHT 16
Je leerkracht voert de synthesereactie tussen ijzer en zwavel uit.
7 g ijzer en 4 g zwavel worden afgewogen.
VEILIGHEIDSVOORSCHRIFT ! Fe S8
1 Observeer de eigenschappen van de stoffen en breng een magneet bij elk van de stoffen. Noteer je waarnemingen.
Stof
Eigenschappen
Magnetisch ijzer ja nee zwavel ja nee
2 De stoffen worden samen in een kroesje gebracht en verwarmd met de bunsenbrander. Er ontstaat een nieuwe stof, ijzersulfide (FeS). Noteer je waarnemingen.
Stof
Eigenschappen
Magnetisch reactieproduct (FeS) ja nee
3 Noteer je besluit.
4 Bepaal eens de massa van het reactieproduct. Wat stel je vast?
Wanneer een stof ontleed wordt in andere stoffen, spreken we van analyse.
Wanneer uit verschillende stoffen één nieuwe stof gevormd wordt, spreken we van synthese.
• Synthese met behulp van licht is fotosynthese
• Synthese met behulp van warmte is thermosynthese
• Synthese met behulp van elektriciteit is elektrosynthese.
` Maak oefening 1, 2 en 3 op p. 229.
Een verbrandingsreactie is een voorbeeld van een synthesereactie. Afhankelijk van de snelheid van de reactie spreken we over een trage, gewone of snelle verbranding. Het roesten van ijzer is een voorbeeld van een trage verbrandingsreactie. Het ijzer vormt immers roest (Fe2O3) door de reactie met zuurstofgas en water.


Een snelle verbrandingsreactie werd bijvoorbeeld toegepast tijdens de Golfoorlog in Irak (1990-1991): brandende olieputten werden geblust door er springstof in te werpen. De aanwezige zuurstof werd door de explosie zeer snel verbruikt, waardoor de olieputten doofden.

De klimaatverandering is een van de grote zorgen van de huidige maatschappij. Ook chemie kan hier een oplossing bieden, meer bepaald met de synthese van water uit waterstofgas en zuurstofgas. De laatste decennia heeft de industrie zich, onder meer onder impuls van de ruimtevaart, toegelegd op de ontwikkeling van zogenaamde brandstofcellen.
Brandstofcellen zijn elektrochemische toestellen die chemische energie van een voortdurende reactie direct omzetten in elektrische energie. De chemische energie hoeft dus niet eerst omgezet te worden in thermische en mechanische energie (bv. verbruik van fossiele brandstoffen), waardoor er nauwelijks verliezen optreden en de brandstofcel op een heel efficiënte manier energie kan leveren. Ook in de autosector wordt er druk met brandstofcellen geëxperimenteerd; ze moeten de huidige verbrandingsmotoren vervangen omdat ze milieuvriendelijker en zelfs zuiniger zijn.
In principe is een brandstofcel een toestel waarin waterstofgas en zuurstofgas reageren met vorming van water, waarbij de vrijkomende energie rechtstreeks (zonder warmte-effect of explosie) wordt geleverd als elektrische energie. Een bijkomend voordeel van een brandstofcel is dat ze enkel water vormt en dus de natuur niet vervuilt.
De brandstofcel is dus een ecologische oplossing voor het grote verbruik van aardolieproducten, zoals benzine, aardgas … Dat roept natuurlijk tegenwerking op in de petroleumindustrie, die haar sterke positie niet wil afstaan. Ze probeert dan ook de politiek te beïnvloeden (het zogenaamde lobbywerk) om haar economische tak te beschermen.
Bekijk het filmpje als je wilt weten hoe een brandstofcel werkt.
Bekijk de reactievergelijkingen. Is het een synthese of een analyse? Kruis aan.
Analyse
Synthese
2 H2 + O2 → 2 H2O
Fe + S → FeS
Li2CO3 → CO2 + Li2O
6 CO2 + 6 H2O → C6H12O6 + 6 O2
NH4Cl → NH3 + HCl
Vul de reactievergelijkingen aan en beantwoord de vragen.
a Het ijzer in boten, auto’s en fietsen roest.
Fe + O2 → Fe2O3
Is dit een analyse of een synthese? Verklaar.
b Aluminium en zuurstof reageren tot vorming van di-aluminiumtrioxide (Al2O3).
Is dit een analyse of een synthese?
Stel dat ammoniak (NH3) aan elektrolyse wordt onderworpen, welke gassen zouden er dan ontstaan?
Schrijf de bijbehorende reactievergelijking.
Is dit een synthese en/of een analyse?
` Verder oefenen? Ga naar .
LEERDOELEN
Je kunt al:
L de wet van behoud van atomen toelichten.
Je leert nu:

L de wet van behoud van massa bij chemische reacties formuleren en toepassen (wet van Lavoisier).
OPDRACHT 17
ONDERZOEK
Tijdens een chemische reactie verandert de soort en het aantal atomen niet tussen de reagentia en de reactieproducten: de wet van behoud van atomen. Welke wet is nog van toepassing tijdens een chemische reactie?
Voer de reactie uit tussen natriumcarbonaat (Na2CO3) en verdund zoutzuur (HCl).
1 Onderzoeksvraag
Welke wetmatigheid kunnen we bewijzen tijdens de reactie tussen natriumcarbonaat (Na2CO3) en verdund zoutzuur (HCl)?
2 Hypothese
Schrap wat niet past.
Bij een chemische reactie is de massa van de reagentia kleiner dan / gelijk aan / groter dan de massa van de reactieproducten. (Schrap wat niet past.)
3 Benodigdheden
Materialen
balans
erlenmeyer (50 mL)
proefbuizenrek
proefbuizen
maatcilinder (10 mL)
trechter
Stoffen
HCl (verdund)
Na2CO3
VEILIGHEIDSVOORSCHRIFT ! HCl HCl en Na2CO3
4 Werkwijze
Proef 1
1 Plaats een proefbuizenrek met één proefbuis op de balans.
2 Breng de balans op nul door te tarreren.
3 Breng met behulp van de maatcilinder 10 mL HCl in de proefbuis en noteer de massa in de tabel (proef 1). Verwijder het proefbuizenrek.
4 Plaats een erlenmeyer op de balans.
5 Breng de balans op nul door te tarreren.
6 Breng een koffielepel Na2CO3 in de erlenmeyer en noteer de massa in de tabel.
7 Giet de 10 mL HCl in de erlenmeyer (die nog op de balans staat).
8 Noteer de massa in de tabel (proef 1).
Proef 2
1 Plaats een proefbuizenrek met één proefbuis op een balans.
2 Breng de balans op nul door te tarreren.
3 Breng met behulp van de maatcilinder 10 mL HCl in de proefbuis en noteer de massa in de tabel (proef 2). Verwijder het proefbuizenrek.
4 Plaats een erlenmeyer en een ballon op de balans.
5 Breng de balans op nul door te tarreren.
6 Breng met behulp van een trechter een koffielepel Na2CO3 in de ballon en noteer de massa in de tabel (proef 2).
7 Breng de 10 mL HCl in de erlenmeyer (die nog op de balans staat).
8 Span de ballon over de erlenmeyer en giet de inhoud van de ballon in de erlenmeyer.
9 Noteer de massa na de reactie in de tabel (proef 2).
5 Waarnemingen Verwerking
Proef 1: zonder ballon
massa HCl (g)
massa Na2CO3 (g)
massa na reactie (g)
6 Besluit
Proef 1
Proef 2: met ballon
Proef 2
7 Reflectie
a De uitvoering van de proef verliep vlot / niet vlot (schrap wat niet past), omdat:
OPDRACHT 17 (VERVOLG)
ONDERZOEK
b Komt de hypothese overeen met je besluit?
c Waarom werd er een ballon gebruikt bij proef 2?
Wil je weten wat de link is tussen Lavoisier, Einstein en het ontstaan van de aarde?
Bekijk de video!
BEKIJK DE VIDEO
In thema 3 heb je geleerd dat elk atoom een vaste massa heeft. Die kennis gecombineerd met de wet van behoud van atomen, leidt direct naar de wet van Lavoisier of de wet van het behoud van massa.
De wet van Lavoisier
De totale massa voor en na een chemische reactie is gelijk.
mreagentia = mreactieproducten
` Maak oefening 1, 2 en 3 op p. 234.
Dat de wet van behoud van massa bijzonder belangrijk is, kun je illustreren met tal van voorbeelden uit het dagelijks leven. Zo kunnen er in de natuur noch atomen noch atoomsoorten ‘verdwijnen’ door chemische processen. Het ontstaan van industrieel afval is dus een onontkoombaar gevolg van de wet van massabehoud. De chemische industrie houdt zich dan ook steeds bezig met het recycleren van allerlei restmateriaal. Daarnaast wordt er gezocht naar nieuwe processen om zo weinig mogelijk afval te produceren.

Bekijk de video’s over de rol van chemie in de recyclage van stoffen.
Lavoisier is niet de enige wetenschapper die een wet definieerde voor een chemische reactie. Zo toonde Proust aan dat stoffen altijd in een vaste massaverhouding met elkaar reageren: de wet van de massaverhoudingen of de wet van Proust.
Die wet heb je toegepast bij opdracht 16: ijzer en zwavel zullen steeds in een massaverhouding van 7 g : 4 g met elkaar reageren ter vorming van ijzersulfide. Wanneer bijvoorbeeld 10 g ijzer bij 4 g zwavel wordt gebracht, zal er 3 g ijzer niet wegreageren. IJzer is in overmaat aanwezig, terwijl zwavel te weinig aanwezig is. In chemie wordt zwavel dan het ‘limiterend reagens’ genoemd.
Dan is er nog de wet van de veelvuldige massaverhoudingen: de wet van Dalton en Richter stelt dat wanneer twee elementen met elkaar reageren ter vorming van een verschillende zuivere stof, de breuk van de massaverhoudingen van die reacties een vast getal is.
Zo kan koolstof met zuurstofgas koolstofmonoxide (CO) of koolstofdioxide (CO2) vormen. CO-vorming heeft een massaverhouding van 0,75, terwijl dat bij CO2 0,375 is (wet van Proust). Volgens de wet van Dalton en Richter zal dus de onderlinge verhouding van de massaverhoudingen steeds gelijk zijn: 0,75 : 0,375 = 2.



Een reepje magnesiumlint wordt verbrand. Bij die reactie ontstaat een wit poeder: magnesiumioxide. De massa daarvan is groter dan die van het oorspronkelijke magnesium. Wil dat zeggen dat de wet van Lavoisier niet geldig is? Motiveer je antwoord.
Pas de chemische reacties aan indien nodig. Noteer telkens of het om een synthese of analyse gaat.
P2O5 + H2O H3PO4
HClO2 Cl2O3 + H2O
Welke wet pas je toe?
Hoe heten de getallen die je aanbrengt?
Waarom is een proef waarbij een gas ontstaat minder geschikt om de wet van Lavoisier aan te tonen?
Waar moet je op letten? Verklaar. ` Verder oefenen? Ga naar .
Je kunt al:

L toelichten dat chemische energie tijdens een chemische reactie omgezet kan worden naar een andere energievorm;
L toelichten wat de termen synthese, analyse, thermolyse, fotolyse en elektrolyse betekenen.
Je leert nu:
L dat chemische reacties gebruikt kunnen worden als energiebron voor toepassingen in het dagelijks leven;
L het verschil duiden tussen exo- en endo-energetische reacties;
L begrijpen dat de interactie tussen materie en energie kan leiden tot gewenste of ongewenste chemische reacties.
In dit thema werd al verschillende keren verwezen naar de verbranding van magnesium. Het is je zeker opgevallen dat er een fel wit licht verschijnt tijdens de reactie.
Tijdens een chemische reactie kan dus een energievorm (in dit geval licht- of stralingsenergie) vrijkomen, maar waar komt die energie vandaan? Welke energievormen kunnen nog vrijkomen?
Kan ook het omgekeerde gebeuren, met andere woorden kan er tijdens een chemische reactie energie opgenomen worden?
Energie kan niet ontstaan, noch gevormd worden. Dat is de wet van behoud van energie, waar je al van hoorde in de lessen fysica. Die wet is ook van toepassing op een chemische reactie. Wanneer we ons huis verwarmen door een open haard aan te steken, hebben we geen warmte ‘gemaakt’. De energie is vrijgekomen vanuit het hout: hout is een energiebron. De energie die een chemische stof bevat, noemen we de chemische energie (of inwendige energie) (E).
Grootheid Symbool Uitgedrukt in chemische energie E J (joule)
OPDRACHT 18
Vul de tabel aan.
1 Noteer enkele voorbeelden van energievormen.
2 Noteer een proces uit het dagelijks leven waarbij die energie beschikbaar wordt.

Energievorm
Voorbeeld uit het dagelijks leven
Bij glowsticks of handwarmers worden stoffen gebruikt om een energievorm te verkrijgen, respectievelijk licht en warmte.
Tijdens een chemische reactie is er meestal sprake van een verschil in chemische energie in de stoffen voor en na de reactie.
• De reactieproducten bezitten minder chemische energie dan de reagentia. = er is energie vrijgekomen tijdens de chemische reactie.
= exo-energetische reactie
• De reactieproducten bezitten meer chemische energie dan de reagentia. = er is energie opgenomen tijdens de chemische reactie.
= endo-energetische reactie
WEETJE
Sommige reacties zijn energieneutraal, omdat er geen energieverschil is tussen de energie-inhoud van de reagentia en de reactieproducten. Op die reacties zullen we niet verder ingaan.
Chemische stoffen bezitten een specifieke chemische energie-inhoud of inwendige energie (E)
Tijdens een chemische reactie geldt de wet van behoud van energie: energie gaat niet verloren of wordt niet bijgemaakt. Energie kan wel worden omgezet van de ene energievorm in de andere of overgedragen van het ene systeem naar het andere.
Tijdens een chemische reactie wordt dus meestal energie afgegeven (exo-energetische reactie) of opgenomen (endo-energetische reactie).


Soms is iets zo vanzelfsprekend dat je er niet bij stilstaat: chemische reacties kunnen ons energie leveren.
Enkele voorbeelden:
• Tijdens een labo gebruik je een bunsenbrander om een proef uit te voeren (aardgas verbranden).
• Voor vuurwerk wordt gebruikgemaakt van verschillende metalen, zoals aluminium, natrium, magnesium en koper. Die zorgen voor het licht- en knaleffect.
Tijdens die chemische reacties komt er energie vrij: we spreken van een exo-energetische reactie. Uit de wet van behoud van energie kun je dan concluderen dat de reagentia meer chemische energie hebben dan de reactieproducten (ER > EP, de reactie levert energie).
De reactie-energie (∆E) wordt gedefinieerd als het verschil tussen de chemische energie-inhoud van de reactieproducten (EP) en de chemische energie-inhoud van de reagentia (ER):
∆E = EP – ER
Een exo-energetische reactie wordt bijgevolg gekenmerkt door een negatieve reactie-energie: er komt energie vrij tijdens de reactie.
exo-energetische reactie: ∆E < 0
Een exo-energetische chemische reactie kan worden weergegeven in een energiediagram.
(s)
Wanneer warmte vrijkomt, spreekt een chemicus van een exotherme reactie Een bekende toepassing daarvan is de hotpack. Door het activeren van de hotpack start een exotherme reactie: de omgevingstemperatuur stijgt.
Valt het je op dat er altijd geredeneerd wordt vanuit de stoffen? De term ‘exo’ is afgeleid van het Latijn en betekent ‘uit’. Tijdens een exo-energetische reactie zal dus energie uit de stoffen komen. Kijk je naar de omgeving, dan zal de energie toenemen: bv. de omgevingstemperatuur stijgt.
OPDRACHT 19
Je leerkracht voert enkele exo-energetische reacties uit.
1 Hij/zij voert de proeven uit.
2 Noteer je waarneming in de tabel.
VEILIGHEIDSVOORSCHRIFT !
Proef 1 Proef 2
• Voeg bijtende soda-oplossing (NaOH) toe aan de zoutzuuroplossing (HCl).
• Voel tijdens de hele proef aan de proefbuis.
Waarneming:
• Vul een proefbuis voor 1/3 met zoutzuur (HCl).
• Rol het lintje Mg op en breng het in de oplossing.
• Voel tijdens de hele proef aan de proefbuis.
Waarneming:
3 Welke stof zou er gevormd kunnen zijn tijdens de tweede proef (reactie tussen Mg en HCl)?
Magnesium wordt ook gebruikt in een vuurstarter. Door met een mes of de bijgeleverde schraper over het magnesium staafje te schrapen, komen vonken vrij die het vuur kunnen doen starten. Een tip: gebruik berkenbast, die is zeer geschikt als brandstof.


Een voorbeeld van een exo-energetische reactie is de reactie van cement met water. Het samenvoegen van water en cement is immers een chemische reactie. Strikt genomen mag je dus niet zeggen dat je cement met water mengt. Tijdens de reactie ontstaat beton, dat water in zijn kristalstructuur opneemt. Daarbij komt warmte vrij.


De vrijgekomen warmte zorgt ervoor dat grote constructies zoals stuwdammen voor elektriciteitscentrales niet in één keer gegoten kunnen worden. De vrijgekomen warmte door de reactie tussen cement en water kan er namelijk voor zorgen dat er scheurtjes ontstaan.
Soms is een exo-energetische reactie net iets wat je níet wilt meemaken, ze worden namelijk ook weleens gebruikt in een foute context. Denk maar aan de grote hoeveelheid energie die vrijkomt bij de explosie van buskruit. Tijdens die reactie komt er niet alleen warmte vrij, maar ook kinetische energie die grote schade kan aanbrengen.

In een bedrijf ontstaan soms explosies omdat bepaalde stoffen niet (meer) goed gestockeerd worden. Twee bekende voorbeelden zijn de vuurwerkramp in Enschede in 2000 en de ontploffing van ammoniumnitraat in Beiroet in 2020. Wil je de indrukwekkende beelden van de explosie in Beiroet zien? Scan dan de QR-code.
OPDRACHT 20
DOORDENKER
• Een exo-energetische reactie is een chemische reactie waarbij een vorm van energie vrijkomt
• Een reactie waarbij warmte vrijkomt, is een exotherme reactie.
• Een exo-energetische reactie kan voor grote schade zorgen bij verkeerd gebruik.
Wat gebeurt er als je Mentos-muntjes aan cola light toevoegt?
Voer deze proef uit op de speelplaats! Je kunt de proef ook thuis uitvoeren en er een filmpje van maken.
1 Verzamel de benodigdheden.
Mentos-muntjes
blad papier
kaartje
fles cola light
2 Ga aan de slag.
1 Maak met een blad papier een koker waarin de Mentos-muntjes gestapeld worden.
2 Gebruik een kaartje als basis voor de snoepjestoren, of plaats je hand eronder.
3 Schroef de fles cola light open en plaats de koker boven de fles. Trek nu het kaartje (of je hand) weg , zodat de snoepjes in de fles vallen.
3 Noteer je waarneming.
4 Hoe verklaar je dat?
OPDRACHT 21
Analyse en synthese zijn tegengestelde reacties. Kunnen we dat doortrekken naar energie-reacties? We weten nu dat sommige chemische reacties energie leveren: ze zijn exo-energetisch. Wanneer we die reacties omdraaien, zal er energie nodig zijn om de reactie uit te voeren. Tijdens zo’n reacties wordt er dus energie opgenomen: het zijn endo-energetische reacties
Uit de wet van behoud van energie kun je concluderen dat de reagentia minder chemische energie hebben dan de reactieproducten (ER< EP). In de eerste graad heb je al kennisgemaakt met zo’n reactie: de fotosynthese.
Bekijk de chemische reactie en los de vragen op.
6 CO2 + 6 H2O → C6H12O6 + 6 O2
1 Welk biologisch proces wordt hier weergegeven?
2 Welke energievorm wordt er gebruikt tijdens de reactie?
3 Kruis de juiste uitspraak aan.
Fotosynthese is een exo-energetische reactie.
Fotosynthese is een endo-energetische reactie.
Een endo-energetische reactie wordt bijgevolg gekenmerkt door een positieve reactie-energie: er wordt energie toegevoegd tijdens de reactie.
Endo-energetische reactie: ΔE > 0
Een endo-energetische chemische reactie kan worden weergegeven in een energiediagram.
OPDRACHT 22
Je leerkracht voert een endo-energetische reactie uit.
1 Je leerkracht voert de proef uit.
2 Noteer je waarneming in de tabel. Gebruik een thermometer.
Proef
• Meng enkele citroenzuurkristallen met een beetje bakpoeder in een proefbuis.
• Voeg eventueel een beetje water toe.
• Monitor de temperatuursverandering tijdens de hele proef.
Waarneming:
In opdracht 22 daalt de omgevingstemperatuur. De reactie heeft energie nodig om te kunnen plaatsvinden: ze neemt warmte op uit de omgeving. We spreken dan van een endotherme reactie. Een bekende toepassing is het coldpack.
Bij sporters wordt vaak een zakje ijs gebruikt om bij een kwetsuur de zwelling tegen te gaan. Zulke zakjes sluiten echter niet goed af rond de kwetsuur en werken minder efficiënt. Daarom werden coldpacks ontwikkeld.
De meeste bevatten een gel die niet bevriest in een diepvries. Zogenaamde instant coldpacks bestaan intern uit twee zakjes; in het ene zit water, in het andere ammoniumnitraat (NH4NO3).
Wanneer de stoffen bij elkaar komen, treedt er een endotherme reactie op waardoor de omgeving, in dit geval dus het gebied rond de kwetsuur, kouder wordt.
Net als bij een exo-energetische reactie kunnen bij een endo-energetische reactie niet alleen warmte-energie maar ook andere energievormen opgenomen worden. Bij bijvoorbeeld een fotolyse start lichtenergie een reactie op.
Sommige reacties hebben geen zichtbaar licht nodig, maar maken gebruik van uv-straling. Een bekende toepassing heb je misschien al ervaren bij de tandarts. De uv-lamp die op een pas behandelde tand wordt geplaatst, zorgt ervoor dat de vulling uithardt. Dit is een endo-energetische reactie.
Naast licht- en warmte-energie kunnen ook andere energievormen een chemische reactie doen ontstaan. Zo werd er in thema 2 elektrische energie gebruikt om water te splitsen in waterstofgas en zuurstofgas (elektrolyse).

Het spontaan initiëren van een reactie door de opname van energie is niet altijd gewenst.
Lichtenergie kan reacties opstarten die nadelig zijn.
Voorbeelden:
• Stoffen worden vaak bewaard in een bruine fles om te voorkomen dat licht de chemische stof aantast. Wijn wordt bijvoorbeeld bewaard in een gekleurde fles omdat blootstelling aan zonlicht de wijn een azijnsmaak geeft.
• Krantenpapier wordt geel als het te lang in de zon ligt.
• Lange blootstelling aan licht kan ervoor zorgen dat de lange moleculen in kunststoffen worden opgebroken in steeds kleinere moleculen. In de volksmond zegt men dat de kunststoffen ‘verduren’, een fenomeen dat vaak voorkomt bij oude pvc-dakgoten.
Röntgenstraling kan schadelijk zijn en bijvoorbeeld leiden tot het ontstaan van kanker in ons lichaam. Röntgenstraling wordt in de medische wereld gebruikt voor het maken van beeldmateriaal van beenderen of organen. Bij radiologie wordt zo weinig röntgenstraling gebruikt dat de kans op schadelijke bijwerkingen bij de patiënt vrijwel te verwaarlozen is. Omdat een radioloog wel dagelijks in contact komt met straling, neemt hij tijdens de behandeling van een patiënt altijd plaats achter een muur met loden platen.
Ook een te hoge temperatuur kan ongewenste reacties opstarten. Styreen, een belangrijke grondstof voor kunststoffen, breekt af onder invloed van warmte. Thuis bewaar je voedsel in de koelkast, wijn wordt dan weer in een donkere kelder opgeslagen.
• Een endo-energetische reactie is een chemische reactie waarbij een vorm van energie wordt opgenomen.
(J)
(s)
• Een reactie waarbij warmte wordt opgenomen, is een endotherme reactie.
• Een endo-energetische reactie kan voor grote schade zorgen bij verkeerd gebruik.
OPDRACHT 23
1 Lees de artikels.
Is dit een exotherme of een endotherme reactie? Kruis aan.
Artikel 1
Warmtepakken of hot packs stralen gedurende een halfuur tot maximaal een uur warmte uit. Nadien kunnen ze weer gebruiksklaar gemaakt worden door ze ongeveer zes minuten in kokend water te plaatsen.
In elke heat pack zit een muntje en een vloeistof die iets dikker is dan water. Buig je het muntje, dan stolt de vloeistof en wordt er warmte gecreëerd.
Na vijftien seconden is de vloeistof veranderd in een halfharde vulling die ongeveer dertig minuten nodig heeft om helemaal hard te worden. Tijdens dit proces blijft de plak warmte uitstralen.
exotherm endotherm
Artikel 2
Het zwembad ’t Beerke sluit in juli 2011 de deuren voor ingrijpende verbouwingen. In september 2012 gaat het vernieuwde zwembad opnieuw open.
Het zwembad moet in orde worden gemaakt met de milieuwetgeving. “In het project is ook een waterzuivering door zoutelektrolyse en UVbehandeling opgenomen”, zegt sportfunctionaris Ronald Van Gils.
Naar: Gazet van Antwerpen
exotherm endotherm
De heat packs bereiken ongeveer 55 °C en zijn geschikt om bv. spierpijn te verhelpen. De inhoud van de plakken is niet giftig of gevaarlijk. Hij bestaat uit water en natriumacetaat, een stof die ook in voedsel gebruikt wordt.

Uit keukenzout in tabletvorm wordt via elektrolyse het ontsmettingsmiddel natriumhypochloriet gevormd. De productie gebeurt in een volledig gesloten circuit. De zoutelektrolyse biedt het voordeel dat er geen transporten van gevaarlijke stoffen meer vereist zijn.
2 Bekijk de ontdekplaat bij het onlinelesmateriaal en ontdek verschillende reacties in het dagelijkse leven.
OPDRACHT 24
ONDERZOEK
Voer het labo rond exotherme en endotherme reacties uit.
Je vindt het bij het onlinelesmateriaal.
Chemische stoffen bezitten een specifieke chemische energie-inhoud of inwendige energie
Tijdens een chemische reactie geldt het behoud van energie: energie gaat niet verloren, maar kan enkel omgezet worden in een andere vorm.
Een exo-energetische reactie is een chemische reactie waarbij een vorm van energie wordt vrijgegeven
Een endo-energetische reactie is een chemische reactie waarbij een vorm van energie wordt opgenomen
Chemische reacties waarbij warmte betrokken is, worden exotherme en endotherme reacties genoemd.
Chemische reacties kunnen nuttig zijn als energiebron in het dagelijks leven (bv. warmte, elektriciteit), maar kunnen ook nadelig zijn (bv. verduren van materialen).
` Maak oefening 1 t/m 6 op p. 246 en 247.
Vul bij elk verschijnsel het bijbehorende begrip in. Opgelet: een van de gegeven begrippen is niet van toepassing. Je mag elk begrip slechts één keer gebruiken.
analyse – endo-energetisch – endotherm – exo-energetisch – exotherm – fysische reactie – synthese
a een vijver die bevriest
b Mg + 2 HCl MgCl2 + H2 + warmte
c grote moleculen kleine moleculen
d thermolyse
e een Mg-lint verbranden (het vrijkomen van licht)
f kleine moleculen grote moleculen
Vul de reactievergelijkingen aan en beantwoord de vragen. Waterstofgas wordt gebruikt in brandstofcellen.
H2 + O2 → H2O
a Is dit een endo-energetische of een exo-energetische reactie? Verklaar.

b Is dit een analyse of een synthese? Verklaar.
Vervolledig de reactievergelijkingen en beantwoord de vragen.
a Planten voeren een fotosynthesereactie uit. + → C6H12O6 + O2
Is dit een endo-energetisch of een exo-energetisch proces? Verklaar.
Welke energie-omzettingen vinden hierbij plaats?
b Methaangas (CH4) wordt gebruikt om woningen te verwarmen.
CH4 + O2 → CO2 + H2O
Is dit een endo-energetisch of een exo-energetisch proces? Verklaar.
Welke energie-omzettingen vinden hierbij plaats?
Beoordeel de stellingen. Duid aan met juist (J) of fout (F). Is de stelling fout?
Juist of fout? Stelling
Tijdens een chemische reactie worden nieuwe stoffen gevormd.
Verbetering:
Tijdens een exo-energetische reactie hebben de stoffen na de reactie de grootste energie-inhoud.
Verbetering:
Als je een endotherme reactie uitvoert in een waterbad dan zal de temperatuur van het water rond de reactiebeker stijgen.
Verbetering:
De stoffen verliezen energie tijdens een exotherme reactie.
Verbetering:
Wat hoort er bij elkaar? Noteer het juiste getal in de tweede tabel.
1fotosynthese
2smelten
3 De reactieproducten bevatten meer energie dan de reagentia.
4De stoffen verliezen energie.
5glimwormen
chemische energie naar lichtenergie
exo-energetische reactie
endo-energetische reactie lichtenergie naar chemische energie fysische reactie
Teken een energietijddiagram van een exo-energetische reactie. Vermeld de volgende gegevens: energieniveau van de reactieproducten (EP); energieniveau van de reagentia (ER); ΔE < 0 of ΔE > 0 (teken een pijl). Benoem de assen.
` Verder oefenen? Ga naar .
WAT IS EEN CHEMISCHE REACTIE?
Tijdens een chemische reactie worden de aanwezige atomen herschikt ter vorming van nieuwe stoffen.
Voor de reactie
Bij samenvoegen
Na de reactie
HOE WORDT EEN CHEMISCHE REACTIE GENOTEERD?
De reactievergelijking
reagentia → reactieproducten
WELKE TYPES CHEMISCHE REACTIES BESTAAN ER?
1 Analyse
Een chemische reactie waarin een samengestelde stof wordt ontleed.
Dat kan met behulp van:
• warmte (thermolyse),
• licht (fotolyse),
• elektriciteit (elektrolyse).
Behoud van atomen
• Per atoomsoort is het aantal atomen voor en na de reactie gelijk.
• Voor stoffen worden coëfficiënten geplaatst om het aantal atomen per soort gelijk te stellen.
2 Synthese
Een chemische reactie waarbij een samengestelde stof gevormd wordt.
Dat kan met behulp van:
• warmte (thermosynthese),
• licht (fotosynthese),
• elektriciteit (elektrosynthese).
WAT GEBEURT ER MET DE MASSA’S VOOR EN NA EEN CHEMISCHE REACTIE?
De wet van Lavoisier (behoud van massa)
De totale massa voor en na een chemische reactie blijft gelijk.
mreagentia = mreactieproducten
ZIJN CHEMISCHE REACTIES NUTTIG ALS ENERGIEBRON?
• Stoffen bevatten een specifieke hoeveelheid energie: de chemische of inwendige energie (E).
• Chemische reacties kunnen nuttig zijn als energiebron in het dagelijks leven (bv. warmte, elektriciteit), maar kunnen ook nadelig zijn (bv. verduren van materialen).
• Er bestaan exo- en endo-energetische reacties.
Exo-energetische reactie
Een chemische reactie waarbij energie vrijkomt tijdens de reactie.
De reagentia hebben meer chemische energie dan de reactieproducten.
Endo-energetische reactie
Een chemische reactie waarbij energie opgenomen wordt tijdens de reactie.
De reagentia hebben minder chemische energie dan de reactieproducten.
> E p
Voorbeeld: verbranden van magnesium
Voorbeeld: elektrolyse van water
Mijn samenvatting
`
1 Begripskennis
• Ik ken het verschil tussen een chemisch en een fysisch proces.
• Ik ken het verschil tussen een coëfficiënt en een index.
• Ik ken het verschil tussen een analyse en een synthese.
• Ik ken de begrippen elektrolyse, thermolyse en fotolyse.
• Ik ken het begrip chemische energie.
• Ik ken het verschil tussen exo- en endo-energetische reacties.
• Ik ken de termen endotherm en exotherm.
2 Onderzoeksvaardigheden
• Ik kan een reactievergelijking opstellen.
• Ik kan reagentia en reactieproducten toelichten.
• Ik kan de wet van behoud van atomen uitleggen en toepassen
• Ik kan een synthese/analyse herkennen en er voorbeelden van geven.
• Ik kan de wet van behoud van massa uitleggen en toepassen
• Ik kan een exo- en endo-energetische reactie grafisch weergeven
• Ik kan een exo- endo-energetische reactie herkennen en er voorbeelden van geven
Je kunt deze checklist ook op invullen bij je Portfolio.
JANOG OEFENEN
CO2-vorming zorgt voor het rijzen van brood, maar er gebeurt zoveel meer. Bekijk de video en beantwoord de vragen.
1 Vul de tabel aan.
Temperatuur
33 °C
62 °C
100 °C
154 °C
Wat gebeurt er?
2 Wat is de formule en de naam van het rijsmiddel in bakpoeder?
3 Tijdens de Maillard-reacties ontstaan nieuwe biomoleculen.
a Kruis aan.
Dit is een analysereactie.
Dit is een synthesereactie.
b Waarvoor zorgen die nieuwe chemische stoffen?
c Kruis aan.
Dit is een exo-energetische reactie.
Dit is een endo-energetische reactie.
d Wat is de naam van de laatste reactie?
• Dit is een analyse / synthese (schrap wat niet past).
Proces
fysisch proces
chemisch proces
fysisch proces
chemisch proces
fysisch proces
chemisch proces
fysisch proces
chemisch proces

• Dit is een endo-energetische / exo-energetische reactie (schrap wat niet past).
e Op welke temperatuur moet je de oven instellen om dit proces te laten plaatsvinden?
Bij het bakken van koekjes ontstaan tijdens de chemische reacties nieuwe stoffen zoals CO2, die zorgen voor het rijzen van het deeg.
Tijdens een chemische reactie geldt de wet van behoud van massa. Omdat er gassen gevormd worden tijdens het bakken van koekjes, zal er massa verloren gaan. De koekjes wegen minder.
Tijdens het bakken zullen eiwitten veranderen van structuur of omgezet worden. Die nieuwe stoffen zorgen voor de specifieke smaken. Wanneer de koekjes te lang gebakken worden, zullen de eiwitten stukgaan en de koekjes verbranden.
En nu maar echt koekjes bakken!