
УДК 375.5+53](075.3)
В27
В27
Величко Л. П. Хімія : рівень стандарту : підруч. для 10 кл. закл. загал. серед. освіти / Л. П. Величко. — Київ : Пед.
10 класу. В основу викладення змісту знань та
узагальнення покладено сучасну модель особистісно орієнтованого навчання, якою передбачено самонавчання і самоконтроль, вироблення особистісного ставлення до об’єктів і явищ, розвиток емоційно-ціннісної сфери учнів. Апарат організації засвоєння змісту підручника (запитання, вправи, задачі, прописи лабораторних і практичних робіт, шрифтові виділення, рубрикація, узагальнювальні таблиці, анонси на початку розділу чи параграфа й резюме – наприкінці) та апарат орієнтування (звертання до учнів, поради щодо самостійної роботи, відповіді до завдань, додаток, іменний і предметний покажчики) спрямовано на навчання учнів у діяльності, що дає змогу сформувати і виявити їхні ключові й предметні компетентності.
УДК 375.5+53](075.3)
© Л. П. Величко, 2018 © Видавництво «Педагогічна думка», 2018
ISBN 978-966-644-468-7
§ 1. Повторення початкових
§ 4. Виведення молекулярної формули речовини ...................................15
§ 5. Карбон-карбонові зв’язки в молекулах
Класифікація органічних сполук
ВУГЛЕВОДНІ ...................................................................................21
§ 6. Алкани ......................................................................................21
§ 7. Алкени ......................................................................................30
§ 8. Алкіни .......................................................................................34
§ 9. Арени. Бензен .............................................................................39
§ 10. Взаємозв’язок і
...........................43
ОКСИГЕНОВМІСНІ СПОЛУКИ ...........................................................45
СПИРТИ І ФЕНОЛ ...........................................................................
§ 11. Насичені одноатомні спирти
§ 12. Гліцерол ...................................................................................55
§ 13. Фенол ......................................................................................58
АЛЬДЕГІДИ І КАРБОНОВІ
4
Лабораторний дослід 2. Окиснення глюкози купрум(ІІ) гідроксидом .......78
§ 18. Сахароза ...................................................................................79
§ 19. Крохмаль .................................................................................81
§ 20. Целюлоза (клітковина) ...............................................................82
Практична робота. Розв’язування експериментальних задач ................85
НІТРОГЕНОВМІСНІ СПОЛУКИ ..........................................................86
§ 21. Аміни. Анілін ...........................................................................86
§ 22. Амінокислоти ...........................................................................93
§ 23. Білки .......................................................................................96
Лабораторний дослід 3. Біуретова реакція ............................................99
Лабораторний дослід 4. Ксантопротеїнова реакція ................................99
СИНТЕТИЧНІ ВИСОКОМОЛЕКУЛЯРНІ СПОЛУКИ ...........................102
§ 24. Загальна характеристика полімерів. Пластичні маси ....................103
§ 25. Синтетичні каучуки .................................................................110
§ 26. Синтетичні волокна .................................................................112
БАГАТОМАНІТНІСТЬ ТА ЗВ’ЯЗКИ МІЖ КЛАСАМИ ОРГАНІЧНИХ РЕЧОВИН ................................................................115
§ 27. Розмаїття органічних речовин, взаємозв’язок між ними ...............115
§ 28. Біологічно активні речовини .....................................................118
§ 29. Роль органічної хімії у розв’язуванні глобальних проблем людства .....................................................................120
Відповіді до додаткових завдань ........................................................127
Додатки ....................................................128
Додаток 1. Зв’язки між органічними речовинами ...........................128
Додаток 2. Число ізомерів алканів................................................129
Додаток 3. Відносні молекулярні маси (округлені) деяких органічних речовин ....................................................130
Додаток 4. Розчинність основ, кислот, амфотерних гідроксидів і солей у воді ..............................................................131
Іменний покажчик ..........................................................................132
Предметний покажчик ....................................................................133

До учнів
У 9 класі ви вже ознайомилися з деякими найважливішими органічними сполуками й реакціями, знаєте, як багато цих речовин існує в природі й ще більше — синтезовано в лабораторіях. Ці знання знадобляться вам для того, щоб глибше пізнати будову, властивості, застосування, значення для організму людини різноманітних сполук Карбону з Гідрогеном, Оксигеном, Нітрогеном, які називають елементамиорганогенами. Особливістю органічної хімії є її струнка побудова — від найпростіших речовин, як метан, до найскладніших, як білки, тому зміст кожного наступного параграфа підручника ґрунтується на змісті попередніх. Якщо ви зрозумієте логіку цієї науки, вам буде легко і просто опанувати найскладніший матеріал. А підручник сприятиме цьому, нагадуючи, де треба, вже вивчене вами, ставлячи запитання, спонукаючи до міркування з приводу різних важливих і цікавих фактів або й за допомогою ілюстрацій. Допоможуть вам у цьому завдання з позначкою , вміщені всередині параграфів. Перелік того, про що ви можете дізнатися з певних тем, наведено на їх початку, а висновки й узагальнення найважливішого матеріалу вміщено після тем. Це зорієнтує вас на основні питання, терміни, що їх треба засвоїти. Свої знання ви зможете перевірити, виконуючи завдання для самоконтролю, вміщені наприкінці параграфів, а для виконання додаткових завдань вам, можливо, доведеться скористатися довідниковою літературою. У тексті параграфів описано хімічні досліди, що проводяться під час засвоєння нових знань. Виконуючи лабораторні досліди і практичні роботи, ви набудете навичок експериментування, без чого ґрунтовне вивчення хімії неможливе.
Сподіваюся, що вивчення органічної хімії буде цікавим і корисним для вас.
Успіхів вам! Авторка

§
1. ПОВТОРЕННЯ ПОЧАТКОВИХ ПОНЯТЬ
ПРО ОРГАНІЧНІ СПОЛУКИ
Пригадайте вивчене і виконайте завдання.
Органічна хімія вивчає сполуки Карбону.
1. Які інші елементи можуть входити до складу органічних речовин?
Наведіть приклади (формули, назви) органічних речовин. Атоми Карбону можуть сполучатися між собою в ланцюги й утворювати молекули різноманітних форм.
2. Наведіть приклади.
3. Чому, на вашу думку, кількість органічних речовин значно переважає кількість неорганічних речовин? Характерні ознаки органічних речовин: ковалентні зв’язки, молекулярні кристалічні ґратки, низька термостійкість, горючість, погана розчинність у воді.
4. Чим різняться між собою органічні та неорганічні речовини?
5. Складіть порівняльну таблицю неорганічних та органічних речовин за відомими вам ознаками. Органічні сполуки становлять основу рослинних і тваринних організмів, з них виробляють харчові продукти, папір, тканини, барвники, лікарські та косметичні засоби, пластмаси, паливо тощо.
6. Позначте перелік, у якому подано лише органічні речовини.
А капрон, метан, сірка, вода
Б каучук, капрон, поліетилен, глюкоза
В вовна, целюлоза, гас, амоніак
Г ацетилен (етин), нафтален, вольфрам, етанова (оцтова) кислота
7. Укажіть предмети, що виготовлені з матеріалів органічного походження.
А книжка Ґ підошва кросівок
Б грифель олівця Д джинси
В кулька кулькової ручки Е водопровідний кран Г хімічний стакан
8. Назвіть інші предмети, що їх, на вашу думку, виготовлено з органічних речовин. 9.
11. Наведіть приклади взаємних перетворень органічних речовин, які ви вивчали.
Поділ на органічні та неорганічні речовини є умовним.
12. Поясніть відносність поділу речовин на органічні та неорганічні, а також умовність
терміна «органічна хімія».
13. Наведіть приклади кругообігу хімічних елементів у природі. Який висновок можна
зробити щодо взаємозв’язку неорганічних та органічних речовин?
14. Наведіть власний приклад взаємозв’язку цих двох груп речовин.
Метан — найпростіша органічна сполука.
15. Складіть молекулярну й структурну формули метану і його хлоропохідних.
16. Що означає риска у структурній формулі?

17. Складіть розповідь про застосування метану і його хлоропохідних.
18. Що таке гомологи? Наведіть приклади (формули, назви) гомологів метану.
результаті повного
сполук утворюються вуглекислий газ і вода.
19. Складіть рівняння реакції горіння метану й етину. Де використовують ці реакції?
Метан як насичений вуглеводень вступає в реакцію заміщення з хлором.
20. Складіть рівняння послідовного заміщення атомів Гідрогену в метані на атоми Хлору.
Етен і етин як ненасичені вуглеводні вступають у реакції приєднання з воднем і бромом.
21. Складіть рівняння реакцій приєднання водню і брому до етину й етену.
Молекули спиртів можуть містити одну, дві, три і більше гідроксильних груп.
22. Наведіть приклади (формули і назви) відомих вам спиртів. Етанова (оцтова) кислота за деякими хімічними властивостями подібна до неорганічних кислот.
23. Складіть рівняння реакцій, що підтверджують це. Крохмаль, целюлоза, бiлки — природнi полiмери.
24. Схарактеризуйте бiологiчне значення цих сполук. Поліетилен — синтетичний полімер.
25. Розкажіть про використання поліетилену.


як утворюються
ізомерів; вивести формулу
знаєте, що органічна хімія вивчає сполуки Карбону, вам відомо багато органічних
сполук: вуглеводні, спирти, карбонові кислоти, жири, вуглеводи, білки та ін. Як самостійна галузь хімічної науки органічна хімія виникла на початку XIX ст. У 1808 р. шведський учений Я. Берцеліус запропонував цю назву, що походить від слова «організм». Органічними, на відміну від неорганічних (мінеральних), називали речовини, що їх добуто з рослинних і тваринних організмів. На той час уже було з’ясовано, що всі ці речовини містять Карбон. Проте жоден учений не міг припустити можливість утворення органічної речовини in vitro (лат. у пробірці). Вважалося, що органічні речовини можна добувати з продуктів рослинного й тваринного походження, вивчати їх у готовому вигляді, але добути в лабораторії з інших речовин, тобто хімічним способом, неможливо.


р.
обміну в організмі (мал. 1, 2). У листі
потребуючи для цього ні нирок, ні живої істоти взагалі, чи то людини, чи собаки. Це повідомлення стало науковою сенсацією. Наведену реакцію вважають в історії хімії першим синтезом органічної речовини, хоча слово «синтез» стосовно органічних сполук уперше вжив у 1845 р. німецький хімік А. Кольбе, який того року синтезував оцтову (етанову) кислоту. У 1854 р. французький учений П. Е. М. Бертло вперше синтезував жироподібну речовину, а в 1861 р. російський учений О. М. Бутлеров — цукристу речовину. Серед авторів перших синтезів органічних

10
український учений, академік Іван Якович Горбачевський. У 1882 р. він синтезував сечову (уреатну) кислоту. Ця сполука є кінцевим продуктом обміну білків у деяких плазунів і птахів.
Першими синтезами органічних сполук було доведено принципову можливість їх добування в лабораторіях, а далі — і в промислових умовах. Це був початок широкого поступу органічної хімії, що триває й донині.
Українські вчені зробили вагомий внесок у розвиток органічної хімії. Усьому науковому світові відомі імена С. М. Реформатського (1860— 1934), І. Я. Горбачевського (1854—1942), М. І. Коновалова (1858—1906), А. І. Кіпріанова (1896—1972), Є. О. Шилова (1893—1970), О. В. Кірсанова (1902—1992) та інших учених. ТЕОРІЯ ХІМІЧНОЇ БУДОВИ ОРГАНІЧНИХ СПОЛУК О. М. БУТЛЕРОВА. У середині XIX ст. в органічній хімії виникли суперечності між накопиченими фактами й теоретичними уявленнями, на ґрунті яких можна було б пояснити ці факти. У 1835 р. Ф. Велер писав: «Органічна хімія може нині кого завгодно позбавити здорового глузду. Вона здається мені дрімучим лісом, повним дивних речей, безмежною хащею, з якої неможливо вибратися, куди не насмілишся проникнути». Схарактеризуйте ситуацію, що склалася в неорганічній хімії напередодні відкриття Періодичного закону, і порівняйте її з описаною ситуацією в органічній хімії.
Важливим кроком у розвитку теоретичних уявлень у хімії було створення вчення про валентність (Е. Франкленд, 1852 р.) і визначення валентності низки елементів. Було висловлено думку про чотиривалентність атомів Карбону та їх здатність сполучатися між собою з утворенням ланцюгів (Ф. А. Кекуле, А. С. Купер, 1857—1858 pp.). Цікаво, що в хімічній науці на той час ще не було чітко визначено поняття атома і молекули. Лише після Міжнародного з’їзду хіміків у 1860 р. ці поняття остаточно увійшли в науку. Все це створило передумови для появи нової теорії


11
Проте, як засвідчує історія науки, для створення теорії недостатньо одних лише передумов. Потрібні нові ідеї, спираючись на які, можна будувати цілісну теорію. Які ж наукові ідеї було покладено О. М. Бутлеровим в основу нової теорії? Учений висловив думку про те, що кожній речовині притаманна своя хімічна будова. За Бутлеровим, хімічна будова — це «спосіб взаємного сполучення атомів у складному тілі», або, сучасною мовою, послідовність (порядок) сполучення атомів у молекулі.
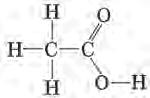
Наявність хімічної будови означає, що атоми в молекулі розміщуються не безладно, а в певному порядку згідно з їхньою валентністю. Хімічну будову речовини можна зобразити за допомогою структурної формули, або формули будови. Пригадаймо структурні формули органічних речовин, які ви вивчали в курсі хімії 9 класу. Наприклад, пропан складу С3Н8 має структурну формулу H H H | | | H—C—C—C—H , або скорочено CH3—CH2—CH3; | | | H H H
етанова (оцтова) кислота складу C2H4O2 має структурну формулу , або скорочено CH3—COOH
Хімічну будову можна встановити на основі хімічних перетворень речовини. Визначення того, які атоми, яка їх кількість і в якій послідовності вони сполучені між собою, інакше кажучи, визначення хімічного складу і хімічної будови — це перші кроки в дослідженні будь-якої речовини. Теорія хімічної будови стверджує також наявність взаємного впливу атомів у молекулі. Розглянемо це явище на прикладі відомих вам неорганічних речовин води Н2O і гідроген хлориду HCl та органічної речовини метану СН4. Вони містять елемент Гідроген, однак він виявляє різні властивості: у гідроген хлориді легко заміщується на металічний елемент, у воді заміщується лише на активний металічний елемент, у метані не заміщується на металічний елемент. Гідроген по-різному поводиться в хімічних реакціях, оскільки на нього по-різному впливають атоми, що сполучені з ним. Отже, властивості речовин не зводяться до суми властивостей окремих
12
Це положення встановлює закономірний зв’язок між складом, хімічною будовою і властивостями речовини та є одним із найважливіших серед теоретичних положень хімічної науки.
Теорія будови виникла на основі дослідження органічних речовин. Поняття хімічної будови О. М. Бутлеров пов’язував насамперед з молекулами органічних речовин. Проте ця теорія є загальнохімічною і поширюється також на речовини немолекулярної будови. Відома вам залежність між типом хімічного зв’язку, кристалічною будовою неорганічних речовин та їх властивостями — це також вияв цього закону. ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ

1. Хто і коли вперше синтезував органічну речовину?
2. Поясніть значення перших синтезів
органічної хімії.
3. Схарактеризуйте стан, що склався
4. Що таке хімічна будова органічних речовин?
5. Хімічну будову речовини можна схарактеризувати А молекулярною формулою
структурною формулою
6. Яка формула дає більше інформації
7. Поясніть, як ви розумієте
ІЗОМЕРІЯ. Звернемося до структурних формул органiчних сполук, якi вiдображають їхню хiмiчну будову. Запишемо структурну формулу бутану, що має склад С4Н10, пам’ятаючи про чотиривалентність Карбону. Можливі два варіанти сполучення атомів:
Виявляється, ці формули належать різним речовинам з різними властивостями, що засвідчують наведені
13
Для пентану складу С5Н12 можливі три варіанти будови, тобто такому складу відповідають три різні речовини.
Складіть структурні формули трьох ізомерів пентану, пам’ятаючи про чотиривалентність Карбону.
Сполуки, що мають однаковий склад молекул (однакові молекулярні формули), але різну будову, а тому й різні властивості, називають ізомерами (від грец. ізос — однаковий і мерос — частина).
Ми розглянули приклади т. зв. структурної ізомерії, зумовленої будовою карбонового скелета молекули. Існують також інші види ізомерії. Явище ізомерії спостерігається і серед неорганічних сполук. Наприклад, натрій ціанат і натрій фульмінат мають однаковий хімічний склад NaOCN. Проте перша сполука плавиться за температури 560 оС, а друга — вибухає від нагрівання. Причина відмінностей полягає в тому, що ці речовини є ізомерами, атоми в них сполучені в різному
ціанат
стала пробним
фульмінат
теорії хімічної
та її тріумфом. О. М. Бутлеров передбачив на основі теорії, що для сполуки складу С4Н10 можливі два ізомери, і синтезував невідомий
той час ізобутан, що, як і очікувалося, відрізнявся за властивостями від бутану.
Пригадайте, які наукові відкриття сприяли утвердженню Періодичного закону. ЗНАЧЕННЯ ТЕОРІЇ ХІМІЧНОЇ БУДОВИ. На основі теорії хімічної будови органічних речовин було узагальнено накопичений наукою фактичний матеріал органічної хімії, пояснено причину ізомерії, передбачено й добуто невідомі раніше сполуки.
Теорія хімічної будови стала інструментом вивчення органічних речовин. На основі закону Бутлерова, тобто з урахуванням складу, хімічної будови, взаємного впливу атомів у молекулі, виявилося можливим передбачати хімічну поведінку речовини. І навпаки — за хімічними властивостями зробити висновок про будову речовини. Це було справді революційним для тогочасної науки.
Отже, теорія хімічної будови поглибила уявлення про природу органічних речовин і сприяла розвитку органічної хімії.
Закономірність взаємозв’язку будови речовин та їх властивостей поширюється не лише на фізичні та хімічні властивості, а й на біологічні функції цих речовин. Цю закономірність покладено в основу створення речовин з необхідним комплексом технічних, біологічних та інших характеристик, наприклад барвників, полімерів, лікарських засобів тощо. РОЗВИТОК ТЕОРІЇ ХІМІЧНОЇ БУДОВИ.
14
човин. Пояснити явище — означає встановити його причину. Часом це можна зробити, користуючись наявними теоретичними знаннями, але іноді цих знань виявляється недостатньо, постає потреба їх розвитку, доповнення, а то й заміни новими. Виявлення нових випадків ізомерії спонукало вчених висунути гіпотезу просторової будови молекул органічних сполук. Подальші дослідження підтвердили справедливість цієї гіпотези: з’ясувалося, що молекули неплоскі, що атоми певним чином
орієнтовані в тривимірному просторі й що властивості речовин залежать від цієї орієнтації. Так виникли вчення про просторову будову молекул і нова галузь хімічної науки — стереохімія (від грец. стереос — просторовий).
На початку XX ст. на ґрунті найновіших на той час досягнень фізики було розкрито електронну природу хімічних зв’язків. Хімічна будова, структурні формули речовин наповнилися електронним змістом, було з’ясовано електронну сутність взаємного впливу атомів у молекулах. Розвиток науки розширив поняття «будова органічних речовин». Якщо раніше розглядали лише хімічну будову, то нині будову речовин розглядають у єдності хімічної, просторової та електронної будови. У зв’язку з цим основне положення теорії будови органічних сполук було уточнено: фізичні й хімічні властивості органічних речовин визначаються складом, хімічною, просторовою та електронною будовою їхніх молекул. Класична теорія хімічної будови — лише етап у розвитку теоретичних поглядів. Вона увійшла до складу сучасної теорії будови органічних сполук. Щоб схарактеризувати речовину згідно із цією теорією, треба вказати якісний і кількісний склад, порядок сполучення атомів у молекулі, просторову форму і розміри молекул, взаємодію електронів у молекулі. ЗАВДАННЯ

1. Дайте означення ізомерів.
2. У чому полягає причина ізомерії?
3. У яких напрямах розвивалася теорія хімічної будови?
4. Які аспекти будови вивчає сучасна теорія будови органічних сполук?
5. Сформулюйте основне положення теорії будови органічних сполук у сучасному трактуванні.
6. Схарактеризуйте значення теорії хімічної будови
1. Чи можна стверджувати, що
2.
3.
4.
5.
6.
15


Висновки

Термін «органічна хімія» запропонував шведський учений Я. Берцеліус.
На початку XIX ст. в органічній хімії панувала віталістична теорія.
Сечовина — перша синтезована органічна сполука.
Перші синтези органічних речовин сприяли розвитку синтетичної органічної хімії.
О. М. Бутлеров запровадив
РЕЧОВИНИ У 7 класі ви навчилися обчислювати масові частки елементів у речовині за її молекулярною формулою. Співвідношення між відносною атомною масою елемента та відносною молекулярною масою сполуки виражається формулою:
Аr(елемента)n W(елемента) = , (1) Мr(речовини)
де п — кількість атомів елемента.
Може ставитися й обернена задача: обчислити кількість атомів кожного елемента в молекулі, тобто вивести молекулярну формулу речовини за відомим умістом елементів. Тоді W (елемента) Мr(речовини) n = . (2) Аr(елемента) Відносну молекулярну масу
16
Звідси можна обчислити шукану відносну молекулярну масу газу: Мr(речовини) = 2DH2 = 32DO2 = 29Dпов. (4)
Задача 1. Визначте молекулярну формулу газуватого вуглеводню, який містить 80 % Карбону. Відносна густина вуглеводню за воднем становить 15. I спосіб. Насамперед визначимо відносну молекулярну масу вуглеводню за формулою (4): Мr = 2 · 15 = 30.
За формулою (2) визначимо кількість атомів Карбону й Гідрогену. Оскільки сполука — вуглеводень, то частка Гідрогену становить: 100 % – 80 % = 20 %.
0,8 · 30
0,2 · 30 n(С) = =2; п(H) = = 6. 12 1
Отже, в молекулі вуглеводню на два атоми Карбону припадає шість
атомів Гідрогену. Формула вуглеводню — С2Н6, відносна молекулярна маса — 30.
Відповідь: формула вуглеводню — С2Н6. II спосіб. Припустимо, що в молекулі вуглеводню міститься x атомів Карбону та y атомів Гідрогену. Маса х атомів Карбону становить 12x, а y атомів Гідрогену — 1y. Маси Карбону й Гідрогену відносяться між собою, як 80 : 20.
80 20
12 х : у = 80 : 20; х : у = : ; х : у = 6,6 : 20.
12 1
Переходячи до цілих чисел, ділимо обидва члени відношення на найменший із них: x : у= 1 : 3.
Отже, в молекулі вуглеводню на один атом Карбону припадає три атоми Гідрогену; так звана найпростіша формула сполуки — СН3. Щоб визначити справжню молекулярну формулу, треба визначити відносну молекулярну масу сполуки за формулою (4): Мr = 2 · 15 = 30.
Оскільки Мr(СН3) = 15, то найпростішу формулу треба подвоїти: шукана формула вуглеводню — С2Н6. Молекулярну формулу речовини можна встановити за масою, об’ємом або кількістю речовини
Оксиген у складі невідомого газу. Якщо газ масою 58 г займає об’єм 22 400 мл, то маса 112 мл газу становить:
58 г · 112 мл Mr= = 0, 29 г. 22 400 мл Визначимо вміст Карбону й Гідрогену в невідомій речовині. Моль вуглекислого газу (22 400 мл) містить 12 г Карбону, а моль води (18 г) містить 2 г Гідрогену, тоді в 448 мл вуглекислого газу міститься Карбону: 12 г · 448 мл = 0,24 г (С), 22 400 мл а в 0, 45 г води міститься Гідрогену: 2 г · 0,45 г = 0,05 г (H). 18 г
Маса Карбону й Гідрогену разом становить 0,24 г + 0,05 г = 0,29 г, як і було визначено вище. Отже, у складі невідомого
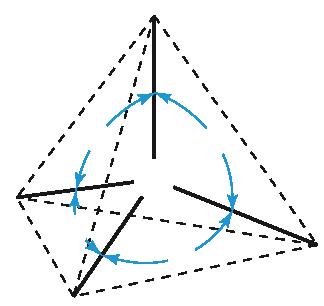
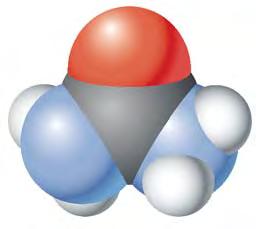
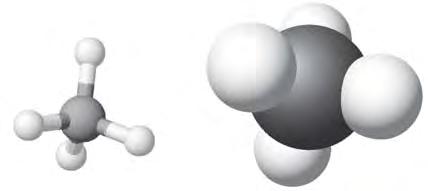
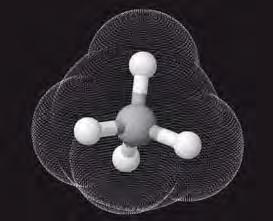
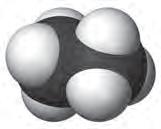
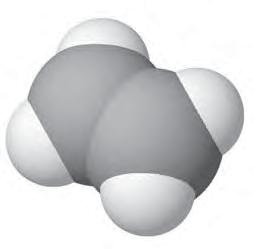
чотири ковалентні зв’язки. Тетраедричний напрямок цих зв’язків забезпечує максимальне перекривання електронів атома Карбону з електронами чотирьох атомів Гідрогену в молекулі метану. Моделі молекули метану наведено на мал. 5 і 6. Пригадайте, які існують види моделей молекул. Які
більше відповідають реальним молекулам? Розгляньте кулестержневу (а) й масштабну (б) моделі молекули метану (мал. 5). Порівняйте їх з комп’ютерною моделлю (мал. 6). Запишіть електронну й структурну формули метану. У молекулі етану С2Н6 кожен атом Карбону віддає у спільне користування по одному електрону, утворюючи ковалентний зв’язок. Інші три електрони кожного атома Карбону беруть участь в утворенні зв’язків з атомами Гідрогену. Моделі молекули етану наведено на мал.7. Запишіть
ПОДВІЙНИЙ С==С-ЗВ’ЯЗОК. У молекулі етену
С2Н4 між атомами Карбону утворюється подвійний зв’язок завдяки усуспільненню чотирьох електронів, тобто утворюються дві електронні пари (два зв’язки). По два електрони, що залишилися в атомів Карбону, утворюють зв’язки з електронами атомів Гідрогену. Модель молекули етену наведено на мал. 11 (с. 30).
Запишіть електронну й структурну формули етену.
ПОТРІЙНИЙ СС-ЗВ’ЯЗОК. У молекулі етину С2Н2 атоми Карбону використовують по три електрони для утворення трьох спільних електронних пар (потрійного зв’язку) і по одному електрону – для утворення зв’язку з атомами Гідрогену. Модель молекули етину наведено на мал.13 (с. 34).
Запишіть електронну й структурну формули етину.
19
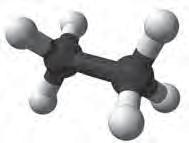
Мал. 7. Кулестержнева (а) й масштабна (б) моделі молекули етану
КЛАСИФІКАЦІЯ ОРГАНІЧНИХ СПОЛУК. З метою упорядкування знань про величезну кількість різних об’єктів, що їх вивчає наука, ці
об’єкти класифікують за певними ознаками. Вам відома класифікація неорганічних речовин на оксиди, кислоти, основи, солі, яка ґрунтується на хімічному складі цих сполук. Класифікаційними ознаками органічних сполук є будова карбонового ланцюга і наявність певних груп атомів, що визначають функції речовин, — т. зв. функціональних груп.
ще називають характеристичними групами. У 9 класі ви вивчали деякі найважливіші органічні речовини, до складу молекул яких входять такі функціональні групи, як гідроксильна, карбоксильна, аміногрупа і які належать, відповідно, до спиртів, карбонових кислот, амінокислот. За складом і функціональними (характеристичними) групами органічні речовини можна згрупувати так:

Вуглеводні (алкани, циклоалкани, алкени, алкіни, арени)
Оксигеновмісні сполуки (спирти, феноли, альдегіди, карбонові кислоти, естери, вуглеводи)
Нітрогеновмісні сполуки (аміни, амінокислоти, білки)
20
Вуглеводні етан, етен, етин ви розрізняли за наявністю в їхніх молекулах простого чи кратного зв’язку між атомами Карбону. Сам карбоновий ланцюг може бути прямим, розгалуженим або циклічної форми. Розглянемо класифікацію вуглеводнів за цими ознаками. Класифікація вуглеводнів Вуглеводні
Ациклічні (аліфатичні) Циклічні Насичені Ненасичені
Алкани CnH2n + 2 Алкени CnH2n Алкіни CnH2n – 2
Циклоалкани CnH2n Ароматичні (арени)
Бензен Відомі вам метан і його гомологи належать до насичених вуглеводнів (за міжнародною назвою — алканів), етилен (етен) — до алкенів, ацетилен (етин) — до алкінів. Із різними групами вуглеводнів ви ознайомитеся в наступному розділі.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Поясніть відмінність між основним і збудженим станами атома Карбону.
2. Які зв’язки утворюються між атомами Карбону? Наведіть приклади
3. Наведіть приклади (формули, назви) відомих вам оксигено- й нітрогеновмісних органічних речовин.
4. Наведіть приклади органічних речовин з йонним зв’язком.
5. Поясніть, як змінюються зв’язки між атомами Карбону в процесі полімеризації етину з утворенням поліетилену.

формули структурних ізомерів;
фізичні

сполук;
реакційну здатність вуглеводнів; записати рівняння реакцій окиснення, заміщення, приєднання, розкладу, ізомеризації; розповісти про застосування вуглеводнів; засвоїти терміни: алкани, алкени, алкіни, арени, номенклатура, алкільний замісник, піроліз, крекінг
§ 6. АЛКАНИ
СКЛАД МОЛЕКУЛ. Пригадайте вивчене в курсі хімії 9 класу і дайте
відповіді на запитання.
Що таке гомологи?
Яка загальна формула гомологів метану?
Пригадайте назви перших десяти гомологів метану, наведіть їхні молекулярні
формули.
Складіть структурні формули вуглеводнів, що містять три, чотири, п’ять атомів Карбону, пам’ятаючи
Таблиця 1 Характеристики
МетанCH4 –182,5–162
ЕтанC2H6 СН3—СН3 –183 –89
ПропанC3H8 СН3—СН2—СН3 –188 –42
БутанC4H10 СН3—(СН2)2—СН3 –138 –0,5
ГексанC6H14 СН3—(СН2)4—СН3 –95
ГептанC7H16 СН3—(СН2)5—СН3 –91 98
ОктанC8H18 СН3—(СН2)6—СН3 –57 126 0,70
НонанС9Н20 СН3—(СН2)7—СН3 –54 151 0,72
ДеканС10Н22 СН3—(СН2)8—СН3 –30174 0,73
ІЗОМЕРІЯ. Насиченим вуглеводням властива структурна ізомерія, що зумовлена різною послідовністю сполучення атомів у молекулі (хімічною будовою). Наприклад, у
ся трьома способами, тобто пентан
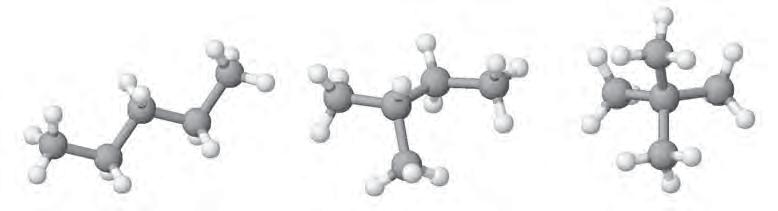
Зверніть увагу, що в молекулах ізомерів зберігаються валентні кути 109,5о і довжина зв’язків С—С 0,154 нм. Завдяки тетраедричній напрямленості зв’язків ланцюг атомів Карбону набуває зигзагоподібної будови. На мал. 9 зображено схеми «скелетів» ізомерів октану С8Н18. Складіть за цими схемами структурні формули. НОМЕНКЛАТУРА. Кожна наука створює й використовує власну мову, що складається зі спеціальних термінів, символів, формул і правил їх застосування. Символи і назви хімічних елементів, хімічні формули, хімічні рівняння, назви сполук, різні інші хімічні терміни — усе це в сукупності становить хімічну мову. В хімії особливе значення мають власні назви сполук, завдяки яким їх можна відрізнити одну від одної, та правила утворення цих назв, тобто номенклатура Історично склалося, що для багатьох органічних сполук використовують традиційні, т. зв. тривіальні назви (від лат. trivialis — звичайний, буденний), які не підлягають жодним правилам і які можна лише запам’ятати. Наукові (систематичні) назви органічних речовин, що є зрозумілими для всіх хіміків світу, складаються за правилами, розробленими міжнародною науковою спільнотою, і відображають хімічну будову речовин.
З назвами алканів нормальної (нерозгалуженої) будови ви вже ознайомлені, їх треба запам’ятати. Ці назви беруть за основу систематичних назв алканів розгалуженої будови, зазначаючи місце та назву груп атомів, що становлять відгалуження. Такі групи атомів називають алкільними замісниками.
Назви алкільних замісників утворюють заміною суфікса -ан у назві алканів на суфікс -ил (-іл) (алкан — алкіл). Загальна формула одновалентних алкільних замісників СnН2n + 1. Приклади найпростіших з них наведено в таблиці 2 на с. 24.
24 За наявності однакових замісників уживають
ди-, три-, тетра-. Таблиця 2
Алкани та алкільні замісники Алкан CnH2n + 2 Алкіл CnH2n + 1
Формула Назва ФормулаНазва CH4
C2H6
СН3—СН3
С3Н8 CH3—CH2—CH3
Метан
Етан
Пропан CH3
C2H5 CH3—CH2
C3H7 CH3—CH2—CH2
Метил
Етил
Пропіл CH3 | CH2 1 2 3| 4 5
Сполука, формула якої CH3 CH—CH—CH2 CH3, називається | CH3
3-етил-2-метилпентаном. ФІЗИЧНІ ВЛАСТИВОСТІ. Звернувшись до наведених у таблиці 1 фізичних констант алканів, можна помітити, що зі збільшенням кількості атомів Карбону в молекулі зростають температури плавлення і кипіння цих речовин. Перші чотири речовини за стандартних умов — гази. Далі йдуть рідини, а починаючи з вуглеводню складу С18Н38 (у таблиці не наведено) — тверді речовини. Від пентану в кожного наступного члена ряду температури кипіння зростають на 20—30 оС.
Густина насичених вуглеводнів збільшується зі збільшенням розмірів молекул, проте всі вони легші за воду.
Пропан і бутан легко скраплюються за підвищеного тиску.
Алкани — неполярні або слабкополярні сполуки, практично нерозчинні у воді, яка є полярною сполукою.
Газуваті й тверді алкани не мають запаху, а рідкі (складу С5—С17) мають характерний запах бензину. Природний газ, що надходить у газові магістралі, має, як ви знаєте, неприємний запах. Він спричинений навмисним добавлянням спеціальних речовин — меркаптанів.
25
пускати крізь розчин калій перманганату фіолетового кольору, то його забарвлення не змінюється, що свідчить про відсутність будь-яких змін окисника.
Низька реакційна здатність алканів зумовлена порівняно високою міцністю зв’язків С—С і С—Н. Для розривання цих зв’язків та ініціювання реакції за їх участі потрібні досить жорсткі умови, наприклад висока температура, наявність каталізатора, дія ультрафіолетового випромінювання тощо. Реакції повного й часткового окиснення. Підпалені на повітрі або в
кисні алкани горять. Горіння вуглеводнів — це реакція повного окиснення, продуктами якого є вуглекислий газ і вода. Крім того, виділяється велика кількість теплоти.
Продукти реакції можна виявити експериментально (цей дослід ви проводили в 9 класі). Якщо підпалити метан, зібраний у циліндрі, або опустити газовідвідну трубку з полум’ям метану в скляний циліндр, то через деякий час можна помітити утворення вологи на стінках циліндра.
Вапняна вода, що її налито в циліндр, стає каламутною. Отже, внаслідок згоряння метану виділяються вода і вуглекислий газ: СН4 + 2O2 СO2 + 2Н2O; Н = –882 кДж/моль Характер горіння алканів залежить від їхнього складу. Вищі алкани (ті, що мають високі відносні молекулярні маси) горять кіптявим полум’ям. Запалимо в порцеляновій чашці шматочки твердого вуглеводню, попередньо розплавивши його. Спостерігатимемо утворення кіптяви під час горіння. Це добре видно, якщо над полум’ям потримати скло. Оскільки газуваті вуглеводні (у нашому досліді — метан) добре змішуються з повітрям, то їх згоряння (окиснення) відбувається повністю. Розплавлений вуглеводень згоряє за нестачі кисню, отже, окиснення відбувається неповністю, частина речовини розкладається, і крім вуглекислого газу утворюється вуглець у вигляді сажі. У разі нестачі кисню метан також окиснюється неповністю, і в результаті утворюється вуглець (сажа) або карбон(ІІ) оксид. 2СН4 + 3O2 2СО + 4Н2O СН4 + O2 С + 2Н2O
Карбон(ІІ) оксид — дуже токсична речовина без запаху і кольору. Пригадайте, що ознакою неповного окиснення метану в побутових газових приладах є жовте забарвлення полум’я, якого йому надають
Молекула метану розщеплюється за температури понад 1000 оС, а молекули вищих алканів — за значно нижчої температури: близько 450 оС. t
2СН4 С2Н2 + 3Н2 Етин (ацетилен)
Розщеплення сполук під дією нагрівання називають піролізом (від грец. пір (пірос) — вогонь і ліз — розкладати). Щодо піролізу алканів, зокрема якщо йдеться про переробку нафти, вживають термін крекінг (від
англ. cracking — розщеплювати).
Розрізняють термічний, каталітичний, гідрокрекінг (за участі водню).
Залежно від умов крекінг алканів супроводжується відщепленням водню, утворенням нижчих вуглеводнів, ізомеризацією, циклізацією тощо.
Реакції заміщення (галогенування). За нагрівання до 250—400 оС або під дією ультрафіолетового випромінювання алкани вступають у реакцію заміщення з галогенами (крім йоду). Атоми Гідрогену поступово заміщуються на атоми галогену. На практиці, за умови достатньої кількості хлору, утворюється суміш моно-, ди-, три-, тетразаміщених сполук, що їх називають галогенопохідними насичених вуглеводнів.
h
CH4 + Cl2
СН3Сl + HCl
Хлорометан
h
СН3Сl + Cl2
СН2Сl2 + HCl
Дихлорометан
h
СН2Сl2 + Cl2
СНСl 3 + HCl
Трихлорометан
h
СНСl3 + Cl2
ССl4 + HCl
Тетрахлорометан
Якщо колбу наповнити сумішшю метану і хлору й залишити її у темряві, то жодних ознак реакції не спостерігатимемо. У колбі, винесеній на світло, одразу можна помітити послаблення жовтого забарвлення хлору, що засвідчує початок хімічної реакції. Вона може супроводжуватися вибухом, якщо суміш газів освітити прямим ультрафіолетовим промінням. Реакція ізомеризації. Під дією підвищеної температури та за наявності каталізатора алкани можуть зазнавати ізомеризації: t CH3—CH2—CH2—CH3 CH3—CH—CH3 [AlCl3] | CH3 Бутан 2-Метилпропан (ізобутан) Реакція
пального.
як
ДОБУВАННЯ. Основними джерелами алканів є
вугілля.
Пригадайте, які алкани входять до складу
газу, продуктів переробки нафти.
вуглецю
Чому, на
теплотворною здатністю, а й цінна хімічна сировина. З метану добувають вуглець (сажу) для виготовлення гуми, друкарської фарби. Крім того, з метану добувають етин (ацетилен):
1500 оС 2СН4 С2Н2 + 3Н2 Метан Етин Так само, як і метан, цінними продуктами є
і бутан — гази, що легко скраплюються (мал. 10).

28
новки з добування біогазу вже нерідкісні в сільській місцевості, де багато сільськогосподарських відходів (соломи, бадилля, качанів тощо).
З’ясуйте, як добування біогазу сприяє розв’язуванню енергетичної проблеми і водночас — поліпшенню екологічної ситуації. Підготуйте доповідь з цього питання.
Природна суміш твердих вуглеводнів з кількістю атомів Карбону в молекулі від 18 до 35 — це відомий вам парафін.


Висновки

ізомеризації. Алкани горять з утворенням вуглекислого газу і води. Природними джерелами алканів є корисні копалини: природний газ, нафта, кам’яне вугілля.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Назвіть відомі вам групи вуглеводнів.
2. Що є причиною ізомерії
карбонового ланцюга
В структура карбонового ланцюга Г розмір молекул
3. Складіть формули ізомерів гексану
4. Назвіть
6.
Додаткові завдання
1. Укажіть назву алкану CH3 CH3
А гептан
Б 4-етил-3,5-диметилгептан
В 3-бутил-4-метилгептан
Г пентадекан
2.
3. За даними таблиці
4.
5. Спалили речовини такої будови:
можна розрізнити ці речовини за об’ємом
(разом
що утворилися в результаті згоряння?
6. Кисню, що міститься в повітрі кухні (площа — 10 м2, висота — 2,5 м), вистачить на спалювання метану таким об’ємом А 2,5 м3 Б 5 м3 В 10 м3 Г 20 м3 Вважати, що вміст кисню в повітрі становить 20 % за об’ємом. 7. Позначте гомологи серед наведених сполук. А 1, 5, 6 Б 1, 3 В 3, 4 Г2, 4
H3C CH3
Н CH3 С H3C H H3 С CH3 С H3C СH2—СН3 С2Н6 CH3 | (CH2)2 | CH3 1 2 3 4 1 CH3—(CH2)2—CH3 i CH2—CH2 | CH2—CH2 2 CH2—CH2—CH2 i CH3 | | CH3 CH3 CH3—CH2—CH—CH3 1 2 3 4 5 6
H3C—С—CH3
вуглеводнів
Назва алкану Формула Теплота згоряння, кДж/моль
згоряння, кДж/моль МетанCH4 890ПентанС5Н12 3536 ЕтанC2H6 1560ГексанС6Н14 4141
ПропанC3H8 2220ГептанС7Н16 4817
БутанС4Н10 2878Октан С8Н18 5474
9. Визначте молекулярну формулу хлоропохідної сполуки, якщо масові частки елементів у ній такі: Карбону — 10 %, Хлору — 90 %, густина за воднем 118,5. § 7. АЛКЕНИ
СКЛАД МОЛЕКУЛ. Вам уже відомі ненасичені вуглеводні, в молекулах яких є подвійний зв’язок між атомами Карбону, та найпростіший серед них — етен (тривіальна назва — етилен) С2Н4 (мал. 11): H H .. ..
H2C==CH2 H:C::C:H
Структурна Електронна формула формула Етен започатковує групу ненасичених вуглеводнів алкенів. Загальна формула — СnН2n. У таблиці 4 наведено характеристики вуглеводнів ряду етену нормальної будови. ІЗОМЕРІЯ. Алкенам властива структурна ізомерія карбонового
2-Етилпент-1-ен ФІЗИЧНІ ВЛАСТИВОСТІ. Алкени легші за воду й нерозчинні у воді сполуки, розчиняються в неполярних розчинниках — хлороформі, бензені. Так само, як у алканів, їхні температури плавлення й кипіння зростають зі збільшенням довжини карбонового ланцюга (табл. 4).
Пригадайте фізичні властивості алканів (див. табл. 1) і порівняйте їх з алкенами (табл. 4).
Таблиця 4
°С молекулярна скорочена
ЕтенС2Н4 Н2С==СН2 –169–104
ПропенС3Н6 Н2С==СН—СН3 –188–48
Бут-1-енС4Н8 Н2С==СН—СH2—СН3 –185–6
2-Метилпроп-1-енС4Н8 СН3 | СН3—C==CH2 –141 –7
Пент-1-енС5Н10 СН2==СН—(СН2)2 СН3 –13830
Пент-2-енС5Н10 СН3—CH2—CH==CH—CH3 –15136,9
Гекс-1-енС6Н12 Н2С==СН (СН2)3—СН3 –139,863,5
Гепт-1-енС7Н14 Н2С==СН (СН2)4—СН3 –11994 Окт-1-енС8Н16 Н2С==СН (СН2)5—СН3 –102122
ХІМІЧНІ ВЛАСТИВОСТІ. Реакції повного й часткового окиснення. Етен і його гомологи горять з утворенням вуглекислого газу і води: СН2=СН2 + 3O2 2СO2 + 2Н2O; Н < 0 Добудемо етен за допомогою приладу,
ну від алканів алкени виявляють значну активність у цій реакції, в чому можна переконатися на досліді (виконується віртуально).
Пропустимо етен крізь розчин калій перманганату: фіолетове забарвлення зникає, тому що відбувається реакція часткового окиснення етену: 3CH3=CH2 + 2KMnO4 + 4H2O 3CH2—CH2 + 2MnO2 + 2KOH | | OH OH
Етен Етиленгліколь У результаті часткового окиснення алкенів утворюються різні оксигеновмісні сполуки, наприклад двохатомний спирт етиленгліколь. Цю реакцію використовують для аналітичного виявлення ненасичених вуглеводнів: зміна кольору калій перманганату свідчить про наявність сполуки з кратним зв’язком.
Реакції приєднання. За наявності каталізатора (Pt, Pd, Ni) за місцем подвійного зв’язку приєднується водень, у результаті чого алкени перетворюються на алкани:
CH2==CH2 + H2
кат.
CH3—CH3
Етен Етан
Реакцію приєднання атомів Гідрогену називають реакцією гідрування (гідрогенізації).
Важливою є реакція алкенів з водою, в результаті якої утворюються
спирти. Етен, приєднуючи воду, перетворюється на етанол:
кат.
CH2==CH2 + HOH CH3—CH2 | OH
Етен Етанол
Реакцію приєднання води до речовини називають реакцією гідратації. Хлор і бром приєднуються за місцем подвійного зв’язку з утворенням галогенопохідних алканів. Якщо пропустити етен крізь розчин бромної води, то забарвлення брому зникає: CH2=CH2 + Br2 CH2Br—CH2Br 1,2-Дибромоетан
Мал. 12. Прилад для добування етену в лабораторії
Цю реакцію також використовують для аналітичного виявлення ненасичених вуглеводнів. Алкени реагують з
утворюючи галогенопохідні сполуки: CH2==CH2 + HBr CH3—CH2Br Бромоетен
Молекули алкенів здатні сполучатися між собою з утворенням полімерів. Результатом реакції полімеризації етилену є поліетилен: t, p, кат. nCH2=CH2 (—CH2—CH2—)n
Пригадайте з курсу хімії 9 класу означення реакції полімеризації. ЗАСТОСУВАННЯ. З алкенів добувають багато різних продуктів. Це насамперед поліетилен і поліпропілен, що їх використовують у виробництві пластмас, а останні — під час виготовлення виробів для потреб промисловості й побуту. З етену добувають етанол (етиловий спирт) для застосування у виробництві багатьох цінних речовин.
Продукт приєднання хлору до етену — 1,2-дихлороетан СН2Сl—СН2Сl є розчинником і засобом знищення шкідників сільськогосподарських культур.
Етен використовують для прискорення достигання овочів і фруктів. Достатньо 0,08 мл етену, щоб протягом 24 год перетворити 1 кг зелених помідорів на червоні. Є сполуки, що можуть гідролізувати з утворенням етену, наприклад етрел. Якщо під час достигання помідорів увести його в рослину разом з іншими поживними речовинами, то він розкладеться в ній з виділенням етену:
|| +H2O
Cl—CH2—CH2—P—OH H2C==CH2 + H3PO4 + HCl | OH Етрел ДОБУВАННЯ. Етен утворюється у процесі переробки насичених вуглеводнів, що містяться в нафті: t H3C—(CH2)4—CH3 H2C==CH2 + H3C—(CH2)2—CH3 Гексан Етен Бутан У дуже малих кількостях алкени трапляються в природному газі, їх добувають також із продуктів переробки кам’яного вугілля. Промисловим методом добування алкенів є дегідрування (відщеплення водню) алканів за підвищеної


33 Висновки

за яким відбуваються реакції приєднання.

1. Скільком структурним
структурні формули, назвіть сполуки.
2. Які реакції характерні для етену? Складіть рівняння реакцій.
3. Назвіть найважливіші галузі застосування алкенів.
Додаткові завдання
1. Порівняйте хімічну активність алканів і етену. Зробіть висновок.
2. Які розчини використовують для аналітичного визначення алкенів? А бромоводень Б бромну воду В калій перманганат Г сульфатну кислоту
3. Запропонуйте спосіб добування етену з метану.
4. Складіть рівняння реакцій, що відбуваються за схемою: С2Н5Cl CH4 ? С2Н6 С2Н4 С2Н4Cl2
5. Обґрунтуйте галузі застосування етену його хімічними властивостями.
6. Спалили вуглеводень, отримали вуглекислий газ (17,6 г) і воду (7,2 г). Визначте формулу вуглеводню.
АЛКІНИ СКЛАД МОЛЕКУЛ.

35
Таблиця 5
Характеристики
Назва ФормулаТемпература, °С
молекулярнаскорочена структурнаплавленнякипіння
ЕтинС2Н2
Пропін
Бут-1-инС4Н6
Бут-2-инС4Н6
Пент-1-инС5Н8
3-Метилбут1-ин С5Н8
Гекс-1-инС6Н10
Гепт-1-инС7Н12
–81–83,8
–102,7–23,2
–126–8,6
–3227
–9840
H3C —29,3
–13272
–81100
–80128
Намалюйте схематично геометрію
Етин започатковує групу ненасичених вуглеводнів алкінів. Загальна формула сполук — СnН2n – 2. ІЗОМЕРІЯ. НОМЕНКЛАТУРА. Алкінам властива структурна ізомерія карбонового скелета і положення кратного зв’язку. Наприклад, для сполуки складу С5Н8 можливі такі ізомери: 5 4
За правилами систематичної номенклатури назви алкінів
(-ін). Спершу треба визначити найдовший карбоновий
атоми з кінця, ближчого до потрійного зв’язку; перед назвою цифрою зазначити місця замісників та їх назви в абетковому порядку; перед суфіксом цифрою вказати
. Як і інші вуглеводні, алкіни горять з утворенням карбон(ІV) оксиду та води й виділенням великої кількості теплоти.
Добудемо етин, скориставшись приладом, зображеним на мал. 14. Етин утворюється в результаті взаємодії кальцій карбіду з водою за реакцією: C H—OH
Ca + HCCH + Ca(OH)2 C H—OH
Підпалимо етин біля газовідвідної трубки — газ горітиме кіптявим
полум’ям:
2НССН + 5O2 4СO2 + 2Н2O;
полум’я під час горіння етину.
Для повного
розчином калій перманганату в кислому, лужному і нейтральному середовищах
утворенням оксигеновмісних сполук. Пропускаючи етин крізь цей розчин, можна спостерігати його знебарвлення. Як і в разі часткового окиснення алкенів, утворюються оксигеновмісні органічні сполуки: O O
3HCCH + 8KMnO4 + 4H2O 3 C—C + 8MnO2 + 8KOH HO OH
Етин Щавлева кислота Реакції приєднання. Алкіни вступають у реакції приєднання за місцем кратного зв’язку. За наявності каталізатора вони приєднують водень, відновлюючись при цьому до алканів. Як проміжні продукти утворюються відповідні алкени: кат. H2, кат. HCCH + H2 H2C==CH2 H3C—CH3 Етин Етен Етан У результаті приєднання до молекули алкіну однієї

сполук різної будови. З двох молекул
утворюється
практики сполука вінілацетилен НСС—СН=СН2. ЗАСТОСУВАННЯ. Найважливішим серед алкінів є етин (ацетилен). Завдяки високій питомій теплоті згоряння ацетилен використовують для газового різання і зварювання металів. З цією метою ним наповнюють спеціальні балони. Ацетилено-кисневе полум’я має температуру 2 800 оС і легко плавить сталь (мал. 15).
Вам відомо, що в XIX ст. ацетилен використовували для освітлення.
Пригадайте, чому ця галузь використання не набула поширення. Нині ацетилен є важливим промисловим продуктом. З нього добувають
вихідні речовини для виготовлення пластмас (хлорвініл Н2С==СНСl, вінілацетат Н2С==СН—ОСОСН3) та каучуків (вінілацетилен НСС—СН==СН2).
Ацетилен є сировиною для добування інших органічних сполук. ДОБУВАННЯ. Ацетилен для зварювальних робіт добувають часто на місці використання змішуванням
CaC2 + 2H2O C2H2 + Ca(OH)2
так
чи ремонту будівель, опишіть (усно) апарати, в яких вона відбувається. Порівняйте цей спосіб з лабораторним способом добування ацетилену. Кальцій карбід утворюється


Економічно вигідніше добувати ацетилен з метану нагріванням його до температури 1500 °С — піролізом . Реакція відбувається за схемою: t 2СН4 Н—СС—Н + 3Н2 Метан Етин
Обчислення кількості речовини, маси або об’єму за кількістю речовини, масою або об’ємом реагенту, що містить певну частку домішок Сировина, що її використовують для добування речовин у промислових умовах, як правило, містить домішки, що не беруть участі в реакції або утворюють побічні продукти. Вміст домішок визначають заздалегідь, а обчислення витрат реагентів проводять, нехтуючи цими домішками. Задача. Якого об’єму етин утвориться в результаті обробки водою кальцій карбіду масою 10 кг, якщо вміст домішок у сировині становить 20 %?
Обчислимо масу чистого кальцій карбіду, що становить 80 % (100 % – 20 % = 80 %):
10 кг · 80 % = 8 кг (CaC2). 100 %
8 кг
СaС2 + 2H2O
64 кг
64 кг
38 Висновки
Ca(OH)2 + C2H2
22,4 м3
м3 = 2,8 м3 (C2H2).
Отже, утвориться етин об’ємом 2, 8 м3.




1.
2.
ли етину.
3. На якій хімічній властивості етину ґрунтується
4. Укажіть правильне твердження. А кальцій карбід пахне ацетиленом Б алкіни горять кіптявим полум’ям В алкіни й алкени — ізомери Г алкіни — насичені вуглеводні
Додаткові завдання
1. Порівняйте будову молекул етену й етину.
2. Наведіть структурні формули й назви ізомерів складу С6Н10.
3. Чим різняться між собою реакції приєднання
4. Обґрунтуйте галузі застосування ацетилену
5. Схарактеризуйте способи добування ацетилену з погляду
6.
АРЕНИ. БЕНЗЕН
СКЛАД І БУДОВА МОЛЕКУЛИ. Молекула бензену має склад С6Н6. Сполука належить до групи ароматичних вуглеводнів (аренів). Ця назва, як і багато інших в органічній хімії, склалася історично, оскільки перші з добутих сполук цієї групи справді мали приємний запах. Будова молекули бензену багато років становила теоретичну проблему, жодна із пропонованих структурних формул не відповідала властивостям речовини, що спостерігалися вченими в лабораторії. У 1865 р. (через 40 років після визначення елементного складу бензену) німецький учений А. Кекуле запропонував зображати структурну формулу бензену у вигляді шестичленного циклу з атомів Карбону, між якими чергуються прості й подвійні зв’язки:
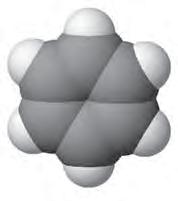
За такої будови очевидно, що всі атоми Карбону є рівноцінними (мал. 16). Проте й ця формула неповністю відповідає хімічним властивостям бензену. Будучи формально ненасиченим, він виявляє певну хімічну інертність.
Щоб показати, що в молекулі бензену немає простих і кратних зв’язків, було запропоновано зображати структурну формулу як правильний шестикутник з кільцем усередині:
ФІЗИЧНІ ВЛАСТИВОСТІ. За стандартних умов бензен — безбарвна рідина з характерним запахом, температурою кипіння 80 оС, практично нерозчинна у воді, але водночас є розчинником багатьох органічних речовин. У цьому можна переконатися на досліді. В одну пробірку наллємо бензену, в іншу — води. Добавимо в обидві пробірки по кілька краплин жиру і збовтаємо їх. Жир розчиняється у бензені, але спливає над водою. Бензен — отруйна речовина, вдихати його випари небезпечно, тому працювати з ним слід обов’язково у витяжній шафі. ХІМІЧНІ ВЛАСТИВОСТІ. Реакції бензену зумовлено наявністю стабільного карбонового кільця. Реакція окиснення. Бензен стійкий проти дії окисників, він не знебарвлює розчин калій перманганату, якщо суміш цього розчину з бензеном збовтати у пробірці. За жорстких умов (каталізатор, висока температура, дія кисню) його все-таки вдається окиснити. Цим бензен нагадує насичені вуглеводні. У результаті горіння бензену утворюються вуглекислий газ і вода: 2С6Н6 + 15O2 12СO2 + 6Н2O; Н < 0 Пригадайте характер горіння метану, етену, етину. В чому полягали відмін-
ності цих реакцій?
Оскільки у складі молекули бензену вміст Карбону є значним, то можна припустити, що горіння бензену на повітрі супроводжуватиметься утворенням кіптяви, як і в разі етину. Переконаємося в цьому на досліді, підпаливши у витяжній шафі в порцеляновій чашці кілька мілілітрів бензену: він справді горить кіптявим полум’ям з утворенням


41
Реакції приєднання. Зважаючи на формальну ненасиченість складу бензену, можна припустити, що йому властиві реакції приєднання, наприклад брому.
У пробірку з бензеном добавимо трохи бромної води і суміш збовтаємо. Бромна вода не знебарвлюється, бром переходить у верхній шар, отже, реакція не відбувається.
На відміну від ненасичених вуглеводнів бензен вступає в реакції приєднання за особливих умов. Наприклад, до молекули бензену, активованої дією ультрафіолетового випромінювання, можуть приєднатися три молекули хлору, при цьому утворюється гексахлороциклогексан, або гексахлоран, відомий як засіб боротьби зі шкідниками сільськогосподарських культур:
Гексахлороциклогексан Приєднання
тиску
Реакції заміщення. Бензен легко вступає в реакції
реакцій
галогенування та ін. Галогенування бензену за типом заміщення


Можуть заміщуватися усі шість атомів Гідрогену з утворенням гексахлоробензену:
Бензен вступає як у реакції заміщення, так і реакції приєднання, причому заміщення відбувається у бензені легше, ніж у насичених вуглеводнях, а приєднання — важче, ніж у ненасичених. Отже, бензену більше властиві реакції заміщення. ДОБУВАННЯ. У минулому столітті бензен добували із продуктів переробки кам’яного вугілля; цей метод і досі використовують у промисловості. Бензен добувають також з нафтопродуктів за допомогою процесів ароматизації, тобто перетворення неароматичних сполук на ароматичні, наприклад дегідруванням гексану за наявності каталізатора. Відбувається процес одночасного дегідрування і циклізації:
CH2 CH2 CH3 CH3 H2C H2C
t, кат. + 4H2


Висновки

Бензен належить до ароматичних вуглеводнів.

1. Чому структуру бензену було з’ясовано лише через
2. За хімічними властивостями бензен не належить ні до насичених, ні до ненасичених вуглеводнів. Чому?
3. На мал. 17 зображено полум’я бензену, метану
зображення відповідає кожній з речовин? Відповідь поясніть.
4. Чи знебарвлює бензен бромну воду? Поясніть, чому.
5. Які реакції характерні для бензену? Складіть рівняння реакцій.
6. Які з наведених сполук належать до насичених, ненасичених, ароматичних: С6Н12, С6Н6, С6Н5СІ, С6Н14?
Додаткові завдання
1. Поясніть умовність формули Кекуле для бензену.
2. Поясніть вплив умов на перебіг реакції бензену з хлором.

3. Зробіть висновок про реакційну здатність бензену порівняно з насиченими і ненасиченими вуглеводнями.
4. Складіть рівняння послідовних перетворень: вугілля на бензен;
5. Для добування
44
чення атомів приводить до утворення ізомеру, тобто нової сполуки з притаманними їй властивостями. У цьому виявляється дія закону залежності вла стивостей органічних речовин від складу і хімічної будови молекул. Наведіть конкретні приклади цієї залежності, підтвердіть їх фізичними константами речовин та хімічними реакціями. За складом молекул вуглеводні різних груп різняться між собою кількістю атомів Гідрогену, що припадають на певну кількість атомів Карбону. Отже, внаслідок приєднання або відщеплення атомів Гідрогену сполуки однієї групи перетворюються на сполуки іншої групи (реакції гідрування і дегідрування).
Наведіть приклади таких реакцій.
Послідовними хімічними перетвореннями з неорганічної сполуки кальцій карбіду можна отримати етин, а з нього — бензен, останній переробити на інші сполуки.
Складіть рівняння цих хімічних перетворень.
Ці приклади засвідчують генетичний взаємозв’язок між вуглеводнями, а також між органічними та неорганічними речовинами. Знання цих взаємозв’язків уможливлює добування багатьох цінних сполук за допомогою хімічного синтезу.

ЗАВДАННЯ
1. Напишіть рівняння реакцій за схемою
Насичений вуглеводень Ароматичний вуглеводень Ненасичений вуглеводень
2. Чим зумовлена структурна ізомерія вуглеводнів? Наведіть приклади.
3. Напишіть структурні формули речовин наведеного складу. Згрупуйте речовини-гомологи: С6Н6, С2Н2, С4Н10, С4Н8, С4Н6, С2Н6, С2Н4, С10Н22
4. Наведені речовини – це


Оксигеновмiснi сполуки вiдiграють визначальну роль у функцiонуваннi живих органiзмiв — рослин i тварин, входять до складу їжi (це вiдомi вам жири i вуглеводи), є основою деревини, з них виготовляють папiр, волокна, вони є складниками мила та iнших мийних засобiв, лiкiв тощо. Відомi вам з курсу xiмiї 9 класу термiни «спирт», «етанова кислота», «естер», «жир», «глюкоза» — це назви оксигеновмiсних органiчних речовин. Саме їx та багато iнших сполук ви докладно вивчатимете в цьому роздiлi органiчної xiмiї.
Розгляньте таблицю
функцiональна (характеристична) група. Оксигеновмiснi органiчнi сполуки

Наприкiнцi вивчення теми ви зможете:
назвати спирти за правилами номенклатури; скласти формули спиртiв за їхнiми назвами та назви — за формулами; скласти формули структурних iзомерiв спиртів; схарактеризувати водневi зв’язки; пояснити електронну будову спиртiв i фенолу; описати фiзичнi властивостi сполук; пояснити реакцiйну здатнiсть спиртiв i фенолу; записати рiвняння реакцiй окиснення, замiщення, дегiдратацiї; пояснити електронну суть взаємного впливу атомiв у молекулах спиртiв i фенолу; пояснити дiю етанолу на органiзм людини; розповiсти про методи добування сполук та їхне застосування; класифiкувати спирти; засвоїти термiни: внутрiшньо- й мiжмолекулярна дегiдратацiя, фенол.
СКЛАД I БУДОВА МОЛЕКУЛ. Як вам уже вiдомо, наявнiсть у молекулi однiєї або кiлькох функцiональних (характеристичних) гiдроксильпих гpyn, сполучених з вуглеводневою групою, є ознакою класу органiчних речовин, що їх називають спиртами. Насиченi одноатомнi спирти можна розглядати як сполуки, що є похiдними насичених вуглеводнiв (алканiв), у яких один атом Гiдрогену замiщений на гiдроксильну групу. Мiжнародна назва цих сполук — алканоли, iнодi застосовують тривiальну назву — алкоголi. Залежно вiд будови вуглеводневої групи розрiзняють спирти насиченi, ненасиченi, ароматичнi, а за кiлькiстю гiдроксильних груп — одно- i багатоатомнi. Вам вiдомi насиченi одноатомнi спирти метанол i етанол, що мiстять залишок насиченого вуглеводню й одну гiдроксильну групу, а також трьохатомний спирт глiцерол. H |
Пригадаймо їxнi формули: Н—С—ОН, або скорочено СН3—ОН; | Метанол H H H CH2 OH | | | H—C—C—OH, або скорочено СН3—СН2—ОН; CH—OH | | Етанол | H H CH2 OH Глiцерол Зв’язок O—Н поляризований, оскiльки атом бiльш електронегатив-
поляризацiї на атомi Гiдрогену виникає частковий позитивний заряд, а на атомi Оксигену — частковий негативний: – + Н3С О Н Полярнiсть зв’язку впливає на властивостi спиртiв. Метанол розпочинає гомологiчний ряд насичених одноатомних спиртiв. Характеристики гомологiв наведено в табл. 6. Моделi молекул метанолу й етанолу зображено на мал. 18.
Загальну формулу насичених одноатомних спиртiв можна вивести iз загальної формули насичених вуглеводнiв замiщенням атома Гiдрогену на гiдроксильну групу: СnН2n + 2 CnH2n + 1OH
Якщо вуглеводневу групу позначити лiтерою R, то загальна формула спиртiв матиме вигляд R—OH. Таблиця 6 Характеристики насичених одноатомних спиртiв Назва спирту
Формула
Температура, oС Густина, г/см3
Розчинність, г/100 г H2 O молекулярна скорочена структурна
лення кипіння
МетанолCH3 OHCH3—OH –94 64,5 0,792Необмежена
ЕтанолC2H5OH CH3—CH2—OH–114 78,4 0,789»
Пропан1-ол C3H7OH CH3—CH2 CH2—OH–127 97,4 0,804»
Бутан-1-олC4H9OH CH3—(CH2)2—CH2 —OH–90,2 117,4 0,810 7,9
Пентан1-ол C5H11OHCH3—(CH2)3—CH2—OH–78,5 137,8 0,814 2,4
Гексан1-ол C6H13OHCH3 —(CH2)4—CH2—OH –52 157 0,821 0,6
Гептан1-ол C7H15OHCH3—(CH2)5—CH2—OH–34 176 0,822 0,1
Октан1-ол C8H17OHCH3—(CH2)6—CH2—OH–17 194 0,825 0,05
Нонан1-ол C9H19OHCH3—(CH2)7—CH2—OH –5 215 0,827Нерозчинний
Декан1-ол C10H21OHCH3 —(CH2)8—CH2—OH 7 230 0,829»
ІЗОМЕРIЯ. НОМЕНКЛАТУРА. Насиченим одноатомним спиртам властива структурна iзомерiя, зумовлена будовою карбонового скелета i положенням гiдроксильної групи. Для спирту складу С4Н9OН можливi такi iзомери: CH3 CH2 CH2 CH2—OH H3C CH2 CH—CH3 | OH 1 2 CH3 CH3 | | H3C CH—CH2—OH H3C C—OH | CH3 3 4
За систематичною номенклатурою назви насичених одноатомних спиртiв (алканолiв) нерозгалуженої будови утворюють вiд назв алканiв додаванням до назв суфiкса -ол (метан — метанол, пропан — пропанол). Щоб назвати спирт розгалуженої будови, треба пронумерувати найдовший карбоновий ланцюг, починаючи вiд атома, найближчого до гiдроксильної групи; перед назвою вказати мiсце i назви алкiльних замiсникiв у абетковому порядку; пiсля назви головного ланцюга цифрою позначити мiсце гiдроксильної групи i додати суфiкс -ол. Наприклад: 4-етил-3-метилгексан-2-ол C2H5 CH3 6 5 | 4 |3 2 H3C CH2 CH—CH—CH—OH 1|
49
Серед спиртiв, на вiдмiну вiд вуглеводнiв, немає газуватих речовин.
Температури плавления i кипiння спиртiв значно вищi, нiж вуглеводнiв з майже такою самою вiдносною молекулярною масою (табл. 7). Таблиця 7 Температури
Формула вуглеводню tкип, oC Формула спирту tкип, oC
C2H6 –89 CH3OH 64,5
C3H8 –42
Таку вiдмiннiсть температур можна пояснити наявнiстю додаткової взаємодiї мiж молекулами спирту. Для з’ясування природи цiєї взаємодiї звернемося до неорганiчної xiмiї й розглянемо температури кипiння сполук Гiдрогену з деякими елементами IV— VII груп Перiодичної системи (мал. 19). Звернiть увагу, що зi збiльшенням вiдносної молекулярної маси цих сполук їxнi температури кипiння пiдвищуються. Виняток становлять гiдроген флуорид, вода та амонiак, константи яких дуже вiдрiзняються вiд констант сполук сусiднiх елементiв у пiдгрупi. Маючи найнижчi вiдноснi молекулярнi маси, вони характеризуються найвищими температурами кипiння, тобто
цих сполук мiцнiше зв’язанi мiж собою. Чому?
50
Зв’язки мiж атомами Гiдрогену й електронегативними атомами N, О, F поляризованi, на атомах Гiдрогену виникає частковий позитивний заряд: + – + +
Н N Н Н
+ H
За рахунок притягання позитивно зарядженого атома Гiдрогену однiєї молекули i негативно зарядженого атома Оксигену, Нiтрогену чи Флуору iншої молекули утворюється т. зв. водневий зв’язок (позначають трьома крапками). Гiдроген є нiби мiстком мiж двома електронегативними атомами:
Так само утворюються водневі зв’язки
спирту:
Водневий зв’язок належить до слабких зв’язкiв, однак для того щоб рiдина, в якiй молекули асоцiйованi за рахунок водневих зв’язкiв, перетворилася на пару (закипiла), потрiбно затратити додаткову енергiю на руйнування цих зв’язкiв.
Отже, порiвняно високi температури кипiння спиртiв (а також води, амонiаку, гiдроген флуориду) пояснюються наявнiстю водневих зв’язкiв мiж їхнiми молекулами. Унаслiдок утворення водневих зв’язкiв мiж молекулами води i спиртiв останнi розчиняються у водi:
51
Проте це характерно лише для нижчих спиртiв, у яких гiдроксильна група становить значну частину молекули. Першi три члени гомологiчного ряду необмежено розчиннi; у наступних гомологiв з подовженням карбонового ланцюга його частка в молекулi збiльшується, тому розчиннiсть спиртiв зменшується. У цьому можна переконатися на дослiдi. У чотири пробiрки з водою добавимо однакову кількість метанолу, етанолу, бутанолу, пентанолу. Спостерiгатиметься повне розчинення перших двох спиртiв i значно менша розчиннiсть двох iнших.
XIMIЧHI ВЛАСТИВОСТI. Реакцiї повного й часткового окиснення. Як i всi органiчнi речовини, спирти горять з видiленням теплоти.
Пiдпалимо зразки метанолу, етанолу, пропанолу, пентанолу в порцелянових чашках. Помiтна вiдмiннiсть у характерi горiння спиртiв: вiд майже несвiтного синюватого полум’я метанолу до кiптявого — пентанолу.
2СН3—ОН + 3O2 2СО2 + 4Н2O; Н < 0
Пояснiть характер горiння спиртiв рiзного складу, спираючись на знання характеру горiння вуглеводнiв. Частково окиснюють спирти калiй дихромат або калiй перманганат у
кислому середовищi, при цьому утворюються карбоновi кислоти: [O] O CH3—CH2 OH CH3 C OH
Етанова кислота Реакції замiщення. Оскiльки електронна густина зв’язку O H змiщена до Оксигену, можна припустити, що для спиртiв можливi реакцiї з вiдщепленням Гiдрогену. Проте проба спирту на електропровiднiсть дає негативний результат; практично не спостерiгається й електролiтичної
дисоцiацiї спирту у водi.
Отже, атом Гiдрогену хоча й набуває рухливостi, але хiмiчний зв’язок
O—Н за таких умов не розривається.
Спробуємо провести реакцiю з активнішими реагентами. Вмiстимо шматочок металiчного натрiю в пробiрку з 2 мл етанолу й закриємо її
пробкою зi скляною трубкою, вiдтягнутою на кiнцi. Вiдбувається реакцiя замiщення з видiленням водню: 2СН3—СН2—ОН + 2Na 2СН3—CH2—ONa + H2 Етанол Натрiй етанолят Як можна переконатися, що видiляється справдi водень? У цiй реакцiї виявляються слабкi кислотнi властивостi спирту: – + 2CH3—CH2—O—H + 2Na 2CH3—CH2—O– + 2Na+ + H2 Загальна назва анiонiв у продуктах замiщення Гiдрогену на металiчний елемент — алканоляти (алкоголяти). Добутий нами натрiй етанолят можна видiлити у твердому вигляді.
Мал. 20. Анестезiя медичним ефiром (1885 р.)
Пригадайте, що реакцiя натрiю з
водою вiдбувається бурхливо, водень видiляється значно енергiйнiше, нiж
у реакцiї натрiю з етанолом. Очевидно, позначається вплив вуглеводневої групи: Гiдроген стає менш рухливим i вiдщеплюється важче порiвняно з
Гiдрогеном води.
З подовженням карбонового ланцюга активнiсть спиртiв у реакцiї з натрiєм спадає. У цьому виявляється взаємний вплив атомів у молекулі.
Реакцiя дегiдратацiї. Перебiг такої реакцiї визначається зовнiшнiми умовами. Якщо етанол нагрiвати до температури понад 170 оС iз сильною кислотою, наприклад концентрованою сульфатною, або пропускати пару спирту над каталiзатором (Аl2O3), то вiдбуватиметься реакцiя внутрiшньомолекулярної дегiдратацiї з утворенням етену: H H | | кат. H—C—C—H H2C==CH2 + H2O | | H OH Етен
Складiть рiвняння реакцiї дегiдратацiї пропанолу. Назвiть речовину, що утворюється.
Якщо ж температура нагрiвання не перевищує 140 оС i спирт узято в надлишку, то вiдбувається реакція мiжмолекулярної дегiдратацiї з утворенням сполуки, що належить до класу етерiв загальної формули R—O—R1 З етанолу утворюється етоксіетан:
t < 140 oC
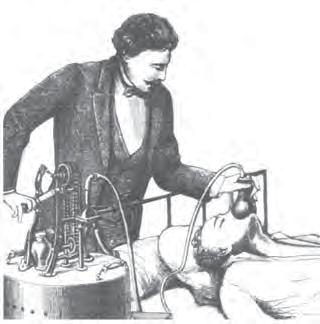
СH3—CH2—OH + OH—CH2—CH3 СH3—CH2 O—CH2—CH3 + H2O Етоксіетан Iз середини XIX ст. етоксіетан (у медицинi вживають термiн «медичний ефiр») вiдомий як засiб для знеболення (мал. 20). Першу операцiю пiд ефiрним наркозом провiв бостонський хiрург Дж. Уоррен у 1846 р. У воєнно-польовiй xipypгiї його вперше застосував видатний хiрург М. І. Пирогов.
ДОБУВАННЯ ЕТАНОЛУ.
53
Етанол утворюється також у результатi реакцiї гiдратацiї етену:
СН2==СН2 + Н2О H3C—CH2—OH
Етен Етанол
Найдавнiший метод добування етанолу — це спиртове бродiння глюкози, що мiститься у виноградi, iнших фруктах. Процес вiдбувається пiд
дiєю природних каталiзаторiв — ензимiв (ферментів), що їх виробляють
дрiжджi деяких видів. У загальному виглядi процес спиртового бродiння
можна подати рiвнянням: С6Н12O6 2СН3СН2ОН + 2СО2 Глюкоза Етанол
Насправдi утворюється сумiш спиртiв та iнших речовин, у якій лише 12 % етанолу. Для його видiлення використовують метод дистиляцiї, або перегонки (мал. 21, 22). У результатi утворюється т. зв. ректифiкат, що мiстить 96 % етанолу i 4 % води.
Етанол добувають також гiдратацiєю етену. Добутий у такий спосiб спирт використовують для технiчних потреб.
Використання етанолу надзвичайно широке. Це розчинник для виготовлення фармацевтичних препаратiв (настоянок, екстрактiв тощо), парфумерних i косметичних виробiв, есенцiй, лакiв (полiтури для меблiв). Етанолом як бактерицидним засобом обробляють рани. У харчовiй промисловостi з нього виготовляють алкогольнi напої. З етанолу в промислових масштабах виробляють оцтову кислоту, хлороформ, медичний ефiр та iн. У багатьох країнах сумiш бензину з етанолом (до 10 %) використовують як пальне.
Схарактеризуйте переваги використання такої сумiшi з погляду зменшення шкiдливих викидiв у атмосферу.
Етанол, призначений для технiчних цiлей, називається денатуратом. Цей продукт мiстить домiшки, що змiнюють запах, смак i колiр етанолу i роблять його непридатним для споживання.


22.
куб Мал. 21. Апарат для перегонки спирту (1500 р.)
54
Дiя етанолу на органiзм. З курсiв xiмiї i бiологiї ви вже знаєте про згубну дiю алкогольних напоїв на органiзм людини, що призводить до тяжкого захворювання — алкоголiзму. Пояснiть на основi цих знань та залучаючи додаткову лiтературу, чому алкоголь особливо небезпечний для молодого органiзму.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Що таке функцiональна (характеристична) група?
2. Якi сполуки називають спиртами?
3. Як позначається вплив атома Оксигену на розподiлi електронної густини в молекулi спирту?
4. Чим зумовлена iзомерiя насичених одноатомних спиртiв? Наведiть приклади.
5. Пояснiть причину аномально високої температури кипiння води.
6. Пояснiть уплив водневих зв’язкiв на фiзичнi властивостi спиртiв.
7. Наведiть рiвняння хiмiчних реакцiй спиртiв, що вiдбуваються з розриванням зв’язкiв С—ОН i СО—Н.
8. Пояснiть уплив умов на перебiг реакцiї дегiдратацiї етанолу.
9. Складiть рiвняння реакцiй за схемою перетворень: СnН2n + 2 СnН2n +1Br СnН2n + 1ОН
Додатковi завдання
1. Укажiть iзомери i гомологи серед наведених сполук, зважаючи на ізомерію між
класами етери — одноатомні спирти. СН3—(СН2)2—СН2—ОН СН3—O—С2Н5 С4Н9—ОН 1 2 3 CH3 |
СН2—СН2—СН2—СН2—ОН С3Н7—ОН CH3—C—OH | | CH3 CH3 4 5 6
А iзомери: 1 i 6, 2 i 5 гомологи: 1, 4, 5
Б iзомери: 1 i 4 гомологи: 5 i 2
В iзомери: 2 i 3 гомологи: 4 i 6
2. Складiть структурнi формули ізомерних спиртів складу С5Н12O.
3. Етин — газ, гiдроген цiанiд — рiдина (н. у.), хоча молекулярнi маси цих сполук приблизно однаковi. Пояснiть це.
4. Якi хiмiчнi властивостi етанолу пiдтверджують, що його формула С2Н5—ОН?
5. Порiвняйте властивостi метанолу з властивостями води i метану. Зробiть узагальнювальний висновок.
6. Які
7.
§ 12. ГЛIЦЕРОЛ
СКЛАД МОЛЕКУЛИ. Молекули спиртiв можуть мiстити двi, три i бiльше гiдроксильних груп бiля рiзних атомiв Карбону. Такi спирти називають вiдповiдно двохатомними, трьохатомними, багатоатомними (якщо таких груп понад три). Щодо трьохатомних застосовують також
загальну назву глiцероли. За систематичною номенклатурою їх називають трiолами.
Найпростiший трьохатомний спирт —
глiцерол (тривiальна назва — глiцерин):
CH2—CH—CH2 | | | OH OH OH
Пропан-1,2,3-трiол (глiцерол)
На мал. 23 зображено масштабну модель
молекули глiцеролу.
ФIЗИЧНI ВЛАСТИВОСТI. Глiцерол —
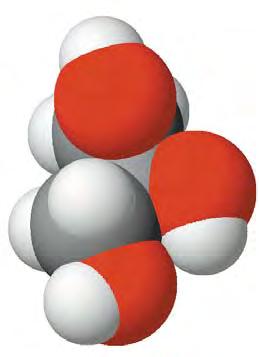
безбарвна в’язка рiдина, добре розчинна у водi. Особливiстю глiцеролу та багатоатомних спиртiв є солодкий смак, що посилюється зi збiльшенням числа гiдроксильних груп у молекулi. Ця властивiсть глiцеролу вiдбита в його назвi, що походить вiд грецького слова глiкос — солодкий. У XVIII ст., коли глiцерол було видiлено з маслинової oлiї, його називали ще олiйним цукром. Завдяки наявностi гiдроксильних груп мiж молекулами багатоатомних спиртiв утворюються водневi зв’язки, як i мiж молекулами одноатомних спиртiв. Цим пояснюються висока густина i розчиннiсть у водi етиленглiколю й глiцеролу.
Складiть схему утворення водневих зв’язкiв мiж молекулами глiцеролу.
Глiцерол гiгроскопiчний (вiд грец. гiгро — волога i скопiя — спостерiгати), глiцерол вбирає з повiтря до 40 % вологи (за об’ємом).
XIMIЧHI ВЛАСТИВОСТI. Для багатоатомних спиртiв характернi реакцiї одноатомних спиртiв, причому вони вiдбуваються за участі однiєї або кiлькох гiдроксильних груп. Реакцiї повного й часткового окиснення. Як й iншi органiчнi речовини, глiцерол окиснюється
CH2—OH CH2—ONa CH2—ONa | 2Na | 2Na | 2CH—OH 2CH—OH 2CH—ONa | –H2 | –H2 | CH2—OH CH2—OH CH2—OH
Наявнiсть кiлькох гiдроксильних груп позначається на хiмiчнiй активностi сполук, зокрема посилюються кислотнi властивостi: якщо одноатомнi спирти утворюють алканоляти лише з лужними металами, то етиленглiколь i глiцерол реагують також з лугами та гiдроксидами важких металiчних елементiв.
Характерною реакцiєю багатоатомних спиртiв, що її використовують
для їx виявлення, є реакцiя з купрум(ІІ) гiдроксидом з утворенням розчину синього кольору.
Цю реакцiю ви проводили в 9 класі. Пригадайте свої спостереження.
ЗАСТОСУВАННЯ. Глiцерол (глiцерин) широко застосовують
передусiм завдяки його гiгроскопiчностi (мал. 24). У парфумерiї та фармацiї — як пом’якшувальний засiб або основу мазей, добавку до мила, зубної пасти (щоб запобiгти їх висиханню); у харчовiй промисловостi — як добавку до напоїв, кондитерських виробiв. Шкiряне виробництво й текстильна промисловiсть послуговуються глiцеролом для обробки
пряжi й шкiри з метою їх пом’якшення та надання еластичностi. Продукт нiтрування глiцеролу — тринiтроглiцерол — вибухова речовина, з якої виготовляють динамiт. Ця сполука чинить судинорозширювальну дiю i пiд назвою «нiтроглiцерин» використовується як лiки вiд серцевих захворювань.





ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. До якого класу сполук належить глiцерол?
2. Якi властивостi глiцеролу пояснюють утворенням водневих зв’язкiв?
3. Порiвняйте хiмiчнi властивостi етанолу та глiцеролу. Складiть рiвняння вiдповiдних реакцiй.
4. У двох пробiрках мiстяться глiцерол та етанол. Як хiмiчним способом розрiзнити цi сполуки?
5. Чи вiдомий вам глiцерол iз побутового застосування? Розкажiть про це. Додатковi завдання
1. Пояснiть причину рiзноманiтностi сполук, що належать до класу спиртiв.
2. Чи є гомологами пропанол i глiцерол? Вiдповiдь пояснiть.
3. Яка сполука має, на вашу думку, бiльшу густину — двохатомний чи трьохатомний спирт? Вiдповiдь пояснiть. Для пiдтвердження свого припущення скористайтеся довiдником.
4. Пояснiть, чому пентанол малорозчинний у водi, а пентантрiол — добре розчинна сполука.
5. У результатi вибуху динамiту утворюється сумiш вуглекислого газу, азоту,


Висновки

Спирти — полярнi сполуки. Електронна
бiльш електронегативного атома Оксигену. Насиченим одноатомним спиртам властивi: структурна iзомерiя, зумовлена будовою карбонового скелета й положенням гiдроксильної групи.
Спирти мають вищi порiвняно з вуглеводнями температури плавлення i кипiння, бiльшу густину внаслiдок утворення водневих зв’язкiв мiж молекулами. У багатоатомних спиртiв цi константи мають ще бiльшi значення.
Спирти розчиннi у водi внаслiдок утворення водневих зв’язкiв. Повне окиснення спиртiв вiдбувається до вуглекислого газу i води; часткове окиснення одноатомних спиртiв — до карбонових кислот. Дегiдратацiя насичених одноатомних спиртiв вiдбувається,
58
§ 13. ФЕНОЛ
СКЛАД I БУДОВА МОЛЕКУЛИ. Якщо гiдроксильна група сполучена безпосередньо з бензеновим ядром, то утворюється сполука фенол, представник класу фенолiв. Структурна формула фенолу
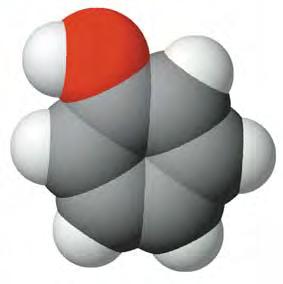
Мал. 25. Масштабна модель молекули фенолу
HC CH C CH CH HC OH | , або скорочено C6H5—OH
Модель молекули фенолу наведено на мал. 25. Слiд розрiзняти фенол й ароматичнi спирти, в яких гiдроксильна група сполучена з бензеновим ядром через бiчну вуглеводневу групу. Наприклад, бензиловий спирт CH2 OH
ФІЗИЧНI ВЛАСТИВОСТI. Фенол — кристалiчна безбарвна речовина з характерним запахом. У разi зберiгання в нещiльно закритому посудi внаслiдок окиснення набуває рожевого кольору.
Фенол — низькоплавка речовина (tпл = 42 °С).
Помiстимо пробiрку з фенолом у посудину з гарячою водою: речовина розплавиться. У холоднiй водi фенол розчиняється погано, проте швидко розчиняється, якщо добавити в пробiрку з фенолом гарячої води.
XIMIЧHI ВЛАСТИВОСТI. За наявнiстю в молекулi фенолу гiдроксильної групи можна припустити його подiбнiсть до спиртiв, а за наявнiстю бензенового ядра — до бензену. З’ясуємо це.
Реакцiї замiщення. Спершу розглянемо реакцiї фенолу за
гiдроксильною групою.
Пригадайте, як взаємодiє етанол з металiчним натрiєм. Складiть рiвняння реакцiї.
Нагрiємо фенол у пробiрцi до плавлення i помiстимо в нього шматочки металiчного натрiю. Спостерiгається видiлення водню, утворюється також натрiй фенолят у результатi реакцiї замiщення гiдроксильного Гiдрогену на Натрiй:
Натрій фенолят
рюючи фенолят:
фенолят Отже, завдяки впливу бензенового
у
O—H послаблюється порівняно зі спиртом.
данiй реакцiї фенол поводиться як кислота, що нейтралiзує луг, утворюючи сiль i воду. Зважаючи на кислотнi властивостi фенолу, його називають ще карболовою кислотою. Це дуже слабка кислота, навiть слабша за карбонатну. У цьому можна переконатися на дослiдi. До водної емульсiї фенолу добавлятимемо по краплинах розчин лугу — утвориться розчин феноляту. Крiзь порцiю феноляту в пробiрцi пропустимо вуглекислий газ — розчин знову каламутніє, бо видiляється вiльний фенол: C6H5ONa + СО2 + Н2O С6Н5OН + NaHCO3
Отже, фенол — слабша кислота, нiж карбонатна, оскiльки остання витiсняє його з феноляту.
Ми розглянули реакцiї фенолу за гiдроксильною групою. Тепер розглянемо реакцiї за бензеновим ядром.
Ви вже знаєте, що бензен не реагує з бромною водою. Якщо ж до розчину фенолу добавити бромної води, то вiдбудеться реакцiя замiщення (бромування) з утворенням бiлого осаду трибромофенолу:
HC CH C CH CH HC OH | + 3Br2 BrC CBr C CH CBr HC OH | + 3HBr
2,4,6-Трибромофенол У реакцiях фенолу виявляється взаємний уплив атомiв у молекулi. Бензенове ядро так впливає на гiдроксильну групу, що полегшується вiдщеплення гiдроксильного Гiдрогену, i фенол виявляє кислотнi властивостi; гiдроксильна група так впливає на бензенове ядро, що полегшується замiщення атомiв Гiдрогену
60
знезаражування примiщень, хiрургiчних iнструментiв, його добавляють до деяких сортiв мила, ним протравлюють деревину, щоб запобiгти гниттю.
Разом з тим це токсична речовина, що може спричинити опiки шкiри. Оскiльки фенол є продуктом коксохiмiчної промисловостi, то вкупi з iншими промисловими викидами вiн потрапляє в стiчнi води, тим самим забруднюючи навколишнє середовище. Щоб запобiгти цьому, фенол окиснюють до нешкiдливих речовин або видаляють за допомогою розчинникiв.


Висновки

У молекулi фенолу функцiональна гiдроксильна група сполучена безпосередньо з бензеновим ядром. Фенол розчиняється у водi завдяки утворенню водневих зв’язкiв. Фенол
фенол виявляє кислотнi властивостi. Основне промислове джерело фенолу — кам’яновугiльна смола. Фенол — антисептик, але вiн отруйний для людини.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. У чому полягає вiдмiннiсть хiмiчної будови ароматичних спиртiв i фенолiв?
2. Пояснiть розчиннiсть фенолу у водi.
3. Якi реакцiї доводять, що фенол має кислотнi властивостi?
4. У чому полягає уплив гiдроксильної групи на бензенове ядро (порiвняйте з бензеном)?
5. Пояснiть уплив бензенового ядра на гiдроксильну групу (порiвняйте з метанолом).
Додатковi завдання
1. Схарактеризуйте подiбнi хiмiчнi властивостi фенолу й одноатомних спиртiв. До якого типу реакцiй належить реакцiя фенолу з лугом?
2. У трьох пробiрках мiстяться етанол, глiцерол, розчин фенолу. Як розрiзнити вмiст пробiрок за фiзичними властивостями цих сполук?
3. До розчину натрiй феноляту обережно по краплинах добавляють розчин сульфатної кислоти. Розчин каламутнiє. Чому? Складiть рiвняння реакцiї.
4. Обчислiть масу трибромофенолу,
6.
Наприкiнцi вивчення теми ви зможете:

назвати альдегiди i карбоновi кислоти за правилами номенклатури; скласти формули структурних iзомерiв;
описати фiзичнi властивостi сполук, багатоманiтнiсть карбонових кислот; пояснити реакцiйну здатнiсть альдегiдiв i карбонових кислот; записати рiвняння реакцiй окиснення, вiдновлення, нейтралiзацiї, естерифiкацiї, дегiдратацiї, гiдратацiї етину за методом Кучерова; пояснити методи добування сполук; розповiсти про·їхнє застосування; засвоїти термiни: альдегiд, карбонiльна група, альдегiдна група, димер. § 14. АЛЬДЕГІДИ
СКЛАД I БУДОВА МОЛЕКУЛ. До класу альдегідів належать речовини, в молекулах яких функцiональна альдегiдна група O —С—Н сполучена з вуглеводневим залишком (у найпростішого альдегiду — з атомом Гiдрогену). Загальна формула альдегiдiв — CnH2n + 1CHO, або R—CHO. Порiвняно зi спиртами у складi молекул альдегiдiв є на два атоми Гiдрогену менше. Це вiдбивається в назвi «альдегiди», що походить вiд слiв «алкоголь» i «дегiдрування», тобто дегiдрований алкоголь. Назва першого члена гомологiчного ряду — метаналь, або формальдегiд, або мурашиний альдегiд: O
H—C , або H—CHO H
Наступний у гомологiчному ряду — етаналь, або ацетальдегiд, або оцтовий альдегiд: H | O
H—C—C , або СH3—CHO | H H
62
Формули i назви деяких iнших альдегiдiв наведено в табл. 8, модель
молекули етаналю — на мал. 26. Таблиця 8
Характеристики альдегідів Назва
Структурна формула
Температура кипіння, оС
систематична тривіальна
МетанальМурашиний альдегід (формальдегід)
ЕтанальОцтовий альдегід (ацетальдегід)
ПропанальПропіоновий альдегід
БутанальМасляний альдегід
H3C—CH2 H
C H3C—CH2—CH2 H
ФІЗИЧНI ВЛАСТИВОСТI. Альдегiди — леткi рiдини (метаналь — газ). Переважна бiльшiсть їx мають характерний запах. Температури кипiння цих сполук нижчi порiвняно зi спиртами, що засвiдчує вiдсутнiсть мiжмолекулярних водневих зв’язкiв.
Нижчi альдегiди, в яких переважає полярна частина над неполярною (вуглеводневою групою), добре розчиннi у водi, iншi — розчиняються в органiчних розчинниках.
XIMIЧHI ВЛАСТИВОСТI. Реакцiї повного й часткового окиснення. Альдегiди легко вступають у реакцiї окиснення. Повне окиснення (горiння) вiдбувається за схемою: H—C O H + O2 H2O + CO2; H < 0
Часткове окиснення альдегiду можна провести за допомогою купрум(II) гiдроксиду. У пробiрцi добудемо купрум(ІІ) гiдроксид, добавивши до кiлькох
t
CH3 C O H + 2Cu(OH)2 CH3 C O OH + 2CuOH + H2O
Етаналь
Етанова Жовтий
кислота осад 2CuOH Cu2O + H2O
Червонокоричневий осад
Окиснити альдегiд можна й iншим реактивом — амонiаковим розчином аргентум(I) оксиду.
У ретельно вимиту пробiрку наллємо 1 мл амонiакового розчину аргентум(I) оксиду й обережно добавимо кiлька краплин розчину етаналю. Нагрiємо пробiрку в стаканi з гарячою водою. На стiнках посудини осiдає металiчне срiбло (мал. 27). Цю реакцiю називають реакцiєю «срiбного дзеркала»: t СH3 C O H + Ag2O СH3 C O OH + 2Ag NH3 · H2O
Проведенi реакцiї характернi для альдегiдiв i використовують з метою їх аналiтичного визначення.
Реакцiї приєднання. Оскiльки альдегiдна група мiстить подвiйний зв’язок, то можна припустити, що альдегiди вступатимуть у реакцiю приєднання за мiсцем цього зв’язку.
Для якої групи органiчних речовин характернi реакцiї приєднання? Наведiть
рiвняння реакції гiдрування.
Приєднуючи водень, етаналь перетворюється на етанол:
кат. CH3 C O H + H2 CH3—CH2 OH
Етаналь Етанол
Отже, альдегiди вiдновлюються до спиртiв. Крiм того, спирт можна
окиснити до альдегiду.
Мiдний дрiт розжаримо в полум’ї спиртiвки. Коли вiн вкриється мiдною окалиною (CuO), опустимо його в пробiрку з етанолом. Вiдчувається характерний запах етаналю. Звернiть увагу на колiр мiдного дроту — окалина вiдновилася до металiчної мiдi: CH3—CH2 OH +CuO CH3 C O H + Cu + H2O

64
Розглянутi реакцiї окиснення й вiдновлення важливi для здiйснення взаємних перетворень речовин рiзних класiв. ДОБУВАННЯ. Загальний метод добування альдегiдiв — окиснення первинних спиртiв. Етаналь утворюється в результатi окиснення етанолу: [O] CH3—CH2—OH СH3 C O H
Етанол Етаналь Етаналь добувають також гiдратацiєю етину за наявностi каталiзатора — сумiшi сульфатної кислоти й меркурiй(ІІ) сульфату. Цю реакцiю вiдкрив росiйський учений М. Г. Кучеров у 1881 р.:
кат. H2C==CH HC CH + H—OH | H3C—C O H OH
Етин Етаналь Реакцiя вiдбувається через утворення промiжного продукту — вiнiлового спирту. Проте сполука з гiдроксигрупою бiля атома, сполученого подвiйним зв’язком, є нестiйкою, через те вiдбувається її iзомеризацiя в альдегiд. ЗАСТОСУВАННЯ. Водний розчин метаналю (формальдегiду, 36—37 %-й) з домiшкою метанолу називають формалiном i застосовують як дезiнфiкційний засiб i консервант анатомiчних препаратiв. Формальдегiд є також сировиною для виробництва фенолоформальдегiдних пластмас. З формальдегiду добувають уротропiн (гексаметилентетрамiн), який використовують у виробництвi пластмас, вибухiвки та як лiкарський засiб: Ця сполука вiдома як харчова добавка (консервант Е 239), однак її використання в Українi заборонено. Етаналь


Висновки

оксиду використовують для аналiтичного визначення альдегiдiв.

1. Яку функцiональну
2. Чим зумовлена хiмiчна активнiсть альдегiдiв?
3. Наведiть рiвняння реакцiй приєднання
групi.
4. До яких сполук вiдбувається повне й часткове окиснення альдегiдiв? Складiть рiвняння реакцiй.
5. Сума коефiцiвнтiв у рiвняннi повного окиснення пропаналю становить А 9 Б 10 В 11 Г 12
6. Якi реакцiї використовують для розпiзнавання альдегiдiв?
7. Що таке реакцiя Кучерова? Як вона вiдбувається? Додатковi завдання
1. Чому в назвах альдегiдiв не зазначають мiсце функцiональної групи?
2. Пояснiть, чому рiзняться мiж собою температури кипiння сполук, що мають близькi вiдноснi молекулярнi маси: пентан — 36 °С, бутаналь — 79 °С, бутан-1-ол — 117,4 °С.
3. Складiть рiвняння реакцiй за схемою: CH3—CH2—OH
4. Як хiмiчним способом розрiзнити
5.
6.
КИСЛОТИ
СКЛАД I БУДОВА МОЛЕКУЛ. Вам вiдомо, що до карбонових кислот належать сполуки, в молекулах яких вуглеводнева група сполучена з
функціональною (характеристичною) карбоксильною груnою —C O OH
Пригадайте, що її назва походить вiд
груп, з яких вона склада-
єтся: карбонільної —C O та гідроксильної —OH. Залежно вiд кiлькостi карбоксильних груп у молекулi розрiзняють одно-, дво-, багатоосновнi карбоновi кислоти; залежно вiд будови вуглеводневого ланцюга — насиченi, ненасиченi, ароматичнi кислоти.
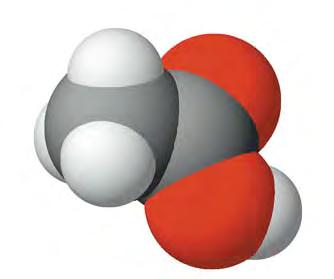
Розглянемо насиченi одноосновнi карбоновi кислоти (їxні характеристики наведено в таблицi 9, масштабну модель молекули етанової кислоти — на мал. 28).
Загальна формула цих сполук:
CnH2n + 1COOH, або R—C O OH
У найпростiшiй карбоновiй кислотi — метановiй (мурашинiй) карбоксильна група сполучена з атомом Гiдрогену (табл. 9).
НОМЕНКЛАТУРА, ІЗОМЕРIЯ. Тривiальнi назви карбонових кислот часто вiдбивають їхнє походження, а за систематичною номенклатурою назви утворюють вiд назв вуглеводнiв додаванням суфiкса -ов-, закiнчення -а та слова кислота.
Пригадайте з курсу xiмiї 9 класу, де в природi, побутi трапляються карбоновi кислоти. Карбоновим
67
ряду за стандартних умов — рiдини з рiзким кислим запахом, добре розчиннi у водi; наступнi шiсть — oлiїcтi рiдини з неприємним запахом; починаючи з кислоти з десятьма атомами Карбону в молекулi, — твердi речовини (табл. 9, мал. 29). Розчиннiсть карбонових кислот у водi зменшується зi зростанням вiдносної молекулярної маси, вищi карбоновi кислоти нерозчиннi у водi. Таблиця 9
Характеристики насичених одноосновних карбонових кислот Назва
систематичнатривіальна
Температура, оС
Структурна формула
МетановаМурашина (форміатна) H—C O OH 8101
ЕтановаОцтова
ПропановаПропіонова
БутановаМасляна
ПентановаВалеріанова
ГексановаКапронова
ГептановаЕнантова
H3C—C O OH 17118
H3C—CH2 C O OH –21141
H3C—(CH2)2 C O OH –5—8164
H3C—(CH2)3 C O OH –35185
H3C—(CH2)4 C O OH 3—4205
H3C—(CH2)5 C O OH 7—10223
ГексадекановаПальмітинова H3C—(CH2)14 C O OH 62—64215
ОктадекановаСтеаринова
H3C—(CH2)16 C O OH 69—70232

Мал. 29. Чиста («льодяна»)
етанова кислота замерзає
Порiвнюючи температури кипiння карбонових кислот i близьких за вiдносними молекулярними масами спиртiв, можна виявити, що
кислоти киплять за значно вищих температур, отже, вони ще бiльше асоцiйованi, нiж спирти. Справдi, водневi зв’язки мiж молекулами карбо-
нових кислот установлюються за двома центрами, в результатi чого утворюються димери:
R— C O HO C O... OH —R
На розривання таких зв’язкiв i руйнування асоцiатiв треба затратити додаткову енергiю, що спричиняє пiдвищення температур кипiння цих сполук.
XIMIЧHI ВЛАСТИВОСТI. Електролiтична дисоцiацiя. Хiмiчнi властивостi карбонових кислот визначаються наявнiстю функцiональної карбоксильної групи, в якiй електронна густина хiмiчного зв’язку С==О змiщується до атома Оксигену, внаслiдок чого зв’ язок O—Н поляризується i атом Гiдрогену набуває здатностi вiдщеплюватися:
Це зумовлює кислотнi властивостi карбонових кислот. Їxнi розчини мають кислий смак, змiнюють забарвлення iндикаторiв, що засвiдчує перебiг електролiтичної дисоцiацiї.
У двi пробiрки наллємо розчин етанової кислоти об’ємом 1—2 мл. В одну з них добавимо кiлька краплин розчину лакмусу, в iншу — розчин метилового оранжевого. Спостерiгаємо змiну забарвлення iндикаторiв.
Карбоновi кислоти (крiм метанової) — слабкi електролiти, мають низькi ступенi дисоцiацiї (див. табл. 9). Через те в рiвняннях йонних реакцiй формули карбонових кислот записують у молекулярнiй формi.
Реакцiї повного й часткового окиснення. Як вам уже вiдомо, карбоновi кислоти можуть утворюватися в результатi окиснення вуглеводнiв, спиртiв, альдегiдiв, проте самi вони (за винятком метанової) стiйкi проти окисникiв. Реакцiї з
69
У пробiрку з розчином етанової кислоти добавляли порошок магнiю або вмiщували в неї стружку магнiю. Спостерiгали видiлення газу.
Складiть рiвняння реакцiї.
У пробiрку з розчином натрiй гiдроксиду об’ємом 1—2 мл добавляли кiлька краплин фенолфталеїну. До забарвленого розчину по краплинах добавляли розчин етанової кислоти до знебарвлення вмiсту пробiрки.
Що засвiдчує цей дослiд? Складiть рiвняння реакцiї.
З побуту вам вiдома взаємодiя питної соди з оцтом. Пояснiть реакцiю, що вiдбувається. Складiть рiвняння реакції.
Реакцiя естерифiкацiї. Карбоновi кислоти реагують зi спиртами. За нагрiвання та наявностi каталiзатора (сульфатної кислоти) вiдбувається реакцiя естерифiкацiї.
До cyмiшi етанолу iз сульфатною кислотою добавимо етанової кислоти i сумiш нагрiємо. Пошириться приємний запах, що засвiдчує утворення речовини, яка належить до класу естерiв:
кат.
CH3COOH + HO—CH2—CH3 CH3 C O O—CH2—CH3 + H2O
Етиловий естер етанової кислоти ДОБУВАННЯ. Загальний спосiб добування карбонових кислот — окиснення первинних спиртiв та альдегiдiв такими окисниками, як калiй перманганат, калiй дихромат, нiтратна кислота:
[O] [O] R—OH R C O OH R—C O H R—C O OH
Спирт Карбонова кислота Альдегід Карбонова кислота
Складіть рівняння реакцій із конкретними речовинами.
З курсу хімії 9 класу вам відомо, що карбонові кислоти дуже поширені в природі, вони містяться у фруктах, овочах, молочнокислих продуктах, їх використовують як харчові добавки. Лабораторний дослід 1 Виявлення карбонових

1. Якi сполуки належать до класу карбонових кислот?
2. Складiть формули iзомерiв масляної кислоти.
3. Пояснiть утворення водневих зв’язкiв мiж молекулами карбонових кислот.
4. Натрiєву сiль трихлороетанової кислоти CCl3COOH використовують як гербiцид. Складiть формулу цiєї сполуки.
5. У яких реакцiях карбоновi кислоти поводяться подiбно до неорганiчних? Складiть рiвняння реакцiй.
6. Етанова кислота витискує карбонатну кислоту з її солей. Про що це свiдчить?
Складiть рiвняння реакцiї.
Додаткові завдання
1. Пояснiть вiдношення карбонових
i вiдновникiв. Складiть рiвняння реакцiй.
2. Карбоновi кислоти можна добути
А гiдруванням етену
Б окисненням естерів В дегiдратацiєю спиртiв
Г окисненням альдегiдiв
3. Складiть рiвняння за схемою таких хiмiчних перетворень: Етанол Етаналь
4. Обчисліть об’єм вуглекислого газу (н. у), що утвориться внаслідок взаємодії оцтової кислоти
Висновки ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ



ЕСТЕРИ
Наприкiнцi вивчення теми ви зможете:

назвати естери за правилами номенклатури; скласти формули естерiв, жирiв;
описати фiзичнi властивостi сполук;
записати рiвняння реакцiй естерифiкацiї та гiдролiзу естерiв, омилення й
гiдрування жирiв; пояснити роль жирiв у харчуваннi людини; розповiсти про застосування сполук; порiвняти мило i синтетичнi мийнi засоби; засвоїти термiни: реакції естерифiкації, омилення, синтетичнi мийнi засоби, детергенти.
СКЛАД I БУДОВА МОЛЕКУЛ ECTEPIB. Загальна формула естерiв R O || C O R1 , група O || C O R1 — це функцiональна естерна група (мал. 30).
Естерам властивi структурна iзомерiя карбонового скелета й iзомерiя мiж класами сполук естери — карбоновi кислоти. Наприклад: 3 2 1
H3C—CH2 C O O H3C—CH2—CH2 C O O —CH2—CH3 —CH3
Етилпропаноат Метилбутаноат (етиловий естер пропанової кислоти) (метиловий естер бутанової кислоти) 5 4 3 2 1 H3C—CH2—CH2—CH2 C O O—H
Пентанова кислота
Назви естерiв за систематичною номенклатурою утворюють вiд назви карбонового ланцюга, що мiстить естерну групу (нумерацiя — вiд естерної групи), додаванням назви алкiльної групи (префiкс) та суфiкса -оат-. Iнакше кажучи, префiкс походить вiд назви спирту, а корiнь — вiд назви карбонової
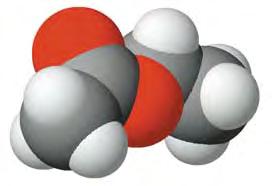
Назва
систематична тривіальна
Метилметаноат
Характеристики естерів
Структурна формула
Таблиця 10
Температура,оC
Метиловий естер мурашиної
кислоти
Етилметаноат Етиловий естер мурашиної кислоти
Пропілметаноат Пропіловий естер мурашиної кислоти H—C O O—CH2—CH2—CH3 –9381
Метилетаноат
Етилетаноат
Метиловий естер оцтової кислоти H3C—C O O—CH3
Етиловий естер оцтової кислоти H3C—C O O—CH2—CH3 –8477
Запах фруктiв, квiтiв зумовлюється переважно естерами (мал. 31). Деякi рослини, наприклад ясенець, видiляють таку велику кiлькiсть естерiв, що навколо рослини утворюється естерна хмаринка. Оскiльки естери — легкозаймистi речовини, то якщо пiднести полум’я до цiєї хмаринки, вона швидко займеться й згорить, не встигши пiдпалити саму рослину. Подiбне явище описане в бiблiйнiй оповiдi про неопалиму купину — кущ, який горить i не згоряє. РЕАКЦIЯ ЕСТЕРИФIКАЦIЇ. Реакцiю мiж карбоновою кислотою i спиртом, унаслiдок

Ця реакцiя оборотна: одночасно з естерифiкацiєю вiдбувається взаємодiя естеру з водою, або гiдролiз (розклад
естеру на спирт i кислоту. Пiсля встановлення рiвноваги в сумiшi мiстяться кислота, спирт, естер i вода.
Пригадайте, що таке хiмiчна рiвновага. За яких умов вона встановлюється?
Оборотнiсть реакцiї становить певну незручнiсть для добування естерiв. З метою збiльшення виходу продукту реакцiї треба змiстити її рiвновагу в потрiбному напрямку. Для цього можна збiльшувати концентрацiю однiєї з вихiдних речовин. Можна також видаляти iз зони реакцiї один iз продуктiв, тим самим стимулюючи його утворення. Для відокремлення естеру його вiдганяють, а воду видаляють за допомогою осушувальних засобiв.
Тепер уявiмо, що наша мета — добути кислоту з естеру за допомогою реакцiї гiдролiзу. Для цього треба хiмiчно зв’язати кислоту або спирт, щоб вони не вступали в реакцiю естерифiкацiї, i тим самим змiстити рiвновагу реакцiї лiворуч. Для зв’язування кислоти можна використати луг, з яким реагуватиме кислота, утворюючи сiль: H3C—C O O—C2H5 + NaOH H3C—C O ONa + C2H5—OH
Спирт можна вiдокремити перегонкою, а кислоту добути iз солi дiєю сильнiшої кислоти, що витiсняє етанову з її солей: H3C—COONa + HCl Н3С—СООН+
74
том глiцеролом i вищими карбоновими кислотами — стеариновою, пальмiтиновою, олеїновою та iншими.
У загальному виглядi реакцiя естерифiкацiї з утворенням жиру записується так:
H2C—O—H + HO—COR H2C—O—COR | |
HC—O—H + HO—COR
HC—O—COR + 3H2O | |
H2C—O—H + HO—COR H2C—O—COR
Глiцерол Карбонова кислота
Жир (триглiцерид)
Кулестержневу модель молекули тристеарину наведено на мал. 32. У першiй чвертi XIX ст. французький учений М. Шеврель установив хiмiчний склад жирiв, а перший синтез жироподiбної речовини здiйснив
його спiввiтчизник М. Бертло (1854 р.), нагрiваючи глiцерол зi стеариновою кислотою. Властивостi жирiв залежать вiд складу i будови карбонових ланцюгiв триглiцеридiв. Нижче наведено температури плавлення деяких жирiв: Вуглеводнева група Жир tпл, oC —С15Н31 Трипальмiтин 72 —С17Н35 Тристеарин 65 —С17H33 Триолеiн –4
Пригадайте
подвійний
у вуглеводневій групі?
Пояснiть, як залежить агрегатний стан жиру вiд характеру (насиченостi чи ненасиченостi) карбонового ланцюга.
Пригадайте з вивченого в 9 класi, що таке oлiї.
Бiльшiсть натуральних жирiв складаються iз сумiшi глiцеридiв, тому не мають точки плавления, а плавляться в певному iнтервалi температур, тобто поступово розм’якшуються пiд дiєю нагрiвання.
Цiкаво, що до складу молекул жиру морських тварин входять за-
лишки ненасичених карбонових кислот.
До складу вершкового масла входять
змiшанi естери насичених i ненасичених кислот (мал. 33).
XIMIЧHI ВЛАСТИВОСТI ЖИРIВ.
Реакцiї окиснення. На повiтрi, пiд
дiєю теплоти i свiтла жири окиснюються
до жирних кислот, альдегiдiв, iнших спо-
лук, що й зумовлюють появу неприємних
запаху i смаку.
75

Реакцiя гiдрування. У молекулах рiдких жирiв за мiсцем подвiйних карбон-карбонових зв’язкiв можлива реакцiя приєднання Гiдрогену. У результатi цiєї реакцiї ненасичена сполука перетворюється на насичену, а рiдкий жир — на твердий. Пригадайте, як вiдбувається реакцiя гiдрування етену. Складiть рiвняння реакцiї.
Гiдрування (тверднення) жирiв вiдбувається за такою схемою:
H2C—O—CO—C17H33
H2C—O—CO—C17H35 | |
HC—O—CO— C17H33 + 3H2
HC— O—CO—C17H35 | |
H2C—O—CO—C17H33
H2C—O—CO—C17H35
Триолеїн Тристеарин На цьому процесi ґрунтується виробництво маргарину (вiд грец. маргароу — перлина).
Пiдготуйте повiдомлення про виробництво маргарину.
Реакцiя гiдролiзу. Жири як естери зазнають гiдролiзу, в результатi утворюються глiцерол і карбоновi кислоти.
Складiть рiвняння гiдролiзу жиру (у загальному виглядi).
Практичне значения має гiдролiз жиру в присутностi лугу, внаслiдок чого утворюються солi вищих карбонових кислот — мила: H2C—O—CO—C17H35
H2C—OH | |
HC—O—CO— C17H35 + 3NaOH HC— OH + 3C17H35—COONa | | H2C—O—CO—C17H35 H2C—OH Тристеарин Глiцерол

Мал. 34. Так виготовляли мило в 1600 р.

35. Фасування мила
Туалетне мило відрізняється від господарського наявністю добавок: барвників, ароматизаторів, антисептиків тощо. Процес виготовлення мила відомий людям здавна (мал. 34, 35). Миловаріння полягало в нагріванні тваринного жиру (сала) з поташем (K2CO3), що його вимивали з рослинного попелу. Повторити цей стародавній процес ви зможете в лабораторії, спостерігаючи демонстраційний дослід. Естери утворюються в результатi реакцiї
промисловостi.


Висновки

Жири — це естери глiцеролу й вищих карбонових кислот.
Твердi жири утворюються насиченими карбоновими кислотами, рiдкi — ненасиченими.

Жири вступають у реакцiї окиснення, гiдрування, гiдролiзу. У результатi омилення жирiв утворюється мило. ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Яка реакцiя називається реакцiєю естерифiкацiї?
2. За яких умов можна змiстити рiвновагу реакцiї естерифiкацiї у бiк утворення: естеру; кислоти i спирту?
3. Пояснiть хiмiчну будову жирiв.
4. Чим рiзняться за складом рiдкi й твердi жири?
5. Якi речовини
6.
7.
ВУГЛЕВОДИ
Наприкiнцi вивчення теми ви зможете:

класифiкувати вуглеводи;
скласти формули найважливiших вуглеводiв; порiвняти хiмiчну будову крохмалю й целюлози;
описати фiзичнi властивостi сполук;
записати рiвняння реакцiй окиснення, вiдновлення, бродiння, естерифiкацiї, гiдолiзу вуглеводiв; розповiсти про застосування сполук; засвоїти термiни: моно-, ди-, полiсахариди, штучний шовк
Вуглеводи — найпоширенiший клас природних органiчних сполук i важливий компонент органiзмiв, джерело їхньої енергiї та будiвельний матерiал. Ви вже знаєте про походження назви вуглеводи, хiмiчний склад i деякi властивостi глюкози, сахарози, крохмалю, целюлози. Тепер розглянемо цi сполуки докладнiше. Передусiм пригадайте, як у природi утворюється глюкоза. Процес фотосинтезу вiдбувається в рослинних клiтинах пiд дією сонячної енергiї та за участі зеленого пiгменту хлорофiлу, що
процес фотосинтезу виражають хiмiчним рiвнянням: сонячне свiтло 6СО2 + 6H2O C6H12O6 + 6O2 Глюкоза У рослинах iз глюкози утворюються сахароза, крохмаль, целюлоза. КЛАСИФIКАЦIЯ ВУГЛЕВОДIВ. Залежно вiд складу вуглеводи
подiляють на такi групи:
моносахариди, або простi вуглеводи (до них належать глюкоза, фруктоза, рибоза);
олiгосахариди можна розглядати як продукти сполучення кiлькох молекул моносахаридiв. Найважливiшими з них є дисахариди (сахароза, лактоза);
полiсахариди — полiмернi сполуки, продукти конденсацiї великої кiлькостi молекул моносахаридiв. Належнiсть сполук до класу вуглеводiв пiдкреслюється в їxнiй назвi закiнченням -оза.
С6Н12О6. У молекулi глюкози мiстяться п’ять гiдроксильних груп і одна альдегідна група: H H H OH H
78
У рiвняннях хiмiчних реакцiй глюкозу прийнято зображувати у спрощеному виглядi: НОСН2—(СНОН)4—СНО. ФIЗИЧНI ВЛАСТИВОСТI. Глюкоза — безбарвна кристалiчна речовина, добре розчинна у водi, солодка на смак (пригадайте походження термiна глюкоза). У вiльному станi мiститься в багатьох фруктах, зокрема у виноградi (звiдси походить iнша назва глюкози — виноградний цукор), у меду, є вона й у корiннi, листках i квiтах рослин, у кровi людини i тварин (близько 0,1 %).
XIMIЧHI ВЛАСТИВОСТI. Внаслiдок повного окиснення глюкози сильними окисниками вона перетворюється на вуглекислий газ i воду.
С6Н12O6 + 6O2 6СО2 + 6Н2O; Н < 0
Оскiльки молекула глюкози мiстить функцiональнi альдегiдну й гiдроксильнi групи, можна припустити, що ця речовина вступатиме в реакцiї, характернi для альдегiдiв i
багатоатомних спиртiв. Унаслiдок вiдновлення альдегiдної групи до спиртової утворюється шестиатомний спирт сорбiт: [H]
HOCH2—(CHOH)4 C O H HOCH2—(CHOH)4—CH2—OH Сорбiт
Ця сполука є замiнником цукру в дiєтi хворих на дiабет.
Як альдегiд глюкоза реагує з амонiаковим розчином аргентум(I) оксиду (реакцiя «срiбного дзеркала») — альдегiдна група окиснюється до карбоксильної й утворюється глюконова кислота: t
HOCH2—(CHOH)4 C O H + Ag2O
HOCH2—(CHOH)4 C O + 2Ag OH
Глюконова кислота
Як альдегiд глюкоза окиснюється й у результатi нагрiвання з купрум(ІІ) гiдроксидом.
Складiть рiвняння цiєї реакцiї за аналогiєю з альдегiдами. З купрум(ІІ) гiдроксидом глюкоза реагує як
спирт. Лабораторний дослід 2 Окиснення глюкози купрум(II) гiдроксидом У пробiрку з кількома
сульфату добавте 1 мл розчину натрiй гiдроксиду. Спостерiгайте утворення осаду купрум(ІІ) гiдроксиду. До осаду добавте розчин
79
щеплюються. Зокрема, пiд дiєю ферментiв дрiжджiв і без доступу повiтря глюкоза перетворюється на етиловий спирт — вiдбувається спиртове бродiння:
С6Н12О6 2С2Н5ОН + 2СО2 Етанол
Процеси бродiння дуже поширенi у природi; залежно вiд кiнцевого продукту є бродiння спиртове, оцтовокисле, молочнокисле та iншi види. Оцтовокисле бродiння має мiсце пiд час скисания вина — утворюється оцтова кислота. Скисания молока, квашення капусти, силосування зелених кормiв для худоби — все це приклади молочнокислого бродiння, в результатi якого утворюється молочна кислота: С6Н12О6 2СН3—CН—СОOH | OH
Молочна кислота ДОБУВАННЯ І ЗАСТОСУВАННЯ. Глюкозу добувають як продукт кислотного гiдролiзу полiсахаридiв, наприклад крохмалю.
Складiть розповiдь про застосування глюкози як поживної речовини, зокрема в медицинi.
У природі поширений інший моносахарид — фруктоза, що є структурним ізомером глюкози. Як ізомери ці сполуки мають таку саму молекулярну формулу — С6Н12О6 і різняться між собою хімічною будовою. Для фруктози ми її не розглядаємо.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Який зв’язок iснує мiж назвою i смаком глюкози?
2. Яка функцiональна група визначає властивість глюкози вступати в реакцiї окиснення й вiдновлення? Які продукти утворюються?
3. До яких сполук окиснюється й вiдновлюється глюкоза?
4. У чому полягає подiбнiсть глюкози i: глiцеролу; етаналю? Як довести цю подiбнiсть експериментально?
5. Пiд дією яких речовин вiдбувається реакцiя бродiння? Вiд чого залежить її напрямок?
6. Яке бiологiчне значення реакцiї повного окиснення глюкози?
7. У процесi спиртового бродiння глюкози масою 200 г утворився вуглекислий газ об’ємом 44,8 л. Визначте

цього навчального закладу. Працював у галузі електрохімії та хімічної технології. Досліджував електроліз розчинів неорганічних і органічних сполук,

XIMIЧHI ВЛАСТИВОСТI. Реакцiя повного окиснення. Сахароза окиснюється з утворенням вуглекислого газу i води: С12Н22O11 + 12O2 12СО2 + 11Н2O Реакцiя гiдролiзу. Пiд дiєю неорганiчних
сахароза гiдролiзує до глюкози i фруктози. Прокип’ятимо розчин сахарози
невеликою кiлькiстю сульфатної кислоти, нейтралiзуємо кислоту лугом i розчин нагрiємо з купрум(ІІ) гiдроксидом. Утворюється червоний осад
оксиду. Ця реакцiя засвiдчує наявнiсть альдегiдної групи, отже, можна припустити, що серед продуктiв гiдролiзу є глюкоза: H2O С12Н22О11 С6Н12О6 + С6Н12О6 Сахароза Глюкоза Фруктоза

Доведено, що середньорiчне споживання людиною цукру становить близько 30 кг. Оскiльки сахароза — цiнний харчовий продукт, її добувають у великiй кiлькостi.
Свiтове виробництво цукру перевищує 50 млн тонн на рiк. Україна виробляє
кiлька мiльйонiв тонн цукру на рiк iз цукрового буряку (мал. 36, 37).
Добування цукру полягає в його видiленнi з природної сировини, очищеннi й кристалiзацiї продукту. Пригадайте з курсу xiмiї 9 класу основнi стадiї виробництва цукру. Складiть загальну схему виробництва.

1.
2.
3.
4.

§ 19. КРОХМАЛЬ
СКЛАД I БУДОВА МОЛЕКУЛИ. Склад молекули крохмалю вiдповiдає формулi (C6H10O5)n. Це природний полiмер, полiсахарид, що синтезується в рослинах з глюкози за такою сумарною реакцiєю: nС6Н12О6 (С6Н10О5)n + nН2О Глюкоза Крохмаль Мономерною ланкою цього полiмеру є залишок глюкози.
Крохмаль — не однорiдна речовина, а сумiш полiмерiв двох типiв: амiлози (25 % ) та амiлопектину (75 % ). Амiлоза має лiнiйнi молекули зi ступенем полiмеризацiї п = 200—1200, а амiлопектин — розгалуженi (п = 600—6 000) (мал. 38).
XIMIЧHI ВЛАСТИВОСТI Реакцiя riдролiзу Накопичений рослинами крохмаль розщеплюється пiд дiєю ферментiв (ферментативний гiдролiз) з утворенням глюкози, а в результатi окиснення останньої вивiльняється енергiя. Процес гiдролiзу можна вiдтворити в лабораторiї, прокип’ятивши крохмаль iз водою за наявностi сульфатної кислоти.
До кожної мономерної ланки полiмерного ланцюга крохмалю приєднується молекула води, полiмерний ланцюг розривається й утворюються молекули глюкози: (С6Н10O5)n + nН2O nС6Н12О6, або ... —С6Н10О5—С6Н10О5—С6Н10О5—... nС6Н12О6 Н—ОН Н—ОН Н—ОН

82
Наведене рiвняння — сумарне. Насправдi гiдролiз вiдбувається послiдовно, з утворенням промiжних продуктiв — декстринiв, що мають меншу, нiж у крохмалю, молекулярну масу. Цей процес вiдбувається пiд час приготування їжi: варiння й смаження картоплi, випiкання хлiба тощо. Пiд час прасування накрохмаленої бiлизни крохмаль також частково гiдролiзує з утворенням декстринiв. Декстрини легше, нiж крохмаль, засвоюються органiзмом. Сумiш продуктiв часткового гiдролiзу (декстринiв i глюкози) називають патокою. ДОБУВАННЯ I ЗАСТОСУВАННЯ. Крохмаль видiляють механiчним способом iз крохмалевмiсних продуктiв (злакiв, картоплi). Пiсля подрiбнення сировини її обробяють водою, вiдцiджують i добуту суспензiю
вiдстоюють; далi продукт вiдокремлюють вiд води i висушують.
Промiжнi продукти гiдролiзу крохмалю — сумiш декстринiв i глюкози (патоку) використовують у кондитерськiй промисловостi для виготовлення цукерок, добавляють у тiсто для печива.
Крохмаль є сировиною для виробництва етилового спирту. З цiєю метою крохмаль пiддають гiдролiзу, в результатi утворюється глюкоза, яка далi внаслідок спиртового бродiння перетворюється на етанол.
Складiть рiвняння послiдовних реакцiй. У текстильнiй промисловостi крохмаль використовують для проклеювання тканин, у паперовiй — для склеювання паперу й картону, в медицинi — для виготовлення присипок, паст, капсул для лiкарських препаратiв.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Пояснiть, як утворюється крохмаль у рослинах.
2. Пояснiть, чому крохмаль належить до полiсахаридiв.
3. Чи можна стверджувати, що крохмаль — однорiдна речовина? Чому?
4. За яких умов можливий гiдролiз крохмалю?
5. Які сполуки утворюються в результаті гiдролiзу крохмалю?
6. Що таке декстрини?
7. Якi процеси вiдбуваються пiд час приготування крохмалевмiсної їжi?
8. Пригадайте з вивченого в 9 класі реакцiю йоду з крохмалем. У чому її особливості?
9. Вдома випробуйте на наявнiсть крохмалю: свiжi зрiзи картоплини i зеленого яблука, варену ковбасу, плавлений сир, борошно, печиво, зубний порошок, косметичну пудру тощо. Зробiть висновки.
10. «Крохмаль є клiтинним паливом органiзму людини». Пояснiть це твердження. 11. На яких
83
Вам вiдома також iнша назва целюлози — клiтковина.
Пригадайте або з’ясуйте за словником походження слова «целюлоза».
Складiть розповiдь про поширення целюлози у природi.
Молекули целюлози ниткоподiбнi, лiнiйнi, вона має волокнисту структуру.
XIMIЧHI ВЛАСТИВОСТI. Реакцiя повного окиснення. Целюлоза горить з утворенням вуглекислого газу та води i видiленням енергiї: (С6Н10O5)n + 6nO2 6nСО2 + 5nН2O; Н < 0
Пiд час спалювання деревини, хмизу, соломи тощо вiдбувається саме ця реакцiя. Реакцiя гiдролiзу. Як i крохмаль, целюлоза зазнає гiдролiзу пiд час нагрiвання з розбавленими кислотами, перетворюючись на глюкозу. Сумарне рiвняння реакцiї: (С6Н10O5)n + nH2O nС6H12О6
В органiзмi людини целюлоза, спожита з рослинною їжею, не гiдролiзується, отже, не засвоюється.
Пригадайте, якi тварини здатнi перетравлювати целюлозу.
Целюлоза зазнає часткового гiдролiзу пiд час силосування соломи, кукурудзи тощо, такi продукти є цiнним кормом для сiльськогосподарських тварин.
Реакцiя розкладу. У результатi нагрiвання деревини без доступу повiтря вiдбувається розклад целюлози з
утворенням деревного вугiлля, метанолу та iнших цiнних оксигеновмiсних сполук: t (С6Н10O5)n Деревне вугiлля, вода, оксигеновмiснi органiчнi сполуки (метиловий спирт, ацетон, етанова кислота та iн.) Штучний шовк. Нинi природнi волокнистi матерiали не можуть задовольнити зрослi потреби людства, тому широко використовують їxнi замiнники, добутi штучно. Серед них — штучний шовк (віскозу, ацетатний шовк), що його виробляють iз целюлози, видiленої з деревини або вiдходiв бавовнику. Для переробки целюлози на волокно її переводять у розчинну форму, наприклад
триацетат: OCOCH3 C6H7O2 OCOCH3 n OCOCH3 Триетаноат целюлози

84
випаровується, а триацетат перетворюється на тонкi нитки, що є основою
для скручування товстіших ниток, з яких виробляють тканини.
БIОЛОГIЧНЕ ЗНАЧЕННЯ ВУГЛЕВОДIВ. Вуглеводи виконують
важливi функцiї у живих органiзмах. З глюкози та iнших моносахаридiв, що утворюються в результатi фотосинтезу, в рослинах синтезуються полiсахариди крохмаль (енергетичний резерв) i целюлоза (будiвельний матерiал клiтин).
Вуглеводи посiдають чiльне мiсце в рацiонi людини, це клiтинне паливо органiзму. Сахароза i крохмаль, спожитi у виглядi їжi, пiд дiєю ферментiв розщеплюються в органiзмi до глюкози, а вже вона окиснюється в клiтинах з вивiльненням енергiї. Сумарно цей процес можна описати рiвнянням:
С6Н12O6 + 6O2 6СO2 + 6Н2O; Н = –2,87 · 103 кДж/моль Надлишки глюкози вiдкладаються в печiнцi у виглядi «запасного» вуглеводню глiкогену, близького за структурою до крохмалю. Якщо людина витрачає енергiю, наприклад пiд час фiзичних чи розумових навантажень, то глiкоген знову перетворюється на глюкозу, яка живить органiзм. Кожен грам вуглеводiв у результатi окиснення в органiзмi дає 19,2 кДж енергiї. Отже, крохмаль — запасна речовина рослин, а тварини запасають енергiю у виглядi глiкогену. На думку фахiвцiв, енергетичнi потреби людини на 60 % мають задовольнятися внаслідок уживання рослинної їжi, зокрема овочiв i фруктiв.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Чим рiзняться мiж собою крохмаль i целюлоза: за складом і будовою молекул?
2. Якi продукти утворюються внаслідок термiчного розкладу целюлози?
3. На якiй реакцiї целюлози ґрунтується виробництво штучного волокна?
4. Позначте назви речовин у схемi реакцiї:
гiдролiз бродiння окиснення 1 2 3 4 А 1 — метан, 2 — етанол, 3 — глюкоза, 4 — вуглекислий газ Б 1 — глюкоза, 2 — сахароза, 3 — етанол, 4 — метан В 1 — целюлоза, 2 — глюкоза, 3 — етанол, 4 — вуглекислий газ
Додатковi завдання
1. Пояснiть класифiкацiю вуглеводiв. Наведiть приклади.
2. Як за допомогою одного й того самого реактиву можна розпiзнати сахарозу й глюкозу?
3. Якi з вивчених вуглеводiв дають реакцiю «срiбного дзеркала»? Що це засвiдчує?
4. Яку спiльну властивiсть мають олiго- i полiсахариди?
5. Яке значення реакцiй гiдролiзу вуглеводiв? Вiдповiдь пояснiть.
6. Складiть рiвняння
10. Чи можна дрова назвати бiопаливом?
11. Унаслiдок окиснення жирiв у органiзмi видiляється вдвiчi бiльше енергiї, нiж пiд час окиснення вуглеводiв. Яке значення це має для пiдтримання нормальної маси тiла?
12. Визначте речовини, що утворюються за схемою перетворень: фотосинтез бродiння (О) СО2 + Н2О А Б В У природi вуглеводи утворюються завдяки реакцiї фотосинтезу. Вуглеводи подiляються на моно-, олiго- та полiсахариди. Глюкоза — моносахарид. Загальна фомула — С6Н12O6


Висновки

Глюкоза вступає в реакцiї окиснення й вiдновлення, естерифiкації, бродiння.
Фруктоза — iзомер глюкози.
Сахароза — дисахарид, загальна формула — С12Н22O11
У результатi гiдролiзу сахарози утворюються глюкоза i фруктоза.
Крохмаль i целюлоза — природнi полiмери, полiсахариди. Загальна формула цих сполук — (С6Н10O5)n.
Крохмаль i целюлоза рiзняться мiж собою будовою молекул, ступенем полiмеризацiї.
Крохмаль — неоднорiдна сполука; вiн складається з амiлози й амiлопектину.
Промiжнi продукти гiдролiзу крохмалю — декстрини, кiнцевий продукт — глюкоза.
Целюлоза вступає в реакцiї окиснення, гiдролiзу (до глюкози), термiчного розкладу.
Естери целюлози є основою виробництва штучних волокон.
Вуглеводи — цiннi поживнi речовини.
Практична робота
Розв’язування експериментальних задач
Задача 1. Доведiть експериментально, що в пронумерованих пробiрках мiститься: а) глiцерол; б) глюкоза.
Складiть перелiк реактивiв та
обладнання, потрiбних для виконання
дослiдiв. Напишiть рiвняння реакцiй.
Задача 2. Доведiть експериментально, що етанова кислота належить
до слабких кислот.
Складiть перелiк реактивiв та
обладнання, потрiбних для виконання дослiдiв. Напишiть рiвняння реакцiй.
Задача 3. Визначте хiмiчним способом, у якiй з виданих вам пробiрок мiститься крохмальний клейстер.
Складiть перелiк реактивiв та
перелiк реактивiв та обладнання, потрiбних для виконання дослiдiв. Напишiть рiвняння реакцiй.


Багато органiчних речовин мiстять крiм Карбону, Гiдрогену, Оксигену ще й Нiтроген. З курсiв xiмiї та бiологiї 9 класу ви можете пригадати, що Нiтроген входить до складу таких важливих сполук, як амiнокислоти, бiлки, нуклеїновi кислоти. Важливими для людини є й амiни, з яких ви розпочнете вивчення нової теми.
Пригадайте:
що таке функціональна (характеристична) група;
які функціональні групи входять до складу амінокислот;
як амінокислоти сполучаються між собою, утворюючи білки; яке біологічне значення амінокислот і білків.
Наприкiнцi вивчення теми ви зможете:

назвати сполуки за правилами номенклатури; скласти формули структурних iзомерiв амiнiв, амiнокислот; пояснити будову амiнiв i амiнокислот;
пояснити рiвнi структурної органiзацiї бiлкiв; описати фiзичнi властивостi сполук; записати рiвняння реакцiй амiнiв як основ i амiнокислот як амфотерних сполук; пояснити роль амiнокислот i бiлкiв у харчуваннi людини; розповiсти про добування та застосування сполук; засвоїти термiни: анiлiн, анiлiновi барвники, бiполярний iон
§ 21. АМIНИ. AHIЛIH
87
або кiлька атомiв Гiдрогену замiщенi на алкiльнi групи. Залежно вiд числа замiщених атомiв розрiзняють первиннi, вториннi та третиннi амiни: H—N—H H3C—N—CH3 H3C—N—CH3 | | | CH3 H CH3
Первинний амiн Вторинний амiн Третинний амiн Електронна формула метанамiну CH3—NH2: H ..
H3C:N:H ..
Атом Нiтрогену має неподiлену пару електронiв, що впливає на властивостi речовини. НОМЕНКЛАТУРА. IЗОМЕРIЯ. Назви первинних амiнiв утворюють поеднанням назви алкану та слова амiн, перед яким цифрою позначають мiсце амiногрупи. Назви вторинних i третинних амiнiв не розглядаємо. 3 2 1 3 2 H3C CH2 CH2—NH2 H3C CH—NH2 | 1CH3
Пропан-1-амін Пропан-2-амін Ми розглядатимемо первиннi амiни, загальна формула яких R—NH2. R — вуглеводнева група насиченого ряду; такі аміни називають аліфатичними. ФІЗИЧНI ВЛАСТИВОСТI. Серед амiнiв є гази, рiдини, твердi речовини. Нижчi амiни мають запах амонiаку, розчиннi у водi. Первинні аміни утворюють водневі зв’язки, тому їхні температури кипіння значно вищі, ніж у вторинних і третинних амінів.
Складіть схеми утворення водневих зв’язків між молекулами метанаміну. Характеристики деяких амiнiв наведено в таблицi 11, модель молекули метанаміну — на мал. 40.
Таблиця 11
Характеристики амінів
Назва Структурна формулаТемпература кипіння, оС Метанамін H3C—NH2 –6,5
ЕтанамінC2H5—NH2 17 Пропан-1-амінC3H7—NH2 48 Бутан-1-амін C4H9—NH2 78
XIMIЧHI ВЛАСТИВОСТI
го газу, води й азоту: 4CH3—NH2 + 9O2 4СО2 + 10Н2O + 2N2 Метанамiн
Мал. 40. Масштабна модель молекули метанамiну
Реакцiї амiнiв як основ. Амiни взаємодiють з
водою. Перевiримо це на дослiдi. До розчину метанамiну додамо фенолфталеїн — вiн забарвлюється в малиновий колiр. Отже, розчин має лужнi властивостi:
CН3 — NН2 + H2O [CH3 — NН3]+ + OH–Метанамонiй гiдроксид
Завдяки наявностi неподiленої пари електронiв амiни реагують з кислотами. Якщо до отвору газовiдвiдної трубки, з якої видiляється метанамiн, пiднести склянку з хлоридною кислотою або скляну паличку, змочену цiєю кислотою, то можна спостерiгати утворення бiлої хмаринки солi: .. Н3C — NН2 + H+Cl– [Н3C — NН3]+ Cl–Метанамоній хлорид Реакцiї амiнiв пiдтверджують, що вони мають основнi властивостi; через це амiни називають органiчними основами. AHIЛIH. СКЛАД I БУДОВА МОЛЕКУЛИ. У разi якщо амiногрупа сполучена з бензеновим ядром, то утворюється ароматичний амiн фенiламiн, або анiлiн (мал. 41): , або скорочено C6H5—NH2.
HC CH CH CH C HC NH2
За фiзичними властивостями анiлiн — безбарвна олiїста рiдина, малорозчинна у водi. XIMIЧHI ВЛАСТИВОСТI анiлiну дещо вiдмiннi вiд властивостей алiфатичних амiнiв. Випробування розчинами фенолфталеїну i фiолетового лакмусу засвiдчують, що анiлiн не змiнює забарвлення iндикаторiв. Вiн реагує лише iз сильними кислотами, утворюючи солi: C6H5—NH2 + HCl [С6Н5—NН3]+Cl–Фенiламонiй хлорид Iз цього можна зробити висновок, що анiлiн — слабкiша основа, нiж алiфатичнi амiни. Така вiдмiннiсть хiмiчної поведiнки, як ви вже знаєте, пояснюється будовою молекули. Очевидно, наявнiсть у молекулi анiлiну бензенового ядра спричиняє послабления основних
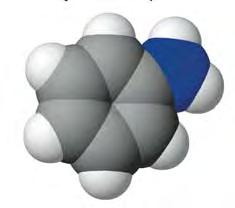
Мал. 41. Масштабна модель молекули анiлiну
Отже, реакції аніліну пiдтверджують, що завдяки впливу амiногрупи анiлiн реагує з бромною водою; водночас через вплив бензенового ядра послаблюються основнi властивостi анiлiну порiвняно з алiфатичними амiнами.
Зважаючи на велике теоретичне й практичне значения анiлiну, розглянемо докладнiше його добування i застосування.
ДОБУВАННЯ AHIЛIHУ. Основний спосiб добування анiлiну — вiдновлення нiтробензену воднем за температури 250 — 350 °С та наявностi каталiзатора:
HC CH CH CH C HC NO2 + 3H2
t, кат.
HC CH CH CH C HC NH2 + 2H2O
Нітробензен Вiдновлення можна також проводити металiчними залiзом, цинком, оловом у середовищi хлоридної кислоти.
Уперше синтез анiлiну з нiтробензену здiйснив росiйський учений М. М. Зiнiн у 1842 р., тому реакцiю називають реакцiєю Зiнiна. Вiдтодi анiлiн став легкодоступною сировиною для виробництва великої кiлькостi рiзноманiтних органiчних речовин.


Микола Миколайович ЗIНIН (1812—1880)
Росiйський хiмiк,

ЗАСТОСУВАННЯ. Анiлiн вiдiграв винятково важливу роль у розвитку синтетичної органiчної xiмiї та хiмiчної промисловостi, зокрема виробництва анiлiнових барвникiв і лiкарських засобiв. Сама назва анiлiну пов’язана з барвниками, його вперше було видiлено з продуктiв розкладу iндиго — синього барвника рослинного походження (від португ. anil — iндиго, що означає блакитний) (мал. 42). Першi синтетичнi барвники мовеїн (фiолетового кольору) та фуксин (червоного кольору) було добуто в результатi хiмiчних перетворень з анiлiну. Поступово вiн ставав основною сировиною для синтезу iнших барвникiв, що дiстали назву анiлiнових. Розвиток анiлiнофарбової промисловостi потребував великої кiлькостi анiлiну як вихiдної сировини. Найдешевший спосiб його добування — з бензену, оскiльки бензен є одним iз продуктiв переробки
кам’яного вугiлля. У результатi реакцiї нiтрування бензену утворюється
нiтробензен, який за реакцiєю Зiнiна вiдновлюється до анiлiну.
Склався такий ланцюг перетворень:
Кам’яне вугiлля Продукти коксування Бензен Нiтробензен
Анiлiн Синтетичнi анiлiновi барвники.
У цьому ланцюзi тiсно переплелися теорiя й практика, наука i потреби промисловостi. Розвиток теоретичних уявлень про взаємозв’язок мiж будовою та властивостями органiчних речовин сприяв з’ясуванню Андрiй Іванович КIПРIАНОВ (1896—1972) Український хiмiк-органiк, академiк.


91
будови барвникiв, вiдкрив шлях для їх синтезу та широкого використання. У свою чергу, розвиток хiмiчних виробництв стимулював розвиток теоретичної органiчної xiмії. Згодом було розроблено теорiю кольоровостi органiчних речовин, що пов’язує їхнiй колiр та електронну будову. У розробцi теорії кольоровостi значна роль належить українським ученим, зокрема А. І. Кiпрiанову та його учням. Застосування цiєї тeopiї уможливило розв’язування таких важливих практичних завдань, як синтез текстильних барвникiв заданого кольору, а також створення свiтлочутливих матерiалiв для виробництва кольорових фото- та кiноплiвок.
Пошуки дешевої сировини для промисловостi сприяли досконалому вивченню складу продуктiв переробки кам’яного вугiлля, серед яких було виявлено багато цiнних сполук, що також використовуються в органiчному синтезi. Анiлiнофарбова промисловiсть потребувала й неорганiчних речовин, зокрема кислот i лугiв. Цi потреби стимулювали паралельний розвиток неорганiчного синтезу. Анiлiн прислужився не лише промисловостi барвникiв, а й фармацевтичнiй промисловостi. Сам анiлiн чинить жарознижувальну й знеболювальну дiї, проте не використовується як лiкарський засiб через високу токсичнiсть, а серед похiдних анiлiну є багато лiкiв. Структура анiлiну лежить в основi т. зв. сульфамiдних препаратiв, як вiдомi вам лiки бiсептол, бiлий стрептоцид та багато iнших.
HC==CH O || H2N—C C—S—NH2 || HC—CH O
Бiлий стрептоцид
Створення нового лiкарського засобу — надзвичайно копiтка праця. Iз десяткiв тисяч сполук лише кiлька можуть виявити фармакологiчну активнiсть, а увiйти в медичну практику — лише одиницi. Пошукова робота потребує участi висококвалiфiкованих фахiвцiв — хiмiкiв-синтетикiв, бiохiмiкiв, фармакологiв, хiмiотерапевтiв, представникiв технiчних спецiальностей (мал. 43).
Українськi вченi мають досягнення в синтезi медичних препаратiв. Популярний нинi протигрипозний засiб ремантадин було створено
участі українських хiмiкiв.
Мал. 43. Лікарські засоби є продуктами багатоступеневого синтезу
92


Висновки

Амiни мiстять функцiональну амiногрупу —NH2, сполучену з вуглеводневою групою.
Через наявнiсть неподiленої пари електронiв у атома Нiтрогену алiфатичні
амiни виявляють основнi властивостi й реагують з кислотами i водою.
Амiни насиченого ряду — сильнiшi основи, а анiлiн — слабша основа.
Анiлiн виявляє властивостi, зумовленi взаємним упливом амiногрупи та бензенового ядра: не дiє на iндикатори, реагує лише із сильними кислотами, а також із бромною водою. Основний спосiб добування амiнiв

1. Якi сполуки належать до класу амiнiв?
2. Наведiть приклади ізомерних амінів.
3. Чим зумовлена здатнiсть метанамiну розчинятися у водi?
4. Як вiдбуваються реакцiї горiння амiнiв?
5. Як вiдбувається реакцiя метанамiну з хлоридною кислотою?
6. Як позначається на хiмiчних властивостях анiлiну
ядро?
7. Пояснiть вплив бензенового ядра на амiногрупу в молекулi анiлiну.
8. Схарактеризуйте значення реакцiї Зiнiна.
9. Яку роль вiдiграв анiлiн у розвитку хiмiчної промисловостi?
10. Порiвняйте галузi застосування анiлiну й фенолу.
11. Пояснiть на прикладi виробництва анiлiнових барвникiв, як ви розумiєте взаємозв’язок теорiї i практики. Додатковi завдання
1. Складiть формули iзомерiв бутанамiну.
2. Пояснiть, чому амiни виявляють властивостi основ.
3. Складiть порiвняльну таблицю хiмiчних властивостей аніліну й метанамiну.
4. Солi амiнiв мiстяться в оселедцевому розсолi. Обробивши його лугом, можна видiлити сумiш амiнiв i використовувати їx для дослiдiв. Складiть у загальному виглядi рiвняння реакцiї, про яку йдеться.
5. Підготуйте повідомлення про лікарські
6. Назвiть
8.
§ 22. АМIНОКИСЛОТИ
СКЛАД I БУДОВА МОЛЕКУЛ. З курсiв бiологiї i xiмiї 9 класу вам вiдомо про роль амiнокислот i бiлкiв у життєдiяльностi органiзмiв, про хiмiчний склад цих сполук. Коротко нагадаємо про це. Молекули амiнокислот мiстять двi функцiональнi групи: карбоксильну —СООН та амiногрупу —NH2.
СН2 СООН | NH2
Амiноетанова (амiнооцтова) кислота (глiцин) За складом амiнокислоти дуже рiзномантнi, можуть мiстити двi карбоксильнi групи або двi амiногрупи, фенiльну (—С6Н5), гiдроксильну (—ОН), сульфiдну (—S—) та iншi групи. Приклади деяких представникiв амiнокислот наведено в таблицi 12. Таблиця 12 Представники амінокислот
Назва
Структурна формула систематичнатривіальна АміноетановаГліцин (амінооцтова)H2N—CH2—COOH
2-Амінопропанова
3-Амінопропанова
2-Аміно-3метилбутанова
2,6-Діаміногексанова
2-Аміно-3-гідроксипропанова
2-Аміно-3сульфанілпропанова
2-Амінопентадіова
-Аланін
(-амінопропіонова)
-Аланін (-амінопропіонова)
Валін (-аміноізовалеріанова)
Лізин (-, -діамінокапронова)
Серин (-аміно-гідроксипропіонова)
Цистеїн (-аміно-меркаптопропіонова)
Глутамінова кислота (-аміноглутарова)
НОМЕНКЛАТУРА. ІЗОМЕРIЯ.
H3C—CH—COOH | NH2
H2C—CH2—COOH | NH2
CH3 | H3C—CH—CH—COOH | NH2
H2N—(CH2)4—CH—COOH | NH2
HO—CH2—CH—COOH | NH2
HS—CH2—CH—COOH | NH2
HOOC—CH2—CH2—CH—COOH | NH2
за систематичною номенклатурою утворюють вiд
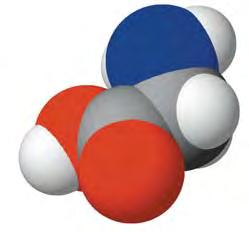
44. Масштабні
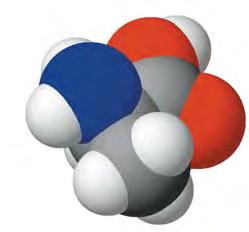
вiд атома Карбону карбоксильної групи) додаванням префiкса амiно-, суфiкса -ова i слова кислота. Перед назвою цифрами позначають положення замiсникiв (у т. ч. й амiногрупи) в абетковому порядку. За традицiйною номенклатурою до назв вiдповiдних карбонових кислот додають префiкс амiно-. Мiсце амiногрупи вiдносно карбоксильної групи позначають лiтерами грецького алфавiту: , , , , (аланiн — -амiнопропанова кислота). Для амiнокислот, що входять до складу бiлкiв, як правило, використовують тривiальнi назви, причому скороченi, в т. ч. й у латинському написаннi: глiцин — глi, Gly; аланiн — ала, Ala; цистеїн — цис, Cys i т. д. Масштабнi моделi молекул глiцину й аланiну наведено на мал. 44. Амiнокислотам властивi структурна iзомерiя карбонового скелета та iзомерiя положення амiногрупи. Складiть формули структурних iзомерiв -амiнобутанової кислоти й назвiть їx за систематичною номенклатурою.
ФIЗИЧНI ВЛАСТИВОСТI. Амiнокислоти на вiдмiну вiд амiнiв та карбонових кислот — кристалiчнi речовини, що мають високi температури плавления, розчиняються у водi, добре кристалiзуються. Цим властивостям бiльшою мiрою вiдповiдає структура амiнокислот як «внутрiшнiх солей», тому формули амiнокислот прийнято записувати у виглядi бiполярного йона: .. + H2N—CH2—COOH H3N—CH2—COO–
XIMIЧHI ВЛАСТИВОСТI
Зважаючи на наявнiсть карбоксильних та амiногруп, можна припустити, що розчини амiнокислот дiють на iндикатори. Результат такої дiї залежить вiд того, якi групи переважають у молекулi амiнокислоти. Розчин амiноетанової кислоти H2N—CH2—COOH нейтральний, а розчин лiзину H2N—(CH2)4—CH(NH2)—COOH має лужну реакцiю. PEAKЦIЇ З КИСЛОТАМИ I ЛУГАМИ. Поєднуючи в собi протилежнi за характером основнi й кислотнi групи, амiнокислоти
H2N—CH2—COOH + HCl (Н3N—СН2—СООН)+Cl–Гідрогенхлоридна сiль глiцину
95
H2N—CH2—COOH + NaOH H2N—CH2—COONa + Н2O Натрiева сiль глiцину
Пригадайте, в чому полягають особливостi неорганiчних амфотерних сполук, наведiть приклади реакцiй. Найважливiшою особливiстю амiнокислот є взаємодiя молекул мiж собою. У реакцiю вступають протилежнi за функцiями групи: карбоксильна група однiєї молекули та амiногрупа — iншої. Унаслiдок реакцiї утворюються ди-, три-, ... , полiпептиди i видiляється вода: O H O || | || H2N—CH2—C—OH + H—N—CH2—C—OH O H O || | || H2N—CH2 C—N—CH2—C—OH + H2O O H Дипептид || | Зв’язок C—N називається пептидним
96
ЗНАЧЕННЯ. До складу бiлкiв входять 20 -амiнокислот, причому 8 з них належать до незамiнних. Що це означає? Тодi як рослини синтезують yci необхiднi їм амiнокислоти з поживних речовин, природа не надiлила такою здатнiстю людину i тварин. Лише деякi необхiднi для життєдiяльностi амiнокислоти органiзм може виробляти самостiйно, iншi ж мають надходити з їжею. Нестача незамiнних амiнокислот призводить до патологiчних процесiв у органiзмi.
З курсу бiологiї вам вiдоме значення амiнокислот. Яким має бути склад їжi, щоб органiзм отримував yci необхiднi амiнокислоти?
Хворим, виснаженим людям iнодi вводять амiнокислоти у кров, тим самим полегшується їx засвоення i пiдтримуються сили органiзму. Деякi амiнокислоти є лiками.
Для вiдгодiвлi сiльськогосподарських тварин використовують синтетичнi амiнокислоти.
Амiнокислоти добувають також гiдролiзом бiлкiв (для цього використовують вiдходи м’ясної промисловостi).
Деякi мiкроорганiзми здатнi виробляти амiнокислоти. На цьому ґрунтується мiкробiологiчний метод виробництва кормового лiзину.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Чи можна скласти загальну формулу амiнокислот?
2. Як утворюється бiполярний iон амiнокислоти?
3. Схарактеризуйте фiзичнi властивостi амiнокислот як йонних сполук.
4. Пояснiть дiю амiнокислот на iндикатори.
5. Схарактеризуйте амiнокислоти як амфотернi сполуки.
6. У якi реакцiї вступають амiнокислоти за: амiногрупою; карбоксильною групою? Складiть рiвняння вiдповiдних реакцiй.
7. Як утворюється пептидний зв’язок?
8. Складiть формулу трипептиду, утвореного будь-якими амiнокислотами, наведеними в таблицi 12.
9. Чому амiнокислоти називають «цеглинками» бiлкiв?
§ 23. БIЛКИ
СКЛАД I БУДОВА. Думку про те, що амiнокислоти є «цеглинками», з яких побудованi бiлки, уперше висловив видатний український бiохiмiк i хiмiк Iван Якович Горбачевський. Автором полiпептидної meopiї будови бiлкiв є видатний нiмецький хiмiк Е. Фiшер. На початку ХХ ст. вiн синтезував першi полiпептиди (прийнято, що полiпептиди мiстять


учений, академiк. Народився
Українi, працював у Вiднi, Празi, професор, ректор Українського вiльного унiверситету в Празi. Науковi працi стосуються органiчної xiмiї та бioxiмiї. Уперше синтезував сечову кислоту i з’ясував шляхи її утворення в органiзмi. Висловив думку про амiнокислотний склад бiлкiв. Уперше видiлив чистi нуклеїновi кислоти iз тваринних органiзмiв. Зробив внесок у розвиток української наукової термiнології. Автор пiдручникiв xiмiї українською мовою.
етилену чи целюлози бiлки мають сталий склад i певне значення вiдносної молекулярної маси. Для вивчених бiлкiв можна скласти загальну формулу, наприклад для бiлка гемоглобiну — це C3032H4816Fe4N780O872S8. Замiна хоча б однiєї амiнокислоти в полiмерному ланцюзi на iншу амiнокислоту має серйознi наслiдки для його функцiонування в органiзмi. Розрiзняють чотири рiвнi структурної органiзацiї бiлкiв — первинну, вторинну, третинну i четвертинну (мал. 46).
Первинну структуру зумовлює
послiдовнiсть сполучення амiнокислотних залишкiв у молекулi бiлка.
Самi амiнокислоти дуже рiзняться за складом, мiстять рiзнi за електронегативнiстю атоми Гiдрогену, Оксигену, Нiтрогену, Сульфуру. Цi атоми взаємодiють мiж собою, «змушуючи» полiпептидний ланцюг вигинатися i набувати просторової будови. Завдяки утворенню водневих зв’язкiв мiж пептидними групами певнi дiлянки бiлка можуть скручуватися у формi спiралi (вторинна структура бiлкiв).
Мiж дiлянками полiмерного ланцюга, де є залишки сульфуровмiсних амiнокислот, можуть утворюватися дисульфiднi мiстки, а мiж карбоксильними та амiногрупами — сольовi мiстки (мал. 47).
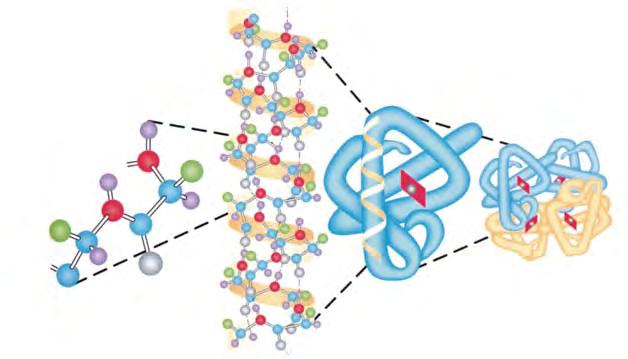
Як наслiдок вiдбувається специфiчна просторова орiєнтацiя
полiмерного ланцюга, яка й зумовлює третинну структуру бiлка.
Деякi бiлки характеризуються четвертинною структурою. У бiлку гемоглобiнi (вiд грец. гема — кров i лат. globus — куля) цю структуру утворюють чотири макромолекули, певним чином зорiєнтованi одна вiдносно одної. У складi кожної мiститься йон Fe2+. Чотирма рiвнями структурної органiзацiї характеризується бiлок волосся -кератин: це суперспiраль, що нагадує багатожильний кабель.
Через складнiсть будови вивчати бiлки надзвичайно важко. ВЛАСТИВОСТI. Денатурацiя. Нагрiємо розчин бiлка курячого яйця i спостерiгатимемо, як вiн зсiдається, або денатурує (вiд лат. denaturare — втрата природних якостей). Саме цей процес денатурацiї ви спостерiгаєте пiд час приготування їжi з м’яса, яєць, риби.
З хiмiчного боку денатурацiю спричиняє руйнування слабких мiжмолекулярних зв’язкiв, а отже, вторинної i третинної структур. Бiлок втрачає властиву йому просторову будову та залежнi вiд неї функцiї (мал. 48). У результатi денатурацiї бiлки втрачають бiологiчну активнiсть, живi клiтини гинуть. Саме тому висока температура тiла, дiя агресив-

48. Денатурацiя бiлка Мал. 47. Хiмiчнi зв’язки в молекулах бiлкiв: 1 — пептиднi; 2 — йоннi; 3 — водневi; 4 — неполярнi; 5 — дисульфiднi СOOH

Емiль Герман ФIШЕР (1852—1919)

хiмiк, член
академiї наук. Науковi працi присвячено xiмiї фiзiологiчно активних речовин. Синтезував низку вуглеводiв, зокрема глюкозу й фруктозу. Встановив, що амiнокислоти сполучаються мiж собою за допомогою пептидних зв’язкiв з утворенням полiпептидiв, уперше добув дипептид. Лауреат Нобелiвської npeмii 1902 р.
них хiмiчних сполук на шкiру, яка має бiлкову природу, небезпечнi для органiзму. За певних умов можливе відновлення початкової структури білка (ренатурація).
Гiдролiз. Це процес, зворотний утворенню полiпептидного ланцюга. Пiд час гiдролiзу молекули води приєднуються за мiсцем пептидних зв’язкiв, утворюються карбокси- та амiногрупи. Внаслiдок цього бiлок розщеплюється на амiнокислоти, з яких вiн побудований: H O H O H O | || | || | || … —N—CH2 C N— CH2 C N— CH2 C— … HO—H HO H HO H HO—H O || 3H2N— CH2 C OH
Процес гiдролiзу вiдбувається пiд час нагрiвання бiлкiв з розчинами кислот i лугiв, у живому органiзмi — пiд дiєю ферментiв.
Розклад. Процес вiдбувається пiд дiєю мiкроорганiзмiв, а продукти розкладу — амонiак, сiрководень, фенол, iншi речовини — мають неприємний запах, знайомий вам iз побуту (протухлi яйце, м’ясо чи риба).
До яких способiв вдаються, щоб запобiгти розкладу бiлкiв у складi їжi?
Для аналiтичного виявлення бiлкiв використовують т. зв. кольоровi реакцiї
Лабораторний дослід 3 Біуретова реакцiя
До розчину бiлка курячого
100
Мал. 49. Спiввiдношення поживних речовин у разі збалансованого харчування
Поява жовтого забарвлення в результатi реакцiї бiлка з концентрованою нiтратною кислотою (ксантопротеїнова реакцiя) свiдчить про наявнiсть бензенових ядер у структурi бiлка, червоно-фiолетове забарвлення бiлка в результатi дiї купрум(ІІ) гiдроксиду (бiуретова реакцiя) засвiдчує наявнiсть пептидних зв’язкiв. БIОЛОГIЧНЕ ЗНАЧЕННЯ АМIНОКИСЛОТ I БIЛКIВ. Бiлки є основним будiвельним матерiалом тваринних органiзмiв, а саме їx клiтин. М’язи, гемоглобiн кровi, волосся, шкiра, ферменти мають бiлкову природу.
Властивi кожному органiзму бiлки будуються з тих, що надходять з їжею (мал. 49). Проте бiлки їжi безпосередньо не засвоюються органiзмом, спершу вони гiдролiзують до амiнокислот пiд дiєю речовин, що мiстяться у травному трактi, потiм амiнокислоти всмоктуються у кров, а вже з нею переносяться до клiтин органiзму, де синтезуються властивi йому бiлки. Проблема синтезу бiлкiв in vitro давно цiкавить учених, хоча досягнення в цiй галузi незначнi: добуто лише окремi бiлки нескладної будови. Причину цього ви, напевне, можете пояснити самi. Певний поступ спостерiгається завдяки автоматизацiї процесiв синтезу. Значно бiльших успiхiв досягнуто в розробцi методiв мiкробiологiчного
синтезу бiлкiв. Розвинулася нова галузь виробництва — бiотехнологiя, що включає промисловi методи, в яких використовують живi органiзми (переважно мiкроорганiзми) та бiологiчнi процеси.
Виготовлення дрiжджового тiста, вина, пива, оцту, кисломолочних продуктiв також належить до бiотехнологiчних процесiв, оскiльки вiдбувається за участі мiкроорганiзмiв (мал. 50).
Унаслiдок здатностi деяких мiкроорганiзмiв швидко розмножуватися можна нарощувати значну бiомасу впродовж короткого часу. До того ж використовується дешева сировина, оскiльки живильним середовищем для мiкроорганiзмiв можуть бути неочищенi вуглеводнi нафти, солома, лузга насiння, тирса, вiдходи бродильної та целюлозної промисловостi тощо. Сучасна мiкробiологiчна промисловiсть виробляє бiлковi добавки до тваринного корму, вiтамiни, антибiотики, ферменти та багато iнших

мiкроорганiзмiв, то її вiдходи, потрапляючи у водойми, ґрунт, можуть завдавати шкоди природним угiддям, порушувати баланс природних процесiв. Щоб запобiгти цьому, слiд дотримуватися високої культури виробництва, за якої апаратура для вирощування мiкроорганiзмiв надiйно герметизується, а вiдходи знешкоджуються. ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ

1. Яка хiмiчна будова бiлкiв?
2. Пояснiть причини багатоманiтностi бiлкiв.
3. Якi чинники визначають первинну, вторинну, третинну i четвертинну структури бiлка?
4. Схарактеризуйте термiчну стiйкiсть бiлкiв.
5. Пояснiть хiмiзм процесiв гiдролiзу i розкладу бiлкiв.
6. Схарактеризуйте бiологiчне значення бiлкiв. Додатковi завдання
1. Пояснiть, як будова амiнокислот позначається на їxнix властивостях.
2. Зробiть припущення про хiмiчнi властивостi серину.
3. У чому полягає складнiсть вивчення структури бiлкiв?
4. Схарактеризуйте значення процесу гiдролiзу бiлкiв, жирiв, вуглеводiв для функцiонування органiзму.
5. Чи можна повнiстю замiнити бiлкову їжу на вуглеводну? Чому? Уci амiнокислоти мiстять карбоксильну групу та амiногрупу. Деякi амiнокислоти мiстять iншi функцiональнi групи. Амiнокислоти — амфотернi сполуки. Найважливiша властивiсть


Висновки



ВИСОКОМОЛЕКУЛЯРНІ
Розрiзняють полiмери натуральнi (природнi), штучнi та синтетичнi. Серед органiчних речовин, що ви їх вивчали, були представники ycix цих
груп. До перших належать полiсахариди, бiлки, нуклеїновi кислоти — їx створює сама природа без втручання людини. Другi — це видозмiненi
природнi полiмери, наприклад штучний шовк, добутий iз целюлози.
Третi є продуктами органiчного синтезу, вони утворюються з речовин неполiмерної будови, наприклад полiетилен.
Пригадайте:
що таке реакція полiмеризацiї;
як називають вихiднi низькомолекулярнi речовини в реакцiї полiмеризацiї;
як називають групи атомiв, що повторюються i становлять основу хiмiчної
будови полiмерного ланцюга; що таке ступiнь полiмеризацiї.

Наприкiнцi вивчення теми ви зможете:
назвати найважливiшi полiмери; скласти їxнi загальнi формули; навести приклади пластичних мас, синтетичних волокон, синтетичних каучукiв; класифiкувати полiмери; пояснити застосування синтетичних високомолекулярних сполук; порiвняти натуральнi й синтетичнi волокна, природний i синтетичний каучуки; засвоїти термiни: термопластичнi, термореактивнi полiмери, вулканiзацiя каучуку, полiамiднi волокна
ПЛАСТИЧНI МАСИ
БУДОВА ПОЛIМЕРIВ. За будовою полiмерного ланцюга розрiзняють
лiнiйнi, розгалуженi й просторовi (сiтчастi) полiмери (мал. 51). До перших належать полiетилен, полiпропiлен i целюлоза. Лiнiйну й розгалужену будову має крохмаль, сiтчасту — вулканiзований каучук.
Залежно вiд розмiщення бiчних відгалужень чи функцiональних груп у полiмерному ланцюзi розрiзняють регулярнi (переважно стереорегулярнi) та нерегулярнi полiмери. Наприклад, у ланцюзi полiпропiлену метильнi групи можуть розмiщуватися з одного чи з двох бокiв карбонового ланцюга. Розмiщення з рiзних бокiв може чергуватися через однаковi промiжки або бути хаотичним (мал. 52).
CH3 CH3
H C H C H C H C H C H C H C H C H C
H H H H H
H CH3 H CH3 H C H C H C H C H C C H C CH3 C H C CH3 C H
104
Характеризуючи будову полiмерiв, слiд брати до уваги також
взаємодiю мiж полiмерними ланцюгами в масi полiмеру. Мiж молекулами значної довжини виникає взаємодiя, в т. ч. встановлюються водневi зв’язки.
Ступiнь полiмеризацiї, розгалуженiсть, упорядкованiсть структури, мiжмолекулярнi зв’язки — все це позначається на властивостях полiмерiв.
ВЛАСТИВОСТI полiмерiв залежать вiд наявностi в речовинi молекул рiзної довжини, а отже, рiзної маси. Насамперед це стосується плавлення полiмерiв. Процес плавления має свої особливостi, зумовленi взаємодiєю мiж молекулами, що мають значну довжину. У процесi нагрiвання в розплавлений стан спершу переходять коротшi молекули, потiм — довшi, отже, плавлення вiдбувається в широкому дiапазонi температур. За вiдношенням до нагрiвання полiмери подiляються на двi групи: термопластичнi й термореактивнi.
Термопластичнi полiмери пiд час нагрiвання розм’якшуються, в цьому станi їм можна надати будь-якої форми, що зберiгається й пiсля охолодження. Важливо, що цей процес є оборотним, тобто сформований полiмер можна знову нагрiти й надати йому iншої форми. Iнакше кажучи, термопластичнi полiмери не втрачають пластичностi за багаторазового нагрiвання.
На вiдмiну вiд них термореактивнi полiмери внаслідок нагрiвання втрачають пластичнiсть, i пiсля тверднення їх неможливо повернути до початкового стану.
Утилiзацiя полiмерiв має важливе екологiчне та економiчне значення. Схарактеризуйте з цих позицiй термопластичнi й термореактивнi полiмери.
Полiмери регулярної будови i просторовi мають бiльшу механiчну мiцнiсть i хiмiчну стiйкiсть.
Пiд дією зовнiшнiх чинникiв (нагрiвання, paдiaцiї, свiтла, вологи, механiчного напруження тощо) може вiдбуватися деструкцiя (вiд лат. destructio — руйнування) полiмеру з розриванням хiмiчних зв’язкiв у макромолекулах. Цей процес призводить до старiння полiмерiв, вони стають непридатними до експлуатацiї. ПЛАСТИЧНI МАСИ. Щоб виготовити пластмасу, до полiмерної маси добавляють спецiальнi речовини.
Мал. 53. Виготовлення пластмасових виробiв методом лиття
З’ясуйте, з якою метою використовують у пластмасах пластифiкатори, стабiлiзатори, пiноутворювачi, антиоксиданти, антистатики, наповнювачi, пiгменти.
Цiннi властивостi пластмас: низька густина (легкiсть) i теплопровiднiсть,
Мал. 54. «Витягування» полiмерних ланцюгiв
виготовлення плiвок i волокон
хiмiчна стiйкiсть, здатнiсть до забарвлювання, високi оптичнi якостi, а також можливiсть змiнювати цi властивостi в широких межах унаслiдок змiни структури полiмерiв роблять їx використання економiчно вигiдним i зручним.
Виготовлення пластмасових виробiв
вiдзначається технiчною й технологiчною простотою — вiд складних за формою до плiвок (мал. 53, 54, 55).
Зразки виробiв iз пластмас зображено на мал. 56.
Полiетилен (—CH2—CH2—)n добувають у промисловостi полiмеризацiєю етилену (етену), яку можна проводити за рiзних умов — високого i низького тиску. Властивостi полiмерiв залежать вiд умов добування.
Полiетилен низького тиску (0,2—2,5 МПа, 80—100 °С) має лiнiйну структуру, молекули в масi полiмеру щiльно упакованi, через те зростає ступiнь кристалiчностi. Полiетилен високого тиску (150—300 МПа, 200—280 оС)
має розгалужену структуру.
Полiетилен — тверда речовина бiлого кольору, легко забарвлюється в рiзнi кольори, не тоне у водi. Полiетилен високого тиску плавиться за температури 102—105 °С, низького — 125—137 оС.
За хiмiчною будовою полiетилен подiбний до парафiну — сумiшi вищих вуглеводнiв складу С18—С35. Пригадайте, що у структурi таких ре-


106
човин повторюються групи —СН2—СН2—. Цим пояснюється подiбнiсть речовин: полiетилен масний на дотик, як i парафiн. Як i насиченi вуглеводнi, полiетилен не проводить електричного струму, стiйкий проти дiї кислот, лугiв, бромної води, окисникiв. Полiетилен — термопластичний полiмер. У розплавленому станi йому можна надати будь-якої форми, що зберiгається пiсля охолодження.
Завдяки описаним властивостям полiетилен набув широкого застосування.
Наведiть приклади застосування полiетилену, вiдомi вам з побуту.
Полiпропiлен дуже близький за властивостям до полi-
етилену. Фрагмент ланцюга цього полiмеру можна подати такою структурною формулою:
За фрагментом молекули полiпропiлену визначте мономер, мономерну ланку полiмеру; напишiть їxнi структурнi формули.
За участі каталiзаторiв добувають полiпропiлен стереорегулярної будови (див. мал. 52). Цей полiмер високомiцний, тому з нього виготовляють деталi машин, труби, плiвку, риболовнi сiтки, побутовi вироби, волокна. Недолiками його є чутливiсть до свiтла, кисню, крихкiсть на холодi.
Полiхлоровiнiл добувають з хлоровiнiлу: n(CH2==CH) —CH2—CH— n | | Cl Cl
Пластмаси, що їх вироблено на основi полiхлорвiнiлу, використовують як замiнники шкiри, з них виготовляють газо- й водогiннi труби, технiчнi волокна, лiнолеум, клейонку тощо. Цi матерiали стiйкi проти дiї кислот, лугiв, легко забарвлюються i водночас важко займаються, здатнi до самогасiння.
(колишня назва — стирол): CH==CH2 (—CH2—CH—)n | CH3 —CH2—CH— n | C6H5
Якими властивостями, на вашу думку, зумовлене використання полiхлорвiнiлу для виготовлення лiнолеуму?
Полістирен (полістирол) — полімер стирену
Це термопластичний матерiал, хiмiчно стiйкий, дiелектрик, хоча досить крихкий. З нього виготовляють пакувальні, оздоблювальнi матерiали тощо (мал. 57).
Полiметилметакрилат — полiмер, який добувають з метилового естеру метакрилової кислоти.
107

H2C==CH—C O OH H2C==C—C O OH | CH3
Акрилова кислота Метакрилова кислота COOCH3 | H2C==C—C O O—CH3 (—CH2—C— )n | | CH3 CH3
Метиловий естер метакрилової кислоти
Поліметилметакрилат
Завдяки своїй прозоростi цей полiмер дiстав назву «органiчне скло» (iнша назва — «плексиглас»). Вiн стiйкий проти ударiв, тому ним склять вiкна автомобiлiв, iлюмiнатори лiтакiв, теплоходiв, виготовляють скло для годинникiв тощо (мал. 58).
Тефлон, що його виробляють з 1,1,2,2-тетрафлуороетену CF2==CF2, має унiкальнi властивостi. Загальна формула полiмеру: (—CF2—CF2—)n
За особливу хiмiчну стiйкiсть його називають «органiчною платиною». Вiн не розчиняється нi в «царськiй водi» (сумiшi нiтратної та хлоридної кислот), нi в органiчних розчинниках, стiйкий проти холоду, нагрiвання
та свiтла, неотруйний.
Завдяки цим властивостям з тефлону виготовляють деталi машин i приладiв, апаратiв, що працюють у хiмiчно агресивних середовищах та в харчовiй промисловостi (мал. 59).
Пригадайте, де в побутi використовують вироби
з тефлоновим покриттям.
Феноло-формальдегiднi пластмаси були
добутi в XIX ст. й дiстали назву «бакелiт» (вiд прiзвища американського хiмiка Л. Х. Бакеланда, який на початку XX ст. здійснив

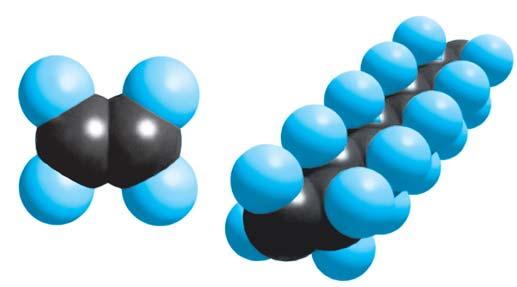

Мал. 59. Моделi молекули тетрафлуороетену (а), фрагмента молекули полiтетрафлуороетену (б)
Полімер —CH2 OH n утворюється в результаті реакції
поліконденсації між фенолом і фольмальдегідом (метаналем): кат. OH | C CH C CH C HC H H + O || C H H + OH | C CH C CH C HC H H OH | C CH C CH C HC CH2 ... OH | C CH C CH C HC ... + H2O і т. д.
Побічним продуктом реакції поліконденсації є низькомолекулярна сполука, в цьому разі — вода. Спершу утворюється полiмер лiнiйної будови, а в мiру подальшої обробки формується сiтчастий полiмер, що має термореактивнi властивостi. Феноло-формальдегiднi пластмаси виготовляють з рiзними наповнювачами: текстолiт наповнюють бавовняною тканиною, склопластики — скловолокном.
Цi матерiали застосовують у ракето- i машинобудуваннi, будiвництвi. Вiдходи деревини, що їx оброблено феноло-формальдегiдною смолою, перетворюються на матерiал, придатний для виготовлення меблiв. Для безпечного використання пластмасових







1 — ПЕТ (PET, PETE) – поліетилентерефталат. Виріб можна використовувати для тимчасового зберігання холодних харчових продуктів і напоїв.
2 — PEHD (HDPE) — поліетилен високої густини. Безпечний пластик, придатний для пакування харчових продуктів і косметичних виробів, напоїв, виготовлення водопровідних труб тощо.
3 — ПВХ (PVC) — полівінілхлорид. Його використання заборонено в харчовій промисловості. Придатний для виробництва покриття підлоги, труб, меблів, тари для хімічних сполук.
4 — ПЕНП (LDPE, PELD) — поліетилен низької густини (плівка). Безпечний пластик, з нього виготовляють харчову плівку, пакети.
5 — ПП (PP) — поліпропілен. Цей безпечний пластик використовують для виробництва дитячих іграшок і харчової тари.
6 — ПС (PS) — полістирен. Потенційно небезпечний матеріал, особливо в разі горіння. Придатний для виготовлення тари для нехарчових продуктів.
7 — OTHER (О) — інші види пластику, в т. ч. полікарбонат. Він нетоксичний, хоча може містити токсичні домішки, що робить його непридатним для пакування харчових продуктів.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Що таке синтетичнi полiмери?
2. Яка відмінність між реакціями полімеризації та поліконденсації?
3. Пояснiть вплив структури полiмерiв на їxнi фiзичнi властивостi.
4. На якi групи подiляють полiмери за вiдношенням до нагрiвання?
5. Що таке пластмаси?
6. Назвiть основнi галузi застосування пластмас.
7. Схарактеризуйте вiдомi вам полiмери, з яких виготовляють пластмаси (мономер, реакцiя добування, мономерна ланка).
8. Схарактеризуйте полiетилен високого i низького тиску.
9. Полiпропiлен стереорегулярної будови — кристалiчна, високоплавка речовина, що утворює мiцнi волокна, а нестереорегуляний полiмер м’який, еластичний. Пояснiть це з погляду тeopiї будови. Додаткове завдання Складiть рiвняння послiдовних реакцiй, за допомогою яких можна добути бакелiт, виходячи з коксу.
§ 25. СИНТЕТИЧНI КАУЧУКИ
Упродовж певного часу потреби промисловостi задовольнялися природним каучуком, що його виготовляли з молочного соку (латексу) каучукового дерева (гевеї) (мал. 60).
Той факт, що природний каучук є полiмером вуглеводню iзопрену СН2=С—СН=СН2, було встановлено в 1910 р.

Мал. 60. Збирання соку каучукового дерева Hevea brasiliensis. Латекс видiляється на зрiзi
Хiмiчна назва полiмеру — полiiзопрен: —СH2—C==CH—CH2 n | CH3
Природний каучук втрачає цю властивiсть за низької температури, стає твердим i крихким, а за високої температури — липким. Свого часу це обмежувало його використання, наприклад для виготовлення водонепроникного одягу.
Проблему було розв’язано пiсля вiдкриття процесу вулканiзацiї каучуку. Виявилося, що внаслiдок нагрiвання каучуку iз сiркою утворюється продукт, позбавлений цих вад: мiцний, еластичний, стiйкий проти змiни температури в широкому дiапазонi.
Пiд час вулканiзацiї сiрка приєднується за мiсцем подвійних зв’язкiв, утворюючи дисульфiднi мiстки, що нiби «зшивають» полiмернi ланцюги мiж собою з утворенням полiмеру просторової будови: | S | CH3 S | —CH2—C—CH—CH2 | S | S | —CH2—C—CH—CH2 | CH3 S | S |
сажа, кремнезем SiO2 або алюмiнiй оксид Аl2O3, що надають гумi пружностi
та стiйкостi проти стирання.
Залежно вiд умiсту сiрки можна добувати полiмери рiзних ступенів еластичностi й твердостi. Для
високовулканiзованого каучуку, вiдомого пiд назвою ебонiт, характерні
високі твердiсть і мiцнiсть.
Автомобiльний транспорт, що роз-
вивався, iншi потреби технiки та й

Мал. 61. Цех шинного
важкодоступнiсть сировини змушували вчених шукати способи добування синтетичного каучуку.
Один iз перших синтезiв каучуку було проведено в 1931 р. за методом С. В. Лебедєва. Це був бутадiєновий каучук, що утворювався полiмеризацiєю бутадiєну — сполуки, що містить два подвійні зв’язки — за участі каталiзатора (металiчного натрiю): Н2С==СН—СН==СН2 + Н2С==СН—СН==СН2 + ··· Бутадієн | | | | —СН2—СН—СН—СН2— + —СН2—СН—СН—СН2— + ··· —СН2—СН==СН—СН2—СН2—СН==СН—СН2— ··· Полібутадієн
Складiть загальну формулу полiмеру.
Нинi промисловiсть виготовляє багато рiзних видiв каучукiв, за властивостями наближених до натурального. Це стало можливим завдяки застосуванню спецiальних каталiзаторiв. Сировиною є продукти переробки нафти.
Бутадiєновий та iзопреновий — це каучуки загального призначення. Їх використовують для виготовлення шин та iнших гумових виробiв технiчного, побутового призначення тощо (мал. 61).
До каучукiв спецiального призначення належить хлоропреновий: —СH2—C==CH—CH2 n | Cl Це негорючий матерiал, а

1.
3.
4.
§ 26. СИНТЕТИЧНI ВОЛОКНА
Як вам вiдомо, натуральнi волокна — бавовну, льон, вовну, шовк — виробляють iз природних волокнистих матерiалiв. Iз природного полiмеру целюлози добувають штучнi (ацетатне, вiскозне) волокна, а з них виробляють штучний шовк.
Речовини, що можуть утворювати волокна, можна й синтезувати.
Якщо бавовна i льон — полiмернi матерiали, мономером яких є вуглевод, то вовна i шовк — полiмери бiлкової природи. Їxнi макромолекули утворюються в результатi взаємодії амiнокислот. З’ясовано, що подiбну структуру має полiмер -амiнокапронової кислоти.
H2N—CH2—CH2—CH2—CH2—CH2 C O OH
H H | | H—N—(CH2)5 C O OH + H—N—(CH2)5 C O OH + H | + H—N—(CH2)5 C O OH + ... H | H—N—(CH2)5 C O NH
У промисловостi для полiмеризації використовують не саму -амiнокапронову кислоту, а її похiдну — капролактам: O H2C—CH2—CH2 || n | C==O —C—N—(CH2)5 n H2C—CH2—N | H H Капролактам Капрон Волокно, що його вироблено з такого полiмеру, називають капроном. Капрон належить до полiамiдних волокон, оскiльки утворюється за рахунок амiдних (пептидних) зв’язкiв. Подiбнiсть структури капрону до природних волокон бiлкового походження,
Мал. 62. Фрагмент будови макромолекули натурального шовку (а) і капрону (б) ...O==C N—H... CH2 CH2
CHR RHC C==O...H—N
H—N C==O H—N C==O C==O...H—N (CH2)5 (CH2)5
RHC CHR ...O==C N—H... N—H...O==C N—H...O==C ...O==C а б
Iншу групу синтетичних волокон становлять полiестернi волокна. Неважко здогадатися, що ця назва вiдбиває будову полiмеру. Справдi, у структурi згаданих волокон є естернi зв’язки. Полiмер, з якого виробляють вiдоме вам волокно лавсан (або терилен), утворюється внаслiдок полiконденсації дикарбонової терефталевої кислоти та етиленглiколю. Взаємодiя вiдбувається мiж гiдроксильними та карбоксильними групами цих сполук:
кат. n C O OH C HO O + nHO—CH2—CH2—OH
Терефталева кислота
Етиленгліколь
кат. C O O—CH2—CH2—O— C O n + 2nH2O
Поліетилентерефталат (лавсан) Лавсанове волокно має цiннi властивостi: воно мiцне, термостiйке, на
нього не дiють розбавленi розчини кислот i лугiв.
Капрон i лавсан використовують для пошиття одягу, виготовлення оздоблювальних матерiалiв. Застосовують їх i в технiцi: з капронової смоли формують деталi рiзних механiзмiв, з лавсану роблять фiльтрувальнi тканини, канати тощо.

ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Якi види волокон вам вiдомi?
2. У чому полягає вiдмiннiсть у хiмiчнiй природi бавовни i шовку?
3.
вiн належить до полiамiдних волокон.
4. Якi переваги i вади капрону? 5.
6.
114
Додаткові завдання
1. Найлон — полiамiдне волокно, утворене внаслiдок взаємодiї дiамiну H2N—(CH2)6—NH2 та дикарбонової
HООС—(СН2)4—СООН. Складiть хiмiчне рiвняння цього процесу.
2. Схарактеризуйте переваги
поліконденсації.


Висновки

Полiмернi ланцюги бувають лiнiйної, розгалуженої та просторової будови.
За вiдношенням до нагрiвання полiмери подiляються на термопластичнi й термореактивнi.
До синтетичних полiмерних матерiалiв належать пластмаси, синтетичнi каучуки, синтетичнi волокна.
Щоб перетворити полiмер на пластмасу, до нього додають спецiальнi речовини. Полiетилен низького тиску



Вивчення органічних речовин побудовано за принципом ускладнення структури і функцій — від вуглеводнів до білків. Між цими сполуками є величезна кількість представників інших класів, різних за складом, будовою і властивостями. Ви переконалися, що попри своє розмаїття органічні речовини утворено обмеженим числом хімічних елементів. Природа дуже економно використала «будівельні матеріали» для створення різноманітних структур, що можуть виконувати надзвичайно складні функції, аж до біологічних. Спробуємо узагальнити ознаки, що зумовлюють різноманітність органічних речовин. Насамперед це характер карбонового ланцюга. Навіть за однакового числа атомів Карбону можуть
116
амінів тощо. Різноманітності додають і сполуки, які містять кілька функціональних груп — амінокислоти, вуглеводи та багато інших, що їх вивчають у курсі органічної хімії у вищих навчальних закладах. Для органічних сполук характерне існування гомологічних рядів. Зміна складу молекули на одну лише групу —СН2— спричиняє появу нової сполуки зі своїми власними константами. Отже, гомологія також є од-
нією з причин різноманітності органічних речовин. Здатність деяких органічних сполук до реакцій полімеризації розширяє кількість органічних сполук, насамперед добутих синтезом. Ізомерія — одна з найважливіших причин розмаїття органічних речовин. Навіть за умови одного й того самого складу молекул можливі різні варіанти їхньої хімічної та просторової будови. Для алкану складу С25Н52 варіантів хімічної будови існує аж 36 797 588. Для обчислення кількості структурних ізомерів алканів, що містять від 1 до 100 атомів Карбону, хімікам Київського національного університету імені Тараса Шевченка довелося розробити спеціальну комп’ютерну програму. Отже, розмаїття органічних сполук, ускладнення їхньої будови і функцій — від метану до білків — пов’язане переважно з необмеженими можливостями комбінування структур, взаємного розміщення атомів і фрагментів молекул за умови одного й того самого складу. Будова, зокрема просторова, визначає специфічні функції білків, нуклеїнових кислот, властивості полімерів, дію лікарських засобів. Рівні структурної організації органічних речовин. Сучасна наука розглядає структурну організацію речовини як упорядкованість, єдність і взаємозв’язки її окремих складників. Такими складниками можуть бути елементарні частинки, атоми, молекули, полімери (макромолекули), надмолекулярні утворення. Останні ще називають супрамолекулярними (від лат. supra — над). Очевидно, що молекулярні речовини складніші за будовою порівняно з атомними, а полімерні — порівняно з молекулярними. У зв’язку з цим речовини можна розташувати в певному порядку, за рівнями складності — від нижчого до вищого, тобто в їхній ієрархії (у широкому розумінні — розташування частин у певному порядку, від вищого до нижчого). Такими рівнями структурної організації речовин є: атомний, молекулярний, полімерний, супрамолекулярний. Кожний вищий рівень ґрунтується на нижчому і включає його. Органічна хімія вивчає молекулярний, полімерний і частково супрамолекулярний рівні організації речовин. Метан, етанол, амінокислоти — це молекули; поліетилен, поліпептид — полімери. Білок у своїй четвертинній структурі є ансамблем молекул, тобто надмолекулярним утворенням, якому властиві специфічні
117
лучення амінокислот є одними й тими самими в природному й денатурованому білку. Але оскільки в останньому зруйновано вторинну і третинну структури, то такий білок позбавлений біологічних функцій. Для їх здійснення у білка має бути структурна організація не будь-якого, а певного рівня. Якщо розглядати рівні організації не лише речовин, а матерії в цілому, то атомний рівень організації межує із субатомним (від лат. sub — під), тобто рівнем елементарних частинок, який вивчає фізика; супрамолекулярний рівень — з клітинним, організмовим та надорганізмовим рівнями, що їх вивчає біологія. Отже, органічні речовини пов’язують у єдиний ланцюг усі рівні організації матерії — від неживої до живої, а органічна хімія як галузь науки є важливою ланкою у зв’язках між природничими науками. Генетичні зв’язки. За всієї різноманітності органічні речовини можуть взаємоперетворюватися. З простіших можна добути складніші, від сполук одного класу перейти до сполук іншого. Окреслимо, наприклад, шлях хімічних перетворень вуглеводнів у естери (схема). Схема






Складіть рівняння реакцій за схемою. Доповнiть схему неорганiчними сполуками. Зробiть висновок.
Завдяки взаємоперетворенню органiчних сполук можна здiйснювати синтези, спрямованi на добування речовин iз заздалегiдь заданими властивостями. Так, з порiвняно простих за будовою вуглеводнiв можна синтезувати велику кiлькiсть складних речовин, потрiбних i корисних людинi. Вуглеводнi є продуктами переробки нафти i природного газу, а тому найдоступнiшою хiмiчною сировиною. Нафтохiмiчна промисловiсть забезпечує величезну кiлькiсть виробництв — синтетичних каучукiв, мийних засобiв, волокон, пластичних мас, лiкiв, засобiв захисту рослин та багато iнших.

3. Наведіть приклади ізомерії карбонового скелета, положення кратного зв’язку, положення функціональної групи. Складіть структурні формули і назви речовин.
4. Наведіть приклади реакцій органічних сполук: гідрування, гідролізу, гідратації, ізомеризації, омилення. Складіть рівняння реакцій.
5. Назвіть речовини, що є основою таких продуктів органічного походження: мило, цукор, оцет, бензин, картопляне борошно, алкоголь, папір, сало, гума, капрон.
6. Складіть кілька схем генетичних перетворень органічних речовин, запропонуйте розв’язати їх вашим однокласникам.
7. Які речовини і яких класів можна було б виявити в колбах, що належали: Миколі Зініну, Миколі Зелінському, Івану Горбачевському, Фрідріху Кекуле, Емілю Фішеру?
8. Прокоментуйте висловлювання одного з літературних героїв А. П. Чехова: «Незабаром хімічним шляхом виготовлятимуть молоко і дійдуть, мабуть, до м’яса!.. З нічого не вартих газів і подібного виготовлятимуть усе, що заманеться!».
9. Уявіть, яким міг бути лист Ф. Велера до Я. Берцеліуса
сполуки,
різними шляхами до організму, певним чином впливають на нього. Цей вплив є специфічним залежно від складу, будови, хімічних чи фізичних властивостей речовин. Ви знаєте про згубний вплив етанолу й нікотину, отруйність бензену, фенолу, формальдегіду, фармакологічну дію лікарських засобів. Речовини, що входять до складу організмів і виконують у них важливі функції, беруть участь у процесах обміну, тобто виявляють біологічну дію, — це відомі вам жири, вуглеводи, білки. Біологічна активність у широкому розумінні — це здатність речовини викликати певну біологічну дію.
Наведіть приклади впливу неорганічних речовин на організм.
Пригадайте біологічні функції жирів, вуглеводів, білків. Виняткову біологічну активність виявляють вітаміни й ферменти.
З’ясуйте за словником походження термінів «вітамін», «ензим», «фермент».
Ферменти, або ензими, — органічні каталізатори, що містяться у клітинах організмів і прискорюють практично всі біохімічні процеси. Каталітична дія ферментів, як і каталізаторів хімічних реакцій, полягає в зниженні енергії
За хімічним складом ферменти (ензими)
належать до білків, так само утворюються із
залишків амінокислот, мають тривимірну структуру завдяки просторовій орієнтації амінокислотного ланцюга.
Біологічна активність властива також
вітамінам, що беруть участь у ферментативних
процесах в організмі. Це низькомолекулярні сполуки, різноманітні за хімічним складом і
складні за структурою. Вони необхідні людині для нормальної життєдіяльності в невеликій кількості. Переважна більшість їх в організмі не синтезується, а надходить до нього з їжею. Нестача вітамінів призводить до хвороб — авітамінозів. Серед близько 20 відомих вітамінів розрізняють жиро- й водорозчинні. Ця обставина має велике значення для засвоєння (всмоктування) вітамінів організмом.
Вітаміни, особливо водорозчинні, належать до нестійких сполук, руйнуються під час приготування, зберігання їжі, під дією кисню й ультрафіолетового випромінювання. Вітамін А (ретинол), жиророзчинний; міститься переважно у тваринних продуктах: риб’ячому жирі, яєчних жовтках, печінці, молоці. Каротин, що є в моркві, інших овочах і фруктах червоного й оранжевого кольорів, перетворюється в організмі на ретинол.
Вітаміни групи В (В1, В2, В3, В5, В6, В7, В8, В9, В12) — розчинні у воді сполуки; містяться в зернових, бобових, горіхах, кукурудзі, м’ясі, печінці, рибі, яйцях, дріжджах.
Вітамін С (аскорбінова кислота), водорозчинний; міститься в овочах і фруктах; потужний антиоксидант; міститься в овочах, фруктах, ягодах, зелені.
Вітамін Д — жиророзчинний вітамін; міститься в риб’ячому жирі, яєчних жовтках, молоці.
Вітамін Е — жиророзчинний; антиоксидант; міститься в зародках пшениці, рослинних оліях, горіхах.
Збалансоване харчування людини передбачає не лише наявність у раціоні достатньої кількості жирів, білків, вуглеводів, а й різноманітних вітамінів.

1.
2.
3.
4.
Кожного з нас упродовж усього
оточують матеріали хімічного виробництва, завдяки яким працюють комп’ютери й мобільні телефони, рухаються автомобілі, проводять медичні обстеження й лікування, з яких виготовляють одяг, якими облаштовують житло, які підвищують врожай і зберігають його. Ми живемо в довкіллі, де відбуваються численні хімічні перетворення, що впливають на повітря, річки, ґрунти і визначають не лише їхній стан, а й стан нашого здоров’я. Вчителі та автори підручників хімії намагаються пояснити вам, як улаштований довколишній світ і як він функціонує — адже саме хімія дає відповіді на ці запитання. Саме для того, щоб розуміти внутрішню будову речовин, закони, що керують хімічними явищами в природі, в організмі, в техніці, використовувати ці знання з користю для природи, для збереження здоров’я, примноження добробуту суспільства, ви й вивчаєте хімію. Спробуймо разом узагальнити знання про здобутки органічної хімії у різних сферах життя, обговорити деякі актуальні проблеми, що їх допомагає розв’язати ця галузь. Для цього вам треба пригадати вивчене, скориставшись у разі потреби підручником, довідником, енциклопедією, інтернет-ресурсами тощо, і поміркувати над запитаннями, які буде сформульовано нижче. У наш час відбувається колосальне розширення й поглиблення хі-

мічних знань. Досягнення цивілізації останніх десятиріч тісно пов’язані з успіхами органічної хімії у науковій та виробничій галузях, її вплив на науково-технічний прогрес і розвиток нехімічної сфери діяльності людини є цілком очевидним.
Наведіть власні аргументи на підтвердження або спростування цієї тези.
Простежуючи розвиток хімії, можна виявити очевидну узгодженість рівня цивілізованості практично всіх
виробничих і побутових сфер та рівня хімічних знань і розвитку синтетичної хімії. Динаміка цього розвитку вражає — показником може бути зростання кількості синтезованих сполук: 1880 р. — близько 12 тис., 1910 р. — 150 тис., 1940 р. — 500 тис. Нині ніхто не ризикне назвати точну кількість відомих речовин, бо щороку синтезують від 200 до 300 тис. лише органічних сполук. Останніх на сьогодні відомо вже понад 100 млн і до цього слід додати близько 700 тис. неорганічних сполук.
Поясніть, як ви розумієте такі висловлювання вчених-хіміків щодо багатоманітності речовин: «Розвиток хімії показав, що різноманітність речовин у природі пояснюється не стільки різноманітністю атомів, скільки різноманітністю сполучень невеликої кількості різних атомів між собою в ансамблі» (В. Ковтуненко). «Багатоманітність сполук Карбону є дивовижним і єдиним свого роду явищем» (П. Карер).
Синтез нових сполук є найголовнішим напрямом розвитку хімії. Органічний синтез, зокрема, відіграє провідну роль не лише у створенні практично корисних речовин, а й у пізнанні складних взаємодій у біологічних системах на молекулярному рівні, що є надзвичайно важливим завданням сучасного природознавства (мал. 64).
Якщо біолог, геолог, астроном досліджують природні об’єкти, що існують у природі, то хімік-синтетик повинен спершу добути речовину, якої до цього в природі не існувало, дослідити її властивості й перетворення. Видатний французький хімік-органік XIX ст. М. Бертло зазна-
122
творить нові світи, які не існували, поки не вийшли, оформившись, із
його рук, подібно до того, як матеріал, щойно вийшовши з рук майстра, набуває сили й виразності витвору мистецтва».
Наведiть власнi аргументи на пiдтвердження або спростування цiєї тези.
Будучи яскраво самобутньою і посідаючи виняткове місце серед інших природничих наук, органічна хімія водночас тісно пов’язана з ними.
Речовина як вид матерії є об’єктом вивчення і хімії, і фізики, і біології. Фізика розглядає дискретну будову речовини, різні її стани, вплив будови на властивості, що «цікавить» також і хімію. У курсі біології вивчають біологічно активні речовини — білки, вуглеводи, жири, нуклеїнові кислоти. Їхня структурна організація є визначальною в здійсненні ними життєво важливих функцій, а пізнати структуру цих речовин можна лише на основі хімічних знань (мал. 65). Плідність провідних ідей органічної хімії доведено розвитком усіх природничих наук, передусім біології. Вам відомо, що органічна хімія розпочиналася з дослідження речовин рослинного і тваринного походження. Завдяки цьому було з’ясовано склад і структуру багатьох біологічних субстанцій. Водночас біологічні субстанції — природні вуглеводи, що становлять основу рослинного світу, є джерелом добування штучних волокон, спиртів, багатьох інших речовин. Саме хіміки розшифрували структуру і штучно відтворили такі складні біологічні об’єкти, як жири, деякі білки, вуглеводи, вітаміни. Хімія сприяє розумінню перебігу процесів у організмах на молекулярному рівні. Хімію біологічно активних речовин, що становлять вищий рівень речовинної форми організації матерії, порівнюють з молекулярою інформатикою, предметом якої є збереження й зчитування інформації, записаної у параметрах молекул.
Пригадайте, як передається генетична інформація, які сполуки беруть участь у цьому процесі.
Відбувається взаємопроникнення біології й органічної хімії: остання, наприклад, використовує природні ферменти як хімічні реагенти в біотехнологічних процесах. Величезна кількість біомаси рослин, накопичена на планеті, розглядається в біотехнології як перспективна сировина для добування вуглеводнів та інших органічних речовин, що є сировиною для органічного синтезу. З хімією Карбону пов’язані й успіхи в застосуванні іншої сучасної технології — нанотехнології. Карбонові нанотрубки вже використовують на практиці завдяки їхнім особливим механічним, оптичним і напівпровідниковим властивостям, а в перспективі наносполуки можуть
123
бів, харчових добавок. У свою чергу, розвиток хімічних виробництв є стимулом розвитку теоретичної хімії. Пошуки дешевої сировини для промисловості сприяли досконалому вивченню складу продуктів переробки кам’яного вугілля, серед яких було виявлено багато цінних сполук. Вивчення речовини розпочинається з ознайомлення з її агрегатним станом за звичайних умов і фізичними властивостями, такими як колір, запах, твердість, еластичність, температури плавлення й кипіння. Для багатьох речовин визначальною щодо їхніх властивостей є міжмолекулярна (фізична) взаємодія. Сучасні методи ідентифікації речовин ґрунтуються на вивченні їхніх спектрів у різних діапазонах. Отже, фізичні знання й фізичні методи органічно входять до хімічної науки. Водночас новітні матеріали — продукти синтетичної органічної хімії — «обслуговують» різноманітні галузі фізики, електроніку, електротехніку. Взаємне проникнення знань з фізики, хімії, біології, технологій виявляється і в методах дослідження, що їх використовують у цих галузях: ядерний магнітний резонанс, спектроскопія у видимій, ультрафіолетовій та інфрачервоній ділянках спектра, полярографія, хроматографія та ін. Органічна хімія тісно взаємодіє з медициною, прикладом чого є створення синтетичних лікарських засобів. Протягом багатьох століть хімія була пов’язана з медициною, а нині є «серцем сучасної медицини». Ще у працях алхіміків описано способи виготовлення ліків із трав, олій, смол, воску тощо за допомогою таких операцій, як екстрагування, настоювання, розчинення, змішування, фільтрування, перегонка тощо. У XV—XVI ст., коли завдяки географічним відкриттям значно розширилися контакти між державами і людьми, розповсюдилися й хвороби, які часто набували характеру епідемій. На боротьбу з ними спрямовувалися зусилля тогочасної медицини. Саме в XVI ст. завдяки працям Парацельса було засновано ятрохімію, що використовувала хімічні сполуки як ліки. На той час це були переважно сполуки Стибію, Арсену, Плюмбуму, Меркурію та деяких інших елементів, а також екстракти рослинного і тваринного походження. Пізніше з рослинних продуктів почали виділяти активні речовини, наприклад хінин з кори хінного дерева, морфін з опіуму. У XIX ст. почали досліджувати фізіологічну дію синтетичних органічних сполук, серед яких було виявлено антисептичні, снодійні, анестезуючі, антипіритичні речовини. З одного боку, створення синтетичних лікарських засобів вплинуло на розвиток усієї медицини. З іншого, хімія лікарських засобів залежала від розвитку хімії кам’яного вугілля, оскільки продукти його переробки, що містяться в кам’яновугільній смолі, є сировиною для органічного синтезу.

Пригадайте, що вам відомо про це, і поясніть, як виникнення промисловості органічного синтезу пов’язане
Величезну кількість органічних сполук «задіяно» в розв’язуванні глобальних проблем людства: продовольчої, сировинної, енергетичної, екологічної. Саме остання пов’язується суспільною думкою зі здобутками й прорахунками хімії.
Створений руками людини світ синтетичних речовин забезпечує її потреби в повсякденному житті, але водночас стає біогеохімічним чинником глобального масштабу. Ідеться не лише про забруднення довкілля під час виробництва, транспортування і використання продуктів синтетич-
ної хімії, а про непередбачуваність реакції природних об’єктів на вплив цих продуктів. Наприклад, поява нових ліків призводить до формування нових резистентних (стійких) штамів мікроорганізмів.
Вплив хімії на довкілля й наше життя в цілому постійно зростає.
Об’єктивно існуючи в техносфері, сучасна людина використовує штучно створені речовини і матеріали, що є продуктами хімічного виробництва. Використання цих продуктів потребує певних хімічних знань, хімічної культури, що стають чинником виживання в реальних умовах екологічних ризиків. Розв’язуючи нагальні потреби сьогодення, людство має дбати і про наступні покоління. Наприклад, зростання виробництва продукції сільського господарства не має призводити до виснаження ґрунту;
125
женню цінних природних ресурсів. Така модель отримала назву сталого
розвитку. Згідно з матеріалами ООН «сталий розвиток — це такий розвиток суспільства, що задовольняє потреби нинішніх поколінь і не становить загрозу можливості наступних поколінь задовольняти свої потреби». Визначено 17 цілей, що їх має досягти людство, серед них — подолання голоду, досягнення продовольчої безпеки, поліпшення якості харчування і сприяння сталому розвитку сільського господарства; забезпечення доступу до недорогих, надійних, стійких і сучасних джерел енергії; раціональне використання водних ресурсів, забезпечення санітарії; вжиття невідкладних заходів щодо боротьби зі зміною клімату та його наслідками; раціональне використання морських ресурсів, захист екосистем суші та інші.
Проаналізуйте зазначені цілі з погляду внеску органічної хімії у досягення їх. Сталий розвиток називають керованим розвитком. Поясніть, як ви розумієте керованість розвитку з погляду виробництва і
нічної хімії. Підготуйте повідомлення про вплив органічних сполук на довкілля, здоров’я людини та про засоби запобігання
Сучасні наукові хімічні знання є підґрунтям реалістичного ставлення до навколишнього світу, в якому велике значення має взаємодія людини з різними речовинами. Істинне знання про природу речей, як у високому науковому сенсі, так і в утилітарному, дає змогу позбутися страху перед глобальними проблемами людства, розкрити шляхи запобігання їм і розв’язування, оскільки саме хімія володіє методами поліпшення екологічної ситуації, забезпечує людство матеріалами, енергією, засобами боротьби з хворобами.
Вплив хімічних знань на духовну й матеріальну культуру людства не потребує додаткової аргументації. Вивчаючи органічну хімію, ви переконалися, що ці знання використовуються в усіх наукових і технологічних галузях, уся практична діяльність людини пов’язана з використанням природних, штучних і синтетичних речовин і матеріалів, а одвічне прагнення людства до розкриття таємниці живого може здійснитися через пізнання процесів у організмах на молекулярному рівні. Усе це визначає важливу гуманістичну функцію знань з органічної хімії, їхнє місце в загальному світогляді людини, її ставленні до навколишнього світу.
126
Природні й синтетичні
органічні продукти
Таблиця 14
Органічні продукти
природнісинтетичні
Корисні копалини (нафта, природний газ, вугілля)
Продукти рослинного походження (целюлоза, цукор, крохмаль, олії, волокна бавовни, льону, каучук)
Продукти планктону
Пластичні маси, волокна, каучуки
Засоби захисту рослин
Добавки до кормів для тварин
Лікарські засоби
Біодизель, біоетанол
Барвники
Мило і мийні засоби
Фотоматеріали
Запашні й смакові речовини

Харчові добавки ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Схарактеризуйте основні хімічні
2. Використовуючи
3.
4.
§ 7. 1. Б. 2. Б, В. 4. 2,375 м3. 5. 1 — так; 2 — ні. 6. А. 7. А, Г. 9. С2Сl6
§ 8. 6. С4Н8.
§ 9. 6. 22,4 л.
§ 10. 5. В.
§ 12. 1. А; 8. С2Н6О.
§ 13. 5. Б
§ 14. 4. 662 г.
§ 15. 7. 20 %. 8. 60 л.
§ 16. 2. Г. 4. 6,05 л.
§ 18. 7. 10 %.
§ 22. 7. А. 8. 79,35 %








491 178 805 831
100 г води); «м» — малорозчинна речовина (розчинність від 1 г до
Бертло П. Е. 9
Берцелiус Й. Я. 8
Бунге М.А. 84
Бутлеров О. М. 9, 10
Велер Ф. 9
Горбачевський І. Я. 10, 102
Зелiнський М. Д. 44
Зiнiн М. М. 96
Кекуле Ф. А. 10, 42
Кiпрiанов А. І. 10, 97
Кiрсанов О. В. 10
Кольбе А. 9
Коновалов М. І. 10
Купер А. 10
Кучеров М. Г. 66
Реформатський С. М. 10
Фiшер Е. Г. 102
Франкленд Е. 10
Шеврель М. 76
Шилов Е. О. 10
Алкани 23
Алканоли 48
Алканоляти 53
Алкени 32
Алкiльнi замiсники 25
Алкiни 37
Алкоголі 48
Альдегiди 63
Амiлоза 86
Амiлопектин 86
Амiни 91
Амiногрупа 91
Амiнокислоти 98
Анiлiн 94
Арени 42
Ароматизацiя 44
Барвники анiлiновi 95
Бензен 42
Бiлки 102
— структура 103
Біогаз 29
Бiотехнологiя 106
Бiполярний iон 100
Бутан 29
Бутанол 49
Взаємний вплив атомiв 11, 54, 61, 94
Вітаміни 119
Волокна
— натуральнi 118
— синтетичнi 118
— штучнi 88
Вугiлля кам’яне 29
Вуглеводи 81
Вуглеводнi
—
ароматичнi 42
— насиченi 23
—
ненасиченi 32
Вулканiзацiя 116
Газ
— природний 29
— чадний 27
Галогенопохiднi 28
Гексан 24
Гексахлоробензен 44
Гексахлороциклогексан (гексахлоран)43
Генетичний зв’язок 122
Гептан 24
Глiкоген 89
Глiцерол 57
Глюкоза 82
Група
— альдегiдна 63
— аміно 90
— гiдроксильна 48
— естерна 73
— карбоксильна 68
— пептидна 100
— функцiональна 21
— характеристична 21
Гума 116
Декан 24
Декстрини 86
Денатурат 55
Денатурацiя 104
Детергенти 79
Димер 70
Динамiт 58
Дипептид 100
Дисоцiацiя карбонових кислот 70
Дихлороетан 35
Дихлорометан 28
Добавки харчовi 66
Довжина зв’язку 16, 18
Ебоніт 117
Елементи-органогени 5
Ензими (див. Ферменти)
Естери 73
Етан 24
Етаналь 63
Етанол (етиловий спирт) 49
Етанолят 53
Етен 32, 33
Етери 54
134
Етил 26
Етин 32, 37, 39
Ефір медичний 54
Жири
— рiдкi 76
— твердi 76
Закон Бутлерова 12
Зв’язок
— водневий 50
— генетичний (див. Генетичний зв’язок)
— ковалентний 15
— пептидний 100
— подвiйний 17
— потрiйний 18
— простий 15
І
зобутан 12
Ізомери 13
Ізомерiя 12
— структурна 24, 32, 37, 50
Ізопрен 116
Індиго 96
Капрон 118
Карбiд 38
Каучук
— натуральний 116
— синтетичний 116
Кислота
—
глюконова 83
—
етанова 69
—
карболова 61
—
метанова 68
— олеїнова 76
— пальмiтинова 76
— стеаринова 76
Клiтковина 87
Крекiнг 28
Крохмаль 86
Лавсан 119
Лізин 99, 101
М
аргарин 77
Метан 29
Метанамін 93
Метаналь 63
Метанол 49
Метил 26
Мило 77
Нанотехнологія 125
Нафта 29
Номенклатура
— алканiв 25
— алкенiв 32
— алкiнiв 38
— альдегiдiв 63
— амiнiв 92
— амiнокислот 98
— карбонових кислот 63
— спиртiв 50
Нонан 24
Октан 24
Парафiн 30
Парафiни 23
Патока 87
Пентан 24
Пiролiз 28, 40
Пластмаси 110
— феноло-формальдегiднi 113
Поліестер 118
Полiетилен 111
Полiмери 109
– термопластичнi 109
– термореактивнi 109
Полiметилметакрилат 113
Полiпептид 100
Полiпропiлен 112
Полiстирол 112
Полiхлорвiнiл 112
Пропан 24
Пропен 33
Пропiл 26
Реакцiя
— бродiння 55, 83
— вiдновлення 82, 95
— галогенування 28
— гiдратацiї 34, 54
—
гiдролiзу 54, 75, 77, 84, 86, 88, 104
—
гiдрування 34, 77
—
дегiдратацiї 54
—
дегiдроциклiзацiї 44
—
дегiдрування 35
— естерифiкацiї 71, 74
—
замiщення 28, 44, 58, 60
— Зiнiна 95
—
iзомеризацiї 28
— Кучерова 66
— окиснення 27, 33, 38, 43, 53, 57, 64, 77, 84, 87, 93
—
омилення 77
—
полiмеризацiї 35
— приєднання 34,39, 43, 65
— розкладу 27, 88, 105
— «срiбного дзеркала» 65
Ремантадин 97
Сажа 27
Сахароза 88
Сечовина 9
Сорбіт 82
Спирти
—
багатоатомнi 57
—
одноатомнi 48
Стереохiмiя 14
Стрептоцид 96
135
Структурна формула (див. Формула
структурна)
Теорiя хiмiчної будови 110
Тетрахлорометан 28
Тефлон 113
Тринітрогліцерол 58
Трипептид 100
Трихлорометан 28
Уротропiн 66
Фенол 60
Ферменти 118
Фільєри 88
Формалiн 66
Формула структурна 11
Фотосинтез 82
Фруктоза 84
Хiмiчна будова 11
Хлоробензен 44
Хлорометан 28
Хлорофiл 82
Целюлоза 87
Циклогексан 43
Цукор 85
Шовк штучний 88
XIMIЯ
https://thumbs.dreamstime.com; https://www.freestockphotos.biz; https://profermu.com; https://www.marinetraffic.com; https://www.amazon.com; https://bottlesetc.com; https://www.quora.com; https://tabletki.ua; www. luontoportti.com; https://siat-ltd.prom.ua; https://elpais.com; https://www.neogenomica.com; https://www.codzienniefit.pl; https://www.shutterstok.com; https://www.merriam-webster.com; https://www.fixinglist.com; https://www.pinterest.com; https://www.clipart.com
70х100 1/16 Гарнітура Шкільна. Друк офсет. Папір офсет. Умов.-друк. арк. Обл.-вид . арк. Наклад 0000 пр. Зам.
