Uso de hongos entomopatógenos dentro de un esquema de manejo integrado de escarabajos ambrosiales
Dr. Roberto Montesinos
Matías
Coordinador de la Colección de Hongos
Entomopatógenos del Centro Nacional de Referencia de Control Biológico-CNRF-DGSV-Senasica
Área de investigación:
Control microbiano de plagas agrícolas
Los insectos son los animales invertebrados dominantes en el planeta tierra, abarcando aproximadamente 3/4 partes de la diversidad de especies y con más de un millón de especies descritas. La mayoría de los insectos son benéficos: polinizadores, depredadores y parasitoides. Sin embargo, menos del uno por ciento, son plagas que afectan la producción mundial de alimentos, por lo que requieren de atención para reducir los efectos negativos que ocasionan, demandando esfuerzos y recursos económicos.
Uno de los métodos aceptados ambientalmente para su control es el uso de patógenos, particularmente los hongos entomopatógenos (del griego entomo = insecto, pathos = padecimiento, gennaein = que produce, patógeno de insectos).
Actualmente, algunas plagas nativas
de Asia, como los complejos escarabajo/hongo fitopatógeno (Euwallacea spp./Fusarium sp. y Xyleborus glabratus/Raffaelea lauricola) han invadido regiones (no nativas) en diferentes países (E.U.A., Israel y Sudáfrica). Esta asociación escarabajo/hongo ha diezmado un gran número de árboles hospederos, entre ellos el aguacate.
Tales invasiones, se dirigieron principalmente hacia árboles vivos, ocasionando deforestaciones de manera inesperada. Esta modificación del comportamiento al colonizar árboles vivos y no muertos es inexplicable, lo cual se ha denominado como un “desajuste evolutivo” de este organismo.
A partir del año 2013, el Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (Senasica), a través del Programa de Vigilancia Epidemiológica Fitosanitaria (PVEF),
incorporó la vigilancia del escarabajo barrenador polífago (Euwallacea sp.Fusarium euwallaceae) y el escarabajo ambrosia del laurel rojo (Xyleborus glabratus - Raffaelea lauricola) con el objetivo de detectar de manera oportuna su eventual introducción al país.
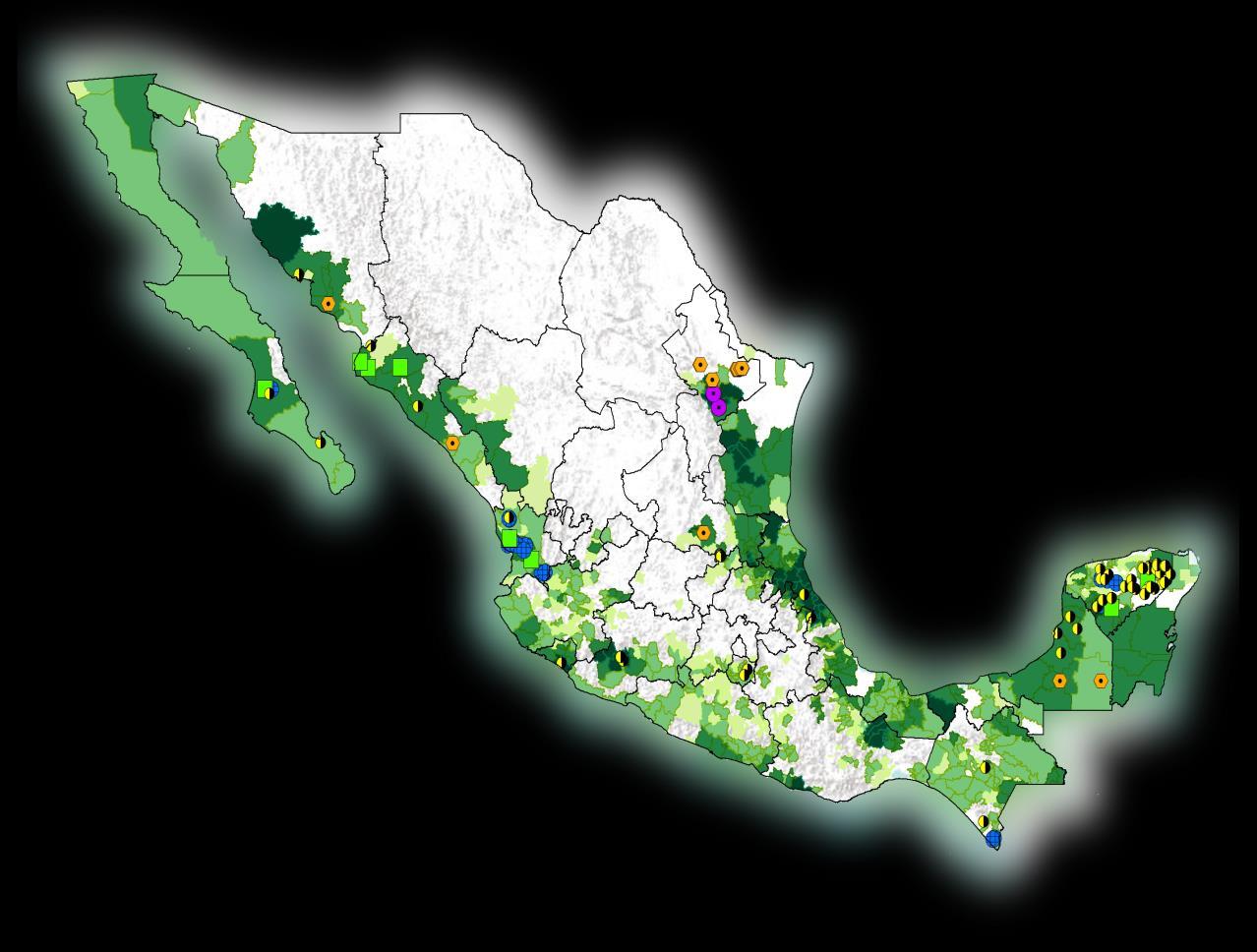
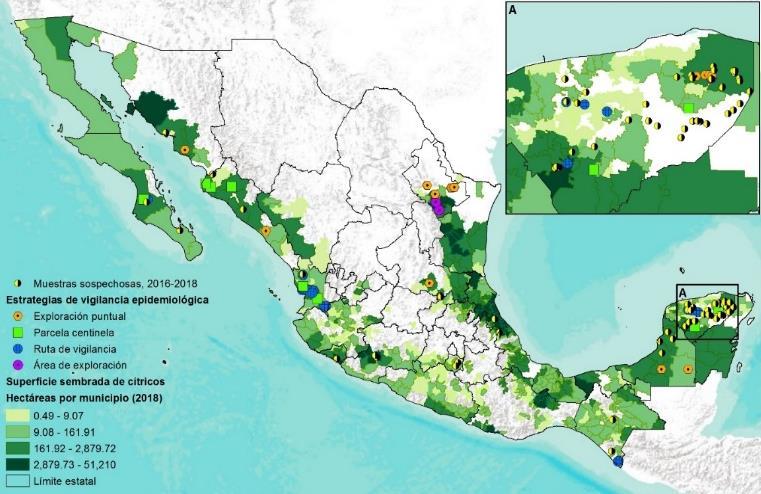
Derivado de estas acciones de vigilancia, en febrero de 2015, fue detectado el escarabajo barrenador polífago (Euwallacea sp.) en la zona urbana del municipio de Tijuana, Baja California afectando principalmente a las especies de Olmo y Sauce blanco (Figuras 1 y 2), por lo que el Senasica ejecutó un plan de acción para su contención y en abril de 2018 comenzó a operar la estrategia de Manejo Fitosanitario de los Ambrosiales, con el propósito de llevar acciones de manejo para contener el avance de Euwallacea sp. en el resto del territorio nacional (https://www.gob.mx/senasica/docum entos/estrategia-operativaambrosiales?state=published).
Figura 1. Especie de olmo colonizado por Euwallacea sp., en Tijuana, BC.
Figura 2. Sauce blanco con síntomas de ataque por Euwallacea sp., en Ensenada, BC.
Actualmente, el escarabajo barrenador polífago (Euwallacea sp.) está ausente en el resto del país, por lo que el Senasica realiza Vigilancia Epidemiológica Fitosanitaria para monitorear la presencia o ausencia de la plaga.
La Subdirección de Control Biológico del Centro Nacional de Referencia Fitosanitaria de la Dirección General de Sanidad Vegetal del Senasica, implementó las líneas de investigación para generar un programa de control microbiano a través del uso de hongos entomopatógenos (Figura 3). Se inició con exploraciones en los sitios con presencia de la plaga, para la colecta de organismos benéficos que interactúan con Euwallacea sp.
Previamente se ha investigado el potencial de diferentes especies de hongos patógenos que son capaces de infectar y matar a la mayoría de los estadios de desarrollo de insectos barrenadores. Hasta el momento no existen reportes de una ocurrencia natural de hongos asociados a Euwallacea sp. en Estados Unidos de América.
EXPLORACIÓN
EVALUACIÓN DE CAMPO
EVALUACIÓN DE EQUIPOSDE APLICACIÓN
GENERACIÓN DE TECNOLOGÍA HE
SELECCIÓN DE CEPAS EVALUACIÓN DE RENDIMIENTODE PRODUCCIÓN
PRUEBAS DE BIOSEGURIDAD
Durante los recorridos en las zonas con presencia del escarabajo polífago en Tijuana Baja California (32.53114° N, -117.01765° W), se encontraron cadáveres de Euwallacea sp. con desarrollo de micosis en árboles de álamo atacados por estos insectos (Fig. 4).
Los especímenes encontrados fueron analizados en la Colección de Hongos Entomopatógenos (CHE) y el Laboratorio de Biología Molecular del Centro Nacional de Referencia de Control Biológico (CNRCB). Los análisis morfológicos y moleculares mostraron que el hongo presente en los insectos recolectados en campo pertenecían a la especie Beauveria bassiana.
EVALUACION DE FORMULACIÓN
Se logran obtener dos aislados, a los cuales se le asignaron los acrónimos CHE-CNRCB 636 y 637; y se incorporaron a la CHE.
Uno de los principios básicos en la patología de insectos para establecer el agente causal infeccioso de una enfermedad, es la aplicación de los Postulados de Koch. Para probar este postulado, se realizaron bioensayos de patogenicidad sobre una colonia de Euwallacea sp. establecida in vitro en las oficinas del Comité Estatal de Sanidad Vegetal del estado de Baja California (CESAVEBC) (Fig. 5), para las cepas antes descritas.
Figura
Figura 5. Desarrollo in vitro de Euwallacea sp en Tijuana BC.
Figura 4. Cadáveres de Euwallacea sp. recolectados en álamo
Los resultados de patogenicidad permitieron cuantificar una mortalidad del 58.3 y 83.3%, para la cepa CHECNRCB 636 y CHE-CNRCB 637 (Fig. 6), respectivamente.
El descubrimiento de patógenos adaptados a las condiciones climáticas donde se pretende su uso, provee una alternativa viable para el desarrollo de tecnología de control biológico de escarabajos ambrosiales, y su integración dentro del Programa de manejo Fitosanitario de los ambrosiales (https://www.gob.mx/senasica/docume ntos/estrategia-operativaambrosiales?state=published).
El control biológico para los escarabajos ambrosiales es una alternativa fitosanitaria prometedora, considerando las restricciones al uso de insecticidas sintéticos en árboles frutales, particularmente, para la producción y exportación del aguacate. Referencias.
Castrejón-Antonio, J. E., Tamez-Guerra P., Montesinos-Matías, R., Ek-Ramos, M. J., GarzaLópez, P. M., y Arredondo-Bernal, H. C. (2019). Selection of strains of Beauveria bassiana
(Hypocreales: Cordycipitaceae) for the biological control of Xyleborus affinis Eichhoff (Curculionidae: Scolytinae). Applied Entomology and Zoology.
Montesinos-Matías R., Gallou A., BerlangaPadilla, A. M., Serna-Domínguez, M. G., Laureano-Ahuelicán, B., Ayala-Zermeño, M. A., Ordáz-Hernández, A., López-Buenfil, J. A. y Arredondo-Bernal, H. C. (2019). Characterization of Beauveria bassiana Isolates Associated with Euwallacea sp nr fornicatus in Populus sp Southwestern Entomologist Vol. 44 ( 2): 423429.
Castrejón-Antonio, J. E., Montesinos-Matías, R., Tamez-Guerra, P., Fuentes-Guardiola, L. T, Laureano-Ahuelican, B. y Arredondo-Bernal, H. C. (2018). Infestation of Xyleborus volvulus (Fabricius) (Coleoptera: Curculionidae: Scolytinae) in Mangifera indica L. (Mangifera: Anacardiaceae) in Manzanillo, Colima. Florida Entomologist, 101(4): 676-680.
Castrejón-Antonio, J. E., Montesinos-Matías, R., Acevedo-Reyes, N., Tamez-Guerra, P., AyalaZermeño, M. A., Berlanga-Padilla, A. M. y Arredondo-Bernal, H. C. 2017. Especies de Xyleborus (Coleoptera: Curculionidae: Scolytinae) asociados a huertos de aguacate en Colima, México. Acta Zoológica Mexicana (Nueva Serie), 33(1):146-150. http://www.scielo.org.mx/pdf/azm/v33n1/00651737-azm-33-01-00146.pdf
https://www.derechoynegocios.net/comercio/onu-y-fao-emiten-alerta-mundial-del-virus-de-la-tilapia/
1.- Antecedentes
En Israel durante el verano del 2009 se registró alta mortalidad de Tilapia, posteriormente, en el 2012 se presentó un caso similar en Ecuador. En el 2014 pudo identificarse que el causante de esos brotes era un virus similar a los de la familia Orthomyxoviridae (Jansen et al., 2018), el cual fue nombrado como Virus de la Tilapia del Lago (TilV) (Eyngor et al., 2014). En mayo del 2017, la FAO publicó la alerta especial 338 del Sistema Global de Información y Alerta Temprana (GIEWs) (FAO, 2017). Esta enfermedad aún no está incluida en el listado de enfermedades de notificación obligatoria de la OIE, pero se está evaluando el lugar donde será incluido en dicha lista (NACA, 2017).
2.- Descripción de la enfermedad
Tanto las tilapias de cultivo como las silvestres pueden ser susceptibles a
este virus, se ha demostrado su presencia en tilapias del Nilo (Oreochromis niloticus), tilapias rojas (O. sp.) y tilapias híbridas (O. niloticus O. aureus) (University of Florida-IFAS Extension, 2019).
El virus puede afectar en todas las etapas de desarrollo, y de acuerdo a la información reportada en brotes de varios países, las tasas de morbilidad y mortalidad son muy variables, y parecen estar relacionadas con temperaturas elevadas y el estrés causado por la transferencia de organismos entre estanques (Ferguson et al.,2014, Dong et al 2017; NACA, 2017). El rango acumulativo de mortalidad se ha reportado entre 10% y 90% (University of Florida-IFAS Extension, 2019).
3. Factores de riesgo
La enfermedad puede presentarse en un amplio rango de temperatura (15–30°C); sin embargo, la mayoría de los brotes se han presentado en las temporadas más cálidas con temperaturas promedio de 25°C (Fathi et al., 2017) .
4. Signos clínicos
Los signos clínicos asociados a esta enfermedad son muy variables, como letargia, pérdida de apetito, oscurecimiento de la piel, ulceraciones o hemorragias en la piel y decoloración en branquias e hígado (Jansen et al., 2018). Adicionalmente, las lesiones en la piel pueden ocasionar infecciones bacterianas.
5. Transmisión:
La duración de este agente fuera del hospedero no se ha determinado aún, sin embargo, se ha demostrado bajo condiciones experimentales que
la transmisión puede ser directa por cohabitación (Jansen et al., 2018). Asimismo, el estudio de Yakamasen et al sugiere la posiblidad de una transmisión vertical hacia la progenie (Yamkasem et al., 2019)
6. Diagnóstico:
Los métodos utilizados para el diagnóstico de esta enfermedad son la histopatología, cultivo celular (utilizando líneas celulares E-11) y el diagnóstico molecular (RT-PCR, RTPCR semianidada y PCR en tiempo real (Thammatorn et al., 2018).
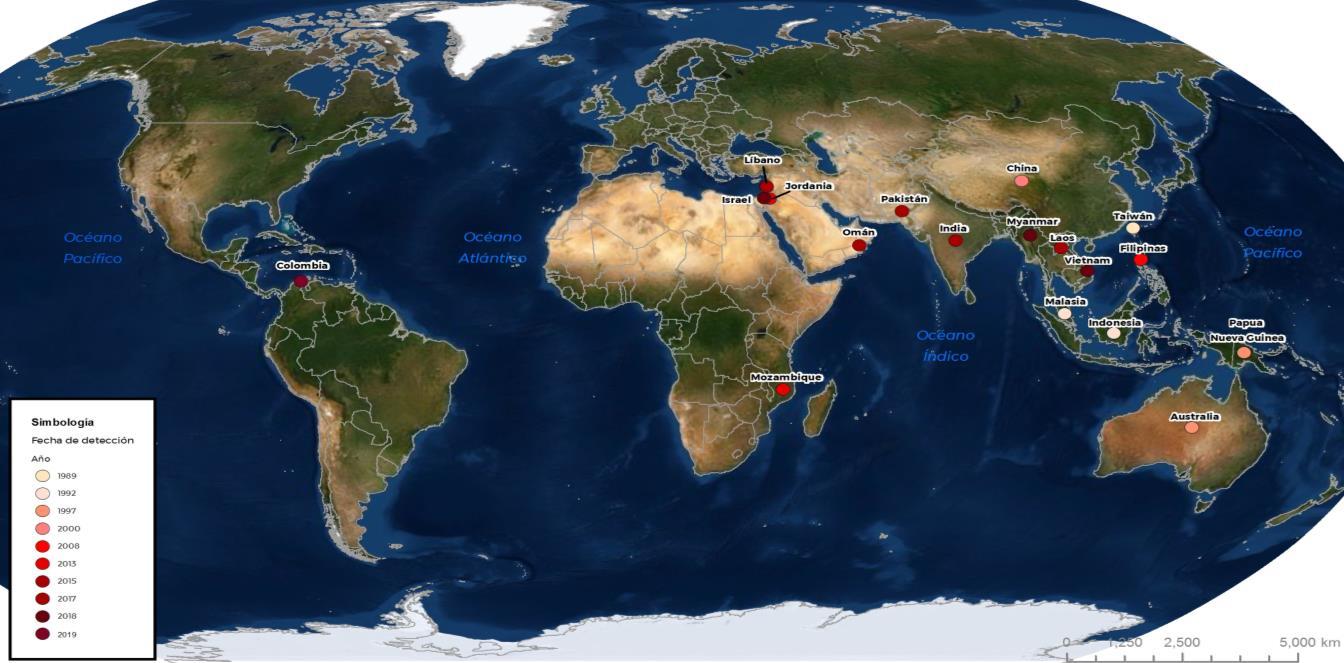
7. Distribución geográfica
Hasta la fecha, se ha identificado la presencia de esta enfermedad en 16 países (Cuadro 1), sin embargo, sólo 9 de éstos han notificado oficialmente los brotes ante la OIE (Mapa 1).
Cuadro 1.-Brotes confirmados de TiLV en el mundo
Continente País Fecha de detección Referencia
África Egipto 2017 (Fathi et al., 2017)
Tanzania 2018 (Mugimba et al., 2018)
Uganda 2018 (Mugimba et al., 2018)
Asia Bangladesh 2018
India 2017 (OIE, 2019a)
Indonesia 2018 (Koesharyani et al., 2018)
Israel 2014 (OIE, 2017a)
Tailandia 2015 (OIE, 2017b)
Malasia 2017 (OIE, 2017c)
Filipinas 2017 (OIE, 2017d)
Taiwán 2017 (OIE, 2017d)
América Colombia 2017 (Kembou et al., 2017)
Ecuador 2014 (Ferguson et al., 2014)
Perú 2017 (OIE, 2018b)
México 2018 (OIE, 2018c)
Estados Unidos de América 2018 (OIE, 2019b)
8.- Impacto:
Existen más de 100 especies de tilapias que constituyen el segundo grupo de peces de cultivo más importante en el mundo después de la carpa (OIE, 2017). De acuerdo con la información de la FAO, la producción mundial de tilapia estimada en el 2017 fue de 6.5 millones de toneladas, siendo los principales productores: China (1.58 millones de toneladas), Indonesia (1.40 millones de toneladas) y Egipto (1.01 millones de toneladas). México ocupó el 9° lugar en producción en ese mismo año (179 mil toneladas) (FAO, 2019).
En nuestro país, el cultivo de tilapia representa el 2° lugar en la acuicultura, que en el 2017 representó una producción de 149 mil toneladas con un valor de 3,036 millones de pesos, lo cual representa el 87.07 % de la producción total nacional de tilapia, y el 7.6% de la producción nacional acuícola y pesquera (CONAPESCA, 2017). Además, nuestro país cuenta con 7,271 Unidades de Producción Acuícola (UPAs) de tilapia las cuales podrían verse afectadas.
Mapa 1. Estatus mundial del Virus de la Tilapia del Lago (
9.- Situación en México
Los primeros casos positivos fueron detectados en julio de 2018 en 21 UPAs de seis estados (Chiapas, Jalisco, Michoacán, Sinaloa, Tabasco y Veracruz), mientras que en agosto del mismo año, sólo se observó la prevalencia en 16 UPAs en Chiapas, Sinaloa, Tabasco y Veracruz. A partir de septiembre de 2018 no se ha detectado la presencia de esta enfermedad en ninguna UPA (Mapa 2) (Senasica, 2019).
El 27 de mayo de 2019, el Senasica, declaró cerrado el evento e informó a la Organización Mundial de Sanidad
Animal que México había recuperado el estatus de país libre del virus de la tilapia del lago en virtud de que se levantó la última cuarentena el 15 de mayo en Michoacán.
10.-Medidas implementadas
La propagación de la enfermedad se puede limitar mediante restricciones en la movilización de tilapias provenientes de criaderos y pesquerías donde el virus ha aparecido. Además, la
implementación de medidas de bioseguridad (limpieza y desinfección), ayudan a evitar la propagación de la enfermedad a través de equipos, vehículos y personal (OIE, 2017).
En agosto de 2018, los médicos veterinarios del Senasica, mediante técnicas de biología molecular, lograron la identificación del virus derivado de las actividades de vigilancia epidemiológica, en granjas de Chiapas, Jalisco, Michoacán, Sinaloa, Tabasco y Veracruz.
Como medida adicional, el personal visitó 280 granjas, 57 productoras de cría y 223 de engorda, distribuidas a lo largo del territorio nacional, sin encontrar evidencia de nuevos casos, por lo que se considera este evento sanitario como cerrado.
Se continuó con el muestreo y análisis en 304 unidades de producción durante el 2019, con la finalidad de evitar el reingreso del virus y proteger la producción de tilapia nacional.
Mapa 2. Casos positivos al TiLV en México
Por recomendación del Senasica, los productores reforzaron las medidas de bioseguridad en sus Unidades de Producción, aplicaron las Buenas Prácticas de Producción y reportaron de manera inmediata cualquier sospecha de la enfermedad, lo que coadyuvó a erradicarla del territorio nacional en menos de un año.
Referencias
CONAPESCA. (2017). Producción Acuícola y Pesquera.
Eyngor, M., Zamostiano, R., Kembou, J., Berkowitz, A., Bercovier, H., Tinman, S. y Eldar, A. (2014). Identification of a Novel RNA Virus Lethal to Tilapia. Journal of clinical microbiology (52). doi:10.1128/JCM.00827-14
FAO. (26 de mayo de 2017a). Alerta especial No. 338. Outbreaks of Tilapia lake virus (TiLV) threaten the livelihoods and food security of millions of people dependent on tilapia farming. Obtenido de http://www.fao.org/3/a-i7326e.pdf
FAO. (2019). Global Aquaculture Production 1950-2017. Recuperado el 01 de abril de 2019, de http://www.fao.org/fishery/statistics/globalaquaculture-production/query/en
Fathi, M., Dickson, M., Leschen, W., Baily, J., Muir, F., Ulrich, K. y Weidmann, M. (2017). Identification of tilapia lake virus in Egypt in Nile tilapia affected by ‘ summer mortality’ syndrome Aquaculture(473), 430-432.
Ferguson, H., Kabuusu, S., Beltrán, E., Reyes, E., Lince, J. y Del Pozo, J. (2014). Syncytial hepatitis of farmed tilapia, Oreochromis niloticus (L.): a case report. Journal of Fish(37), 583-589.
Jansen, M., Dong, H. y Mohan, C. (2018). Tilapia lake virus: a threat to the global tilapia industry? Reviews in Aquaculture doi: https://doi.org/10.1111/raq.12254
Kembou, T, J., Zamostiano, R., Watted, S., Berkowitz, A., Rosenbluth, E., Mishra, N. y Bacharach, E. (2017). Detection of tilapia lake virus in clinical samples by culturing and nested reverse transcription‐PCR. Journal of Clinical Microbiology(55), 759.767. doi:https://doi.org/10.1128/JCM.01808-16
Koesharyani, I., Gardenia, L., Widowati, Z., Khumaira, K. y Rustianti, D. (2018). Studi kasus infeksi Tilapia lake virus (TiLV) pada ikan nila (Oreochromis niloticus). Jurnal Riset Akuakultur, 13(1), 85-92. doi:https://doi.org/10.15578/jra.13.1.2018.85-92
Leaño, E. M. y Liang, Y. (Edits.). (abril de 2018). Emergency Regional Consultation for Prevention and Management of Tilapia Lake Virus (TiLV) in the Asia-Pacific. Obtenido de https://digitalarchive.worldfishcenter.org/bit stream/handle/20.500.12348/713/2018-TiLVChina-
Proceedings.pdf?sequence=1&isAllowed=y
Mugimba, K., Chengula, A., Wamala, S., Mwega, E., Kasanga, C., Byarugaba, D. y Mutoloki, S. (2018). Detection of tilapia lake virus (Ti LV) infection by PCR in farmed and wild Nile tilapia (Oreochromisniloticus) from Lake Victoria. Journal of Fish Diseases(41), 1181-1189. doi:https://doi.org/10.1111/jfd.12790
NACA. (2017). Tilapia Lake Virus (TiLV) - An Emerging Threat to Farmed Tilapia in the Asia-Pacific Region. Disease Advisory, Network of Aquaculture Centres in AsiaPacific
OIE. (2017). Virus de la Tila´pia de Lago (TiLV) - Un nuevo tipo de virus del tipo Orthomyxo Tarjeta de la enfermedad, Organización Mundial de Sanidad Animal (OIE).
OIE. (21 de 05 de 2017a). Notificación inmediata: Virus de la Tilapia del Lago, Israel. Obtenido de World Animal Health Information Database (WAHIS) Interface: https://www.oie.int/wahis_2/public/wahid.ph p/Reviewreport/Review?reportid=23954
OIE. (24 de 09 de 2017b). Notificación Inmediata: Virus de la Tilapia del Lago, Tailandia. Obtenido de World Animal Health Information Database (WAHIS) Interface:
https://www.oie.int/wahis_2/public/wahid.ph p/Reviewreport/Review?page_refer=MapFull EventReport&reportid=23832
OIE. (25 de 09 de 2017c). Notificación inmediata: Virus de la Tilapia del lago, Malasia. Obtenido de World Animal Health Information Database (WAHIS) Interface: https://www.oie.int/wahis_2/public/wahid.ph p/Reviewreport/Review?page_refer=MapFull EventReport&reportid=24809
OIE. (14 de 06 de 2017d). Notificación inmediara: Virus de la Tilapia del Lago, Taipei Chino. Obtenido de World Animal Health Information Database (WAHIS) Interface:
https://www.oie.int/wahis_2/public/wahid.ph p/Reviewreport/Review?reportid=24033
OIE. (23 de 11 de 2017d). Notificación inmediata: Virus de la Tilapia del Lago, Filipinas. Obtenido de World Animal Health Information Database (WAHIS) Interface: https://www.oie.int/wahis_2/public/wahid.ph p/Reviewreport/Review?page_refer=MapFull EventReport&reportid=25278
OIE. (12-14 de diciembre de 2018a). Reporting emerging diseases - tilapia lake virus a case study. Obtenido de http://www.rrasia.oie.int/fileadmin/Regional_Representati on/Programme/I_Welfare/2017.12_FP_AA_Qi ngdao/1-6._Peeler_Emerging_diseaseswhy_report_case_study-TiLV_a.pdf
OIE. (27 de 02 de 2018b). Notificación inmediata: Virus de la Tilapia del Lago, Perú. Obtenido de World Animal Health Information Database (WAHIS) Interface: https://www.oie.int/wahis_2/public/wahid.ph p/Reviewreport/Review?page_refer=MapFull EventReport&reportid=26027
OIE. (25 de 08 de 2018c). Notificación inmediata: Virus de la Tilapia del Lago, México. Obtenido de World Animal Health Information Database (WAHIS Interface: https://www.oie.int/wahis_2/public/wahid.ph p/Reviewreport/Review?page_refer=MapFull EventReport&reportid=27650
OIE. (06 de 05 de 2019). Virus de la Tilapia del Lago. Notificación inmediata. Obtenido de Organización Mundial de Sanidad Animal. WAHIS Interface: https://www.oie.int/wahis_2/public/wahid.ph p/Reviewreport/Review?page_refer=MapFull EventReport&reportid=30412
OIE. (21 de 06 de 2019a). Notificación inmediata: Virus de la Tilapia del Lago, India. Obtenido de World Animal Health Information Database (WAHIS) Interface: https://www.oie.int/wahis_2/public/wahid.ph p/Reviewreport/Review?page_refer=MapFull EventReport&reportid=30775
OIE. (06 de mayo de 2019b). Notificación Inmediata: Virus de la Tilapia del Lago, Estados Unidos de América. Obtenido de World Animal Health Information Database (WAHIS) Interface: http://www.oie.int/wahis_2/public/wahid.ph p/Reviewreport/Review?page_refer=MapFull EventReport&reportid=30412
Senasica. (27 de mayo de 2019). Recupera México el estatus de país libre del virus de la tilapia del lago: SADER. Obtenido de senasica.gob.mx: https://www.gob.mx/senasica/prensa/recupe ra-mexico-estatus-de-pais-libre-del-virus-dela-tilapia-del-lago-sader-201636
Senasica (20 de marzo de 2019). Sistema de Información Nacional de Enfermedades Exóticas y Emergentes. (SINEXE).
Thammatorn,W., Rawiwan, P. y Surachetpong, W. (25 de octubre de 2018). Minimal risk of tilapia lake virus transmission via frozen tilapia fillets. Journal of Fish Diseases(42), 3-9. doi:https://doi.org/10.1111/jfd.12924
University of Florida-IFAS Extension. (2019). Tilapia Lake Virus (TiLV): a Globally Emerging Threat to Tilapia Aquaculture. Obtenido de University of Florida-IFAS Extension: https://edis.ifas.ufl.edu/fa213
Yamkasem,J., Tattiyapong, P., Kamlungdee, A., & Surachetpong, W. (29 de abril de 2019). Evidence of potential vertical transmission of tilapia lake virus. Journal of Fish Diseases(00), 1-8. doi:10.1111/jfd.13050
La marchitez por Fusariosis de las musáceas es causada por el hongo Fusarium oxysporum f. sp. cubense. La aparición en el sudeste asiático a finales de los 80´s de la Raza 4 Tropical, constituye una gran amenaza para los productores de musáceas a nivel mundial, por lo que es catalogada como una de las enfermedades más destructivas de los cultivos de banano y plátano. También se caracteriza por su amplia variabilidad.
Los principales hospedantes de la plaga Fusarium oxysporum f. sp.
cubense Raza 4 Tropical son: plátano y banano, abacá, heliconia, platanera silvestre bijao, avecilla, platanillo, xacate borrego, canutillo, ensete, leche vana, lechosa, hierba de San Juan y leche de sapo.
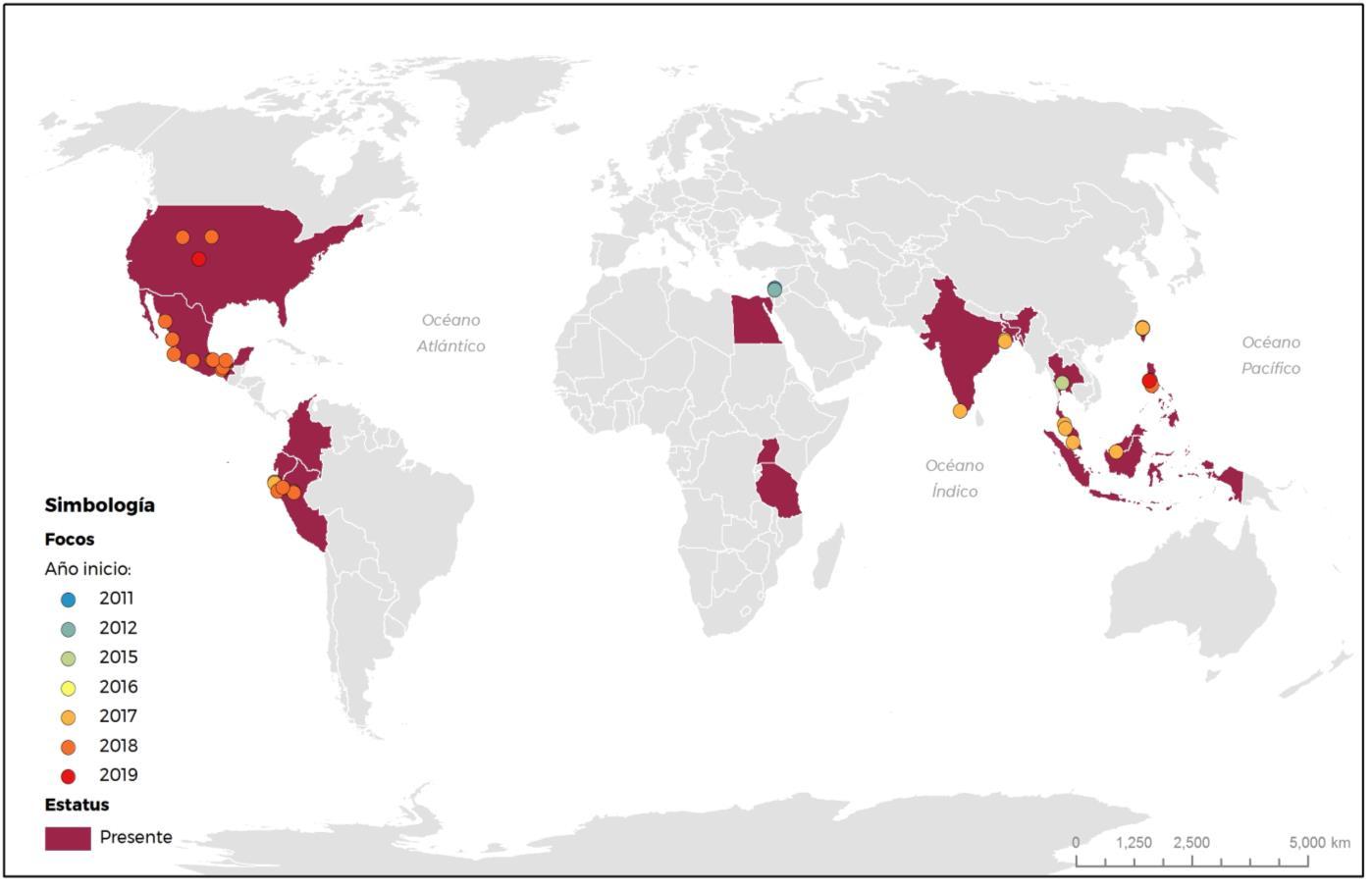
Se encuentra presente en 17 países y recientemente se confirmó la presencia en Colombia, siendo el primer país en América con presencia de Fusarium oxysporum f. sp. cubense Raza 4 Tropical. (Figura 1) (OIRSA, 2018).
Figura 1. Distribución mundial de Fusariosis de las Musáseas (Fusarium oxysporum f. sp. cubense Raza 4 Tropical)
Conforme a la Convención
Internacional de Protección
Fitosanitaria (IPPC, por sus siglas en inglés), Fusarium oxysporum f. sp. cubense raza 4 Tropical, se encuentra incluida en la Lista de Plagas Cuarentenarias
Reglamentadas (LPCR) de México: asimismo, se cataloga como una plaga ausente según lo dispuesto en la NIMF 08.
Entre los principales daños que provoca el hongo están los de tipo externo que consisten en el amarillamiento de las hojas iniciando en las más viejas hasta llegar a las más jóvenes, a lo largo del margen foliar hasta que la hoja se encuentre completamente seca y de color café. Las hojas colapsan gradualmente en la unión del pecíolo con el pseudotallo quedando colgadas alrededor.
Los daños de tipo interno son la necrosis en el sistema vascular, formación de geles o tilosas. Existe decoloración de los haces vasculares del pseudotallo y del raquis. Las vainas de las hojas externas del pseudotallo extendiéndose hacia las más internas, en el pseudotallo y cormos infectados se observan bandas de color marrón o negro que corresponden a los haces vasculares afectados por el hongo.
F. oxysporum f. sp. cubense Raza 4
Tropical se desarrolla a una temperatura óptima de 25‐28 °C, el crecimiento se inhibe cuando la temperatura es cercana a 33 °C y no es favorable por debajo de 17 °C (Cook y Baker, 1983). Es capaz de crecer y esporular sobre un amplio rango de valores de pH (óptimo a pH 7.5‐8.5); creciendo mejor en
condiciones de oscuridad continua (Nelson et al., 1981).
Puede sobrevivir en residuos vegetales y formar estructuras de resistencia llamadas clamidosporas, los cuales permanecen latentes en el suelo, residuos vegetales y raíces de hospederos alternantes, hasta por 30 años (Moore et al., 1995).
De introducirse y dispersarse esta enfermedad en México pondría en riesgo 2,229,519 toneladas de plátano con una superficie sembrada de 82,154 hectáreas, lo que representa una valor de 7,029 millones de dólares (SIAP, 2019).
Durante el 2018, México exportó 569,875 toneladas de plátano principalmente a Estados Unidos de América; cabe resaltar que en 2017, México ocupó a nivel mundial el lugar n° 18 dentro de los países productores de banano y plátano (Cuadro 1).
Cuadro 1. Principales países productores de banano y plátano 2017
A nivel mundial, Fusarium oxysporum f. sp. cubense Raza 4 Tropical ha causado pérdidas económicas en plantaciones de Taiwán, Malasia, Indonesia, China, Filipinas y el Norte de Australia, más de 8 millones de plantas en traspatios y más de 5,000 ha. de plantaciones comerciales del cultivar Cavendish han sido afectadas, con pérdidas anuales que superan los 75 millones de dólares (Lara, 2009); la Gráfica 1 resume la producción mundial de banano y plátano por continente.
Gráfica 1. Producción mundial de banano y plátano por continente
Las principales formas de dispersión de la enfermedad son la vía natural (material vegetal contaminado, suelo, y agua contaminada) y la antropogénicas (factores climáticos, inmigración, contrabando, turismo, y comercio) (Moore et al., 1995).
El Senasica cuenta con tres barreras de defensa para prevenir la introducción de Fusarium oxysporum f. sp. cubense Raza 4 Tropical:
Primera Barrera de defensa
Inspección a productos agropecuarios, acuícolas y pesqueros de importación y de movilización nacional.
Segunda Barrera de defensa
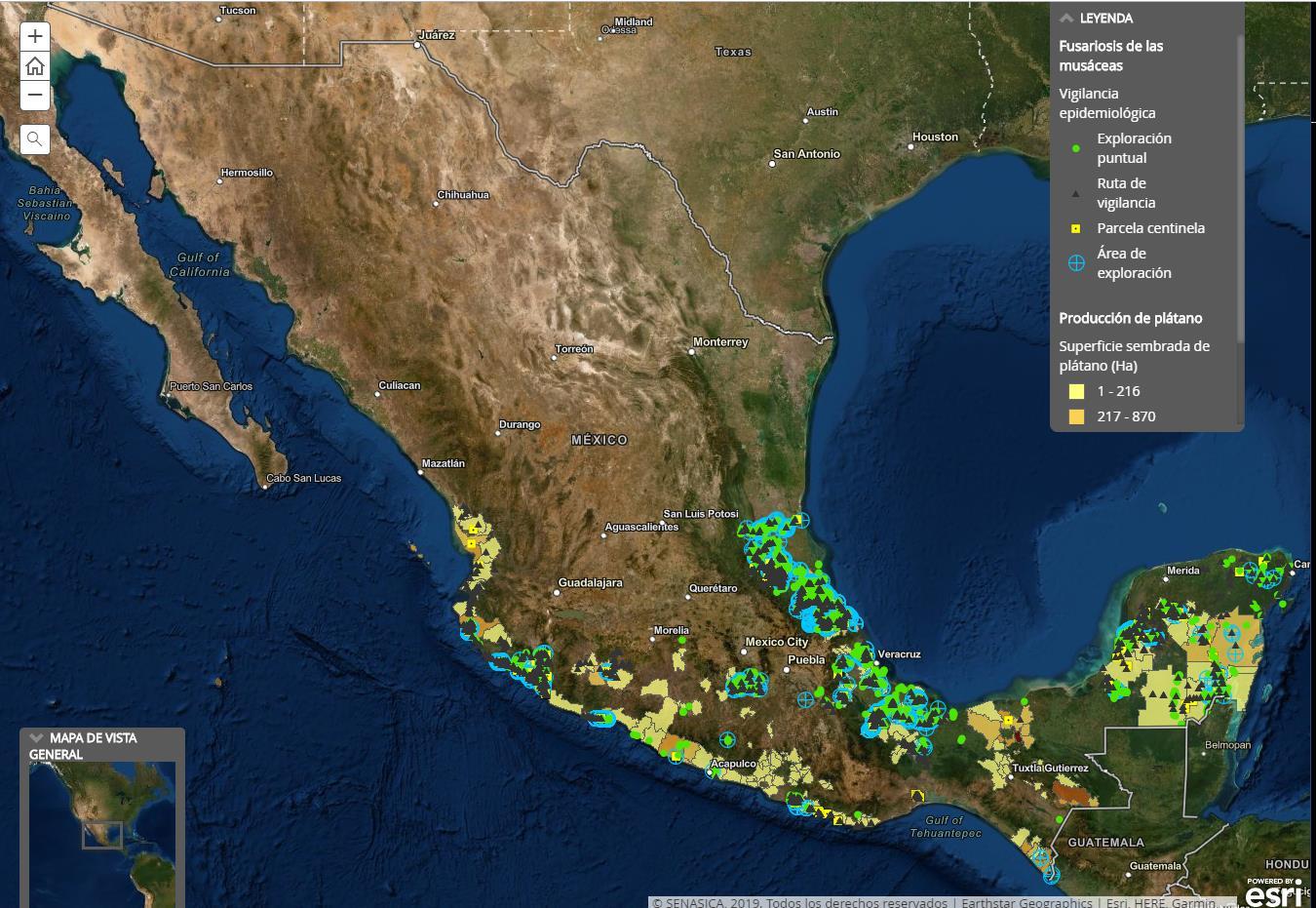
Se realizan actividades de vigilancia epidemiológica fitosanitaria para esta plaga en 16 estados del país, mediante 281 parcelas centinelas instaladas, 1,233 sitios de vigilancia, exploración de 7,441.84 hectáreas y 3,884 puntos de inspección para la detección de este patógeno (Mapa 2).
Mapa 2. Acciones de vigilancia epidemiológica (2019).
Tercera Barrera de defensa Se cuenta con Plan de Contingencia ante un Brote de la Raza 4 Tropical de Fusarium oxysporum f. sp. cubense en un país de la región OIRSA. Asimismo, se han realizado tres simulacros fitosanitarios para el fortalecimiento técnico y sector productivo, donde han participado:
• Organismo Internacional Regional de Sanidad Agropecuaria (OIRSA).
• Empresa Brasileña de Investigación Agropecuaria (EMBRAPA).
• Red Latinoamericana y del Caribe para la Investigación y el Desarrollo de las Musáceas (MUSALAC).
• Corporación Bananera Nacional (CORBANA).
• Plant Ontology (PO).
• Consejo Sistema Producto Plátano.
• Bioverity Internacional.
• Colegio de Postgraduados (COLPOS).
• Universidad Autónoma Chapingo (UACh).
• Comités Estatales de Sanidad Vegetal (CESV).
• Dirección General de Sanidad Vegetal (DGSV) del Senasica.
Referencias
Caracol Televisión, 2019 En línea: https://caracol.com.co/radio/2019/08/08/n acional/1565300822_263603.html Fecha de consulta: agosto 2019
Cook, RJ and Baker KF. 1983. The nature and practice of biological control of plant
pathogens. The American Phytopathological Society, St. Paul, MN, USA. 539 pp
ICA, 2019 Instituto Colombiano Agropecuario. En línea: https://www.ica.gov.co/noticias/icaamplia-y-refuerza-las-medidas-que-yavenia-im. Fecha de consulta: agosto 2019
Lara, F. D. F. 2009. Uso de bacterias endofíticas para el control biológico del Mal de Panamá (Fusarium oxysporum f. sp. cubense) en el cultivar Gros Michael (AAA). Centro Agronómico Tropical de Investigación y Enseñanza (CATIE). Tesis de Maestría. 59 p
Moore, N. Y., Bentley, S., Pegg, K. G. y Jones D. R. 1995. Fusarium wilt of banana. Musa Disease Fact Sheet No. 5. International Network for the Improvement of Bananan and Plantain (INIBAP). Montpellier, Cedex 5, France. 4.page.
OIRSA, 2017 Organismo Internacional Regional de Sanidad Agropecuario. “Análisis de Riesgo de Plagas Fusarium oxysporum f. sp. cubense raza 4 Tropical (FocR4T), como plaga cuarentenaria para la región del OIRSA” San Salvador, El Salvador. 239 p
OIRSA, 2018 Organismo Internacional Regional de Sanidad Agropecuario. “Plan de Contingencia ante un Brote de la Raza 4 Tropical de Fusarium oxysporum f. sp cubense en un país de la región OIRSA,” San Salvador, El Salvador. 190 p
SIAP, 2019. Servicio de Información Agroalimentaria y Pesquera. Cierre Agrícola 2018. En línea: https://nube.siap.gob.mx/cierreagricola/ Fecha de consulta: Agosto de 2019
SIAVI, 2019. Sistema de Información Arancelaria Vía Internet de la Secretaria de Economía. En línea http://www.economiasnci.gob.mx/ <http://www.economiasnci.gob.mx/>. Fecha de consulta: agosto de 2019
El Ministerio de Agricultura, Pesca y Alimentación (MAPA), organizó los días 4 y 5 de junio de 2019, un simulacro de la presencia de la Peste Porcina Africana (PPA) en jabalíes silvestres, siendo la sede para la coordinación de este evento el Instituto de Investigaciones en Recursos Cinegéticos (IREC) en Ciudad Real, España.
El simulacro contó con la participación de 55 especialistas de sanidad animal, caza y ambiente provenientes de:
Ministerio de Agricultura, Pesca y Alimentación (MAPA).
Ministerio para la Transición Ecológica y del Servicio de Protección de la Naturaleza (SEPRONA).
Instituto de Investigaciones en Recursos Cinegéticos (IREC).
Comunidades Autónomas (CCAA).
Tres escenarios en diferentes zonas geográficas del país en función de:
La densidad de jabalís
Los tipos de producción
La orografía
Fuente: IREC
Fuente: IREC
Objetivos:
Evaluar los sistemas de respuesta rápida ante emergencias.
Fomentar la relación, coordinación e intercambio de información entre los servicios veterinarios, de caza y de medio ambiente, así como la estimación de recursos humanos y materiales para mejorar la capacidad de respuesta por aparición de focos de PPA en jabalíes.
Evitar que la PPA llegue a España.
Activación del centro local de crisis
Ejes
Práctica, revisión y mejora de los protocolos para la repuesta ante focos de PPA en jabalíes
Desarrollo de un programa de control y erradicación adaptado a cada escenario
Estimación y organización de recursos materiales y humanos
Organización y fomento de la comunicación y coordinación de todos los sectores implicados
Fuente: IREC
Fuente: IREC
Fuente: MAPA
Fuente: Caza y Safaris
Conclusiones del simulacro de PPA en jabalíes, emitidas por el Ministerio de Agricultura, Pesca y Alimentación de España
Fortalezas
Disponibilidad de planes de contingencia y protocolos de trabajo.
Extensa red de comunicación entre el personal oficial y productores.
Disponibilidad inmediata de información de calidad sobre movilización, censos y unidades de producción, así como de ranchos cinegéticos, resultados de caza y ecología y dinámica de poblaciones de jabalíes a nivel local.
Canales de comunicación bien establecidos entre las autoridades sanitarias y de medio ambiente- caza.
Cuerpos de seguridad especializados en sanidad animal, ganadería y caza como el SEPRONA.
Presencia de una red de Agentes Medioambientales (personal en campo).
Recursos para el control de la PPA asegurados a través de la declaración oficial de emergencia nacional.
Experiencia con la PPA, pues en los años noventa se logró erradicar en España.
Recomendaciones y necesidades específicas del MAPA de España
Actuar rápido: la prioridad es tratar de limitar la expansión de la enfermedad y conocer la situación a través de la aplicación de sistemas de vigilancia y monitoreo enfocados al riesgo.
Priorizar acciones con base en el riesgo: asegurar que los recursos humanos y materiales se destinan a las actividades prioritarias y a las zonas de mayor riesgo.
Evitar subestimar. Es necesario prepararse para el peor escenario posible en cuanto a recursos materiales y humanos.
Garantizar altos estándares de bioseguridad en todos los
Debilidades
Falta de información práctica sobre la eficacia de diferentes medidas de gestión del jabalí tomando como referencia la experiencia de los países afectados de la Unión Europea.
No existe un plan detallado de comunicación destinada a la población en general, asimismo, falta de expertos en el tema.
Escasez de los medios de sacrificio, efectivos y rápidos para el ganado porcino.
Falta de canales de comunicación efectivos con las asociaciones de cazadores asentadas en áreas rurales.
Falta un protocolo detallado del sistema de búsqueda de cadáveres en caso de emergencia.
CCAA con sistemas cartográficos y fuentes de información diferentes, lo cual dificulta el intercambio de información entre las CCAA y los niveles centrales.
Algunas regiones cuentan con recursos materiales y humanos limitados para garantizar una capacidad de respuesta inmediata y efectiva ante los brotes.
Se identificaron requerimientos complementarios en el manual práctico de PPA.
procedimientos dentro y fuera de la zona afectada.
Considerar todas las fuentes de información disponibles.
Optimizar la coordinación y cadena de mandos.
Colocar información (cárteles) en gasolineras y áreas de descanso de carreteras, para garantizar una buena gestión de los residuos de alimentos.
Capacitación especializada para el personal involucrado (agentes medioambientales, cazadores, médicos veterinarios, ganaderos) y concienciación de todos los sectores.
Implementar una Estrategia Nacional de control de poblaciones de jabalíes como medida preventiva en ausencia de enfermedad.
El simulacro ha permitido evaluar de forma práctica la capacidad de alerta y respuesta inmediata, en diversas situaciones, para mejorar los protocolos de trabajo ante un eventual brote de PPA en jabalí.
En cualquier caso, no hay una receta única, la actuación depende de la zona geográfica, superficie afectada, población de jabalíes, distribución de explotaciones, por lo cual será necesario adaptar la gestión a estas particularidades.
Referencias:
Caza y Safaris. La UNAC muestra su “preocupación” por las conclusiones del MAPA sobre la PPA. En línea: https://cazawonke.com/actualidad/85559-launac-muestra-su-preocupacion-por-lasconclusiones-del-mapa-sobre-la-ppa (Fecha de consulta: julio de 2019).
Diario Veterinario. 2019. Las autoridades españolas realizan simulacro de Peste Porcina Africana. En línea: http://www.diarioveterinario.com/textodiario/mostrar/1445193/autoridades-espanolasrealizan-simulacro-peste-porcina-africana (Fecha de consulta: junio de 2019.
Instituto de Investigaciones en Recursos Cinegéticos. 2019. Simulacro de Peste Porcina Africana organizado por el IREC. En línea: http://www.irec.es/difusion/noticias/simulacropeste-porcina-africana-organizado-irec/ (Fecha de consulta: julio de 2019).
Ministerio de Agricultura, Pesca y Alimentación. Dirección General de Sanidad de la Producción Agraria. 2019. Conclusiones simulacro foco de Peste Porcina Africana (PPA) en jabalíes Fortalezas, debilidades, recomendaciones y necesidades específicas identificadas por los participantes. En línea: https://www.3tres3.com/3tres3_common/art/3tr es3/41417/fitxers/simulacro%20ppa%20jabali.pd f (Fecha de consulta: julio de 2019).
Ministerio de Agricultura, Pesca y Alimentación. 2019. El Ministerio de Agricultura, Pesca y Alimentación realiza una simulación de foco de peste porcina africana para evaluar los sistemas de respuesta rápida ante emergencias. En línea: https://www.mapa.gob.es/es/prensa/ultimasnoticias/El-Ministerio-de-Agricultura,-Pesca-yAlimentaci%C3%B3n-realiza-unasimulaci%C3%B3n-de-foco-de-peste-porcinaafricana-para-evaluar-los-sistemas-derespuesta-r%C3%A1pida-ante-emergencias/tcm:30-510099 (Fecha de consulta: junio de 2019).
Introducción
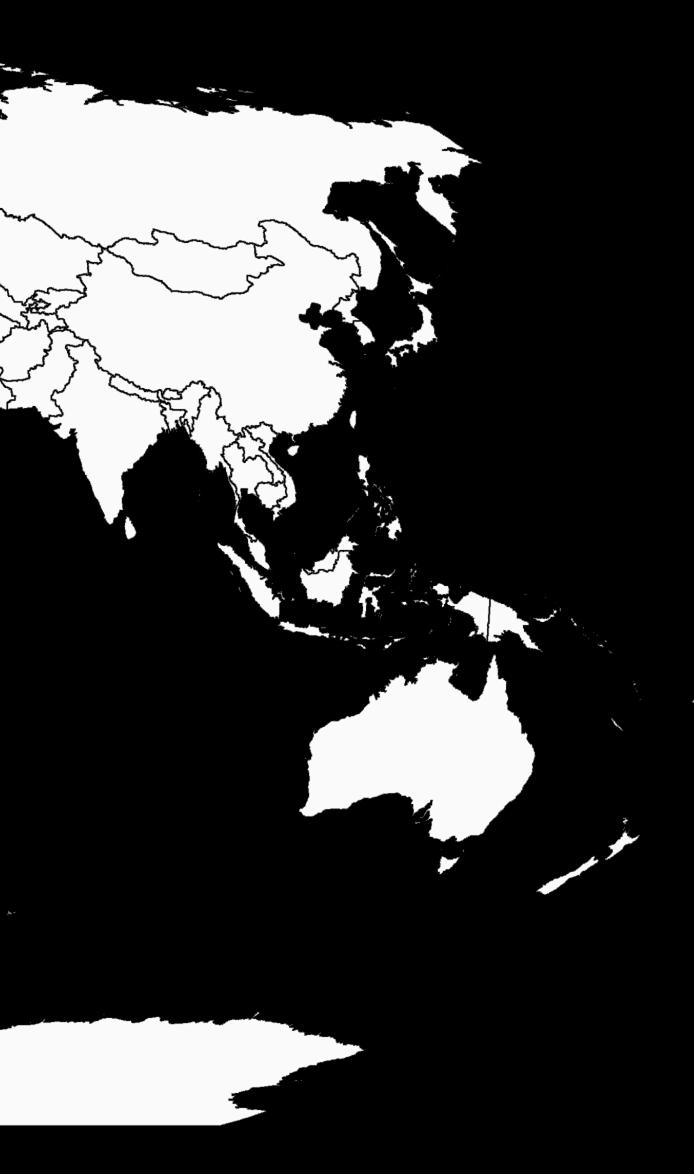
La Palomilla de nopal Cactoblastis cactorum Berg., es una especie nativa de Sudamérica que fue introducida de Argentina hacia Australia en 1925 con el objetivo de controlar plantas del género Opuntia, logrando con ello controlar 25 millones de hectáreas de nopal. Actualmente C. cactorum se encuentra presente en 24 países (CABI, 2018) (Mapa 1).
Su alimentación se basa en varios géneros de Opuntia, por ejemplo: Opuntia albicarpa, O. cochenillifera, O. atrispina, O. aurea, O. auberi, entre otras especies de la familia Cactaceae.
De introducirse la palomilla del nopal a México afectaría una producción de 1.7 millones de toneladas de nopal y tuna (SIAP, 2019).
Primera detección en 2006
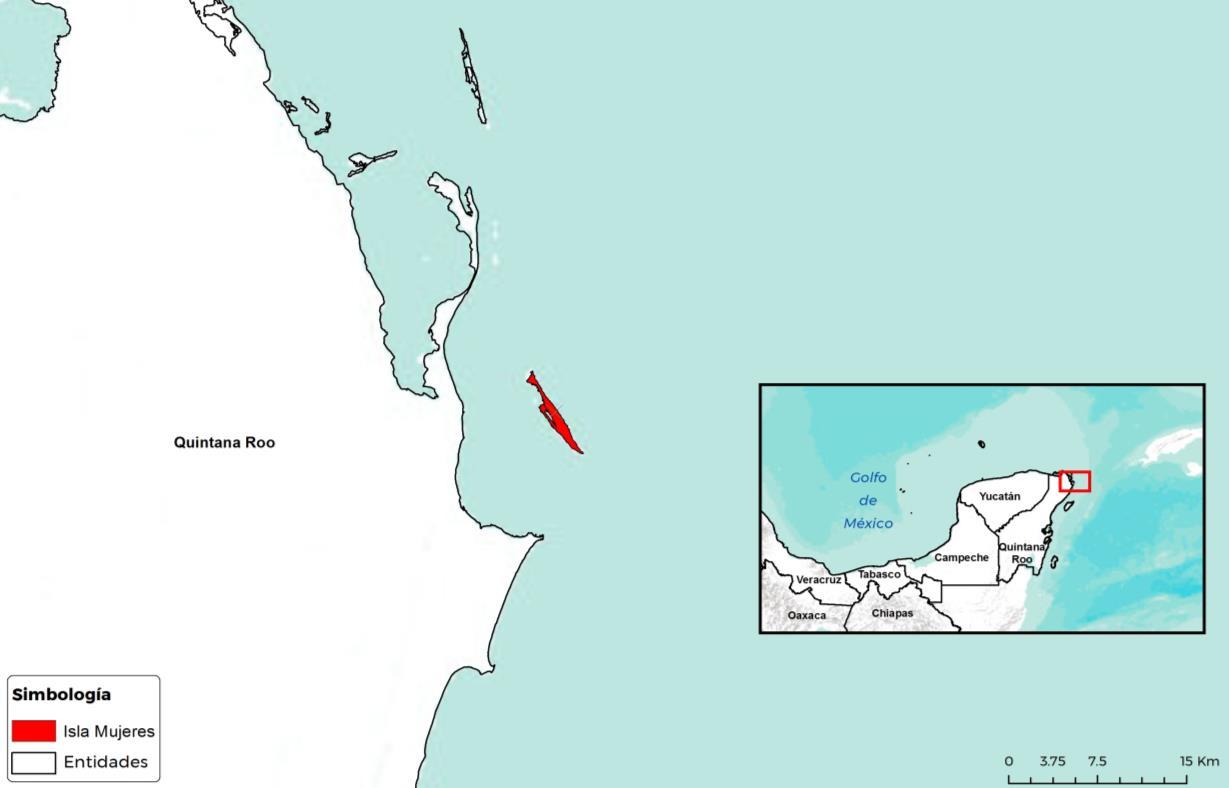
El 01 de agosto 2006 el Comité de Sanidad Vegetal de Quintana Roo notificó al Senasica, sobre la posible presencia de Cactoblastis cactorum en Isla Mujeres (Mapa2), Quintana Roo.
El Senasica, a través del Centro Nacional de Referencia
Fitosanitaria, dio seguimiento, evaluó y confirmó que la muestra colectada correspondía a la Palomilla del Nopal (NAPPO, 2006).
Mapa 1. Países con presencia de C. cactorum
Medidas fitosanitarias
Ante la detección, se implementaron medidas fitosanitarias, conforme a lo señalado en la NOM-081-FITO-2001, consistente en el Manejo y eliminación de focos de infestación de plagas, mediante el establecimiento o reordenamiento de fechas de siembra, cosecha y destrucción de residuos, (DOF, 2009).
El Senasica en conjunto con la Comisión Nacional de Áreas Naturales Protegidas de la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT), el Departamento de Agricultura de los Estados Unidos de América (USDA) y la Organización Internacional de Energía Atómica, realizaron remoción y control de
hospederos, eliminación de pencas con larvas, utilización de plantas centinelas y trampas con feromonas, uso de insecticidas, capacitación, divulgación, además de aplicar la Técnica de Insecto Estéril.
Segundo brote: mayo, 2007
En la Reserva Natural Protegida de Isla Contoy, se capturaron dos ejemplares de palomilla del nopal sin embargo, se implementó una estrategia de erradicación diferente, se utilizaron únicamente trampas con feromonas, se realizó la remoción de pencas y se implementó la Técnica del Insecto Estéril, por tratarse de un área en donde interactúan distintas especies (animales y vegetales) de importancia ecológica
Mapa 2. Primera detección de la Palomilla del Nopal en México
El proceso de erradicación
El brote de Cactoblastis cactorum Berg en Quintana Roo se consideró erradicado (NAPPO, 2009), en febrero, al cumplirse el periodo equivalente a tres ciclos biológicos de la plaga sin detecciones, de acuerdo al modelo teórico de Tassan.
Durante el periodo de 2010 a 2018 se vigilaron 31,173 áreas de exploración. Asimismo, se establecieron 27,418 parcelas centinela y 179,756 observaciones en rutas de trampeo, además de 11,759 observaciones en rutas de vigilancia, en zonas de cultivos comerciales y de riesgo de introducción (Senasica-PVEF, 2018).
Con la erradicación de esta plaga a nivel nacional se protege una superficie de 77 mil hectáreas, de las cuales se obtiene una producción de nopal y tuna de 1.7 millones de toneladas, con un valor de 3 mil millones de pesos (SIAP, 2019); así
como también, la protección de Áreas Naturales que albergan 104 especies silvestres y 60 endémicas hospedantes de la plaga.
Actualmente en México, la especie C. cactorum se encuentra en la categoría de Plaga Cuarentenaria, ausente en el país, de acuerdo a la Norma Internacional para Medidas Fitosanitarias (NIMF) No. 5, Glosario de términos fitosanitarios (IPPC, 2019). Además, se da seguimiento a la especie a través de actividades de Vigilancia Epidemiológica Fitosanitaria en los estados de Baja California Sur, Campeche, Coahuila, Chihuahua, Ciudad de México, Hidalgo, Estado de México, Morelos, Nuevo León, Puebla, Quintana Roo, San Luís Potosí, Tabasco, Tamaulipas, Veracruz, Yucatán y Zacatecas; realizando acciones de exploración de 1,543 ha, 416 parcelas centinela y 1,498 rutas de trampeo y 245 rutas de vigilancia en los cultivos de nopal.
Referencias
CABI, 2018. Invasive Species Compendium. Cactoblastis cactorum (cactusmoth). En línea: https://www.cabi.org/isc/datasheet/106 80. Fecha de consulta: agosto de 2019.
DOF, 2009. ACUERDO mediante el cual se declara erradicado el brote de palomilla del nopal (Cactoblastis cactorum Berg.) en Isla Mujeres, Municipio de Isla Mujeres, Quintana Roo. Fecha de consulta: agosto de 2019.
NAPPO, 2006. Detección de un brote de Palomilla del Nopal Cactoblastis cactorum En línea: https://www.pestalerts.org/espanol/opr
Detail.cfm?oprID=216 Fecha de consulta: agosto de 2019.
NAPPO, 2009. Detección de un brote de Palomilla del Nopal Cactoblastis cactorum. En línea: https://www.pestalerts.org/espanol/opr Detail.cfm?oprID=376 Fecha de consulta: agosto de 2019.
Senasica, Dirección General de
Sanidad Vegetal. Palomilla del Nopal. Mayo 2019.
Senasica-PVEF. 2018. Programas de trabajo de Vigilancia Epidemiológica Fitosanitaria. Senasica-Sader. México, D.F. Programa de Vigilancia Epidemiológica Fitosanitaria (PVEF)Servicio Nacional de Sanidad Inocuidad y Calidad Agroalimentaria (Senasica).
SIAP, 2019. Cierre agrícola 2018, producción de Nopal, nopalitos y tuna. En línea: https://nube.siap.gob.mx/cierreagricola / Fecha de consulta: agosto de 2019.
Las garrapatas son los ectoparásitos más nocivos para la salud animal, debido al gran número de especies que afectan (mamíferos, aves, reptiles y anfibios) (Imamura et al., 2005) y por los daños que causan a sus hospederos como el debilitamiento por la succión de sangre, disminución de la producción, daños en la piel, alérgias, inoculación de toxinas causantes de parálisis temporales y aumento en los costos de producción (Heath, 2016; Calderón et al., 2005; Muñoz y Casanueva, 2001).
Recientemente se ha señalado el establecimiento generalizado de una nueva especie de garrapata en algunas regiones de los Estados Unidos, en octubre de 2017 en el estado de Nueva Jersey se recolectó un gran número de garrapatas Haemaphysalis longicornis también conocida como "garrapata asiática de cuernos largos", “garrapata del arbusto” (Australia) y “garrapata del ganado” (Nueva Zelanda) la cual se consideraba exótica para el continente americano (Hutcheson et al., 2019; USDA, 2019; Raghavan et al., 2019).