Actualización EMS Mortalidad acumulada (%) 100
80
60
BSA (10 o 20 µg/g) ToxA (5 0 10 µg/g) ToxB (5 µg/g) ToxB (10 µg/g) ToxA + ToxB 2:2 µg/g ToxA + ToxB 5:5 µg/g ToxA + ToxB 10:10 µg/g
AHPND
Mortalidad sin AHPND
40
20
camarones aparentemente saludables, una vez que mueren y se descomponen por cinco horas previo a la fijación mejora significativamente la sensibilidad de la detección (usando iniciadores AP4), mientras que camarones preservados inmediatamente no resultaron positivos usando los mismos iniciadores. Finalmente, se puede recolectar heces de pájaros depredadores de camarón y realizar la prueba de detección sobre este material, ya que investigadores en Tailandia obtuvieron resultados positivos.
Patogénesis hipotética de la enfermedad
0 0
6
12
24
36 48 Horas post-infección
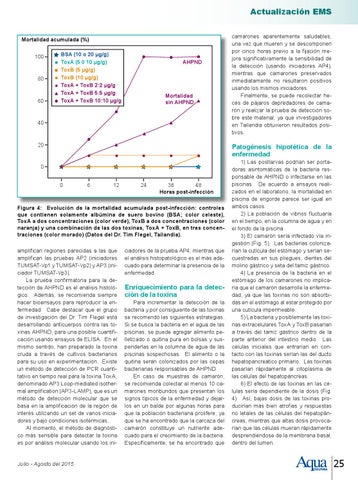
Figura 4: Evolución de la mortalidad acumulada post-infección: controles que contienen solamente albúmina de suero bovino (BSA; color celeste), ToxA a dos concentraciones (color verde), ToxB a dos concentraciones (color naranja) y una combinación de las dos toxinas, ToxA + ToxB, en tres concentraciones (color morado) (Datos del Dr. Tim Flegel, Tailandia). amplifican regiones parecidas a las que amplifican las pruebas AP2 (iniciadores TUMSAT-Vp1 y TUMSAT-Vp2) y AP3 (iniciador TUMSAT-Vp3). La prueba confirmatoria para la detección de AHPND es el análisis histológico. Además, se recomienda siempre hacer bioensayos para reproducir la enfermedad. Cabe destacar que el grupo de investigación del Dr. Tim Flegel está desarrollando anticuerpos contra las toxinas AHPND, para una posible cuantificación usando ensayos de ELISA. En el mismo sentido, han preparado la toxina cruda a través de cultivos bacterianos para su uso en experimentación. Existe un método de detección de PCR cuantitativo en tiempo real para la toxina ToxA, denominado AP3 Loop-mediated isothermal amplification (AP3-LAMP), que es un método de detección molecular que se basa en la amplificación de la región de interés utilizando un set de varios iniciadores y bajo condiciones isotérmicas. Al momento, el método de diagnóstico más sensible para detectar la toxina es por análisis molecular usando los ini-
Julio - Agosto del 2015
ciadores de la prueba AP4, mientras que el análisis histopatológico es el más adecuado para determinar la presencia de la enfermedad.
Enriquecimiento para la detección de la toxina
Para incrementar la detección de la bacteria y por consiguiente de las toxinas se recomendó las siguientes estrategias. Si se busca la bacteria en el agua de las piscinas, se puede agregar alimento pelletizado o quitina pura en bolsas y suspenderlas en la columna de agua de las piscinas sospechosas. El alimento o la quitina serán colonizados por las cepas bacterianas responsables de AHPND. En caso de muestras de camarón, se recomienda colectar al menos 10 camarones moribundos que presentan los signos típicos de la enfermedad y dejarlos en un balde por algunas horas para que la población bacteriana prolifere, ya que se ha encontrado que la carcaza del camarón constituye un nutriente adecuado para el crecimiento de la bacteria. Específicamente, se ha encontrado que
1) Las postlarvas podrían ser portadoras asintomáticas de la bacteria responsable de AHPND o infectarse en las piscinas. De acuerdo a ensayos realizados en el laboratorio, la mortalidad en piscina de engorde parece ser igual en ambos casos. 2) La población de vibrios fluctuaría en el tiempo, en la columna de agua y en el fondo de la piscina. 3) El camarón sería infectado vía ingestión (Fig. 5). Las bacterias colonizarían la cutícula del estómago y serían secuestradas en sus pliegues, dientes del molino gástrico y seta del tamiz gástrico. 4) La presencia de la bacteria en el estómago de los camarones no implicaría que el camarón desarrolle la enfermedad, ya que las toxinas no son absorbidas en el estómago al estar protegido por una cutícula impermeable. 5) La bacteria y posiblemente las toxinas extracelulares ToxA y ToxB pasarían a través del tamiz gástrico dentro de la parte anterior del intestino medio. Las células iniciales que entrarían en contacto con las toxinas serían las del ducto hepatopancreático primario. Las toxinas pasarían rápidamente al citoplasma de las células del hepatopáncreas. 6) El efecto de las toxinas en las células sería dependiente de la dosis (Fig. 4). Así, bajas dosis de las toxinas producirían más bien atrofias y respuestas no letales de las células del hepatopáncreas, mientras que altas dosis provocarían que las células mueran rápidamente desprendiéndose de la membrana basal, dentro del lumen.
25