




Introducción
La nomenclatura inorgánica es el conjunto de reglas que permiten nombrar y formular correctamente los compuestos inorgánicos. Su objetivo es facilitar la comunicación científica y evitar confusiones. Actualmente, se aceptan principalmente tres sistemas de nomenclatura: el sistema estequiométrico o sistemático (IUPAC), el sistema tradicional o funcional, y el sistema Stock.
1. Sistemas de nomenclatura
• Nomenclatura sistemática (IUPAC): Usa prefijos numéricos para indicar el número de átomos de cada elemento en el compuesto. Ejemplo: P2O5 se nombra como pentaóxido de difósforo
• Nomenclatura tradicional o funcional: Se basa en raíces y sufijos que indican el tipo de compuesto y el estado de oxidación del elemento. Ejemplo: ácido sulfúrico, óxido ferroso.
• Nomenclatura Stock: Indica el número de oxidación del metal o elemento en números romanos entre paréntesis. Ejemplo: Fe2O3 se nombra óxido de hierro(III).
2. Reglas generales para nombrar compuestos inorgánicos
• Se escribe primero el nombre del anión (o elemento con carga negativa) y luego el catión (o elemento con carga positiva)
• El número de oxidación se indica entre paréntesis en números romanos cuando el elemento puede tener varios estados de oxidación.
• No se mezclan prefijos numéricos con números de oxidación; se elige un sistema y se mantiene.
• Para compuestos de coordinación, los ligantes se nombran en orden alfabético sin considerar prefijos.
3. Nomenclatura de
3.1 Óxidos
• Compuestos formados por oxígeno y otro elemento.
• Ejemplos:
• Óxidos metálicos: FeO (óxido de hierro(II)).
• Óxidos no metálicos o ácidos: CO2 (dióxido de carbono).
3.2 Hidróxidos
• Formados por un metal y grupos hidroxilo (OH)
• Ejemplo: NaOH (hidróxido de sodio)
3.3 Ácidos
• Compuestos que liberan iones hidrógeno (H+) en solución acuosa.
• Ácidos hidrácidos: Formados por hidrógeno y un no metal. Ejemplo: HCl (ácido clorhídrico).
• Oxiácidos: Contienen hidrógeno, oxígeno y otro elemento no metálico.
Ejemplo: H2SO4 (ácido sulfúrico).
3.4 Sales
• Resultan de la reacción entre un ácido y una base.
• Se nombran con la raíz del anión + sufijo -uro + "de" + nombre del catión + número de oxidación si es necesario.
• Ejemplo: NaCl (cloruro de sodio), CuS (sulfuro de cobre(II))
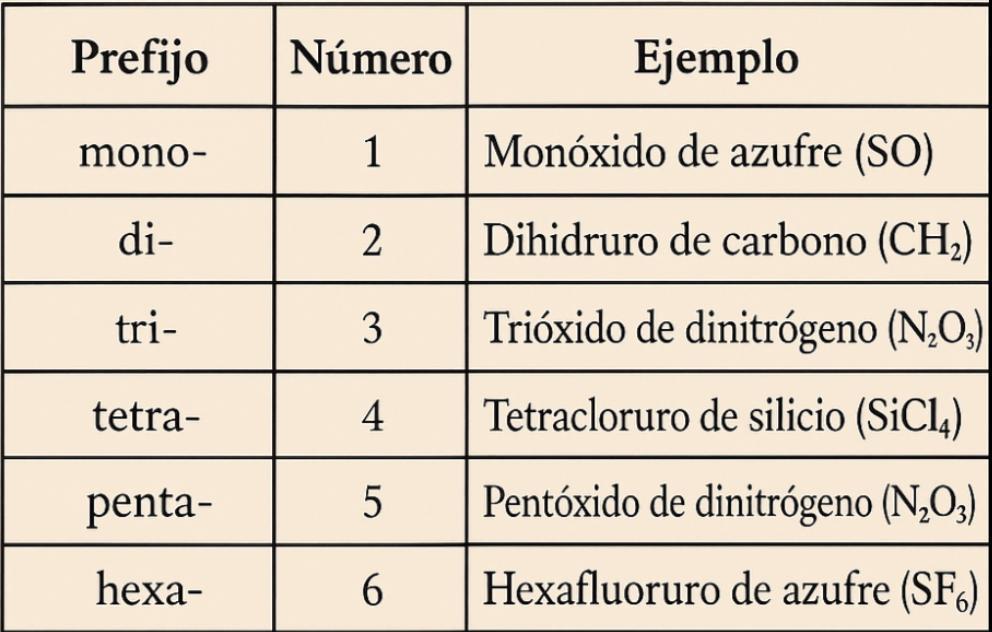
4. Uso de prefijos numéricos
• Mono- (1), di- (2), tri- (3), tetra- (4), penta- (5), hexa- (6), etc
• Se usan en nomenclatura sistemática para indicar la cantidad de átomos.
• Ejemplo: CO (monóxido de carbono), N2O5 (pentóxido de dinitrógeno).
5. Signos de agrupación en fórmulas
• Paréntesis ( ), corchetes [ ], y llaves { } se usan para agrupar átomos o ligantes en compuestos complejos.
• Ejemplo: [Pt(NH3)2Cl2] se nombra diaminodicloroplatino(II).
• Portal Académico del CCH - UNAM. Reglas de nomenclatura química.
• Libros OA UNAM. Nomenclatura básica de Química Inorgánica.
• Guía Breve para la Nomenclatura de Química Inorgánica (EHU).
• Dialnet (Universidad de La Rioja). Nomenclatura química y normas de la IUPAC. Guías breves para la nomenclatura inorgánica según el Libro Rojo de la IUPAC.
