Écris des messages secrets, fais une explosion de couleur et amuse-toi avec la chimie !

ATTENTION
Ne convient pas aux enfants de moins de 8 ans. À utiliser sous la surveillance d’un adulte. Lire les instructions avant utilisation, s’y conformer et les garder comme référence. Contient des produits chimiques qui présentent un danger pour la santé. Éviter tout contact des produits chimiques avec le corps, notamment la bouche et les yeux. Éloigner les jeunes enfants et les animaux de la zone où sont réalisées les expériences. Mettre le coffret d’expériences hors de portée des enfants de moins de 8 ans. Ce produit contient des ballons. Attention ! Les ballons de baudruche non gonflés ou abîmés peuvent présenter un risque d’étouffement ou de suffocation pour les enfants de moins de huit ans. La surveillance d’un adulte est nécessaire. Ne pas laisser de ballons de baudruche non gonflés à la disposition des enfants. Les ballons de baudruche abîmés doivent être jetés immédiatement. En latex de caoutchouc naturel. Petits éléments (danger d'étouffement). Bords coupants. L'image est uniquement à titre indicatif, le contenu ou les couleurs peuvent varier. Garder toutes les informations pour toute référence future. D'autres matériaux ménagers courants peuvent être nécessaires.
15 expériences
8+
Chers parents et superviseurs
En jouant, les enfants développent différentes aptitudes cognitives. Des études scientifiques démontrent que lorsqu’on passe un bon moment ou lorsqu’on fait des découvertes lors d’expériences, un neurotransmetteur appelé dopamine est libéré.
La dopamine est responsable de sensations et de comportements tels que la motivation, la recherche de récompense et l’apprentissage, c’est pourquoi les expériences sont liées à des sentiments positifs. Ainsi, si l’apprentissage engendre un sentiment positif, cela stimulera le cerveau à développer diverses compétences.
Science4you vise donc à développer des jeux éducatifs qui combinent le plaisir et l’apprentissage en favorisant la curiosité et l’expérimentation.
Découvrez ci-dessous quelles compétences peuvent être développées à l’aide de ce jouet éducatif !
Concentration
Interaction sociale
Vocabulaire
Raisonnement
Apprentissage
Le caractère éducatif est l’une des principales forces de nos jeux. Notre objectif est de concevoir des jeux qui permettent aux enfants de développer leurs compétences physiques, affectives et sociales.
1 ère édition 2024, Lisbonne, Portugal
Auteur : Inês Martins
Traduction : Delphine Martinez
Relecture scientifique : Ana Garcia
Vérification de conformité : Rute Cesário; Susana Ferreira
Développement du produit : Ana Garcia
Directeur du projet : Inês Martins ; Joana Lemos
Pagination : Jorge Faria
Illustrations : Filipa Rocha
2
Sommaire
RÈGLES DE SÉCURITÉ
INFORMATIONS GÉNÉRALES DE PREMIERS SECOURS
RECOMMANDATIONS POUR LES ADULTES SURVEILLANTS
LISTE DES SUBSTANCES FOURNIES
ÉLIMINATION DES SUBSTANCES
CONTENU DU KIT
1. Expériences
1.1. Mélange de substances et solutions
Expérience supplémentaire. Comparer plusieurs mélanges
1.2. Séparation des mélanges
Expérience 1. Préparation d’un filtre
Expérience 2. Séparation de l’eau et du sable
Expérience 3. Cromatographie
1.3. Diffusion
Expérience supplémentaire. Est-ce que les molécules de l’eau bougent réellement ?
Expérience 4. Diffusion
1.4. Densité
Expérience 5. Une lampe de lave… ou presque
Expérience 6. Verre coloré
1.5. Le pH des substances
Expérience 7. Le pH des substances
Expérience 8. Messages secrets colorés
1.6. Oxydation
Expérience 9. Messages secrets avec du citron
Expérience supplémentaire. Pourquoi les pommes coupées brunissent-elles ?
1.7. Tension superficielle
Expérience 10. Explosion de couleur
1.8. Cristaux
Expérience 11. Cristaux
Expérience supplémentaire. Stalagmites et stalactites
1.9. Production de dioxyde de carbone
Expérience 12. Colonne de mousse
Expérience 13. Comment gonfler un ballon sans souffler ?
Expérience 14. Éruption volcanique
supplémentaire. Mousse de blanc d’œuf
1.10. Osmosis
Expérience 15. Comment les bonbons en gelée se comportent-ils dans différentes solutions ?
1.11. Fluides et solides qu’on peut mouler
Expérience supplémentaire. Solide ou liquide
1.12. Molécules
Expérience supplémentaire. Fais des molécules fantastiques !
2.
Tous droits réservés. Aucune partie de cette publication ne peut être reproduite, archivée ou transmise, sous quelque forme ou par quelque moyen que ce soit (électronique, mécanique, par photocopie, sous forme enregistrée ou autre) sans l’autorisation écrite préalable, ou ainsi qu’expressément autorisé par la loi, ou en vertu des accords convenus avec l’organisation de droits de reproduction appropriée. Toute utilisation non autorisée de ce livre, ou toute violation des droits de ce livre, permet à l’entreprise, de recevoir une juste compensation sur le plan juridique, sans exclure la responsabilité criminelle pour les responsables de ces violations.
3
Expérience
Questionnaire 4 4 4 5 5 6 8 8 8 9 9 10 10 11 11 12 13 13 14 15 15 17 18 19 20 20 21 22 22 23 24 25 26 27 28 29 29 30 30 31 32 34
RÈGLES DE SÉCURITÉ
- Lire ces instructions avant utilisation, s’y conformer et les garder comme référence.
- Éloigner les jeunes enfants et les animaux de la zone où sont réalisées les expériences.
- Ranger ce coffret d’expériences et les cristaux obtenus hors de portée des enfants de moins de 8 ans.
- Nettoyer la totalité du matériel après utilisation.
- S’assurer que tous les récipients sont hermétiquement fermés et convenablement stockés après utilisation.
- S’assurer que tous les récipients vides et/ou l’emballage non refermable sont correctement éliminés.
- Se laver les mains une fois les expériences terminées.
- Ne pas utiliser d’autre matériel que celui fourni avec le coffret ou recommandé dans la notice d’utilisation.
- Ne pas manger ou boire dans la zone où sont réalisées les expériences.
- Éviter tout contact des produits chimiques avec les yeux ou la bouche.
- Ne pas remettre les denrées alimentaires dans leur récipient d’origine. Les jeter immédiatement.
- Ne pas appliquer de substances ou solutions sur le corps.
- Ne pas mettre en développement des cristaux là où des aliments ou des boissons sont manipulés ou dans les chambres à coucher.
- Manipuler l’eau chaude et les solutions chaudes avec soin.
- S’assurer que, pendant le développement des cristaux, le récipient contenant le liquide est hors de portée des enfants de moins de 8 ans.
INFORMATIONS GÉNÉRALES
DE PREMIERS SECOURS
- En cas de contact avec les yeux : laver abondamment à l’eau en maintenant les yeux ouverts si nécessaire. Consulter immédiatement un médecin.
- En cas d’ingestion : rincer la bouche abondamment avec de l’eau, boire de l’eau fraîche. Ne pas faire vomir. Consulter immédiatement un médecin.
- En cas d’inhalation : transporter la personne à l’extérieur.
- En cas de contact avec la peau et de brûlures : laver abondamment à l’eau la zone touchée pendant au moins 10 minutes.
- En cas de doute, consulter un médecin sans délai. Emporter le produit chimique et son récipient.
- En cas de blessure, toujours consulter un médecin.
RECOMMANDATIONS POUR LES ADULTES SURVEILLANTS
- Lire et observer ces instructions, les règles de sécurité et les informations relatives aux premiers secours, et les garder comme référence.
- L’utilisation incorrecte des produits chimiques peut engendrer des blessures et nuire à la santé. Réaliser uniquement les expériences décrites dans les instructions.
- Ce coffret d’expériences est à utiliser uniquement par des enfants de plus de 8 ans.
- Compte tenu de très grandes variations des capacités des enfants, même au sein d’un groupe d’âge, il convient que les adultes surveillants apprécient avec sagesse quelles sont les expériences appropriées et sans risque pour les enfants. Il convient que les instructions permettent aux adultes surveillants d’évaluer chacune des expériences afin de pouvoir déterminer son adéquation à un enfant particulier.
- Il convient que l’adulte surveillant s’entretienne des avertissements et des informations de sécurité avec l’enfant ou les enfants avant de commencer les expériences. Il convient d’accorder une attention particulière à la sécurité lors de la manipulation d’acides, d’alcalis et de liquides inflammables.
- Il convient que la zone où sont réalisées les expériences soit sans obstacles et ne soit pas située près d’une réserve de denrées alimentaires. Il convient qu’elle soit bien éclairée et aérée, et à proximité d’une adduction d’eau. Il convient d’utiliser une table solide dont la surface est résistante à la chaleur.
- Si des matériaux non fournis avec ce coffret sont suggérés et utilisés, assurez-vous qu’ils conviennent à cet usage et qu’ils sont en bon état (par exemple, stockage et durée de conservation).
- Ce coffret contient des colorants (pigments). Les colorants peuvent tacher. Gardez-les loin des objets et des tissus.
- Ce coffret contient des gants qui peuvent être fabriqués à partir de latex. Le latex peut provoquer des allergies.

4
En cas d’empoisonnement par l’un des composants utilisés dans ce coffret, contactez le centre antipoison ou l’hôpital le plus proche.
Veuillez consulter le lien suivant pour plus d’informations : https://poisoncentres.echa. europa.eu/appointed-bodies
En cas d’urgence, contactez
LISTE DES SUBSTANCES FOURNIES
Bicarbonate de sodium NaHCO3 (CAS 144-55-8)
INGRÉDIENTS : HYDROGÉNOCARBONATE DE SODIUM
Colorant rouge
INGRÉDIENTS : EAU, PHÉNOXYÉTHANOL, CI 16255, BENZOATE DE SODIUM, SORBATE DE POTASSIUM
Recommandations pour les substances et les mélanges : ne pas ingérer. Éviter le contact avec les yeux et la bouche. Utiliser seulement selon les instructions. Conserver dans des récipients hermétiquement fermés. Conserver dans un endroit frais et sec. Protéger de l’humidité, de la lumière directe du soleil et des sources de chaleur.
ÉLIMINATION DES SUBSTANCES
Ne jetez pas de substances et / ou de mélanges avec les ordures ménagères. Pour plus de détails, contactez une autorité compétente. Pour disposer de l’emballage, utilisez les points de collecte collectifs.
5
: EU 112 | UK 999 | USA & CAN 911 | AU 000
CONTENU DU KIT






Entonnoir





Gants
































































Grands verres à mesurer









Petits verres à mesurer
















Spatules en bois Filtres en papier





6































































Colorant




rouge











Éprouvettes avec couvercles














































Pipettes Pasteur


















Bicarbonate de sodium









Ensemble de papier indicateur de pH Balloons










Spatule en plastique
7
Bonjour scientifique !
Veux-tu devenir un véritable chimiste ?
1.1. Mélange de substances et solutions
EN APPRENDRE DAVANTAGE…
1. Expériences
Avant de commencer, tu devrais apprendre à manipuler correctement la pipette Pasteur. Les pipettes Pasteur sont des instruments de mesure utilisés dans les laboratoires pour transférer de petites quantités de liquide de contenant en contenant. Avec une pipette Pasteur, il est possible de compter les gouttes et c’est pour cette raison qu’on l’appelle également le compte-goutte.
La matière peut être une substance pure ou un mélange. Connais-tu la différence entre une substance et un mélange ? Une substance est constituée d’atomes ou de molécules, elle a une composition caractéristique et un ensemble de propriétés. Elle peut être simple quand elle est constituée d’un seul élément chimique (comme, l’or ou le fer) ou composée quand elle est formée de plus d’un type d’atomes (comme l’eau, le sel et le sucre). Les mélanges sont composés de deux substances ou plus. Les mélanges peuvent être homogènes, hétérogènes et colloïdaux. Les mélanges homogènes sont également appelés solutions. Une solution est composée d’au moins un solvant et un soluté. Un solvant est une substance capable d’en dissoudre une autre, alors qu’un soluté est une substance qui se dissout dans une autre substance.
1st Faire sortir l’air en appuyant sur la partie supérieure de la pipette Pasteur; 2nd Relâcher la pression à l’intérieur du liquide pour remplir la pipette Pasteur; 3rd Presser lentement jusqu’à ce que les gouttes commencent à tomber une à une.


EXPÉRIENCE SUPPLÉMENTAIRE
Comparer plusieurs mélanges
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants


• Grands verres à mesurer
• Spatule en bois
Matériel supplémentaire :
• Eau • Huile d’olive • Jus d’orange
8
Procédure :
1. Remplis la moitié des grands verres à mesurer avec de l’eau.
2. Ajoute de l’huile dans un des verres et du jus d’orange dans l’autre verre. Mélange bien avec la spatule en bois.
Quel genre de mélanges avons-nous dans chaque verre ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
Explication :
Le mélange d’eau avec le jus d’orange est un mélange homogène. Les forces intermoléculaires entre les molécules de l’eau sont semblables à celles qui existent entre les molécules du jus d’orange. Ainsi, les molécules d’eau subissent le même type d’interaction avec le jus d’orange. La miscibilité des deux liquides est donc créée, ils peuvent se mélanger. Ainsi, dans un mélange homogène ou solution, le mélange a un aspect uniforme dans lequel il n’est pas possible de distinguer ses constituants, même au microscope. Le mélange de l’eau avec l’huile est un mélange hétérogène Dans ce type de mélange, nous arrivons à distinguer parfaitement ses constituants à l’œil nu. Les interactions entre les molécules sont différentes dans ces mélanges. Les molécules d’eau et d’huile d’olive ont des propriétés différentes qui les rendent immiscibles.
1.2. Séparation des mélanges
EN APPRENDRE DAVANTAGE…
Parfois, nous voulons récupérer une des substances présentes dans un mélange. Il est alors nécessaire d’utiliser une méthode spécifique de séparation pour l’obtenir. Il y a plusieurs processus de séparation des mélanges et pour choisir le mieux adapté à nos besoins, nous devons prendre en considération le type de mélange que nous avons. Il faut d’abord observer si le mélange est homogène ou hétérogène et ensuite il est possible de choisir le processus de séparation.
Les liquides immiscibles sont des liquides qui ne se mélangent pas.


EXPÉRIENCE 1
Préparation d’un filtre
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Entonnoir

• Pipette Pasteur

• Filtre en papier • Gants
Matériel supplémentaire : • Eau
Procédure :
1. Plie le filtre en papier tel qu’illustré sur l’image suivante. Puis place le filtre dans l’entonnoir.
1 2 3 4 5 5 mm
Image 1. Montage d’un filtre dans un entonnoir. Mot clé : mm - millilmètre.
9
2. Avec la pipette Pasteur, ajoute quelques gouttes d’eau pour que le filtre en papier adhère mieux à l’entonnoir.
Remarque : conserve ce montage, il te servira dans d’autres expériences
Arrives-tu à séparer l’eau du sable ?
Comment s’appelle la technique que tu viens d’utiliser ?
Explication :


EXPÉRIENCE 2
Séparation de l’eau et du sable
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants

• Filtre en papier

• Entonnoir

• Grand verre à mesurer

• Petit verre à mesurer

• Éprouvette avec couverle

• Spatule en bois plastique
Matériel supplémentaire :
• Eau • Sable
Procédure :
1. Avec le petit verre à mesurer, ajoute 10 millilitres (ml) d’eau dans le grand verre à mesurer. Puis, avec la spatule en plastique, ajoute une cuillerée de sable. Mélange bien avec la spatule en bois.

2. Place l’entonnoir avec le filtre en papier, comme à l’expérience 1, dans une éprouvette.
3. Verse le mélange d’eau et de sable dans l’entonnoir.
Le filtre retient le sable, ses particules sont plus grandes que les trous (pores) présents dans le filtre. Le sable reste donc coincé dans le filtre et l’eau qui tombe dans l’éprouvette est propre. Ce procédé de séparation des mélanges s’appelle la filtration. Dans un processus de filtration, nous séparons les particules solides en suspension dans un liquide en passant dans un filtre.


EXPÉRIENCE 3
Chromatographie
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants

• Filtre en papier
Matériel supplémentaire :
• Marqueurs de couleur • Eau
• Papier absorbant (essuie-tout)
Procédure :
1. Avec les marqueurs de couleur, dessine des petits points sur le filtre en papier, en les plaçant comme sur l’image suivante.

2. Fais un petit rouleau avec une feuille de papier absorbant et mouille la pointe avec de l’eau.
10




3. Place la pointe mouillée du papier absorbant au centre du filtre en papier afin de le mouiller.

Observe ce qui arrive aux petits points de différentes couleurs que tu as dessinés sur le papier !
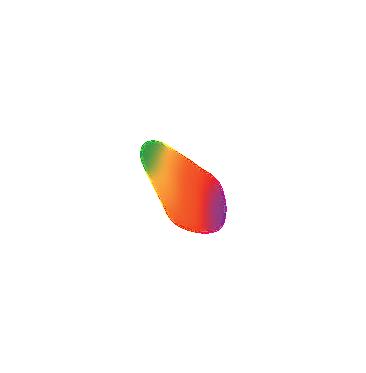
Explication :
Ce processus est appelé chromatographie
La chromatographie est une méthode physique et chimique de séparation de mélanges homogènes. La séparation de ses composants est possible puisqu’ils ont des poids, des masses et des densités différents.
Dans le cas d’une couleur secondaire, il est possible de la décomposer en couleurs primaires à l’aide de la technique de chromatographie, puisque les couleurs de base ont des poids différents. Ainsi, elles restent à des endroits différents sur le papier quand l’eau n’est plus capable de les entraîner.
1.3. Diffusion
EN APPRENDRE DAVANTAGE…
La capacité qu’ont les substances de se déplacer vers d’autres substances s’appelle la diffusion. Ainsi, la diffusion d’un colorant alimentaire est plus élevée dans l’eau que dans l’eau salée.



EXPÉRIENCE SUPPLÉMENTAIRE
Est-ce que les molécules de l’eau bougent réellement ?
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants

• Colorant rouge
• Pipettes Pasteur


• Grands verres à mesurer
Matériel supplémentaire :
• Eau du robinet (chaude et froide)
ATTENTION : demande de l’aide à un adulte.
Procédure :
1. Remplis un grand verre à mesurer avec de l’eau froide du robinet.
2. Remplis l’autre verre avec la même quantité d’eau chaude.
3. Avec la pipette Pasteur, ajoute une goutte de colorant alimentaire rouge dans chaque verre, en même temps. Assure-toi que tu mets exactement le même nombre de gouttes dans les deux verres. Ne les mélange pas.
Qu’est-ce que tu observes ?
11
Explication :
Le colorant alimentaire se répand dans l’eau des deux verres, mais à des vitesses différentes. Quand l’eau est chaude, les molécules d’eau bougent plus rapidement, alors le colorant alimentaire se répand plus vite. Dans l’eau froide, le colorant alimentaire se répand moins vite puisque le mouvement des molécules d’eau n’est pas aussi rapide que dans l’eau chaude.
3. Ajoute une goutte de colorant alimentaire rouge dans chaque grand verre à mesurer avec la pipette Pasteur. Ne mélange pas les mélanges.
Qu’observes-tu ? Dans quel verre le colorant bouge-t-il plus vite ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.


EXPÉRIENCE 4
Diffusion
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :
• Pipette Pasteur
• Spatule en bois

• Gants


• Grands verres à mesurer

• Colorant rouge
Matériel supplémentaire :
• Sel • Eau
• Cuillère à soupe
Procédure :
1. Remplis les deux grands verres à mesurer avec de l’eau.
2. Dans l’un des verres, ajoute du sel jusqu’à ce que tu n’arrives plus à le dissoudre. En d’autres mots, prépare une solution saturée.
Explication :
Le colorant alimentaire bouge plus rapidement dans le verre qui contient seulement de l’eau. Après un certain temps, le liquide des deux verres est totalement coloré.
Même si nous n’arrivons pas à les voir, les molécules d’eau sont toujours en mouvement. Quand tu places du colorant dans l’eau, les molécules d’eau entrent en collision avec celles du colorant, les faisant aussi bouger. Ainsi, le colorant et l’eau vont complètement se mélanger et le liquide prend la couleur du colorant. Si les molécules d’eau bougent plus vite, les molécules du colorant bougent vite aussi et le liquide changera rapidement de couleur. Le colorant se déplace plus lentement dans l’eau avec le sel, parce qu’en plus des molécules d’eau, il y a aussi des molécules de sel. Les molécules de sel occupent de l’espace ce qui complique le mouvement des molécules dans la solution. Dans cette solution, il y a plus de molécules et donc moins d’espace libre pour qu’elles bougent, ce qui rend le mouvement plus lent.
12
Eau
Eau avec du sel
1.4. Densité
EN APPRENDRE DAVANTAGE…
La densité est une mesure de la matière. Elle nous aide à quantifier la matière constituée par des atomes, des molécules ou des ions présents dans un certain volume d’une substance. Par exemple, les substances moins denses que l’eau vont flotter alors que les substances plus denses que l’eau vont couler.
3. Remplis le reste de la bouteille avec de l’huile. Tu peux utiliser l’entonnoir.


EXPÉRIENCE 5
Une lampe de lave… ou presque
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants

4. Attends un peu jusqu’à ce que les deux liquides se séparent complètement.
5. Ensuite ajoute du sable dans la bouteille avec la spatule en plastique.
Qu’est-ce que tu observes ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.

• Pipette Pasteur plastique
• Colorant rouge

• Entonnoir
Matériel supplémentaire :
• Sel • Eau • Huile de cuisson
• Bouteille vide et propre avec le bouchon
Procédure :
1. Remplis le ¾ de la bouteille avec de l’eau.
2. Ajoute un peu de colorant alimentaire rouge à l’eau à l’aide de la pipette Pasteur. Ferme la bouteille et secoue-la un peu pour mélanger le colorant et l’eau.
Explication :
L’huile flotte sur l’eau parce qu’une goutte d’huile est plus légère qu’une goutte d’eau de la même taille. Ainsi, l’huile est moins dense que l’eau.
La densité est la masse d’un matériel avec le volume qu’il occupe.

Le sel est plus lourd (plus dense) que l’eau alors il coule vers le bas de la bouteille. Dans cette expérience, en ajoutant du sel dans la bouteille, il y a des petites gouttes d’huile qui s’attachent aux grains de sel et coulent dans le fond de la bouteille. Quand le sel est dissout, l’huile remonte sur le dessus, créant presque l’effet d’une lampe de lave.
13


EXPÉRIENCE 6
Verre coloré
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants

• Petit verre à mesurer
• Pipette Pasteur

• Colorant rouge

• Grand verre à mesurer
• Spatule en bois
Matériel supplémentaire :
• Grand verre • Eau • Miel
• Huile de cuisson • Marqueur
• Éthanol (96 %) ou éthanol commercial
ATTENTION : demande de l’aide à un adulte.
Sois prudent, l’éthanol est facilement inflammable.

Procédure :
1. Verse 25 ml d’eau dans le grand verre à l’aide du petit verre à mesurer.
2. Identifie et marque le niveau de l’eau.
3. Verse l’eau du grand verre dans le grand verre à mesurer.
4. Ajoute le miel dans le grand verre jusqu’au niveau que tu as marqué plus tôt.
5. Avec la pipette Pasteur, ajoute 2 gouttes de colorant alimentaire rouge dans l’eau que tu as mise dans le grand verre à mesurer. Mélange l’eau et le colorant alimentaire avec la spatule en bois.
6. Verse l’eau (avec le colorant) dans le grand verre où il y a le miel.
7. Avec le petit verre à mesurer, ajoute 25 ml d’huile dans le grand verre.
8. Verse également, avec précaution et très lentement, 25 ml d’éthanol dans le grand verre. Utilise le petit verre à mesurer pour t’aider.
Qu’est-ce que tu observes ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
Explication :
Les substances que tu as utilisées dans cette expérience présentent des densités différentes. Les quatre substances restent les unes au-dessus des autres sans se mélanger. Tu as pu observer que le liquide plus dense est le miel puisqu’il reste au fond. Ensuite viennent la couche d’eau, puis la couche d’huile et finalement, la couche d’éthanol. Ces substances ont des densités différentes, certaines sont plus denses que d’autres. En d’autres mots, les substances plus denses ont plus de particules dans le même volume que les moins denses. C’est pour cette raison que les substances les plus denses restent toujours en dessous des moins denses. Dans ce cas-ci, le miel est la substance la plus dense, ensuite, l’eau, puis l’huile. L’éthanol reste au-dessus, parce que c’est la substance la moins dense.
14
1.5. Le pH des substances
EN APPRENDRE DAVANTAGE…
Les substances peuvent être acides, basiques ou neutres. Les substances chimiques (basiques ou acides faibles) créent des changements de couleur sur les indicateurs de pH. Ainsi, nous pouvons déterminer si nous sommes en présence d’une substance acide, neutre ou basique. Ces indicateurs peuvent être naturels ou synthétiques. On utilise souvent un papier indicateur, appelé indicateur universel. Ce papier permet d’identifier les valeurs du pH, puisque ses couleurs ont été bien définies.



EXPÉRIENCE 7
Le pH des substances
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants


• Grands verres à mesurer

plastique

• Bicarbonate de sodium
• Pipette Pasteur
• Spatule en bois

• Ensemble de papier indicateur de pH
Matériel supplémentaire :
• Citron • Eau
Procédure :
Première partie - prépare une solution acide.
1. Afin d’obtenir une solution acide, presse la moitié d’un citron dans un verre à mesurer.
2. Ensuite, mets tes gants, prends une languette de papier indicateur de pH et plonge-la dans le liquide. Assure-toi que tu as les gants afin de ne pas contaminer le papier indicateur de pH.
Qu’est-il arrivé au papier indicateur de pH ?
15
Image 2. Indicateur de pH.
Explication :
La languette de papier indicateur de pH a changé de couleur, maintenant elle est jaune. Que s’est-il passé ? Nous avons introduit l’indicateur de pH dans une solution acide, ce qui a causé un changement de couleur.
Deuxième partie - prépare une solution basique.
1. Afin d’obtenir une solution basique, verse un peu de bicarbonate de sodium dans le deuxième grand verre à mesurer propre.
Utilise la spatule en plastique pour t’aider. Ajoute un peu d’eau. Mélange bien avec la spatule en bois.
2. Puis, avec tes gants, mets une languette de papier indicateur de pH dans le liquide.
Scientifique, que s’est-il passé avec la languette de papier indicateur de pH ?
3. Ajoute lentement, à l’aide de la pipette Pasteur, la solution de bicarbonate de sodium à la solution acide. Observe le changement graduel de couleur sur la languette de papier indicateur de pH.
Compare les couleurs des deux tests avec l’échelle de pH !
Astuce : Si le papier pH ne fonctionne pas correctement, essaie d’ajouter plus de soluté dans tes solutions.
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
Explication :
La languette de papier change de couleur si tu ajoutes du bicarbonate de sodium. Le bicarbonate de sodium est une base. Quand tu ajoutes une base à un acide, la solution devient neutre.
Si tu continues à ajouter du bicarbonate, il y aura un moment où l’indicateur deviendra vert. À ce moment-là, nous passons d’une solution neutre à une solution basique.
Solutions neutres
16
Image 3. Échelle universelle d’indicateur de pH.
Acidité
Solutions
Alcalinité
Solutions acides
croissante
basiques
croissante


EXPÉRIENCE 8
Messages secrets colorés
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :
• Pipette Pasteur

• Spatule en boiss plastique



• Bicarbonate de sodium
• Petit verre à mesurers

Matériel supplémentaire :
• Chou rouge • Couteau • Cuillère en bois
• Contenant grand et large • Eau chaude
• Contenant avec un couvercle • Pinceau • Citron
• Coton-tige • Feuille de papier ou de carton
ATTENTION : demande de l’aide à un adulte.
Procédure :
Première partie - prépare un indicateur de pH naturel
1. Mets l’eau chaude dans le contenant grand et large.
2. Demande à un adulte de couper le chou rouge en petits morceaux et place les morceaux dans l’eau chaude.
4. Enlève les morceaux de chou et garde le liquide indicateur dans un contenant avec un couvercle. Tu en auras besoin dans la deuxième partie de cette expérience.
Observe l’échelle de pH indicateur pour le chou rouge !
SUBSTANCES
Acides
Neutres
Basiques
3. Mélange avec la cuillère en bois pendant quelques minutes.
SAVAIS-TU…

Qu’il y a plusieurs types d’indicateurs de pH ? Il y a des indicateurs naturels et des indicateurs synthétiques. Les indicateurs naturels proviennent de la nature. C’est en partie dû à la proportion de pigments naturels (anthocyanine et anthoxanthine) qu’ils possèdent.

Image 5. Exemples de produits naturels qui contiennent des anthocyanines.

Lorsque tu places le chou rouge dans l’eau chaude, tu sépares l’anthocyanine du chou rouge et elle se sépare dans l’eau.
17
2,5 3,5 6,5 7,5 8,5 10,5
Image 4. Échelle de pH pour le chou rouge.
ATTENTION : conserve le liquide de cette expérience pour les prochaines expériences. Garder hors de la portée des jeunes enfants et des animaux (des boissons et de la nourriture également).
Deuxième partie - écris tes messages secrets.
1. Mouille la pointe du coton-tige dans la solution basique.
Prépare une solution basique : ajoute un peu de bicarbonate de sodium et trois gouttes d’eau dans le petit verre à mesurer. Mélange bien avec la spatule en bois.

2. Avec le coton-tige que tu as trempé dans la solution basique, écris ou dessine ton message sur la feuille de papier.
3. Ensuite, trempe l’autre bout du coton-tige dans la solution acide.
Prépare une solution acide : presse un demi-citron dans un verre à mesurer et ajoute, à l’aide de la pipette Pasteur, quelques gouttes d’eau.
4. Avec la partie du coton-tige trempée dans la solution acide, écris ou dessine ton message sur la même feuille de papier que tu as déjà utilisée.
5. Attends que l’encre invisible sèche !
6. Lorsque ton encre est sèche, mouille le pinceau dans ton indicateur de chou rouge et «passe le » sur tes messages secrets !
Arrives-tu à révéler les messages colorés ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
Explication :
Un indicateur de pH est une substance qui présente des couleurs différentes selon le pH d’une solution. Dans cette expérience, tu as utilisé un indicateur de pH naturel préparé avec du chou rouge. Ainsi, si la solution est acide, l’indicateur va révéler une couleur qui varie entre le rose et le rouge. D’un autre côté, une solution basique présentera une couleur qui varie entre le bleu et le vert, comme tu peux observer sur l’image de l’échelle de pH de cet indicateur. Avec cet indicateur naturel, tu arrives à découvrir tes propres messages secrets de façon colorée !
1.6 Oxydation
EN APPRENDRE DAVANTAGE…
Certaines substances peuvent s’oxyder quand elles entrent en contact avec l’oxygène. Même si l’oxydation est définie comme un processus plus complexe, voici une façon simple de la définir.



18
1x 3x


EXPÉRIENCE 9
Messages secrets avec du citron
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :
• Pipette Pasteur

• Gants

• Grand verre à mesurer
Matériel supplémentaire :
• Citron • Coton-tige
• Feuille de papier ou de carton
• Séchoir à cheveux • Eau
ATTENTION : demande de l’aide à un adulte.
Procédure :
1. Presse la moitié d’un citron dans le grand verre à mesurer.
4. Avec le coton-tige, écris ou dessine un message sur la feuille de papier.
2. Ajoute quelques gouttes d’eau au jus de citron à l’aide de la pipette Pasteur.
5. Laisse bien sécher ton encre invisible !
6. Afin de découvrir ton message secret, utilise le séchoir à cheveux et approche-le de ta feuille en papier.
3. Mouille le coton-tige dans le jus de citron.
Observe l’image révélée ! Quelle couleur a-t-elle ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
Explication :
Comme tu le sais déjà, le jus de citron est constitué d’acide citrique. En chauffant l’acide citrique, il subit une réaction d’oxydation !
En chauffant la feuille, l’oxydation de l’acide citrique se produit et elle affaiblit le papier. La zone où tu as écrit ou dessiné ton message brûle plus facilement et devient brune, révélant ainsi ton message secret !
19



EXPÉRIENCE SUPPLÉMENTAIRE
Pourquoi les pommes coupées brunissent-elles ?
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :
• Pipette Pasteur

• Gants

• Petit verre à mesurer
Matériel supplémentaire :
• Pomme • Couteau • Pellicule de plastique
• Jus de citron
ATTENTION : demande de l’aide à un adulte.
Procédure :
1. Demande à un adulte de couper, sans l’éplucher, une pomme en trois morceaux.
2. Ajoute 10 ml de jus de citron dans le petit verre à mesurer. Mets du jus de citron sur un des morceaux de la pomme à l’aide de la pipette Pasteur, laisse un autre morceau à l’air libre et mets le troisième dans la pellicule de plastique.
Explication :
Le morceau de pomme sur lequel tu as placé le jus de citron gardera sa couleur originale, ainsi que celui enveloppé dans la pellicule de plastique. Par contre, celui qui est resté à l’air pur a bruni. Plusieurs fruits brunissent quand ils sont mûrs. Une grande partie du processus de mûrissement des fruits est provoqué par l’action de l’oxygène présente dans l’air.
Scientifique, savais-tu que c’est à cause d’un processus accéléré d’oxydation, la corrosion, que les pièces de monnaie en cuivre sont recouvertes de vert-de-gris ?

EN APPRENDRE DAVANTAGE…
La tension superficielle est une propriété très importante, propre à la surface des liquides et qui permet au liquide de résister à une certaine force externe. Grâce à cette propriété, beaucoup d’objets peuvent flotter sur la surface d’un liquide, même s’ils sont plus denses.
3. Après quelques minutes, observe ce qui arrive à chaque morceau de pomme.
Qu’est-ce que tu observes ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
20
1.7. Tension superficielle


EXPÉRIENCE 10
Explosion de couleur
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants
• Pipette Pasteur

• Colorant rouge

• Grand verre à mesurer
Matériel supplémentaire :
• Bol à soupe • Lait • Cure-dents
• Détergent à vaisselle liquide
ATTENTION : demande de l’aide à un adulte.
Procédure :
1. Mesure 100 ml de lait avec le grand verre à mesurer et versele dans le bol à soupe.
2. Avec la pipette Pasteur, ajoute quelques gouttes de colorant alimentaire rouge.
3. Avec l’aide d’un adulte, ajoute du détergent à vaisselle liquide dans le grand verre à mesurer. Puis, trempe l’extrémité du cure-dent dans le détergent à vaisselle liquide, juste assez pour recueillir une seule goutte.
4. Place le cure-dent (avec la goutte de détergent) au milieu d’une goutte de colorant.
Observe l’explosion de couleur !
5. Tu peux refaire l’étape 4 et t’amuser avec les explosions de couleurs !
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
Explication :
Le lait est un liquide constitué d’eau, de matière grasse et de protéines. Quand tu places le colorant à sa surface, il ne se mélange pas avec le lait. Mais, si tu places un cure-dent avec du détergent à vaisselle liquide dans les gouttes de colorant, elles s’éloignent et créent une explosion de couleur ! Le détergent va casser les liens entre les molécules du lait et rompre la tension superficielle. Les molécules du lait se mélangent et créent l’explosion de couleur que tu observes !
La tension superficielle a lieu, car les molécules de lait à la surface ont une grande attraction entre elles.
21
Air
Lait
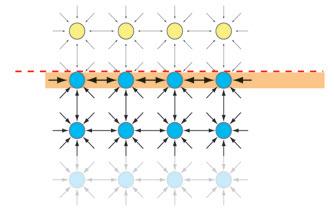
Tension superficielle
Molecule
Image 6. La tension superficielle du lait.
À l’intérieur du liquide, toutes les molécules du lait subissent ces mêmes forces d’attraction, mais dans toutes les directions.
Les molécules de lait à la surface supportent uniquement l’attraction des molécules qui sont à leur côté et en dessous, étant donné qu’au-dessus il n’y a que de l’air.
Comme le nombre de molécules qui s’attirent est plus petit, il y a une certaine compensation, créant une plus grande force d’attraction à la surface et formant une sorte de pellicule. Nous appelons cette propriété la tension superficielle.
1.8. Cristaux
EN APPRENDRE DAVANTAGE…
La plupart des solides dans la nature sont des cristaux. En d’autres mots, leurs atomes, leurs molécules et leurs ions sont ordonnés géométriquement dans l’espace. Cet état ordonné de plusieurs solides contraste avec le désordre présent dans les gaz et les liquides. Quand un solide n’a pas une structure cristalline, il est amorphe. Les substances unies par des liaisons ioniques et qui présentent une structure propre sont appelées cristaux. En fonction de leurs constituants et de leur structure interne, différentes substances forment des cristaux différents.


EXPÉRIENCE 11
Cristaux
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :




• Petit verre à mesurer • Grands verres à plastique

• Gants
• Pipette Pasteur
• Spatule en bois
Matériel supplémentaire :
• Sucre • Eau chaude du robinet
• Contenant sécuritaire
Procédure :
1. Avec la spatule en plastique, place quatre portions de sucre dans le petit verre à mesurer. Il deviendra le verre A
4 Portions
4 portions

Verre A
Verre A
2. Remplis le grand verre à mesurer avec de l’eau chaude.
3. Rapidement, à l’aide de la pipette Pasteur, ajoute un peu d’eau chaude dans le verre A et mélange bien la solution de sucre et d’eau. Si la solution ne se dissout pas complètement, ajoute un peu plus d’eau jusqu’à ce que la dissolution soit complète.
22
4. Verse la solution dans un contenant sécuritaire et laisse la solution reposer pendant plusieurs jours.
5. Avec le temps, l’eau va s’évaporer et le sucre commencera à former des cristaux au fond du verre.

SUPER SCIENTIFIQUE :
Refais ces étapes avec le sel de mer. Ça sera le Verre B. Est-ce que les cristaux formés se ressemblent ?
Sont-ils pareils dans les deux substances ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
Explication :
Quand tu prépares une solution avec de l’eau chaude, tu arrives à dissoudre plus de sel que si l’eau était froide. Celle-ci est appelée solution saturée. En d’autres mots, une solution qui contient la quantité maximum de soluté dans un certain volume de solvant, à une certaine température. Au fur et à mesure que la solution refroidit, elle va déposer le sel qui est en trop, créant ainsi les cristaux. En fonction de leurs constituants et de leur structure interne, différentes substances formeront des cristaux distincts.


EXPÉRIENCE SUPPLÉMENTAIRE
Stalagmites et stalactites
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants


• Grands verres à mesurer

• Bicarbonate de sodium

• Petit verre à mesurer

• Spatule en plastique
Matériel supplémentaire :
• Eau chaude
• Petit mouchoir en papier
• 3 morceaux de fil en laine ou de ficelles
• Assiette
ATTENTION : demande de l’aide à un adulte.
Procédure :
1. Remplis chacun des grands verres à mesurer avec 20 ml d’eau chaude. Utilise le petit verre à mesurer pour t’aider.
2. Avec la spatule en plastique, ajoute du bicarbonate de sodium dans les deux grands verres à mesurer, de façon à produire des solutions saturées.
Remarque : Tu devrais réussir à atteindre des solutions saturées avec environ 2 portions de bicarbonate de sodium dans 20 ml d’eau. Utilise le petit verre d’eau pour mesurer 20 ml d’eau et ajoute-la dans le grand verre à mesurer avec le bicarbonate de sodium.
2 portions
2 portions

23
Une solution saturée est une solution qui contient la quantité maximum de soluté dans un certain volume de solvant, à une certaine température.
3. Tords le mouchoir de papier. Attache les extrémités et le centre avec les ficelles.
4. Place les extrémités du mouchoir de papier dans les verres avec les solutions. Les pointes doivent toucher le fond des verres. S’il le faut, rapproche les verres.
5. Place l’assiette en dessous du mouchoir de papier, entre les deux verres.
les espaces d’air existant dans le mouchoir de papier. Ce processus se nomme l’action capillaire. Le bicarbonate de sodium est entraîné par l’eau et lorsque l’eau s’évapore, il se dépose au centre, en se cristallisant.
Scientifique, si tu n’as plus de bicarbonate de sodium, ne t’inquiète pas ! Tu peux trouver ce réactif dans tous les supermarchés. Tu pourras alors continuer de faire tes expériences chimiques fantastiques !
1.9. Production de dioxyde de carbone
EN APPRENDRE DAVANTAGE…
Quand certaines substances chimiques se mélangent, une réaction chimique et une libération de gaz (dioxyde de carbone) peuvent se produire.
Scientifique, le gaz qui se libère quand les êtres vivants respirent se retrouve aussi dans les combustibles fossiles (comme l’essence).
6. Attends quelques jours.
Que s’est-il passé ?
Explication :
La solution saturée de bicarbonate de sodium monte dans le mouchoir de papier et coule au centre. Les gouttes se transforment en piliers durs de sodium. Certains se forment du haut vers le bas (stalactite) et d’autres du bas vers le haut (stalagmite). La solution se déplace dans la corde formée par le mouchoir de papier parce qu’elle remplit
SAVAIS-TU…

Que le dioxyde de carbone est responsable de l’effet de serre ?
La production excessive de ce gaz est attribuable aux activités humaines.
24


EXPÉRIENCE 12
Colonne de mousse
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants


• Colorant rouge

• Pipette Pasteur

• Grand verre à mesurer
3. Prépare une solution d’environ 25 ml d’eau et de 2 cuillerées de bicarbonate de sodium dans un grand verre à mesurer. Mélange bien.
2 Cuillères

4. Mélange les deux solutions dans le grand verre à mesurer.
Scientifique, que se passe-t-il ?


• Petits verres à mesurer plastique
• Bicarbonate de sodium
Matériel supplémentaire :
• Vinaigre • Détergent à vaisselle liquide • Eau
ATTENTION : demande de l’aide à un adulte.
Procédure :
1. Prépare une solution avec 20 ml de vinaigre et 5 ml de détergent à vaisselle liquide dans un petit verre à mesurer. Demande de l’aide à un adulte.
2. Si tu veux, avec la pipette Pasteur, ajoute environ 2 gouttes de colorant alimentaire rouge à la solution de vinaigre.
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
Explication :
Il y a une production de mousse ! La mousse est produite grâce au dioxyde de carbone qui est libéré de la solution de détergent lorsque l’acide acétique (vinaigre) réagit avec le bicarbonate de sodium.
Le bicarbonate de sodium est un composant constitué des éléments suivants : hydrogène, sodium, oxygène et carbone. Quand on mélange la solution de vinaigre (eau et acide acétique), une réaction chimique a lieu :
Les éléments du carbone et de l’oxygène se lient, produisant un nouveau composé gazeux, le dioxyde de carbone.
25
H+ (aq) + HCO3- (aq) CO2 (g) + H2O (l)


EXPÉRIENCE 13
Comment gonfler un ballon sans souffler ?
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants


• Bicarbonate de sodium

• Ballon

• Entonnoir en plastique
Matériel supplémentaire :
• Vinaigre • Petite bouteille en plastique 0,33 L
Procédure :
1. Remplis le ¼ de la bouteille avec le vinaigre.
2. Ajoute 3 portions de bicarbonate de sodium avec la spatule en plastique dans le ballon. Utilise l’entonnoir pour t’aider.
3. Attache le ballon au goulot de la bouteille. Attention de ne pas laisser tomber le bicarbonate dans la bouteille.
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
SUPER SCIENTIFIQUE :
Tu peux refaire l’expérience en utilisant des quantités différentes de bicarbonate de sodium et de vinaigre. Observe comment cela influence la pression dans le ballon.
Explication :
Le vinaigre réagit avec le bicarbonate de sodium et produit un gaz, le dioxyde de carbone. C’est ce gaz qui permet de gonfler le ballon en y augmentant la pression !
Si tu as essayé de modifier les concentrations des deux composés chimiques, tu as pu observer que quand elles sont plus grandes, la production de gaz est aussi plus grande.


Scientifique, nous allons simuler une éruption volcanique !
4. Soulève le ballon et laisse tomber le bicarbonate de sodium dans la bouteille.
Observe comment le dioxyde de carbone va remplir le ballon !
26


EXPÉRIENCE 14
Éruption volcanique
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants
• Spatule en bois

• Petit verre à mesurer

• Colorant rouge

• Grand verre à mesurer

• Pipette Pasteur plastique
• Bicarbonate de sodium

Matériel supplémentaire :
• Vinaigre • Farine de blé • Bol
ATTENTION : demande de l’aide à un adulte.
Procédure :
1. Prépare la « lave » dans le petit verre à mesurer: ajoute 2 portions de bicarbonate de sodium à l’aide de la spatule en plastique.
2 portions

3. Avec la spatule en bois, mélange doucement le contenu du grand verre à mesurer. Ce verre sera ton volcan ! Place le volcan dans le bol.
4. Avec la pipette Pasteur, ajoute 2 gouttes de colorant alimentaire dans le grand verre à mesurer. Utilise la spatule en bois et mélange à nouveau.
5. Ajoute le contenu du petit verre à mesurer dans le volcan (grand verre à mesurer).
Observe l’éruption volcanique ! Quelle réaction chimique a lieu dans cette éruption ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
2. Remplis le ¾ du grand verre à mesurer avec du vinaigre. Ensuite, ajoute 3 portions de farine de blé à l’aide de la spatule en plastique.
3 portions
2 portions 3 portions

Explication :
Le bicarbonate de sodium réagit à l’acide acétique qui est présent dans le vinaigre, il libère du dioxyde de carbone. La farine de blé nous aide à simuler la lave, elle la rend plus visqueuse. Par contre, ce n’est pas vraiment ce qui se produit dans un volcan ! Cette expérience ne sert qu’à t’aider à visualiser une éruption volcanique.
27


EXPÉRIENCE SUPPLÉMENTAIRE
Mousse de blanc d’œuf
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants

• Petit verre à mesurer
• Spatule en bois

• Colorant rouge

• Pipette Pasteur plastique

• Bicarbonate de sodium
Matériel supplémentaire : • Bol • Verre en plastique • Blanc d’œuf • Vinaigre • Eau
ATTENTION : demande de l’aide à un adulte.
Procédure :
1. Avec précaution, sépare le blanc de l’œuf du jaune de l’œuf.
4. Ajoute 2 portions de bicarbonate de sodium au verre, à l’aide de la spatule en plastique. Mélange avec la spatule en bois.
5. Avec la pipette Pasteur, ajoute 3 gouttes de colorant alimentaire rouge au mélange.
2. Verse la moitié du blanc de l’œuf dans le verre en plastique et place le verre dans le bol.
Scientifique, demande à un adulte de faire cuire le restant de l’œuf, tu pourras le manger après les expériences !
3. Avec l’aide du petit verre à mesurer, ajoute 25 ml d’eau dans le verre avec le blanc d’œuf.
6. Toujours avec le petit verre à mesurer, mesure 25 ml de vinaigre et ajoute-le également dans le verre.
Que se passe-t-il ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
Explication :
Le blanc de l’œuf ne sert pas seulement à faire des desserts délicieux. Il peut également servir pour fixer le gaz formé pendant une expérience. Quand tu ajoutes le vinaigre, une grande quantité de mousse colorée se forme et déborde du verre. Parfois, en retournant le verre, la mousse ne tombe pas !
Sais-tu pourquoi ?
L’acide du vinaigre, acide acétique, réagit avec le bicarbonate de sodium, produit un gaz, le dioxyde de carbone. Le gaz reste coincé dans le blanc de l’œuf, ce qui produit la formation d’une grande quantité de mousse.
28
1.10. Osmosis
EN APPRENDRE DAVANTAGE…
L’osmose est le processus où l’eau se déplace d’une solution moins concentrée vers une solution plus concentrée, à travers une membrane semi-perméable. La concentration d’une solution correspond à la quantité de soluté présente dans une certaine quantité de solution.
Prépare les solutions :
Eau avec du sel - verse 50 ml d’eau et ajoute 2 portions de sel avec la spatule en plastique.
Eau avec du vinaigre – ajoute 50 ml d’eau et 15 ml de vinaigre.
2. Place une feuille de papier sous chaque verre. Identifie les 2 verres avec le nom des solutions que tu vas utiliser.


EXPÉRIENCE 15
Comment les bonbons en gelée se comportent-ils dans différentes solutions ?
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants




• Petits verres à mesurer

• Grands verres à mesurer plastique
Matériel supplémentaire :
• Bonbons en gelée • Vinaigre • Eau
• Sel • Feuille de papier • Crayon
Procédure :
1. Avec la spatule en plastique et le petit verre à mesurer, prépare d’abord une solution de sel et une solution de vinaigre. Une dans chaque grand verre à mesurer.
Vinaigre 15ml
3. Place un bonbon en gelée dans chaque verre et attends environ une heure.
4. Mets seulement de l’eau dans le petit verre à mesurer et ajoutes-y également un bonbon en gelée. Attends afin d’observer les résultats.
1 heure
Eau salée
Eau avec el vinaigre
Eau
Observe les résultats ! Qu’arrive-t-il aux bonbons ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
Explication :
2 portions 15 ml Sel Vinaigre
2 portions Salt

Les bonbons en gelée sont normalement faits avec de la gélatine. La gélatine et les solutions que tu as préparées sont des mélanges d’eau (solvant) avec une substance dissoute (le soluté). Dans le verre avec uniquement de l’eau, le bonbon en gelée augmente de volume. Toutefois, le bonbon en gelée dans la solution salée n’a pratiquement pas changé de taille. C’est un phénomène que l’on appelle osmose.
29
Ce phénomène peut être défini comme le passage de l’eau d’un endroit moins concentré vers un endroit plus concentré.
Osmose
Eau sucre
Concentration de sucre plus basse
Concentration de sucre plus élevée
Membrane semi-perméable sélective
Passage de l’eau du côté le moins
concentré de sucre vers le plus concentré.
Concentration d’eau plus élevée
Concentration d’eau plus basse
L’osmose n’est pas influencée par le type de soluté, mais par le nombre de particules dans la solution. Ainsi, dans ce processus, l’eau passe de la solution qui a le moins de particules vers celle qui en a le plus, jusqu’à ce qu’un équilibre soit atteint. L’équilibre est atteint lorsque les deux solutions ont le même nombre de particules dissoutes. Ainsi, en plaçant un bonbon en gelée dans de l’eau, elle entrera dans le bonbon, en le faisant grandir. Par contre, quand il y a plus de molécules dans une solution où il y a un bonbon en gelée, il y a une plus petite quantité d’eau qui se déplace dans le bonbon en gelée ! De cette façon, dans la solution d’eau salée, le bonbon ne grandira pas autant que dans l’eau. Le vinaigre est un acide. Il finit par dégrader les liens entre les molécules de la gélatine, de sorte que les bonbons augmentent de taille, mais perdent leur forme originale.
1.11. Fluides et solides qu’on peut mouler
EN APPRENDRE DAVANTAGE…
Il y a des matériaux qui sont faciles à modeler grâce à leur structure.


EXPÉRIENCE SUPPLÉMENTAIRE
Solide ou liquide
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants

• Grand verre à mesurer

• Colorant alimentaire rouge
• Pipette Pasteur
• Spatule en bois
Matériel supplémentaire :
• Eau • Amidon de maïs
• Cuillère à soupe • Bol
Procédure :
1. Mets 6 cuillères à soupe d’amidon de maïs dans le bol.
2. Remplis le grand verre à mesurer avec 25 ml d’eau.
3. Avec la pipette Pasteur, ajoute deux gouttes de colorant alimentaire rouge dans le verre avec l’eau.
4. Avec la spatule en bois, mélange l’eau et le colorant.
5. Ajoute cette eau à l’amidon de maïs dans le bol.
6. Mélange l’eau et l’amidon avec tes mains.
30
7. Retire le mélange du bol. Touche-le avec les mains.
Astuce : si ta pâte est trop sèche, ajoute un peu d’eau avec une pipette Pasteur ; si c’est trop liquide, ajoute un peu plus d’amidon de maïs.
Ce mélange semble-t-il être un solide ou un liquide ?
8. Place le mélange sur la table et observe-le.
Et maintenant, semble-t-il être un solide ou un liquide ?
ATTENTION : quand tu auras fini l’expérience, jette tous les aliments utilisés pendant celle-ci.
Explication :
Quand on retire le mélange du bol, le mélange semble être un solide sec, mais quand on le place sur la table, il semble couler comme un liquide visqueux. C’est parce que l’amidon de maïs contient de l’amidon. Dans le mélange d’amidon avec l’eau, les particules d’amidon vont occuper les espaces vides laissés entre les particules d’eau. Ainsi, quand on appuie sur le mélange et qu’on le serre avec les mains, les particules d’eau demeurent plus rapprochées et le mélange semble être un solide dur et sec. Quand on laisse le mélange sur la table, les particules d’amidon et d’eau vont se séparer et le mélange semble être un liquide visqueux, qui coule lentement sur la table. Cette substance s’appelle fluide, car elle peut couler comme les liquides !
1.12. Molécules
EN APPRENDRE DAVANTAGE…
Les atomes sont l’unité de base qui constitue toutes les substances ou matières. Les atomes peuvent se lier avec des liens chimiques pour créer les molécules. Les molécules peuvent être simples (atomes identiques) ou composées (atomes différents).
31


EXPÉRIENCE SUPPLÉMENTAIRE
Fais des molécules fantastiques !
Qu’est-ce qu’il te faut ?
Matériel inclus dans le kit :

• Gants
Matériel supplémentaire :
• Pâte à modeler • Cure-dents
Procédure :
1. Façonne de petites boules de pâte à modeler ! Ces boules seront tes atomes ! Crée des atomes rouges et d’autres sans couleur pour avoir des atomes de couleurs différentes pour tes molécules ! Les cure-dents vont représenter les liaisons chimiques qui s’établissent entre les atomes de la molécule.
Astuce : utilise une couleur pour représenter un atome précis.
2. Suis les instructions pour créer les molécules !
Tu peux représenter une liaison simple avec un cure-dent, une liaison double avec deux cure-dents et une liaison triple avec trois cure-dents.

a) Molécule d’eau (H2O)
Qu’est-ce qu’il te faut ?
• 2 atomes de H
• 1 atome de O
• 2 liaisons simples
Image 7. Modèle de la molécule d’eau. L’hydrogène est représenté en blanc et l’oxygène en rouge.
Image 8. Représentation de la manière dont tu devras construire ta molécule d’eau
L’eau est une ressource naturelle indispensable pour la vie de notre planète. Les molécules d’eau sont composées de 2 atomes d’hydrogène et 1 atome d’oxygène.

32
O H H O H H
b) Molécule d’oxygène (O2)
Qu’est-ce qu’il te faut ?
• 2 atomes de O
• 1 liaison double
Image 9. Modèle de la molécule d’oxygène. Les atomes d’oxygène sont en rouge.
L’oxygène est une molécule composée de 2 atomes d’oxygène liés par une liaison double. C’est un gaz incolore et inodore à température ambiante et qui est l’un des principaux composés de l’atmosphère terrestre.
c) Molécule de dioxyde de carbone (CO2)
Qu’est-ce qu’il te faut ?
• 1 atome de C
• 2 atomes de O
• 2 liaisons doubles
Image 11. Modèle de la molécule de dioxyde de carbone. L’oxygène est représenté en rouge et le carbone en noir.
Image 10. Représentation de la manière dont tu dois construire ta molécule d’oxygène.

Image 12. Représentation de la manière dont tu dois construire ta molécule de dioxyde de carbone.
Le dioxyde de carbone est un gaz. À température ambiante, il est incolore et inodore. Il est composé de 2 atomes d’oxygène et 1 atome de carbone. Ce composé est très important pour les plantes et végétaux puisqu’il est essentiel au processus de photosynthèse.
d) Molécule d’azote (N2)
Qu’est-ce qu’il te faut ?
• 2 atomes de N
• 1 liaison triple O O O O O C O N N

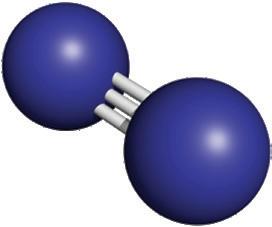
Image 13. Modèle de la molécule d’azote. L’azote est représenté en bleu.
Image 14. Représentation de la manière dont tu dois construire la molécule d’azote.
L’azote correspond au gaz le plus abondant dans l’atmosphère de notre planète (plus de 70 %).
La molécule d’azote est constituée de 2 atomes d’azote liés par une liaison triple. Il s’agit d’un gaz inerte (non réactif), incolore et inodore.

33
O
O C
2. Questionnaire
1. Le mélange d’eau et d’huile est :
a) Hétérogène
b) Homogène
c) Colloïdal



6. La réaction chimique qui a lieu entre le vinaigre et le bicarbonate de sodium libère :

a) De l’oxygène
b) Du méthane
c) Du dioxyde de carbone

2. Le processus de filtration permet de séparer :
a) Un solide d’un solide
b) Un solide d’un liquide
c) Aucune des options




7. Quel phénomène désigne le passage de l’eau d’un endroit avec peu de concentration de soluté vers un endroit avec plus de concentration ?
a) La capillarité
b) L’osmose
c) La décantation

8. La molécule d’eau est constituée de :
a) 2 atomes d’oxygène et 1 d’hydrogène
b) 2 atomes d’hydrogène et 1 d’oxygène
c) 3 atomes d’oxygène


34
3. Les molécules d’eau bougent plus rapidement quand l’eau est :


a) Froide
b) Tiède
c) Chaude


5. Quel type de solution est le jus de citron ?
a) Acide
b) Basique
c) Neutre


9. Quel est le pH d’une substance neutre ?
a) Plus que 7

4. Complète : L’éthanol a ______ de densité que l’eau.
a) Moins
b) Plus
c) La même


b) Moins que 7
c) Égal à 7
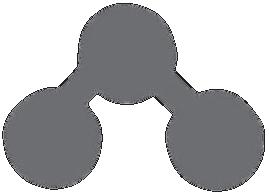

10. Une molécule d’oxygène est constituée de :
a) 2 atomes d’oxygène
b) 1 atome d’oxygène
c) 3 atomes d’oxygène
35 Réponses : 1-a) 2-b) 3-c) 4-a) 5-a) 6-c) 7-b) 8-b) 9-c) 10-a)
www.keycraftglobal.com P05