
20 minute read
Profilassi dell’infezione da Virus Respiratorio Sinciziale
MTD
MORE THAN
Advertisement
DRUG
Health, Ethics & Compliance program
Angela Umbaldo, Ida D’Acunzo, Annamaria Pagano, Raimondo Cecere, Francesca Diana, Germana Nardini, Giuseppe Schiano di Cola, Francesco Raimondi U.O.S.D. di Neonatologia e Terapia Intensiva Neonatale Dipartimento Assistenziale Integrato Materno-Infantile Università degli Studi di Napoli “Federico II”
Il Virus Respiratorio Sinciziale (VRS) rappresenta il principale agente etiologico delle infezioni delle basse vie respiratorie durante i primi due anni di vita - con un picco di incidenza intorno ai 3-6 mesi - ed è la causa principale di ospedalizzazione dei bambini di età inferiore a un anno (1), soprattutto nei primi 2 mesi. In determinate categorie a rischio il decorso può essere molto grave, conducendo ad un esito mortale (2-3-4). Il VRS è stato descritto per la prima volta nel 1956 (5). Appartiene alla famiglia dei Paramyxoviridae, genere Pneumovirus. Il genoma del VRS è composto da RNA a singola catena lineare e contiene 10 geni che codificano le 2 proteine non strutturali NS1 e NS2 (ritrovate solo nelle cellule infette ma non nei virioni) e le 8 proteine strutturali (presenti sia nelle cellule infette che nei virioni). Le glicoproteine strutturali di superficie G ed F sono i maggiori determinanti antigenici del virus. Il ciclo replicativo ed infettante del virus inizia con l’adesione della proteina G alla cellula ospite; successivamente la proteina F induce la penetrazione del virus all’interno della cellula attraverso la fusione del pericapside con la membrana citoplasmatica e il successivo rilascio del nucleocapside nel citoplasma, dove avvengono la replicazione virale, la sintesi delle nuove proteine e l’assemblaggio di nuovi virioni (6).
Epidemiologia del Virus Respiratorio Sinciziale
Il VRS è caratterizzato da un’estrema contagiosità, grazie alla capacità di sopravvivere e di mantenere la virulenza nell’ambiente esterno per ore e alla breve durata della protezione conferita dalla risposta immune, che spiega le frequenti infezioni e/o reinfezioni. L’essere umano costituisce l’unico reservoir conosciuto del virus. La trasmissione può avvenire per contatto diretto con secrezioni infette oppure per contaminazione di oggetti;
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
la maggiore facilità di contagio si osserva in ambienti chiusi, come famiglie, comunità, scuole, ospedali. Il periodo di incubazione è di 2-8 giorni ed il periodo di contagiosità del soggetto infetto è di circa 10 giorni. Nei paesi con climi temperati, l’infezione da VRS si presenta in forma epidemica. In Italia l’andamento della curva epidemica è tipicamente stagionale, sviluppandosi da ottobre ad aprile, con picco nel mese di febbraio (7).
Virus Respiratorio Sinciziale: manifestazioni tipiche e atipiche
Pur essendo la causa più nota e frequente di bronchiolite in età evolutiva, il VRS è implicato anche in situazioni patologiche diverse, quali episodi di apnea e sindrome da morte improvvisa. I primi segni di infezione da VRS sono quelli di una comune infezione delle alte vie respiratorie, caratterizzata da congestione nasale, tosse, febbre, inappetenza. Nel 30% dei bambini affetti l’infezione raggiunge le basse vie respiratorie, generando quadri di severità diversi da forme moderate a forme gravi di insufficienza respiratoria (3). Sebbene le manifestazioni cliniche da VRS siano prevalentemente di natura respiratoria, negli ultimi anni sono state descritte manifestazioni extrapolmonari legate ad infezione da VRS, in particolare cerebrali, cardiache ed epatiche. In circa il 2% dei pazienti con bronchiolite da VRS sono state riportate convulsioni, letargia,apnea centrale, difficoltà nella deglutizione, anomalie del tono muscolare, strabismo, anomalie del liquor ed encefalopatie (8). Sono stati segnalati, inoltre, casi di aritmia e insufficienza del miocardio nei pazienti con infezione da VRS9, ma rimane dubbio il ruolo diretto del virus. E’ stato ipotizzato che vi sia un’associazione tra infezione da VRS e ipertensione polmonare come causa di scompenso ventricolare destro e danno del miocardio (10). Durante gli episodi di bronchiolite è stato riportato un aumento del valore di transaminasi fino al 49% dei bambini ventilati e sono stati descritti casi di epatite severa con coagulopatia (11). La prevalenza di epatite è maggiore nei pazienti con cardiopatia congenita rispetto ai bambini non affetti e ciò potrebbe essere correlato alla congestione delle vene epatiche secondaria all’insufficienza del ventricolo destro (12). Dalle colture delle biopsie epatiche è stato tuttavia isolato il virus, dimostrando quindi una invasione epatica diretta da parte dello stesso (13). Esistono evidenze scientifiche che l’infezione precoce delle basse vie respiratorie da VRS, in particolare nei casi che hanno richiesto ospedalizzazione, sia legata ad aumentato rischio di wheezing recidivante, asma, ridotta funzionalità respiratoria e di iperreattività delle vie aeree in epoca scolare (14-15-16). Recenti studi di follow up condotti fino
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
all’età adulta (18-30 anni) dimostrano che fino al 30-40% dei soggetti precedentemente ospedalizzati per bronchiolite presenta asma e utilizza farmaci antistaminici (17).
La diagnosi di bronchiolite da Virus Respiratorio Sinciziale: l’importanza della clinica
La diagnosi di bronchiolite si basa sulle manifestazioni cliniche, sull’età del paziente e sulla stagionalità. I test di laboratorio sono finalizzati all’identificazione del virus, dell’RNA virale,degli antigeni virali nelle secrezioni respiratorie. Il campione ottimale è rappresentato da un aspirato del muco o da un lavaggio nasofaringeo dalla cavità nasale posteriore del bambino (3). La radiografia del torace non è necessaria di routine; può evidenziare la presenza di infiltrati e segni di iperinflazione (3). A volte può essere presente una discrepanza tra il quadro radiografico, che nel 50% dei bambini affetti può apparire addirittura normale, ed il quadro clinico che appare più grave (18). Il tipico quadro radiografico include: iperinflazione con rafforzamento della trama interstiziale e ispessimento peribronchiale. Spesso si associa atelettasia segmentale, che poi scompare completamente. I bambini affetti dalla polmonite, invece, presentano fini crepitazioni e un pattern alveolare, segmentale o consolidazione lobare. L’Rx del torace va riservato ai casi gravi o nel sospetto di complicanza (19).
La profilassi per l’infezione da Virus Respiratorio Sinciziale: il lattante a rischio
Non ci sono al momento terapie specifiche per la bronchiolite da VRS, ma è possibile solo una terapia di supporto, che miri ad ottenere una adeguata ossigenazione ed idratazione. In assenza di una terapia etiologica, la profilassi - sia ambientale che farmacologica - assume un ruolo fondamentale. In attesa di un vaccino anti-VRS, a cui da anni si sta lavorando, l’immunoprofilassi passiva con Palivizumab rappresenta la strategia seguita a livello internazionale. Il Palivizumab è un anticorpo monoclonale umanizzato rivolto contro la glicoproteina F del VRS (20). È distribuito con il nome commerciale di Synagis, confezionato in fiale da 50 o 100 mg da mantenere alla temperatura di 2-8°C. Viene somministrato in muscolo alla dose di 15 mg/Kg ogni 25-28 giorni per 5 dosi durante la stagione epidemica, generalmente da novembre a marzo. I più comuni effetti avversi riportati (1-3% dei pazienti studiati) sono eritema locale, dolore nel sito di iniezione, febbre e rash. Il Palivizumab è un prodotto ricombinante, pertanto non causa malattie infettive trasmissibili per via ematica; non interferisce con le vaccinazioni MPR o con altri virus vivi (21).
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
Alcuni bambini sono maggiormente a rischio di infezioni gravi da VRS. Accanto ai fattori di rischio legati all’ospite - quali prematurità, bassa età anagrafica durante la stagione epidemica, patologie polmonari, cardiopatie emodinamicamente significative, immunodeficienze, malattie neuromuscolari - grande importanza rivestono i fattori di rischio ambientali, in particolare l’esposizione a fumo passivo, condizioni di sovraffollamento, la presenza di fratelli in età scolare, il basso stato socioeconomico, la frequentazione degli asili nido e l’assenza di allattamento al seno (22-23-24). La profilassi con Palivizumab è iniziata negli Stati Uniti nel 1998, quando sono state pubblicate le prime linee guida della AAP (25), modificate nel 2003 (23), nel 2009 (26) e nel 2014 (27). In Italia il Palivizumab è stato introdotto nel 2000, sulla scorta delle linee guida americane del 1998.Nel corso di questo ventennio sono state pubblicate in Italia due raccomandazioni della Società Italiana di Neonatologia - una nel 2004 (28) ed una nel 2015 (29). Tra il 2015 ed il 2017 si sono inoltre susseguite diverse delibere dell’AIFA che hanno individuato di volta in volta le classi di lattanti ritenute ad elevato rischio di infezione grave da VRS e quindi eleggibili all’immunoprofilassi passiva con Palivizumab.
Profilassi anti-VRS nel neonato prematuro: quali certezze?
Da anni c’è ormai unanime consenso sull’utilità dell’immunoprofilassi passiva con Palivizumab nei neonati estremamente prematuri fino a 29 settimane di età gestazionale, nei broncodisplasici e nei cardiopatici, mentre è ancora in corso un’animata discussione sui prematuri con età gestazione 30-35 settimane, sui quali si è focalizzata l’attenzione, poiché sembrano presentare un rischio di infezione grave da VRS e una necessità di ospedalizzazione superiore rispetto ai nati a termine e paragonabile ai prematuri di più bassa età gestazione. Durante la stagione epidemica 2016-2017 - sulla scorta delle linee guida dell’AAP del 2014 - l’AIFA ha ristretto l’immunoprofilassi ai prematuri fino alle 29 settimane di età gestazionale, escludendo, quindi, quelli con età gestazionale fra 30 e 35 settimane, arruolabili alla profilassi sia nelle stagioni precedenti che in quelle successive (Fig. 1)
Figura 1. Eleggibilità all’immunoprofilassi passiva con Palivizumab nelle diverse stagioni epidemiche
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
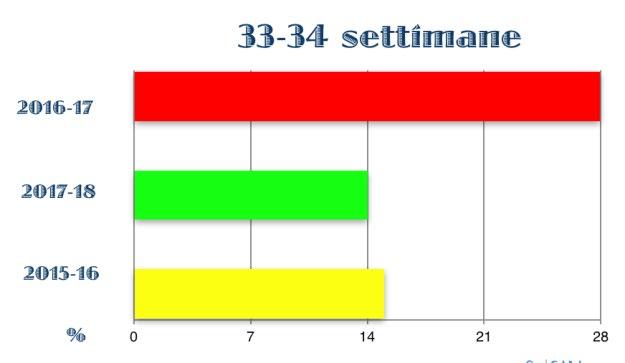
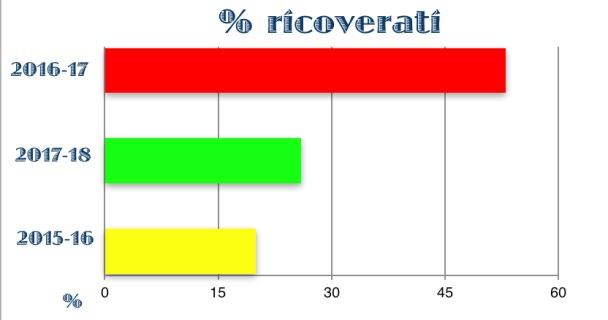
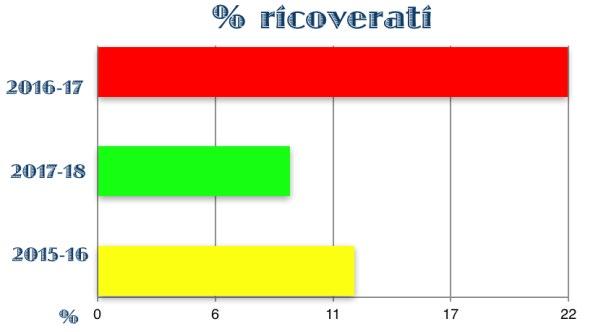
La sensazione di un’aumentata incidenza di bronchiolite da VRS nei late preterm durante la stagione epidemica in cui non sono stati profilassati ha portato al fiorire di una serie di studi nazionali ed internazionali, sia monocentrici che multicentrici. Il confronto tra popolazioni di neonati prematuri, nati tra le 30 e le 35 settimane di età gestazionale - profilassati e non con Palivizumab - ed omogenee per caratteristiche anagrafiche, cliniche e fattori di rischio, ha confermato una maggiore incidenza di bronchiolite e di ricoveri per bronchiolite nella popolazione dei non profilassati, mentre la durata della degenza e la necessità di ossigeno-terapia sono risultate sovrapponibili (30-31-32-33-34). (Fig. 2-3-4-5)

Figura 2. Incidenza di bronchiolite nei neonati con EG 30-32 settimane profilassati o non profilassati
Figura 4. Incidenza di bronchiolite nei neonati con EG 30-32 settimane profilassati o non profilassati
Figura 3. Incidenza di bronchiolite nei neonati con EG 33-35 settimane profilassati o non profilassati
Figura 5. Incidenza di ricovero per bronchiolite nei neonati con EG 33-35 settimane profilassati o non profilassati
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
L’immunoprofilassi passiva dei prematuri 30-35 settimane senza fattori di rischio aggiuntivo ridurrebbe inoltre l’incidenza di infezione da VRS nei nati a termine, probabilmente per una minore circolazione del virus.
Profilassi anti-VRS e le categorie a rischio speciale: i lattanti con Sindrome di Down
Negli ultimi anni maggiore attenzione è stata dedicata anche alle cosiddette categorie a rischio speciale, tra le quali la più numerosa è costituita dai bambini con Sindrome di Down. In diversi studi popolazioni di lattanti con Sindrome di Down sono state confrontate con popolazioni di lattanti sani e senza fattori di rischio per bronchiolite da VRS, di pari età gestazionale e cronologica. I lattanti con Sindrome di Down hanno mostrato un aumento statisticamente significativo di infezioni da VRS, di necessità di ospedalizzazione e ricorso all’assistenza respiratoria e di ricoveri multipli (Fig. 6).

Figura 6. Incidenza delle infezioni delle vie respiratorie nei neonati con Sindrome di Down
Inizialmente si credeva che il maggiore rischio per infezione grave da VRS nei lattanti con Sindrome di Down potesse essere legato alla presenza di cardiopatia. Ulteriori studi hanno dimostrato che tale spiegazione non sembra essere sufficiente. L’elevato numero di ricoveri per bronchiolite da VRS è sovrapponibile tra le due sottoclassi di lattanti con Sindrome di Down con o senza cardiopatia, a testimonianza che la Sindrome di Down è un fattore di rischio indipendente per infezione grave. Pur essendo riconosciuta la cardiopatia come fattore di rischio per infezione da VRS, altre variabili potrebbero entrare in gioco, come l’immunodeficienza e una peculiare anatomia delle alte vie respiratorie (35-36-37).
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
Il Virus Respiratorio Sinciziale ai tempi del COVID: l’importanza della profilassi ambientale
Durante la fase finale della precedente stagione epidemica (febbraio-marzo 2020) e durante l’attuale stagione epidemica si è assistito ad una netta riduzione dell’incidenza di brochiolite sia nei nati pretermine profilassati che nei nati a termine non sottoposti a immunoprofilassi (Fig.7)

Figura 7. Epidemiologia della bronchiolite da VRS durante la stagione epidemica 2019-2020
Le misure di distanziamento sociale e l’attenzione alle più comuni regole igieniche imposte dalla pandemia da SARS-CoV2 sembrano aver giocato un ruolo fondamentale in tal senso (38-39-40). Accanto all’immunoprofilassi farmacologica con Palivizumab riveste quindi un ruolo fondamentale anche la prevenzione ambientale, che permette di ridurre la diffusione virale sia nei neonati prematuri che in quelli a termine. Fondamentali sono il lavaggio e l’igienizzazione delle mani e la pulizia degli oggetti e delle superfici potenzialmente contaminate con soluzioni alcoliche o a base di ipoclorito di
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
sodio. Il latte materno costituisce un fattore protettivo, che quindi va sempre incentivato, mentre un effetto negativo è rappresentato dal fumo materno in gravidanza ed in epoca postnatale, sia attivo che passivo, compreso quello di terza mano. Sono particolarmente a rischio i neonati che vivono in ambienti affollati e quelli che hanno fratelli in età scolare. La profilassi ambientale anti-VRS deve essere incoraggiata, poiché promuove comportamenti ed interventi a costo quasi zero. I Punti nascita di I livello rivestono un ruolo importante in tal senso: i genitori dei neonati prematuri hanno una maggiore percezione dei possibili pericoli per la salute dei loro figli e sono più complianti alle indicazioni mediche, mentre i genitori dei neonati a termine, soprattutto quando non sono primi figli, vivono talvolta “troppo” fisiologicamente la condizione di lattanti. La sezione campana della Società Italiana di Neonatologia ha pertanto prodotto un opuscolo distribuito nei Punti nascita della Campania da offrire ai genitori al momento della dimissione. La profilassi ambientale permette di ridurre l’incidenza di bronchiolite nei neonati a termine che non possono essere protetti dal Palivizumab, i quali, anche se meno suscettibili ad infezione grave, sono estremamente più numerosi dei neonati prematuri, incidendo molto sul numero di ricoveri totali (41). La profilassi ambientale inoltre potenzia l’azione di prevenzione del Palivizumab, soprattutto durante l’inizio della stagione epidemica, quando la copertura anticorpale non è ancora massima.
La profilassi con Palivizumab ai tempi del COVID: come ci siamo riorganizzati
Nella realtà Campania la profilassi anti-VRS è ormai codificata e la copertura è vicina al 100%. Nel corso degli anni è stata creata una rete tra le Terapie Intensive Neonatali (TIN) ed i Centri di riferimento territoriale per la profilassi. Vengono sottoposti all’immunoprofilassi tutti i bambini individuati secondo la determina AIFA 1836/2017 del 2 novembre 2017. I neonati dimessi “in season” praticano la prima dose di Palivizumab qualche giorno prima della dimissione e quindi vengono indirizzati ai Centri di riferimento territoriale per le successive. I neonati dimessi “out season” vengono arruolati dalla TIN dove sono stati ricoverati ed inviati a praticare la profilassi presso il Centro di riferimento territoriale dalla prima dose. Anche durante la pandemia da SARS-CoV2 l’immunoprofilassi è stata considerata tra i livelli essenziali di assistenza e non è mai stata interrotta, considerato anche che la
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
possibile sovrapposizione e similitudine tra i sintomi delle due infezioni avrebbe potuto creare confusione e congestione dei Pronto Soccorso. L’Associazione Ospedali Pediatrici Italiani (AOPI), la Federazione Italiana Medici Pediatri (FIMP) e la Società Italiana di Pediatria (SIP) hanno sostenuto la necessità di riorganizzare gli spazi e le risorse umane, in modo da poter garantire l’immunoprofilassi in sicurezza (42-43). Tutte le strutture hanno identificato percorsi dedicati con personale formato, dotato di dispositivi di protezione individuali e di materiale per l’igienizzazione delle mani e delle superfici. Al fine di evitare gli assembramenti sono stati istituiti dei Percorsi DiagnosticoTerapeutici Assistenziali (PDTA) condivisi tra ospedale e territorio ed è stato fatto largo utilizzo della telemedicina, in modo da ridurre al minimo la permanenza negli ambulatori, scaglionando gli accessi. Gli sforzi intrapresi sia in Campania che in tutta Italia negli ultimi anni - ed ulteriormente potenziati durante questa ultima stagione epidemica - hanno permesso una profilassi estesa nelle popolazioni a rischio, determinando una netta riduzione dei casi di bronchiolite da VRS e della necessità di ospedalizzazione.
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
BIBLIOGRAFIA
1. Kimpen JLL. Prevention and treatment of respiratorysyncytial virus bronchiolitis and postbronchiolitic wheezing. Respir Res 2002; 3 (suppl1):S 40-5. 2. Nair H, Nokes DJ, Gessner BD, et al. Global burden of acute lower respiratory infections due to respiratory syncitial virus in young children: a systematic review and meta-analysis. Lancet 2010; 375:1545–55. 3. American Academy of Pediatrics. Respiratory syncitial virus. In: Pickering LK, eds.
Red Book: 2012 Report of the Committee on Infectious Diseases. 29th ed. Elk Grove
Village: Churchill Livingstone; 2012:609–18. 4. Meissner HC. Selected populations at increased risk from respiratory syncytial virus infection. Pediatr Infect Dis J 2003; 22: S40-45. 5. Chanock RM, Roizman B, Myers R. Recovery from infants with respiratory illness of a virus related to chimpanzee coryzal agent (CCA). Isolation, properties and characterization. Am J Hyg 1957; 66:281-290. 6. 6. Simoes EA. Respiratory syncytial virus infection. Lancet 1999; 354:847-52. 7. Anderson LI, Parker RA, Strikas RL. Association between respiratory virus outbreaks and lower respiratory tract deaths of infants and young children. J Infect Dis 1990; 161:640-6. 8. Sweetman LL, Ng YT, Butler IJ, Bodensteiner JB. Neurologic complications associated with respiratory syncitial virus. Pediatr Neurol 2005; 32:307-10. 9. Playfor SD, Khader A. Arrhythmias associated with respiratory syncitial virus infection. Pediatr Anesthesia 2005; 15:1016–8. 10. Sreeram N, Watson JG, Hunter S. Cardiovascular effects of acute bronchiolitis.
Acta Paediatr Scand 1991; 80:133–6. 11. Eisenhut M, Thorburn K. Hepatitis associated with severe respiratory syncitial virus-positive lower respiratory tract infection. Scand J Infect Dis 2002; 34:235. 12. Eisenhut M, Thorburn K, Ahmed T. Transaminase levels in ventilated children with respiratory syncytial virus bronchiolitis. Intensive Care Med 2004; 30:931–4. 13. Nadal D, Wunderli W, Meurmann O, et al. Isolation of respiratory syncytial virus from liver tissue and extrahepatic biliary atresia material. Scand J Infect Dis 1990; 22:91–3.
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
14. Hall CB, Weinbergh GA, Iwane MK. The burden of respiratory syncytial virus infection in young childrem. N Engl J M, 2009; 360: 588-598 15. Sigurs N, Aljassim F, Kjellman B, Robinson PD. Asthma and allergy patterns over 18 years after severe RSV bronchiolitis in the first year of life. Thorax 2010, 65:1045-1052 16. Sigurs N, Gustafsson PM, Bjarnason R, et al. Severe respiratory syncitial virus bronchiolitis in infancy and asthma and allergy at age 13. Am J Respir Crit Care Med 2005; 171:137–41. 17. Backman K, Piippo-Savolanein E, Ollikainen H. Increased asthma risk and impaired quality of life after bronchiolitis or pneumonia in infancy. Pediatr Pulmunol 2014,49:318-325 18. Sessini F, Copula M, Carta G, Battista Corona G, Carboni G, Corrias A. La
Bronchiolite.Pneumologia Pediatrica 2005; 18: 9-19. 19. American Academy of Pediatrics. Clinical practice guidelines: the diagnosis, management, and prevention of Bronchiolitis. Pediatrics Vol 134, num 5, Nov 2014. e1474-e1500 20. Meissner HC, Long SS American Accademy of Pediatrics Committee on Infectious
Diseases and Committee on fetus and Newborn. Revised indications for the use of palivizumab and respiratory syncytial virus immune globulin intravenous for the prevention of respiratory syncytial virus infections. Pediatrics 2003; 112:1447-52. 21. Samson L. Prevention of respiratory syncytial virus infection. Paediatr Child
Health 2009;14:521–32. 22. Purcell K, Fergie J. Driscoll Children’s Hospital respiratory syncitial virus database: risk factors, treatment and hospital course in 3308 infants and young children, 1991 to 2002. Pediatr Infect Dis J 2004; 23:418–23. 23. Miller S. A community health concern: respiratory syncytial virus and children. J
Pediatr Nurs. 2010 Dec;25(6):551-4. 24. Lanari M, Giovannini M, Giuffrè L, Marini A, Rondini G, Rossi A, Merolla R,
Zuccotti GV, Salvioli GP and the investigators R.A.D.A.R. Study Group. Prevalence of Respiratory Syncytial Virus infection in Italian infants hospitalized for acute lower respiratory tract infection, and association between Respiratory Syncytial Virus infection risk factors and disease severity. Pediatric Pulmonology 2002; 33: 458-465. 25. American Academy of Pediatrics Committee on Infectious Disease and Committee
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
on Fetus and Newborn. Prevention of respiratory syncytial virus infections: indications for the use of pavilizumab and update on the use of RSV-IGIV. Pediatrics 1998; 102:1211-1216. 26. American Academy of Pediatrics Committee on Infectious Disease and Committee on Fetus and Newborn. Policy statement-modified recommendations for use of pavilizumab for prevention of respiratory syncytial virus infections. Pediatrics 2009; 124:1694-701 27. American Academy of Pediatrics Committee on Infectious Diseases; American
Academy of Pediatrics Bronchiolitis Guidelines Committee.. Pediatrics. 2014
Aug;134(2):e620-38..2014-1666. 28. Raccomandazioni della Societa` Italiana di Neonatologia per la prevenzione delle malattie da virus respiratorio sinciziale (VRS). 2004 29. Raccomandazioni della Societa` Italiana di Neonatologia per la prevenzione delle malattie da virus respiratorio sinciziale (VRS). Aggiornamento del 2015 30. Renato Cutrera, Andrea Wolfler, Simonetta Picone, Giovanni A Rossi, Giuliana
Gualberti,Rocco Merolla,Antonio Del Vecchio,Alberto Villani,Fabio Midulla,Andrea
Dotta - Impact of the 2014 American Academy of Pediatrics recommendation and of the resulting limited financial coverage by the Italian Medicines Agency for palivizumab prophylaxis on the RSV-associated hospitalizations in preterm infants during the 2016-2017 epidemic season: a systematic review of seven Italian reports -
Italian J Pediatr 2019 Nov 9;45(1):139. doi: 10.1186/s13052-019-0736-5. 31. Silvestri M, Marando F, Costanzo AM, di Luzio PU, Rossi GA. Respiratory syncytial virus-associated hospitalization in premature infants who did not receive palivizumab prophylaxis in Italy: a retrospective analysis from the Osservatorio study.
Ital J Pediatr. 2016;42:40. 32. Venafra R, Franco C, Del Vecchio A. Incidenza di ospedalizzazione per bronchiolite da RSV in nati pretermine prima e dopo l’ultima determina AIFA 2016. Abstract,
XXIII Congresso Nazionale della Società Italiana di Neonatologia Milano, 25–28 settembre 2017. 33. Santisi A, Ronchetti MP, Marrocco G, Braguglia A, Reale A. Incidenza di ricovero per bronchiolite da Virus Respiratorio Sinciziale (RSV) nella stagione 2016/2017: analisi monocentrica degli accessi in pronto soccorso (PS) e tratificazione per età gestazionale. Abstract, XXIII Congresso Nazionale della Società Italiana di
Neonatologia Milano, 25–28 settembre 2017.
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
34. Santisi A, Ronchetti MP, Marrocco G, Braguglia A, Reale A. Incidenza di ricovero per bronchiolite da Virus Respiratorio Sinciziale (RSV) nella stagione 2016/2017: analisi monocentrica degli accessi in pronto soccorso (PS) e tratificazione per età gestazionale. Abstract, XXIII Congresso Nazionale della Società Italiana di
Neonatologia Milano, 25–28 settembre 2017. 35. Kimura T, Takeuchi M, Kawakami K. - Utilization and efficacy of palivizumab for children with Down syndrome. Pediatr Int. 2020 Jun;62(6):677-682. doi: 10.1111/ ped.14157. Epub 2020 Jun 1. 36. Galleguillos C, Galleguillos B, Larios G, Menchaca G, Bont L, Castro-Rodriguez
JA - Down’s syndrome is a risk factor for severe lower respiratory tract infection due to respiratory syncytial virus.Acta Paediatr. 2016 Nov;105(11):e531-e535. doi: 10.1111/ apa.13552 37. Paes B, Mitchell I, Yi H, Li A, Lanctôt KL; CARESS Investigators - Respiratory syncytial virus prophylaxis in Down syndrome: a prospective cohort study. Pediatrics 2014 Jun;133(6):1031-7. doi: 10.1542/peds.2013-3916 38. Daniel K Yeoh, David A Foley, Cara A Minney-Smith, Andrew C Martin, Ariel O
Mace, Huong Le, Avram Levy, Christopher C Blyth, Hannah C Moore - The impact of COVID-19 public health measures on detections of influenza and respiratory syncytial virus in children during the 2020 Australian winter Clin Infect Dis 2020 Sep 28;ciaa1475. doi: 10.1093/cid/ciaa1475. Online ahead of print. 39. Ilari Kuitunen, Miia Artama, Lotta Mäkelä, Katri Backman, Tarja Heiskanen-
Kosma, Marjo Renko - Effect of Social Distancing Due to the COVID-19 Pandemic on the Incidence of Viral Respiratory Tract Infections in Children in Finland
During Early 2020. Ped Infect Dis J 2020 Dec;39(12):e423-e427. doi: 10.1097/
INF.0000000000002845. 40. Nolen LD, Seeman S, Bruden D, Klejka J, Desnoyers C, Tiesinga J, Singleton R. -
Impact of Social Distancing and Travel Restrictions on non-COVID-19 Respiratory
Hospital Admissions in Young Children in Rural Alaska. Clin Infect Dis. 2020 Sep 5:ciaa1328. doi: 10.1093/cid/ciaa1328. Online ahead of print 41. Marcello Lanari, Federica Prinelli, Fulvio Adorni, Simona Di Santo, Silvia
Vandini, Michela Silvestri , Massimo Musicco, Study Group of Italian Society of
Neonatology on Risk Factors for RSV Hospitalization - Risk factors for bronchiolitis hospitalization during the first year of life in a multicenter Italian birth cohort. Ital J
Pediatr 2015 May 26;41:40. doi: 10.1186/s13052-015-0149-z.
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
42. 42. Position paper AOPI - LA PANDEMIA DA SARS-COV-2 E LA SPECIFICITÀ
PEDIATRICA. Sept 2020 43. Gruppo di lavoro COVID-19 Segreteria Scientifica della Federazione Italiana
Medici Pediatri - Emergenza COVID-19 VADEMECUM DEL PEDIATRA DI
FAMIGLIA . Maggio 2020
MTD
MORE THAN
DRUG
Health, Ethics & Compliance program
Edizioni Improve Communications
Sede Legale - Via Viticella, 48 - Quarto (NA) Sede Operativa - Via Diomede Carafa, 58 - 80124 - Napoli
Direzione Grafica ed Impaginazione: Alessia Raffaella Di Maio



