
3 minute read
Cambio de fase
CAMBIO
D E F A S E
Advertisement
El cambio de fase termodinámico es una transición de estado líquido a estado gaseoso, se provoca por la disminución o aumento de presión y el cambio de temperatura.
El cambio de fase libera energía de modo que el aire circundante se calienta, y las moléculas de agua que se condensan del aire son las más lentas.
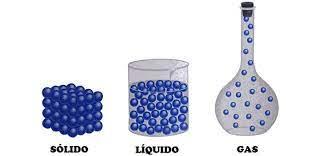
El cambio de entalpía es la cantidad de calor que se libera o absorbe cuando se genera presión en un cuerpo, la entalpía equivale a la cantidad de energía que contiene un sistema termodinámico con el trabajo mecánico aplicado al cuerpo. Cuando hablamos de entalpía hacemos referencia al cambio de fase que agrupa los tres estados de la materia: sólido, líquido y gaseoso.
Cualquier tipo de sustancia puede presentarse en cada uno de los estados de la materia dependiendo el cambio de fase que realizen, temperatura y el límite de presión ejercida.

Cuando el proceso de entalpía se invierte ( gaseoso a líquido ) impiden que las moléculas realicen un proceso de expansión y el vapor que se genera por el proceso de evaporización desaparece regresando a la forma proporcional del recipiente. La temperatura que producen los cambios de fase depende de la presión que actúa sobre el cuerpo, los líquidos a presión atmosférica se solidifican cuando su temperatura disminuye y se evapora.
Cuando la temperatura disminuye las fuerzas de cohesión que es la fuerza de atracción que mantiene las moléculas unidas y aumentan absorbiendo o liberando energía en cambio de temperatura, en el estado gaseoso de agregación las moléculas están en estado de reposo es decir disminuye la distancia entre ellas. Carecen de volumen y forma ya que se comprenden en espacios libres donde el vapor se expande adquiriendo la forma proporcional del cuerpo o recipiente. Cada cuerpo tiene su propio calor de fusión y vaporización ya que la estructura molecular es proporcional a la diferencia de temperatura que es la que separa las temperaturas ambientales de una misma escala.

La presión en un fluido que se encuentra en reposo se define como la fuerza que actúa en la superficie de un cuerpo, los cuerpos no almacenan calor, transfieren energía interna de equilibrio térmico en condiciones con distintas temperaturas y magnitudes. El calor específico de estos procesos dependientes de la temperatura produce condensación generando el proceso inverso de vaporización que también puede llamarse sublimación inversa. En presión de vapor el líquido llega a su punto de ebullición ya que si se duplica la temperatura no es necesario el aumento de presión en el cuerpo, es decir siempre va a existir un valor fijo de presión de vapor aumentando la energía cuando las moléculas se calientan y se suministran.
Logran alcanzar velocidad y frecuencia para cambiar fase al estado gaseoso, la presión de vapor también puede adquirir el nombre de presión de saturación ambas fases de líquido y gaseoso se encuentran en equilibrio siempre manteniendo una relación inversamente proporcional. El equilibrio se produce cuando la superficie de la entalpía es mayor entre el líquido y el vapor interviene en el proceso de evaporación, ya que afecta el punto de equilibrio enfocado en el cambio de presión o el cambio de volumen.
La conductividad térmica de los cambios transmite energía de sus moléculas a la sustancia que está en el interior del recipiente y cuando mayor sea su conductividad será más efectivo el funcionamiento del conductor y si es menor se minimiza la transferencia de calor.
Los factores que suelen afectar a los tres estados de la materia dependen de la fuerza que mantienen a las partículas del vapor unidas y cuando se ejerce la fuerza de cohesión entre ellas la alta presión tiende a separarlas facilitando su interacción.

Los mecanismos de transferencia de energía en interacciones representan la energía que pierde o gana el cambio de fase con las dos variables de energía que es el trabajo y calor y son las que desarrollan balance en el proceso de entalpía.







