VTAGlutamateNeuronActivityDrivesPositive ReinforcementAbsentDopamineCo-release
VivienZell,1 ThomasSteinkellner,1 NickG.Hollon,2 ShelleyM.Warlow,1 ElizabethSouter,1 LaurenFaget,1 AveryC.Hunker,3 XinJin,2 LarryS.Zweifel,3 andThomasS.Hnasko1,4,5,* 1DepartmentofNeurosciences,UniversityofCalifornia,SanDiego,LaJolla,CA92093,USA
2MolecularNeurobiologyLaboratory,TheSalkInstituteforBiologicalStudies,LaJolla,CA92037,USA 3DepartmentofPharmacology,UniversityofWashington,Seattle,WA98195,USA 4ResearchServiceVASanDiegoHealthcareSystem,SanDiego,CA92161,USA
5LeadContact
*Correspondence: thnasko@health.ucsd.edu https://doi.org/10.1016/j.neuron.2020.06.011
SUMMARY
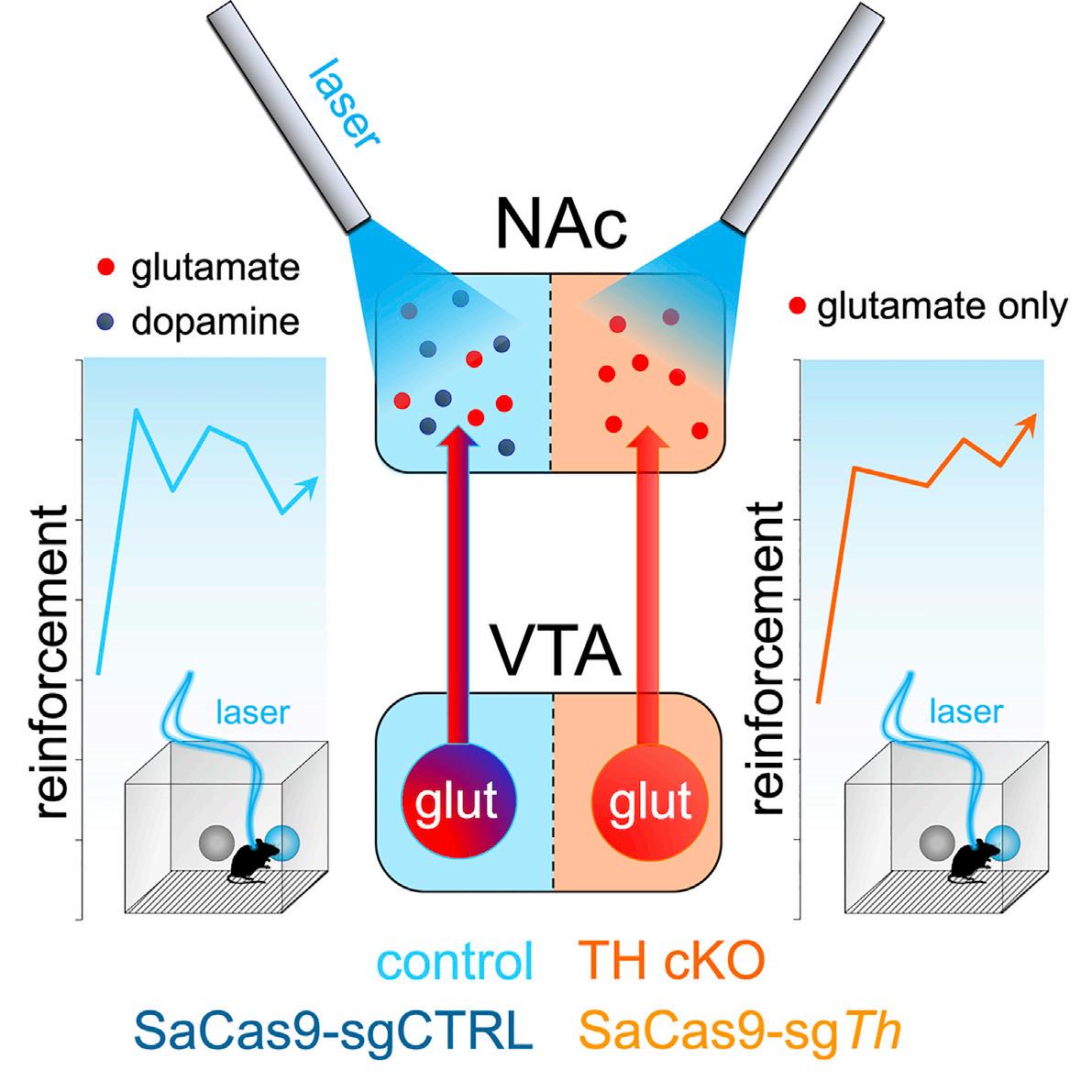
Likeventraltegmentalarea(VTA)dopamine(DA)neurons,VTAglutamateneuronactivitycansupportpositive reinforcement.However,asubsetofVTAneuronsco-releaseDAandglutamate,andDAreleasemightbe responsibleforbehavioralreinforcementinducedbyVTAglutamateneuronactivity.Totestthis,weusedoptogeneticstostimulateVTAglutamateneuronsinwhichtyrosinehydroxylase(TH),andthusDAbiosynthesis, wasconditionallyablatedusingeitherfloxed Th miceorviral-basedCRISPR/Cas9.Bothapproachesledto lossofTHexpressioninVTAglutamateneuronsandlossofDAreleasefromtheirdistalterminalsinnucleus accumbens(NAc).DespitelossoftheDAsignal,optogeneticactivationofVTAglutamatecellbodiesoraxon terminalsinNAcwassufficienttosupportreinforcement.Theseresultssuggestthatglutamatereleasefrom VTAissufficienttopromotereinforcementindependentofconcomitantDAco-release,establishinganon-DA mechanismbywhichVTAactivitycansupportreward-seekingbehaviors.
INTRODUCTION
Theventraltegmentalarea(VTA)hasapivotalroleinthecontrol ofmotivatedbehaviors.Dopamine(DA)transmissionfromVTA tonucleusaccumbens(NAc)andotherlimbicstructurescontributestotheprocessesunderlyingmotivatedbehaviorandbehavioralreinforcementandisakeystructurefortheinitiationofdrug addiction(IkemotoandBonci,2014).DAreleasefromVTAneuronsissufficienttosupportpositivereinforcement,reward learning,andtoinvigoraterewardseeking;thus,DAreleaseis oftenconceptualizedasaprimaryrewardsignal(Berridge etal.,2009; Fieldsetal.,2007; KeiflinandJanak,2015).However,increasingevidencehasestablishedimportantfunctionaland physiologicalrolesfornon-DAneuronsinVTA,includingthose thatreleaseglutamateorGABA(Barisellietal.,2016; Pupe andWalle ´ n-Mackenzie,2015).Furthercomplexityisaddedby thefactthatsomeVTAneuronsco-releasemultipleneurotransmitters(HnaskoandEdwards,2012; Trudeauetal.,2014).
Approximately36%ofNAc-projectingVTAneuronsexpress thetype-2vesicularglutamatetransporter(VGLUT2)(Yamaguchi etal.,2011),andelectrophysiologicaldatademonstratethat essentiallyallmediumspinyneurons(MSNs)inmedialNAcshell receiveglutamatergicinputfromVTA(Hnaskoetal.,2012; Mingoteetal.,2015, 2019; Stuberetal.,2010; Yooetal.,2016)as dostriatalcholinergicinterneurons(CaiandFord,2018; Chuhma
etal.,2014, 2018).OptogeneticactivationofVTAglutamatecell bodiesorterminalsinNAccansupportself-stimulation(Wang etal.,2015; Yooetal.,2016),buttheiractivationhasalsobeen showntodriveapparentavoidanceinsomebehavioralassays (Qietal.,2016; Yooetal.,2016).Thisavoidancebehaviormight beaparadoxicalconsequenceresultingfromapreferencefor shortdurationtrainsofVTAglutamateneuronstimulation(Yoo etal.,2016).Alternatively,glutamatereleasefromVTAterminals inNAcmightdriveavoidancethroughpreferentialactivationof NAcinterneurons,eventhoughDAco-releasefromasubsetof theseneuronscontributestoreward(Qietal.,2016).Thus,itremainsunclearwhethertherewardsignalssupportingself-stimulationofVTAglutamateneuronsaremediatedbyglutamateper se,orbytheconcomitantco-releaseofDA.
Here,wetestedwhetherVTAglutamateprojectionstoNAc driverewardindependentlyofDAco-release.Wegeneratedconditionalknockout(cKO)miceinwhich Tyrosinehydroxylase (Th) wasspecificallyknockedoutfromVGLUT2-expressingneurons todisruptDAsynthesis.OptogeneticstimulationofVTAglutamateneuronsortheiraxonterminalsledtorobustDAreleasein NAcofcontrolsbutnotcKOmice.Further,whilecKOsdisplayed onlyaminorreductioninbasallocomotoractivity,lossofDAcoreleasedidnotabolishorotherwiseimpactself-stimulationor othermeasuresofbehavioralreinforcement.ToovercomepotentialcompensatoryadaptationsassociatedwiththelossofThfrom
Pleasecitethisarticleinpressas:Zelletal.,VTAGlutamateNeuronActivityDrivesPositiveReinforcementAbsentDopamineCo-release,Neuron (2020),https://doi.org/10.1016/j.neuron.2020.06.011
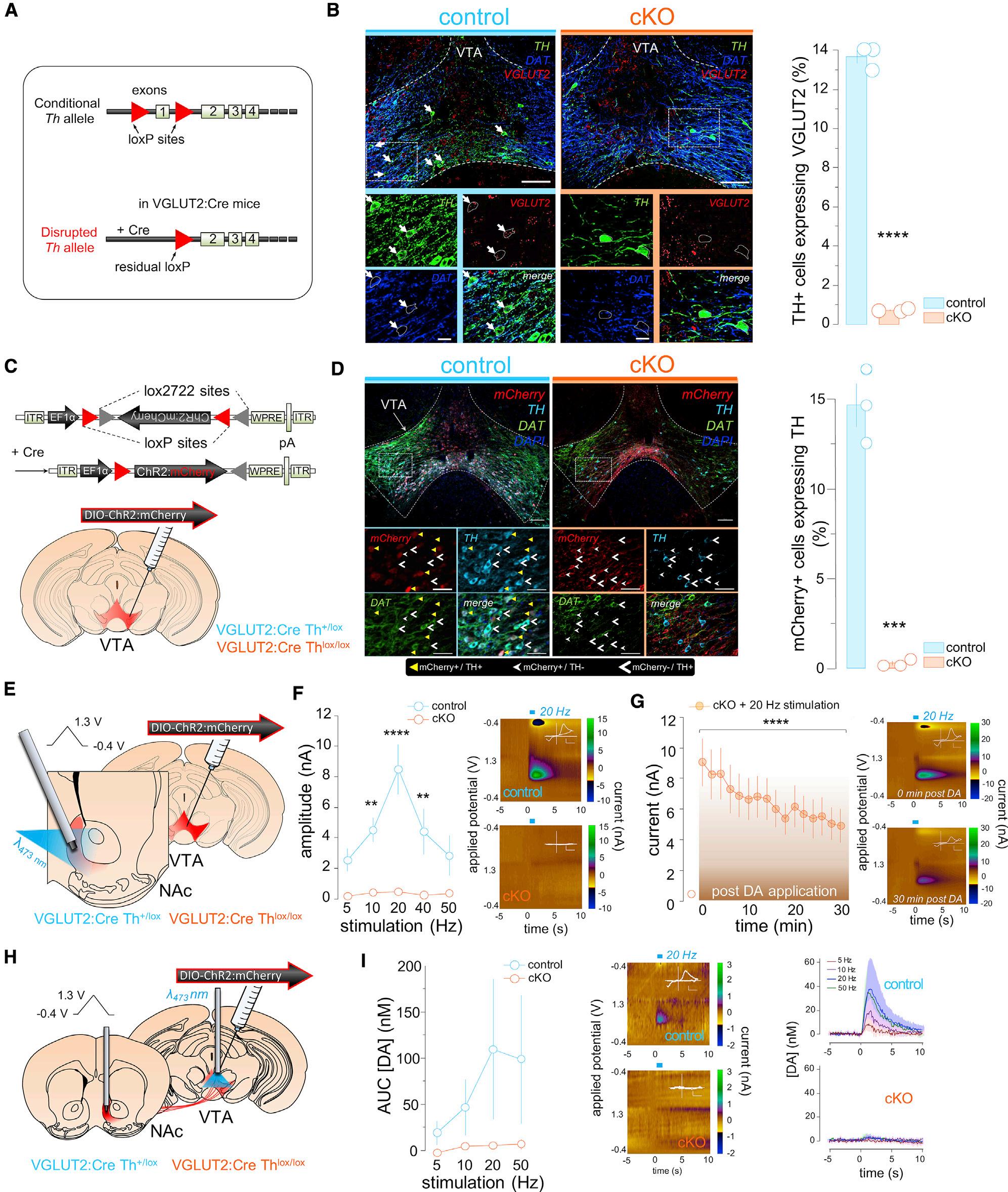
Figure1.DisruptionofTHExpressionandDAReleasefromVTAGlutamateNeurons (A)Geneticdisruptionoffloxed Th genein Slc17a6Cre (VGLUT2-Cre)mice.
(B)CoronalsectionsthroughVTAlabeledwithantibodiesagainstTHanddopaminetransporter(DAT),plusRNAscopeprobestargetingVGLUT2transcripts. Neuronsco-expressingTHandVGLUT2(arrows)incontrolswerevirtuallyabsentincKO;scale,500 mm(top)and100 mm(bottom);ttest,****p<0.0001(n=3 mice/group).
(legendcontinuedonnextpage)
2 Neuron 107,1–10,September9,2020
Pleasecitethisarticleinpressas:Zelletal.,VTAGlutamateNeuronActivityDrivesPositiveReinforcementAbsentDopamineCo-release,Neuron (2020),https://doi.org/10.1016/j.neuron.2020.06.011
Report
VTAglutamateneuronsduringdevelopment,wealsoimplementedavirus-basedCRISPR/Cas9approachtodisruptTh expressionandDAreleasefromVTAglutamateneuroninadult mice,tosimilareffect.Together,ourresultsindicatethatVTA glutamateneuronactivitycansupportrobustbehavioralreinforcementindependentoftheirabilitytorecruitDArelease.
RESULTS
ConditionalAblationofDASynthesisinVTAGlutamate Neurons
TotestthecontributionofDAco-transmissiontoVTAglutamate neuronfunction,wegeneratedmicewithconditionaldeletion of Th (DarvasandPalmiter,2010)selectivelyinVGLUT2-Creexpressingneurons(Figure1A).BrainsectionsfromcKO (Slc17a6+/Cre;Thlox/lox),andheterozygouscontrollittermates(control: Slc17a6+/cre;Th+/lox)wereusedtoconfirmthelossofTHin VTAglutamateneurons.Usingacombinationof insitu hybridizationandimmunohistochemistry,wefoundthat 14%ofneurons expressingVGLUT2mRNAwerealsoTH+ incontrolmice, whereasTH+ VGLUT2neuronswereessentiallyabsentinthe VTAofcKOmice(Figure1B).Althoughnumerousstudiesdemonstratethat10%–20%ofVTADAneuronsexpressVGLUT2inthe adult,amuchhigherproportiontransientlyexpressVGLUT2duringdevelopment(Berube-Carriereetal.,2009; Kouwenhoven etal.,2019; Mendezetal.,2008; Steinkellneretal.,2018).Asa consequence,weobserved 80%decreaseinthenumberof TH-immunoreactivecellbodiesinbothVTAandSNcofcKOs(FiguresS1AandS1B).Wealsoobservedacorrespondingdecrease inTH-immunoreactiveDAaxonterminalsintheNAc,andcaudate/ putamen(CPu)(FiguresS1CandS1D).Incontrast,DAtransporter (DAT)immunoreactivitywasunaltered,indicatingthatDAneuronal architecturewasintactincKOmice.DespitethereducedTH expression,weobservedonlyamodestreductioninbaseline locomotoractivityincKOmice,andlocomotorresponsesto L-DOPA,amphetamine,ortheD1RagonistSKF81297were similarbetweencKOandcontrolmice,suggestingintactpsychomotorfunction(FigureS2).
DisruptionofDATransmissionfromVTAGlutamate Neurons
TocontrolVTAglutamateneuronactivity,weinfusedanadenoassociatedvirus(AAV)engineeredforCre-dependentexpressionofChannelrhodopsin-2:mCherry(ChR2:mCherry)intothe
(C)StrategyforselectiveexpressionofChR2:mCherryinVGLUT2VTAneurons.
medialVTAofcontrolandcKOmice(Figure1C).Approximately 15%ofmCherry+ VTAglutamatecellbodiesco-labeledwithTH incontrolmice,butco-expressingcellswerevirtuallyabsentin cKOs,furtherconfirmingtheconditionallossofTHfrom VGLUT2+ VTAneurons(Figure1D).
TotestwhetherthelossofTHfromVTAglutamateneurons wassufficienttoabolishevokedDArelease,weusedfast-scan cyclicvoltammetry(FSCV)inbrainslicesthroughthemedial NAcshell(Figure1E).OptogeneticstimulationofVTAglutamate terminalsintheNAcproducedarobustfrequency-dependentincreaseinevokedDAincontrolsbutnotthecKO(Figure1F). However,bathapplicationofDA(10 mM,10min)rescued ChR2-evokedDAtransientsincKOs(Figure1G),demonstrating thatVTAglutamateterminalsretainthecapacitytoreleaseDA whensubstrateisavailable.
Importantly,wealsodemonstratethatDAreleaseisabsent followingoptogeneticstimulationofVTAglutamateneurons invivo.Inthisexperiment,ChR2wasexpressedinVTAglutamateneurons,opticfiberswereimplantedinVTA,andcarbonfiberswereimplantedinmedialNAc(Figures1Hand S4).Optogeneticstimulation(1s)elicitedfrequency-dependentDAreleasein controlbutnotcKOmice(Figure1I).Together,theseresults demonstratethefunctionallossofNAcDAreleaseincKO miceuponoptogeneticstimulationofVTAglutamateneurons.
VTAGlutamateTransmissionIsSimilaratBothD1 andD2MSNsandIsIntactincKO
TotestwhetherglutamatereleasewasalteredincKOmice,we measuredexcitatorypostsynapticcurrents(oEPSCs)evokedby optogeneticstimulationofVTAglutamateterminalsinNAc(FigureS3A).Wefound6,7-dinitroquinoxaline-2,3(1H,4H)-dione (DNQX)-sensitiveoEPSCsofsimilaramplitudeincKOandcontrol mice(FigureS3B),suggestingthat,unlikeDArelease,glutamate transmissionwasintact.Wealsomeasuredpaired-pulseratios (PPRs)andfoundsubstantialpaired-pulsedepressioninbothgenotypes,thoughdepressionwasreducedinthecKO(FigureS3C), whichcouldbeduetoreducedDAauto-receptoractivationat theseexcitatorypre-synapticterminals(Adroveretal.,2014; Chuhmaetal.,2009).Theonsetdelayanddeactivationtimeconstant(t)ofoEPSCsdidnotdifferacrossgenotypes(FigureS3D). D1-andD2-typeMSNscomprise>95%ofNAcneuronsbut havedistinctfunctionalroles(Coleetal.,2018; Kravitzetal., 2012; LoboandNestler,2011; Thibeaultetal.,2019).Totest whetherVTAglutamateneuronsmightpreferentiallyimpact
(D)CoronalsectionsshowcolocalizationofTHandChR2:mCherryisnearlyabsentinthecKO;scale,100 mm(top)and50 mm(bottom);ttest,***p=0.0003(n=3 mice/group).
(E)Schematicof exvivo FSCVtomeasureDAevokedfromVTAglutamateterminals.
(F)Photostimulationelicitedfrequency-dependentDAtransientsinthemedialNAcshellincontrolbutnotcKO;RMtwo-wayANOVA,maineffectoffrequency, F(4,28) =11.0,p<0.0001;genotype,F(1,7) =22.5,p=0.002andinteraction,F(4,28) =9.6,p<0.0001.Sidak’smultiplecomparisonstest****p<0.0001,**p<0.01 (controln=4,cKOn=5mice).Rightinsetsshowexamplecolorplotsfollowing20Hzphotostimulation.Voltammogramscale:2nA;0.3V.
(G)BathapplicationofDA(10 mM,10min)rescuedopto-triggeredDAtransientsincKO;RMone-wayANOVA,maineffectoftreatment,F(16,64) =17.5,p<0.0001 (n=5mice).Bonferroni’smultiplecomparisonstest****p<0.0001.Rightinsetsshowexamplecolorplotsfollowing20Hzphotostimulationat0(top) and30 (bottom)minafterDAbathapplication/wash.Voltammogramscale:2nA;0.3V.
(H)Schematicof invivo FSCVtomeasureevokedDAfromVTAglutamateterminals.
(I)PhotostimulationofVTAglutamatecellbodieselicitedfrequency-dependentDAsignalsinNAc;Friedmantest,maineffectoffrequencyincontrols,p<0.0001 (n=4mice)butnotcKOmice,p=0.43(n=5).Voltammogramscale:1nA;0.3V. Dataarerepresentedasmean±SEM.Seealso FiguresS1–S4
,1–10,September9,2020
thesesub-populations,weusedD1R-Cre 3 VGLUT2-Creor A2a-Cre 3 VGLUT2-Credouble-transgenicmicetoachieveconditionalexpressionof(1)ChR2:EYFPinVTAVGLUT2neurons and(2)mCherryinD1orD2(A2a)subtype-definedNAcMSNs (FigureS3E).Toourknowledge,thereisnoVGLUT2expressing neuronsintheNAcnorD1RorA2aexpressingneuronsinVTA, cf.AllenBrainAtlas:Slc17a6(73818754),Drd1(352),and Adora2a(72109410)(Leinetal.,2007).WeobservedoEPSCs atbothMSNtypes,andnosignificantdifferencewasdetected betweenD1R+ versusputativeD1R– norA2a+ versusputative A2a– neurons(FigureS3F).PPR,delay,and t werealsounchangedacrossMSNsubtypes(FiguresS3GandS3H). TogethertheseresultsshowthatVTAglutamateneuronsdo notmakepreferentialcontactontoD1-typecomparedtoD2typeprojectingMSNs.
Self-stimulationofVTAGlutamateNeuronsinthe AbsenceofDACo-release
PreviousworkfromourlabdemonstratedthatoptogeneticactivationofVTAglutamatecellbodiesortheirterminalsinNAccansupportintracranialself-stimulation(ICSS)(Wangetal.,2015; Yoo etal.,2016).Curiously,micethatself-stimulatedtheseneurons inanoperanttaskshowedacounter-intuitivefrequency-dependentavoidancefortheirstimulationinareal-timeplacepreference (RTPP)assay.However,thisapparentavoidancewasaccompaniedbyanincreasedrateofentriesintotheactivesideandapreferenceforshortdurationtrainsofVTAglutamateneuronstimulation(Yooetal.,2016).Whilethesedataimplydistinctfunctional rolesforVTADAandglutamateneuronsinpositivereinforcement, optogeneticactivationofVTAglutamateneuronsalsoincreases DAsignalinginNAc(Figure1)throughtransmitterco-release and/orlocalexcitatorysynapsesontoVTADAneurons(Dobi etal.,2010; Qietal.,2016; Yooetal.,2016).Therefore,totest thecontributionofDAtobehavioralreinforcementdrivenbyVTA glutamateneurons,weperformedICSSandRTPPusingcKO micethatlacktheabilitytosynthesizeandco-releaseDA.
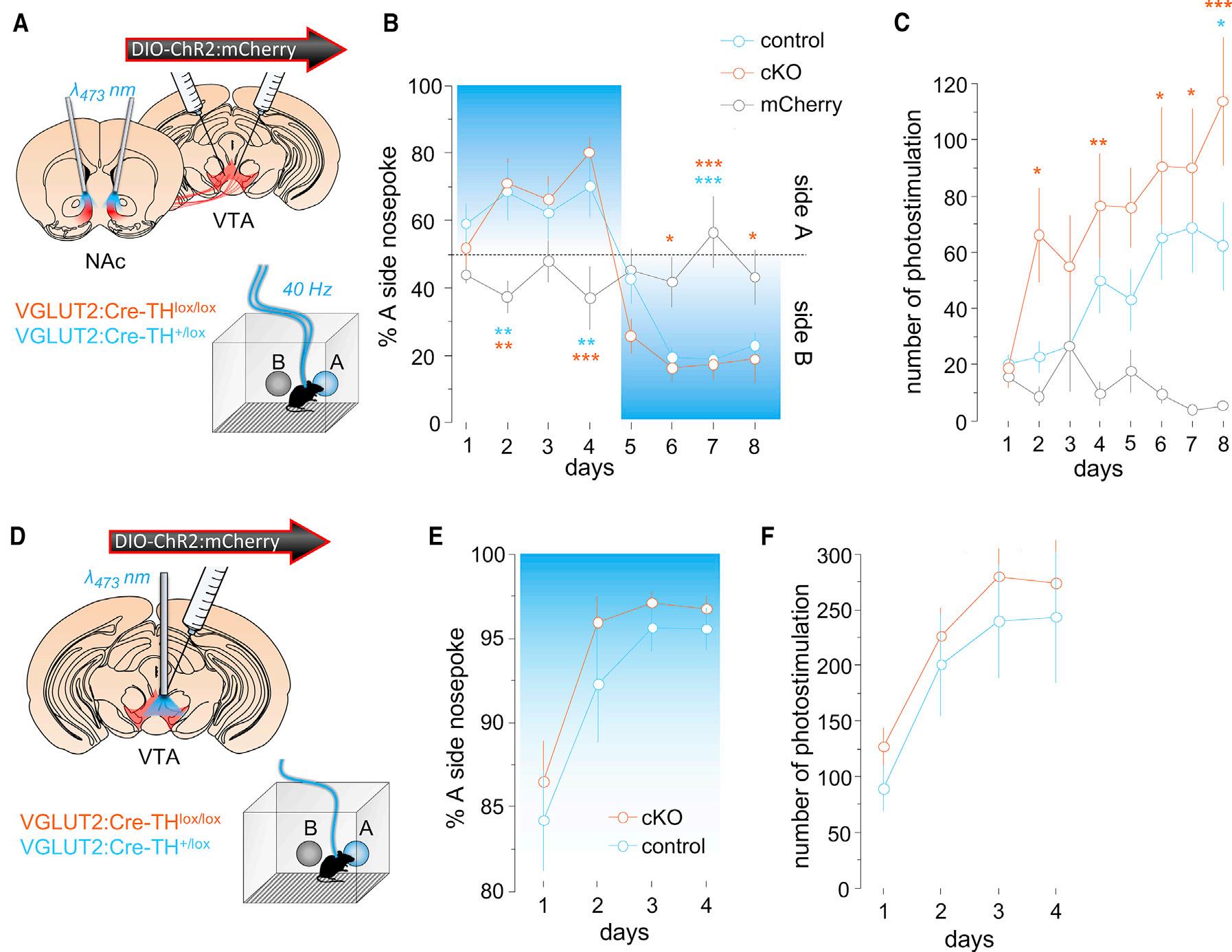
ChR2:mCherryormCherrywasexpressedinVTAglutamate neuronsincontrolandcKOmice,andopticfiberswerebilaterally implanteddorsaltomedialNAcshelltotargetaxonterminals. Micewerefirsttestedona2-holeICSSassaywherenosepokes onhole‘‘A’’(active)triggeredalasertodelivera1s40-Hzstimulus,whilenosepokesonhole‘‘B’’(inactive)werewithouteffect (Figure2A).Thisfrequencyandpatternofstimulationwas selectedbecausepriorworksshowthatmicecandiscriminate andshowpreferenceforitandbecauseVTAglutamateneurons canfireatsimilarfrequencyinresponsetosalientstimuli(Root etal.,2018a; Wangetal.,2015; Yooetal.,2016).Acrossthefirst 4testsessionsmicedisplayedstrongpreferencefortheactive holewithnosignificantdifferencesdetectedbetweengenotypes (Figures2B).Overthesubsequent4sessionsholes‘‘A’’and‘‘B’’ wereswapped,andbothgenotypesswitchedtheirpreferenceto engagewiththeactivehole;mCherry-expressingcontrolmice didnotshowapreferenceoraswitchandperformedfewnosepokes(Figures2Band2C).Wealsotestedaseparatecohortof animalswithopticfibersimplanteddorsaltoVTAglutamatecell bodiesratherthanNActerminals(Figure2D);theseanimalsalso displayedarobustpreferencefortheactivenosepokewithno differencebetweengenotype(Figures2Eand2F).
WenexttestedmiceintheRTPPprocedurewheretheywere providedfreeaccesstotwocompartments:entranceintoactive sideA-triggered40-HzoptogeneticstimulationthatdiscontinueduponentryintosideB(Figure3A).WhentargetingVTAglutamatefibersinNAc,bothgenotypesspentlesstimeintheactive chamberandswitchedtheirsidepreferencetotheinactive chamberwhensideBwasswitchedtoactive;mCherry-expressingmiceshowednosignificantpreferenceoravoidance(Figure3B).Bothgenotypesalsoshowedanincreasedapproach rateintotheactivesidecomparedtomCherry-expressing mice(Figure3C),andtherewasnosignificantdifferencebetweencontrolsandcKOmicethatlacktheevokedDAsignal. MicewithimplantsdorsaltoVTAwereusedtotargetthecell bodies(Figure3D)anddisplayedsimilarpatternsofactiveside avoidance(Figure3E),withincreasedapproachratesovertime (Figure3F),andnoeffectofgenotypeonthesebehaviors. Together,theseresultsdemonstratethatVTAglutamateneuron activationcandriveself-stimulationandapproachbehaviorin theabsenceofconcomitantDAco-release,suggestingVTA glutamateneuronsrepresentaDA-independentmesolimbic rewardcircuit.
CRISPR/Cas9DisruptionofDATransmissionfromVTA GlutamateNeurons
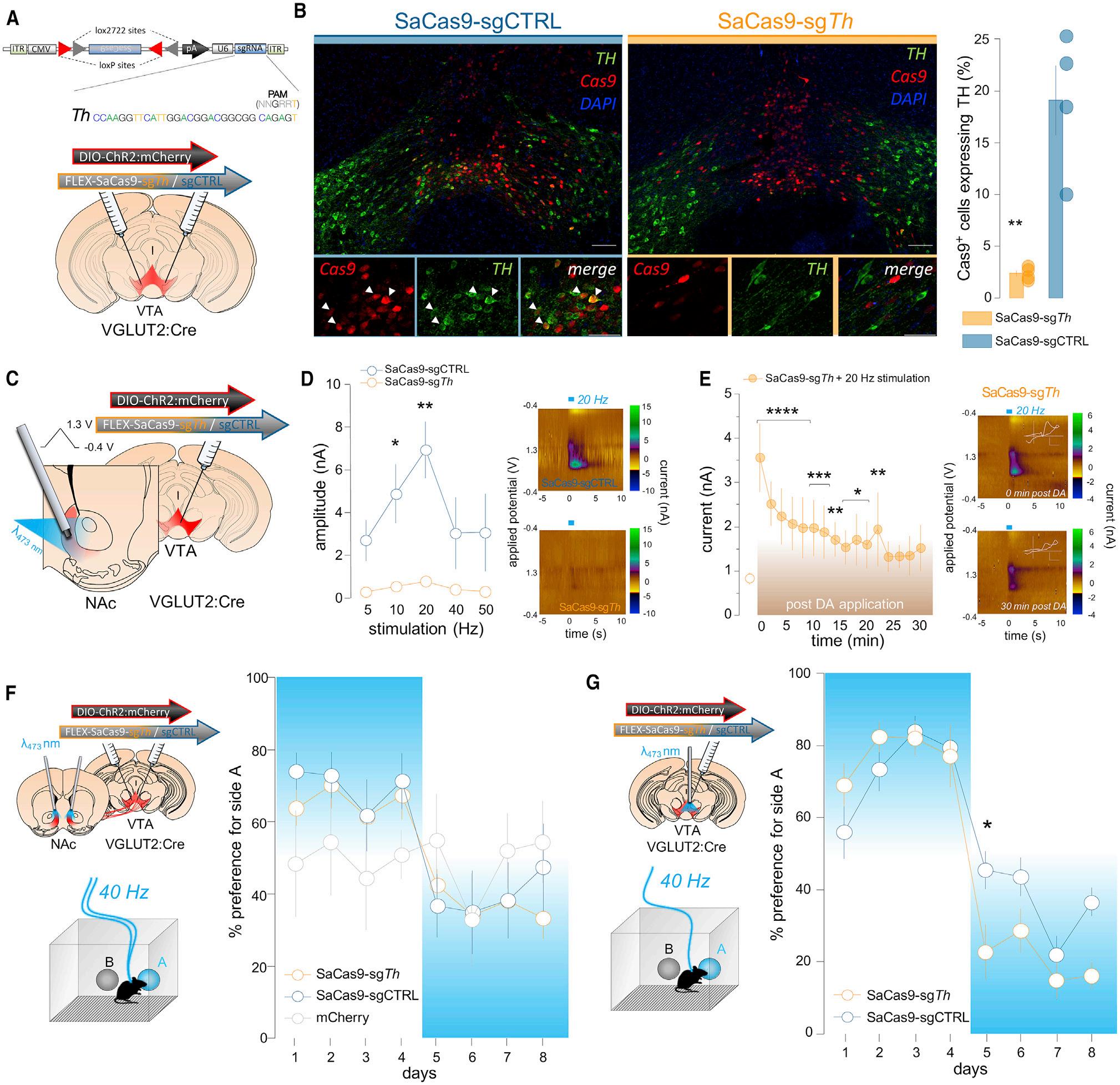
WhiletheabovedatasuggestthatVTAglutamateneuronscan conveyareinforcementsignalthatdoesnotdependon increasedDArelease,thedisruptionofDAsynthesisandrelease includedneuronsthatdonotexpressVGLUT2intheadultdueto transientdevelopmentalexpressionofVGLUT2inawiderpopulationofmidbrainDAneurons(FigureS1).Further,lossofTH fromearlydevelopmentmightcausecompensatoryadaptations incKOmice.Tobypasstheseissues,weturnedtoarecently developedviral-basedCRISPR/Cas9approachtodisruptDA synthesisandreleaseselectivelyfromadultVTAneuronsthatexpressVGLUT2.ThisapproachreliedonasingleAAVvectorfor Cre-dependentexpressionof Staphylococcusaureus Cas9 (SaCas9)andU6promoter-drivenexpressionofasingle-guide RNAtoinduceindelmutationsinthe Th gene(sgTh)(Hunker etal.,2020).ThisAAVvector(orsgCTRL)wasinfusedtogether withAAV-DIO-ChR2:mCherryintoVTAofVGLUT2:Cremice (Figure4A).Immunohistochemicalanalysisshowed19%of Cas9-expressing(VGLUT2)VTAneuronsexpressedTHinthe sgCTRLgroup,butonly2%expressedTHinthesgTh group (Figure4B).Using exvivo FSCV,wefoundsubstantiallyreduced ChR2-evokedDAreleaseinthesgTh-comparedtosgCTRL-injectedbrains,demonstratingsuccessfuldisruptionofDArelease fromVTAglutamateneurons(Figures4Cand4D).ExogenousDA applicationrescuedevokedDAtransientsfromthesgTh brains, confirmingthatVTAglutamateterminalsretainedtheabilityto recycleandreleaseDAwhensubstratewasavailable(Figure4E).
ThesgCTRLandsgTh animalswerealsotestedforself-stimulationofVTAglutamateneuronsusingthe2-holeICSStask.In accordancewithourresultsobtainedincKOmice,sgCTRLand sgTh micedisplayedanequivalentpreferenceforthenosepoke holecoupledtooptogeneticstimulationofVTAglutamateterminalsinNAcandswitchedpreferencewhenweswitchedthe activenosepoke(Figure4F).Weobservedsimilarresults whentheactivenosepokeholewascoupledtooptogenetic
Figure2.Self-stimulationofVTAGlutamateNeuronsincKOMice
(A)Approachforself-stimulationofVTAglutamateterminalsinNAc.
(B)ChR2:mCherry-expressingcontrolandcKOmicedisplayedequivalentpreferencefortheactivenosepokehole(days1–4,holeA)andfollowedtheactiveside afteraswitch(days5–8,holeB);RMtwo-wayANOVA,maineffectofday,F(7,175)=18.6,p<0.0001andinteraction,F(14,175)=7.2,p<0.0001(n=10control, n=10cKO,n=8mCherry).Tukey-Kramer’smultiplecomparisonstest***p<0.001,**p<0.01,*p<0.05.
(C)ChR2:mCherry-expressingcontrolandcKOincreasethenumberofphotostimulationsearnedacrosssessionscomparedtomCherry-expressingmice;RM two-wayANOVA,maineffectofgenotype,F(2,25)=5.2,p=0.013andinteraction,F(14,175)=1.8,p=0.043.Sidak’smultiplecomparisonstest***p<0.001,**p< 0.01,*p<0.05.
(D)Approachforself-stimulationofVTAglutamatecellbodies.
(E)ControlandcKOmicedevelopedanequivalentpreferencefortheactivenosepokehole;RMtwo-wayANOVA,maineffectofday,F(3,57)=15.9,p<0.0001.
(F)ControlandcKOmiceearnedanequivalentnumberofphotostimulationspersessionacrossdays;RMtwo-wayANOVA,maineffectofday,F(3,57)=27.2,p< 0.0001(n=11control,n=10cKOmice).
Dataarerepresentedasmean±SEM.Seealso FigureS4
stimulationofglutamatecellbodiesinVTA(Figure4G).These dataprovideadditionalindependentevidencethatVTAglutamateneuronactivitycansupportpositivereinforcementabsent concomitantincreasesinDAsignaling.
DISCUSSION
Priorworkhasdemonstratedthat,likeVTADAneurons,optogeneticactivationofVTAglutamateneuronscansupportapproach behaviors(Wangetal.,2015; Yooetal.,2016).However,the extenttowhichVTAglutamateneuronsrelyonDAsignalingto driverewardbehaviorsremainedunclear.Indeed,asubsetof VTAglutamateneuronsco-expressDAmarkersandco-release DAdirectly(Kawanoetal.,2006; Lavinetal.,2005; Mingoteetal., 2019; Stuberetal.,2010).Inaddition,VTAglutamateneurons makelocalsynapsesontoVTADAneurons,representing anothermechanismbywhichtheymightelicitincreasedDA signaling(Dobietal.,2010; Qietal.,2016; Yooetal.,2016).In thisreport,weusedconditionalablationofTHinglutamateneuronstotestthecontributionofDAtransmissionforreinforcement behaviorsevokedbyVTAglutamateneuronactivity.Wefound that,whileVTAglutamateneuronstimulationevokesDArelease, thisDAsignalwasnotnecessaryfortheactivationofVTAglutamateneuronstosupportself-stimulationandapproachbehaviors.WethusproposethatglutamateandDAprojectionsfrom VTAtoNAcrepresentpartiallyoverlappingbutfunctionally distinctparallelpathwaysthatcanindependentlyanddistinctivelysupportpositivereinforcement.
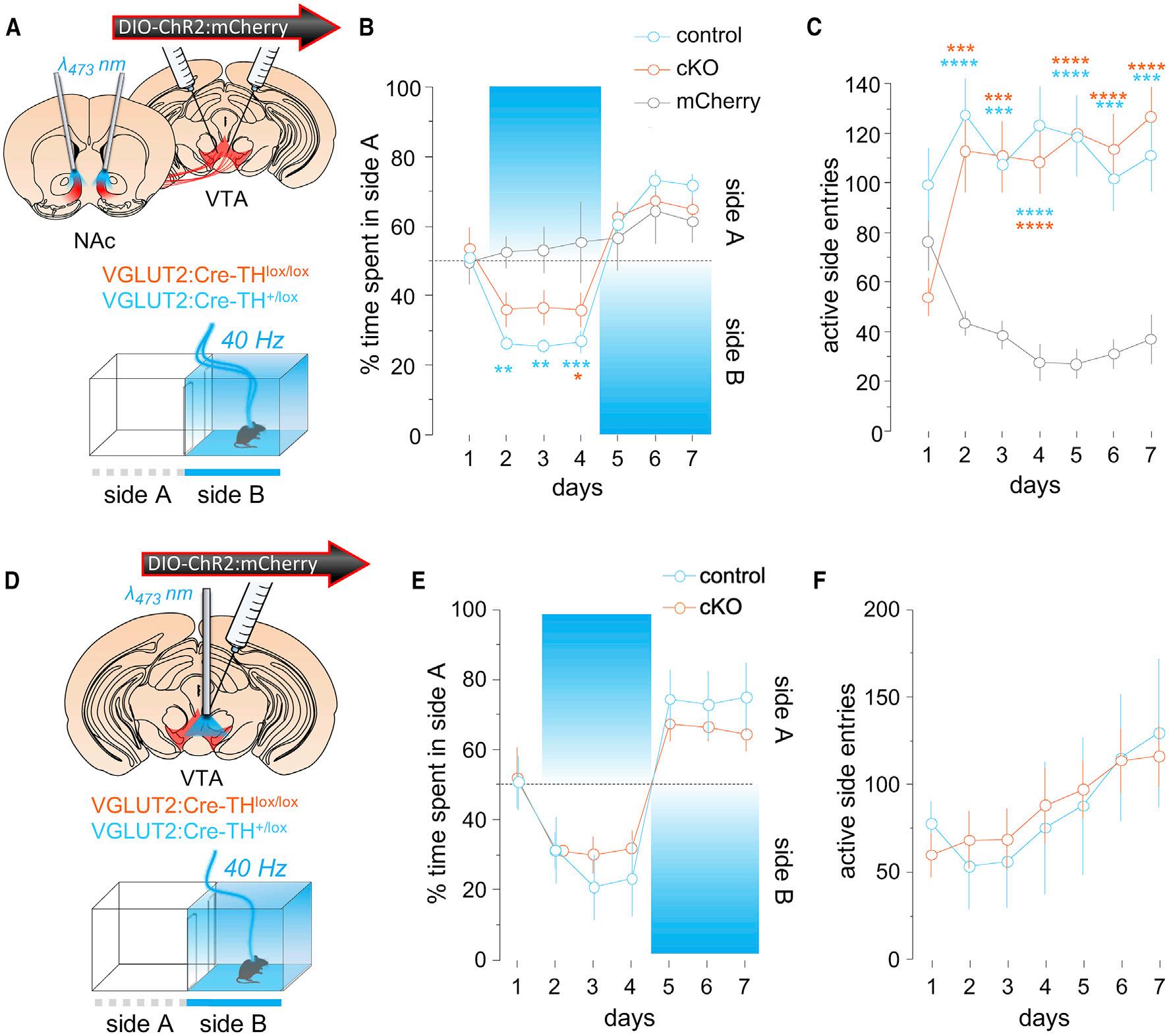
Figure3.BehaviorinReal-TimePlacePreferenceAssayIsUnchangedbytheLossofDACo-releaseincKOMice
(A)Schematicofthereal-timeplacepreferenceassay(RTPP)withstimulationofVTAglutamateterminalsinNAc.
(B)ChR2:mCherry-expressingcontrolandcKOmicespentlesstimeintheactivesidecomparedtomCherry-expressingmice;RMtwo-wayANOVA,maineffect ofday,F(6,150) =23.8,p<0.0001andinteraction,F(12,150) =3.7,p<0.0001(n=10controlmice,n=10cKO,n=8mCherry).Tukey-Kramer’smultiplecomparisons test***p<0.001,**p<0.01,*p<0.05.
(C)ChR2:mCherry-expressingcontrolandcKOdisplayedanincreaseinapproachrateintotheactivecompartment;RMtwo-wayANOVA,maineffectofgenotype,F(2,25) =17.1,p<0.0001andinteractionF(25,150) =7.3,p<0.0001.Tukey-Kramer’smultiplecomparisonstest****p<0.0001,***p<0.001.
(D)SchematicofRTPPwithstimulationofVTAglutamatecellbodies.
(E)ControlandcKOmicespentlesstimeinthesidepairedwithlaser;RMtwo-wayANOVA,maineffectofday,F(6,78) =14.6,p<0.0001.
(F)ControlandcKOdisplayedaconcomitantincreaseinapproachrateacrosssessions;RMtwo-wayANOVA,maineffectofday,F(6,78) =6.6,p<0.0001(n=11 control,n=10cKOmice).Dataarerepresentedasmean±SEM.Seealso FigureS4
Weconsistentlyfoundthat10%–20%ofVTAneuronsthatexpressVGLUT2inadultmouseVTAalsoco-expresstheDA markerTH.Thisisinlinewithotherrecentreportsanddemonstratesthatthereisalargerpopulationofnon-DAglutamateneuronsconcentratedinmedialVTAofmice(Hnaskoetal.,2012; Yamaguchietal.,2015).Weprovidenewevidencethatboth invivo and exvivo optogeneticstimulationofglutamatecell bodiesinVTAortheirterminalscandirectlydriveDAreleasein themedialNAc.DualTH/VGLUT2-expressingneuronswere virtuallyabsentinourcKOandsgTh animals,aswasoptogenetic-evokedDArelease,demonstratingsuccessfuldisruption
ofDAco-releasefromVTAglutamateneuronsinourmodels. Importantly,ourdataalsosuggestthatanyDAreleasethatmight beevokedthroughfeedforwardmechanismsorthroughrecyclingofextracellularDAreleasedbyotherneuronsisabrogated inthecKOmicethatlackedevokedDArelease invivo.Despite thelossofDAsignalsinourcKOandsgTh animals,optogenetic activationofVTAglutamateneuronssupportedreinforcement andapproachbehaviorsinourICSSandRTPPassaysthat wereindistinguishablefrommicewithintactDA/glutamatecotransmission.Similarresultswereobtainedwhetheroptogenetic stimulationwasdeliveredatthelevelofVTAglutamatecell
Pleasecitethisarticleinpressas:Zelletal.,VTAGlutamateNeuronActivityDrivesPositiveReinforcementAbsentDopamineCo-release,Neuron (2020),https://doi.org/10.1016/j.neuron.2020.06.011
Figure4.Self-stimulationofVTAGlutamateTerminalsinNAcfollowingCRISPR/Cas9DisruptionofTHandDACo-release
(A)SchematicofAAVvectorsandapproachforCRISPR/Cas9conditionaldeletionof Th fromVTAglutamateneuronswithChR2:mCherryexpression.
(B)Coronalsectionsshowco-localizationofTHinCas9-expressingneuronsinsgCTRLmiceisabsentinsgTh mice;scale,100 mm(top),50 mm(bottom);ttest, **p=0.0025(n=4mice).
(C)Schematicof exvivo FSCVapproach.
(D)PhotostimulationevokedDAtransientsfromVTAglutamateterminalsinmedialNAcshellofsgCTRLbutnotsgTh mice;RMtwo-wayANOVA,maineffectof frequency,F(4,24) =12.9,p<0.0001;treatmentF(1,6) =7.1,p=0.038andinteraction,F(4,24) =8.1,p=0.0003,Sidak’smultiplecomparisonstest**p<0.01,*p< 0.05(n=4micepergroup).Rightinsetsshowexamplecolorplotsfollowing20Hzphotostimulation.
(E)Timecourseofopto-triggeredDAtransientsizesafterbathapplication/wash;RMone-wayANOVA,maineffectoftreatment,F(16,48) =15.5,p<0.0001. Bonferroni’smultiplecomparisonstest****p<0.0001,***p<0.001,**p<0.01,*p<0.05(n=4mice).Rightinsetsshowexamplecolorplotsfollowing20Hz photostimulationat0min(top)and30min(bottom)afterDAbathapplication/wash.Voltammogramscale:2nA;0.4V.
(F)Left:approachforself-stimulationofVTAglutamateterminalsinNAc.Right:miceinjectedwitheithersgTh orsgCTRLdevelopanequivalentpreferenceforthe activenosepokehole;RMtwo-wayANOVA,maineffectofday,F(7,126) =5.7,p<0.0001(n=7sgTh,n=8sgCTRL,n=6mCherrymice).
(legendcontinuedonnextpage)
Neuron 107,1–10,September9,2020 7
Pleasecitethisarticleinpressas:Zelletal.,VTAGlutamateNeuronActivityDrivesPositiveReinforcementAbsentDopamineCo-release,Neuron (2020),https://doi.org/10.1016/j.neuron.2020.06.011
bodies,ortheirterminalsinNAc.Thus,aconcomitantincreasein DAsignalingdoesnotappearnecessaryforbehavioralreinforcementdrivenbyVTAglutamateneuronactivity.
Consistentwithourpreviousobservations,wefoundthatthe sameanimalsthatreadilyself-stimulatedVTAglutamateneuronsdisplayedcounter-intuitiveavoidancebehaviorinthe RTPPassay(Yooetal.,2016).However,thereductionintime spentintheactivechamberwasaccompaniedbyanincreased approachratetothatsameactivechamber,andbothofthese findingswerealsoobservedinthecKO.Thispatternofbehavior increasesthenumberofshortdurationstimuliandprobablyreflectsmiceadjustingtheirbehaviorovertimetooptimizetheir preferredpatternofstimulation.Indeed,usinganinstrumental assay,micedisplayedstrongpreferenceforbriefstimulation ofVTAglutamateneurons,andbycomparisonlongerstimulationofVTADAneuronswaspreferred(Yooetal.,2016).We thereforehypothesizethatbothVTADAandglutamateneuron activitycandrivepositivereinforcementbutthattheydosoin distinctivewaysandthatrewarddrivenbyVTAglutamate neuronactivitydoesnotdependonaccompanyingincreases inDArelease.
AnalternativehypothesisisthatdifferentsubpopulationsofVTA glutamateneuronsdifferentiallydriverewardandaversionthrough differentmechanisms,similartodifferentprojection-definedVTA DAsub-populations(deJongetal.,2019).Indeed,initialinvestigationsofVTAglutamateneuronactivity invivo showsadiversityof responsestosalientrewardingandaversivestimuli(Montardy etal.,2019; Rootetal.,2018b).Thus,onepopulationofVTAglutamateneuronscoulddriveapproachthroughintra-VTAexcitation ofDAneurons,whileanotherpopulationmaydriveavoidance viaprojectionstoNAcorotherdistalstructures.Inthiscase, perhapsdifferentpatternsofstimulationdifferentiallyrecruitsubpopulationsofVTAglutamateneuronsresultingincomplexsequencesofapproachandavoidance.However,ourpresentfindingsargueagainstthismechanism,asmicethatlackDArelease evokedbyVTAglutamateneuronstimulationcontinuetoselfstimulateVTAglutamatecellbodiesorterminalsinNAc.Further, ourfindingthatmicethatself-stimulateinanoperantassaycan showapparentplaceavoidanceintheRTPPassaycautionagainst interpretingwidelyusedmeasuresofavoidancebehaviorsas conclusivelyindicativeofaversion.Instead,wesuggestthata reducedapproachrateorevidenceofanegativeaffectivereaction (e.g.,conditionedavoidanceorinnatefearresponses)mightbe necessarytoconcludeastimulusisaversive.Inanycase,future studieswillbenecessarytoreconciletheheterogeneityinVTA glutamateresponsesfound invivo withtheirfunctionalrolesin reward-relatedorotherbehaviors.
WealsoexaminedtheimpactofablatedDAsynthesisand releasefromVTAVGLUT2neuronsonglutamateneurotransmissionintheNAcusingelectrophysiology.Light-triggeredDNQXsensitiveoEPSCswererecordedinbothcontrolandcKO mice,withnodifferenceintheircharacteristics.However,we observedasignificantreductioninpaired-pulsedepressionin
thecKO.Thismightindicatealowerreleaseprobabilityinthe cKO,reducedD2-autoreceptorinhibition,orreducedglutamate quantalcontentasaconsequenceofreducedvesicularsynergy (Adroveretal.,2014; Aguilaretal.,2017; HnaskoandEdwards, 2012; Hnaskoetal.,2010; Silmetal.,2019).
PreviousstudiesshowedthatVTAglutamatesynapsesmight preferentiallyimpactstriatalinterneurons(CaiandFord,2018; Chuhmaetal.,2014, 2018; Qietal.,2016).However,VTAglutamateneuronsalsodirectlysynapseontoandcanalter invivo firing rateofNAcprojectionneurons(Mingoteetal.,2015; Stuberetal., 2010; Tecuapetlaetal.,2010; Wangetal.,2017).Yetithadnot beendeterminedwhetherD1orD2neurons,whichplaydifferent functionalroles,mightbedifferentiallyconnectedtoglutamate neuronsfromVTA.Althoughmorestudieswillbenecessaryto assesshowVTAinputsontodistinctNAccelltypesinfluencetheir activityandeffectonbehavior invivo,ourdatacomparingoEPSC propertiessuggestnoclearbiasintheconnectivityofVTAglutamatesynapsesontoMSNcelltype.
Previousattemptsatunderstandingtherelativecontributions ofdualDA/glutamateco-transmissionfocusedprimarilyon isolatingtheDAcomponent.Mingoteandcolleaguesachieved apartialreductioninglutamatereleasefrommidbrainDAneuronswithintactDAtransmissionandobservedadecreasein amphetaminesensitizationandapotentiationoflatentinhibition, implyingaroleforglutamateco-releaseinmotivationalsalience andcontextdiscrimination(Mingoteetal.,2017).Conditional deletionofVGLUT2fromDAT-expressingDAneuronsabolished evokedoEPSCsinNAcandotherterminalstructures(Soden etal.,2016; Stuberetal.,2010; Tritschetal.,2012)andledto reducedpsychostimulant-inducedlocomotoractivityand reward-seekingbehaviors(Alsio etal.,2011; Birgneretal., 2010; Hnaskoetal.,2010; Wallen-Mackenzieetal.,2010),while self-stimulationofDAneuronswasunaffected(Wangetal., 2017).LossofVGLUT2alsosensitizedDAneuronstoneurotoxins,suggestingaroleforVGLUT2inselectiveDAneuron vulnerability(Shenetal.,2018; Steinkellneretal.,2018).
Here,wereportthefirstresultsthatisolatetheglutamate componentofVTAprojectionneuronsusingconditionalgenetic manipulations.WefoundthatoptogeneticstimulationofVTA glutamateneuronsissufficienttodrivepositivereinforcement andthatthisappearstobeindependentofconcurrentDA release.Glutamateneuronsthereforerepresentanalternate VTApathwaywithuniquefeaturesbywhichmesolimbicprojectionscouldintegraterewardandmotivationalsignalstocontrol reward-seekingbehaviors.
STAR+METHODS
Detailedmethodsareprovidedintheonlineversionofthispaper andincludethefollowing:
d KEYRESOURCESTABLE
d RESOURCEAVAILABILITY
(G)Left:approachforself-stimulationofVTAglutamatecellbodies.Right:miceinjectedwitheithersgTh orsgCTRLdevelopanequivalentpreferenceforthe activenosepokehole;RMtwo-wayANOVA,maineffectofday,F(7,84) =43.1,p<0.0001andinteraction,F(7,84) =2.7,p=0.015(n=6sgTh,n=8sgCTRLmice). Sidak’smultiplecomparisonstest*p<0.05. Dataarerepresentedasmean±SEM.Seealso FigureS4
8 Neuron 107,1–10,September9,2020
Pleasecitethisarticleinpressas:Zelletal.,VTAGlutamateNeuronActivityDrivesPositiveReinforcementAbsentDopamineCo-release,Neuron (2020),https://doi.org/10.1016/j.neuron.2020.06.011
Report
B LeadContact
B MaterialsAvailability
B DataandCodeAvailability
d EXPERIMENTALMODELANDSUBJECTDETAILS
B Animals
d METHODDETAILS
B Stereotacticsurgery
B Immunohistochemistry
B Insitu hybridizationfollowedbyimmunohistochemistry
B Electrophysiologicalrecordingsfromadultbrainslices
B Fast-scancyclicvoltammetryrecordings
B Behavioralstudies
d QUANTIFICATIONANDSTATISTICALANALYSIS
SUPPLEMENTALINFORMATION
SupplementalInformationcanbefoundonlineat https://doi.org/10.1016/j. neuron.2020.06.011
ACKNOWLEDGMENTS
WethankDr.MartinDarvasforprovidingTHfloxedmiceandDr.NicholasSpitzerforguidanceoncombiningRNAscopewithimmunohistochemistry.This workhasbeensupportedbytheNIH(R01DA036612,K99AG059834, K99MH119312,andK99DA046514),VA(I01BX003759),aNIDA-INSERM postdoctoralDrugAbuseResearchFellowship,aSchrӧdingerpostdoctoral fellowshipfromtheAustrianScienceFund(J3656-B24),andaJonasSalk Fellowship.
AUTHORCONTRIBUTIONS
V.Z.andT.S.H.conceivedtheprojectanddesignedexperiments.N.G.H.conductedandanalyzedthe invivo FSCVrecordingswithsupportfromX.J.V.Z. conductedandanalyzedtheelectrophysiologicalrecordings.V.Z.conducted andanalyzedthebehavioralandoptogeneticstudieswiththehelpofE.S.,L.F., andS.W.V.Z.conductedandanalyzed exvivo FSCVrecordingswithsupport fromN.G.H.T.S.conductedandanalyzedISH/IHCexperimentsandbehavioralpharmacology.A.C.H.andL.Z.providedAAVCRISPR/Cas9constructs. V.Z.andT.S.H.supervisedallaspectsofthework.V.Z.andT.S.H.wrotethe paperwitheditorialinputfromallauthors.
DECLARATIONOFINTERESTS
Theauthorsdeclarenocompetinginterests.
Received:February11,2019
Revised:April21,2020
Accepted:June7,2020
Published:June30,2020
REFERENCES
Adrover,M.F.,Shin,J.H.,andAlvarez,V.A.(2014).Glutamateanddopamine transmissionfrommidbraindopamineneuronssharesimilarreleasepropertiesbutaredifferentiallyaffectedbycocaine.J.Neurosci. 34,3183–3192. Aguilar,J.I.,Dunn,M.,Mingote,S.,Karam,C.S.,Farino,Z.J.,Sonders,M.S., Choi,S.J.,Grygoruk,A.,Zhang,Y.,Cela,C.,etal.(2017).Neuronal DepolarizationDrivesIncreasedDopamineSynapticVesicleLoadingvia VGLUT.Neuron 95,1074–1088.
Alsio,J.,Nordenankar,K.,Arvidsson,E.,Birgner,C.,Mahmoudi,S.,Halbout, B.,Smith,C.,Fortin,G.M.,Olson,L.,Descarries,L.,etal.(2011).Enhancedsucroseandcocaineself-administrationandcue-induceddrugseekingafterloss ofVGLUT2inmidbraindopamineneuronsinmice.J.Neurosci. 31, 12593–12603.
Bariselli,S.,Glangetas,C.,Tzanoulinou,S.,andBellone,C.(2016).Ventral tegmentalareasubcircuitsprocessrewardingandaversiveexperiences. J.Neurochem. 139,1071–1080.
Berridge,K.C.,Robinson,T.E.,andAldridge,J.W.(2009).Dissectingcomponentsofreward:‘liking’,‘wanting’,andlearning.Curr.Opin.Pharmacol. 9,65–73.
Berube-Carriere,N.,Riad,M.,DalBo,G.,Levesque,D.,Trudeau,L.E.,and Descarries,L.(2009).Thedualdopamine-glutamatephenotypeofgrowing mesencephalicneuronsregressesinmatureratbrain.J.Comp.Neurol. 517, 873–891.
Birgner,C.,Nordenankar,K.,Lundblad,M.,Mendez,J.A.,Smith,C.,le Greves,M.,Galter,D.,Olson,L.,Fredriksson,A.,Trudeau,L.E.,etal.(2010). VGLUT2indopamineneuronsisrequiredforpsychostimulant-inducedbehavioralactivation.Proc.Natl.Acad.Sci.USA 107,389–394.
Cai,Y.,andFord,C.P.(2018).DopamineCellsDifferentiallyRegulateStriatal CholinergicTransmissionacrossRegionsthroughCoreleaseofDopamine andGlutamate.CellRep. 25,3148–3157.
Chuhma,N.,Choi,W.Y.,Mingote,S.,andRayport,S.(2009).Dopamine neuronglutamatecotransmission:frequency-dependentmodulationinthe mesoventromedialprojection.Neuroscience 164,1068–1083.
Chuhma,N.,Mingote,S.,Moore,H.,andRayport,S.(2014).Dopamineneuronscontrolstriatalcholinergicneuronsviaregionallyheterogeneousdopamineandglutamatesignaling.Neuron 81,901–912.
Chuhma,N.,Mingote,S.,Yetnikoff,L.,Kalmbach,A.,Ma,T.,Ztaou,S.,Sienna, A.C.,Tepler,S.,Poulin,J.F.,Ansorge,M.,etal.(2018).Dopamineneuron glutamatecotransmissionevokesadelayedexcitationinlateraldorsalstriatal cholinergicinterneurons.eLife 7.PublishedonlineOctober8,2018. https:// doi.org/10.7554/eLife.39786
Clark,J.J.,Sandberg,S.G.,Wanat,M.J.,Gan,J.O.,Horne,E.A.,Hart,A.S., Akers,C.A.,Parker,J.G.,Willuhn,I.,Martinez,V.,etal.(2010).Chronicmicrosensorsforlongitudinal,subseconddopaminedetectioninbehavinganimals. Nat.Methods 7,126–129.
Cole,S.L.,Robinson,M.J.F.,andBerridge,K.C.(2018).Optogeneticself-stimulationinthenucleusaccumbens:D1rewardversusD2ambivalence.PLoS ONE 13,e0207694.
Darvas,M.,andPalmiter,R.D.(2010).Restrictingdopaminergicsignalingto eitherdorsolateralormedialstriatumfacilitatescognition.J.Neurosci. 30, 1158–1165.
deJong,J.W.,Afjei,S.A.,PollakDorocic,I.,Peck,J.R.,Liu,C.,Kim,C.K.,Tian, L.,Deisseroth,K.,andLammel,S.(2019).ANeuralCircuitMechanismfor EncodingAversiveStimuliintheMesolimbicDopamineSystem.Neuron 101,133–151.
Dobi,A.,Margolis,E.B.,Wang,H.-L.,Harvey,B.K.,andMorales,M.(2010). Glutamatergicandnonglutamatergicneuronsoftheventraltegmentalarea establishlocalsynapticcontactswithdopaminergicandnondopaminergic neurons.J.Neurosci. 30,218–229.
Fields,H.L.,Hjelmstad,G.O.,Margolis,E.B.,andNicola,S.M.(2007).Ventral tegmentalareaneuronsinlearnedappetitivebehaviorandpositivereinforcement.Annu.Rev.Neurosci. 30,289–316.
Heien,M.L.A.V.,Khan,A.S.,Ariansen,J.L.,Cheer,J.F.,Phillips,P.E.M., Wassum,K.M.,andWightman,R.M.(2005).Real-timemeasurementofdopaminefluctuationsaftercocaineinthebrainofbehavingrats.Proc.Natl.Acad. Sci.USA 102,10023–10028.
Heusner,C.L.,Beutler,L.R.,Houser,C.R.,andPalmiter,R.D.(2008).Deletion ofGAD67indopaminereceptor-1expressingcellscausesspecificmotordeficits.Genesis 46,357–367.
Hnasko,T.S.,andEdwards,R.H.(2012).Neurotransmittercorelease:mechanismandphysiologicalrole.Annu.Rev.Physiol. 74,225–243.
Hnasko,T.S.,Chuhma,N.,Zhang,H.,Goh,G.Y.,Sulzer,D.,Palmiter,R.D., Rayport,S.,andEdwards,R.H.(2010).Vesicularglutamatetransportpromotesdopaminestorageandglutamatecoreleaseinvivo.Neuron 65, 643–656.
Neuron 107,1–10,September9,2020 9
Pleasecitethisarticleinpressas:Zelletal.,VTAGlutamateNeuronActivityDrivesPositiveReinforcementAbsentDopamineCo-release,Neuron (2020),https://doi.org/10.1016/j.neuron.2020.06.011
Hnasko,T.S.,Hjelmstad,G.O.,Fields,H.L.,andEdwards,R.H.(2012).Ventral tegmentalareaglutamateneurons:electrophysiologicalpropertiesandprojections.J.Neurosci. 32,15076–15085.
Howard,C.D.,Li,H.,Geddes,C.E.,andJin,X.(2017).DynamicNigrostriatal DopamineBiasesActionSelection.Neuron 93,1436–1450.
Hunker,A.C.,Soden,M.E.,Krayushkina,D.,Heymann,G.,Awatramani,R., andZweifel,L.S.(2020).ConditionalSingleVectorCRISPR/SaCas9Viruses forEfficientMutagenesisintheAdultMouseNervousSystem.CellRep. 30, 4303–4316.
Ikemoto,S.,andBonci,A.(2014).Neurocircuitryofdrugreward. Neuropharmacology 76 (PtB),329–341.
Kawano,M.,Kawasaki,A.,Sakata-Haga,H.,Fukui,Y.,Kawano,H.,Nogami, H.,andHisano,S.(2006).Particularsubpopulationsofmidbrainandhypothalamicdopamineneuronsexpressvesicularglutamatetransporter2intherat brain.J.Comp.Neurol. 498,581–592.
Keiflin,R.,andJanak,P.H.(2015).DopaminePredictionErrorsinReward LearningandAddiction:FromTheorytoNeuralCircuitry.Neuron 88,247–263.
Keithley,R.B.,andWightman,R.M.(2011).Assessingprincipalcomponent regressionpredictionofneurochemicalsdetectedwithfast-scancyclicvoltammetry.ACSChem.Neurosci. 2,514–525.
Keithley,R.B.,Heien,M.L.,andWightman,R.M.(2009).Multivariateconcentrationdeterminationusingprincipalcomponentregressionwithresidualanalysis.TrendsAnalyt.Chem. 28,1127–1136.
Kouwenhoven,W.M.,Fortin,G.,Penttinen,A.-M.,Florence,C.,DelignatLavaud,B.,Bourque,M.-J.,Trimbuch,T.,Luppi,M.P.,Poulin,J.-F., Rosenmund,C.,etal.(2019).Vglut2expressionindopamineneuronscontributestopost-lesionalstriatalreinnervation.bioRxiv,12.23.887323.
Kravitz,A.V.,Tye,L.D.,andKreitzer,A.C.(2012).Distinctrolesfordirectand indirectpathwaystriatalneuronsinreinforcement.Nat.Neurosci. 15,816–818. Lavin,A.,Nogueira,L.,Lapish,C.C.,Wightman,R.M.,Phillips,P.E.,and Seamans,J.K.(2005).Mesocorticaldopamineneuronsoperateindistincttemporaldomainsusingmultimodalsignaling.J.Neurosci. 25,5013–5023.
Lein,E.S.,Hawrylycz,M.J.,Ao,N.,Ayres,M.,Bensinger,A.,Bernard,A.,Boe, A.F.,Boguski,M.S.,Brockway,K.S.,Byrnes,E.J.,etal.(2007).Genome-wide atlasofgeneexpressionintheadultmousebrain.Nature 445,168–176.
Lobo,M.K.,andNestler,E.J.(2011).Thestriatalbalancingactindrugaddiction:distinctrolesofdirectandindirectpathwaymediumspinyneurons. Front.Neuroanat. 5,41.
Mendez,J.A.,Bourque,M.-J.,DalBo,G.,Bourdeau,M.L.,Danik,M.,Williams, S.,Lacaille,J.-C.,andTrudeau,L.-E.(2008).Developmentalandtargetdependentregulationofvesicularglutamatetransporterexpressionbydopamineneurons.J.Neurosci. 28,6309–6318.
Mingote,S.,Chuhma,N.,Kusnoor,S.V.,Field,B.,Deutch,A.Y.,andRayport, S.(2015).FunctionalConnectomeAnalysisofDopamineNeuron GlutamatergicConnectionsinForebrainRegions.J.Neurosci. 35, 16259–16271.
Mingote,S.,Chuhma,N.,Kalmbach,A.,Thomsen,G.M.,Wang,Y.,Mihali,A., Sferrazza,C.,Zucker-Scharff,I.,Siena,A.C.,Welch,M.G.,etal.(2017). Dopamineneurondependentbehaviorsmediatedbyglutamatecotransmission.eLife 6.PublishedonlineJuly13,2017. https://doi.org/10.7554/ eLife.27566
Mingote,S.,Amsellem,A.,Kempf,A.,Rayport,S.,andChuhma,N.(2019). Dopamine-glutamateneuronprojectionstothenucleusaccumbensmedial shellandbehavioralswitching.Neurochem.Int. 129,104482. Montardy,Q.,Zhou,Z.,Lei,Z.,Liu,X.,Zeng,P.,Chen,C.,Liu,Y.,Sanz-Leon, P.,Huang,K.,andWang,L.(2019).CharacterizationofglutamatergicVTAneuralpopulationresponsestoaversiveandrewardingconditioninginfreely-movingmice.Sci.Bull.(Beijing) 64,1167–1178.
Pupe,S.,andWalle ´ n-Mackenzie,A ˚ .(2015).Cre-drivenoptogeneticsinthe heterogeneousgeneticpanoramaoftheVTA.TrendsNeurosci. 38,375–386.
Qi,J.,Zhang,S.,Wang,H.L.,Barker,D.J.,Miranda-Barrientos,J.,and Morales,M.(2016).VTAglutamatergicinputstonucleusaccumbensdrive aversionbyactingonGABAergicinterneurons.Nat.Neurosci. 19,725–733.
Root,D.H.,Zhang,S.,Barker,D.J.,Miranda-Barrientos,J.,Liu,B.,Wang, H.-L.,andMorales,M.(2018a).SelectiveBrainDistributionandDistinctive SynapticArchitectureofDualGlutamatergic-GABAergicNeurons.CellRep. 23,3465–3479.
Root,D.H.,Estrin,D.J.,andMorales,M.(2018b).AversionorSalience SignalingbyVentralTegmentalAreaGlutamateNeurons.iScience 2,51–62. Shen,H.,Marino,R.A.M.,McDevitt,R.A.,Bi,G.-H.,Chen,K.,Madeo,G.,Lee, P.-T.,Liang,Y.,DeBiase,L.M.,Su,T.-P.,etal.(2018).Geneticdeletionofvesicularglutamatetransporterindopamineneuronsincreasesvulnerabilityto MPTP-inducedneurotoxicityinmice.Proc.Natl.Acad.Sci.USA 115, E11532–E11541.
Silm,K.,Yang,J.,Marcott,P.F.,Asensio,C.S.,Eriksen,J.,Guthrie,D.A., Newman,A.H.,Ford,C.P.,andEdwards,R.H.(2019).SynapticVesicle RecyclingPathwayDeterminesNeurotransmitterContentandRelease Properties.Neuron 102,786–800.
Soden,M.E.,Miller,S.M.,Burgeno,L.M.,Phillips,P.E.M.,Hnasko,T.S.,and Zweifel,L.S.(2016).GeneticIsolationofHypothalamicNeuronsthat RegulateContext-SpecificMaleSocialBehavior.CellRep. 16,304–313.
Steinkellner,T.,Zell,V.,Farino,Z.J.,Sonders,M.S.,Villeneuve,M.,Freyberg, R.J.,Przedborski,S.,Lu,W.,Freyberg,Z.,andHnasko,T.S.(2018).Rolefor VGLUT2inselectivevulnerabilityofmidbraindopamineneurons.J.Clin. Invest. 128,774–788.
Stuber,G.D.,Hnasko,T.S.,Britt,J.P.,Edwards,R.H.,andBonci,A.(2010). Dopaminergicterminalsinthenucleusaccumbensbutnotthedorsalstriatum coreleaseglutamate.J.Neurosci. 30,8229–8233.
Tecuapetla,F.,Patel,J.C.,Xenias,H.,English,D.,Tadros,I.,Shah,F.,Berlin, J.,Deisseroth,K.,Rice,M.E.,Tepper,J.M.,andKoos,T.(2010).Glutamatergic signalingbymesolimbicdopamineneuronsinthenucleusaccumbens. J.Neurosci. 30,7105–7110.
Thibeault,K.C.,Kutlu,M.G.,Sanders,C.,andCalipari,E.S.(2019).Cell-type andprojection-specificdopaminergicencodingofaversivestimuliinaddiction.BrainRes. 1713,1–15.
Tritsch,N.X.,Ding,J.B.,andSabatini,B.L.(2012).Dopaminergicneurons inhibitstriataloutputthroughnon-canonicalreleaseofGABA.Nature 490, 262–266.
Trudeau,L.E.,Hnasko,T.S.,Wallen-Mackenzie,A.,Morales,M.,Rayport,S., andSulzer,D.(2014).Themultilingualnatureofdopamineneurons.Prog.Brain Res. 211,141–164.
Wallen-Mackenzie,A.,Wootz,H.,andEnglund,H.(2010).Geneticinactivation ofthevesicularglutamatetransporter2(VGLUT2)inthemouse:whathavewe learntaboutfunctionalglutamatergicneurotransmission?Ups.J.Med.Sci. 115,11–20.
Wang,H.L.,Qi,J.,Zhang,S.,Wang,H.,andMorales,M.(2015).Rewardingeffectsofopticalstimulationofventraltegmentalareaglutamatergicneurons. J.Neurosci. 35,15948–15954.
Wang,D.V.,Viereckel,T.,Zell,V.,Konradsson-Geuken,A ˚ .,Broker,C.J., Talishinsky,A.,Yoo,J.H.,Galinato,M.H.,Arvidsson,E.,Kesner,A.J.,etal. (2017).DisruptingGlutamateCo-transmissionDoesNotAffectAcquisitionof ConditionedBehaviorReinforcedbyDopamineNeuronActivation.CellRep. 18,2584–2591.
Yamaguchi,T.,Wang,H.-L.,Li,X.,Ng,T.H.,andMorales,M.(2011). Mesocorticolimbicglutamatergicpathway.J.Neurosci. 31,8476–8490. Yamaguchi,T.,Qi,J.,Wang,H.L.,Zhang,S.,andMorales,M.(2015). Glutamatergicanddopaminergicneuronsinthemouseventraltegmental area.Eur.J.Neurosci. 41,760–772.
Yoo,J.H.,Zell,V.,Gutierrez-Reed,N.,Wu,J.,Ressler,R.,Shenasa,M.A., Johnson,A.B.,Fife,K.H.,Faget,L.,andHnasko,T.S.(2016).Ventraltegmental areaglutamateneuronsco-releaseGABAandpromotepositivereinforcement.Nat.Commun. 7,13697.
Pleasecitethisarticleinpressas:Zelletal.,VTAGlutamateNeuronActivityDrivesPositiveReinforcementAbsentDopamineCo-release,Neuron (2020),https://doi.org/10.1016/j.neuron.2020.06.011
STAR+METHODS
KEYRESOURCESTABLE
REAGENTorRESOURCESOURCEIDENTIFIER Antibodies
SheepAnti-tyrosinehydroxylase(TH)Pel-FreezeP60101-0
RabbitAnti-tyrosinehydroxylase(TH)MilliporeAB152
RatAnti-dopaminetransporter(DAT)MilliporeMAB369
RabbitAnti-DsRedClontech632496
RabbitAnti-HASigmaH6908
DonkeyAnti-SheepAlexaFluor647JacksonImmunoResearch713-605-147
DonkeyAnti-RatAlexaFluor488-conjugatedJacksonImmunoResearch712-545-150
DonkeyAnti-RabbitFluor594-conjugatedJacksonImmunoResearch711-585-152
DonkeyAnti-RabbitFluor647-conjugatedJacksonImmunoResearch711-605-152
BacterialandVirusStrains
rAAV1-EF1a-DIO-hChR2(H134R)-mCherryUNCvirusvectorcoreN/A rAAV5-EF1a-DIO-mCherryUNCvirusvectorcoreN/A rAAV5-EF1a-DIO-hChR2(H134R)-EYFPUNCvirusvectorcoreN/A
AAV1-FLEX-SaCas9-sgTh
Chemicals,Peptides,andRecombinantProteins
Hunkeretal.,2020 N/A
6,7-Dinitroquinoxaline-2,3(1H,4H)-dione(DNQX)Sigma-AldrichD0540 DopaminehydrochlorideAlfaAesarA11136 3,4-Dihydroxy-L-phenylalanine(L-DOPA)Sigma-AldrichD9628 BenserazidehydrochlorideSigma-AldrichB7283 D-amphetaminehemisulfateSigma-AldrichA5880 SKF81297hydrobromideTocris1447
CriticalCommercialAssays
RNAscopeMultiplexFluorescentKitAdvancedCellDiagnostics320850 Mm-Slc17a6-C1(VGLUT2Antisenseprobe)AdvancedCellDiagnostics319171
ExperimentalModels:Organisms/Strains
Mouse:Slc17a6tm2(cre)Lowl
Mouse:Thlox/lox
Mouse:Tg(Adora2a-cre)K139Gsat/Mmcd
Mouse:Drd1a+/Cr
RESOURCEAVAILABILITY
LeadContact
TheJacksonLaboratory016963
DarvasandPalmiter,2010 N/A
TheJacksonLaboratory036158
Heusneretal.,2008 N/A
FurtherinformationandrequestsforresourcesandreagentsshouldbedirectedtoandwillbefulfilledbytheLeadContact,Thomas S.Hnasko(thnasko@health.ucsd.edu)
MaterialsAvailability
d Thisstudydidnotgeneratenewplasmids.
d Thisstudydidnotgeneratenewmouselines.
d Thisstudydidnotgeneratenewuniquereagents.
DataandCodeAvailability
d Thisstudydidnotgenerateanycode.
d Thisstudydidnotgenerateanyparticulartypeofdataset.
Pleasecitethisarticleinpressas:Zelletal.,VTAGlutamateNeuronActivityDrivesPositiveReinforcementAbsentDopamineCo-release,Neuron (2020),https://doi.org/10.1016/j.neuron.2020.06.011
EXPERIMENTALMODELANDSUBJECTDETAILS
Animals
MicewerebredattheUniversityofCalifornia,SanDiego(UCSD),grouphoused(max5mice/cage),andmaintainedona12hlight–darkcyclewithfoodandwateravailable adlibitum unlessnoted.Initialbreedersfor Slc17a6tm2(cre)Lowl andTg(Adora2a-cre) K139Gsat/MmcdbreederswereobtainedfromTheJacksonLaboratory(stockno:016963and036158,respectively). Drd1a+/Cre (Heusneretal.,2008)breederswereobtainedfromthelabofLarryZweifel(UniversityofWashington)and Thlox/lox micewereprovided bythelabofMartinDarvas(UniversityofWashington).AllmiceweremaintainedfullybackcrossedontoC57BL/6.ControlandTh cKOmiceweregeneratedbybreedinghomozygous Thlox/lox micetodoubleheterozygous Th+/lox;Slc17a6+/Cre miceandheterozygouslittermateswereusedascontrols.Drd1+/Cre orAdora2a-Cremicewerebredto Slc17a6Cre/Cre Micewere3-8monthsoldfor behavioralexperiments, invivo FSCVandimmunohistochemistryand8-12weeksoldforsliceelectrophysiologyand exvivo FSCVexperiments.Maleandfemalemicewereincludedinallexperiments,andallexperimentsperformedinaccordancewithprotocolsapprovedbytheUCSDInstitutionalAnimalCareandUseCommittee.
METHODDETAILS
Stereotacticsurgery
Mice(>4-week-old)wereanaesthetizedwithisoflurane,placedinastereotaxicframe(Kopf),and300nLofAAV1-EF1a-DIOChR2(H134R):mCherryorAAV5-EF1a-DIO-mCherry(UNCgenetherapycentervirusvectorcore)infusedintotheVTAofheterozygote(Th+/lox;Slc17a6+/Cre)andTHcKO(Thlox/lox;Slc17a6+/Cre)mice(ml:±0.35,ap: 3.4,dv: 4.4mmrelativetoBregma)at100 nl.min-1 (WPIUltraMicroPump)usingcustommade30-gaugestainlesssteel(PlasticsOne,VA)injectors.ForCRISPR/Cas9experimentsVGLUT2:CremicewereinjectedbilaterallywitheitherAAV1-FLEX-SaCas9-U6-sgTh oracontrolvectortargetinghuman Th at aregionoflowcomplementarityAAV1-FLEX-SaCas9-U6-sgTh(human)(sgCTRL)(Hunkeretal.,2020).Cas9vectorsweremixed2:1 withAAV1-EF1a-DIO-ChR2(H134R):mCherryandatotalof300nLinjectedperside.Fortheelectrophysiologyrecordingsfrom definedD1orD2typeneurons, Drd1+/cre;Slc17a6+/Cre or Adora2a-Cre;Slc17a6+/Cre micewereinfusedwith2differentAAVsunilaterally:firstwithAAV5-EF1a-DIO-mCherryinthemedialNAcshell(ml: 0.5,ap:+1.1,dv: 4.5)plusAAV5-EF1a-DIO-hChR2(H134R)EYFPinVTA(ml: 0.35,ap: 3.4,dv: 4.4).Foreachinfusion,theinjectiontipwasleftinplacefor10minandthenslowlyretracted. Miceusedinbehavioralexperiments,werealsoimplantedwitha200-mm-coreopticfiber(NewdoonInc.)insertedeitherunilaterallyin VTA(ml:±0.5,ap: 3.4,dv: 4.0)orbilaterallyinNAcfollowinga10 mediolateralangle(ml:±1.13,ap:+1.4,dv: 3.81)following viralinfusion.Fiberswerestabilizedusingdentalcement(Langdental)securedbyatleasttwoskullscrews.Animalsweretreatedwith theanalgesicCarprofen(Pfizer,5mg.kg-1 s.c.)beforeandaftersurgery.Miceweremonitoreddailyandallowedtorecoverfromsurgeryfor>3weeksbeforesubsequentassay.
Immunohistochemistry
Miceweredeeplyanaesthetizedwithpentobarbital(200mg.kg-1 i.p.;Virbac)andtranscardiallyperfusedwith10–20mLofphosphate-bufferedsaline(PBS)followedby60-70mLof4%paraformaldehyde(PFA)atarateof6ml.min-1.Brainswereextracted, post-fixedin4%PFAat4 Covernightandcryoprotectedin30%sucroseinPBSfor48–72hat4 C.Brainsweresnapfrozeninchilled isopentaneandstoredat 80 C.Sections(30 mm)werecutusingacryostat(CM3050S,Leica)andcollectedinPBScontaining 0.01%sodiumazide.Forimmunostaining,brainsectionswereblockedwith5%normaldonkeyseruminPBScontaining0.2%Triton X-100(block)for1hatroomtemperature.Sectionswerethenincubatedwithoneormoreofthefollowingprimaryantibodies(rabbit anti-TH,1:2,000,MilliporeAB152;sheepanti-TH,1:1,000,Pel-FreezP60101-0;rabbitanti-DsRed,1:2000,Clontech632496;ratantiDAT1:1000,MilliporeMAB369;mouseanti-TH1:1000,MilliporeMAB318;rabbitanti-HA,1:1000,H6908,Sigma-SaCas9hasa hemagglutinin(HA)-epitopetagontheCterminus)inblockingbufferovernightat4 C.Sectionswererinsed3x15minwithPBS andincubatedinappropriatesecondaryantibodies(JacksonImmunoResearch)conjugatedtoAlexa488,Alexa594orAlexa647 fluorescentdyes(5 mg.ml-1)for2hatroomtemperature.Sectionswerewashed3x15minwithPBS,mountedontoglassslides andcoverslippedwithFluoromount-Gmountingmedium(SouthernBiotech)+DAPI(Roche,0.5 mg.ml-1).
Imageswereacquiredusingwidefieldepifluorescence(ZeissAxioObserver).ForthecolocalizationofTHwithmCherry,imagesof VTAwereacquiredusinga20Xobjectivewithidenticalacquisitionsettingsacrossslides.Forfluorescencedensitometry,imagesof theventralanddorsalstriatumwereacquiredandfourtosixstriatalsectionswereanalyzedperanimal.Briefly,regionsofinterestin thestriatumweredelineatedandpixeldensitieswerequantifiedusingImageJ.Backgroundstainingwasquantifiedbymeasurement ofpixelintensitiesinthecorpuscallosumandsubtractedfromstriatalregionsfornormalization.Forcellcounting,sectionscovering therostrocaudalextentoftheVTAwerecollectedandstainedforTHandmCherry(Figure1D)orHA(tovisualizeSaCas9)andTH (Figure4B).ThreetofoursectionscoveringtheVTAwerecountedperanimalbyanexperimenterblindtothetreatment.Fordensitometryquantification,fourstriatalsectionsperanimalwereanalyzedusingImageJ.Regionsofinterestinthedorsalandventral striatumweredelineatedandpixeldensitieswerequantifiedusingImageJ.Backgroundstainingwasquantifiedbymeasurement ofpixeldensityinthedorsomedialcortexandsubtractedfromstriatalregionsfornormalization.
Pleasecitethisarticleinpressas:Zelletal.,VTAGlutamateNeuronActivityDrivesPositiveReinforcementAbsentDopamineCo-release,Neuron (2020),https://doi.org/10.1016/j.neuron.2020.06.011
Insitu hybridizationfollowedbyimmunohistochemistry
Micewereanesthetizedwithpentobarbital(200mg.kg-1,i.p.)andtranscardiallyperfusedwith4%PFA.Brainswereremoved,postfixedin4%PFAovernight,andcryoprotectedin30%sucroseinPBSfor48-72h.Brainswerecutserially(16 mm)onacryostat (CM3050S,Leica)andmounteddirectlyontoSuperfrostglassslides(Fisher).Sectionswerestoredat–80 CbeforestartingtheRNAscopeassay(AdvancedCellDiagnostics).Briefly,slideswerebakedat60 Cfor30min,rehydratedinPBSfollowedbyboilingin TargetRetrievalSolution(ACD)for5min.Slideswerewashedtwiceindistilledwaterandoncein100%ethanolbeforeincubation withproteaseIII(ACD)at40 Cfor30min.RNAhybridizationwasperformedaccordingtotheFluorescentMultiplexKit(ACD)using anantisenseprobeagainst Slc17a6/VGLUT2(ACD319171-C1).Afterthelastwashstep,slideswererinsedtwotimesinPBS, blockedin5%normaldonkeyserum/0.2%TritonX-100inPBSfor1hatroomtemperatureandincubatedwithprimaryantibodies (rabbitAnti-TH1:500;AB152,Chemicon;rat-Anti-DAT1:500;MAB369,Chemicon)overnightat4 Cinblockingbuffer.Nextday, slideswerewashedthreetimesinPBSfor15minandincubatedwithsecondaryantibodies(1:400;AlexaFluor488and647;Jackson ImmunoReseach)fortwohoursatroomtemperature.Finally,slideswerewashedthreetimesinPBSfor15minandcoverslipped usingDAPI-containingFluoromount-G.Imagesweretakenat20xmagnificationusingaZeissAxioObserverEpifluorescencemicroscope.Forcellcountingquantification,sectionscoveringtherostrocaudalextentoftheVTAwerecollectedandstainedforTH,DAT andVGLUT2.ForRNAscopequantificationofVGLUT2-positiveneurons,cellsweredeemedpositiveaboveathresholdof4puncta. 3-4sectionscoveringtheVTAwerecountedperanimalbyanexperimenterblindtothetreatment.
Electrophysiologicalrecordingsfromadultbrainslices
Adultmice(7–12wks)weredeeplyanaesthetizedwithpentobarbital(100mg.kg-1 i.p.;Virbac)andtranscardiallyperfusedwith10mL ice-coldsucrose-artificialcerebrospinalfluid(ACSF)containing(inmM):75sucrose,87NaCl,2.5KCl,7MgCl2,0.5CaCl2,1.25 NaH2PO4,25NaHCO3 andcontinuouslybubbledwithcarbogen(95%O2–5%CO2).Brainswereextracted,and200-mmcoronal sliceswerecutinsucrose-ACSFusingaLeicaVibratome(vt1200).Slicesweretransferredtoaperfusionchambercontaining ACSFat31 C(inmM):126NaCl,2.5KCl,1.2MgCl2,2.4CaCl2,1.4NaH2PO4,25NaHCO3,11glucose,continuouslybubbledincarbogen.After>45minrecovery,slicesweretransferredtoarecordingchambercontinuouslyperfusedwithACSF(2–3ml.min-1)maintainedat29–31 Cusinganin-lineheater.Patchpipettes(3.5–5.5MU)werepulledfromborosilicateglass(KingPrecisionGlass)and filledwithinternalrecordingsolutioncontaining(inmM):120CsCH3SO3,20HEPES,0.4EGTA,2.8NaCl,5TEA,2.5Mg-ATP,0.25 Na-GTP,atpH7.25and285±5mOsm.mCherry-labeledVGLUT2VTAterminalsaswellasD1R-andA2a-expressingNAcneurons werevisualizedbyepifluorescenceandvisuallyguidedpatchrecordingsweremadeusinginfrared-differentialinterferencecontrast (IR-DIC)illumination(AxiocamMRm,Examiner.A1,Zeiss).ChR2wasactivatedbyflashingbluelight(5-ms)throughthelightpathof themicroscopeusingalight-emittingdiode(UHP-LED460,Prizmatix)undercomputercontrol.Excitatorypostsynapticcurrents (EPSCs)wererecordedinwhole-cellvoltageclamp(Multiclamp700Bamplifier,AxonInstruments),filteredat2KHz,digitizedat 10KHz(AxonDigidata1550,AxonInstruments),andcollectedonlineusingpClamp10software(MolecularDevice).Seriesresistance andcapacitancewereelectronicallycompensatedbeforerecordings.Estimatedliquid-junctionpotentialwas12mVandleftuncorrected.Seriesresistanceand/orleakcurrentweremonitoredduringrecordingsandcellsthatshowed>25%changeduringrecordingswereconsideredunstableanddiscarded.Neuronswereheldinvoltage-clampat 60mVtorecordAMPAREPSCsinwhole-cell configurationandsingle-pulse(5-ms)photostimuliwereappliedevery55sand10photo-evokedcurrentswereaveragedperneuron percondition.DMSOstocksolutionofDNQX(10mM,Sigma)wasdiluted1,000-foldinACSFandbathappliedat10 mM.Current sizeswerecalculatedbyusingpeakamplitudefrombaseline.Decaytimeconstants(t)werecalculatedbyfittinganexponentialfunctiontoeachaveragedcurrenttraceusingthefollowingformula:f(t)=e-t/t+C.
Fast-scancyclicvoltammetryrecordings
InvivoFSCV
VGLUT2-Cre-expressingcontrolandcKOmicewerepreparedasdescribedabovewithCre-dependentChR2:mCherryvirusinfusion andopticfiberimplantationtargetingtheVTAunilaterally.Following>6weeksrecovery,micewereanesthetizedwithisoflurane (inducedat3%,maintainedat0.5%–1.5%throughoutrecordings)andplacedinastereotaxicframe(Kopf).AAg/AgClreference electrodewasimplantedinthecontralateralhemisphere,andacarbon-fibermicroelectrode(Clarketal.,2010)wasloweredinto themedialNAcshell(ml:±0.4,ap:1.34,dv: 3.55mm).APC-basedsystemrunningTarheelCVsoftwarewritteninLabView(National Instruments)wasusedforvoltammetricwaveformapplicationanddataacquisition.Thepotentialatthecarbon-fiberelectrodewas heldat 0.4VversustheAg/AgClreference,rampedto+1.3Vandbackto 0.4Vat400V.s-1.Thisvoltammetricwaveforminitially wasappliedat60Hzfor 15minandthenat10Hzforthedurationoftherecording.OptogeneticstimulationwasdeliveredtotheVTA throughtheopticfibercoupledtoa473-nmlaser(LaserGlow).Stimulationtrains(1s,10mW,10mspulsewidth)atfrequenciesof5, 10,20,or50Hzweredeliveredevery2minininterleaved,ascendingorder,withfourrepetitionsofeachfrequency.Thisfullstimulationprotocolwasrepeatedat3-5recordingsitesperanimal200 mmapartinthedorsoventralaxis.Thismultisiteprocedure increasedchancesofappropriaterecordingsitewithinthemedialNAcshell,thenconfirmedusingposthochistology.Thelast recordingsitewasmarkedwithanelectrolyticlesion(70 mA,20s).Whenmultiplerecordingsiteswerelocatedwithinthemedialshell foragivenanimal,asinglesitewasincludedinthefinalgroupanalyses,basedonminimizednoisethroughoutthestimulationprotocol.Dopaminesignalwasisolatedfromthebackground-subtractedvoltammetricsignalusingchemometricanalysis(Heienetal., 2005)withcustomcodeforprinciplecomponentregression(Keithleyetal.,2009)writteninMATLAB(MathWorks).Trainingsetsfor ll
Neuron 107,1–10.e1–e4,September9,2020 e3
thisanalysisincludedstandardcyclicvoltammogramsofdopamineandpHchangesobtainedfromoptogeneticstimulationinDATcremiceexpressingChR2intheVTA,aswellaselectrode-specificbackgrounddriftfromthecurrentrecordings(Howardetal.,2017; KeithleyandWightman,2011).Dopamineconcentrationwasestimatedbasedonaveragepost-implantationelectrodesensitivity (Clarketal.,2010).NisslstainingwasusedtovisualizelesionsitescreatedfollowingFSCVmeasurements.Briefly,30 mmfrozenvibratomesectionsweremountedonslides,air-driedandplacedinto1:1ethanol/chloroformovernight.Slideswerethenrehydrated throughethanoldilutionstodistilledwater,stainedin0.1%cresylvioletsolutionfor10minutes.Slideswerethenrinsedwithwater anddifferentiatedin95%ethanolfor30minutesanddehydratedin100%ethanolfor2 3 5minutesbeforebeingclearedinxylene2 3 5minutesandcoverslipped.
InvitroFSCV
Forrecordingelectrodes,cylindricalcarbon-fiberelectrodeswerepreparedwith7 mmdiameterfibers( 100 mmofexposedfiber, GoodFellow)insertedintoaglasspipette(1.0mm,A-Msystems)andpulledtosealthepipettearoundthecarbon-fiber.Theelectrode washeldat 0.4VversusAg/AgClandatriangularvoltageramp( 0.4to+1.3at400V.s-1)wasdeliveredat10Hz.DAtransientswere evokedinthemedialNAcshellbyoptogeneticstimulations(473nm,1s,5mspulse-width)atvariousfrequencies(5-50Hz)through thelightpathofthemicroscope.DatawerecollectedandanalyzedusingTarheelCVsoftware.TheamplitudeofDAtransientswas measuredfromtheoxidationpeakregionand3responseswereaveraged.ForpositivecontrolrecoveryexperimentsDAwaspreparedfreshdailyandbath-appliedat10 mMfor10minfollowedbybathapplicationofACSF(10min,wash)priortorepeatedDA measurementatthesamerecordingsite.
Behavioralstudies
Behavioralpharmacology
Horizontallocomotoractivitywasmeasuredinsquareplasticchambers(17 3 8.9cm)usinganautomatedvideotrackingsystem (ANY-maze,StoeltingCo.).Thefollowingdrugs(allSigma-Aldrichunlessindicated)wereinjected:50mg.kg-1 L-DOPAand 12.5mg.kg-1 benserazide(i.p.)in0.25%(wt/vol)ascorbateinPBS,d-amphetaminehemisulfate(5mg.kg-1,i.p.)insaline, SKF81297(0.2mg.kg-1,i.p.;Tocris#1447)insaline.Alldrugswereinjectedat10ml.kg-1 exceptforL-DOPA/benserazide,which wasinjectedat33ml.kg-1
2-nosepokeself-stimulation
Micewereplacedonarestrictedfeedingschedule:foodrestrictionconsistedofremovingfoodtheeveningbeforethefirstdayand ad libitum accesswasthenrestrictedtoa3-hdailyperiodfollowingtheassay.Atthebeginningofthesession,ferruleswereconnected toa50-mmopticalpatchcableconnectedtoanopticalcommutator(DoricLenses)andmicewereplacedinoperantchambers(Med Associates)controlledbyMedPCIVsoftware.Thestartofthesessionwassignaledbyabrieftone(2kHz,1s),illuminationofoverheadhouselight,andLEDcuelightsoverthenosepokeholes;sessionslasted45min.Thechambercontainedtwophotobeamequippednosepokeholeswhichwereeachbaitedatthestartofeachsessionwithasucrosepellet(Bio-Serv,F0071).Beam-breaks ontheactivenosepokeledtoa0.5stone,theLEDcuelightsoverthenosepokesturnedoffforthedurationofthephotostimulus,and theactivationofaTTL-controlledDPSSlaser(473nm,ShanghaiorOEMlaser)settodeliverpulsesat10mW(80mW.mm-2 at200-m fibertip)at40Hz(1s,10-mspulsewidth)controlledbyanArduinostimulusgenerator.Laserpowerwasmeasuredusingadigital powermeter(ThorlabsPM100D/S121C).Nosepokesthatoccurredduringongoingphotostimulationwererecordedbutwerewithout effect;inactivenosepokesledtoidenticaltoneandcuelighteffectsbutdidnottriggerthelaser. Real-timeplacepreference
Onabaseline(pre-test)day,micewereplacedontheborderbetweentwoadjoining(20 3 20cm)homogeneousgraycompartments andtheamountoftimespentineachcompartmentwasrecordedusingvideotrackingsoftware(ANY-maze).Onthesubsequentday, onesidewasdesignatedactive,whereentriestriggeredphotostimulation(473nm,10mW,40Hz,10-mspulsewidth)usingthelasers asdescribedabovebutcontrolledbyanANY-mazeinterface(SanDiegoInstruments).Sessionslastedfor30minandtheamountof timespentineachcompartmentandthenumberofcrossingswasrecorded.
QUANTIFICATIONANDSTATISTICALANALYSIS
Toevaluatestatisticalsignificance,datafrom Figures1B,1D, 4B, S1B,S1D, S2A–S2C, S3B,S3D,S3F,andS3Hweresubjectedto Student’sttests(KyPlot).Datafrom Figures1F, 1G, 2B,2C,2E,2F, 3B,3C,3E,3F, 4D–4G, S2A–S2C, S3C,andS3Gweresubjected toRMone-ortwo-wayANOVAsfollowedbySidakorTukeyposthocanalysis(GraphPadPrismv6).Friedmannonparametrictest wasusedfornon-Gaussian-assumeddatafrom Figure1I.Inallthefiguresdataarepresentedasmeans±SEMunlessnotedand statisticalsignificancewassetatp<0.05.
Other documents randomly have different content
suorittavat ne, jotka liikkuvat lukemattomilla merillä, monissa eri ilmastoissa ja useiden vieraiden kansojen keskuudessa hankkiakseen sitä, mitä nimitetään onnen antimiksi; ne taas, joihin ryhdytään sekä Jumalan että maailman tähden, kuuluvat urhoollisille sotureille, jotka tuskin ehtivät huomata vihollisen varustuksissa pyöreän tykinkuulan kokoisen aukon, kun jo yhtään pelkäämättä, ollenkaan harkitsematta ja varomatta uhkaavaa vaaraa, halunsa siivittäminä pyrkivät taistelemaan uskonsa, isänmaansa ja kuninkaansa puolesta syöksyen pelkäämättä niihin tuhansiin kuolemanvaaroihin, jotka ovat heitä odottamassa. Semmoisiin tehtäviin yleensä käydään, ja niistä koituu kunniaa, mainetta ja hyötyä, vaikka niihin liittyy lukemattomia vastuksia ja vaaroja; mutta siitä, jonka sinä sanot mieliväsi aloittaa ja toteuttaa, ei sinulle koidu Jumalan kunniaa, ei onnen antimia eikä mainetta ihmisten keskuudessa; vaikka näet suoriudutkin siitä toiveesi mukaisesti, et kumminkaan tule tyytyväisemmäksi, et rikkaammaksi etkä kunnioitetummaksi kuin olet nyt; jos taas et suoriudu, joudut suurimpaan kurjuuteen, mitä ajatella saattaa, sillä silloin ei sinun auta ajatella, ettei kukaan tiedä sinua kohdanneesta onnettomuudesta, koska sinua riittävästi kiduttaa ja tuhoaa se, että itse sen tiedät. Tämän totuuden varmennukseksi luen sinulle tässä stanssin, jonka on sepittänyt kuuluisa runoilija Luigi Tansillo[13] sijoittaen sen Pyhän Pietarin kyynelten ensimmäiseen osaan. Se kuuluu näin:
Kun aamu koittaa, mieltä Pietarin jää häpeä ja tuska tuivertamaan; hän yksin on, mut häpee kuitenkin, käy synnintunto sydänjuuriin hamaan: näät ilmitulo synnintuskihin jaloa miest' ei yksin murra lamaan — hän lankeemustaan häpee vaikertain, vaikk' ois sen nähneet maa ja taivas vain.
Sinä et siis voi tuskaasi välttää, vaikka sen salaat; päinvastoin: joudut itkemään lakkaamatta, ja elleivät silmäsi kostukaan, vuodatat kumminkin sydämen verikyyneliä, niinkuin niitä vuodatti se yksinkertainen tohtori, jonka runoilijamme kertoo tehneen maljakokeen,[14] minkä tekemisestä Rinaldo, paremmin asiaa harkiten, pidättyi; vaikka näet tuo onkin runoilijan keksimää, sisältyy siihen kumminkin salattua opettavaa tarkoitusta, joka kannattaa ottaa huomioon, ymmärtää ja omaksua toimintansa ohjeeksi. Sitä suuremmalla syyllä, kun sinä tulet siitä, mitä nyt aion sinulle sanoa, täysin tajuamaan, kuinka väärin mielit menetellä. Sanohan minulle, Anselmo: jos taivas tai onnellinen sattuma olisi tehnyt sinusta erinomaisen hienon timantin haltian ja laillisen omistajan ja kaikki jalokivisepät, joille sitä näyttäisit, olisivat vakuutettuja sen oivallisuudesta ja aitoudesta sekä kaikin yhteen ääneen ja yksimielisesti selittäisivät sen arvoltaan, oivallisuudeltaan ja puhtaudeltaan niin hyväksi kuin semmoinen kalleus konsanaan voi olla, ja sinä itse uskoisit samoin, tietämättä mitään, mikä saattaisi vakaumustasi horjuttaa, niin olisiko oikein, jos sinun tekisi mieli ottaa se timantti, asettaa se vasaran ja alasimen vähin ja vain huimasti iskemällä koetella, onko se niin luja ja hieno kuin väitetään? Entä sitten, jos aikeesi toteuttaisit: eihän jalokivi, jos se kestäisikin sellaisen mielettömän kokeen, siitä tulisi arvokkaammaksi eikä kuuluisammaksi, ja jos se murskautuisi, kuten saattaisi tapahtua, eikö se silloin olisi auttamattomasti hukassa? Epäilemättä, ja sen omistaja joutuisi sellaiseen maineeseen, että kaikki pitäisivät häntä houkkiona. Ajattelehan nyt, parahin Anselmo, että Camila on hienonhieno timantti, sekä omasta mielestäsi että toisten arvioinnin mukaan, ja ettei ole järjellistä saattaa sitä murskautumisen vaaraan; jos näet se säilyykin eheänä, ei se kumminkaan voi tulla entistä arvokkaammaksi, ja jos se olisi liian heikko eikä kykenisi koetta
kestämään, niin arvaathan jo ennakolta, miten sinun kävisi, kun sen menettäisit, ja kuinka aiheellisesti voisit syyttää itseäsi, koska olisit vikapää sen ja oman itsesi tuhoutumiseen. Ota huomioon, ettei maailmassa ole siveän ja kunniallisen naisen arvoista kalleutta ja että naisten kunniana on yksinomaan heidän nauttimansa hyvä maine; ja, koska puolisosi maine, kuten itse tiedät, on täysin moitteeton, miksi tahdot saattaa tämän varmuuden epäilyksenalaiseksi? Muista, ystäväni, että nainen on epätäydellinen olento ja ettei hänen tielleen pidä asettaa loukkauskiviä, joihin hän kompastuu ja kaatuu, vaan on niitä raivattava pois ja puhdistettava hänen polkunsa kaikista esteistä, jotta hän voi vaivattomasti ja kevyin askelin rientää saavuttamaan kaipaamaansa täydellisyyttä, joka on siinä, että hän säilyy siveänä. Luonnontutkijat kertovat, että kärppä on pieni eläin, jolla on lumivalkea turkki, ja että metsästäjät sitä pyydystäessään käyttävät seuraavaa temppua: tuntien eläimen kulku- ja oleskelupaikat he sulkevat ne kasaamalla niihin lokaa ja säikyttävät sen sitten kulkemaan sinnepäin, ja kärppä, saavuttuaan lokaiseen paikkaan, pysähtyy ja antautuu saaliiksi, koska ei tahdo astua liejuun ja tahria ja tärvellä valkoista turkkiansa, jota pitää vapauttaan ja henkeään kalliimpana. Kunniallinen ja siveä vaimo on kärpän kaltainen, ja kunniallisuuden hyve on valkeampi ja puhtaampi kuin vitilumi; ja sen, joka ei tahdo nähdä naisen sitä menettävän, vaan haluaa sen säilyvän ja säästyvän, tulee menetellä toisin kuin kärppää pyydystettäessä, sillä hänen eteensä ei pidä asettaa tungettelevien rakastajien imartelun lokaa, koska hänessä kentiesi, ja varmaankaan, ei ole sellaista synnynnäistä kuntoa ja voimaa, että hän kykenisi omin neuvoin raivaamaan tieltään ja voittamaan mainitut esteet; niinmuodoin onkin välttämätöntä poistaa ne ja asettaa hänen näkyviinsä hyveen puhtaus ja hyvään maineeseen sisältyvä kauneus. Hyvä vaimo on myös kuin kirkas ja hohteleva kristallikuvastin; sen
saattaa huurtaa ja himmentää mikä hyvänsä siihen sattuva henkäys.
Kunniallista naista tulee kohdella niinkuin pyhäinjäännöksiä: palvoa, mutta ei koskettaa. Hyvää vaimoa tulee vaalia ja arvostaa niinkuin vaalitaan ja arvostetaan kaunista puutarhaa, joka on täynnä kukkia ja ruusuja ja jonka omistaja ei salli kenenkään siellä käyskelevän tai kukkiin kajoavan: he saavat tyytyä loitolta ja rautaristikon takaa nauttimaan niiden tuoksusta ja kauneudesta. Tahdon vielä lopuksi lausua sinulle muutamia mieleeni muistuneita säkeitä, jotka kuulin erästä uutta huvinäytelmää esitettäessä ja jotka mielestäni sopivat tässä käsittelemäämme asiaan. Eräs viisas vanhus neuvoo toista, jolla on tytär, pitämään tyttöä tarkan valvonnan alaisena, vartioimaan ja sulkemaan suojiinsa, ja esittää muiden syiden ohella tämänkin:
Lasia on nainen, mutta paha sulta järjen vei, jos et usko kokeilutta, särkyykö se vaiko ei.
Helposti sen rikki saa, siks' en järkees saata luottaa, jos noin aiot paloittaa, mit' et ehjäks taida juottaa.
Syystä kyllä sitä mieltä ovat kaikki, että jos Danacit'[17] on, silloinkos kultaa sataa taivaantieltä.
Kaikki, mitä olen toistaiseksi sanonut sinulle, Anselmo, on koskenut yksinomaan sinua, ja nyt on hyvä kuulla jotakin myös siitä, mikä liikuttaa minua; jos olen laajasanainen, suo anteeksi, sillä kaikki on tarpeen sen surmansokkelon vuoksi, johon olet eksynyt ja josta pyrit minun avullani pelastumaan. Sinä pidät minua ystävänäsi ja tahdot riistää minulta kunnian, mikä sotii kaikkea ystävyyttä vastaan, ja mielitpä vielä saada aikaan senkin, että minä riistän sinun
kunniasi. On selvää, että tahdot riistää minulta kunnian, sillä Camilan, kun hän huomaa, että häntä liehittelen, kuten vaadit, täytyy varmaan pitää minua kunniattomana ja halpamaisena miehenä, koska minä suunnittelen ja teen sellaista, mikä on niin kaukana kaikesta, niihin minua velvoittaa oma olemukseni ja sinun ystävyytesi. Aivan varmaa on, että tahdot riistää kunnian itseltäsi, sillä havaitessaan minun liehittelevän itseään Camila johtuu välttämättä ajattelemaan, että minä olen huomannut hänessä jonkinlaista kevytmielisyyttä ja sen rohkaisemana ilmaissut pahan himoni, ja koska hän niinmuodoin pitää itseään solvattuna, tulee solvaus koskemaan sinuakin, jonka oma hän on. Ja tästä johtuu yleinen käytäntö: että uskottoman vaimon miestä, vaikka hän ei tietäisikään eikä olisi antanut aihetta siihen, ettei hänen vaimonsa ole sellainen kuin hänen tulisi olla, ja vaikka vaimoa kohdanneen onnettomuuden ehkäiseminen ei olisi ollut hänen vallassaan eikä syyksi voitaisi katsoa hänen huolimattomuuttaan tai puutteellista varovaisuuttaan, kaikesta tuosta huolimatta mainitaan herjaavalla ja alhaisella nimellä ja että ne, jotka tietävät hänen vaimonsa kehnouden, katselevat häntä halveksuvin eikä säälivin silmin, kuten heidän pitäisi, koska näkevät, ettei hän ole joutunut tähän onnettomuuteen omasta syystään, vaan kehnon aviopuolisonsa himon vuoksi. Mutta mielinpä ilmaista sinulle, miksi huonon vaimon mies syystäkin saa häpeän kantaakseen, vaikka ei tiedäkään vaimon kehnoutta, ei ole siihen syypää eikä ole suonut hänelle aihetta eikä tilaisuutta. Älä väsy kuuntelemaan minua, sillä tuleehan tämän kaiken koitua sinun eduksesi. Pyhä Raamattu kertoo, että Jumala, luotuaan naisessa paratiisissa ensimmäisen isämme Aatamin, vaivutti hänet uneen ja hänen nukkuessaan otti hänen vasemmasta kyljestään luun, josta teki äitimme Eevan. Herättyään ja hänet nähtyään Aatami sanoi: »Tämä on liha minun lihastani ja luu minun
luustani». Ja Jumala sanoi: »Sentähden on miehen luopuminen isästänsä ja äidistänsä ja liittyminen vaimoonsa, ja he tulevat yhdeksi lihaksi.» Silloin perustettiin avioliiton pyhä sakramentti sellaisin sitein, että yksin kuolema voi ne purkaa. Ja tässä ihmeellisessä sakramentissa on sellainen voima ja vaikutus, että se tekee kaksi eri henkilöä yhdeksi lihaksi, ja moitteettomissa aviopuolisoissa sen vaikutus on vielä syvällisempi: vaikka näet heissä on kaksi sielua, on heillä kumminkin vain yksi ainoa tahto. Ja koska vaimon ja miehen liha on yhtä, johtuu siitä, että ne tahrat, joita vaimoon ilmaantuu, tai ne hairahdukset, joihin hän tekee itsensä vikapääksi, koituvat miehen lihan vahingoksi, vaikka hän, kuten sanottu, ei olisikaan antanut aihetta siihen onnettomuuteen. Jalan tai minkä tahansa ihmisruumiin muun jäsenen kipu tuntuu koko ruumiissa, koska se on kokonaisuudessaan samaa lihaa, joten pää tuntee kehräsluun kokeman vaurion, vaikka ei ole siihen syynä, ja samalla tavalla mies osallistuu vaimon häpeään, koska he molemmat ovat yhtä. Ja koska kaikki kunnia ja kunniattomuus tässä maailmassa riippuu ja syntyy lihasta ja verestä ja kehnon vaimon kunniattomuus on tätä lajia, täytyy miehen välttämättä saada siitä osansa ja joutua kunniattoman maineeseen, vaikka hän ei siitä mitään tietäisikään.
Harkitse siis, Anselmo, millaiseen vaaraan syöksyt tahtoessasi häiritä rauhaa, jossa hyvä puolisosi elää, ajattele, millaisen joutavan ja mielettömän uteliaisuuden vuoksi mielit kiihoittaa viettejä, jotka nyt uinuvat siveän puolisosi povessa; ota huomioon, että se, mitä saatat toivoa voittavasi, on vähäpätöistä, mutta se, mitä varmaan menetät, niin ylen tärkeätä, että jätän sen lähemmin selvittelemättä, koska minulta puuttuu sanoja sen riittävään tehostamiseen. Ellei kaikki, mitä olen sanonut, kumminkaan riitä estämään sinua ryhtymästä pahaan aikomukseesi, saat etsiä toisen välineen häpeääsi ja onnettomuuttasi varten, sillä minä en aio siihen suostua, vaikka
senvuoksi menettäisin ystävyytesi, mikä olisi suurin kaikista onnettomuuksista, joita kuvitella voin.
Tuon sanottuaan hyvä ja viisas Lotario vaikeni, ja Anselmo oli niin hämillään ja mietteissään, ettei kyennyt pitkään aikaan virkkamaan sanaakaan. Vihdoin hän kumminkin sanoi:
— Näithän, parahin Lotario, kuinka tarkkaavasti sinua kuuntelin, ja minä huomasin sinun sanoistasi, esimerkeistäsi ja vertauksistasi, kuinka älykäs olet ja kuinka erinomainen ja aito on sinun ystävyytesi. Käsitän ja tunnustan myös, että kieltäytyessäni noudattamasta sinun neuvoasi ja seuratessani omaa ajatustani pakenen hyvää ja tavoittelen pahaa. Sen myönnän, mutta sinun tulee ottaa huomioon, että minä olen nyt potemassa samaa sairautta kuin toisinaan naiset, joiden tekee mieli syödä multaa, kipsiä, hiiltä ja muita vielä pahempia aineita, jotka ovat tympäiseviä nähdä ja sitäkin mahdottomampia syödä. On siis välttämätöntä käyttää parantamisekseni jotakin temppua, ja niin voidaan helposti tehdä, kunhan sinä alat, vaikkapa vain laimeasti ja näennäisesti, mielistellä Camilaa, joka ei suinkaan liene niin hauras, että hänen siveytensä luhistuu ensimmäisistä iskuista. Minä tyydyn sellaiseen aloitteeseen, ja sinä tulet siten täyttäneeksi, mitä olet ystävyydellemme velkaa, koska et ainoastaan lahjoita minulle elämää, vaan annat vielä vakuuden, että kunniani säilyy. Ja sinä olet velvollinen sen tekemään yhdestä ainoasta syystä, nimittäin siksi, ettet nyt, kun olen tosiaan päättänyt suorittaa tämän kokeen, saa sallia minun ilmaisevan mieletöntä aiettani kenellekään muulle, koska siten menetellen panisin vaaralle alttiiksi kunniani, jota sinä yrität varjella; ja vaikka sinun kunniallisuutesi ei olekaan Camilan mielestä niin taattu kuin sen olla pitäisi, sinun häntä liehiessäsi, ei siitä koidu paljon, eipä mitäänkään haittaa, koska voit aivan pian, havaittuasi hänet niin
lujaksi kuin edellytämme, sanoa hänelle selvän totuuden juonestamme, joten pääset entiseen arvoosi. Ja koska vaarannat niin vähän, mutta voit samalla tuottaa minulle niin suuren tyydytyksen, pyydän sinua siihen suostumaan, vaikka näkisit siinä enemmänkin vaikeuksia, sillä minä, kuten jo sanoin, katson asian päätökseen saatetuksi, kunhan vain sen aloitat.
Lotario, joka havaitsi Anselmon pysyvän järkkymättä päätöksessään eikä osannut mainita enempiä esimerkkejä tai esittää lisää syitä saadakseen hänet aikeesta luopumaan ja nyt vielä kuuli hänen uhkaavan ilmaista pahan suunnitelmansa jollekin toiselle, päätti suurempaa onnettomuutta torjuakseen myöntyä ja tehdä, mitä hän pyysi, mutta vakavasti aikoen menetellä niin, että Anselmo tulisi tyydytetyksi Camilan mielenrauhan joutumatta järkytetyksi. Hän siis kehoitti Anselmoa olemaan mainitsematta aikeestaan kenellekään toiselle, lupasi ottaa tehtävän suorittaakseen ja aloittaa sen, milloin Anselmo hyväksi näkisi. Anselmo syleili häntä hellästi ja rakkaasti lausuen hänelle kiitokset hänen suostumuksestaan, ikäänkuin toinen olisi tehnyt hänelle jonkin erinomaisen palveluksen, ja he sopivat keskenään, että juoneen käytäisiin jo seuraavana päivänä. Anselmo lupasi hankkia Lotariolle aikaa ja tilaisuutta Camilan puhuttelemiseen kahden kesken sekä toimittaa hänelle rahoja ja koruja Camilalle annettaviksi ja tarjottaviksi. Hän neuvoi vielä Lotarioa pitämään hänelle serenadeja sekä sepittämään säkeitä hänen ylistyksekseen luvaten kirjoittaa ne itse, ellei Lotario mielinyt sitä vaivaa nähdä. Lotario selitti suostuvansa kaikkeen, vaikka hänen tarkoituksensa oli toisenlainen kuin Anselmo saattoi arvata, ja tämän sopimuksen solmittuaan he palasivat Anselmon kotiin, missä havaitsivat miestään odottaneen Camilan olevan levottomana ja huolestuneena, koska Anselmo oli sillä kertaa viipynyt poissa tavallista kauemmin.
Lotarion lähdettyä omaan asuntoonsa Anselmo jäi kotiin varsin tyytyväisenä; Lotario sitävastoin painui sangen syviin mietteisiin, koska ei tietänyt, mitä keinoa pitäisi onnellisesti suoriutuakseen tuosta arveluttavasta toimesta. Mutta samana yönä hän jo keksi keinon, miten pettäisi Anselmon loukkaamatta Camilaa, ja meni seuraavana päivänä päivälliselle ystävänsä luo. Camila tervehti häntä ystävällisesti ja kohteli kaikin puolin erittäin suopeasti, koska tiesi, kuinka miehensä oli häneen kiintynyt. Kun ateria oli päättynyt ja pöytäkalusto korjattu pois, Anselmo pyysi Lotarioa jäämään Camilan luo, hänen lähtiessään toimittamaan erästä välttämätöntä asiaa luvaten palata puolentoista tunnin kuluessa. Camila pyysi Anselmoa jäämään, ja Lotario tarjoutui lähtemään hänen kanssaan, mutta Anselmo ei suostunut mihinkään, pyysi vain pyytämällä, että Lotario jäisi häntä odottamaan, koska halusi myöhemmin keskustella hänen kanssaan eräästä erittäin tärkeästä seikasta. Hän kehoitti vielä Camilaa olemaan Lotarion seurassa, kunnes hän tulisi takaisin. Hän osasikin kuvailla, kuinka välttämätön hänen joutava poistumisensa oli, niin kekseliäästi, ettei kukaan olisi voinut havaita sitä teeskentelyksi. Anselmo lähti, ja Camila ja Lotario jäivät pöydän ääreen kahden kesken; kaikki talon palvelijat näet olivat menneet aterialle. Lotario näki nyt olevansa sillä taistelutanterella, jota hänen ystävänsä toivoi, edessään vihollinen, joka olisi voinut pelkällä kauneudellaan voittaa eskadroonan asestettuja ritareita, joten Lotariolla epäilemättä oli täysi syy häntä pelätä. Hän ei kumminkaan ryhtynyt mihinkään toimenpiteisiin, nojasihan vain kyynärpäänsä pöytään ja poskensa kämmenpohjaansa sekä pyysi Camilalta anteeksi epäkohteliaisuuttaan sanoen mielivänsä hiukan levätä, kunnes Anselmo ehtisi takaisin. Camila vastasi, että hän voisi levätä salin tyynyillä paremmin kuin tuolissa ja kehoitti siis häntä menemään sinne nukkumaan. Lotario ei kumminkaan huolinut
lähteä, vaan istui paikallaan unenhorroksissa, kunnes Anselmo palasi. Anselmo, joka oli viipynyt sangen kauan, näki Camilan olevan huoneessaan ja Lotarion uneen vaipuneena, otaksui heillä niinmuodoin olleen aikaa sekä keskustelemiseen että nukkumiseenkin eikä olisi mielellään malttanut odottaa Lotarion heräämistä, koska tahtoi päästä lähtemään hänen kanssaan ulos tiedustellakseen häneltä, kuinka yritys oli luonnistunut. Kaikki kävi hänen toivomustensa mukaan: Lotario heräsi, he lähtivät kohta talosta, Anselmo kysyi, mitä tietää halusi, ja Lotario vastasi, ettei ollut katsonut hyväksi ilmaista itseään täydellisesti ja että hän senvuoksi oli vain ylistänyt Camilaa kauniiksi, sanoen hänelle, ettei koko kaupungissa puhuttu muusta kuin hänen kauneudestaan ja älystään. Hän sanoi pitäneensä tuota hyvänä alkuna Camilan suosion voittamiseen ja hänen taivuttamiseen kuuntelemaan toiste mielellään; ja tässä menettelyssään Lotario oli käyttänyt samaa juonta kuin paholainen käyttää tahtoessaan pauloa jonkun, joka on varuillaan voidakseen puolustautua: hän, pimeyden enkeli, muuttuu silloin valkeuden enkeliksi ja asettaa hänen nähtäväkseen kauniin silmänlumeen lopulta ilmaisten itsensä ja saavuttaen tarkoituksensa, ellei hänen petoksensa tule ilmi heti alussa. Anselmo oli erittäin tyytyväinen tuohon kaikkeen ja sanoi järjestävänsä Lotariolle joka päivä samanlaisen tilaisuuden, vaikka ei kotoa poistuisikaan; hän näet sanoi askartelevansa kotona sellaisissa toimissa, ettei Camila voisi huomata hänen juontansa.
Kului sitten useita päiviä, joina Lotario ei virkkanut sanaakaan Camilalle, mutta siitä huolimatta Anselmon kysyessä sanoi keskustelleensa hänen kanssaan kumminkaan saamatta häneltä pienintäkään merkkiä siitä, että hän suostuisi mihinkään pahaan tai antaisi toivon varjoakaan; Lotario sanoi hänen päinvastoin uhanneen