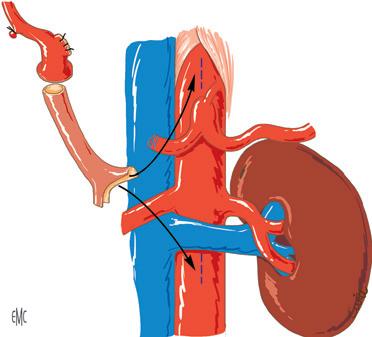Tecniche di trapianto di fegato negli adulti
H. Jeddou, S. Tzedakis, F. Robin, A. Merdrignac, P. Houssel, M. Rayar, V. Desfourneaux, D. Bergeat, M. Lakehal, L. Sulpice, K. Boudjema
Riassunto: Il 1◦ marzo 1963, Thomas Starzl tenta il primo trapianto di fegato a Denver, in Colorado. Operazione “dell’impossibile”, che si conclude “in tragedia” con un’emorragia incontrollabile. I fallimenti si susseguono e in realtà sono dovuti all’assenza di terapia immunosoppressiva. Questi fallimenti non scoraggeranno il chirurgo che, facendo affidamento su un programma pluriennale di sperimentazione animale, finisce per imporre il “suo” trapianto come l’unica cura efficace delle gravi malattie del fegato. È la ciclosporina che salva il trapianto di fegato e il suo promotore. I primi successi dell’innesto ortotopico cosiddetto “classico”, con circolazione extracorporea, daranno l’avvio a perfezionamenti tecnici e alla variazione della tecnica principale: innesto senza bypass, trapianto a partire da fegati ridotti, innesto per due a partire da un innesto condiviso in situ o ex vivo, innesto con emitrasposizione cavoportale, innesto ausiliario eterotopico e poi ortotopico e infine innesto a partire da un emifegato prelevato da un donatore vivente. Non ce n’è più uno solo, ma esistono numerosi trapianti di fegato.
© 2022 Elsevier Masson SAS. Tutti diritti riservati.
Parole chiave: Epatopatia; Insufficienza epatica; Innesto ortotopico; Innesto ausiliario; Donatore vivente; Innesto; Fegato nativo
■ Introduzione 1
■ Organizzazione generale del trapianto di fegato in Francia 1
■ Impostazioni generali 2
Fase I dedicata all’exeresi del fegato nativo 2 Fase II caratterizzata dall’assenza anatomica e funzionale del fegato 2
Fase III dedicata alla ricostruzione arteriosa e biliare 2
■ Trapianto ortotopico del fegato intero 3 Preparazione ex vivo dell’innesto 3
Trapianto standard: exeresi del fegato nativo con conservazione della vena cava inferiore, anastomosi portocavale temporanea e impianto dell’innesto a “piggyback” 4
Trapianto senza conservazione della vena cava inferiore retroepatica 12
Trapianto combinato e simultaneo del fegato e di un altro viscere 15
■ Trapianto ortotopico di un emifegato 16
Trapianto di emi-innesti prelevati da donatore cadavere 16
■ Trapianto ausiliario 19
Principi generali 19
Principi dell’impianto 20
Impianti ortotopici 20
■ Conclusioni 21
Introduzione
Applicato all’inizio come terapia di ultima istanza, il trapianto di fegato è diventato il trattamento più efficace per l’epatopatia cronica allo stadio terminale, per alcuni tumori primari e per le forme più gravi di insufficienza epatica acuta. Questa prestazione,
legata in primo luogo al progresso dell’immunosoppressione, alla qualità della conservazione dell’innesto nonché all’esecuzione dell’anestesia e della rianimazione perioperatoria, è anche il risultato di un costante miglioramento della tecnica chirurgica di impianto dell’innesto.
Nel suo lavoro Experience in hepatic transplantation [1] pubblicato nel 1969, Thomas Starzl, padre della metodica, descrisse i principi fondamentali che, ancora oggi, garantiscono il successo dell’operazione. Il miglioramento e la semplificazione dei mezzi di derivazione del sangue della vena cava inferiore durante l’impianto dell’innesto, la razionalizzazione dei processi di ricostruzione vascolare e biliare, lo sviluppo di tecniche di riduzione [2] o di bipartizione del trapianto di fegato per trapiantare i bambini [3] o gli adulti [4] e, più recentemente, l’utilizzo di innesti prelevati da donatori viventi [5, 6] sono venuti ad arricchire la tecnica di trapianto e ad ampliare il campo della sua applicazione. Sono successivamente affrontate qui le tecniche di trapianto epatico ortotopico (TEO) di un fegato intero e di un emifegato e di trapianto ausiliario. In quanto processo del tutto eccezionale in Francia, il trapianto di fegato da un donatore vivente è qui citato in un capitolo che tratta l’impianto dell’innesto e anche la sua rimozione, vera e propria sfida tecnica.
Organizzazione generale del trapianto di fegato in Francia
Esistono attualmente 16 centri di trapianto di fegato per gli adulti in Francia. Quando si considera un’indicazione per il trapianto di fegato [7] , i candidati al trapianto vengono inseriti in una lista d’attesa. La lista d’attesa per il trapianto di fegato è unica e nazionale. Qualsiasi paziente in attesa di un trapianto in Francia deve essere iscritto lì, e questo in un unico centro. Il livello di ciascun paziente nella lista dipende dalla gravità della sua malattia.
I
– 40-165-B Tecniche di trapianto di fegato negli adulti
Per poter classificare i pazienti, tale gravità viene quantificata da un punteggio chiamato “punteggio fegato”. Il punteggio fegato viene stabilito al momento dell’iscrizione e fissa il livello di attesa, poi viene riaggiustato almeno ogni 3 mesi.
Il punteggio fegato è calcolato a partire dal livello di gravità dell’insufficienza epatica, valutato attraverso il model for end stage liver disease (MELD) oppure, per i tumori o le malattie gravi senza insufficienza epatica, attraverso l’assegnazione regolamentata di punti. Più alto è il punteggio del fegato di un paziente, più breve è il tempo che lo separa dal trapianto. È possibile stimare con grande precisione il momento in cui il paziente verrà trapiantato. È l’Agence de la biomédecine (ABM) che organizza e regola l’attività del trapianto di fegato. Gestisce la lista d’attesa nazionale, definisce con esperti del settore le modalità di calcolo del “punteggio fegato” e riceve tutte le proposte di trapianto che distribuisce tra i pazienti e il centro da cui dipendono in base al loro livello nella lista. La compatibilità immunologica tra donatore e ricevente è limitata all’identità del gruppo sanguigno.
Impostazioni generali
Possono essere impiantati diversi tipi di innesti: • innesti interi, perché non hanno subito alcuna riduzione di volume, prelevati da donatore cerebroleso o deceduto per arresto circolatorio [8] . I peduncoli vascolari sono intatti, lunghi e di buon calibro, quindi facili da impiantare; • emi-innesti destri o sinistri, derivanti dalla bipartizione ex situ o in situ [9] di un innesto intero o prelevato da un donatore vivente. La loro funzione immediata proporzionale al loro volume, il piccolo calibro dei vasi spesso multipli e delle vie biliari e la presenza di una fetta di sezione sono tutti elementi che aumentano la morbilità postoperatoria. Qualunque sia la natura dell’innesto utilizzato, un trapianto di fegato avviene in tre fasi successive, distinte per la loro difficoltà tecnica e per le loro conseguenze fisiologiche.
Fase I dedicata all’exeresi del fegato nativo
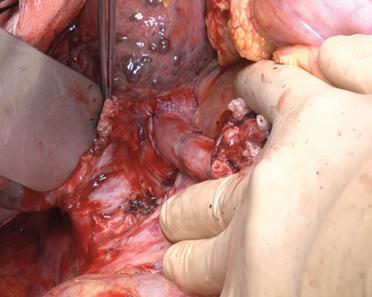
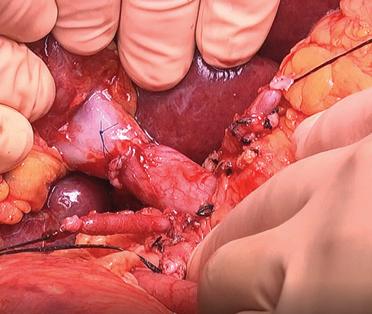
L’exeresi del fegato nativo può essere rapida e semplice. Questo è il caso quando l’indicazione al trapianto è rappresentata da un’epatite fulminante o un’epatopatia metabolica senza alterazione macroscopica della struttura del fegato e del suo peduncolo. In realtà è spesso complicata da ipertensione portale e da disturbi emostatici che accompagnano la cirrosi, indicazione più comune al trapianto. Una storia di chirurgia dell’ipocondrio destro aggiunge, in questo contesto, un’ulteriore difficoltà legata alla presenza di aderenze, responsabili di varici legate all’ipertensione portale. Queste aumentano le difficoltà di dissecazione e possono rendere questa fase una tappa talmente emorragica da coinvolgere la prognosi vitale dell’operato, precipitandolo nelle complicanze della trasfusione massiva.
Fase II caratterizzata dall’assenza anatomica e funzionale del fegato
Questa è la fase “anepatica”. Inizia nel momento in cui il fegato nativo è stato rimosso e termina con la rivascolarizzazione dell’innesto. Di durata variabile a seconda delle condizioni operatorie, questa fase è dedicata al perfezionamento dell’emostasi del letto di epatectomia e poi alla preparazione delle anastomosi venose che precedono la rivascolarizzazione dell’innesto. La fase anepatica è caratterizzata dall’insorgenza di anomalie emodinamiche e metaboliche legate rispettivamente all’interruzione del ritorno venoso dai territori splancnico e dalla vena cava inferiore e all’assenza di funzionalità epatica. Il deficit di funzionalità epatica può essere compensato dall’assunzione parenterale di fattori della coagulazione e dalla correzione dell’ipocalcemia o dell’acidosi metabolica che si instaurano rapidamente. L’interruzione del flusso portale e della vena cava inferiore, in assenza di vie di derivazione, può avere gravi conseguenze:

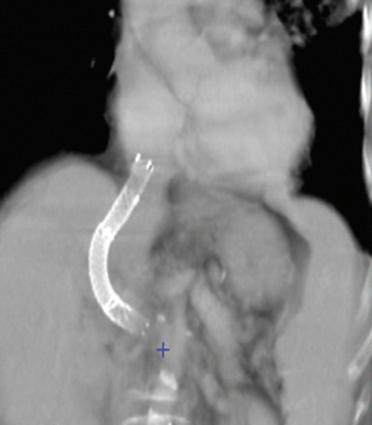
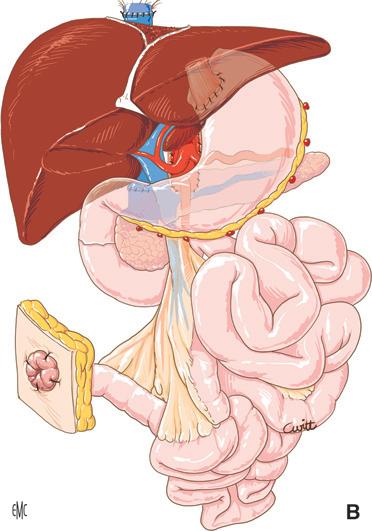
Figura 1. La rimozione del fegato nativo viene eseguita preservando la continuità della vena cava inferiore. Viene praticata temporaneamente un’anastomosi portocavale terminolaterale per preservare, durante la fase anepatica, il drenaggio venoso del territorio splancnico. 1. Vena cava inferiore; 2. anastomosi portocavale.
• calo della gittata cardiaca a causa della grave amputazione del precarico;
• anuria dovuta all’associazione di un’ipoperfusione arteriosa e di un ostacolo all’effluente venoso dei reni;
• stasi venosa nel territorio splancnico, le cui conseguenze sono una proliferazione microbica con rilascio di endotossine al momento della riperfusione nonché un aumento dell’ipertensione portale che rende difficile, se non impossibile, l’asciugatura, per quanto indispensabile, del letto di epatectomia.
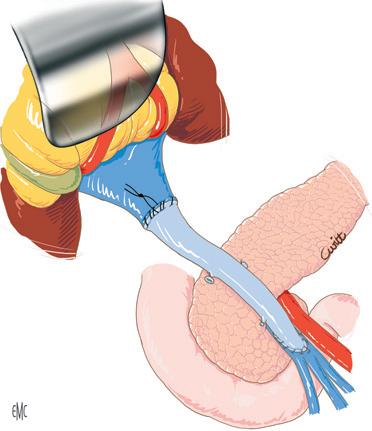
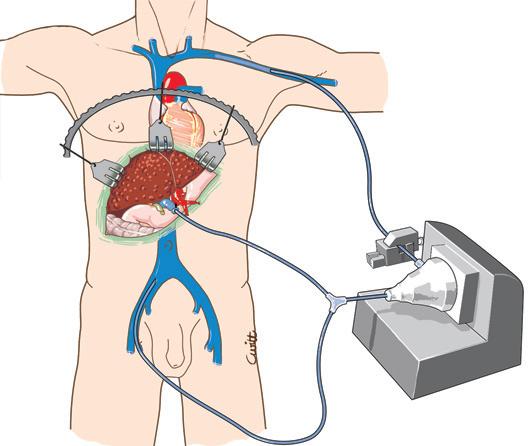
La conservazione della continuità della vena cava inferiore durante la rimozione del fegato malato e la creazione di un’anastomosi portocavale temporanea (durante la fase anepatica) sono i modi più semplici ed efficaci di evitare queste complicanze [10] (Fig. 1). È divenuto inoltre eccezionale il ricorso all’impianto di uno shunt extracorporeo venovenoso tra la vena porta e la vena cava inferiore (VCI) (attraverso la vena iliaca esterna) da un lato e la vena cava superiore (tramite la vena ascellare) dall’altro (Fig. 2). Una volta installato, lo shunt utilizzato dalla maggior parte delle equipe è uno shunt “attivo”, con il sangue propulso tramite una pompa. L’uso proposto da Shaw et al. [11] della pompa non occlusiva, operante per effetto Venturi (Biomedicus® ) e associata a un circuito “rivestito” di eparina, evita l’anticoagulazione del ricevente per via sistemica.
Una volta effettuate le anastomosi cavoportali, si rimuovono le clamp e si rivascolarizza l’innesto.
Questo istante può essere segnato dall’insorgere di una sindrome da rivascolarizzazione, dall’espressione emodinamica del rilascio da parte del fegato riossigenato di sostanze tossiche accumulate durante il suo stoccaggio e dalla produzione di radicali liberi al momento della sua riperfusione.
Fase III dedicata alla ricostruzione arteriosa e biliare
In questa fase, il trapianto, rivascolarizzato attraverso la vena porta e drenato dalla VCI, non è più in stato di ischemia e il ricevente non è più in situazione di anepatia. Questa fase segna quindi la fine dell’atmosfera stressante che a volte caratterizza le due fasi precedenti. Tutta l’attenzione degli operatori è dedicata alla ricostruzione accurata dell’arteria e del dotto biliare. Queste
EMC - Tecniche chirurgiche - Addominale
Figura 2. Il fegato nativo viene talvolta rimosso insieme al segmento retroepatico della vena cava inferiore. Il mantenimento del flusso cavale inferiore e del flusso splancnico è assicurato dal posizionamento di uno shunt venovenoso extracorporeo attivo. La puntura venosa dei territori della vena cava inferiore e dell’area splancnica viene eseguita rispettivamente attraverso la vena safena interna destra e il tronco portale o la vena mesenterica inferiore. Il ritorno avviene nel territorio della vena cava superiore attraverso la vena ascellare.
due anastomosi rimangono la sede della maggior parte delle complicanze chirurgiche del trapianto di fegato [12, 13] .
Trapianto ortotopico del fegato intero
Preparazione ex vivo dell’innesto
Questa fase, eseguita contestualmente all’inizio dell’intervento nel ricevente, su un tavolo dedicato, consiste nella preparazione dei siti di anastomosi vascolare e biliare dell’innesto. L’operatore (idealmente colui che ha rimosso l’organo) e il suo assistente sono seduti l’uno di fronte all’altro ai lati di un tavolo di dissecazione. L’innesto, estratto dal suo contenitore di trasporto con le maggiori precauzioni asettiche, viene immerso in una vasca contenente liquido di conservazione, la cui temperatura è mantenuta tra i 4 e gli 8 ◦ C con del ghiaccio sterile.
Preparazione della vena cava inferiore
L’innesto è esposto attraverso la sua superficie posteriore. La VCI è tesa tra quattro fili di riferimento, posti a ore 3 e a ore 9 rispetto ai margini delle sue estremità. Il suo segmento sovraepatico viene liberato dal collarino diaframmatico che è stato asportato con il fegato. Durante questa manovra, le vene diaframmatiche vengono accuratamente legate o suturate. Il loro ostio, visibile nel lume della vena cava, ne facilita l’individuazione. A destra, il rilascio del frammento di diaframma portato via con il fegato prosegue nel piano del legamento triangolare destro, rimanendo a contatto con la capsula epatica.
Preparazione
degli elementi del peduncolo epatico
Questa fase dipende dal metodo di prelievo realizzato in monoblocco o con dissecazione in situ. Il prelievo in monoblocco è più accurato ed evita incidenti come ferite arteriose, portali o biliari. Il prelievo in monoblocco ha generalmente asportato in continuità il peduncolo epatico, la testa del pancreas e il tronco arterioso celiomesenterico.
Ogni elemento del peduncolo deve essere isolato. I vasi vanno manipolati con la massima delicatezza, senza trazioni, evitando la dissecazione per discissione che traumatizza l’avventizia e favorisce la trombosi.
In pratica, la vena porta viene liberata dai tessuti circostanti pur rimanendo a filo con la sua avventizia. Ciò evita il sezionamento accidentale dei rami a destinazione coledocica dell’arteria epatica e del suo ramo destro che attraversano davanti o talvolta dietro la vena. La dissecazione prosegue posteriormente fino all’altezza della placca ilare, dove si biforca. Questo rilascio, spinto in alto sotto la placca ilare, permette di aggiustare al meglio l’asse della vena al momento del suo impianto e di evitare il twisting. La vena porta viene infine incannulata mediante un drenaggio che spurga il fegato, prima che sia rivascolarizzato, dai prodotti del metabolismo anaerobico e dai detriti cellulari accumulati durante la fase di conservazione.
L’arteria epatica viene preparata secondo la sua distribuzione anatomica. Il rischio è quello di recidere inavvertitamente uno dei suoi rami anormalmente distribuiti: arteria epatica nata da un tronco gastroepatico e che attraversa il piccolo epiploon o arteria epatica destra nata dall’arteria mesenterica superiore (AMS) e che scorre dietro alla vena porta e alla sua destra. Oggi, tutti i donatori sono stati esplorati mediante TC total body con fase arteriosa e le varianti anatomiche dell’arteria epatica vengono riconosciute prima del prelievo ed è eccezionale non conoscerle al momento della preparazione dell’innesto.
L’arteria epatica è fragile e una trazione mal dosata può provocare fratture dell’intima in corrispondenza degli speroni delle biforcazioni. La conseguenza di queste fratture è drammatica. Il vaso, infatti, si intasa immediatamente o nelle ore successive al trapianto. La riparazione è illusoria. Bisogna rifare il trapianto.

I segmenti retro- e sottoepatici della VCI vengono poi ripuliti dal tessuto cellulare lasso che li ricopre. Il legamento epatocavale viene reciso per fornire tessuto alla VCI retroepatica perché è lì che si porterà l’anastomosi. La vena surrenale destra viene legata al suo sbocco nella VCI, con questa legatura assicurata da un punto a “x”. La perfetta tenuta dell’asse cavale viene infine verificata obliterando il suo orifizio superiore e iniettando, attraverso l’orifizio inferiore, del liquido di conservazione freddo, a bassa pressione. Le estremità prossimale e distale della vena cava retroepatica vengono lasciate aperte o chiuse con una fila di graffette a seconda della modalità di impianto scelta.

Spesso unica, l’arteria è stata prelevata in continuità con il tronco celiaco e un segmento dell’aorta. L’ostio celiaco viene individuato e intorno ad esso viene intagliato un patch aortico. Un filo guida, fatto passare attraverso questo patch, mantiene l’asse arterioso teso dal peso di una piccola pinza inguainata, mentre viene rilasciato in maniera anterograda dalla sua guaina linfatica. Così vengono successivamente identificati uno o due rami diaframmatici nati dall’origine del tronco celiaco, il moncone dell’arteria gastrica sinistra, l’origine dell’arteria splenica (che potrebbe essere stata prelevata con l’innesto pancreatico) e il moncone dell’arteria gastroduodenale. Quest’ultimo segna il limite oltre il quale è pericoloso andare a dissecare. Tutti i rami dell’arteria epatica sono lasciati aperti e possono essere utilizzati come patch di ingrandimento al momento dell’impianto.
In quasi il 40% dei casi, è presente un’arteria epatica destra o sinistra di distribuzione non modale [3] . Dal momento che la distribuzione arteriosa del fegato è di tipo terminale, queste arterie devono essere conservate indipendentemente dal loro calibro. L’arteria epatica sinistra atipica di solito nasce da un tronco gastroepatico sorto dal tronco celiaco (Figg. 3A, B) e prelevato contemporaneamente ad esso. Il trattamento di questo vaso accessorio comporta la legatura del ramo a destinazione gastrica del tronco gastroepatico. Quando un’arteria epatica sinistra nasce direttamente dall’aorta, il suo ostio viene identificato e trasportato insieme al tronco celiaco sul patch aortico.
L’arteria epatica destra di solito nasce dall’AMS. Il peduncolo epatico comprende quindi due arterie separate che conviene unire. Questo lavoro è meglio farlo ex situ. Sono stati riportati molti metodi di ricostruzione: la tecnica originale, descritta da Gordon et al. [14] (Figg. 3C, D), consiste nell’anastomizzare in continuità il tronco celiaco e l’AMS e poi nell’impiantare l’estremità distale del segmento dell’AMS asportato. Questa tecnica è fonte di piegamenti. Si preferisce anche il reimpianto diretto dell’arteria
I – 40-165-B Tecniche di trapianto di fegato negli adulti
epatica destra nel moncone dell’arteria gastroduodenale o, in mancanza, quello dell’arteria splenica (Figg. 3E, F).
Identificati gli elementi arteriosi e venosi del peduncolo epatico, il tessuto linfatico da cui sono stati separati viene accorciato e legato con piccoli punti restando lontano dal dotto biliare principale, per non devascolarizzarlo.
L’innesto preparato viene pesato (il rapporto tra peso dell’innesto e peso del trapiantato è un parametro importante per l’analisi della sua funzione iniziale). In attesa del suo impianto, viene tenuto immerso nella sua soluzione di conservazione a 4 ◦ C oppure messo in una macchina di perfusione [15] . I vasi iliaci prelevati dal donatore contemporaneamente al fegato vengono spogliati del loro tessuto cellulare, sigillati tramite l’obliterazione degli osti collaterali e conservati anche a 4 ◦ C, pronti all’uso se necessario al momento del reimpianto.
Trapianto standard: exeresi del fegato nativo con conservazione della vena cava inferiore, anastomosi portocavale temporanea e impianto dell’innesto a ‘‘piggyback’’
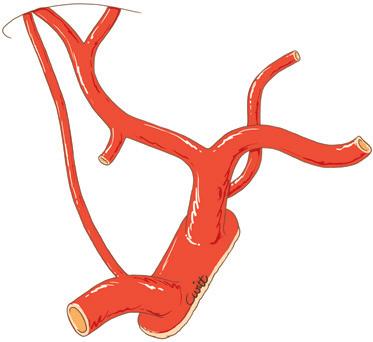
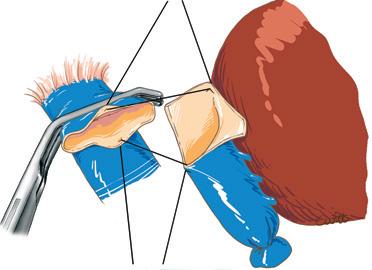
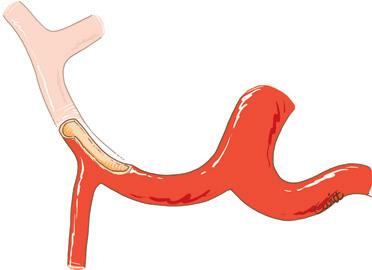
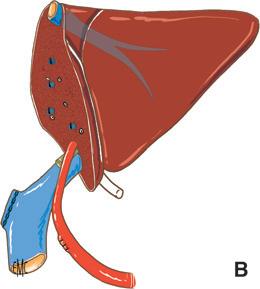
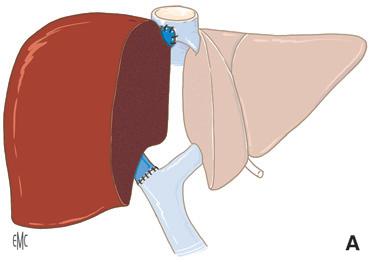
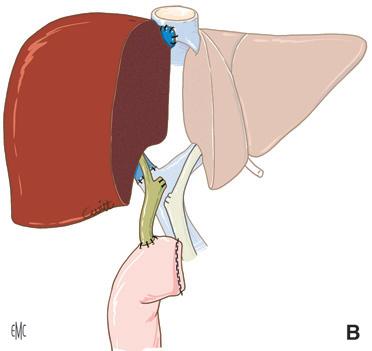
Piggyback è il termine anglosassone che caratterizza il modo in cui si porta qualcuno “a cavallo sulle spalle”. Questa metafora illustra perfettamente la tecnica del trapianto epatico che consiste nel preservare la continuità della vena cava dal lato ricevente, per impiantare lì, addossandola, la vena cava dell’innesto che riceve gli osti delle vene epatiche [16] . Il vantaggio di questa tecnica è quello di aggirare la difficoltà di realizzare le due anastomosi cavali inferiori (sovra- e sottoepatica) nella tecnica originaria descritta da Starzl (Fig. 4).
Installazione
Il ricevente entra in sala operatoria 1-2 ore prima del momento previsto per l’incisione. Si tratta del tempo necessario per l’equipe di anestesia per impostare le vie d’accesso vascolare necessarie per il riempimento e il controllo dell’emodinamica (grandi vie venose e catetere arterioso radiale e talvolta catetere di Swan-Ganz).
Il paziente viene posto in posizione supina, con il braccio destro lungo il corpo per lasciare spazio all’operatore e al suo secondo aiutante. Il braccio sinistro in abduzione rimane accessibile agli anestesisti. I punti di appoggio sensibili (punti delle scapole, gomiti, testa del perone, sacro, talloni), esposti nei cirrotici malnutriti, sono accuratamente protetti per prevenire l’insorgere di piaghe da decubito o di paralisi periferiche.
La pelle viene lavata, asciugata e poi disinfettata. Il campo standard va dalla linea mammaria al pube. Lateralmente, l’incisione deve poter arrivare fino ai fianchi. Quando si prevede di utilizzare uno shunt venovenoso durante la fase anepatica, i teli ven-
gono applicati in modo da esporre contemporaneamente l’accesso addominale e i siti di cannulazione (cavo ascellare sinistro e radice della coscia destra). Nell’esperienza degli autori, lo shunt non è stato utilizzato per 20 anni in più di 2 000 trapianti.
L’operatore si colloca alla destra del paziente. Il primo e il secondo aiutante sono posti rispettivamente di fronte a lui e alla sua sinistra. Vengono installati due aspiratori, uno dei quali può essere collegato a un sistema di autotrasfusione (Cell-Saver® ).
Fondamentale è la presenza di uno strumentista e di un toelettatore circolante. Lo strumentista siede ai piedi e alla sinistra del paziente (Fig. 5).
Vie d’accesso
È ormai accettato che la via d’accesso sia esclusivamente addominale (Fig. 6). Un’incisione sottocostale che inizia all’apice del processo xifoideo, che, a destra, scende in basso nel fianco, espone perfettamente l’intero piano sovra-meso-colico e fornisce accesso al piano sotto-meso-colico. Se necessario, questa incisione sottocostale destra può essere estesa a sinistra.
Il tessuto adiposo preperitoneale sottoxifoideo viene asportato insieme alle grosse varici che lo percorrono per evitare che vengano accidentalmente infilzate durante la chiusura dell’aponeurosi.
Tutte le venule parietali di derivazione portocavale vengono accuratamente collegate prima di essere recise. Il legamento rotondo, a volte carico di una grossa vena ombelicale permeabilizzata, viene reciso tra due legature supportate. Dal lato del fegato, il filo posto in attesa su una pinza robusta serve a sollevare il fegato e a esporre la regione sottoepatica. L’impugnatura è solida e non rischia di lacerare il parenchima. I primi centimetri del legamento falciforme vengono recisi, liberando la faccia anteriore del fegato dal suo attacco parietale. Viene esplorata la cavità addominale così aperta: l’ascite viene prelevata per l’esame batteriologico, poi svuotata. Viene controllata la corretta posizione del sondino gastrico. In questa fase dell’esplorazione è necessario ricercare l’eventuale lesione che potrebbe essere sfuggita alle indagini preoperatorie e che metterebbe in discussione la prosecuzione dell’intervento chirurgico.

La parete è protetta e viene posto un retrattore rigido e potente, in grado sia di sollevare che di allargare l’arcata costale. Possono essere utilizzati due semplici valvole sottocostali attaccate a picchetti di testa articolati o meno oppure un retrattore più sofisticato come il retrattore Bookwalter® (Codman® ) o di Ulrich® (Ulrich medical). La qualità dell’esposizione fornita da questi retrattori facilita notevolmente le fasi successive.
Fase I: exeresi del fegato nativo
Non esiste una tattica operatoria individuale per eseguire l’escissione del fegato nativo. Tutte le tecniche sono buone purché soddisfino la regola d’oro di questa fase: ridurre al minimo le
3.
A. Principali anomalie delle modalità di distribuzione delle arterie dell’innesto. a. Arteria epatica sinistra che ha origine da un tronco gastroepatico. L’arteria epatica sinistra (1) scorre nel piccolo epiploon all’incrocio tra pars flaccida e condensa. Nasce da un tronco gastroepatico (2) che irrora anche l’arteria gastrica sinistra (3). b. Arteria epatica destra (1) che ha origine dall’arteria mesenterica superiore (2).
Figura
Figura 3. (seguito)
B. Arteria epatica destra che ha origine dall’arteria mesenterica superiore. Plastica secondo Gordon [14] a. Vengono tagliati dei patch d’aorta a “8” intorno agli osti dei due tronchi arteriosi. b. Una cerniera, trattenuta tra i due arrotondamenti, permette di accostare gli osti l’uno all’altro. È l’estremità distale dell’arteria mesenterica superiore che ormai funge da unico asse di impianto.
C. Altre metodiche di ricostruzione ex situ di un’arteria epatica destra che ha origine dall’arteria mesenterica superiore. a. Impianto nell’ostio dell’arteria gastroduodenale. b. Impianto terminoterminale all’estremità distale di un segmento di arteria splenica.
perdite ematiche. La difficoltà dell’obiettivo deriva dall’esistenza di cirrosi con ipertensione portale dove tutti i legamenti del fegato sono sede di un denso e fragile circolo venoso collaterale. La sezione tra le legature deve essere preferita alla coagulazione elettrica. Questa prima fase può essere complicata dall’esistenza di aderenze periepatiche, più dense se il paziente è già stato operato nel quadrante superiore destro (colecistectomia o intervento di riparazione biliare).
Epatectomie semplici
Prima fase: isolamento degli elementi del peduncolo epatico. Gli elementi del peduncolo devono essere mantenuti sufficientemente a lungo in modo da non correre il rischio di rimanere senza tessuto durante l’impianto dell’innesto. Vengono avvicinati un po’al di sopra del bordo superiore del primo duodeno, perché a questo livello sono il più delle volte unici e di grosso calibro. Una colecistectomia preliminare non è raccomandata. Questa fa sanguinare. La dissecazione viene eseguita passo dopo passo, legando tutti i tessuti prima di sezionarli. Questo atteggiamento limita la perdita ematica intraoperatoria e previene la linforragia che può complicare il periodo postoperatorio. Il secondo aiutante, munito di una valvola protetta, spinge verso l’alto il margine libero del fegato mentre il primo aiutante abbassa il blocco duodenopancreatico per presentare un peduncolo epatico teso (Fig. 7).
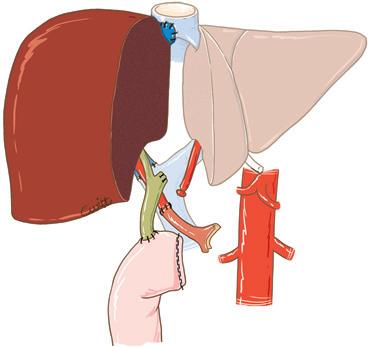
Figura 4. Metodi di impianto della vena cava inferiore dell’intero innesto in situazione ortotopica.
A. Metodo classico. Il segmento di vena cava retroepatica dell’innesto è interposto sul percorso della vena cava inferiore nativa portata via con il fegato nativo. Ci sono due anastomosi cavali: sovra- e sottoepatica.
B. Impianto a piggyback. Il segmento di vena cava retroepatica dell’innesto è “appoggiato” contro la vena cava nativa conservata.
La dissecazione del peduncolo epatico prevede tre fasi successive.
La prima consiste nel portarsi sul lato destro del peduncolo per avvicinarsi al coledoco. Quest’ultimo è esposto dal basso verso l’alto fino all’origine del dotto cistico che viene reciso tra delle legature. A questo livello, il coledoco viene bypassato “alla larga” per non rischiare di ledere le grosse vene fragili che lo circondano. Questa manovra viene eseguita utilizzando un dissettore a punta smussata. Il coledoco viene sezionato tra due legature supportate e la sua estremità distale viene reclinata verso il basso. Non è raro scoprire, posteriormente, un’arteria epatica destra che viene legata e recisa. La sezione del coledoco espone il fianco destro del tronco portale e il ramo destro dell’arteria epatica.
La seconda ricerca l’arteria epatica sulla faccia anteriore del peduncolo. L’apertura del foglietto anteriore del piccolo epiploon e il graduale assottigliamento del peduncolo espongono prima l’arteria epatica propria. Questa viene recuperata tramite un laccetto e il suo rilascio a valle si arresta ai suoi rami di divisione che sono legati e messi su dei fili trattori. L’asse arterioso viene delicatamente tirato in avanti per essere separato dall’alto in basso dal tessuto linfatico denso che lo riveste. L’asse arterioso viene così liberato fino all’impianto dell’arteria gastroduodenale. Meglio non lasciare una clamp alla sua origine. L’ischemia della parete arteriosa a valle può essere un fattore che favorisce la trombosi postoperatoria e la stenosi anastomotica.
Figura 5. Posizione dell’equipe intorno al paziente. 1. Anestesista; 2. secondo aiutante; 3. primo aiutante; 4. operatore; 5. strumentista.
Nel peduncolo rimane solo la vena porta. Questa viene esposta facilmente, a filo con il duodeno, rimuovendola dal tessuto linfatico che la circonda. Il tronco della vena porta viene successivamente liberato dal basso verso l’alto, viene clampato e i suoi rami destro e sinistro vengono tagliati tra legature solide o più semplicemente sezionati mediante una suturatrice tagliente tipo endo-GIA® vascolare.
Seconda fase: anastomosi portocavale temporanea. Questa anastomosi portocavale assicura il drenaggio del territorio splancnico durante tutta la fase anepatica appena iniziata. Il suo interesse rimane dibattuto. Molti lavori retrospettivi non hanno mostrato il suo interesse. Tuttavia, uno studio prospettico randomizzato ha mostrato i benefici che fornisce in termini di consumo di emoderivati [17] e, in uno studio comparativo di popolazioni aggiustate, gli autori hanno mostrato il suo interesse nel migliorare la sopravvivenza degli innesti marginali [18] Comunque sia, gli autori difendono l’idea che non vi sia alcun rischio nel realizzarla mentre il beneficio può essere notevole se per caso la fase anepatica deve essere prolungata in maniera anomala o per dare sicurezza ai chirurghi in formazione.

Il segmento interepatorenale della VCI è quindi ben esposto. Viene liberato dal foglietto peritoneale precavale che lo ricopre e la faccia anteriore della VCI viene clampata lateralmente. L’anastomosi portocavale terminolaterale è facilmente realizzabile grazie all’ottima esposizione fornita dalla sezione del peduncolo epatico. Quando il lobo di Spiegel è ipertrofico, l’esposizione del segmento sottoepatico della VCI può essere difficile, al punto da abbandonare l’idea di un bypass temporaneo (Fig. 8).
Terza fase: resezione del fegato nativo mantenendo la continuità della vena cava inferiore. Il fegato è ora completamente devascolarizzato. È collassato. Questa riduzione di volume ne facilita la mobilizzazione. Con la mano sinistra, possibilmente indossando un guanto di stoffa per migliorare la presa, l’operatore abbassa il fegato posizionando l’indice e il medio su entrambi i lati del legamento falciforme. Questo è sezionato all’origine dei lembi anteriori dei legamenti triangolari destro e sinistro. La trazione
6. Incisione a J (1) ingrandita a sinistra a “stella di Mercedes” (2).
Figura 7. Exeresi del fegato nativo. Esposizione del peduncolo epatico. Il primo aiutante abbassa il blocco duodenopancreatico. Il secondo aiutante solleva il bordo libero del fegato ed espone la sua faccia inferiore.

esercitata sul fegato tende la vena cava sovraepatica, rivelando il suo bordo destro, corrispondente al bordo destro della vena epatica destra. Questo punto di repere localizza il livello della faccia anteriore della VCI nel tessuto cellulare lasso che lo ricopre e consente di esporre in tutta sicurezza il tronco comune delle vene epatiche media e sinistra, più anteriore. È rimanendo a contatto con esso che si trova il piano di distacco del legamento triangolare destro, il cui collasso inizia nell’arco di pochi centimetri. La mobilizzazione del fegato continua a sinistra. Il legamento triangolare sinistro viene sganciato passo dopo passo. Il lobo sinistro viene inclinato a destra dal secondo assistente. La sezione del piccolo epiploon, fino all’inserzione diaframmatica della pars condensa, consente l’accesso al fianco sinistro della VCI ancora ricoperta dal segmento I. Il passo successivo è il distacco del fegato dai suoi attacchi posteriori. Molte equipe liberano il fegato passando da destra. L’assistente per primo, con la mano destra (coperta da un guanto in tessuto che aggancia senza sforzo la capsula epatica), reclina il fegato a sinistra e senza trazione in avanti, mentre l’operatore scolla il legamento triangolare destro. Questo basculamento epatico viene portato sul fianco destro della VCI. La ghiandola surrenale destra doveva essere prima scollata, la sua vena di drenaggio doveva essere eventualmente legata e, più in alto, doveva
EMC - Tecniche chirurgiche - Addominale
Figura
Figura 9. Campo operatorio durante la fase anepatica. Il flusso della vena cava e il flusso splancnico sono rispettivamente preservati dalla conservazione della vena cava inferiore retroepatica e dalla creazione di un’anastomosi portocavale temporanea.


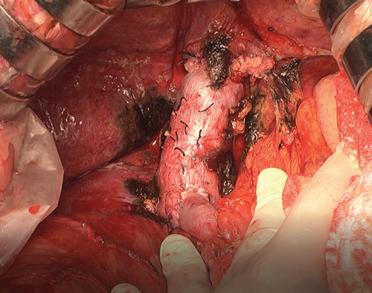
essere sezionato, tra legature supportate o usando l’endo-GIA® vascolare, il legamento epatocavale. Resta da liberare la VCI dal settore dorsale che la racchiude e a cui è attaccata attraverso le sue vene epatiche. Le vene epatiche accessorie provenienti dal fegato destro sono collegate passo dopo passo dal basso verso l’alto man mano che si presentano. Il tronco della vena epatica destra finisce così per essere esposto. La sua sezione a monte di una legatura supportata permette l’accesso alla fila dei vasi epatici nati dalla parte sinistra del settore dorsale. Il tronco comune delle vene epatiche media e sinistra viene sezionato per primo per esporre in gran parte le piccole vene spiegeliane di sinistra. Questa fase è lunga e deve essere guidata con cautela, con ogni legatura che merita di essere sostenuta. Ogni ferita vascolare è fonte di sanguinamento abbondante. Sembra però che passare da sinistra offra il vantaggio di indurre meno ipotensione in relazione al ripiegamento della VCI e di essere più facilitati quando, come spesso accade in un fegato cirrotico, il fegato destro è ipotrofico e il sinistro è ipertrofico [19] . Il fegato viene espiantato e inviato nella sua interezza per l’esame anatomopatologico. L’ipocondrio destro è vuoto. La VCI lo attraversa longitudinalmente nella sua parte sinistra (Fig. 9). Si increspa sotto le onde pressorie dall’atrio destro. La vena porta vi sbocca a pieno canale. Il ritorno al cuore destro è così preservato, il territorio splancnico è drenato ed è limitata la perdita di sangue.
Epatectomie difficili
Questo è il caso quando l’ipertensione portale è grave e c’è una storia di chirurgia dell’ipocondrio destro. L’esistenza di aderenze spesse, retrattili, estremamente emorragiche e la scomparsa dei piani di dissecazione impediscono l’accesso ai vari siti di clampaggio e di anastomosi. Nella pratica, si incontrano tre tipi di difficoltà.
Mancanza di passaggio tra il diaframma e il fegato. Può essere il caso dopo una precedente epatectomia su un fegato con cirrosi. La fetta di sezione si è fusa con il muscolo diaframmatico e
Figura 8. Creazione di un’anastomosi portocavale temporanea terminolaterale sulla superficie anteriore della vena cava inferiore sottoepatica (A, B). Previene la stasi venosa splancnica e la congestione del tubo digerente e assicura il mantenimento di una buona emodinamica per il tempo necessario all’epatectomia totale.
qualsiasi tentativo di attraversarlo provoca un’emorragia difficile da controllare oppure una breccia pleurica o addirittura entrambe. La deafferentazione vascolare primaria del fegato descritta nel capitolo precedente permette di fatto di passare in zona sottocapsulare o nel parenchima senza il rischio di emorragie significative poiché il fegato non è più vascolarizzato.
Vena cava sovraepatica inaccessibile. Questa è una situazione frequente quando l’origine della cirrosi è la sindrome di Budd-Chiari o quando si tratta di un’echinococcosi alveolare che si sviluppa nella parte superiore del fegato. La malattia infiammatoria o il “tumore” parassitario avvolgono la VCI con un tessuto cicatriziale impossibile da sezionare. Meglio non avvicinarsi alla vena cava nello spazio inter-epato-diaframmatico. Si controlla molto facilmente attraverso una breve frenotomia orizzontale nel suo segmento intrapericardico.
Peduncolo epatico indissecabile. Il peduncolo viene clampato in massa alla sua base e sezionato il più distalmente possibile. Ciascuno degli elementi che lo compongono può essere riconosciuto e sezionato a partire dalla fetta di sezione.
Non è raro, in questa situazione, scoprire una trombosi della vena porta. La realizzazione di un’anastomosi portocavale temporanea non è necessaria poiché nel tempo sono state create numerose ed efficaci vie di derivazione. Nel capitolo dedicato al reimpianto, si vede come aggirare la difficoltà di impianto creata da questa situazione.
Fase II: anepatia
Questa fase è dedicata al perfezionamento dell’emostasi del letto di epatectomia e poi all’esecuzione delle due anastomosi venose (cava e porta) dovute all’impianto dell’innesto epatico prima della sua rivascolarizzazione.
Emostasi del letto di epatectomia
Sul lato destro della vena cava, la ghiandola surrenale destra, deperitoneizzata e talvolta privata del suo sistema di drenaggio, trasuda ancora. Gli aghi fatti passare non faranno altro che peggiorare l’emorragia. L’emostasi viene eseguita con un’elettrocauterizzazione. L’utilizzo di un coagulatore a getto di argon, quando disponibile, rende l’operazione molto semplice. L’area cruenta di inserzione del legamento triangolare destro viene chiusa mediante alcuni punti a forma di X o con un bisturi elettrico. Gli autori sconsigliano le suture andata e ritorno, che finiscono per avvicinare le sue radici anteriore e posteriore e restringere il compartimento subfrenico destro al punto da ostacolare l’impianto dell’innesto.
Il perfezionamento dell’emostasi è un imperativo che può richiedere molto tempo. Questo è il vantaggio di aver realizzato un’anastomosi portocavale.
Preparazione delle anastomosi venose
L’innesto viene estratto dal suo contenitore sterile o scollegato dalla macchina di perfusione. Durante l’intero processo di realizzazione delle anastomosi, viene ricoperto con un campo umido e freddo regolarmente spruzzato con acqua ghiacciata.
La tecnica per eseguire le anastomosi venose varia da scuola a scuola. Variano soprattutto l’ordine delle anastomosi, il calibro e la natura dei fili utilizzati, la necessità o meno di spurgare il fegato
Figura 11. Prima anastomosi vascolare: impianto della vena cava dell’innesto sulla vena cava del ricevente, laterolaterale. L’anastomosi deve portarsi sul fianco destro della vena cava inferiore del ricevente per evitare qualsiasi “twist” quando l’innesto viene inclinato nell’ipocondrio destro.
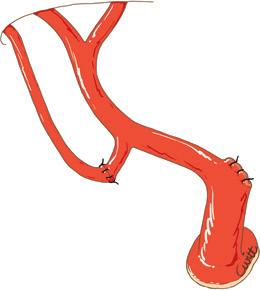
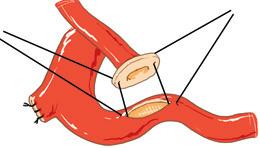
prima che venga rimesso in carica nonché la natura del liquido di lavaggio (sangue, albumina diluita, soluzione fisiologica, ecc.). Impianto cavale. A seconda della natura dell’anastomosi eseguita tra la vena cava del donatore e del ricevente, sono state descritte tre tecniche (Fig. 10).
Nella prima (Figg. 10A, B), la più antica, l’estremità distale della vena cava retroepatica dell’innesto è impiantata in modalità terminolaterale, alla faccia anteriore della vena cava del ricevente, a livello dello sbocco delle vene epatiche. I ponti di parete venosa che separano gli osti dalle vene epatiche vengono caricati
Figura 10. Le tre modalità di attuazione piggyback dell’innesto.
A. Terminolaterale sugli osti uniti delle vene epatiche media e sinistra con clampaggio della vena cava.
B. Terminolaterale sugli osti uniti delle vene epatiche destra, media e sinistra senza clampaggio della vena cava. 1. Vena cava inferiore sovraepatica; 2. vena epatica destra; 3. vena epatica sinistra; 4. vena epatica media.
C. Faccia a faccia. La vena cava dell’innesto viene divisa longitudinalmente e fissata sulla vena cava inferiore del ricevente.
D. Laterolaterale.
su un dissettore e poi sezionati. Questa plastica di ingrandimento crea un’ampia bocca anastomotica e facilita l’esecuzione dell’anastomosi cavo-sovra-epatica. L’esecuzione di questa anastomosi di solito richiede un doppio clampaggio della VCI. Una variante senza clampaggio della VCI (Figg. 10A, B) è stata descritta da Tayar et al. [20] L’estremità prossimale della VCI sul lato dell’innesto viene legata o graffata dopo aver pulito l’innesto.
Nella seconda (Fig. 10C), la vena cava dell’innesto viene tagliata in un ampio patch che circonda gli osti di tutte le vene epatiche, principali e accessorie. Questo patch di vena cava viene impiantato “faccia a faccia” sulla superficie anteriore della vena cava del ricevente lungo un’incisione verticale [3] . È nuovamente necessario un doppio clampaggio della cava.
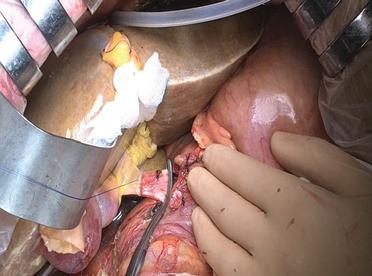
La terza è quella preferita dagli autori (Figg. 10D, 11). La vena cava dell’innesto è conservata, ma impiantata laterolateralmente alla VCI del ricevente. Per fare ciò, le due estremità della vena cava dell’innesto vengono chiuse per prime (usando una fila di graffette vascolari o una sutura a punti continui) e poi viene chiusa la sua faccia posteriore anastomizzata sulla VCI nativa, lungo un’incisione lateralizzata a destra, nell’asse del moncone della vena sovraepatica destra.
È sufficiente un semplice clampaggio laterale della VCI del ricevente. Con la realizzazione di un’anastomosi portocavale temporanea, il flusso portocavale viene dunque mantenuto. Dopo aver superato i punti d’angolo superiore e inferiore dell’anastomosi, l’innesto viene posizionato nella loggia epatica. I punti dell’angolo superiore e inferiore vengono legati. Con la mano sinistra, il secondo assistente solleva il lobo sinistro. Il bordo destro della sutura viene reso transanastomotico da sinistra a partire dall’angolo superiore. I punti caricano uno spessore di vena
- Tecniche chirurgiche - Addominale
12.
vascolare: anastomosi portale terminoterminale.
Figura 13. Anastomosi portale terminoterminale. Confezionamento di un growth factor o fattore di espansione della sutura sotto pressione venosa splancnica.
pari al passo. Quando sono interessati i tre quarti dell’anastomosi, si utilizza l’altro capo per completare l’anastomosi. Il risciacquo dell’innesto viene drenato attraverso le maglie allentate della sutura. Questo risciacquo libera il fegato del potassio che si è accumulato lì durante lo stoccaggio statico e svuota la VCI dell’aria che contiene.
Figura 14. Jump graft tra la vena porta dell’innesto e la superficie anteriore della vena mesenterica superiore per trattare l’obliterazione completa della vena porta del ricevente. L’innesto è una vena iliaca prelevata dal donatore.
colico, all’estremità della vena mesenterica superiore. L’innesto venoso passa successivamente davanti al blocco duodenopancreatico, poi attraverso la radice del mesocolon trasverso ai piedi della quale viene impiantato in posizione terminolaterale sulla faccia anteriore della vena mesenterica superiore (Fig. 14). La vena mesenterica superiore è controllata nella radice del mesentere, ai piedi del mesocolon trasverso davanti al terzo segmento duodenale. Viene liberata per 2-3 cm, il che avviene attraverso la sezione tra legature di uno o due affluenti digiunali. Questa dissecazione presenta un grave rischio emorragico per la presenza di vene digiunali fini, tese e numerose. In questo contesto, può essere utile posizionare uno shunt venovenoso tra il territorio splancnico e il territorio della vena cava inferiore.

Anastomosi portale (Fig. 12). Di solito, è un’anastomosi facile da realizzare. La vena porta nativa viene staccata dal suo impianto cavale. Una legatura supportata o una fila di graffette, 0,5 cm sopra l’anastomosi portocavale è sufficiente. La vena porta del ricevente è collegata a quella del trapianto in posizione terminoterminale. Le lunghezze devono essere valutate attentamente per non rischiare piegamenti durante l’allentamento dei retrattori. La distanza corretta è a 15 mm dal bordo superiore del pancreas sul lato ricevente e a livello del moncone della vena pancreaticoduodenale sul lato destro della porta dell’innesto. L’anastomosi viene eseguita utilizzando una sutura continua di Prolene® 5/0. Il nodo della sutura viene realizzato dopo declampaggio a distanza dall’anastomosi, lasciandogli una possibilità di espansione (Fig. 13). È il growth factor descritto da Starzl et al. [21] .
L’anastomosi portoportale può essere difficile nei pazienti con trombosi parziale o completa della vena porta, complicanza frequente nel corso di una cirrosi. Il coagulo che, di regola, non supera la confluenza splenomesaraica è nella maggior parte dei casi estirpabile. Il piano di scissione si situa oltre l’endotelio, lasciando in posizione un manicotto di avventizia abbastanza solido da supportare una sutura. Si epitelizza nel tempo. Raramente, il trombo non è estirpabile. Non è stato quindi possibile effettuare un’anastomosi portocavale provvisoria. Tuttavia, l’ipertensione portale è raramente fastidiosa perché l’obliterazione portale cronica ha favorito lo sviluppo di una collateralità significativa ed efficace. L’allungamento della vena porta dell’innesto con l’aiuto di un segmento di vena iliaca dello stesso donatore, prelevato sempre contemporaneamente al fegato [22] , permette di andare a cercare un flusso splancnico a livello sotto-meso-

In alcuni casi eccezionali, l’intero sistema venoso splancnico è otturato. Questa situazione non costituisce una controindicazione al trapianto. L’impianto della vena porta dell’innesto può riguardare l’estremità distale della vena renale sinistra, anastomosi terminale (i fattori trofici derivanti dal territorio splancnico passano attraverso le molteplici derivazioni splenorenali che si sono sviluppate con il tempo nel paziente cirrotico), o la VCI, che realizza quella che è stata chiamata emitrasposizione cavoportale (Fig. 15). È di tipo terminoterminale [23] dopo la legatura della VCI a valle dell’anastomosi. Che sia renoportale o cavoportale, l’emitrasposizione non corregge l’ipertensione portale, ma la normalizzazione della funzionalità epatica riduce il rischio di sanguinamento e contribuisce alla risoluzione dell’ascite. L’anastomosi renoportale ha il vantaggio di non interrompere il flusso cavale.
Declampaggio
La comunicazione con gli anestesisti è particolarmente importante al momento del declampaggio, consentendo di anticipare e prevenire la sindrome da riperfusione e l’iperkaliemia associate al ripristino della vascolarizzazione epatica.
La clamp cavale viene rilasciata per prima. La tenuta della sutura viene verificata prima di ricollegare la vena porta; segue il declampaggio della vena porta. Massaggiare l’anastomosi aiuta la sutura portocavale a distendersi per allargare la linea di sutura. La ricolorazione dell’innesto è lenta; il parenchima epatico viene massaggiato delicatamente per “lisciare” i sinusoidi. Il fegato viene riscaldato cospargendolo di soluzione tiepida.
Bisogna assicurarsi nell’immediato che non vi siano perdite dalle anastomosi o dall’innesto. Il lobo destro del fegato viene impalmato dal primo aiutante e totalmente inclinato a sinistra. Questa manovra espone perfettamente il lato destro della vena cava e il segmento retroepatico della VCI. Poi il lobo sinistro viene
Figura
Seconda anastomosi
Figura 15. Trombosi del sistema venoso splancnico: non è più una controindicazione al trapianto. La vena porta dell’innesto può essere impiantata in tre siti.
A. Sulla vena renale sinistra in posizione terminoterminale.
B. Sulla vena cava inferiore e quest’ultima collegata o aggraffata a valle per impedire il furto del flusso portale.
C. Sulla vena cava inferiore sezionata e sganciata per darle lunghezza. Un taglio smussato permette di adattare il suo calibro a quello della vena porta.
Figura 16. Realizzazione dell’anastomosi arteriosa. Tre siti sono privilegiati per le possibilità che offrono di eseguire una plastica di ingrandimento.
A. Biforcazione tra arterie epatiche destra e sinistra.
B. Biforcazione tra arteria epatica propria (1) e arteria gastroduodenale sezionata (2).
C. Confluenza tra arteria epatica comune (3) e arteria gastroduodenale (2).
inclinato a destra per controllare il lato sinistro. Si verifica che la sutura della vena porta sia tesa e che vi sia una buona emostasi nei tessuti che circondano gli elementi del peduncolo. Una clamp bulldog non traumatica viene posizionata sopra l’arteria e la via biliare per evitare che il reflusso di sangue venoso inondi il campo.
L’emostasi deve essere perfetta prima di passare alla fase successiva.
Fase III: ricostruzione arteriosa e biliare
La creazione di una buona anastomosi arteriosa è necessaria per la vascolarizzazione della via biliare dell’innesto. Tuttavia, non è sufficiente garantire la qualità dell’anastomosi biliare, che deve essere tecnicamente perfetta. La distribuzione anatomica non modale è associata a un aumentato rischio di trombosi postoperatoria [24, 25] .
Fondamentale è il rilascio di un eventuale legamento arcuato.
Anastomosi arteriosa
Devono essere preferite le anastomosi arteriose a punti separati, meglio se eseguite con gli occhialini.
È stato descritto un gran numero di tecniche di arterializzazione dell’innesto epatico, diverse per sito di anastomosi utilizzato, lato dell’innesto o lato ricevente. Si presentano due situazioni radicalmente differenti a seconda che l’arteria epatica del ricevente si presti o meno a realizzare un’anastomosi di buona qualità in virtù della sua consistenza.
Arterie epatiche del ricevente utilizzabili. L’arteria è di buone dimensioni, con una parete sana.
L’impianto viene eseguito meglio a cavallo dell’arteria epatica comune e propria, di fronte all’ostio dell’arteria gastroduodenale.
Quest’ultima è infatti un’importante via di sostituzione in caso di stenosi dell’origine del tronco celiaco da parte di un legamento arcuato e il suo ostio allarga la zona dell’anastomosi.
Dal lato dell’innesto, non è necessario conservare l’intero asse arterioso. La sua lunghezza viene regolata tra tensione eccessiva e plicatura. Sono preferibili due siti di impianto: la convergenza arteria gastroduodenale/arteria epatica comune oppure la convergenza tronco celiaco/arteria splenica (Fig. 16). Un’arteria adeguatamente rivascolarizzata batte forte e freme sotto le dita. In ogni caso, il controllo del flusso per effetto Doppler è sistematico alla fine dell’operazione. La riparazione dell’anastomosi arteriosa in caso di dubbio sulla sua qualità è una misura efficace per ridurre l’incidenza delle trombosi arteriose postoperatorie.
Quando un’arteria epatica destra è stata collegata al tronco celiaco con la tecnica di Gordon, l’anastomosi viene eseguita sull’estremità distale dell’AMS, possibilmente spatolata con una linea di divisione (Fig. 17).
Arterie epatiche del ricevente non utilizzabili. Ciò avviene quando sono trombizzate o quando le loro pareti sono state dissecate da un ematoma sottoavventiziale.
L’arteria splenica è il sito recettore più vicino. È accessibile nel suo quarto prossimale al bordo superiore del pancreas, dove generalmente descrive una bella ansa. L’asse arterioso dell’innesto è sufficientemente lungo da potervi essere impiantato senza ricorrere all’interposizione di un innesto vascolare. L’anastomosi è di tipo terminolaterale, utilizzando per esempio il patch aortico, o di tipo terminoterminale, tra il tronco celiaco dell’innesto e l’arteria splenica prossimale mobilizzata e sezionata per essere ribaltata (Fig. 18). Gli autori utilizzano quest’ultimo metodo di reimpianto quando la lunghezza dell’arteria dal lato dell’innesto non è sufficiente per ottenere un’anastomosi senza tensione o quando è
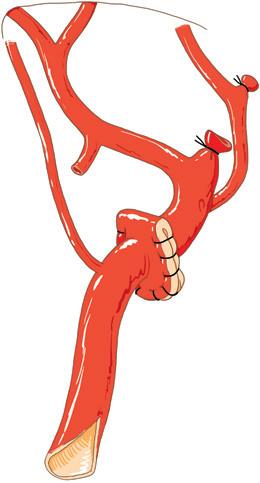
Figura 17. Sito di anastomosi arteriosa sul lato dell’innesto dopo plastica di Gordon (cfr. Fig. 7). Plastica di taglio sull’arteria mesenterica superiore impiantata nel sito arterioso del ricevente. 1. Arteria epatica sinistra; 2. tronco celiaco; 3. arteria mesenterica superiore.
A
B
Figura 18. Arterializzazione dell’innesto epatico. Quando l’arteria epatica del ricevente non può essere utilizzata, bisogna che sia impiantata sull’arteria splenica in posizione terminolaterale (A) o sull’arteria splenica in posizione terminoterminale (B). La milza rimane arterializzata attraverso dei vasi corti.
indicata la legatura dell’arteria splenica (deafferentazione di un aneurisma situato a valle).
Quando non è possibile utilizzare né l’arteria epatica né l’arteria splenica prossimale del ricevente, l’arteria dell’innesto viene impiantata direttamente nell’aorta. L’aorta celiaca è accessibile all’impianto diretto, ma è difficile da esporre perché è profondamente incastonata tra i pilastri del diaframma, a meno che l’impianto non sia stato preparato durante la fase anepatica mediante un primo innesto di un segmento di arteria iliaca prelevato dal donatore.
La faccia anteriore dell’aorta addominale sottorenale è un sito molto più conveniente, facilmente esposto per via sotto-meso-colica, mobilizzando la prima ansa digiunale. L’aorta viene liberata dalle strutture linfatiche che la ricoprono per alcuni centimetri, per consentire un clampaggio laterale sicuro. L’allungamento dell’asse arterioso dell’innesto è stavolta essenziale. Per fare ciò, gli autori utilizzano il treppiede iliaco prelevato contemporaneamente al fegato fino a quel momento tenuto freddo. La biforcazione iliaca esternoipogastrica permette di applicare idealmente questo innesto alla faccia anteriore dell’aorta (Fig. 19). Ci sono due possibili vie per portare l’innesto iliaco sul sito di anastomosi aortica. La via retroperitoneale (che passa successivamente davanti alla vena renale sinistra, a destra dell’origine dell’AMS, dietro il corpo del pancreas, e che infine emerge nell’ilo del fegato, al margine sinistro della VCI sottoepatica) viene utilizzata eccezionalmente perché non è possibile alcun controllo dell’innesto arterioso nel suo tragitto retropancreatico. La seconda via è meno diretta ma intraperitoneale, e l’innesto arterioso è facil-
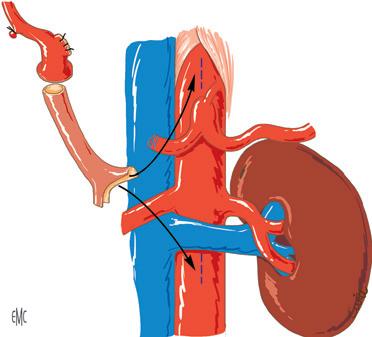
Figura 19. Arterializzazione dell’innesto epatico. Quando l’arteria epatica o l’arteria splenica del ricevente sono impraticabili, l’arteria dell’innesto viene impiantata nell’aorta mediante l’interposizione di un innesto iliaco (prelevato dal donatore). Sono possibili due siti aortici: l’aorta celiaca, esposta e preparata durante la fase anepatica, o l’aorta sottorenale, immediatamente al margine inferiore della vena renale sinistra.
mente controllabile su tutta la sua lunghezza. Questa via passa successivamente attraverso la radice del mesocolon trasverso e poi nella cavità posteriore degli epiploon, prima di emergere nella parte sinistra dell’ilo del fegato. L’anastomosi sull’aorta viene eseguita utilizzando una sutura monofilamento riassorbibile 4 × 0. L’anastomosi arteriosa distale non presenta difficoltà. Quando l’apporto arterioso dell’innesto è completo, l’emostasi viene nuovamente controllata prima di iniziare la fase di ricostruzione del dotto biliare. Il fegato viene sganciato da destra, poi da sinistra, alla ricerca di eventuali sanguinamenti sulle anastomosi cavali o sul letto di epatectomia. In questa fase, ci si concentra in particolare sull’emostasi del tessuto connettivo pericoledocico, ricco di arteriole che iniziano a sanguinare non appena l’arteria viene ricostruita, segno di una buona vascolarizzazione.
Ricostruzione biliare
Dopo essere stato oggetto di tecniche esoteriche (anastomosi colecistodigiunale su ansa a “Y”, doppio dotto di Calne, ecc.), il principio base che guida questa fase operatoria è semplice e fisiologico nel rispetto dei principi della chirurgia biliare convenzionale. La scelta della tecnica di ricostruzione biliare dipende dalle condizioni anatomiche. Quando le estremità coledociche sono sane, larghe, ben vascolarizzate e sufficientemente lunghe da consentire un’anastomosi senza tensione, tutto si presta a eseguire un’anastomosi coledoco-coledocica terminoterminale [26] Altrimenti, viene utilizzata un’anastomosi biliodigestiva.
Qualunque sia la tecnica scelta, il primo passo è rimuovere la vescicola dall’innesto. L’emostasi del letto della colecisti deve essere perfetta e le legature dell’arteria e del dotto cistico devono essere ben fissate.
Anastomosi coledoco-coledocica terminoterminale. Questa anastomosi coinvolge dotti fini.
Viene realizzata con l’aiuto di punti separati di sutura riassorbibile monofilamento (PDS® ). È meglio proteggerla con un drenaggio a “T”, anche se uno studio randomizzato ha mostrato il beneficio a breve termine di non drenare [27] La presenza di un drenaggio nella via biliare permette di controllare l’esistenza di un flusso biliare nei primi giorni postoperatori e offre la possibilità di opacizzare le vie biliari in caso di complicanza o di dubbio sullo stato dell’anastomosi.
Dopo aver unito le due estremità coledociche utilizzando due punti d’angolo destro e sinistro, il piano posteriore viene costruito per primo. Sono sufficienti pochi punti regolarmente distribuiti, che afferranno ampiamente i margini coledocici. I fili vengono annodati all’interno del lume biliare.
Viene poi posizionato un drenaggio di Kehr (Fig. 20). Il ramo verticale della “T” si esteriorizza attraverso l’anastomosi oppure attraverso la parete del coledoco del lato ricevente, a distanza (da
Figura 20. Anastomosi coledoco-coledocica terminoterminale. Un drenaggio di Kehr è stato posizionato in zona transanastomosi.
0,5 a 1 cm) dalla linea di sutura (Fig. 21). Prima di essere posizionati nel lume coledocico, i rami orizzontali della “T” vengono tagliati per evitare che attraversino lo sfintere di Oddi sottostante o che cateterizzino selettivamente uno dei due dotti epatici in alto. Il piano anteriore viene infine chiuso, utilizzando punti di presa spessi.
La tenuta dell’anastomosi viene verificata iniettando acqua attraverso il drenaggio.
Anastomosi coledoco-coledocica laterolaterale. Questa anastomosi proteggerebbe dalle stenosi anastomotiche [28] Viene criticata perché richiede una buona lunghezza del coledoco dal lato dell’innesto e, perciò, di posizionare l’anastomosi su un’area poco vascolarizzata.
Anastomosi biliodigestiva. L’anastomosi viene eseguita su un’ansa digiunale montata a “Y” secondo la tecnica di Roux. La lunghezza dell’ansa esclusa è di 75 cm. L’anastomosi ai piedi dell’ansa, terminolaterale, viene eseguita manualmente anziché con una pinza automatica per garantire l’emostasi delle fette di sezione digestiva. Il coledoco viene impiantato in modalità terminolaterale, utilizzando punti separati di fili riassorbibili fini, sul bordo antimesenterico dell’ansa, a 1 cm dalla sua estremità prossimale. È preferibile drenare la via biliare secondo la tecnica di Voelker, utilizzando un drenaggio (tipo transcistico CH 5) esteriorizzato ai piedi dell’ansa dove è “tunnellizzato” secondo Witzell per 2-3 cm (Fig. 22).
Dopo aver eseguito un ultimo “giro di emostasi” e aver lavato il sito chirurgico con soluzione calda, il compartimento epatico viene drenato mediante due drenaggi fini posti dietro il fegato e messi in aspirazione. Il ramo verticale del drenaggio di Kehr è esteriorizzato alla cute, sotto la porzione costale destra, al di sopra della linea di incisione. Il suo tragitto intraperitoneale è quindi il più breve possibile e passa attraverso il letto vescicolare, zona favorevole alla creazione di aderenze. Questo drenaggio rimarrà al suo posto 4 mesi ed è importante che tenga bene. Per questo, viene utilizzata una tecnica qui descritta.
La parete viene richiusa piano per piano con l’aiuto di fili riassorbibili forti.
Trapianto con shunt intraepatico transgiugulare
Lo shunt portosistemico intraepatico transgiugulare (TIPS) è un trattamento efficace per l’ascite refrattaria, per l’emorragia digestiva alta o per la sindrome epatorenale nei candidati al trapianto di fegato [29] .
L’impianto di un TIPS prima del trapianto migliora gli esiti dell’intervento e la sopravvivenza del paziente [30] Tuttavia, nel 30% dei pazienti possono verificarsi complicanze come la migrazione dello stent nella vena porta o nella VCI o persino nell’atrio destro e complicare l’impianto del trapianto di fegato. Dal momento che l’imaging preoperatorio ha identificato uno stent posizionato male o spostato, è necessario prevedere la gestione chirurgica dello stent migrato durante il trapianto di fegato.
La migrazione dello stent nella vena porta e nella vena mesenterica superiore è il caso più frequente. Lo stent si è incastrato nella parete e insistere nel tentativo di rimuoverlo può provocare una lesione venosa irrecuperabile. La vena e la protesi devono essere recise e l’anastomosi deve essere portata al di sopra, come se fosse assente (Fig. 23).
Figura 21. Anastomosi coledoco-coledocica terminoterminale. Quando le condizioni anatomiche lo consentono, non è necessario drenare (A). In caso contrario, è meglio proteggere l’anastomosi con un drenaggio a “T”, il cui ramo verticale esce attraverso l’anastomosi (B) o il segmento distale del coledoco (C).
Figura 22. Anastomosi biliodigestiva su ansa montata a “Y” e drenata alla Voelker.
La migrazione dello stent nella VCI sovraepatica è meno frequente. In questo caso, la protesi può essere lasciata in posizione e la sutura si porterà su di essa [31] . Gli autori hanno recentemente riportato un caso di trapianto di fegato eseguito in una giovane donna la cui estremità superiore del TIPS raggiungeva la valvola tricuspide e che ha potuto essere rimossa sotto circolazione extracorporea (CEC) [32]
Trapianto senza conservazione della vena cava inferiore retroepatica
È la tecnica originale descritta da Starzl [1] . La sua applicazione è diventata eccezionale, riservata alle situazioni in cui la VCI retroepatica merita di essere resecata (tumore al contatto, vena cava inferiore, TIPS intracavale). Si differenzia dalla tecnica standard per la necessità di controllare la vena cava retroepatica prima di asportarla con il fegato nativo, di allestire uno shunt venovenoso extracorporeo durante la fase anepatica se si vogliono derivare le aree della vena cava inferiore e splancniche e di includere due anastomosi cavali al momento del reimpianto.
Installazione dello “shunt” venovenoso
Oggi, l’installazione dello shunt venovenoso è eccezionale. Essa anticipa e presume di aver lasciato accessibili i siti di cannulazione durante l’installazione dei teli.
Figura 24. Installazione dello shunt venovenoso extracorporeo. Il momento delicato di questa manovra è l’introduzione della cannula di prelievo del sangue venoso splancnico nella vena porta.
L’accesso delle vene femorale e ascellare può essere realizzato mediante puntura percutanea sotto controllo ecografico o per via diretta. L’arco della vena safena interna destra viene avvicinato nella cavità inguinale destra, mediante un’incisione verticale di 5 cm, tracciata un dito traverso all’interno dell’arteria femorale.
Figura 23. L’endoprotesi (shunt intraepatico transgiugulare [TIPS]) si è incastrata nella parete e persistere nel tentativo di rimuoverla può portare a una lesione venosa irrecuperabile. La vena e la protesi devono essere recise e l’anastomosi deve essere portata al di sopra, come se fosse assente (A, B). VCI: vena cava inferiore; AE: arteria epatica; freccia: TIPS.
Viene messo in attesa su due fili di Nylon® forte che permettono di fissare la cannula dello shunt.
Gli ultimi centimetri della vena basilica e l’origine della vena ascellare vengono esposti attraverso un’incisione orizzontale praticata sul lato interno della radice del braccio sinistro. La vena è sottoaponeutica. Viene accuratamente liberata dagli elementi del plesso brachiale che la circondano sempre a questo livello. Viene liberata dai suoi affluenti per 3-4 cm e poi messa in attesa su due laccetti, montati su tornelli.
Due cannule vengono introdotte rispettivamente nella vena safena destra e nella vena ascellare sinistra alla sua origine. Spinte per 10 cm circa, la loro corretta posizione è confermata dall’esistenza di un reflusso. Entrambe vengono accuratamente fissate, sciacquate con soluzione fisiologica tiepida e poi clampate in attesa di essere collegate al circuito extracorporeo.
La cannula portale può essere inserita nella vena mesenterica inferiore (VMI) e spinta nella vena porta. La posizione della sua estremità prossimale viene controllata per consentire il clampaggio della vena porta sopra. Può anche essere posizionata direttamente nella vena porta. La manovra di introduzione della cannula portale è caratterizzata dal rischio di lasciarsi scappare la vena. Per evitare questo incidente, si procede in tre fasi (Fig. 24):
• il tronco portale viene serrato all’origine e poi sezionato a livello della sua biforcazione, con i rami destro e sinistro legati con filo di Nylon® lasciato in attesa;
• in esso viene introdotta una cannula serrata alla sua estremità distale fino a battere contro la clamp; un tornello assicura la cannula;
• la clamp portale viene aperta, con il tornello, tenuto stretto, che non impedisce di spingere la cannula di soli 5 cm, in modo che la sua estremità sia a livello della confluenza splenomesaraica. La vena viene poi fissata saldamente alla cannula utilizzando un filo di Nylon® forte. Quest’ultimo viene liberato dall’aria. Le estremità distali delle cannule safena e porta vengono unite mediante un connettore a “Y”. Questo connettore e la cannula ascellare sono collegati a entrambe le estremità del circuito extracorporeo che passa dietro il secondo assistente, in cui la testa della pompa è collegata al suo motore.
Tutte le clamp vengono aperte e la pompa viene attivata.
Controllo della vena cava sopra e sotto il fegato
Il legamento falciforme viene reciso all’origine dei foglietti anteriori dei legamenti triangolari destro e sinistro. La trazione esercitata sul fegato sollecita la vena cava sovraepatica. A questo punto si vede il bordo esterno della vena epatica destra. È rimanendo a contatto con esso che si trova il piano di dissecazione
della faccia posteriore della VCI, staccato di tre quarti da questo lato, con l’aiuto di un dissettore a punta mozza. L’aggiramento della vena cava sovraepatica si completa passando per il suo lato sinistro. La sezione del piccolo epiploon consente l’accesso alla superficie posteriore della VCI e di ricongiungersi al piano della dissecazione iniziata a destra. La VCI sovraepatica viene messa in attesa con un laccio.
La VCI sottoepatica, esposta reclinando la cannula portale a sinistra, si presenta attraverso la sua superficie anteriore. Dopo aver liberato il peritoneo che la ricopre, viene aggirata a questo livello, utilizzando il dissettore a punta mozza, rimanendo in buon contatto con la sua parete in modo da non perdere il piano di dissecazione. Al suo bordo sinistro, si passa sopra l’impianto della vena renale sinistra. Questa viene messa su laccio.
Resezione epatica nativa
Il fegato deve prima essere liberato dai suoi attacchi posteriori destri. Questa fase è facile quando il parenchima epatico è devascolarizzato (Fig. 25).
I foglietti anteriore e posteriore del legamento triangolare destro vengono sezionati mediante elettrocauterizzazione, rimanendo a filo con la capsula epatica. Il lobo destro, rilasciato gradualmente, viene inclinato a sinistra. Questa manovra dà accesso alla VCI retroepatica di cui vengono liberati il fianco destro e poi la faccia posteriore. In basso, questa manovra è possibile solo dopo aver sezionato la vena surrenale destra tra due legature.
La vena cava sovraepatica viene clampata utilizzando una clamp vascolare lunga e solida (tipo De Bakey, Codman® ) che afferra il diaframma. La presenza del pilastro destro del diaframma conferisce all’asse di clampaggio una direzione obliqua. La vena cava sottoepatica viene clampata perpendicolarmente al suo asse e su un piano frontale mediante una clamp più sottile, sufficientemente corta da entrare nella cavità addominale (tipo De Bakey, Codman® ). I due anelli di ciascuna clamp sono fissati da un robusto filo metallico, per impedirne l’apertura accidentale durante l’impianto dell’innesto.
La vena cava sovraepatica è sezionata 1 cm a monte dell’impianto delle vene epatiche per mantenere un moncone sufficiente, facile da anastomizzare. Non bisogna esitare a incidere il parenchima epatico per soddisfare questo requisito.
Inserendo il dito medio della mano sinistra nella vena cava retroepatica, l’operatore solleva il fegato e lo inclina verso destra. La vena cava retroepatica viene separata dal lobo di Spiegel per 2 cm prima di essere sezionata.
L’emostasi del letto di scollamento della VCI retroepatica si ottiene utilizzando una sutura a punti continui oppure tre o quattro punti a cornice.
Impianto cavale dell’innesto
Il moncone cavale sottodiaframmatico viene liberato dal tessuto epatico circostante. L’ultimo centimetro delle vene epatiche
Figura 25. Exeresi del fegato nativo con il suo segmento di vena cava.
A. Emostasi del letto di resezione della vena cava inferiore.
B. Emostasi della superficie d’inserzione del legamento triangolare destro.
Figura 26. Plastica d’ingrandimento del moncone distale della vena cava inferiore utilizzando gli osti delle vene epatiche.
destra, media e sinistra si collega al suo fianco destro e alla sua faccia anteriore. Il ponte di parete venosa che le separa dalla vena cava viene caricato su un dissettore e poi sezionato al centro. Questa plastica di ingrandimento facilita la realizzazione dell’anastomosi cavale sovraepatica (Fig. 26). La vena cava sottoepatica viene preparata obliterando gli orifizi di impianto delle vene del settore dorsale del fegato che sono state recise durante l’exeresi del fegato nativo.
La realizzazione dell’anastomosi cavale sovraepatica richiede una perfetta esposizione. Dopo aver superato i punti d’angolo destro e sinistro della linea di sutura, l’innesto viene introdotto nell’ipocondrio destro. Con la mano sinistra, il primo assistente lo spinge in fondo alla sua loggia mentre lo abbassa per esporre l’area dell’anastomosi. Con la mano destra, tiene la sutura. Per questa anastomosi, viene utilizzata una sutura monofilamento 4/0 non riassorbibile. Il piano posteriore viene realizzato per primo per via anteriore, partendo dall’angolo sinistro. I punti comprendono un ampio spessore di vena e sono evertenti, applicando ciascun margine dell’intima l’uno contro l’altro (Fig. 27) e, quando viene raggiunto il centro della faccia anteriore, si utilizza l’altro capo per finire l’anastomosi.
L’anastomosi della vena cava sottoepatica viene eseguita con una sutura 4/0 non riassorbibile utilizzando la stessa tecnica della precedente: la vena cava dal lato ricevente è talvolta troppo lunga e in questo caso deve essere recisa. I punti d’angolo sono messi a posto e sotto tensione per garantire l’assenza di twist dal lato dell’innesto. Durante la realizzazione della sutura, il fegato viene
EMC - Tecniche chirurgiche - Addominale
27. Preparazione dell’anastomosi cava sovraepatica. La sutura del piano posteriore, effettuata attraverso il piano anteriore, fa un effetto “materasso”.
lavato per via portale, utilizzando una soluzione (1 litro) di albumina umana diluita al 4%, fredda oppure no. Il risciacquo viene interrotto contemporaneamente alla chiusura dell’anastomosi.
Trapianto combinato e simultaneo del fegato e di un altro viscere
È una situazione sempre più frequente dopo la spettacolare osservazione di un trapianto di cuore-fegato, eseguito nel febbraio 1984 dall’equipe Starzl sulla persona di Stormy Jones [33] . Da allora, si sono moltiplicati gli esempi di trapianti di fegato associati a quello di altri visceri, siano essi trapianti doppi (fegato-rene) [34] , tripli (fegato-cuore-polmoni) [35] o trapianti in monoblocco, del fegato e di un segmento più o meno grande del tubo digerente. Questi ultimi, chiamati a “grappolo” (cluster operation), poiché tutti gli organi che costituiscono l’innesto sono contigui allo stesso tronco vascolare, hanno indicazioni limitate [33, 36] .
Trapianti doppi o tripli
Il trapianto di fegato viene eseguito secondo la tecnica descritta sopra, immediatamente prima dell’innesto ad esso associato o dopo. La scelta dell’ordine di impianto dell’innesto è determinata dalla resistenza all’ischemia fredda e dalla tolleranza ai disturbi emodinamici nella fase anepatica.
In tal modo:
• in caso di doppio trapianto fegato-rene, è meglio trapiantare prima il fegato, che ha una tolleranza all’ischemia fredda più breve rispetto al rene. Inoltre, l’interruzione del flusso della vena cava durante la fase anepatica potrebbe essere causa di una compromissione della funzionalità del trapianto renale, se fosse impiantato prima del fegato. Il rene viene impiantato per via convenzionale, iliaca retroperitoneale, dopo aver richiuso l’incisione epatica;
• durante un trapianto fegato-cuore o fegato-cuore-polmone, è necessario iniziare con l’impianto degli organi toracici la cui tolleranza all’ischemia fredda è molto più breve di quella del fegato (da 4 a 6 ore rispetto a 12 ore).
Trapianti a “grappolo” o “cluster operation”
Bisogna considerare due situazioni radicalmente diverse. Trapianto di fegato e del blocco duodenopancreatico
L’indicazione viene generalmente posta per il trattamento di un tumore maligno epatico o pancreatico a sviluppo regionale, la cui asportazione radicale comporta lo svuotamento del piano sovrameso-colico comprendente fegato, pancreas, stomaco, milza e talvolta colon trasverso.
Figura 28. Trapianto del blocco fegato-pancreas o cluster operation L’anastomosi cavale è di tipo laterolaterale o classica (doppia). A livello del peduncolo, l’anastomosi venosa si porta tra le vene mesenteriche superiori del ricevente e dell’innesto. Viene impiantato un patch di aorta che comprende tronco celiaco e arteria mesenterica superiore sulla faccia anteriore dell’aorta del ricevente. La continuità esofagodigiunale viene ristabilita utilizzando un’ansa montata a “Y”.
L’innesto comprende il fegato e il blocco duodenopancreatico. Il suo peduncolo afferente è doppio, costituito dal tronco arterioso celiacomesenterico prelevato da un ampio patch d’aorta e di vena mesenterica superiore, reciso al margine inferiore dell’istmo pancreatico. Il ritorno venoso avviene nella vena cava adiacente al fegato, attraverso le vene epatiche.
L’impianto dell’innesto inizia con l’impianto cavale. Dato l’ingombro causato dall’innesto, la seconda anastomosi è l’anastomosi arteriosa tra il patch aortico che contiene il tronco celiacomesenterico dal lato dell’innesto e la faccia anteriore dell’aorta celiaca oppure la biforcazione arteria splenica-arteria epatica comune del ricevente.
È solo quando l’anastomosi arteriosa è completata che la VMS del ricevente viene impiantata su quella dell’innesto, in modalità terminoterminale.
Il ripristino della continuità digestiva si ottiene utilizzando la prima ansa digiunale che drena successivamente il secondo duodeno dal lato dell’innesto e poi lo stomaco (Fig. 28).
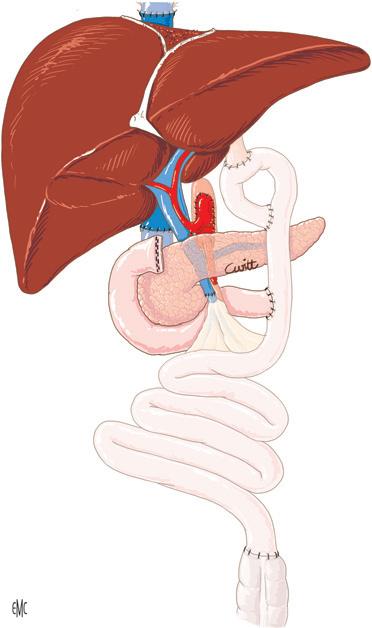
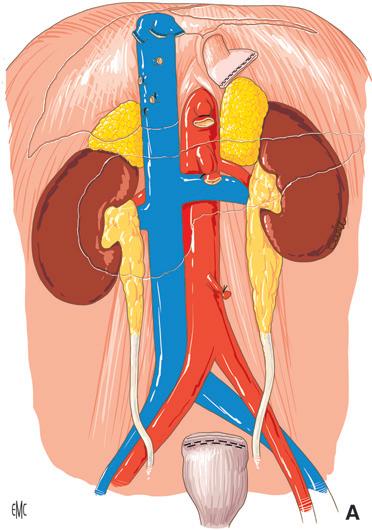
Trapianto di fegato, pancreas e intero apparato digerente È stato Starzl a riportare per primo questo tipo di trapianto [37] Il trapianto comprende i due terzi dello stomaco, il fegato, il blocco duodenopancreatico, tutto l’intestino tenue e talvolta il colon. Questo innesto “multiviscerale” viene perfuso unicamente attraverso il tronco arterioso celiacomesenterico prelevato da un ampio patch aortico e drena nel segmento di vena cava prelevato con il fegato. Il peduncolo epatico è intatto.
La prima fase dell’operazione consiste nell’eviscerazione intraperitoneale, cercando di mantenere la continuità della vena cava. I limiti superiore e inferiore dell’exeresi digestiva sono determinati dalle possibilità di drenaggio venoso dei restanti segmenti. In basso, la sezione del colon passa a filo del riflesso e, in alto, la sezione gastrica si appoggia sul cardias, lasciando un collarino gastrico intorno all’esofago (Fig. 29A).
Figura
L’impianto dell’innesto comprende successivamente:
• l’impianto del tronco celiacomesenterico sulla faccia anteriore dell’aorta e poi quello della vena cava sovraepatica sulla faccia anteriore della VCI mediante la tecnica del piggyback;
• il ripristino della continuità digestiva, impiantando l’esofago del ricevente sulla faccia anteriore della cavità gastrica dell’innesto. La continenza gastroesofagea viene ripristinata mediante una plastica anteriore secondo Nissen. Una piloroplastica assicura il corretto svuotamento dell’innesto denervato;
• l’apertura cutanea dell’estremità inferiore del segmento digestivo per fornire un facile accesso alle biopsie iterative, essenziali per il monitoraggio dell’innesto (Fig. 29B).
Trapianto ortotopico di un emifegato
Il trapianto di un emifegato adulto generato dalla bipartizione di un intero fegato o dal prelievo da un donatore vivente, inizialmente concepito per trovare una soluzione alla drammatica carenza di trapianti di fegato pediatrici [2] , è oggi un mezzo per gestire la carenza di trapianti nella popolazione adulta. Il ricorso a un donatore vivente è eccezionale in Francia.
Trapianto di emi-innesti prelevati da donatore cadavere
La dissecazione del fegato di un donatore in morte cerebrale può essere eseguita in situ a cuore pulsante o ex situ. Ogni fegato genera potenzialmente due innesti. Può essere un emifegato destro e sinistro o un lobo destro e un lobo sinistro. La scelta dell’innesto dipende dalle anomalie di distribuzione vascolare riscontrate, la maggior parte delle quali è stata smembrata da Couinaud e Houssin [3] . Dipende anche dal peso del destinatario. La regola d’oro per il ricevente è rispettare un rapporto peso innesto/peso ricevente maggiore o uguale allo 0,8% [5]
La sezione in situ, “a cuore pulsante”, del parenchima epatico ha il notevole vantaggio di generare innesti in cui l’emostasi delle fette viene acquisita prima del reimpianto. Lo svantaggio è che questa epatotomia può essere difficile in un donatore con scarsa emostasi, la cui emodinamica è labile.
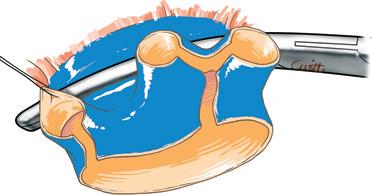
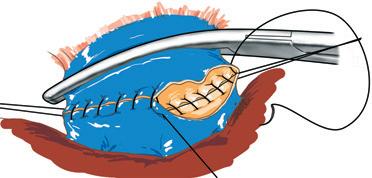
Bipartizione fegato destro-lobo sinistro (Fig. 30)
La linea di sezione parenchimale passa a destra della scissura ombelicale, segue il fianco destro del peduncolo glissoniano sini-
Figura 29. Trapianto multiviscerale.
A. Exenterazione addominale in preparazione dell’impianto di un blocco viscerale.
B. Innesto viscerale in sede. L’innesto ha comportato due anastomosi vascolari: vena cava inferiore e poi asse arterioso celiomesenterico.
L’esofago viene inserito nella tasca gastrica dell’innesto. Ileostomia terminale che dà accesso alle biopsie necessarie per la diagnosi precoce del rigetto.
stro e raggiunge il solco di Arantius. Vengono dunque separati due emifegati.
L’innesto sinistro è un lobo sinistro (segmenti II e III) drenato dalla vena epatica sinistra recisa a filo con il tronco comune che condivide con la vena epatica media.
L’intera lunghezza dell’arteria epatica e della vena porta viene assegnata ad esso, se richiesto dall’equipe di trapianto del lobo sinistro. La via biliare è limitata al dotto epatico sinistro perché la via biliare principale è vascolarizzata da rami provenienti dal ramo destro dell’arteria epatica (che va all’innesto destro).
Questo lobo sinistro è destinato a un bambino piccolo. È “agganciato” alla faccia anteriore della vena cava del ricevente mediante un’anastomosi epaticocavale terminolaterale. L’ostio del tronco comune delle vene epatiche media e sinistra sul lato ricevente è un sito perfetto per il reimpianto sovraepatico. Può essere clampato selettivamente, il che consente di eseguire l’anastomosi a flusso cavale conservato. L’impianto delle arterie e delle vene portali non pone particolari problemi a parte il loro piccolo calibro quando la distribuzione vascolare è modale. La via biliare del ricevente è troppo corta e troppo piccola per consentire un’anastomosi diretta. Meglio derivare il dotto epatico sinistro dell’innesto su un’ansa digiunale montata a “Y”.
Molte equipe liberano l’innesto destro dalla parte sinistra del segmento I (settore dorsale). Rimane quindi un innesto destro costituito dai segmenti IV, V, VI, VII e VIII (e della parte destra del settore dorsale). Questo innesto è destinato a un adulto. Il suo drenaggio venoso è fornito dalle vene epatiche destre (per il settore posterolaterale) e media (per il settore paramediano). Queste due vene sono in continuità con la VCI retroepatica rimasta con questo innesto. L’ostio della vena sovraepatica sinistra, reciso a filo con il suo impianto nel tronco comune delle vene media e sinistra, viene chiuso lungo un asse perpendicolare alla VCI. Il segmento IV (le cui afferenze arteriose e portali sono rimaste sul lato sinistro dell’innesto) si atrofizza nel giro di poche settimane. È inutile volerlo asportare (Fig. 31).
Il peduncolo vascolare afferente comprende i rami destri della vena porta e dell’arteria epatica. Il dotto epatico destro viene spesso lasciato in continuità con il dotto biliare principale, la cui vascolarizzazione dipende principalmente dal ramo destro dell’arteria epatica.
L’impianto di questo innesto non comporta grosse difficoltà. Le vene cave sono idealmente addossate a piggyback [38] La vena porta e l’arteria epatica del ricevente devono essere mantenute il più a lungo possibile; le anastomosi riguardano i rami di destra della vena e dell’arteria. Il ripristino della continuità biliare avviene
EMC - Tecniche chirurgiche - Addominale
Figura 30. Bipartizione fegato destro-lobo sinistro.
A. La linea di sezione parenchimale passa a destra della scissura ombelicale.
B. L’innesto del “lobo sinistro” è costituito dai segmenti II e III. Il segmento I viene resecato. Il suo peduncolo è costituito da un dotto epatico sinistro breve, da un’arteria lunga poiché continua con l’asse celiaco e da una vena lunga poiché è in continuità con il tronco portale. La vena epatica sinistra viene recisa alla sua terminazione sul tronco comune delle vene sinistra e media.
C. L’innesto destro è costituito dai segmenti IV, V, VI, VII e VIII e della parte destra del settore dorsale. Comporta un lungo dotto biliare costituito dal dotto epatico destro e dal coledoco. Il ramo destro della vena porta e l’arteria epatica destra sono corti. La vena cava retroepatica che riceve le vene epatiche destra e media rimane adiacente all’innesto. 1. Vena epatica destra; 2. vena epatica sinistra; 3. vena epatica media.
Figura 31. Innesto costituito da un lobo epatico destro dopo bipartizione lobo destro-lobo sinistro. Si noti l’assenza di vascolarizzazione arterioportale del segmento IV.
attraverso il dotto biliare primario del ricevente o attraverso un’ansa montata a “Y”.
Le anomalie della distribuzione arteriosa e portale destra possono ostacolare notevolmente questo reimpianto. Infatti:
• a livello della vena, solo un’eccezionale assenza di duplicazione portale rende impossibile la bipartizione. L’assenza di una vena porta destra porterebbe nel migliore dei casi a mantenere il tronco portale dalla parte dell’innesto destro, se non ad addossare i rami settoriali anteriore e posteriore a canna di fucile prima dell’impianto;
• a livello dell’arteria, la presenza di un’arteria destra esclusiva derivante dall’AMS semplifica la procedura poiché l’arteria è lunga e il tronco dell’AMS può fungere da patch per la realizzazione di un’anastomosi di buon calibro. La duplicazione arteriosa (un ramo per ogni settore) complica il reimpianto in quanto riduce il calibro dei vasi e aumenta il numero di reimpianti. In questa situazione, quando l’arteria per l’innesto sinistro è singola, si preferisce la continuità arteriosa sul lato destro.
Bipartizione fegato destro-fegato sinistro (Fig. 32)
La sezione parenchimale passa nel piano della scissura portale principale. La questione è quindi sapere quale lato conserva la vena epatica mediana e/o la vena cava.
Lasciare a destra la vena epatica mediana, questo per facilitare il drenaggio dei segmenti VIII e V. Lasciarla a sinistra è favorire il drenaggio del IV segmento, ma è mettersi in una situazione di congestione del settore paramediano destro e di grave emorragia sulla fetta di sezione durante il riposizionamento di questo innesto. Sono presenti delle provvidenziali anomalie anatomiche come l’esistenza a destra di una grossa vena epatica inferiore (e talvolta anche media) che drena il settore paramediano o la presenza di una vena del IV segmento a sinistra che si getta nella vena epatica sinistra. È anche possibile lasciare la vena media a sinistra e ricostruirla sul lato destro impiantando le vene dei segmenti V e VIII in un innesto venoso iliaco.
Piuttosto che lasciare la VCI a uno dei due innesti, molte equipe la separano longitudinalmente in due grandi patch in cui si gettano tutte le vene provenienti dall’innesto interessato. Questa bipartizione cavale ha il vantaggio di potere, a sinistra, mantenere il segmento I e le vene accessorie che lo drenano. Tuttavia, è ovviamente necessario che i suoi peduncoli afferenti, vascolari e biliari siano stati preservati.
La distribuzione delle arterie e dei rami portali obbedisce alle stesse regole menzionate sopra nella bipartizione fegato destrolobo sinistro. Infatti, notevoli difficoltà possono derivare dalle anomalie di distribuzione vascolare, sovraepatica e ancor più arteriosa e biliare, soprattutto quando coesistono a destra e a sinistra. Ciò dimostra l’interesse nell’eseguire una TC con contrasto nel donatore e una colangiografia su tavolo prima di programmare la ripartizione di un fegato.
Caso eccezionale del trapianto con innesto prelevato da un donatore vivente
Questa pratica, molto rara in Francia, è regolamentata molto rigorosamente dalla legge. Il donatore è necessariamente un parente di primo o di secondo grado o un parente stretto legato al ricevente da un legame affettivo forte e duraturo. È in nome di questo legame che può essere accettata la donazione tra coniugi. Esistono quattro tipi di innesti che possono essere prelevati a seconda delle condizioni anatomiche locali, di quanto fegato è necessario lasciare nel donatore e di quanto fegato è necessario per garantire una funzionalità epatica vitale nel ricevente. Prelievo e impianto del fegato destro (segmenti V, VI, VII e VIII). Il fegato destro (segmenti V, VI, VII e VIII) è l’innesto più voluminoso possibile. Si tratta della porzione che di solito viene prelevata nella combinazione donatore adulto-ricevente adulto. La tecnica di questo prelievo e del suo impianto è perfettamente regolata [39]
Nel donatore. L’incisione deve essere la minima possibile. Incisione a J o semplice sottocostale destra. Alcune equipe
propongono un prelievo laparoscopico assistito, che ha il vantaggio di ridurre l’apertura della parete al minimo necessario per l’estrazione dell’innesto. Si succedono poi le seguenti fasi:
• colecistectomia, intubazione del dotto cistico e colangiografia per riconoscere l’anatomia biliare del fegato destro e confermare i dati della risonanza magnetica (RM) biliare preoperatoria;
• mobilizzazione completa del fegato destro e controllo delle vene epatiche più grandi (più di 5 mm di diametro). Un laccetto di gomma viene poi fatto passare intorno alla vena epatica destra e dietro eventuali vene epatiche accessorie media e inferiore. Questo laccetto permette di guidare e fissare il taglio del parenchima epatico “sollevando” il piano della scissura portale principale. Questa manovra di sospensione nota come manovra hanging ha davvero rivoluzionato la separazione dei fegati destro e sinistro [40] ;
• apertura del peduncolo epatico nella metà superiore del suo fianco destro a livello del moncone dell’arteria cistica. L’arteria epatica destra viene rapidamente riconosciuta dietro il dotto epatico comune, accuratamente separata dal suo tessuto e avvolta da un laccio per sollevarla con cautela. La dissecazione si ferma in alto all’origine dei rami anteriore e posteriore e in basso all’inizio del primo dei rami destinati al fegato sinistro. Può essere quello del IV o l’arteria epatica sinistra. Il fianco destro della vena porta si presenta poi facilmente. Il suo ramo destro viene mobilizzato e circondato. Questa manovra è facilitata dalla sezione tra le legature di un piccolo ramo posteriore destinato alla parte destra del settore dorsale del fegato. Il dotto biliare destro, contenuto nello spessore della capsula di Glisson, non viene circondato fino all’apertura del parenchima epatico. L’arteria e la vena porta destinate al fegato destro vengono clampate per alcuni minuti per rivelare la linea di demarcazione dei due fegati, cioè quella che guiderà la sezione del parenchima. Va dal letto vescicolare alla fossa sovraepatica, dove emerge il capo superiore dei lacci della manovra hanging. Altrimenti, si dovrebbero sospettare una distribuzione anomala del peduncolo o un controllo incompleto dei rami portali destinati al fegato destro. Tutto è pronto per passare alla fase di taglio del parenchima.
La sezione del fegato è realizzata nel piano della scissura portale principale. La vena epatica media viene solitamente lasciata al donatore per non compromettere il drenaggio del segmento IV.
Il parenchima inizia a livello del lobo di Spiegel dietro il peduncolo epatico. Lì, il processo caudato, depressione più o meno marcata, mostra il punto della sezione che viene eseguita fino al contatto con la capsula di Glisson. Il capo inferiore dei laccetti sospensori può essere impegnato in corrispondenza del suo punto di emergenza inferiore nella trincea così scavata.
La sezione parenchimale ricomincia quindi a livello della fossa sovraepatica nel punto di emergenza del capo superiore dei laccetti sospensori, contro il fianco destro della vena epatica media, poi viene condotta dal basso verso l’alto e da davanti a dietro. Il tetto della convergenza viene rapidamente scoperto, consentendo di recuperare il capo inferiore dei laccetti sospensori da dietro. I due capi sollevati ormai danno la profondità e la direzione del piano che occorre aprire. Questa fase espone le vene originate dai
Figura 32. Bipartizione fegato destro-fegato sinistro.
A. La linea di sezione parenchimale passa nel piano della scissura portale principale.
B. La vena epatica media viene lasciata a destra, assicurando il drenaggio del settore paramediano destro.
segmenti V e VIII che devono essere sezionate tra legature sostenute e marcate. Completata la sezione parenchimale, i due fegati vengono separati. L’innesto rimane attaccato attraverso il peduncolo afferente e le vene epatiche destre. Prima di procedere alla fase successiva, occorre accertarsi che l’epatectomia eseguita contemporaneamente sul ricevente si svolga senza incidenti che possano mettere in discussione la prosecuzione del trapianto.
La sezione dei dotti biliari destri viene eseguita nello spessore della placca ilare con grande cautela. L’area della sezione è stretta. Troppo a sinistra, danneggerebbe la via biliare del donatore. Troppo a destra, accorcerebbe la via destra e moltiplicherebbe i dotti dell’innesto. Un nuovo controllo colangiografico e l’identificazione della linea di taglio biliare mediante una clamp sono utili per rendere sicuro questo momento delicato.
La deafferentazione dell’innesto viene eseguita solo quando il ricevente è pronto a riceverlo. Poi si susseguono rapidamente per ridurre la durata dell’ischemia calda:
• la sezione dell’arteria a valle di una clamp vascolare. Legatura sostenuta del moncone a monte;
• la sezione della vena porta destra a valle di una clamp vascolare, la cui regolazione deve aver cura di risparmiare la lunghezza dal lato dell’innesto senza limitare il calibro del ramo sinistro;
• la sezione delle vene epatiche destre a monte di una clamp vascolare o, meglio perché molto sicura, a monte di una fila di graffette vascolari.
L’innesto viene portato su un tavolo di dissecazione, perfuso e lavato dalla vena porta con una soluzione di conservazione refrigerata. L’arteria non deve essere sciacquata per evitare di traumatizzarla. I dotti biliari settoriali vengono sciacquati. Le vene drenanti dei segmenti V e VIII vengono eventualmente reimpiantate in una protesi vascolare (o in un segmento di vena ombelicale prelevato dal ricevente) per garantire un buon drenaggio del settore anteriore. L’innesto viene pesato e poi confezionato in ambiente sterile, immerso nella sua soluzione di conservazione prima di essere trasferito nella stanza del ricevente:
• la chiusura della vena porta con una sutura “andata e ritorno”;
• la chiusura degli orifizi biliari. La tenuta stagna di questa riparazione viene controllata iniettando del blu di metilene o del siero trasparente. Il drenaggio cistico viene rimosso;
• il fissaggio del fegato sinistro al diaframma attraverso il suo legamento sospensore quando è stato reciso;
• dopo un ultimo giro di emostasi e biliostasi sulla sezione di epatectomia, la cavità addominale viene richiusa. Nel ricevente. La rimozione del fegato nativo è guidata dagli stessi principi di quando il trapianto viene eseguito a partire da un fegato intero. La particolarità e la difficoltà in questa situazione sono che gli elementi del peduncolo devono essere conservati il più a lungo possibile. Anche in questo caso, è consigliabile essere sistematici e concatenare con attenzione le fasi successive. Dissecazione del peduncolo epatico. La prima fase è a destra del peduncolo epatico:
• dissecazione del triangolo di Calot i cui elementi sono sezionati tra legature. Il moncone dell’arteria cistica dà la direzione da seguire per trovare il ramo destro dell’arteria epatica;
• bypass del dotto biliare principale e sezione molto in alto nella placca, al limite oppure oltre la convergenza. Il dotto biliare viene allora rilasciato dall’alto verso il basso per esporre la faccia anteriore del peduncolo, in particolare la biforcazione dell’arteria epatica e il suo ramo destro;
• liberazione dell’arteria epatica propria e dei suoi rami destro e sinistro per quanto possibile. L’arteria epatica destra viene sezionata a livello della sua biforcazione in rami settoriali;
• liberazione della vena porta dal suo tessuto linfatico e dissecazione il più lontano possibile dall’ilo. Sezione dei suoi rami destro e sinistro.
La preparazione di un’anastomosi portocavale temporanea è sempre preferibile quando la lunghezza della vena porta lo consente. Le fasi successive sono riservate all’escissione del fegato malato pur mantenendo la VCI. Non sono specifiche e sono state descritte nei capitoli precedenti.
L’innesto viene posizionato nell’ipocondrio destro. Si succedono:
• l’impianto delle vene epatiche sul fianco destro della VCI del ricevente sull’ostio della vena epatica destra del ricevente allargato verso il basso. Queste anastomosi terminolaterali devono essere larghe;
• l’impianto della vena porta, terminoterminale sul ramo destro o sul tronco portale del ricevente, da regolare tra tensione e plicatura;
• la restituzione del flusso portale e la rivascolarizzazione dell’innesto che segna la fine della durata dell’ischemia e della fase anepatica;
• l’impianto arterioso sul ramo destro dell’arteria epatica. Questa anastomosi viene eseguita meglio al microscopio;
• la ricostruzione biliare è la fase più difficile. Viene eseguita su un’ansa montata a Y o sul dotto biliare principale del ricevente. La scelta tra questi due siti dipende dalla qualità e dalla complessità anatomica delle vie biliari dell’innesto. Un singolo canale è facilmente reimpiantato sul dotto epatico del ricevente. Quando ci sono due o anche tre canali separati, bisogna usare l’astuzia e la precisione per trovare dei siti di impianto del giusto calibro. Questa ricostruzione biliare è il tallone d’Achille del trapianto da donatore vivente apparentato. È spesso complicata da perdite o stenosi, il cui difficile trattamento richiede dapprima tecniche percutanee o endoscopiche.
Prima della chiusura è indispensabile un ultimo giro di emostasi. Una colangiografia attraverso i drenaggi tutori o il dotto cistico verifica la qualità delle anastomosi, mentre un Doppler verifica la qualità dei flussi venosi e arteriosi.
Prelievo e impianto del settore posteriore destro (segmenti VI e VII). Questo innesto può essere sufficiente in un destinatario sotto i 60 kg. Il suo utilizzo è considerato quando il fegato destro è troppo grande per il ricevente o il donatore, con quest’ultimo a rischio di grave insufficienza epatica. L’arteria e la vena settoriali posteriori vengono isolate. Una volta clampate, segnano la linea di sezione del parenchima. La parenchimotomia viene eseguita su un piano orizzontale, davanti alla vena epatica destra e al suo livello [41] L’impianto non pone particolari problemi a parte il piccolo calibro dei vasi del peduncolo afferente. L’uso della microchirurgia garantisce la qualità dell’anastomosi arteriosa. Il dotto biliare settoriale posteriore, di calibro molto piccolo, viene impiantato sul dotto biliare comune o sul dotto cistico. Un’anastomosi biliodigestiva su ansa montata a Y è possibile quando il dotto biliare del ricevente non è utilizzabile.
Rimozione e impianto di un innesto sinistro. Il lobo sinistro (segmenti II e III) e il fegato sinistro (segmenti II, III, IV) con o senza il segmento I sono riservati ai bambini o agli adulti di piccolo peso. Il prelievo si effettua tramite una breve laparotomia o, spesso oggi, per via laparoscopica.
Negli adulti, è stato proposto di impiantare il fegato sinistro a destra, dal basso verso l’alto, per consentirgli di trovare una base stabile nel fondo dell’ipocondrio destro. È questa tecnica chiamata flip-flop che l’equipe dell’Asan Medical Center in Corea del Sud ha utilizzato per realizzare una serie di doppi trapianti da donatore vivente. Due fegati sinistri, prelevati rispettivamente da due membri della famiglia, sono stati impiantati in un ricevente adulto. Questa tecnica riduceva il rischio di prelievo da ciascuno dei due
donatori e forniva al ricevente un volume epatico compatibile con la rapida ripresa di una funzione postoperatoria [42]
Trapianto ausiliario
Per trapianto epatico ausiliario (TEA) si intendono tutte le tecniche che consistono nell’impianto di un innesto di fegato nella cavità addominale, lasciando in sede tutto il fegato nativo o una sua parte.
Storicamente, l’applicazione clinica del TEA ha preceduto quella del TEO [43] . Era infatti un mezzo per evitare l’escissione irreversibile del fegato nativo e la fase anepatica [44] con conseguenze emodinamiche e metaboliche mal controllate. All’inizio degli anni ’80, la perfetta padronanza di queste due insidie e l’eccellente controllo della tolleranza immunologica dell’innesto hanno reso necessario il TEO. Sono l’irreversibilità del TEO e l’importanza degli effetti collaterali dell’immunosoppressione a lungo termine che spiegano il rinnovato interesse per il TEA, in particolare nei giovani pazienti con grave insufficienza epatica acuta. La necrosi epatica acuta, indipendentemente dalla sua origine, è stata a lungo l’indicazione preferita del TEO convenzionale [45] ; tuttavia, la rimozione del fegato nativo necrotico e la sua sostituzione con un trapianto negano le possibilità di rigenerazione del fegato nativo. Tuttavia, questo processo è possibile, come evidenziato dall’evoluzione di alcuni casi verso il recupero spontaneo senza sequele e la presenza costante, all’interno dei fegati necrotici, di pochi epatociti residui vitali, potenziale punto di partenza per la rigenerazione [46] Il TEA, ripristinando la normale funzionalità epatica, garantisce la sopravvivenza del paziente e dà al fegato nativo il tempo di rigenerarsi. Numerose osservazioni hanno confermato questi concetti, con un tasso di sopravvivenza globale di circa il 65% e un tasso di recupero tramite rigenerazione del fegato nativo di oltre il 50% [47] . Il TEA ha trovato più recentemente un campo di applicazione nel trattamento delle malattie metaboliche ereditarie dovute a deficit enzimatico di origine epatica [47] Queste condizioni colpiscono principalmente i bambini e sono indicazioni riconosciute per il trapianto di fegato convenzionale. L’escissione totale di un fegato macroscopicamente sano, che normalmente svolge quasi tutte le sue funzioni, incoraggia a ritardare l’indicazione al trapianto nella fase in cui le conseguenze della carenza enzimatica sono pericolose per la vita e alla fine oscurano quelle del trapianto. L’impianto di un innesto ausiliario consente di correggere precocemente il deficit enzimatico nel corso della malattia, salvaguardando la funzionalità epatica propria, vera e propria ruota di scorta in caso di rigetto dell’innesto. In questa indicazione sono state riportate solo poche osservazioni di TEA, per il trattamento delle sindromi di Crigler-Najjar [47]
Principi generali
Le tecniche di TEA sono solo la combinazione di fasi operatorie prese in prestito dalle tecniche di prelievo e trapianto del fegato. Queste sono già state descritte in questo capitolo. Sono possibili due tipi di trapianti ausiliari:
• il TEA eterotopico (TEAE), che ha il vantaggio di non alterare l’integrità del fegato nativo, ma che pone l’innesto in posizione non fisiologica, sotto il fegato nativo, nella pratica non viene più effettuato;
• il preferito è il TEA ortotopico (TEAO), che pone l’innesto in situazione fisiologica, facilitandone il drenaggio venoso, ma che richiede l’amputazione di parte del fegato nativo, gesto che determina un aumento della morbilità.
Il trapianto ausiliario utilizza un innesto ridotto per evitare gli ingombri causati dalla presenza di due fegati. La compressione dell’innesto durante la chiusura è infatti una delle principali cause di fallimento. Possono essere utilizzati tutti i tipi di innesti ridotti: settore posteriore, fegato destro, fegato sinistro o lobo sinistro. Sono prelevati da un soggetto vivo o in stato di morte encefalica, preparati in situ o ex vivo. Tuttavia, nell’epatite fulminante, la necessità di fornire una massa parenchimale sufficiente per trattare l’edema cerebrale porta all’uso dell’innesto più grande. Negli adulti, la preferenza degli autori è per il fegato destro. Nei bambini,

un fegato destro di donatore adulto (situazione più frequente) non potrebbe trovare posto in una piccola cavità addominale, anche dopo epatectomia destra. Bisogna fare un innesto sinistro. La durata dell’ischemia fredda deve essere quanto più breve possibile per non amputare la funzione di un innesto di volume già ridotto e per ripristinare il più rapidamente possibile la funzionalità epatica ottimale in un ricevente con una condizione neurologica spesso precaria.
Sono quindi auspicabili due equipe formate: l’equipe di raccolta si occupa del prelievo e della preparazione del fegato, mentre l’equipe di trapianto prepara il sito di impianto.
Principi dell’impianto
La via d’accesso è quella di un trapianto di fegato standard, trasversale con fenditura verso il processo xifoideo.
L’impianto ortotopico di un innesto ausiliario impone l’esecuzione di un’epatectomia sinistra o destra. Qualunque sia l’opzione scelta, il clampaggio totale del peduncolo portale nativo deve essere evitato per non aumentare la sofferenza epatocitaria. Per fare ciò, si eseguono le epatectomie previa dissecazione e clampaggio selettivo dei peduncoli destro o sinistro e si eseguono le anastomosi venose, portale o cavale, su vasi clampati lateralmente.
L’emostasi deve essere perfetta, sia nelle zone di distacco che sulle fette di epatectomia.
La colecistectomia è sistematica e un drenaggio di Escat introdotto nella via biliare principale attraverso il moncone cistico consente di controllare la biliostasi delle sezioni di epatectomia mediante iniezione intraoperatoria di blu di metilene e costituisce un mezzo semplice e affidabile per monitorare la produzione biliare epatica nativa, produzione strettamente correlata al grado di rigenerazione.
Siti di innesti ortotopici
Un TEAO destro richiede l’esecuzione di un’epatectomia destra [48] . La sezione parenchimale, eseguita sotto clampaggio selettivo dei vasi del peduncolo destro, passa a destra della vena epatica media. La vena epatica destra viene temporaneamente legata. L’epatectomia destra espone quasi l’intera vena cava retroepatica.
Un TEAO sinistro richiede una lobectomia o un’epatectomia sinistra. Nell’esperienza degli autori, è apparso che un’epatectomia sinistra (escissione del segmento IV che passa a destra della vena epatica media) risparmiava un luogo più comodo per l’innesto sinistro e soprattutto un sito di impianto più largo sulla vena cava, poiché non consisteva più solo nell’ostio della vena epatica sinistra, ma nel tronco comune delle vene epatiche sinistra e media.
L’uso di una CEC non è necessario. Tuttavia, è prudente esporre i siti di cannulazione durante l’installazione dei teli chirurgici,
nel caso in cui il TEA sia impossibile (scoperta intraoperatoria di fibrosi epatica) e si converta in TEO. Nulla deve opporsi allo scorrimento del flusso portale e sovraepatico del trapianto. La chiave del successo risiede nella realizzazione di grandi anastomosi vascolari e nella perfetta regolazione della lunghezza dei vasi sovraepatici e della porta.
Indipendentemente dal tipo di impianto ausiliario, il dotto biliare dell’innesto viene drenato attraverso un’ansa digiunale di 50-60 cm, montata a Y. L’anastomosi viene intubata utilizzando un drenaggio perso o, meglio, cateterizzata utilizzando un drenaggio tipo Escat, esteriorizzato ai piedi dell’ansa alla Volker. Questo dispositivo permette di seguire la produzione biliare dell’innesto.
Va ricordato che, in tutti i casi, una perfetta emostasi del sito chirurgico e delle fette di sezione epatica è una condizione essenziale per il successo del trapianto.
Impianti ortotopici
Nella variante sinistra (Fig. 33), gli innesti sono un lobo sinistro o un fegato sinistro.
Per prima cosa vengono impiantati la vena epatica sinistra del lobo sinistro o il tronco comune delle vene epatiche media e sinistra del fegato sinistro. L’anastomosi, di tipo terminolaterale, viene eseguita sul lato sinistro della VCI, o sull’ostio della vena epatica nativa sinistra precedentemente allargata da un taglio in basso o in alto o sull’ostio del tronco comune delle vene epatiche sinistra e media native. Durante la preparazione di queste anastomosi, l’innesto viene risciacquato con la sua soluzione di conservazione.
La vena porta dell’innesto, la cui lunghezza è stata regolata, viene poi impiantata nel fianco sinistro della vena porta nativa. Il clampaggio laterale di quest’ultima è preferibile al clampaggio completo, ma non è sempre possibile. Dopo declampaggio portale e sovraepatico, l’arteria dell’innesto, allungata mediante un segmento di arteria iliaca prelevato dal donatore, viene impiantata sull’aorta celiaca (esposta dall’epatectomia sinistra) o sull’aorta sottorenale.
Nella variante destra (Fig. 34), l’innesto è un fegato destro.
L’estremità prossimale del segmento retroepatico della VCI adiacente viene obliterata utilizzando una sutura di “andata e ritorno” di Prolene® 4/0. La sua estremità distale viene impiantata sul fianco laterale destro della vena cava nativa sull’ostio della vena epatica destra fortemente ingrandita verso il basso. La vena porta e l’arteria dell’innesto vengono successivamente impiantate sul fianco destro della vena porta nativa e sulla faccia anteriore dell’aorta sottorenale. Per quanto riguarda l’innesto sinistro, il dotto biliare viene drenato su un’ansa digiunale montata a Y.
Drenaggi di Redon o una lama vengono posizionati dietro l’anastomosi biliodigestiva. La chiusura viene eseguita dopo aver assicurato il posizionamento favorevole della vena porta dell’innesto e l’assenza di attorcigliamento dell’anastomosi sovraepatica.
Figura 33. Trapianto ausiliario ortotopico sinistro (A-C). L’innesto è un fegato sinistro.
Conclusioni
Il trapianto di fegato è una procedura chirurgica lunga e complicata che viene eseguita in un individuo indebolito dalla lunga evoluzione di una malattia epatica cronica. Per questo motivo, oltre alla sofisticatezza delle tecnologie chirurgiche, il controllo dell’anestesia e quello della rianimazione intraoperatoria rimangono le integrazioni essenziali per il successo di un intervento che, pur dovendo mantenere un ritmo sostenuto, ha perso il suo carattere precipitoso. In queste condizioni, può essere garantita la qualità dell’emostasi e delle anastomosi, che costituisce la migliore prevenzione delle complicanze chirurgiche postoperatorie.
Sotto la pressione creata dalla carenza di innesti, il trapianto di fegato ha intrapreso la strada dei trapianti a partire da innesti condivisi o prelevati da donatore vivente. In quest’ultimo, l’asportazione del fegato destro, l’unico in grado di soddisfare per volume la funzionalità epatica di un ricevente adulto, costituisce un’assunzione di rischi che molti considerano inaccettabile in un Paese come il nostro, dove il prelievo su cadavere potrebbe ancora aumentare.
Sicuramente questo declino sarà fonte di progresso. Infatti, l’adeguamento quasi estemporaneo delle norme di attribuzione dei trapianti alle esigenze della nazione, il più ampio utilizzo di innesti cadaverici condivisi, il miglioramento delle condizioni di conservazione, in particolare l’uso dell’infusione continua e, quindi, l’uso di innesti marginali e di innesti prelevati da donatori a cuore fermo sono strade che le equipe più dinamiche stanno già esplorando.
Allo stesso tempo, il trapianto epatico ausiliario trova un posto nel trattamento delle malattie del fegato, specialmente nel trattamento dell’epatite fulminante o subfulminante. In questo campo, sono in corso studi prospettici per collocare il TEA in relazione con il TEO e per valutare il beneficio di un impianto eterotopico od ortotopico dell’innesto.
Riferimenti bibliografici
[1]Starzl TE. Experience in hepatic transplantation Philadelphia: WB Saunders; 1969.
[2]Bismuth H, Houssin D. Reduced-size orthotopic liver graft in hepatic transplantation in children. Surgery 1984;95:367–70.
[3]Couinaud C, Houssin D. Partition réglée du foie pour transplantation. Contrainte sanatomiques Paris: Masson; 1991.
[4]Gundlach M, Broering D, Topp S, Sterneck M, Rogiers X. Split-cava technique: liver splitting for two adult recipients. Liver Transpl 2000;6:703–6.
[5]Lo CM, Fan ST, Liu CL, Chan JK, Lam BK, Lau GK. Minimum graft size for successful living donor liver transplantation. Transplantation 1999;68:1112–26.
[6]Raia S, Nery JR, Mies S. Liver transplantation from live donors. Lancet 1989;2:497.
[7] Houssel-Debry P, Latournerie M, Rayar M, Jezequel C, Camus C, Sulpice L, et al. Transplantation hépatique chez l’adulte. EMC - Traité de médecine Akos 2018;13(1):1–10.
[8] Kootstra G, Daemen JH, Oomen AP. Categories of non-heart-beating donors. Transplant Proc 1995;27:2893–4.
[9]Rogiers X, Malago M, Habib N, Knoefel WT, Pothmann W, Burdelski M. In situ splitting of the liver in the heart-beating cadaveric organ donor for transplantation in two recipients. Transplantation 1995;59: 1081–3.
[10] Belghiti J, Sauvanet A, Panis Y, Gayet B, Fekete F. Transplantation hépatique sans clampage de la veine cave inférieure. Presse Med 1992;21:569–71.
[11] Shaw BW, Martin DJ, Marquez JM, Kang YG, Bugbee AC, Iwatzuki S. Veno venous bypass in clinical liver transplantation. Ann Surg 1984;200:524–33.
[12] Gunawansa N, McCall JL, Holden A, Plank L, Munn SR. Biliary complications following orthotopic liver transplantation: a 10-year audit. HPB 2011;13:391–9.
[13] Pérez-Saborido B, Pacheco-Sánchez D, Barrera-Rebollo A, Asensio-Díaz E, Pinto-Fuentes P, Sarmentero-Prieto JC. Incidence, management, and results of vascular complications after liver transplantation. Transplant Proc 2011;43:749–50.
[14] Gordon RD, Shaw Jr BW, Iwatzuki S, Todo S, Starzl TE. A simplified technique for revascularization of homografts of the liver with a variant right hepatic artery from superior mesenteric artery. Surg Gynecol Obstet 1985;160:475–6.
[15]Schlegel A, Muller X, Dutkowski P. Hypothermic machine preservation of the liver: state of the art. Curr Transplant Rep 2018;5:93–102.
[16] Tzakis A, Todo S, Starzl TE. Orthotopic liver transplantation with preservation of the inferior vena cava. Ann Surg 1989;210:649–52.
[17]Figueras J, Llado L, Ramos E, Jaurrieta E, Rafecas A, Fabregat J, et al. Temporary portocaval shunt during liver transplantation with vena cava preservation. Results of a prospective randomized study. Liver Transpl 2001;7:904–11.
[18] Rayar M, Levi Sandri GB, Cusumano C, Locher C, Houssel-Debry P, Camus C, et al. Benefits of temporary portocaval shunt during orthotopic liver transplantation with vena cava preservation: A propensity score analysis. Liver Transplant 2017;23:174–83.
[19] Dondéro F, Liddo G, Andraus W, Sommacale D, Sauvanet A, Belghiti J. Left-to-right approachfacilitates total hepatectomy with caval flow preservation. Liver Transplant 2008;14:1380–2.
[20] Tayar C, Klugel MD, Laurent A, Cherqui D. Optimizing outflow in Piggyback liver transplantation without caval occlusion: the three-vein technique. Liver Transplant 2011;17:88–92.
[21] Starzl TE, Iwatsuki S, Shaw Jr BW. A growth factor in fine vascular anastomoses. Surg Gynecol Obstet 1984;159:164–5.
[22] Compagnon P, Sulpice L, Cardon A, De Wailly P, Lakehal M, Thiebot T, et al. Technique des prélèvements multiorganes et de vaisseaux. EMCTechniques chirurgicales - Appareil digestif 2014;9(1):1–16.
[23] Gerunda GE, Merenda R, Neri D, Angeli P, Barbazza F, Valmasoni M, et al. Cavoportal hemitransposition: a successful way to overcome the problemof total portosplenomesenteric thrombosis in liver transplantation. Liver Transpl 2002;8:72–5.
[24] Warner P, Fusai G, Glantzounis GK, Sabin CA, Rolando N, Patch D. Risk factors associated with early hepatic artery thrombosis after orthotopic liver transplantation - univariable and multivariable analysis. Transpl Int 2011;24:401–8.
Figura 34. Trapianto ausiliario ortotopico destro (A-C). L’innesto è un fegato destro.
[25]Oberkofler CE, Reese T, Raptis DA, Kuemmerli C, de Rougemont O, De Oliveira ML, et al. Hepatic artery occlusion in liver transplantation: What counts more, the type of reconstruction or the severity of the recipient’s disease? Liver Transpl 2018;24:790–802.
[26] Krom RA, Kingma LM, Hagasma EB, Wesen-Hagen H, Slooff MJ, Gips CH. Choledochocholedochostomy: a relatively safe procedure in orthotopic liver transplantation. Surgery 1985;97:552–6.
[27]Scatton O, Meunier B, Cherqui D, Boillot O, Sauvanet A, Boudjema K. Randomized trial of choledochocholedochostomy with or without a T tube in orthotopic liver transplantation. Ann Surg 2001;233:432–7.
[28] Weiss S, Schmidt SC, Ulrich F, Pascher A, Schumacher G, Stockmann M. Biliary reconstruction using a side-to-side choledochocholedochostomy with or without T-tube in deceased donor liver transplantation: a prospective randomized trial. Ann Surg 2009;250:766–71.
[29] Patidar KR, Sydnor M, Sanyal AJ. Transjugular portosystemic shunt. Clin Liver Dis 2014;18:853.
[30] Guerrini GP, Pleguezuelo M, Maimone S, Calvaruso V, Xirouchakis E, Patch D, et al. Impact of tips preliver transplantation for the outcome posttransplantation. Am J Transplant 2009;9:192–200.
[31] Meyer C, Odeh M, Herrera JJ, Resende A, Perarnau JM, Ellero B, et al. Orthotopic liver transplantation with a suprahepatic vena caval anastomosis over a transjugular intrahepatic portosystemic shunt. J Am Coll Surg 1998;187:217–27.
[32] Merdrignac A, Jeddou H, Houssel-Debry P, Flecher E, Rayar M, Boudjema K. Venous stent in liver transplant candidates: Dodging the top tip traps. Liver Transpl 2017;23:972–5.
[33]Starzl TE, Bilheimer DW, Bahnson HT, Shaw Jr BW, Hardesty RL, Griffith BP. Heart-liver transplantation in a patient with familial hypercholesterolemia. Lancet 1984;1:1382–3.
[34] Margreiter R, Kramar R, Huber C, Steiner E, Niederwieser D. Combined liver and kidney transplantation. Lancet 1984;1:1077–8.
[35] Wallwork J, Williams R, Calne RY. Transplantation of the liver, heart and lungs for primary biliary cirrhosis and primary pulmonary hypertension. Lancet 1987;2:182–5.
[36] Starzl TE, Todo S, Tzakis A. Abdominal organ cluster transplantation for the treatment of upper abdominal malignancies. Ann Surg 1989; 210:374–86.
[37]Starzl TE, Rowe MI, Todo S, Jaffe R, Tzakis A, Hoffman AL. Transplantation of multi abdominal viscera. JAMA 1989;261:1449–57.
[38] Lerut J, De Ville de Goyet J, Donataccio M, Reding R, Otte JB. Piggyback transplantation with side-to-side cavocavostomy is an ideal technique for right split liver allograft implantation. J Am Coll Surg 1994;179: 573–6.
[39] Trotter JF, Wachs M, Everson GT, Kam I. Adult-to-adult transplantation of the right hepatic lobe from a living donor. N Engl J Med 2002;346:1074–82.
[40] Tzedakis S, Jeddou H, Boudjema K, Gaujoux S. Hanging and modified liver hanging maneuver. J Visc Surg 2020. S1878-7886(20)3022 8-9.
[41] Kokudo T, Hasegawa K, Arita J, Yamamoto S, Kaneko J, Akamatsu N, et al. Use of a right lateral sector graft in living donor liver transplantation is feasible, but special caution is needed with respect to liver anatomy. Am J Transplant 2016;16:1258–65.
[42] Lee SG, Park KM, Hwang S, Lee YJ, Kim KH, Ahn CS. Adult-to-adult living donor liver transplantation at the Asan Medical Center, Korea. Asian J Surg 2002;25:277–84.
[43] Fortner JG, Beatti EJ, Shiu MH, Kawano N, Howland W. Orthotopic and heterotopic liver homografts in man. Ann Surg 1969;172: 24–32.
[44] Rela M, Kaliamoorthy I, Reddy MS. Current status of auxiliary partial orthotopic liver transplantation for acute liver failure. Liver Transpl 2016;22:1265–74.
[45]Bismuth H, Samuel D, Castaing D, Adam A, Saliba F, Johann M. Orthotopic liver transplantation in fulminant and subfulminant hepatitis. The Paul Brousse experience. Ann Surg 1995;222:109–19.
[46] Boudjema K, Jaeck D, Siméoni U, Bientz J, Chenard MP, Brunot P. Temporary auxiliary liver transplantation for subacute liver failure in a child. Lancet 1993;342:778–9.
[47] Whitington PF, Emond JC, Heffron T, Thistlethwaite JR. Orthotopic auxiliary liver transplantation for Crigler-Najjar syndrome type 1. Lancet 1993;2:779–80.
[48] Boudjema K, Cherqui D, Jaeck D, Chenard-Neu MP, Steib A, Freis G. Auxiliary liver transplantation for fulminant and subfulminant hepatic failure. Transplantation 1995;59:218–23.
H. Jeddou (heithem.jeddou@chu-rennes.fr).
S. Tzedakis.
F. Robin.
A. Merdrignac.
P. Houssel.
M. Rayar.
V. Desfourneaux.
D. Bergeat.
M. Lakehal.
L. Sulpice.
K. Boudjema.
Service de chirurgie hépatobiliaire et digestive, Hôpital Pontchaillou, Université de Rennes, 1, rue Henri-Le-Guillou, 35033 Rennes, France.
Ogni riferimento a questo articolo deve portare la menzione: Jeddou H, Tzedakis S, Robin F, Merdrignac A, Houssel P, Rayar M, et al. Tecniche di trapianto di fegato negli adulti. EMC - Tecniche chirurgiche - Addominale 2022;28(1):1-22 [Articolo I – 40-165-B].