Recalibrating the Relevance of Adult Neurogenesis
Jason S. Snyder1,*,@
Conflicting reports about whether adult hippocampal neurogenesis occurs in humans raise questions about its significance for human health and the relevance of animal models. Drawing upon published data, I review species’ neurogenesis rates across the lifespan and propose that accelerated neurodevelopmental timing is consistent with lower rates of neurogenesis in adult primates and humans. Nonetheless, protracted neurogenesis may produce populations of neurons that retain plastic properties for long intervals, and have distinct functions depending on when in the lifespan they were born. With some conceptual recalibration we may therefore be able to reconcile seemingly disparate findings and continue to ask how adult neurogenesis, as studied in animals, is relevant for human health.
The Continuous Controversy of Adult Neurogenesis
While broadly recognized today, the prospect of adult neurogenesis was essentially nonexistent until the 1960s when Joseph Altman reported that neurons continue to be produced throughout adulthood [1,2]. Despite its implications (or perhaps because of them), further research on adult neurogenesis stalled until the 1990s when advances in immunohistochemistry and microscopy enabled the unambiguous identification of birthdated neurons [3] Since then, there have been debates about methodological accuracy, the brain regions that harbor adult neurogenesis, and the species that possess it [4–8], but the general consensus for the past decade has been that neurons are added, in adulthood, to at least one brain region in humans and most mammals: the dentate gyrus (DG) subregion of the hippocampus [9–12]
A recent high profile report, arguing that hippocampal neurogenesis ends in childhood in humans [13], has reignited the controversy [14–20] However, a closer look reveals that this is not the only study reporting that features of neurogenesis, whether stem cells, mitotic cells, or immature neurons, decline to low or absent levels by childhood [21–25]. While methodological factors may contribute to the discrepancies between studies that do and do not observe signs of human adult neurogenesis [15], uncertainty may also stem from more general differences in study design and interpretation [26] For example, human studies that have included fetal and infant subjects often conclude that neurogenesis ends in childhood, but note the occasional sign of neurogenesis in older subjects [13,23–25] Conversely, studies that have solely examined adults report ongoing DG neurogenesis, but at low rates [11,12] Now that a reasonable amount of quantitative data exists for both humans and animals, I attempt here to objectively address the issue by comparing lifelong patterns of DG neurogenesis across rodents, nonhuman primates, and humans. It is worth noting that adult neurogenesis in the subventricular zone–olfactory bulb is well characterized [27], and new neurons have also been described in the adult mammalian neocortex [28] and striatum [29], among other regions [8] However, since too few quantitative datasets exist for these regions for a comprehensive comparison, here I will focus on the DG.
Highlights
Animal work has revealed that immature neurons born in the adult dentate gyrus have key cellular and behavioral functions.
Recent reports are conflicted about whether adult neurogenesis occurs in humans.
Discrepancies could arise from species differences in neurodevelopmental timing and differences in subject ages.
Regardless of its extent, postnatally, an extended period of neurogenesis may produce a heterogeneous population of dentate gyrus neurons, due to prolonged cellular maturation and differences in the stage of the lifespan when neurons are born.
These developments warrant a recalibration of when and how dentate gyrus neurogenesis contributes to cognition and mental health in humans.
1Department of Psychology, Djavad Mowafaghian Centre for Brain Health, University of British Columbia, 2211 Wesbrook Mall, Vancouver, BC V6T 2B5 Canada @Twitter: @jsnsndr
*Correspondence: jasonsnyder@psych.ubc.ca (J.S. Snyder).
Critical Periods and Functional Properties of Adult-Born Neurons
Before continuing, it is important to clarify exactly why we care about adult hippocampal neurogenesis. A comprehensive review of its behavioral functions is beyond the scope of this article, but suffice it to say that animal work has demonstrated that adult neurogenesis is causally involved in many of the functions of the hippocampus. New neurons promote flexible learning and adaptive behavioral and endocrine responses to cognitive and emotional challenges [30–32] The potential relevance for mental health is also substantial since neurogenesis may be involved in many disorders that are known to impact the hippocampus including depression, anxiety, schizophrenia, addiction, epilepsy, age-related memory loss, and dementia [33,34]
Behavioral functions of hippocampal neurogenesis have been identified almost exclusively from rodent studies. One can also turn to cellular properties that speak to function, some of which I will compare across human and animal models. Foundational studies in rodents, particularly mice, have revealed that new neurons progress through discrete stages of maturation into hippocampal circuits [35,36] (Figure 1). Particularly relevant for theories of memory, and hearkening back to classic studies of developing systems, adult-born neurons have a critical period for plasticity and excitability during their immature stages. From 2–6 weeks of age they have a lower threshold for long-term potentiation (LTP) of their cortical inputs, due to the presence of T-type Ca2+ channels, NR2B-containing NMDA receptors and reduced

Figure 1. Neuronal Maturation and Critical Period Properties. Many key maturational steps occur over the first weeks of neuronal life, when adult-born neurons possess unique properties during a critical period. As identified in rodents, during the first few weeks (A) adult-born neurons first receive slow GABAergic signals [36], then (B) depolarizing and trophic GABAergic inputs [44,151], and finally (C) fast GABAergic and glutamatergic synaptic inputs [36] Over this interval they (D) lose expression of the immature neuronal marker, DCX, and gain higher levels of NeuN expression [152] Experience modulates (E) neuronal survival [153], (F) dendritic remodeling [154], and (G) alters long-range GABAergic innervation [49] At 4 weeks of age, new neurons (H) are more efficiently recruited by afferent inputs [155], (I) they have enhanced afferent [40] and (J) efferent [41] synaptic plasticity, and (K) they drive feed-forward inhibition [156] Immature adult-born neurons also (L) receive inputs primarily from the lateral entorhinal cortex [139,140], (M) promote [157] or differentially contribute [43] to feedback/lateral inhibition in the DG, have different functions in memory [158] and have distinct receptive fields during behavior [53] (not shown), although it remains unclear whether these properties are lost as cells mature. It is generally believed that as they mature, adult-born neurons exit these critical periods and become functionally similar to the general population. However, there is evidence that some unique properties persist beyond the traditional critical period, and depend on when in the lifespan a dentate granule neuron was born (see Figure 4). Moreover, rodent studies have revealed that the timeframe of maturation is slowed dramatically with age [98,159] The dial on the left highlights the fact that, while little is known about maturation rates in other species, studies of adult-born neurons in primates and longer-lived mammals [160], and studies of DG growth in humans [111,161], suggest the process is slower. In this way, later-born neurons might provide a substantial source of critical period plasticity for years after their birthdate. Abbrevations: DG, dentate gyrus; LPP, lateral perforant path; MPP, medial perforant path.
2 Trends in Neurosciences, Month Year, Vol. xx, No. yy
Matura on
GABAergic inhibition [37–40]. Adult-born neurons also display enhanced LTP at their efferent synapses onto CA3 pyramidal neurons at 4 weeks of age, relative to 2 and 8 weeks [41] Differential excitation–inhibition properties also cause immature neurons to uniquely respond to, filter, and integrate synaptic inputs [42–45] Structurally, learning and environmental enrichment alter the survival and connectivity of adult-born neurons during defined windows of immaturity [46–50] These unique properties are likely to endow adult-born neurons with distinct roles in sensory processing and memory [51–53] Indeed, behavioral changes arise within weeks after arresting neurogenesis, indicating that these immature neurons are functionally important [54–56] The transient nature of these critical periods, along with evidence that adult-born neurons become broadly comparable to developmentally born neurons [57,58], suggests that neurogenesis ultimately results in a homogeneous population of DG neurons. Some have even proposed that, after a transient period of functional potency, DG neurons become silent with age [59,60] According to this perspective, an early decline in human neurogenesis could imply that there would be no meaningful neurons remaining in adulthood. After comparing neurogenesis rates across species, I therefore review emerging evidence that questions the exclusive and privileged role of immature DG neurons and suggests that some important functional properties are retained beyond the traditional critical window.
How Does Dentate Neurogenesis in Humans Align with Animals?
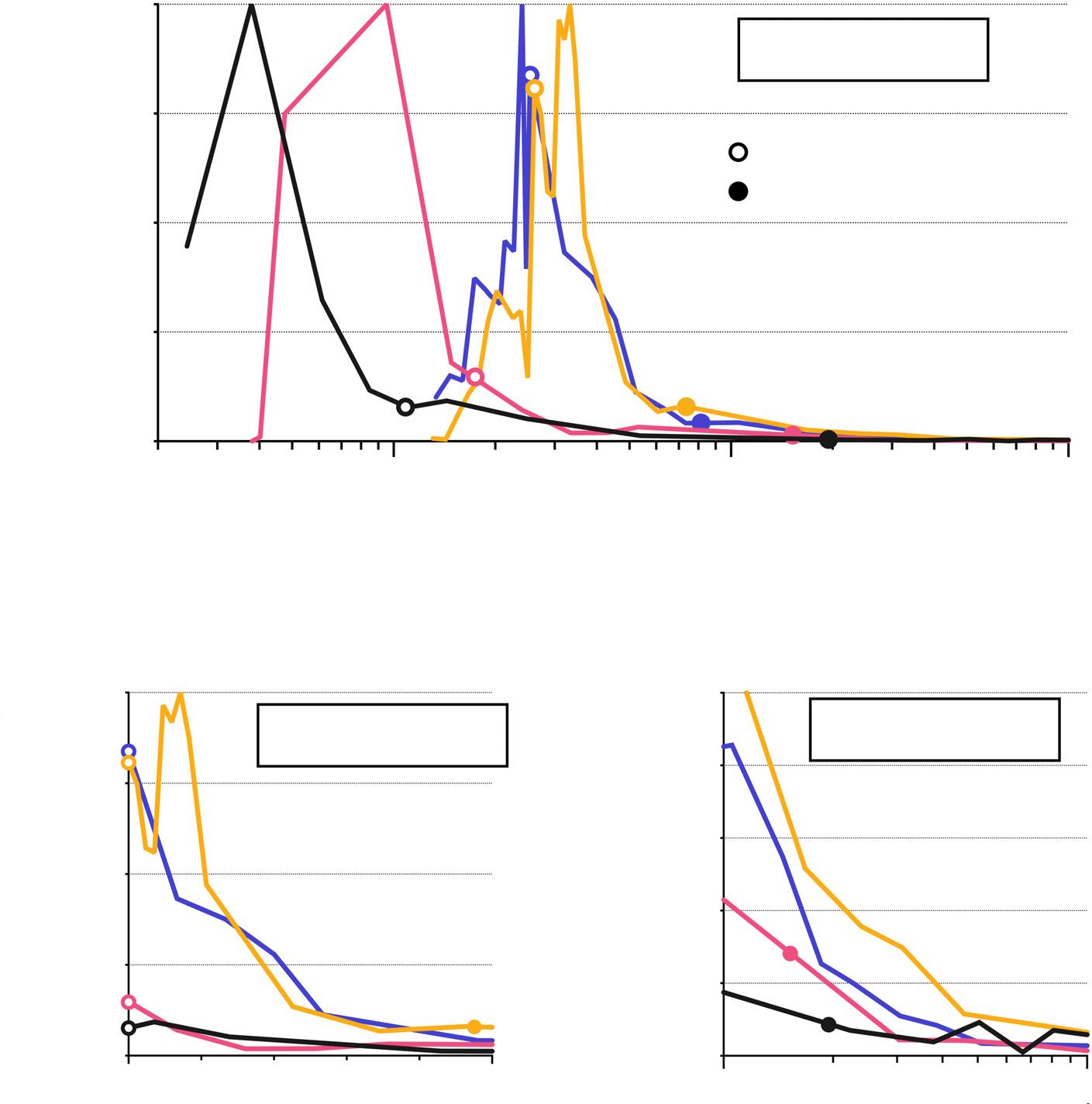
A number of considerations complicate the comparison of neurogenesis across species: neurogenesis declines with age, subject ages vary across studies, and neurodevelopmental timing differs between species. Accordingly, an objective comparison of neurogenesis levels across the full lifespan may help elucidate differences and commonalities between species. To this end, Figure 2 (Key Figure) displays neurogenesis rates from published studies of mice, rats, primates, and humans, plotted alongside each other (see the supplemental information online for details).
The general pattern of neurogenesis is similar across all species: early in life, neurogenesis rapidly rises and falls, and then remains at lower levels for most of the lifespan. However, there are notable species differences in the timing of neurogenesis, particularly with respect to birth. In humans, neurogenesis peaks in the first half of gestation and the DG is mostly formed by birth, consistent with qualitative reports [61] In rodents, neurogenesis peaks later, around the time of birth, and continues at moderate to high levels during the early postnatal period. The picture in rhesus monkeys is intermediate, with 60% of neurons born prenatally and 25% in the first three postnatal months [62] (in marmosets, a similar pre- vs postnatal pattern is observed [63]). The timing of DG neurogenesis is therefore consistent with the broader comparative pattern of neurodevelopment, where humans and nonhuman primates are born with a mature nervous system (at least in terms of cell production) compared to that in rodents [64,65] Thus, defining birth as T0 can be misleading and gives the appearance that neurogenesis is conspicuously low in primates and humans compared to rodents (Figure 2B; y axis still scaled to peak lifetime rates). In contrast, when aligning T0 to the date of conception (Figure 2A), the postnatal differences seem reasonable given the amount of prenatal neurogenesis that occurs in primates and humans. Indeed, a comparative analysis found that neurogenesis rates decline with absolute age and are not proportionally extended in longer-lived mammals [66]. Also, a recent modeling study has suggested that human and animal DG neurogenesis rates are generally consistent with one another once species differences in neurodevelopmental timing are accounted for [19]
DG neurogenesis is often labeled as developmental or adult but these distinctions are typically ill defined (discussed in [67]). Since neurogenesis is continuous, it is reasonable to consider it as a
Key Figure
Human Primate Mouse Rat Dentate gyrus neurogenesis (% max)
Fulllifespan
Birth
Sexual maturity
Concep on
Lifespan
Alignedtobirth10%–100%lifespan
Birth P42, P37,
2.2 y, 2 y, 1.3 y, 3.5 y 25 y, 70 y
Figure 2.
(A) To objectively compare neurogenesis rates, published data of mitotic markers (3H-Thy, BrdU, and Ki67) were used (and extracted from graphs with Plot Digitizer where necessary). Ranges of overlapping ages allowed different studies to be normalized to one another, with peak neurogenesis set at 100%. For mice, studies by Angevine [162], Ben Abdallah et al [163], Mathews et al [164], and Kronenberg et al [165] span the full age range, from the onset of DG neurogenesis at E10 to near the end of the lifespan, at 2 postnatal years. For rats, studies by Schlessinger et al [119], Altman and Das [166], and Kuhn et al [167] span embryonic day 11 to 2.25 postnatal years. For primates (rhesus monkeys), studies by Jabes et al [62] and Ngwenya et al [75] cover the end of the embryonic period (E140) through the majority of postnatal life (up to 25.5 years). There are no quantitative studies (to our knowledge) of prenatal DG development but Rakic and Nowakowski [120] describe a highly neurogenic period from E45 to P32. Since cells that span the width of the granule cell layer are generated from E60 to E120, E90 was designated as an approximate peak of primate DG neurogenesis. Timepoints before (E45) and after (E140) were adjusted to produce a curve where 40% of DG neurons are generated postnatally in 7year-old monkeys [78] For humans, studies by Yang et al [168], Sorrells et al [13], Seress et al [23], and Dennis et al [24] have quantified Ki67 from gestational week 9 to 59 years. Since rates of decline varied, data points were averaged across studies as follows. First, counts were converted to cells/mm3 based on the section thickness used in the study. Up to birth,
(Figure legend continued on the bottom of the next page.)
4
unitary, but protracted, phenomenon. The pattern of early DG neurogenesis is therefore likely to impact neurogenesis later in life, potentially contributing to species differences. For example, accelerated DG development in humans may lead to lower rates of neurogenesis in childhood and adulthood if DG precursor cells undergo a finite number of divisions [68–70] This is suggested by Figure 2C, where postnatal neurogenesis rates are lower in humans until about halfway through life, when in rodents the rates decline to comparable levels.
In contrast to the dynamic changes early in life, neurogenesis rates are more stable in the second half of the lifespan and remain at 0.1–0.5% of maximum levels across all species (Figure 2C). Middle- and old-aged rodents typically have hundreds of cells that are born per day [71–73], and rhesus macaques have thousands (mid age) to hundreds (old age) of labeled cells [74,75]. Assuming 600 000 DG granule neurons in mice [76], 2 400 000 in rats [77], and 7 000 000 in rhesus macaques [75,78], this translates to less than 0.1% of DG cells in middle age and less than 0.01% in old age. This could be seen as reasonably on par with the proportion of DCX+ cells in adult humans ( 0.005%, [79]) and the rate of daily turnover estimated by 14C dating (0.004%, [10]). Commonly-used histological methods that only detect new cells generated in a snapshot of time will therefore reveal only one new cell for every 10 000 + DG neurons, which amounts to few or no cells per brain section. This may be high enough to detect in controlled animal studies but too low to reliably detect in human samples.
The data in Figure 2 provide a semiquantitative starting point for reconciling DG neurogenesis in humans and animals. Differences in developmental timing may explain why rodents have greater neurogenesis than primates and humans, particularly in early postnatal life. While the data cannot definitively address whether neurogenesis falls to zero in one species and not another, it suggests that middle- to old-aged humans and animals are not so different from one another in that few neurons (in proportion to the total number of DG neurons) are added, on a daily basis, for much of the lifespan (see also [80]).
Age-Related Sampling Biases in Neurogenesis Studies
Why might negative human reports generate concern when new neurons are in fact fairly rare in animals in later stages of the lifespan? One possibility is that the overwhelming focus on young animals in neuroscience research [81] inflates the perceived magnitude of adult neurogenesis. To explore this possibility, we examined subject ages in published studies of adult DG neurogenesis and found that neurogenesis tends to be examined at young ages in rodents, when neurogenesis levels are high (median age of 90 days, 12% lifespan; Figure 3). In contrast, the ages of human subjects span the full lifespan, and the majority are beyond the age when neurogenesis has plateaued at low levels (median age 44 years; 63% lifespan). Rodent studies
time points and cell counts were grouped and averaged across studies if they fell within 3 weeks of the mean age of the group. With age, the window expanded such that for the first year of life subject ages were grouped if within 1 month of one another. Subjects aged 2–9 years were pooled and all other time points reflected averages for respective decades of life. To be consistent with the animal data, which covered the entire lifespan, a data point was added for humans at 70 years [average human lifespan, World Health Organization; calculated by averaging the three prior data points (since the curve was asymptotic)]. The time scale on the x axis was normalized to postconception age (which approximates the species lifespan – mice: 2 years, rats: 2.25 years, macaques: 25.5 years, humans: 70 years). Ages of birth and sexual maturity are indicated by the circles that are embedded in the curves. They are merely meant to highlight, approximately, developmental milestones, and are not data points with regards to neurogenesis. For sexual maturity ages, the following estimates were used (postnatally): mice: 42 days, rats: 40 days, rhesus monkeys: 3.5 years, humans: 13 years. Data, calculations, and detailed discussion of methodology are available as supplemental material. (B) Aligning the early postnatal period to time of birth gives the impression that neurogenesis is greater in rodents than in humans and non-human primates. Graph shows 5% of lifespan. (C) Enlargement of 10–100% lifespan suggests that neurogenesis rates can be seen as broadly comparable across species later in life. Abbreviations: DG, dentate gyrus.
Neurogenesis manipula on studies
Neurogenesis quan fica on studies
that have manipulated neurogenesis do so at even younger ages (median 60 days). Thus, neurogenesis is often studied soon after rodents reach sexual maturity ( P40), which is routinely used as a rough approximation of an adult-like stage of development. However, compared to humans, not only does neurogenesis peak later in rodents but sexual maturity occurs earlier (Figure 2A). Therefore, once ages and developmental differences are accounted for, it is not surprising that young adult-like rodents have greater neurogenesis rates than the middle-aged humans that comprise most studies.
Recalibrating According to Neurodevelopmental Timing
The data indicate that DG neurogenesis declines early in humans, raising the question of how it might be relevant for health. Possibly, low rates may have substantial cumulative effects as has been estimated for rats [82] and demonstrated in mice [83] Spalding et al estimated that only 0.004% of neurons are added each day in adult humans [10] While this would appear negligible under the microscope (1 cell in 25 000), it translates to 15% over a decade; a sizable fraction that could reasonably be expected to offset hippocampus-based mental health disorders.
Alternatively, if human neurogenesis ends in childhood, or if rates are too low to produce a meaningfully-sized population of highly-plastic neurons, it becomes important to recalibrate predictions about when in the lifespan DG neurogenesis is most relevant. Indeed, the high rates of neurogenesis in early postnatal mice may be relevant for understanding infantile amnesia [84]. Adult neurogenesis, as commonly studied in (young) animals, may be a more accurate model of childhood neurogenesis in humans, and may make less of a contribution to
Figure 3. Subject Ages Differ in Rodent and Human Studies of Adult DG Neurogenesis. Subject ages in DG neurogenesis studies (horizontal scatterplots) are plotted alongside lifetime neurogenesis curves. Subject-age data points do not have y-axis values, but are overlaid on neurogenesis curves to facilitate comparison of the ages when subjects are sampled with the amount of neurogenesis at those ages. Filled symbols indicate subject ages when proliferation markers have been used to quantify adult neurogenesis; open symbols (rodents only) indicate subject ages when neurogenesis was manipulated in studies of behavioral function; boxes and whiskers indicate quartiles. In rodents, 75% of studies quantified neurogenesis rates at 4 months of age. At this age, the animals are considered young adults or adolescents; they only recently have reached sexual maturity and neurogenesis has not yet substantially declined. By contrast, in humans, 75% of subjects are beyond 19 years of age, when neurogenesis rates have largely plateaued at low levels. Neurogenesis quantification: rodent studies were identified in Pubmed using the search terms ‘dentate gyrus’ and ‘neurogenesis’ , sorted according to date, and over 100 studies were randomly sampled with the exception that efforts were made to relatively evenly sample the period of 1994 to 2018. Animal age was defined as the age when cell birth was assessed (time of BrdU injection, or age of euthanasia for Ki67). If multiple BrdU injections were given, the average age was used. If multiple ages were examined, each age was included as a data point. Neurogenesis manipulation: rodent manipulation–behavior studies were identified by including additional search terms such as ‘irradiation’ , ‘tk’ , ‘tmz’ , ‘mam’ , ‘arac’ , ‘tamoxifen’ , ‘chemogenetics’ , and ‘optogenetics’ , in order to obtain a complete list of studies. Subject age was defined as the earliest age when neurogenesis manipulation began. Mice and rats are pooled for the rodent subject age datasets. For humans, the individual ages of 375 subjects from 14 studies are shown. Human studies were excluded if they did not provide individual subject ages and rodent studies were excluded if they did not define animal age. Since the intention was to compare rodent and human studies of adult neurogenesis, studies were excluded if they focused entirely on the prenatal or early postnatal period. A list of studies and ages is provided as supplemental material. Open and closed symbols that are embedded in the lifetime neurogenesis curves indicate birth and sexual maturity, respectively, as in Figure 1 Abbreviations: DG, dentate gyrus. 6
Aβ vulnerable In vivo firingSemilunar
Dendrite plas city IEG response Precursor diversity
Earlier born
Later born
Figure 4. Ontogeny-Based Cellular Heterogeneity. DG neurons born at different stages of the lifespan acquire distinct properties, many of which persist throughout the lifespan of the cell. (A) Early-born, superfi cially-located neurons undergo atrophy in a mouse model of Alzheimer’ s disease [149] (B) Matureappearing, highly branched neurons are more likely to fire during spatial navigation [129] (C) Semilunar granule neurons are born on E14 in mice [126,127] (D) A subset of DG neurons have elaborate mossy fi ber extensions [136] and (E) higher than usual spine density [108,109,135], although the age of these cells and their ontogenetic origins, if any, remain to be determined. (F) Neurons born in early postnatal rat development die at old (neuronal) ages [133,134] (G) Old adult-born neurons display experience-dependent plasticity [100] and (H) unique patterns of IEG expression compared to early-born neurons [130,169] and depending on when in adulthood they were born [131] (I) Heterogeneity in the DG precursor cell population may also contribute to neuronal diversity [170 –172] Abbreviations: DG, dentate gyrus; IEG, immediate-early gene.
hippocampal function and disorders later in life. As indicated in Figure 3, few have tested this hypothesis. However, blocking neurogenesis in 1-month-old mice has greater behavioral effects than in 3–4-month-old mice [85] Additionally, one study found that new neuron functions in object recognition were absent in young irradiated mice and mice that have aged to 7 months, suggesting that neurogenesis rates are too low by early-middle age to have a behavioral impact [56] Collectively, these data highlight the need to study older animals that
Late death
Spine rich
Axon plas city
can better model adult humans, and they provide a fresh impetus for identifying strategies to enhance neurogenesis in older age.
While neurogenesis may decline early, this does not render irrelevant the large body of work that has identified important roles for new neurons in cognition and mental health. It is becoming increasingly clear that many mental health disorders, including those that involve the hippocampus, emerge prior to adulthood while the human brain continues to develop during childhood and adolescence [86–89] Of all mental illnesses, DG neurogenesis has most consistently been linked to depression in animal models [90] In humans, depression is often precipitated by early life adversity and can emerge in adolescence [89,91,92] Similarly, DG neurogenesis is also implicated in anxiety, addiction, and schizophrenia [34,90,93], all of which are influenced by early life events and can arise prior to adulthood [94–96]. Thus, functions of neurogenesis, as identified in adult animals, remain relevant for understanding human disorders. However, given the timecourse of neurogenesis and the developmental trajectory of mental illness, greater emphasis on the relevance for younger humans is warranted.
Neuronal Development and Plasticity: Questioning the Critical Period
Immature DG neurons have distinct properties that could endow them with important behavioral functions. What happens as the cells mature? One possibility is that, upon reaching a certain age, DG neurons become comparable to the larger, older population. While mature adult-born neurons do share properties with mature developmentally-born neurons, there is emerging evidence that adult-born neurons have unique properties that extend beyond the traditional 4–6-week critical period.
The first line of evidence comes from studies of the maturation of neurons born at different stages of life in rodents. DG neurons born in adulthood mature slower than neurons born in early postnatal development [97], and this pattern continues throughout adult life: neurons born in middle-aged mice (8 –12 months) extend dendrites, and gain spines and functional synaptic inputs at slower rates than neurons born in young adult mice [98] Twelve-day-old neurons also have larger dendritic trees in young adult rats than in middle to old-aged rats, suggesting prolonged development with age [73]. Thus, while fewer neurons are added with age, they retain distinct properties and may provide signi ficant plasticity for longer portions of the lifespan.
A second line of evidence comes from studies of experience-dependent modification of adultborn neurons. Initial studies reported that spatial water maze training increases the dendritic length and spine density of 1-week-old adult-born neurons in rats, but not putative older neurons [99] Subsequent work revealed that enhanced structural plasticity is also observed in 2- and 4-month-old adult-born neurons, and that removal of these older cohorts of adultborn cells impaired learning [100] Our own unpublished work also reveals that, while 4-weekold adult-born neurons in rats are structurally comparable to neurons born in infancy, growth of spines and presynaptic terminals surpasses infant-born neurons if examined at later intervals, when cells are 2–6 months old. Collectively, these data raise fundamental questions about exactly how long new neurons retain enhanced plasticity and they suggest that important functional roles of newborn neurons may persist much longer than is generally appreciated.
Recalibration Based on the Speed of Neuronal Maturation
While the full timeframe of new neuron development is unknown, some cellular features are clearly limited to de fined windows of immaturity. Translating the developmental trajectory of
new neurons across species is therefore necessary to determine the timeframe of new neuron functions in humans (Figure 1). This is dif ficult because there are few precise non-rodent studies of DG neuron development. However, clues from longer-lived mammals suggest that neuronal maturation is likely to be longer in humans than mice and rats. Naked mole rats, which live up to 30 years, undergo extended development and retention of immature neural features compared with mice [101,102] Red foxes also have disproportionately high numbers of doublecortin-positive cells given their low rates of proliferation, suggesting prolonged maturation and/or preservation of immature features as a compensatory source of plasticity [103] In mice and rats, doublecortin is primarily expressed for the first 2–3 weeks of neuronal development [104] but in primates it is expressed for at least 6 months [62,91] This is a 10 difference in duration, which also approximates the difference in lifespan between primates and rodents. Applying this rule to the critical period for enhanced LTP ( 6 weeks [40]), newborn DG neurons might be expected to have enhanced synaptic plasticity for over a year in primates and even longer in humans. Similarly, if the enhanced capacity for morphological plasticity, which lasts at least 4 months in rats [100], is scaled according to human lifespan (30 ), DG neurons in humans would be expected to retain this heightened plasticity for at least a decade.
The data suggest that even DG neurons born in childhood in humans could retain unique functions in adolescence and adulthood. Indeed, other aspects of human neurodevelopment, such as the pruning of prefrontal neurons, extend well into adulthood [105] A similarly long period of development may also apply to the human DG. Calbindin expression patterns, as a crude measure of neuronal maturity, indicate that human DG neurons develop over the first decade of life [106] Neuroanatomical gradients of calbindin loss suggest that later-born neurons in the adult human DG are more vulnerable to epilepsy-related damage [107] Finer aspects of maturation may occur over even longer intervals, as suggested by observations that DG neuron dendrites do not reliably reach the hippocampal fissure in primates as they do in rodents [108–110] Quantitative support comes from reports that human DG neurons continue to extend dendrites through old age [111,112] In this context it is notable that Alzheimer’s pathology can begin in the upstream entorhinal cortex long before old age [113] Thus, the prolonged ‘development’ of late-generated DG neurons could overlap with disorders that emerge many years after they were born.
DG Neurogenesis and Ontogenetic Diversity
Neurodevelopmental studies often characterize the spatiotemporal patterns by which different cell types are generated. For example, the excitatory neurons of the different layers of the neocortex are comprised of distinct populations that are generated sequentially and in a stereotyped fashion. Despite originating in the same germinal zone, neurons in the various layers are functionally distinct in their physiology and circuit connectivity [114] This persistent form of cellular heterogeneity is distinct from the maturation-based heterogeneity described above because differences do not disappear as cells age, but depend on when in the lifespan the cell was born.
While appearing homogeneous upon super fi cial inspection, pyramidal neurons in the hippocampus also display a surprising degree of variation that depends on neurodevelopmental timing. In CA1, pyramidal neurons are arranged in layers that are generated at different stages of development and have distinct morphology, connectivity, and behavioral functions [115,116] In CA3, a unique subset of highly-active pyramidal neurons are generated in a brief, early window of prenatal development [117] . Developmental timing also dictates intrahippocampal connectivity, where subcircuits of
preferentially-connected neurons are embedded in the trisynaptic pathway based on neuronal birthdate [118]
Despite its protracted development, the role that ontogenetic timing plays in DG cellular heterogeneity is surprisingly underexplored. In rodents and primates, DG neurons are added along ventral to dorsal, suprapyramidal to infrapyramidal, and superficial to deep gradients [119,120] Patterns of activity-dependent gene expression [121], morphology [122], physiology [123], and behavioral functions [124] vary across the same gradients, broadly linking cellular properties to developmental birthdate.
More precise ontogenetic relationships are only beginning to be investigated. By tagging agedefined cohorts of DG neurons, it was recently revealed that physiologically-distinct semilunar granule cells [125] are born around embryonic day 14 in mice [126,127], and their dendritic patterning is substantially different from neurons born just a few days later, on the day of birth [127] Early work demonstrated that superficially-located, presumably older, cells in rats have more primary dendrites, greater total dendritic length, and broader dendritic arborization [122]. The ontogenetic basis of many of these morphological differences was recently confirmed [127] Given the important role of dendritic architecture in integrating/processing synaptic inputs [128], this suggests that DG neurons are likely to perform distinct computational functions based on their birthdate. Indeed, reconstruction of recorded DG neurons has revealed that neurons with higher-order dendritic branching patterns are preferentially active during spatial navigation [129]
The extent to which adult-born neurons are fundamentally different from other neurons, or simply in a protracted stage of development, is unclear. Some observations suggest that functional differences may extend into cellular maturity, arguing in favor of the former scenario. For instance, 4-month-old adult-born neurons in rats show unique patterns of experiencedependent zif268 expression relative to 4-month-old infant-born neurons [130] Differences may also extend to cells born at different times in adult life, as old neurons born in young adult rats show greater zif268 expression than old neurons born in middle-aged rats [131] Patterns of neuronal persistence also suggest fundamental differences: adult-born neurons in rodents survive indefinitely once they have reached 4 weeks of age [132,133] but some infant-born DG neurons die off between 2 and 6 months of cell age [133,134] Finally, some superficiallylocated neurons, which are unlikely to substantially differ in age, are capable of synaptic LTP whereas others exhibit none [37,40]
In summary, cell age cannot fully explain differences in cellular properties between DG neurons. Instead, heterogeneous properties depend, at least in part, on when in the lifespan a neuron was born. Future work can examine if neurodevelopmental timing can explain other intriguing types of heterogeneity in the DG, such as neurons with twice the normal spine density [108,109,135] and neurons with unusually long and plastic mossy fi ber extensions [136] .
Recalibrating According to Ontogeny
How might the relative timing and order in which neurons are generated result in meaningful, persistent functional differences between cells? One possibility is that protracted DG neurogenesis is needed to produce a continuous gradient of cell types. For instance, a continuum of anatomical and physiological differences could facilitate the separation of cortical input patterns, one of the hypothesized core functions of the DG in memory [137]. A similar argument has been put forth based on patterns of gene expression across hippocampal neurons [138],
where graded differences in cell type may help tune neuronal receptive fields to the array of incoming sensory signals.
Another possibility is that there are more fundamental differences in DG cell types. For example, differences in immediate-early gene expression and morphological plasticity are likely to impact memory storage [92,122,123,131], and differential susceptibility to cell death might underlie distinct roles in memory turnover [133,134] It is unknown whether differential connectivity with medial and lateral entorhinal cortex persists or disappears as new neurons mature [139,140] This question is signifi cant because these subregions provide the hippocampus with the contextual and content-related components of experience, respectively [141] Unique connectivity will therefore dictate which aspects of sensory experience DG neurons are responsive to.
Finally, the vast majority of psychiatric and neurological disorders are associated with cell type-speci fic vulnerability. For example, aging and Alzheimer ’s disease are associated with specific loss of layer 2 entorhinal cortex neurons [142,143] . Nigral dopaminergic neurons, and other speci fic cell types, are highly vulnerable in Parkinson’s disease [144] Cellular heterogeneity in the DG may therefore result in some populations being more vulnerable than others to various pathologies. Furthermore, impaired neurogenesis may be involved in the reduced hippocampal volume that is observed in disorders such as depression [145], schizophrenia [146] , mild cognitive impairment [147], and Alzheimer’s disease [148] However, given the unique pattern of delayed death of earlier-born DG neurons in rats [133,134], it is also possible that earlier-born cells are more vulnerable to pathology. Indeed, in a mouse model of Alzheimer ’s disease, super fi cially-located, presumably earlier-born, neurons undergo greater dendritic atrophy [149] Finally, in the context of epilepsy, given the different electrophysiological pro files and activity patterns that have been observed in DG neurons, it is also plausible that subpopulations of neurons differentially contribute, or are vulnerable, to seizure-related hippocampal damage [150]
Concluding Remarks and Future Perspectives
Reports of limited neurogenesis in adult humans have been difficult to reconcile with animal work demonstrating persistent neurogenesis throughout life, and with human studies arguing for lifelong neurogenesis. Our review suggests that, once developmental timing is accounted for, the human and animal literatures are generally consistent with one another: the human hippocampus develops largely prenatally, leaving less opportunity for postnatal neurogenesis. In contrast, the rodent DG forms postnatally and is typically studied in adolescence and young adulthood, when neurogenesis rates remain high. Thus, some confusion has arisen as a result of modeling adult humans with juvenile rodents. While it remains unresolved whether neurogenesis drops to zero in adult humans, our comparative analysis suggests that it falls to low rates for much of adult life in all species.
What then is the relevance of adult neurogenesis for humans? Our review offers several perspectives for interpreting the literature and guiding future research questions. First, low rates of neurogenesis in adulthood, over years and decades, may have substantial additive effects that promote long-term health. Second, higher rates in early life may play a significant role in childhood and adolescent brain function, when many mental health disorders originate. Third, an ontogenetic perspective may help identify heterogeneous cell types in the DG, and how they differentially contribute to health and disease. Uncertainties about human–animal differences, and the extent to which cellular properties reflect maturational states versus persistent features, also highlight opportunities for future research (see Outstanding
Outstanding Questions
How many subpopulations of DG neurons exist, and how can one define them? In some instances, such as the semilunar granule neuron, the birthdate, morphology, and physiology are defined and distinct. In contrast, while old adult-born neurons differ from infant-born neurons in immediate-early gene expression and morphological plasticity, the corresponding physiological properties remain unknown. Given that neurogenesis may also interact with other lifespan processes (e.g., hormones and environment) a fuller understanding requires a detailed investigation of neurons born at different stages of life.
Which properties of newborn neurons are due to their immature state and which are permanent features? Properties related to cellular development can be expected to disappear with time and age, as neurogenesis declines. In contrast, permanent features would lead to functionsthatpersist throughoutthelifespan. With this knowledge, one could makebetter predictions abouthow neurogenesis could be harnessed to improve health throughout life.
How can we better model human DG neurogenesis? Transgenic mouse models are invaluable for studying age-defined cohorts of DG neurons and addressing mechanistic questions, but their translational relevance is limited, partly due to neurodevelopmental differences. Conversely, primates present a closer model for some aspects of human neurogenesis, but are often costly and time-consuming, and for certain applications can be ethically challenging. Shorter-lived animals that are born with a relatively mature brain, or primate models such as marmosets that are experimentally more practical, may provide new insights into the nature of human DG neurogenesis.
Can the age-related decline in neurogenesis be reversed or offset? This is an ongoing pursuit, and the low neurogenesis observed in aged rodents makes them a suitable model for this problem.
Cell types are often defined by differences in gene expression. Do DG
Questions). In summary, consideration of the broader neurodevelopmental context will help us take advantage of the benefits that neurogenesis may offer for human mental health.
Acknowledgments
Work in the Snyder Laboratory is supported by the Canadian Institutes of Health Research, the Natural Sciences and Engineering Research Council of Canada and the Michael Smith Foundation for Health Research.
Supplemental Information
Supplemental information associated with this article can be found online at https://doi.org/10.1016/j.tins.2018.12.001
References
1. Altman, J. and Das, G.D. (1965) Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. J. Comp. Neurol. 124, 319–335
2. Altman, J. (2011) The discovery of adult mammalian neurogenesis. In Neurogenesis in the Adult Brain I, pp. 3–46, Springer
3. Gross, C.G. (2000) Neurogenesis in the adult brain: death of a dogma. Nat. Rev. Neurosci. 1, 67–73
4. Rakic, P. (1985) Limits of neurogenesis in primates. Science 227, 1054–1056
5. Gould, E. et al. (1998) Proliferation of granule cell precursors in the dentate gyrus of adult monkeys is diminished by stress. Proc. Natl. Acad. Sci. U. S. A. 95, 3168–3171
6. Kornack, D.R. and Rakic, P. (1999) Continuation of neurogenesis in the hippocampus of the adult macaque monkey. Proc. Natl. Acad. Sci. U. S. A. 96, 5768–5773
7. Rakic, P. (2002) Neurogenesis in adult primate neocortex: an evaluation of the evidence. Nat. Rev. Neurosci. 3, 65–71
8. Gould, E. (2007) How widespread is adult neurogenesis in mammals? Nat. Rev. Neurosci. 8, 481–488
9. Knoth, R. et al. (2010) Murine features of neurogenesis in the human hippocampus across the lifespan from 0 to 100 years. PLoS One 5, e8809
10. Spalding, K.L. et al. (2013) Dynamics of hippocampal neurogenesis in adult humans. Cell 153, 1219–1227
11. Eriksson, P.S. et al. (1998) Neurogenesis in the adult human hippocampus. Nat. Med. 4, 1313–1317
12. Boldrini, M. et al. (2018) Human hippocampal neurogenesis persists throughout aging. Stem Cell 22, 589–599.e5
13. Sorrells, S.F. et al. (2018) Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults. Nature 555, 377–381
14. Tartt, A.N. et al. (2018) Considerations for assessing the extent of hippocampal neurogenesis in the adult and aging human brain. Stem Cell 23, 782–783
15. Kempermann, G. et al. (2018) Human adult neurogenesis: evidence and remaining questions. Cell Stem Cell 23, 25–30
16. Kuhn, H.G. et al. (2018) Adult hippocampal neurogenesis: a coming-of-age story. J. Neurosci. 38, 10401–10410
17. Arellano, J.I. et al. (2018) Adult human hippocampus: no new neurons in sight. Cereb. Cortex 28, 2479–2481
18. Lee, H. and Thuret, S. (2018) Adult human hippocampal neurogenesis: controversy and evidence. Trends Mol. Med. 24, 521 –522
19. Charvet, C.J. and Finlay, B.L. (2018) Comparing adult hippocampal neurogenesis across species: translating time to predict the tempo in humans. Front. Neurosci. 12, 706
20. Paredes, M.F. et al. (2018) Does adult neurogenesis persist in the human hippocampus? Stem Cell 23, 780–781
21. Del Bigio, M.R. (1999) Proliferative status of cells in adult human dentate gyrus. Microsc. Res. Tech. 45, 353–358
22. Blümcke, I. et al. (2001) Increase of nestin-immunoreactive neural precursor cells in the dentate gyrus of pediatric patients with early-onset temporal lobe epilepsy. Hippocampus 11, 311–321
23. Seress, L. et al. (2001) Cell formation in the human hippocampal formation from mid-gestation to the late postnatal period. Neuroscience 105, 831–843
24. Dennis, C.V. et al. (2016) Human adult neurogenesis across the ages: an immunohistochemical study. Neuropathol. Appl. Neurobiol. 42, 621–638
25. Cipriani, S. et al. (2018) Hippocampal radial glial subtypes and their neurogenic potential in human fetuses and healthy and Alzheimer’s disease adults. Cereb. Cortex 27, 16
26. Lipp, H.-P. and Bonfanti, L. (2016) Adult neurogenesis in mammals: variations and confusions. Brain Behav. Evol. 87, 205–221
27. Lledo, P.-M. and Valley, M. (2016) Adult olfactory bulb neurogenesis. Cold Spring Harb. Perspect. Biol. 8, a018945
28. Cameron, H.A. and Dayer, A.G. (2008) New interneurons in the adult neocortex: small, sparse, but significant? Biol. Psychiatry 63, 650–655
29. Inta, D. et al. (2015) New neurons in the adult striatum: from rodents to humans. Trends Neurosci. 38, 517–523
30. Anacker, C. and Hen, R. (2017) Adult hippocampal neurogenesis and cognitive flexibility – linking memory and mood. Nat. Rev. Neurosci. 18, 335–346
31. Cameron, H.A. and Glover, L.R. (2015) Adult neurogenesis: beyond learning and memory. Annu. Rev. Psychol. 66, 53–81
32. Opendak, M. and Gould, E. (2015) Adult neurogenesis: a substrate for experience-dependent change. Trends Cogn. Sci. 19, 151–161
33. Toda, T. et al. (2018) The role of adult hippocampal neurogenesis in brain health and disease. Mol. Psychiatry 145, 1
34. Yun, S. et al. (2016) Re-evaluating the link between neuropsychiatric disorders and dysregulated adult neurogenesis. Nat. Med. 22, 1239–1247
35. Zhao, C. et al. (2006) Distinct morphological stages of dentate granule neuron maturation in the adult mouse hippocampus. J. Neurosci. 26, 3–11
36. Espósito, M.S. et al. (2005) Neuronal differentiation in the adult hippocampus recapitulates embryonic development. J. Neurosci. 25, 10074–10086
37. Wang, S. et al. (2000) Heterogenous properties of dentate granule neurons in the adult rat. J. Neurobiol. 42, 248–257
38. Snyder, J.S. et al. (2001) Effects of adult neurogenesis on synaptic plasticity in the rat dentate gyrus. J. Neurophysiol. 85, 2423–2431
39. Schmidt-Hieber, C. et al. (2004) Enhanced synaptic plasticity in newly generated granule cells of the adult hippocampus. Nature 429, 184–187
40. Ge, S. et al. (2007) A critical period for enhanced synaptic plasticity in newly generated neurons of the adult brain. Neuron 54, 559–566
41. Gu, Y. et al. (2012) Optical controlling reveals time-dependent roles for adult-born dentate granule cells. Nat. Neurosci. 15, 1700–1706
42. Marín-Burgin, A. and Schinder, A.F. (2012) Requirement of adult-born neurons for hippocampus-dependent learning. Behav. Brain Res. 227, 391–399
neurons of different ages, and ones born at different stages of the lifespan, have unique genetic signatures? If so, this could lend support to the ontogenetic diversity model, and facilitate strategies for targeting neuronal populations in animal models and possibly for treatment of human disorders.
43. Temprana, S.G. et al. (2015) Delayed coupling to feedback inhibition during a critical period for the integration of adult-born granule cells. Neuron 85, 116–130
44. Chancey, J.H. et al. (2013) GABA depolarization is required for experience-dependent synapse unsilencing in adult-born neurons. J. Neurosci. 33, 6614–6622
45. Pardi, M.B. et al. (2015) Differential inhibition onto developing and mature granule cells generates high-frequency filters with variable gain. eLife 4, e08764
46. Gould, E. et al. (1999) Learning enhances adult neurogenesis in the hippocampal formation. Nat. Neurosci. 2, 260–265
47. Epp, J.R. et al. (2007) Hippocampus-dependent learning promotes survival of new neurons in the dentate gyrus at a specific time during cell maturation. Neuroscience 149, 273–285
48. Dupret, D. et al. (2007) Spatial learning depends on both the addition and removal of new hippocampal neurons. PLoS Biol. 5, e214
49. Bergami, M. et al. (2015) A critical period for experience-dependent remodeling of adult-born neuron connectivity. Neuron 85, 710–717
50. Alvarez, D.D. et al. (2016) A disynaptic feedback network activated by experience promotes the integration of new granule cells. Science 354, 459–465
51. Becker, S. (2017) Neurogenesis and pattern separation: time for a divorce. WIREs Cogn. Sci. 8, e1427
52. Aimone, J.B. et al. (2009) Computational influence of adult neurogenesis on memory encoding. Neuron 61, 187–202
53. Danielson, N.B. et al. (2016) Distinct contribution of adult-born hippocampal granule cells to context encoding. Neuron 90, 101–112
54. Snyder, J.S. et al. (2005) A role for adult neurogenesis in spatial long-term memory. Neuroscience 130, 843–852
55. Shors, T.J. et al. (2001) Neurogenesis in the adult is involved in the formation of trace memories. Nature 410, 372–376
56. Denny, C.A. et al. (2012) 4- to 6-week-old adult-born hippocampal neurons influence novelty-evoked exploration and contextual fear conditioning. Hippocampus 22, 1188–1201
57. Laplagne, D.A. et al. (2006) Functional convergence of neurons generated in the developing and adult hippocampus. PLoS Biol. 4, e409
58. Stone, S.S.D. et al. (2011) Functional convergence of developmentally and adult-generated granule cells in dentate gyrus circuits supporting hippocampus-dependent memory. Hippocampus 21, 1348–1362
59. Lisman, J. (2011) Formation of the non-functional and functional pools of granule cells in the dentate gyrus: role of neurogenesis, LTP and LTD. J. Physiol. (Lond.) 589, 1905–1909
60. Alme, C.B. et al. (2010) Hippocampal granule cells opt for early retirement. Hippocampus 20, 1109–1123
61. Arnold, S.E. and Trojanowski, J.Q. (1996) Human fetal hippocampal development: I. Cytoarchitecture, myeloarchitecture, and neuronal morphologic features. J. Comp. Neurol. 367, 274–292
62. Jabès, A. et al. (2010) Quantitative analysis of postnatal neurogenesis and neuron number in the macaque monkey dentate gyrus. Eur. J. Neurosci. 31, 273–285
63. Amrein, I. et al. (2015) Septo-temporal distribution and lineage progression of hippocampal neurogenesis in a primate (Callithrix jacchus) in comparison to mice. Front. Neuroanat. 9, 85
64. Bayer, S.A. et al. (1993) Timetables of neurogenesis in the human brain based on experimentally determined patterns in the rat. Neurotoxicology 14, 83–144
65. Workman, A.D. et al. (2013) Modeling transformations of neurodevelopmental sequences across mammalian species. J. Neurosci. 33, 7368–7383
66. Amrein, I. et al. (2011) Comparing adult hippocampal neurogenesis in mammalian species and orders: in fl uence of chronological age and life history stage. Eur. J. Neurosci. 34, 978 – 987
67. Abrous, D.N. and Wojtowicz, J.M. (2015) Interaction between neurogenesis and hippocampal memory system: new vistas. Cold Spring Harb. Perspect. Biol. 7, a018952
68. Encinas, J.M. et al. (2011) Division-coupled astrocytic differentiation and age-related depletion of neural stem cells in the adult hippocampus. Cell Stem Cell 8, 566–579
69. Zhou, Y. et al. (2018) Autocrine Mfge8 signaling prevents developmental exhaustion of the adult neural stem cell pool. Stem Cell 23, 1–14
70. Pilz, G.-A. et al. (2018) Live imaging of neurogenesis in the adult mouse hippocampus. Science 359, 658–662
71. Kronenberg, G. et al. (2003) Subpopulations of proliferating cells of the adult hippocampus respond differently to physiologic neurogenic stimuli. J. Comp. Neurol. 467, 455–463
72. Heine, V.M. et al. (2004) Prominent decline of newborn cell proliferation, differentiation, and apoptosis in the aging dentate gyrus, in absence of an age-related hypothalamus-pituitaryadrenal axis activation. Neurobiol. Aging 25, 361–375
73. Rao, M.S. et al. (2006) The window and mechanisms of major age-related decline in the production of new neurons within the dentate gyrus of the hippocampus. Aging Cell 5, 545–558
74. Gould, E. et al. (1999) Hippocampal neurogenesis in adult Old World primates. Proc. Natl. Acad. Sci. U. S. A. 96, 5263–5267
75. Ngwenya, L.B. et al. (2015) Age-related changes in dentate gyrus cell numbers, neurogenesis, and associations with cognitive impairments in the rhesus monkey. Front. Syst. Neurosci. 9, 1–16
76. Kempermann, G. et al. (1997) More hippocampal neurons in adult mice living in an enriched environment. Nature 386, 493–495
77. West, M.J. et al. (1991) Unbiased stereological estimation of the total number of neurons in the subdivisions of the rat hippocampus using the optical fractionator. Anat. Rec. 231, 482–497
78. Jabès, A. et al. (2011) Postnatal development of the hippocampal formation: a stereological study in macaque monkeys. J. Comp. Neurol. 519, 1051–1070
79. Monje, M.L. et al. (2007) Impaired human hippocampal neurogenesis after treatment for central nervous system malignancies. Ann. Neurol. 62, 515–520
80. Lazic, S.E. (2012) Modeling hippocampal neurogenesis across the lifespan in seven species. Neurobiol. Aging 33, 1664–1671
81. McCutcheon, J.E. and Marinelli, M. (2009) Age matters. Eur. J. Neurosci. 29, 997–1014
82. Snyder, J.S. and Cameron, H.A. (2012) Could adult hippocampal neurogenesis be relevant for human behavior? Behav. Brain Res. 227, 384–390
83. DeCarolis, N.A. et al. (2013) In vivo contribution of nestin- and GLAST-lineage cells to adult hippocampal neurogenesis. Hippocampus 23, 708–719
84. Akers, K.G. et al. (2014) Hippocampal neurogenesis regulates forgetting during adulthood and infancy. Science 344, 598–602
85. Wei, L. et al. (2011) Affiliative behavior requires juvenile, but not adult neurogenesis. J. Neurosci. 31, 14335–14345
86. Lee, F.S. et al. (2014) Mental health. Adolescent mental health –opportunity and obligation. Science 346, 547–549
87. Lupien, S.J. et al. (2009) Effects of stress throughout the lifespan on the brain, behaviour and cognition. Nat. Rev. Neurosci. 10, 434–445
88. Kessler, R.C. et al. (2005) Lifetime prevalence and age-of-onset distributions of DSM-IV disorders in the National Comorbidity Survey Replication. Arch. Gen. Psychiatry 62, 593–602
89. Kim-Cohen, J. et al. (2003) Prior juvenile diagnoses in adults with mental disorder: developmental follow-back of a prospectivelongitudinal cohort. Arch. Gen. Psychiatry 60, 709–717
90. Miller, B.R. and Hen, R. (2015) The current state of the neurogenic theory of depression and anxiety. Curr. Opin. Neurobiol. 30, 51–58
91. Heim, C. et al. (2008) The link between childhood trauma and depression: insights from HPA axis studies in humans. Psychoneuroendocrinology 33, 693–710 Trends
92. Halligan, S.L. et al. (2007) Disturbances in morning cortisol secretion in association with maternal postnatal depression predict subsequent depressive symptomatology in adolescents. Biol. Psychiatry 62, 40–46
93. Mandyam, C.D. and Koob, G.F. (2012) The addicted brain craves new neurons: putative role for adult-born progenitors in promoting recovery. Trends Neurosci. 35, 250–260
94. Lewis, D.A. and Levitt, P. (2002) Schizophrenia as a disorder of neurodevelopment. Annu. Rev. Neurosci. 25, 409–432
95. Breslau, N. et al. (1999) Previous exposure to trauma and PTSD effects of subsequent trauma: results from the Detroit Area Survey of Trauma. Am. J. Psychiatry 156, 902–907
96. Paus, T. et al. (2008) Why do many psychiatric disorders emerge during adolescence? Nat. Rev. Neurosci. 9, 947–957
97. Overstreet-Wadiche, L.S. et al. (2006) Delayed development of adult-generated granule cells in dentate gyrus. J. Neurosci. 26, 2326–2334
98. Trinchero, M.F. et al. (2017) High plasticity of new granule cells in the aging hippocampus. Cell Rep. 21, 1129–1139
99. Tronel, S. et al. (2010) Spatial learning sculpts the dendritic arbor of adult-born hippocampal neurons. Proc. Natl. Acad. Sci. U. S. A. 107, 7963–7968
100. Lemaire, V. et al. (2012) Long-lasting plasticity of hippocampal adult-born neurons. J. Neurosci. 32, 3101–3108
101. Orr, M.E. et al. (2016) Extended postnatal brain development in the longest-lived rodent: prolonged maintenance of neotenous traits in the naked mole-rat brain. Front. Neurosci. 10, 473–17
102. Penz, O.K. et al. (2015) Protracted brain development in a rodent model of extreme longevity. Sci. Rep. 5, 11592
103. Amrein, I. and Slomianka, L. (2010) A morphologically distinct granule cell type in the dentate gyrus of the red fox correlates with adult hippocampal neurogenesis. Brain Res. 1328, 12–24
104. Brown, J.P. et al. (2003) Transient expression of doublecortin during adult neurogenesis. J. Comp. Neurol. 467, 1–10
105. Petanjek, Z. et al. (2011) Extraordinary neoteny of synaptic spines in the human prefrontal cortex. Proc. Natl. Acad. Sci. U. S. A. 108, 13281–13286
106. Abrahám, H. et al. (2009) Ontogeny of calbindin immunoreactivity in the human hippocampal formation with a special emphasis on granule cells of the dentate gyrus. Int. J. Dev. Neurosci. 27, 115–127
107. Abrahám, H. et al. (2011) Degree and pattern of calbindin immunoreactivity in granule cells of the dentate gyrus differ in mesial temporal sclerosis, cortical malformation- and tumorrelated epilepsies. Brain Res. 1399, 66–78
108. Seress, L. and Frotscher, M. (1990) Morphological variability is a characteristic feature of granule cells in the primate fascia dentata: a combined Golgi/electron microscope study. J. Comp. Neurol. 293, 253–267
109. Seress, L. (1992) Morphological variability and developmental aspects of monkey and human granule cells: differences between therodentand primatedentategyrus. EpilepsyRes.Suppl. 7,3–28
110. Claiborne, B.J. et al. (1986) A light and electron microscopic analysis of the mossy fibers of the rat dentate gyrus. J. Comp. Neurol. 246, 435–458
111. Flood, D.G. et al. (1985) Age-related dendritic growth in dentate gyrus of human brain is followed by regression in the ‘oldest old’ Brain Res. 345, 366–368
112. Flood, D.G. et al. (1987) Dendritic extent in human dentate gyrus granule cells in normal aging and senile dementia. Brain Res. 402, 205–216
113. Braak, H. et al. (2011) Stages of the pathologic process in Alzheimer disease: age categories from 1 to 100 years. J. Neuropathol. Exp. Neurol. 70, 960–969
114. Molyneaux, B.J. et al. (2007) Neuronal subtype specification in the cerebral cortex. Nat. Rev. Neurosci. 8, 427–437
115. Slomianka, L. et al. (2011) Hippocampal pyramidal cells: the reemergence of cortical lamination. Brain Struct. Funct. 216, 301–317
116. Li, Y. et al. (2017) A distinct entorhinal cortex to hippocampal CA1 direct circuit for olfactory associative learning. Nat. Neurosci. 20, 559–570
117. Marissal, T. et al. (2012) Pioneer glutamatergic cells develop into a morpho-functionally distinct population in the juvenile CA3 hippocampus. Nat. Commun. 3, 1316
118. Deguchi, Y. et al. (2011) Temporally matched subpopulations of selectively interconnected principal neurons in the hippocampus. Nat. Neurosci. 14, 495–504
119. Schlessinger, A.R. et al. (1975) An autoradiographic study of the time of origin and the pattern of granule cell migration in the dentate gyrus of the rat. J. Comp. Neurol. 159, 149–175
120. Rakic, P. and Nowakowski, R.S. (1981) The time of origin of neurons in the hippocampal region of the rhesus monkey. J. Comp. Neurol. 196, 99–128
121. Snyder, J.S. et al. (2009) Anatomical gradients of adult neurogenesis and activity: young neurons in the ventral dentate gyrus are activated by water maze training. Hippocampus 19, 360–370
122. Claiborne, B.J. et al. (1990) Quantitative, three-dimensional analysis of granule cell dendrites in the rat dentate gyrus. J. Comp. Neurol. 302, 206–219
123. Scharfman, H.E. et al. (2002) Structural and functional asymmetry in the normal and epileptic rat dentate gyrus. J. Comp. Neurol. 454, 424–439
124. Kheirbek, M.A. et al. (2013) Differential control of learning and anxiety along the dorsoventral axis of the dentate gyrus. Neuron 77, 955–968
125. Larimer, P. and Strowbridge, B.W. (2010) Representing information in cell assemblies: persistent activity mediated by semilunar granule cells. Nat. Neurosci. 13, 213–222
126. Save, L. et al. (2018) Temporal embryonic origin critically determines cellular physiology in the dentate gyrus. Cereb. Cortex 32, 6688
127. Kerloch, T. et al. (2018) Dentate granule neurons generated during perinatal life display distinct morphological features compared with later-born neurons in the mouse hippocampus. Cereb. Cortex 301, 365
128. Lefebvre, J.L. et al. (2015) Development of dendritic form and function. Annu. Rev. Cell Dev. Biol. 31, 741–777
129. Diamantaki, M. et al. (2016) Sparse activity of identified dentate granule cells during spatial exploration. eLife 5, e20252
130. Tronel, S. et al. (2015) Influence of ontogenetic age on the role of dentate granule neurons. Brain Struct. Funct. 220, 645–661
131. Ohline, S.M. et al. (2018) Adult-born dentate granule cell excitability depends on the interaction of neuron age, ontogenetic age and experience. Brain Struct. Funct. 383, 335
132. Kempermann, G. et al. (2003) Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development 130, 391–399
133. Dayer, A.G. et al. (2003) Short-term and long-term survival of new neurons in the rat dentate gyrus. J. Comp. Neurol. 460, 563–572
134. Cahill, S.P. et al. (2017) Early survival and delayed death of developmentally-born dentate gyrus neurons. Hippocampus 49, 553
135. Williams, R.S. and Matthysse, S. (1983) Morphometric analysis of granule cell dendrites in the mouse dentate gyrus. J. Comp. Neurol. 215, 154–164
136. Galimberti, I. et al. (2010) EphA4 signaling in juveniles establishes topographic specificity of structural plasticity in the hippocampus. Neuron 65, 627–642
137. Yassa, M.A. and Stark, C.E.L. (2011) Pattern separation in the hippocampus. Trends Neurosci. 34, 515–525
138. Cembrowski, M.S. and Menon, V. (2018) Continuous variation within cell types of the nervous system. Trends Neurosci. 41, 337–348
139. Vivar, C. et al. (2012) Monosynaptic inputs to new neurons in the dentate gyrus. Nat. Commun. 3, 1107
140. Woods, N.I. et al. (2018) Preferential targeting of lateral entorhinal inputs onto newly integrated granule cells. J. Neurosci. 38, 5843–5853
141. Knierim, J.J. et al. (2014) Functional correlates of the lateral and medial entorhinal cortex: objects, path integration and localglobal reference frames. Philos. Trans. R. Soc. B Biol. Sci. 369, 20130369
142. Kordower, J.H. et al. (2001) Loss and atrophy of layer II entorhinal cortex neurons in elderly people with mild cognitive impairment. Ann. Neurol. 49, 202–213
143. Gómez-Isla, T. et al. (1996) Profound loss of layer II entorhinal cortex neurons occurs in very mild Alzheimer s disease. J. Neurosci. 16, 4491–4500
144. Giguère, N. et al. (2018) On cell loss and selective vulnerability of neuronal populations in Parkinson’s disease. Front. Neurol. 9, 455
145. McKinnon, M.C. et al. (2009) A meta-analysis examining clinical predictors of hippocampal volume in patients with major depressive disorder. J. Psychiatry Neurosci. 34, 41–54
146. Harrison, P.J. (2004) The hippocampus in schizophrenia: a review of the neuropathological evidence and its pathophysiological implications. Psychopharmacology (Berl) 174, 151–162
147. Yassa, M.A. et al. (2010) High-resolution structural and functional MRI of hippocampal CA3 and dentate gyrus in patients with amnestic mild cognitive impairment. Neuroimage 51, 1242–1252
148. Jack, C.R. et al. (2000) Rates of hippocampal atrophy correlate with change in clinical status in aging and AD. Neurology 55, 484–489
149. Wu, C.-C. et al. (2004) Selective vulnerability of dentate granule cells prior to amyloid deposition in PDAPP mice: digital morphometric analyses. Proc. Natl. Acad. Sci. U. S. A. 101, 7141–7146
150. Scharfman, H.E. and Myers, C.E. (2016) Corruption of the dentate gyrus by dominant granule cells: implications for dentate gyrus function in health and disease. Neurobiol. Learn. Mem. 129, 69–82
151. Ge, S. et al. (2006) GABA regulates synaptic integration of newly generated neurons in the adult brain. Nature 439, 589–593
152. Snyder, J.S. et al. (2009) Adult-born hippocampal neurons are more numerous, faster maturing, and more involved in behavior in rats than in mice. J. Neurosci. 29, 14484–14495
153. Tashiro, A. et al. (2007) Experience-specific functional modification of the dentate gyrus through adult neurogenesis: a critical period during an immature stage. J. Neurosci. 27, 3252–3259
154. Gonçalves, J.T. et al. (2016) In vivo imaging of dendritic pruning in dentate granule cells. Nat. Neurosci. 19, 788–791
155. Marín-Burgin, A. et al. (2012) Unique processing during a period of high excitation/inhibition balance in adult-born neurons. Science 335, 1238–1242
156. Restivo, L. et al. (2015) Development of adult-generated cell connectivity with excitatory and inhibitory cell populations in the hippocampus. J. Neurosci. 35, 10600–10612
157. Drew, L.J. et al. (2016) Activation of local inhibitory circuits in the dentate gyrus by adult-born neurons. Hippocampus 26, 763–778
158. Nakashiba, T. et al. (2012) Young dentate granule cells mediate pattern separation, whereas old granule cells facilitate pattern completion. Cell 149, 188–201
159. Rao, M.S. et al. (2005) Newly born cells in the ageing dentate gyrus display normal migration, survival and neuronal fate choice but endure retarded early maturation. Eur. J. Neurosci. 21, 464–476
160. Kohler, S.J. et al. (2011) Maturation time of new granule cells in the dentate gyrus of adult macaque monkeys exceeds six months. Proc. Natl. Acad. Sci. U. S. A. 108, 10326–10331
161. Coleman, P.D. and Flood, D.G. (1987) Neuron numbers and dendritic extent in normal aging and Alzheimer’s disease. Neurobiol. Aging 8, 521–545
162. Angevine, J.B., Jr (1965) Time of neuron origin in the hippocampal region. An autoradiographic study in the mouse. Exp. Neurol. Suppl. (Suppl 2), 1–70
163. Ben Abdallah, N.M.-B. et al. (2010) Early age-related changes in adult hippocampal neurogenesis in C57 mice. Neurobiol. Aging 31, 151–161
164. Mathews, E.A. et al. (2010) A distinctive layering pattern of mouse dentate granule cells is generated by developmental and adult neurogenesis. J. Comp. Neurol. 518, 4479–4490
165. Kronenberg, G. et al. (2006) Physical exercise prevents agerelated decline in precursor cell activity in the mouse dentate gyrus. Neurobiol. Aging 27, 1505–1513
166. Altman, J. and Das, G.D. (1966) Autoradiographic and histological studies of postnatal neurogenesis. I. A longitudinal investigation of the kinetics, migration and transformation of cells incorporating tritiated thymidine in neonate rats, with special reference to postnatal neurogenesis in some brain regions. J. Comp. Neurol. 126, 337–389
167. Kuhn, H.G. et al. (1996) Neurogenesis in the dentate gyrus of the adult rat: age-related decrease of neuronal progenitor proliferation. J. Neurosci. 16, 2027–2033
168. Yang, P. et al. (2014) International Journal of Developmental Neuroscience. Int. J. Dev. Neurosci. 38, 1–9
169. Imura, T. et al. (2018) Differential expression of a stress-regulated gene Nr4a2 characterizes early- and late-born hippocampal granule cells. Hippocampus Published online October 26, 2018. http://dx.doi.org/10.1002/hipo.23045
170. Berg, D.A. et al. (2018) Radial glial cells in the adult dentate gyrus: what are they and where do they come from? F1000Research 7, 277
171. Hochgerner, H. et al. (2018) Conserved properties of dentate gyrus neurogenesis across postnatal development revealed by single-cell RNA sequencing. Nat. Neurosci. 21, 1–15
172. Lugert, S. et al. (2010) Quiescent and active hippocampal neural stem cells with distinct morphologies respond selectively to physiological and pathological stimuli and aging. Cell Stem Cell 6, 445–456
Another random document with no related content on Scribd:
The
Project Gutenberg eBook of Madame de Staël
This ebook is for the use of anyone anywhere in the United States and most other parts of the world at no cost and with almost no restrictions whatsoever. You may copy it, give it away or re-use it under the terms of the Project Gutenberg License included with this ebook or online at www.gutenberg.org. If you are not located in the United States, you will have to check the laws of the country where you are located before using this eBook.
Title: Madame de Staël
Author: L. Onerva
Release date: July 6, 2024 [eBook #73980]
Language: Finnish
Original publication: Porvoo: WSOY, 1920
Credits: Tuula Temonen
*** START OF THE PROJECT GUTENBERG EBOOK MADAME DE STAËL ***
Kirj.
L. Onerva
Porvoossa, Werner Söderström Osakeyhtiö, 1920.
Kuuluisan geneveläisen rahamiehen vielä kuuluisampi tytär, Germaine Necker, paroonitar Staël von Holstein, julkisuudessa tunnettu yksinkertaisesti nimellä madame de Staël, on yksi kirjallisuudenhistorian mieltäkiinnittävimpiä henkilöitä, huolimatta siitä, että hänen teostensa taiteellinen kantavuus ei ole erittäin suuri. Hänen luova voimansa ei ole niin merkitsevää laatua, että se yksin jaksaisi säilyttää hänet jälkimaailman muistossa, mutta hän on ollut valtavilla historiallisilla tapahtumilla ja neroudella sähkötetyn aikansa monisäikeinen heijastaja, myötäeläjä ja myötäkärsijä, ja sellaisena on hänen nimensä kuin vain ani harvan liitetty Europan silloiseen kulttuurihistoriaan. Rouva de Staëlin elämäntyön aaterikkaus, hänen naisellisen sydämensä myrskyävä romaani ja ne syvät inhimilliset arvot, jotka siihen sisältyvät, tulevat sitäpaitsi aina takaamaan
MADAME DE STAËL
hänelle pysyvän sijan suurten personallisuuksien muotokuvakokoelmassa.
Syntyperältään tasavaltalaisena, mutta hovissa kasvaneena, Ranskan ministerin tyttärenä ja Ruotsin lähettilään puolisona, kuuluen sukujuuriltaan kansaan, säädyltään ylimystöön, luonteeltaan ja lahjoiltaan kirjailijaboheemiin, muodostaen ylimenon kahden suuren vuosisadan ja maailmankatsomuksen, l'ancien régimen ja vallankumouksen välillä, on hänen väkevä, valveutunut, elämän täyteläisyyttä ja utopistisia unelmia uhkuva henkilöllisyytensä ja kosmopoliittinen hermosoinnutuksensa kuin luotu sen ajan Europan henkiseksi sähkönjohdattimeksi. Siinä liikkuvien virtausten lakkaamatonta tilitystä on koko hänen elämänsä ja kirjallinen toimintansa. Hän oli aikansa loistava älyllinen omatunto, kuten Emile Faguet hänestä todistaa.
Ranskan keisari-ajan etevimpänä naiskirjailijana edustaa rouva de Staël tavallaan jälkikaikua XVIII:n vuosisadan keveästä kirjallisuussuunnasta, Voltairen tapaista maltillista vapaamielisyyttä ja yleismaailmallista henkeä, mutta samalla oli hän nuoruudestaan asti Rousseaun innostunut oppilas ja astunut elämään melkoisilla sentimenttaalisilla ja romanttisilla tarpeilla. Kuten joku rouva Roland tai George Sand on hänkin Rousseaun tytär voimakkaan tunneelämänsä puolesta. Hänellä on levoton, kuumekiihkoinen mielikuvitus ja hehkuva, kapinallinen sydän, jossa pulppuaa loppumaton intohimon lähde. Hänessä on jaloa itsekkäisyyttä, raivokasta onnen janoa itselleen ja muille. Siitä johtuu hänen suuri saalinsa ja laaja myötätuntonsa, hänen kiihkeä pyrkimyksensä oikeuteen; siitä myös hänen yksilöllisyytensä voimakkaat ilmestymismuodot, hänen vastenmielisyytensä kaikkea pakollista ja rajoittavaa kohtaan. Hänellä on Rousseaun sielu, mutta hengeltään on hän Voltairen,
järkeilevän XVIII:n vuosisadan lapsi. Hänen järkensä on miehekäs, laaja, kestävä, totuudenjanoinen ja pelkäämätön, mutta sillä on myöskin lajinsa rajoitukset. Schiller on eräässä kirjeessään Goethelle erittäin sattuvasti tuonut ne esiin. Hän sanoo siinä m.m.: »Hänen (rouva de Staëlin) tunne-elämänsä on parempi kuin hänen metafysiikkansa. Hänen kirkas järkensä kohoaa nerollisuuteen. Hän tahtoo kaikki selittää, ymmärtää, mitata; sitä, mitä hänen henkensä soihtu ei voi kirkastaa, sitä ei ole hänelle olemassakaan. Sitä, mitä me nimitämme runoudeksi, ei hän tajua, korkeintaan puhetaidollisen, intohimoisen puolen siitä.» Siitä johtuu, että rva de Staëlin mielikuvamaailma, kaikista hänen jaloista aatteistaan ja ylevistä mielenliikkeistään huolimatta, tuntuu jonkin verran laakeakattoiselta ja arkipäiväiseltä, liian hetkelliseltä ja meluisalta kuolemattomien runottarien tyyssijaksi. Niinpä onkin tämän muusana ja muusain ystävänä koko ikänsä esiintyneen naisen kirjallinen tragiikka siinä, ettei hän ole voinut jättää jälkeensä ainoatakaan sellaista teosta, joka syvemmin vangitsisi runollisella tehollaan.
Aikalaiset pitivät häntä merkitsevänä poliitikkona, etevänä filosofina ja suurena romaanikirjailijana. Jälkimaailma on vaihtanut hänen filosofinimensä moralistin arvonimeen ja siirtänyt hänet Jumalan armoittamien taiteilijain Parnassolta aate- ja muistelmakirjailijan vaatimattomammalle paikalle. Nykyaikaisen ihmisen silmissä on hänen ansionsa näilläkin aloilla etupäässä vain hyötyjän ja yleistäjän. Rva de Staël oli yleisen mielipiteen innoittaja ja hän lietsoi sitä pääasiallisesti vielä vanhan Ranskan perintämuodollisissa puitteissa: salongeissa, jotka siihen aikaan olivat samanlainen valtiomahti kuin mitä sanomalehdistö on nykyään. Salonki-yhteiskunnat olivat päätekijöinä rva de Staëlin valtiollisessa toiminnassa, joka suurelta osaltaan oli henkilökohtaisen vaikutusvallan käyttämistä. Hänen naisellisen sydämensä
päämääränä oli palvella henkisillä lahjoillaan niitä, joita hän rakasti, ja hänen salainen kunnianhimonsa oli olla suurten miesten hunnutettu kohtalo. Ja yllin kyllin hän sai sitä ollakin, joskaan ei minkään salaperäisyyden hunnun peitossa, siksi oli kohtalon kohu korkea ja pauhaava hänen väsymättömän poliittisen ja eroottisen toimintansa ympärillä.
Hänen vapaudenrakkautensa vei hänet vallankumouksen pyörteisiin. Mutta hänen lahjomattoman oikeudentuntonsa kunniaksi on mainittava, että hän inhosi sortoa yhtä paljon, tuli se sitten alhaalta tai ylhäältä päin, ja siksipä häntä, vapaamielisen maltillisuuden ystävää, parjataan milloin »vallankumouksen bakkhantiksi», milloin kuningasmielisten ja emigranttien kätyriksi. Lukemattomia heistä hän pelastikin giljotiinin alta hirmuvallan aikana, sillä ihmisrakkaus oli hänessä yhtä suuri, jollei suurempikin, kuin vapaudenrakkaus. Hän oli elämänsä ijän ihanteellinen ystävä, kuten yleensä nuo rakkauden asioissa niin kevytmieliset XVIII:n vuosisadan ihmiset. »Voin antaa ystävieni puolesta henkeni, en vakaumustani», kerrotaan rva de Staëlin lausuneen. Ja käytäntö todistaa, ettei mielipiteiden eroavaisuus milloinkaan estänyt häntä ojentamasta auttavaa kättä hädänalaisille, edes niillekään, jotka häntä vihasivat ja vainosivat. Hän itse oli pohjimmaltaan »mahdoton vihaan». Pahimmatkin loukkaukset hän unohti helposti, hyljätyn rakkauden hän palkitsi elämänikäisellä ystävyydellä; hänen olentonsa luontainen perussävy oli hyvyys.
Tämä piirre tuli näkyviin myös hänen maailmankuulussa keskustelutaidossaan. Hän antoi toisen aina esiintyä täydessä arvossaan, niin että se, jolla oli ollut onni vaihtaa ajatuksia hänen kanssaan, oli myös tyytyväinen itseensä. Ja aikalaiset vakuuttavat, ettei ollut niin tyhmää ihmistä, ettei rouva de Staël olisi saanut
jotakin hänestä ulos. Itse hän puhui paremmin kuin hän kirjoitti, niin henkevästi, huvittavasti, mukaansatempaavasti, että muuankin rouva de Tessé huudahti: »Jos olisin Ranskan kuningatar, niin määräisin rouva de Staëlin aina minulle puhumaan.» Varmastikin puhkesi tuo Ranskan valistussalonkien keskustelutaituruuden muinaissulolle tuoksuava perintökukka täydellisimpään loistoonsa juuri rva de Staëlin huulilla.
Samoin kuin keskustelijana oli rva de Staël kirjailijanakin tuokiosepittäjä. Hän ei kirjoittanut luodakseen taideteoksia, vaan siksi, että oli ajatellut ja tuntenut. Hän kirjoitti samasta syystä kuin hän puhui: välittääkseen vaikutelmiaan. Hänen kirjallinen toimintansa käy jälkimaailmalle mielenkiintoiseksi vasta sitten, kun sen kanssa rinnastetaan hänen elämänsä, kun siihen lisätään hänen merkityksensä ihmisenä, hänen henkilökohtainen osuutensa ajan johtavien voimien väliseen jännitykseen ja sen polttaviin elinkysymyksiin, jotka hän niin syvästi tunsi myös omikseen. Mutta pelkkä ulkonainen valaistus ei tässäkään kohden riitä. Vasta tunkeutuminen rva de Staëlin sisäisien elämyksien, hänen henkensä intiimin säteilyn piiriin voi kirkastaa tämän merkillisen naisen, tämän ranskalaisen Rahel Varnhagenin oikean luonteen ja tehdä ymmärrettäväksi sen keskeisen aseman, mikä hänellä omassa ajassaan oli.
Rouva de Staëlista on julkaistu lukemattomia tutkielmia ja elämäkertoja, ristiriitaisia tiedonantoja ja poleemisia arvioimia puolesta ja vastaan. Etenkin ovat ranskalaiset kirjailijat miehissä tehneet kunniaa hänen muistolleen. Ani harva elämäntarina pystyykin tarjoamaan siinä määrin runsasaiheista ja mielikuvituskylläistä maaperää tutkimukselle kuin hänen. Sitä on nimitetty romaaniksi. Tapausrikkaan, kiihkeän tahtinsa puolesta voisi
sitä yhtä hyvin nimittää draamaksi. Ja mikä valtava draama tosiaan! Tapahtumapaikkana Europa koko laajuudessaan, taustassa maailmanhistoriallisten myllerrysten jylinä, kohtalokkaana vastavoimana ei kukaan sen vähäpätöisempi kuin itse Napoleon, ensimäisenä rakastajana Benjamin Constant, toisella sijalla tunnetut hovi- ja valtiomiehet Narbonne ja Talleyrand, muissa osissa päähenkilön seurapiiriä Ranskan, Ruotsin, Saksan, Itävallan ja Venäjän hoveista, kuninkaita ja keisareita, runoilijoita ja filosofeja, taiteilijoita ja valtiomiehiä kaikista Europan maista, jopa Amerikastakin.
Epäilemättä on rva de Staëlissa mielenkiintoisinta juuri hänen ympäristönsä tai, toisin sanoen, se keskihakuinen voima hänen personallisuudessaan, joka kykeni luomaan itselleen tällaisen mitä monipuolisimpia kulttuurinäköaloja ja -hahmoja käsittävän ympäristön. Laajimman asteikon tässä kuvasarjassa tarjoaa tietysti hänen oma maansa, par'aikaa käymistilassa oleva Ranska: kuvia vapaamielisen valistus-ajan viimeisistä salongeista ja kirjavista ja kiihkeistä vallankumousklubeista; siron ja traagillisen, keveän ja sankarillisen naissulon edustajia sekä rococon että empiren tyyliin, alkaen onnettomasta Marie-Antoinettesta keisari-ajan ihailtuun kaunottareen rouva de Récamier'hen asti; lemmen leikittelyä ja ritaruutta XVIII:n vuosisadan hupien Amorin ja XIX:n vuosisadan kelmeän ja intohimoisen muusan valtakaudelta; rakkauden runoutta ja rakkauden erittelyä; vaihteleviin muotoihin pukeutuvaa valistuksen ja vapauden haaveilua; stoalaisen isänmaallisuuden murhemieltä ja epätasaista valtiollista pallopeliä Voltairen ja Rousseaun perinnöllä. Vuorovaikutusta Saksaan päin edustavat rouva de Staëlin tuttavapiirissä m.m. nimet sellaiset kuin Goethe, Schiller, Wieland, Rahel Varnhagen, A.W. Schlegel, Chamisso, Wilhelm ja Alexander Humboldt, Zacharias Werner, Englantia nimet sellaiset kuin Byron ja
Coleridge, pohjoismaita Adam Oehlenschläger, Leopold, Atterbom. Tuskinpa on ainoatakaan siihen aikaan elävää merkillisempää henkilöä koko Europassa, jonka kanssa rva de Staël ei monilla matkoillaan tulisi jonkun kerran henkilökohtaiseen kosketukseen tai jonka kanssa hän ei ainakin olisi kirjevaihdossa. Tämä huomautus koskee ei ainoastaan ajatusten ylimystöä vaan myös suku-ylimystöä, hallitsijahuoneiden jäseniäkin. Hän on kirjevaihdossa Kustaa III:n kanssa, vierailee Weimarin herttuan luona, Venäjän ja Ruotsin hoveissa ja Aleksanteri I käy hänen luonaan vastavierailulla. Ja Parisissa on rva de Staëlin salonki Ranskan kuuluisin. Siellä filosofit, puhujat, sotaurhot ja poliitikot kilvan välkyttelevät ajan levottomia soihtuja ihmisten päiden yllä, jotka siihen aikaan eivät todellakaan olleet varsin lujassa. Mutta suoranaisen maailmanmaineen saavuttaa myöhemmin Coppet, rva de Staëlin maatila Sveitsissä, jossa hän pitkän maanpakonsa aikana pitää yleismaailmallista salonkia. Coppet on tällöin se aatteellinen ahjo, jossa lietsotaan koko Europan mielipiteitä seuraelämällisiä, taiteellisia, kansallisia ja valtiollisia ennakkoluuloja vastaan. Ja sinne kokoontuvat hengen miehet eri tahoilta tekemään kunniaa naiselle, joka valtion kiron alaisenakin on hallitsija, samoin kuin Voltaire aikoinaan Ferney'ssä.
Rva de Staëlin tuotanto kantaa tämän henkisen korkeapaineen leimaa. Joskin siis hänen teostensa arvosta voinee tinkiä pois paljonkin, mitä niiden ajatussisällön itsenäisyyteen ja niiden esteettiseen täyspitoisuuteen tulee, niin jää niiden kulttuurihistoriallinen arvo joka tapauksessa jälelle.
Mutta vaikka vielä kaikki tämäkin muistista murenisi, jää rouva de Staëlin nimi kuitenkin keinumaan ajantietojen aalloille, kuin satu, kuin laulu. Niin paljon suorastaan inhimillistä sähköä on sen ympärille aikain vieriessä keräytynyt, ettei se ole edes riippuvainen
kirjallisesta maineestaan. Rva de Staëlin, tuon monisäikeisen naisen elämäntarina on valloittanut itselleen paikan niiden suurien ja yksinkertaisten mielikuvien maailmassa, jotka kestävät kauemmin kuin kauneinkaan historian kiitos, kuin todistetuin totuus, kuin pisin ansioluettelo. Rouva de Staël ja Benjamin Constant! Nuo yhteenjuotetut kirjailijanimet ovat se mielikuva, ja sen edessä palaa traagillisen rakkauden sammumaton tuli, jota vuosisatain viima vain lietsoo. He muodostavat, kuten puoli vuosisataa myöhemmin samassa maassa George Sand ja Alfred de Musset, yhden noita mainehikkaita kirjallishistoriallisia rakastajapareja, jollaisiin, paitsi kirjallista, aina liittyy myös ei-kirjallinen mielenkiinto ja joilla täten uudestaan runoiltuna on kaunis kohtalo oltuaan itse runoilijoita painua takaisin runokuviksi ihmisten sydämiin. Siellä he rakkauden vertauskuvina kilpailevat kuolemattomuudesta itse Romeon ja Julian, Faustin ja Margaretan, Elsan ja Lohengrinin, Tristanin ja Isolden kanssa.
Rakkauden tuskasta on tehty se valokehä, joka kirkkaimmin sädehtii rva de Staëlin muiston ympärillä, mutta elämän aikana painoi se häntä orjantappurakruununa. Näennäisesti tavoitteli hän ainoastaan pintapuolista mainetta ja kunniaa ja näytti hyvin viihtyvän siinä, mutta syvimmässään etsi hän tällä kaikella ainoastaan sydämen arvoja. Menestys seurasi häntä, mutta rakkauden pohja murtui murtumistaan hänen altaan. Rva de Staëlin rakkaudenpettymyksissä on sekä rococota että romantiikkaa, eikä kaikkia niitä ole niin tuiki vakavasti otettava. Mutta vakava hän niissä asioissa pohjaltaan oli, paljon vakavampi kuin yleensä hänen aikalaisensa. Intohimoisen luonteensa puolesta kuuluukin hän oikeastaan elämän murhenäytelmän suuriin rakastajatar-tyyppeihin, joskin hänen hyvä päänsä, herkeämätön valtiollinen ja yhteiskunnallinen toimintansa ja ajan keveät seurustelutavat
viivyttivät ja vaimensivat traagillista ratkaisua ja painoivat sen loppujen lopuksi hänen sydämensä salaisimpaan sopukkaan, jossa se vuosien mukana viihtyi surunvoittoiseksi ihmisymmärtämykseksi ja lempeäksi talttumukseksi.
Kuten Rahel Varnhagen ja yleensä salonkinaiset oli rva de Staëlkin ensi sijassa elämän säteilijä, enemmän esittävä kuin luova taiteilija ja itse parempi taideteos kuin hänen teoksensa. Hänen teoksiaan lukiessaan etsii niistä etupäässä häntä itseään. Niissä heijastuu koko hänen levoton elämänsä ja hänen siitä kasvanut maailmankatsomuksensa. Kirjoittaessaankin hän luuli puhuvansa vielä. Hänellä oli palava halu selittää, mitä hänen sielussaan liikkui. »Kun kirjoittaa tyydyttääkseen sisäistä innoitusta, niin tahtomattaankin paljastaa oman olemuksensa sen hienoimpia vivahduksia myöten», sanoo hän. Tässä hänen teostensa pääviehätys. Ne ovat erikoisia sentähden, että ne on kirjoittanut juuri hän, tuo tavallisuudesta poikkeava personallisuus, jolla, kuten sanottiin, oli naisen sydän ja miehen aivot, tuo kaikkien vapautusta sukupuolestaan vaativien, itsenäistyvien naisten onneton ja uljas esiäiti.
Tästä sielunäytelmästä, jossa runsauden pula on vallitsevana ja jossa juuri kaikki sen lukemattomat yksityiskohdat olisivat mielenkiintoisimmat, voimme seuraavassa lyhyessä katsauksessa esittää ainoastaan tärkeimmät vaiheet, nekin vain pääpiirteissään.
I.
Monet tutkijat ovat sukutaulujen avulla perinnöllisyyden salauumenista koettaneet etsiä sen liekin alkukipinää, joka rva de Staëlissa niin levottomana roihuaa. Niinpä saa Neckerin suku, joka alkuaan kenties on kotoisin Irlannista, mutta ainakin 1000 -luvun vaiheilla sukeltaa esiin Pommerissa, kantaa vastuun hänen luonteensa ei-ranskalaisista piirteistä. Ja äidin, kauniin sveitsiläisen papintyttären Suzanne Curchod'n verenviaksi taaskin on luettu tyttären intohimoisen sydämen monet hairahdukset. Tämän edesvastuun ovat teoreetikot salakavalasti langettaneet Suzanneparan hartioille eräiden pienten lemmenseikkailujen vuoksi, joita tämä salli itselleen nuoruusvuosinaan ollessaan opettajattarena Lausannessa, huolimatta siitä, että hän myöhemmin Neckerin rouvana on tullut tunnetuksi Ranskan uskollisimpana aviopuolisona, oikeana Penelopena. Oli noiden perimyssuhteiden laita nyt miten tahansa, tosiasiana vain pysyy, että isällä, joka uskoi yleisen mielipiteen arvovaltaan, joka oli ankarin moralisteista ja moraalisin ministereistä, mitä Ranskalla koskaan on ollut, ja äidillä, joka turhantarkassa säädyllisyydessään ja ankaran sovinnaisessa kasvatusmenetelmässään oli suorastaan esikuvalliseksi kaavoittunut, oli tytär, joka ainakin ulkonaisesti sangen vähän muistutti heitä ja jonka tulisielu aina oli valmis heittämään taisteluhansikkaan
yhteiskuntaa, sen muodollisuutta ja moraalia vastaan, silloin kun se ei käynyt yhteen hänen yksilöllisen vakaumuksensa tai mielihalujensa kanssa.
Anne Louise Germaine Necker syntyi 22 p. huhtikuuta v. 1766 Parisissa, jonne pankkiiri Necker hiljattain oli asettunut nuoren rouvansa kanssa. Hän oli heidän ensimäinen ja ainoa lapsensa. Rouva Necker, jonka ajan muodin mukaan tuli pitää salonkia, hoiti puolisonsa salongin kunniaa harkitulla ja arvokkaalla mallikelpoisuudella, joskaan hänestä ei koskaan tullut mitään siroa ranskalaista seurustelunaista. Parisilaiset nimittivät häntä piloillaan koulumamseliksi, eikä aivan syyttäkään. Kerrotaan hänen joka aamu kirjoittaneen tunnollisesti muistiin kaikki ne kohteliaisuudet, joita hän päivän kuluessa aikoi sanoa, ja ilkeimmät väittivät, että hän seurustelussaan oli jäykkä kuin kaulaa myöten tärkkelykseen kastettu. Seuraava Goncourt-veljesten antama arviointa hänestä ei myöskään ole erikoisemmin mairitteleva: »Rouva Necker oli hyväätekeväinen vailla sydämellisyyttä, hyveellinen vailla suloa, turhamainen, henkevä, mutta samalla kylmän järkevä.» Luonnollista olikin, ettei hänen puritaanisuudella ja sinisukkaisuudella höystetty maalaisluonteensa koskaan oikein voinut koteutua siihen suurkaupunkilaiseen ja kevytmieliseen ilmakehään, mihin hän oli joutunut. Siitä huolimatta onnistui hänen koota ympärilleen varsin kunnioitettava parvi ajan parhaita filosofeja ja muita kuuluisia miehiä, jopa kiinnittää toiset heistä itseensä ikuisin ystävyyden sitein.
Tämä olisi ylläolevan luonnekuvan pohjalta ihmeteltävää, ellei samalla rouva Neckerin päiväkirjaotteista huomaisi, että tällä »koulumamselilla» oli kylmän kuoren alla lämmin sydän ja kiihkoisa, liioitteleva tunne-elämä, joka tosin pääasiassa kohdistui hänen
mieheensä, mutta josta myös riitti platoonista hehkua muillekin läheisille ystäville. Niinpä oli hän elämänsä ijän runoilija Thomas'n runotar ja luonnontutkija Buffonin ylin ystävä. Ja kun tämä viimeksi mainittu teki kuolemaa, ei hän arkaillut muuttaa hänen luokseen häntä hoitamaan sulostaakseen hänen viimeisiä hetkiään. Myöskin Montesquieu, Diderot, d'Alembert, Grimm, Bernardin de Saint-Pierre, Marmontel sekä englantilainen historioitsija Gibbon, rouva Neckerin nuoruuden rakkaus, ynnä monet muut viihtyivät hyvin hänen salongissaan, joka oli Parisin merkitsevimpiä.
Tällaisessa salonki-ympäristössä kasvoi ja kasvatettiin nuori Germaine. Jo pienestä pitäin sai hän istua äitinsä nojatuolin vieressä puupallilla ja kuunnella filosofien keskusteluja. »Tällöin hän», sanoo muuan pilkkakirves, »vaikeni koko loppuelämänsä varalle.» Tämä vaikenemisen aika ei kuitenkaan mahtanut olla kovin pitkä, sillä jo sangen varhain tiedetään hänen ryhtyneen pikkuvanhoihin keskustelemuksiin suurten miesten kanssa. »Hän oli aina nuori, ei koskaan lapsi», sanoo hänestä rouva Necker de Saussure. Eikä rouva Neckerin kasvatusmenetelmässä jäänytkään paljon tilaa lapsenvaistoille. Hän lähti nimittäin siitä periaatteesta, että kaikki voitiin oppia, että opiskelu oli pääasia, ja hän oli päättänyt tehdä tyttärestään äidintaidon ja kasvatuksen mestariteoksen, kaikkitietävän ja hurskaan, intomielisen ja vaatimattoman, viehättävän ja puhtaan. Tätä varten hän ajoi hänen päähänsä velvollisuutta, työtä, järkeä, kirjallisuutta. Mutta äiti ei jaksanut kauan hallita tätä voimakasta henkeä, joka oli häntä itseään nerokkaampi eikä mahtunut hänen tulevaisuussuunnitelmiensa ahtaisiin puitteisiin. Hänen mielenkiintonsa tyttäreen väheni sikäli mikäli hän huomasi, ettei hän voinutkaan ohjata tätä mielensä mukaan. Ja kun häntä myöhemmin onniteltiin tuosta lahjakkaasta
tyttärestä, huokasi hän: »Se ei ole mitään, ei mitään siihen verraten, mitä minä tahdoin tehdä hänestä.»
Rva de Staëlin ja hänen äitinsä suhde ei koskaan ollut erittäin lämmin eikä läheinen. Sitä enemmän oli tytär kiintynyt isäänsä, suorastaan sairaloisella rakkaudella. Muuten oli koko Neckerin perhe aivan kuin perustettu keskinäiselle jumaloimiselle, jonka itsekäs nurkkakuntaisuus oli yleensä tunnettu ja naurunalainen asia. Necker ihaili vaimoaan, vaimo ihannoi miestään, molemmat tytärtä, joka taas näki isässään Ranskan ja koko maailman merkitsevimmän henkilöllisyyden. Isä oli rouva de Staëlin epäjumalana hänen kuolemaansa saakka. Hän rakastaa häntä samanlaisella hehkuvalla antaumuksella kuin rouva de Sévigné tytärtään. Jo lapsena kuullessaan häntä kiitettävän saa hän mielenliikutuksesta kyyneleet silmiinsä, nuorena tyttönä ja rouvana ovat ministerivaihdosten voitot ja tappiot, mikäli ne hänen isäänsä koskevat, hänen tärkein elämyksensä, ja vielä vanhana saa kiintymys isään, jonka suhteen tuo muuten niin selvänäköinen nainen on aivan sokea, hänet mitä lapsellisimpiin ja liioittelevimpiin tunnepurkauksiin. »Olen rakastanut Jumalaa, isääni ja vapautta», siinä hänen uskontunnustuksensa vielä kuolinvuoteellaan. Myöskin Necker, joka muuten mielipiteiltään oli niin rajallinen ja käytökseltään niin sovinnainen, on tyttäreensä nähden vapaamielisyys itse. Viisaalla vaistolla antaa hän tämän olla täydessä vapaudessaan yrittämättä sitä koskaan rajoittaa, sillä tytär oli luonteeltaan, isän lausuman mukaan »kuin intiaanit, jotka aamulla hajoittavat majansa tietämättä, mihin illalla yöpyvät.»
Tämä »intiaani»-luonne sai mahdollisimman runsasta ravintoa siitä ilmakehästä, missä nuori Germaine kasvoi. Sillä jos rouva Neckerin personallinen kasvatus jättikin hyvin vähän jälkeä tyttäreen, niin sitä syvemmin vaikutti häneen ympäristö. Siinä filosofisessa
sulatusuunissa ja yhteiskunnallisten ja kirjallisten ajatusten säkenöivässä työpajassa, joksi rouva Neckerin salonki oli muodostunut, varttui nuoren tytön äly piankin erittäin varhaiskypsäksi. Jo aikaiseen herättää hän huomiota lahjakkaisuudellaan, ja kuuluisuudet keskustelevat lapsen kuin ainakin täysikasvuisen kanssa. Kahdentoista vuotiaana sepittelee hän ajan muodin mukaisia luonnekuvia, muistosanoja ja viidentoista vuotiaana laatii hän selostuksen Montesquieun L'esprit des lois'sta (»Lakien hengestä») ja esseen isänsä Compte rendu- (»Lopputili») kirjoitelmasta, lisäksi näytelmiä ja novelleja. Hän lukee paljon ja jos jotakin, kaikkea muuta kuin lasten kirjallisuutta. Rousseau on hänen ensimäinen ihanteensa, Wertheron hänelle suoranainen elämys, sillä hänen kiihkoisa mielikuvituksensa ja heltyvä, tunteileva, mielenliikutuksille erittäin altis sydämensä viihtyvät parhaiten intohimon kuvauksissa: eniten huvittaa häntä se, mikä saa hänet itkemään. Jo nyt paisuttaa hänen purjeitaan se sama onnen- ja rakkaudenjanon rajutuuli, joka myöhemmin elämässä muuttuu todelliseksi pyörremyrskyksi, jonka edessä ei mikään este, ei kärsimys, ei ulkonainen muodollisuus merkitse mitään. Mutta samalla on hänellä myös luja ankkuri luonteensa toisessa puolessa: aimo annos moraalista tasapainoa, sveitsiläistä porvarisymmärrystä, tervettä järkeä, joka varsin hyvin tiesi mahdollisuuksien rajat, ja terävää erittelykykyä, joka viimeksi mainittu ominaisuus oli omiaan tekemään hänet oikeaksi encyklopedistain soihdunkantajaksi, mutta samalla myös tehostamaan hänen sielullisia tuskiaan. Perinpohjainen syventyminen ei sen sijaan kuulunut hänen hyveisiinsä, ei varsinaisina kehitysvuosina eikä myöhemmin. Sata vuotta aikaisemmin oli Ranskassa oppineempiakin naisia kuin rva de Staël, joka ei koskaan tahtonutkaan käydä n.s. »oppineesta naisesta». Mutta tietorikkauden laajuudessa kykeni tuskin kukaan lyömään
häntä laudalta; väsymättä, elämänsä loppuun asti hän luki, opiskeli, tutki kaikkia probleemeja, harjoitti lakkaamatonta henkisten arvojen löytöretkeilyä.
Lahjakkaana ja rikkaana perijättärenä oli nuori neiti Necker siis ympäristössään erittäin mielenkiintoinen ja toiveita herättävä ilmiö, eikä vähiten naimiskauppa-ehdokkuuden kannalta. Tosin hän ei ollut perinyt äitinsä kauneutta, mutta hänellä oli mieleenpainuva, yksilöllisesti vaikuttava ulkomuoto, eräänlainen »beauté de diablesse», ja hänen suurin viehätysvoimansa oli hänen vilkkaudessaan ja älyssään. Lisäksi ylistävät kaikki aikalaiset hänen silmiensä ilmehikkyyttä ja loistoa. Kreivi Guibert, perheen ystävä, antaa seuraavanlaisen vahvasti ihannoidun kuvan neiti Neckeristä. »Hänen suurista, mustista silmistään säihkyy neron tuli, hänen ebenpuun väriset kutrinsa putoavat tuuheina alas olkapäille, hänen piirteensä ovat enemmän omalaatuiset ja voimakkaat kuin herkät, niissä on jotakin, joka viittaa hänen sukupuolensa tavallisten rajojen yläpuolelle.» Kreivi Fersenin mielipide taaskin on se, että hän ei ole kaunis, mutta älykäs, iloinen, miellyttävä, hyvin kasvatettu ja lahjakas. Sainte-Beuve toteaa erään tältä ajalta periytyvän muotokuvan perusteella, että nuorella Germainella on luottava, kirkas katse, puhuva, puoliavoin suu, hyvyyttä ilmaisevat, kohtalaisen paksut huulet, heleä iho.
Rousseaun innoittamana näkee tämä elämäntaisteluun niin hyvin varustettu Germaine Necker koko elämän tarkoitusperän onnessa, ja jo varhain tuntee hän, että hänen oli tämä onni etsittävä rakkaudesta. Kuitenkaan ei hän vielä ymmärrä taistella sen puolesta, myöskään ei hän pidä rakkautta identtisenä avioliiton kanssa; niin ei sitä siihen aikaan käsitetty.
Ja niin tapahtuukin, että hänen avioliittonsa valmistelu jää muiden huoleksi ja hänen oma onnen-unelmansa särkyy ainiaaksi. Jo silloin, kun Germaine istui jakkaralla äitinsä vieressä, tätä avioliittoa punottiin ja valmisteltiin sitten vuosikausia isä Neckerin ja Kustaa III:n välillä kuin mitäkin ruhtinaallista liittoa. Ja tulos: Germaine annettiin aviovaimoksi kyynilliselle ja mitättömälle maailmanmiehelle, joka osti hänen myötäjäisensä arvonimellään. Tällä elämänsä viimeisellä passiivisella teolla sinetöi Germaine 20-vuotiaana kiinni lapsuutensa tarutarhat, siitä lähtien on hän täysin havahtunut, taistelija, kapinoitsija, olennoitu aktiivisuus.
Mutta vielä pari sanaa tästä onnettomasta avioliittovalmistelusta.
Olisi luullut, että rikkaan Neckerin tyttärellä olisi ollut kosijoita legio. Niin ei kuitenkaan ollut laita, sillä isä Necker oli pannut tulevalle vävylle muutamia vaikeasti täytettäviä ehtoja: ensiksikin täytyi hänen Neckerin perheen uskonnon vuoksi olla protestantti, siis ulkomaalainen, mutta samalla tuli hänen asua Ranskassa, sillä ei tullut kysymykseenkään, että vanhemmat olisivat tahtoneet luopua tyttärensä läheisyydestä. Vävyehdokkaita kyllä oli eräitä. Sellaisina mainitaan m.m. Georg August von Mecklenburg, hallitsevan herttuan veli, englantilainen valtiomies Pitt, kreivi Axel von Fersen, jonka isä oli asian puolella, ja rikas itävaltalainen pankkiiri kreivi Friesen, jota Marie-Antoinette suunnitteli Neckerin rahojen haltijaksi. Mutta oikeastaan oli Germainen kohtalo ratkaistu jo sinä kevätpäivänä v. 1776, jolloin eräs Erik Magnus Staël von Holstein -niminen nuori ruotsalainen luutnantti seikkailevana onnenritarina saapui Parisiin. Alkuaan oli hän aikeissa lähteä Amerikan vapaussotaan mainetta ja arvonimeä valloittamaan, mutta huomasi pian sen olevan saatavissa lähempääkin; hänen silmiinsä iskivät Ranskan lähettilään paikka ja neiti Neckerin rahat. Kuinka paljon hamekeinottelua ja hovi juonittelua kahden nuorta luutnanttia suosivan, vaikutusvaltaisen
ylimysnaisen kreivitär de la Marckin ja de Boufflers'n välityksellä kymmenen vuoden aikana tämän päämäärän tavoittamiseen käytettiin, ei kuulu tämän kirjasen puitteisiin. Kuitenkin mainittakoon, että tuon yli korvien velkaantuneen, epävarmalla paroonin arvonimellä pöyhistelevän hovimiehen nerokas suunnitelma oli tämä: voittaa vähitellen Kustaa III:lta jo toiselle luvattu lähettilään paikka silloisen rahaministerin Neckerin raha- ja arvovallalla ja voittaa
Neckerin porvarillinen kunnianhimo puolelleen Kustaa III:n muka lupaamalla lähettiläsarvolla, siis: tulla lähettilääksi toivossa päästä
Neckerin vävyksi ja Neckerin vävyksi toivossa päästä lähettilääksi. Staël pääsikin suunnitelmissaan pian vakavalle pohjalle saatuaan paitsi silloisen Ruotsin lähettilään kreivi Creutzin, myös MarieAntoinetten ja Ranskan kuninkaan suositukset. Ja asia menee niin pitkälle, että Necker lopuksi asettaa vävynsä puolesta seuraavat hullunkurisen mahtipontiset ehdot itselleen Ruotsin kuninkaalle: 1) kuningassana siitä, että parooni Staël aina saa olla lähettiläänä, 2) varma vakuus 25000 fr. eläkkeestä siinä tapauksessa, että hän kadottaisi tämän paikan, 3) kreivin arvonimi, jotta neiti Neckeriä ei sekoitettaisi erääseen toiseen huonomaineiseen paroonitar Staëliin, 4) Nordstjärnan ritarimerkki, 5) vakuus siitä, että lähettiläs ei koskaan matkusta vaimoineen Ruotsiin muuten kuin tilapäisesti ja isän luvalla. Vihdoin tuhansien tuskastuttavien sovittelujen jälkeen niin puolelta kuin toiselta pääsee Staël tarkoitustensa erille ja 150 000 livren velkataakkoineen käsiksi Neckerin 650 000 livren myötäjäisiin seuraavan, joten kuten vaikeasti kokoon haalitun sulhastittelin perusteella: »Très haut et très puissant seigneur , son Excellence Eric Magnus Staël de Holstein, baron de Holstein, chevalier de Sa Majesté la Reine de Suède et ambassadeur extraordinaire deSaMajestédeRoideSuèdeauprèsdesaMajesté trèsChrétienne.»
Tämä naimiskauppa, josta kahdeksan vuotta oli neuvoteltu kaikkien muiden paitsi morsiamen kanssa, solmittiin lopullisesti 14 p. tammikuuta v. 1786.
Pienessä novelliharjoitelmassaan Adélaïde et Théodore, joka, vaikka vasta myöhemmin julkaistuna, on kirjoitettu samana vuonna, juuri avioliiton kynnyksellä, purkaa myyty morsian tuskiaan. Adélaïde menee avioliittoon niinkuin mestauslavalle, hyvin tietäen, ettei hän tule miestään koskaan rakastamaan. »He ovat ryöstäneet minulta tulevaisuuden», huudahtaa Adélaïde, ja lisää, »rakkauden onni on minulta ainaiseksi kielletty.» Mutta tämä on vain tunnelma vailla syvempää traagillisuutta. Sovinnaiset järkiavioliitot kuuluivat ajan tapaan ja joskin tämä oli niistä järjettömimpiä ja joskaan ei nuori rouva de Staël rakastanut miestään, hänen romanttisen ihastuksensa ollen kohdistunut aivan toisenlaisiin henkilöihin, kuten kreivi Guibertiin ja kreivi Narbonneen, niin ei tämä isän kunnianhimon alttarille uhrautuminen liene sentään ollut hänelle niin tuiki tuskallista, etteivät uuden aseman avaamat loistavat mahdollisuudet olisi toiselta puolen mairitelleet hänen turhamaisuuttaan. Sitäpaitsi ei hän olisi ollut se liekkiluonne, mikä hän oli, jos hän olisi antanut tämän sovinnaisuuden kuoren kauan kahlita itseään. Pakollinen avioliitto ei vielä sinään ollut hänelle surmanisku, mutta siitä alkoi hänen elämänsä tragiikka: kotionnen puute, sydämen loppumaton odysseia kohti rakkautta, ainaiset pettymykset, jotka johtuivat siitä ainaisesta hurskaasta uskosta, että jokainen viimeinen rakkaus oli ensimäinen ja jokainen uusi rakkaus viimeinen. Huonommalle puolen tässä naimiskaupassa joutui sittenkin heikkolahjainen ja -luonteinen Staël, joka ei missään asiassa ollut tasaväkinen nerokkaan rouvansa kanssa, vaikkakin seitsemäntoista vuotta häntä vanhempi. Ja jos hän aikoinaan olisi aavistanut, mikä tulimeri piili tuossa äitinsä vieressä jakkaralla istuvassa tyttösessä, jonka hän oli valinnut rappioituneiden
raha-asioittensa pelastavaksi enkeliksi, niin tuskinpa hän olisi sen tulivuoren kupeelle keinotekoista onnen-uraansa perustanut.
II.
Lähettilään rouvana, ambassadricena, joksi häntä yleisesti nimitetään, alkaa vasta rva de Staëlin oikea nuoruuden ja vapauden, työn ja maineen loistokausi. Hänen kirjallinen ensi-esiintymisensä julkisuudessa tapahtuu v. 1789, jolloin hän julkaisee jo edellisenä vuonna painetun tutkielmansa Lettressurlesécritsetlecaractèrede
Jean Jacques Rousseau (»Kirjeitä Jean-Jacques Rousseaun luonteesta ja kirjoitelmista») tehden siinä kunniaa ensimäiselle kirjalliselle oppi-isälleen. Etenkin kiinnittää hänen mieltään tämän tuotannossa LanouvelleHéloïse, jonka sankarittaren kohtalossa hän epäilemättä vainuaa sukulaisuuspiirteitä omansa kanssa. Hän säälittelee naisia, joiden täytyy mennä naimisiin ilman rakkautta, ja Rousseaun sankaritar on hänestä etenkin siksi niin surkuteltava, että hän elää maalla eikä »suurmaailman pyörteessä, joka saa naisen unohtamaan sekä miehensä että rakastajansa.»
Rva de Staël ei itse ehdi suuriakaan suremaan onnetonta avioliittoaan. Hän lääkitsee nuoren sydämensä tyydyttämättömät tunteet seura-elämän huumauksella, joka tempaa hänet kokonaan mukaansa. Kaikkialla, hovissa, äitinsä salongissa ja omassaan, rue du Bac'in varrella herättää hän mitä suurinta huomiota. Tällöin, vallankumouksen kynnyksellä, tyynessä ennen myrskyä, elävät
Ranskan vanhat salonki-yhteiskunnat vielä viimeiset, henkevimmät ja nautintorikkaimmat hetkensä. »Joka ei ole elänyt noina vuosina, ei tiedä mitä elämänilo on», sanoi myöhemmin Talleyrand. Ajateltiin puhuakseen, puhuttiin herättääkseen suosiota ja suosittiin kaikkia niitä onnen ja vapauden unelmia, joita Amerikan vapaussodasta palailevat vapaaehtoiset kylvivät mieliin. Vanhat muodot saivat uutta sisältöä, ja uusi sisältö puolestaan särki vanhoja sovintatapoja. »Parisi ei enää ole Europan salonki, vaan Europan kahvila», sanoo tähän viitaten eräs aikalainen. Missään ei seura-elämä ollut loistavampaa ja vakavampaa, henkinen äly räiskyvämpää, mielipiteiden vaihto ennakkoluulottomampaa ja sisältörikkaampaa kuin juuri rva de Staëlin ympärillä, josta pian tuli kaikkien valtion uudistajien ja utopistien runotar. Hän oli tulevan Ranskan kuningatar, niinkuin Marie-Antoinette oli menevän. Ollen vapaamielisen valistuksen intomielinen lapsi, antautui hän koko sielullaan yhteiskunnallisiin ja valtiollisiin harrastuksiin ja pysyi koko elämänikänsä vapaamielisille aatteille uskollisena. Mutta vallankumous, johon hän ensin niin suurella ihastuksella suhtautui, oli tuottava hänelle, samoin kuin yleensäkin koko politiikka, lukemattomia pettymyksiä ja kärsimyksiä. Kun vallankumous alkoi, oli aatelisia sen puolesta puhumassa ja taistelemassa, pappeja sitä järjestämässä, piispoja siunaamassa, ruhtinaita maksamassa, kuningas, joka salli kaiken tapahtua. Kaikki uskoivat, että uusi järjen valta oli alkamassa. Mutta näiden idealistien laskelmat rikkoi kerrassaan kaksi suurta tuntematonta, joita he eivät olleet osanneet ottaa lukuun. Ensimäinen oli kansanvalta ja toinen oli Napoleon. Rva de Staëlkin kuului siihen maltilliseen keskustaan, niihin tasavaltalaisiin aristokraatteihin, jotka ihailivat brittiläistä hallitusmuotoa ja valistunutta ruhtinas- ja aatelisvaltaa ja jotka vallankumouksen esitaistelijoista piankin joutuivat sen uhreiksi. Sitä paitsi oli hänellä
liiaksi paljon naisellisia ja inhimillisiä ominaisuuksia ollakseen johdonmukainen poliitikko. Yli kaiken rakasti hän vapautta, mutta sitäkin enemmän — ihmisiä. Hän ei tuntenut sellaista oikeuskäsitettä, joka olisi voinut vaientaa hänessä ihmisrakkauden äänen. Ei ollut sitä aatteellista päämäärää, jota hän ei olisi syrjäyttänyt auttaakseen jotakin ystävää ja sellaisiakin, jotka eivät olleet sitä. Ja niitäkin oli paljon. Rouva de Staël oli suuri lumoojatar, mutta ihmisten suosiota hän ei suinkaan saanut ilmaiseksi. Lakkaamatta sai hän voittaa ennakkoluuloja ja taistella vihamielistä suhtautumista vastaan. Hänen porvarillinen syntyperänsä ja epäsovinnainen käytöksensä herättivät alun pitäen pahennusta vanhoillisissa ylimyspiireissä. Hän oli erikoisolento, mutta karsain silmin todettiin, että hän sen myös itse tiesi ja salli itselleen neron vapauksia, jotka olisivat olleet anteeksiantamattomia tavalliselle kuolevaiselle. Tahallaan hän ei tahtonut loukata ketään. Hän oli sitä mieltä, että henkinen ylemmyys tuli paremmin näkyviin hyväksymisen kuin kielteisen arvostelun kautta, ja toteutti yleensä tätä sääntöä myös käytännössä, mutta vilkkaan, suoran ja väkevän temperamenttinsa vuoksi ei hän aina tullut tarpeeksi ottaneeksi huomioon ympäristönsä hermoviritystä: hänen tapanaan oli virittää se itse. »Tässä seurustelukykyisessä hengessä oli omituinen anomalia, häneltä puuttui tahdikkaisuutta», kirjoittaa rva de Staëlista hänen rococokulttuurin läpitunkema ystävättärensä, kreivitär de Boigne muistelmissaan. »Hän kauhisti naisia ja loukkasi miehiä», sanoo hänestä muuan pahansuopainen naishuomioija. Ja myöhemmän ajan kirjailijoista ovat etenkin Goncourt-veljekset lainanneet elävän taiteilija-siveltimensä mitalin nurjan puolen esittämiseen. Kas tässä eräs sellainen pienoiskuva rouva Neckerin salongista: »Kaikkien keskellä nähdään punakka nainen, jalopeuran harjaa muistuttava tukkalaite päässä ja ihonyppylöitä kasvoissa. Hän
kävelee edestakaisin kuivin huulin, yhtä kulmikkain liikkein kuin aattein, miesmäisin elein, ja linkoaa silloin tällöin pojan äänellä jonkun voimaperäisen tai onton lauseen — se on rouva de Staël.» Ylläoleva kuvaus ei tietenkään ole aivan hyväntahtoisesta mielenlaadusta lähtenyt, mutta siinä kohden se on paikkansa pitävä, että rva de Staël kylmästi katsottuna oli ruma. Se on kaikkien ensi vaikutelma hänestä. Kuitenkin se jo seuraavassa silmänräpäyksessä unohtuu, ja nähdessään hänen kauniin katseensa, kuullessaan hänen äänensä soinnun, seuratessaan hänen kasvonilmeittensä leikkiä ja hänen ajatustensa vaihtelevaa virtaa joutuvat tavallisesti vastahakoisimmatkin hänen henkensä vastustamattoman vetovoiman valtoihin ja palkitsevat häntä siitä liioittelevan ihastelevin mainesanoin. Ei kunnian, vaan sydämien ja sympatiojen voittaminen olikin rva de Staëlille tärkeintä. Mutta vaikka hänen viehättämisenhalussaan täten itse asiassa oli enemmän vaistomaista rakkauden kaipausta kuin varsinaista turhamaisuutta, oli tämä hänen rumuutensa hänelle koko elämän ijän salaisen kärsimyksen aiheena.
Ja muihinkin nähden oli hän tässä suhteessa erittäin hienotunteinen. Jos hänelle sanottiin, että joku oli ruma, tuotti se hänelle mielipahaa. Itse hän aina asetti sanansa niin, ettei hänen tarvinnut käyttää tuota sanaa, hän puhui vain ulkonaisista etuuksista tai niiden puutteesta.
Missään tapauksessa ei rva de Staël voinut valittaa sitä, että »ulkonaisten etuuksien» puute olisi tuominnut hänet osattomaksi rakkaudesta ja ihailusta. Hänen aikansa henkinen ylimystö oli polvillaan hänen edessään. Ranskan hienoimmat, hurmaavimmat ja älykkäimmät seuramiehet kurkoittivat hänelle rakkauttaan, joka seikka ei suinkaan ollut hänelle epämieluista. Sillä sitä miesihannetta, jota hän ei löytänyt avioliitostaan, etsi hän kernaasti sen ulkopuolelta, maailmanmiesten, menestyssankarien, salonkileijonain joukosta. Hän tahtoi loistaa ollakseen rakastettu ja rakastaa itseään
loistavampaa ja voimakkaampaa miestä. Tämä hemmoiteltu, itsehillintään tottumaton, nerokas lapsi olisi tarvinnut rakkaudessa herran, elämässä johtajan, »un guide fort et doux», kuten hän itse sanoo; sellaista hän ei koskaan saanut ja hänen onnettomuutensa alkoi siitä, että hän luuli sellaisen löytäneensä. »Narbonne, Talleyrand ja Mathieu de Montmorency ovat ne kolme miestä, joita eniten olen rakastanut», sanoo rouva de Staël myöhemmin puhuessaan näistä nuoruusvuosistaan. Paitsi viimemainittua suhdetta, joka koko ajan pysyi pelkän ystävyyden rajoissa, tuottivat molemmat edellämainitut herrat, jotka keskenään kilpailivat sekä Ranskan salonkimaailman ensimäisestä sijasta että rouva de Staëlin suosiosta, hänelle yhtämittaisia pettymyksiä. Hänen ensimäisen todellisen sydänsurunsa aiheutti kreivi Narbonne ja monta kovaa sisäistä taistelua sai hän käydä tämän kiintymyksensä vuoksi, kunnes sekin, kuten kaikki intohimot hänen sydämessään, vaimentui epäitsekkääksi ja palvelevaksi ystävyydeksi.
Sellaista pian tarvittiinkin. Vallankumous kaikkine hirmuineen oli tullut ja kehittyi yhä väkivaltaisemmaksi ja aivan toisenlaiseksi kuin mitä rva de Staël ensi innostuksessaan oli kuvitellut. Alkutapaukset olivat kylläkin lupaavia ja niiden ensi vaiheet tuottivat hänelle pelkkiä iloisia ja ylpeitä hetkiä. Hänen jumaloidun isänsä lyhyen valtiomiesonnen aurinko huikaisi hänet. Necker, joka v. 1787 oli kadottanut ministeripaikkansa ja karkoitettu maasta, kutsuttiin nimittäin takaisin elokuussa v. 1788 pelastamaan vararikon partaalla olevaa maata. Seuraavan vuoden heinäkuussa kuitenkin kuningas erotti hänet, mutta kutsutti heti uudelleen kolmannen kerran takaisin, jolloin Neckeriä tervehdittiin Ranskan pelastajana ja jolloin hänet tyttärineen vietiin riemusaatossa Versailles'iin lippujen liehuessa ja soiton pauhatessa, ihmisten vetäessä heitä ja naisten polvistuessa heidän eteensä maantiellä. Tämä oli Neckerin poliittisen
keskinkertaisuuden viimeinen voitto ja samalla viimeinen täysin onnellinen päivä hänen tyttärensä elämässä. V. 1790 syyskuussa asustaa Necker jo julkisesta elämästä lopullisesti syrjäytettynä maatilallaan Coppet'ssa, joka oli hänen ja josta oli tuleva myös hänen tyttärensä vakituinen maanpakopaikka.
Toistaiseksi on rva de Staël vielä Parisissa. »Hänen kotinsa on», kirjoittaa amerikalainen ministeri Morris Washingtonille, »jonkinlainen muusain temppeli, jonne henkevä ja ylhäinen maailma kokoontuu kaksi kertaa viikossa illalliselle, kerran tai useammin päivälliselle.» Hänen maineensa kasvaa päivä päivältä, sitä häväistään yhtä paljon kuin kunnioitetaan. Vallankumouksen lietsoessa kaikkia intohimoja herättivät välittävät mielipiteet, joita rva de Staël edusti, juuri eniten pahaa verta kummassakin vastapuolueessa. Vastavallankumoukselliset painattivat hänestä suorastaan häväistyskirjoitelmia, joissa hänen yksityisestä elämästään ja politiikastaan tehdään mitä verisintä pilaa. Kuuluisin näistä lentokirjasista on Rivarolin Actes des Apôtres (»Apostolien teot»). Tätä vainoa jatkui vielä senkin jälkeen, kun rva de Staël oli pelastanut lukemattomia rojalisteja pyövelin piilun alta. Vielä v. 1797 omistaa »Le Thé» hänelle tällaisen kiitospuheen: »Älkää sekaantuko julkisiin asioihin. Ruotsi vaatii teitä takaisin. Teidän aviolliset velvollisuutenne odottavat teitä. Jos kuitenkin, kuten pimeyden tyttäret, olette saanut alkunne Acheronista ja yöstä, niin palatkaa varjojen valtakuntaan. Teidän paikkanne on Raivottarien rinnalla.»
Hänen suhteensa Narbonneen oli julkinen salaisuus ja kun tämä v. 1791 rva de Staëlin toimesta sai sotaministerin paikan, virkahti kuningatar hieman pisteliäästi: »Mikä kunnia rouva de Staëlille, jolla nyt on koko armeija käytettävänään.» Mutta elettiin nopeain muodonvaihdosten aikaa; jo seuraavana vuonna erotettiin Narbonne
ja siitä lähtien asettaa aika rva de Staëlin älylle ja hyvyydelle yhä suurempia koettelemuksia. Hänen lähin valtiollinen toimintansa keskittyy tästä alkaen melkein yksinomaan vallankumouksen onnettomain uhrien pelastamiseen. Henkensä kaupalla auttoi hän valtion pannahisia pakenemaan syyskuun murhien aikana, m.m. saivat Narbonne ja Talleyrand kiittää häntä hengestään. Tutut ja tuntemattomat, ystävät ja viholliset, kaikki mikä eli ja kärsi, mahtui hänen sydämeensä. Ja vasta viimeisessä tingassa pelastautui hän itse Sveitsiin, jossa hänen toinen poikansa Albert syntyi samana syksynä.
Tulee kysyneeksi: miten oli rva de Staëlin koti- ja avioelämän laita näinä aikoina? Mitä osaa näytteli parooni de Staël vaimonsa moniharrastuksellisessa elämässä? Täytyy vastata: sangen vähäistä, vähempää kuin moni muu, heidän avioliittonsa kun yleensä oli aivan virallista laatua. Heidän perhetapahtumistaan voidaan mainita, että v. 1787 heille syntyi tytär, joka kuoli heti syntymän jälkeen, ja v. 1790 syntyi vanhin poika August. Tiedetään myös, että rva de Staël jonkun verran auttoi miestään tämän poliittisessa kirjevaihdossa, mutta tämä tapahtui tietenkin vain ulkonaisista ja yhteisistä etusyistä, joita rva de Staël aina piti silmällä, joskin voi olla eri mieltä siitä, kuinka sopivaa ja edullista oli tehdä juuri Ruotsin lähettilään talo koko Europan valtiollisten juonien ahjoksi. Niinpä väittääkin professori Schuck, että Staël aina voitti, kun hän oli yksin, ja aina kärsi tappion, kun hänen levoton rouvansa oli mukana pelissä; mutta ainakin sai Staël sekä aluksi että lopuksi kiittää rouvaansa lähettilästoimestaan.
Yhtä vähän kuin rouva de Staëlin isällä oli hänen miehellään valtiollisella uralla mitään erikoisempaa menestystä. Kustaa III ei luottanut häneen ja koko lähettiläsaikansa oli Staëlilla Ruotsin