REGULATORY AFFAIRS UND KÜNSTLICHE INTELLIGENZ


3.-6.JUNI





3.-6.JUNI


IchhabevormehralsdreiJahrzehntenChemiestudiertundwürde mich trotz meiner journalistischen Abzweigung immer noch als Wissenschaftlerbezeichnen.Diesmachteesmirauchschwer,globalpolitische Ereignisse zu kommentieren, war ich doch meist der einschlägigenWissenschaftler-Meinung,nichtgenügendFaktenzu kennen. Das, was gerade in den USA passiert, lässt mich diese Prämisse allerdings vergessen. Unabhängigen Universitäten Forschungsgelder wegen nicht linientreuer politischer Ausrichtung vorzuenthalten, ist ein noch nie dagewesener Eingriff Nicht auszudenken,wennz.B.einForschungsprojektzurKrebstherapiewegen fehlender Gelder nicht mehr weitergeführt werden kann oder ein neuartiger OP-Roboter nicht fertiggestellt werden kann. Und nicht nur den Universitäten drohen finanzielle Einschnitte, für das gesamte amerikanische Gesundheitssystem sind massive Einsparungen angekündigt. Der neue amerikanische Gesundheitsminister Robert F. Kennedy will die Zahl der Mitarbeiterinnen und Mitarbeiter in Gesundheitsbehörden von 82.000 auf 62.000 reduzieren. Betroffen davon sind neben der Gesundheitsbehörde CDC auchdieArzneimitt instituteNIH. te, Hilfspersonal und Gerade die können auch nehmenAuswi
Behörden sind
Zulassungdieser den vergangenen denUnternehmen dass es einfacher denUSAzuzu
Obdiesangesichts ten Kürzungen weiterhin so bleibt abzuwa
MARC PLATTHAUS
Chefredakteur marc.platthaus@vogel.de

DerCommunityNewsletter
DierelevantestenInformationen fürIhrenberuflichenErfolg!
JetztdenCommunityNewsletterabonnieren
ErhaltenSieaktuelleInformationenausder Medtech-BranchedirektinIhrPostfach. www.devicemed.de/newsletter
ist eine Marke der
TITELTHEMA
Regularien-Chaos:
Nicht den Überblick verlieren S. 14
„SHARED AUTONOMY“ IM OP
18 KI und Mensch arbeiten Hand in Hand
CLOUD-BASIERTE SOFTWAREPLATTFORM
20 Bei der Compliance den Überblick behalten
MEDIZINTECHNIK
PROFITIERT VON KIGESTÜTZTEN LÖSUNGEN
22 KI als Schlüssel zu personalisierter Medizin
INNOVATIONSCHANCE STATT
REGULIERUNGSBREMSE
24 Wie KI Medtech-Unternehmen bei Compliance entlastet
DAS BEDEUTET DER KI ACT FÜR MEDTECHUNTERNEHMEN
26 Mit dem AI Act Innovation und regulatorische Sicherheit verbinden
29 Marktübersicht

INTERVIEW:START-UPSINDER MEDIZINTECHNIK
8 „Die Medizinprodukteherstellung ist kein einfacher Weg“
HIGH-END-
BILDDOKUMENTATIONSSYSTEM MITHILFEDIGITALER
SPALTLAMPENFOTOGRAFIE
30 Tief ins Auge geblickt
PRODUKTENTWICKLUNG
DeviceMed TOPONLINE
Whitepaper
5 zentrale Entwicklungen in der OP-Personalisierung
Von den neuesten Fertigungstechnologien profitieren
So wichtig ist Wartung und Aufbereitung von Heißkanälen Webinar
Wie Medtech- & Biotech-Unternehmen von ERP profitieren, am 5. Juni um 11 Uhr Newsletter abonnieren www.devicemed.de/newsletter
32 Zukunftsweisende Medizintechnik durch Synergien
PFAS-VERBOT
34 PFAS-freie Medizinprodukte –Fluch und Chance
37 Marktübersicht
OPTIMIERUNGENMESSBAR MACHEN
42 Product Carbon Footprint für Verpackungen und Bauteile aus Kunststoff
INTERVIEW
46 „Wir haben durch die Gruppe jetzt Zugang zu einem größeren Kundenpotenzial“
INTERVIEW
48 „KI revolutioniert die Qualitätskontrolle im Spritzguss“
50 Marktübersicht
CYBERSECURITYBEI MEDIZINPRODUKTEN
54 Zwischen Regulierung und Praxis

Die zunehmende Digitalisierung und Vernetzung medizinischer Geräte macht moderne Medizintechnik zu einem potenziellen Angriffsziel für Cyberkriminelle. Unser Special zeigt, worauf es bei Cybersecurity ankommt. ab S. 54

Welche Fristen stehen 2025 noch an und mit welchen Verordnungen sollten sich Medtech-Hersteller vertraut machen?
SICHERHEITSSTRATEGIEN
58 Wenn die Lieferkette die eigene Software gefährdet
CYBERSECURITYÜBERDEN GESAMTENLEBENSZYKLUS
60 Sichere Medizinprodukte – von Anfang bis Ende
64
TÜV-Röntgenreport 2025
Gesamtzahl aller durch TÜV-Sachverständige geprüften Röntgengeräte
15.567
Gesamtzahl aller geprüften Geräte
W Dentalmedizin
W Humanmedizin
W Technische Anwendungen
W Veterinärmedizin
TÜV-Röntgenreport 2025
Geräte mit Mangel und Mängelkategorie
W Ohne Mängel
W Mit Mängeln
Mängel
TÜV-Sachverständige haben
2024 rund 15.600 Röntgengeräte geprüft
Der „TÜV-Röntgenreport 2025“ zeigt den aktuellen Stand der technischen Sicherheit in der Röntgentechnik
Quelle: TÜV-Verband/Röntgenreport 2025
W Einfache bzw. formale Mängel
W Erhebliche Mängel
W Schwerwiegende Mängel
*Mehrere Mängel pro Gerät möglich
Quelle: TÜV-Verband/Röntgenreport 2025
TÜV-Röntgenreport 2025
Geprüfte humanmedizinische Geräte und ihre Mängel
2.939 geprüfte humanmedizinische Geräte
W Ohne Mängel
W Mit Mängeln
W Einfache bzw. formale Mängel
W Erhebliche Mängel
W Schwerwiegende Mängel
*Mehrere Mängel pro Gerät möglich
Quelle: TÜV-Verband/Röntgenreport 2025
Interview
„Die Potenziale von KI entwickeln sich weiterhin sehr dynamisch“
Digitalisierung und KI bieten Chancen für die Medizintechnik Für HerstelleristjetztderrichtigeZeitpunkt, diese zu erschließen.
Herr Bursig, was kann die Digitalisierung für die Medizintechnik leisten?
VomkleinenBlutdruckmessgerätbis zum großen CT-Scanner: Digitalisierung verbessert und erweitert permanent die Funktionsweisen medizintechnischer Geräte. Daneben eröffnet sie immer neue Möglichkeiten, Medizintechnik in die tägliche Arbeit des medizinischen Personals einzubinden, z. B. in der sektorübergreifenden Versorgung oder der Telemedizin. Das führt zu wesentlich effizienteren Abläufen, etwa bei der Planung von Behandlungen oder der Verwaltung von Patientendaten in Krankenhäusern.
„Entscheidend ist, die KI gezielt a ihre Aufgaben hin zu tr einen sicheren Betrieb zu gewährleist
Hans-Pet
GeschäftsführerFachverband„Elek medizinischeTechnik”

um jetzt einzusteigen, ist es für Hersteller keineswegs: Die Potenziale von KI entwickeln sich weiterhin sehr dynamisch.
Welche Fortschritte sehen Sie bei der Digitalisierung der Medizintechnik, insbesondere im Bereich der vernetzten Geräte und digitalenGesundheitsanwendungen?
Wie wichtig ist künstliche Intelligenz (KI) heute schon für Medizintechnik-
Hersteller? Haben viele schon den Aufsprungverpasst? KIkannAnwenderinnenundAnwenderbei vielen Routineaufgaben entlasten Auch in der Medizintechnik gewinnt die TechnologiedeshalbimmermehranBedeutung Entscheidend ist, die KI gezielt auf ihre Aufgaben hin zu trainieren und einen sicheren Betriebdauerhaftzugewährleisten.Zuspät,
Dieses Thema beschäftigt die Brancheseitüber20Jahren.IndieserZeit hat die Technik große Fortschritte gemacht–esisteinfachergeworden, Ideen und Konzepte zur Vernetzung zu realisieren. Heute können viele medizintechnische Geräte problemlos mit anderen Systemen kommunizieren. Daher kommt es jetzt darauf an, im Gesundheitssystem eine umfassende vernetzte Gesundheitsinfrastruktur aufzubauen, in der smarte Geräte und digitale Gesundheitsanwendungen nahtlos zusammenarbeiten können. (je) www.zvei.org
MitdenbrandaktuellenArtikelnderDeviceMedbleibenSiestetsaufdemneuestenStand zurelevantenNormenundRichtlinienausderMedizintechnikindustrie
www.devicemed.de/regulatory-affairs
Interview: Start-ups in der Medizintechnik
Im Partnernetzwerk Gesundheit der Bayern Innovativ GmbH sind viele Start-ups, die die Gesundheitsbranche mit neuen Ideen voranbringen. Eines davon ist die Angiolutions GmbH. Was genau das junge Unternehmen macht, erzählt Dr. Isabel N. Schellinger, Mitgründerin des Start-ups.
Was genau macht Angiolutions? Was ist das Besondere an Angiolutions?
DAS INTERVIEW FÜHRTE
SophiaWenzel
Marketing
Bayern Innovativ GmbH
Dr.IsabelN.Schellinger:Ichglaube,besondereSachen gibt es einige, aber vielleicht in Bezug auf das Produkt: Im Moment sind wir die erste Firma, die ein Klasse-IIIMedizinprodukt,alsoeinimplantierbaresDevice,bauen undentwickelnmöchte,dasindieAortaeingebautwird, also die große Hauptschlagader, das größte Blutgefäß desMenschen,ummitdiesemProdukteineErkrankung in ihrem Frühstadium aufzuhalten, die im Moment im Frühstadium keine Behandlung hat: nämlich das sogenannte abdominelle Aortenaneurysma. Das ist eine krankhafte Aussackung in der Aorta, die immer weiter wächst.UnddadurchwächstauchdieGefahr,dassdiese Aussackung einreißt und der Mensch dann verblutet. DasabdominelleAortenaneurysmaisteineErkrankung

DeviceMed ZURPERSON
Dr. Isabel N. Schellinger ist Ärztin, Wissenschaftlerin und Mitgründerin des Start-ups Angiosolutions.
Bild: Angiolutio ns GmbH
desälterenMenschen–Patientensindmeistensälterals 60 Jahre und auch hauptsächlich Männer Aber wenn Frauen betroffen sind, sind diese meistens schwerer betroffenundsterbenfrüher DasProduktbasiertaufeiner Stent-Plattform – es ist aber kein Stent, sondern beeinflusstdurchseinDesignvorallemdiebiomechanischen Eigenschaften der Gefäßwand.
Das Besondere in Bezug auf das Gründungsteam ist, dass es aus Ärzten aus der Gefäßmedizin und HerzKreislauf-Medizin besteht. Dr Uwe Raaz und ich haben unsbeieinemwissenschaftlichenForschungsaufenthalt in den USA an der Universität Stanford kennengelernt, und ich glaube, das spiegelt sich im Spirit von Angiolutionswider,weilwirausderForschungkommenundwir alle sehr patientenorientiert sind. Neben dem sehr innovativen Produkt ist es daher aus meiner Sicht das Team, was Angiolutions ausmacht.
Was ist denn Ihre Mission? Was treibt Sie an?
Als Arzt sieht man eine bestimmte Anzahl Patienten in seinem Leben. Die Zeit, in der ich eine Patientin oder einen Patienten sehe, ist aber begrenzt. Und wir hatten die Vorstellung: Wenn ich jetzt in die Forschung gehe unddaetwasNeuesentwickle,mitdemmandasLeben der Patienten verbessern oder schützen kann, dann hat man so viel mehr Möglichkeiten, Menschen zu helfen, als das jetzt an einem gegebenen Tag in der Klinik oder in der Praxis sein könnte. Und das ist, glaube ich, was einen auch gerade durch die Tiefen dieser Reise bringt, weil – wir alle wissen – Medizinprodukteherstellung ist kein einfacher Weg. Es gibt viele Herausforderungen –entwicklungstechnisch, regulatorisch und so weiter –, aberwennmansichimmerwiedervorAugenführt,dass es um die Patienten geht, dann hält man durch.
UndwiegehtesjetztgeradeweitermitAngiolutions? NochistunserProduktnichtzertifiziert.Allerdingswerden wir dieses Jahr die erste klinische Studie durchführen und da sind wir schon auch alle sehr gespannt. Das ist natürlich jetzt ein großer Meilenstein und auch ein großer Wendepunkt in der Firmengeschichte und wir alle haben lange darauf hingearbeitet. Die Studie wird jetzt in den nächsten Monaten starten und wir hoffen natürlich, dass die Studie genauso gut verläuft, wie die Vorversuche verlaufen sind. Die sehr positiven Ergebnisse der Präklinik stimmen uns optimistisch. (je)
BV-Med kritisiert neuen DiGA-Bericht
DerneueDiGA-BerichtdesGKV-Spitzenverbandes(GKV-SV)verkenntnachAnsichtdes Bundesverbandes Medizintechnologie (BVMed) die großen Potenziale von digitalen Gesundheitsanwendungen.„StattseinerBerichtspflicht neutral und objektiv nachzukommen, blickt der GKV-SV ausschließlich negativ auf digitale Gesundheitsanwendun-
gen. Unsere Botschaft lautet: In Sachen DiGA ist Deutschland EU-weit Vorreiter Der DiGA-Markt etabliert sich gerade erst und bietetgroßesPotenzialzurVerbesserungder Patienten-Versorgung Wirmüssendieinnovationshemmenden Hürden abbauen, um digitale Medizinprodukte schneller in die Versorgung zu bringen“, so BV-Med-Digital-

BV-Med-Digitalexpertin
Zukunftsbranche Medizintechnik
Die Medizintechnik gehört zu den zehn wichtigsten Zukunftsbranchen Deutschlands Dies zeigt eine Studie der Futuremanagementgroup, die in Kooperation mit dem deutschen Industrieverband Spectaris entstandenist.DieUntersuchungbewertete 25 Industriezweige hinsichtlich zentraler Zukunftstrendsbis2040.Dieübergreifende Branche Analysen-, Labor- und Medizintechnik, zu der die Medizintechnik zählt, belegte dabei Platz 4 im Ranking der Zukunftsindustrien.
Folgende Technologien werden die Branche in den kommenden Jahren prägen:
Telemedizin und digitale Plattformen verbessern die Patientenversorgung unabhängig von Standort und Zeit.
KI-gestützte Diagnostik ermöglicht schnellere und präzisere medizinische Entscheidungen.
Wearables und smarte Gesundheitslösungen unterstützen Prävention und Monitoring
Robotikgestützte OP- und Assistenzsysteme steigern Qualität und Effizienz.
Kreislaufwirtschaft und nachhaltige Produktionsprozesse gewinnen an Bedeutung
Mit folgenden Herausforderungen sieht
sich die Branche konfrontiert:
Regulatorische Hürden wie die MDR (Medical Device Regulation) könnten Innovationsprozesse verlangsamen.
Wachsende Abhängigkeit von globalen Technologieplattformen birgt Risiken für die digitale Souveränität.

Eine Studie identifiziert die Medizintechnik als eine der chancenreichsten Branchen bis 2040
expertin Natalie Gladkov Die gezielte NutzungevidenzbasierterdigitalerLösungenist nachAnsichtdesBV-MedVoraussetzungfür eine zukunftsorientierte Gestaltung des deutschen Gesundheitswesens. „Bereits für eine vorläufige Aufnahme müssen Hersteller systematische Datenerhebungen dem Bundesinstitut für Arzneimittel und Medizinprodukte(BfArM)vorlegen,umeineausreichende Begründung für zu erwartende positive Versorgungseffekte zu liefern. DabeihandeltessichzumüberwiegendenTeil um randomisierte kontrollierte Studiendesigns (RCTs) Die pauschale Aussage des GKV-SVüberfehlendenNutzenbeiDiGAist daher nicht richtig Darüber hinaus finden weder der Mehrwert von DiGA angesichts knapper Ressourcen im Gesundheitswesen noch die Herausforderungen, die für DiGAHersteller durch die andauernde Verschärfung der Anforderungen bestehen, im GKVBericht Erwähnung“, so Gladkov Als BeispielenenntdieDigitalexpertindiemangelhafte Gestaltung des zeitlichen Ablaufs der BSI-ZertifizierungsowiedievonÜbergangslösungenundplanerischenUnsicherheiten geprägte Umsetzung der ePA-Anbindung (je)
Unternehmen, die auf den Einsatz von KI, digitalen Plattformen und automatisierten Managementsystemen verzichten, werden vom Markt verdrängt.
Fachkräftemangel und hohe Anforderungen an IT-Kompetenzen erschweren den Wandel
Internationale Wettbewerbsfähigkeit muss durch gezielte Förderung gestärkt werden.
Dr Martin Leonhard, Vorsitzender der MedizintechnikbeiSpectaris:„Deutschland istderzweitgrößteMedizintechnik-Standort weltweit. Um international wettbewerbsfähig zu bleiben, braucht die Branche ein klares industriepolitisches Konzept. Die neue Bundesregierung muss die Handlungsempfehlungen des ‚Round Table Gesundheitswirtschaft‘ zügig umsetzen. Dazu gehören die beherzte Rücknahme überbordender Regulierung, innovationsfreundliche Zulassungsbedingungen,FörderungvonFreihandel und gezielte Investitionen in Forschung undEntwicklung NurwennForschung,Entwicklung und Produktion in Deutschland gehaltenwerden,kanndieBranchelangfristig zu Versorgungsautonomie und wirtschaftlichem Wachstum beitragen.“ (kb)
DeviceMed Köpfe
Vorstandswechsel

Christoph Schell (Bild) übernimmt die Position des Vorstandsvorsitzenden (CEO) der Kuka AG. Der Technologie-Manager und derzeitige Chief Commercial Officer (CCO) von Intel folgt ab dem 1. Juli auf Peter Mohnen, der das Unternehmen nach 13 Jahren Zugehörigkeit zum Kuka-Vorstand auf eigenen Wunsch verlässt. www.kuka.com
Wechsel an Vorstandsspitze

Der Vorstandsvorsitzende der Carl Zeiss Meditec AG, Dr. Markus Weber, scheidet auf eigenen Wunsch und im besten Einvernehmen mit Ablauf des 31. Mai aus dem Vorstand aus. Als sein Nachfolger wurde Maximilian Foerst (Bild) ernannt, der zum 1. Juni übernimmt. Foerst war seit 2009 Head of Zeiss Greater China. www.zeiss.com
Neuer Bereichsleiter

Dr. Jörg Traub verabschiedet sich nach fünf Jahren als Bereichsleiter Gesundheit bei Bayern Innovativ. Sein Nachfolger ist Sebastian Hilke (Bild), der bereits seit 2021 das Themenfeld Digitale Gesundheit innerhalb des Bereichs verantwortet. Hilke will die bereits geschaffenen Strukturen weiter stärken und neue Themen mutig angehen. www.bayern-innovativ.de
Neuer Geschäftsführer

Tim Merforth (Bild) wurde vom Vorstand des IVAM Fachverbands zum neuen Geschäftsführer berufen. Er ist seit 1. Mai im Amt und folgt damit auf Dr. Hans van den Vlekkert, der zuletzt als Interimsgeschäftsführer den Verband begleitet hatte. Merforth legt seinen Fokus auf Digitalisierung und Internationalisierung www.ivam.de
BV-Med-Jahresbericht
2024/25
„Der neuen Bundesregierung bietet sich mit der Medizintechnik eine große Chance“

Der Jahresbericht wurde zur BV-Med-Mitgliederversammlung am 24. April 2025 vorgelegt.
„DiedeutscheMedizintechnik-BranchestehtfürWettbewerb,Innovationskraft, Versorgungssicherheit, Exportstärke und Arbeitsplätze. Wenn es um die wirtschaftlicheZukunftdesLandesgeht,istdieMedizintechnikmitdiegrößteChance“, erklären Mark Jalaß, Vorstandsvorsitzender, und Dr. Marc-Pierre Möll, Vorstandsmitglied und Geschäftsführer des Bundesverbands Medizintechnologie (BV-Med),imVorwortzumneuenBV-Med-Jahresbericht.DiesesPotenzialmüssedieneueBundesregierungausschöpfenunddasVertrauenindenWirtschaftsstandortwiederherstellen.Besonders,daDeutschlandfürMedizintechnik-HerstellerindenletztenJahrenstarkanAttraktivitäteingebüßthabe.„DieEU-KommissionwilldieWettbewerbsfähigkeitdereuropäischenWirtschaftstärken.Und Deutschland?WirhabeninDeutschlandnochmehrreguliertundnochweniger investiert Die deutsche Politik muss endlich gegensteuern“, so die Forderung imBericht,derzurBV-Med-Mitgliederversammlungam24.April2025vorgelegt wurde. „Wir haben in Deutschland eine starke Medizintechnik. Wir haben Tausende mittelständische Unternehmen und Familienbetriebe, die hier forschen und produzieren – darunter viele Hidden Champions der Medtech-Branche weltweit.WirhabenProduktionsstättenundZulieferer,Leistungserbringerund Fachhändler DochunserWirtschaftsstandorthatindenletztenJahrenstarkan Attraktivität verloren“, beschreiben Jalaß und Möll die aktuelle Lage der Medtech-Branche in Deutschland. Mit der Kampagne #NurMitMedTech macht der Medtech-VerbandaufdieBedeutungderMedizintechnologienfürdieGesundheitsversorgung und den Wirtschaftsstandort Deutschland aufmerksam.
DerneueJahresberichtbeleuchtetdieaktuellenwirtschafts-undgesundheitspolitischen Themen – sowohl branchenübergreifend als auch fachspezifisch:
Neue Bundesregierung: Potenzial entfalten,
MDR: Konkret werden,
Krankenhaus: Adäquat finanzieren,
Infektionsschutz: Hygienemaßnahmen intensivieren,
Ambulantisierung: Zuhause versorgen,
Wundversorgung: Ganzheitlich behandeln,
Nachhaltigkeit: Praxisnah gestalten,
Digitalisierung: Datengetrieben versorgen,
Compliance: Rechtssicher kooperieren,
Europa: Standort stärken.
Zusätzlich werden die wichtigsten Branchen-Kennzahlen dargestellt: Es gibt in etwa 450.000 verschiedene Medizinprodukte Die Branche beschäftigt in Deutschlandüber210.000Menschenundiststarkmittelständischgeprägt
–93ProzentderUnternehmenbeschäftigenwenigerals250Mitarbeitende.Die Bruttowertschöpfung beträgt 19,7 Milliarden Euro mit einem Gesamtumsatz von über 40 Milliarden Euro Im Durchschnitt investiert die MedtechBranche 9ProzentihresUmsatzesinForschungundEntwicklung 68Prozent des Umsatzes stammen aus dem Auslandsgeschäft (kb)
TÜV-Röntgenreport
Im Jahr 2024 haben die TÜV-Sachverständigen bundesweit rund 15.600 Röntgengeräte geprüft. Das entspricht einem Anstieg von 4 Prozent im Vergleich zum Vorjahr (2023: rund 15.000 Geräte). Gleichzeitig ist die Mängelquote von 16 Prozent auf 12 Prozentgesunken.„TrotzderpositivenEntwicklung weist jedes achte Röntgengerät sicherheitsrelevanteMängelauf Dasisteinklares Zeichen, dass wir bei regelmäßigen Prüfungen und hohen Qualitätsstandards nicht nachlassen dürfen“, sagt Dr Alexander Schröer, Strahlenschutzexperte des TÜVVerbands. Besorgniserregend ist, dass fast jeder fünfte Mangel (19 Prozent) in die Kategorie der „schwerwiegenden Mängel“ fällt. GerätemiteinemschwerwiegendenMangel dürfenerstnachderMängelbeseitigungund
einer erneuten Prüfung wieder in Betrieb genommen werden. Mehr als die Hälfte der gefundenenMängel(56Prozent)sindals„erheblich“ klassifiziert und 25 Prozent als „geringfügig“
Insgesamt wurden 8.407 dentalmedizinischeGerätegeprüft.DiemeistenPrüfungen entfallen auf „Dental-Tubus-Geräte“ (4.965 Prüfungen), mit denen Aufnahmen einzelnerZähneangefertigtwerdenunddieinder RegeldirektimBehandlungszimmerstehen Panoramaschichtaufnahmegeräte (2.747 Prüfungen) sind in Praxen oder Zahnkliniken in eigenen Räumen untergebracht und werden für Aufnahmen des vollständigen Gebisses verwendet. 1.245 aller geprüften Anlagen (15 Prozent) weisen mindestens einen Mangel auf Die häufigsten Mängel be-
Compamed Innovationsforum 2025 Krebsdiagnostik im Wandel
Moderne Diagnoseverfahren ermöglichen eineindividualisierteAnalysevonTumoren
Das verbessert nicht nur die Erkennungsrate, sondern auch die Qualität der Therapie –mit positiven Effekten auf die LebensqualitätderPatienten.PersonalisierteMedizinist heute keine Zukunftsvision mehr, sondern Realität.
Mikrofluidik,Lab-on-a-Chip-Systemeund künstliche Intelligenz revolutionieren die Diagnostik Miniaturisierte,hochfunktionaleGeräteermöglichenpräzisePoint-of-CareTests, die lebenswichtige Diagnosen beschleunigen. Gleichzeitig sorgen FortschritteinderBiokompatibilitätundSensorikfür
einfachereAnwendungenundzuverlässigere Ergebnisse.
Die nächste Generation von DiagnosetoolskombiniertEchtzeit-Überwachungmit intelligenter Datenanalyse. Nanotechnologie und 3D-Druck ermöglichen individuell zugeschnittene Systeme – abgestimmt auf das molekulare Profil eines Tumors.
Das diesjährige Compamed Innovationsforumwidmetsicham5.Junidenneuesten Trends und Technologien in der Krebsdiagnostik. Die Online-Veranstaltung richtet sich an Unternehmen, die Komponenten und Systeme für die Medizintechnik entwickeln,sowieanmedizinischeFachkräfte,die
treffenunzureichendgekennzeichneteKontrollbereiche und mangelhafte Patientenschutzmittel „Mängel an Patientenschutzmitteln und eine unzureichende Kennzeichnung des Kontrollbereichs sind keine Formfehler, sondern ein konkretes Risiko für Patienten und Personal“, sagt Schröer „Gerade in der Dentalmedizin, wo Röntgengeräte häufig innerhalb des Behandlungsraums eingesetzt werden, ist ein abgegrenzter Kontrollbereich essenziell, um unbeabsichtigteStrahlenexpositionzuvermeiden.“
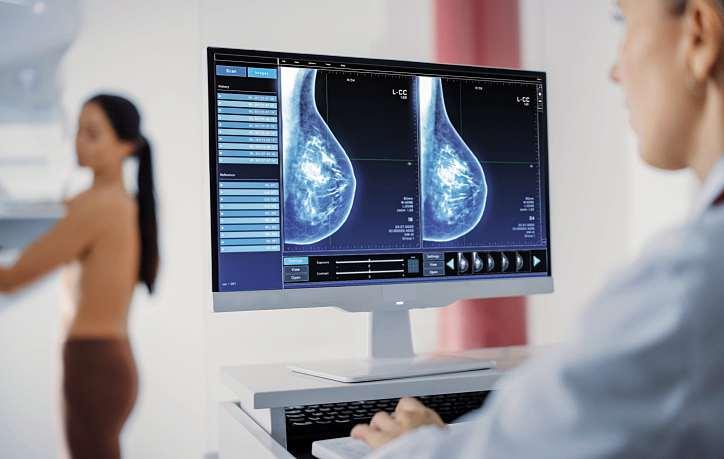
Im Bereich der Humanmedizin wurden im Jahr 2024 insgesamt 2.939 Röntgengeräte geprüft. Davon waren 394 Geräte mängelbehaftet,waseinerMängelquotevon13Prozent entspricht (2023: 14 Prozent). Die Sachverständigen dokumentierten 698 einzelne Mängel, durchschnittlich 1,77 Mängel pro beanstandetem Gerät. 19 Prozent der festgestelltenMängelsind„schwerwiegend“,72 Prozent „erheblich“ und 9 Prozent „geringfügig“ Die meisten schwerwiegenden Mängel betreffen Bildwiedergabesysteme. Das Mammographie-Screening-ProgramminDeutschlandfeiertindiesemJahr sein 20-jähriges Bestehen. Im Fokus des Röntgenreports2025stehendaherMammographiegeräte. In einer Sonderauswertung der Mammographiegeräte zeigt sich, dass die Qualitätskontrollen funktionieren. Von 109 geprüften Mammographiegeräten wiesennur11Mängelauf,waseinerMängelquote von 10 Prozent entspricht. Der Röntgenreport 2025 zeigt die Bedeutung wiederkehrender und unabhängiger Prüfungen für den sicheren Betrieb von Röntgeneinrichtungen. Die Vermeidung von Mängeln an RöntgengerätenhängtdarüberhinausmaßgeblichvoneinergezieltenAus-undWeiterbildung aller beteiligten Akteure ab (je)
sich über aktuelle Entwicklungen informieren möchten. Die Teilnahme ist kostenfrei, aberanmeldepflichtig DieVortragssprache wird Englisch sein. Mit Vorträgen werden u. a. Hahn-Schickard, Art Photonics, CSEM und das Fraunhofer-Institut für Angewandte Optik und Feinmechanik IOF vertreten sein.
Organisiert wird das Forum vom Fachverband IVAM in Zusammenarbeit mit der Messe Düsseldorf Ziel ist es, aktuelle Herausforderungen, Lösungen und Perspektiven für die Branche aufzuzeigen – mit Blick auf die kommende Compamed, Europas Messe für medizinische Zulieferer (je)
Medtec Live Healthtech Pavilion auf der Automatica Medizintechnik trifft
Auf dem Medtec Live Healthtech Pavilion treffendieBesucherderAutomaticavom24 bis 27 Juni 2025 in München auf Hersteller und Dienstleister aus dem medizintechnischen Zulieferbereich, die entlang der gesamten Wertschöpfungskette von der Entwicklung bis zur Marktzulassung tätig sind Der Fokus liegt auf der engen Vernetzung
von Herstellern und Anwendern. Zu den Ausstellern zählen Unternehmen, die wegweisende Lösungen für die Medizintechnik präsentieren.Dazugehörtbeispielsweisedie A&D Verpackungsmaschinenbau GmbH, die maßgeschneiderte Verpackungslösungen für Medizinprodukte entwickelt. Die DesotecGmbHSondermaschinenbaubietet

Der Gemeinschaftsstand der Medtec Live mit seinen Anbietern stellt auf der Automatica ein Bindeglied zwischen Medizintechnik und Automatisierungslösungen dar und setzt wertvolle Impulse.
Ottobock hat sich an Phantom Neuro beteiligt, einem Neurotechnologie-Unternehmen, das an einer Technologie für eine intuitive Mensch-Maschinen-Schnittstelle arbeitet.OttobockagiertalsLead-Investorin der 19 Millionen Dollar schweren Series-AFinanzierungsrunde. Die Investition markiert für das Medtech-Unternehmen den nächstenSchrittzurweiterenErschließung zukunftsweisender Möglichkeiten im Bereich Prothetik und Orthetik.
Das in Austin im US-Bundesstaat Texas ansässige Start-up Phantom Neuro hat eine minimal-invasive Schnittstelle entwickelt, die eine intuitive Steuerung von Prothesen und robotischen Exoskeletten ermöglicht Mit dem Kapital sollen die klinischen Studien und die Markteinführung der Technologie finanziert und beschleunigt werden. Das Herzstück der Plattform, Phantom X, soll Amputierten und Menschen mit eingeschränkter Mobilität die natürliche Bewegung und Funktionalität zurückgeben, sodass Prothesen, Orthesen und Exoskelette als nahtlose Erweiterungen des menschlichen Körpers funktionieren.
Zur Stärkung der Partnerschaft wird Ottobock zusätzlich einen Sitz im Board of
Directors von Phantom Neuro einnehmen und das junge Unternehmen auch aktiv im weiteren Wachstum begleiten und unterstützen.
„PhantomNeurohatdasPotenzial,dieArt und Weise, wie Menschen mit Prothesen interagieren, zu revolutionieren“, erklärt Oliver Jakobi, CEO der Ottobock SE & Co

Ottobock fördert ein neurotechnologisches Steuerungssystem für Prothesen
individuelleLösungenfürZuführ-,MontageundPrüftechnikan.DieACILaserGmbHist aufLasersystemezumMarkieren,Gravieren und Lasertrimmen spezialisiert. Ergänzt wird das Ausstellerfeld durch zahlreiche Unternehmen aus den Bereichen Maschinenbau, Prozessentwicklung und Softwarelösungen. Der Pavilion setzt zudem Schwerpunkte auf Robotik in der Chirurgie oder intelligente Automatisierungssysteme für die Medizintechnik.
Silke Ludwig, Deputy Director Medtec Live, freut sich auf den neuen Healthtech Pavilion auf der Automatica: „Die Medtec Live bringt Zulieferer, OEMs, Inverkehrbringer und Hersteller medizintechnischer Produkte zusammen und deckt dabei die gesamte Wertschöpfungskette ab Damit hat sich die Medtec Live als zentrale Plattform für die Medizintechnikbranche etabliert. Durch die enge Verzahnung von Medizintechnik und Automatisierung bieten wir jetzt mit dem Healthtech Pavilion eine einzigartige Anlaufstelle für alle, die sich auf der Automatica über die spezifischen Angebote von Zulieferern für die Entwicklung und Herstellung von Medizintechnik informieren möchten.“ (je)
Bild: Ott obock
KGaA. „Ihre minimal-invasive neuronale Schnittstellentechnologie ist ein großer Fortschritt in unserem Feld. Wir freuen uns auf die Zusammenarbeit mit Phantom Neuro.“
Dr Connor Glass, Gründer und CEO von Phantom Neuro, zeigt sich erfreut: „Die Unterstützung von Ottobock unterstreicht die zunehmendeKonvergenzvonNeurotechnologie mit der Prothetik, Orthetik sowie Exoskeletten.OttobockistseitJahrzehntenführend in seinen Bemühungen, die Mobilität von Millionen von Menschen wiederherzustellen.DiePartnerschaftmitOttobockwird uns helfen, die Markteinführung von Phantom X zu beschleunigen und so den Grundstein für eine Zukunft zu legen, in der Prothesen, Orthesen und Exoskelette als natürliche Erweiterung des menschlichen Körpers funktionieren.“
Die Finanzierung folgt auf die kürzliche AnerkennungvonPhantomXdurchdieU.S. Food and Drug Administration (FDA) als so genannte Breakthrough Device und die TAP-Auszeichnung (Targeted Acceleration Pathway), was zu zusätzlichen Vorteilen im Entwicklungs- und Markteinführungsprozess führt. (kb)
















































































Regulatory Affairs und künstliche Intelligenz
Hersteller schon einmal den Überblick verlieren. Welche Fristen stehen 2025 noch an und mit welchen Verordnungen sollten sich Medtech-Hersteller vertraut machen? Ein Überblick.
DieregulatorischeLandschaftfürMedizintechnikHersteller bleibt auch 2025 in Bewegung. Für die Unternehmen in Deutschland sind wichtige Fristen und Entwicklungen zu beachten, die ihre Produktzulassung und Marktpräsenz beeinflussen.
MDR: Verlängerte Übergangsfristen, kritische Bewertung möglich
Die verlängerten Übergangsfristen der EU-Medizinprodukteverordnung(engl.MedicalDeviceRegulation,kurz MDR) bieten eine kurze Atempause, erfordern jedoch eine strategische Planung Legacy-Produkte mit gültigem Richtlinien-Zertifikat dürfen abhängig von der Risikoklasse bis zu den genannten Fristen in Verkehr gebracht werden:
Klasse III, implantierbare Produkte der Klasse IIb (ausgenommen die Produkte mit „Well-Established Technology“): 31. Dezember 2027
Sonstige Klasse IIb-, IIa-, Is- und Im-Produkte: 31. Dezember 2028
Produkte der Klasse I unter den Richtlinien, welche unter der MDR höher klassifiziert wurden und deshalb eine benannte Stelle im Konformitätsbewertungsverfahren einbezogen werden muss (z. B wiederverwendbare chirurgische Instrumente, viele Software-Produkte): 31. Dezember 2028
DieseerweitertenÜbergangsfristengeltenjedochnur unterbestimmtenBedingungen(Bsp.:DerHerstellerhat keinewesentlichenÄnderungenandemProduktvorgenommenundhatbiszum26 Mai2024einenAntragauf MDR-ZertifizierungbeieinerbenanntenStellegestellt.)
Bis Ende März 2025 hatten u. a Medtech- und In-vitro-Diagnostik(IvD)-HerstellerdieMöglichkeit,überdie Webseite der Europäischen Kommission die MDR und die EU-Verordnung über In-vitro-Diagnostika (engl. In Vitro Diagnostic Regulation, kurz IVDR) kritisch zu bewerten. Diese Bewertungen sollen es nun der Kommission ermöglichen, Bilanz zu ziehen und zu überprüfen, ob die Vorschriften wirksam, effizient und verhältnismäßig sind, gegenwärtig und auch für die Zukunft bedarfsgerechtsind,aufandereMaßnahmenabgestimmt sind und einen EU-Mehrwert haben. Mit ersten ErgebnissenkannimviertenQuartal2025gerechnetwerden. Eine kurze Randnotiz zur Eudamed: Die Eudamed ist die europäische Datenbank für Medizinprodukte Sie geht auf einen Beschluss der EU-Kommission zurück, mit dem Zweck, die Marktüberwachung zu verbessern. Die MDR verpflichtet Hersteller, Daten über sich und über ihre Produkte in der Eudamed zu speichern. Die Eudamed ist in sechs verbundene Module und eine öffentlicheWebsitegegliedert.EssindallerdingsersteinigeModuleverfügbar,diefreiwilliggenutztwerdenkönnen:dasModulfürdieRegistrierungvonAkteuren,das Modul zur UDI/Produktregistrierung sowie das Modul „Benannte Stellen und Bescheinigungen“ Die übrigen Module (Vigilanz, klinische Untersuchungs- und Leis-
tungsstudien sowie Marktüberwachung) befinden sich laut der EU-Kommission aktuell in der Entwicklung
IVDR: Verlängerte Übergangsfristen, aber mit Bedingungen
Um die Verfügbarkeit von In-vitro-Diagnostika für die Patientenversorgung sicherzustellen, gewährt die EUKommission Herstellern unter bestimmten BedingungenmehrZeitfürdieUmstellungaufdieIVDR.DieVerlängerung der Übergangsfristen betrifft die Risikoklassen, in denen die Einschaltung einer benannten Stelle erforderlich ist:
31. Dezember 2027 für Produkte der Klasse D 31. Dezember 2028 für Produkte der Klasse C
31. Dezember 2029 für Produkte der Klasse B und sterile Produkte der Klasse A DieseÜbergangsfristenkönnennurdannAnwendung finden,wenndieHerstellerbestimmteBedingungenerfüllen(ebensowiebeiderMDR).SomüssendieProdukte weiterhin der IVDD entsprechen und es darf keine wesentlichen Änderungen an ihrer Auslegung und Zweckbestimmunggeben.AlsneueBedingungkommt u. a. hinzu, dass der Hersteller bis spätestens 26. Mai 2025 ein Qualitätsmanagementsystem (QMS) gemäß Artikel 10 Absatz 8 eingerichtet hat.
Cybersecurity: Neue Anforderungen für vernetzte Medizinprodukte
Ab dem 1. August 2025 treten neue Cybersecurity-AnforderungenunterderRadioEquipmentDirective(RED) inKraft.DiesebetreffenMedizinproduktemitintegrierten Funkkomponenten. Während der Cyber Resilience Act(CRA)Medizinprodukteexplizitausschließt,sollten Hersteller die allgemeinen Cybersecurity-Anforderungen der MDR und IVDR im Blick behalten und ihre Produkteentsprechendabsichern.MehrzumThemaCybersecurity finden Sie in unserem Special ab Seite 54.
KI-Medizinprodukte: Neue regulatorische Anforderungen
KI-Medizinprodukte, also Medizinprodukte mit Systemen künstlicher Intelligenz, die eine medizinische Zweckbestimmungerfüllen,stehenseit2025unterdoppelterRegulierung AlsKI-MedizinproduktegeltenSoftware und Geräte, die für Diagnose, Überwachung, Vorhersage oder Behandlung von Krankheiten eingesetzt werden und auf Technologien wie Machine Learning oder Deep Learning basieren – beispielsweise KI-Systeme zur Tumorerkennung in Röntgenbildern oder zur Analyse von EKG-Daten.
Die 2024 verabschiedete EU-KI-Verordnung (AI Act) giltzusätzlichzurMDRundklassifiziertdiemeistenKIMedizinproduktealsHochrisiko-KI-Systeme.Diesbringt seit2025erheblicheZusatzanforderungenmitsich:Her-
VERFASST VON
JuliaEngelke Stv. Chefredakteurin Devicemed
steller müssen die Qualität ihrer Trainingsdaten nachweisen, erweiterte Risikomanagementprozesse implementierenundgewährleisten,dassdieKI-Systemestets untermenschlicherAufsichtbleiben.Diesesogenannte „humanoversight“mussbiszumInkrafttretendervollständigen Anwendungspflicht des AI Acts technisch sichergestelltsein HerstellervonKI-Medizinprodukten sollten bereits jetzt prüfen, ob ihre Entwicklungs- und Dokumentationsprozesse den strengeren Transparenzund Nachweispflichten gemäß AI Act und MDR standhalten. Einen ausführlichen Überblick bietet unser Artikel ab Seite 26
Betrifft der Green Deal die MedtechBranche?
Der europäische Green Deal ist eine Herausforderung für die Medtech-Branche. Europa soll der erste klimaneutraleKontinentwerden.Hierfürsindrund80Initiativengeplant,vieledavonbetreffendirektoderindirekt die Medizintechnik. Der Bundesverband Medizintechnologie stellt auf seiner Webseite (www.bvmed.de/ themen/recht/umweltrecht)Infoblätterbereit,damitdie Medtech-Hersteller den Überblick nicht verlieren. FürUnternehmenmitmehrals1.000Mitarbeiternist z. B die EU-Lieferkettenrichtlinie (engl. Corporate Sustainability Due Diligence Directive, kurz CSDDD) interessant:DieCSDDDistzum25 Juli2024inKraftgetreten und muss aktuell bis zum 26. Juli 2027 in nationales Recht umgesetzt werden, in Deutschland voraussichtlich durch Anpassung des Lieferkettensorgfaltspflichtengesetzes (LkSG) Auch wenn kleine und mittelständischeUnternehmen(KMU)aufgrundihrerMitarbeiterzahlennichtdirektvondemGesetzbetroffensind,könnensieindirektalsLieferantvongroßenUnternehmen und Konzernen in die Verantwortung gezogen werden. EbenfallsrelevantfürMedtech-Herstelleristdieneue europäischeVerpackungsverordnung(kurzVerpackVO, engl. Packaging and Packaging Waste Regulation, kurz PPWR) Sie bildet den aktualisierten Rechtsrahmen für
DeviceMed INFO
Ein guter Indikator, was die Medtech-Branche beim Thema Regulatory Affairs beschäftigt, sind die Regulatory Affairs Expert Talks von Devicemed. Anfang April fand in Würzburg die diesjährige Ausgabe statt. An zwei Tagen standen Cybersecurity, MDR und KI im Mittelpunkt von Vorträgen, Workshops und Gesprächen. Das Fazit: Der Rede- bzw. Austauschbedarf ist v. a. beim Thema KI hoch: Es handelt sich um eine neue Technologie, auf die sich die MedizintechnikBranche noch einlassen bzw. einstellen muss. Die Digitalisierung ist zudem wichtig und sollte nicht aus dem Fokus gelassen werden Außerdem muss immer geschaut werden, unter wie viele verschiedene Regularien das eigene Medizinprodukt fallen kann. Auch im kommenden Jahr finden die Regulatory Affairs Expert Talks wieder in Würzburg statt. Am 14. und 15. April 2026 bietet sich die Möglichkeit, sich über die neuesten regulatorische Themen, die die Medizintechnik-Branche betreffen, auszutauschen und aufzuschlauen. Auf www.regulatory-affairs-talks.de gibt es regelmäßige Event-Updates.
Verpackungen und Verpackungsabfälle in der EU Die VeröffentlichungimAmtsblattderEUfandEndeJanuar 2025stattunddieVerordnungistam11.FebruarinKraft getreten. Die Bestimmungen der Verordnung gelten ab dem 12. August 2026. In Deutschland wird die Umsetzung der Vorgaben bis zum Ablaufen der Übergangsfristen noch durch das Verpackungsgesetz (VerpackG) geregelt.DieVerpackVOgiltfüralleVerpackungen,unabhängig von dem verwendeten Material und für alle Verpackungsabfälle. Inhaltlich soll es zu keiner Veränderung im Vergleich zur bisherigen Rechtslage kommen. Die VerpackVO enthält keine generellen Anwendungsbereichsausnahmen. Allerdings sind in einigen BereichenpflichtenspezifischeAusnahmenvorgesehen –insbesonderefürkontaktempfindlicheVerpackungen für Medizinprodukte, IvDs, Arzneimittel (Human und Tier) und bestimmte Speziallebensmittel. Dies betrifft v. a die Anforderungen an den Mindestrezyklatanteil und an die Verpackungskennzeichnung Dabei ist jedochzubeachten,dassnichtalleVerpackungenfürMedizinprodukte jeweils ausgenommen sind, sodass es einerspezifischenEinzelfallprüfungbedarf,welcheVerpackungeninwelchemUmfangvoneinzelnenPflichten ausgenommen sind.
Das geplante Verbot der Nutzung von per- und polyfluoriertenAlkylsubstanzen,kurzPFAS,wirktsichauchauf die Medizintechnik aus. Denn viele Medizinprodukte sindmitPFASbeschichtet,weildiesedieidealenEigenschaften mitbringen: PFAS reagieren nur schwer mit anderen Substanzen; Hitze oder Flüssigkeiten machen ihnen nichts aus. Deshalb kommen sie bevorzugt in langlebigen Implantaten wie Stents oder HerzschrittmachernzumEinsatz.AuchinFiltern,Dichtungenund SchläuchenvonDialysegerätensindsieenthalten.PFAS eignen sich zudem ideal für Katheter und Endoskope, weilsiebesonderswenigReibungauslösen.DieseOberflächeneigenschaftenmachensiewertvollfürminimalinvasiveEingriffe Medtech-Herstellerstehenjetztunter Zugzwang, nach Alternativen zu suchen. Mehr dazu können Sie im Beitrag „PFAS-freie Medizinprodukte –Fluch und Chance“ ab Seite 34 nachlesen.
Compliance des Medizinprodukts sicherstellen
MDR,AIAct,Cybersecurity,GreenDeal, Medtech-Hersteller können bei der Vielzahl der Regularien schnell denÜberblickverlieren.Dennochisteswichtig,sichmit ihnen über den gesamten Produktlebenszyklus hinweg auseinanderzusetzen FehlendeComplianceführtnicht nurdazu,dassProduktevomMarktgenommenwerden, sondern kann auch schnell sehr teuer werden. Ratsam ist deshalb, strukturiert vorzugehen:
Prüfen, welche Regularien für das Medizinprodukt gelten,
die Anforderungen über den Lebenszyklus des Medizinprodukts hinweg identifizieren und umsetzen,
die Umsetzung überwachen und ggf. geforderte Änderungen und Aktualisierungen anpassen,
das gesamte Unternehmen einbinden – nicht nur einzelne Abteilungen.
Sokannsichergestelltwerden,dassMedizinprodukte auf dem Markt bleiben (je)

Roboter erobern den Healthcare-Markt im Sturm. Mittlerweile transplantieren Robotersysteme Herzen, Sechsachser arbeiten in der Zell- und Gentherapie, Cobots unterstützen in der Reha oder im Labor und jetzt rücken Mobilroboter in aseptische Bereiche vor. Die Entwicklung ist spektakulär – wie spektakulär erfahren die Besucher der Leitmesse automatica vom 24. bis 27. Juni 2025 in München.
Alle Wachstumsprognosen für Robotersysteme in Pharma, Medizin und Gesundheitswesen kennen nur eine Richtung: steil nach oben. Laut Mordor Intelligence ist von einem durchschnittlichen jährlichen Wachstum von über 16 Prozent bis zum Jahr 2029 auszugehen Auch auf der automatica 2025 steht das Thema im Fokus Auf dem MedtecLIVE Healthtech Pavillon in Halle A4 präsentieren sich unterschiedlichste Aussteller aus dem medizintechnischen Zulieferbereich, die die komplette Wertschöpfungskette abbilden Begleitet wird die Initiative durch den MedtecSUMMIT am zweiten und dritten Messetag in Halle B4 sowie einer kuratierten Auswahl relevanter AusstellerLösungen.
Inspiriert von den Aktivitäten der automatica werden viele Aussteller praxisbewährte Robotik-, Cobot- und Mobilroboterlösungen für Healthtech-Applikationen sowie innovative Montageanlagen für Medical Devices zeigen
Stäubli bietet mit accessPharma, Stericlean und Stericlean+ ein breites Portfolio hygienegerechter Roboter für GMP Klasse A/B-Umgebungen an, etwa für die Zell- und Gentherapie oder Laborautomation. Auch Yaskawa liefert mit den Modellen Motoman HD7 und Motoman HD8 ein hochleistungsfähiges System, das Wasserstoffperoxid-Dekontamination problemlos bewältigt und bereits bei Pharmabotix im Einsatz ist. Parallel erobern kollaborative Roboter wie der Cobotta von Denso die Labortechnik. In der Reha unterstützt der Roboter Robert® von Life Science Robotics Pflegekräfte bei der patientenschonenden Mobilisierung durch lernfähige Bewegungsabläufe – ein anschauliches Beispiel für den praktischen Nutzen robotischer Assistenzsysteme.




Neben innovativer Robotik rückt auf der automatica 2025 auch die automatisierte Serienproduktion von Medical Devices in den Fokus. Führende Anbieter wie Mikron Automation, Teamtechnik, BBS Automation, Kahle und Hekuma – vereint unter dem Dach der Dürr AG – präsentieren leistungsfähige Plattformlösungen für Produkte wie Inhalatoren oder Injektionssysteme. Besonders Mikrons halbautomatische Montageplattform Maia steht exemplarisch für den Trend zu mehr Flexibilität bei kleinen Losgrößen. Ergänzend zeigen Aussteller wegweisende Mobilrobotiklösungen für neue Aufgaben in der Pharmafabrik der Zukunft. Problematisch wird es, wenn mobile Robotersysteme in sterilen Umgebungen zum Einsatz kommen sollen, denn hierfür gab es bislang keine Lösung. Das ändert sich jetzt: Mit Sterimove stellt Stäubli erstmals ein vollständig gekapseltes, GMP-zertifiziertes Fahrzeug vor, das auch in sterilen Umgebungen autonom agieren kann – ein Meilenstein für Transport und Logistik in hochsensiblen Bereichen.

Roboterassistierte Operationssysteme werden zunehmend mit intelligenter Software kombiniert.
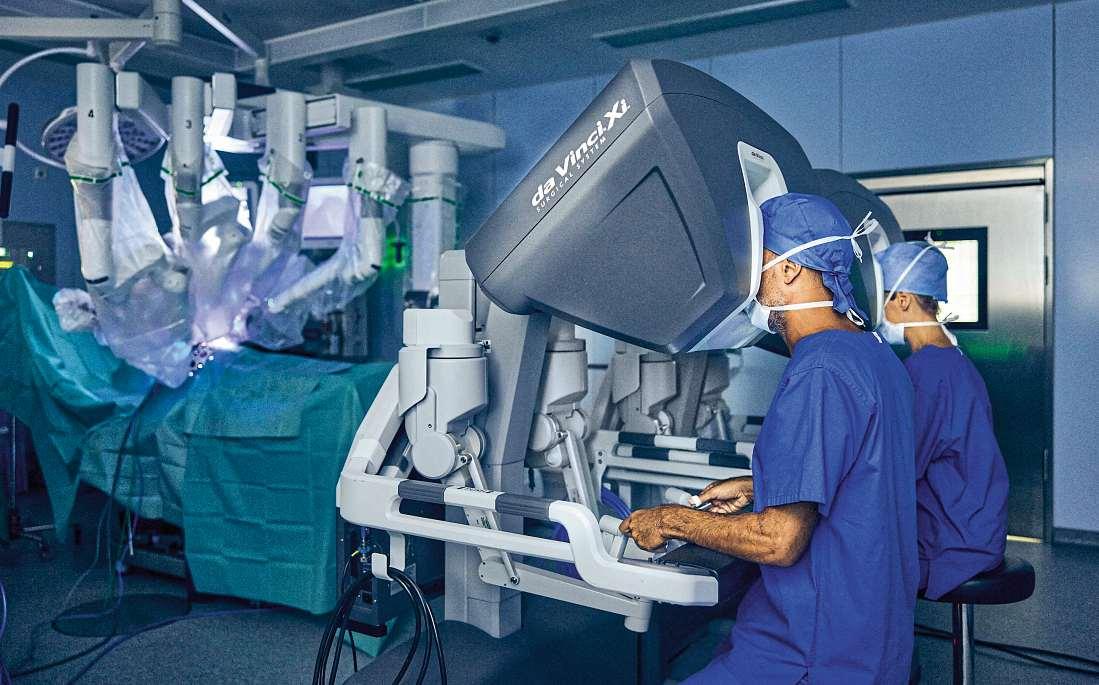
„Shared Autonomy“ im OP
Roboter sind aus vielen OP-Sälen nicht mehr wegzudenken – nun ergänzt künstliche Intelligenz das Team. Sie verspricht eine neue Dimension operativer Präzision und Sicherheit für Ärzte wie für Patienten. Angesichts von Personalmangel und steigenden Eingriffszahlen können KI-gestützte Assistenzsysteme entscheidend für eine zukunftsfähige Chirurgie werden
VERFASST VON
RolandSchulz
Fachredakteur
TBN Public Relations
GmbH
ProfessorAlexanderKönig,kommissarischerLeiter des Lehrstuhls für Robotik und Systemintelligenz anderTechnischenUniversitätMünchen,beschäftigtsichseitvielenJahrenmitdemZusammenspielvon MenschundMaschine.Eristüberzeugt:„AutomatisierteAssistenzsystemekönnendiePatientensicherheiterhöhen. Denn um sie überhaupt am Patienten einsetzen zu dürfen, müssen sie zugelassen werden – in Europa durch die CE-Kennzeichnung, in den USA durch die FDA. Diese Prozesse stellen hohe Anforderungen an Hardware, Software und Prozesse Solche Systeme sind zuverlässigundhandelnnichtunerwartet–undsiewerden nicht müde Das kann die Qualität und Sicherheit erhöhen, auch wenn sie nicht den besten Operateur ersetzen.“
InmodernenOperationssälenhabensichSystemewie „da Vinci“, „Versius“ oder „Hugo RAS“ etabliert. Diese
robotischenHelferwerdenzunehmendmitintelligenter Software kombiniert. KI analysiert, lernt und interpretiert. Der Unterschied zur klassischen Robotik liegt in der Anpassungsfähigkeit: Die Systeme reagieren auf neue Situationen, lernen aus vergangenen Eingriffen und optimieren sich stetig
Dynamische Interaktion
KI-AlgorithmenkönnendabeianmehrerenStellenzum Einsatzkommen.SieidentifizierenOrganeundGefäße aufKamerabildern,berechnendieoptimaleSchnittlinie oder analysieren Vitalparameter in Echtzeit. Die Systemelernen,kritischeSituationenzuerkennenundrechtzeitig zu warnen. So entsteht eine dynamische Interaktion. „Die Medizintechnik ist sehr konservativ – von vollständig autonomen Systemen sind wir noch weit
entfernt“,glaubtAxelWeber,VicePresidentMedicalRobotics bei Kuka „Aber man sollte die Chancen, die zusätzliche Autonomie und Robotik bieten, nicht unterschätzen Gerade KI kann enorm zur Entlastung beitragen,etwabeiderDokumentationvonBehandlungen – auch wenn das nicht direkt etwas mit Robotik zu tun hat.“
Kuka, ein weltweit tätiger Anbieter für intelligente Automatisierung, bringt schon seit einem Vierteljahrhundert seine Erfahrung aus der Industrie in die Medizintechnik ein. Das Unternehmen stellt Roboterplattformen wie den LBR Med bereit, die von Partnern in klinische Lösungen integriert werden. Der Fokus liegt aufflexiblen,kollaborativenSystemen,diesichsicherin den Klinikalltag einfügen. Gerade im Zusammenspiel mit KI entfalten diese Systeme ihr Potenzial
Personalisierte Chirurgie
Der technologische Fortschritt bietet auch ökonomischesPotenzial.EffizientereOP-Abläufe,kürzereLiegezeitenundwenigerFolgeeingriffeentlastendasSystem. Nicht zuletzt ebnet KI den Weg zur personalisierten Chirurgie: Algorithmen könnten künftig individuelle OP-Pläne berechnen, basierend auf der medizinischen Vorgeschichte und Bildgebung
Die Implementierung in der Breite beginnt gerade erst. „Teilautonome Robotiklösungen – ob in der Medizin oder Produktion – sind noch nicht dort, wo wir sie gernehätten.Gleichzeitigsehenwireinstarkwachsendes Interesse von Investorenseite. Man kommt mit 10 ProzentderMittelzwarschonsehrweit,aberdieletzten 10 Prozent bis zur Marktreife erfordern enorme finanzielle Ressourcen – und genau da tun sich derzeit viele schwer“, betont König
Jeder Fortschritt bringt auch Fragen mit sich Technischgesehenstelltv.a dieVerarbeitunggroßerDatenmengeninEchtzeiteineHerausforderungdar Rechtlich und ethisch bleibt ebenfalls manches ungeklärt. Wer haftet, wenn ein KI-System eine falsche Empfehlung gibt? „Dass eine KI in naher Zukunft vollständig autonome Operationen durchführt, halte ich für unrealistisch. Zwar gibt es erste zugelassene medizinische Entscheidungssysteme, aber im Bereich der verkörperten KI–also,wennRoboterphysischmitderWeltinteragieren – sind wir noch weit davon entfernt“, ordnet König ein.„EingroßesForschungsthemaistdaherdie‚Shared Autonomy‘, also die geteilte Autonomie, in der KI und Mensch Hand in Hand arbeiten.“
Weltweit arbeiten interdisziplinäre Teams daran, chirurgischeSystemeintelligenter,sichererundtransparenter zu gestalten. Im Mittelpunkt stehen so genannte „Explainable-AI“-Modelle – also künstliche Intelligenz, deren Entscheidungswege nicht im Verborgenen bleiben, sondern nachvollziehbar sind.
Gefördert wird die Entwicklung durch nationale und internationale Programme. In Deutschland arbeiten Universitätskliniken an der Erprobung KI-basierter Navigationshilfen in der Leberchirurgie oder der automatisiertenGewebeanalyseinderlaparoskopischenOnkologie. Zugleich bringen Start-ups frische Impulse: Ihre modularenPlattformlösungenermöglicheneinestufenweiseIntegrationintelligenterFunktioneninbestehen-
deRobotersysteme–einwichtigerSchritt,umdieTechnologieauchfürkleinereHäuserzugänglichzumachen.
„Wir stehen erst am Anfang einer Entwicklung, die sich in den nächsten Jahren stark beschleunigen wird“, glaubt König „Was heute noch im Labor getestet wird, könnte morgen schon klinischer Alltag sein – vorausgesetzt, wir sichern Qualität und Akzeptanz gleichermaßen.“
Kompetenzanforderungen steigen
DerBlickindieZukunftzeigt:DerOperationssaalkönnte zu einem digitalen Kontrollraum werden, in dem Mensch und Maschine in enger Symbiose agieren KISystemekönntenetwaerkennen,obsicheineunerwarteteKomplikationanbahnt–unddaraufbasierendoperative Alternativen vorschlagen. Auch die Fernsteuerung von Operationen gewinnt an Bedeutung: Durch KI-gestützteAnalyseundpräziserobotischeAusführung sind Eingriffe künftig ortsunabhängig möglich. Gerade in strukturschwachen Regionen oder in Katastrophenszenarien bietet dies eine neue Dimension medizinischer Versorgung
„Entscheidend wird sein, dass wir die Systeme nicht nurtechnischdenken“,mahntKönig „Wirmüssenauch die Auswirkungen auf Rollen, Kompetenzen und VerantwortlichkeitenimBlickbehalten–sonstdrohtÜberforderung statt Entlastung.“
Langfristig wird sich die Rolle der Chirurgen verändern. Sie werden zu Koordinatoren eines hochkomplexen Systems, in dem Entscheidungen zwar vom Menschengetroffen,aberzunehmenddatenbasiertvorbereitet werden. Damit steigen die Anforderungen an AusbildungunddigitaleKompetenz–nichtnurimUmgang mit der Technik, sondern auch im kritischen Hinterfragen algorithmischer Vorschläge. Auch der Regulierungsrahmen muss sich anpassen: Zulassungsverfahren, Datenschutz und Haftung stehen vor grundlegenden Änderungen. Axel Weber: „Der Wandel wird nicht sprunghaft kommen, sondern schrittweise Aber wir müssendieWeichenheutestellen,damitmorgensichere,integrierteundpatientenzentrierteSystemeRealität werden.“
Medtec Live Healthtech Pavilion fördert den Transfer
Vom24.bis27 Juni2025bietetdieMedtecLivemitdem HealthtechPavilionaufdemrenommiertenMesse-Duo Automatica und Laser World of Photonics in München einePlattformfüralljene,diedieseTransformationmitgestalten. Der Gemeinschaftsstand fungiert dabei als Branchen-Vertical für die Medizintechnik – Entwickler und Zulieferer treffen hier auf eine Zielgruppe, die sich auf Automatisierung, Robotik und Photonik konzentriert.
„MitderMedtecLivebildenwirdieganzeWertschöpfungskette in der Medizintechnik-Herstellung ab Mit dem Healthtech Pavilion bringt die Medtec Live jetzt eineAnlaufstellefürInformationenvonHerstellernund DienstleisterndesmedizintechnischenZulieferbereichs nachMünchen“,sagtSilkeLudwig,DeputyDirectorMedtecLive „DabeiliegtderFokusaufLösungenimBereich Automatisierung,RobotikundPhotonik–Zukunftstechnologien, die letztlich auch in effizienteren und zuverlässigen Prozessen im klinischen Alltag münden.“ (je)
TIPP
Vom 24. bis 27. Juni 2025 präsentiert die Medtec Live den Healthtech Pavilion auf dem MesseDuo Automatica und Laser World of Photonics in München.
Die Größe und Komplexität der digitalen Herausforderung bei B.Braun ist beträchtlich, wenn man die Bandbreite der Produkte bedenkt, die durch den Einsatz von Robotik und KI immer komplexer werden.

Cloud-basierte Softwareplattform
In einem komplexen Umfeld wie der Medizintechnik kann es schwierig sein, die Einhaltung einer ganzen Reihe an sich ständig ändernden Regularien in verschiedenen Ländern zu gewährleisten – vor allem, wenn es um Serviceeinsätze geht. Hilfe bietet dabei eine Cloud-basierte Softwareplattform.
Die Fähigkeit, Kundenanliegen zu klären, in jeder Service-Interaktion Wert zu schaffen und langfristige Kundenbeziehungen zu stärken, unterscheidet heute erfolgreiche Serviceorganisationen und HerstellervomWettbewerb–sodas„IDCMarketScape: Worldwide Field Service Management Applications 2023-2024VendorAssessment“ WarfrüherdieAnkunft beimKundendasZiel,daseszuoptimierengalt,müssen Außendienstteams heute die Kunden verstehen und wissen,wasausgefallenist,bevorsieeintreffen.SiemüssendierichtigenTeileundKompetenzenhaben,umdas Problem beim ersten Besuch zu lösen und zusätzliche Mehrwertdienste anzubieten.
B.Braunprägtundbereichertseitmehrals180Jahren das Gesundheitswesen weltweit entscheidend mit. Die Produkte und Lösungen des Unternehmens sowie die umfangreiche Forschungs- und Entwicklungsinitiative setzenneueStandardsinderstationärenundambulan-
ten Versorgung Diese Innovationskraft nutzte B.Braun sowohl bei seinen Gesundheitsprodukten als auch bei den internen Prozessen weltweit, v. a im Bereich des Service. Um das Servicegeschäft in einem vielfältigen undreguliertenUmfeldweltweitzusteuernundweiterzuentwickeln, waren zuverlässige und harmonisierte Daten erforderlich. Idealerweise sollte dies durch eine einzigedigitalePlattformerreichtwerden,umeinehohe Effizienz in Prozessen, bei der Entscheidungsfindung und der Einhaltung gesetzlicher Vorschriften zu erzielen.2016hatderglobaletechnischeServicevonB.Braun die Field-Service-Management-Plattform Servicemax eingeführt,umdieBetriebszeitundLebensdauerseiner Produkte weiter zu verbessern und Serviceabläufe und das Compliance-Management zu optimieren. Servicemax,seit2023TeilvonPTC,bieteteineCloudbasierte Softwareplattform, die die Produktivität von Technikern optimiert, Workflows für betriebliche Effi-
zienz rationalisiert und die Anlagenverfügbarkeit maximiert. Die Software-Suite unterstützt Serviceteams und ermöglicht eine effiziente Servicebereitstellung und -ausführung, eine Steigerung der Serviceumsätze und eröffnet wertvolle, datenbasierte Einblicke In der IDC Market Scape wurde Servicemax als Leader eingestuft.
Von Lebenszyklus und Rückverfolgbarkeit bis hin zu komplexer Compliance
„Unser wichtigster Auslöser für die Umstellung auf ein modernes Field-Service-Management-System war damals die Rückverfolgbarkeit“, erklärt Felix Cramer, Senior Manager Global Service Platform bei B.Braun „In der Medizintechnikbranche sind Lebenszyklus und Rückverfolgbarkeit von entscheidender Bedeutung.“ Ineinemsichschnellveränderndenundzunehmend komplexen Umfeld kann es schwierig sein, die EinhaltungeinerganzenReiheansichständigänderndenRegularien in verschiedenen Ländern zu gewährleisten –und das während des gesamten Lebenszyklus eines jeden Produkts. Zu einer besonderen Herausforderung wird das, wenn es um Serviceeinsätze geht Um sicherzustellen, dass alle Wartungsarbeiten oder Ersatzteile mit den lokalen Vorschriften übereinstimmen, muss B.Braun in der Lage sein, die Wartungsaktivitäten und -verfahrenabzubilden.Alldieserforderteinedetaillierte Dokumentation für Auditzwecke.
„Mit Servicemax haben wir die Servicedaten immer zurHand“,fährtCramerfort.„IndemwirdieService-Aktivitäten in einer Software-Plattform erfassen und analysieren – und nicht mit mehreren Tools mit widersprüchlichenDatenformatenundmanuellenProzessen –,könnenwirQuerverweisemachensowieDatenanforderungen mischen und anpassen, abhängig von den spezifischenAnwendungsfällen.DasspartZeitundGeld undwirkönnenunsaufdiewichtigsteAufgabekonzentrieren–denSchutzunddieVerbesserungderGesundheit der Menschen weltweit.“

Asset-zentrierte Ansicht der Servicedaten
„DieRückverfolgbarkeitunseresinstalliertenGerätebestands, die Servicemax geliefert hat, war 2016 ein entscheidenderWendepunktfüruns.Servicemaxistbereits weltweitimEinsatz,undimLaufedeskommendenJahres rollen wir die Implementierung in weiteren Regionen aus“, fügt Cramer hinzu.
„Unser Ziel ist es, digitale Exzellenz in allen unseren harmonisierten Prozessen zu erreichen, von der RegulierungundCompliancebishinzumVertrieb,denWartungsunterlagen und unserem ERP-System. Aktuell prüfen wir, wie wir Servicemax mit unserer Gesamtarchitekturverbindenkönnen,umeineeinzigeQuelleder Wahrheit für alle Produktdaten in der Organisation zu schaffen Wir wollen datengesteuert sein, nicht dokumentengetrieben. Künftig werden wir uns überlegen, wiewirverschiedenePlattformenimUnternehmen,einschließlichServicemax,ambestenmitunsererGesamtarchitektur verbinden können, anstatt das nur auf der Funktionsebenezutun“,erläutertPhilipHaller,Regional Head IT Germany bei der B.Braun Gruppe.
Die Größe und Komplexität der digitalen HerausforderungbeiB.Braunistbeträchtlich,wennmandieBandbreite der Produkte bedenkt, die durch den Einsatz von Robotik und künstlicher Intelligenz immer komplexer werden, sowie die ständig wechselnden ComplianceVerpflichtungen vieler Regulierungsbehörden und die 66.000 Mitarbeiter rund um den Globus.
„Wir müssen unsere Produktdaten effizient verwalten“, so Haller. „Das bedeutet eine vollständige Digitalisierung und keine Zeit für unproduktive Aufgaben zu verschwenden sowie die Sicherstellung von Genauigkeit, Effizienz und Transparenz.“ Für ein 180 Jahre altes Unternehmen ist das ein gewaltiger kultureller Wandel injederAbteilung „FürunsistServicemaxmehralsnur ein Softwareanbieter Wir haben eine strategische Partnerschaft zwischen unseren beiden Unternehmen. Das bedeutet, dass wir im Rahmen einer langfristigen Kooperation sehr eng zusammenarbeiten.“ (je)









Medizintechnik profitiert von KI-gestützten Lösungen
Der Einzug von künstlicher Intelligenz in medizintechnische Geräte erfolgt mit rasanter Geschwindigkeit – und ihre Sinnhaftigkeit ist in den allermeisten Fällen auch unumstritten. Italien nimmt dabei sowohl mit Blick auf die Innovationskraft als auch bei der Akzeptanz international einen Spitzenplatz ein.
VERFASST VON
MarcoBazzani
Innovation Manager
Teoresi Group
GuidoComai
Operations & Corporate Development Manager
Teoresi MedTech
Künstliche Intelligenz (KI) hat mittlerweile im LifeScience-ÖkosystemItalienseinehoheBedeutung DiesbelegendieaktuellenZahlen:Sosindsichlaut einer Befragung des Politecnico di Milano 93 % der befragten Unternehmen aus der Branche sowie 74 % der medizinischenFührungskräftesicher,dassKIinnerhalb der nächsten drei bis fünf Jahre die personalisierte Medizinrevolutionierenwird.ZudemgabenineinerweiterenUmfragedesPolitecnicodiMilanomehrals70%der italienischen Ärzte an, dass ihrer Meinung nach KI die Präzision bei der Betreuung von Patienten nachhaltig verbessern wird. Geteilt wird dieser Optimismus auch vondenPatientenselbst.Vondenenglaubenrund58%, dassKIdenÄrztenbeiderEntscheidungsfindunghelfen kann. 65 % wären bereit, eine digitale Therapie zu nutzen, sofern diese vom Facharzt vorgeschlagen wird.
Ein Vertrauensvorschuss, der sich auch in den InvestitionenimBereichLifeScienceswiderspiegelt:BeiF&EAusgabenliegenitalienischeUnternehmeneuropaweit anneunterStelle(13,1EuroproEinwohner).MitBlickauf entsprechende öffentliche Ausgaben belegt das Land sogar Platz sieben (14 Euro pro Einwohner).
Kernkompetenz von KI: schnelle und präzise Verarbeitung von Patientendaten Angesichts dieser positiven Einschätzung drängt sich die Frage auf: Woher rührt dieser Optimismus bzw. was machtKIzumGamechangerinderMedizintechnik?Die KernkompetenzderKIindiesemKontextistdieschnelleundpräziseVerarbeitungbzw AnalyseriesigerDatensätze. Nutzbar gemacht wird diese Fähigkeit beispiels-
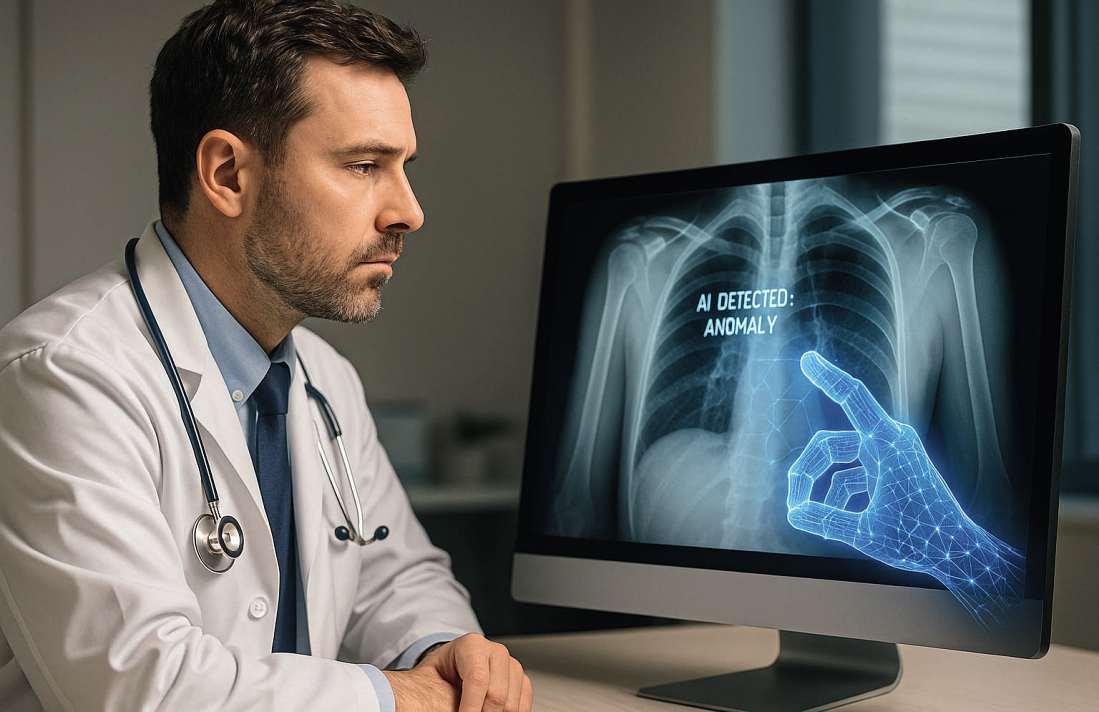

Eine Kernkompetenz der KI ist die schnelle und präzise Analyse riesiger Datensätze. So können Muster und Korrelationen quasi in Echtzeit erkannt werden.
Analyse und Patientenbetreuung: KI in Bildgebungstechnologie und Wearables
Zwei laufende KI-basierte Medtech-Projekte des Unternehmens Teoresi betreffen den Bereich der Bildgebung im Bereich Kardiologie. Dabei geht es zum einen darum, die Bildgebung bei der Analyse von Elektrokardiogrammen durch KI weiter zu verbessern, um Herzrhythmusstörungen automatisch zu erkennen und so die Diagnose zu unterstützen. In einem weiteren Projekt wird KI genutzt, um die vom Echokardiographen erzeugten Bilder und Videos zu analysieren. In beiden Fällen geht es um Entscheidungsunterstützungssysteme – so genannte DSS. Diese dienen dazu, die Arbeit des medizinischen Personals zu verbessern, menschliche Fehler zu reduzieren und dem Arzt Hinweise auf etwaige Probleme des Patienten zu geben.
weise bei der Genomsequenzierung oder bei Bildgebungstechnologien. In beiden Fällen ermöglicht KI quasi in Echtzeit die Erkennung von Mustern und Korrelationen,diebislangentwedergarnichtoderabererst imZugeeineslangwierigenProzessessichtbarwurden. Entsprechende neue Technologien verarbeiten Daten aus klinischen Studien, elektronischen Gesundheitsakten und tragbaren Geräten und werten diese – KI-basiert – aus
KI-gestützte Diagnose-Tools modifizieren bzw. beschleunigendemnachdieErkennungvonGesundheitsproblemen signifikant. Die entsprechenden Systeme nutzen hierzu Algorithmen des maschinellen Lernens, umz.B.medizinischeBilder,genetischeProfile,Lebensgewohnheiten,LaborergebnisseoderKrankengeschichten zu analysieren und so Anzeichen von Krankheiten wie Herzerkrankungen oder Krebs frühzeitig zu erkennen. Die Technologie kann Unregelmäßigkeiten oder Biomarkerfinden,dievonMenschenübersehenwerden könnten – und so Entscheidungen von Ärzten unterstützen, Ergebnisse für Patienten verbessern und dabei Kosten und Komplexität von Behandlungen reduzieren
(Branchenübergreifende) Bündelung von Kompetenzen als Erfolgsschlüssel
Kurz gesagt macht KI personalisierte Medizin zu einer Realität, indem sie auf den Einzelnen zugeschnittene, präziseBehandlungenermöglicht.AufdieserLogikbauen auch zahlreiche Lösungen auf, die Teoresi gemeinsam mit Unternehmen der eigenen Gruppe bzw. mit privatwirtschaftlichenoderakademischenPartnernentwickelt: Die F&E-Philosophie des Unternehmens fußt dabei zum einen auf dem Prinzip, durch die Bündelung von interdisziplinären internen und externen Kompetenzen zukunftsweisende Lösungen zu schaffen Zum anderen ist dieser komplementäre Ansatz branchenüberschreitend konzipiert; das Zauberwort lautet hier Cross-Fertilisation.
Anfangs war das Unternehmen auf den Automobilsektorspezialisiert.MittlerweilehatsichTeoresibreiter aufgestellt.Cross-Fertilisationbedeutetinternv.a.,dass das Fachwissen aus der jahrelangen Zusammenarbeit mitinternationalführendenKundenimAutomobilsek-
Ein weiterer KI-Schwerpunkt liegt auf Wearables. Hier hat Teoresi an einer tragbaren Technologie für die personalisierte Betreuung von Senioren bzw. Patienten mitgearbeitet, die an mehreren, oftmals chronischen Krankheiten leiden. Hierbei sammelt ein modulares System, bestehend aus Sensoren und Parametern, klinische Informationen und speist diese in eine IoMT-Plattform (Internet of Medical Things) ein. Ein weiteres Gebiet, in dem das Unternehmen den Einsatz tragbarer Geräte testet, ist die Parkinson-Therapie: Die entsprechende Technologie erkennt die Bewegung des Arms und stimuliert die Muskeln, um den Tremor zu verhindern oder zu verringern.
Software und Hardware: KI für HPV-Screening und Messung des Venendrucks
In den vergangenen Monaten hat das Unternehmen seine KI-Lösungen nach den genannten Prinzipien – Bündelung interner und externer Kompetenzen und Cross-Fertilisation – auf weitere Anwendungsbereiche der Medizintechnik ausgeweitet. So haben die seit Anfang 2023 zur Unternehmensgruppe gehörenden Firmware-Spezialisten von Hifuture eine auf Machine Learning aufbauende Software für die Interpretation und Verarbeitung von Papillomavirus(HPV)-Genamplifikationsergebnissen entwickelt, die in Screening-Programmen zur Früherkennung von Gebärmutterhalskrebs eingesetzt werden kann.
Bei der im Frühjahr 2024 gegründeten dedizierten Medtech-Sparte gibt es derzeit zwei Neuerungen. Gemeinsam mit einem auf Konzeption und Design von medizinischen Geräten spezialisierten Unternehmen wurde ein nicht-invasives Gerät zur Messung des Venendrucks entwickelt. Mit diesem kann innerhalb weniger Minuten zu Hause, im Krankenhaus oder im Krankenwagen der geschätzte Venendruckwert ermittelt werden. Eine weitere Kooperation hat das tragbare Diagnosegerät Nanoanalyzer für den Nachweis von sechs Biomarkern für traumatische Hirnverletzungen mit Bluttests hervorgebracht. Während herkömmliche Diagnostik auf kosten- und zeitintensiven invasiven CT-Scans aufbaut, liefert der Nanoanalyzer auf Basis von SAW-Technologie (Surface Acoustic Wave) und KI-Algorithmen schnelle und exakte Ergebnisse – und unterstreicht so ebenfalls die Kernkompetenz von KI für die Medizintechnik.
tor zunächst auf die technologische Entwicklung von intelligenten Mobilitätsprojekten übertragen wurde. Von dort aus fand und findet das Know-how dann den Weg in den Bereich Medtech. (kb)
Innovationschance statt Regulierungsbremse
Regulatorische Dokumentation beansprucht in Medizintechnik-Unternehmen bis zu
40 Prozent der Entwicklungsressourcen – Zeit, die besser in neue Produkte investiert wäre. Wer KI sinnvoll nutzt, kann R&D-Ressourcen freisetzen und sich dadurch einen Wettbewerbsvorteil verschaffen.
VERFASST VON
DavidBoutellier
Co-Gründer und CEO
Rematiq
DieMedizintechnikhatmiteinerDokumentationsflut zu kämpfen: Entwickler verbringen einen signifikanten Teil ihrer Zeit mit regulatorischen Tätigkeiten statt mit echter Innovation. Eine Umfrage des BV-Med zeigt, dass 65 Prozent der Medtech-Unternehmen Entwicklungsressourcen in die Regulatorik umlagern müssen. Der Aufwand steigt weiter – nicht zuletzt durch die MDR und strenge Vorgaben der FDA. So sind die Dokumentationskosten unter der MDR im Schnitt um 111 Prozent gestiegen.
Doch in diesem Mehraufwand steckt eine Chance: Wer Compliance nicht als Bürde sieht, sondern strategisch angeht, kann davon profitieren. Ein effizientes, intelligentes Regulatory-Requirements-Management –unterstütztdurchkünstlicheIntelligenz(KI)–beschleunigt Zulassungsprozesse, spart Kosten und verschafft Wettbewerbsvorteile.
Regulatorische Auflagen gelten als Innovationsbremse Nr. 1 in der Branche – und damit wird der Weg von der IdeezummarktreifenMedizinproduktimmerlänger:In EuropadauerteslautBV-MedimSchnitt18Monate,um ein MDR-Zertifikat zu erhalten. Zum Vergleich: In den USAnimmtein510(k)-Verfahrentypischerweisenur90 TageinAnspruch,selbstfürHochrisikoprodukte(PMA) selten mehr als ein halbes Jahr. HinzukommteinemassiveZunahmeregulatorischer Anforderungen: Seit 2015 hat sich die Zahl der relevanten Regularien in der Medizintechnik mehr als verdreifacht.ThemenwieCybersecurity,NachhaltigkeitoderKI machen der Branche zu schaffen. Daraus ergeben sich in komplexen Produkten über 15.000 individuelle Anforderungen,dieeinProduktüberseinengesamtenLe-
KI kann Medtech-Unternehmen bei der Einhaltung von Vorschriften unterstützen und ComplianceProzesse optimieren.

benszyklus hinweg erfüllen muss – inklusive prozessbezogener und länderspezifischer Vorgaben
Traditionell werden diese Anforderungen von hochqualifiziertenFachkräften–oftausderProduktentwicklung – manuell erfasst, gepflegt und dokumentiert. Das ist fehleranfällig, bindet Ressourcen und verzögert Marktzulassungen. Laut einer gemeinsamen Umfrage vonDIHK,MedicalMountainsundSpectarissehenrund 77 Prozent der Hersteller die MDR als Innovationshemmnis ÜberdieHälftehabenbereitsProjekteaufEis gelegt.KeinWunder,dass88ProzentderUnternehmen neue Produkte zuerst in den USA zulassen
Wie KI Innovation beschleunigen kann
AngesichtsdieserHerausforderungennutzenVorreiter inzwischen hochspezialisierte KI, um den Dokumentationsaufwandzuminimieren.WährendgenerativeKIoft noch mit Chatbots assoziiert wird, entstehen zunehmendbranchenspezifischeAnwendungen–v.a instark regulierten Industrien wie der Medizintechnik.
In diesen Spezialfällen ersetzt KI keine Menschen, sondernübernimmtdieAnalyseundVerarbeitungkomplexer, industriespezifischer Texte und baut so einen spezifischen Datensatz auf So kann KI z. B Regularien automatisiertanalysieren,relevantePassagenextrahieren, Versionen vergleichen und daraus konkrete, kontextspezifischeAnforderungenfürdieProduktentwicklung formulieren.
Die Ergebnisse sind nicht generisch, sondern auf die jeweilige Aufgabenstellung in Forschung und Entwicklung, Qualitätssicherung oder Regulatory Affairs zugeschnitten–undlassensichdurchNutzerprüfen,ergänzenundfreigeben.Soentstehteineunternehmensspezifische, strukturierte Datenbank externer Anforderungen, die immer präziser wird, sich dynamisch anpasst und zum strategischen Asset entwickelt.
RoutineaufgabenwiedasVergleichenvonNormenbei Änderungen, das Nachvollziehen regulatorischer Updates oder das Ableiten von Anforderungen lassen sich sosignifikantbeschleunigen–oftmitEinsparungenvon bis zu 90 Prozent. Wichtig bleibt dabei ein „Human-inthe-Loop“-Ansatz: Die KI liefert Vorschläge, aber der Mensch trifft die Entscheidung – insbesondere bei Unsicherheiten oder Interpretationsspielräumen. Mit jedem Durchlauf wird die KI treffsicherer – der Mensch bleibt aber unverzichtbar
Praxisbeispiele aus der Medtech-Branche
Zahlreiche Medtech-Unternehmen haben KI-Pilotprojekte bereits erfolgreich umgesetzt. Ein international führender Hersteller berichtet, dass mit KI-Unterstützung Aufgaben, die früher Wochen dauerten, nun in wenigenTagenerledigtwerden.EinweiteresBeispielist derHörgerätespezialistSonova:DurcheineKI-gestützte DokumentationssoftwarekonnteSonovadieZeitfürdie BearbeitungvonAudit-undZulassungsdokumentenum 80 Prozent reduzieren. Entwickler gewinnen damit wertvolle Zeit für das Produktdesign, während die Software im Hintergrund repetitive Aufgaben übernimmt. Natürlich gibt es Herausforderungen Besonders wichtig: KI-basiertes Anforderungsmanagement entfaltet nur dann sein volles Potenzial, wenn Unternehmen bereits ein objektbasiertes Anforderungssystem eingeführt haben oder dies planen. Erst auf dieser
Grundlage lassen sich regulatorische Anforderungen präzise zuordnen, nachverfolgen und automatisiert in Entwicklungsprozesse integrieren.
Zudem zögern viele Teams noch: Laut einer Umfrage vonGreenlightGurunutzenbislangwenigeralseinDrittelderFachleuteKI-Tools,oftausSorgeumGenauigkeit. HierhelfenklareProzessezurQualitätssicherung,transparente Kommunikation und gezielte Schulung
KI als Compliance-Gamechanger Expertenerwarten,dassKIeinintegralerBestandteilvon Product-Lifecycle-Management(PLM)-undQuality-Management(QM)-Systemen wird und sich entlang des gesamtenProduktlebenszyklusetabliert.Dabeiwirddie TechnologienichtalsErsatz,sondernalsWerkzeugspezialisierter Fachkräfte eingesetzt: KI-Systeme helfen, regulatorischeAnforderungenschnellerzuerfassen,zu strukturieren und nachvollziehbar zu machen.
Das verändert nicht nur die Effizienz, sondern auch dieErwartungshaltung:Washeutenochalstechnologische Pionierleistung gilt, könnte bald zum neuen Standard werden – auch aus Sicht der Behörden. Unternehmen, die jetzt in eine saubere Datenbasis und prozessorientierte Umsetzung investieren, sichern sich nicht nur einen Vorsprung, sondern auch langfristige Anschlussfähigkeit.
EffektivesManagementregulatorischerAnforderungen kann ein Wettbewerbsvorteil sein. Wer früh auf KI-gestützte Compliance setzt, verkürzt Entwicklungszeiten, spart Ressourcen und meistert Regularien mit weniger Aufwand. Richtig eingesetzt wird KI zur Chance – und Compliance entwickelt sich vom Bremsklotz zum strategischen Enabler Medtech-Unternehmen, die diese Chance ergreifen, sparen Zeit und Kosten in signifikantemUmfang–undbringenlebensrettendeInnovationen schneller zum Patienten. (kb)
DeviceMed INFO
Klein anfangen – aber heute: Wer den Einstieg in KI wagt, sollte nicht zu lange abwarten oder nur beobachten. Die Technologie entwickelt sich sehr schnell: Was heute cutting edge ist, wird schon in zwei Jahren Standard sein. Besser: In Pilotprojekten erste Erfahrungen sammeln – etwa bei der automatisierten Analyse regulatorischer Texte oder strukturierter Normenrecherche. So lassen sich Technologie, Prozesse und – am wichtigsten – die Mitarbeiter gezielt vorbereiten.
KI als Enabler der Digitalisierung begreifen: KI ist kein Add-on, sondern ein Katalysator. Sie hilft, bestehende Dokumentationen effizient in datenbasierte Systeme zu überführen – und schafft damit die Grundlage für durchgängige, digitale Entwicklungsprozesse.
Den Wert holistisch betrachten: Auch wenn sich einzelne Prozesse um 70 bis 90 Prozent beschleunigen lassen – Effizienzgewinne sind nicht alles. Genauso wichtig: KI-Kompetenz intern aufbauen, Fachkräfte binden, Innovation beschleunigen. Wer jetzt nicht investiert, riskiert, den Anschluss zu verlieren
Das bedeutet der AI Act für Medtech-Unternehmen
Welche Anforderungen stellt der AI Act konkret an Medizintechnik-Unternehmen? Wie können Hersteller regulatorische Sicherheit und Innovationskraft erfolgreich verbinden? Und wie stellt man sein Unternehmen heute strategisch auf, um morgen zu den Gewinnern im KI-getriebenen Gesundheitsmarkt zu gehören? Eine Analyse von Metecon.

Der AI Act ist mehr als eine regulatorische Vorschrift: Er ist ein Gestaltungsrahmen für verantwortungsvollen, sicheren und innovationsfördernden KI-Einsatz.
Mit dem AI Act (EU 2024/1689) schlägt die EuropäischeUnioneinneuesKapitelinderRegulierungkünstlicherIntelligenz(KI)auf:Zumersten MalweltweitwirdderEinsatzvonKIbranchenübergreifendundrisikobasiertverbindlichgeregelt.ZielderVerordnung ist es, Innovationen und Investitionen zu fördern und gleichzeitig Grundrechte wie Datenschutz, Transparenz und Sicherheit konsequent abzusichern. Was viele unterschätzen: Der AI Act betrifft nahezu jedes Unternehmen, das KI entwickelt oder nutzt – und ganz besonders die Medizintechnikbranche. Für HerstellervonMedizinproduktengehtesdeshalbnichtnur darum,zusätzlicheregulatorischeHürdenzumeistern. Ihr Ziel sollte es sein, mittels AI Act strategisch die Zukunftsfähigkeit zu sichern, Innovationspotenziale zu
nutzen und das Vertrauen in KI-Lösungen aktiv aufzubauen. Denn wer die Anforderungen des AI Acts frühzeitigundgezieltumsetzt,kannnichtnurregulatorische Compliance gewährleisten, sondern auch neue Innovationspfadeeröffnen,vonKI-gestützterDiagnostikbiszu intelligenten Therapieassistenzsystemen.
Doppelregulierung mit System: MDR/IVDR und AI Act im Zusammenspiel
Der AI Act klassifiziert KI-Systeme risikobasiert in vier StufenundordnetAnwendungenimmedizinischenBereich in der Regel automatisch der zweithöchsten Kategorie zu: als sogenannte „Hochrisiko-KI“. Produkte, die bereits unter die MDR (Medical Device Regulation, Verordnung (EU) 2017/745) oder IVDR (In-vitro Diagnostic Regulation, Verordnung (EU) 2017/746) fallen und sicherheitsrelevante KI-Komponenten enthalten, sind deshalb künftig zusätzlich AI-Act-zulassungspflichtig Dabei ersetzt der AI Act die bestehenden Regularien nicht, er ergänzt sie.
Für Medizintechnik-Hersteller entsteht so eine neue regulatorische Realität: Produkte mit KI-Komponenten müssenkünftigparallelbeidenRegulierungswerkengerecht werden. Was bedeutet das konkret?
EinMedizinproduktmitintegrierterKIkanntrotzbestehender MDR- oder IVDR-Zertifizierung eine zusätzlicheBewertungnachdemAIActbenötigen.FürHochrisiko-KI-Systeme (wie KI-gestützte Diagnosesoftware oder Therapieassistenzsysteme) gilt: Die MDR-/IVDRKonformität bezieht sich auf die Sicherheit und Leistungsfähigkeit als Medizinprodukt, die AI-Act-KonformitätaufzusätzlicheAspektewieTransparenz,Robustheit und menschliche Aufsicht der KI.
Je nach Anwendungsfall muss ein separater Konformitätsbewertungsprozess durchgeführt werden, der anderePrüfunterlagenundandereBewertungskriterien umfasst als die klassische MDR-/IVDR-Bewertung. Benannte Stellen sollten dabei frühzeitig eingebunden werden,umSynergienzunutzenundMehrfachaufwände zu vermeiden. Der AI Act stellt zusätzliche AnforderungenandietechnischeDokumentation–insbesondere in den Anhängen IV und VII: Systembeschreibung der KI-Komponente (Architektur, Funktionsweise, Lernprozesse),
Datenmanagement (Quellen, Qualitätssicherung, Bias-Analysen der Trainings-, Tuning- und Validierungsdaten),
Leistungsbewertung (Nachweis der Robustheit, Genauigkeit, Zuverlässigkeit und Sicherheit des KI-Systems),
Human Oversight (Beschreibung, wie menschliche Kontrolle sichergestellt wird),
Cybersicherheit (Darstellung von Schutzmaßnahmen gegen Angriffe und Manipulationen).
DieKI-spezifischenInhaltemüssenzusätzlichzuden MDR-/IVDR-Anforderungen abgedeckt und klar erkennbardokumentiertwerden.EinebloßeErweiterung vorhandenerBerichteohnestrukturelleAnpassungund Kennzeichnung reicht dabei nicht aus.
Während MDR und IVDR bereits umfassende Anforderungen an die Marktüberwachung stellen (z B. Vigilanz, regelmäßige Sicherheitsberichte), geht der AI Act noch weiter und fordert:
Monitoring der KI-Performance: Überwachung auf Veränderungen im Verhalten des KI-Systems im Laufe der Zeit
Protokollierung und Analyse: Speicherung und Auswertung von KI-Entscheidungen, insbesondere bei selbstlernenden Systemen
Korrekturmaßnahmen: Klare Prozesse für Updates, Nachtrainings oder Deaktivierungen bei Abweichungen oder Fehlfunktionen
DieHerausforderungfürHerstellerwirddarinliegen, dass Post-Market Surveillance nicht mehr nur auf klassische Produktfehler reagieren können muss, sondern auch auf veränderte KI-Ausgänge und algorithmische Risiken.
Fasst man die Ziele und Empfehlungen offizieller Quellen(AIAct(Verordnung(EU)2024/1689),Team-NB Positionspapier (April 2025), ISO 13485:2016) zusammen,wirddeutlich,dasseineharmonisierteUmsetzung der Regelwerke MDR/IVDR und AI Act entscheidend sein wird, um redundante Prüfungen zu vermeiden, interneProzesseeffizientzugestalten,Ressourcengezielt einzusetzen und v. a., um Verzögerungen bei Markteinführungen oder Rezertifizierungen zu verhindern.
DamitsehensichHerstellerwiederummitanspruchsvollen und ressourcenintensiven Aufgaben konfrontiert: die MDR-/IVDR- und AI-Act-Anforderungen im Qualitätsmanagementsystem (QMS) prozessorientiert zuverknüpfen,sichfrühzeitigmitihrerbenanntenStelle abzustimmen sowie ihre technische Dokumentation strukturiertzuerweiternmiteindeutigerundkonsistenter Trennung bzw. Integration der AI-Act-spezifischen Inhalte.
DerErfolgbeiderUmsetzungdesAIActstehtundfällt mit einer klaren Verteilung der Rollen und Pflichten. Anders als bei klassischen Medizinprodukten erweitert derAIActdieVerantwortungaufmehrereAkteureentlangdesgesamtenLebenszykluseinesKI-Systems–vom EntwicklerüberdenBetreiberbishinzumHändler Der AI Act definiert verschiedene Akteure mit spezifischen Pflichten (s. Abb. 1)
EinBlickindienaheZukunft:EinArztträgteinesmarte Datenbrille, die ihm in Echtzeit patientenspezifische Hinweise zur besten Behandlungsmethode liefert – KIgestützt, individuell, evidenzbasiert. Im OP unterstützt
Rolle
Beschreibung
Anbieter (Provider) entwickelt/lässt entwickeln, bringt KI-System unter eigenem Namen auf den Markt
Produkthersteller (Manufacturer) wird Anbieter, wenn das Produkt ein KI-System als Sicherheitsbauteil enthält
Betreiber (Deployer) nutzt das KI-System in eigener Verantwortung
Bevollmächtigter (Authorised Representatives) EU-Vertreter für Anbieter, übernimmt Pflichten in seinem Namen
Einführer (Importer)bringt KI-Systeme aus Drittstaaten auf den EU-Markt
Quelle: Met ec on
Händler (Distributor)vertreibt KI-Systeme in der EU, ohne Anbieter/Einführer zu sein Akteur (Operator) umfasst Anbieter, Produkthersteller, Betreiber, Bevollmächtigter, Einführer, Händler
Benannte Stelle (Notified Body) prüft Hochrisiko-KI-Systeme auf Konformität
Marktüberwachungsbehörden (Market Surveillance Authorities) nationale Behörde zur Durchsetzung der Verordnung
Abb. 1: Der AI Act definiert verschiedene Akteure mit spezifischen Pflichten.
einAssistenzsystemdenChirurgenbeikomplexenEingriffenunderkenntautomatischRisikostrukturen Eine AppmeldetsichbeimPatienten,wennseineVitaldaten auffälligwerden,bevorSymptomeüberhauptauftreten All das ist keine Science-Fiction mehr, sondern technisch bereits heute möglich.
Die KI steht bereit, jetzt muss sie sicher und verantwortungsvolleingesetztwerden.DerAIActgibthierfür den Rahmen vor. Und wer als Hersteller von Medizinprodukten jetzt klug handelt, kann diese Technologien nicht nur schneller und sicherer in den Markt bringen, sondern sich auch nachhaltig als Innovationsführer positionieren.
KI verändert die Zusammenarbeit – denn der AI Act stelltbereichsübergreifendeAnforderungen,dietechnisches, regulatorisches, rechtliches und organisatorisches Know-how erfordern. Einzelabteilungen können dieseKomplexitätalleinkaumbewältigen.EininterdisziplinäresProjektteamausManagement,Regulatory,IT, Legal, QM und R&D ist daher entscheidend, um Anforderungen effizient zu integrieren, Zuständigkeiten klar zu regeln und widerspruchsfreie Entscheidungen zu ermöglichen. So wird regulatorische Pflicht zur strategischen Chance.
Die regulatorischen Anforderungen aus MDR und IVDR decken bereits viele wichtige Aspekte wie Risikomanagement, technische Dokumentation und PostMarketSurveillanceab MitdemAIActkommenjedoch neue Anforderungen hinzu, die speziell auf KI-Systeme zugeschnitten sind, wie:
Datenqualität und -Governance (AI Act Artikel 10)
Transparenz und Bereitstellung von Informationen für die Betreiber (Artikel 13)
Protokollierungspflichten (Artikel 12)
Menschliche Aufsicht (Human Oversight) (Artikel 14)
Genauigkeit, Robustheit und Cybersicherheit (Artikel 15)
Viele dieser Themen sind nur teilweise oder anders gelagert in der MDR/IVDR geregelt. Das bedeutet: Hersteller müssen genau verstehen, wo ihre bestehenden ProzesseundDokumentationenbereitsausreichenund wo gezielt nachgearbeitet oder ergänzt werden muss
Aufbau eines KI-Governance-Frameworks
Künstliche Intelligenz unterscheidet sich grundlegend von klassischen Medizinproduktefunktionen: KI-Sys-
Der AI Act gilt bei Inverkehrbringung in der EU und wenn seine Nutzung Menschen in der EU betrifft
VERFASST VON PeterHartung Senior Expert für aktive Medizinprodukte und Software Metecon GmbH
Anforderung MDR/IVDR AI Act
Risikomanagement
Technische Dokumentation (Anhang IV/VII)
Post-Market Surveillance (inkl. Monitoring & Protokollierung)
EU-Konformitätserklärung (separat)
Rolle der Benannten Stellen (eigene Bewertung erforderlich)
Abb. 2: Die MDR/IVDR und der AI Act im Zusammenspiel
teme sind dynamisch, lernfähig und oft nicht vollständig deterministisch. Risiken entstehen nicht nur durch technische Fehler, sondern auch durch Datenqualität, algorithmische Verzerrung (Bias) und unerwartete VerhaltensänderungenüberdieZeit.ZudemverlangtderAI Act eine durchgängige Überwachung und Steuerung dieser Risiken – von der Entwicklung bis zum Betrieb. Ein KI-spezifisches Governance-Framework schafft eine verbindliche Struktur, um diese Anforderungen systematischzumanagenundregulatorischeKonformität dauerhaft sicherzustellen. Es muss alle KI-spezifischen Prozesse regeln: Risikomanagement, Trainings-, Tuning-undValidierungsprozesse,ComplaintHandling sowieDokumentations-undMeldepflichten.Hersteller sollten ihr KI-Governance-Framework als das organisatorischeRückgratihrererfolgreichenAI-Act-Umsetzung verstehen: Ohne ein belastbares Framework ist weder regulatorische Compliance noch nachhaltiger Markterfolg möglich.
DamitKI-SystemeimGesundheitsbereichsicherbleiben,verlangtderAIActeinejederzeitmöglichemenschliche Kontrolle. Explizit gefordert sind klar definierte Eingriffsmöglichkeiten, die Schulung von Nutzern zur korrekten Überwachung und Bewertung von KI-Entscheidungen sowie Mechanismen zur Deaktivierung oder Anpassung von KI-Systemen bei Auffälligkeiten. Zielistes,Fehlentscheidungenzuverhindern,dasRisiko zureduzieren,dasVertraueninKI-basierteMedizinprodukte zu stärken und sich einen Wettbewerbsvorteil
DeviceMed INFO
Der AI Act tritt in mehreren Stufen in Kraft:
Ab 2. Februar 2025: Kapitel I (Allgemeine Bestimmungen) und Kapitel II (verbotene KI-Praktiken) gelten.
Ab 2. August 2025: Teile der Governance, Sanktionen und Anforderungen an KI-Modelle mit allgemeinem Verwendungszweck werden verpflichtend.
Ab 2. August 2026: Hauptteil der Anforderungen tritt in Kraft – inkl Konformitätsbewertungsverfahren, Transparenzpflichten und Überwachung
Ab 2. August 2027: Spezielle Regelung zur Hochrisiko-Einstufung gemäß Artikel 6 Absatz 1 wird aktiv
Die Fristen wirken auf den ersten Blick komfortabel – in der Praxis bleibt aber wenig Zeit: Prozesse müssen neu aufgesetzt, Schnittstellen geschaffen, Teams geschult, Dokumentation erzeugt, Produkte qualifiziert und benannte Stellen rechtzeitig einbezogen werden. Wer 2026 konform sein will, muss 2025 vollständig vorbereitet sein
Quelle: Met ec on
durch erklärbare KI zu sichern: Wer „beherrschbare“ KI liefernkann,hateinenVorteilinMärkten,indenenVertrauen eine zentrale Rolle spielt, z. B. der Medizin. Die Qualität der Trainings- und Betriebsdaten entscheidet maßgeblich über die Leistungsfähigkeit, SicherheitundFairnesseinesKI-Systemsunddamitüber seineregulatorischeZulassungsfähigkeit.Nurwenndie Daten vollständig, relevant, repräsentativ und frei von systematischenVerzerrungen(Bias)sind,kanndasSystemverlässliche,diskriminierungsfreieEntscheidungen treffen. Für Hersteller liegt hier eine entscheidende Stellschraube: Durch transparente Dokumentation, gezielteDatenkontrolleundeinelückenloseNachvollziehbarkeitderSystementscheidungenerfüllensienichtnur gesetzliche Vorgaben, sondern schaffen zugleich VertrauenbeiBehörden,AnwendernundPatienten.Erklärbarkeit und Transparenz sind deshalb nicht nur regulatorische Pflichten, sondern ein aktives Qualitätsmerkmal.
Schulung der Mitarbeiter zu AI-Actspezifischen Pflichten
Alle Beteiligten – von der Entwicklung über die Qualitätssicherung bis zum Management – müssen verstehen: Was verlangt der AI Act konkret? Und wie verändern sich ihre Aufgaben und Verantwortlichkeiten? Regelmäßige,zielgruppenspezifischeSchulungenschaffenhierdienotwendigeGrundlage:SieverhindernFehlinterpretationen, fördern die abteilungsübergreifende Zusammenarbeitundsorgendafür,dassregulatorische Vorgaben effizient und konsistent im Alltag umgesetzt werden.FürHerstelleristdasnichtnureinComplianceFaktor, sondern ein entscheidender Hebel, um Reibungsverluste zu minimieren und eine robuste, zukunftsfähige KI-Strategie im Unternehmen zu verankern.
Cybersecurity ist keine reine IT-Aufgabe mehr, sondern regulatorische Pflicht. Besonders bei KI-Systemen inderMedizintechnikmüssenTrainings-undBetriebsdaten vor unbefugtem Zugriff, Manipulation und Missbrauch geschützt werden; ebenso wie die Entscheidungslogik des Systems selbst.
Planung und Erweiterung der PMS
KI-basierte Medizinprodukte verändern sich, und zwar nichtnurbeiUpdates,sondernpotenziellverbessernsie ihreLeistungauchdurchselbstlernendeMechanismen imBetrieb,sofernsiedafürzugelassenwordensind.Der AI Act trägt dieser Dynamik Rechnung, indem er eine aktive, kontinuierliche Post-Market Surveillance (PMS) verlangt:HerstellermüssennachdemInverkehrbringen dauerhaft beobachten, dokumentieren und bei Bedarf eingreifen.DasumfasstdasMonitoringderSystemleistung unter realen Einsatzbedingungen, die Erfassung undBewertungvonAuffälligkeitenundFehlfunktionen sowiedieUmsetzunggezielterKorrektur-undVerbesserungsmaßnahmen. Für Hersteller heißt das: Die klassische MDR-/IVDR-konforme PMS muss um KI-spezifische Aspekte erweitert werden, insbesondere in Bezug auf die Veränderbarkeit von Modellen, Datendrift oder unerwartetes Nutzerverhalten. Da KI-Systeme künftig sowohlMDR-/IVDR-alsauchAI-Act-Anforderungenerfüllenmüssen,istdieAuswahlundEinbindungderrichtigen benannten Stelle entscheidend. (je)
Krebsdiagnostik
Regulatorisch sichere GenAI für den medizinischen Alltag
Das Schweizer Healthtech-Start-up CGC Genomics strebt mit Qnomx die erste regulatorisch zugelassene Generative-AI-Lösung für die Krebsdiagnostik an – unter EinhaltungvonIVDR,MDRunddemeuropäischen AI Act. Die Plattform wird unter einem ISO13485-zertifizierten Qualitätsmanagementsystem (QMS) entwickelt und bietet eine transparente, auditierbare Alternative zu unregulierten Tools wie Chat-GPT, die aktuell teils in der klinischen Praxis eingesetzt werden.
Weltweit steigt die Zahl der Krebserkrankungen–alleinimJahr2022wurdenüber20 Millionen neue Fälle diagnostiziert. Die gezielteBehandlung(targetedtherapy)basiert zunehmendaufmolekularerTumoranalyse mittels Next Generation Sequencing (NGS) Doch: Nur 20 bis 30 Prozent der Patienten, die laut Leitlinien sequenziert werden sollten, erhalten aktuell überhaupt eine entsprechende Analyse. Der Grund: Laut Umfragen empfinden rund 80 Prozent der Onkologen heutige NGS-Reports als zu komplex, um daraus schnell und sicher eine Therapieentscheidung ableiten zu können Die Interpretation erfordert spezialisiertes Wissen und ist zeitaufwändig
Genau hier setzt Qnomx an: Die KI-gestützte Plattform verarbeitet die Ergebnisse der NGSAnalyse(d h.denfinalenReport der so genannten Tertiäranalyse), übersetzt sie in klare, klinisch relevante ZusammenfassungenundkannsoZeit,Kosten und Interpretationsfehler ersparen. Die interne Anwendung zeigt bereits Effizienzgewinne; diesewerdennuninPilotprojekten mit dem Labor Becker und der Onkomedeor Gruppe in der Praxisvalidiert.Stattbiszuzwei Stunden manueller Analyse liefert Qnomx in wenigen Minuten eine prägnante klinischeZusammenfassungderwichtigstenBefundezurEntscheidungsunterstützung–in der jeweiligen Landessprache und immer mit „Human in the Loop“.

Mitte April sicherte sich das Schweizer Healthtech-Start-up eine Finanzierung in Höhe von 1,7 Millionen Euro. Die Pre-SeedRunde verschafft dem Team die nötige Schlagkraft, um die klinische Validierung abzuschließen, den Marktzugang vorzubereiten und die Plattform international aus-
zurollen.AnderRundebeteiligtsindImpactundHealthtech-InvestorenwieHealCapital, Becker Ventures, Springboard Health Angels,SuperangelsoderdasgrößteImpactAngel-Netzwerk Better Ventures über die Business Angels Christoph Behn, Nicolas Weber und Helmut Deschauer CGC Genomics wurde 2023 von James Creeden(Co-CEO),MarcusOlivecrona(CTO) und Joerg Hoelzing (Co-CEO) ins Leben gerufen, um medizinische Exzellenz mit KIund Geschäftskompetenz zu vereinen. www.qnomx.ai
Wearable
KI-Sensorik verwandelt drahtlose Kopfhörer in intelligentes Wearable TragbareTechnologienhabenindenletzten Jahren erhebliche Fortschritte gemacht, doch viele der bestehenden Systeme sind entwedergeschlossen,alsonichtanpassbar, oder bieten nur begrenzte Messmöglichkeiten. Mit Open Earable 2.0 geht das Forschungsteam um Dr Tobias Röddiger von der Forschungseinrichtung Technology for PervasiveComputing(TECO)desKarlsruher Instituts für Technologie (KIT) nun einen Schritt weiter: Die Open-SourcePlattform für ohrbasierte Sensoranwendungen ist leicht anpassbar und erweiterbar und erlaubt es Entwicklern, maßgeschneiderte Software zu erstellen. So können sie die Ohrhörer individuell für spezifische Anforderungen programmieren. Über eine Kombination von Sensoren lassen sich mehr als 30 physiologische ParameterdirektamOhrmessen–von der Herzfrequenz über Atemmuster bis hin zur Erkennung von Ermüdung und Körpertemperatur.
DieOhrhörersindmiteinerbreiten Palette an Sensoren ausgestattet:Beispielsweiseerfassenmehre-
re Mikrofone Vibrationen im Schädel, um Essaktivitäten zu registrieren. Sie dienen auch zur Spracherkennung in lauten Umgebungen, Bewegungssensoren können Stürze erkennen und Biosensoren messen Gesundheitsindikatoren wie Sauerstoffsättigung und Körpertemperatur
Die Positionierung am Ohr ermöglicht präzise Messungen. So können wichtige Signale erfasst werden, die anderswo am Kör-
per schwer zugänglich sind. Die drahtlosen Ohrhörer kommunizieren über Bluetooth LEAudio,eineenergiesparendeVersionder drahtlosen Datenübertragung Über eine mobile App sowie ein Web-Dashboard verarbeiten und analysieren sie die gesammelten Daten in Echtzeit.

DasPotenzialvonOpenEarable2.0reicht über den Laborbereich hinaus. Die Wissenschaftler haben die Plattform in mehreren Studien validiert. „Es hat sich gezeigt, dass sie physiologische Daten sehr genau und zuverlässig erfasst und im Vergleich zu etablierten Standardmessungen genauere Messergebnisse liefern kann“, erklärt Röddiger Die Plattform könne in der medizinischen Diagnostik zur Früherkennung von Krankheiten beitragen, die Sicherheit in der Industrie erhöhen oderSportlerdurcheinedetaillierte Leistungsanalyse unterstützen. Der nächste Schritt wird es sein, diePlattformweiterzuoptimieren und in verschiedenen realen Szenarien zu testen. www.kit.edu

Das Auge mit seinen schnellen Bewegungen stellt ein anspruchsvolles Fotomotiv dar, Bewegungsunschärfe und Verwackeln sind typische Bildfehler. Um die Diagnostik für Augenärzte und Augenoptiker zu erleichtern, sind schnelle und zuverlässige Spaltlampen-Dokumentationssysteme gefragt.
VERFASST VON
Silke vonGemmingen
Referentin für Unternehmenskommunikation
IDS Imaging Development Systems GmbH
High-End-Bilddokumentationssystem mithilfe digitaler Spaltlampenfotografie
Schnelle und zuverlässige Spaltlampen-Dokumentationssysteme sind in der Augenheilkunde unverzichtbar für präzise Diagnosen.
Ein Wetzlarer Medizintechnik-Spezialist bietet jetzt eine Lösung mit integrierter High-End-Industriekamera, die die digitale Spaltlampenfotografie voranbringt.
DieSpaltlampenuntersuchunggehörtzudenwichtigsten diagnostischen Techniken in der Augenheilkunde.SieermöglichteinedetaillierteUntersuchung des vorderen, mittleren und hinteren Augenabschnittes. Augenärzte können damit kleinste Veränderungen, Anomalien oder Schäden erkennen. Dieses Verfahren dient der Früherkennung sowie der Überwachung des Fortschreitens von Augenerkrankungen. Doch das Auge mit seinen schnellen Bewegungen stellt einanspruchsvollesFotomotivdar,BewegungsunschärfeundVerwackelnsindtypischeBildfehler UmdieDiagnostik für Augenärzte und Augenoptiker zu erleichtern, den Arbeitsablauf zu verbessern und gleichzeitig Untersuchungszeiten zu verkürzen, sind schnelle und zuverlässige Spaltlampen-Dokumentationssysteme gefragt.SiemüssenaussagekräftigeBilderliefernunddazu benutzerfreundlich und ergonomisch gestaltet sein. Das Wetzlarer Unternehmen Oculus Optikgeräte GmbHentwickeltInstrumentezurAugendiagnostikfür
Ophthalmologen,OptometristenundAugenoptiker Teil desumfangreichenPortfolios:einesderweltweitkleinsten und leichtesten Bilddokumentationssysteme für Spaltlampen. Integriert ist eine leistungsstarke, hochauflösende USB3-Vision-Industriekamera von IDS, die sichbesondersfürAnwendungeninderMedizintechnik und Mikroskopie eignet.
Serienaufnahmen mit bis zu 60 Bildern pro Sekunde
Das universelle Spaltlampen-BilddokumentationssystemOculus-Image-Cam3istnichtnurintuitivundleicht zubedienen,sondernsetztauchhoheStandardsindigitaler Spaltlampenfotografie. Dazu gehört ein hervorragendes Sehfeld, das höchst präzise Diagnosen des vorderen,mittlerenundhinterenAugenabschnittesermöglicht. Erfasst werden die Bilder von einer besonders Low-Light-performanten IDS-Kamera aus der USB3-U-
Eye+-CP-Familie. „Nur eine lichtstarke Kamera liefert rauscharme Bilder in den schwierigen Aufnahmesituationen am Auge“, erklärt Michael Moos, Produktmanager bei Oculus, die Auswahl des Kameramodells. Ein weiteres wichtiges Anforderungskriterium ist die Geschwindigkeit. „Durch die fortschrittlichen KameraeigenschaftenlassensichSerienaufnahmenmitbiszu60 Bildern pro Sekunde erstellen. Unter anderem ermöglichen es diese Serienaufnahmen, das Auge in seinen Bewegungspausenaufzunehmen.DieinnovativeFrameOut-Of-Video-Funktion ermöglicht die einfache Dokumentation des gesamten Untersuchungsprozesses an der Spaltlampe, wobei anschließend die qualitativ bestenEinzelbilderfürdieAuswertungausgewähltwerden können“,soMoos.DieOculus-Image-Cam3ermöglicht dies ohne Qualitätsverlust bei gleichzeitig minimalem Zeitaufwand.
Die IDS-Kamera aus der CP-Familie ist für die Anwendung in der Medizintechnik prädestiniert, da sie umfangreiche Pixelvorverarbeitung bietet und über einen internen120-MB-BildspeicherzumZwischenspeichern von Bildsequenzen verfügt. Sie ermöglicht damit eine hoheDatenratevon420MByte/s,einegeringeCPU-AuslastungundeineeinfacheIntegration.DerSonyPregius IMX265 im hier verwendeten Modell gilt als einer der besten CMOS-Bildsensoren in der 3-MP-Klasse. Die USB3-Vision-Industriekamera U3-3270CP Rev.2.2 mit dem 1/1.8" Global-Shutter-Sensor erreicht damit eine Auflösung von 3,19 Megapixeln (2.064 x 1.544 px). „In diesemFallwirddasBildjedochmittelsAOIverkleinert, um eine deutlich höhere Bildrate zu erreichen“, erklärt PhillipSchissler,SalesManagerMedicalandMicroscopy bei IDS Eingebunden hat Oculus die Kamera mit der KamerasoftwareIDSPeak.„MitIDSPeaklassensichKamerafunktionen im Detail testen und für die eigenen Anwendungenoptimieren“,sagtderIDS-Medical-Experte Doch nicht nur hinsichtlich Empfindlichkeit, DynamikbereichundLinearitätempfiehltsichdieKamerafür dieMedizintechnikundMikroskopie.NebendergefragtenLichtstärkeundGeschwindigkeitwarauchdieBaugröße der Kamera ein entscheidendes Auswahlkriterium für das Modell. Das 29 x 29 x 29 Millimeter kleine

MagnesiumgehäusederKameraistmitrund50Gramm ebensoleichtwierobustundunterstreichtihreEignung für platzkritische Anwendungen.
Strahlenteiler mit mechanischer Irisblende Um optimale diagnostische Bilder zu liefern, ist neben der Kamera u. a. auch ein hochwertiger Strahlenteiler BestandteildesSystems EinStrahlenteilerteiltdasLicht zwischen der Kamera und dem Okular der Spaltlampe, umdasAugegleichzeitigzubeleuchtenundzubetrachten, was eine detaillierte Untersuchung des jeweiligen Augenabschnitts ermöglicht. Der Strahlenteiler des Oculus-SystemsverfügtübereinereinmechanischeIrisblende,diedeutlichdieSchärfentiefeerhöht,unabhängig von der Lage des pathologischen Befunds Sie lässt sich außerdem an alle handelsüblichen Spaltlampen adaptieren.
„Die Kameraeinheit und der Strahlenteiler sind extrem klein und leicht. Das bedeutet in der täglichen Praxis: Sie ist kaum zu bemerken, lässt sich ganz einfach anbringen und liefert Bilder wie keine Zweite in dieser Abmessung Dies erleichtert die tägliche Spaltlampendiagnostik im wahrsten Sinne des Wortes“, so der Hersteller
Die Spaltlampenfotos der Oculus-Image-Cam 3 ermöglichen eine objektive Dokumentation der Augenzustände,umeineVerlaufskontrollevonErkrankungen und Behandlungsvergleiche zu erstellen. Auch Patienten profitieren von dem Bild-Dokumentationssystem Die damit erstellten visuellen Referenzen der Diagnose helfen ihnen, ihren Zustand und den Behandlungsplan der Ärzte besser zu verstehen. Die erstellten Befunde lassen sich entsprechend speichern und archivieren. InnovativeBildverarbeitungssystemewiedieOculusImage-Cam, die mithilfe leistungsstarker Industriekamerasaussagekräftige,kontrastreicheBildermithoher Tiefenschärfeliefern,tragendazubei,Diagnosegenauigkeit, Effizienz und Patientenversorgung in der Augenheilkundezuverbessern.KünstlicheIntelligenz(KI)wird zunehmend in die Analyse von Spaltlampenbildern integriert,umKrankheitenautomatischzuerkennen,diagnostische Entscheidungen zu unterstützen, den ArbeitsablauffürÄrztezuverbessernsowieneueBehandlungsmethoden zu entwickeln. (je)
Elastischer Pumpen-, Pharma- und Förderschlauch für höchste Ansprüche
• High-Tech-Elastomer EPDM/PP: Temperaturbeständig bis +135 °C, UV-beständig, chemikalienresistent, niedrige Gaspermeabilität
• Für Schlauchquetschventile und Peristaltikpumpen: Bis zu 30 mal höhere Standzeiten gegenüber anderen Schläuchen
• Biokompatibel und sterilisierbar: Zulassungen nach FDA, USP Class VI, ISO 10993, EU 2003/11/EG
Reichelt Chemietechnik GmbH + Co.
Englerstraße 18 D-69126 Heidelberg
Tel. 0 62 21 31 25-0
Fax 0 62 21 31 25-10 rct@rct-online.de
Produktentwicklung
Kooperationen mit den richtigen Partnern führen schnell zu
neuen Lösungen für das Gesundheitswesen. Wie genau das funktioniert, zeigen Projekte von Haeberle, einem Spezialisten für multifunktionale Wagensysteme.

Gemeinsam mit den Kooperationspartnern Laserneedle und Medilab hat Haeberle Gerätewagen und Produkte für das Gesundheitswesen entwickelt.
In einer Zeit, in der Innovation und Schnelligkeit entscheidende Erfolgsfaktoren sind, hat Haeberle gemeinsam als Entwicklungs- und Designpartner mit den Kooperationspartnern Laserneedle und Medilab Gerätewagen und Produkte für das Gesundheitswesen entwickelt. Diese Zusammenarbeit, geprägt von einer gemeinsamen Philosophie und Vision, hat es ermöglicht,inkurzerZeitNeuentwicklungenaufdenMarktzu bringen.DieSynergienindiesenPartnerschaftenzeigen sichindenEntwicklungen,diesowohlmitihrentechnologischen Features als auch in der praktischen Anwendung überzeugen.
Mit Fokus auf das Ziel, Nutzer in medizinischen Einrichtungen effizient zu unterstützen, haben Haeberle und Laserneedle in einer Kooperation einen maßgeschneiderten Gerätewagen für Anwendungen in der Lasertherapieentwickelt DerLaserneedle-Gerätewagen basiertaufdemWagensystemFuegovonHaeberle.DieseszeichnetsichdurchseineDesign-undFunktionsviel-
falt aus, die es ideal für die Kombination mit technisch anspruchsvollen medizinischen Geräten macht.
Durch die Integration der Lasergeräte in das FuegoWagensystem wird eine optimale Mobilität und Benutzerfreundlichkeit ermöglicht. Diese ermöglicht es Anwendern,dieLasertherapieflexibelundeffizientinverschiedenen klinischen Umgebungen einzusetzen.
Diese Entwicklung macht den Laserneedle-Gerätewagen zu einem State-of-the-Art-Wagensystem, das in der Orthopädie, Physiotherapie, Neurologie, in Dentalbereichen sowie in der Sportmedizin und Laserakupunktur erfolgreich eingesetzt wird.
Kompetenzbündelung ergibt Produkte mit neuen Standards
Mit dem Laserneedle-Gerätewagen, individualisiert für eine effiziente und sichere Lasertherapie, wurde eine optimale Lösung für die herausfordernde Organisation
der Lichtwellenleiter in der Lasertherapie geschaffen Das Wagensystem Fuego von Haeberle wurde exakt auf dieAnforderungenderLasertechnologieangepasst.Ingenieure beider Unternehmen haben in kürzester Zeit eine Produktentwicklung geschaffen, die höchsten Anforderungen gerecht wird und auch das Branding von Laserneedleintegriert.Sowurdenu.a.einweißesFahrgestell,eineweitereAblageplatte,einejustierbareVESAHalterung sowie ein Monitorhalter für die Aufnahme des Laserneedle-Touch-Systems integriert.
Bernd Hofacker, Geschäftsführer von Haeberle, beschreibt:„DieZusammenarbeitmitLaserneedlewarfür uns eine sehr bereichernde Erfahrung Durch die enge Kooperation konnten wir ein maßgeschneidertes Wagensystem entwickeln, das den speziellen Anforderungen der Lasertherapie gerecht wird. Unsere Entwicklungsabteilung hat intensiv daran gearbeitet, eine Lösung zu schaffen, die sowohl funktional als auch ästhetisch überzeugt. Wir sind stolz auf diese intensive Partnerschaft und dass unser Fuego-Wagensystem als Laserneedle-Gerätewagen einen wichtigen Beitrag zur Optimierung der Arbeitsprozesse in der Lasertherapie leistet.Wirstrebendanach,Meilensteinezusetzenund höchste Werte in unsere Produkte zu integrieren, um eine harmonische und effiziente Arbeitsumgebung zu schaffen sowie die Welt des Gesundheitswesens hochwertig zu gestalten.“
Neue Meilensteine im Gesundheitswesen setzen
Die definierte Mission von Haeberle ist es, die AusstattungderPflege-undGesundheitseinrichtungenaufdas „nächste Level“ zu bringen. Durch maßgeschneiderte WagensystemeundneueEntwicklungenwillderGerätewagenhersteller die Arbeitsumgebung für medizinisches Personal sowie das Behandlungserlebnis von Patienten verbessern. Entwicklungskooperationen mit Unternehmen, die diese Vision teilen und ihre Kompetenzen einbringen, um neue Produktinnovationen zu realisieren, stehen auf der Agenda bei Haeberle, die als AnbietervonmultifunktionalenWagen-undTrägersystemen auch im internationalen Markt etabliert sind.
Nachhaltigkeit und Umweltbewusstsein als wichtige Bausteine
Haeberle legt großen Wert auf Nachhaltigkeit und Umweltbewusstsein. Das Unternehmen setzt auf umweltfreundliche Materialien und Produktionsprozesse, um die ökologischen Auswirkungen zu minimieren, sowie auf recycelbare Materialien und energieeffiziente Produktionsmethoden. Auch diese Aspekte werden in den KooperationeneinegroßeRollespielen „UnserEngagement geht über die reine Produktentwicklung hinaus –wir bei Haeberle wollen nachhaltige ‚next-level‘Produktinnovationen in das Gesundheitswesen bringen“, erklärt Hofacker
Synergieeffekte als Basis für die Weiterentwicklung
Ein weiteres Beispiel dafür, dass Innovationsgeist, gemeinsame Visionen und hohe Entwicklungsschnelligkeit entscheidend für den Fortschritt sind, ist die KooperationvonHaeberlemitdemUnternehmenMedilab
Hier wurde gemeinsam das neuartige Moveo-WagensystemfürdieCare-Therapy-Geräteentwickelt.Medilab istaufdieEntwicklungunddenVertriebvonmodernen Geräten für die Physiotherapie und Rehabilitation spezialisiert.DieMedilabCare-TherapyisteineneueMethodeimBereichderphysikalischenTherapieundRehabilitation. Der Gerätewagen Moveo – als ideale Basis für die Care-Therapy-Geräte – wurde u. a. um eine speziell angefertigte Stahlplatte, Kabelführungen, Sensor- und Flaschenhalter ergänzt, so dass er alle notwendigen Funktionen für eine effiziente und komfortable Therapie bietet. Diese durchdachte Integration ermöglicht denTherapeuteneineflexibleundsichereNutzung,die die Behandlungsergebnisse verbessert und Arbeitsabläufe optimiert.
Marktpositionierung durch starke Vision und Partner
„Die Synergieeffekte, die wir durch gemeinsame VisionenundBündelungderKompetenzenmitunserenEntwicklungspartnernerzielen,lassendiebestenLösungen entstehen. Wir sind überzeugt, dass daraus auch neue, vielversprechende Kooperationen entstehen werden. Das Ergebnis von leidenschaftlichem Ingenieur-Knowhow, hoher Präzision und Umsetzungsstärke sind neue Produktentwicklungen für das Gesundheitswesen. Wir sehen,dasswirmitunsererStrategieaufeinemsehrguten Weg sind“, so Bernd Hofacker. (je)
Der Gerätewagen Moveo – als ideale Basis für die CareTherapy-Geräte – wurde u. a. um eine speziell angefertigte Stahlplatte, Kabelführungen, Sensorund Flaschenhalter ergänzt.
VERFASST VON VeronikaGuld
Agentur für Public Relations & Medien
PFAS-Verbot
Ein PFAS-Verbot würde die Medizintechnikbranche hart treffen –müssten doch viele Geräte und Hilfsmittel komplett neu entwickelt, getestet und zertifiziert werden. Welche Chancen liegen hier für Hersteller und worauf muss die Branche sich einstellen? Ein Überblick.

Durch den Einsatz von PFAS werden z. B Outdoor-Ausrüstungen wasser- und schmutzabweisender. In der Medizintechnik punkten viele PFAS mit einzigartiger Biokompatibilität.
PFAS(per-undpolyfluorierteAlkylsubstanzen)sind ein Erfolgsmodell par excellence. Allein durch ihren Einsatz werden Outdoor-Ausrüstungen, Lebensmittelverpackungen,medizinischeHilfsmittelund andere Produkte widerstandsfähiger, wasser- und schmutzabweisender, hitzebeständiger, gleitfähiger, anti-haftendundvielesmehr HinzukommtdieeinzigartigeBiokompatibilitätvielerPFAS,diefürdiemoderne Medizintechnik unerlässlich geworden ist.
Dochsovielversprechendsieklingenmag,dieErfolgsgeschichte der PFAS hat auch eine dunkle Seite: Als „ewigeChemikalien“sinddieunsichtbarenSubstanzen extrem langlebig Sie verbreiten sich Stück für Stück in derUmweltundreichernsichinNahrungskettenan.So haben bspw. das UFZ Helmholtz Zentrum für UmweltforschungunddasDeutscheZentrumfürNeurodegenerative Erkrankungen festgestellt, dass PFAS Leberschäden, Krebs, Störungen des Immunsystems, Fruchtbarkeitsprobleme und andere Krankheiten verursachen können.
VERFASST VON
StefanLange
Text 4 PR
DieListedermöglichen„Nebenwirkungen“vonPFASist lang – sehr lang sogar Deshalb haben Behörden aus mehreren Ländern die Europäische Chemikalienagen-
Ra umedic A G
tur(ECHA)aufgefordert,einmöglichesVerbotvonPFAS zu prüfen. Entscheidet sich die Europäische KommissionfüreineeuropaweiteSubstitutionvonPFAS,wäredas Ende dieser hilfreichen Substanzen eingeläutet. Viele Unternehmen gehen davon aus, dass ein PFASVerbotdieBereicheMedizintechnikundPharmabesondersharttreffenwürde,dennhierkommenPFASinden verschiedensten Produkten zum Einsatz. Ohne PFAS wärenunzähligeAnwendungeninderAnalytik,beider HerstellungvonImpfstoffenundverschiedeneImplantat-Technologien derzeit praktisch nicht mehr umsetzbar Das Ende von PFAS könnte also dazu führen, dass herkömmliche Herzkatheter, Endoskope, Schläuche, Implantate, Kanülen und viele medizinische Standardkomponenten zu einem Zeitpunkt X nicht mehr verwendet werden dürfen. Kommt das Verbot, müssten viele Geräte und Hilfsmittel komplett neu entwickelt, getestet und zertifiziert werden.
Veränderungen voraus
Tatsächlich könnte die finale Entscheidung über das europaweite Verbot von PFAS schon sehr bald fallen, denn die EU möchte einheitliche Regeln für die Registrierung, Bewertung, Zulassung und Beschränkung von Chemikalien (REACH) sowie eine aktualisierte Trinkwasserverordnung erlassen. Hierzu gehört auch die Erweiterung einer bestehenden Liste von eingeschränkt nutzbarenundgänzlichverbotenenPFAS Nochhatder Gesetzgebernichtentschieden.DochangesichtsderRisiken, die von PFAS nachweislich ausgehen, liegt „die Betonungvorallemaufdemnoch“,meintDanielMielert vomMedizintechnik-SpezialistenRaumedic.AlserfahrenerProduktentwicklersuchtMielertnachPFAS-freien Materialien und testet die verschiedensten Materialien auf ihre Eignung für Ärzte bzw. Patienten. Mielert stellt fest: „Wenn wir ehrlich sind, spielt der offizielleTerminfürdasPFAS-Verbotschonlängstkeine Rolle mehr Mit dem Einsatz dieser Substanzen stellen sichheutesovieleethischeFragen,dasswirnichtmehr wegschauen können. Das Verbot ist nur der letzte Schritt. Sobald es ausgesprochen ist, wird ein finaler Wettlauf einsetzen, dem keiner mehr entrinnen kann –HerstellermüssenProdukteneuentwickeln,derenHerstellbarkeit und Anwendbarkeit umfangreich testen sowiealleerforderlichenZertifizierungenbiszumTagX
erfolgreich absolvieren.“ Die Herausforderung scheint gewaltig, denn die Zulassungsbehörden müssten in der Tat alle eingereichten PFAS-Alternativen nach den veränderten europäischen Vorgaben ganzheitlich prüfen undeindeutigfeststellen,obdieSubstitutionsprodukte bzw. -materialien den neuen Anforderungen entsprechen.IndiesemZusammenhanghatderBundesverband Medizintechnologie (BV-Med) bereits im Mai 2023 in einer offiziellen Stellungnahme darauf hingewiesen, dassdasPFAS-VerbotweitüberdiedurchdieMDR(Medical Device Regulation) geschaffene Anforderung hinausgehen würde. Demnach müssten Medizinprodukte, die PFAS enthaltende Medizinprodukte substituieren, „nicht nur neu zertifiziert werden, sondern ihre gesamteZusammensetzungwürdeeinekomplettneueSicherheits- und Leistungsprüfung erfordern. Die Zertifizierung für eine materialbasierte Produktumgestaltung würde Designkontrollaktivitäten wie Material-Scoping, Materialentwicklung, Einrichtung und Qualifizierung vonLieferanten,Produktübernahmeeinschließlichder EntwicklungvonHerstellungsprozessen,Leistungstests undErstellungoderAktualisierungdertechnischenDokumentation, klinische Tests und die Zertifizierung durch benannte Stellen umfassen.“
BetroffenehabeneinlegitimesRechtaufihreGesundheit. Dennoch ergeben alternative Produkte erst dann auchSinn,wennihremedizinischePerformanceunddie RisikobewertungmitdenPFASmithaltenkannoderdiese sogar übertrifft Hinzu kommt die Gesamtbetrachtung in Bezug auf Nachhaltigkeit, Energie und Umwelt sowie Sicherheit.
Jetzt schnell handeln?
Verfolgt man die aktuellen Berichte über das bevorstehendePFAS-Verbot,gewinntmanschnelldenEindruck, dassdereuropäischenKunststoffindustriedramatische Zeitenbevorstehen.Doch„genaugenommenbietetder konsequentePFAS-VerzichtvieleChancen“,erklärtMielert. „Denn Unternehmen, die bereit sind, mutig und frühzeitigneueWegezugehen,könnensichinden‚neuen alten‘ Märkten wertvolle Plätze sichern.“ Universitäten,InstituteundUnternehmensuchenseit Jahren nach Alternativen. So hat beispielsweise das Fraunhofer IFAM im November 2024 erste PFAS-freie Materialienvorgestellt,dieauchdenAnforderungender Medizintechnik entsprechen. Nicht zuletzt werben ersteAnbieterbereitsmitderPFAS-Freiheitvonausgewählten Produkten.
Dennoch halten sich viele Hersteller in Bezug auf die PFAS-Substitution nach wie vor bedeckt Das bedeutet nicht zwingend, dass sie untätig sind. Wir sollten vielmehrdavonausgehen,dasssiediesesThemalängstauf ihre Agenda gesetzt haben, aktuelle Entwicklungen genau beobachten und alternative Lösungen vorbereiten –sowiedieRaumedicAGausdembayerischenHelmbrechts.DerMedizintechnikspezialistbietetseinenKunden beispielsweise maßgeschneiderte Drug-DeliverySystemesowieLösungenfürdieKardiochirurgie,fürdas Neuromonitoring sowie für die Orthopädie, aber auch ProduktefürdieZell-undGentherapieundv.a Komponenten.
Seit vielen Jahren hat Raumedic ein PFAS-freies MaterialimProgramm,dasgleitoptimiertunddaherbeider Herstellung von kundenspezifischen Silikonstopfen sehr gefragt ist. Doch die ebenso beliebten Softkanülen
When performance is vital.
ÜBERNEHMEN SIE
TIPP
Weitere Informationen zum Thema finden Sie auf www.devicemed.de, Stichwort PFAS



PFAS-freie Lösung von Raumedic für die Drug Delivery: Auswahl an Softkanülen Bild: Ra umedic A G

von Raumedic werden u. a. aus FEP (TetrafluorethylenHexafluorpropylen-Copolymer) gefertigt. Obwohl derzeit keine gesundheitlichen Gefährdungen bekannt sind, die von FEP ausgehen, könnte es vom geplanten Verbot der ECHA betroffen sein. Daher entschied sich dasUnternehmen,alternativeMaterialienzutesten,die ebenso flexibel, gleitfähig und medikamenten- wie patientenverträglich sind wie die bisherige Lösung Die neuen Konzepte sind sehr vielversprechend, denn Raumedic ist damit in der Lage, praxistaugliche Materialalternativenanzubieten.IndiesemZusammenhang versteht sich das Unternehmen als Entwicklungspartner,derengmitseinenKundenzusammenarbeitet,um individuelle Lösungen für spezielle Anwendungen zu erarbeiten.
Die PFAS-freie Zukunft auf eine breite Basis heben
Die bisherigen Ausführungen zeigen klar, dass es keine Alternative zu einer PFAS-freien Zukunft gibt und dass der Umstieg nicht auf Leuchtturmprojekte beschränkt seindarf DabeistelltsichnatürlichauchdieFragenach dem „Wie“, denn wir sprechen bei einem PFAS-Verbot von bis zu 10.000 betroffenen Substanzen und somit überweiteTeilederindustriellenProduktionindenBereichen Kunststoff, Medizintechnik und Pharma.
SomitbestehteinezentraleAufgabeinderIdentifikation und Analyse von Produkten sowie Prozessen, die PFAS enthalten. Anbieter sind also in der Pflicht, ihr gesamtesProduktportfoliozuanalysierenundkritische Komponenten wie Schläuche, Geräte, Verpackungen, Hilfsmittel und andere medizintechnische Komponenten lückenlos zu identifizieren
DasselbegiltfürForschungundEntwicklung Beiausreichenden Ressourcen und Kompetenzen kann diese Aufgabenatürlichinhouseerfolgen.DochvieleMedizintechnikanbieterverfügenhiernurüberbegrenzteKapazitäten,denndieBrancheisthocharbeitsteilig Mittlerweile werden Komponenten in der Regel von spezialisierten Dienstleistern nach den Vorgaben eines Anbieters entwickelt und produziert Daher benötigen viele Anbieter für die erfolgreiche PFAS-Substitution einen sehr erfahrenen Partner, der geeignete Materialien in hoherQualitätschnellundzuverlässigentwickelt Inder Regel geschieht das in speziellen Pilotprojekten, in denen der Entwicklungsdienstleister neue Produkte und Materialientestet–auchinFormvonklinischenStudien – und die technische bzw kommerzielle Machbarkeit vor der Antragstellung zuverlässig validiert. DadieseAufgabenoftmalsanspruchsvollsind,sollten Anbieter bei der Entscheidung für den richtigen Entwicklungspartner äußerst sorgfältig vorgehen und v. a jene Unternehmen in Betracht ziehen, die durch eine
hohe Materialkompetenz, Innovationskraft und erste ErfahrungenimUmgangmitkundenspezifischenPFASAlternativen überzeugen
Sind diese beiden Schritte erfolgreich absolviert, folgen die nötige (Re-)Zertifizierung, neue Strategien und Wege in Vertrieb und Marketing, (technische) Umstellungen oder Anpassungen in der Serienfertigung und vieleandereAufgaben,damitKundenund/oderPatienten lückenlos weiter versorgt und von der Qualität der neuen Materialien überzeugt werden können. Gelingt das nicht, drohen Versorgungslücken, ist die Qualität nichtwieerwartetodersteigendiePreisedeutlich,steht das Vertrauen einer ganzen Branche ernsthaft auf dem Spiel.
Das Ende von PFAS hat längst begonnen
Keine Frage, das angekündigte PFAS-Verbot hat die Gemüter erhitzt. Doch der große Aufschrei ist vorbei und das Verbotsverfahren der EU die einzig logische sowie folgerichtigeKonsequenz.DieserSchrittsolltedieeuropäische Medizintechnikbranche, die seit jeher für hohe Qualität und Zuverlässigkeit steht, nicht im Geringsten überraschen. Schließlich wissen die Protagonisten seit der Veröffentlichung erster Studien, worauf sie sich beimThemaPFASeingelassenhaben.Damitstehteinzig undalleinderZeitpunktdesVerbotsalsungewisseGröße in den Sternen. Dem gilt es nun zuvorzukommen. HierzuerläutertMielert:„Schauenwirnachvorn,anstatt zu klagen und an Dingen festzuhalten, die keine Zukunft haben. Aus meiner Sicht ist die Situation eindeutig–fürUnternehmen,dieesgewohntsind,innovativ zu denken und sich dynamisch mit dem Markt zu bewegen, bietet ein PFAS-Verbot viel mehr Chancen als Risiken. Genau genommen macht die EU PFAS nun sogar zu einem Nachhaltigkeitsthema im Interesse von GesundheitundUmwelt.AuchwenneinzelneAnbieter heutenochverunsichertsind,glaubeich,dassdieeuropäische Wirtschaft gestärkt aus diesem Prozess hervorgehenwird Denn:DiePFAS-SubstitutionistderAnstoß für eine nachhaltige Diversifikation. Diese Form der Transformation zwingt zur Innovation. Das mag schmerzlich sein, doch sobald die Alternativen mit den entsprechenden Patenten und Zertifikaten vorliegen, kann die europäische Industrie ihre guten Karten und ihreneuenTrümpfeiminternationalenWettbewerbvoll ausspielen.“
Für eine nachhaltig erfolgreiche Entwicklung bedarf essehrvielInnovationundDynamik.IndiesemProzess sind erfahrene Entwicklungsspezialisten mit hohem Material-Know-howbesondersgefragt,dennsiekönnen die PFAS-Substitution auf breiter Basis umsetzen und jenen Anbietern, die über keine eigenen Entwicklungsressourcenverfügen,neueMöglichkeiteneröffnen–damit die betroffenen Produkte weiterhin in der gewohntenQualitätundohnezwischenzeitlicheLieferengpässe angeboten werden können. Hierzu ergänzt Mielert abschließend:„WersichaufdasPFAS-Verboteinstelltund rechtzeitig vorbereitet, muss nichts befürchten. Im Gegenteil.AusunsererSichtkanndasVerbotgetrostkommen. Dennoch muss die Umstellung richtig gemacht werden.NursowirdsieaucherfolgreichseinundUnternehmen in ganz Europa deutlich voranbringen.“ (je)
Modularität und Komfort für anspruchsvolle medizinische Anwendungen
Der neue Push-Lock Medical von Odu überzeugt durch einen intuitiven PushPull-Verriegelungsmechanismus, der eine schnelle, sichere und fehlerfreie Verbindung gewährleistet. Besonders in der Medizintechnik, wo Effizienz und Präzision im Arbeitsalltag entscheidend sind, bietet dieser Steckverbinder einen Mehrwert. Die Modularität des Systems ermöglicht eine individuelle Anpassung an die spezifischen Anforderungen der jeweiligen Anwendung, von der Signal- und Datenübertragung bis hin zur Stromversorgung. Die Vorteile des Push-Lock Medical:

Hygienisches Design: Der Steckverbinder besteht aus robusten, reinigungsfreundlichen Materialien, die für den Einsatz in sterilen Umgebungen geeignet sind.
Einfache Handhabung: Dank des Push-Pull-Mechanismus ist ein schnelles und sicheres Stecken und Lösen auch unter Zeitdruck oder mit Handschuhen möglich.
Vielseitigkeit: Die modulare Bauweise erlaubt eine flexible Konfiguration für unterschiedliche medizintechnische Anforderungen.
Langlebigkeit: Der Push-Lock Medical bietet eine hohe mechanische Lebensdauer, ideal für Anwendungen mit häufigem Steckzyklus.
Individuelle Belaserung: Auf dem Gehäuse kann ein Logo, ein individuelles Motiv oder ein Code zur Rückverfolgbarkeit des Steckverbinders gemäß UDI angebracht werden. https://odu-connectors.com/
Großes Sortiment an Edelstahlkupplungen Hygienesicher

DasProduktprogrammvonKBK Antriebstechnik umfasst Kupplungen mit verschiedensten Eigenschaften: Während MetallbalgkupplungenDrehmomente hochpräzise und spielfrei übertragen, kompensieren ElastomerkupplungenSchwingungen undStößeundverlängernsodie Lebensdauer von Maschinen und Anlagen. GelenkkupplungeneignensichfürdiedrehstarreDrehmomentübertragungbei großem Radial- und Winkelversatz. Magnetkupplungen werden für die dauerhafte Absicherung von Überlastvorgängen eingesetzt, Schlitzkupplungen übertragen auf engem Raum hohe Drehmomente.
InderEdelstahl-AusführungzeichnensichalleKupplungendurcheinelange Lebensdauer und eine hohe Beständigkeit gegenüber Hitze und Korrosion aus DeshalbwerdendieauchbesondersleichtzureinigendenKupplungeninmedizintechnischen Anwendungen und in Verpackungsanlagen verbaut.
Für Anwendungen mit besonders hohen Anforderungen an den Korrosionsschutz bietet KBK die Kupplungen auch in V4-Edelstahl sowie als lasergeschweißte Variante an. Mit diesen Eigenschaften sind die Kupplungen prädestiniert für den Einsatz in Umgebungen mit höheren Temperaturen. Sämtliche Kupplungen für hygienekritische Applikationen werden mit hochfesten Edelstahlschraubengeliefert,dieeineuneingeschränkteDrehmomentübertragung gewährleisten. www.kbk-antriebstechnik.de
INNOVATION IN MINIATURE











INNOVATIVE LÖSUNGEN FÜR FLÜSSIG-
Die Lee Company bietet innovative Lösungen auch für präzise Flüssigkeitsdosierung in verschiedenen Branchen. Von medizinischer Diagnostik bis zur wissenschaftlichen Forschung – mit der revolutionären Disc Pump Technologie und den schnellschaltenden Ventilen setzen wir neue Maßstäbe. Lee Komponenten ermöglichen kompaktere und leichtere Geräte, revolutionieren die Labor- und Medizintechnik, sparen Raum und maximieren Leistung und Präzision. Machen Sie Ihre Anwendungen kompakter, effizienter und präziser!
Interesse? Kontaktieren Sie uns!
+49 6196 77369-0 info@lee.de | www.lee.de



Hydroaktive Wundversorgung
Gesichtsmaske aus biosynthetischer Cellulose in Medizinproduktqualität
Jenacell, ein Unternehmen der Evonikgruppe, hat den Wundverband Epicite Calm entwickelt. Der Verband soll Gesicht und Halsbereich nach Laser-, Licht- und energiebasierten Behandlungen versorgen. Epicite Calm wird nach eigenen Angaben als weltweit erster medizinischer Verband aus biosynthetischer Cellulose nach den Normen der Europäischen Medizinprodukteverordnung (MDR) zertifiziert sein. Er bietet eine
sichere, sterile und hypoallergene Option, diedieNachwirkungenmindern,dieWundheilung fördern und den Patientenkomfort verbessern soll.
DerhydroaktiveWundverbandwurdeentwickelt, um ein feuchtes Wundmilieu zu schaffen, das die Heilung fördert und die AusfallzeitennachästhetischenBehandlungen mit energiebasierten Technologien wie CO2-Laser und Radiofrequenz(RF)-Micro-

needling minimieren soll. Diese Verfahren werden zur Steigerung der Kollagenproduktion und gegen Zeichen der Hautalterung eingesetzt. Aufgrund ihrer Intensität können Wunden entstehen, die mit leichten Verbrennungen vergleichbar sind. Einige Technologien dringen bis zu sieben Millimeter tief in die Dermis ein. Ärzte können sich daher Haftungsrisiken aussetzen, wennsieaufdergeschädigtenHautProdukte von nicht-medizinischer Qualität anwenden.
Der in Deutschland unter strengen Reinraumbedingungen hergestellte WundverbandsolleinesichereundsterileOptionfür Dermatologen und plastische Chirurgen sein. Das Produkt wird aus natürlicher biosynthetischer Cellulose hergestellt und ist daher nicht okklusiv und hypoallergen. Es werden keine Duftstoffe, Konservierungsmittel und Parabene eingesetzt.
Epicite Calm ist das neueste Produkt der Epicite-Familie für die moderne, hydroaktive Wundversorgung und basiert auf dem Produktportfolio von Jenacell zur Behandlung von Verbrennungen und chronischen Wunden.
www.evonik.com Bild: E vo nik
Mobile Schlaganfalleinheit
Schlaganfalldiagnose
Für Schlaganfallpatienten ist eine rechtzeitige Behandlung entscheidend. Mobile SchlaganfalleinheitenkönnenwichtigeZeit einsparen, weil sich der Verdacht auf einen Schlaganfall noch vor Einlieferung in die Klinikbestätigenlässt.IndiesemZugestellt Siemens Healthineers seine mobile Lösung fürdieSchlaganfalldiagnosevor,diezeitkritischeTherapieentscheidungenbeschleunigen und Patienten schnellstmöglich die richtigeBehandlungzukommenlassensoll. Das Herzstück der Lösung ist der in den Krankenwagen integrierte CT-Scanner SomatomOn.site ErlieferteinehoheBildqualität, die mit stationären Scannern vergleichbar ist, und unterstützt damit eine zuverlässigeErkennungvonIschämienoder Blutungen.
Somatom On.site ist nahtlos in den Krankenwagen integriert und liefert CT-Bilder des Kopfes am Ort der Versorgung für schwerkrankePatienteninderselbenhohen QualitätwiestationäreCT-Geräte–nochvor Einlieferung in die Klinik. Ein integrierter Kopfhalter sorgt dafür, dass der Kopf in der richtigen, isozentrischen Position des Scanners gehalten wird. Der am Boden fixierte Trolley und die Teleskop-Gantry von Soma-
tomOn.sitereduzierenBewegungsartefakte, die normalerweise durch Bewegungen des Scanners entstehen.
Die digitale Plattform Stroke Connect ermöglicht eine durchgängige Bildübertragung und überbrückt damit Datensilos vor und nach der Aufnahme im Krankenhaus. So kann das radiologische und neurologischeKlinikpersonalausderFerneperAudioundVideoübertragungdenSchweregraddes
Schlaganfalls beurteilen. Dank dieses telemedizinischen Ansatzes können Ärzte den Fall im Voraus einordnen und Therapieentscheidungentreffen,nochehediePatienten dasKrankenhauserreichen.Durchdiefrühzeitige Diagnose vor Ort können die Patienten direkt einer spezialisierten Behandlung zugeführt werden, etwa in die Angio-Suite zur Thrombektomie. www.siemens-healthineers.com
Schnelle Verfügbarkeit
In vielen Branchen werden Aktoren benötigt, die höchste Genauigkeit unter extremen Bedingungen erfordern. Genau hier setzt PI Ceramic mit seinen Picma-StackMultilayer-Piezoaktoren an. Die Aktoren können nicht nur bei Temperaturen bis zu 150°C, Feuchtigkeit und AC/DC-Betrieb zuverlässig arbeiten, sondern gewährleisten darüberhinausPräzisionimSubnanometerbereich und schnelle Reaktionszeiten im
Für Blutzucker-Sensoren
Klebstoff

Delo hat einen lichthärtenden medizinischenKlebstoffaufden Markt gebracht: Delo Photobond MG4047 wurde für tragbare medizinische Anwendungen wie Glukose-Sensoren entwickelt. Mit einem Elastizitätsmodul von 230 MPa und einer Reißdehnung von 200 Prozent bei einer Druckscherfestigkeit von 9 MPa ist Delo Photobond MG4047 ein hochflexibler und gleichzeitigausreichendstarker Klebstoff EinerdergrößtenVorteile ist die IBOA-Freiheit. Isobornylacrylatisteinechemische Verbindung, die in vielen Polymermaterialien vorkommt und als herauslösbares Material gilt. Wennmedizinische,vonPatienten getragene Wearables Medien wie Regen oder Schweiß ausgesetzt sind, können kleine Mengen extrahiert werden und mit der Haut in Kontakt kommen, was zu Reizungen oder Allergien führen kann. Die IBOA-FreiheitreduziertdasRisiko solcher Reaktionen. www.delo.de
Mikrosekundenbereich. Das Unternehmen, das zahlreiche Piezolösungen für Industrie und Forschung herstellt, bietet mit diesen Aktoren ein Produkt an, das sich ideal für den Einsatz in einer Vielzahl von Anwendungen und Branchen eignet. Mit UHVKompatibilität bis 10–9 hPa sind die Multilayer-Aktoren optimal für Ultrahochvakuum-Anwendungen geeignet. Variable Geometrien und gekapselte Ausführungen
ermöglichen einen maßgeschneiderten Einsatz.
Künftigkönnenbiszu1.000Picma-StackMultilayer-Piezoaktoren, in Abhängigkeit vom Querschnitt, in nur vier Wochen statt wiebisherzwölfWochenhergestelltwerden DiesistaufeinesignifikanteVerkürzungder Durchlaufzeiten sowie eine Optimierung in der Lagerhaltung zurückzuführen. www.piceramic.de
















































Antriebslösungen
Thomson Industries, Hersteller mechanischer Antriebslösungen, hat sein OnlineAuswahltool für Gleitgewindetriebe mit erweitertenKonfigurationsoptionenfürseine Miniaturmodelleausgestattet.DieinDurchmessern von 2, 3 und 4 mm erhältlichen Thomson-Miniaturgewindetriebe wurden speziell für Anwendungen entwickelt, die eine kompakte, präzise Antriebslösung erfordern – insbesondere für die Märkte der
Medizintechnik, Robotik und Automatisierung In der aktualisierten Version verfügt das Auswahltool über ein dynamisches Einblendfenster (ein so genanntes „Modalfenster“), in dem die Anwender die Bearbeitung des abgestützten und angetriebenen Endes der Spindel nach Bedarf anpassen können Für das abgestützte Ende können verschiedene Standard-Lagerzapfen konfiguriert werden. Zu den wählbaren Konfigurations-

varianten für das Antriebsende gehören eineintegrierteMotorkupplungfürdasRapid PrototypingsowieÜbermaß-Zapfen,diemit handelsüblichen Lagern kompatibel sind. Mit diesen Funktionen können die Anwender direkt auf der Thomson-Website ihre maßgeschneiderte Sonderlösung konfigurieren.DamitwirdderWegvonderAuswahl bis zur Bestellung deutlich verkürzt „Unser Ziel war es, den KonfigurationsprozessfürunsereMiniatur-Gleitgewindetriebe so niederschwellig und effizient wie möglichzugestalten.Somitmüssensichunsere Kunden nicht erst an den technischen Support wenden, sondern haben direkten Zugriff auf leistungsstarke Konfigurationswerkzeuge“, erklärt Ojesh Singh, Produktmanager bei Thomson Industries für die Region EMEA. „Dieses Update manifestiert unserVersprechen,dieErstellungvonPrototypenzuunterstützen.Dasgiltinsbesondere für Branchen, in denen es auf kurze Innovationszyklen ankommt.“ Typische Einsatzbereiche für die Miniatur-Gleitgewindetriebe sind medizinische Handgeräte wie InjektionspumpenundGreifersowieRobotik-und kompakte Automatisierungssysteme. www.thomsonlinear.com/de Bild: T ho mso n Industries
Drehmomentsensoren
Universell einsetzbarer Robotikantrieb
Sensojoints kommen in Industrie- und Medizinrobotik zum Einsatz. Sie sind deshalb voll nach allen für das Sicherheitsintegritätslevel SIL3/PLe relevanten Sicherheitsnormen zertifiziert: IEC 61508, IEC 62061, IEC 61800-5-2 sowie ISO 13849. Bislang mussten Hersteller von Cobots und Medizinrobotern ihre Antriebeselbstentwickelnundzertifizieren lassen – mit hohen Kosten und jahrelangem Zeitaufwand. Wer stattdessen die einbaufertigen Sensojoint-Antriebe in seine Robotik-Lösungen integriert, spart sich diesen gesamten Aufwand und sichert sich Wettbewerbsvorteile.
Die Sensojoints bringen die Entwicklung sensitiver Robotiklösungen gleich in mehrfacher Hinsicht nach vorn. Herz der Sensojoints sind die patentierten Drehmomentsensoren von Sensodrive mit einer hohen Messgenauigkeit,dieauchunter Einfluss von Störfaktoren stets hochpräzise Performance bieten.DiesePräzisionbeiDrehmo-
mentmessung und -regelung verleiht den Sensojoints eine hohe Sensitivität. Ob Industrie-Cobot oder Stative für Operationsmikroskope – die Sensojoints lassen sich in nahezu jede Robotiklösung integrieren, welche die Sensitivität einer Drehmomentregelung benötigt. Dank universeller Schnittstellen,flexiblerSoftware-Lösungen und diverser Baugrößen bieten sie für jede sensitive Anwendung eine Antriebslösung Die integrierten Sensodrive-AdvancedControl-Algorithmen garantieren hohe Genauigkeit bei der Bewegungsausführung und eine zuverlässige Positionsregelung So verhindert beispielsweise die aktive Schwingungsdämpfung zuverlässig unerwünschtes Nachschwingen und ermöglicht mit präziser ReibungskompensationdasfeineAusregeln kleinster Schwingungen – auch bei höheren Trägheiten und Traglasten.

Die Sensojoints sind in fünf Standardgrößen mit jeweils mehreren Leistungsoptionen verfügbar Bei Bedarf werden Komplettantriebe individuell auf die Anforderungen des jeweiligen Kunden abgestimmt. www.sensodrive.de Bild: J . SP ./Sensodriv e
One-Person-Surgery soll Realität werden Cyber-physischer OP-Roboter made in Germany
Das deutsche Deep-Tech-Start-up Hellstern Medical hat mit Noac eine Core Technology entwickelt Noac ist ein cyber-physischer OP-Roboter, der jede Bewegung des Chirurgen in Echtzeit fühlt, sensorbasiert stabilisiert und Ausdauer, Präzision und Konzentration auf ein neues Niveau hebt. Noac erweitert den menschlichen Körper der Operateure funktional – und bringt ihn auf das Leistungsniveau industrieller Robotik. Mit dieser Technologie wird es möglich, IndustrieroboterindenOperationssaalzuintegrieren–unddadurchOne-Person-SurgeryRealität werden zu lassen.
Noac liefert damit eine Lösung für zwei der größten Herausforderungen im globalenGesundheitswesen:denFachkräfteman-
gel und die Ineffizienz operativer Prozesse. Weltweit müssen aktuell bis zu 40 Prozent allerOperationenverschobenoderabgesagt werden – allein wegen fehlendem Fachpersonal.Zugleichhabenbislangnurrundfünf Prozent der Patienten Zugang zu roboterassistierter Chirurgie – und damit zu mehr Präzision, Stabilität und Sicherheit im OP Das ändert Noac: Erstmals können bis zu 95ProzentallerchirurgischenEingriffe–darunterauchoffeneundstandardisierteOperationen–robotischmitUnterstützungvon Noac durchgeführt werden. Damit erhalten Millionen Patienten Zugang zu präziser, stabiler und sicherer Chirurgie – unabhängig von Personalengpässen. www.hellstern-med.com
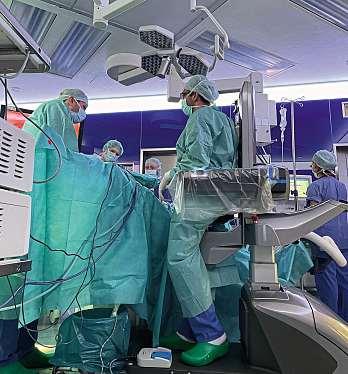
Service-Robotik
Denso Robotics stellt den Healthcare AMR (HAMR)vor:einenautonomenLieferroboter für den „Last-Meter“-Warentransport in Krankenhäusern und Laboren. Entwickelt wurde die Lösung in strategischer Partnerschaft zwischen Denso Robotics und Robotise, einem auf Service-Robotik spezialisierten Unternehmen mit Sitz in München. HAMR ist mit individuell bestückbaren, verschließbaren Schubladen ausgestattet und kann in einer Fahrt mehrere Stationen (Service Points) ansteuern. Daher eignet er sichfürRoutinelieferungenvonProben,Medikamenten oder Materialien zwischen Lager, Labor und Krankenstation. Nach Abschluss seiner Tour kehrt der Lieferroboter selbstständig zur Ladeposition zurück und
Neurostimulation
wartet auf den nächsten Einsatz. Ein laut Hersteller weltweit einzigartiges Merkmal: Der Roboter verfügt optional über eine integrierteKühleinheit,diedentemperaturkontrollierten Transport sensibler medizinischer Güter wie Laborproben, Zytostatika (Medikamente zur Hemmung des Zellwachstums in Tumoren) oder Impfstoffe ermöglicht – direkt im mobilen System, ohne externeInfrastruktur Darüberhinausistder Roboter mit einer digitalen Bezahllösung ausgestattet, etwa für die automatisierte Ausgabe von Verpflegung oder ggf. auch Apothekenware.
Der Healthcare AMR interagiert nahtlos mit der Gebäudeinfrastruktur: Automatisierte Türen, Tore und Aufzüge können an-
Stimulationssystem ermöglicht eine selektive
Aneuvo hat für sein Exastim-System die CEKennzeichnung sowie die Zertifizierung nach ISO 13485 erhalten. Damit ist der Weg fürdieklinischeAnwendungundMarkteinführung des RückenmarkstimulationssystemsinEuropageebnet.Exastimisteintragbares Neurostimulationsgerät, das elektrische Impulse an ein Multi-Elektroden-Pad sendet, um Nerven entlang des Rückenmarks und der Rückenwurzeln zu stimulieren. Das Neurostimulationssystem besteht aus drei Grundteilen, die zusammenarbeiten sollen, um die motorische Funktion zu verbessern: einem tragbaren Pulsgenerator, externen Elektroden und einem Patientenprogrammierer Das System wird über eine proprietäreProgrammiersoftwareaufeinem
gesteuertwerden–ganzohnemenschliches Zutun.DurchdievollautomatisierteBelieferung von Laboren sowie die Integration in bestehende Krankenhaus-Managementsysteme(KIS/LIS)lässtsichderRoboternahtlos in die vorhandenen klinischen Prozessabläufe einbinden. So entstehen keine Medienbrüche, manuelle Übergaben werden überflüssig
Dank der Kooperation mit Robotise und der umfassenden Erfahrung des UnternehmensinderIntegrationmobilerRobotikim Gesundheitswesen erfüllt HAMR alle relevanten EU-Normen und Sicherheitsstandards und ist bereits in mehreren Pilotprojekten im praktischen Einsatz. www.densorobotics-europe.com/de
handelsüblichen mobilen Digitalgerät gesteuert. Hierüber lassen sich Stimulationsprogramme einstellen und speichern. Die Einstellungen werden drahtlos über eine Bluetooth-VerbindungvomTabletzumPPGStimulationsgerät kommuniziert.
Das Stimulationssystem ermöglicht eine gezielte und selektive Rückenmarkstimulation, die nicht-invasiv erfolgt – d. h., sie erfordertkeineOperation,keineSchnitteund keinEinführenindenKörper DasSystemist darauf ausgelegt, die motorische Funktion bei Personen mit chronischen Rückenmarksverletzungen zu verbessern, und soll dieWiederherstellungbeschädigterkortikospinaler Verbindungen erleichtern. www.aneuvo.com
Bild: Aneuv o
Mehr Klimaschutz und Ressourcenschonung lässt sich beziffern.
Mithilfe des Eco-Design-Konzepts und mit Vorher-Nachher-Vergleichen berechnet der Kunststoffspezialist Pöppelmann FAMAC den Product Carbon Footprint (PCF) eines Produkts und legt die Reduktion von Treibhausgas-Emissionen (THG-Emissionen) offen.
Von sterilen Verpackungen bis zu hochpräzisen funktionalenBauteilen–KunststoffistausBereichen wie der Pharmaindustrie oder der Medizintechnik nicht mehr wegzudenken. Doch während viele Unternehmen lange Zeit v. a die Sicherheit und Funktionalität beim Entstehungsprozess ihrer Produkte im Fokus hatten, bezieht moderne Produktentwicklung inzwischen auch in streng regulierten Branchen mehr undmehrdieUmweltaspekteein.Unternehmenstehen dabei vor der Herausforderung, ressourcenschonende Materialien und Herstellungsverfahren zu integrieren, ohnedieQualitätoderdiestrengenregulatorischenAnforderungenzubeeinträchtigen.AmEndestelltsichoft die Frage, ob die Maßnahmen für mehr Umwelt- und KlimaschutzunterdemStrichdiegewünschteWirkung erzielt haben.
Sicherheit, Effizienz und mehr Ressourcenschonung vereint
Bei dieser Bewertung unterstützt Pöppelmann FAMAC. Als Spezialist für technische Bauteile und Baugruppen ausKunststofffürdiePharmabranche,dieMedizintechnik sowie Labor & Diagnostik verfolgt die Division der Pöppelmann-Gruppe aus Lohne höchste Qualitätsstandards und erfüllt die regulatorischen Anforderungen nach GMP (Good Manufacturing Practice) Durch sein umfassendes,nachISO13485zertifiziertesQualitätsmanagement mit strengen Produktionskontrollen sowie der lückenlosen Rückverfolgbarkeit der ProduktionsschrittehatsichdasUnternehmenalszuverlässigerPartner von Kunden aus streng regulierten Branchen etabliert. Doch bei Pöppelmann FAMAC geht man noch einen Schritt weiter: Neben kompromissloser Qualität undGMP-KonformitätsetztderKunststoffspezialistauf mehrKlimaschutzundRessourcenschonunginderProduktentwicklung Diese findet nach den Prinzipien des Eco-Design-Konzepts statt. Optional berechnet das Unternehmen auch den Product Carbon Footprint (PCF) eines Produkts, legt damit das Optimierungspotenzial im Vergleich zu bestehenden Artikeln offen und macht Verbesserungen in Bezug auf den ökologischen Fußabdruck messbar Mit dieser Kombination aus Präzision und Umweltbewusstsein profitieren Kunden von einer ressourcenschonendenundzugleichhochfunktionalen Produktgestaltung.
Product Carbon Footprint: Messbare Optimierungen
Der PCF bezeichnet die Gesamtmenge an THG-Emissionen, gemessen in CO2-Äquivalenten, die über den gesamten Lebenszyklus eines Produkts entstehen. Er umfasst alle Phasen – von der Rohstoffgewinnung über
VERFASST VON
LeaMiddendorf
Key-Account-Manage-
rin Vertrieb FAMAC Verpackungen
dieProduktion,denTransport,dieNutzungbiszurEntsorgungoderdemRecycling–undwirdbeiPöppelmann von der Wiege bis zum Werkstor („cradle-to-gate“) berechnet.„DerPCFverschafftUnternehmenTransparenz überdieKlimaauswirkungenihresProdukts.Siekönnen transparent nachvollziehen, an welchen Stellen die meisten THG-Emissionen entstehen und gezielt Maßnahmen zur Verbesserung vergleichen“, betont Mike Landwehr, stellvertretender Vertriebsleiter bei Pöppelmann FAMAC. Der besondere optionale Service des KunststoffspezialistenistderVorher-Nachher-Vergleich: DerPCFeinesbestehendenKundenartikelswirdberechnet und den Werten gegenübergestellt, die das Produkt mit den von Pöppelmann FAMAC entwickelten VorschlägenzurVerbesserungerreichenkann.MitdenVergleichen auf Basis fundierter Daten können Kunden ganztransparentnachvollziehen,wiesichÄnderungen imProduktdesignoderHerstellungsprozessaufdieUmweltbilanz auswirken. Dank der präzisen BerechnungsmethodenkönnendieReduzierungennichtnurinTonnen beziffert, sondern auch monetär bewertet werden, erklärt Mike Landwehr: „Jede eingesparte Tonne hat einen wirtschaftlichen Wert. Indem wir Optimierungen messbarmachen,unterstützenwirunsereKundennicht nurbeieinerverbessertenUmweltbilanz,sondernauch dabei, diese Optimierungen in Euro-Beträgen auszudrücken.“
Produktentwicklung nach dem Eco-Design-Prinzip
WiePöppelmannFAMACzudiesenberechenbarenOptimierungengelangt,verräteinBlickhinterdieKulissen
DeviceMed INFO
Pöppelmann FAMAC steht für höchste Qualitätsstandards in der Kunststoffverarbeitung für streng regulierte Branchen – mit GMPzertifizierten Prozessen, lückenloser Rückverfolgbarkeit und innovativer Produktentwicklung. Dabei macht der Kunststoffspezialist Optimierungen messbar: Mithilfe von Vorher-Nachher-Vergleichen des Product Carbon Footprints (PCF) wird die Reduzierung von Treibhausgas-Emissionen präzise berechnet, sodass sie sich wirtschaftlich bewerten lässt. Das Unternehmen unterstützt damit nicht nur mit zuverlässigeren und gleichzeitig ressourcen- und klimaschonenderen Produkten, sondern schafft für seine Kunden konkrete Mehrwerte, die sich auch in monetären Kennzahlen abbilden lassen.
„DerPCFverschafftUnternehmen TransparenzüberdieKlimaauswirkungen ihresProdukts.Siekönnentransparent nachvollziehen,anwelchenStellen diemeistenTHG-Emissionenentstehen undgezieltMaßnahmenzurVerbesserung vergleichen.“
Mike Landwehr, stellvertretender Vertriebsleiter bei Pöppelmann FAMAC
der Produktentwicklung in Lohne. Diese findet nach dem Eco-Design-Konzept statt. Dabei werden die Umweltaspekte eines Produkts entlang seines gesamten Lebenszyklus einbezogen, um Ressourcenschonung und die Reduktion von THG-Emissionen voranzutreiben.Zielistes,denökologischenFußabdruckeinesProduktssogeringwiemöglichzuhalten.DasEco-DesignKonzept basiert auf den drei Säulen Reduce, Reuse und Recycle.„Reduce“beinhaltetdieReduzierungdesMaterial-undEnergieeinsatzesdurchoptimiertesDesignund effizientere Prozesse. Mit „Reuse“ ist die Nutzung wiederverwendbarerMaterialienundVerpackungskonzepte gemeint. „Recycle“ schließlich bezeichnet die Entwicklung von Produkten mit verbesserter Recyclingfä-
higkeitunddieSchließungvonWertstoffkreisläufen.„In BranchenwiederPharmabrancheoderMedizintechnik istesallerdingsaufgrundderstrengenRegulierungsehr schwer,dasfüreinProdukteinmalgewählteMaterialzu ändern, z. B. im Hinblick auf eine bessere Recyclingfähigkeit. Hier gibt es aber andere Stellschrauben, mit denen man den Ausstoß von THG-Emissionen senken kann. Dazu zählen Aspekte wie Designoptimierungen, die in der Logistik die Emissionen reduzieren, Prozessanpassungen,mitdenensichderEnergiebedarfsenken lässt, und weitere“, sagt Vertriebsspezialist Landwehr
Praxis-Beispiel Medizintechnik: Optimierte Atemsystemfilter
EinerfolgreichesBeispielfürdieUmsetzungdiesesAnsatzes ist ein gemeinsames Projekt von Pöppelmann FAMACundderDrägerwerkAG&Co.KGaA,einemLübeckerHerstellervonMedizin-undSicherheitstechnik. Hier war der Kunststoffspezialist Entwicklungspartner für Kunststoffteile von Atemwegsfiltergehäusen für die Anästhesie und Intensivmedizin. Pöppelmann FAMAC konntemitseinerweitreichendenKunststoffkompetenz umfassendeBeratungbieten,sodassgleichmehrereAnsatzpunkte zur Optimierung genutzt wurden. Das ReDesign brachte die ursprünglich runden Filter-Bauteile ausKunststoffineinequadratischeForm.DasdafüreingesetzteMaterialkonntedurchAngussrückführungen, alsodurchdieWiederverwendungvonKunststoffanteilen,diebeimSpritzgießenentstehen,abernichtTeildes eigentlichenBauteilssind,nochbessergenutztwerden. Durch das überarbeitete Design sind die Bauteile nun

Atemsystemfilter, konstruiert nach Eco-Design-Konzept: Das Projekt belegt, dass Nachhaltigkeit auch in streng regulierten Bereichen, z. B in der Medizintechnik, möglich ist.
Konsequente Klimastrategie der Pöppelmann-Gruppe: Kontinuierliche Produkt-Optimierungen – für volle Leistungsfähigkeit und verbesserte Umweltbilanz
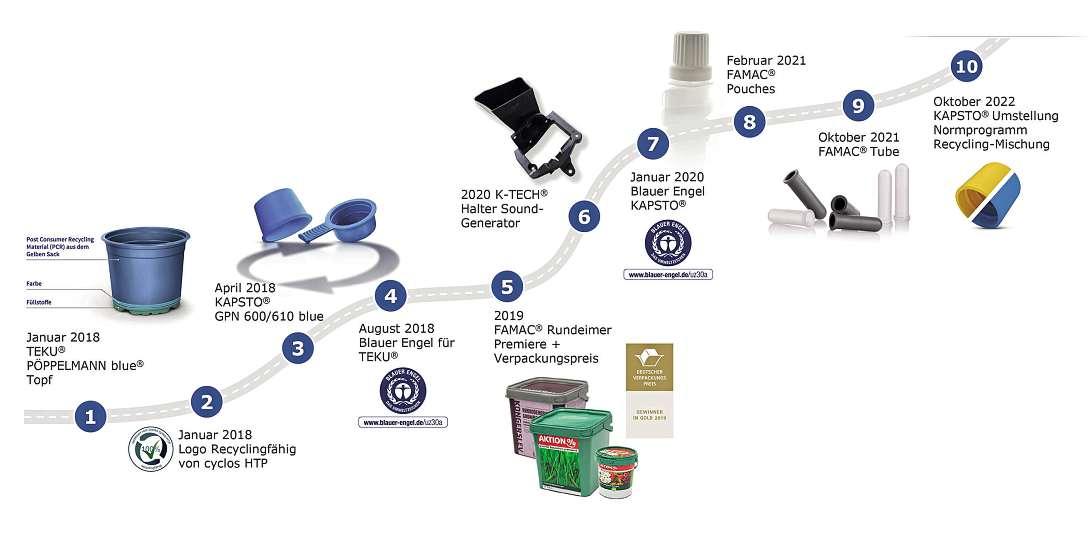
außerdemsehrgutstapelbar DadurchwerdenLagerung und Transport verbessert: Die Produkte werden nun nichtmehrlosegeschüttet,sonderngestapeltverpackt. Jeder Karton kann durch die neue Stapelung jetzt mit über 50 Prozent mehr Inhalt bestückt werden. Dies reduziert den Verbrauch an Verpackungsmaterial, StellflächenunddenAufwandindergesamtenLogistikkette. „In Zahlen ausgedrückt bedeutet dies: Bei den jährlich millionenfach hergestellten Teilen werden durch die Angussrückführung4.800kgKunststoffeingespartund damit die THG-Emissionen um 7,8t CO2e reduziert. Die veränderte Verpackung durch gute Stapelbarkeit reduziert die THG-Emissionen noch einmal um 3,3t CO2e. Daraus ergibt sich ein CO2-Impact von -6 Prozent bezogen auf das Material und -32 Prozent bei der Bewertung des Transports von Pöppelmann bis zum Kunden“, erklärt Mike Landwehr
Aktives Engagement für Kreislaufwirtschaft und Klimaschutz
DiemessbarenOptimierungen,diePöppelmannFAMAC seinen Kunden anbietet, sind auch das Ergebnis einer konsequenten Klimastrategie und einem aktiven Engagement der gesamten Pöppelmann Gruppe für die Transformation zur Kreislaufwirtschaft. Als eines von nursiebendeutschenUnternehmenistesTeildesGlobal CommitmentderEllenMacArthurFoundation,diesich für eine weltweite Umstellung auf Kreislaufwirtschaft einsetzt.ImRahmenderInitiativePÖPPELMANNblue® bündelt Pöppelmann seit 2018 alle Aktivitäten der vier Geschäftsbereiche, die sich für mehr Klimaschutz und Ressourcenschonung einsetzen. Außerdem hat der Kunststoffspezialist nach dem anerkannten Standard derScienceBasedTargetsinitiative(SBTi)seinenCorporate Carbon Footprint (CFF), also die Menge der THGEmissionen der gesamten Unternehmensgruppe, berechnen lassen und konkrete Klimaziele bis zum Jahr 2030 festgelegt. Demnach verpflichtet sich die Pöppel-
mann Gruppe zur Reduzierung ihrer absoluten THGEmissionenbis2030imVergleichzu2021um50Prozent in Scope 1 (Emissionen, die auf dem Werksgelände entstehen, z. B. durch Verbrennung von Gas) und Scope 2 (Emissionen, die durch den Bezug von Energie verursachtwerden)undum25ProzentinScope3(alleübrigen Emissionen, die in der vor- und nachgelagerten Wertschöpfungskette verursacht werden). Die Validierung durch die Science Based Targets initiative bestätigte, dassdieseKlimazieleimEinklangmitdem1,5-Grad-Ziel des Pariser Klimaabkommens stehen. 2023 erhielt der Kunststoffspezialist für seine ambitionierten KlimaschutzzielesowieseineAnstrengungenbeiderEnergieeffizienz und dem Einsatz Erneuerbarer Energien die Auszeichnung „Klimaschutz-Unternehmen“, vergeben vom Bundesumweltministerium, dem Bundeswirtschaftsministerium und der Deutschen Industrie- und Handelskammer.„Wirsinddavonüberzeugt,dassTHGReduktionen eine entscheidende Rolle in der Zukunft der Kunststoffindustrie spielen werden und sich zur ‚neuen Währung’ in der Industrie entwickeln wird Unternehmen müssen ihre Strategien entsprechend anpassen. Mit unserem Service, Optimierungen nach anerkannten Standards berechenbar zu machen, leisten wir dabei wertvolle Unterstützung“, so Mike Landwehr
Messbare Verbesserungen, zukunftsfähige Produkte
Pöppelmann FAMAC beweist durch Eco-Design, transparente Berechnungen der THG-Emissionen und Vorher-Nachher-Vergleiche,dassauchinstrengregulierten Branchen berechenbare Optimierungen zugunsten einesverbessertenPCFmöglichsind.MitseinemEngagement für Kreislaufwirtschaft und der konsequenten Umsetzung von Science Based Targets positioniert sich der Kunststoffspezialist als kompetenter Partner für mehr Ressourcenschonung in Bereichen wie Pharma, Medizintechnik, Labor & Diagnostik. (pl)
TIPP Auf www.devicemed.de unter dem Suchbegriff „Nachhaltigkeit“ gibt es mehr zum Trendthema. Während des Compamed Suppliers Forum vom 17. bis 20. November widmen sich diverse Vorträge auch der Nachhaltigkeit.
DAS INTERVIEW FÜHRTE
JuliaEngelke
Stv. Chefredakteurin
Devicemed
Das Familienunternehmen Friedrich Daniels, auf die Herstellung von chirurgischen Instrumenten spezialisiert, wurde 2023 in den Geschäftsbereich Medtech der Acrotec-Gruppe aufgenommen.
Im Interview erzählt Bernd Daniels, Co-CEO, wie aus den SynergieEffekten innerhalb der Gruppe profitiert werden kann.
HerrDaniels,dieFriedrichDanielsGmbHistjetztseit 75 Jahren tätig. Erzählen Sie mir doch, wo Ihr Unternehmen herkommt und wo Sie jetzt stehen.
Bernd Daniels: Gegründet wurde die Firma 1948 damals durch unseren Großvater, Friedrich Daniels 1966 hat unser Vater die Leitung des Unternehmens übernommen. Dann sind mein Bruder und ich eingetreten und mittlerweile ist auch mein Sohn im Unternehmen. Wirhabenca.50Mitarbeiterundsind2023derAcrotecGruppebeigetreten.BeiAcrotecimVerbundsindesjetzt 31Firmen,davonsindzwölfimMedizintechnik-Bereich tätig InsgesamtkanndieGruppe3.000CNC-Maschinen und2.800Mitarbeitervorweisen.DasProduktportfolio wirdausgebaut,von5.000Produktenjetztalleindurch den Verbund mit der Medizintechnik-Sparte zu über50.000KomponentenundArtikeln.Wir versuchen durch die Synergien, die durch den Verbund entstanden sind, die anderen Firmen zu bedienen. Und das geht bisher auch auf

DeviceMed ZURPERSON
Wo haben Sie neben dem Solinger Standort noch Standorte?
Keinen weiteren, der zur Acrotec-Gruppe gehört. Wir haben Zulieferer in Süd-
deutschland,diedannauchteilweisedenNamentragen, aber nichts mit dem Firmenverbund Acrotec zu tun haben.
Um das Thema Acrotec gleich aufzugreifen: Wie genau sehen die Synergie-Effekte mit den anderen Unternehmen in der Gruppe aus? Können Sie mir Beispielprojekte nennen?
DenNamenkannichjetztnichtnennen,abereineFirma aus den USA hat seit langem einen Kunden, für den Implantategefertigtwerdensollen.Wirkönnenjetztdurch denVerbundinderGruppediepassendenInstrumente liefern. Das sind die Synergien, die es dann auch ausmachen. Außerdem haben wir jetzt Zugang zu einem Kundenpotenzial,dasunsohnedenVerbundeigentlich verschlossen geblieben wäre.
Bevor Sie der Gruppe beigetreten sind, hatten Sie da nur den deutschen Markt bedient und können sich jetzt auch den US-amerikanischen Markt erschließen?
Tatsächlich umgekehrt. Wir hatten vorher 98 Prozent USA-Geschäft. Wir sind immer noch USA-lastig, aber jetztdurchdieSynergienauchnochinternationaleraufgestellt.
SiebezeichnensichalseineArt„OneStopShop“.Wie kann ich mir das vorstellen?
Das ist die Zielsetzung aus der Acrotec-Gruppe heraus. WirhabeninderGruppeUnternehmen,diesichmitImplantaten beschäftigen, mit Instrumenten, jetzt haben wireinUnternehmen,daseinenReinraumhat.Wirkönnen im Grunde alles anbieten, was gefordert ist.
Bernd Daniels ist Co-CEO der Friedrich Daniels GmbH. Er ist seit 40 Jahren in der Medizintechnik aktiv. 1985 ist er ins Familienunternehmen eingetreten und sammelte 1986 internationale Erfahrungen in den USA bei Zimmer-Biomet als International Trainee
Sie expandieren mit Ihrer Produktionsstätte am Standort Solingen. Wie sieht das Projekt momentan aus?
Genau, momentan wird die Produktionsfläche verdoppelt.DieFertigstellungderGebäudeistfürAugustdieses Jahres geplant. Und dann müssen wir sehen, welche
Projekte wir mit welchen Kunden dann dort umsetzen, also was für ein Maschinenpark da explizit reinkommt.
Wiesiehtesaus,wennKundenmitsehrspezifischen Wünschen auf Sie zukommen? Wie begleiten Sie diese Kunden dann bei ihren Projekten?
WirbegleitensievomWunschbiszurFertigstellung Also ein Beispiel: Wir hatten gerade erst eine Konferenzschaltung mit einer neuen Firma aus Österreich Die möchtengerneSilikongriffevonunshaben Dabeginnt dann das Projekt für uns von der Entwicklung her. Ein erster Schritt ist es, eine To-do-Liste zu machen: Was sind die Anforderungen? Was stellen sich die Kunden vor?Wiekönnenwiresumsetzen?Soläuftesdannauch ab, wenn sie einen eigenen Griff haben wollen. Dann schauen wir: Was haben wir für Werkzeugkosten? Und dann wird so etwas realisiert. Das ist meistens ein Projektvon,ichschätzemal,sechsMonaten.Unddanngibt es noch den Fall, dass ein Unternehmen auf uns zugekommenistundeinInstrumentensethabenwollte–wir sind ja spezialisiert im Orthopädie-Bereich, speziell im Wirbelsäulen-Bereich –, um Cages einzusetzen. Da gibt es dann von uns die Hilfe bei der Erstellung von einem Set.
Wie sieht es im Werkzeugportfolio bei Ihnen aus? Also Stichwort Bohrer?
Bohrer haben wir letztes Jahr implementiert, eine Bohrerproduktion. Da haben wir ca. 1,5 Millionen Euro investiert und konnten dadurch auch Kunden gewinnen. WobeiwirdaauchaufAnfragederKundenhininvestiert haben und dann sind glücklicherweise auch weitere Kunden aufgesprungen.
Dannistesauchwirklichso,dass,wennichalsKunde mit einem sehr speziellen Wunsch auf Sie zukomme, dieser auch umgesetzt wird? Ja, auf jeden Fall.
KönnenSiemirnocheinenAusblickgeben,wasnoch bei Ihnen ansteht?
Die Zielsetzung ist, dass der Medtech-Bereich bei AcrotecindennächstenJahrenverdoppeltwird,unddasind wir auf einem guten Weg (je)


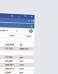

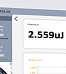

















Interview
Die manuelle Stichprobenkontrolle, die häufig zur Überprüfung der Qualitätsstandards im Spritzgießen eingesetzt wird, birgt zahlreiche Herausforderungen. In einem Forschungsprojekt untersuchen Kistler und die OST – Ostschweizer Fachhochschule, welche Lösungen maschinelles Lernen und Automatisierung bieten können. Im Interview erklärt Oliver Schnerr, Head of Plastics Academy & Application Technology bei Kistler, wie diese Innovationen die Zukunft der Qualitätskontrolle prägen werden.

HerrSchnerr,Siebeschäftigensichseit30Jahrenmit derQualitätssicherungbeimKunststoffspritzgießen – welche Ziele verfolgt Kistler mit dem Forschungsprojekt?
WirwollendieMöglichkeitenderKombinationdervollautomatisierten optischen Qualitätssicherung mit der klassischen Prozessüberwachung mittels WerkzeuginnendruckundderQualitätsmodellierungmitMethoden der künstlichen Intelligenz (KI) erforschen. Im VordergrundstehenverbesserteDatenqualitätundoptimierte Qualitätsvorhersagen durch maschinelles Lernen. In ZusammenarbeitmitdemInstitutfürWerkstofftechnik und Kunststoffverarbeitung der OST – Ostschweizer FachhochschuleinRapperswilmöchtenwirzeigen,wie insbesondere die Spritzgießproduktion von diesen Innovationen profitieren kann. Durch die Automatisierung des gesamten Qualitätskontrollprozesses können wir menschliche Fehler minimieren und die Effizienz deutlich steigern.
WieunterscheidetsichIhrAnsatzvonderderzeitigen Praxis?
Aktuell setzen viele produzierende Unternehmen auf statistischeProzesskontrollen.Dasheißt,dassStichproben manuell entnommen und geprüft werden. Diese Methodeistsehrzeit-undpersonalintensivunddieQualität der erhobenen Daten kann stark variieren, da sie von den Fähigkeiten der Prüfenden abhängt. Das ist be-
DeviceMed ZURPERSON
Dr.-Ing. Oliver Schnerr ist Head of Plastics Academy & Application Technology bei Kistler Instrumente AG. Seit 2000 ist er bei Kistler angestellt.
sonders in sicherheitskritischen Bereichen wie der Medizintechnikproblematisch:IndiesemBereichsinddie Fehlertoleranzensehrgering,wasdieAnforderungenan dieQualitätskontrolleerhöht EineautomatisierteStichprobenkontrolle schafft Abhilfe, indem sie die Datenqualität konstant auf einem hohen Niveau hält und die Prüfprozesse effizienter gestaltet.
SiehabenbereitsersteVorteilederAutomatisierung der Stichprobenkontrolle erwähnt – gibt es weitere?
Ja, sogar mehrere: Erstens erhöht sich die Reproduzierbarkeit der Prüfergebnisse, da die automatisierten Systeme unabhängig von menschlichen Schwankungen arbeiten ZweitenswerdenpersonelleundzeitlicheRessourcenerheblicheingespart,wasbesondersinProduktionen mit hohem Durchsatz und in Anbetracht des Fachkräftemangels von Vorteil ist. Drittens ermöglicht die Integration von KI, die Qualitätsvorhersagen fortlaufend zu verbessern, da die Systeme kontinuierlich ausdenerhobenenDatenlernenundsichanpassenkönnen. Dies reduziert signifikant Ausschuss und Nacharbeit, was wiederum Kosten spart.
KönnenSieunsdenbeispielhaftenPrüfprozessIhres Forschungsprojekts näher erläutern?
Unser Fertigungs- und Prüfprozess ist vollständig automatisiert.EineSpritzgießmaschineproduziertBauteile undversiehtdiesemitindividuellenQR-CodeszurNachverfolgung Bereits während der Produktion überwacht unser Prozessüberwachungssystem Comoneo mithilfe von Sensoren den Werkzeuginnendruck Die Softwarefunktion Comoneo Predict trifft mithilfe eines trainiertenKI-AlgorithmusQualitätsvorhersagenfürdieeinzelnenTeile.FahrerloseTransportfahrzeugebringendiefür die Stichproben ausgewählten Teile autonom zur optischen Prüfzelle, die sich bereits in Prüfbereitschaft befindet. Dort durchlaufen sie dann ein vordefiniertes Prüfprogramm, bei dem sie auf Maßhaltigkeit, Oberflächendefekte und spritzgießspezifische Anomalien wie schwarze Stippen oder Feuchtigkeitsschlieren untersucht werden. Die Prüfzelle haben wir im Vorfeld mit entsprechend unterschiedlichen Prüfprogrammen ausgestattet. Das Prüfsystem erkennt die Bauteile und startet das entsprechende Programm.
WelcheRollespieltdabeidieKooperationmitderOST – Ostschweizer Fachhochschule?
Die Zusammenarbeit mit der OST ist sehr wichtig und eineWin-win-SituationfürbeideSeiten.DieMitglieder des Instituts bringen neben ihrem umfangreichen Know-howimBereichWerkstofftechnikundKunststoffverarbeitung auch ihr hohes Engagement ein. Darüber hinaus unterstützen sie uns bei der Entwicklung und dem Training der KI-Modelle, die für die Qualitätsvorhersagen eingesetzt werden. Diese interdisziplinäre Zusammenarbeitermöglichtesuns,innovativeLösungen zuentwickeln,diesowohltechnischalsauchwirtschaftlich tragfähig sind.
Apropos Wirtschaft: Wie sehen Sie die Zukunft der Qualitätssicherung in der Spritzgießindustrie?
Ichbindavonüberzeugt,dassdieZukunftderQualitätssicherung in der Spritzgießindustrie stark von Automatisierung und maschinellem Lernen geprägt sein wird Die Fortschritte, die wir in unserem Forschungsprojekt erzielen,zeigenbereits,wievielPotenzialindiesenTech-

Die innovative Prüfzelle von Kistler führt vollautomatisierte, präzise Prüfungen in der Spritzgießproduktion durch und setzt so neue Maßstäbe für Effizienz und Genauigkeit.
nologiensteckt.Langfristigwerdenautomatisierteund KI-gestützte Systeme die manuelle Qualitätskontrolle weitgehend ersetzen und konsistente, zuverlässige Ergebnisse liefern. Dies wird nicht nur die Effizienz und Wirtschaftlichkeit der Produktion verbessern, sondern auch die Sicherheit und Zufriedenheit der Endkunden erhöhen.
Welche weiteren Schritte planen Sie, um die Ergebnisse des Forschungsprojektes in die Praxis umzusetzen?
Im nächsten Schritt werden die im Forschungsprojekt entwickelten Lösungen bei unseren Projektpartnern MedmixundWeidmannMedicalinrealenProduktionsumgebungen getestet und weiterentwickelt. Dabei arbeitenwirengmitunserenPartnernzusammen,umdie Praxistauglichkeit der Systeme sicherzustellen. Zudem planen wir, die gewonnenen Erkenntnisse in unsere bestehendenProduktezuintegrierenundneueLösungen aufdenMarktzubringen.UnserlangfristigesZielistes, die Automatisierung und Digitalisierung der Qualitätssicherung in der gesamten Spritzgießindustrie weiter voranzutreiben. (kb)
DAS INTERVIEW FÜHRTE KristinBreunig Redaktion Devicemed
„Langfristigwerdenautomatisierte undKI-gestützteSystemediemanuelle Qualitätskontrolleweitgehend ersetzenundkonsistente,zuverlässige Ergebnisseliefern.“
Oliver Schnerr, Head of Plastics Academy & Application Technology bei Kistler
Medical-Systemlösung
nur
Ausführliche Vorversuche, Lohnreinigung und echtes Teamwork haben es möglich gemacht, dass die LPW Reinigungssysteme GmbH in vier Monaten eine kundenspezifische Anlage für die Viant Aura GmbH fertigstellen konnte. Das Doppelkammersystem der Baureihe Power Jet 670 T5 Twin Ultra Medical kommt bei der Endreinigung von Kapillarröhrchen (z. B. in Inhalationsgeräten)zumEinsatzundistmiteinermaßgeschneiderten Automationslösung verbunden, die den sauberen Transfer in den Reinraum sicherstellt. Die Projekt-Partner verbindeteinejahrelangeZusammenarbeit, die 2019 mit den ersten CNp-Versuchen im reinraumbasierten Test- und Dienstleistungszentrum von LPW in Riederich begann. Neben der Erarbeitung der besten Reinigungsparameter für die Kapillarröhr-
chen wurde auch ein Handling- und Verpackungskonzept konzipiert. Darauf folgte eine knapp dreijährige Lohnreinigungszeit bei den High-Purity-Spezialisten. Mit stetig steigenden Mengen und unter dem Motto „from the lab to the fab“. Bedeutete für das LPW-Applikationsengineering in Abstimmung mit dem technischen Vertrieb: Einbindung in die Gesamtvalidierung des Kunden; Definition/Festschreibung der qualitätsrelevanten Parameter und Prozesse; Erstellen einer auftragsbegleitenden DokumentationinFormvonChargenprotokollen und einem übergreifenden Prozessmonitoring; Erarbeitung eines serientauglichen Warenträgerkonzepts sowie Erweiterung des Bauteilspektrums auf Grundlage der ErfahrungswerteunddesProzederes Schlussendlich entschied sich Viant aufgrund des

LPW/V iant
Bild:
steigenden Bedarfs, der hohen Anforderungen an die Prozess-Stabilität und der diesbezüglich vertrauensvollen Partnerschaft und guten Erfahrungen mit LPW für ein eigenesReinigungssystemaufBasisderHighPurity-BaureihePowerJetUltramitderBitte, innerhalbvonvierMonatenandenStandort Aura im Spessart zu liefern. Ambitioniert –doch auf Grundlage der vorangegangenen Zusammenarbeit und Definition aller wichtigen Projekt-Parameter für die Riedericher Reinigungsexperten kein Problem. So entstand die Power Jet 670 T5 Twin Ultra Medical mit folgenden technischen Eckdaten:
Chargengröße 670 x 480 x 300 mm
Doppelkammersystem mit insgesamt 5 Tanks (Reinigen, Spülen 1 bis 4)
Ultraschall in Kammer 1 mit 25 Hz
Ultraschall in Kammer 2 mit 40 kHz
H13-filtrierte Heißlufttrocknung
Kombinierte Infrarot-Vakuumtrocknung
Integrierte Hochleistungs-VE-Kreislaufanlage inkl. UV-Desinfizierung für die letzte Kreislaufspüle
„Saubere“ Automation als Verbindungs-/ Transferelement vom Vorprozess über die Reinigung zum Reinraum mit FFUEinheiten und integrierter Reinraumschleuse
Auf Basis des integrierten Prozessmonitorings wird im laufenden Betrieb ein Chargenprotokoll erstellt, über das integrierte RFID-System mit der jeweiligen Charge mitgetragen und mit jedem Prozessschritt erweitert. Des Weiteren enthält das System eineWasserversorgung,bestehendauseiner Umkehrosmoseeinheit zur Aufbereitung desStadtwassers(ca.300μs)aufeinenWert von max. 5 μs. www.lpw-cleaning.com
Filtrationstechnologie und Automatisierungstechnik
Die Alpha Plan GmbH, Hersteller von Anlagen für medizinische Einwegprodukte und Teil der Zhejiang GMT Group, hat einen wichtigen Erfolg auf demWeltmarkterzielt.DasUnternehmen sicherte sich einen Großauftrag von einem indischen Medizintechnikhersteller, der als Tochtergesellschaft eines der führenden indischen PharmaunternehmenweltweitimGesundheitssektor tätig ist.
Ein Schwerpunkt des indischen Pharmaunternehmens liegt auf Forschung und Entwicklung, wo ein großesTeamvonWissenschaftlernanverschiedenenStandorteninnovativeMedikamente entwickelt.

„Wir sind stolz darauf, unseren indischen Kunden bei seinem Wachstum zuunterstützenundmitunsererTechnologie einen Beitrag zur weltweiten Gesundheitsversorgung zu leisten“, sagt Dr Michael Juchem, Geschäftsführer von Alpha Plan. Die moderne Anlage ist speziell auf die Anforderungen des indischen Marktes zugeschnitten. www.alpha-plan.de Bild: Alpha Plan GmbH
Der Auftrag umfasst die Lieferung einer hochautomatisiertenProduktionsanlagefür medizinische Filter, die für die Herstellung der lebensrettenden Dialysatoren unerlässlichsind.DieseInvestitionstärkt die Marktposition des indischen Unternehmens im Bereich MedizintechnikundunterstreichtdasVertrauenin die Technologie und langjährige Expertise von Alpha Plan.
Silikon-Revolution
Additiv gefertigte Harzformen optimieren Flüssigsilikon-Spritzguss
Die additive Fertigung, oder auch 3D-Druck genannt,zeigtinsbesonderebeiderHerstellung komplexer, individualisierter Bauteile ihre Stärken. Dabei können v. a in der Produktentwicklung von Spritzgießbauteilen oder bei der Kleinserienfertigung additiv hergestellte,harzbasierteWerkzeugeinsätze erhebliche Vorteile bringen. Denn im Vergleich zu konventionellen Metallwerkzeugen lassen sich nicht nur die Produktionszeiten signifikant verkürzen, sondern auch die Fertigungskosten senken. So können auch Kleinserien von Bauteilen aus dem gewünschten Werkstoff wirtschaftlich hergestelltwerden.DerProduktentwicklungsprozessmitmehrerenIterationsschleifenkann dabei flexibel bleiben. Das Würzburger Kunststoff-Zentrum SKZ und das Unipace (PolymerApplicationCenter)derUniversität KasselstartetendeshalbimFebruar2025ein wegweisendes Forschungsprojekt mit dem Titel„ADDmoldfürLSR“.LSRstehtdabeifür LiquidSiliconeRubber–alsoFlüssigsilikon. BisherwarderEinsatzvon3D-gedruckten Werkzeugeinsätzen im Spritzguss auf die Thermoplastverarbeitungbeschränkt–also auf Kunststoffe, die immer wieder schmelz-
Bild: FSKZ
bar sind. Insbesondere Flüssigsilikone, die in vielen Industriezweigen wie der Medizintechnik, Automobilbranche oder Elektrotechnik unverzichtbar sind, konnten deshalbnichtohneklassischeMetallwerkzeuge nebst Zeitaufwand und Kosten verarbeitet werden,wiedieForschersagen.Aberdurch die Kombination von additiver Fertigung und Flüssigsilikonverarbeitung soll nun eine völlig neue Ära zur Herstellung von Silikonbauteilen eingeläutet werden. Die Vor-

teile der wirtschaftlichen KleinserienfertigungsowieverkürzteProduktentwicklungszyklen sollen damit künftig auch für LSR-Typen nutzbar sein.
DurchdenEinsatzvonadditivgefertigten Werkzeugeinsätzen für das LSR-Spritzgießen können v. a kleine und mittlere Unternehmen flexibler auf Kundenwünsche reagieren,Entwicklungszeitenreduzierenund sich schneller an veränderte Marktanforderungen anpassen, wie die Würzburger konkretisieren. Das trage dazu bei, die Wettbewerbsfähigkeit der Unternehmen nachhaltig zu stärken. Auch entstehen neue Möglichkeiten für maßgeschneiderte Produkte, die bisher aus wirtschaftlichen oder technischen Gründen nicht so leicht herstellbar waren. Interessierte Unternehmen können aktiv an dem Forschungsprojekt teilnehmen. Die Projektpartner laden ein, sich kostenfrei am Projektausschuss zu beteiligen. Durch die Mitwirkung könnten Unternehmen nicht nur frühzeitig von den Forschungsergebnissen profitieren, sondern auch eigene Anforderungen und Anwendungsfälle in die Entwicklung einbringen. www.skz.de
Silikon, das bewegt Vom Handschuh bis zum Herz: Muskeln aus dem 3D-Drucker
Ein Forscherteam aus dem Empa-Labor für Funktionspolymerearbeitetankünstlichen Muskeln, so genannten Aktoren, aus weichen Materialien. Nun haben sie eine Methode entwickelt, um die komplexen Komponenten per 3D-Drucker herzustellen Die so genannten dielektrischen elastischen Aktoren (DEA) bestehen aus zwei silikonbasierten Materialien: einem leitenden Elektrodenmaterial und einem nichtleitenden Dielektrikum. Diese greifen schichtförmig ineinander Legt man an den Elektroden eineelektrischeSpannungan,ziehtsichder Aktor wie ein Muskel zusammen. Schaltet man die Spannung wieder ab, entspannt er sich in seine Ursprungsposition. Ziel des Projekts ist es, einen Handschuh zu entwickeln, der virtuelle Welten greifbar macht, indem die künstlichen Muskeln durch Wi-
derstand das Greifen von Gegenständen simulieren.JedochsindweitausmehrAnwendungsmöglichkeiten denkbar: Sie könnten herkömmliche Aktoren in Autos, MaschinenundinderRobotikersetzen.Entwickelt man sie weiter, kommen sie auch für medizinische Anwendungen in Frage. Dorina Opris, Leiterin der Forschungsgruppe Functional Polymeric Materials, und Empa-ForscherPatrickDannerarbeitenbereitsdaran: MitihremVerfahrenlassensichnebenkomplexenFormenauchlangeelastischeFasern drucken. „Wenn wir sie noch etwas dünner machen, kommen wir der Funktionsweise vonechtenMuskelfasernschonrechtnahe“, sagt Opris. In Zukunft könnte man aus solchen Fasern womöglich ein ganzes Herz drucken, glaubt die Forscherin. www.empa.ch
Bild: E mpa

Zertifizierte Auftragsfertigung fürIhre Produkte Wirübernehmen das – ISO 13485 zertifiziert

Kunststoffteile nach Kundenvorgaben Technische Beratung und Umsetzung | Materialvielfalt und Verarbeitungskompetenz Skalierbare Produktion EigenerFormenbau | | www.dino-ag.de info@dino-ag.de Tel. 030-8027231 | |
3D-Druck
Personalisierte Gesichtsimplantat-Fertigung direkt am Patientenbett
3DSystemshatinZusammenarbeitmitdem Universitätsspital Basel (Schweiz) erstmals ein MDR-konformes, 3D-gedrucktes GesichtsimplantatausPEEKmithilfederPointof-Care-Lösung des Unternehmens entworfen und gefertigt. Prof Florian Thieringer undDr NehaSharmaentwickeltengemeinsam mit ihrem Team aus biomedizinischenIngenieu ren ein patientenspezifischesImplantat,dasmitder Technologie und Ferti gungsexpertise von 3D Systems umgesetzt wurde. Das Implantat kam im Rahmen einer erfolgreichen Operation im März 2025 im Uni versitätsspital zum Einsatz. Gefertigt wurde dieses MDR-konforme Gesichts implantatmitdemMaterial Vestakeep i4 3DF PEEK von Evonik auf dem EXT 220 MED von 3D Systems. Die reinraumtaugliche Architektur des Druckers sowie die optimierten Nachbear beitungsprozesse ermögli
chen die effiziente Produktion patientenspezifischer Medizinprodukte direkt im Krankenhaus.
„Unser Ziel ist es immer, unseren Patientinnen und Patienten die bestmögliche Versorgung zu bieten“, erklärt Prof Thieringer „Durch die direkte Einbindung hier im Krankenhaus sowohl indasDesignalsauchin die Herstellung patientenspezifischer Implantate können wir Behandlungen exakt auf individuelle Bedürfnisse abstimmen, schneller reagieren und die OP-Ergebnisseverbessern Die Möglichkeit, Implantate bei Bedarf direkt vor Ort zuproduzieren,markiert den Beginn einer neuen Ära der personalisierten Medizin.“

Seit über einem Jahrzehnt nutzen Chirurgen VSP-Lösungen für die chirurgische Planung Diese Lösungen kombi-
nierendigitaleWorkflowsmiteinembreiten Portfolio an 3D-Druckern und Materialien und ermöglichen so patientenindividuelle Versorgungskonzepte.DieengeZusammenarbeit von Chirurgen, Ingenieuren und Technologie direkt im klinischen Umfeld machtesmöglich,sofortmaßgeschneiderte Behandlungsansätze zu entwickeln, und überwindet die Grenzen konventioneller Medizinprodukte. So können Gesundheitsanbieter nicht nur Behandlungsergebnisse verbessern, sondern auch Abläufe effizienter gestalten und die Kosten der Patientenversorgung senken.
„Die schnelle Einführung des EXT 220 MED durch führende GesundheitseinrichtungeninKombinationmitderwachsenden Anzahl an klinischen Anwendungen unterstreicht das transformative Potenzial des 3D-DrucksimmedizinischenUmfeld“,soDr Stefan Leonhardt, Director Medical Devices bei 3D Systems. „Wir sind stolz darauf, mit den wegweisenden Klinikteams des Universitätsspitals Basel sowie führenden Krankenhäusernweltweitzusammenzuarbeiten, um das Anwendungsspektrum der additiven Fertigung kontinuierlich zu erweitern.“ www.3dsystems.com
Prozessinformationen nutzen
Montage
Mechanisch optimiert für die Handhabung und Montage biegeschlaffer Teile: Mit dem selbst entwickelten Handling-Head setzt Knoll Feinmechanik eine ausgereifte Greifertechnologie in seinen Automatisierungslösungen ein. Dabei entstehende Prozessdaten lassen sich nutzen, um die automatisierten Vorgänge zu überwachen. Das ist notwendig, da auf den modularen Anlagen meistmedizintechnischeProduktegefertigt werden. Diese Prozessinformationen können auch für die Validierung oder bei der Systemüberwachung von Nutzen sein Der Handling-Head ist in verschiedenen Ausführungen erhältlich und verwendetbiszudreiServomotoren,die unterschiedliche Bewegungen im Prozess steuern. Bei einem Fügevorgang wird beispielsweise das Ende eines biegeschlaffen medizinischen Schlauchs über eine starre Hülse geschoben. Das dauert nur Bruchteile einer Sekunde. Die Stromaufnahme derServomotorenwirdwährenddes Fügens im Millisekunden-Bereich aufgezeichnet, sodass anschließend Messwert-Verlaufskurven zur Verfügungstehen.SindgenügendKurven
des fehlerfrei abgelaufenen Prozesses aufgezeichnet, lassen sich mittels KI oder statistischerAnalyseAbweichungenerkennen Zusammen mit den Bildern der in den Anlagen installierten Kameras lässt sich so jeder einzelne Fügeprozess überwachen und dokumentieren.„Damitstellenwirunseren Anwendern wichtige Daten zur Verfügung, die in der laufenden Produktion, zur Qualitätssicherung und Dokumentation notwendig sind“, sagt Simon Fey, Leiter Software & Controls bei Knoll Feinmechanik. Aus den Prozessinformationen lässt sich so einiges herauslesen, was von Mehrwert ist. Bei ei-

nem Fügevorgang kann beispielsweise mittels des Drehmomentverlaufs und der BilddokumentationdieEinsteck-bzw.Montagetiefe überwacht werden. Ob alle notwendigen Komponenten zur Verfügung standen, wird auf dieselbe Art und Weise überwacht. Sotrivialletzteresklingt,sowichtigistdiese Information. Doch Sicherheit entsteht erst durch die Kombination der gesammelten Daten. Mit dem Drehmoment-Verlauf und dem Bild zusammen sind alle Informationenverfügbar,umwährendderProduktion IO und NIO voneinander zu unterscheiden. „Darüber hinaus können diese Daten schon im Vorfeld bei der Prozessvalidierung gemäß MDR unterstützen oder auchnachdemInverkehrbringenzu Dokumentations-undNachweiszwecken“,sagtFey.„Wirverstehenunsin diesem Zusammenhang nicht nur als Anlagenbauer, sondern unterstützen und begleiten unsere Kunden gern auch in der Validierungsphase.“ Vom 24. bis 27 Juni 2025 präsentiert Knoll Feinmechanik auf der Automatica in München seine Lösungen. www.knoll-feinmechanik.de Bild:











GehörenSiezudenBestenderMedTech-Branche?
ZeigenSieunsIhreInnovationenundbewerbenSiesich inderKategorieMedizintechnikumdenBestofIndustryAward2025. DieBewerbungistkostenfreiundkanndirektonlineeingereichtwerden. www.bestofindustry.de/bewerbung sucht
Mit der zunehmenden Vernetzung wächst auch die Angriffsfläche. Während klassische Medizinprodukte meist isoliert arbeiteten, sind moderne Geräte in Krankenhausnetzwerke, Cloud-Plattformen oder auch mobile Anwendungen integriert

Cybersecurity bei Medizinprodukten
Moderne Medizintechnik ist vernetzter denn je – und damit auch zunehmend ein Angriffsziel für Cyberkriminelle. Verschärfte regulatorische Anforderungen, wie sie die MDR und die IVDR vorgeben, fordern von den Herstellern sowohl technologische als auch organisatorische Maßnahmen. Worauf kommt es bei der Cybersecurity von Medizinprodukten wirklich an? Ein Überblick.
Medizinprodukte sind längst Teil des Internet of MedicalThings(IoMT)undbietenvieleVorteile – von der Fernüberwachung von Patienten bis hinzuKI-gestütztenDiagnosen.DieseVernetzungbirgt auch erhebliche Risiken. Schwachstellen in Software und Netzwerken können für Cyberangriffe ausgenutzt werden, die nicht nur Daten, sondern auch Patientenleben gefährden.
VERFASST VON
MalteKnowles
Schmidt
Manager Global Service
Portfolio Software, Artificial Intelligence and Cybersecurity
TÜV Süd Product Service
GmbH
„Die Zeiten, in denen Cybersicherheit nur ein nachgelagertesIT-Themawar,sindvorbei.HeuteistsieintegralerBestandteilderProduktentwicklung“,betontMalteKnowlesSchmidt,GlobalPortfolioManagerSaMD,AI und Cybersecurity bei TÜV Süd.
Mit der zunehmenden Vernetzung wächst auch die Angriffsfläche. Während klassische Medizinprodukte meist isoliert arbeiteten, sind moderne Geräte in Krankenhausnetzwerke,Cloud-Plattformenoderauchmobi-
le Anwendungen integriert. „Das bedeutet, dass Cybersecurity nicht nur auf das Gerät selbst beschränkt ist, sondern das gesamte Ökosystem betrachtet werden muss“,ergänztKnowlesSchmidt.DiewachsendeBedrohungslage zeigt sich auch in der steigenden Zahl von Angriffen auf das Gesundheitswesen. Krankenhäuser und medizinische Einrichtungen geraten zunehmend insVisiervonCyberkriminellen,dienichtnurDatenerbeuten, sondern auch kritische Systeme lahmlegen. Hersteller müssen daher Sicherheitsmaßnahmen von Beginn an priorisieren.
Regulatorische Anforderungen: Was Hersteller beachten müssen
DieEU-Medizinprodukteverordnung(MDR)unddieInvitro-Diagnostik-Verordnung (IVDR) setzen neue Maß-
stäbe für die Cybersicherheit von Medizinprodukten HerstellermüsseneinrobustesRisikomanagementvorweisen, das über den gesamten Lebenszyklus des Produkts hinweg Bestand hat. Zentral sind u a. die Identifizierung und Bewertung von Risiken, die regelmäßig aktualisiert werden müssen. Ebenso wichtig ist der Security-by-Design-Ansatz, bei dem Schutzmaßnahmen bereits in der Entwicklungsphase berücksichtigt werden.
AuchdasUpdate-undPatch-Managementspielteine wesentlicheRolle:Sicherheitsupdatesmüssenüberden gesamten Produktlebenszyklus hinweg gewährleistet sein DarüberhinausisteinelückenloseDokumentation für die CE-Kennzeichnung erforderlich. Ein weiteres wichtiges Element ist die Software Bill of Materials (SBOM), mit der Hersteller detailliert nachweisen müssen, welche Softwarekomponenten und Bibliotheken von Drittanbietern in ihren Produkten enthalten sind, umbekannteSchwachstellenschnellidentifizierenund schließen zu können.
Ein zentrales Element in der praktischen Umsetzung dieserAnforderungenistdasPenetrationTesting Eserlaubt die Identifikation potenzieller Schwachstellen in Soft-undHardwareundliefertauchkonkreteHinweise darauf,wieSicherheitslückeneffektivgeschlossenwerden können. Pen-Tests sind damit weit mehr als eine formale Pflicht – sie sind ein zentrales Instrument zur Qualitätssicherung und Risikominimierung. TÜV Süd
verfügtübereinakkreditiertesLabormitspezialisierten Prüfern,diesichaufmedizintechnischeAnwendungen und branchenspezifische Protokolle wie DICOM, HL7 FHIRoderIEEE11073SDCspezialisierthaben.„DieHerausforderungensindvielfältig,aberdieregulatorischen Anforderungen helfen, die Sicherheit von Medizinprodukten systematisch zu verbessern“, so Knowles Schmidt.
Sicherheitskonzept frühzeitig entwickeln
Risikobewertung regelmäßig durchführen
Verschlüsselung und Authentifizierung implementieren
Update-Strategie sicherstellen
Mitarbeiterschulungen etablieren
Penetrationstests durchführen
Incident-Response-Pläne erstellen



21.Mai2025

RuhrCongressBochum
21.Oktober2025
VogelConventionCenter Würzburg




EineexplosionshafteVerbreitungkünstlicherIntelligenz,digitalerToolsundRechnerleistungeröffnetCobotsdenZugangzu immerneuenArbeitsbereichen.Sielassensichschnelleinrichten,intuitivsteuernundflexibeleinsetzen.DieConExpo COBOTS4YOUinformiertSieumfassendüberdieaktuellenEinsatzmöglichkeitenundVorteilekollaborativerRoboter. www.cobots4you.com
Eine
Neue Technologien wie KI oder vernetzte Implantate eröffnen einerseits große Chancen, bringen andererseits aber auch neue Herausforderungen für die IT-Sicherheit mit sich.
Cybersecurity in der Praxis: Die größten Stolpersteine
Viele Hersteller stehen vor der Herausforderung, regulatorische Vorgaben mit der praktischen Umsetzung in Einklangzubringen.EinzentralesProblemistunzureichendes Threat Modeling, da Bedrohungsszenarien oft nicht ganzheitlich betrachtet werden Hinzu kommen häufigfehlendeSicherheitsupdates:Produktesindüber Jahre hinweg im Einsatz, ohne dass Sicherheitslücken geschlossen werden. Dies erhöht das Risiko erheblich. DarüberhinausistdasBewusstseinfürCybersecurity invielenUnternehmennochgeringausgeprägt.Oftwird sie als isoliertes IT-Thema betrachtet und nicht ausreichendindieUnternehmenskulturintegriert.InsbesonderekleinereundmittelständischeUnternehmenhaben Schwierigkeiten,Cybersecurity-Maßnahmeninihrebestehenden Entwicklungsprozesse zu integrieren, ohne hoheZusatzkostenoderVerzögerungenzuverursachen. Ein entscheidender Punkt ist laut Knowles Schmidt diefrühzeitigeEinbindungvonCybersecurity-Experten: „Viele Probleme entstehen, weil Security erst am Ende derProduktentwicklungberücksichtigtwird.Dasmuss sich ändern.“ Besonders die Durchführung strukturierterPen-TestskannhieralsKatalysatorwirken Sieliefern fundierte Entscheidungsgrundlagen, um technische undorganisatorischeMaßnahmengezieltauszurichten. „Ein systematischer Pen-Test zeigt, wo die wirklichen Risikenliegen–undzwarnichtnuraufdemPapier,sonderninderechtenAnwendung“,sagtKnowlesSchmidt.
Checkliste: So gelingt die Cybersicherheit bei Medizinprodukten
TÜV Süd empfiehlt eine strukturierte Vorgehensweise zur Absicherung von Medizinprodukten:
Sicherheitskonzept frühzeitig entwickeln – Securityby-Design von Anfang an einplanen.
Risikobewertung regelmäßig durchführen – Bedrohungen und Schwachstellen kontinuierlich analysieren.
Verschlüsselung und Authentifizierung implementieren – Schutzmechanismen gegen unbefugten Zugriff
Update-Strategie sicherstellen – regelmäßige Patches und Sicherheitsupdates bereitstellen.
Mitarbeiterschulungen etablieren – Sensibilisierung und Training für alle Beteiligten.
Penetrationstests durchführen – regelmäßige Angriffs- und Sicherheitstests, um Schwachstellen frühzeitig zu erkennen.
Incident-Response-Pläne erstellen – Notfallstrategien definieren, um bei einem Cyberangriff schnell reagieren zu können.
„Hersteller, die Cybersicherheit nicht als regulatorische Hürde, sondern als Qualitätsmerkmal begreifen, werden langfristig erfolgreich sein“, fasst Knowles Schmidt zusammen.
Zukunft der Cybersecurity in der Medizintechnik
Die Bedrohungslandschaft verändert sich stetig Neue Technologien wie künstliche Intelligenz oder vernetzte Implantate eröffnen einerseits große Chancen, bringen andererseitsaberauchneueHerausforderungenfürdie IT-Sicherheit mit sich. Hersteller müssen sowohl bestehende Vorschriften einhalten als auch zukünftige Risiken proaktiv adressieren.
Ein besonders kritischer Punkt ist die Langlebigkeit von Medizinprodukten. Während klassische IT-Geräte oft schon nach wenigen Jahren ersetzt werden, bleiben viele Medizingeräte jahrzehntelang im Einsatz. „Die größte Herausforderung wird es sein, eine langfristige Sicherheitsstrategie zu entwickeln, die mit den technologischen Entwicklungen Schritt hält“, erklärt Knowles Schmidt.
Ein weiterer Aspekt ist die globale Harmonisierung vonCybersecurity-Standards.InEuropageltenMDRund IVDR,indenUSAgibtdieFDAspezifischeLeitlinienvor, und auch China und andere Länder haben eigene Vorgaben.„InternationalagierendeHerstellermüssensich auf ein komplexes regulatorisches Umfeld einstellen. Hier helfen strukturierte Prüf- und Zertifizierungsprozesse, um den Überblick zu behalten“, betont Knowles Schmidt.
DarüberhinausgewinntdieAutomatisierungvonSicherheitsmaßnahmen zunehmend an Bedeutung Künstliche Intelligenz und Machine Learning können dabeihelfen,potenzielleAngriffefrühzeitigzuerkennen und darauf zu reagieren. „Automatisierte Sicherheitssysteme, die sich kontinuierlich an neue Bedrohungen anpassen,werdeninderMedizintechnikunverzichtbar werden“, sagt Knowles Schmidt.
DieCybersicherheitvonMedizinproduktenisteinekomplexe, aber unumgängliche Herausforderung Regulierungen wie MDR und IVDR geben klare Leitlinien vor, docherstdiekonsequenteUmsetzunginderPraxisführt zueinemwirklichsicherenProdukt.Hersteller,diefrühzeitigSicherheitsstrategienimplementieren,profitieren sowohlregulatorischalsauchdurchdasgesteigerteVertrauen ihrer Kunden.
TÜV Süd unterstützt Unternehmen auf dem Weg zur sicheren Medizintechnik mit umfassenden Prüf- und Zertifizierungsdienstleistungen – darunter gezielte Penetrationstests, Sicherheitskonzeptanalysen und branchenspezifische Trainings – sowie praxisnahen Schulungen. (je)


Auf der einzigen Fachmesse on Tour finden Sie alles für Ihren Laboralltag. Und das Beste: Direkt in Ihrer Nähe!










Die LAB-SUPPLY kommtauch2025inIhreRegion
LAB-SUPPLYistdiekostenfreieFachmessefürinstrumentelleAnalytik,Labortechnik, BiotechnologieundLifeScience–an10TermineninunterschiedlichenStädtenin DeutschlandundÖsterreich ImFokusderAusstellungundFachvorträgestehenSie undIhrLaboralltag.InformierenSiesichohnegroßen
AufwandannureinemTagüberdieneuestenTrendsinderLaborbranche www.lab-supply.info
Sicherheitsstrategien durch professionelles Lieferkettenmanagement
Ist die Software auf den eigenen Medizinprodukten sicher vor Angriffen? Korrekt können Hersteller diese Frage nur dann beantworten, wenn sie alle Bestandteile kennen, überwachen und Ressourcen für Updates bereithalten. Da nahezu jede Software Module von Drittanbietern enthält, müssen diese ebenfalls laufend überwacht werden – eine Aufgabe, die nur mit professionellen Werkzeugen machbar ist.
VERFASST VON
Dr.Martin
Neumann
Senior Consultant Life
Science & Regulatory
Affairs Manager
Infoteam Software AG
ModerneHackernutzeneinenperfidenTrick:Anstatt Kliniken direkt anzugreifen und lahmzulegen, schleichen sie sich heimlich, still und leise über die Lieferkette der MedizinprodukteHersteller in Softwarelösungen, die auf Tausenden von Medizingeräten zum Einsatz kommen. Diese Taktik funktioniert, weil Softwareverantwortliche üblicherweise nicht den kompletten Code von Grund auf entwickeln, sondern fast immer auch auf Software-
module von Drittanbietern zurückgreifen. Dazu zählen einerseitsSoftwarebibliothekenundSchnittstellen,andererseits aber auch Standardfunktionalitäten, deren ständigeNeuentwicklungzuaufwändigundkostspielig wäre Für solche Bedarfe bieten sich häufig OpenSource-ModuleanundmittlerweileauchKI-generierter Code.HinzukommenModule,dieexterneDienstleister stellvertretend für den Gerätehersteller entwickeln, dabei womöglich ihrerseits auf Module von Drittanbie-

Professionelles Lieferkettenmanagement kann frühzeitig Sicherheitslücken in Software entdecken und vermeiden.
tern zurückgreifen und diese in die Softwarelösung integrieren.
Bei Angriffen auf die Lieferkette versuchen Hacker hier den Fuß in die Tür zu bekommen, indem sie das Softwaremodul eines Drittanbieters kompromittieren. Gelingtdies,soverteiltsichdieSchwachstelleohneweiteres Zutun in Softwarelösungen, die weltweit tausendfachaufGerätenverschiedenerHerstellerlaufen,indie genau dieses Drittanbietermodul eingebunden ist. Der Imageschaden für die Hersteller und ihre Dienstleister istimmens,SchadensersatzforderungenseitensderKlinikensindwahrscheinlichundimschlimmstenFallsind sogarMenschenlebengefährdet.Dochwiefunktioniert ein solcher Angriff und was kann dagegen getan werden?
Eine Studie aus dem Jahr 2023 zeigt einen erschreckenden Umgang mit unsicheren Softwaresystemen: Die ForschersammeltenzehnJahrelangDatenzuMedizinprodukten,dieinKlinikenweltweitzumEinsatzkamen bzw. kommen. In diesem Zeitraum traten 661 verschiedene Schwachstellen auf, mehr als die Hälfte davon gilt als kritisch oder hochgradig angreifbar Ausgerechnet die Hochrisikogeräte der Klassen II und III waren am meisten betroffen. Bemerkenswert: Sogar wenn Schwachstellenbereitsbekanntwaren,kamendieGeräte weiterhin in den Verkauf – Updates erfolgten oft erst Jahre später Sicherheitslücken, die Angreifer über die Lieferkette in Software schmuggeln (sogenannte „Supply Chain Attacks“), gelten als besonders gefährlich. Die ENISA (European Union Agency for Cybersecurity) prognostiziert,dassdieseAngriffsformimJahr2030aufPlatz1der Bedrohungsszenarien stehen wird. Die Gründe hierfür sind vielfältig:
GroßeAngriffsfläche: Ein erfolgreicher Angriff auf einen einzigen Drittanbieter (Lieferanten) kann potenziell viele nachgelagerte Unternehmen betreffen.
SchwächereSicherheitsvorkehrungen: Kleine und mittlere Unternehmen, die Teil der Lieferkette sind, haben oft weniger ausgeprägte Sicherheitsmaßnahmen als große Unternehmen.
Vertrauensstellung: Lieferanten und Partner haben oft privilegierten Zugang zu Systemen und Daten des Hauptunternehmens. Angreifer können diesen vertrauenswürdigen Zugang missbrauchen, um sich unbemerkt in das System zu schleichen.
ErschwerteEntdeckung: Angriffe auf die Lieferkette sind schwer zu entdecken, da sie oft über legitime Kommunikationswege und vertrauenswürdige Zugänge erfolgen.
Wege zur sicheren Lieferkette und Software
Im normativ regulierten Umfeld der Medizin- und Labortechnik(u.a.auchinanderensicherheitsrelevanten BranchenwieinderBahntechnik)forderndiegängigen NormenundGesetzeinderTheorielängsteinengewissenhaften und nachhaltigen Umgang mit der Cybersicherheit. In der Praxis tun sich viele MedizinprodukteHersteller jedoch noch schwer mit der Umsetzung, da die notwendigen Maßnahmen sehr umfangreich, entsprechendzeitintensivundzudemkontinuierlich–also
nicht einmalig – anzuwenden sind. Doch mit den richtigen Werkzeugen, Hilfsmitteln und Prozessen öffnen sich schnell fundierte Wege:
Lieferantenqualifizierung: Mit normenkonformen Fragebögen können Medizinprodukte-Hersteller ihre Softwaredienstleister dahingehend qualifizieren, ob sie über die verpflichtenden Qualitäts- und Informationssicherheits-Managementsysteme sowie über Prozesse zur Schwachstellenüberwachung verfügen.
SoftwareBillofMaterials(SBOM): Softwareverantwortliche dokumentieren jede Komponente der Software in einer Art Stückliste Dazu zählen auch Module von Drittanbietern. Nur so ist eine vollumfängliche Überwachung von Schwachstellen möglich. Elementar ist, dass solch eine SBOM stets aktuell sein muss. Anders als bei einer händisch geführten SOUP(Software of unknown provenance)Liste ist eine SBOM maschinell lesbar. Deshalb existiert eine mannigfaltige Tool-Landschaft, die automatisiert den Source-Code analysiert, stets aktuell ist und das Fehlerpotenzial reduziert.
SBOMManagementTool: Solche Tools verwalten die SBOM zu jedem Projekt und prüfen laufend, ob Softwarekomponenten von Schwachstellen betroffen sind. Hierfür fragen sie bei offiziellen Stellen neue gemeldete Schwachstellen ab Im Falle eines Treffers benachrichtigen die Tools festgelegte Personen oder Gruppen, damit diese zeitnah das Gefährdungspotenzial bewerten und ggf. beheben können.
BelastbarerProzessimFalleeinergefundenen Sicherheitslücke: Verantwortliche können auf Softwareschwachstellen im Ernstfall nur dann sofort angemessen reagieren, wenn ein vorab definierter Notfallplan vorliegt und hierfür alle benötigten Ressourcen zur Verfügung stehen. Der übliche Ablauf umfasst die Analyse der Sicherheitslücke und wie sie sich auf die Software auswirkt (Können Hacker die Schwachstelle überhaupt ausnutzen?), die Risikobewertung (Welche Auswirkungen hätte eine ausgenutzte Lücke?) und ggf. das Beheben der Schwachstelle, inkl. Validierung und Release des Updates sowie Dokumentation des gesamten Prozesses.
HinzukommenzahlreicheMaßnahmen,umauchbei der Softwareentwicklung selbst bereits von Beginn an ein hohes Maß an Angriffssicherheit zu gewährleisten (secure by design). Zu einem sicheren Produktdesign zähltbeispielsweiseeingewissenhafterUmgangmitallen physischen und logischen Produktschnittstellen. Hierbei geht es darum, ob Schnittstellen extern oder intern zugänglich sind, welche Benutzer oder Systeme welche Zugriffe benötigen, wie sie sich sicher authentifizieren und wie sich ihre Eingaben validieren lassen.
Die Sicherheit von Software in Medizinprodukten erfordert umfassende Wachsamkeit und proaktives Management. Hersteller müssen alle Softwarekomponenten, insbesondere jene von Drittanbietern, genau überwachen,umpotenzielleSicherheitslückenzuerkennen und rechtzeitig zu beheben. Nur durch konsequente Maßnahmen können Medizintechnik-Hersteller den wachsenden Bedrohungen der Cybersicherheit effektiv begegnen. (kb)
TIPP
Dr. Martin Neumann und sein Kollege Michael Friedl sprechen auf YouTube über Tool Chain, SBOM und Dependency Tracking –ein Crashkurs zur Cybersecurity in 25 Minuten: www youtube.com/ watch?v=uJUCRPMtvcc

Cybersecurity über den gesamten Lebenszyklus
Vernetzte Medizintechnik wie ein drahtlos nachjustierbarer Herzschrittmacher birgt Cyberrisiken. Regelmäßige Bedrohungsanalysen und Software-Updates bei vernetzten Medizinprodukten sind entscheidend, um die Informations- und Patientensicherheit zu erhalten. Hersteller sind hier in der Pflicht.
VERFASST VON
DirkMüller
Team Lead
Bayoomed GmbH
Ein drahtlos nachjustierbarer Herzschrittmacher oder eine cloudbasierte Infusionspumpe – solche Szenarien sind längst Klinikalltag Doch die dafür nötigen Schnittstellen eröffnen neue Angriffsflächen: für Cyberkriminelle ebenso wie für technikaffine Anwender,dieunbeabsichtigtSchadenanrichtenkönnten. Jede Software- oder Datenbankaktualisierung, jede App-Synchronisation kann potenziell zur Bedrohung werden.DemsolltebereitsinderEntwicklungmitsicherer Softwarearchitektur und codeseitiger Umsetzung nachdemStandderTechnikbegegnetwerden.DieVerordnung (EU) 2017/745 über Medizinprodukte (Medical Device Regulation, kurz MDR) fordert dies implizit in Annex I, Kapitel 17.4. Nach der Markteinführung steigt
durchdiebreitereöffentlicheZugänglichkeitdasRisiko gezielter Angriffe deutlich. Daher ist eine kontinuierliche Überwachung ebenso unerlässlich wie die aktive Einbindung des Betreibers
Regulatorische Vorgaben und Empfehlungen Hersteller sind verpflichtet, ihre Produkte über den gesamten Lebenszyklus – von der Entwicklung bis zur Außerbetriebnahme – vor neuen Bedrohungen zu schützen.DieMDCG-Leitlinie2019-16„GuidanceonCybersecurity for Medical Devices“ und der Standard IEC 81001-5-1„HealthsoftwareandhealthITsystemssafety, effectiveness and security“ setzen genau hier an. Beide
Jede Software- oder Datenbankaktualisierung, jede App-Synchronisation kann bei vernetzten Medizinprodukten potenziell zur Bedrohung werden.

verlangeneinendurchgängigen,risikobasiertenSicherheitsprozess über den gesamten Produktlebenszyklus hinweg.IEC81001-5-1liefertkonkreteMaßnahmen,beispielsweise zur Überwachung und Schwachstellenbewertung nach dem Inverkehrbringen. Der Standard ergänzt damit die Anforderungen der MDR hinsichtlich des sicheren Betriebs vernetzter Medizinprodukte.
Ziel all dieser Maßnahmen ist es, die Vertraulichkeit personenbezogener Daten, die Integrität gespeicherter oderübertragenerInformationenunddieVerfügbarkeit des Medizinprodukts sicherzustellen. Da Cyberrisiken auch die Patientensicherheit direkt gefährden können, isteinekontinuierlicheÜberwachungunerlässlich–sowohl im Sinne der Produktsicherheit als auch zur Einhaltung regulatorischer Vorgaben.
Konkrete Aktivitäten zur Erfüllung der Vorgaben
Eine strukturierte Bedrohungsanalyse aus Angreiferperspektive,unterBerücksichtigungallerSchnittstellen und des jeweiligen Datenverkehrs, erlaubt die gezielte IdentifikationrealistischerAngriffsszenarien.ImFokus stehendabeiSchutzgüterwiepersonenbezogeneDaten oder systemkritische Konfigurationsinformationen. Um Sicherheitslücken systematisch zu erkennen, ist zunächst zu klären, welche externen Softwarekomponenten im Gerät enthalten sind. Hier kommt die Software-Bestandsliste(SoftwareBillofMaterials,SBOM)ins Spiel: Sie dokumentiert alle verwendeten Softwarebestandteile – von Drittanbieterbibliotheken bis hin zu Open-Source-Komponenten–inklusiveihrerVersionen MitHilfederSBOMkönnenHerstellergezieltöffentliche Schwachstellendatenbanken wie die National Vulnerability Database (NVD) abgleichen. Dort veröffentlichte Schwachstellen werden in der Regel mithilfe des CommonVulnerabilityScoringSystem(CVSS)bewertetund risikobasiertpriorisiert.Dabeigilt:Nichtjededokumentierte Schwachstelle ist auch produktrelevant. Deshalb solltedieBewertungstetsinengerAbstimmungmitder Entwicklungsabteilungerfolgen.ZusätzlichliefernVigilanzmeldungenzuvergleichbarenProduktenHinweise auf potenzielle Risiken.
Penetrationstests dienen der praxisnahen Überprüfung identifizierter Bedrohungsszenarien durch gezielte simulierte Angriffe unter realitätsnahen Bedingungen. Besonders geeignet sind so genannte White-BoxTests – bei denen die Tester vollständigen Zugriff auf Quellcode,SystemarchitekturundKonfigurationerhalten. So lassen sich auch tieferliegende Schwachstellen identifizieren
Die Kombination aus theoretischer Bedrohungsanalyse und regelmäßigen Penetrationstests nach der Markteinführung ist ein wirksames Mittel, um das tatsächliche Schutzniveau eines Medizinprodukts kontinuierlichzuüberprüfen.SieliefertzudemkonkreteAnhaltspunkte für notwendige Sicherheitsmaßnahmen
Die gewonnenen Erkenntnisse aus Schwachstellenanalysen, Bedrohungsbewertungen oder Penetrationstests fließenindieAktualisierungderRisikoanalyseein–entsprechend den Vorgaben des zuvor festgelegten Cybersecurity-Risikoplans.AufdieserBasiswerdenrisikominderndeMaßnahmenabgeleitetundderenWirksamkeit
hinsichtlich der Reduktion identifizierter Risiken überprüft. Dabei ist sicherzustellen, dass die ergriffenen Schutzmaßnahmen nicht ihrerseits neue Risiken verursachen–insbesonderekeine,diediePatientensicherheit beeinträchtigen könnten. Ein typisches Beispiel wäre eine eingeschränkte Verfügbarkeit des Produkts infolge eines überzogenen Schutzgrads.
Ein strukturiertes Vorgehen ermöglicht es, auf Basis der Bewertung eine risikobasierte Liste erforderlicher Korrekturmaßnahmenzuerstellen.DieseMaßnahmen werden anschließend im Rahmen eines gesteuerten Softwareaktualisierungsprozesses in das Produkt überführt.
Meldepflichten und koordinierter Informationsaustausch
Bei Cybervorfällen ist ein schnelles, strukturiertes Vorgehenentscheidend.Handeltessichumschwerwiegende Vorkommnisse im Bereich der Informationssicherheit,sindHerstellerverpflichtet,dieseunverzüglichden zuständigenBehördenzumelden–inDeutschlandbeispielsweise dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM). Um in solchen Fällen wirksam reagieren zu können, sollte bereits im Vorfeld ein klar definierter Vorfallreaktionsplan vorliegen. Dieser unterstützt dabei, Schäden einzugrenzen, Anwender zeitnah zu informieren und geeignete Korrekturmaßnahmen schnellstmöglich einzuleiten.
Ein kooperativer Umgang mit Bedrohungen und Schwachstellen ist ebenso essenziell: Der koordinierte Austausch über ein Coordinated-Vulnerability-Disclosure(CVD)-Programm fördert die vertrauensvolle Zusammenarbeit zwischen Herstellern, Anwendern und Sicherheitsforschern. Eine offene, transparente Kommunikation über identifizierte Schwachstellen ist ein zentralerErfolgsfaktorfürdiekontinuierlicheVerbesserung der Informationssicherheit.
Dokumentation und Berichterstattung
SämtlicheMaßnahmenimZusammenhangmitderCybersicherheit eines Medizinprodukts sind lückenlos zu dokumentieren.BereitsimPlanzurÜberwachungnach dem Inverkehrbringen müssen die relevanten Aktivitäten zur Sicherheitsüberwachung klar definiert sein ZudemisteinSicherheitsberichtregelmäßigzuerstellen undaktuellzuhalten.Dieserdokumentiertidentifizierte Risiken, durchgeführte Maßnahmen sowie deren Wirksamkeit und dient als Nachweis für die Erfüllung regulatorischer Anforderungen – etwa im Rahmen von Audits oder behördlichen Inspektionen.
Hersteller können ein hohes Maß an Produkt- und Patientensicherheit nach dem Inverkehrbringen sicherstellen, wenn sie ihre Systeme kontinuierlich überwachen, erkannte Risiken systematisch bewerten und bewährteSchutzmaßnahmenkonsequentanwenden.Die Einhaltung regulatorischer Vorgaben sowie die fortlaufende Weiterentwicklung der Cybersicherheitsstrategien sind unerlässlich, um den hohen Qualitäts- und SicherheitsanforderungenderMedizintechnikwährend des gesamten Produktlebenszyklus gerecht zu werden. (je)
Fertigung
Etwa neun Mio Menschen in Deutschland benötigenjährlichZahnersatz–z.B.Kronen, Brücken und Prothesen. Dabei kommt immer häufiger die additive Fertigung mittels 3D-Druck zum Einsatz. An der Hochschule Osnabrück widmet sich Marius Behnecke dieserTechnikundforschtimRahmeneiner kooperativen Promotion an neuen Verfahren zur Herstellung bioaktiver Zahnersatzteile mittels 3D-Druck. Kern des Projekts ist die Integration des antiseptischen WirkstoffsChlorhexidininindividuellgefertigte Zahnersatzkomponenten.
DieadditiveFertigungerlaubteinepräzise Steuerung des Materialaufbaus und damit eine gezielte Freisetzung des Wirkstoffs. Diese Kombination aus Individualisierbar-
keit und Funktionalität soll die Effektivität und Sicherheit dentaler Anwendungen signifikanterhöhen.DieBauteilebestehenaus einem Gemisch flüssiger Monomere, Glaspartikeln und Chlorhexidin. Eine gleichmäßige Verteilung der Komponenten ist entscheidend für die mechanischen Eigenschaften und die gleichmäßige Integration des Wirkstoffs. Die Aushärtung erfolgt mittels UV-Licht, wobei Parameter wie Belichtungszeit und Lichtintensität gezielt angepasst werden.
Behnecke betont, dass die Kombination aus Softwaresteuerung und gängiger Hardware in der Zahntechnik es erlaubt, die neuartigen Zahnersatzteile mit vorhandenen 3D-Druckern herzustellen – ohne größere
Investitionen in Spezialgeräte. Das entwickelte Materialkonzept eröffnet Perspektiven weit über die Zahntechnik hinaus. Insbesondere in der Orthopädie und bei ImplantatengibtesvielversprechendeEinsatzmöglichkeiten. Die Integration bioaktiver Materialien in medizintechnische Anwendungen – insbesondere in Verbindung mit Elektronik–könnediePatientenversorgung deutlich verbessern.
DieEuropäischeUnionfördertdasProjekt 3D-Perm – Bioaktiver 3D-gedruckter permanenter Zahnersatz – im Rahmen von EFRE 2.2.2. Die Förderlinie unterstützt praxisorientierte Forschung an Fachhochschulen, um den Technologietransfer in die praktische Anwendung zu fördern. (je)
3D-Druck
Der3D-Druckhilftdabei,ZeitundKostenin der Orthopädietechnik einzusparen – vorausgesetzt, die gedruckten Orthesen oder Prothesenschäfte, also das VerbindungsstückzwischenStumpfundProthese,halten den realen Belastungen auch stand. PromovendBrunoSchubertwilldafürimLaborfür Biomechatronik der FH Münster Sorge tragen. Mit einem selbst konstruierten Prüfstand testet er 3D-gedruckte ProthesenschäftehinsichtlichihrerBelastbarkeitund erforscht, welche Kunststoffe sich für den Druckbesonderseignen Dieswürdeermöglichen, individuell auf die Bedürfnisse der jeweiligen Patienten abgestimmte Prothesenschäfte schnell und kostengünstig herzustellen. „Ich habe schon mehr als 15 verschiedene Materialien getestet“, sagt Schubert. „Jetzt gerade arbeite ich mit PET, dem
ich Carbon-Kurzfasern beigemischt habe Daseignetsichgutfürden3D-Druck.“Erbefindet sich gerade im Labor für Kunststofftechnologie und Makromolekulare Chemie aufdemTechnologie-CampusSteinfurt,dessenTeamSchubertdabeihilft,dieKunststoffezufindenundanzupassen.„Eindenkbarer nächster Schritt wäre es auch, das ideale Material einfach selbst zu entwickeln.“
Hinter ihm steht der Prüfstand, in den SchubertdenProthesenschafteinklinkt Ein darin verbauter Metallzylinder – der übrigens selbst im Labor für Werkzeugmaschinen und Fertigungstechnik im Metall-3DDrucker entstanden ist – wirkt mit einem definierten Kraftniveau von rund 450 Kilogramm30SekundenlangaufdenSchaftein „Eine für Prothetik zuständige DIN-Norm gibt vor, dass eine Prothesenkomponente

Ein eigens konstruierter Prüfstand übt die nötige Belastung auf den Schaft aus, um zu testen, ob er den notwendigen Bedingungen einer DIN-Norm entspricht.
Bild: FH Münst er/F re derik T ebbe
drei Millionen Zyklen lang halten soll – das entsprichtdreiMillionenSchrittenundumgerechnet einer Lebenszeit von drei Jahren pro Schaft.“ Eine Herausforderung ist, dass dieseNormbishernichtfürProthesenschäfte gilt. Ein weiteres Problem ist das Fehlen einesgeeignetenModellsdesmenschlichen Stumpfes. Das Modell dient während der Prüfung dazu, das menschliche Bein zu simulieren. Es muss einerseits alle wesentlichen Eigenschaften des menschlichen Gewebes abbilden und andererseits kostengünstig und einfach reproduzierbar sein. Schuberts Aufgabe neben der Normung istes,einerseitsdasgeeigneteAusgangsmaterial für den 3D-Druck zu finden, aber andererseits auch die passenden Parameter herauszuarbeiten,umdieSchäfterichtigzu drucken. Dazu zählen etwa die richtigen Temperatureinstellungen oder die Druckgeschwindigkeit. „Die Herausforderung besteht außerdem darin, trotz individueller AnforderungenandenProthesenschaft,die zum Beispiel je nach Körpergröße, -gewicht oder Geschlecht variieren können, eine gleichbleibende Qualität zu gewährleisten“, so Schubert. Um künftig Zeit und Material zu sparen, plant der Doktorand die Simulation in einem digitalen Zwilling Würde diese vielversprechend ausfallen, könnte er anschließendunterrealenBedingungenim Prüfstandtesten.Der3D-Druckseieineechte Bereicherung für die Orthopädietechnik, jedoch werde er in Europa noch nicht weitläufig angewandt. „Wir greifen darum auch auf Wissen zurück, das in der OrthopädietechnikbishertraditionellanderWerkbank erarbeitetwurde.SoentstehteinAustausch: BeideSeitenprofitierenvomKnow-howder jeweils anderen.“ (je)
KI-Modell soll Stent-Analyse beschleunigen
Stentskommenweltweitmillionenfachzum Einsatz. Sie halten verengte Gefäße offen –meist nach einem Herzinfarkt. Doch die Nachsorgebleibtaufwendig.ÄrztlicheFachkräfte müssen beurteilen, wie sich das Gewebe rund um die Implantate entwickelt. Wächst es unregelmäßig oder lagert sich Plaque ab, steigt das Risiko für eine erneute
Verengung Ein genaues Bild liefern sogenannte OCT-Aufnahmen. Die optische Kohärenztomographie erzeugt Querschnitte derGefäßinnenwand–ähnlicheinemhochauflösendenUltraschall.Dochdiemanuelle Auswertung dieser Bildserien ist laut Forschenden sehr zeitintensiv. Für den klinischenAlltagseidasVerfahrenbislangkaum

Deep Neo erkennt Narbengewebe (Neointima) mit Präzision auf Expertenniveau.
Projekt „HATE-Fluor“
Viele Unternehmen suchen nach Alternativen für poly- und perfluorierte Alkylverbindungen (PFAS), da deren Einsatzmöglichkeiten in der Zukunft ungewiss sind und freiwillige Selbstverpflichtungen erwartet werden. PFAS stecken in Alltagsprodukten wiebeschichtetenPfannen,aberauchinMedizintechnik, Wärmepumpen, Batterien WährendesfüreinigeAlltagsanwendungen bereitsfluorfreieSubstitutegibt,bestehtfür technischeAnwendungen,dieextremenBedingungen standhalten müssen, ein großer BedarfanneuenindividuellenLösungenzur Substitution von Fluorpolymeren. In dem neu initiierten Projekt „HATE-Fluor“ werden Expertenteams am FraunhoferInstitut für Betriebsfestigkeit und Systemzuverlässigkeit LBF und am Fraunhofer-Institut für Fertigungstechnik und Angewandte Materialforschung IFAM fluorfreie beschichtete Elastomere entwickeln und anpassbare Baukastenlösungen anbie-
ten, um den wachsenden Marktbedarf zu decken. Die Lösung umfasst drei Hauptschritte: die Verbesserung der thermischen Stabilität fluorfreier Elastomere durch neuartige Antioxidantien, die Herstellung abgestimmterElastomer-Formulierungenund die Entwicklung eines Beschichtungssystems zum Schutz des Elastomers vor oxidativem und chemischem Angriff. Durch den modularen Aufbau dieses Systems, bestehendausLack-undPlasmabeschichtungen, soll ein breites Spektrum im Bereich der fluoralternativen Dichtungen abgedeckt werden. Die Zieleigenschaften werden durch die Einsatzgebiete derjenigen Fluor-

Kick-off: Das Fraunhofer-Projektteam und die Beiräte aus der Industrie von „HATE-Fluor“
praktikabel. Abhilfe verspricht eine neue Software. Das KI-Modell Deep Neo erkennt aufOCT-BildernverschiedeneGewebearten rundumStents.EntwickeltwurdederAlgorithmus von Helmholtz Munich und dem Klinikum der TU München. Laut einer Veröffentlichung in „Nature Communications Medicine“ arbeite die KI so präzise wie medizinischesFachpersonal–jedochineinem Bruchteil der Zeit.
Für das Training nutzten die Forscher 1.148manuellannotierteAufnahmenvon92 Patienten. Deep Neo klassifiziert unter anderemGewebedicke,Stentabdeckungsowie krankhafte Strukturen wie Neoatherosklerose. Im Tiermodell erkannte die KI in 87 ProzentderFällekrankhafteGewebekorrekt, verglichen mit histologischen Laboranalysen.
„Mit Deep Neo erreichen wir eine automatisierte,standardisierteundäußerstpräzise AnalysederStent-undGefäßheilung“,sagte ValentinKoch,ErstautorderStudie.DieSoftwarekönnelautTUundHelmholtzMunich dazu beitragen, Diagnosezeiten zu verkürzenundTherapieentscheidungenfundierter zu treffen. Auch die Integration in den Klinikalltag rückt näher. (je)
elastomere vorgegeben, die im Projekt ersetzt werden.
Das Fraunhofer LBF konzentriert sich im Projekt „HATE-Fluor“ auf die Entwicklung vonHochleistungselastomerenalsErsatzfür Fluorpolymere in technischen Anwendungen. Ein Schwerpunkt liegt auf der Verbesserung der thermischen und thermo-oxidativenStabilitätfluorfreierElastomeredurch neuartige Antioxidantien. Zudem werden anwendungsoptimierte Elastomer-Formulierungenentwickelt,ummaximaleBeständigkeit und optimale Haftanbindung zu gewährleisten. Ergänzt wird dies durch die Formulierung eines Beschichtungssystems fürdieElastomere.LetztereswirdamFraunhofer IFAM entwickelt, um das Material vor oxidativem Angriff und chemischer Zersetzung zu schützen.
Zudem arbeitet das Fraunhofer IFAM innerhalb des Projekts an der Beschichtung dieser Elastomere, um deren Reibungsreduktion und Barriere-Eigenschaften zu verbessern. Ein besonderer Fokus liegt auf der EntwicklungvonPolyimid-Beschichtungen inKombinationmitSchichtsilikaten,diedie Permeation von schädlichen Gasen und Feuchtigkeit verhindern. (je)
www.devicemed.de
Leserservice devicemed.de/hilfe oder E-Mail an vertrieb@vogel.de mit Betreff „DeviceMed“ Gerne mit Angabe Ihrer Kundennummer vom Adressetikett: *CS-1234567*
Redaktionsservice
Kontakt zur Redaktion: Tel. +49 931 418-2333 fachmedien@vogel.de
Chefredakteur: Marc Platthaus (pl), V.i.S.d.P
Redaktion:
Julia Engelke (je)
Kristin Breunig (kb)
Layout: Alexandra Geißner
Schreibweisen, Firmen- und Produktnamen: Wir halten uns generell an die Schreibempfehlungen des Dudens.
Haftungsausschluss: Für den Inhalt der einzelnen Artikel sind die jeweils benannten Autoren verantwortlich, er spiegelt nicht zwangsläufig die Meinung der Redaktion wider. Eine Haftung für die Richtigkeit der Veröffentlichungen kann trotz sorgfältiger Prüfung nicht übernommen werden. Kein Teil dieser Publikation darf ohne ausdrückliche schriftliche Genehmigung in irgendeiner Form reproduziert oder unter Verwendung elektronischer Systeme verarbeitet, vervielfältigt oder verbreitet werden.
VerkaufvonMedialeistungen
Director Sales: Annika Schlosser Tel. +49 931 418-2982 sales@vogel.de
Auftragsmanagement: auftragsmanagement@vogel.de
Abonnement
Bezugspreis (inklusive Versandkosten):
Inland: jährl 130,90 €
Ausland: jährl. 154,90 €
Einzelheft: 26,18 €
Verbreitete Auflage:
Angeschlossen der Informationsgemeinschaft zur Feststellung der Verbreitung von Werbeträgern – Sicherung der Auflagenwahrheit. Aktuelle Zahlen: www.ivw.de ISSN 1860-9414

Vogel Communications Group GmbH & Co. KG
Max-Planck-Str. 7/9, 97082 Würzburg Tel. +49 931 418-0 www.vogel.de
Beteiligungsverhältnisse:
Persönlich haftende Gesellschafterin:
Vogel Communications Group Verwaltungs GmbH
Max-Planck-Straße 7/9, 97082 Würzburg
Kommanditisten:
Dr. Kurt Eckernkamp GmbH, Nina Eckernkamp, Klaus-Ulrich von Wangenheim, Heiko Lindner, Axel von Kaphengst
Geschäftsführung: Matthias Bauer (Vorsitz), Günter Schürger Druck:
Vogel Druck und Medienservice GmbH Leibnizstraße 5, 97204 Höchberg Gedruckt auf PEFC zertifiziertem Papier Fragen zur Produktsicherheit: produktsicherheit@vogel.de
Copyright: Vogel Communications Group GmbH & Co. KG
Hybrid-System vereint Exoskelett und Elektrostimulation

Wolfgang Korisanski ist einer der 24 Patienten, die das neue System aus Exoskelett und Elektrostimulation für eine Studie bereits getestet haben
Forscher der Technischen Universität München (TUM) haben ein System entwickelt, mit dem Patienten schon kurz nach einem Schlaganfall wieder lernen können, von Lähmungen betroffene Arme und Hände zu bewegen. Eine gezielte Anregung der Muskulatur im Unterarm und ein Exoskelett sind dafür nötig
Die Forscher der TUM regen durch so genannte funktionale Elektrostimulation (FES) gezielt Muskeln im Unterarm an. Das ist etwa nötig, um Finger zu bewegen, Dinge zu greifen oder Bälle zu fangen. Da bei einer halbseitigen LähmungnacheinemSchlaganfallinderRegeljedochnichtnurdieHandbetroffen ist, sondern die gesamte Körperseite, unterstützt ein Gerüst zusätzlich den gesamten Arm bis zur Schulter
24Schlaganfall-BetroffenehabendasGesamtsystemauseinemExoskelettfür Arm und Schulter in Kombination mit der FES im Rahmen des Forschungsprojektes„ReHyb“bereitseingesetzt–dieHälftevonihneninderSchönKlinikBad Aibling Harthausen, die die Leitung der Studie übernommen hatte. Um das GreifenundBewegendesArmssehrschnellnachdemSchlaganfallzutrainieren, setzen die Forscher zudem auf ein Computerspiel, das sich im SchwierigkeitsgradautomatischandieFähigkeitenderNutzeranpasst:AufeinemBildschirm kommen Bälle in verschiedenen Farben und Geschwindigkeiten auf die Patientenzugeflogen.DieAufgabebestehtdarin,dieBällezufangenunddenentsprechenden verschiedenfarbigen Fächern zuzuordnen.
Im Zentrum der Entwicklung von TUM-Professorin Sandra Hirche steht ein digitalerZwilling,derdieindividuellenVoraussetzungenjedesPatientenerfasst undineinenRegelkreisbringt.UnteranderemmüssendieForscherbestimmen, wie gut jeder Patient Arm und Hand bewegen kann. Bei einem Schlaganfall können Lähmungen beispielsweise durch eine Beschädigung des für die Bewegung zuständigen motorischen Areals im Gehirn entstehen Doch lässt sich nicht vorhersagen, wie stark die Signale nach dem Schlaganfall beeinträchtigt sein werden, die vom Gehirn bis zur Muskulatur im Unterarm weitergeleitet werden. „Einzelne Muskelstränge in der Unterarmmuskulatur lassen sich im richtigenMaßeanregen,umHandundFingerzubewegen“,sagtdieForscherin vom Lehrstuhl für Informationstechnische Regelung NebenInformationenzurMuskelaktivitätimUnterarmmüssendieForscher wissen,wiestarkdieMuskulaturstimuliertwerdenundwiestarkdasExoskelett assistieren sollte. „Mithilfe von Algorithmen bringen wir diese individuellen InformationenineinemRegelkreiszusammen“,sagtdieExpertinfürRegelungstechnikHirche.DieserdigitaleZwillingistalsonötig,umdieBewegungvonArm und Hand bei betroffenen Menschen individuell zu unterstützen.
Prof Hirche spricht von einer intentionsgesteuerten intelligenten Regelung, da Patienten sich mit Hilfe dieser Technologie nach einem Schlaganfall wieder einStückweitsobewegenkönnen,wiesieeswollen.UndauchCarmenKrewer, TeamleiterinderForschungsgruppebeimKooperationspartnerSchönKlinikaus BadAibling,istbegeistert:„EinderartmodularesSystemmitElektrostimulation undExoskelettgabesbishernochnicht.ZudemermöglichtesBetroffenen,auch ohne Unterstützung anderer zu Hause weiter zu trainieren.“ (je)
Nicht-invasive Methode
Harnwegstents und -katheter sind in der Human-undVeterinärmedizinweitverbreitet und dienen der Ableitung von Urin in oderausderBlase Ureterstentswerdeneingesetzt, wenn der Harnleiter, das heißt der Gang zwischen Niere und Blase, durch Tumore, Schwangerschaft, Steine oder anatomische Verengungen blockiert ist. Verstopfungen durch bakteriellen Biofilm oder kristalline Ablagerungen – sogenannte Verkrustungen – zählen zu den häufigsten KomplikationennachderImplantation Diese Ablagerungen entstehen an Innen- und Außenwänden solcher Stents und Katheter undkönnenschmerzhafteInfektionenoder garVersagendieserGeräteverursachen Um diese Probleme zu vermeiden, müssen Harnwegstents und -katheter alle zwei bis sechs Monate ausgetauscht werden, was
nichtnurdieLebensqualitätderBetroffenen erheblich einschränkt, sondern auch zu einer großen Belastung der Spitäler und hohen Kosten führt.
UnterderLeitungvonDanielAhmed,Professor für akustische Robotik an der ETH Zürich, und Francesco Clavica vom Artorg Center der Universität Bern simulierte das internationale Team die Verhältnisse in einem gestenteten Harnleiter Sie konnten zeigen, dass durch Ultraschall aktivierte künstliche Flimmerhärchen auf der Oberfläche des Stents Biofilme und Verkrustungen effizient entfernen können. Die Ergebnisse wurden in der Fachzeitschrift PNAS veröffentlicht.„MitUnterstützungdesInnovationOfficederUniversitätBernhabenwir dieGrundlagenforschungmeinerETH-Doktorarbeit in eine anwendungsnahe Techno-
Noch ist das Zukunftsmusik: Ein Arzt reinigt den Harnwegstent eines Patienten mit Ultraschall ohne invasiven Eingriff. (Symbolbild)
Bild: © zink ev yc hst oc k.ado be. co m
logie überführt“, erklärt Cornel Dillinger Er teilt sich die Erstautorenschaft mit Pedro Amado, beide vom Artorg Center der Universität Bern. Die Forscher möchten neue medizinischeGerätemitwinzigenFlimmerhärchen an den Innen- und Außenwänden ausstatten,diedurchgezielteUltraschallreize eine reinigende Strömung erzeugen, die BakterienundKristallevondenOberflächen löstundwegspült.AufdieseWeisekönnten Stents und Katheter nicht-invasiv gereinigt werden, was das Risiko einer Verstopfung deutlich verringern würde.
Die Forscher konnten zeigen, dass Ultraschallwellen,dieaufglatteOberflächentreffen, kaum Strömung erzeugen. Weist die Oberfläche hingegen Mikrostrukturen mit scharfen Kanten auf, z. B. Flimmerhärchen, entsteht eine sehr effiziente Strömung, die als akustische Strömung bezeichnet wird. DieErgebnissederMikrofluidik-ExperimenteübertrafendieErwartungenderForschenden bei weitem. „In allen Tests konnten typischeVerkrustungenundBiofilme,wiesie in Harnwegstents und -kathetern vorkommen, mit unserer Technologie innerhalb von Minuten oder sogar Sekunden entfernt werden“, erklärt Daniel Ahmed, Co-Leiter der Studie. Diese Technologie könnte nicht nur in der Urologie, sondern auch in anderen Bereichen wie beispielsweise der ViszeralchirurgieoderderTiermedizineingesetzt werden,wodieReinigungimplantiertermedizinischer Geräte ebenfalls entscheidend ist. Die nicht-invasive Reinigung durch Ultraschallaktivierung birgt das Potential, invasive Folgeeingriffe zu reduzieren und damitsowohldieLebensqualitätvonPatienten zu verbessern als auch das Gesundheitssystem zu entlasten. (je)













Beilagenhinweis


Dieser Ausgabe liegen Prospekte folgender Firmen bei:
• RCT Reichelt Chemietechnik GmbH & Co., 69126 Heidelberg
• senetics healthcare group GmbH & Co. KG, 91522 Ansbach
Wir bitten unsere Leser freundlichst um Beachtung




EinweiteresQuartalistvergangen,undwirkönnenaufeinewahrhaftaufregendeZeitzurückblicken.DasWetter warsoaußergewöhnlichgut,dassesmöglicherweisezueinergeringerenAnzahlanneuenRichtliniengeführthat.
EU-MDR & IVDR Updates: Ein bedeutendes Update betrifft die MDCG 2020-16 rev.4 Guidance on Classification Rules for in vitro Diagnostic Medical Devices unter der Verordnung (EU) 2017/746. Besonders wichtig sind die bevorstehenden Fristen: Die Kennzeichnung mit der Unique Device Identification (UDI) für Klasse 1 und IVD C+B muss bis zum 25. bzw 26 Mai abgeschlossen sein. European Health Data Space (EHDS): Neben den üblichen Regularien habe ich diesmal etwas Besonderes, den European Health Data Space (EHDS). Vor kurzem war ich auf einer Konferenz in Luxemburg, die sich als die wohl beste Konferenz aller Zeiten herausgestellt hat. Klare, harte Fakten ohne Umschweife – ein Traum für jeden Bürokraten. Aber worum geht es tatsächlich? Der EHDS zielt darauf ab, einen gemeinsamen Rahmen für die Nutzung und den Austausch elektronischer Gesundheitsdaten in der gesamten EU zu schaffen. Dies soll den Einzelpersonen mehr Kontrolle über ihre Gesundheitsdaten geben und die Wiederverwendung dieser Daten für Forschung und öffentliche Interessen ermöglichen. Langfristig könnten viele Studien durch die Sekundärdatennutzung obsolet werden.
DeviceMed NACHGEFRAGT

AI Act Update: Der AI Act fordert, dass Unternehmen ab dem 2 August 2025 sicherstellen, dass ihre Mitarbeiter im Umgang mit künstlicher Intelligenz (KI) geschult sind und dies nachweisen können. Leider fehlt das noch bei vielen Unternehmen auf der To-do-Liste, aber es ist ein Must-have. Also ran an die Schulungsprogramme.
*StefanBolleininger,GeschäftsführenderGesellschaftervon„beonQuality“,hatals ConsultantvieleJahreErfahrung.EristzudemTrainer,LehrbeauftragterderTHNürnberg, QM-Beauftragter,Auditoru.v.m.FürDevicemedbefundeterexklusivdieaktuelleLageinSachen QualitätsmanagementundRegulatoryAffairs www.be-on-quality.com
Die Analyse und Kontrolle der Beschichtung sind entscheidend im Engineering Das Unternehmen Cemecon unterstützt seine Kunden bei der Werkzeugfertigstellung.
Herr Balzereit, die Anforderungen in Branchen wie Medizintechnik, Elektromobilität oder Elektronik sind hoch. Wie unterstützt Cemecon Werkzeughersteller dabei, sich erfolgreich im Markt zu positionieren?
Jürgen Balzereit: Oft kommen Werkzeughersteller auf uns zu, weil sie ein neues Werkzeug auf den Markt bringen möchten und unsere Expertise anfragen oder das Ziel verfolgen, sich noch mehr vom Wettbewerb zu differenzieren. Manchmal kommt es zudem vor, dass die Zerspanung beim Anwender nicht optimal läuft und das Werkzeug besser auf die Anwendung abgestimmt werden soll. Unser Engineering-Team analysiert Zerspanergebnisse, Materialeigenschaften und Werkzeuggeometrien, um eine optimale Beschichtungslösung zu entwickeln. Diese Maßanfertigungen verschaffen unseren Kunden einen klaren Wettbewerbsvorteil.
Wie läuft ein solcher Prozess in der Praxis ab?
Balzereit: Zunächst betrachten wir die Anforderungen an das Werkzeug und das zu bearbeitende Material. Je mehr Informationen wir haben, desto besser können wir eine kundenindividuelle Beschichtungsspezifikation erstellen. Dazu gibt es einige Stellschrauben: Schichtwerkstoff, Schichtdicke, Tole-
ranz, Vorbehandlung, Finishing und noch weitere. Dabei arbeiten wir eng mit unseren Kunden zusammen und setzen auf das so genannte Sampling: Die Werkzeuge erhalten verschiedene Beschichtungen, die im Zerspantest beim Kunden validiert werden. Erst wenn das bestmögliche Ergebnis erzielt wurde, definieren wir eine finale Beschichtungsspezifikation.
Herr Geisen, Sie analysieren die Beschichtungen im Detail. Welche Rolle spielen Ihre Untersuchungen im EngineeringProzess?
Stephan Geisen: Eine entscheidende! Unsere Kunden erwarten eine gleichbleibend hohe Qualität, und dafür müssen wir jedes Detail der Beschichtung kennen Wir messen u. a. die Schichtdicke, analysieren die Rauheit der Oberfläche und überprüfen die mechanischen Eigenschaften wie Härte und Haftung. Dabei setzen wir auf modernste Messtechnik – beispielsweise nutzen wir ein High-End-Raster-Elektronenmikroskop von Zeiss, um feinste Details sichtbar zu machen. Diese Daten helfen uns, die Premium-Beschichtungen optimal auf die jeweiligen Zerspanprozesse abzustimmen
Das Interview führte Marc Platthaus








