
1
3


1
3
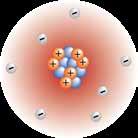
Zeewater is een mengsel en kan je met een fysisch proces scheiden tot zout (NaCl) en water (H2O). Water (H2O) kan verder ontleed worden tot 2 moleculen waterstofgas (H2) en 1 molecule zuurstofgas (O2).
Duid met het cijfer aan op de tekening: mengsel (1), zuivere stof (2), molecule (3), atoom(4).









Oriëntatie
Onderzoeksvraag










Hoeveel moleculen water zitten er in een glas water ?
Hypothese








Het is gemakkelijk om het aantal druiven in een glas te tellen. Als je de druiven vervangt door rijstkorrels, duurt het iets langer om ze te tellen. Als je dan nog kleinere deeltjes gebruikt, zoals zoutkorrels, duurt het nog langer en wordt het veel moeilijker om ze te tellen. Watermoleculen zijn zelfs nog kleiner!
weinig in 1 glas veel in 1 glas




eenvoudig te tellen moeilijk te tellen
We geven alvast het antwoord op de vraag. In een glas water zitten 8 360 000 000 000 000 000 000 000 moleculen, of 8,36 · 1024 moleculen. Dit is ongelooflijk veel! Om een idee te geven: dit zijn meer moleculen dan dat er tot op heden voor ons bekende sterren in het hele universum zijn. In deze module zullen we ontdekken hoe je het zelf kan uitrekenen.

Onderstaande vergelijkingen zullen je een beter beeld schetsen over de grootte van dit getal.
Vul in met kleiner, groter of gelijk aan. Zoek online op.
a Het aantal zandkorrels op onze aarde is dan het aantal watermoleculen in 1 glas water.
b Het aantal mieren op onze aarde is dan het aantal watermoleculen in 1 glas water.
c Het aantal atomen in je lichaam is dan het aantal watermoleculen in 1 glas water.
Nu we ons een idee kunnen vormen bij dit getal, zijn we klaar om in de wereld van het chemisch rekenen te duiken!
Eerst zullen we leren hoe we de massa van een atoom kunnen berekenen om vervolgens over te stappen naar het berekenen van de massa van moleculen.
1.1 Massa van een atoom
Je leerde in ISAAC-chemie 3 dat stoffen zijn opgebouwd uit kleine deeltjes die dezelfde fysische eigenschappen hebben als de stof zelf. Je maakte kennis met de verschillende atoommodellen. Atomen zijn opgebouwd uit protonen, neutronen en elektronen. Het aantal hiervan kunnen we afleiden uit het periodiek systeem van de elementen (PSE)
Atomen van hetzelfde element kunnen een verschillend aantal neutronen bevatten. We noemen dit isotopen. Hoewel elke isotoop van eenzelfde element steeds hetzelfde aantal protonen en elektronen bevat, verschilt het aantal neutronen per isotoop, waardoor isotopen van één element een verschillende massa hebben
Ga met de applet van PHET op onderzoek naar de stabiele isotopen, dit wordt onder het isotoop vermeld.
Zoek de isotopen van waterstof, zuurstof en koolstof.
isotoop aantal p+ aantal e– aantal n0
1.1.1
Absolute atoommassa (ma)
De absolute massa van een atoom is een maat voor de hoeveelheid materie waaruit dit atoom is opgebouwd.
grootheid
absolute atoommassa m a kilogram kg
Waarom wordt er bij de atoommassa geen rekening gehouden met de massa van elektronen?
Om het rekenen eenvoudiger te maken werd de ‘atomic mass unit’ of ‘amu’ geïntroduceerd.
De ‘internationale atoommassa-eenheid’ amu (u). amu is de afkorting van het Engelse woord ‘atomic mass unit’.
1 u = 1,66 10-27 kg of 1,66 10-24 g
De atoommassa-eenheid (u) is gelijk aan 1/12 deel van de absolute massa van een 12C-atoom.
Er mag worden aangenomen dat de massa van een proton en een neutron beiden gelijkgesteld kunnen worden aan de massa van 1 unit. De absolute atoommassa kan dus ofwel in kg, g of ‘units’ uitgedrukt worden.
De absolute massa van één ijzeratoom kan dan berekend worden met de massa van de protonen en neutronen. We nemen als voorbeeld 56Fe.
Z = A = aantal protonen: aantal neutronen:
m( 56 26 Fe) = (26 · mproton) + (30 · mneutron) + (26 · melektron) = (26 · 1,673 · 10-27 kg) + (30 · 1,675 · 10-27 kg) + (26 · 9,109 · 10-31 kg)
= 9,375 · 10-26 kg
Doordat de massa van een elektron ongeveer 2000 maal kleiner is dan de massa van een proton of neutron, mag de massa van het elektron in de berekening van de atoommassa verwaarloosd worden.
1.1.2 (Gemiddelde) relatieve atoommassa (Ar)
De absolute atoommassa van een atoom is zeer klein. Daarom gaan we eerder gebruik maken van de relatieve atoommassa.
De gemiddelde relatieve atoommassa (A r) is een onbenoemd getal dat uitdrukt hoeveel keer de massa van een atoom groter is dan de atoommassa-eenheid. Het is een verhouding tussen de absolute massa van één atoom en de atoommassa-eenheid.
Voorbeeld
Het berekenen van de relatieve atoommassa van m ( 56 26 Fe)
Ar= ma u = m( 56 26 Fe) u = 9,375 · 10-26 kg 1,66 · 10-27kg ≈ 56,5
Wat meer gebruikt wordt, is de gemiddelde relatieve atoommassa. Dit is het gewogen gemiddelde van de atoommassa’s van de isotopen van een element, rekening houdend met hun natuurlijke rijkdom, en wordt uitgedrukt zonder eenheid. Dit zijn ook de waarden die in het periodiek systeem van de elementen (PSE) zijn opgenomen
IJzer heeft verschillende isotopen. Niet elk isotoop komt evenveel voor, namelijk:
1 54Fe: 5,85%
2 56Fe: 91,75 %
3 57Fe : 2,1 %
4 58Fe: 0,3 %
Gemiddelde
Chloor (Cl) bestaat uit twee stabiele isotopen, namelijk 35Cl en 37Cl. Ze komen respectievelijk 75% en 25% voor in het dagelijks leven. Bereken de gemiddelde relatieve atoommassa.
Door een nauwkeurige berekening staat in het periodiek systeem een andere waarde dan hierboven vermeld. Afgerond komen we wel aan dezelfde waarde.
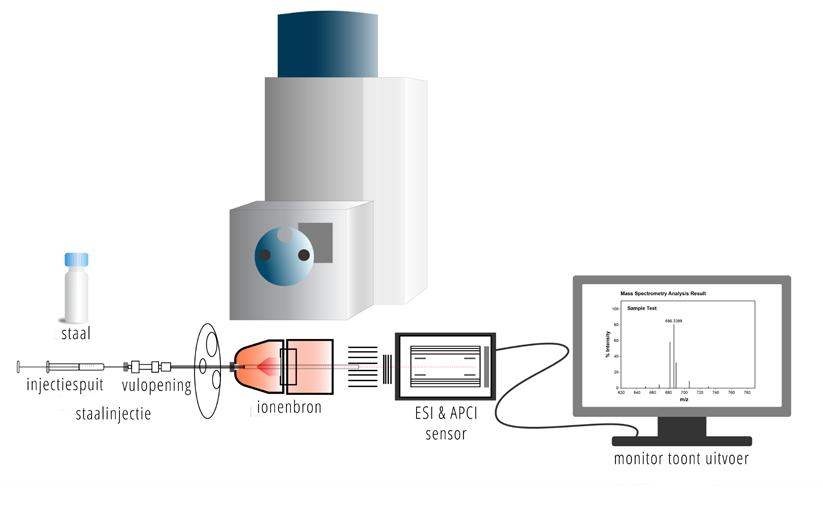
Wetenschappers kunnen met behulp van een techniek die massaspectrometrie noemt, de massa van atomen bepalen. Ze doen dit door een lading te geven aan een molecule en deze geladen molecule door een magnetisch veld te sturen. De manier waarop deze deeltjes afbuigen, gebeurt aan de hand van de massa.
Er werd dus eerst ontdekt dat koolstof bestaat uit 2 stabiele isotopen, namelijk 12C en 13C. Er werd als standaard 12C gekozen, omdat dit de meest stabiele is en veel voorkomt in de natuur.
Wetenschappers wisten dat een 12C-atoom bestaat uit 6 protonen, 6 neutronen en 6 elektronen.
Ze gebruikten dit om een relatieve schaal te maken, waarbij 1 u = 1 12 massa van het 12C-atoom.
Om te begrijpen hoe iemand ooit in staat was om de massa te bepalen van 1 atoom, moeten we nog een beetje verder gaan in dit hoofdstuk.
Vul onderstaande tabel aan.
Markeer de massa die terug te vinden is in het PSE.
Deze tabel kan als samenvatting dienen van dit hoofdstuk over massa’s van atomen.
De volgende stap is de massa berekenen van moleculen die bestaan uit verschillende atomen. We maken hier het onderscheid tussen de molecuulmassa en de formulemassa.
Je kan dit vergelijken met het inpakken van een koffer als je op reis gaat. Je mag maximum 10 kg bagage meenemen op het vliegtuig en je meet de massa van:
• de koffer: 3,2 kg
• een T-shirt: 0,4 kg
• een broek: 0,8 kg
• schoenen: 1,1 kg

Hoeveel weegt je koffer als je 5 T-shirts, 3 broeken en 2 paar schoenen meeneemt?
Je kan de totale massa van de koffer berekenen als je de massa van de afzonderlijke delen kent.
1.2.1 Relatieve molecuulmassa (Mr)
Om de relatieve moleculemassa (M r) te berekenen van een molecule nemen we de som van de gemiddelde relatieve atoommassa’s van alle atomen in de molecule die verbonden werden via een atoombinding. We houden rekening met het aantal atomen van elke atoomsoort.
Hoe bereken je de molecuulmassa?
1 Noteer het aantal atomen dat per atoomsoort voorkomt in de molecule.
2 Noteer de massa per atoom.
3 Maak de som.
Net als de relatieve atoommassa heeft de relatieve molecuulmassa geen eenheid.
Voorbeeld
Bereken de molecuulmassa van fosforzuur (H3PO4, triwaterstoffosfaat).
Gegeven: 1 molecule H3PO4
Gevraagd: Mr(H3PO4)
Oplossing: 1 De molecule bestaat uit 3 H-atomen, 1 P-atoom en 4 O-atomen.
2 Ar(H) = 1,008 Ar(P) = 30,974 Ar(O) = 15,999
3 Mr(H3PO4) = 3 · Ar(H) + 1· Ar(P) + 4 · Ar(O) = (3 · 1,008) + (1 · 30,974) + (4 · 15,999) = 97,994
Nu hebben we de massa berekend in de eenheidsmassa. Om deze om te rekenen naar kilogram, vermenigvuldigen we met een constante. De massa van 1 u is de massa van 1 12 van het 12C- isotoop,
wat gelijk is aan 1,66 · 10-27 kg. De massa van 98,0 u wordt dan:
Mr(H3PO4) = 97,994 · 1,66 · 10-27 kg = 1,63 · 10-25 kg
Bereken de molecuulmassa van koolzuur (H2CO3, diwaterstofcarbonaat) in kg.
1.2.2 Formulemassa

Je leerde al over de verschillende soorten bindingen. De atoombindingen, zoals in de molecule water (H2O), en ionbindingen, zoals in keukenzout (NaCl) kwamen aan bod.
De interactie tussen ionbindingen is verschillend ten opzichte van atoombindingen. Daarom is het ‘correct’ om voor dit soort moleculen te spreken over de formulemassa.
De formulemassa wordt berekend door de som van de gemiddelde relatieve massa’s van de ionen, die we uit die formule-eenheid (brutoformule) nemen, op te tellen.
De manier van berekenen is hetzelfde als bij de molecuulmassa. We blijven werken met de massa van het atoom, niet van het ion.
Wat is de reden dat we gewoon kunnen rekenen met de massa van het atoom en niet van het ion?
Voorbeeld
Bereken de formulemassa van het onkruidbestrijdingsmiddel natriumchloraat (NaClO3).
Gegeven: 1 molecule NaClO3
Gevraagd: Mr(NaClO3)
Oplossing: 1 De molecule bestaat uit 1 Na-atoom, 1 Cl-atoom en 3 O-atomen.
2 Ar(Na) = 22,99
Ar(Cl) = 35,453
Ar(O) = 15,999
3 Mr(NaClO3) = 1 · Ar(Na) + 1 · Ar(Cl) + 3 · A r(O) = (1 · 22,99) + (1 · 35,453) + (3 · 15,999) = 106,44
Om de massa uit te drukken in kg als eenheid, krijg je de volgende berekening:
Mr(NaClO3) = 106,44 · 1,66 · 10-27 kg = 1,77 · 10-25 kg
Bereken de formulemassa van salpeter (KNO3, kaliumnitraat) in kg.
Zowel de molecuul- als formulemassa zijn manieren om de massa van een chemische verbinding, bestaande uit verschillende atomen, te berekenen.
type massa
molecuulmassa
formulemassa
soort moleculen voorbeelden
Atomen gebonden door atomaire bindingen.
Atomen gebonden door ionbindingen.
Niet-metaaloxiden: CO2, SO2, N2O …
Zuren: HCl, HNO2, H3PO4
Koolstofverbindingen: CH3OH, C3H8 …
Metaaloxiden: MgO, Na2O, Fe2O3, Al2O3 …
Hydroxiden: Al(OH)2, NaOH …
Zouten: NaCl, Na2SO4
We weten hoe we de werkelijke massa van atomen kunnen berekenen, dit zijn zeer kleine getallen. Chemici werken in de praktijk met de relatieve atoommassa en molecuulmassa.
2.1 De mol en het getal van Avogadro
We hebben al geleerd hoe we de massa van een atoom of een molecule kunnen berekenen. Het is vandaag echter niet mogelijk om 1 atoom of molecule te isoleren en de massa te bepalen op een balans. In het ISAAC-moment werd al aangegeven hoeveel moleculen er in 1 glas water zitten, dit kunnen we namelijk wegen.
Verbind de begrippen met hun hoeveelheid.
een kwartet een week een dozijn een glas water een diamant van 12 gram





6,02 · 1023 atomen C 4 muzikanten 7 dagen 8,36 · 1024 moleculen H2O 12 eieren
2.1.1 Het getal van Avogadro (NA)
Binnen de chemie werd er een nieuwe eenheid gedefinieerd, namelijk de mol.
1 mol zijn het exact aantal deeltjes die 12 gram van het 12C isotoop bevat.
NA = 6,02 1023 deeltjes mol . Dit getal is de constante van Avogadro (NA).
2.1.2 Stofhoeveelheid (n)
Het getal van Avogadro is een constante waarde en kan dus niet wijzigen. Wat wel kan wijzigen is het aantal deeltjes, wat we weergeven met het symbool N en de stofhoeveelheid, wat we weergeven met symbool n.
Het aantal deeltjes (N) is gelijk aan het aantal mol of stofhoeveelheid (n) vermenigvuldigt met het getal van Avogadro (NA).
N = n NA aantal deeltjes = mol deeltjes mol
Amedeo Avogadro (1776-1865) was een Italiaanse wetenschapper die bekend is geworden voor zijn hypothese waarbij hij stelde dat hetzelfde volume gas, bij dezelfde temperatuur en dezelfde druk, hetzelfde aantal deeltjes bevatte
Dit inzicht heeft vervolgens geleid tot de bepaling van het getal van Avogadro. Avogadro heeft dit getal echter nooit zelf berekend, het werd pas later afgeleid door anderen, gebaseerd op experimenten met gassen en koolstof-isotopen.
In het Latijn betekend mol ‘een hoop’. Het heeft dus in dat opzicht dezelfde aanduiding als andere aanduidingen: een dozijn (12), een paar (2) …

Het getal van Avogadro kunnen we bijgevolg ook de constante van Avogadro noemen. De waarde verwijst steeds naar hetzelfde aantal deeltjes per mol. Zo zitten er in 1 mol water evenveel moleculen als in 1 mol zuurstofgas, 1 mol helium, 1 mol ammoniak of 1 mol hydroxide-ion.
Het is net zoals vragen: wat is zwaarder, 1 kilogram veren of 1 kilogram cement? De massa is evenveel, beide wegen 1 kilogram of 1000 gram. Bij de stofhoeveelheid mol is het precies hetzelfde. We kunnen alleen de deeltjes niet zien. Het blijft een beetje abstract.
Zoals het aantal moleculen in een glas water, is het aantal deeltjes in een mol heel moeilijk te vatten, het zijn 602 triljard deeltjes per mol.
Voorbeeld
a Hoeveel moleculen zitten er in 5 mol water?
Gegeven: H2O, n = 5,0 mol
Gevraagd: N
Oplossing: N = n · NA
N = 5,0 mol · 6,02 · 1023 deeltjes mol = 3,01· 1024 moleculen
b Uit hoeveel atomen bestaat 5 mol water?
Elk molecule water bevat 3 atomen (2 H-atomen een 1 O-atoom), dus moeten we het aantal deeltjes vermenigvuldigen met 3.
Oplossing: N = n · NA · 3
N = 5,0 mol · 6,02 · 1023 deeltjes mol · 3 = 9,03 · 1024 atomen
2.2 Link tussen aantal mol (n) en massa (m)
2.2.1 De molaire massa (M)
Het wordt pas echt interessant als we een nieuw begrip gaan definiëren, namelijk de molaire massa. Om dit te begrijpen, stellen we ons even een bakkerij voor.
In een bakkerij wil een bakker graag verschillende dozen maken, die elk 1,0 kg koekjes bevatten. Elk koekje heeft een massa van 10 g.
Hoeveel koekjes heb je nodig om precies 1,0 kg te krijgen?
aantal koekjes
bakkerij chemie

aantal atomen 1 doos 1 mol massa van de koekjes in de doos massa van de atomen of moleculen massa van de koekjes per doos
molaire massa: hoeveel gram atomen of moleculen per mol
De molaire massa (M) is gelijk aan de verhouding tussen de massa (m) en het aantal mol (n).
De molaire massa verteld hoeveel massa je hebt van een stof per mol.
De formule die we hiervoor gebruiken is:
M = m n
De molaire massa heeft als eenheid g mol .
De molaire massa is altijd een gegeven of kunnen we berekenen aan de hand van de relatieve atoommassa’s in het periodiek systeem (PSE). De waarde van de molaire massa (M) is gelijk aan die van molecuulmassa (Mr) maar de molaire massa wordt uitgedrukt in g/mol terwijl de molecuulmassa geen eenheid heeft.
De symbolen lijken hard op elkaar. Je kan de formule onthouden door te denken aan M&M snoepjes of de radiozender M · n = m, waarbij je start met een hoofdletter zoals in een zin. De formules kan je altijd omvormen:
M = m n ⟺ M · n = m ⟺ n = m M

Reken NOOIT met afgeronde waarden. Je past op het einde pas de regel van de beduidende cijfers toe, net zoals in de fysica. De beduidende cijfers zijn alle cijfers van het eerste van nul verschillend getal, met andere woorden: de nullen vooraan zijn niet beduidend, de nullen achteraan wel. Machten met grondtal 10 tellen niet mee voor het aantal beduidende cijfers, alsook getallen zonder eenheid.
Voorbeeld
Om dit nog beter te begrijpen, gaan we terug naar ons voorbeeld van het 12C-isotoop. Dit isotoop werd eerder gebruikt om het aantal deeltjes af te leiden.
a Hoeveel 12C-isotopen zitten er in 1 mol?
b Hoeveel is de massa in kg van dit aantal deeltjes?
Gegeven: n = 1,0 mol
m12C-isotoop = 12,0
Gevraag: N(12C)
m(12C)
Oplossing: a N(12C) = n · NA = 1,0 mol · 6,02 · 1023 deeltjes mol = 6,02 · 1023 deeltjes
b De massa van 12C is 12,0 maar nu hebben we 6,02 · 1023 deeltjes, dus hebben we in totaal: 12,0 · 6,02 · 1023 deeltjes = 7,224 · 1024 deeltjes
m(12C) = 7,224 · 1024 · 1,66 · 10-27 kg = 12,0 · 10-3 kg = 12,0 g
In woorden: de massa van 1 mol 12C-atomen is gelijk aan 12,0 u, maar ook gelijk aan 12,0 g.
Dit is interessant! We kunnen concluderen dat de constante van Avogadro en de atomaire eenheid niet zomaar gekozen zijn. Ze zijn zo gekozen dat de massa van 1 mol atomen of moleculen gelijk is aan de relatieve massa van dit atoom of molecule.
Met behulp van het PSE kunnen we dus altijd de molaire massa bepalen. Bijvoorbeeld voor Fe2O3:
M(Fe2O3) = 2 · M(Fe) + 3 · M(O) = 2 ·
In vraagstukken wordt de molaire massa niet altijd gegeven, je moet de waarde uit het PSE afleiden.
Wat betekent dit nu voor de atoom-, molecule en formulemassa? Vul de tabel aan.
We kunnen de formule M = m n gebruiken voor drie type oefeningen:
1 we kennen de massa en molaire massa, maar niet de stofhoeveelheid (aantal mol), 2 we kennen stofhoeveelheid (aantal mol) en molaire massa, maar niet de massa, 3 de massa en stofhoeveelheid zijn gekend, maar de molaire massa nog niet (dit komt niet vaak voor).
We werken de voorbeelden naast elkaar uit. Het voorbeeld gaat telkens om water (H2O).
M(H2O) = (2 · 1,008 g mol ) + (1 · 15,999 g mol ) = 18,015 g mol 1 2 3
Gegeven: m = 36,0 g n = 2,00 mol m = 36,0 g M = 18,015 g mol M = 18,015 g mol n = 2,00 mol
Gevraagd: n m M
Oplossing: n = m M m = n · M M = m n = 36,0 g 18,015 g mol = 2,00 mol · 18,015 g mol = 36,0 g 2,00 mol = 2,00 mol = 36,0 g = 18,0 g mol
Optie 3 komt erg weinig voor. Meestal kennen we de molecule en kunnen we met behulp van het periodiek systeem de molaire massa bepalen.
stofhoeveelheid (n) de constante van Avogadro 6,02 . 1023 deeltjes per mol
N = n NA
massa (m)
Molaire massa Bereken aan de hand van het PSE.

m = n M
aantal deeltjes (N)
n = N NA
In Isaac-fysica 4 leer je over de fysische wetten bij gassen. De stofhoeveelheid van een gas bepalen is nodig binnen de formule van de ideale gaswet. Een mooie crossover tussen de wetenschappen chemie en fysica.
Stoichiometrie, Stoechiometrie of Stechiometrie zijn begrippen die afkomstig zijn uit het Oudgrieks en betekenen (letterlijk vertaald):
Stoicheion= element, Metron = maat of verhouding.
In de keuken gebruik je dit principe. Stel je wil een cake maken en het recept geeft de volgende informatie:
Ingrediënten voor 2 cakes
1 cakemix
4 eieren
2 appels

Het recept anders geschreven:
1 cakemix + 4 eieren + 2 appels → 2 cakes
Duid de coëfficiënten aan.

Als je 4 cakes wilt maken, hoeveel ingrediënten heb je nodig?
Hoeveel cakes kan je maximaal maken als je 12 eieren hebt?
Wat is de hoeveelheid van de andere ingrediënten in dat geval?
Wat als je nu 2 cakemixen, 10 eieren en 6 appels hebt. Hoeveel cakes kun je maken?
De synthesereactie van water is de reactie waarbij waterstofgas (H2) en zuurstofgas (O2) reageren tot water (H2O).
Door gebruik te maken van de wet van behoud van atomen krijgen we volgende reactievergelijking:
2 H2 + O2 → 2 H2O
2 moleculen H2 + 1 molecule O2 → 2 moleculen H2O of (2 · NA) · H2 + (1 · NA) · O2 → (2 · NA) · H2O
En uit het vorige deel leerde je al dat N = n · NA, dus met andere woorden als N = 6,02 · 1023 deeltjes dan:
=
· NA ⟺
= n N
n = 6,02 · 1023 deeltjes 6,02 · 1023 deeltjes mol = 1 mol dan krijgen we: 2 mol H2 + 1 mol O2 → 2 mol H2O
We noemen dit ook de molverhoudingen of stoichiometrie
Samengevat
reactievergelijking 2 · H2 1 · O2 2 · H2O moleculen 2 moleculen 1 molecule 2 moleculen
deeltjes (N)
2 · 6,02 · 1023 moleculen
1 · 6,02 · 1023 moleculen
2 · 6,02 · 1023 moleculen
mol (n) 2 mol 1 mol 2 mol
De coëfficiënten van een reactievergelijking geven de molverhouding weer van de reactie. Dit noemen we ook de stoichiometrische verhouding.
Het is zeer interessant dat we dit kunnen herleiden naar molverhoudingen, want zo kan je exact berekenen hoeveel je nodig hebt en hoef je geen kostbare materialen te verspillen. Zo kan je dus bijvoorbeeld perfect berekenen hoeveel gram waterstofgas en zuurstofgas je nodig hebt om 2,00 mol water te vormen. Dit principe wordt constant gebruikt in de chemische industrie bij synthesevaten.
De coëfficiënten geven niet aan hoeveel je 'echt' hebt, maar geven een verhouding weer binnen een reactie.
De molverhouding binnen een reactievergelijking kan gecontroleerd worden met volgende website. Een handige tool om je antwoord in een vraagstuk te controleren.
1 Typ de reactievergelijking in.
2 Vul bij 1 molecule het aantal mol in, bij de andere moleculen wordt de molverhouding aangevuld.
Bestaat er ook een massaverhouding?
We nemen opnieuw de synthese van water.
mol H2 + 1 mol O2 → 2 mol H2O
Gegeven: n
Gevraagd: m m m
Oplossing:
Een massaverhouding bestaat niet. De molaire massa’s van de verschillende stoffen zijn verschillend.
De wet van behoud van massa is wel voldaan. De som van de massa’s van de reagentia is gelijk aan de som van de massa’s van de reactieproducten. Bij de wet van behoud van massa gaan we uit van een reactie die plaatsvindt in een gesloten systeem. In elke andere situatie geldt de wet niet.
In de farmaceutische industrie is stoichiometrie enorm belangrijk. Bijvoorbeeld bij het maken van aspirine (tegen hoofdpijn) reageren salicylzuur en azijnzuuranhydride tot aspirine (acetylsalicylzuur) en azijnzuur (bijproduct).
salicylzuur + azijnzuuranhydride → aspirine + azijnzuur
Echter, als je bijvoorbeeld kijkt naar de veiligheidswaarschuwingen voor azijnzuuranhydride, merk je op dat je dit niet wil hebben in je pilletje. Het is daarom van groot belang de stoichiometrische verhouding te kennen zodat er exact genoeg producten worden toegevoegd, om de aspirine te maken.

Stappenplan oplossen van stoichiometrische vraagstukken
1 Stel de reactievergelijking op en balanceer zodat de wet van behoud van atomen voldaan is.
2 Bereken de molaire massa (M) van de componenten in de reactievergelijking die je nodig hebt.
3 Bereken de stofhoeveelheid (n) van de gekende producten.
4 Bepaal de stofhoeveelheden van de andere producten in de reactievergelijking.
Tip: vaak gebruiken we hiervoor de regel van 3.
5 Bereken de massa van de gevraagde stoffen.
Voorbeeld
Je hebt 0,20 mol zuurstofgas (O2).
a Hoeveel mol water kan je maximaal maken?
b Hoeveel mol waterstofgas heb je hiervoor nodig?
c Hoeveel gram water heb je dan gevormd?
Gegeven: n(O2) = 0,20 mol
Gevraagd: n(H2O)
n(H2)
m(H2O)
Oplossing: 1 2 H2 + O2 → 2 H2O
2 M(H2O) = 2 · 1,008 g mol + 1 · 15,999 g mol = 18,015 g mol
3 & 4 Met 1 mol zuurstofgas (O2) heb je 2 mol waterstofgas (H2) nodig om 2 mol H2O te maken → een dubbel aantal mol. Dus met 0,20 mol zuurstofgas:
0,40 mol H2 + 0,20 mol O2 → 0,40 mol H2O
Je kan maximaal 0,40 mol water (H2O) maken en je hebt daarvoor 0,40 mol waterstofgas (H2) nodig.
5 m(H2O) = n · M = 0,40 mol · 18,015 g mol = 7,2 g
Je hebt 7,2 gram water gevormd.
Met één gegeven kan je dus enorm veel berekenen.
Zoals bij ons voorbeeld met de cake op pagina 17 zijn we soms beperkt in het maken van een stof aan de hand van de hoeveelheid stoffen die we voor handen hebben.
Bij een reactie zoals:
2 H2 + O2 → 2 H2O
Om 2 mol water te maken, heb je 2 mol H2 en 1 mol O2 nodig.
Als je maar 1 mol H2 hebt en 5 mol O2, dan kan je reactie maar één ding maken: zoveel water als je H2 toelaat. Dan is H2 het limiterend reagens
De stof die eerst opraakt tijdens een chemische reactie noemen we een limiterend reagens of beperkend reagens. Het bepaalt hoeveel product er maximaal gevormd kan worden.
Stappenplan oplossen van stoichiometrische vraagstukken met limiterend reagens
1 Stel de reactievergelijking op en balanceer zodat de wet van behoud van atomen voldaan is.
2 Bereken de molaire massa (M) van de componenten in de reactievergelijking die je nodig hebt.
3 Bereken de stofhoeveelheid (n) van de gekende producten.
4 Vergelijk met de molverhouding en bepaal het limiterend reagens.
5 Bereken de stofhoeveelheid (n) van de gevraagde producten.
6 Bereken de massa (m) van de gevraagde producten.
Voorbeeld
Wanneer ijzer reageert het met zuurstof uit de lucht wordt roest of ijzer(III)oxide (Fe2O3) gevormd. Je hebt 56,0 gram ijzer (Fe) en 32,0 gram zuurstofgas (O2).
Wat is het limiterend reagens en hoeveel gram roest (Fe2O3) kan er maximaal gevormd worden?
Gegeven: m(Fe) = 56,0 g
m(O2) = 32,0 g
Gevraagd: limiterend reagens, m(Fe2O3)
Oplossing:
1 4 Fe + 3 O2 → 2 Fe2O3
2 M(Fe) = 55,845 g mol
M(O2) = 2 · 15,999 g mol = 31,998 g mol
M(Fe2O3) = 2 · 55,845 g mol + 3 · 15,999 g mol = 159,687 g mol
3 n(Fe) = m M = 56,0 g 55,845 g mol = 1,00 mol
n(O2) = m M = 32,0 g 31,998 g mol = 1,00 mol

4 Reactieverhouding: op 3 mol · 4 3 = 4 mol → 1 mol O2 vereist 4 3 = 1,33 mol Fe
Je hebt maar 1,00 mol Fe, dus Fe is het limiterend reagens
5 4 mol Fe → 2 mol Fe2O3
Je hebt maar 1,00 mol Fe:
1,00 mol Fe → 0,500 mol Fe2O3
6 m(Fe2O3) = n · M = 0,500 mol · 159,687 g mol = 79,8 g
Er wordt 79,8 gram roest gevormd uit 56,0 g ijzer en 32,0 gram zuurstofgas.
Binnen dit hoofdstuk hebben we geleerd dat stoichiometrie in de chemie de kwantitatieve relaties tussen reagentia en reactieproducten in chemische reacties bestudeerd. Het stelt ons in staat om hoeveelheden van stoffen te berekenen op basis van een reactievergelijking. Door gebruik te maken van molverhoudingen kunnen we voorspellen hoeveel van een stof nodig is of gevormd wordt. Stoichiometrie vormt daarmee een onmisbare schakel in zowel theoretische als praktische chemie, van laboratoriumexperimenten tot industriële toepassingen.
4.1 Oplossing, opgeloste stof en oplosmiddel
Een oplossing is een mengsel waarin een stof, de opgeloste stof, volledig wordt verdeeld in een andere stof, het oplosmiddel
Opgeloste stof
Oplosmiddel
Oplossing
Een voorbeeld van een oplossing heb je als je pasta kookt in gezouten water. Je voegt keukenzout toe in water. Keukenzout is de opgeloste stof, het water is het oplosmiddel.
Vul de tabel met voorbeelden uit het dagelijks leven aan.
voorbeeld opgeloste stof oplosmiddel
suikerwater
ontsmettingsalcohol
bruisend water wijn oploskoffie
De concentratie (c) zegt iets over de verhouding tussen de hoeveelheid van een opgeloste stof ten opzichte van de hoeveelheid van het oplosmiddel
c = hoeveelheid opgeloste stof volume van de oplossing
1000 g opgeloste stof
hoge concentratie oplossing oplosmiddel opgeloste stof oplosmiddel opgeloste stof
100 g opgeloste stof
lage concentratie oplossing
Omcirkel.
Hoe meer opgeloste stof in het oplosmiddel zit, hoe hoger / lager de concentratie in de oplossing.
Hoe minder opgeloste stof in het oplosmiddel zin, hoe hoger / lager de concentratie in de oplossing. In verschillende toepassingen is het enorm belangrijk de juiste concentratie te weten, omdat een klein verschil een zeer groot effect kan hebben, bijvoorbeeld in de geneeskunde. Medicijnen zijn vaak zeer effectief als ze in een bepaalde concentratie in het lichaam zijn. Maar mocht je te veel van dit medicijn innemen, dat kan het orgaanschade of fatale bijwerkingen hebben. Dit is waarom je van sommige medicijnen bijvoorbeeld maar 1 pilletje per 4 uur mag nemen … om de juiste concentratie in het lichaam te behouden.

Er bestaan verschillende soorten concentraties. Hierbij wordt er gewisseld in de eenheid van de opgeloste stof en de eenheid van het oplosmiddel.
4.2 Massaconcentratie (γ)
We nemen 1 liter water voor onze pasta te koken en voegen 5 gram keukenzout (NaCl) toe. Dan kunnen we zeggen dat we 5 gram NaCl per liter hebben. Dit is een uitdrukking van concentratie.
Als de massa (m) van de opgeloste stof en het volume (V) van het oplosmiddel gekend is, praten we over de massaconcentratie (γ). We kunnen de massaconcentratie berekenen met volgende formule.
γ= m V ⟺ m = γ V ⟺ V = m γ
In woorden: de massaconcentratie (γ) met eenheid g l is gelijk aan de massa (m) met eenheid gram (g) gedeeld door het volume (V) in liter (l).
Ook in het dagelijkse leven wordt de massaconcentratie vaak gebruikt. Geef enkele voorbeelden?
In de fysica gebruiken we massadichtheid (ρ) waarin we massa (m) delen door het volume (V) in m³. In de chemie werken we met massaconcentratie waarbij het volume wordt uitgedrukt in liter (l).
Voorbeeld
De hoeveelheid vet in melk is af te lezen op het etiket. Deze brik melk bevat 1,50 g vet per 100 ml melk.
Wat is de massaconcentratie aan vet in de melk?
Gegeven: m = 1,5 g V = 100 ml = 0,100 l
Gevraagd: γ
Oplossing: γ = m V
γ = 1,50 g 0,100 l
γ = 15,0 g l
Een olympisch zwembad is 50 m lang, 25 meter breed en 2 meter diep. In publieke zwembaden is het aangeraden om 0,002 g l chloortabletten te hebben om bacteriën te doden.
a Bereken het volume van het zwembad in liter. b Hoeveel tabletten chloor moet de zwembadmeester toevoegen in het zwembad als je weet dat 1 chloortablet een massa heeft van 250 g?


Reken eenheden altijd om naar de SI-eenheid.
Als we bijvoorbeeld 5 mol zout (NaCl) oplossen in 1 l water, dan kunnen we zeggen dat we 5 mol NaCl per liter water hebben. Ook dit is een uitdrukking van concentratie. Deze uitdrukking is voor chemici interessanter omdat hier over stofhoeveelheid gepraat wordt.
Als de stofhoeveelheid (n) van de opgeloste stof en het volume (V) van de oplossing gekend zijn, praten we over molaire concentratie of molariteit.
c = n V ⟺ n = c ⋅ V ⟺ V = n c
In woorden: de concentratie (c) met eenheid mol l is gelijk aan de stofhoeveelheid (n) met eenheid mol gedeeld door het volume (V) in l van de oplossing.
De molaire concentratie noemen we soms ook de molariteit van een oplossing met eenheid
M. Hiervoor geldt dat:
1 mol l = 1 M
molaire concentratie c mol/l of M (molair)
M is zowel de eenheid van molaire concentratie als het symbool voor de molaire massa. Het begrip molair is een verouderde term. In de hedendaagse chemie gebruiken we de eenheid mol per liter ( mol l ).
Voorbeeld 1
De baxter van 1,00 l in een ziekenhuis heeft een massaconcentratie aan glucose (C6H12O6) van 50,0 g l
Wat is de molaire concentratie?
Gegeven: γ = 50,0 g l m(C6H12O6) = 50,0 g V = 1,00 l
Gevraagd: c
Oplossing: 1 M(C6H12O6) = 6 · M(C) + 12 · M(H) + 6 · M(O) M(C6H12O6) = 6 · 12,011 g mol + 12 · 1,008 g mol + 6 · 15,999 g mol = 180,156 g mol
2 n = m M = 50,0 g 180,156 g mol = 0,2775372455 mol
3 c = n V = 0,2775372455 mol 1,00 l = 0,278 mol l
Voorbeeld 2
De saliniteit van zeewater is gemiddeld 35 g l . Dit betekent dat in 1,0 l zeewater 35 g zeezout (NaCl) zit. Bereken de molaire concentratie.
Gegeven: γ = 35 g l m (NaCl) = 35 g V = 1,0 l
Gevraagd: c
Oplossing: 1 M(NaCl) = 1 · 22,99 g mol + 1 · 35,453 g mol = 58,443 g mol
2 n = m M = 35 g 58,433 g mol = 0,5988741167 mol
3 c = n V = 0,5988741167 mol 1,0 l = 0,60 mol l
In de praktijk bestaan er heel veel soorten concentraties. Enkele voorbeelden zijn massaconcentratie, volumeconcentratie, ppm, ppb, promille …
Bij een alcoholcontrole gaat de politie na hoeveel promille alcohol er in het bloed zit. 1 promille is 1 op 1000.
1 promille alcohol in je bloed betekent dat je 1 gram alcohol hebt per 1000 gram bloed.
Stel, iemand weegt 70 kg = 70 000 gram. Als je 0,5 promille alcohol in je bloed hebt, betekent dit dat er 0,5 gram alcohol is per 1000 gram bloed.
Dus: 70 · 0,5 gram = 35 gram alcohol in het bloed. Dit voorbeeld is een algemene benadering. In werkelijkheid spelen ook andere factoren een rol, zoals geslacht, hoeveel je gegeten hebt en hoe snel je alcohol opneemt en afbreekt.

Luchtvervuiling wordt uitgedrukt in ppm: parts per million. De huidige concentratie van CO₂ in de lucht is ongeveer 420 ppm, wat betekent dat er 420 CO₂-moleculen zijn per miljoen luchtmoleculen.
massaconcentratie (γ)
molaire concentratie (c)
c = n V
γ = m V
massa (m)
m = γ V
n = c V
stofhoeveelheid (n)
m = n M
Molaire massa
Bereken aan de hand van het PSE.
4.4 Aanpassen van de concentratie van een oplossing
N = n NA
n = N NA
de constante van Avogadro
6,02 1023 deeltjes per mol
aantal deeltjes (N)
Een concentratie kan je ook aanpassen. Je kan zowel wijzigingen brengen aan het oplosmiddel als de opgeloste stof.
4.4.1 Wijzigen van oplosmiddel
Wat verwacht je dat er gebeurt als je: 1 evenveel oplosmiddel toevoegt dan dat er al aanwezig is, 2 je niets doet, 3 de helft van het oplosmiddel gaat verdampen?
Teken het volume en de moleculen voor elke situatie in de maatbeker. 1 2 3
Wat stel je vast als je de concentraties van links naar rechts in de maatbekers vergelijkt?
De concentratie in een oplossing kan aangepast worden door het wijzigen van het oplosmiddel
• Bij het verdunnen wordt er oplosmiddel toegevoegd. De concentratie daalt
• Bij het verdampen verdampt er oplosmiddel. De concentratie stijgt.
Voorbeeld
We hebben 100 ml van een NaOH-oplossing met een concentratie van 5,0 mol l . We voegen hier 200 ml oplosmiddel aan toe.
Wat gebeurt er met de concentratie?
Gegeven: c1 = 5,00 mol l
V1 = 100 ml = 0,100 l (oplossing 1)
V2 = 100 ml + 200 ml = 300 ml = 0,300 l (oplossing 2)
Gevraagd: c2
Oplossing: 1 Hoeveel mol NaOH zit er in de beginoplossing (oplossing 1)?
c1 = n1 V1 ⟺ n1 = c1 · V1
n1 = 5,00 mol l · 0,100 l = 0,500 mol
2 We weten dat het aantal mol in situatie 1 en 2 gelijk is, want we voegen enkel oplosmiddel toe (= verdunnen), dus n1 = n2 = 0,500 mol
3 Met deze nieuwe gegevens kunnen we c2 bereken:
c2 = n2 V2 = 0,500 mol 0,300 l = 1,67 mol l
Aangezien n1 = n2 kunnen we eigenlijk bovenstaande berekening vereenvoudigen, want er geldt ook:
n1 = c1 · V1 en n2 = c2 · V2
Dus kunnen we dit herschrijven tot:
c1 · V1 = c2 · V2
We noemen dit de verdunningsformule.
De verdunningsformule kunnen we enkel toepassen als n1 = n2
De formule wordt dan: c1 V1 = c2 V2 met c1 de beginconcentratie in de beginsituatie, V1het beginvolume in de beginsituatie, c2 de eindconcentratie na verdunning en V2 het eindvolume na verdunning.
Bij het maken van parfum worden geuren, aromatische elementen, uit allerlei zaken getrokken, bijvoorbeeld uit planten. Deze geur bevindt zich in een oplossing van water of alcohol. Er bestaan verschillende soorten parfums, bijvoorbeeld Eau de Parfum en Eau de Toilette. Het verschil tussen beiden heeft te maken met de hoeveelheid oplosmiddel dat er verdampt is uit de parfums. Een Eau De Parfum bevat een hogere concentratie aan geurende moleculen dan een Eau de Toilette, hierdoor ruikt de Eau De Parfum vaak gedurende een langere tijd, maar is de prijs ook duurder!
Zoutvelden zijn grote vlaktes waar zeewater of zoutoplossingen in ondiepe bassins worden geleid om zout te winnen. Het zuiveringsproces gebeurt hier op een natuurlijke manier door verdamping. Onder invloed van zon en wind verdampt het water geleidelijk, waardoor het opgeloste zout achterblijft. Naarmate het water verder verdampt, neemt de concentratie zout toe en begint het zout uit te kristalliseren. Dit proces laat onzuiverheden die niet mee kristalliseren deels achter in de vloeistof. Het zout dat overblijft wordt vervolgens verzameld en kan verder gezuiverd worden indien nodig. Verdamping speelt dus een cruciale rol bij het scheiden van zout en water in dit natuurlijke zuiveringsproces.

4.4.2 Wijzigen van opgeloste stof
Wat verwacht je dat er gebeurt als het oplosmiddel ongewijzigd blijft en:
1 je evenveel opgeloste stof toevoegt, 2 je niets doet,
3 de helft van de opgeloste stof weg reageert?
Teken het volume en de moleculen voor elke situatie in de maatbeker.
1 2 3
Wat stel je vast als je de concentraties van links naar rechts in de maatbekers vergelijkt?
De concentratie in een oplossing kan aangepast worden door het wijzigen van opgeloste stof Het volume van het oplosmiddel blijft constant.
• Bij het opconcentreren wordt er extra opgeloste stof toegevoegd. De concentratie stijgt
• Bij het zuiveren halen we opgeloste stof uit de oplossing. De concentratie daalt.
Bij vergiftiging wordt actieve kool gegeten. Het gif wordt geadsorbeerd uit het maag-darmstelsel waardoor de concentratie in het lichaam daalt. Actieve kool wordt niet alleen gebruikt bij een vergiftiging maar ook bij waterzuivering of in gasmaskers.
Voorbeeld
Je hebt 500 ml van een 3,0 mol l NaOH oplossing. Je voegt 15,0 g NaOH toe aan deze oplossing.
Wat is de nieuwe concentratie?
Gegeven: c1 = 3,0 mol l
V1= 500 ml = 0,500 l
V2 = 0,500 ml
m(NaOH) = 15,0 g
Gevraagd: c2
Oplossing: We berekenen c2 als volgt: c2 = n2 V2
n2 bestaat uit 2 delen, enerzijds de stofhoeveelheid die we toevoegen (15,0 g) (ntoevoegen) anderzijds de stofhoeveelheid die in c1 zit:
n1 = c1 · V1 = 3,00 mol l · 0,500 l = 1,50 mol
M(NaOH) = 1 · 22,99 g mol + 1 · 15,999 g mol + 1 · 1,008 g mol = 39,997 g mol
n toevoegen = m M = 15,0 g 39,997 g g mol = 0,37 50281271 mol
Concentratie n2 wordt dan:
n1 = n2 + n toevoegen = 1,50 mol + 0,3750281271 mol = 1,88 mol
De nieuwe concentratie c2 wordt dan:
c2 = n2 V2 = 1,88 mol 0,500 l = 3,76 mol l
4.4.3 Wijzigen van oplosmiddel en opgeloste stof
We mengen twee oplossingen met dezelfde opgeloste stof, maar met een verschillende concentratie met elkaar.
Stel, je maakt een vanille cake en je voegt een beetje vanille extract toe om de cake lekker naar vanille te doen smaken. Je proeft van het beslag en hebt het gevoel dat je cake te weinig naar vanille smaakt, een oplossing met lage concentratie aan vanille. Je beslist dus om er nog vanille extract aan toe te voegen, oplossing met hoge concentratie aan vanille. De nieuwe concentratie van het cakebeslag zal nu stijgen in de oplossing en zal ergens liggen tussen de initiële lage concentratie en de hoge extract concentratie.
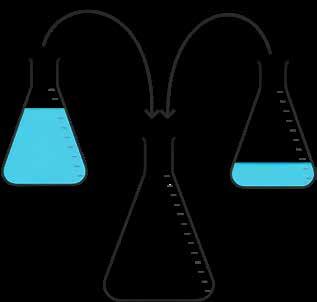
Voorbeeld
In het labo staan twee restjes HCl-oplossing. In erlenmeyer 1 zit
nog 250 ml HCl-oplossing met een concentratie van 2,00 mol l .
In erlenmeyer 2 zit nog 800 ml van een 1,20 mol l oplossing.
Je hebt echter 1 fles nodig. Breng de volumes samen tot één volume. Wat is de molaire concentratie van de nieuwe oplossing?
Gegeven:
c1 = 2,00 mol l c2 = 1,20 mol l
V1 = 250 ml V2 = 800 ml
Gevraagd: c3
Oplossing: We kunnen dit uitrekenen door zowel in c1 als in c2 het aantal mol te berekenen:
n1 = c1 · V1 = 2,00 mol l · 0,250 l = 0,500 mol
n2 = c2 · V2 = 1,20 mol l · 0,800 l = 0,960 mol
In de nieuwe situatie kunnen we de stofhoeveelheden samentellen, dus:
n3 = n1 + n2 = 0,500 mol + 0,960 mol = 1,460 mol
Het volume in de nieuwe fles is:
V3 = V1 + V2 = 250 ml + 800 ml = 1050 ml = 1,050 l
We kunnen nu c3 berekenen als volgt:
c3 = n3 V3 = 1,46 mol 1,050 l = 1,39 mol l
De concentratie van c3 is lager dan de concentratie van c1 en hoger dan concentratie c3
De concentratie berekenen van een oplossing van een mengsel van twee oplossingen met een verschillende concentratie aan opgeloste stof kan als volgt: c3 · V3 = c1 · V1 + c2 · V2 of c3 · (V1 + V2) = c1 · V1 + c2 · V2 HCl 1,20 mol/l HCl 2,00 mol/l
In vraagstukken worden de verschillende concepten die we eerder hebben geleerd met elkaar gecombineerd, waardoor de opgave wat complexer wordt. Maar eigenlijk kun je elke oefening opsplitsen in een van de eenvoudige oefeningen uit vorige hoofdstukken.
Stappenplan
1 Stel de reactievergelijking op en balanceer zodat de wet van behoud van atomen voldaan is.
2 Bereken de molaire massa (M) van de componenten in de reactievergelijking die je nodig hebt.
3 Bereken de stofhoeveelheid (n) van de gekende producten.
4 Bepaal de stofhoeveelheden van de andere producten in de reactievergelijking aan de hand van de stoichiometrische molverhouding. Tip: vaak gebruiken we hiervoor de regel van 3.
5 Bereken de massa van de gevraagde stoffen.
Voorbeeld
In het laboratorium voegt Isaac 250 ml van een 0,500 mol l CuSO4-oplossing toe in een overmaat 500 ml natriumhydroxide-oplossing. Er vormt een blauwe neerslag Cu(OH)2 en Na2SO4 blijft in oplossing.
Hoeveel massa neerslag ontstaat er?
Gegeven:
c(CuSO4) = 0,500 mol l
V(CuSO4) = 250 ml = 0,250 l
Gevraagd: m(CuSO4)
Oplossing:
1 CuSO4 + 2 NaOH → Cu(OH)2 + Na2SO4
2 M(CuSO4) = 1 · 63,546 g mol + 1 · 32,065 g mol + 4 · 15,999 g mol = 159,607 g mol
M(NaOH) = 1 · 22,99 g mol + 1 · 15,999 g mol + 1 · 1,008 g mol = 39,997 g mol
M(Cu(OH)2) = 1 · 63,546 g mol + 2 · 15,999 g mol + 2 · 1,008 g mol = 97,560 g mol
M(Na2SO4) = 2 · 22,99 g mol + 1 · 32,065 g mol + 4 · 15,999 g mol = 142,041 g mol
3 Er wordt 250 ml van een 0,500 mol l kopersulfaatoplossing toegevoegd:
c = n V ⟺ n = c · V
n = 0,500 mol l · 0,250 l = 0,125 mol
Er wordt 0,125 mol CuSO4 toegevoegd.
4 De stoichiometrische molverhouding geeft aan dat er per mol CuSO4 ook een mol Cu(OH)2 wordt gevormd. Aangezien we hier 0,125 mol CuSO4 hebben, zal er dus ook 0,125 mol Cu(OH)2 gevormd worden.
n(mol) 0,125 Voldoende 0,125
5 m = n · M = 0,125 mol · 97,560 g mol = 12,2 g
Er zal dus 12,2 g Cu(OH)2 neerslag gevormd worden in deze reactie.
1 Massa
1 Juist of fout? Verbeter waar nodig.
a De massa van een proton, neutron en elektron is even groot.
b Bij de berekening van de atoommassa houden we rekening met het aantal protonen, elektronen en neutronen.
c In het PSE lezen we de absolute atoommassa af.
2 Verbind het begrip met het overeenkomstige symbool.
relatieve atoommassa m a atoommassa A gemiddelde relatieve atoommassa A r absolute atoommassa <A r >
3 Bereken de absolute atoommassa van het 18O-isotoop.
4 Broom (Br) bestaat uit twee stabiele isotopen, namelijk 79Br en 81Br. Ze komen respectievelijk 50,7 en 49,3% voor in het dagelijks leven. Bereken de relatieve atoommassa.
5 Bereken de molecuulmassa van zwavelzuur (H2SO4).
6 Bereken de formulemassa van ammoniumnitraat (NH4NO3).
7 a Geef voor de volgende stoffen aan of je de molecuulmassa of de formulemassa moet berekenen. Omcirkel.
H3PO4 molecuul / formulemassa
Na2HPO4 molecuul / formulemassa
HClO3 molecuul / formulemassa
CH3COOH molecuul / formulemassa
CaCl2 molecuul / formulemassa
Cu(OH)2 molecuul / formulemassa
b Bereken de molecuul- of formulemassa.
Chemisch rekenen
8 a Hoeveel moleculen zwavelzuur (H2SO4) zitten in 2,5 mol zwavelzuur?
b Hoeveel atomen zuurstof zitten in 2,5 mol zwavelzuur?
9 Hoeveel mol water zit er in 1 glas water van 250 gram?
10 Hoeveel gram goud zit er in 1,50 mol goud?
11 Hoeveel mol moleculen zitten er in 320 g zwavelzuur (H2SO4)?
12 Wat is de massa van 3,00 mol keukenzout (NaCl)?
13 Je hebt 1,23 mol kaliumnitraat, wat is de massa?
14 Hoeveel atomen zitten er in 250 g KClO4?
15 Hoeveel atomen zitten er in 761,4 g dijood?
16 Calciumnitraat is een kunstmeststof die vaak gebruikt wordt, maar hoeveel atomen zitten er in 500 g calciumnitraat?

17 Hoeveel is de massa van 1,50 · 1024 moleculen waterstofchloride (HCl)? Tip: Begin van achter naar voor.

18 Hamza en Emma gaan taarten bakken, maar ze gebruiken allebei een andere zoetstof.
Hamza gebruikt 2,0 mol glucose (C6H12O6).
Emma gebruikt 1,0 mol sucralose (C6H19Cl3O8).
a Wie gebruikt in massa de meeste zoetstof?

b Wie voegt het grootste aantal moleculen toe, en hoeveel moleculen zijn het?
c Wie voegt het meeste atomen toe, en hoeveel atomen zijn het?
19 Odette werkt in het labo en heeft een stukje metaal gevonden, maar ze weet niet uit welk element dit metaal bestaat. Ze weet wel dat het exact 1,50 mol is. Ze heeft het blokje ook op de balans geplaatst en die geeft exact 88,04 g aan. Om welk metaal gaat het hier?

Stoichiometrische vraagstukken
20 Je hebt 2,00 mol zuurstofgas.
a Hoeveel mol waterstofgas (H2) heb je nodig?
b Hoeveel mol water wordt er gevormd?
c Hoeveel gram water wordt er gevormd?
21 Bij een volledige verbranding van methaangas (CH4), ontstaat koolstofdioxide (CO2) en water (H2O). Als je 64,2 g methaan wilt verbranden, hoeveel gram zuurstof heb je nodig? Hoeveel gram koolstofdioxide en water wordt er gevormd?
a Stel de reactievergelijking op en balanceer zodat de wet van behoud van atomen is voldaan.
b Bereken de molaire massa van elk component.
c Bereken hoeveel mol methaangas (CH4) er in 64,2 g zit.
d Pas de stoichiometrische verhouding toe om te bepalen hoeveel mol zuurstofgas er nodig is. Bepaal ook hoeveel mol koolstofdioxide en water er gevormd wordt.
e Bereken de massa’s van de reagentia en reactieproducten.
22 De synthese van Ammoniak (NH3) vindt plaats door waterstofgas en stikstofgas (N2) op hoge temperatuur te laten reageren.
Hoeveel gram waterstofgas (H2) en stikstofgas (N2) heb je nodig als je 125 g NH3 wilt vormen?
23 Je wilt een mini-raket bouwen waarbij waterstof en zuurstof reageren om water en energie te vormen. Je hebt 10,0 gram waterstofgas (H2) en 80,0 gram zuurstofgas (O2).
a Wat is het limiterend reagens?
b Hoeveel gram water (H2O) kan er maximaal gevormd worden?
4 Concentraties van oplossingen
24 In welke twee eenheden kan concentratie voorkomen? Leg het verschil tussen beiden uit.
25 Wat is het verschil tussen M als grootheid en M als eenheid?
26 Een laborant lost 450 g zilvernitraat (AgNO3) op in water. Het eindvolume van de oplossing is 2,50 l.
Wat is de molaire concentratie van deze oplossing?
27 Lees het voedingsticket en bereken de molaire concentratie van calcium die opgelost is in deze halfvolle yoghurt.

28 Een brik chocolademelk toont op het etiket dat het 120 g suiker per liter bevat. Als je maar 40 gram suiker wilt drinken, hoeveel chocomelk mag je dan drinken?
29 De kok heeft een bouillonblokje opgelost in 100 ml water. Hij meet de zoutconcentratie (NaCl) en bekomt 1,5 mol l NaCl. De kok weet dat de perfecte soepsmaak enkel bekomen wordt als hij
0,3 mol l NaCl heeft, en wil dus oplosmiddel toevoegen. Hij vraagt hulp aan een echte chemicus!
Hoeveel ml water moet de kok toevoegen om 0,3 mol l oplossing te krijgen?
Opgelet, we vragen hier niet het eindvolume, maar hoeveel water er moet worden toegevoegd!
30 De lucht bevat 1,30 g zuurstof per liter lucht bij standaardomstandigheden. Hoeveel gram lucht zit er in een klaslokaal met volume van 171 m³?
31 Augurken worden bewaard in een mengsel van water en azijnzuur (CH3COOH). Het azijnzuur lost op in het water, en heeft een molaire concentratie van 0,800 mol l

Als er in een pot 350 ml oplossing zit, hoeveel gram azijnzuur zit er dan in de pot?
32 Kaliumperchloraat (KClO4) wordt in water opgelost met een concentratie van 1,23 mol l . Je hebt
hiervan 0,330 l in een maatbeker. Je hebt voor je experiment echter een concentratie van 1,00 mol l nodig. In de kast heb je een tweede fles KClO4 staan met een concentratie van 0,75 mol l .
Hoeveel van de tweede fles moet ik bij de eerste fles gieten om een concentratie van 1,00 mol l te bekomen?
33 In een baxter van 500 ml zit 5% dextrose of glucose (C6H12O6) en 0,9% natriumchloride (NaCl).
a Bereken de massaconcentratie glucose en natriumchloride.
b Bereken de molaire concentratie glucose en natriumchloride.
34 In een flesje bier van 250 ml met een alcoholpercentage van 5% zit 12,5 g alcohol.
a Bereken de massaconcentratie.
b Bereken de molaire concentratie.
c Hoeveel ml alcohol zit in een flesje?
5 Algemene oplosstrategie van vraagstukken
35 Je hebt een oplossing van zwavelzuur (H2SO4) met een concentratie van 0,50 mol l .

Je voegt 50,0 ml van deze oplossing toe aan een overmaat natriumhydroxide NaOH. Er wordt hierbij water (H2O) en natriumsulfaat (Na2SO4) gevormd.
a Hoeveel mol zwavelzuur zit er in 50,0 ml oplossing?
b Hoeveel gram NaOH wordt er minimaal gebruikt bij deze reactie?
c Hoeveel gram natriumsulfaat wordt er gevormd?
In dit practicum zullen we kopersulfaat CuSO4 oplossen in water en vervolgens ook verdunnen.
Oriëntatie
Onderzoeksvragen
Wat is het effect van kopersulfaat in water?
En wat is het effect van een verdunning op de kopersulfaatoplossing?
Hyotheses
Voorbereiding
Benodigdheden
kopersulfaat-pentahydraat (CuSO4 · 5H2O) water
balans bekerglas (100 ml of 250 ml) 2 maatcilinders (100 ml) roerstaafje veiligheidsbril labojas handschoenen
Oplossingen worden meestal gemaakt met een maatkolf, verdunningen met een maatkolf en pipet. In dit labo moet niet analytisch gewerkt worden, daarom maken we de verdunningen met een maatcilinder en bekerglas.
Veiligheid
Werkwijze
Maak 100 ml van een 0,5 mol l CuSO4 oplossing in water.
Vanuit deze oplossing: maak een verdunning van 100 ml (0,25 mol l ) en 250 ml (0,10 mol l ) oplossing.
Oplossing maken:
1 Bereken, op volgende pagina, hoeveel gram CuSO4 er moet worden afgewogen om 100 ml van een 0,5 mol l oplossing te maken.
2 Los deze massa op in 100 ml water.
3 Roer de oplossing
4 De oplossing is klaar, we noemen dit ook wel de stockoplossing.
Verdunningsreeks maken:
1 Bereken, op volgende pagina, hoeveel ml van de stockoplossing je moet nemen om de verdunningen te maken.
2 Met behulp van het pipet neem je de juiste volumes uit de stockoplossing en doe je dit in het nieuwe bekerglas.
3 Leng aan met water tot je het juiste volume (100 ml of 250 ml) hebt.
4 De verdunningsreeks is klaar. Je hebt nu 3 verdunningen: 0,5 mol l , 0,25 mol l en 0,1 mol l
Uitvoering
Berekeningen
Waarnemingen
Reflectie
Besluit
Reflectie
Was mijn hypotheses correct?
Hoe verliep de uitvoering van de proef?
paginanummer
Ik kan uitleggen wat absolute atoommassa is. 6
Ik kan uitleggen wat de gemiddelde relatieve atoommassa is en deze berekenen. 7
Ik ken het verschil tussen relatieve molecuulmassa en relatieve formulemassa en de soort binding waarbij ik deze moet gebruiken. 9 - 11, 35
Ik kan de relatieve molecuulmassa en relatieve formulemassa berekenen. 9 - 11, 35
Ik ken het getal van Avogadro. 12
Ik kan het aantal deeltjes, de stofhoeveelheid, het aantal atomen en moleculen berekenen. 12 - 13, 36
Ik kan de molaire massa berekenen aan de hand van het periodiek systeem. 14 - 15, 36
Ik kan de formule van molaire massa omvormen naar stofhoeveelheid of massa. 14 - 16, 36
Ik kan de molverhouding toepassen bij een reactievergelijkingen. 17 - 22, 37
In kan in een stoichiometrisch vraagstuk het beperkend of limiterend reagens bepalen. 22 - 23, 37
Ik kan in een reactievergelijking de oplossing, opgeloste stof en oplosmiddel benoemen. 23
Ik kan de massaconcentratie berekenen en de formule omvormen naar een andere grootheid in de formule.
Ik kan de molaire concentratie berekenen en de formule omvormen naar een andere grootheid in de formule.
Ik ken het verschil tussen een verdunning en verdampen en de invloed op de concentratie.
24 - 25, 37 - 38
25 - 27, 37 - 38
28 - 29, 37 - 38
Ik kan de verdunningsformule toepassen in een vraagstuk. 38
Ik ken het verschil tussen opconcentreren of zuiveren en de invloed op de concentratie.
Ik kan de concentratie berekenen van een oplossing van een mengsel met twee oplossingen met een verschillende concentratie aan opgeloste stof.
Ik kan vraagstukken oplossen met behulp van chemisch rekenen.
30 - 31
31 - 32, 38 - 39
36 - 37, 38 - 39
Colofon
Auteur Dries De Laet - Noortje Duysters – Nathalie
Vanneste
Eerste editie
Bestelnummer 90 808 0566 (module 3 van 6)
ISBN 978 90 4865 144 3
KB D/2025/0147/149
NUR 126
Thema YPMP3
Verantwoordelijke uitgever die Keure, Kleine Pathoekeweg 3, 8000 Brugge
RPR 0405 108 325 - © die Keure, Brugge
Niets uit deze uitgave mag verveelvoudigd en/of openbaar gemaakt worden door middel van druk, fotokopie, microfilm of op welke wijze ook zonder voorafgaande schriftelijke toestemming van de uitgever. No parts of this book may be reproduced in any form by print, photoprint, microfilm or any other means without written permission from the publisher. De uitgever heeft naar best vermogen getracht de publicatierechten volgens de wettelijke bepalingen te regelen. Zij die niettemin menen nog aanspraken te kunnen doen gelden, kunnen dat aan de uitgever kenbaar maken.
Die Keure wil het milieu beschermen. Daarom kiezen wij bewust voor papier dat het keurmerk van de Forest Stewardship Council® (FSC®) draagt. Dit product is gemaakt van materiaal afkomstig uit goed beheerde, FSC®-gecertificeerde bossen en andere gecontroleerde bronnen.