
1
2
2.2.1
3.1.1


1
2
2.2.1
3.1.1
In het vorig thema leerde je dat samengestelde stoffen onderverdeeld kunnen worden in twee grote groepen: de anorganische stoffen of minerale verbindingen en organische stoffen of koolstofverbindingen
Noteer 3 eigenschappen van organische stoffen.
Bekijk onderstaande foto.

Welke voorwerpen in deze kamer zijn gemaakt uit organische stoffen? Omcirkel op de afbeelding.
Lees de webpagina en bekijk het filmpje.
In welke 4 grote thema’s spelen chemische grondstoffen een belangrijke rol?
Geef bij elk thema een voorbeeld uit de tekst en formuleer een eigen voorbeeld.
1 voorbeeld:
2 voorbeeld:
3
voorbeeld:
4
voorbeeld:
Hoeveel procent van onze gebruiksgoederen komen tot stand dankzij ontwikkelingen in de chemie, kunststoffen en life sciences? %
Ga terug naar de antwoorden die je gaf op de vorige pagina bij de afbeelding. Neem een ander kleur en verbeter je antwoorden of vul nog extra aan met wat je nu weet.
Toch moeten we opletten met het verbruik van die gebruiksgoederen. Ze bestaan vaak uit chemische grondstoffen die grotendeels uit fossiele grondstoffen komen.
Deze grondstoffen zijn uitputbaar. Als we die grondstoffen in hetzelfde tempo gebruiken zoals de voorbije eeuw, dan zullen er onvoldoende grondstoffen voor handen zijn. Ook in de industrie groeit het besef dat we duurzaam moeten omgaan met wat onze aardbol ter beschikking heeft. Men denkt sterk na over andere manieren van produceren.
We moeten zo efficiënt mogelijk met grondstoffen omgaan. We produceren vaak voor éénmalig gebruik en nadien wordt het nutteloos afval. Dit kan anders door afval zoveel mogelijk nuttig te gebruiken. Een veel gebruikt principe daarvoor is de ladder van Lansink.
De uitdaging is om meer circulair te denken.
ladder van Lansink
A Preventie
B Hergebruik
C Recycling
D Energie
E Verbranden
F Storten
Geef 3 voorbeelden van het bewust omspringen met grondstoffen of verbruiksgoederen.
grondstoffen
recycleren
stoffen
productie
opnieuw gebruiken / vermaken
inzameling
downcyclen
verkoop
consumptie
inzameling
Essenscia is een Belgische organisatie die de belangen verdedigt van bedrijven die actief zijn in chemie, kunststoffen, biotechnologie, farma en kunststoffen. In bijna ieder land bestaat dat soort federaties. De rol van Essencia bestaat erin lidbedrijven een dienstverlening op maat aan te bieden met expertise en advies over sectorspecifieke thema’s. Daarnaast is Essencia de spreekbuis van de sector in de media en behartigt de federatie de belangen van de chemie en life sciences op alle politieke niveaus.
In de eerste module hebben we al kort koolwaterstoffen aangehaald. Maar wat zijn deze chemische stoffen nu precies en hoe kunnen we ze herkennen?
Koolwaterstoffen is een verzamelnaam voor koolstofverbindingen die enkel koolstof (C) en waterstof (H) in hun structuur hebben. In het Engels noemt men dit hydrocarbons. Hydro refereert naar het atoom waterstof en carbon naar het atoom koolstof.
Veel van deze stoffen komen uit onze aarde en worden ook wel fossiele grondstoffen genoemd. We gebruiken het woord ‘fossiel’ omdat ze miljoenen jaren terug ontstaan zijn uit de resten van plantaardig en dierlijk afgestorven materiaal. Er moet soms tot meer dan een aantal kilometer in de aarde geboord worden om die resten te vinden en op te pompen of te ontginnen in mijnen. De gevormde producten zijn onder andere aardolie, aardgas en steenkool. Men spreekt ook over ruwe olie omdat het opgepompte product nog veel onzuiverheden bevat en nog gezuiverd moet worden door onder andere gefractioneerde destillatie in destillatietorens.




Uit deze fossiele grondstoffen haalt men verschillende basisstoffen die dan verfijnd worden tot brandstoffen, kunststoffen, oliën … en die met allerlei bijkomende chemische processen kunnen omgezet worden tot talrijke consumptieproducten zoals waspoeders, kledij, plastic …
Bij gefractioneerde destillatie gebruikt men vooral het principe van het verschil in kooktemperatuur van de verschillende bestanddelen die in de fossiele grondstoffen aanwezig zijn. Nadien laat men verschillende producten met elkaar chemisch reageren om tot nieuwe structuren te komen.

In Isaac chemie 3 module 2 zuivere stoffen en mengsels heb je geleerd dat een destillatie wordt gebruikt om 2 verschillende vloeistoffen van elkaar te scheiden op basis van het kookpunt. Bij een gefractioneerde destillatie kunnen we meer dan twee verschillende stoffen scheiden.
opslag van ruwe olie
stoomketel
waterstofbehandelingsinstallatie
(autogas)
nafta kerosine diesel smeerolie stookolie residu
destillatietoren
kraakeenheid
Aangezien er heel veel verscheidenheid bestaat in het aantal koolstofverbindingen zal dit een invloed hebben op bepaalde fysische eigenschappen van de stoffen zoals kooktemperatuur, aggregatietoestand, brandbaarheid …
Hoe meer koolstoffen aanwezig zijn in de stof die opgegraven of opgepompt wordt, hoe hoger de massadichtheid en het kookpunt zullen zijn.
fossiele grondstof massadichtheid (kg/ m³) aantal koolstoffen kook(punt) traject (°c) toepassing
bitumen (vast tot dik vloeibaar)
(vloeibaar)
370 asfalt voor de wegen
Bij zuivere stoffen zoals gedestilleerd water kunnen we een vast kookpunt bepalen. Voor onzuivere stoffen of mengsels bv. zoutwater spreken we over een kooktraject. Er is geen exact kookpunt te bepalen.
Een voorbeeld van nog een ander product uit de gefractioneerde destillatie is olie. Je merkt dat door de destillatie de zwarte kleur van ruwe olie verdwijnt.

Het schema toont het proces waarbij plastic gemaakt wordt uit aardolie en aardgas om het nadien terug te recycleren.
Aardolie en aardgas worden geraffineerd tot synthetische organische monomeren.
Het maken van plastic: polymerisatie Monomeren (zoals ethyleen en propyleen) worden door middel van chemische synthese omgezet naar lange ketens van polymeren. Als deze zijn gevormd, stolt het vloeibare plastic en dit wordt omgezet naar plastic korrels, pellets.

De pellets worden gebruikt om verschillende plastic producten van te maken.
olie en aardgas
Een deel van de momomeren kan worden gebruikt voor andere plasticsoorten en chemische producten zoals was, smeermiddelen en brandstof.
Plastic afval wordt met een chemisch proces omgezet naar momomeren.
Plastic afval wordt gewassen en omgesmolten tot polymeren.
verkoop aan consumenten en bedrijfsleven.
stortplaatsen
Het menselijk lichaam bestaat vooral uit volgende chemische elementen:
• waterstof (H) 62,9%
• zuurstof (O) 25,5%
• koolstof (C) 9,5%
Deze elementen komen in het lichaam niet alleen als enkelvoudige stoffen voor maar ook als samengestelde stoffen zoals water.
In het heelal komt er 77% waterstof voor in de vorm van H2 en in de aardkorst komt er 49,2% zuurstof voor in verschillende vormen.
1.1 Algemene afspraken bij organische stoffen
a Teken de elektronenconfiguratie van het C-atoom en het H-atoom.
b Teken daarnaast het elektronstipmodel (Lewisstructuur) van het C-atoom en het H-atoom. C-atoom
Wat is het verschil tussen de elektronenconfiguratie en het elektronstipmodel (Lewisstructuur)?
Waarom gebruiken we het elektronstipmodel (Lewisstructuur)?
Elk element heeft doorgaans een verschillend aantal valentie-elektronen, wat bepaalt hoeveel bindingen het kan aangaan met een ander element in een verbinding. Onderstaand kader toont een overzicht van de meest voorkomende atomen in een koolstofverbinding met eventuele functionele groep.




In de chemische taal is er een verschil tussen de begrippen ‘verbinding’ en ‘binding’.
Een ‘verbinding’ of stof bestaat uit twee of meer atomen of ionen die met elkaar gebonden zijn door chemische bindingen
Een chemische 'binding' is een aantrekkingskracht die ontstaat tussen 2 atomen of ionen onder invloed van hun elektronen op de buitenste schil.

Is er een elektronenoverdracht tussen de atomen? Dan spreken we over een ionbinding. Stellen de atomen elektronen gemeenschappelijk? Dan spreken we over een covalente binding
Bij de organische chemie focussen we ons enkel op covalente verbindingen.
We kunnen koolwaterstoffen (KWS) en andere organische stoffen op verschillende manieren voorstellen.
1.1.1 Brutoformule
De brutoformule is een notatievorm voor een chemische verbinding. Alle elementen en hun aantal (index) worden in een afgesproken volgorde na elkaar geschreven zonder rekening te houden met de (ruimtelijke) structuur van de verbinding.
Het element koolstof (C) komt altijd eerst, gevolgd door het element waterstof (H).
Voorbeelden
benzeen (C6H6), hexeen (C6H12) …
Hoeveel koolstofatomen en waterstofatomen zijn er in propaan (C3H8)?
1.1.2 Voorstelling 2D
Structuurformule
De structuurformule is een voorstellingswijze waarbij alle elementen na elkaar worden geschreven en hun covalente bindingen duidelijk worden getoond.
Er bestaat zowel een beknopte als uitgebreide voorstellingswijze van de structuurformule. Je kan alle elementen in de verbinding op één horizontale lijn noteren en enkel de C-bindingen weergeven (beknopt) of je plaatst de C-atomen op een horizontale lijn met daarrond alle bindingen getekend. stof beknopt uitgebreid
ethaan etheen




Skeletnotatie
De skeletnotatie is een voorstellingswijze waarbij alle elementen worden voorgesteld door een zigzag- of ringstructuur. Elk hoekpunt stelt een C-atoom voor.
De skeletnotatie is de kortste manier om een molecule voor te stellen maar het geeft wel alle mogelijke informatie over de structuur van de stof. Waterstofatomen die rechtstreeks aan een C-atoom gebonden zijn, worden niet voorgesteld. Soms wordt er geen enkel element genoteerd, soms wel om wat meer duidelijkheid te geven.

zigzag beknopt ringstructuur butaan (C4H10) propaan (C3H8) benzeen (C6H6)


In werkelijkheid gaan de koolstof- en waterstofatomen meestal niet altijd in een rechte lijn met elkaar binden maar onder specifieke hoeken. Dit zie je in de voorstellingen hieronder. Daarover leer je meer in de derde graad.
De voorgaande voorstellingsmethoden gebruiken allemaal een tweedimensionaal (2D) vlak. Met de vele digitale middelen die nu beschikbaar zijn, kan dit ook perfect in drie dimensies (3D) worden weergegeven. We nemen het voorbeeld van butaan.


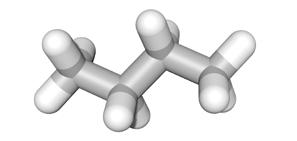
1.2 Algemene groepen
Naast de voorstelling is er ook nog een mogelijkheid om de organische stoffen in algemene groepen onder te verdelen.
1.2.1 Op basis van de vertakking
onvertakt organische stof vertakte organische stof
De koolstofatomen zijn verbonden in een rechte keten of zigzagstructuur zonder vertakkingen of zijtakken aan de keten.

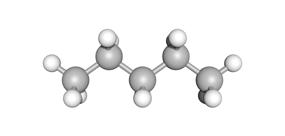
pentaan (C5H12)
De koolstofatomen zijn verbonden in een keten met 1 of meerdere vertakkingen

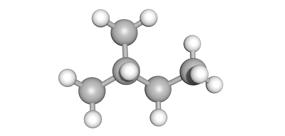
2-methylbutaan (C5H12)
Zo een extra vertakking krijgt dan ook weer een speciale naam zoals methyl… en ethyl… maar hier gaan we niet verder op in. Dat is leerstof voor een derde graad.
1.2.2 Op basis van de vorm van de molecule
acyclisch cyclisch
De structuur is lineair met een begin- en eindpunt.

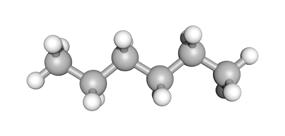
hexaan (C6H14)
De structuur is een ringstructuur.

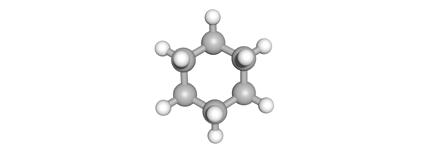
(C6H12)
1.2.3 Op basis van de soort binding
verzadigd
De structuur is enkel opgebouwd uit enkelvoudige bindingen

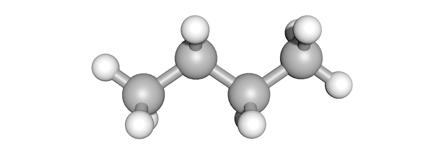
butaan (C4H10)
onverzadigd
De structuur is opgebouwd uit een combinatie van enkelvoudige, dubbele of drievoudige bindingen

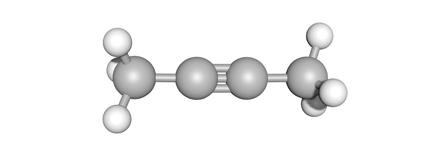
but-2-yn (C4H6)
Je hebt misschien wel al eens op een etiket van een voedingsmiddel gelezen 5 g vetten waarvan 2,7 g verzadigd.
Verzadigde en onverzadigde vetten verschillen voornamelijk in de manier waarop de koolstofatomen in hun keten verbonden zijn. Verzadigde vetten hebben alleen enkelvoudige bindingen tussen de koolstofatomen, waardoor de keten recht is en de moleculen dicht bij elkaar kunnen liggen. Dit zorgt ervoor dat verzadigde vetten bij kamertemperatuur vaak vast zijn, zoals boter of dierlijk vet.
Onverzadigde vetten, daarentegen, bevatten één of meerdere dubbele bindingen tussen de koolstofatomen, wat de keten een ‘kromming’ geeft en voorkomt dat de moleculen dicht op elkaar liggen. Dit maakt onverzadigde vetten vloeibaar bij kamertemperatuur, zoals olijfolie en visolie.
Gezondheidswetenschappers maken vaak een onderscheid tussen ‘goede’ en ‘slechte’ vetten. Goede vetten zijn voornamelijk onverzadigde vetten, die het risico op hart- en vaatziekten kunnen verlagen wanneer ze in de plaats van verzadigde vetten worden vervangen. Slechte vetten zijn verzadigde vetten, die in grote hoeveelheden het cholesterolniveau kunnen verhogen en het risico op hartziekten kunnen vergroten. Het is dus belangrijk om onverzadigde vetten te verkiezen boven verzadigde vetten voor een gezonde levensstijl.
Tenslotte zijn er regels over de naamgeving van de verbindingen, gelinkt aan het aantal koolstofelementen in de formule. Het aantal koolstofelementen (n) wordt duidelijk gemaakt door de stam of de prefix. Dit wordt vooraan in de naam gezet. Afhankelijk van de formule of soort verbinding, wordt een andere uitgang of achtervoegsel bijgezet.
Onderstaande tabel toont een overzicht van de prefixen. De achtervoegsels, per soort organische stof, komt later aan bod.
n voorbeeld prefix
1 C… meth-…
2 C2… eth-…
3 C3… prop-…
4 C4… but-…
5 C5 pent-…
6 C6 hex-…
7 C7 hept-…
8 C8 oct-…
9 C9 non-…
10 C10… dec-…
Index 1 noteren we niet bij het C-atoom.
In de tabel belichten we enkel ketens opgebouwd uit maximaal 10 C-atomen, maar er bestaan natuurlijk koolwaterstoffen die opgebouwd zijn uit veel meer C-atomen. Paraffine, de basisstof voor kaarsen, is een mengsel van verzadigde koolwaterstoffen (alkanen) met een variabel aantal koolstofatomen. De koolstofketens in paraffine bevatten meestal tussen de 20 en 40 koolstofatomen.De precieze samenstelling hangt af van de oorsprong en het raffinageproces. Paraffine wordt niet alleen gebruikt bij kaarsen maar ook in cosmetica en smeermiddelen. Dit vanwege de wasachtige eigenschappen.

Binnen de koolwaterstoffen hebben we verschillende soorten moleculen die elk bepaalde eigenschappen hebben. We bestuderen volgende 3 moleculen.
1 2 3
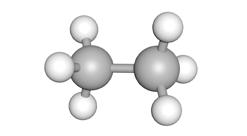

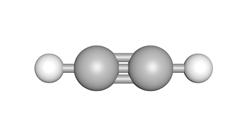
gelijkenissen
verschillen
2.1.1 Wat zijn alkanen?
Alkanen zijn de eenvoudigste organische moleculen.
Alkanen zijn verzadigde koolwaterstoffen. Ze bestaan uitsluitend uit koolstof- (C) en waterstofatomen (H). Ze bevatten alleen enkelvoudige bindingen tussen de koolstofatomen. Er is een duidelijk verband tussen het aantal koolstof- en waterstofatomen in een lineair alkaan, namelijk:
nH2n+2
Op basis van deze formule wordt de brutoformule opgesteld.
Het aantal waterstofatomen hangt af van het aantal bindingen dat de C-atomen nog kunnen maken, nadat het gebonden heeft met een ander C-atoom.
We nemen opnieuw het voorbeeld van ethaan. Verbind de valentie-elektronen die een binding aangaan.
Het koolstofatoom gaat een binding aan met het andere koolstofatoom. Daarnaast heeft elk koolstofatoom nog 3 valentie-elektronen over die kunnen binden met een H-atoom dat 1 valentieelektron heeft.
Teken op een kladblad de Lewisstructuur van het alkaan dat bestaat uit 3 en 4 C-atomen.
Vul het aantal waterstofatomen aan in de tabel.
We herkennen voor het aantal waterstofatomen ten opzichte van het aantal koolstofatomen een patroon met een zekere regelmaat. Daar kunnen we volgende formule voor het aantal H-atomen gebruiken: 2n + 2, met n = aantal C-atomen. Dit is enkel bij lineaire ketens zonder zijtakken.
2.1.2 Soorten alkanen
Naamgeving
De naam van een lineair alkaan bestaat uit twee delen: 1 de stam, die weergeeft hoeveel koolstofatomen in de molecule aanwezig zijn, 2 uitgang of achtervoegsel -aan






7H16 octaan
8H18 nonaan



10H22
9H20 decaan

Ga aan de slag met een moleculedoos. Heb je geen moleculedoos in de klas? Geen probleem, je kan werken met molview en van je eindresultaat een QR-code maken en delen.
De alkanen worden gekarakteriseerd door een meer uitgesproken geur: White Spirit (mengsel van van hexanen, heptanen en octanen), de geur van lpg (mengsel van propaan en butaan) …
Er zijn heel wat toepassingen waarin alkanen gebruikt worden. De verzadigde structuur van alkanen is zeer stabiel, hierdoor zijn ze weinig reactief en kan je ze lang bewaren. Je kan bepaalde van deze producten gebruiken zoals ze uit de destillatie komen. Alle alkanen zijn brandbaar en zullen zeer weinig tot niet oplosbaar zijn in water, maar wel goed in organische oplosmiddelen
Ze hebben een hydrofobe aard en zijn niet geleidend
Alkanen van methaan CH4 tot butaan C4H10 zijn bij kamertemperatuur gasvormig. Denk bijvoorbeeld aan propaan en butaan, die je wellicht kent van gasflessen. Helaas heeft methaangas een negatieve invloed op het milieu. Het is één van de belangrijkste broeikasgassen. Eén molecule methaan heeft hetzelfde effect als 25 moleculen CO2, dat ook een broeikasgas is. Het komt door verschillende factoren in de atmosfeer terecht.
Methaan bevindt zich onder andere in:
• de mest van koeien,

• smeltende permafrost, bevroren grond die meer dan 2 jaar een temperatuur had lager dan 0°C.
Van pentaan (C5H12) tot C16H34 spreken we over vloeibare producten; denk maar aan benzine, diesel, kerosine … Het zijn ook oplosmiddelen om een chemische stof in oplossing te brengen.



Vanaf C17H36 spreken we over vaste producten, denk maar aan paraffine en vaseline.


smelt- en kooktemperatuur bij alkanen aantal C-atomen
Wat stel je vast in deze grafiek over het verband tussen het aantal koolstofatomen en het smelt- en kookpunt?
2.2.1 Wat zijn alkenen?
Alkenen zijn onverzadigde koolwaterstoffen. Ze bestaan uitsluitend uit koolstof- (C) en waterstofatomen (H). Ze bevatten 1 of meerdere dubbele bindingen tussen de koolstofatomen.
Er is een duidelijk verband tussen het aantal koolstof- en waterstofatomen in een alkeen, namelijk:
C nH2n
Op basis van deze formule wordt de brutoformule opgesteld.
Het aantal waterstofatomen hangt af van het aantal bindingen dat de C-atomen nog kunnen maken, nadat het een dubbele binding heeft met een ander C-atoom.
Vul het aantal H-atomen aan voor volgende alkenen.



aantal C-atomen 2 3 4
aantal H-atomen
We herkennen voor het aantal waterstofatomen ten opzichte van het aantal koolstofatomen opnieuw een patroon met een zekere regelmaat. Daar kunnen we volgende formule voor het aantal H-atomen gebruiken: 2n, met n = aantal C-atomen.
De formule C nH2n is niet geldig bij een ringstructuur, vertakte verbindingen of verbindingen met meerdere dubbele bindingen.
2.2.2 Soorten alkenen
Naamgeving
De naam van een alkeen bestaat uit twee delen: 1 de stam, die weergeeft hoeveel koolstofatomen in de molecule aanwezig zijn. 2 uitgang of achtervoegsel -een









Een alkeen met 1 koolstofatoom bestaat niet!
In de systematische naam zet men soms nog een cijfer om te duiden waar de dubbel binding zit.
voorbeeld: but-2-een, op de tweede koolstof begint de dubbele binding.

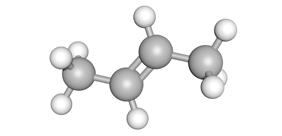
Bij oefeningen mag je voorlopig zelf kiezen waar je de dubbele binding zet. Het is dus niet noodzakelijk dat deze altijd tussen het eerste en tweede koolstofatoom zit, vooral niet bij formules met meer dan twee koolstofatomen.
In de derde graad zal je leren dat er daar wel degelijk internationale logische afspraken over zijn. Dat hoort tot de IUPAC-naamgeving, waar we in vorige modules al eerder over spraken.
Omschrijf, aan de hand van de algemene groepen, nauwkeurig de structuur van een alkeen?
2.2.3 Voorbeelden uit het dagelijks leven
Aangezien deze structuren minimum 1 dubbele binding hebben en dus onverzadigd zijn, betekent dat ze reactief zijn, veel reactiever dan de alkanen en ze gaan chemisch verder reageren tot andere stabielere chemische structuren.
Op de plaats waar er een dubbele binding aanwezig is, staan de koolstoffen iets dichter bij elkaar en dat is een verklaring voor het hebben van meer energie om zich te binden.
Bij hetzelfde aantal koolstofatomen zal een alkeen een iets lager kookpunt hebben dan een alkaan. Alkenen zijn apolair en lossen niet op in water.
De alkenen worden gekarakteriseerd met een meer uitgesproken geur
De grootste toepassingen zijn alkenen die zich verder laten polymeriseren tot kunststoffen, die we allemaal in ons dagelijks leven gebruiken. Denk aan schoolmateriaal zoals doorzichtige mapjes, balpennen …
Om te polymeriseren laten ze monomeren, dit zijn de basismaterialen met een heel korte ketenlengte, chemisch reageren tot lange ketens die we ook polymeren noemen.
In het geval van de kunststof polyetheen, is het monomeer etheen, bij polypreen, is het monomeer propeen.


monomeer etheen polymeer polyetheen
Vele alkenen zijn de basis om kunststoffen te maken zoals polypropeen en polyetheen. We noemen die soms ook polypropyleen en polyethyleen. Dit zijn plastic materialen die je vaak terugvindt als verpakkingsmaterialen, zakjes ...

2.3.1 Wat zijn alkynen?

Etheen wordt ook gebruikt om bepaalde vruchten vlugger te laten rijpen. Denk maar aan het rijpingsproces bij bananen. Ze zijn nog groen bij het transport over zee, maar eenmaal ze in de winkel worden verkocht moeten ze een gele kleur hebben.
Alkynen zijn onverzadigde koolwaterstoffen. Ze bestaan uitsluitend uit koolstof- (C) en waterstofatomen (H). Ze bevatten minstens 1 drievoudige binding tussen de koolstofatomen. Er is een duidelijk verband tussen het aantal koolstof- en waterstofatomen in een alkyn, namelijk:
C nH2n–2
Op basis van deze formule wordt de brutoformule opgesteld.
De formule is niet geldig bij een ringstructuur, vertakkingen of structuren met meerdere driedubbele bindingen.
We herkennen voor het aantal waterstofatomen ten opzichte van het aantal koolstofatomen opnieuw een patroon met een zekere regelmaat. Daar kunnen we volgende formule voor het aantal H-atomen gebruiken: 2n–2, met n = aantal C-atomen.
Naamgeving
De naam van een alkyn bestaat uit twee delen:
1 de stam, die weergeeft hoeveel koolstofatomen in de molecule aanwezig zijn. 2 uitgang of achtervoegsel -yn.
systematische naam brutoformule structuur
ethyn
propyn
but-2-yn
pent-1-yn
hex-1-yn
hept-1-yn
oct-1-yn
non-1-yn
dec-1-yn
C2H2
C3H4
C4H6
C5H8
C6H10
C7H12
C8H14
C9H16
C10H18









Een alkyn met 1 koolstofatoom bestaat niet!
In de systematische naam zet men soms nog een cijfer om te duiden waar de driedubbele binding zit.
voorbeeld: oct-3-yn, op de derde koolstof begint de driedubbele binding.

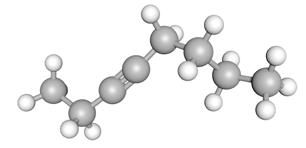
2.3.3 Voorbeelden uit het dagelijks leven
Ethyn of acetyleen is een gas en wordt gebruikt als:
brandstof voor raketten, het kan temperaturen van meer dan 3000°C bereiken, bij het lassen van bepaalde metalen, als chemische component in chemische reacties: bv. om vitamine A en E te maken.


Ethyn wordt ook als precursor, uitgangsstof die tijdens een chemische reactie omgezet wordt naar een ander stof, gebruikt voor de bereiding van vinylchloride. Dat is een monomeer om polyvinylchloride te maken. Het is beter bekend als PVC en dat zit in regenbuizen of regenlaarzen.

In de praktijk zie je veel minder toepassingen van alkynen dan van alkenen en alkanen.
Binnen de groep van organische stoffen of koolstofverbindingen zijn er niet enkel chemische verbindingen waar er enkel de elementen koolstof (C) en waterstof (H) voorkomen, zoals de koolwaterstoffen. In vele gevallen worden andere elementen teruggevonden in de formule zoals: zuurstof (O), stikstof (N) of halogenen (Cl, Br …) … of vaste atoomcombinaties zoals -OH, -COOH.
In ISAAC chemie 4 bespreken we enkel de alcoholen en de carbonzuren. Maar er zijn nog veel meer. In de derde graad breiden we de koolstofchemie uit met koolstofketens met verschillende functionele groepen zoals amines, ketonen, ethers …
3.1.1 Wat zijn alcoholen?
Alcohol ken je misschien wel, het zit in alcoholische dranken. De alcoholverbinding die in deze dranken zit, is ethanol.
Bij dit soort koolstofverbindingen gaan we dezelfde structuur nemen als een alkaan, maar we vervangen een waterstofatoom door een hydroxylgroep (-OH).

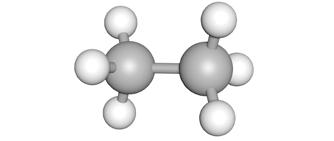

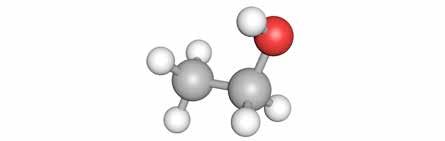
Alcoholen zijn koolstofverbindingen waar één of meerdere hydroxylgroepen (-OH) gebonden zijn aan een verzadigd koolwaterstof.
Bij alcoholen met één hydroxylgroep kunnen we met volgende formule de molecuulformule opstellen:
nH2n+1OH
In deze module bekijken we vooral alcoholen waar er slechts 1 hydroxylgroep aanwezig is, in de praktijk kan je alcoholen hebben met meerdere hydroxylgroepen.
Ondanks dat alcoholen een (-OH) groep in de formule hebben, zijn het geen basen. Alcoholen zijn covalente bindingen terwijl hydroxiden zich in een rooster bevinden met ionbindingen tussen metaalionen en hydroxide-ionen (OH-).
Met indicatoren kan al snel het verschil tussen de twee worden aangetoond.
3.1.2 Soorten alcoholen
Naamgeving
De naam van een alcohol bestaat uit twee delen: 1 de stam, die weergeeft hoeveel koolstofatomen in de molecule aanwezig zijn, 2 uitgang of achtervoegsel -anol of -aan-cijfer-ol
systematische naam
methanol
CH3OH hexaan-1-ol C6H13OH
ethanol C2H5OH heptaan-1-ol
propaan-1-ol
butaan-1-ol
pentaan-1-ol
7H15OH
C3H7OH octaan-1-ol C8H17OH
C4H9OH nonaan-1-ol C9H19OH
C5H11OH decaan-1-ol C10H21OH
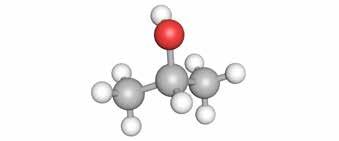
Teken de beknopte structuurformule van ethanol.
In de systematische naam zet men meestal nog een cijfer om te duiden waar de hydroxylgroep zit.
Bv. propaan-1-ol, op de 1ste koolstof is er een -OH functie, of propaan-2-ol, op de 2de koolstof is er een -OH functie.
Dit kunnen we enkel toepassen als we een structuurformule of skeletnotatie hebben.



3.1.3 Voorbeelden uit het dagelijks leven
Methanol (CH3OH) wordt ook wel brandalcohol genoemd. Dit is een molecule die heel belangrijk is in de chemische industrie om andere stoffen te produceren. Het zit naast ethanol in brandspiritus voor fonduetoestellen. Het product is voor ons zeer giftig en kan al vanaf 1 ml/kg lichaamsmassa voor ernstige gevolgen zorgen zoals blindheid en levensgevaar.
Aangezien het eruit ziet als water, is het gevaarlijk om het ergens te bewaren zonder een duidelijk etiket. Neem dus altijd de nodige veiligheidsmaatregelen.

a Wat betekenen de veiligheidspictogrammen op het etiket van methanol?
b Wat zijn de gevaren bij het werken met methanol?
c Wat zijn de voorzorgsmaatregelen die je moet nemen?
CAS 67-56-1 Gevaar
H 225-331-311-301-370 .
P 210-233-280.1+3+7-301+310-302+352 WGK 1 Mr: 32,04 KHLim 51B

De veiligheidsicoontjes heb je gezien in module 1 van Isaac chemie 3. De H-en P-zinnen bevinden zich achteraan in die module of kunnen online geraadpleegd worden op Polpo.
Ethanol (C2H5OH) of (drank)alcohol is waarschijnlijk de bekendste molecule op basis van een alcoholfunctie. Deze molecule komt tot stand bij gisting van suikerhoudende stoffen uit granen, fruit of zelfs aardappelen. We kunnen deze alcohol terugvinden in alcoholische dranken zoals wijn, wodka, bier …
C6H12O6 → 2 C2H5OH + 2 CO2 glucose gisting ethanol koolstofdioxide

Methanol kan soms in alcohol terecht komen door het slecht stoken waardoor de gisting niet enkel ethanol zal opleveren. Om alcohol te stoken moeten er heel wat accijnzen betaald worden op ethanol. Om dat te vermijden vertrekt men soms vanuit producten met minder ethanol en meer methanol, zoals spiritus. Methanol wordt daaruit gedestilleerd maar dat lukt niet 100%, wegens de kookpunten die heel dicht bij elkaar liggen, met de negatieve gevolgen vandien.
Ethanol komt in sommige deodorants, antitranspiranten of parfums voor. Aangezien alcoholen zeer brandbaar zijn, zal je op de etiketten steeds dit veiligheidspictogram tegenkomen.
In het kader van een duurzamere toekomst komen er steeds meer bio-ethanolen op de markt. Deze brandstoffen worden geproduceerd uit biomassa (afgestorven organisch materiaal) en kunnen de CO2-uitstoot met meer dan 50% reduceren, wat bijdraagt aan het terugdringen van broeikasgassen.
Propanol, butanol en isopropanol worden ook gebruikt als oplosmiddelen. Dat laatste product wordt onder andere in ontsmettingsmiddelen voor huishoudproducten gebruikt.
Alcoholen met een klein aantal koolstofatomen lossen goed op in water. Naarmate er meer koolstofatomen aanwezig zijn, verlaagt de oplosbaarheid.

Het kookpunt van alcoholen ligt meestal wat hoger dan de alkanen met overeenkomstig aantal C-atomen.
We zien steeds meer alcoholvrije dranken in het aanbod op de markt. Wat is daar de oorzaak van? Som er 3 op. Zoek online op.
Hoe maken ze alcoholvrij bier?
Wat is het verschil tussen alcoholvrij en alcoholarm in Nederland? En is dat hetzelfde in België?
3.2.1 Wat zijn carbonzuren?
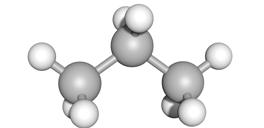
Bij dit soort koolstofverbindingen vervangen we 1 waterstofatoom van het overeenkomstige alkaan met een carboxylgroep (-COOH).
propaan
propaanzuur
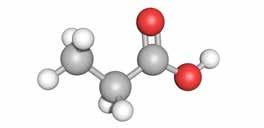
Carbonzuren zijn koolstofverbindingen waar één of meerdere carboxylgroepen (-COOH) gebonden zijn aan een verzadigd koolwaterstof.
Een carboxylgroep bestaat uit een carbonylgroep (-CO) met daaraan een hydroxylgroep (-OH).

carbonylgroep
hydroxylgroep
Bij carbonzuren met één carboxylgroep kunnen we met volgende formule de molecuulformule opstellen:
C nH2n+1COOH
Hou er rekening mee dat bij de carboxylgroep het C-atoom een dubbele binding aangaat met het eerste zuurstofatoom.
3.2.2 Soorten carbonzuren
Carbonzuren bestaan in hun eenvoudigste vorm uit een waterstofatoom gecombineerd met een alkaanstructuur. De eenvoudigste vorm verwijst naar de basisstructuur van een carbonzuur. Het gaat om de kleinste en meest eenvoudige carbonzuren, zoals mierenzuur, waarin de molecule slechts 1 koolstofatoom bevat.
Naamgeving
De naam van een carbonzuur bestaat uit twee delen: 1 de stam, die weergeeft hoeveel koolstofatomen in de molecule aanwezig zijn, 2 uitgang of achtervoegsel -aanzuur
Het totaal aantal koolstofatomen in de molecule telt voor de stamnaamgeving.
In het kader op vorige pagina is telkens slechts 1 carboxylgroep aanwezig. In de praktijk kan je carbonzuren hebben met meerdere carboxylgroepen of kan je carbonzuren hebben met dezelfde basisstructuur als een alkeen. In de derde graad ga je nog andere zuren zien en dan benoemen we het achtervoegsel met -zuur.
In de praktijk is het niet altijd duidelijk dat het om een carbonzuur gaat. De brutoformule van propaanzuur kan men als volgt noteren: C3H6O2. Daarmee is de carboxylstructuur niet duidelijk zichtbaar.
Het is effectief zo dat bepaalde carbonzuren meer gebruikt worden met hun triviale namen, dan hun systematische namen.
3.2.3 Voorbeelden uit het dagelijks leven
Methaanzuur of mierenzuur (HCOOH) komt in de natuur veel voor bij planten of dieren. Denk maar aan het branderig gevoel dat je krijgt bij het aanraken van brandnetels. Wespen, bijen, mieren …. gaan zich verdedigen door het aanmaken van mierenzuur. Zuiver mierenzuur is zeer corrosief en kan brandwonden veroorzaken.
Ethaanzuur of azijnzuur (CH3COOH) is een multifunctioneel product. In de voeding kan het gebruikt worden in een verdunde oplossing, 4% azijnzuur, om bepaalde voedingsmiddelen te bewaren: zoals augurken, uitjes … In een zuur milieu kunnen micro-organismen zich minder gemakkelijk vermenigvuldigen. Het wordt ook gebruikt om een saladedressing of -vinaigrette te maken. Het maken van appelazijn(zuur) is nog een ander voorbeeld. Dit azijn voor voedingsdoeleinden wordt witte natuurazijn genoemd.
In schoonmaakmiddelen, 5-10% azijnzuur, kan het gebruikt worden om kalkaanslag te verwijderen. Dit azijn noemen we huishoudazijn
Heb je een waterkoker met veel kalkaanslag? Kook een mengsel van water met azijnzuur in de verhouding 50% op 50% en dat euvel is opgelost.


Daarnaast kan het in huis gebruikt worden om vetvlekken op te lossen of om kleuren te fixeren van kledij zodat het niet afgaat bij de eerste wasbeurt. De kleur van een rode trui kan vervagen of afgeven na het wassen. Vul een emmer met koud water en voeg een kopje huishoudazijn toe. Dompel de rode trui volledig onder in het mengsel en laat deze 30 minuten weken. Azijnzuur helpt de kleurstof in de vezels van de trui te fixeren. Na het weken spoel je de trui goed uit met koud water en laat je hem drogen. Deze tip werkt ook bij zweetgeurtjes in merinowol. Wol mag niet veel gewassen worden. De geur van azijn neutraliseert de geurtjes die in kleding aanwezig zijn.
De voornaamste werkzame stof in valeriaanwortel is valeriaanzuur, ook wel bekend als pentaanzuur (C4H9COOH). Deze geurstof wordt door de plant ingezet om insecten en dieren aan te trekken of juist af te weren.
In de hersenen bindt valeriaanzuur zich aan een receptor die een sleutelrol speelt bij het ontspannen van spieren en het verminderen van angstgevoelens en onrust.
Let op: het gebruik van valeriaanzuur in combinatie met alcohol wordt afgeraden.

De meeste zuren ruiken niet echt lekker, maar als je ze laat reageren met een alcohol, ontstaat er een nieuwe stof die bijvoorbeeld naar ananas kan ruiken. Ethylbutanoaat is daar een voorbeeld van. Met andere zuren kun je ook andere zoete en aangename geuren maken. Dit is één van de vele aroma’s die je op een kunstmatige manier kunt maken.
De geuren en smaken bij het mengen van een zuur met een alcohol kunnen enorm variëren. Ze kunnen fruitig, bloemig, zoet of zelfs chemisch zijn. Ze dragen bij aan de kenmerkende geur van veel fruitsoorten zoals: appels, bessen en peren. Daarom worden ze vaak gebruikt in de voedingsindustrie om kunstmatige smaakstoffen en aroma's te creëren.

Daarnaast worden ze ook gebruikt in parfums en cosmetica om aangename geuren te geven aan producten zoals lotions, shampoos en zeep
In het vorig hoofdstuk zagen jullie dat er ook anorganische zuren zijn. Wat zijn volgens jullie de grote verschillen met de carbonzuren?
Er bestaan uiteraard nog heel wat andere koolstofverbindingen, maar die worden in de derde graad verder in detail bestudeerd.
1 Koolwaterstoffen
1 Omcirkel in het groen wat voorbeelden zijn van organische stoffen of koolstofverbindingen?






2 a Markeer in het groen welke van de volgende moleculen behoren tot de koolwaterstoffen.
C2H4 CO2 C12H22O11 H2O HCN CH4 NaOH HCl C6H12 H2
b Verklaar.
3 Doorstreep de onderstaande voorstellingen die niet correct zijn om koolwaterstoffen voor te stellen.
Koolstof3waterstof8




4 Omcirkel wat niet in de rij past. Verklaar.
a Uitleg:



b Uitleg:
c Uitleg:






2 Soorten koolwaterstoffen Alkanen
5 Noteer de brutoformule van volgende alkanen. Vul het aantal koolstofatomen en waterstofatomen aan.
6 Noteer de naam bij de correcte voorstelling. Kies uit: methaan, butaan, pentaan, hexaan en nonaan



7 Bouw de moleculen met een moleculebouwdoos of molview.
a Noteer de naam.
b Teken de skeletnotatie en uitgebreide structuurformule.
brutoformule naam skeletnotatie uitgebreide structuurformule
8 Wie ben ik? Geef steeds de naam en de brutoformule.
a Ik ben een verzadigd koolwaterstof met 8 koolstofatomen en 18 waterstofatomen.
b Samen zijn we goed voor een acyclische koolwaterstofstructuur met 3 koolstoffen met enkel enkelvoudige bindingen.
9 Hoeveel C-atomen kunnen deze afbeeldingen minimaal en maximaal hebben? Leg uit.



10 a Om de Kilimanjaro te beklimmen staat er je een hoogte van 5895 m te wachten. De begeleiders van deze uitdagende bergbeklimming nemen kleine gasflessen propaan mee op hun tocht. Waarom verkiezen ze propaangas boven butaangas?
b Wat is een nadeel van propaangas specifiek bij het klimmen in hooggebergtes?
11 Zoek de fout en corrigeer.
CH2
C10H1
C0,5H10
C2H3
12 Wie ben ik? Geef de naam en de brutoformule. We voelen ons goed in een vijfhoek. Ieder hoekpunt stelt een C voor.
13 Juist of fout? Verbeter indien nodig.
a Alkenen zijn verzadigde koolwaterstoffen.
b Een alkeen met 1 dubbele binding en 5 koolstofatomen heeft 12 waterstofatomen.
c Een alkeen met 1 koolstofatoom bestaat niet.
14 Noteer de juiste naam of brutoformule.
brutoformule naam
15 Je krijgt de skeletnotatie gegeven.
a Noteer de brutoformule en naam.
b Teken de uitgebreide structuurformule.
brutoformule naam skeletnotatie uitgebreide structuurformule


16 Noteer de juiste naam van het polymeer of monomeer. monomeer
17 Waarom is polyetheen brandbaar?
18 Je krijgt de verkorte notatie gegeven. Noteer de brutoformule en de naam.
brutoformule
19 Wie ben ik?
verkorte notatie


Ik ben een koolwaterstof met 5 koolstofatomen en bevat een dubbele binding tussen het 2e en 3e koolstofatoom.
a Geef de naam:
b Teken de verbinding.
c Noteer minimum 1 typisch kenmerk voor de koolwaterstof.
20 Zoek online op wat volgende afbeeldingen met alkenen te maken hebben.


Alkynen
Vanaf hier gaan de oefeningen zowel over alkanen, alkenen als alkynen.
21 Schrijf de brutoformule of naam van volgende stoffen.
naam brutoformule
hex-1-een
but-1-yn
pent-1-yn
butaan
etheen
dec-1-yn
22 Welk alkyn wordt afgebeeld? Noteer de naam en teken de uitgebreide structuurformule.

23 Teken de skeletstructuur van de volgende moleculen. mogelijkheid 1 mogelijkheid 2 mogelijkheid 3
C3H6
C7H16
C6H10
C8H14
C9H18
24 Verbind de juiste namen met de overeenkomstige afbeelding.




25 a Geef de naam van volgende beknopte notaties.
b Noteer de brutoformule.



26 Zoek de fout en verbeter.
a Nonnyn is een alkyn met 9 C-atomen.
b Meth-3-yn is een onzichtbaar alkyn.
27 Bestudeer in de applet het verschil in gevormde hoeken als je één koolstofatoom hebt met 4 enkele bindingen (bv. CH4) en één koolstofatoom met 2 dubbele bindingen (bv. CO2). Teken dit na en wat is het verschil in hoekgrootte?
Andere organische stoffen
28 Noteer de molecuulformule en teken de structuurformules van onderstaande koolstofverbindingen: methanol en ethaanzuur.
methanol ethaanzuur
molecuulformule:
structuurformule:
29 Noteer de triviale naam van volgende carbonzuren.
methaanzuur: ethaanzuur:
butaanzuur: pentaanzuur:
30 Maak van onderstaande molecule een alcohol. Dit kan op papier, met de moleculenbouwdoos of molview. Duid aan wat je allemaal moet veranderen.

31 Vul de tabel aan.

32 Vul de tabel aan.
molecuulformule
C2H5COOH
33 Wat hoort niet in het rijtje? Verklaar.
a zoutzuur valeriaanzuur propaanzuur huishoudazijn
b butaanzuur mierenzuur propeenzuur pentaanzuur
c fosforzuur salpeterzuur hexaanzuur zwavelzuur
34 Uit onderstaande grafiek blijkt dat alcoholen een veel hoger kookpunt hebben dan het overeenkomstige alkaan met evenveel koolstofatomen.
Alcohol Alkanen Kookpunt aantal C-atomen temperatuur (in °C)
Waarom? Verklaar.
35 Zet in dalende volgorde op vlak van het aantal H-atomen die in de verbinding aanwezig zijn. but-2-yn azijnzuur propaan decaan-1-ol hex-2-een cyclohexaan
36 Los het kruiswoordraadsel op. Noteer eerst het goede woord en noteer het in het kruiswoordraadsel op de volgende pagina.
Horizontaal
5 C6H13OH
8 De basismolecule voor de kunststof polypropeen is …
9 Een ander woord voor koolstofverbindingen: … stoffen.
10 C10H20 11

12 Een mogelijke voorstelling voor een koolstofverbinding is de … notatie.
Verticaal
1 Hoe noemen we organische stof met een ringstructuur nog in de chemie?
2 Synoniem voor ethaanzuur:
3 Andere naam voor brandspiritus (of 1 onderdeel ervan):
4 Ander woord in het Engels voor koolstof:
6 C-C-C-C-C-C-C=C
7 De basis voor alle koolwaterstoffen is …
13 Afkorting voor koolwaterstoffen:
Oplossing
De PMD-zak is een bron aan verschillende kunststoffen.
Op kunststofverpakkingen zie je vaak recyclage-icoontjes die aanvullende informatie geven over het type kunststof dat is gebruikt.
a Leid uit de afkortingen af welke kunststoffen opgebouwd zijn uit alkenen?

b Geef enkele voorbeelden van verpakkingen uit jouw dagelijks leven die bestaan uit alkenen.
Neem uit een PMD-zak een aantal verschillende plastiek verpakkingen. Zoek op uit welk soort kunststof ze zijn gemaakt.
Oriëntatie
Onderzoeksvraag
Hoe kan ik de kunststoffen van elkaar onderscheiden als er geen recyclage-icoon op staat?
Hypothese
Voorbereiding
Benodigdheden
stoffen
een voorwerp uit PET (flesje of dopje) een voorwerp uit PP (folie) een voorwerp uit PE (folie)
Werkwijze
1 Neem een stuk plastiek.
bunsenbrander brandhandschoenen veiligheidsbril kroestang trekkast labojas
2 Houd het stuk plastiek, met een kroestang, minimaal 5 seconden onder de vlam van een bunsenbrander.
3 Observeer nauwkeurig het verloop van de brand (ontbrandingstijd, rookontwikkeling, kleur van de vlam …)
4 Noteer je waarnemingen.
Uitvoering
Waarneming
Brandbaarheid:
Vlamkenmerken:
Rookkenmerken:
Brandgeurkenmerken:
Brandbaarheid:
Vlamkenmerken:
Rookkenmerken:
Brandgeurkenmerken:
Brandbaarheid:
Vlamkenmerken:
Rookkenmerken:
Brandgeurkenmerken:
Brandbaarheid:
Vlamkenmerken:
Rookkenmerken:
Brandgeurkenmerken:
Brandbaarheid:
Vlamkenmerken:
Rookkenmerken:
Brandgeurkenmerken:
Resultaten
Scan de QR-code en zoek op de website, aan de hand van de kenmerken, de soort kunststof.
Reflectie
Besluit
Geef een antwoord op de onderzoeksvraag.
Reflectie
Was mijn hypothese correct?
Hoe verliep de uitvoering van de proef?
Colofon
Vanneste
Eerste editie
paginanummer
Ik kan de verschillen tussen organische (koolstofverbindingen) en anorganische (minerale verbindingen) stoffen benoemen en herkennen. 6-8
Ik kan uitleggen waaruit koolwaterstoffen bestaan en waar ze voorkomen. 6
Ik kan koolwaterstoffen herkennen aan de hand van een voorstelling. 8-11
Ik kan toelichten hoe het elektronstipmodel (Lewisnotatie) gebruikt wordt om koolstofverbindingen voor te stellen. 9
Ik kan de verschillende voorstellingswijzen herkennen en uitleggen: wat het verschil is tussen een brutoformule, molecuulformule, structuurformule en skeletnotatie. 10-11
Ik ken het verschil tussen een 2D en 3D voorstelling. 10-11
Ik kan de verschillende organische stoffen in algemene groepen catalogeren. 12-13
Ik ken de prefixen, aan de hand van het aantal koolstofatomen in de keten, bij koolstofverbindingen van buiten. 14
Ik kan een alkaan herkennen aan de hand van de voorstelling, naam of brutoformule. 15-16
Ik kan de naamgeving en verschillende formules van alkanen uitleggen en toepassen. 16
Ik kan eigenschappen en specifieke toepassingen van alkanen in ons dagelijks leven toelichten. 17
Ik kan verbanden zien en toelichten tussen het aantal koolstofatomen en bepaalde fysische eigenschappen. 17-18
Ik kan een alkeen herkennen aan de hand van de voorstelling, naam of brutoformule. 18-19
Ik kan de naamgeving en verschillende formules van alkenen uitleggen en toepassen. 19-20
Ik kan eigenschappen en specifieke toepassingen van alkenen in ons dagelijks leven toelichten. 20-21
Ik kan een alkyn herkennen aan de hand van de voorstelling, naam of brutoformule. 22
Ik kan de naamgeving en verschillende formules van alkynen uitleggen en toepassen. 22
Ik kan eigenschappen en specifieke toepassingen van alkynen in ons dagelijks leven toelichten. 23
Ik kan een alcohol herkennen aan de hand van de voorstelling, naam of brutoformule. 24-25
Ik kan de naamgeving en verschillende formules van alcoholen uitleggen en toepassen. 25
Ik kan toelichten waar de alcoholen voorkomen in bepaalde specifieke toepassingen uit ons dagelijks leven. 26-27
Ik kan een carbonzuur herkennen aan de hand van de voorstelling, naam of brutoformule. 28-29
Ik kan de naamgeving en verschillende formules van carbonzuren uitleggen en toepassen. 29
Ik kan toelichten waar de carbonzuren voorkomen in bepaalde specifieke toepassingen uit ons dagelijks leven. 30-31
Auteur Dries De Laet - Noortje Duysters – Nathalie
Bestelnummer 90 808 0566 (module 2 van 6)
ISBN 978 90 4865 144 3
KB D/2025/0147/149
Niets uit deze uitgave mag verveelvoudigd en/of openbaar gemaakt worden door middel van druk, fotokopie, microfilm of op welke wijze ook zonder voorafgaande schriftelijke toestemming van de uitgever. No parts of this book may be reproduced in any form by print, photoprint, microfilm or any other means without written permission from the publisher. De uitgever heeft naar best vermogen getracht de publicatierechten volgens de wettelijke bepalingen te regelen. Zij die niettemin menen nog aanspraken te kunnen doen gelden, kunnen dat aan de uitgever kenbaar maken. STUDIEWIJZER
NUR 126
Thema YPMP3
Verantwoordelijke uitgever die Keure, Kleine Pathoekeweg 3, 8000 Brugge
RPR 0405 108 325 - © die Keure, Brugge
Die Keure wil het milieu beschermen. Daarom kiezen wij bewust voor papier dat het keurmerk van de Forest Stewardship Council® (FSC®) draagt. Dit product is gemaakt van materiaal afkomstig uit goed beheerde, FSC®-gecertificeerde bossen en andere gecontroleerde bronnen.