

Vigilancia que protege vidas:
fortaleciendo la seguridad con cada reporte
La seguridad del paciente es un compromiso colectivo que se construye día a día, no solo desde la atención clínica, sino también desde la observación y el reporte responsable. Este boletín farmacéutico presenta un análisis detallado de los reportes de Problemas Relacionados con Medicamentos (PRM), Dispositivos Médicos y Reactivos durante el primer semestre de 2025 en nuestra institución, como una oportunidad de aprendizaje y mejora continua.
Si bien los datos muestran una disminución en las notificaciones, esto más que una buena señal, representa un llamado a fortalecer la cultura del reporte. Cada evento identificado y reportado —por mínimo que parezca— puede evitar que se repita y proteger a futuros pacientes.
Gracias a la implementación del nuevo software Almera, hoy contamos con una herramienta más amigable, visible y eficiente para facilitar estos reportes. Invitamos a todos los colaboradores a apropiarse de esta plataforma y a ser parte activa de los programas de Farmacovigilancia, Tecnovigilancia y Reactivovigilancia.
Conocer, reportar y actuar no solo mejora los procesos, también salva vidas. Sigamos avanzando juntos hacia una atención más segura, informada y humana.

Caracterización de reportes de problemas
relacionados con medicamentos (PRM), Dispositivos Médicos y Reactivos en la institución.
El reporte de Problemas Relacionados con los Medicamentos y los eventos e incidentes adversos con Dispositivos Médicos y Reactivos, tiene el objetivo de conocer cuáles son los problemas de seguridad que se relacionan con determinados productos farmacéuticos comercializados en el país, buscando fortalecer y velar por la calidad, prevención y promoción del uso seguro.
El presente Boletín Farmacéutico muestra el comportamiento de las diferentes notificaciones recibidas a través de la plataforma de reporte institucional VitoReporta y en el proceso de migración a la plataforma Almera, durante el primer semestre del año 2025.
Análisis de reportes
Gráfica No. 1 -
Mes de Reporte
La gráfica No. 1, ilustra la tendencia del número total de notificaciones por mes durante el primer semestre del 2025 en la institución, con un total de 202 notificaciones. Comportamiento con una tendencia lineal descendente, lo que evidencia poca cultura de reporte institucional.
Teniendo en cuenta lo anterior, en el mes de Junio se inició actividad de educación de los diferentes programas de vigilancia (Farmacovigilancia, Tecnovigilancia, Reactivovigilancia) y retroalimentación de las notificaciones en la plataforma institucional. Se inició dicha actividad con área de enfermería Hospitalización y Urgencias, y con el personal del Servicio Farmacéutico.
Por otra parte, durante el mismo mes se inicia la implementación del nuevo software Almera, que cuenta con un módulo de gestión del riesgo para reportes de seguridad, la cual está disponible en equipos de cómputo y código QR visibles en todos los servicios de la institución.

¿Tienes una situación que reportar?
Gráfica No. 2 - Distribución mensual de Reportes notificados al programa de Farmacovigilancia y Tecnovigilancia. ¡Hazlo fácilmente en ALMERA!
Invitamos a nuestros colaboradores a participar en la identificación y notificación de cualquier sospecha de problema relacionado con los Medicamentos, Dispositivos Médicos y Reactivos y reportarlos en la herramienta Almera.

Eventos e incidentes adversos con dispos itivos medicos
Problemas de calidad a medicamentos
Errores de medicación
Reacciones adversas a medicamentos
Análisis de reportes
En la gráfica No. 2, se observa el comportamiento respecto a la clasificación de los reportes evaluados, durante el primer semestre del 2025, evidenciando que en su mayoría son reportes de Reacciones Adversas a Medicamentos (145 notificaciones), seguido de Errores de Medicación (29 notificaciones) superando el 85% de las notificaciones totales, y seguido a eventos e incidentes adversos asociados a Dispositivos Médicos (24 notificaciones).
Durante el primer semestre no se notificaron incidentes o eventos adversos con Reactivos de diagnóstico in vitro y Reactivos in vitro.
En cuanto a la clasificación de las notificaciones según la gravedad, 173 de los reportes de Problemas Relacionados con los Medicamentos fueron clasificados como no graves y 5 reacciones adversas con criterio de gravedad. Los eventos e incidentes adversos con reactivos se clasificaron como no serios.
Por medio de Farmacovigilancia activa institucional también se detectaron 8 reacciones adversas graves.
Medicamento
R-CHOP
(Rituximab, Ciclofosfamida, Doxorrubicina, Vincristina)
Daratumumab
Montelukast
Difenhidramina
Acetaminofén
Bleomicina
Dacarbazina
Doxorrubicina
Carboplatino
Fluorouracilo
Oxaliplatino
Fluorouracilo
Reacción adversa grave
Neutropenia febril que progresa a choque séptico.
Opresión torácica, sialorrea - prolongación de la hospitalización.
Opresión torácica, fiebre - prolongación de la hospitalización.
Reacción infusional - prolongación de la hospitalización.
Extravasación - requerimiento de intervención médica y hospitalización.
Trombosis venosa - prolongación de la hospitalización.
Pembrolizumab Lupus
Trastuzumab/Pertuzumab Opresión torácica, parestesias - prolongación de la hospitalización.
Doxorrubicina
Carboplatino
Difenhidramina
Fosaprepitant
Acetato de Leuprolide
Alopurinol
Lanreotide
Extravasación - requerimiento de intervención médica y hospitalización.
Hipersensibilidad - prolongación de la hospitalización.
Toxicodermia

Alertas sanitarias
e informes de seguridad
Una alerta sanitaria es toda sospecha de una situación de riesgo potencial para la salud de la población y/o de trascendencia social, frente a la cual es necesario el desarrollo de acciones de salud pública urgente y eficaz. Estas son comunicadas por el INVIMA.
1. 2. Los criterios para realizar una alerta sanitaria son:
Si el producto es alterado(s) o fraudulento(s).
Si se establece un nuevo riesgo sanitario, o un riesgo mayor al previsto con un producto determinado.
Durante el período comprendido entre enero y junio del 2025 se han publicado en la página web del INVIMA:
• 72 alertas sanitarias y 4 informes de seguridad relacionada a Medicamentos.
• 152 alertas sanitarias y 35 informes de seguridad asociadas a Dispositivos Médicos
• 42 alertas sanitarias y 16 informes de seguridad asociadas a Reactivos de diagnóstico in vitro y Reactivos in vitro.
Vigilancia Sanitaria y Alertas del INVIMA

Esta información fue compartida oportunamente con los líderes de proceso de la institución por medio de correo electrónico para su divulgación en los equipos de trabajo, sin embargo, las alertas sanitarias no tenían aplicabilidad en la institución.
Las alertas de seguridad relacionada a Medicamentos, consistieron en denuncias de hurtos y falsificación, productos fraudulentos principalmente al uso de suplementos dietarios, productos naturales o Fitoterapéuticos, sustancias quemadoras de grasa, sin registro sanitario.
Con respecto a las alertas sanitarias e informes de seguridad relacionada a Dispositivos Médicos y Reactivos, se relacionaron a inconsistencia en etiquetados, fallos durante el uso, problemas de calidad, calibración, anomalías o mal funcionamiento en alguna de las partes que conforma el producto, entre otras.
Por medio de este boletín se publica nuevamente los informes de seguridad de medicamentos que acoge la institución para el conocimiento del personal asistencial e información para prescribir.
Tabla No 2: Reacciones adversas graves asociadas a medicamentos de uso institucional:
Medicamento Indicación
AMOXICILINA
ROSUVASTATINA
Tratamiento de infecciones de origen bacteriano que se presentan comúnmente en las vías respiratorias superiores, vías respiratorias inferiores; profilaxis de infecciones como endocarditis o de bacteriemia asociada a intervenciones quirúrgicas.
Riesgo de eventos cardiovasculares en pacientes con múltiples factores de riesgo de enfermedad coronaria; Hipercolesterolemia familiar; Hiperlipoproteinemia familiar tipo 3; Aterosclerosis generalizada; Hiperlipidemia primaria; Hipertrigliceridemia.
ANTAGONISTAS DE RECEPCIÓN DE ANGIOTENSINA (ARA II)
Tratamiento de hipertensión arterial
METFORMINA Diabetes Mellitus tipo 2
Descripción informe de seguridad
La European Medicines Agency (EMA) solicitó la inclusión de reacciones adversas: síndrome de Kounis, y enterocolitis inducida por el fármaco. Las agencias regulatorias como Health Canada, el Instituto de Salud Pública de Chile y el Ministerio de Salud de Panamá acogieron esta medida.
Síndrome de Kounis es un síndrome coronario agudo, causado por la liberación de mediadores inflamatorios durante la activación de mastocitos y posterior degranulación de los mismos. Síndrome de enterocolitis inducida por fármacos (DIES): reacción de hipersensibilidad no IgE mediada, caracterizada por síntomas gastrointestinales.
El Ministerio de Salud de Canadá ha comunicado la actualización de la información de seguridad para los productos Brilinta (Ticagrelor) y Crestor (Rosuvastatina) en su monografía, insertos e información para pacientes la inclusión en la sección de interacciones el riesgo de miopatías incluyendo rabdomiólisis como resultado de una interacción entre ticagrelor y Rosuvastatina.
La European Medicines Agency (EMA) concluyó que existe el riesgo de presentarse angioedema intestinal asociado al consumo de fármacos del grupo farmacológico ARA II solos o en combinación.
La European Medicines Agency (EMA) indicó incluir la información de los riesgos de encefalopatía mitocondrial, acidosis láctica y episodios stroke-like y diabetes de herencia materna y sordera en pacientes con enfermedades mitocondriales conocidas.
Alertas sanitarias - informes de seguridad | Invima - Alertas Sanitarias. (s. f.-b). https://app.invima. gov.co/alertas/alertas-sanitarias-general?field_tipo_de_documento_value=1&field_a_o_value=1
Sanitaria y Alertas del INVIMA
Vigilancia
de los medicamentos Seguridad en el uso
En este contenido se presentan tips para el uso seguro de medicamentos que ayudan a minimizar la probabilidad que ocurran errores.
¿Cuáles son las prácticas seguras más eficaces para evitar los errores en el uso de medicamentos?
Dentro de las recomendaciones de las prácticas seguras en el manejo de medicamentos, se destaca la identificación y el reconocimiento de los medicamentos de ALTO RIESGO y medicamentos llamados internacionalmente LASA.
1
Los medicamentos “LASA” son los medicamentos que presentan las siguientes semejanzas:
• Similitud ortográfica
• Similitud fonética
• Similitud envasado
• Similitud de dosis.
Estos pueden asociarse a múltiples dificultades en las etapas de almacenamiento, dispensación o administración.
Ejemplo: que el medicamento administrado no sea el necesario, que la forma farmacéutica sea incorrecta, que la dosis sea distinta a la indicada, que la formulación no se ajuste exactamente a la prescripción o que la potencia o dosis presentadas sean distintas a la indicada.
Los “medicamentos de alto riesgo” son aquellos que cuando se utilizan incorrectamente presentan un riesgo elevado de causar daños graves o incluso mortales a los pacientes.
Ejemplo: Lista de medicamentos alto riesgo en pacientes crónicos.
Grupos terapéuticos
• Antiagregantes plaquetarios (Incluyendo aspirina)
• Anticoaguiantes orales
• Antiepilépticos de estrecho margen (carbamazepina, fenitoína y valpróico)
• Antipsicóticos
• Benzodiacepinas y análogos
• ß -Bloqueantes adrenérgicos
• Citostáticos orales
• Corticosteroides largo plazo ( > 3 meses)
• Diuréticos del ASA
• Hipoglucemiantes orales
• Inmunosupresores
• Insulinas
• Opioides
Dada la elevada complejidad del sistema de utilización de los medicamentos y el gran número de medicamentos disponibles, el Servicio Farmacéutico marca o rotula los medicamentos de ALTO RIESGO con marcación de color ROJO y los medicamentos LASA se rotulan con marcación de color AMARILLO como señal de alerta para todo el personal asistencial, con el fin de que se enfatice su verificación en toda la ruta de los medicamentos que mejora la seguridad de nuestros pacientes.
Los medicamentos LASA y ALTO RIESGO están definidos, identificados, disponibles en la casita de calidad de fácil acceso para todo aquel personal de salud que los prescribe, dispensa y administra.
Conoce el listado en la siguiente ruta institucional:
Resultados de la búsqueda en \\aquilestc\Sistema_Calidad\11.SERVICIO FARMACEUTICO\9. FORMATOS
Medicamentos: Uso seguro
Seguridad en el uso
de Dispositivos Médicos
¿Cómo minimizar Riesgos eléctricos con el uso de electrobisturí y dispositivos similares?
• El uso de electrobisturí debe sujetarse a lo previsto por el fabricante.
• Los equipos de cirugía deben estar aislados de tierra
• El electrodo de retorno debe estar cercano al electrodo activo.
• Se recomienda el uso de la función de corte más que de coagulación, pues el uso de un voltaje alto en un ambiente cerrado puede ocasionar combustión.
• Ante el riesgo de combustión, no usar electro bisturí en áreas expuestas a soluciones inflamables. (Antisépticos en base a alcohol: povidona yodada, clorhexidina y tinturas con alcohol)
• El paciente debe ser aislado de partes metálicas y de la mesa de cirugía.
• La placa de retorno debe ser ubicada lo más cerca del campo quirúrgico y en un área grande con buena masa muscular.
• La zona de ubicación de la placa debe estar seca y limpia, preferiblemente sin vellos.
• La placa o electrodo de retorno es un dispositivo de un solo uso, por lo que, para evitar posibles complicaciones como quemaduras, no debe ser reutilizado.
• Verificar que, tanto el cable de alimentación como del electrodo y el lápiz, no presenten torceduras o se encuentren expuestos.
• En el momento del uso del electrobisturí se debe utilizar la potencia más baja posible para llevar a cabo el procedimiento.
• Mantener lo más lejos posible los electrodos de ECG del campo quirúrgico para evitar la circulación de corrientes de fuga.
• Asegurarse que no ingresen líquidos o fluidos entre la placa y el paciente antes oO durante el procedimiento quirúrgico.
• Verificar antes de cada uso el estado del cable de placa, así como el sistema de alarma visual y auditiva de los equipos, que se activa cuando la placa de retorno no hace buen contacto o está ausente.
¿Conoces que significan los símbolos en la etiqueta de los dispositivos médicos?
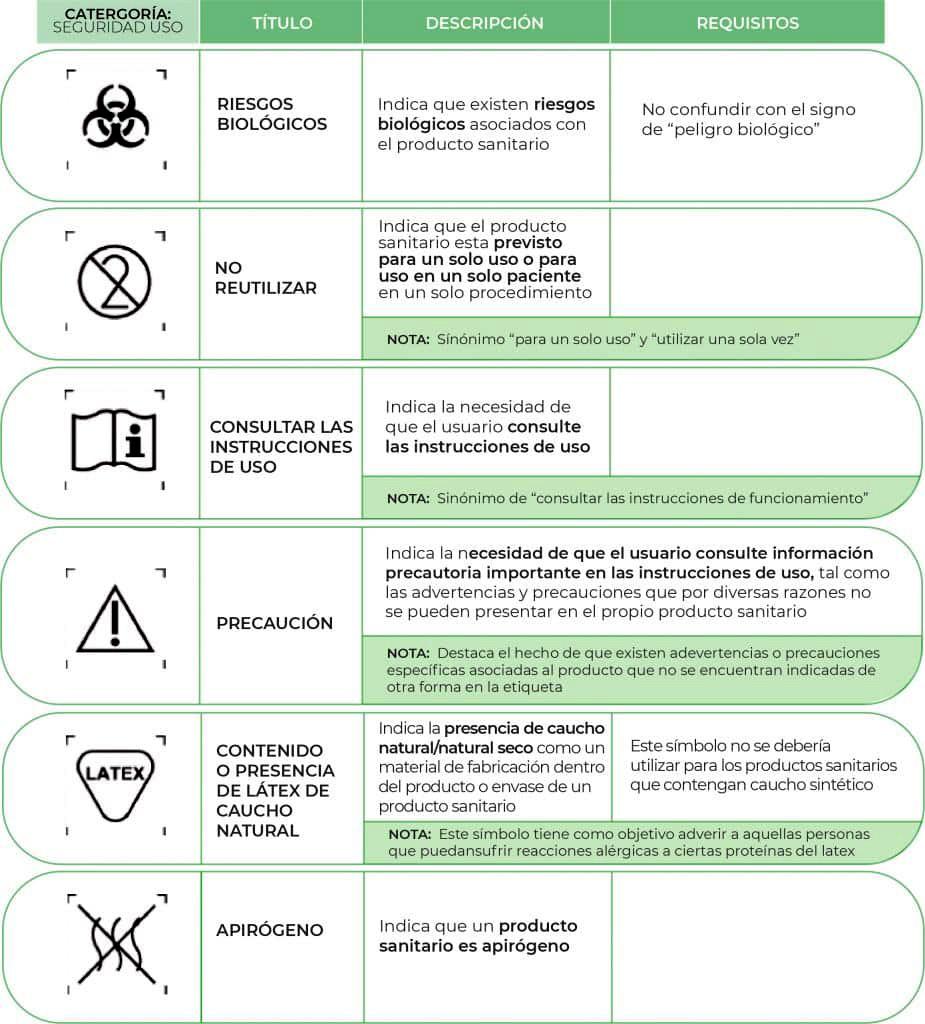
Dispositivos Médicos: Uso seguro.
Seguridad en el uso
de Reactivos de Diagnóstico In Vitro
¿Sabes qué es un Reactivo de Diagnóstico In Vitro?
Es un producto reactivo, calibrador, elaborado en material de control, destinado por el fabricante a ser utilizado in vitro para el estudio de muestras procedentes del cuerpo humano.
La clasificación de los reactivos de diagnóstico in vitro se basa en el riesgo sanitario.
Categoría I:
• Medios de cultivo
• Componentes de reposición de un estuche Materiales colorante
• Soluciones diluyentes
• Tampones y lisantes
• Soluciones de lavado.
Categoría III: Categoría II:
• Usados para el tamizaje de enfermedades transmisibles en donantes de sangre, componentes sanguíneos, tejidos y órganos para trasplante.
• Usados para asegurar compatibilidad inmunológica de sangre, tejidos y órganos para trasplante.
• Usados para diagnóstico de enfermedades transmisibles.
• Biología Molecular
• Endocrinología
• Tóxico-Farmacología
• Química sanguínea
• Hematología
• Inmunología
• Microbiología
• Coproparasitología
• Coagulación
• Gases sanguíneos
• Uroanálisis
• Células de rastreo de inmunohematología
• Pruebas de auto diagnóstico y autocontrol
Algunas situaciones que podemos reportar en Almera:
DEFECTOS DE CALIDAD DEL PRODUCTO FALLAS DEL DESEMPEÑO
• Humedad.
• Daños en los empaques.
• Etiquetado incorrecto e inconsistente en los diferentes empaques del producto.
• Falta de inserto o que el mismo no se encuentre en idioma castellano.
• Productos abiertos, con derrames, abolladuras.
Haz parte de la vigilancia:
• Falsos positivos y negativos que llegaron a menos del paciente.
• Percistencia en errores sistemáticos y/o aleatorios.
• Los medicamentos que están rotulados en la etiqueta o en el vial con indicación administración solo por vía intravenosa (autorizados por el INVIMA), solo deben ser administrados por esta vía, evitar prescribir o administrar por otra vía. Aplica además para los medicamentos con indicación de administración solo intramuscular.
• La indicación del uso de los dispositivos médicos y los Reactivos de diagnóstico in vitro son propuestos por el fabricante, es decir, para su utilización se deben seguir las instrucciones contenidas en su ficha técnica o injerto.
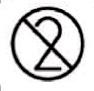
• Algunos Dispositivos Médicos en su etiqueta se encuentran marcados con el símbolo de “un solo uso”. Estos Dispositivos Médicos NO se deben reutilizar.
Actualmente en la institución no contamos con políticas de reuso de Dispositivos Médicos.
Bibliografía:
Instituto Nacional de Vigilancia de Medicamentos y Alimentos - Invima. (2025, 29 julio). https://www.invima.gov.co/
MEJORAR LA SEGURIDAD EN LA UTILIZACIÓN DE MEDICAMENTOS. Gov.co. Recuperado el 29 de julio de 2025, de https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/ RIDE/DE/CA/seguridad-en-la-utilizacion-de-medicamentos.pdf
Seguridad del Paciente - Uso seguro del medicamento. (s/f). Gob.es. Recuperado el 29 de julio de 2025, de https://seguridaddelpaciente.sanidad.gob.es/practicasSeguras/ usoSeguroMedicamentos/home.htm
de Diagnóstico In Vitro

