




Para prevenir o reducir los eventos adversos o incidentes adversos en los pacientes asociados al uso de Medicamentos, Dispositivos Médicos o Reactivos de Diagnóstico in vitro, es fundamental contar con mecanismos que permitan evaluar y controlar su seguridad una vez comercializados.
En nuestra institución, el Servicio Farmacéutico lidera los programas de Farmacovigilancia, Tecnovigilancia y Reactivovigilancia, los cuales garantizan un monitoreo constante para minimizar riesgos y mejorar la seguridad en el uso de estos productos.
A través de este boletín, buscamos difundir los conceptos clave de estos programas entre todos los miembros de la Fundación Colombiana de Cancerología Clínica Vida, fomentando su participación activa en la vigilancia y el reporte de eventos e incidentes. Asumir una co-responsabilidad en la gestión de estos riesgos es clave para garantizar una atención más segura para nuestros pacientes.
Este canal seguirá ofreciendo información relevante sobre la gestión de estos programas, seguridad del paciente, alertas sanitarias e informes de seguridad, entre otros temas de interés.
Gabriel Agudelo Suárez
Químico farmacéutico
coordinador Servicio
Farmacéutico
Andrés Camilo Rojas Maldonado
Químico Farmacéutico
Asistencial
Ambulatoria Sede 80 / Sede Conquistadores
Erika Jiménez Hernández
Química Farmacéutica
Asistencial
Ambulatoria Sede 80 / Sede Poblado
Juan Fernando Agudelo
Químico Farmacéutico
Asistencial
Ambulatoria Sede 80 / Sede Yolombó
Carlos Lizarazo
Químico Farmacéutico
Asistencial
Sede Caucasia
Katya Luz Arroyo Moreno
Química Farmacéutica
Asistencial
Hospitalización Sede 80
Gloria Mercedes Suárez Moreno
Química Farmacéutica
Asistencial
Hospitalización Sede 80
Stefanie Henao Castro
Química Farmacéutica
Asistencial
Ambulatoria Sede 80
Es la ciencia y las actividades relativas a la detección, evaluación, comprensión y prevención de los efectos adversos de los medicamentos o cualquier otro Problema Relacionado con los Medicamentos (PRM).
• Reacción Adversa a Medicamentos (RAM):
Los PRM pueden ser: Ejemplos de errores de medicación (evitable):
Es una reacción nociva y no deseada que se presenta tras la administración de un medicamento, a dosis utilizadas habitualmente.
• Fallo terapéutico:
Inefectividad terapéutica de un medicamento.
• Error de Medicación:
Acontecimiento que puede evitarse y que es causado por una utilización inadecuada de un medicamento pudiendo producir lesión a un paciente.
• El objetivo de la FV es Vigilar la seguridad, efectividad y calidad de los medicamentos durante la etapa de comercialización.
• La FV es fundamental para que el país determine realmente el perfil de seguridad de los medicamentos que son comercializados.
Resolución 1403 de Mayo 14 de 2007
Circular externa 3000-0471-2021

Almacenamiento

Administración
Prescripción

Dispensación

Es el conjunto de actividades que tienen por objeto la identificación y la cualificación de eventos e incidentes adversos producidos con los Dispositivos Médicos o Equipos Biomédicos, así como la identificación de los factores de riesgo asociados a estos. Es un sistema de vigilancia post-mercado.
¿Qué se entiende por dispositivos médicos?
Es cualquier instrumento, aparato, máquina, software, equipo biomédico u otro artículo similar o relacionado, utilizado sólo o en combinación, incluyendo sus componentes, partes, accesorios y programas informáticos que intervengan en su correcto uso.
Dispositivo médicos estándar y Biomédico
Dispositivo médicos sobre medida
Catéteres centrales

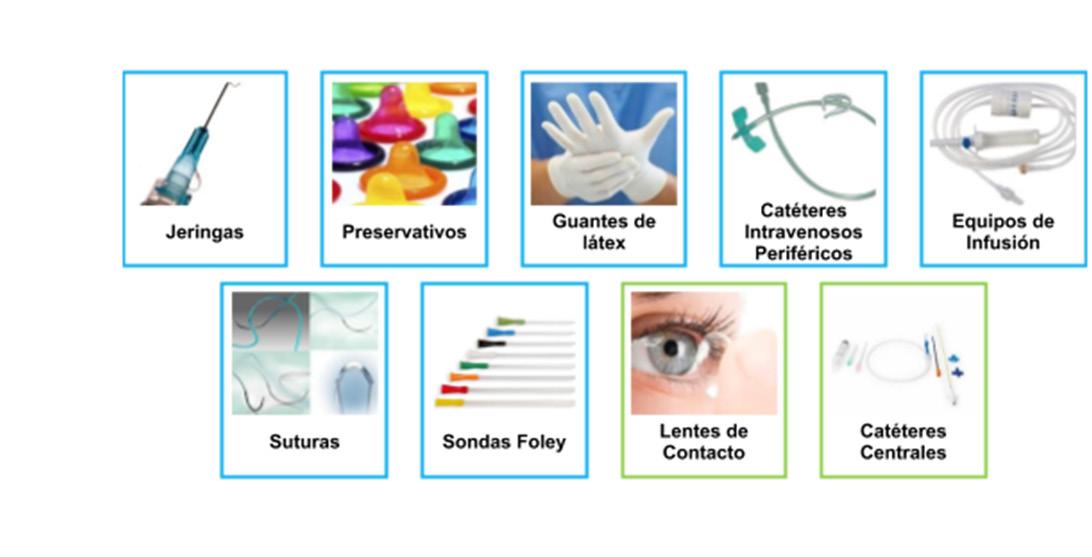
Ejemplos de dispositivos médicos
Guantes de látex

Catéteres intravenosos periféricos

Jeringas Preservativos
Equipos de infusión
Sondas Foley






Es el conjunto de actividades que tiene por objeto la identificación y cualificación de los efectos indeseados: eventos e incidentes adversos, asociados al uso de los reactivos de diagnóstico in vitro, así como a la identificación de los factores de riesgo o características que puedan estar relacionadas con estos. Es un sistema de vigilancia post-mercado.
¿Qué es un Reactivo de Diagnóstico in vitro?
Es un producto reactivo, calibrador, elaborado en material de control, utilizado sólo o en asociación con otros, destinado por el fabricante a ser utilizado in vitro para el estudio de muestras procedentes del cuerpo humano, incluidas las donaciones de sangre, órganos y tejidos.

Medios de cultivo, soluciones de lavado, materiales colorantes, soluciones diluyentes, tampones y lisantes, entre otros.
Química sanguínea, Hematología, Inmunología, Microbiología, Coagulación, Endocrinología, Coproparasitología, Uroanálisis entre otros.
Usados para el tamizaje de enfermedades transmisibles en donantes de sangre, componentes sanguíneos y demás tejidos y órganos para trasplante, diagnóstico de enfermedades transmisibles de alto riesgo de peligrosidad vida.
Decreto 3770 del 12 de Noviembre de 2004
Resolución 2013038979 del 26 de Diciembre de 2013
Daño no intencionado al usuario, paciente o al medio ambiente que ocurre como consecuencia de la utilización de un medicamento, dispositivo médico o reactivo.
Potencial daño no intencionado al usuario, paciente o al medio ambiente que podría ocurrir como consecuencia de la utilización de un medicamento, dispositivo médico o reactivo.
Los programas de Farmacovigilancia, Tecnovigilancia y Reactivovigilancia incluye la participación de todos los actores de la institución (médicos, enfermeras, farmacéuticos, técnicos auxiliares, etc.) involucrados en el uso de los medicamentos, dispositivos médicos y Reactivo de Diagnóstico in vitro.

¿Qué reportar y cómo hacerlo en VITOREPORTA?
¿Qué notificar?
Toda sospecha de problemas relacionado con los medicamentos, eventos e incidentes adversos con los dispositivos médicos y reactivos de diagnóstico in vitro, el cual se debe realizarse por medio de la plataforma institucional VITOREPORTA
¿Cómo realizar el reporte de eventos adversos en VITOREPORTA?
Ruta: Red - Aquiles - Compartidas - VITO REPORTA - VITO
1.
Ingreso a la Ruta VITO
2.
Iniciar un reporte
3.
Esta es nuestra plataforma

4.
Información que debemos incluir en la descripción

Se requiere que la descripción cumpla con tres criterios fundamentales:
• ¿Cuándo ocurrió?: antes, durante o después del uso del medicamento, dispositivo médico o reactivo.
• ¿Qué ocurrió? ¿Qué le sucedió al paciente durante el evento o incidente?
• Describir el estado clínico del paciente.
5.
6.
Información adicional
Todo PRM, evento o incidente adverso con dispositivos médicos o reactivos de diagnóstico, se debe consignar en historia clínica.
Si es una falla de calidad o mal funcionamiento de dispositivos o equipos biomédicos favor conservar una imagen y suministrar al servicio farmacéutico.
Acciones tomadas

Se debe informar las acciones que se realizaron inmediatamente materializado el evento
7.
Información del reportante


8.
Datos asociado a medicamento, dispositivos o reactivos

Esta información NUNCA debe ser omitida ya que generaría que el reporte sea anulado.
9.
Enviar...
Farmacovigilancia, Tecnovigilancia y Reactivovigilancia
• Análisis de eventos adversos y su respectivo reporte
Gestión de todos los reportes asociados a los Problemas Relacionados con Medicamentos (PRM), eventos e incidentes con dispositivos médicos y reactivos de diagnóstico, notificados por los diferentes actores por medio de vitoreporta, con el fin de conocer cuáles son los problemas de seguridad que se relacionan con determinado insumo y así poder tomar medidas y/o acciones pertinentes a las que haya lugar para minimizar o controlar los riesgos.
1
Identificar
Prevenir
Intervenir
5
2
3 4
Reportar
Gestión y Análisis
• Gestión de alertas e informes de seguridad
Una de las funciones destacadas de nuestros programas es Identificar, gestionar y comunicar las alertas sanitarias e informes de seguridad emitidas por INVIMA que tienen aplicabilidad en el país. Estas son notificadas a través de los líderes de cada área por medio de correo electrónico.

• Comités FV, TV, RV
Se muestra Consolidado de los reportes de eventos e incidentes relacionados con los medicamentos, dispositivos médicos y reactivos in vitro en la institución, identificando los problemas de seguridad subyacentes de los casos, y así poder establecer las estrategias necesarias para garantizar su uso correcto y seguro.
Toma de decisiones de tipo educativo, administrativo o sanitario encaminadas a reducir los riesgos detectados.
• Estrategias para el Uso Seguro de Medicamentos, educaciones, capacitaciones
Esperamos que esta información nos ayude a fortalecer los diferentes programas asistenciales.
