5.2 Módulo 3. Nombres para las fórmulas de los compuestos iónicos (cubre los conceptos en esta sección).
Módulo 4. El mol (cubre los conceptos en esta sección).
Módulo 5. Predicción de la solubilidad en agua de los compuestos iónicos comunes (cubre los conceptos en esta sección).
Módulo 6. Escritura de ecuaciones iónicas netas (cubre los conceptos en esta sección).
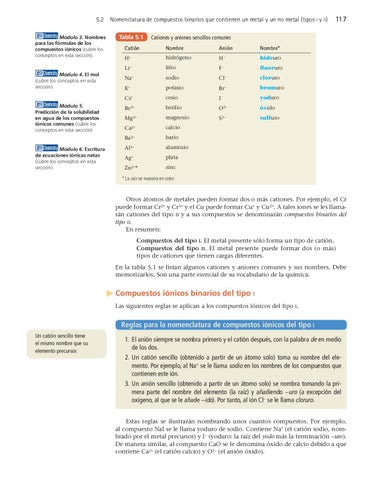
Nomenclatura de compuestos binarios que contienen un metal y un no metal (tipos I y II) Tabla 5.1
117
Cationes y aniones sencillos comunes
Catión
Nombre
Anión
Nombre*
H+
hidrógeno
H−
hidruro
Li+
litio
F−
fluoruro
Na+
sodio
Cl−
cloruro
K+
potasio
Br−
bromuro
Cs+
cesio
I−
yoduro
Be2+
berilio
O2−
óxido
Mg2+
magnesio
S2−
sulfuro
Ca2+
calcio
Ba2+
bario
Al3+
aluminio
Ag+
plata
Zn2+*
zinc
* La raíz se muestra en color.
Otros átomos de metales pueden formar dos o más cationes. Por ejemplo, el Cr puede formar Cr2+ y Cr3+ y el Cu puede formar Cu+ y Cu2+. A tales iones se les llamarán cationes del tipo II y a sus compuestos se denominarán compuestos binarios del tipo II. En resumen: Compuestos del tipo I. El metal presente sólo forma un tipo de catión. Compuestos del tipo II. El metal presente puede formar dos (o más) tipos de cationes que tienen cargas diferentes. En la tabla 5.1 se listan algunos cationes y aniones comunes y sus nombres. Debe memorizarlos. Son una parte esencial de su vocabulario de la química.
Compuestos iónicos binarios del tipo I Las siguientes reglas se aplican a los compuestos iónicos del tipo I.
Reglas para la nomenclatura de compuestos iónicos del tipo I Un catión sencillo tiene el mismo nombre que su elemento precursor.
1. El anión siempre se nombra primero y el catión después, con la palabra de en medio de los dos. 2. Un catión sencillo (obtenido a partir de un átomo solo) toma su nombre del elemento. Por ejemplo, al Na+ se le llama sodio en los nombres de los compuestos que contienen este ión. 3. Un anión sencillo (obtenido a partir de un átomo solo) se nombra tomando la primera parte del nombre del elemento (la raíz) y añadiendo −uro (a excepción del oxígeno, al que se le añade −ido). Por tanto, al ión Cl− se le llama cloruro. Estas reglas se ilustrarán nombrando unos cuantos compuestos. Por ejemplo, al compuesto NaI se le llama yoduro de sodio. Contiene Na+ (el catión sodio, nombrado por el metal precursor) y I− (yoduro: la raíz del yodo más la terminación −uro). De manera similar, al compuesto CaO se le denomina óxido de calcio debido a que contiene Ca2+ (el catión calcio) y O2− (el anión óxido).