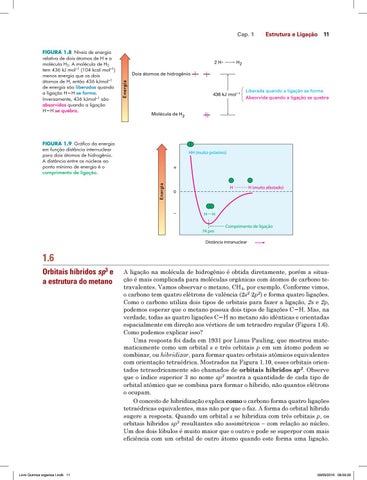
Cap. 1 Estrutura e Ligação 11
2H
H2
Dois átomos de hidrogênio Energia
FIGURA 1.8 Níveis de energia relativa de dois átomos de H e a molécula H2. A molécula de H2 tem 436 kJ mol–1 (104 kcal mol–1) menos energia que os dois átomos de H, então 436 kJmol–1 de energia são liberados quando a ligação HH se forma. Inversamente, 436 kJmol–1 são absorvidos quando a ligação HH se quebra.
436 kJ mol 1
Liberada quando a ligação se forma Absorvida quando a ligação se quebra
Molécula de H2
FIGURA 1.9 Gráfico da energia em função distância internuclear para dois átomos de hidrogênio. A distância entre os núcleos ao ponto mínimo de energia é o comprimento de ligação.
HH (muito próximo)
Energia
+ H
0
–
H
H (muito afastado)
H
74 pm
Comprimento de ligação
Distância intranuclear
1.6 Orbitais híbridos sp3 e a estrutura do metano
Livro Quimica organica I.indb 11
A ligação na molécula de hidrogênio é obtida diretamente, porém a situação é mais complicada para moléculas orgânicas com átomos de carbono tetravalentes. Vamos observar o metano, CH4, por exemplo. Conforme vimos, o carbono tem quatro elétrons de valência (2s2 2p2) e forma quatro ligações. Como o carbono utiliza dois tipos de orbitais para fazer a ligação, 2s e 2p, podemos esperar que o metano possua dois tipos de ligações CH. Mas, na verdade, todas as quatro ligações CH no metano são idênticas e orientadas espacialmente em direção aos vértices de um tetraedro regular (Figura 1.6). Como podemos explicar isso? Uma resposta foi dada em 1931 por Linus Pauling, que mostrou matematicamente como um orbital s e três orbitais p em um átomo podem se combinar, ou hibridizar, para formar quatro orbitais atômicos equivalentes com orientação tetraédrica. Mostrados na Figura 1.10, esses orbitais orientados tetraedricamente são chamados de orbitais híbridos sp3. Observe que o índice superior 3 no nome sp3 mostra a quantidade de cada tipo de orbital atômico que se combina para formar o híbrido, não quantos elétrons o ocupam. O conceito de hibridização explica como o carbono forma quatro ligações tetraédricas equivalentes, mas não por que o faz. A forma do orbital híbrido sugere a resposta. Quando um orbital s se hibridiza com três orbitais p, os orbitais híbridos sp3 resultantes são assimétricos – com relação ao núcleo. Um dos dois lóbulos é muito maior que o outro e pode se superpor com mais eficiência com um orbital de outro átomo quando este forma uma ligação.
09/05/2016 08:59:26