

Química USAC 2022
Grupo Editorial

Profesorado de Enseñanza Media en Pedagogía y Ciencias Naturales con Orientanción Ambiental
Coatepeque, Quetzaltenango, Mayo 2022

Universidad de san Carlos de Guatemala
Facultad de Humanidades
Departamento De Pedagogía
Curso: Química
Catedrático: Abner Samuel Cifuentes De León
Carrera: PEM. En Pedagogía Y Ciencias Naturales
Con Orientación Ambiental.
Diagramador: Nancy Fabiola Bámaca Pérez


Integrantes de grupo

Estudiante: Reg. Académico:
1 Alma Dalila López Rodas. 201516069
2 Brenda Roxana Elías García 201860052
3 Kimberly Analy González Gómez 201860145
4 Nancy Fabiola Bámaca Pérez 201706113

Estudio de la Química
La química tiene como objetivo difundir los principales avances científicos en química y áreas afines sin necesidad de tener una formación científica completa y puede lograr conocer los descubrimientos más destacados de estas ciencias.
No se aceptan trabajos de investigación experimental, pero sí trabajos de revisión que hayan sido escritos con objeto de divulgación.
La química es la ciencia que estudia tanto la composición, estructura y propiedades de la materia como los cambios que ésta experimenta durante las reacciones químicas.
La química se lleva o se practica en cada una de las demás ciencias ya que todas se tienen que llevar a la práctica y a la elaboración de procesos tanto químicos como prácticos, no hay nada material que pueda existir sin químicos y establece diseños de reacciones que conviertan las sustancias que satisfagan nuestras necesidades; entonces la química estudia los cambios físicos y químicos que tiene la materia así como las reacciones químicas que ocurren en ella.
Las disciplinas de la química se han agrupado según la clase de materia bajo estudio o el tipo de estudio realizado entre éstas se tienen la química inorgánica que estudia la materia inorgánica; la química orgánica que trata con la materia orgánica; la bioquímica el estudio de sustancias en organismos biológicos.
La química es considerada una ciencia central pues es esencial tener un conocimiento químico básico ya que es fundamental para toda aquella persona que estudia biología, física, geología, ecología y otras disciplinas; ya que todo está hecho de materia y es necesario conocer sus propiedades y los cambios que en ella ocurren.


Por: Alma Dalila López Rodas



Historia de la Química
La historia de la química abarca un periodo de tiempo muy amplio que ya desde la prehistoria hasta el presente y está ligada al desarrollo cultural de la humanidad y su conocimiento de la naturaleza; las civilizaciones antiguas ya usaban tecnologías que demostraban su conocimiento de las transformaciones de la materia y algunos servirían en base a los primeros estudios de la química. Entre ellas se encuentran la extracción de los metales de sus minas, la elaboración de aleaciones como el bronce y la fabricación de tejidos rojos cerámica, esmaltes y vidrio, las fermentaciones de la cerveza y del vino, la extracción de sustancias de las plantas para usarlas como medicinas o perfumes y la transformación de las grasas en jabón. Entonces en el desarrollo de la química se identifican los siguientes periodos: prehistoria y antigüedad, griego, alquimia, la iatriquímica, flogisto y moderno.
Prehistoria: Este periodo corresponde a la edad de piedra, el descubrimiento del fuego le permite defenderse de depredadores, protegerse del fuego le permite cocinar y transformar los materiales.
Antigüedad: En la antigüedad no hay realidad química científica solo es empírica más que una ciencia era un arte, una de las características de la antigüedad es la de un complejo filosófico-religioso-técnico. (Interpretaciones fantásticas entre lo racional y lo incoherente).
Hipótesis atómica: Los filósofos griegos discuten mucho sobre la naturaleza de la materia y concluyeron que el mundo era más sencillo de lo que parecía.
Alquimia: Es un conjunto de especulaciones y experiencias generalmente de carácter esotérico, relativas a las transmutaciones de la materia y que influyó en el origen de las ciencias químicas. Tenía dos metas fundamentales.
1. Transmutación de metales comunes en oro o plata.
2. Encontrar medios que prolongaran definitivamente la vida humana.

Por: Brenda Roxana Elías García


Definición y concepto de la Química
La química es la ciencia que estudia la composición, estructura y propiedades de la materia, incluyendo su relación con la energía y también los cambios que pueden darse en ella a través de las llamadas reacciones. Es la ciencia que estudia las sustancias y las partículas que las componen, así como las distintas dinámicas que entre éstas pueden darse.
La química es una de las grandes ciencias contemporáneas, cuya aparición revolucionó el mundo para siempre. Esta ciencia ha ofrecido explicaciones funcionales y comprobables para la compleja conducta de los materiales conocidos, capaces de explicar tanto su permanencia como sus cambios. Por otro lado, los conocimientos químicos están presentes en la vida cotidiana, en la medida en que empleamos sustancias naturales y creamos otras artificiales. Procesos como la cocción, la fermentación, la metalurgia, la creación de materiales inteligentes e incluso muchos de los procesos que tienen lugar en nuestros cuerpos, pueden ser explicados a través de una perspectiva química (o bioquímica).
Por otro lado, el dominio de la química permitió el surgimiento de la industria: la transformación de materiales a voluntad del hombre para crear objetos útiles (o los materiales necesarios para fabricarlos). En ese sentido, se trata de una de las ciencias que mayor impacto ha tenido en el mundo y en la historia de la humanidad.
La química se encuentra presente en la gran mayoría de los procesos industriales, así como en aspectos muy cotidianos de nuestra vida. Gracias a ella hemos desarrollado materiales complejos adaptados a nuestras diversas necesidades a lo largo de la historia.
Desde las aleaciones metálicas, hasta los compuestos farmacológicos o los combustibles para impulsar nuestros medios de transporte, el conocimiento de las reacciones químicas ha sido fundamental.
De hecho, gracias a la química hemos modificado el mundo a nuestro alrededor, para bien y para mal.
Por otro lado, probablemente la química nos brindará el conocimiento para enmendar los daños producidos al ecosistema a lo largo de nuestra historia.


Por: Brenda Roxana Elías García


Enfoque científico de la Química
El enfoque científico puede describirse en términos de cierto número de características. En primer lugar, es un proceso sistemático, disciplinado y controlado. Los científicos fundan sus descubrimientos en observaciones empíricas, lo cual significa que las pruebas están arraigadas en la realidad objetiva y se compitan a través de los sentidos humanos o por sus extensiones. A diferencia de muchas otras técnicas para resolver preguntas, el enfoque científico pretende ser general e intenta establecer explicaciones conceptuales o teorías referentes a las relaciones entre fenómenos.
La investigación científica puede clasificarse en términos de sus funciones u objetivo. Las metas más corrientes de la investigación son descripción, exploración, explicación, predicción y control de los fenómenos.
También es posible describir la investigación en términos de la utilidad práctica directa que aspira lograr. La investigación básica se dedica a ampliar la base de conocimientos en una disciplina en aras del conocimiento mismo. La investigación aplicada se enfoca en describir soluciones para problemas prácticos inmediatos.
Al tratar seres humanos en situaciones de investigación, han de plantearse algunos temas éticos. Tres requisitos éticos comunes son: participación voluntaria, libertad de daño y molestia física o psicológica y anonimato o carácter confidencial de la información.
La ética en la investigación es una preocupación constante y desorientadora, pues sus exigencias a menudo están en conflicto con las necesidades científicas. El investigador necesita adquirir gran seriedad en cuanto a las consideraciones éticas.


Por: Kimberly Analy González Gómez


De la hipótesis a la teoría (método científico)
Una teoría es un sistema lógico-deductivo (o inductivo) constituido por un conjunto de hipótesis, un campo de aplicación (de lo que trata la teoría, el conjunto de cosas que explica) y algunas reglas que permitan extraer consecuencias de las hipótesis.
Una hipótesis puede usarse como una propuesta provisional que no se pretende demostrar estrictamente, o puede ser una predicción que debe ser verificada por el método científico. En el primer caso, el nivel de veracidad que se otorga a una hipótesis dependerá de la medida en que los datos empíricos apoyan lo afirmado en la hipótesis. Esto es lo que se conoce como contrastación empírica de la hipótesis o bien proceso de validación de la hipótesis. Este proceso puede realizarse mediante confirmación (para las hipótesis universales) y o mediante verificación (para las hipótesis existenciales).
Se expone a diversas pruebas (experimentales o empíricas) con el objeto de comprobarla. Por medio de la comprobación (experimental o empírica), la hipótesis se comprueba, rechaza o reformula. Cuando una hipótesis se comprueba se convierte en teoría científica.



Por: Nancy Fabiola Bámaca Pérez


Materia y sus estados
Los estados de la materia son las diversas formas en que se presenta la materia en el universo. Se conocen también como estados de agregación de la materia, ya que las partículas se agregan o agrupan de maneras diferentes en cada estado.
Se puede considerar que existen cuatro estados fundamentales de la materia, tomando en cuenta aquellas formas de agregación que se presentan bajo condiciones naturales. Los estados fundamentales de la materia son:
Estado sólido.
Estado líquido.
Estado gaseoso.
Estado plasmático.
Sin embargo, los estudios sobre los estados de agregación de la materia se han extendido en la actualidad. Además de aquellos que se presentan naturalmente, hoy se estudian aquellos que se presentan en condiciones extremas, inducidas en laboratorio. De este grupo, los científicos han comprobado la existencia de tres nuevos estados: el condensado de Bose-Einstein (BEC); el condensado de Fermi y el supersólido.
Las características de los estados de la materia dependen de la fuerza de atracción entre las partículas y su movilidad. La temperatura y/o la presión son los factores que afectan cómo se agrupan dichas partículas y cómo interactúan entre sí.
Cuando hay alteraciones sensibles en las variables de temperatura y/o presión, se producen cambios de un estado de la materia al otro. Estos cambios son solidificación, vaporización, fusión, sublimación, sublimación inversa, ionización y desionización.
Estado sólido
El estado sólido es aquel que percibimos como materia fija, la cual se resiste a los cambios de forma y volumen. En la materia en estado sólido, las partículas tienen mayor atracción entre ellas, lo que reduce su movimiento y las posibilidades de interacción. Por ejemplo: rocas, madera, utensilios de metal, vidrio, hielo y grafito, entre otros.
Las características del estado sólido son:
La fuerza de atracción entre las partículas individuales es mayor que la energía que causa separación.
Las partículas se encierran en su posición limitando su energía vibracional.
Mantiene su forma y volumen.

Estado líquido
El estado líquido corresponde a los fluidos cuyo volumen es constante, pero se adapta a la forma de su contenedor. Por ejemplo: agua, bebidas refrigerantes, aceite y saliva.
Las características del estado líquido son:
Las partículas se atraen entre sí, pero la distancia es mayor que en los sólidos.
Las partículas son más dinámicas que los sólidos, pero más estables que los gases.
Tiene un volumen constante.
Su forma es indefinida. Por ende, el líquido toma la forma de su contenedor.
Estado gaseoso
El estado gaseoso corresponde a los gases. Técnicamente se define como el agrupamiento de partículas con poca atracción entre sí que, al chocar unas con otras, se expanden en el espacio. Por ejemplo: vapor de agua, oxígeno (O2) y gas natural.
Las características del estado gaseoso son:
Concentra menos partículas que los sólidos y los líquidos.
Las partículas tienen poca atracción entre sí.
Las partículas se encuentran en expansión, por lo cual son más dinámicas que los sólidos y los gases.
No tiene forma ni volumen definido.
Estado plasmático
El estado plasmático es un estado semejante al gaseoso, pero posee partículas cargadas eléctricamente, es decir, ionizadas. Se trata, pues, de gases calientes. La materia en estado plasmático es muy común en el espacio sideral y constituye, de hecho, el 99% de su materia observable. Sin embargo, el estado plasmático también se reproduce naturalmente en algunos fenómenos terrestres. Asimismo, se puede producir artificialmente para diversos usos. Por ejemplo, hay plasma en el sol, las estrellas y las nebulosas. También está presente en las auroras polares, en los rayos y en el llamado Fuego de San Telmo. En cuanto a su producción artificial, algunos ejemplos son los televisores de plasma, los tubos fluorescentes y las lámparas de plasma.
Las características del estado plasmático son:
Carece de forma y volumen definidos.
Sus partículas están ionizadas.
Carece de equilibrio electromagnético.
Es buen conductor eléctrico.
Forma filamentos, capas y rayos cuando se expone a un campo magnético.

Cambios de estados de la materia
Los cambios de estados de la materia son procesos que permiten que la estructura espacial de la materia cambie de un estado a otro. Dependen de las variaciones en las condiciones ambientales como la temperatura y/o la presión.
Tomando en cuenta los estados fundamentales de materia, los cambios de estado de la materia son: solidificación, vaporización, fusión, sublimación, sublimación inversa, ionización y deionización.
Fusión o derretimiento. Es el cambio del estado sólido al estado líquido. Se produce cuando el sólido se expone a temperaturas más elevadas que de costumbre, hasta derretirse.
Solidificación. Es el cambio del estado líquido al estado sólido. Cuando la temperatura de un líquido desciende, las partículas comienzan a aproximarse entre sí y se reduce el movimiento entre ellas. Al llegar al punto de congelación, se convierten en materia sólida.
Vaporización. Es el cambio del estado líquido al estado gaseoso. Ocurre cuando se eleva la temperatura de manera sensible, lo que se rompe la interacción entre las partículas. Esto ocasiona su separación y el aumento de su movimiento, dando lugar a un gas.
Condensación. Es el cambio del estado gaseoso al estado líquido. Al bajar la temperatura y/o subir la presión, las partículas del gas pierden alguna movilidad y se aproximan entre sí.
Sublimación. Es el cambio del estado sólido al estado gaseoso sin pasar por el estado líquido. Se produce, por ejemplo, en las esferas de naftalina. Estas esferas que se usan para alejar las polillas de los armarios tienen la propiedad de desvanecerse solas con el tiempo. Esto significa que pasan del estado sólido al gaseoso sin pasar por el estado líquido.
Sublimación inversa. Se llama sublimación inversa, sublimación regresiva, deposición o cristalización al cambio del estado gaseoso al sólido de manera directa.
Ionización. Es el cambio de gas a plasma, el cual se produce cuando las partículas del gas son cargadas eléctricamente, lo cual es posible cuando se calienta un gas.
Desionización. Consiste en el paso del estado plasmático al estado gaseoso. Se trata, pues, del proceso contrario a la ionización.

Por: Alma Dalila López Rodas


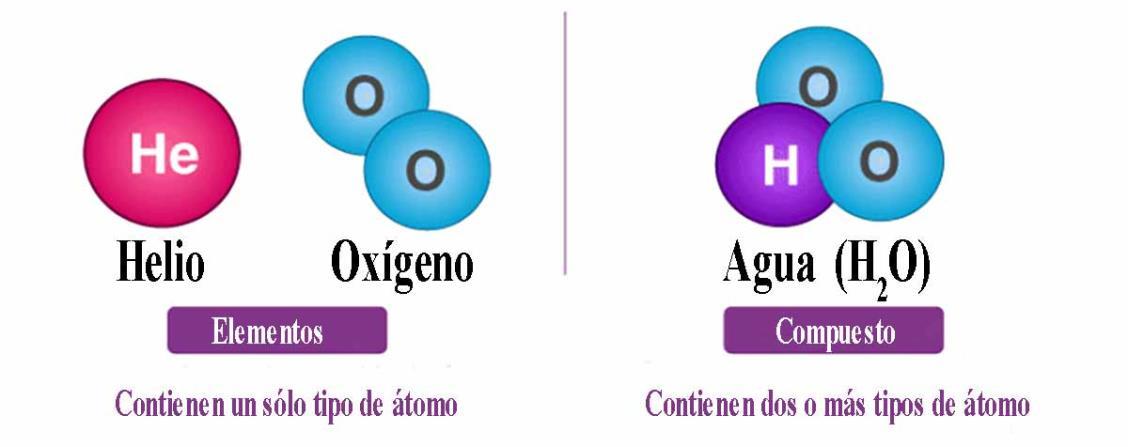
Elementos y compuestos
Elemento: Un elemento es un material compuesto de un simple tipo de átomo, un compuesto es una sustancia formada por dos o más elementos que se combinan químicamente y una mezcla es la combinación de sustancias, iguales o no, que pueden ser separadas por métodos físicos.
Tipos de elementos
Metales: son los elementos caracterizados por conducir la electricidad, ser maleables y mostrar brillo. Por ejemplo: el oro Au, el hierro Fe, el sodio Na.
No metales: son los elementos caracterizados por no ser buenos conductores de la electricidad, no magnéticos y no maleables. Ejemplo: el oxígeno O, el cloro Cl y el neón Ne.
Metaloides: aquellos elementos que presentan algunas características de los metales y no metales. Ejemplo: arsénico As, silicio Si, boro B.
Ejemplos de elementos
Carbono C
El carbono, cuyo símbolo es C, es el elemento clave de los compuestos orgánicos. Su número atómico es 6 y se encuentra también en el grafito y el diamante.
Hidrógeno H
El hidrógeno, cuyo símbolo es H, es el elemento más abundante en el Universo. Su número atómico es 1 y se encuentra en la naturaleza como un elemento diatómico H2
Compuesto: Un compuesto es una sustancia química pura formada por un conjunto particular de moléculas o iones que están unidos químicamente. Pueden ser:
compuestos moleculares unidos por enlaces covalentes;
sales unidas por enlaces iónicos;
compuestos metálicos con uniones metálicas; y
compuestos complejos.

Tipos de compuestos
Compuestos inorgánicos: son aquellos compuestos en cuya composición no existen enlaces entre carbonos. Ejemplo: agua H2O, ácido sulfúrico H2SO4, nitrato de plata AgNO3.
Compuestos orgánicos: son aquellos compuestos donde el carbono es el elemento base de la construcción de la molécula. Ejemplo: el etanol H3C-CH2OH, las proteínas y los carbohidratos.
Ejemplos de compuestos
Agua
El agua es un compuesto químico formado por la unión química de dos átomos de hidrógeno y un átomo de oxígeno H2O. El agua es el compuesto más indispensable para el mantenimiento de la vida sobre la faz de la Tierra.
Sal de mesa o cloruro de sodio
La sal que usamos en la cocina es el cloruro de sodio NaCl, que es un compuesto iónico, es decir, entre los elementos sodio y cloro se establecen enlaces iónicos, donde existe transferencia de electrones.
Glucosa
La glucosa, de fórmula C6H12O6, es un compuesto orgánico formado por carbono, hidrógeno y oxígeno. Se sintetiza en las plantas por el proceso de fotosíntesis y es empleado por los organismos heterótrofos como fuente de energía.
Por: Alma Dalila López Rodas

Sustancias puras y mezclas
Las sustancias puras pueden ser de dos tipos: elementos y compuestos
Elementos: Sustancias puras que no se pueden descomponer en otras más sencillas empleando métodos químicos. Son por ello, los constituyentes más sencillos de materia, que se ordenan en el Sistema Periódico y se representa cada uno con su símbolo químico: Sodio (Na), Calcio (Ca), Azufre (S) etc… También se pueden considerar elementos los sólidos formados por agrupaciones de átomos iguales: una porción de un metal, donde todos los átomos tiene las mismas características, por ejemplo el oro, o el ordenamiento de átomos de carbono en el diamante o en el grafito. Igualmente, las moléculas gaseosas formadas por la unión de átomos iguales como O2 (oxígeno gaseoso o molecular), O3 (ozono), Cl2 (cloro gaseoso o molecular)
Compuestos: Son sustancias puras formadas por dos o más elementos, siempre en la misma proporción y pueden descomponerse empleando métodos químicos. Se representan mediante fórmulas químicas. Ejemplos: Agua (H2O), azúcar (C6H12O6), sulfuro de hierro (II) (FeS).
Mezclas: Una mezcla es una porción de materia formada por dos o más componentes. Hay dos tipos de mezclas:
1. Mezclas homogéneas (o disoluciones): Se caracterizan por estar formadas por dos o más componentes que no se pueden distinguir visualmente. Las mezclas homogéneas presentan las mismas propiedades en todas sus partes. Ejemplo: Alcohol + agua; agua con sal disuelta.
2. Mezclas heterogéneas: Se caracterizan por estar formadas por dos o más porciones distinguibles a simple vista. En las mezclas heterogéneas, las propiedades varían de una parte a otra de la muestra. Ejemplo: Azúcar + arena; granito; agua y aceite. En general, los componentes de una mezcla homogénea o heterogénea, pueden hallarse en cualquier proporción, y se pueden recuperar empleando métodos físicos de separación.


Por: Brenda Roxana Elías García


Propiedades
Las propiedades de la materia son aquellas que definen las características de todo aquello que tiene masa y ocupa un volumen.
Es importante reconocer lo que es la propiedad de la materia, ya que está en todo lo que nos rodea, siendo la materia todo lo que ocupa un lugar en un espacio.
Las propiedades de la materia pueden ser generales o específicas.
Propiedadesgeneralesdelamateria
Las propiedades generales de la materia son aquellas características comunes a todos los cuerpos como lo son:
Masa: cantidad de materia que contiene un cuerpo.
Volumen o extensión: espacio que ocupa un cuerpo.
Peso: la fuerza que ejerce la gravedad sobre los cuerpos.
Porosidad: espacio que existe entre las partículas.
Inercia: característica que impide a la materia moverse sin intervención de una fuerza externa.
Impenetrabilidad: propiedad de que un cuerpo no pueda usar el espacio de otro cuerpo al mismo tiempo.
Divisibilidad: capacidad de la materia dividirse en partes más pequeñas. Es importante recalcar que la materia y sus propiedades estarán siempre afectadas por las fuerzas gravitatorias del medio en que se encuentran y por la fuerza de atracción entre las moléculas que la componen.
Propiedades específicas la materia
Las propiedades específicas la materia son las características que diferencian un cuerpo de otro y son agrupadas en:
Propiedades físicas: son aquellas que definen la estructura medible del objeto. Por ejemplo, el olor, la textura, el sabor, el estado físico, etc.
Propiedades químicas: son las propiedades que cada sustancia tiene con respecto a otras sustancias con la habilidad de crear otras nuevas. Por ejemplo, la combustibilidad, la oxidación, la reactividad, la afinidad electrónica, entre otros.
Cambios físicos
Los cambios físicos son transformaciones que pueden cambiar el estado de alguna agregación y el aspecto de cualquier material, pero nunca su naturaleza química (su compuesto). Los cambios físicos o métodos físicos, pueden usarse para separar los componentes de una mezcla formada por distintas sustancias químicas, pero no sirven para separar los componentes de uncompuestoensuselementos
Los cambios físicos son transformaciones que pueden cambiar el estado de alguna agregación y el aspecto de cualquier material, pero nunca su naturaleza química (su compuesto). Los cambios físicos o métodos físicos, pueden usarse para separar los componentes de una mezcla formada por distintas sustancias químicas, pero no sirven para separar los componentes de un compuesto en sus elementos
Un cambio físico es una transformación en la que no varía la naturaleza de la materia.
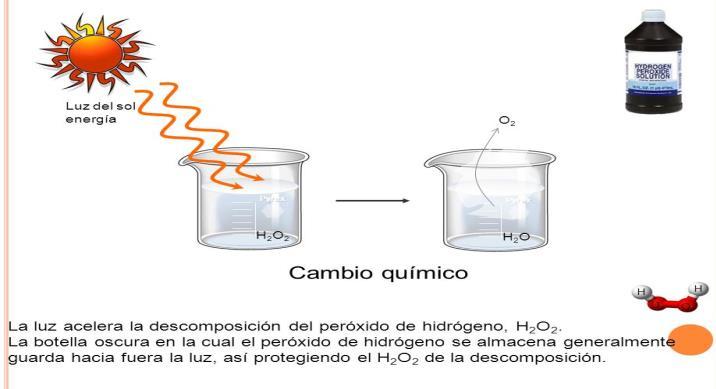
Cambio Químico
Un cambio químico es una transformación en la que varía la naturaleza de la materia. Durante una transformación química cambia la composición de la materia, sus componentes se reorganizan y se mezclan con otros nuevos originando sustancias con propiedades diferentes de las originales


Por: Brenda Roxana Elías García


Ley de conservación de la masa
La ley de conservación de la materia, conocida también como ley de conservación de la masa o simplemente como ley Lomonósov-Lavoisier (en honor a los científicos que la postularon), es un principio de la química que plantea que la materia no se crea ni se destruye durante una reacción química, solo se transforma.
Esto significa que las cantidades de las masas involucradas en una reacción determinada deberán ser constantes, es decir, la cantidad de reactivos consumidos es igual a la cantidad de productos formados, aunque se hayan transformado los unos en los otros.
Este principio fundamental de las ciencias naturales fue postulado por dos científicos de manera simultánea e independiente: el ruso Mijaíl Lomonósov en 1748 y el francés Antoine Lavoisier en 1785. Llama la atención que esto ocurriera antes del descubrimiento del átomo y la postulación de la teoría atómica, con la cual es mucho más sencillo explicar e ilustrar el fenómeno.
La excepción a la regla la constituyen las reacciones nucleares, en las que es posible convertir masa en energía y viceversa. Junto a la equivalencia entre masa y energía, la ley de la conservación de la materia fue clave para la comprensión de la química contemporánea.
Ejemplo
Un perfecto ejemplo de esta ley lo constituye la combustión de hidrocarburos, en la que puede verse al combustible arder y “desaparecer”, cuando en realidad se habrá transformado en gases invisibles y agua.
Por ejemplo, al quemar metano (CH4) tendremos la siguiente reacción, cuyos productos serán agua y gases invisibles, pero de una cantidad de átomos idéntica que los reactivos:


Por: Kimberly Analy González Gómez



Energía y cambio químico
Cuando una sustancia se transforma en otra, u otras, mediante una reacción química se rompen enlaces y se forman nuevos, de modo que se libera energía. A este tipo de energía la conocemos como energía química
La energía química es el potencial de una sustancia química para experimentar una transformación a través de una re acción química o, de transformarse en otras sustancias químicas. Formar o romper enlaces químicos implica energía Esta energía puede ser absorbida o evolucionar desde un sistema químico.
Los cambios químicos son un tipo de alteración en la materia que modifica su constitución química, o sea, que altera su naturaleza y no solamente su forma. Esto quiere decir que los cambios químicos, también llamados reacciones químicas o fenómenos químicos, implican ruptura y formación de los enlaces químicos de sustancias o compuestos químicos para formar nuevas sustancias o compuestos.
Las reacciones químicas ocurren cuando se combinan químicamente dos o más sustancias (llamadas reactivos o reactantes) que cambian su estructura química en el proceso, y pueden consumir (reacciones endotérmicas) o liberar (reacciones exotérmicas) energía, para generar dos o más sustancias nuevas (llamadas productos). Algunas reacciones químicas son peligrosas para el ser humano, pues pueden involucrar o producir compuestos tóxicos o corrosivos. Otras reacciones, como es el caso de ciertas reacciones exotérmicas, pueden provocar explosiones.
En la industria química se producen muchos materiales que usamos en la vida diaria mediante reacciones químicas controladas. Algunas reacciones ocurren de forma espontánea y otras deben ser generadas por el ser humano en plantas industriales o en laboratorios químicos.

Fotosíntesis y metabolismo
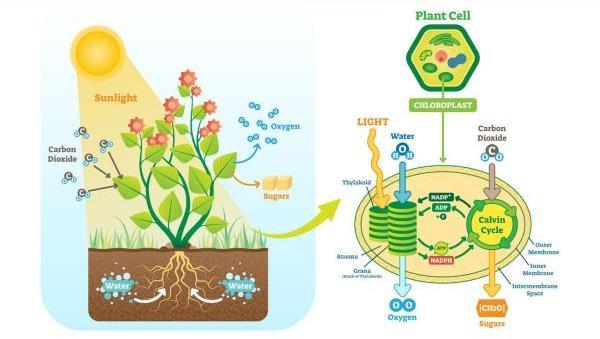
La fotosíntesis es el proceso químico que se produce en las plantas, las algas y algunos tipos de bacterias cuando se exponen a la luz del sol. Durante la fotosíntesis, el agua y el dióxido de carbono se combinan para formar carbohidratos (azúcares) y se desprende oxígeno. Para realizar la fotosíntesis, las plantas necesitan de la clorofila, que es una sustancia de color verde que tienen en las hojas. Las plantas son capaces de producir sus propios alimentos a través de un proceso químico llamado fotosíntesis. Para realizar la fotosíntesis las plantas disponen de un pigmento de color verde llamado clorofila que es el encargado de absorber la luz adecuada para realizar este proceso.
Fases de la fotosíntesis
Hay varias etapas de la fotosíntesis. Cuando nos referimos a la fotosíntesis de las plantas, que es lo más común, diferenciamos 4 etapas o fases principales: absorción, circulación, fotosíntesis y alimentación.
1) Absorción: en la etapa de absorción la planta absorbe agua y minerales del entorno, generalmente mediante sus raíces.
2) Circulación: en la etapa de circulación, los nutrientes absorbidos circulan a través del vegetal hasta las hojas, que es donde se realizar casi siempre la fotosíntesis.
3) Fotosíntesis: en la etapa propia de la fotosíntesis es donde se lleva a cabo el proceso de transformar agua, dióxido de carbono y luz en energía para la planta. Es un proceso muy complejo en el que pueden diferenciarse dos grandes fases de la fotosíntesis: la fase luminosa y la fase oscura. En la fase luminosa, la planta utiliza la energía lumínica para convertir las moléculas de CO2 y H2O en ATP, una unidad básica de energía bioquímica que todos los seres vivos usamos. Los responsables de esto son los cloroplastos, unos orgánulos que cuentan con su propio ADN y están presentes en todos los seres vivos capaces de llevar a cabo el proceso de fotosíntesis gracias a la clorofila que contienen, que les da a las plantas su color verde característico. Aquí puedes aprender más sobre Qué es la clorofila y sus tipos. En la fase oscura, el ATP producido en la fase luminosa se transforma en materia orgánica, en un proceso químico complejo que ya no necesita de luz.
4) Alimentación y crecimiento: por último, la planta usa los compuestos producidos para alimentarse y para producir nuevas estructuras y crecer.
Metabolismo
Las células individuales o agrupadas en algún tejido, nunca están aisladas, continuamente están intercambiando materia y energía con su alrededor o entorno. La materia y la energía que entran o que salen de la célula son o han sido transformadas en su interior, con el propósito de crear y mantener sus propias

estructuras y proporcionar la energía necesaria para sus actividades vitales. El conjunto de intercambios y transformaciones que tienen lugar en el interior de la célula, se realizan a través de procesos químicos catalizados por enzimas, los cuales constituyen el metabolismo celular. Entonces, se define el metabolismo como el conjunto de todas las reacciones químicas catalizadas por enzimas que ocurren en la célula. Es una actividad coordinada y con propósitos definidos en la que cooperan diversos sistemas multienzimaticos. En otras palabras es el proceso global que abarca la suma total de todas las reacciones enzimáticas que tienen lugar en la célula y en él participan muchos conjuntos enzimáticos mutuamente relacionados los cuales permiten el intercambio de materia y energía entre la célula y su entorno. El metabolismo se realiza a fin de cumplir con cuatro funciones específicas:
1) Obtener energía química del entorno, a partir de la luz solar o de la degradación de moléculas ricas en energía.
2) Transformar las moléculas nutrientes en precursores de las macromoléculas celulares.
3) Sintetizar las macromoléculas celulares a partir de los precursores.
4) Formar y/o degradar las biomoléculas necesarias para las funciones especializadas de las células (hormonas, neurotransmisores, etc.)....
Las distintas reacciones químicas del metabolismo que se agrupan con una determinada función se denominan vías o rutas metabólicas y las moléculas que en ellas intervienen se llaman metabolitos. Todas las reacciones del metabolismo están reguladas por enzimas, que son específicas para cada compuesto llamado sustrato y para cada tipo de transformación. Las sustancias finales de una vía metabólica se denominan productos. Tipos de metabolismo Según la fuente de carbono que utilicen las células u organismos poseerán un metabolismo autótrofo y se llamarán células u organismos autótrofos, o bien, un metabolismo heterótrofo y se denominarán seres heterótrofos. Las células o seres autótrofos se nutren exclusivamente de materia inorgánica y realizan reacciones anabólicas para transformarla en materia orgánica a partir de la energía que toman del medio. La fuente de carbono es el CO2 atmosférico. Según la fuente de energía que utilicen, las células y los organismos autótrofos pueden ser:
a) Quimio sintéticos si la fuente de energía química (ATP) procede de la energía que se desprende en reacciones químicas inorgánicas (ejemplo las bacterias quimio sintéticas) y
b) Fotosintéticos: si utilizan la energía luminosa y la transforman mediante fotosíntesis la transforman en energía química (ejemplos: bacterias fotosintéticas,
cianofíceas, algas verdes y las células vegetales fotosintéticas de las hojas). Por su parte las células y organismos heterótrofos se nutren básicamente de materia orgánica que toman del medio (proveniente de los autótrofos) y su fuente de energía es el ATP obtenido a través de sus reacciones catabólicas. Es propia de (ejemplos las células de los animales, la mayoría de las bacterias, hongos y células vegetales no fotosintéticas).


Por: Nancy Fabiola Bámaca Pérez

Ley de conservación de la energía
La ley de la conservación de la energía establece que la energía no puede crearse ni destruirse, sólo convertirse de una forma de energía a otra. Esto significa que un sistema siempre tiene la misma cantidad de energía, a menos que se añada desde el exterior.
De acuerdo al Principio de Conservación de la Energía, al introducir en un sistema una cantidad de calor (Q) determinada, ésta será siempre igual a la diferencia entre el aumento de la cantidad de energía interna (ΔU) más el trabajo (W) efectuado por dicho sistema. De esa manera, tenemos la fórmula: Q = ΔU + W, de donde se desprende que ΔU = Q – W.
Este principio aplica también al campo de la química, pues la energía involucrada en una reacción química tenderá a conservarse siempre, al igual que la masa, excepto en los casos en que esta última se transforme en energía, como lo indica la famosa fórmula de Albert Einstein de E = m.c2, donde E es energía, m es masa y c la velocidad de la luz. Esta ecuación es de suma importancia en las teorías relativistas.
La energía, entonces, no se pierde, como se ha dicho ya, pero sí puede dejar de ser útil para realizar un trabajo, conforme a la Segunda ley de la termodinámica: la entropía (desorden) de un sistema tiende al incremento a medida que transcurre el tiempo, es decir, los sistemas tienden irremediablemente al desorden.
La acción de esta segunda ley en concordancia con la primera es lo que impide que existan sistemas aislados que conserven su energía intacta para siempre (como el movimiento perpetuo, o el contenido caliente de un termo). Que la energía no puede crearse ni destruirse no significa que permanezca inmutable.


Por: Nancy Fabiola Bámaca Pérez

