서울대학교 약학정책연구회 학회지 제 3 호 발행 서울대학교 약학대학 약학정책연구회 제작 및 검수 성미강ㆍ김재희ㆍ김희진


2022년도 1학기 서울대학교 약학정책연구회 구성원 3 교수님 인사말 4 학회장 인사말 .......................................................... 5 부학회장 인사말 6 부학회장 인사말 7 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 9 국내 신속심사 제도의 현황 및 시사점 ..................................... 37 원격의료에 따른 올바른 의약품 제공에 관한 고찰 .......................... 75 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 ........ 108
2022년도 1학기 서울대학교 약학정책연구회 구성원 학회장 성미강 부학회장 김재희 김희진 학회원 김윤지 김준희 김찬호 김태기 김희진 배한경 서윤열 안대권 안이진 김재희 우상준 유승주 이민주 이재희 정유진 조재현 최은지
무엇보다도 먼저, 대학 캠퍼스라이프에 지대한 영향을 미치던 코로나
시대가 저물고 활기 가득한 학창생활을 새로운 동아리 회원들과 함께 맞이하니 희망찹니다. 그간 제2대 성미강 회장단의 헌신으로
약학정책회지 2호가 발간되고, 3호가 조만간 발간될 예정입니다 동아리 여러분의 지성과 성찰 그리고 열정이 모아진 결과입니다 소중한 여름방학을 할애해서 만든 결실입니다 분명, 바람직한 미래 약학교육과 약사환경 조성에 보탬이 될 것입니다 이번 회지에서도 변화하는 약사 그 해결방식이 참신하고 기발합니다 발상의 전환으로 약사의 권역을 넓히고자 하는 여러분의 열정과 지도력이 눈부십니다 다시금 여러분의 선도적 성찰과 노력에 찬사를 보냅니다 앞으로도, 약사환경이 변화할 때마다 약사정책에 대한 관심이 고조될 것입니다. 여러분에 대한 사회적 기대도 더불어 커질 것입니다 어려운 정책 현안에 대한 여러분의 심도 깊은 분석과 해결방안을 보니, 미래 약사환경은 밝아 보입니다 약정연이라는 동아리 이름으로 여러분의 생각을 나누고, 다양한 의견을 포용하고 수렴하는 과정에서 여러분의 학창생활이 가을처럼 풍요롭고 깊어지길 바랍니다. 서울대학교 약학대학 약학정책연구회 지도교수

교수님 인사말
국가정책들에 대해 여러분의 발 빠른 조사와 분석을 보면서 약정연 동아리 중요성을 다시금 깨닫습니다. 위험분담제와 고가신약 관리방안, 신속심사제도, 원격의료에 따른 의약품제공 등 묵직한 현안들에 대하여 젊은 열정과 시각이 담긴 분석이 돋보입니다 거기에, 약사정책의 단골 안건인 안전상비의약품 판매제한 방안도
홍송희

학회장 인사말 작년 여름‘약학정책연구회’의 첫 활동을 한지가 엊그제 같은데 벌 써 저의 회장 임기가 끝나가고 있어 감회가 새롭습니다 돌아보니 정 말 보람차고 행복한 시간들이었습니다 저는 1년이 조금 넘는 시간 동 안 몸담으면서 함께 토론하고 발전할 수 있는 동료들을 만났고, 좋은 팀원들과 세 편의 소논문을 작성하면서 관심은 가지고 있었지만 잘 알 지 못했던 법과 정책에 대해서 많이 공부해볼 수 있었습니다. 경험이 쌓일수록 법과 정책의 중요성에 대해 다시금 실감할 수 있었습니다. 약 지대로 저희 학회가 저 뿐만 아니라 저희 학회원들, 그리고 학회지를 접 소중한 경험이 될 수 있기를 바랍니다 나아가서 약학정책연구회가 약학대 공론의 장으로서의 역할을 하고, 이후 약사로서 어떠한 일을 하던 사회와 약학의 이음새 같은 역할을 수행하기 위해서 이때 한 공부가 큰 힘이 되었으면 좋겠습니다 이번 세 번째 학회지에서는 네 팀의 연구를 담았습니다. 급여팀은 위험분담제에 대해, 허가팀 은 국내 신속심사제도에 대해, 정책1팀은 원격의료에 대해, 그리고 정책2팀은 안전상비의약품에 대해 탐구하였습니다 모두 시의성이 높고 지금 이 시대를 살아가고 있는 우리의 시선과 고민을 담은 연구들입니다 더 좋은 사회를 희망하며 내딛는 우리의 걸음이 의미 있는 울림이 되기를 희 망합니다 마지막으로, 이번 회기를 마무리 짓는 학회지를 발간하며 이 자리를 빌려 감사인사를 전하고자 합니다. 가장 먼저 약학정책연구회에 해외에 계실 때에도 따뜻한 격려와 애정 어린 조언을 아낌 없이 보내주신 지도교수 홍송희 교수님께 감사드립니다 다음으로, 학회의 든든한 기둥 역할을 해 준 부학회장 희진이와 재희 덕분에 무사히 한 회기를 또다시 마무리할 수 있었습니다 그리고 방 학 중 귀중한 시간을 투자하여 최선을 다해 연구를 수행해준 모든 학회원분들께 박수를 보냅니다 학회원분들께서는 정말 짧은 시간 동안 낯선 연구 활동을 논문 작성이라는 단계까지 완료해 내셨 습니다. 특히 이번 기수부터 대면 활동이 이루어졌기 때문에 어려움이 있었을 것 같은데, 끝까지 따라와주셔서 고마웠습니다. 약학정책연구회에서의 한 학기가 모든 학회원 여러분의 빛나는 미래 를 준비하는 데 있어 조금이나마 보탬이 되기를 바랍니다 모두가 각자의 자리에서 사회와 공동 체를 위해 필요한 일들을 하며 기여하기를 응원하며, 글을 마칩니다 2022년도 서울대학교 약학대학 약학정책연구회 제2대 학회장 성미강

부학회장 인사말 지난 겨울에 이어 3기 활동을 하면서 다양한 약학 정책을 배우게 되었습니다. 지금껏 약학정책연구회에서 논문을 작성하면서 특허, 정책 분야의 주제를 깊이 있게 조사해 보았고 다른 팀의 발표를 통해 허가, 급여, 정책에 대한 지식을 배웠습니다 연구 과정에서 많은 문헌들을 읽고 조원들과 토론하고 학회원들의 조언을 받으며 서로 소통하고 탐구하는 능력을 기르게 되었습니다 2기까지는 모든 활동이 비대면으로 이루어졌지만 이번 3기부터 세미나와 최종 발표회를 대면으로 진행하며 서로 직접 얼굴을 보고 이야기를 나눌 수 있어 뜻 깊은 시간이었습니다. 부학회장으로서 1년간 학회 활동을 진행하면서 처음 오리엔테이션부터 세미나, 연사 초청 세미나, 중간발표회와 최종발표회 마지막으로 학회지 발간까지 하면서 바쁜 약대 생활 와중에 보람찬 활동이었습니다 매 기수마다 기존 활동을 이어가면서 더 발전하고 풍성한 동아리 활동을 한 것 같습니다 여전히 부족한 점과 아쉬운 점이 있겠지만 앞으로도 많은 관심을 받으며 꾸준히 이어지고 발전하는 동아리가 되었으면 좋겠습니다. 함께 동아리를 이끌어 주었던 성미강, 김희진 선배님 정말 고생 많았고 그 동안 도움 주셔서 감사했습니다 약학정책에 관심을 가져주고 방학에 귀중한 시간과 노력을 들인 학회원 분들에게 정말 감사드립니다 약학정책은 보건, 산업, 연구 등 다양한 사회분야에서 중요한 작용을 한다고 생각합니다 약학정책연구회에서 논문을 함께 작성해 주신 분들, 관심을 가지고 저희 학회지를 읽어 주신 분들 모두에게 앞으로 저희 동아리의 경험이 여러 분야에서 도움이 되었으면 좋겠습니다. 2022년도 서울대학교 약학대학 약학정책연구회 제2대 부학회장 김재희

부학회장 인사말 이번 3기에서는 소논문 작성 활동과 함께 연사님을 모셔 허가 특허 존속기간 연장제도에 대한 강의를 들었습니다. 소논문 작성 활동과 함께 보다 더 다양한 경험을 할 수 있게 된 것 같아 좋았습니다 아쉽게도 3기에서는 소논문 작성 활동에 참여하지 못했지만, 학우들이 쓴 3기 학회지를 읽으며 논문의 높은 완성도와 자료의 풍부성에 놀랐고, 현 약학 정책 관련 현황을 알 수 있게 된 것 같습니다 또한 3기 소논문 작성 활동을 한 후배, 동기들이 얼마나 열심히 활동에 임했는지 느껴져 고마웠습니다. 1기, 2기, 3기 모두 약학정책연구회 활동을 할 수 있어서 기뻤고 부학회장으로 활동하면서 약학 정책에 대한 내용은 물론이고 소논문 작성 방법, 사람들과 소통하며 결실을 맺는 방법 등에 대해 정말 많이 배운 것 같습니다 앞으로 약학정책연구회에 많은 학우들이 참여하여 연사님들을 모신 세미나 개최, 학회원 간 친목 활동, 소논문 작성을 통한 학회지를 발간 등의 활동, 더 나아가 학회원들끼리 자율 연구를 하며 친목을 쌓을 수 있는 다양한 활동을 할 수 있으면 좋겠습니다. 또 이런 활동을 통해 학우들에게 유익하고 좋은 영향을 주어 후에 약학정책연구회의 경험을 통해 사회에서도 각자가 원하는 역할을 할 수 있게 되면 좋겠습니다 3기 학회원분들 너무 수고 많으셨습니다! 2022년도 서울대학교 약학대학 약학정책연구회 제2대 부학회장 김희진

약학정책연구회 연구 소논문 서울대학교 약학대학 약학정책연구회 ▶ 급여팀: 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 킴리아주 사례연구를 중심으로 [최우수연구] ▶ 허가팀: 국내 신속심사 제도의 현황 및 시사점 해외 신속 프로그램 및 사례 비교를 바탕으로 [우수연구] ▶ 정책1팀: 원격의료에 따른 올바른 의약품 제공에 관한 고찰 ▶ 정책2팀: 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 해외 사례를 중심으로
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 9 서울대학교 약학정책연구회 [서울대학교 약학정책연구회 급여팀 연구] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 킴리아주 사례연구를 중심으로 서울대학교 약학대학 약학정책연구회 3기 급여팀 김윤지, 김태기, 성미강, 최은지 <초록> 최 우수 연구 (1 등 ) 본 연구는 학회 내부 상호 평가를 통해 2022년도 서울대학교 약학정책연구회 최우수 연구(1등) 으로 선정되었습니다 평가 기준에는 발표의 완성도, 내용의 완결성, 연구방법의 적절성, 연구 결과의 학문적 기여도, 피드백의 수용이 있었습니다.
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 10 서울대학교 약학정책연구회 위험분담계약은 신약의 최종적으로 나타낼 가치에 대한 불확실성이 있을 때 실제 진료 상황에서 사용하여 나타난 치료효과를 평가하여 급여 및 약가의 결정에 연계하는 방식으로서, 보험자와 제약회사 상호간의 위험을 분담하여 환자에의 접근성을 높이기 위한 목적으로 시행되었다 위험분담제 확대 적용 정책이 논의되고 있는 지금, 위험분담제에 대해서 평가하고 분석할 필요성이 있으나 이전 연구 수의 부족함으로 인해 우리나라에서 종합적인 진행 현황을 파악하는 데에는 어려움이 있었다 따라서 본 연구는 위험분담계약 현황을 파악하고, 계약 유형을 정리 및 분석하며, 2022년 등재된 초고가 신약인 킴리아주에 대한 사례 연구를 통해 최신 계약 적용 경향성을 알아보았다. 분석을 위해서 공식 정부 자료, 기존 연구 문헌 리뷰를 기본으로 언론 보도 자료 등을 포함하였다. 연구 결과 우리나라 위험분담제에는 환급형, 총액제한형, 환자 단위 사용량 제한형, 근거 생산 조건부 급여형, 환자 단위 성과 기반형의 총 5가지 유형이 존재한다. 2022년 7월 현재 총 60개의 약제가 위험분담계약을 맺었다 단일 유형으로서는 총액제한형과 환급형이 가장 많았다. 고가신약 및 최근에 등장한 원샷치료제에 대해서는 여러 유형을 중복 적용하는 경향을 보였다 질병 유형에 따라서는 항악성 종양제가 대부분이었다 연도별로는 초반에는 환급형과 총액제한형이 많았으나 점차 여러 형태를 섞은 형태의 계약이 증가하고 있고 2022년에 환자단위성과기반 위험분담제가 첫 시행되었다 적용 약제의 약 50%는 희귀질환 치료제였다 급여 가격분석 결과 1인당 연간 소요 비용이 3억원 이상인 약제는 3건 존재하였으며, 단위 복용 비용이 1백만원 이하의 약제가 위험분담계약 적용 약제의 과반수를 차지하였다 또한 한국 최초의 환자단위 성과기반 위험분담제 적용 약물인 킴리아주를 중심으로 사례 연구를 하였다 별다른 위험분담제가 적용되지 않는 일본을 제외하면 유럽 국가들의 경우 근거생산 조건부급여(프랑스, 영국), 성과기반 방식(독일, 이탈리아, 스페인)을 사용하는 것이 확인되었다 현재 위험분담제에 몇 가지 한계점이 존재하였다. 재정 기반 방식의 경우 대부분의 정보를 미공개하므로 투명성과 공정성이 떨어진다 성과 기반 방식의 경우 약효를 입증하기 위한 평가 변수의 설정이 중요한데, 평가변수 설정의 어려움과 평가 시 복합적인 요인이 겹칠 수 있음에 대한 복잡함이 문제점으로 남는다 또한 위험분담제를 통해 급여 소요 시간을 약 2달정도 단축함으로써 환자의 접근성을 향상시켰지만, 협상 결렬 시 급여 중지가 되고, 이는 환자의 치료 중지 사유가 된다는 점에서 환자에게 부담을 줄 수 있다 이러한 한계점들을 개선하기 위해 본 연구에서는 여러 가지 개선방안을 제시하였다 첫째, 정보의 불균형을 해결하기 위해 평가변수에 대한 자세한 가이드라인을 공개한다 둘째, 환자의 접근성 향상을 위해 다양한 방법들을 제고한다. 셋째, 국가적으로 위험분담계약 약물의 재정 영향에 대한 분석을 진행한다 넷째, 고가 의약품의 위험 분담 방안과 관련하여 보험재정 상황과 환자 접근성을 모두 충족할 수 있도록 혁신 신약에 대한 별도 재원을 조성하는 방안 등을 검토한다 [주제어] 위험분담제, 위험분담계약, Risk Sharing Agreement (RSA), 초고가 신약, 킴리아주
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 11 서울대학교 약학정책연구회 목 차 제1장 서론 12 제1절 연구 배경 12 1. 연구 주제 및 목적 12 2. 위험분담제: 초기부터 현재까지 .................................................. 13 제2절 연구 방법 14 제2장 본론 .............................................................. 15 제1절 국내 위험분담제 현황 분석 .............................................. 15 1. 국내 위험분담계약 현황 15 2. 질병 유형별 분류 20 3. 연도별 분석 22 4. 희귀질환, 경제성 평가 .......................................................... 22 5. 급여 가격 분포 ................................................................. 23 제2절 초고가 신약의 위험분담제 적용 24 1. 초고가 신약의 위험분담계약 방식 및 보험금액 24 2. 사례연구: 킴리아 ............................................................... 26 제 3절 현행 위험분담제의 한계점 29 제3장 결론 .............................................................. 31 제1절 현행 위험분담제의 개선방안 제언 ........................................ 31 제2절 요약 및 결론 33 제3절 연구의 의의 및 한계점 .................................................. 34 참고문헌 ................................................................ 35
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 12 서울대학교 약학정책연구회 제1장 서론 제1절 연구 배경 1. 연구 주제 및 목적 약제비 지출이 빠르게 상승하고 최근 도입되는 신약들이 고가화되면서 보험 급여 및 약가 결정 시점에서 의사결정에 따른 재정적 위험이 증가하고 있다 . 중증질환이나 희귀난치성 질환 치료제의 경우 환자 수가 적어 충분한 임상자료를 확보하기 어렵고, 대부분 고가이므로 선별등재제도의 경제성평가를 통과하기 쉽지 않다 이러한 고가의 비급여 신약은 환자의 비용부담을 높일 뿐만 아니라 대체 의약품이 없는 경우에 특히 접근성이 문제가 된다 (허순임, 2021). 위험분담계약은 이처럼 최종적으로 나타낼 가치에 대한 불확실성이 있을 때 그 신약을 실제 진료 상황에서 사용하여 나타난 치료효과를 평가하여 급여 및 약가의 결정에 연계하는 방식으로서, 보험자와 제약회사 상호간의 위험을 분담하고자 합의한 계약이다 ( 박실비아 , 2010). 그러나 시행과정이 복잡하고 적지 않은 사회적 비용과 자원이 요구된다는 단점이 있다 2022 년 6 월 새 정부 국정과제로 항암제 , 중증질환 치료제 등의 의약품에 대한 신속등재와 위험분담제 확대 적용 등이 포함되었다 제약계에서는 심사평가원과 건강보험공단의 검토 기간을 단축시키고 위험분담제 적용 확대를 통한 신속 등재 등을 요구하고 있다 위험분담제 확대 적용을 위해서는 경제성평가 면제 항목을 지금보다 더 넓히는 방안을 고려 중인 것으로 알려졌다. 위험분담제 적용에서 경제성 평가 면제는 20 14년부터 시작하여 2015년과 2020년에 각각 한 차례 씩 확대되었다 이러한 지속적인 규제완화 정책은 안전 문제를 발생시키고 건강보험재정을 악화시킬 위험성이 있다. 따라서 위험분담제 확대 적용 정책 도입 전에 현재까지의 위험분담제에 대해서 평가하고 분석할 필요성이 있다. 위험분담계약의 증가 및 연구의 필요성에 비해 국내 위험분담제에 대한 연구는 비교적 적다 위험분담제를 종합적으로 다룬 연구에는 위험분담제의 도입 전 해외사례 등을 통하여 위험분담제를 분석한 박실비아의 연구(박실비아, 2010)와 이태진 등의 위험분담제 적용 약제의 사후관리 방안 등 연구(이태진 외, 2016) 등이 있다 이종혁과 방준석은 위험분담제가 환자의 접근성에 미친 영향을 확인하기 위하여 위험분담계약으로 등재된 신약을 투여받은 환자 수 및 환자 본인부담금에 대한 영향을 분석하였다 (이종혁, 방준석 , 2018) 그러나 본 연구들은 위험분담제가 본격적으로 확대되기 이전에 이루어졌으며, 정책에 대해 해외 사례 등을 통해 탐구하는 데에 주안점을 두어 현재 우리나라의 위험분담계약 현황을 파악하는 데에는 부족함이 있다 또한 위험분담제 유형에 대한 정의가 연구마다 다르고 외국의 용어와도 달라서 유형분담제 유형의 분류 기준에 대한 의문점이 존재하며, 우리나라에서 어떠한 기준에 따라서 특정 약제의 위험분담제 유형이 결정되는지도 확실하지 않다. 뿐만 아니라 위험분담제 성과 평가 연구 용역이 2022년에야 요청되었고 아직 결과가 나오지 않은 만큼 우리나라에서 위험분담제의 종합적인 진행 현황을 파악하는 데에는 어려움이 있다
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 13 서울대학교 약학정책연구회 따라서 본 연구의 연구 목표는 다음과 같다 첫째, 위험분담계약 현황을 파악한다 둘째, 위험분담제의 유형을 정리하고 각 유형의 특징 및 장단점을 분석한다 셋째, 최근 약제 적용 사례를 연구하고 평가해본다 이를 통해 현행 위험분담제를 분석하고 한계점을 파악하며, 이를 바탕으로 개선방안을 찾는 것을 목적으로 한다. 2. 위험분담제: 초기부터 현재까지 국내에서 위험분담제은 근거가 불확실한 신약의 급여를 성과에 연계하여 의사결정할 수 있는 대안으로 2013년 2월부터 시범사업으로 도입되었고, 이후 2014년, 2019년, 2020년에 한 차례씩 범위가 확대되었다. 표1. 위험분담제 및 경제성 평가 생략 대상의 확대 연도 제도 내용 2013 위험분담제 대체가능한 약제가 없는 항암제, 희귀질환치료제의 효과나 재정영향 등에 대한 불확실성을 제약사가 일부 분담 2014 허가 평가 연계 제도 신약 또는 희귀의약품에 대하여 식약처 허가 완료 前 약제 급여결정 신청을 가능하도록 허용 2015 경제성평가 자료제출 생략 제도 희귀질환치료제나 항암제 중 대체 가능 치료법(약제)가 없고 근거생산 곤란 등의 일정 요건 충족시 경제성 평가 자료 제출 생략 가능 2015 약가협상 생략 제도 약가 협상 생략 기준금액 요건(대체약제 대비 90∼100%) 충족 시 통상 60일에 해당하는 협상기간을 단축 2019 위험분담제 대상 확대 임상적으로 삶의 질 개선을 입증한 중증 난치질환 치료제(중증 아토피) 확대 적용 2020 경제성평가 자료제출 생략 대상 확대 국가필수의약품 중 항균제, 결핵치료제, 응급치료제 등 확대 적용 2020 위험분담제도 제도 확대 위험분담 적용 약제의 후발약제까지 확대 적용 현재 시행되고 있는 위험분담제 유형으로는 크게 총액제한형, 환급형, 환자단위 사용량 제한형 , 근거생산조건부제한형 등이 있으며 총액제한형 또는 환급형 방식의 계약이 대부분이다. 2022년 7월 기준 총 60개의 약제가 위험분담계약을 체결하였다. 우리나라 위험분담제의 경우 행정 부담이 적은 재정 기반 계약방식이 대다수였다. 이탈리아, 영국 등 초기에 성과 기반 계약이 주를 이루던 나라들도 행정부담에 비해 명확한 성공을 거두지 못한 탓에 최근에는 다시 재정 기반 계약방식들이 높은 비율을 차지하고 있다 성과 기반 위험분담계약의 행정 부담이라 함은 곧 성과를 객관적으로 측정하기가 어렵다는 걸 뜻한다. 2.3절에서 보다 자세히 서술하겠지만, 성과 기반 계약,
위험분담제의 유형, 특징, 그리고 장단점 분석을 위해서 기존 연구에 대한 문헌 리뷰를 한다 리뷰를 위해 검색을 할 데이터베이스는 RISS, KISS 등 한국의 문헌 데이터베이스와 Pubmed, Google Scholar, SCOPUS 등 외국 문헌 데이터베이스를 포함한다. 국내 문헌의 경우 200 9 년부터 2022 년 현재까지를 대상으로 “ 위험분담 ” “ 위험분담계약 " , “위험분담제”를 주제어로 검색한다. 외국 문헌은 “risk sharing agreement”, “RSA” 등으로 검색한다. 문헌 연구를 토대로 유형의 분류를 정립하고 유형별 위험분담계약의 특징을 정리한다. 현재 계약 현황에 따라 질병, 계약체결 연도, 경제성 평가 면제 여부, 약제 가격 등에 따른 위험분담계약의 특징을 분석한다.
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 14 서울대학교 약학정책연구회 특히 환자 단위 성과 기반 계약방식을 취할 경우 약효를 가장 직접적으로 나타낼 수 있는 성과 기준을 제시해야 하고, 이를 관찰하기 위해 꾸준한 모니터링이 필요하다. 이런 이유로 2010년대까지는 많은 위험분담계약이 재정 기반의 방식을 취했다 그러나 최근 킴리아주, 졸겐스마 등 회당 수억을 호가하는 초고가신약들이 나오면서 이들에 대한 급여 요구가 증가하고 있고, 환자들의 신약 접근성을 높이기 위해 다시 성과 기반 위험분담계약들이 이루어지고 있다 특히 국내의 경우 올해 킴리아주, 졸겐스마 두 원샷치료제 모두 환자단위 성과기반방식의 계약이 이루어졌다 . 해외에서도 구체적인 내용은 조금씩 다르지만 대부분 초고가신약들, 특히 원샷치료제들을 대상으로 성과 기반 방식의 위험분담계약을 맺고 있다 이 부분에 대해서는 제2장 제2절에서 보다 자세히 서술한다 제2절 연구 방법 먼저 , 현재 실시되고 있는 위험분담제 계약 현황을 조사한다 약학정보원의 급여평가위원회 심의결과 , 보험인정기준 약가파일 등 건강보험심사평가원 ( 심평원 ) 보도자료를 기초로 하되, 구체적인 보도자료가 없는 경우에는 뉴스 기사 등을 토대로 파악한다.
이후 초고가 신약의 위험분담제 계약에 대해 알아보기 위해 킴리아주의 사례를 중점적으로 알아본다 킴리아주는 2022 년 환자단위성과기반 위험분담제가 처음으로 적용된 약제이므로, 현재 초고가 신약에 대한 위험분담 적용 방식을 알아보는 데 가장 적절한 사례이다 졸겐스마주도 2022년 환자단위성과기반 위험분담제가 적용되었으나, 8월에 고시가 되었으므로 적용 방식에 대한 자료가 충분하지 않아 킴리아주가 본 연구 목적에 더 부합한다고 판단하였다. 킴리아주에 위험분담계약에 적용된 배경, 그 결과 변화된 환자 부담률, 환자단위성과를 분석할 수 있는 평가변수, 해외에서 적용되는 방식 등을 알아본다. 사례분석을 바탕으로 현재 위험분담제의 작용방식과 의의, 한계점을 알아보는 것을 목적으로 한다. 위의 분석들을 바탕으로 현재 위험분담제의 한계점을 파악하고 개선방안을 제시한다 개선방안 제시를 위해 외국의 위험분담제 적용 사례들을 참고하였다.
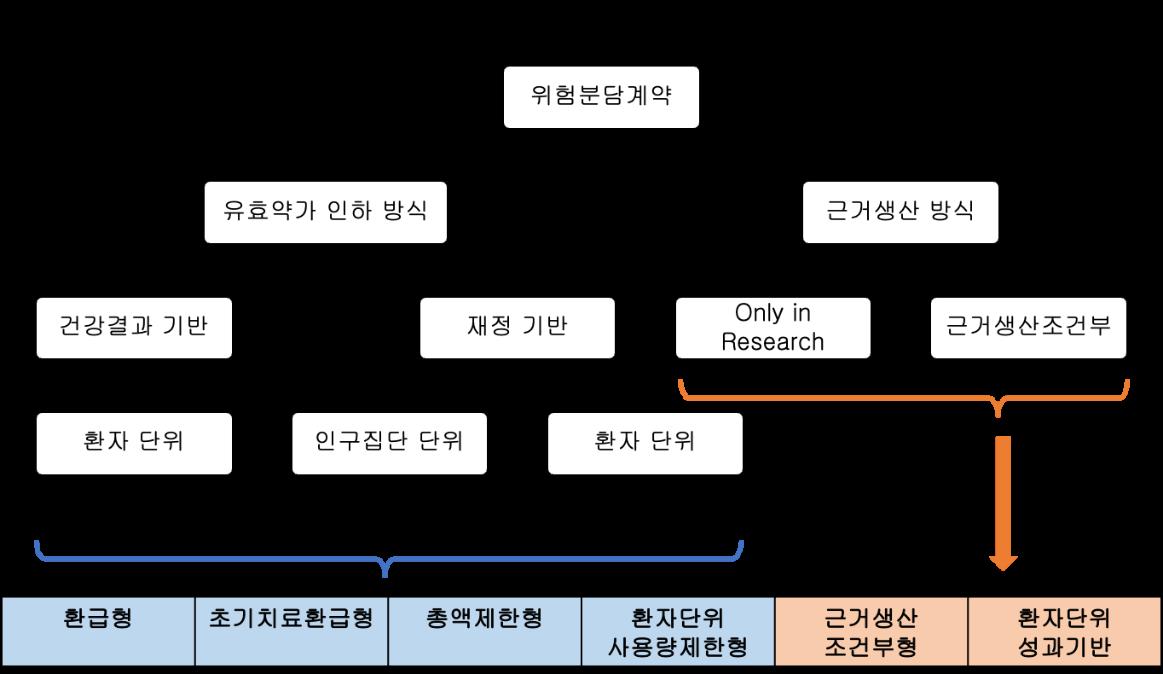
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 15 서울대학교 약학정책연구회 제2장 본론 제1절 국내 위험분담제 현황 분석 1. 국내 위험분담계약 현황 2022년 7월 기준 총 60개의 약제가 위험분담계약을 체결하였다 자세한 계약 사항에 대한 목록은 부록 1. 에 수록하였다. 우리나라의 위험분담제도는 크게 재정기반(총액제한형, 환급형, 환자 단위 사용량 제한형)과 성과기반(조건부 지속 치료와 환급 혼합형, 근거생산 조건부 급여)로 나뉜다. 위험분담제 유형에 대한 분류는 다음과 같다 그림1 위험분담제 유형의 분류 위와 같이 위험분담제는 크게 6가지 유형으로 나눌 수 있다. 각각에 대한 자세한 설명은 다음과 같다. 표2 위험분담제의 종류 설명 환급형 총액제한형 환자 단위 사용량 제한형
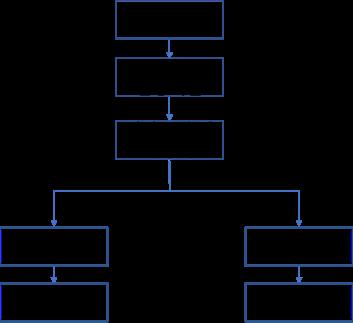
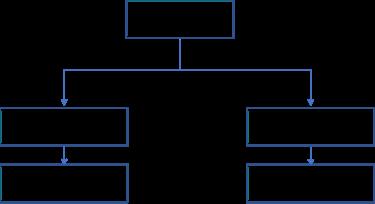
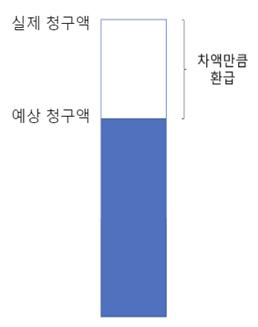
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 16 서울대학교 약학정책연구회 근거생산 조건부 급여 조건부 지속 치료와 환급 혼합형 환자 단위 성과기반형 환급형은 제약사와 공단의 계약을 통해 약품의 실제 가격보다 높은 표시가격을 설정하고, 그 차액만큼 제약사가 보험공단에 환급하는 유형이다. 약물 투여 초기 일정기간에 대한 환급을 진행하는 초기치료환급형, 환자 초기치료비와 예상 청구액 초과분 일정비율을 환급하는 계약환급형 등의 기존의 구조에서 변형된 환급형도 존재한다 환급형은 추가적인 재정부담이 일어날 가능성이 적고, 제약사 입장에서 실제가격보다 높게 받을 수 있다는 장점이 존재한다 총액제한형은 미리 정해진 연간 지출액을 초과할 경우 일정 비율을 보험공단에 환급하는 방식으로 이루어진다. 국내에서 경제성평가 면제 약물은 기본적으로 이 유형을 이행해야 하며, 필요에 따라 환급형 등 을 추가로 적용받기도 한다 이 유형을 적용받을 경우, 제약사와 보험공단과의 협상을 통애 예상청구액을 결정하는 것이 중요하다. 환자 단위 사용량 제한형은 환자 당 사용량 한도를 미리 설정하고, 정해진 한도를 초과한 경우 초과분의 일정 비율만큼 제약사가 환급하는 방식으로 이루어진다 근거생산 조건부 급여의 경우 의약품 등재 전 치료효과 입증이 불확실한 경우에 사용한다 우선적으로 의약품을 등재하고 추가적인 임상시험을 실시, 효과를 재평가한다 만약 임상시험 결과가 정해진 기준을 충족하지 못한 경우 급여 제외, 환수 조치 등이 이루어지고, 기준을 충족한 경우에만 급여를 지속하는 방식으로 이루어진다 조건부 지속 치료화 환급 혼합형의 경우 약제를 일정기간 투여 후 환자별로 약물 반응성을 평가한다. 치료효과가 있는 환자의 경우 치료를 지속하나, 없거나 기준 미달인
시행 조건
경평 면제 약물은 총액제한형 적용 시행중인 약제 없어 평
등재 전 약효 입증이 불완전한 경우 (시행중인 약제 1종으로 정확한 평가 어려움) 시행중인 약제 없어 평가 불가 원샷치료제 초고가신약
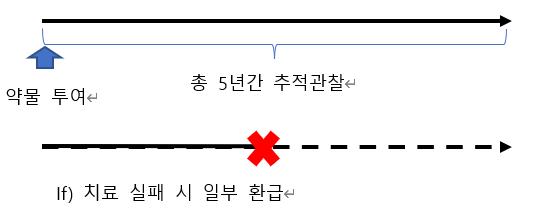
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 17 서울대학교 약학정책연구회 경우 해당 환자의 사용분만큼의 금액을 제약사가 공단에 환급하는 방식이다 해당 유형에 대해서는 기존 연구 및 자료에 소개되고 있으나, 현재 확인되는 적용중인 약제는 존재하지 않는다 환자 단위 성과기반형의 경우 가장 최근에 적용되기 시작한 유형으로, 환자별로 치료 성과를 매년마다 보고, 총 5년을 추적 관찰하여 치료 실패 시 일정 비율에 해당하는 금액을 환급하는 방식으로 이루어진다 해당 유형은 고가 중증질환 신약에 대한 신속한 보험적용 요구가 증가함에 따라 의약품에 대한 환자의 접근성을 높이고 급여 관리를 강화하기 위한 방안으로 2022년 급여된 초고가신약 2종에 적용되고 있다 우리나라에서 시행중인 위험분담제의 유형별 정의와 특징을 다음과 같이 정리해보았다 표3 위험분담제 유형별 세부사항 환급형 총액제한형 환자단위 사용량제한 근거생산 조건부 급여 조건부 지속 치료와 환급 혼합 환자단위 성과기반 정의 실제가격보 다 높은 표시가격, 차액만큼 환급 진행 사전 협상된 예상청구액의 초과분의 일정 비율 환급 환자당 사용량 제한, 초과 시 일정 비율 환급 의약품 우선 등재, 추가적인 임상시험 시행 후 평가 환자별로 약물 반응성 평가, 결과 따라 급여 지속 총 5년간 추적 관찰, 치료 실패 시 일정 비율 환급 적정 대상 약제 별다른 조건이 존재하지 않음 과소비가 일어날 수 있는 약제
가 불가 매 6개월/1 년간 성과 보고 필요 특징 추가적인 지출이 일어날 가능성 적음 약제의 과도한 사용 방지, 재정 부담을 줄임 성과가 없는 환자의 경우 급여 중지/환급 조치 등으로 보험공단의 재정 부담을 줄일 수 있음 위험분담제 유형별 약제 계약 현황은 다음과 같다 표4. 위험분담제 유형별 약제 계약 현황 환급형 단독 (20) 나글라자임주 * 닌라로캡슐 로즐리트렉켑슐 솔리리스주 오니바이드주 젤코리캡슐 피레스파정 레블리미드캡슐 버제니오정 사이람자주 스티바가정 얼비툭스주 엑스탄디연질캡슐 옵디보주 입랜스캡슐 키스칼리정 키트루다주 키프롤리스주 퍼제타주 포말리스트캡슐
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 18 서울대학교 약학정책연구회 초기치료환급형+환급형 +총액제한형 (3) 환급형+총액제한형 (9) 듀피젠트프리필드주 다잘렉스주 루타테라주 바벤시오주 렉라자정 비트락비캡슐 스트렌식주 스핀라자주 벤리스타주 여보이주 임핀지주 조스파타정 변형된 환급형 (1) 타그리소정 변형된 환급형 환자별로 초기 일정기간 해당하는 약제비용 제약사가 환급 총액제한형 단독 (22) 데피텔리오주 디테린정 라트루보주 라핀나캡슐 린파자캡슐 매큐셀정 베스폰사주 불린사이토주 비미짐주 빈다켈캡슐 실반트주 아이클루시그 알레센자 캡슐 임브루비카 제줄라캡슐 젤보라프정 카프렐사정 헴리브라피하주사 벤클렉스타정 올리타정 티쎈트릭주 프락스바인드주 환자 단위 성과기반형 + 총액제한형 (1) 킴리아주 B세포 급성 림프성 백혈병(B ALL) 및 미만성 거대 B세포 림프종 치료제 (DLBCL) → ALL에 비해 임상성과가 미흡한 DLBCL은 환자 단위 치료성과 여부에 따른 성과기반 지불 위험분담제(RSA)를 적용 → 치료효과가 없는 환자에 대해 추가 환급 일정 금액을 초과하면 100% 환급되는 형태의 총액제한이며, 성과기반을 적용하면 사망자는 원인에 관계없이 환급 환급형 + 환자 단위 성과기반형 + 총액제한형 (1) 졸겐스마주 척추성 근위축증 질환 치료제 고가 약제로서 1회 투여(one shot) 치료제인 만큼, 치료 효과 모니터링 및 급여 적정 관리를 위해 환급형, 총액제한형 및 환자 단위 성과기반형까지 총 3가지 위험 분담제 유형을 계약 조건에 명시 환자 단위 사용량 제한형 (2) 카보메틱스정(카보잔티닙) 20, 40, 60mg 캐싸일라주 100mg
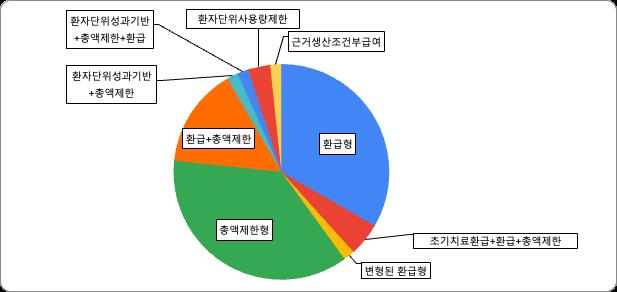
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 19 서울대학교 약학정책연구회 근거생산 조건부 급여 (1) 에볼트라주(클로파라빈) 20mg/20mL *취소선은 계약종료를 뜻함 2022년 7월 현재의 계약 유형별 체결 현황 (계약 종료 약물 포함)은 다음과 같다. 누적 (계약종료 포함, 2022.08.01 기준 졸겐스마주 포함)으로 체결 현황을 파악하였다 현재 총 60개의 약제가 위험분담제 계약을 맺은 바 있다 표5. 위혐분담제 계약 유형별 계약 건수 환급형 초기치료 환급형 변형된 환급형 총액제한형 근거생산 조건부형 환자단위 사용량제한형 환자단위 성과기반 단일 20 0 1 22 1 2 2 중복 3 3 0 3 0 0 0 9 0 0 9 0 0 0 총계 32 3 1 34 1 2 2 60 (중복 제외) 그림2. 계약 유형별 위험분담제 건수 단일 유형으로서 총액제한형 (22 건 ), 환급형 (20 건 ) 위험분담계약이 가장 많이 체결되었다 또한 초기치료환급 + 환급 + 총액제한, 환급 + 총액제한 등 여러 유형의 위험분담제가 중복하여 적용된 경우도 존재한다 1. 위험분담제 유형 분석 어떤 요인이 약물의 위험분담제 계약 유형에 영향을 미치는지 알아보기 위해 위험분담제 적용약물의 특이사항에 대해 확인해 보았다. 확인한 사항으로는 ① 2020년 개정 이후로 선발약제가 존재함에도 위험분담제 계약이 가능해지며 해당 계약을 적용 받은 후발약제인지 ② 약효 입증은 되었으나 임상적 유효성이 입증되지 않은 경우인지 ③ 1차
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 20 서울대학교 약학정책연구회 치료 약물을 실패한 후 2차 치료 이상에서 사용 가능한 약제인지 ④ 적응증이 확대되며 위험분담제 계약이 이루어졌는지의 여부이다. 첫 번째로, ①치료적 위치가 동등한 선발약제가 존재하는 경우 후발약제의 위험분담제의 유형에 대해 확인해 보았다 조사 전 후발약제의 경우 대체할 수 있는 약제가 존재하므로 재정부담이 다소 적어 예상청구액을 초과하지 않는 것이 중요한 총액제한형을 사용하기에 부담이 적은 조건이라 생각하여 해당 유형에 해당하는 것이 많을 것이라 추론하였다 조사 결과 후발약제로서 위험분담제를 적용받은 약제는 닌라로캡슐 ( 선발약제 : 키프롤리스주 ), 렉라자주 ( 선발약제 : 타그리소정 ), 키스칼리정 ( 선발약제 : 입랜스캡슐 , 버제니오정) 세 종류가 있으며, 각각에 해당하는 위험분담제 유형은 환급형/초기치료환급 + 환급 + 총액제한 / 환급형으로 모두 환급형이거나 환급형에 다른 유형을 추가적으로 적용받는 것을 확인할 수 있었다 후발약제의 경우 이미 시장에 대체할 선발약제가 존재하기 때문에 예상 청구액 협상 등 제약사와 보험공단 간의 재정에 대한 협상이 중요한 다른 유형보다는 재정 협상의 중요도가 다소 적어 빠르게 급여를 진행할 수 있는 환급형을 선택하는 것이 제약사 입장에서 이득이기에 환급형을 중점으로 급여 진행된 것으로 보인다. ②약효 입증을 바탕으로 허가는 받았지만 임상적 유효성이 입증되지 않은 경우나 ③2 차 이상에서 사용하라고 명시된 약제의 경우 risk 가 큰 편이었지만 , 여러 유형의 위험분담계약이 중복 적용되기보다는 총액제한형 등 한가지 유형이 단독 적용된 경우가 많았다 이는 위험분담제 자체가 약물의 효과에 대한 risk를 전제하고 설계된 것이기 때문에 해당 약제에 대해서 단독 유형으로 충분히 커버할 수 있다는 보험공단의 판단 기준이 존재하기 때문이라고 사료되었다 또한 치료 순서가 환자의 재정적 부담이나 장기적인 예후 등 다양한 요인을 고려하여 정해지는 만큼 2차 치료 이상으로 정해졌다 해도 risk가 크다고 단정지을 수 없는 것도 해당 결과에 영향을 미친 것으로 보인다 마지막으로 ④위험분담제 적용 약물의 적응증이 확대되는 경우는 공개된 내용이 적어 명확한 결론을 내리기는 어려우나 , 조사한 자료를 바탕으로 파악한 바로는 별다른 위험분담제 유형의 변화는 보이지 않았다 . 기존 존재하는 약물의 적응증 확대에도 위험분담제를 적용받을 수 있으며, 적응증이 확대된다면 약가가 인하된다 해당 내용에 대해서는 적응증 확대 시 적응증별로 비용효과성 평가를 해서 약가를 다르게 적용해야 한다는 주장이 존재하나 현재 적용되고 있는 사안은 아니다 2. 질병 유형별 분류 질병 유형에 따른 위험분담제 계약 현황은 다음과 같다 항악성종양제가 대부분 (60건 중 44건, 74%)을 차지하였다.
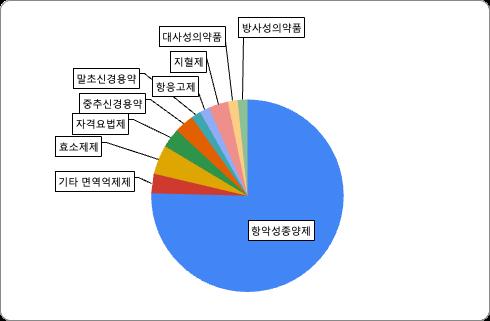
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 21 서울대학교 약학정책연구회 표6. 질병 유형 및 계약 유형별 위험분담계약 약제 건수 분류 항악 성 종양 제 기타 면역 억제제 효소 제 자격 요법 제 중추 신경 용약 말초 신경 용약 항응고 제 지혈 제 대사 성의 약품 방사 성의 약품 총 합 환급형 17 2 1 20 초기치료 환급+환급 +총액제한 1 2 3 변형된 환급형 1 1 총액 제한형 16 1 1 1 2 1 22 환급 +총액제한 6 1 1 1 9 근거생산 조건부 1 1 환자단위 사용량 제한 1 1 2 환자단위 성과기반 2 2 총합 44 2 3 2 2 1 1 2 1 1 60 그림3 질병별 위험분담계약 건수
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 22 서울대학교 약학정책연구회 3. 연도별 분석 연도별 위험분담제 계약 현황은 다음과 같다 표7 연도별 위험분담제 계약 현황 연도 환급형 초기치료 환급+환급 +총액제한 변형된 환급형 총액 제한형 환급 +총액 제한 환자단위 성과기반 환자 단위 사용량 제한 근거 생산 조건부 급여 총합 2015 1 1 2016 2 1 3 2017 6 1 9 1 1 18 2018 4 6 10 2019 2 1 4 2 1 10 2020 2 2 3 7 2021 2 2 1 5 2022 1 3 2 6 위험분담제 도입 초기인 2018년까지는 환급형와 총액제한형 계약이 주로 체결되었다. 특히 2017년까지는 계약 방법이 비교적 간단하고 외국 등에서의 선행 사례가 많은 환급형 계약이 많이 체결되었다 . 또한 2017 년 이후로 총액제한형이 많이 적용된 데에는 경제성평가 면제 (이하 경평면제) 약물이 필수적으로 총액제한형을 적용하도록 한 것이 영향을 미쳤을 수 있다 하지만 2020년 개정 이후 경평면제 약물도 환급형 등 다른 유형을 적용받을 수 있게 되어 총액제한형 적용 약물의 수의 감소에 영향을 끼쳤을 수 있다 2019년부터 최근까지 환급+총액제한, 초기치료환급+환급+총액제한 등 여러 유형을 섞은 형태의 계약이 증가하고 있다 위험분담제 시행에 대한 경험이 쌓임에 따라 다양한 형태의 계약을 시험해보고 있는 것으로 보인다. 근거생산조건부급여계약은 에볼트라주가 2017 년에 처음이자 마지막으로 계약이 체결되었으나, 현재는 계약 종료되었다. 2022년에 킴리아주, 졸겐스마주와 같은 초고가 신약을 대상으로 환자단위성과기반 위험분담제가 첫 시행되었다 4 희귀질환, 경제성 평가 표8. 경제성 평가와 희귀질환 유무에 따른 위험분담제 현황 분석 경제성평가 O 경제성평가 X 합 희귀질환 O 10 22 (경평면제) 32 희귀질환 X 26 2 28 합 36 24 60 현재 위험분담제를 적용받은 약제 중 경제성 평가 면제를 받은 약물은 22건 (36.6%) 이다 경제성 평가를 한 약물은 36건 (60%)로, 희귀질환치료제가 아닌 경우에는 대부분
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 23 서울대학교 약학정책연구회 경제성 평가를 시행하였다 위에서 서술하였던 위험분담제 적용 가능 조건 중 희귀질환치료제로서 경제성평가 면제를 받은 약물이 있다는 점을 고려하였을 때 타당한 비율로 보인다 경제성평가 생략 가능으로 선정된 근거 중 “외국 7개국 중 3개국 이상에서 공적으로 급여되는 경우”가 가장 빈번하게 나타났다. 경제성 평가 면제를 받은 약제는 2건을 제외하고 모두 다국적 제약회사의 약제였다. 이를 고려하였을 때 2019년 위험분담 약제에 대한 경제성평가 특례 도입, 위험분담 대상 약제 확대, 그리고 2020년 위험분담제 대상 약제 대폭 확대(후발의약품, 경제성평가 면제 약제, 3상 조건부허가 약제)는 다국적 제약사들의 이익과 관련이 있을 수 있다 희귀질환치료제의 비율은 32건 (53.3%) 였다 이는 위험분담제 도입 취지 중 하나인 “ 대체 가능하거나 치료적 위치가 동등한 제품 또는 치료법이 없는 항암제나 희귀질환치료제로서 생존을 위협할 정도의 심각한 질환에 사용되는 경우의 환자 접근성 향상”이라는 목적에 부합한다고 볼 수 있다 5. 급여 가격 분포 위험분담계약 적용 약제의 재정 부담의 경향성에 대해 살펴보기 위해 현재 적용된 급여 가격에 대하여 알아보았다. 비급여 된 경우의 가격에서 급여 가격의 차이를 통해 환자 부담률 및 건강보험재정 부담률을 분석할 수 있으나, 위험분담제 적용 전의 비급여 가격은 대부분의 경우 공개되지 않았다. 또한 본 분석에서는 1회 / 1정 / 1바이알 등 단위용량의 가격을 기준으로 하였다. 보다 정확한 분석을 위해서는 모든 약제들의 투약 횟수 및 용량을 적용하여 총 투여 비용을 살펴보아야 할 것이나, 약제 및 환자 특성에 따른 투약 방법의 다양성으로 인하여 분석의 어려움이 있어 생략하였다 표9 위험분담계약 적용 약제의 급여 가격 단회 투여 비용 3억원 이상 1인당 연간 소요 비용 3억원 이상 1천만원 이상 1억원 이하 1백만원 이상 1천만원 이하 1백만원 이하 계약 건수 2 3 4 18 35 평균 \1,170,883,146 \811,375,141 \14,889,243 \2,340,545 \182,081 분석 결과 단회 투여 비용이 3억원 이상인 원샷치료제는 2건, 1인당 연간 소요 비용이 3 억원 이상인 약제는 3 건 존재하였다 단위 복용 비용이 1 백만원 이하의 약제가 위험분담계약 적용 약제의 과반수 (35건, 57%)를 차지하였다 위에서 언급하였듯이 실제 건강보험공단 재정이 부담해야하는 금액은 알 수 없었다.
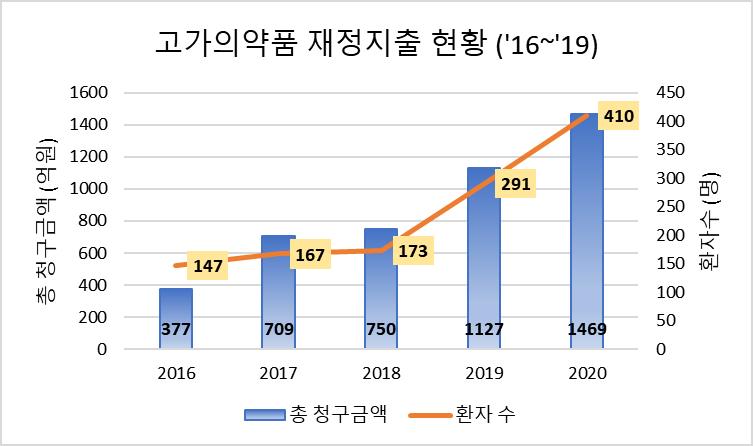
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 24 서울대학교 약학정책연구회 제2절 초고가 신약의 위험분담제 적용 1. 초고가 신약의 위험분담계약 방식 및 보험금액 2.1. 고가의약품으로 인한 재정 지출 증가 연간 약제비 지출이 빠르게 상승하는 원인 중 하나는 초고가 신약의 수가 증가함에 따라서 생기는 고가의약품의 재정지출 증가이다 . 우리나라의 경우 201 9 년 4 월 8 일 척수성근위축증치료제 (스핀라자) 급여 이후 고가의약품의 재정지출이 급증하였다 또한 2022년 1회 투여 치료제(원샷치료제)인 소아백혈병치료제 급여로 인해 재정지출이 훨씬 증가할 것으로 예상된다 초고가 신약이라고도 불리는 1인당 소요비용 3억원 이상 약제 그림4. 고가의약품 재정지출현황( 16~’20) (자료 출처: 보건복지부, 2022) 국제적으로 고가( high cost , high priced , premium priced ) 의약품에 대한 일치된 정의는 없는 상황으로, 우리나라 실정에 맞는 관리범위 설정이 필요하다 현재 우리나라는 고가의약품을 ➀높은 가격, 효과의 불확실성 등으로 인하여 가격 관리 및 장기 효과 확인이 필요한 약제 또는 ➁재정영향이 상당하여 사용량 관리 등이 필요한 약제로 정의하고 있다. 우리나라도 고가의약품에 대해 급여 관리 방안이 필요하다고 판단되어 급여 의약품 또는 등재 신청 의약품 중 ➀ 1회투여로 장기 효과를 기대하는 약제(one shot 치료제) 또는 1인당 연간 소요금액 3억 이상 약제(초고가신약) 또는 ➁ 연간 청구액이 300억 이상 약제 (단일성분 또는 동일효능군)를 급여 관리방안 적용 대상으로 설정했다 (보건복지부, 2022). 2.2. 고가의약품의 위험분담제 적용 고가의 의약품이 증가하고 있는 상황에서 환자의 실질적인 접근성을 보장하기 위해 현행 급여 제도 등의 보완이 필요하다 이러한 상황에서, 늘어나는 재정지출의 부담을
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 25 서울대학교 약학정책연구회 줄이기 위해 위험분담제 도입은 필수적이라고 볼 수 있다 그러나 기존에 주로 사용하던 재정기반 위험분담제인 총액 제한형, 환급형 위험분담제와 다르게 원샷 치료제 등 고가 신약은 높은 가격‧장기 효과에 대한 불확실성이 존재한다. 따라서 기존 평가방법으로는 비용효과성 입증에 한계가 있어 2022년 4 월 소아백혈병치료제(킴리아주)를 시작으로 환자단위 성과기반 위험분담제를 실시하였고 , 후속 고가 신약 ( 척수성근위축증 , 망막색소변성증 치료제 등)도 확대 적용할 예정이다 2022년 현재 기준 위험분담제 적용 약제 중 초고가신약의 정의인 “1인당 연간 소요금액 3억 이상 약제(초고가신약)” 는 졸겐스마, 킴리아, 스핀라자주 총 세가지이다 해당 약제들의 특징 및 위험분담제 적용 방식은 다음과 같다. 표10 위험분담계약 적용된 초고가 약물의 특징 비교 졸겐스마 킴리아 스핀라자 위험분담계약 유형 환급형 + 환자 단위 성과기반형 + 총액제한형 환자단위성과기반+ 총액제한 환급+총액제한 분류 근골격계 약물 항악성종양제 근골격계 약물 적응증 SMN1 이중대립형질 돌연변이 SMA(제1형, SM N2 3개 이하) 25세 이하 재발/불응성 B세포 ALL, DLBCL(3차 ~) 5q 척수성 근위축증 고시 (계약) 일자 2022/08/01 2022/04/01 2019/07/26 급여 가격 1,981,726,933원/1키트 360,039,359원/1회 92,359,131원/5mL/병 투여횟수 단회투여 단회투여 척수성 근위축증으로 진단 후 가능한 빨리 0 일, 14일, 28일, 63 일에 4회 도입 용량(lo ading dose)으로 투여를 시작하며, 이후에는 4개월마다 유지용량으로 투여 예상총액 (급여가격 * 투여횟수) \1,981,726,933 \360,039,359 \369,436,524 희귀질환 O O O 경제성평가 유무 X X X 회사 한국노바티스(주) 한국노바티스(주) (주)사이넥스 졸겐스마와 킴리아는 공통적으로 단회 투여 ( 원샷치료제 ) 약물이며 2022 년 환자단위성과기반 위험분담제를 적용받았다. 세 약물 모두 경제성 평가를 진행하지 않았고, 그 중 킴리아와 스핀라자는 경제성평가면제 트랙을 밟았다 단회 투여 약물의 경우 경제성 평가가 어려워서 진행을 하지 않았을 수 있다.
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 26 서울대학교 약학정책연구회 2. 사례연구: 킴리아 우리나라의 경우 초고가 신약에 대해서 환자단위 성과기반 위험분담제를 도입했지만, 다른 나라의 경우 위험분담제를 사용하지 않거나, 다른 방식의 위험분담제를 사용한다 경제성평가 생략 가능 근거 중 “외국 7개국 중 3개국 이상에서 공적으로 급여되는 경우” 가 있을 정도로 우리나라는 급여제도와 관련하여 해외의 사례를 많이 참고한다 또한 초고가 의약품의 경우 대부분 해외에서 우선적으로 약가가 선정되고, 급여방식이 결정되기 때문에 해외에서는 어떤 방식으로 초고가 의약품을 대처하고 있는지 비교해 볼 필요가 있다. 따라서 우리나라에서 처음으로 환자단위 성과기반 위험분담제를 실시한 킴리아주를 예시로 초고가 신약에 대해서 나라별로 비교해보았다 또 환자단위성과기반 위험분담제가 적용된 졸겐스마주의 경우 2022년 8월에 계약 유형이 고시가 되었으므로 아직 적용 방식에 대한 자료가 충분하지 않아 킴리아주가 본 연구 목적에 더 부합한다고 판단하였다 2.1. 대한민국 우리나라는 2021년 3월 5일 킴리아주가 허가된 이후 10월 13일 급여를 위한 첫번째 단계인 중증(암)질환심의위원회 심의 결과 급여기준을 설정했다 킴리아주는 제약사의 추가 재정분담을 조건으로 제약사가 신청한 두 가지 적응증 ‘급성림프성백혈병(ALL)'과 ‘ 미만성 거대 B 세포 림프종( DLB C L ) ' 에 대하여 식약처에서 허가한 사항과 동일하게 건강보험 급여 기준이 설정되었다 (건강보험심사평가원, 2021) 심의 결과 약제 급여 적용을 위한 추가 재정분담 조건은 ➀ 해외 약가 수준을 고려한 제약사의 더 높은 수준의 위험분담이 필요하며, ➁ ‘급성림프성백혈병'에 비해 임상성과가 미흡한 ‘미만성 거대 B세포 림프종'의 경우 환자단위로 치료성과 여부에 따른 성과기반 지불 모형의 위험분담제 적용이 추가로 필요하며, ③ 킴리아주 전체 지출에 대한 총액 설정이 필요하다고 판단했다 이렇게 급여기준이 설정된 후 2022년 1월 13일 약제급여평가위원회 심의 결과 급여의 적정성이 있다고 판단되었고, DLBCL의 경우 환자단위 성과기반 위험분담을 시행하고, 킴리아주 전체 지출에 대한 총액제한 적용을 조건으로 급여를 인정했다 (건강보험심사평가원, 2022) 따라서 결과적으로 2022년 3월 31일 킴리아주의 상한금액을 회당 약 3.6 억원으로 결정했다 . 비급여로 투약 시 환자 부담이 4 억원에 달했으나 , 급여화로 인해 환자 부담이 최대 598만원 (건강보험 본인부담상한제 적용) 수준으로 대폭 경감된 것이다 (보건복지부, 2022) 2.2. 일본 일본의 경우 앞서 언급했던 “외국 7개국" 중 유일하게 포함된 아시아 국가이다 우리나라와 인접한 국가이면서, 킴리아주의 약가협상 단계에서 보건당국은 일본의 약가를 고려했을 정도로 일본의 사례는 파악하는 것은 연구에 있어서 중요하다. 일본의 모든 의료기기는 궁극적으로 국민건강보험(NHI)에 의해 지불된다. 사실상 거의 대부분의 사례에서 일본 정부가 환급 가격을 결정하지 않은 의료기기에 대하여 일본인이 구매하는 것은 불법이다 (BMI, Worldwide Guide to Medical Devices Pricing & Reimburs ement, March 2018) 약품도 마찬가지로 99% 보험 급여가 이루어지고 있기 때문에, 킴리아주에 대해 별다른 위험분담제를 사용하고 있지 않다. 하지만 최근 몇 년간 고가 의약품에 대한 지출이 증가함에 따라 이를 억제하기 위해 2 019년 4월부터 HTA를 실시했다 구체적으로는 Cost effectiveness assessment (CEA)
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 27 서울대학교 약학정책연구회 제도를 도입했는데, 이는 개별 환자의 데이터 분석을 통해 비용 대비 효과를 평가하여 약품의 가격 인하 또는 가격 인상을 진행하는 제도이다 (하세가와 마사타카, 2019). 이 제도로 인하여 2019년 5월 3,400만 엔으로 약가가 책정된 킴리아주는 2021년 4월 CEA에 의해 4.3% 인하된 3,265만 엔으로 결정되었다. 2.3. 유럽 유럽도 마찬가지로 앞서 언급했던 “외국 7개국” 중 5개의 나라가 유럽에 속하기 때문에 유럽의 사례를 자세히 살펴보는 것은 중요하다. 영국을 포함한 많은 유럽 국가들은 건강 보험이 우리나라와 비슷하게 국가 단위로 진행되고 있고, 대부분의 글로벌 제약사가 유럽에 분포하고 있어 신약에 대한 접근성 및 정책 결정이 우리나라보다 빠른 편이다. 따라서 초고가 신약에 대한 급여 방식 및 관리가 어떻게 이루어지고 있는지 자세히 알아볼 필요가 있다 표11 대한민국 및 EU5의 킴리아주 급여와 관련된 제도 및 가격* 대한민국 프랑스 독일 이탈리아 스페인 영국 급여방식 성과기반 환급방식, 총액제한 근거생산 조건부급여 성과기반 rebate 방식 성과기반 환급방식 성과기반 환급방식 근거생산 조건부급여 세부사항 개별 환자의 치료 성과와 연계하여 지급 방식 주요 임상시험부 터 프랑스 환자들에게 사용되는 자료를 장기적으로 모아 매년 재평가 개별 환자의 치료 성과와 연계하여 r ebate (환불) 개별 환자의 치료 성과와 연계하여 3 분할 지급 방식 개별 환자의 치료 성과와 연계하여 2 분할 지급 방식 주요 임상시험부 터 영국 환자들에게 사용되는 자료를 장기적으로 모아 향후 가격 재평가 평가변수 관해상태 생존률 생존률 관해상태 질병악화 이상반응 생존 세부사항 기밀 완전 관해 & 생존 생존 & 치료 후 줄기세포 이식 여부, 면역 글로불린 사용 여부 가격 ($**) \3.6억 ($271,350) €320,000 ($321,152) €320,000 ($321,152) €300,000 ($301,080) €320,000 ($321,152) £282,000 ($333,380) *Jesper Jørgensen, 2020 내용 일부 번역 **2022년 8월 22 환율 기준 우리나라와 E U 5 의 비교를 용이하게 하기 위해 킴리아주의 급여 방식 , 세부사항 , 평가변수, 가격을 표로 정리하였다 우리나라의 경우 성과기반 환급방식 및 총액제한형을 혼합한 형태로 급여가 이루어지고 있지만, 프랑스와 영국의 경우 근거생산 조건부급여가
2.3.2. 독일 독일은 출시되는 첫 신약은 12개월동안 무료로 가격이 책정되고, 이 기간 동안 HTA가 시행된다. HTA는 독일 109개의 의료보험사의 산하 기관인 the National Association of Statutory Health Insurance Funds (GKV Spitzenverband)와의 가격 협상에 사용된다 킴리아주도 마찬가지로 이 12개월 기간 동안 무료로 가격이 책정되었고, 그 기간 동안
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 28 서울대학교 약학정책연구회 이루어지고 있다 이러한 급여 형태는 Coverage with Evidence Development (CED)라고 불리는데, 장기적으로 real world data(RWD)를 수집하여 향후 가격 및 급여를 재평가하는 방식이다 독일의 경우 성과 기반 rebate 방식을 채택했고, 이탈리아와 프랑스는 성과기반 환급방식을 채택했다. 독일의 경우 특정 기간 내에 환자가 사망을 하게 된다면 제약사가 일부 환불을 하게 된다 그리고 이탈리아와 스페인의 경우 분할 지급 방식을 통해 특정 기간 내에 환자의 상태를 평가하여 급여 기준을 만족하면 환급이 진행되는 방식이다. 여기서 환자의 상태를 평가하는 기준을 평가변수라고 한다 평가변수의 경우 EU5 모두 제각기 다른 평가변수를 가지고 있지만, 생존 혹은 관해 상태가 약의 효과에 있어서 중요한 변수로 나타나는 것을 알 수 있다 2.3.1. 프랑스 프랑스는 European MA 이전 약물을 사용할 수 있는 ‘Temporary Authorisation for Us e’ ( Autorisation T emporaire d’Utilisation , A T U )를 통해 소수의 환자에 대해 킴리아주를 투약하여 안전성, 유효성 및 임상 실무에 대한 실제 데이터를 수집했다. ATU 는 안전성, 유효성 및 임상 실무에 대한 실제 데이터를 수집하기 위한 수단으로 사용되며, 이 정보는 임상 데이터 외에 MA 시 후속 건강기술평가(Health Technology Assessment, H TA) 및 가격 재평가를 위해 사용된다 결론적으로 2018년 12월 킴리아주에 대한 평가 결과 치료 과정의 장기적 효과, 안정성 및 복잡성에 관한 불확실성을 해결하기 위해 추가적인 장기 데이터를 수집해야 한다고 판단했다 따라서 투약 후 28일, 100일, 6개월 및 이후 6개월마다 환자의 데이터를 기록하고 병원에 보고된다.
성과기반 rebate 방식의 계약으로 체결되었다 결론적으로 킴리아주 투약 후 기간 내에 사망한 환자에 대해 rebate를 제공하게 된다. 생존 기간 및 rebate의 규모는 공적인 조사가 이루어지지 않았지만, 주요 조사에 따르면 각각 12개월과 50% 미만인 것으로 나타났다. 2.3.3. 이탈리아 이탈리아는 킴리아주의 출시로 인해 단계별 지불 체계를 처음 도입했다. 이탈리아 의약품청 ( AI F A ) 는 환자의 데이터를 수집하는 인프라인 AI F A registr y 를 2005 년에 설립하였다. 따라서 이 인프라를 바탕으로 개별 환자의 치료 결과를 파악하고, 이것이 달성되고 지속되는 한 분할 방식으로 급여가 진행된다. 킴리아주의 경우 주입 시, 6개월 후, 12개월 후로 총 세 시점에서 급여가 이루어진다 2.3.4. 스페인 스페인은 이탈리아와 비슷하게 킴리아주에 대하여 단계별 지불 체계가 이루어진다 스페인의 의료 보험에 관한 관리 시스템인 Valtermed의 임상 데이터를 바탕으로 결과 기반 단계별 급여를 진행했다 따라서 킴리아주 주입 시 52%의 비용이 급여가 이루어지고,
제 3절 현행 위험분담제의 한계점 위험분담제의 치명적인 문제 중 하나는 정보의 불균형이다. 표8에서 알 수 있듯이, 위험분담계약이 성사된 약제들 중 절반 이상이 경제성 평가 자료 제출을 면제받았다. 따라서 위험분담제의
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 29 서울대학교 약학정책연구회 18개월 후 환자의 치료 결과에 따라 나머지 48%의 비용에 대하여 급여가 이루어진다 2.3.5. 영국 영국은 유럽 의약품청(European Medicines Agency, EMA)의 기준을 충족한 항암 약물에 대하여 Cancer Drugs Fund(CDF)로부터 급여가 이루어진다. CDF는 건강보험 급여적용이 되지 않는 항암제의 지원을 위해 2011년 도입된 제도로, 제약회사와 정부, 민간의료재단 등이 출자해 재원을 조성하며, 비용효과성이 다소 떨어지더라도 사회적 요구도가 높은 고가 항암제를 보장하고 있다 킴리아주의 경우 임상 데이터의 높은 불확실성과 한계로 보편화를 권고할 수는 없다고 판단했지만, 실제 효과에 대한 더 많은 데이터를 수집하는 조건으로 CDF의 접근을 승인했다 킴리아주는 MA를 획득한 지 10일도 안되어 CDF를 통한 ALL 급여가 진행되었고, 차례로 DLBCL에 대해서도 급여가 진행되었다 두 적응증 모두 기밀 할인(confidential discounts) 및 향후 가격 재평가를 위한 추가 데이터 수집 및 제출을 조건으로 승인되었다 2.4 소결 결론적으로 유럽은 서론에서 언급했듯, 킴리아주와 같은 초고가 신약에 대해서 재정 기반 위험분담 방식이 아닌 개별 환자 데이터의 수집을 통한 성과기반 환급방식 (Outcom es based reimbursement, OBR)에 대한 수요가 높다는 것을 알 수 있다. 특히 이탈리아와 스페인의 경우 단계별 지불이라는 새로운 방법을 통해 OBR에 대한 새로운 방식을 제공하고 있다. 일본 또한 위험분담제를 사용하지 않지만 개별 환자 데이터의 수집을 통해 비용 대비 효과를 평가하여 향후 의약품의 가격을 재평가한다 이처럼 개별 환자의 데이터인 real world evidence(RWE)는 임상 환경에서 건강 편익의 가치를 입증하는 데 점점 더 강력한 역할을 하고 있다
재정 효과에 대한 후속 연구가 필요하다 그러나 심사평가원 등을 통해 대중에게 공개되는 자료는 계약의 세부적인 숫자와 평가의 이유 등이 가려져 있어(그림5) , 관계자 이외의 연구자들은 어떤 위험분담계약이 객관적으로 합당한지 평가하기 어렵다. 따라서 심사평가원, 국민건강보험공단 등에서 고가 신약의 사용 비율 등의 자료를 보다 적극적으로 공개해야 할 필요가 있다

[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 30 서울대학교 약학정책연구회 그림5. 건강보험심사평가원의 킴리아주 급여 적정성 평가 결과 자료. 금액 등의 구체적인 조건들은 모두 가려져서 외부 연구자들은 해당 위험분담계약이 합리적인지 판단하기 어렵다 국내외 위험분담계약에서 주를 이루고 있는 재정 기반 방식의 경우 상대적으로 행정 부담이 적고 모니터링이 필요하지 않아 보건당국 입장에서 운영하기에 효율적이지만, 성과 기반 방식에 비해 다소 투명성이 떨어지는 단점이 있다 (이태진, 2016). 특히 국내 위험분담계약 중에서는 환급형이 많은데 , 환급형의 경우 상한가격 ( 표시가격 ) 과 실제가격의 차이가 발생하여 전세계적으로 필요 이상의 높은 약가가 책정되는 등 약가 체계의 투명성에 대한 이의가 제기될 수 있다. 또한, 일반적으로 어떤 나라에서 어떤 약에 대한 약가를 책정할 때 타 국가에서의 약가를 참고하는 경향이 있는데, 이때 실제 가격보다 더 높은 표시가격으로 인해 윤리적인 문제가 발생할 수 있다 한편, 앞서 예시를 든 킴리아주에 적용된 성과에 기반한 위험분담계약의 가장 큰 맹점은 ‘성과’ 측정의 기준이 모호하다는 것이다. 약효가 어느정도 작용한다면 성공한 것이 아니냐고 생각할 수 있지만, 약효라는 것은 사실 굉장히 모호한 기준이다 환자의 사망 여부, 사망한 환자의 직접 사인, 환장의 림프구 수치 등 그 기준이 될 수 있는 후보들은 많다 이들 중에서 어떤 지표가 가장 직접적으로 약효를 나타내는지를 확인해야 하는데, 이는 많은 시간과 비용이 소모되는 작업이다. 예를 들어, 어떤 림프암 치료제의 성과 기준을 환자의 직접 사인으로 정하고 사인이 림프암과 직접적으로 연결되어 있을 때를 ‘실패’로 간주할 수 있다. 그렇다면 해당 치료제를 투여받은 림프암 환자가 파상풍 감염으로 인해 사망했을 경우 치료제의 성패를 가리기 위해 림프암과 파상풍 발생이 10 0% 독립적인지를 확인해야 한다 이를 위해서는 림프암 환자와 파상풍 환자의 데이터를 수집하여 역학연구를 수행하는데 이렇게 모든 가능한 원인들에 대해 매번 역학연구를 수행하는 것은 현실적으로 불가능하다 뿐만 아니라 어느 정도의 수치를 기준치로 둘 것인지에 대한 선행연구가 필요하며, 환자의 림프구 수치를 측정하고 기준치와 비교하기
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 31 서울대학교 약학정책연구회 위해 꾸준한 모니터링이 필요하다 이렇듯 성과 기반 위험분담계약 방식에는 막대한 행정부담이 따른다. 이로 인해 여러 국가들에서 대체적으로 재정 기반 방식의 위험분담계약을 선호하였으나, 최근 들어 성과 기반 계약을 맺은 신약들이 다시 등장하고 있다 이들은 과거의 경험을 바탕으로 성과 기반 계약 방식을 체결하되, 행정 부담을 줄이기 위해 간단하면서도 약효를 직관적으로 드러낼 수 있는 평가 지표를 사용하고자 하였다 영국의 경우, 게피티닙에 대한 위험분담계약을 맺으면서 첫 3개월 이내 약 복용이 중단된다면 제약사에 대금을 지불하지 않을 것을 명시했다 즉, 약 복용의 중단을 실패로 간주한 것이다 환자가 스스로 혹은 의사의 진찰 하에 약효가 듣지 않는다고 판단했거나, 약물에 의한 부작용을 겪거나, 약효가 없어 사망한 경우 등을 ‘첫 3개월 이내 약물 복용 중단’으로 뭉뚱그린 것이다 이를 통해 영국 보건당국은 행정 부담을 최소화하면서 환자들에게 약물에 대한 조기 접근을 가능케 할 수 있었다. 반면 이탈리아 의약품청(AIFA)의 경우 에스브리트정에 대한 위험분담계약을 맺으면서 성공 사례(success fee) 방식을 제시하였다 치료 시작 후 165~195일째 기간중에 환자가 속한 의료 기관에서 치료의 성패를 평가하여 제약사에 전달하고, 제약사는 이를 토대로 보건당국에 송장을 보낸다 이 경우는 치료 성패 평가의 기간을 한정짓고, 또 엄격한 치료 성공 기준을 내세우는 대신 의료진에게 치료 성공 여부의 평가를 맡겨 행정부담을 줄일 수 있었다 하지만 이러한 노력에도 불구하고 여전히 한계점들이 남아있다 우선, 정보가 부족하다 계약을 체결할 당시 해당 평가변수가 약효를 평가하기에 타당한지를 판단해야 하는데, 이때는 계약이 체결되기 전이므로 임상시험 데이터 외에는 실제로 약을 투여받은 환자가 거의 없어 실제 outcome 데이터에 대한 접근성에 제한이 발생한다 또한, 치료제는 effe ctiveness뿐만 아니라 비용, baseline risk, baseline quality of life 등 여러 가지 요소들에 그 가치를 두는데, 성과 기반 위험분담계약은 그중 오로지 effectiveness에 기반한 치료제의 가치만을 보증하게 된다. 따라서 baseline risk가 높거나 치료 효과에 대한 불확실성이 큰 경우 치료제의 가치에서 effectiveness가 차지하는 비율이 커져 성과에 기반한 위험분담계약이 효과적이지만, 그렇지 않고 baseline risk가 낮거나 natu ral history에 대한 평가가 정밀하지 못할 경우 성과 기반 방식이 효과적이지 못하다 제3장 결론 제1절 현행 위험분담제의 개선방안 제언 위에서 분석한 한계점을 바탕으로 제언할 개선방안들은 다음과 같다. 첫째, 위험분담계약 시의 정보의 불균형을 해결하기 위해 성과기반 위험분담제의 경우 자세한 가이드라인 공개가 필요하다 가이드라인에 제시되어야 할 내용으로는 성과를 인정하는 임상 기준과 그 평가 근거가 있다 성과기반 위험분담제가 2022년부터 도입하게 된 가장 큰 이유는 고가 의약품의 등장이라고 볼 수 있다 그러나 고가 의약품에 대한 급여 관리방안도 2022년 7월이 되어서야 발표되었고, 고가의약품에 대한 기준도 명확하지 않다 ‘1인당 소요비용 3억원 이상의 약제’는 2021년 기준 품목수 15개 (성분수 10개)
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 32 서울대학교 약학정책연구회 로 나타나 있지만, 1인당 소요비용이라는 것이 완치가 기준인 것인지 1년 동안 소요된 비용인 것인지 정확하지 않다. 이처럼 고가의약품에 대한 정의 자체도 불투명한 상황에서, 성과기반 위험분담제를 시행하기 위한 데이터 수집이 원활하게 이루어질 수 있을지는 의문이다. 개별 환자 데이터의 평가변수에 대한 명확한 가이드라인 및 투명성을 확보하면 재정 지출의 낭비를 막고, 공정성도 확보할 수 있을 것이다 둘째, 환자의 접근성 향상을 위해 다양한 방법들을 생각해볼 수 있다 우선 위험분담제의 경제성평가 면제 대상을 확장해볼 수 있다. 경제성평가면제 요건에는 환자의 ‘생명을 위협하는’이라는 필수조건이 포함되어 있는데, 희귀질환 중 일부는 생명을 단기간 내에 위협하지는 않지만 환자 삶의 질을 현저히 떨어트리는 경우가 있어 이들을 경제성평가면제대상에 포함하는 것을 검토할 필요가 있다 특히 이러한 질환들은 장기간, 거의 평생에 걸쳐 약을 복용해야 하기 때문에 환자들의 지출 비용이 큰 편이므로, 이러한 환자들을 위험분담제도 안으로 수용한다면 현재 약을 제공 받지 못하는 많은 이들의 삶의 질에 기여할 수 있을 것이다 또, 제도 등재 절차의 소요 기간을 단축하는 방안 역시 검토해볼 수 있다 현재 건강보험심사평가원의 평가 기간과 건강보험공단의 가격 협상 기한은 각각 120~150일, 60일인데, 이를 단축한다면 환자들이 약물에 보다 일찍 접근할 수 있을 것이다 다만, 구체적으로 얼마나 단축했을 때 가장 큰 효율을 얻을 수 있을지, 소요 기한 단축 시 안정성 및 효과성에 대한 충분한 검토가 이루어질 수 있을지에 대해서는 추가적인 연구가 필요하다. 셋째, 위험분담계약 약물의 재정 영향에 대한 분석이 국가적으로 이루어져야 한다 특히 요즘 논의 중인 선진입 후평가 급여 모델의 효율에 대한 연구 역시 필요하다 이는 대체 약제가 없거나 임상자료가 불충분한 약제들에 대한 환자의 접근성을 증진시키기 위하여 현재의 데이터만으로 판단하여 등재하되, 이후 그 유용성이나 경제성에 대한 재평가를 실시하여 약가를 결정한 뒤 환급하는 제도이다 그러나 일반적으로 한 번 급여가 등재된 약제가 이후에 유용성이나 경제성이 떨어진다고 판단되어도 그때까지 혜택을 누린 사람들이 지속적인 급여를 요구하기 때문에 이를 급여 시장에서 퇴출하기 어렵다 실제로 네덜란드의 경우 초기 위험분담계약 약물들의 1/3 가량이 재평가 과정에서 급여 중지가 결정되었지만, 사회적 압력에 의해 재평가 이후에도 지속적으로 급여가 이루어졌다 따라서 이러한 명확한 재평가 기준 등을 제시하기 위해 많은 연구가 이루어져야 할 것이다. 넷째, 고가 의약품의 위험 분담 방안과 관련하여 다양한 방법을 시도해볼 수 있다 보험재정 상황과 환자 접근성을 모두 충족할 수 있도록 혁신 신약에 대한 별도 재원(기금) 을 조성하는 방안을 검토할 수 있다 앞서 보았듯, 영국의 CDF의 경우 의약품의 가치를 평가할 수 있는 자료가 불충분하여 불확실성이 발생하는 경우가 있다는 점 등을 고려하여 급여의 예외 기전으로 다양한 형태의 의약품 별도 기금제도를 운영하고 있다 우리나라의 경우도 C DF 를 착안하여 제약사와 정부 , 의료재단 등이 합의하여 일정 기준에 따라 출원하거나, 사회복지기금을 통해 기부를 받아 건강보험공단이 자금을 관리 및 운영하는 방식을 통하여 아직 급여가 이루어지지 않은 약제에 대해서도 빠르게 환자가 제공받을 수 있도록 할 수 있다 또한 킴리아주의 예시에서 알 수 있듯이 위험분담제를 사용하는 고가 의약품의 경우 개별 환자의 데이터 분석을 통한 성과기반 환급방식으로 급여가 이루어지고 있다 따라서
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 33 서울대학교 약학정책연구회 일본의 경우와 마찬가지로 데이터를 바탕으로 비용 대비 효과성 평가를 통하여 의약품에 대한 약가를 지속적으로 재평가하여 고가 의약품의 약가를 낮추는 방법이 있다. 실제로 보건복지부는 제1차 국민건강보험종합계획(2019년 5월)에 따라, 약제 급여 적정성 재평가 대상 성분을 선정하고 각각 재평가를 추진하였다. 재평가 대상의 품목 선정 기준은 ① 청구현황(청구금액 연간 총 청구액의 0.1% 이상(약 191억 원) 및 최근 증가율) ②제외국 (A8) 허가 및 급여현황 ③정책적·사회적 요구도 ④기타 약제급여평가위원회가 필요하다고 인정하는 경우이다(보건복지부, 2019). 여기서 더 나아가서, 약제 급여적정성 재평가 뿐 만 아니라 약가 재설정 또한 이루어질 수 있다. 그러나 ①의 경우를 제외하고는 그 기준이 모호하다 따라서 보건복지부가 설정한 고가 의약품의 급여 관리방안 적용 대상 의약품 역시 약제 급여 적정성 재평가 대상으로 선정하여 지속적으로 약제 급여 적정성 재평가 및 약가 재설정이 이루어진다면 보다 효과적으로 재정적 부담을 완화할 수 있을 것이다. 제2절 요약 및 결론 위험분담계약은 고가화되는 신약의 재정적 부담을 완화하고, 환자에의 접근성을 높이기 위한 목적으로 시행되어왔다. 2013년 2월 첫 도입 이후 계약 건수가 꾸준히 증가해왔으며, 2022년 현재 누적 총 60종의 약물(성분명 기준)에 5개의 유형이 적용되었다 Risk가 큰 약물의 위험 분담이 목적인 만큼 고가신약 및 최근에 등장한 원샷치료제에 대해서는 여러 유형을 중복 적용하는 경향을 보이며, 적용 약제의 약 50%가 희귀질환치료제임에 근거하여 환자의 접근성을 향상한다는 기존의 목적에 맞게 운영되고 있음을 알 수 있었다 초고가신약의 재정적 위험 분담을 위하여 한국의 경우 2022 년부터 성과기반 위험분담제를 도입, 환자 부담을 줄이는 동시에 재정 지출 위험을 줄이고자 하였다 한국 최초의 한자단위 성과기반 위험분담제 적용 약물인 킴리아주를 중심으로 사례 연구를 진행하였으며, 국내 보건당국이 급여 책정에 있어 해외 사례를 많이 참고하는 점을 감안하여 국내외 사례를 모두 분석하였다 국가 의료 정책 특성상 별다른 위험분담제가 적용되지 않는 일본을 제외하면 유럽 국가들의 경우 근거생산 조건부급여(프랑스, 영국), 성과기반 방식(독일, 이탈리아, 스페인)을 사용하는 것이 확인되었다 평가변수를 통해 파악한 환자의 상태에 따라 환급하는 방식으로 이루어지며 , 세부 사항은 국가마다 차별점이 있었다 위험분담제가 대체로 원 목적에 부합함에도 불구하고 몇 가지 한계점이 존재하였다 재정 기반 방식의 경우 대부분의 정보를 미공개하므로 투명성과 공정성이 떨어진다. 성과 기반 방식의 경우 약효를 입증하기 위한 평가 변수의 설정이 중요한데, 평가변수 설정의 어려움과 평가 시 복합적인 요인이 겹칠 수 있음에 대한 복잡함이 문제점으로 남는다 또한 위험분담제를 통해 급여 소요 시간을 약 2달정도 단축함으로써 환자의 접근성을 향상시켰지만, 협상 결렬 시 급여 중지가 되고, 환자의 치료 중지 사유가 된다는 점에서 환자에게 부담을 준다는 한계점이 있다 (이원국, 2022). 이러한 한계를 개선하기 위해 본 연구에서는 ①평가변수에 대한 자세한 가이드라인 공개 및 계약 내용에 대한 사실을 공개하여 투명성과 공정성을 확보 ② 추가적인 환자의 의약품 접근성 증가 방법 도모 ③ 위험분담계약의 재정 영향에 대한 연구를 통해 재평가 등에 대한 기준을 제시 ④보험재정 상황과 환자 접근성을 모두 충족할 수 있도록 혁신
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 34 서울대학교 약학정책연구회 신약에 대한 별도 기금 조성 검토 ⑤ 전반적인 경제성평가면제제도 및 위험분담제를 확대하여 더 넓은 범위의 희귀의약품 치료제 등을 대상으로 하는 방안을 제시하였다. 제3절 연구의 의의 및 한계점 본 연구는 위험분담제의 적용 기준과 방법에 대해 분석한 후 평가하였다 위험분담제 및 경제성 평가 확대에 대한 논의가 이루어지고 있는 지금, 시의성이 높으며 관련 논의가 이루어질 때 판단의 준거로 사용될 수 있다 2022년 정부 주도로 위험분담제 성과평가 연구 용역이 진행되고 있으나 완료되기까지 시간이 꽤 필요할 것으로 보이며, 정부 주도가 아닌 독립적인 연구자의 입장에서의 연구도 꼭 필요하다 또한 현행 규제기관에서 사용하고 있는 위험분담제 유형의 분류를 사용하여 연구를 진행하였다. 이러한 실제 정책과의 정합성은 유형 관련 용어 차이가 많아서 이해에 어려운 점이 있는 선행 연구들을 보완할 수 있다 그리고 우리나라에서 원샷치료제 킴리아주 등 최근 신약의 위험분담제 적용 사례, 특히 2022년부터 도입된 환자단위 성과기반 계약방식에 대하여 심층 분석을 진행하였다 최신 계약 방식인만큼 이에 관련한 국내 연구는 거의 없는 상황에서 분석을 진행하였다는 점에서 큰 의미가 있다. 그러나 본 연구에는 다음과 같은 한계점이 존재한다. 첫째, 현재 계약이 체결된 약제에 대한 2022년 기준 완성된 리스트가 없어서 이전 자료들과 보도 자료를 종합하여 계약 현황을 파악하였으므로 누락된 부분이 존재할 수 있다. 규제기관 자체적으로 위험분담계약 등 정책들이 적용된 약물의 목록을 주기적으로 출판한다면 국민의 알 권리와 연구에 큰 도움이 될 것이라고 생각한다. 둘째, 위험분담제 정책의 경제적 효과 분석이 충분히 이루어지지 못했다 기존 비급여 가격이 공개되지 않아 알기 어려웠고, 모든 약제들의 투약 횟수 및 용량을 반영하지 못하여 단회 투여 시의 가격 분석에 그쳤다 본 연구의 연구결과를 통해 현재 위험분담제 적용 약제의 급여가격 경향성을 파악할 수는 있으나, 보다 정확한 재정 효과 분석을 위해서는 추가 자료와 연구가 필요하다 셋째, 환자단위 성과기반 계약방식의 경우 아직 체결 건수가 2 건으로 사례가 많지 않아 일반적인 결론을 도출하는 데에는 어려움이 있다 넷째, 킴리아주의 사례분석을 통해 외국의 위험분담제 적용 방식을 소개하였으나, 단일 사례를 통해 해외 위험분담제의 적용 양상에 대해 알기는 어려울 것이다 해외의 위험분담제와 우리나라의 위험분담제를 비교하고자 한다면 보건 체계 분석과 철저한 방법론을 이용한 추가 비교 연구가 필요하다. 이러한 한계점들을 바탕으로 이후 위험분담제 연구를 발전시키기 위해 위험분담제의 경제적 효과에 대한 분석 및 환자단위 성과 기반 계약 방식 등 성과 기반 계약의 ‘성과’ 평가 방식에 대한 연구가 이루어져야 한다 또한, 위험분담제 및 경제성 평가 면제 대상의 확대 여부, 평가 기한 단축의 효율, 새로운 급여 모델 도입 등에 대한 추가적인 연구가 필요하다 이 연구가 위험분담제의 추후 연구에 도움을 주고 심평원 등 정책 입안자 및 관련자들이 참고할 수 있기를 기대한다.
보고서 이태진 외 ( 2 0 1 6) 위험분담제 적용약제의 사후관리 방안 등 연구 건강보험심사평가원 , 서울대학교 산학협력단. 건강보험정책연구원(2017). 건강보험 고비용의약품 현황과 관리방안
건강보험심사평가원(2020), 201008_신약 등 협상대상 약제의 세부평가기준(개정전문) 국회입법조사처(2022), 2022 국정감사 이슈 분석 제9권 보건복지위원회, 여성가족위원회 보도자료 식품의약품안전처 (2021), 키메라 항원 수용체 T세포(CAR T) 항암제 ‘킴리아주’ 국내 허가 건강보험심사
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 35 서울대학교 약학정책연구회 참고문헌 논문 박실비아. (2010). 의약품 가격 지불에서 위험분담계약의 동향과 고찰. 보건 ·복지 Issue&Focus, 21( ), 1 8 허순임 . ( 2 0 21 ) . 의약품급여정책에 대한 행위자 중심 제도주의 분석 선별등재제도와 위험분담제를 중심으로 보건경제와 정책연구, 27(1), 33 66 이종혁, 방준석 (2018) 우리나라 건강보험의 위험분담제도가 재정 및 환자접근성에 미친 영향 한국임상약학회지, 28(2), 124 130. Sandhu, A T., Heidenreich, P A., Lin, J., Parizo, J., Bhattacharya, J., & Goldhaber Fieb ert, J. D. (2022). Perks and Pitfalls of Performance Linked Reimbursement for Novel Drugs: The Case of Sacubitril Valsartan Circulation: Cardiovascular Quality and Ou tcomes, 15(1), e007993. https://doi org/doi:10.1161/CIRCOUTCOMES.121.007993 Holleman, M S., Uyl de Groot, C A., Goodall, S., & van der Linden, N (2019) Determinin g the Comparative Value of Pharmaceutical Risk Sharing Policies in Non Small Cell L ung Cancer Using Real World Data. Value in Health, 22(3), 322 331. https://doi.org/ https://doi org/10.1016/j jval.2018 08 007 Jørgensen, J., Hanna, E., & Kefalas, P (2020) Outcomes based reimbursement for gene the rapies in practice: The experience of recently launched CAR T cell therapies in maj or European countries. Journal of Market Access & Health Policy, 8(1), 1715536.
평가원 (2022), 2021년 제7차 중증(암)질환심의위원회 심의결과 공개 건강보험심사평가원 (2022), 제7차 중증(암)질환심의위원회에서 심의된 ‘킴리아주’ 관련 보도 참고자료 보건복지부 (2022), 2022년 제7차 건강보험정책심의위원회 개최 (3.31) 보건복지부 (2022), 2022년 제16차 건강보험정책심의위원회 개최 (7.20) 인터넷 자료 “英 ‘이레사’ 고정가격에 급여권고” 의학신문, 2010.05.27 http://www bosa co kr/news/articleView html?idxno=153349 “‘성공과 실패 경험’으로 단단해지고 있는 RSA” 뉴스더보이스헬스케어, 2020.6.10 http://www.newsthevoice.com/news/articleView.html?idxno=12429 국민건강보험공단, 위험분담계약약제 전액본인부담환자 환급 담당 연락처, 2022. 1. 10 https://www ksacs org/board/list html?num=4951&start=15&sort=top%20desc,thread%20desc,pos& code=notice&key=&keyword= 건강보험심사평가원, 약제급여평가위원회 심의결과 https://www hira or kr/bbsDummy do?pgmid=HIRAA020041000100 건강보험심사평가원, 보험인정기준 약가파일
http:// hitnews 364
[급여팀] 한국의 위험분담제 현황과 초고가 신약에서의 적용 방법에 관한 연구 36 서울대학교 약학정책연구회 https://www.hira.or.kr/rd/insuadtcrtr/InsuAdtCrtrList.do?pgmid=HIRAA030069000400 최은택, RSA, 38개 성분 적용 공단 제약 재정분담 '일변도' , 히트뉴스, 2019 05 03 http://www.hitnews.co.kr/news/articleView.html?idxno=8240 “영국'CDF’처럼 희귀질환 치료제 별도기금 조성 필요" 히트뉴스, 2021.10.15
www.
.co.kr/news/articleView.html?idxno=
34 이원국,“위험분담제 5년 재평가, 암으로 묵직하게 응어리진 ‘생존본능’을 자극하다”경향신문, 2022.06.22 https://m khan co kr/life/health/article/202206161753002#c2b 기타 국민건강보험 약제관리실 (2021) 「위험분담제도 성과평가」 연구용역 추진 제안요청서 국민건강보험 약가협상부 (2020) 위험분담약가협상 및 사후관리 협상회 자료 국민건강보험공단 약가협상부. (2020). 위험분담제 설명회 자료 (20.11.2 배포용) 보건복지부 (2019) 제1차 국민건강보험종합계획(2019 2023) 건강보험심사평가원 약제급여평가위원회, (2022), 약제 요양급여의 적정성 평가 결과 tisagenlec leucel 1.2×106 ~ 6×108 개 (킴리아주, 한국노바티스(주)) 건강보험심사평가원 공고 제2022 87호, 2022.4.1. 시행
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 37 [서울대학교 약학정책연구회 허가팀 연구] 국내 신속심사 제도의 현황 및 시사점 해외 신속 프로그램 및 사례 비교를 바탕으로 서울대학교 약학대학 약학정책연구회 3기 허가팀 김준희, 서윤열, 정유진, 최형우 우수 연구 (2 등 ) 본 연구는 학회 내부 상호 평가를 통해 2022년도 서울대학교 약학정책연구회 우수 연구(2등)으로 선정되었습니다 평가 기준에는 발표의 완성도, 내용의 완결성, 연구방법의 적절성, 연구 결과의 학문적 기여도, 피드백의 수용이 있었습니다.
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 38 <초록> 식품의약품안전처의 ‘신속심사제도’는 신속심사 대상이 되는 의약품의 허가 신청 시 다른 의약품보다 먼저 신속하게 심사하여 환자의 치료 기회를 신속하게 보장하기 위한 제도이다 세계 다양한 국가의 규제기관에서 의약품의 신속한 개발과 허가를 지원하기 위하여 다양한 신속 프로그램을 운영하고 있으며, 특히 미국의 경우 1974년 Prioritization Matrix를 시작으로 다양한 허가 사례와 함께 신속 프로그램 제도가 구체화된 바 있다. 우리나라의 현행 신속심사 제도는 미국의 Priority Review 제도를 차용한 형태이므로, 본 연구에서는 해외 국가 중 우리나라 신속심사 제도와 가장 관련 있는 미국 FDA의 신속 프로그램을 알아보고, 이를 국내 현행 신속심사 제도와 사례 중심으로 비교함으로써 국내 신속심사 제도의 한계와 앞으로 나아가야 할 방향을 논의하였다 우선, 본 연구에서는 최근 FDA의 신속 프로그램을 통해 허가된 의약품에 대한 치료적 가치를 선행연구의 연구방법을 이용해 분석하여 FDA의 신속 프로그램의 현황을 파악하였다 이를 통해 FDA의 신속 프로그램은 일반 허가에 비해서 높은 치료적 가치를 갖는 약물을 승인할 가능성이 크나, 여전히 신속 프로그램을 통해 허가 받은 약물의 과반수 이상은 낮은 치료적 가치를 가진다는 결론을 도출할 수 있었다. 이러한 결론을 바탕으로 신속 프로그램을 통해 승인받은 의약품의 확증적 후속 임상 연구나 시판 후 안전관리의 중요성이 높다는 시사점을 제시하였다 또한, 본 연구에서는 미국의 신속 프로그램과 한국의 신속심사 제도를 셀루메티닙, 프레토마니드, 브론패스정 등 허가 사례를 중심으로 비교 및 분석하여 국내 신속심사 제도의 보완점을 분석하고 나아가야 할 방향성을 제시하였다 그 결과로 신속심사 대상 지정에 있어서 FDA의 Priority Review와 같은 구체적인 기준을 마련해야 한다는 점, 식약처가 제약사의 임상시험 설계와 진행을 적극적으로 조력해야 하며 제약사의 불성실한 이행 시 지정 취소가 가능하게 해야 한다는 점, 제약사의 후속 확증 연구 의무화를 위해 제도적 조치가 필요하다는 점을 제언하였다 또한 혁신적 제약기업이 세계시장을 겨냥한 R&D에 투자할 수 있도록 독려하는 제도적 보완이 필요함을 제시하였다. [주제어] 신속 승인, 신속 프로그램, 신속심사과, 셀루메티닙, 프레토마니드, 브론패스정
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 39 목차 제1장 서론 .............................................................. 40 제1절 연구 배경 및 목적 40 제2절 연구 내용 및 방법 41 제2장 본론 .............................................................. 42 제1절 신속 프로그램 소개 ..................................................... 42 1. 해외와 국내 신속 프로그램 소개 42 2. 미국의 신속 프로그램 42 2.1 미국 신속 프로그램의 개정 전 내용과 개정 배경 .............................................................. 42 3. 한국의 신속 프로그램 ........................................................................................................ 47 제2절 신속 승인 현황 및 사례 분석 52 1. 신속 프로그램 적용 품목의 치료적 가치 평가 분석 52 2. 사례 중심의 한·미 신속 프로그램 제도 비교 56 3. 한국의 혁신형 제약기업 제도 및 신속심사 제도 제언: 브론패스정의 사례를 바탕으로 ........ 66 제3장 결론 .............................................................. 68 제1절 요약 및 정리 ........................................................... 68 제2절 연구의 의의 ............................................................ 70 제3절 연구의 한계 및 발전 방향 71 참고문헌 ................................................................ 72
제1절 연구 배경 및 목적 2021년 6월, 미국 식품의약국(이하 FDA)가 아두카누맙(Aducanumab)을 알츠하이머 치료제로 조건부 허가하여 큰 파장을 불러 일으켰다(성은아, 2022). 아두카누맙은 β 아밀로이드에 대한 단일클론항체로, 2003년에 등장한 메만틴(Memantine) 이후 18년만에 등장한 알츠하이머 치료제로 각광받았다(양현덕, 2021). 그러나 아두카누맙에 대한 두 차례의 임상 3상에서 치료 효과에 대해 상반된 결과가 나타났음에도 허가되었다는 사실이 알려지면서 논란이 불거졌다(성은아, 2022). 또한 임상 시험의 대리평가변수(Surrogated endpoint)1 로 것은 FDA의 신속 프로그램이 적용되었기 때문이다(FDA, 2021). FDA의 신속 프로그램(Expedited programs for serious condition)이란 의학적 미충족2 을 해결할 수 있는 중증 질환 치료제의 빠른 허가를 위해 도입된 제도로, 패스트 트랙(Fast Track), 혁신의약품 지정(Breakthrough Therapy), 신속심사(Accelerated Approval), 그리고 우선 심사(Priority Review) 제도가 포함되어 있다. 미국(FDA) 뿐만 아니라 한국(MFDS), 일본(PMDA), 그리고 유럽(EMA) 등 세계 각국에서 의약품의 신속한 승인 및 허가를 위한 제도 이하 신속 프로그램(Expedited Approval)으로 통칭 를 운영하고 있다. 미국의 신속 프로그램은 의학적 미충족을 해결할 수 있는 치료제의 개발에서 새로운 표준으로 자리 잡았다(Senior, M. 2022). 2015년 이후 미국에서 전체 허가 의약품 중 FDA의 신속 프로그
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 40 제1장 서론
채택한 β 아밀로이드가 실제로 알츠하이머를 일으키는 원인 물질인지 확신할 수 없다는 논란에 휩싸이며 임상시험 결과에 대한 의구심은 더욱 증폭되었다. 이러한 논란에 따라 이듬해 미국에서는 아두카누맙의 급여 적용 대상을 제한하였고, 개발사인 바이오젠은 유럽의약품청(EMA)에 제출한 허가 신청을 자진 철회하였다(이슬비, 2022). 아두카누맙이 불충분한 임상 시험 결과를 가지고도 FDA의 조건부 허가를 받을 수 있었던
램을 통해 허가된 의약품의 비율은 항상 60%를 넘겨 왔으며, 지난해 2021년에는 그 비율이 76%에 달하며 최고치를 기록했다 신속 프로그램을 통해 허가된 의약품 중에서는 항암제가 가장 큰 비중을 차지하는 것으로 나타났다. 또한 같은 해 두 가지 이상의 신속 프로그램이 적용된 의약품은 41개 품목 중 28개 품목으로 절반 이상을 차지했다. 신속 승인의 효과는 킴리아(Kymriah)와 같은 성공적인 사례를 통해 확인할 수 있다. 세계 최초의 CAR T 치료제인 킴리아는 우수한 임상 시험 결과를 바탕으로 FDA의 Priority Review와 Breakthrough Therapy 프로그램을 적용 받았다(FDA, 2017). 그에 따라 BLA(생물의약품허가신청) 제출 6개월 만인 2017년 8월에 FDA의 허가를 받았다. 1회 투여에 5억원이라는 고비용과 비표적 부작용의 가능성에도 불구하고 의학적 미충족의 해결과 혁신치료제 및 적응증 확장의 가능성을 인정받아 시장 진입에 성공할 수 있었다. 킴리아가 이끄는 CAR T 치료제 시장의 규모는 2017년 7,200만 달러에서 2021년 17억 1 대상 질환에 대해 임상적으로 의미 있는 치료효과를 예측할 수 있는 평가변수 확증적 평가변수와 서로 인과관계를 가지며 전구체로 간주된다 2 기존 치료법으로 치료할 수 없는 상태
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 41 달러로 성장했고, 2028년에는 250억 달러까지 성장할 것으로 예측된다(Lam, C., 2019). 이렇듯 신속 프로그램이 긍정적으로 활용되는 경우 신약 개발 활성화와 빠른 치료제의 보급, 더 나아가 제약시장의 활성화로 이어질 수 있다 그러나 신속 프로그램이 항상 긍정적인 결과를 불러오지는 않는다 신속 프로그램은 주로 의학적 미충족에 해당하는 질환에 대한 치료제를 대상으로 하고 있어 1차 유효성 평가 변수를 신속하게 확인하기 어렵거나 인과관계가 명백한 대리평가변수가 없는 경우가 많다(Liu K. Y., 2021). 따라서 타당하지 않은 대리평가변수를 가지고 진행된 임상 시험 결과로 의약품을 승인하는 사례가 빈번하다 일각에서는 신속 승인을 통해 허가된 의약품 중 실제로 유의미한 효과를 보이는 의약품이 적다는 점을 지적하고 있다(Beaver J A., 2018). 국내 식품의약품안전처(이하 식약처)는 2020년 8월 31일‘신속심사과’를 설립하여 본격적으로 신속 심사를 위한 인력을 배치하였고, 2022년 5월까지 총 22 품목에 대해 신속 심사를 대상으로 지정했다(식품의약품안전처, 2022). 미국과는 대조적으로 신속 심사를 통한 의약품 허가 사례가 부족하지만, 국내 제약업계의 규모가 점차 성장하고 있어 빠르게 사례가 추가될 것으로 전망된다. 따라서 아두카누맙과 같은 신속 프로그램의 남용 사례를 방지하기 위해 미리 국내 제도를 정비할 필요성이 있다 그와 동시에 국내 신약 개발을 활성화시키고 궁극적으로 글로벌 제약시장으로의 진출을 돕는 방안을 마련해야 한다 본 연구에서는 국내외의 신속 프로그램 및 사례를 비교하여 식약처의 현행 신속심사 제도의 한계점을 분석하고 나아가야 할 방향성을 제시하고자 한다 제2절 연구 내용 및 방법 본론 제1절에서는 신속 프로그램의 발전을 조사하였다. 해외 각국에서 시행중인 신속 프로그램을 알아보고, 이 중 미국 FDA와 한국 식약처를 중점으로 신속 프로그램의 역사와 현행 제도의 특징을 조사하였다 현재 미국과 한국이 시행 중인 제도와 나아가는 방향에 대해 비교하고, 이를 바탕으로 근래에 시행한 식약처의 신속심사 프로그램이 발전할 방향을 제언한다 본론 제2절에서는 신속 프로그램을 통해 허가받은 품목의 치료적 가치 평가 자료를 분석하였다. 이를 위한 자료는 규제 당국(미국, 유럽)과 조사 기관(독일, 프랑스)의 데이터베이스로부터 수집하였으며, 선행 연구(Hwang T J et al, 2020)를 참고하여 연구를 설계했다. 이후 구체적인 사례를 통해 미국과 한국의 신속 프로그램을 비교하였다. 미국과 한국에서 모두 신속 프로그램을 통해 허가 받은 품목(셀루메티닙, 프레토마니드)와 한국에서만 신속 프로그램을 통해 허가 받은 품목(브론패스정)을 구분하여 서술하였으며, FDA와 식약처의 품목허가 보고서를 근거로 작성하였다. 미국과 한국에서 모두 허가 받은 품목에 대해서는 비교 분석을, 한국에서만 허가 받은 품목에서는 혁신형 제약기업 제도를 초점으로 하여 허가 과정을 알아보고, 이를 통해 한국 식약처의 의약품 허가제도 및 신속심사 제도가 나아갈 방향을 제언한다
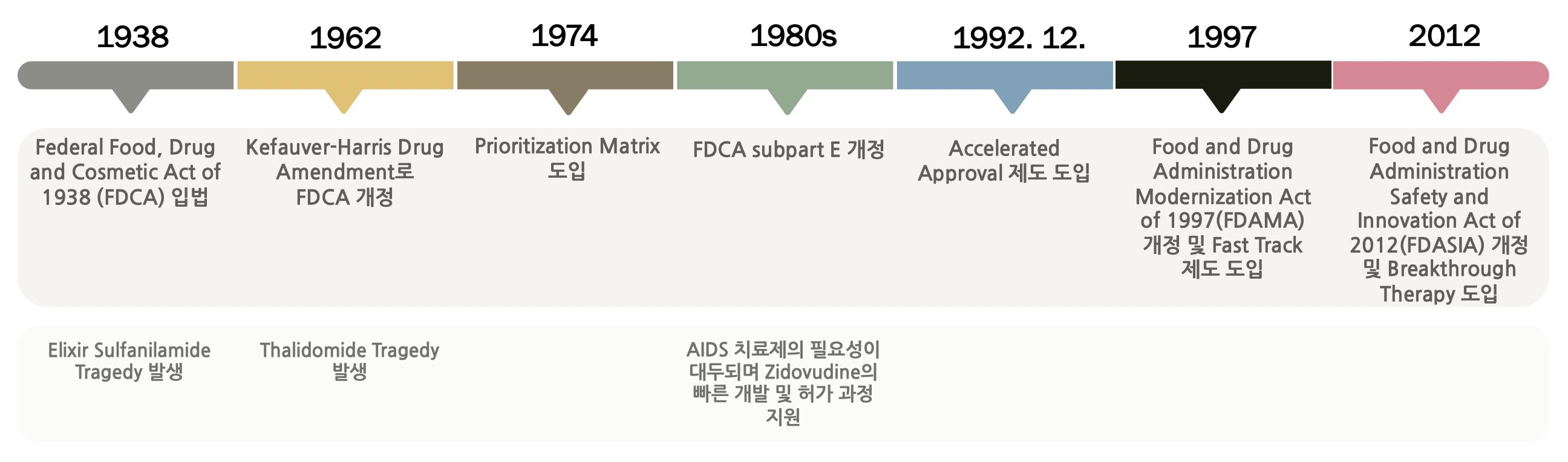
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 42 제2장 본론 제1절 신속 프로그램 소개 1. 해외와 국내 신속 프로그램 소개 1.1. 미국, 유럽, 일본의 제도 소개 미국 FDA, 유럽 EMA, 일본 PMDA는 의약품의 신속한 개발과 허가를 지원하기 위하여 다양한 신속 프로그램을 운영하고 있다(신속심사과, 2021.10.21) 미국 FDA의 경우 Fast Track(패스트 트랙), Breakthrough Therapy(혁신의약품 지정), Accelerated Approval(신속심사), Priority Review(우선심사), 유럽 EMA의 경우 MAEC(예외적 허가), PRIME(프라임), Accelerated Assessment(신속심사), CMA(조건부 허가), 일본 PMDA는 Priority Review(우선심사), SAKIGAKE Designation(사키가케 지정), CEA(조건부조기허가)의 세부적인 분류로 나누고 있다. 미국, 유럽, 일본의 각 규제기관별 신속 프로그램은 제도 도입 목적에 따라 그 특징이 상이하며 적용 대상이 나뉘게 된다 미국의 신속 프로그램은 1974년부터 원형인 Priority Matrix가 도입되어 역사가 길고 이에 따라 많은 의약품이 허가되었으며, 우리나라의 현행 신속심사 제도는 미국의 Priority Review 제도를 차용한 형태이다 따라서 우리는 해외 국가 중 우리나라 신속심사 제도와 가장 관련 있는 미국 FDA의 신속 프로그램을 알아보고, 이를 국내 현행 신속심사 제도와 비교해 봄으로써 우리나라 신속심사 제도의 한계와 앞으로 나아가야 할 방향을 논해보도록 하겠다. 2. 미국의 신속 프로그램 2.1 미국 신속 프로그램의 개정 전 내용과 개정 배경 그림 1 미국 신속 프로그램 타임라인 1938년 Elixir Sulfanilamide Tragedy 발생으로 Federal Food, Drug and Cosmetic Act of 1938 (FDCA) 입법, 1962년 Thalidomide Tragedy 발생으로 Kefauver Harris Drug Amendment로 FDCA 개정, 1974년 Prioritization Matrix 도입, 1980년대 AIDS 치료제의 필요성이 대두되며 Zidovudine의 빠른 개발 및 허가 과정 지원, FDCA subpart E 개정, 1992년 12월 Accelerated Approval 제도 도입, 1997년 FDCA subpart E로부터 발전해 Food
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 43 새로운 의약품 개발 시 FDA에 검토와 승인을 거치는 현대의 제도는 1938년 Federal Food, Drug and Cosmetic Act of 1938(이하 FDCA)의 입법으로부터 시작되었다. 1938년, Elixir Sulfanilamide Tragedy로 인해 입법되었다. 이 법으로 인해 의약품 제조업체는 신약을 시판하기 위해서 FDA에 제품의 안전성을 입증하고, 승인 절차를 거치게 되었다 1962년 Thalidomide Tragedy로 인해 입법부는 Kefauver Harris Drug Amendment를 통해 FDCA를 개정한다. 의약품 제조업체가 신약의 안전성과 효능을 입증하는 실질적인 증거를 제출하도록 의무화하여 현대 임상시험 단계의 토대를 마련하였다 의약품마다 개발 및 승인 절차에 소모되는 시간과 비용이 다르지만, 1962년 Kefauver Harris Drug Amendment를 통한 개정으로 IND와 NDA를 검토하게 되면서 새로운 화합물의 임상 개발 기간이 점차 증가하는 추세였다. 1960년대와 1970년대의 임상 개발에는 평균 7.9년, 8.2년이 걸렸다는 추정이 있으며, 1980년대와 1990년대에 가면서 개발 기간은 더욱 늘어났다. 1990년대 미국 및 유럽연합(EU)에서 출시된 제품은 특허출원부터 시장 출시까지 평균 개발기간이 9.7년에 달하였으며, 2000년 이후 마케팅을 시작한 제품은 13.9년으로 늘어난 것으로 분석됐다. 임상시험 기간이 늘어나는 것과 맞물려 새로운 화합물의 개발 비용도 크게 올랐다. DiMasi의 한 연구에 따르면, 1983년~1994년 사이에 임상시험을 거쳐 1997년 전후로 출시된 의약품의 총 개발 비용은 약 $8023으로, 이는 10년 차이인 1970년 1982년 사이 임상시험을 거쳐 1984년 전후로 출시된 의약품의 총 개발 비용의 2배가량이나 높았다 특히나, 시간에 관련된 비용이 총 비용의 절반을 차지한다는 증거가 제시되었고, 임상시험 비용이 시장 승인을 위한 비용 증가에서 큰 몫을 차지한다고 분석되었다 새로운 의약품 개발에 소요되는 시간과 비용이 증가되는 것과 함께, 질병에 대한 병리학적 이해가 증강되고 질병의 조건들을 과학적으로 규명하게 되면서 신약 승인에 있어 신속한 승인을 촉진하는 제도들이 도입되었다. 가장 먼저 도입된 것은 1974년 FDA에 의해 규격화된 Prioritization Matrix이며, 제도가 더욱 세분화되고 발전됨에 따라 현재의 4가지 신속승인 제도4 가 도입되었다. Original Prioritization Matrix는 FDA가 1974년부터 1992년 1월 1일까지 사용했던 제도이다 FDA 내부적으로 IND와 NDA를 검토할 때, 우선 순위를 매기기 위해서 의약품의 화학적 유형과 치료 효과를 분류하는 Matrix를 사용하기 시작했다. 분류된 약물의 분류 순위가 높을수록 검토자는 NDA 검토 우선순위를 높게 책정하여 자료의 조기제출을 포함한 여러 혜택을 제공했다. 1978년 FDA가 일반적으로 NDA를 승인하는데 평균 32개월이 걸렸던 것에 반해, Priority Matrix를 통해 새로운 화합물로 분류된 21개 NDA가 평균 21개월만에 승인되었다. 3 2000년도 달러환율 기준 4 Fast Track, Breakthrough Therapy, Accelerated Approval, Priority Review. and Drug Administration Modernization Act of 1997(FDAMA)를 개정하며 Fast Track 제도 도입, 2012년 Food and Drug Administration Safety and Innovation Act of 2012(FDASIA)를 개정하며 Breakthrough Therapy가 도입
Approval을 도입한다 중대하거나 인명에 위협을 끼치는 질병에 대한 신약이 환자에게 치료적 효과를 제공하는 경우 Accelerated Approval이 적용될 수 있으며, 의약품의 치료 효과를 임상 효능 Endpoint가 아닌 Surrogate Endpoint로 임상적 편익을 예측해 치료효과를 입증할 수 있도록 했다 예시로써 사망률이 아닌 무진행 생존율(PFS)을 통해 의약품의 치료효과를 평가할 수 있었다 따라서 오랜 시간이 소요되는 임상시험 지표를 대리평가변수로 대체하여 임상시험 기간을 단축할 수 있었다
Fast Track의 지정은 Subpart E로부터 발전하여 1997년, 입법부가 Food and Drug Administration Modernization Act of 1997(FDAMA)를 개정하며 도입되었다. 마지막으로 입법부가 2012년, Food and Drug Administration Safety and Innovation Act of 2012(FDASIA)를 개정하며 Breakthrough Therapy가 도입되었다 FDASIA는 Breakthrough Therapy의 도입뿐 아니라 Accelerated Approval의 보다 광범위한 사용을 허가하였다 이로써
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 44 1980년대에 들어서며 새로운 Tragedy로 AIDS가 부상하였다 AIDS로 대표되는 Tragedy는 천천히 진행되며, 생활 습관을 포함한 환경 요인과 유전적 요인이 복잡하게 작용하는 현대의 여러 질병을 의미한다 이로 인해 FDA가 특정 질환들에 관한 신규 의약품을 빠르게 승인하도록 규제 제도의 변화가 촉진되었다. AIDS의 규명 이후 몇 년간 신약이 출시되지 않았기 때문에, 환자들은 HIV virus로 인한 AIDS의 진행에 아무런 대응을 하지 못했다. 이에 따라 환자들이 암시장에서 인증되지 않은 의약품을 이용하거나, 근거 없는 치료법을 직접 시행하는 등 문제가 심화되었다 제약업계와 환자들은 이런 상황 속에서 FDA의 승인 절차가 보수적이며 위험을 회피한다고 비판하였고, 이러한 압박 속에서 FDCA에 Risk benefit을 고려하는 신규 허가 절차가 도입되었다 FDA는 약 2년만에 첫 AIDS 치료제인 Zidovudine(AZT)를 승인하도록 집중 개발 및 검토 프로그램을 진행했다. AIDS의 유행에 따라 입법부는 ‘Drug lag(약물 지연)’을 조사했고, 의약품의 느린 승인이 FDA의 자원 부족으로 인해 발생한다고 판단해 ‘Prescription Drug User Fee Act(PDUFA)’를 1992년 10월에 통과시킨다. 이에 따라 제약회사는 NDA를 검토해주는 FDA에 요금을 지불했고 FDA는 인력을 충당했으며 우선 순위 검토와 표준 검토의 2가지 트랙을 완성한다. 1992년 12월, FDA는 승인 과정동안 NDA를 빠르게 검토하는 현대의 Accelerated
현대 FDA의 4가지 신속 프로그램인 1) Fast Track, 2) Breakthrough Therapy, 3) Accelerated Approval, 4) Priority Review이 법으로써 성문화되고 제도로 사용되게 되었다. 2.2. 개정된 현재 제도와 그 효과 미국의 신속 프로그램은 FD&C Act (21CFR 314.500)에서 규정하고 있다 Part 314: Application for FDA Approval to market a new drug의 Subpart H: Accelerated Approval of New Drugs for Serious or Life Threatening Illness의 314.500에서 규정되고 있다. 따라서 중대하거나 생명을 위협하는 질환에 대한 신약에 관한
FDA와 더 자주 회의하여 의약품의 개발 계획을 논의하고 의약품 허가에 필요한 데이터 수집을 보장 받을 수 있다.
FDA와 서면 회의를 더 자주하여 설정한 임상계획과 Biomarker의 사용을 검토 받을 수 있다.
기준이 충족될 시, Accelerated Approval과 Priority Review가 적용될 수 있다. Rolling Review 5가 적용될 수 있다.
2) Breakthrough Therapy(FDA, 2018b, Translated by Auther)
Breakthrough Therapy 지정은 심각한 질환에 대한 치료법의 개발 및 심사를 신속하게 처리하기 위한 과정으로, 해당 의약품이 임상적으로 유의한 평가변수6 에 의해 기존 치료법보다 개선점7 이 뚜렷한 경우 해당한다.
Breakthrough Therapy 지정은 제약사가 FDA에 신청
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 45 신속심사로, 그 목적은 해당 의약품이 특정 질환에 대해 최초로 이용 가능한 치료법이거나 기존의 치료보다 이점이 있을 경우, 중대한 질환을 치료하는 의약품을 신속하게 이용 가능하게 하는 것으로 규정하고 있다 현재 FDA는 1) Fast Track, 2) Breakthrough Therapy, 3) Accelerated Approval, 4) Priority Review 4가지 제도로 나누어 신속한 허가를 지원하고 있다 1) Fast Track(FDA, 2018a, Translated by Auther) Fast Track은 의약품 개발 기간을 단축시키기 위한 제도이며, 심각한 질환이나 미충족된 의약품 수요를 해결하는 것이 목적으로, 신약을 환자에게 빠르게 공급하는 것을 목표로 한다 Fast Track 지정 의약품은 반드시 기존의 치료제 대비 치료효과에 이점을 가져야 한다 Fast Track은 제약회사에서 FDA에 지정을 요청하여 이루어진다. Fast Track으로 지정된 의약품은 전체 개발 및 심사 과정동안 FDA와 제약회사 간 긴밀한 커뮤니케이션이 가능해지며 이는 빠른 의약품 허가와 공급으로 이어진다. 다음 중 일부 혹은 전체의 혜택을 받는다
해야 한다. FDA는 (1) 제출된 자료를 검토했을 때 의약품이 Breakthrough Therapy 지정 기준을 만족하며, (2) 지정된 후 남아있는 의약품 개발과정이 혜택을 받을 수 있을 때 신청을 권유할 수 있다. 이상적으로는 임상 2상 종료 후 회의가 끝나기 전까지 지정을 받아야 한다 Breakthrough Therapy 지정의 주된 목적이 효율적으로 허가에 필요한 자료 제작을 할 수 있도록 돕는 것이므로, FDA는 BLA나 NDA가 제출된 다음 신청할 것으로 기대하지는 않는다 Breakthrough Therapy 지정 시의 혜택은 다음과 같다 5 제약사가 Biologic License Application(BLA)나 New Drug Application(NDA)를 FDA에 완성된 section 단위로 제출해 FDA에 평가받는 것 일반적으로는 전문이 작성되어야 FDA에 제출해 평가받는다 6 비가역적인 이환율 또는 사망률(Irreversible morbidity or mortality, 이하 IMM) 혹은 질환을 대표하는 중요한 증상에 대한 영향 7 개선점의 경우 치료효과 및 임상 결과를 통해 판단된다
4) Priority Review(FDA, 2018d, Translated by Auther) 일반적으로 우선심사라고 불리는
Priority Review는 FDA가 1992년, Prescription
Drug User Act(PDUFA)에 따라 의약품 심사 기간을 표준심사(Standard Review)와 우선심사(Priority Review)로 나누며 생
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 46 Fast Track 지정 기능 전체 임상 1상부터, 효율적인 의약품 허가를 위한 가이드 제공 Senior manager가 담당하여 개발 과정에 전념 3) Accelerated Approval(FDA, 2018c, Translated by Auther) 일반적으로 신속심사라고 불리는 Accelerated Approval은 ‘임상적 유의성(Clinical benefit)’을 측정하는 데 대리결과변수(Surrogate endpoint)를 사용할 수 있도록 허용하는 것이다 임상적 유의성이란 주어진 질환에서 임상적으로 의미 있는 긍정적인 치료 효과를 의미한다. 중대한 상태에 대해 미충족된 의료 수요를 채우는 의약품에 Accelerated Approval이 적용되면 대리결과변수를 근거로 하여 허가될 수 있다. 대리평가변수8 란 임상적 유의성을 예측할 수 있다고 간주되지만 그 자체로 임상적 유의성의 척도가 되지는 않는 마커(Marker)이다. 대리평가변수 혹은 중간 임상적 결과변수에 대한 의약품의 효과를 증명하는 시험은 FD&C Act에 명시된 대로 적절히 관리되어야 한다 대리평가변수의 사용은 의약품 허가 과정에서 시간을 단축시켜준다 예시로써 항암제의 경우, 암 환자의 생존이 증가되는 것을 확인하기 위해 기다리지 않고 종양을 축소시킨다는 것을 근거로 의약품을 허가 받을 수 있다 그 이유는 종양의 축소가 실제 임상적 유의성을 합리적으로 예측 가능하다고 간주되기 때문이다. 제약회사는 종양의 축소가 환자들의 생존을 연장시킬 것이라고 예측한 것을 확인하기 위한 시험을 수행해야 하며, 이를 임상 4상 확증적 시험이라고 한다. 확증적 시험을 통해 임상적 유의성이 검증되면 FDA는 해당 건을 종료한다. 임상적 유의성을 검증하지 못하거나 의약품 관련 위해성에 대한 검증이 부족한 경우 허가가 철회되거나 적응증이 변경될 수 있다.
겨났다. FDA는 표준심사에 대해 10개월 이내, 우선심사에 대해 6개월 이내로 의약품 허가신청에 대한 결정을 내리는 것을 목표로 한다. 우선심사 지정은 지정된 의약품이 허가될 경우, 표준 신청 대비 중대한 상태의 치료, 진단 혹은 예방의 안전성 및 유효성에 있어 유의적인 개선을 줄 수 있는 의약품에 대해 이루어진다. FDA는 모든 신청에 대해 자체적으로 표준심사와 우선심사를 결정한다. 그러나 신청자는 ‘Guidance for Industry Expedited Programs for Serious Conditions Drugs and Biologics(FDA, 2020)’에 근거해 우선심사를 요청할 수 있으며, 이는 임상시험 기간에 영향을 주지 않는다. 8 실험적 변수, 방사선 이미지, 신체증상 및 기타 측정치들
등 신속 공급에 대응하였다. 특히 2020년 4월부터는 국내의 코로나19 치료제 및 백신 개발을 프로그램’을 실행하였다.‘허가전담심사팀’을 구성해 운영하면서 허가심사 처리 기간을 기존 180일 이상에서 40일 이내로 단축하여 코로나19 백신의 신속심사를 위해 노력하였다(식품의약품안전평가원, 2022). 우리나라는 코로나19 대유행을 기점으로 2020년 8월 허가심사 전문성을 강화하고 개발중인 의약품의 신속한 제품화를 지원하기 위해 식품의약품안전평가원에 신속심사과를 신설하였다(신속심사과, 2021b). 이로써 의약
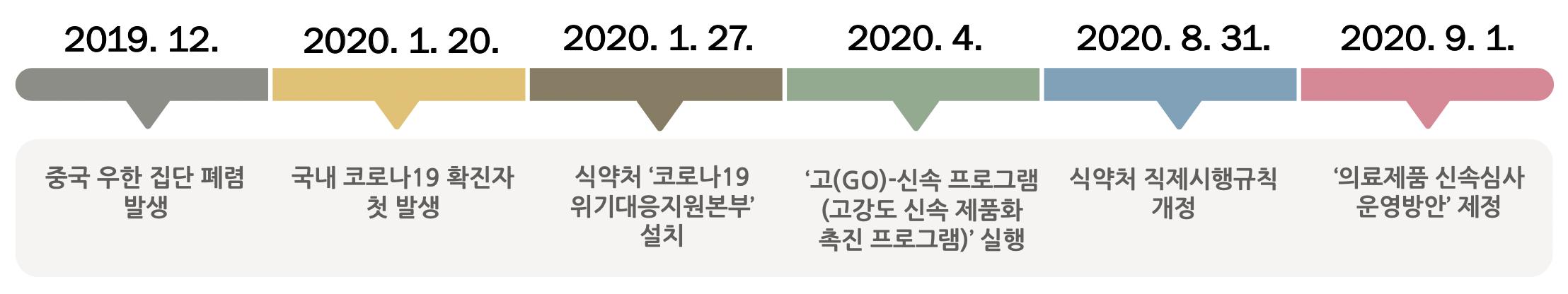
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 47 3. 한국의 신속 프로그램 3.1. 한국 신속 프로그램의 도입 이전 내용과 도입 배경 그림2 한국 신속 프로그램 타임라인 2019년 12월 중국 우한 집단 페렴 발생, 2020년 1월 20일 국내 코로나19 첫 발생, 2020년 1월 27일 식약처‘코로나19 위기대응지원본부 설치, 2020년 4월‘고(GO) 신속 프로그램(고강도 신속 제품화 촉진 프로그램)’실행, 2020년 8월 31일 식약처 직제시행규칙 개정, 2020년 9월 1일‘의료제품 신속심사 운영방안 제정 2019년 12월 중국 우한에서 새로운 유형의 코로나바이러스로 인한 호흡기 질환이 발생하였고 2020년 1월 8일 중국 우한시를 방문하였던 우한시 입국자의 확진으로 국내 코로나19 상황이 시작되었다. 이에 2020년 1월 27일, 식약처 내에는 코로나19 위기대응지원본부가 설치되어 지원본부 내 백신팀이 예방백신위기대응 및 허가 간소화
촉진하고, 국내외에서 개발된 치료제 및 백신을 철저하게 심사하여 신속한 허가를 지원하는 ‘고(GO) 신속
품, 생물학적제제, 한약(생약)제제, 의료기기 허가심사 규정에 따른 신속심사 대상 및 절차를 마련하게 되었다. 3.2. 현재 제도와 그 의의 신속심사과 신설 후 신속심사 업무를 체계적으로 수행하기 위해 2020년 9월 1일‘의료제품 신속심사 운영 방안’이 제정되었다 후술할 내용은 주로 신속심사과에서 제정한 ‘의료제품 신속심사 운영 방안’(신속심사과, 2020b)과 식품의약품안전평가원에서 제시한 ‘의약품의 신속심사 적용 기준에 대한 가이드라인’(식품의약품안전처, 2021b)에 따를 것이다. 현재 신속심사과에서는 신속심사의 대상으로 총 6가지 1) 생명을 위협하는 질환 또는 중대한 질환의 치료를 목적으로 하는 의약품9 으로서 기존 치료법이 없거나 기존 치료법보다 유효성 등에서 의미 있는 개선을 보인 경우, 2) 생물테러감염병 또는 9 희귀의약품 및 개발단계 희귀의약품을 포함한다
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 48 감염병의 대유행10 등 공중보건에 심각한 위해를 끼칠 우려가 있는 감염병의 예방 또는 치료를 목적으로 하는 의약품으로서 기존 치료법이 없거나 기존 치료법에 비해 작용 원리 기전 등이 전혀 새로운 신개념의약품 또는 기존 치료법보다 유효성 등에서 의미 있는 개선을 보인 경우, 3) 혁신형 제약기업이 개발한 신약, 4) 희소의료기기11 , 5) 혁신의료기기12 , 6) 융복합 혁신의료제품13 로 지정하고 있다 그 중에서도 본 글의 주된 논점인 의약품에 관하여 1)부터 3)까지의 내용을 자세히 알아보고자 한다. 1) 생명을 위협하는 질환 또는 중대한 질환의 치료를 목적으로 하는 의약품으로서 기존 치료법이 없거나 기존 치료법보다 유효성 등에서 의미 있는 개선을 보인 경우 위에서 말하는‘생명을 위협하는 질환 또는 중대한 질환’이란, 적절한 치료가 수반되지 않는 경우 사망할 가능성이 높은 질환 또는 일상적 기능 수행에 심각한 영향을 주는 질환을 말한다 질병 또는 상태가 중대한지 여부는 생존, 일상적 기능 수행, 또는 치료하지 않고 방치했을 때 질환의 상태가 악화될 가능성 등과 같은 인자들에 미치는 영향을 고려하여 임상적 판단에 따라 판정된다 기존치료법은 신청하고자 하는 의약품과 동일한 적응증으로 국내에서 이미 허가된 의약품이면서 현재 신청하고자 하는 적응증에 대한 국내 표준치료와 부합하는 치료를 말한다 만약 약물이 대리평가변수 또는 중간 임상적 평가변수를 근거로 하여 신속심사로 허가되었고, 허가 후 치료적 확증 임상시험을 통해 임상적 유익성이 아직 입증되지 않은 경우에는 해당 약물을 기존 치료법으로 간주하지 않는다. 기존 치료법이 없는 경우 명백한 의학적 미충족 상태에 해당되어 신속심사 대상으로 보고, 기존 치료법이 있지만 기존 치료와 비교하였을 때 유효성 등에서 유의미한 장점 및 개선이 있을 때에도 신속심사 적용 대상으로 볼 수 있다 후자의 경우 의학적 미충족을 해결할 것이라고 기대하는 것이며, 기존 치료법과 비교하여 기대되는 작용기전 등의 다양성을 제공하는데 의의를 둔다(식품의약품안전처, 2021b). 2) 생물테러감염병 또는 감염병의 대유행 등 공중보건에 심각한 위해를 끼칠 우려가 있는 감염병의 예방 또는 치료를 목적으로 하는 의약품으로서 기존 치료법이 없거나 기존 치료법에 비해 작용 원리 기전 등이 전혀 새로운 신개념의약품 또는 기존 치료법보다 유효성 등에서 의미 있는 개선을 보인 경우 아스트라제네카, 얀센, 모더나의 COVID 19 백신주가 감염병 예방 목적으로 신속심사 대상으로 지정되어 허가되었다 10 대유행이 현저히 우려되는 감염병의 발생을 포함한다 11 「의료기기법」 제8조제1항제2호에 의거,‘국내에 대상 질환 환자 수가 적고 용도상 특별한 효용가치를 갖는 의료기기로서 식품의약품안전처장이 지정하는 희소의료기기’에 해당한다 12 「의료기기 산업 육성 및 혁신 의료기기 지원법」제2조제4호에 의거,‘의료기기 중 정보통신기술, 생명공학기술, 로봇기술 등 기술집약도가 높고 혁신 속도가 빠른 분야의 첨단 기술의 적용이나 사용방법의 개선 등을 통하여 기존의 의료기기나 치료법에 비하여 안전성ㆍ유효성을 현저히 개선하였거나 개선할 것으로 예상되는 의료기기로서 식품의약품안전처장으로부터 지정을 받은 의료기기’에 해당한다 13 융복합 의료제품에 정보통신 생명공학 데이터 기술 인공지능 등 신기술이 집약된 것으로서 기술 혁신의 정도가 뛰어나거나 사용 목적 등이 유사한 기존 제품보다 안전성, 유효성을 현저히 개선하였거나 개선할 것으로 예상되어 허가심사에 고도의 전문성이 요구되는 제품을 말한다
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 49 3) 혁신형 제약기업이 개발한 신약 혁신형 제약 기업이란 「제약산업 육성 및 지원에 관한 특별법」제2조에 근거하여, 신약 연구개발에 대통령령으로 정하는 일정 규모 이상(최소인증 요건)의 투자를 하는 제약 기업 중 인증을 받은 기업을 말한다. 2022.6.29 보건복지부 고시에 따르면 총 43개 제약기업이 혁신형 제약기업으로 지정되어 있고, 본래 2021.12.24 개정안에 존재하던 파마리서치바이오와 영진약품이 탈락한 상태이다 혁신형 제약기업 제도의 도입 목적은 크게 두 가지에 있다. (1) 국내 제약기업이 복제약(generic), 리베이트 위주의 영업 관행에서 벗어나 글로벌 신약개발 역량을 갖추고, (2) 수출 경쟁력을 제고할 수 있도록 혁신형 제약기업을 선정, 집중 지원함으로써 국내 제약산업의 선진화를 유도 즉, 연구개발 투자를 통해 신약개발 및 품질 향상을 도모하고 다른 기업의 선도적인 역할을 수행하는 것에 의미를 둔다. 혁신형 제약기업으로 인증 받기 위해서는 제약산업육성 지원위원회(특별법 제6조)에서 법령에서 정한 최소요건(시행령 제2조)을 만족해야 한다. 최근 3년을 평균 적용하였을 때, 의약품 매출액 1,000억원 이상의 경우 의약품 R&D 비율 5% 이상, 의약품 매출액 1,000억원 미만의 경우 의약품 R&D 비율 7% 이상 또는 R&D 50억원 이상, 미국 또는 EU GMP 시설을 보유하고 있는 경우 의약품 R&D 비율 3% 이상을 만족해야 최소요건에 부합할 수 있다 최소요건(시행령 제2조)을 갖춘 제약기업 중 미래 R&D 투자 계획, 특허 보유 실적 등 실질적인 신약 개발, 글로벌 진출 역량 및 의지 등을 종합 심사해서 최종 인증을 받을 수 있으며, 특별법 제8조에 따르면, 인증 유효기간은 3년으로 3년마다 재평가를 통해 인증이 연장되는 방식이다. 3년마다 이루어지는 재평가 기간동안 혁신형 제약기업으로서의 인증이 취소될 수 있다 특별법 제9조에 따르면, 혁신형 제약기업으로 인증 받은 기업이 다음 두 가지 중 어느 하나에 해당하는 경우에 보건복지부령으로 정하는 바에 인증이 취소될 수 있다14 . 1. 거짓이나 그 밖의 부정한 방법으로 인증을 받은 때. 2. 인증기준에 적합하지 아니하게 된 때. 혁신형 제약기업 인증 등에 관한 규정 제11조에 따르면, 혁신형 제약기업이 인증 이후에 발생한 위반 행위로 인하여 식약처나 공정거래위원회로부터 행정처분을 받은 경우 해당 기업에 대하여 인증을 취소할 수 있다. 또는 혁신형 제약기업 중‘반복적 리베이트 기업’에 대한 인증이 취소될 수 있다(보건복지부, 2022a) 리베이트 반복 기업에 대해 과징금 및 행정처분횟수 누계가 일정 이상15인 경우 인증 심사 시 결격 또는 인증을 취소하되, 다만 기업의 연구개발(R&D) 투자를 확대하고 신약개발 역량을 제고하고자 하는 혁신형 제약기업 인증 제도의 취지를 고려하여 매출액 대비 연구개발(R&D) 투자 비율이 혁신형 제약기업 인증기준을 일정 이상 상회할 경우 과징금의 일부를 경감할 수 있다16 실제로 2014년 50억원대의 리베이트 혐의로 14 다만 제1호에 한하면 인증을 취소하여야 한다 15 과징금 누계액이 20백만원(약사법), 600백만원(공정거래법) 이상인 경우와 과징금 누계액에 관계없이 3회 이상 과징금 처분 시 16 과징금 경감 기준: 기업의 매출액 대비 R&D비율이 혁신형 제약기업 인증요건(1000억원 미만 기업 7%, 1000억원 이상 기업 5%)을 1.5배 상회 시 과징금의 25% 감경, 2배 상회 시 50% 감경
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 50 공정거래위원회로부터 과징금을 받았던 동화약품의 경우 2015년 혁신형 제약기업 재지정에 신청하지 않은 사례도 존재한다. 신속심사 절차는 크게 신속심사 대상 지정과 신속심사를 통한 허가로 나누어진다. 신청자는 신속심사 대상으로 지정되어야 의약품 신속심사를 신청할 수 있다 신속심사 대상에 해당하는 의료제품의 허가 신청 시 신속심사를 받고자 하는 경우, 허가 신청 전에 ‘의료제품신속심사 지정 신청서’를 제출하여 신속심사 대상으로 지정해 줄 것을 신청할 수 있다. 이때 신속심사 대상 지정을 위해 별도의 신청이 필요할 수 있고, 불필요할 수도 있다 생물학적제제, 유전자재조합의약품, 한약제제 및 생약제제 등을 포함하는 신속심사대상 의약품은 신속심사 대상 지정을 위한 별도 신청이 필요하다 혁신형 제약기업에서 개발한 신약은 허가 신청과 동시에 신속심사 대상 지정을 신청할 수 있다 반면에, 생물테러감염병 또는 감염병의 대유행 등에 사용하는 의약품과 같이 신속한 도입이 필요한 경우에는 지정 신청이 없는 경우라도 신속심사 대상 의약품으로 지정할 수 있으며, 지정하는 경우 ‘의약품신속심사 지정(신청)결과 통지서’를 발급한다. 이 경우 신속심사 대상 지정과 심사를 동시에 진행할 수 있다(신속심사과, 2021a) 신속심사 대상 지정 신청이 접수되면 신속심사과 접수 담당자가 처리담당자에게 지정신청서와 제출자료를 배정하고, 처리담당자는 지정 신청사항을 검토하여 30일 이내에 신청인에게 결과를 회신한다 그 과정에서 보완자료가 필요한 경우 신청인에게 요청할 수 있다. 신속심사 대상으로 지정이 완료되면 신청자는 의약품 신속심사 지정신청 결과 통지서과 제출자료를 포함하여 해당 의약품을 신속심사로 신청할 수 있다. 접수 부서(허가총괄담당관)가 신속심사과로 협의 의뢰하면 신속심사과의 접수 담당자가 처리 담당자에게 ‘허가신청서 및 제출 자료’를 배정한다. 처리담당자가 제출된 자료를 검토, 각 분야별 심사결과를 취합하여 허가총괄담당관에게 전달한다 신속심사 대상으로 지정 받았다 하더라도 다음 두 가지의 경우 신속 심사 대상 지정이 취소될 수 있다 (1) 거짓이나 그 밖의 부정한 방법으로 지정을 받은 경우, (2) 후속 임상시험 등에서 신속심사 지정 기준에 충족되지 않은 결과가 나타난 경우에 해당된다. 임상시험에서 임상적 유익성이 입증되지 못하거나 의약품과 관련된 위험성을 정당화할 만큼 임상적 유익성이 충분히 크지 않다면 해당 의약품 허가는 취소될 수 있다(식품의약품안전처, 2021b) 신속심사 대상 의약품의 경우 다른 의약품의 허가신청에 우선하여 신속히 심사하기 때문에 해당 제품의 허가 소요 시간을 법정처리기간인 120일보다 최대 30일 정도 단축된 90일로 기대한다. 특히 신속검사 지정 대상 신청을 허가자료 준비시점 또는 후기 임상시험 완료 직전단계 등에 미리 하거나, 식약처와의 긴밀한 협의 및 사전 논의를 거치면 실제 허가신청 후 요청되는 보완사항 감소로 허가 기간을 단축할 수 있다. 신속심사 업무는 감염병의 대유행 예방 또는 치료, 기존 치료법이 없는 생명을 위협하거나 중대한 질환의 치료 등을 위한 의료제품의 신속한 제품화를 도모하고자 수행되는 업무이며, 이를 통해 공중보건 및 국민의 삶의 질 향상에 기여할 것으로 기대된다(신속심사과, 2021a) 또한 기존 치료법이 미비하거나 혁신형 제약기업 개발의 신약 등을 신속심사 대상으로 지정함으로써 국내 희귀의약품 개발과 연구개발 등을 유도하는 데 큰 의의를 두고 있다
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 51 3.3. 미국과 한국 신속 프로그램의 비교 3.3.1. 제도의 비교 미국의 신속승인 제도는 1) Fast Track, 2) Breakthrough Therapy, 3) Accelerated Approval, 4) Priority Review 4가지 제도로 나누어져 있다 세분화된 각 제도는 궁극적인 목적을 다르게 두고 있어 각 제도가 지원하는 기능이나 효과가 상이하다 Fast track 제도는 의약품 개발을 단축시키고 의약품 미충족 상태를 빠르게 해결하는 데에 초점을 두어, 전체 기간 동안 FDA와 제약회사 간 긴밀한 협의로 더욱 빠른 허가와 공급을 이루어 낼 수 있다 Breakthrough Therapy 지정의 경우 의약품 허가를 위한 가이드 제공이나 senior manager의 컨설팅 등으로 허가를 위한 자료 제작을 도와 중대한 질병에 대한 치료법 개발 및 심사가 신속하고 효율적으로 이루어질 수 있도록 한다 Accelerated Approval의 경우, 미충족 상태에 있는 의약품에 한해 대리평가변수에 근거하여 의약품을 허가 시킴으로써 치료적 확증 임상시험에 드는 시간과 허가 과정에서 시간을 단축시켜준다. Priority Review은 중대한 상태의 치료, 진단 혹은 예방의 안전성 및 유효성에 있어 유의적인 개선을 줄 수 있는 의약품에 대해 표준 심사보다 4개월 빨라진 6개월 이내로 허가신청에 대한 결정을 내리는 것이다 이에 반해 한국의 신속심사 승인 제도는 신속심사 대상 분류에 따라 세분화된 제도를 두고 있지 않으며 크게 묶어 동일한 신속심사 대상 지정 절차와 신속심사 절차를 거치고 있다 또한 신속심사 제도의 효과로써 ‘단축된 허가심사 기간’ 이외에는 다를 바 없이 진행되고 있다. 식약처와의 긴밀한 협업을 요하고는 있지만 실상 미국처럼 체계적인 절차를 따라 이루어지고 있지는 않다 3.3.2. 제도 개선 방향의 비교 앞서 언급하였듯이, 국내에서는 코로나19의 대유행을 기점으로 2020년 8월 식약처에 신설된 신속심사과를 통해 국내 신속심사 제도가 활용되기 시작하였고, 그 결과 식약처의 신속심사 가이드라인이 개정된 2021년 9월 기준으로 17개의 약물이 신속심사 대상으로 지정되어 그 중 9개 항목이 허가되었다. 신속심사를 통한 의약품 허가가 비교적 최근에 시행되어 신속심사 제도의 역사가 그리 길지 않은 국내와 달리, FDA(미국), EMA(유럽), PMDA(일본)에서는 이미 많은 의약품이 신속심사 및 우선심사 제도를 통해서 통과된 상태이다. 대표적으로 미국의 경우 1960년대 이래로 새로운 화합물 및 의약품에 대한 개발 빈도수와 임상 개발 기간이 점점 증가하면서 신속한 신약 승인에 대한 필요성이 점차 대두되었고 FDA에 의해 1974년부터 신속 프로그램이 시작되었다 그 후 의약품에 의해 많은 사람이 피해를 입는 Tragedy를 겪고 개선하는 방향으로 발전됨에 따라 현재의 4가지 신속 프로그램이 도입되었다. 이러한 세분화된 신속 프로그램에 따라 2016년부터 2020년 사이에‘최초 허가 시 Fast Track 제도가 적용된 의약품’이 82건, Breakthrough Therapy 지정이 73건, Priority Review 지정은 141건으로 다수의 의약품이 신속 프로그램의 수혜를 받았다(최윤수, 2021) 반면, 우리나라의 경우 신속심사 제도가 세분화 되어있지 않으며, 단순히 미국 제도의 Priority Review 혜택을 차용하였기 때문에 일반 허가 대비‘단축된 허가심사 기간’을 목표하는 것 이외에는 체계적인 절차가 정립되어 있지 않다 미국과 비교하였을 때, 신속 프로그램을 통해 허가된 의약품 또한 현저히 적은 상태이다
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 52 신속 프로그램 대상 의약품의 경우 일반 심사 과정을 거치는 의약품에 비해 요구되는 임상시험의 건수와 규모가 더 작고 소요 시간이 더 짧은 만큼 뒤늦게 지연성 이상반응이 발견되거나 시판 후 추가적인 시험에서 드문 이상반응이 발생하는 경우가 다수 존재한다(식품의약품안전처, 2021b). 따라서 조건부 허가를 받았다고 하더라도 후에 허가 취소 등을 겪으며 논란이 꾸준히 일어나는 추세이다 특히 대리평가변수를 이용하여 허가된 의약품의 유효성 논란이 존재한다. 대표적으로 조건부 허가를 받았던 치매치료제 아두카누맙(aducanumab)이 효능 논란에 휩싸였으며, 근래 25년간 Accelerated Approval을 통해 허가된 항암제의 유효성이 낮아 신속 프로그램이 무분별한 의약품 허가를 조장하고 있다는 주장도 있다(Julia A Beaver, MD et al., 2018) 반면 신속 프로그램을 통해 승인된 약물들의 치료적 가치 평가를 목적으로 한 일부 후향적 코호트 연구에 따르면, 신속 프로그램에 지정되어 승인된 의약품이 일반적인 허가 과정을 거치는 의약품보다 2000년대 이후로 매년 일관적으로 높은 치료적 가치를 나타낸다는 연구 결과도 존재한다(Hwang, T. J. et al., 2020, Vokinger, K. N. et al., 2022). 따라서 미국의 경우 신속 프로그램의 많은 사례를 바탕으로 여러 논의를 통해 제도의 장벽을 높여가고 있는 추세이다. 한편 국내 제도는 신속심사를 활성화하기 위해 지정 대상을 확대시키거나 임상 시험 승인 및 허가 시 제출자료를 면제하는 등 점차 범주를 넓혀가는 발돋움하는 단계에 있으므로, 미국의 선례를 잘 참고하여 신속심사를 거치는 의약품의 유효성을 확실히 점검해야 할 것이다. 이를 위해 신속심사 제도가 제공하는 혜택을 명확히 하고, 필요에 따라 미국의 사례처럼 세분화해야 한다. 제2절 신속 승인 현황 및 사례 분석 1. 신속 프로그램 적용 품목의 치료적 가치 평가 분석 1.1 분석 배경 본 항에서는 제1절에서 언급한 신속 프로그램 남용 논란을 배경으로, 최근 FDA의 신속 프로그램을 통해 허가 받은 약물의 치료적 가치를 비교 분석하고자 한다. 2007년부터 2017년까지 11년간 허가된 품목에 대해 분석한 선행연구(Hwang et al., 2020)에 따르면, 신속 프로그램을 통해 허가 받은 품목이 그렇지 않은 품목에 비해 유의미하게 치료적 가치가 높다는 결론을 내렸다. 유사한 연구 목적과 방법으로 2018년부터 2019년까지 FDA 및 EMA에서 허가된 품목에 대해 진행한 선행 연구(Kerstin N Vokinger et al., 2022)와 2007년부터 2021년까지 미국과 유럽에서 Accelerated Approval을 통해 승인된 약물들의 치료적 가치를 분석한 선행 연구(Vokinger et al., 2022)가 존재하나, Accelerated Approval의 치료적 가치 분석에만 집중하였으며 그 외의 신속 프로그램인 Priority Review, Breakthrough Therapy, Fast Track에 대한 결과 분석은 이루어지지 않았다 즉, Accelerated Approval 이외의 FDA의 신속 프로그램을 통해 허가된 약물과 일반 허가 약물 간 치료적 가치의 비교가 부재하기에 전반적인 신속 프로그램의 동향을 살펴보지는 못했다 또한 2022년의 선행 연구(Vokinger et al., 2022)는 주된 결과 분석이 항암제와 그 외의 적응증을 갖는 약물 간 치료적 가치에 대한 비교로 이루어진다. 2017년 이후로 전반적인 신속 프로그램에 대한 치료적 가치를 일반 허가 의약품에 대하여 평가 및 분석하는 연구가 부재하기에, 이러한 연구의 필요성에 따라 Thomas J Hwang의 선행 연구를 뒤이어 2018년부터 2020년까지 허가된 품목에
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 53 대하여 치료적 가치 평가를 분석하고 신속 프로그램 남용 논란에 대한 의견을 제시하고자 한다. 1.2. 분석 방법 연구 방법은 Hwang의 선행 연구에 사용된 방법론을 참고해 설계하였다(Hwang, 2020). 2018년부터 2020년까지 FDA로부터 허가를 받은 품목은 FDA의 데이터베이스를 이용하였다 2018년 1월 1일부터 2020년 12월 31일까지 허가된 품목의 목록을 작성하였는데, 2021년 이후에 허가된 품목에 대해서는 치료적 가치 평가 결과가 부족하여 통계적으로 유의성이 있는 결론을 도출하기 어려워 제외하였다 또한 조사 대상 품목의 신속 프로그램 지정 여부 및 종류에 대한 자료도 동일한 방법으로 수집하였다 조사 대상 품목의 치료적 가치(Therapeutic value)는 프랑스의 HAS(French National Authority for Health)와 독일 IQWiG(Institute for Quality and Efficiency in Health Care)의 국가 기관 및 비영리단체(Prescrire)에서 제공하는 치료적 가치 평가 자료를 참고하였다 해당 기관에서는 새로 개발된 의약품이 기존의 의약품에 비해 얼마나 임상적으로 유익(Clinical added benefit)한지 각자의 기준에 따라 등급을 나누어 평가한다 본 연구에서는 서로 다른 등급 체계를 통일하기 위해, HAS의 ‘Moderate’와 ‘Substantial’, IQWIG의 ‘Proven’, 그리고 Prescrire의 ‘Clear advance’을 치료적 가치가 높은 것으로, 그 외의 평가는 치료적 가치가 낮은 것으로 분류하였다 이는 규제 당국에서 보험 및 상환 여부 결정을 위해 사용하는 기준과 동일하게 적용된 것이다. 하나의 평가 기관이 조사 대상 품목에 대하여 두 가지 이상의 등급을 매긴 경우17 가장 높은 등급을 채택하였다 또한 하나의 품목이 두 가지 이상의 기관에서 평가를 받은 경우에도 그 중에서 가장 높은 등급을 채택하였다 수집한 치료적 가치 평가 자료를 바탕으로 치료적 가치가 높은 품목에 대해 분석하였다 신속 프로그램 적용 여부, 적용된 신속 프로그램의 종류 및 개수에 따라 치료적 가치가 높은 품목의 비율을 계산하였다. 또한 본 연구의 목적을 달성하기 위해 계산 결과를 비교하였으며, Odds ratio 및 p value를 근거로 통계적 유의성을 입증하였다. 데이터 분석에는 Microsoft Excel(version 16.64)를 사용하였다. 1.3. 분석 결과 1.3.1. 신속 프로그램 적용 여부에 따른 분석 2018년부터 2020년까지 FDA는 총 160개의 품목을 허가하였으며, 그 중 신속 프로그램이 1개 이상 적용된 품목은 107개(66.9%)였다. 전체 품목 중 조사 기관에서 평가 결과를 공개한 76개의 품목에 대하여 18개(23.7%)의 품목이 치료적 가치가 높다고 평가받았다. 신속 프로그램 적용 여부에 따라 구분한 경우 치료적 가치가 높은 품목의 비율은 다르게 나타났다(그림3). 신속 프로그램을 1개 이상 적용 받은 품목과 그렇지 않은 품목은 그 비율이 각각 32.1%(17/53)과 4.35%(1/23)로, 신속 프로그램을 적용 받은 품목이 치료적 가치가 더 높았다(Odds ratio=10.4, p=0.028). 17 적응증에 따라 평가 결과가 다른 경우 등
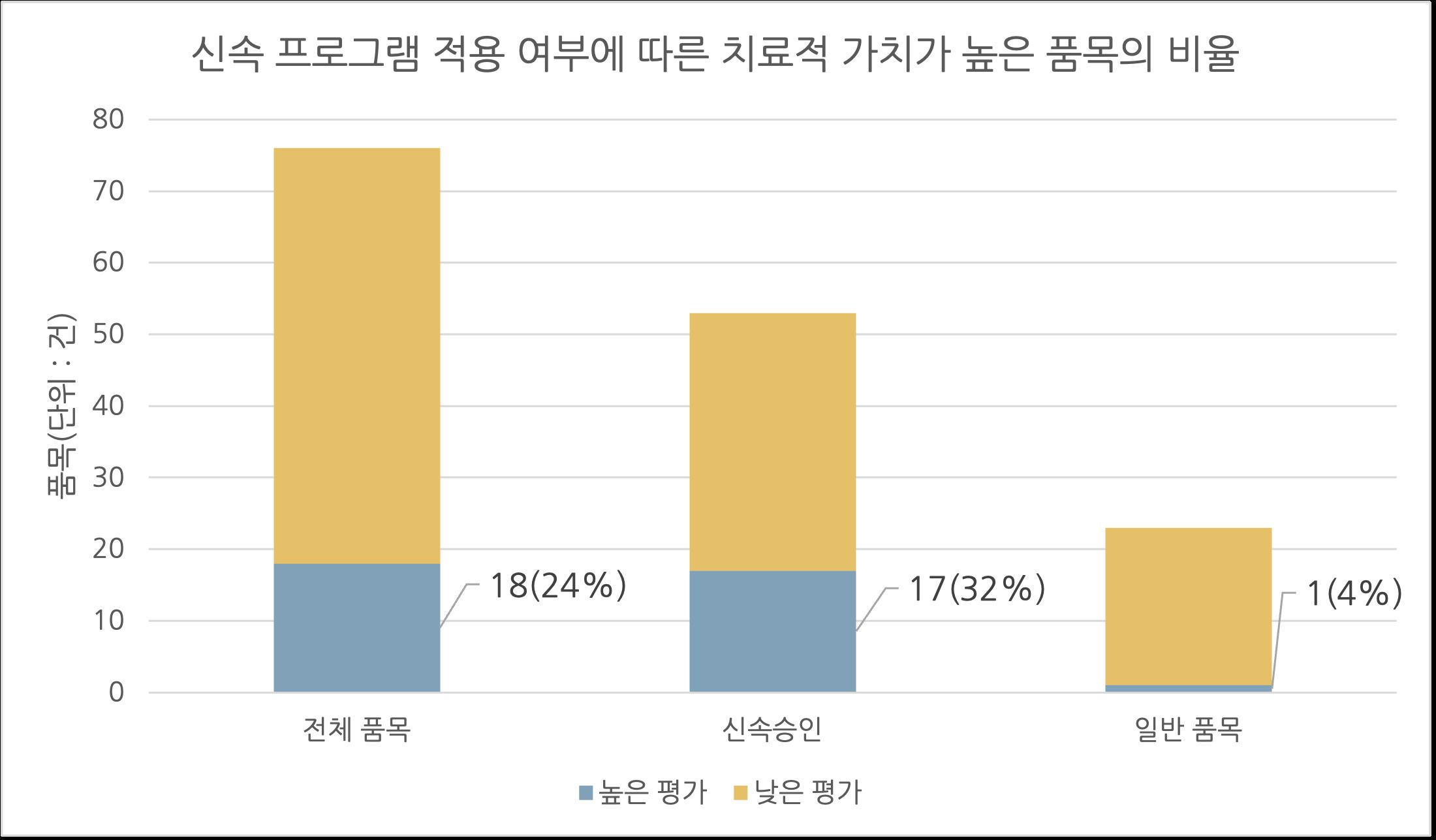
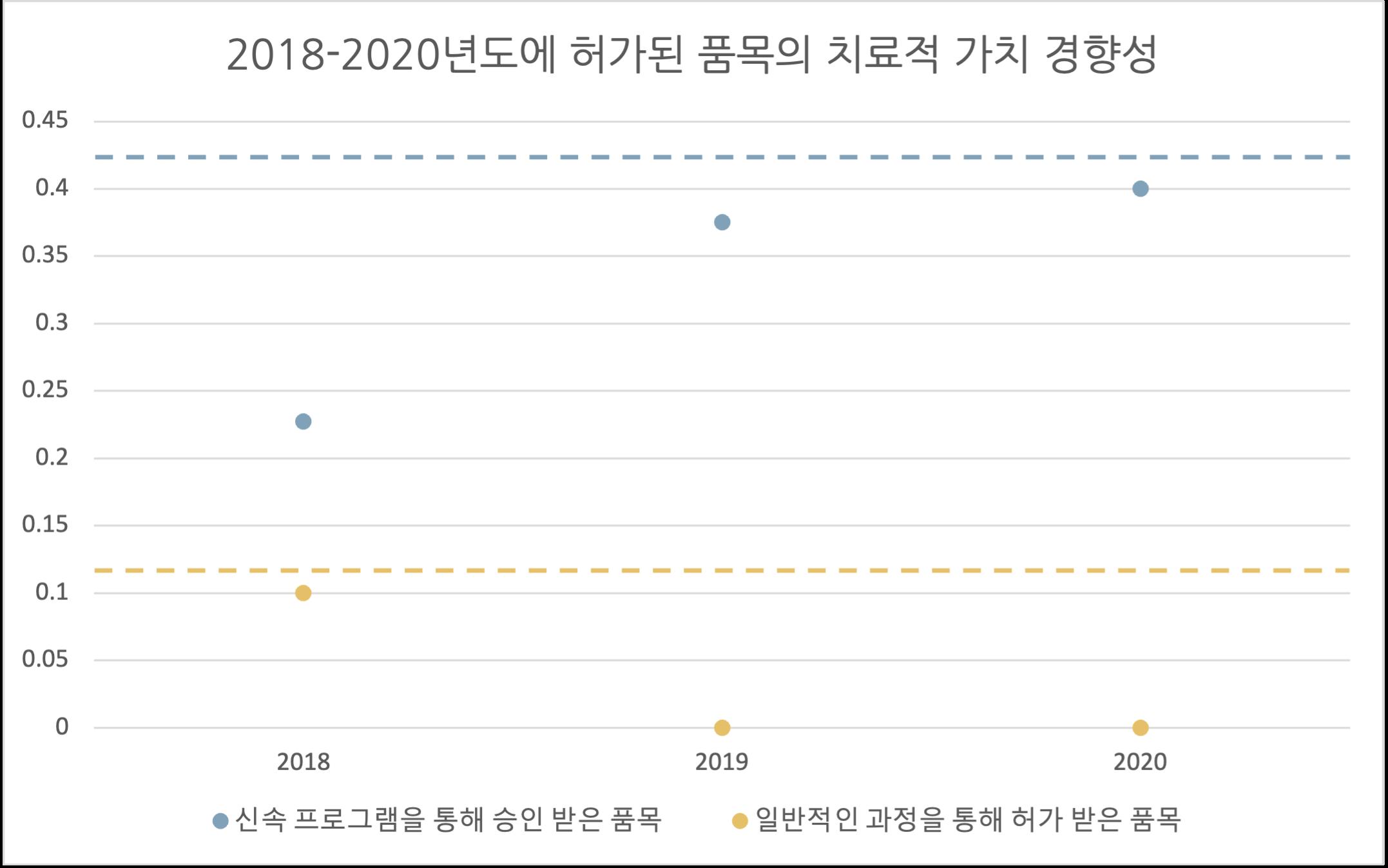
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 54 그림3. 신속 프로그램 적용 여부에 따른 치료적 가치가 높은 품목의 비율 비교 Hwang의 선행 연구에 따르면, 2007년에서 2017년 사이에 FDA의 신속 프로그램을 통해 허가된 의약품 중 치료적 가치가 높은 품목의 비율을 45%(69/153)이며, 일반 허가제도를 통해 승인된 품목의 비율은 13%(15/114)이다(Hwang et al., 2020). 이러한 평균값에 2018년부터 2020년까지 FDA의 허가 의약품에 대한 치료적 가치 평가 점수를 종합하여 2007년부터 2020년까지의 비율을 계산한 결과, 신속 프로그램을 통해 승인된 의약품은 평균적으로 42%(86/203), 일반 허가제도를 통해 승인된 의약품은 평균적으로 12%(16/137)의 비율로 높은 치료적 가치를 가졌다(그림4). 또한 3개년 중 2018년이 신속 프로그램을 통해 승인된 의약품 중 높은 치료적 가치를 갖는 비율이 가장 낮았으며, 2019년, 2020년으로 오면서 비율이 증가하는 경향성을 나타냈다. 마지막으로 2007년부터 2020년간 신속 프로그램을 통해 승인된 의약품 중 높은 치료적 가치를 가지는 비율의 평균값보다 2018년, 2019년, 2020년 각 해의 비율이 모두 더 낮게 나타났다. 그림4. 2018년~2020년 사이에 신속 프로그램을 통해 승인 받은 약물과 일반 허가과정을 통해 승인 받은 약물의 치료적 가치 평가의 비교
Designation(Odds ratio=3.01, p=0.046)과 Priority Review(Odds ratio=5.26, p=0.036)를 통해 허가된 품목 또한 상대적으로 치료적 가치가 높은 것으로 보였다 Accelerated Approval을 통해 허가된 품목은 그렇지 않은 품목에 비해 치료적 가치가 낮은 것으로 보이나,
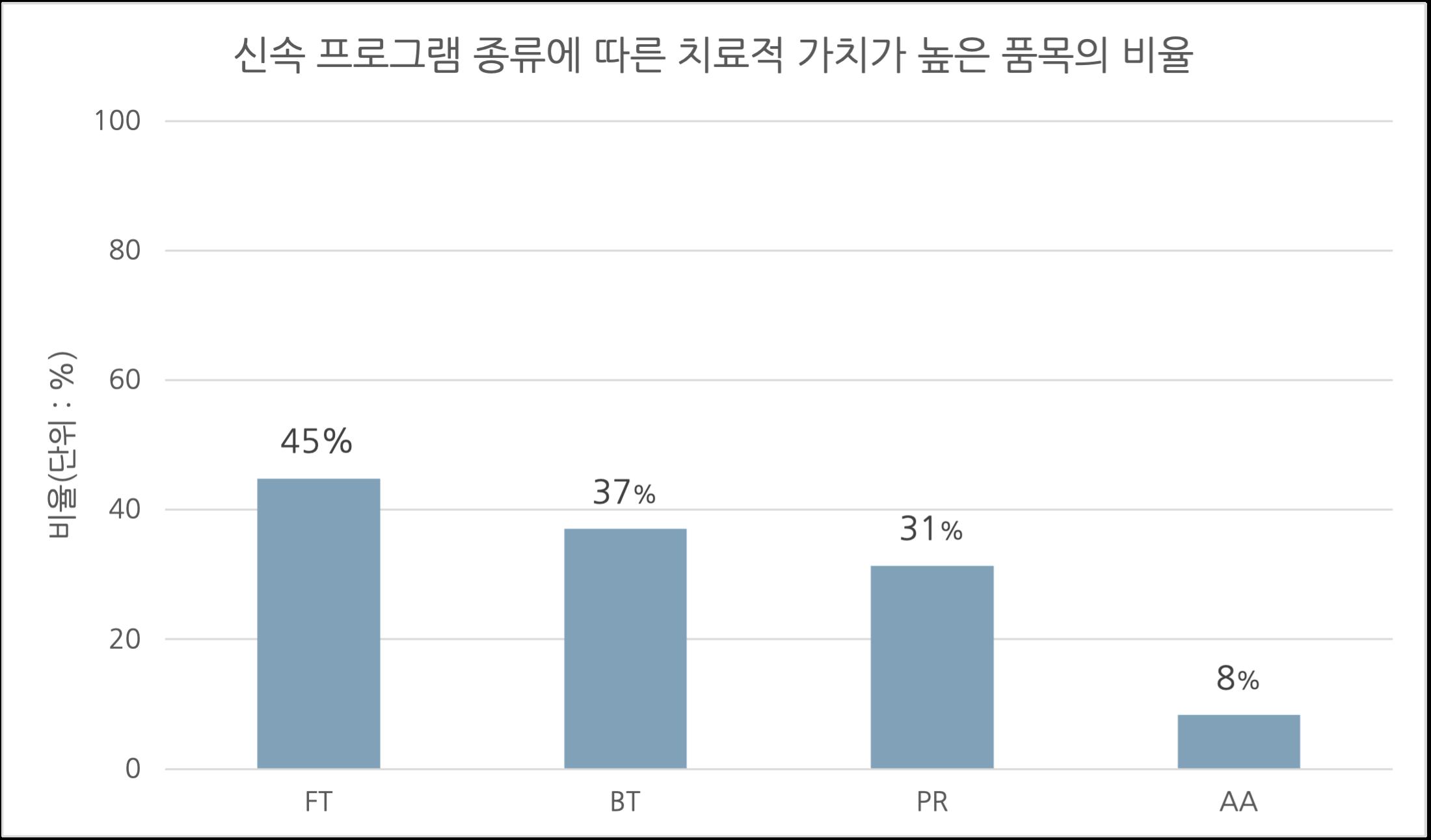
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 55 1.3.2. 신속 프로그램 종류에 따른 분석 FDA의 네 가지 신속 프로그램에 따른 치료적 가치가 높은 품목의 비율을 조사하였다(그림5). Fast Track(FT), Breakthrough Therapy(BT), Priority Review(PR), 그리고 Accelerated Approval(AA)을 적용 받은 품목 중 높은 치료적 가치를 지닌 것으로 평가 받은 품목의 비율은 각각 44.8%(13/29), 37.0%(10/27), 31.4%(16/51), 그리고 8.33%(1/12)이었다 Fast Track을 통해 허가된 품목은 그렇지 않은 품목에 비해 치료적 가치가 뚜렷하게 높은 것으로 나타났고(Odds ratio=6.825, p=0.001), Breakthrough
표본 수가 부족해 통계적 유의성을 확보하기는 어려웠다(Odds ratio=0.25, p=0.20). 1.3.3. 신속 프로그램 적용 개수에 따른 분석 적용된 신속 프로그램의 개수에 따른 치료적 가치가 높은 품목의 비율을 분석하였다(그림6) 적용 신속 프로그램의 개수를 0개, 1개, 2개, 그리고 3개 이상으로 분류하였는데, 신속 프로그램을 3개 이상 적용 받은 품목의 개수가 적기 때문에 하나의 분류군에 포함시켰다 신속 프로그램을 2개 적용 받은 품목과 3개 이상 적용 받은 품목에 대해서 그 비율은 각각 41.0%(9/22)과 33.3%(7/21)로 전체 품목에 대한 비율(23.7%)보다 높았다. 그러나 신속 프로그램을 1개 적용 받은 품목은 그 비율이 10.0%(1/10)로 전체 품목에 대한 비율보다 낮게 나타났다 그림5 신속 프로그램 종류에 따른 치료적 가치가 높은 품목의 비율 비교 (FT: Fast Track, BT: Breakthrough Therapy, PR: Priority Review, AA: Accelerated Ap proval)
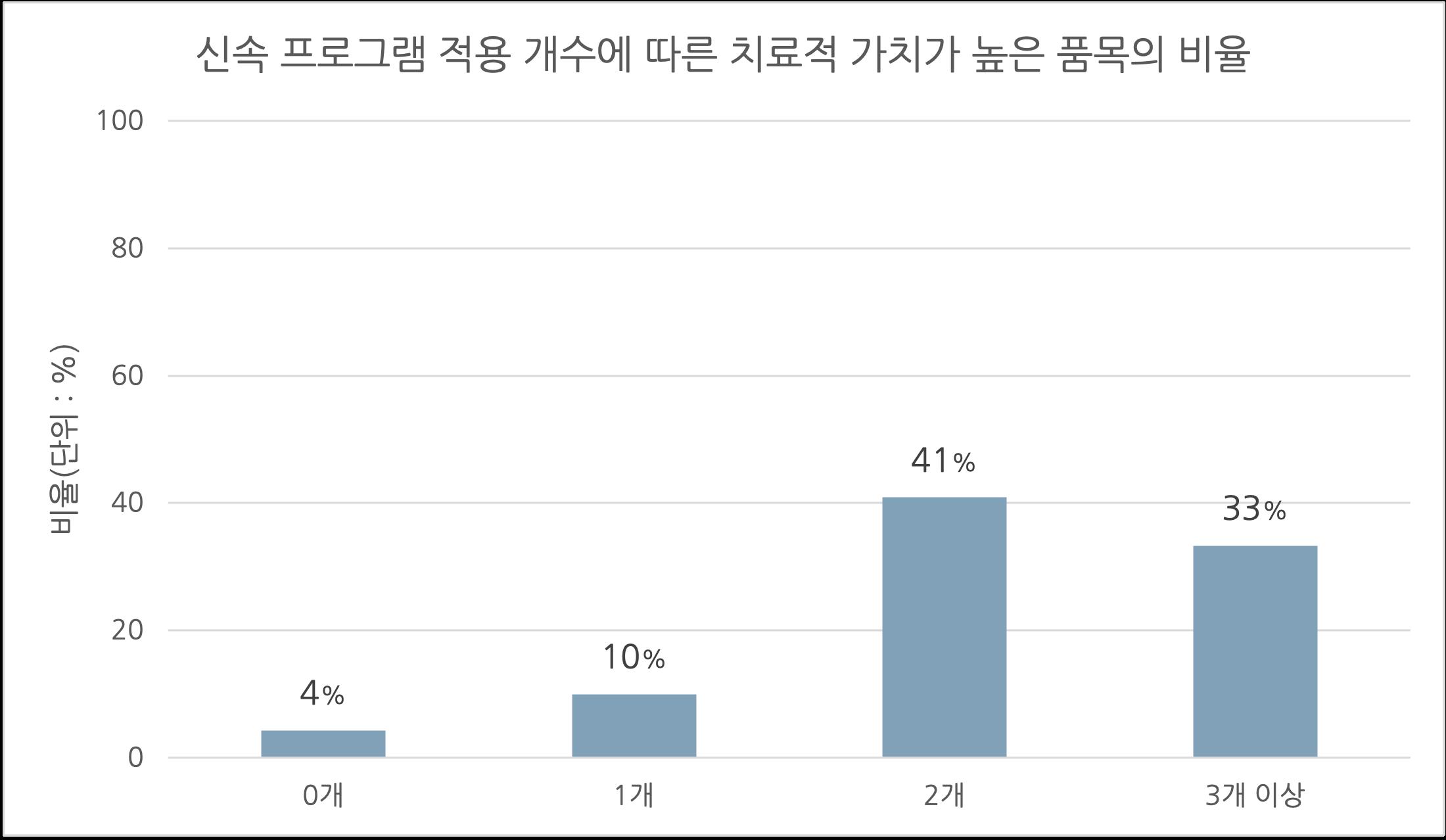
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 56 그림6 신속 프로그램 적용 개수에 따른 치료적 가치가 높은 품목의 비율 비교 1.4. 논의 위 항목의 결과를 바탕으로, FDA의 신속 프로그램을 통해 승인된 품목은 일반 허가 과정을 통해 승인된 품목보다 치료 가치가 높다는 평가를 받을 가능성이 더 크다는 결론을 도출할 수 있으며 이는 선행 연구(Hwang et al., 2020)에서 보여준 10년간의 경향성과 일치한다 그러나 선행 연구와 위 항목의 결과를 종합해보았을 때, 신속 프로그램을 통해 허가 받은 품목 중 치료적 가치가 높은 의약품의 비율은 시간이 지나도 변하지 않았음을 알 수 있다 또한 그 비율은 약 40% 가량으로 여전히 낮았다 이러한 결과를 통해 FDA의 신속 프로그램은 일반 허가에 비해서 높은 치료적 가치를 갖는 약물을 승인할 가능성이 크나, 여전히 신속 프로그램을 통해 허가 받은 약물의 과반수 이상은 낮은 치료적 가치를 가질 가능성이 크다는 결론을 도출할 수 있다. 이러한 결론을 바탕으로 신속 프로그램을 통해 승인 받은 의약품의 확증적 임상 연구나 시판 후 안전관리의 중요성이 높다는 시사점을 얻을 수 있다. 또한 현존하는 치료적 가치 평가 기관은 대부분 유럽 국가가 중심이기에, 제약시장의 규모가 큰 미국에서 이러한 평가 기관이 존재한다면 FDA의 허가 의약품을 집중적으로 분석할 수 있을 것이다. 마지막으로 국내에서도 치료적 가치를 분석할 수 있는 비영리 기관이나 공공기관을 통해 국내 특성에 맞게 자체적으로 치료적 가치를 분석할 수 있기를 기대한다. 2. 사례 중심의 한·미 신속 프로그램 제도 비교 본론1의 개괄적인 소개를 바탕으로, 본론 2에서는 미국과 한국에서 신속 프로그램에 지정되어 허가 절차를 밟은 특정 약물들의 사례를 통해 미국과 한국의 신속 프로그램을 비교하고자 한다. 국내에서 최초의 신속심사 대상으로 지정된 두 개의 의약품인 셀루메티닙과 프레토마니드를 사례로 선정하여 각국에서의 허가 배경, 허가에 핵심이 된 임상시험 과정과 결과, 허가과정을 서술하였다.
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 57 2.1. 셀루메티닙(Selumetinib) 2.1.1. 허가 배경 및 선정 이유 셀루메티닙(코셀루고)는 국내에서 증상이 있고 수술이 불가능한 총상 신경섬유종 (plexiform neurofibroma)을 동반한 신경섬유종증 1형인 만 3세 이상 소아 환자의 치료에 허가를 받은 약물로, 희귀의약품에 해당한다(식품의약품안전처 의약품통합정보시스템, 2022). 식약처는 국내 최초로 해당 약물을‘신속심사 대상 의약품’으로 지정하여 우선 심사한 결과, 21년 5월 허가하였고, 미국 FDA 역시 우리나라보다 먼저 셀루메티닙을 희귀의약품에 지정하여 허가 승인 접수 6개월만에 시판 승인하였다(식품의약품안전처, 2020). 제1형 신경섬유종증(NF1)은 신생아 3500~4000명 중 한 명 빈도로 발생하는 희귀 질환이다 증가하는 유병인구에도 불구하고 그동안 NF1은 대증 치료, 즉 질병의 근본 원인을 치료하는 것이 아닌 증상 개선에 초점을 맞추어 그 치료가 이루어져 왔다 NF1 환자의 절반 가량은 총상신경섬유종(PN)을 겪는데,PN으로 인해 외형적으로 나타나는 증상과 통증으로 인해 환자들은 심리적 위축을 동반한 큰 고통을 느껴왔다 PN의 경우 외과적 절제술이 유일한 치료법이었으나 환자마다 종양의 형태가 다양하여 완벽히 제거하기 어렵다는 한계가 있었다 또한 외과적 절제로는 대부분 완치되지 않으며, 후속적인 종양의 재성장이 일반적이었다(Casey, 2021). 이러한 상황에서 코셀루고는 수술이 불가능한 망상 신경섬유종 환자를 위한 최초의 경구용 MEK1/2 저해 단독요법제로서 개발되었고, 한미 양국에서 모두 신속심사를 거쳐 빠르게 승인되었다. 식약처는 해당 약물을 신속심사 대상 의약품으로 정해 우선 심사해왔으며, 21년 5월 ‘SPRINT 임상 3상’을 근거로 허가하였다 미국 FDA도 셀루메티닙을 네 가지 신속 프로그램에 모두 지정하여 접수 6개월만에 시판 승인하였다(National Library of Medicine [NLM], NCT02407405) 셀루메티닙은 FDA의 희귀의약품 지정 및 신속 승인을 거쳐 국내에서 최초로 신속심사대상 의약품으로 지정 받은 약물이며, NF1 소아를 대상으로 FDA 및 식약처의 허가를 받은 최초의 치료제이다 따라서 그 지정 근거와 임상시험 결과, 그리고 신속심사 및 승인 과정을 자세히 서술하여 한/미의 제도적 차이점과 국내 신속심사 제도의 개선방향을 서술하고자 한다. 2.1.2. 임상 시험 셀루메티닙의 신약 허가신청(NDA)에 대한 FDA의 승인은 총상 신경섬유종을 가진 수술 불가능한 제1형 신경섬유종증 소아 환자를 대상으로 한 공개(open label), 단일군(single arm), 다기관, two part trial 인 SPRINT 임상시험을 바탕으로 했다. SPRINT 임상시험은 미국 국립암연구소(NCI) 항암제 평가 프로그램(CTEP)에서 비용을 지원한 가운데 이루어졌으며, 2016년 1월부터 2021년 8월까지 진행되었다 (NLM, NCT02407405) 해당 SPRINT 임상시험 1상의 경우 SPRINT 2상에서의 용량을 결정하기 위하여 진행되었으며, SPRINT 2상에서는 28일을 주기로 1일 2회, 25mg/m2의 투약이 진행되었다. SPRINT의 2상 환자는 50명으로, 수술이 불가능한 제1형 신경섬유종증 소아 환자로 총상
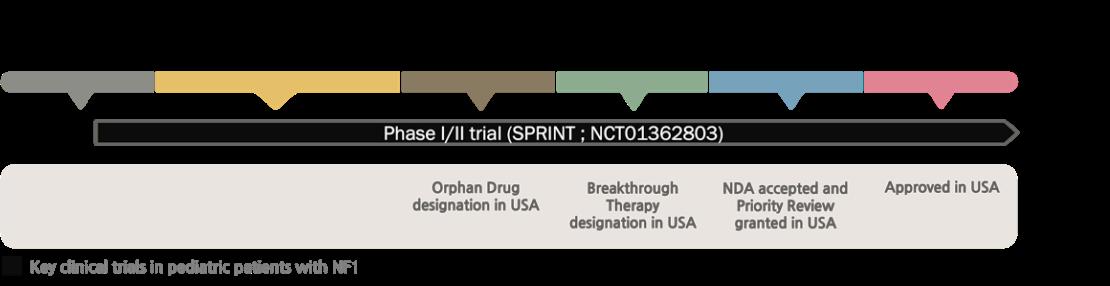
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 58 신경섬유종을 가진 환자를 대상으로 하였다 해당 임상시험의 1차 평가변수는 객관적 반응률(ORR)로, REiNS 기준을 부합하는 결과를 3D MRI를 통해 측정하였다. 부분 반응(PR)은 3~6개월 이내 총상신경섬유종의 용적이 20% 이상 감소된 환자의 비율을 확인하는 방식으로 측정됐다. SPRINT 2상에서 REiNS 기준에 따라 확인된 ORR의 경우, NCI review에 따르면 66%(95% confidence interval(CI), 51 79)였고 ICR에 따르면 44%(95% CI, 30 59)였다. 전체 환자 중 68%(50명 중 34명)에서 종양 용적이 20% 이상 감소하는 부분 반응이 확인됐고, 이 같은 반응의 지속 시간 중간값은 7.2개월로 나타났다(Casey, 2021). 임상시험의 2차 평가변수는 DOR로, time to progression, PFS, 안전성 등이 COA(clinical outcome assessments)에 의해 측정되었다 임상시험의 2차 평가변수를 참고하였을 때 임상에 참여한 82%의 환자는 12개월 이상 반응을 지속한 것으로 나타났다. 안전성 검증의 경우, 20 30mg/m2의 셀루메티닙을 하루 두 번 투여 받은 74명의 NF1, 총상 신경섬유종 환자들에 대해서 진행되었다 각각 SPRINT 임상 1상에서 24명, 2상에서 50명의 소아 환자들을 대상으로 하였다. 또한 FDA는 7가지의 다른 항암 임상시험에서 얻은 347명의 성인 환자에 대하여 안전성 정보를 검토하였다 셀루메티닙 노출에 대한 중간값은 74명의 SPRINT 환자들에서 28개월이었으며, 치명적인 약물이상반응은 발생하지 않았다 중대한 약물이상반응의 경우 23%의 환자군에서 일어났으며 설사, 크레아틴 카이네이스의 농도 증가, 빈혈, 저산소증이 각각 최소 두 명 이상에서 발생하였다. 12%의 환자들이 이상반응으로 인해 임상시험을 영구적으로 중단했으며 32%는 용량 감소를 요구하는 이상반응을 경험하였다(NLM, NCT02407405) 2.1.3. 미국에서의 허가 과정 그림7 셀루메티닙의 FDA 허가 타임라인 셀루메티닙은 임상시험 2상을 진행중이던 2018년 2월 14일, 희귀의약품으로 지정되었으며, 2019년 4월에 혁신 치료제로 지정되었다 2019년 11월, 희귀 소아질환에 대한 우선 심사권(PRV, Priority Review Voucher)을 바탕으로 우선심사로 지정되며 신약 허가신청(NDA)이 승인되었고 패스트 트랙 (Fast Track)으로 지정 받기도 하였다 우선심사 혜택을 바탕으로 심사되어, 기존 9개월의 심사 기간이 아닌 신약 허가신청 6개월만인 2020년 4월 10일, 품목허가를 취득할 수 있었다(Markham & Keam, 2020). 셀루메티닙의 허가신청서는 미국 국립암연구소(NCI) 항암제 평가 프로그램(CTEP)에서 비용을 지원한 가운데 이루어졌던 임상 1/2상인,‘SPRINT 시험’에서 도출된 긍정적인 결과를 근거로 제출되었다. 이 시험에서 셀루메니팁 단독요법제를 1일 2회 복용한 소아 제 1형 신경섬유종증 및 증후성, 수술불가성 망상
약물의 안전성 평가를 위해서 FDA는 MEK 약물에 대한 안전 예방 조치 및 용량 조절, 관리 지침을 제품 라벨에 포함하였다 SPRINT에서 상대적으로 긴 치료 기간동안 중단율이 낮았고, 이는 권장 용량의 셀루메티닙의 안전성 평가에 대한 근거가 되었다(Casey, 2021).
신속심사 이후 안전성 평가는 FD&C Act의 section 505(o)에서 규정되어 있다(FDA, 2011). 셀루메티닙의 경우 FDA는 제조사에 SPRINT 임상시험 참여자를 포함하여 투여 환자의 성장 및 발육에 대한 안전성 평가, 이상반응에 대한 평가, 그리고 식단요법에 따른 위장관 독성에 대한 평가를 위한 추가 시험을 2025년 9
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 59 신경섬유종 환자들은 66%에서 객관적 반응률을 나타냈음이 눈에 띄었다. 66%의 객관적 반응률은 종양 부피가 20% 이상 감소하면서 완전반응 또는 부분반응을 나타낸 환자들을 포함해 도출된 수치이다 셀루메티닙의 신속심사를 위한 FDA의 승인 과정에서 발생한 주요 쟁점은 크게 세 가지로, 조직학적으로 양성인 종양 적응증에서 규제적인 평가 지표로 ORR을 사용하는 것의 적절성 여부, 임상시험에서 제출한 환자 자료(Patient level clinical outcomes Data)를 바탕으로 충분한 효과를 판단할 수 있는 지의 여부, 그리고 소아 환자에서 만성 MEK 억제제 사용의 안전성을 평가하는 것이다(Casey, 2021). 이 과정에서 FDA는 대리평가변수로 이용된 객관적 반응률에 관한 결과가 임상적 이점을 반영한다는 근거를 위해, SPRINT 임상시험의 대리평가변수가 총상신경섬유종과 관련된 기능 손상이나 증상, 외관 손상에 측정 가능한 영향을 가진다는 것을 보여줄 수 있도록 임상시험이 설계되어야 한다고 조언하였다 이에 따라 임상시험에서는 환자간 이질성, 나이, 종양 위치, 동반 질환 등을 고려하여 증상과 기능의 변화를 측정하기 위한 다양한 COA 도구들이 이용되었고, 모집단에 대한 환자의 개별 환자 검토(IPR) 문서를 추가로 제출하여 이것이 셀루메티닙의 임상적 이점을 판단하는 데 핵심적인 역할을 하였다(Markham & Keam, 2020)
월까지 진행할 것을 요청하였다 또한 셀루메티닙을 투여 받는 소아 환자에서 발생하는 안구, 심장, 근육 및 위장 이상반응을 모니터링하고 신속히 보고하기 위해 강화된 약물 감시 프로그램이 구현되었다(FDA, NDA 213756). 2.1.4 한국에서의 허가 과정 코셀루고캡슐(한국아스트라제네카)는‘생명을 위협하는 질환 또는 중대한 질환의 치료를 목적으로 하는 의약품으로서 기존 치료법이 없는 경우’에 해당하여 2020년 10월, 최초의 신속심사 대상 의약품으로 지정되었다(신속심사과, 2021). 또한 이에 따른 지정 혜택으로 일반 심사 대비 신속심사과에서 우선적으로 심사가 진행되었고, 기존의 허가기간인 9개월보다 3개월 빠른 6개월의 심사 기간을 거친 후 2021년 5월 허가를 획득했다 허가 획득의 근거로 FDA와 동일하게, SPRINT 임상 2상이 이용되었다(의약품통합정보시스템, 2022). 2.2. 프레토마니드(Pretomanid) 2.2.1. 허가 배경 및 선정 이유
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 60 프레토마니드는 Nitroimidazooxaznie계 항진균제로, 성인의 광범위 약제 내성 폐결핵(XDR TB)18 및 치료 내성 또는 비반응성 다제내성 폐결핵(TI/NR MDR TB)19 에 대한 베다퀼린과 리네졸리드와의 병용 요법(BpaL)을 적응증으로 한다(식품의약품안전처, 2021a). 결핵 치료제를 개발하는 비영리 단체 기구 TB 얼라이언스(TB alliance)에서 개발하였으며, 밀란(Mylan)과 협력하여 전세계적으로 보급되었다 결핵은 감염성이 있고, 만성 질환으로 이어지며, 치료제 개발의 역사가 짧기 때문에 수천년 동안 인류를 위협해왔다(질병관리청, 2021). 1993년 결핵 비상사태를 선포한 세계보건기구(WHO)의 노력으로 결핵 발생률과 사망률이 꾸준히 감소하는 추세를 보이고 있지만, 여전히 수 백 만명의 환자가 발생하고 결핵으로 사망한다(WHO, 2021) 특히 초기 약물 관리의 실패로 약물 내성을 가진 결핵균이 등장하였기에 결핵은 생명을 위협하는 중대한 질환으로 여겨진다 한국의 경우 OECD 가입국 중 결핵 환자 발생률 1위와 사망률 3위를 차지하였고(질병관리청, 2021), WHO에 따라 다제내성 결핵 고위험군 국가로 지정되어 꾸준한 질병 관리가 필요한 실정이다(WHO, 2021) 이전에는 내성 결핵에 대해 베다퀼린과 리네졸리드가 사용되었으나, 용법이 일정하지 않고 평균 치료 기간이 2년에 달하는 등의 한계점을 안고 있었다. 이러한 배경에서 등장한 프레토마니드는 향상된 유효성과 새로운 치료 선택지라는 임상적 이익을 인정받아 한국과 미국 모두에서 허가를 받았다. 양국에서 각 규제 당국의 신속 프로그램을 적용받았으나, 조사 결과 적용 혜택 및 허가 과정에서 뚜렷한 차이점이 발견되었다. 본 목에서는 프레토마니드를 중심으로 신속 승인에 대한 한/미의 제도적 차이점을 서술하고자 한다 2.2.2 임상 시험 프레토마니드의 핵심임상시험 Nix TB(NCT02333799)은 다른 항결핵제와 병용 시 프레토마니드의 유효성과 안전성을 평가하기 위해 진행된 임상 실험으로, 공개(Open label) 및 단일군(Single Group Assignment)으로 진행되었다(식품의약품안전처, 2021a). 적응증에 해당하는 환자 109명을 대상으로 남아프리카공화국에서 6개월간 진행되었으며, 베다퀼린(100mg 정, B)과 프레토마니드(200mg 정, Pa), 그리고 리네졸리드(600mg 정, L)의 세 가지 약제를 병용하는 BPaL 요법20을 적용했다 해당 시험은 2015년 3월에 시작하여 2020년 8월에 완료되었다. 1차 유효성 평가 변수는 치료 종료 후 6개월 시점에서 측정한 치료 성공률21 (95% CI 하한 50%)으로 설정하였고, MITT 분석군에서 치료성공 환자의 비율은 92%(95% CI 85~96%)로 성공적인 치료 기준을 통과했다. 2차 유효성 평가 변수로는 치료 기간 중 18 주요 항결핵제인 이소니아지드(Isoniazid)와 리팜피신(Rifampicin)에 더해 한 가지 이상의 퀴놀론계 약제와 A군 약제에 내성을 보이는 결핵 19 주요 항결핵제인 이소니아지드(Isoniazid)와 리팜피신(Rifampicin)에 내성을 보이는 결핵 20 베다퀼린은 첫 2주 동안 400mg(QD), 이후에는 200mg(TIW)로 복용하고, 프레토마니드와 리네졸리드는 각각 200mg(QD), 1200mg(QD)로 복용하는 요법 21 세균학적 실패(치료 기간 동안 배양 음성 전환의 실패), 세균학적 재발(추적 기간 동안 배양 양성 전환), 그리고 임상적 실패(치료 실패로 인한 요법의 변경, 추적 기간 동안 재치료, 또는 결핵 관련 사망)를 확인한다
NDA(신약승인신청, New Drug Application)에는 2018년 6월 29일까지의 핵심임상시험(Nix TB)을 기반으로 한 안전성 결과 자료(환자 81명)가 포함되어 있다. 이러한 혜택을 받을 수 있었던 것은 환자 15명의 Nix TB 자료가 확보될 때마다 FDA에 자료를 제출하여 해당 임상시험이 긍정적이고 일관된 결과를 보임을 밝혔기 때문이다. 이후 2018년 8
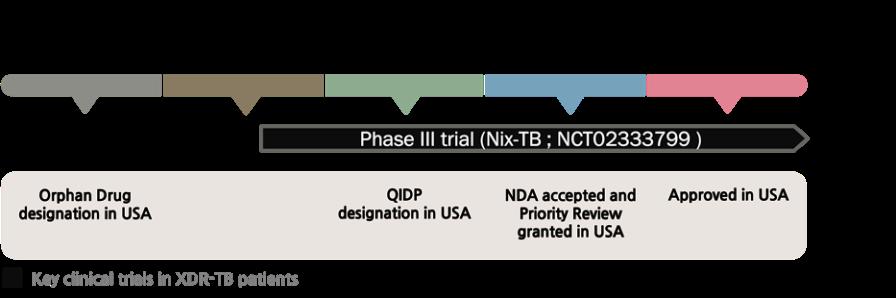
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 61 객담 배양 음성 전환, 환자가 보고한 결핵 증상 프로파일(TB Symptom Profile), 그리고 체중 등을 확인하여 모두 긍정적인 결과를 확보했다. 2.2.3. 미국에서의 허가 과정 그림8. 프레토마니드의 FDA 허가 타임라인 프레토마니드는 허가신청 전 희귀의약품(2007), 중대하고 생명을 위협하는 감염병 치료제(2017), 그리고 우선 심사 대상(2018)으로 지정되었다(그림8). 결핵을 비롯한 열대병(Tropical disease)은 오랜 기간 인류를 위협했음에도 이에 대한 치료제의 개발은 지난 50년간 진전이 없었다(FDA, 2016). 이에 따라 FDA는 열대병에 대한 치료제 개발을 활성화하기 위해 2007년부터 열대병을 적응증으로 하는 의약품을 신속심사 대상으로 지정했고, 프레토마니드 역시 해당 제도의 혜택을 받았다. 이후 2019년 8월 FDA는 BpaL 요법이 결핵의 추가 확산을 막을 수 있는 현실적인 방안이 될 것이라고 제언하며 해당 의약품을 승인했다(FDA, 2019). FDA는 프레토마니드를 신속하게 허가하기 위해 진행 중인 임상시험의 중간 결과의 제출을 허가했다(FDA, 2019). 2018년 12월 14일에 제출된 프레토마니드의
월 15일까지의 Nix TB 자료를 바탕으로 2019년 1월 18일 유효성 결과 자료를 갱신하였으며, FDA의‘120 Day Safety Update22 ’에 따라 2019년 4월 5일 해당 자료를 NDA에 추가하였다. 이러한 혜택 외에도 FDA는 개발사와의 협의를 통해 일부 연구를 지원하였다. Nix TB를 바탕으로 한 유효성 입증을 보충하기 위해 과거에 진행된 XDR TB 환자 연구를 비교 분석하였다. 치료 요법을 제외한 실험 조건(지역, 환자군, HIV 여부 등)이 유사하게 설정된 대조군 코호트 연구를 근거로 하여, 단일군으로 진행된 프레토마니드의 Nix TB 임상 시험을 뒷받침할 수 있었다. 또한 BPaL 3제 병용 요법의 효능에 대한 프레토마니드의 기여도를 분석하기 위해 각 구성 약제(베다퀼린, 프레토마니드, 리네졸리드)의 기여를 입증하는 사전 임상 데이터를 지원했다. 2.2.4. 한국에서의 허가 과정 식약처는 프레토마니드에 대해 해당 약제 및 요법이 내성 결핵 환자에게 효과적이고 편리한 치료 옵션을 제공할 것이라고 판단했다(식품의약품안전처, 2021a). 선행 코호트 22 첫 NDA 제출 후 4개월 이내로 업데이트된 자료를 FDA에 제출해야 하는 제도(21 CFR 324.50)
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 62 연구를 근거로 단일군 시험을 인정한 FDA와 달리, 식약처에서는 임상시험이 수행된 남아프리카공화국에서 표준 치료를 받은 환자의 사망률이 75%라는 점을 고려하여 단일군 시험을 인정했다 하지만 말초신경병증, 시신경증, 그리고 빈혈 등의 이상 사례가 빈번하게 나타난다는 점을 지적하며 정기적인 모니터링과 용량 감량 등의 관리가 필요하다고 주장했다 프레토마니드는‘생명을 위협하는 중대한 질환의 치료제’로서 기존의 결핵 치료제에 비해 유효성을 개선했다는 점을 인정받아 신속심사 대상으로 지정되었다. 신속심사 대상 지정 신청은 품목허가 신청 전인 2020년 10월 12일에 이루어졌고, 25일 후인 2020년 11월 6일에 신속심사 대상으로 지정되었다 제도에서 명시하는 신청 처리 기간인 30일 이내로 진행되었기에 지정 절차는 원활했음을 확인할 수 있었다 하지만 품목허가 과정에서는 신속심사의 혜택을 제대로 적용 받지 못한 것으로 보인다 품목허가 신청은 2020년 12월 23일에 이루어졌고 2021년 10월 15일에 품목허가가 승인되었다. 총 296일의 기간으로, 신속심사의 단축 목표인 90일뿐만 아니라 일반적인 심사 과정에 소요되는 120일보다 훨씬 오래 걸렸다 프레토마니드 심사 과정의 검토 이력(Error! Reference source not found.)을 참고하여 허가가 늦추어진 원인에 대해 분석해볼 수 있었다 일반적으로 1차 보완 자료 요청은 전체 허가 또는 심사 기간의 2/3시점(신속심사 기준 60일)에 이루어지며, 보완 기간은 60일 이내이다. 프레토마니드의 허가신청 65일 후인 2021년 2월 26일에 식약처에서 1차 보완 요청을 보냈고, 제약사는 124일 후인 2021년 6월 30일에 보완 자료를 제출했다. 제약사는 자료 보완에 식약처에서 요구하는 기간(60일)의 두 배가 넘는 시간을 소모하였다 게다가 식약처는 2021년 7월 28일에 2차 보완 요청을 보냈는데, 이는 1차 보완 자료가 미비한 경우에 이루어진다 따라서 프레토마니드가 신속심사의 혜택을 누리지 못하고 오히려 일반적인 심사보다 기간이 연장된 것은 제약사의 부족한 자료 제출에 원인이 있음을 유추할 수 있다. 표1. 프레토마니드 심사 과정 검토 이력 구분 품목허가 기준및시험방법 관련 자료 안전성 유효성 관련 자료 제조및품질관리기준 관련 자료 신청일자 2020.12.23. 보완요청 일자 2021.02.26. 2021.07.28 2021.02.26. 2021.07.28 2021.02.26. 2021.07.28 2021.01.27. 보완접수 일자 2021.06.30. 2021.08.09. 2021.06.30. 2021.08.09. 2021.06.30. 2021.08.09. 2021.07.30. 최종처리 일자 2021.10.15.
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 63 2.3. 국내 신속심사 제도에 대한 제언 위 절에서는 셀루메티닙과 프레토마니드에 대한 한국과 미국에서의 허가 과정을 서술하였다 본 절에서는 서술한 내용을 바탕으로 미국과의 허가 및 허가 후 과정에서의 차이점을 분석하여, 국내 현행 신속 프로그램의 개선점을 제언해보고자 한다 2.3.1. 허가 과정에서 규제기관의 적극적인 지원 첫 번째는, 규제기관과 제약사 사이의 보다 긴밀한 협업이 필요하다. 우선 셀루메티닙의 경우, 제약사는 FDA의 임상시험 구조 설계에 대한 조언을 바탕으로 대체 평가변수의 적절성과 약물의 임상적 유익성을 증명할 수 있었다. 신속심사 과정에서 중요하게 여겨지는 요소 중 하나는, 임상시험에서 이용된 평가변수가 약물의 임상적인 이점과 효과를 적절히 반영하는 지이다. 본론 1절의 2.2.3에서 언급하였듯, 신속 프로그램은 일반적으로 대리평가변수라 불리는 임상적 평가변수를 기반으로 성공 여부를 판단한다 항암제의 경우, 약물의 직접적인 임상적 이점이란 질병의 진행을 막을 수 있는지, 혹은 치료받은 환자의 수명을 연장시킬 수 있는지에 대한 것이다 그러나 대체 지표와 임상적 이점 사이의 연관성이 항상 명확한 것은 아니다 또한 설사 그렇더라도, 그 효과 크기가 지나치게 작다면 환자의 삶을 눈에 띄게 개선시키지 못할 수도 있다(Fleming et al., 2005). SPRINT의 경우 대리평가변수로 객관적 반응율(ORR)이 이용되었다 NF1과 같은 종양은 양성 종양이기 때문에, 종양의 크기 감소가 지속적이고 치료와 연관되어 나타난다고 하더라도 개선된 생존율을 예측할 것이라고 기대하기 힘들다는 문제점이 있었다. 따라서 FDA는 ORR 결과가 임상적으로 연관성을 가지기 위해서는,‘종양 크기의 감소’가 총상신경섬유종과 관련된 기능 손상이나 증상, 외관 손상에 측정 가능한 영향을 가진다는 것을 보여줄 수 있도록 SPRINT를 설계해야 한다고 조언하였다. 이에 따라 임상시험에서는 환자간 이질성, 나이, 종양 위치, 동반 질환 등을 고려하여 증상과 기능의 변화를 측정하기 위한 다양한 COA 도구들이 이용되었고, 모집단에 대한 환자의 개별 환자 검토(IPR) 문서를 추가로 제출하여 이것이 셀루메티닙의 임상적 이점을 판단하는 데 중요한 역할을 하였다(Casey, 2021) 프레토마니드의 사례에서도 FDA의 적극적인 지원을 확인할 수 있었다 해당 품목의 핵심임상시험인 Nix TB는 단일군으로 진행되어, 기존의 요법으로 치료받는 대조군 없이 BPaL 요법을 받는 실험군으로만 구성되었다 대조군의 설정은 실험 결과의 신뢰도를 결정하는 중요한 요소이지만, 결핵과 같이 생명을 위협하는 질병에 대해서는 신약이 있음에도 불구하고 치료 효과가 낮은 기존의 요법을 적용 받는 대조군의 설정이 윤리적인 문제를 야기할 수 있다. 이에 따라 우리나라의 식약처에서는 기존의 표준 치료법을 결핵 환자에게 적용할 경우 사망률이 높다는 점을 고려하여 단일군 설정을 인정하였다. 그러나 FDA는 Nix TB 단일군 시험의 유효성을 뒷받침하기 위해 연구 과정에 도움을 주었다 제약사 대신 문헌 조사를 진행하여, Nix TB와 유사한 조건으로 진행된 기존의 결핵 표준 치료법에 대한 선행 연구를 제공하였다 이를 통해 제약사는 해당 연구를 과거 대조군(Historical Control)으로 설정하여 BPaL 요법의 유효성을 보충할 수 있었다 결과적으로는 FDA와 식약처 모두 Nix TB가 단일군으로 진행되었다는 점을 인정해주었으나, FDA의 임상시험 평가가 더 합리적으로 이루어졌다고 볼 수 있다
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 64 신속 프로그램의 적극적인 운용을 위해 규제 당국은 단순히 제출 자료를 우선적으로 검토하는 것에 그치지 않고 제약사가 원활하게 자료를 수집할 수 있도록 적극적으로 조력해야 한다 현재까지의 국내 신속심사 사례는 FDA 등 해외 규제기관에서 먼저 승인된 약물들에 대하여 국내에서 후향적으로 진행된 것이었다. 하지만 국내 제약산업의 활성화에 따라 식약처의 조력이 필요한 상황이 예상되므로 이에 대한 대비가 필요하다 해외 사례를 참고하여 문제 상황에 따른 적절한 대응책을 마련하거나, 조력을 위한 신속심사과 인원 배치 등의 방안을 제시할 수 있다 2.3.2. 신속심사 기준의 구체화 국내 신속심사 대상 지정의 기준이 지나치게 포괄적이라는 점 또한 개선되어야 한다 국내의 경우, 신속심사 대상이 되는 의약품의 분류를‘생명위협 질환 및 중대한 질환의 치료 목적 의약품’, ‘공중보건 위해 감염병 예방 또는 치료 의약품’,‘혁신형 제약기업이 개발한 신약’의 3가지로 분류하고 있으나, 각 항목에 대한 하위 항목을 구체적으로 분류하지는 않은 상태이다. 미국의 경우 우선심사권(PRV, Priority Review Voucher)의 종류를‘열대병에 대한 우선 심사권(Tropical Disease Priority Review Voucher)’ , ‘희귀소아질환에 대한 우선 심사권(Rare Pediatric Disease Priority Review Voucher)’ , ‘Medical countermeasures’의 3가지로 분류하였지만,‘열대병에 대한 우선 심사권’에서는 그 하위 항목을 질환별로 구체적으로 분류하였으며,‘희귀 소아질환에 대한 우선 심사권’에서는‘미국에서 200,000명 이하의 18세 이하 유병인구를 갖는 질환’이라고 구체적인 기준을 명시하였다. 미국과 한국의 기준에 대한 차이는 셀루메티닙과 프레토마니드의 사례에서도 나타난다 두 치료제의 적응증은 각각 신경섬유종증과 결핵으로 뚜렷하게 구분되나, 국내의 신속심사 제도에서는‘생명위협 질환 및 중대한 질환의 치료 목적 의약품’이라는 동일한 항목으로 지정되었다. 하지만 FDA는 각각의 품목에 대해‘희귀 소아질환에 대한 우선 심사권’과‘열대병에 대한 우선 심사권’을 제공하여 두 의약품을 구분하였다(FDA, NDA 213756). 따라서 식약처는 신속심사 대상의 6가지 분류에 대한 구체적인 기준이나 적응증을 제시해야 한다 미국과 같이 신속심사 대상의 기준을 차츰 세분화하고 구체화한다면 해당 약물에 대한 신속심사 지정의 당위성을 보완할 수 있고, 미충족 수요 분야에 대한 공론화를 통해 제약사의 신약개발에 필요한 원동력을 제공하게 될 것이다 2.3.3. 안전성 및 효과에 대한 후속연구 의무화 신속 프로그램은 높은 임상적 이점을 제공하는 약물을 환자에게 신속하게 제공한다는 목표를 바탕으로 시행되었으며, 이는 FDA 신속 프로그램의 85%를 차지하는 항종양 약물이 급속도로 확장되는데 일조하였다. 그러나 본론 1절의 3.3에서 서술하였듯 신속 프로그램을 통해 허가된 의약품의 유효성이나 안전성이 검증되지 않았다는 비판도 다수 제기되었다(Beaver et al., 2018). 이에 따라 FDA는 2021년 셀루메티닙을 포함한 6개의 항암제의 신속심사를 위해 외부 전문가 회의를 소집하였으며, 더 엄격한 심사를 약속한 바 있다 그 영향으로 당해 많은 제약사들이 이전에 신속 승인된 약물이나 신속심사 신청을 사전에 철회하기도 하였다 더 나아가 FDA는 신속 프로그램을 통해 허가된 품목의 후속 연구를 의무화하고,
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 65 후속 연구 자료 미제출 시 약의 시장 철수를 명령할 수 있도록 받는 법안을 발의하였다(이경숙, 2022). 국내의 경우, 후속 연구에서 신속심사 지정 기준을 충족하지 못한다면 허가가 취소될 수 있다는 내용이 명시되어 있다 하지만 미국의 경우 그러한 명시에도 불구하고 제약사가 후속 연구를 불성실하게 이행하더라도 실제로 허가를 취소한 선례가 극히 적기에, FDA가 시장 철수를 명령할 수 있는 권한을 가지도록 법안을 22년 5월에 다시금 발의한 바 있다. 따라서 우리나라 역시 만약 제약사가 허가 후 후속 연구를 불성실하게 진행할 경우, 실제로 허가 취소까지 이어질 수 있도록 제도적 보완이 필요하다 또한, 앞서 서술했듯 국내 신속심사 사례의 대부분은 해외에서 허가 받은 품목을 후향적으로 승인하는 경우가 대다수이다 이러한 국내 실정을 반영하여, 해외에서 허가 받은 신속 프로그램 품목에 대해 해외 허가 이후 후속 연구를 추적할 수 있는 제도의 보완이 필요하다. 2.3.4 신속심사 대상 지정 취소 신속심사 제도는 제약사의 의약품 개발을 빠르게 진행시켜 국내 R&D를 촉진시키기 위해 설립되었다 신속심사로 지정된 의약품은 다른 품목보다 우선하여 심사될 뿐만 아니라 해당 의약품의 상담 및 심사를 위한 전담팀이 배치된다. 해당 제도가 긍정적으로 활용되면 국내 제약사는 의약품 개발에 투자하는 시간과 돈을 절약할 수 있고, 우리나라의 입장에서는 신약 개발이 활성화되고 중대한 질환에 대한 치료제를 자국민에게 보급할 수 있어 모두에게 이득이 될 것이다 하지만 제약사에서 해당 제도를 남용하는 경우 식약처 및 국가에게 피해가 발생할 수 있다 대표적인 예시로 노바티스사에서 개발한 척수성 근위축증 치료제‘졸겐스마(Zolgensma, 성분명 : 오나셈노진아베파르보벡)’를 제시할 수 있다. 중대한 질환을 치료할 수 있고 일본 내에서 개발 및 허가가 이루어질 것이라는 명목으로‘사키가케(Sakigake)’로 지정되어 신속심사의 혜택을 받았으나, 해당 제약사에서는 임상시험 결과 및 PMDA의 요구 사항에 대한 정보를 제대로 제출하지 않아 심사가 오래 연장되었다(Montotsugu T. et al., 2021). 우리나라의 경우 위에서 서술한 프레토마니드가 유사한 사례에 해당한다 제약사의 불성실한 대응으로 인해 허가하는 데에 목표 기간인 90일을 훨씬 넘긴 296일이나 걸렸다. 이처럼 제약사가 의약품 신속심사 제도에 불성실하게 대응할 수 있었던 것은 관련 법안에서 제약사의 자료 제출 기한을 따로 규정하지 않았기 때문이다 국내 제도에서도 제약사의 제출 기한은 제도화되어 있지 않고, 식약처에서 제공하는‘의약품 허가, 심사 분야 자주 묻는 질의응답집’에만 기술되어 있다. 또한 신속심사 지정 취소 조건에도 제약사의 불성실한 대응은 포함되어 있지 않다 신속심사 혜택의 남용은 신속심사 전담팀의 인력 낭비, 더 나아가 다른 의약품의 개발 지연으로 국민 건강의 증진이라는 목적 도달에 실패할 수도 있다 일본에서는졸겐스마 사례 이후 2020년에 법이 개정되어 신속심사 지정 취소에 대한 규정을 강화했다. 우리나라 역시 제약사의 성실한 참여를 독려할 수 있도록 제출 기한 등의 구체적인 사항을 규정해야 하며, 신속심사 혜택의 남용으로 이어질 시 지정을 취소할 수 있도록 제도를 정비해야 한다.
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 66 3. 한국의 혁신형 제약기업 제도 및 신속심사 제도 제언: 브론패스정의 사례를 바탕으로 3.1. 브론패스정 브론패스정은 한림제약㈜에서 개발한 급성 기관지염 치료제이다 염증반응과 관련된 대식세포의 NO 생성 억제, 염증성 cytokine TNF α, IL 1β 분비를 억제하여 항염증 작용을 한다 따라서 호중구, 림프구 감소, 폐 조직의 폐포섬유 파괴와 염증세포 침입을 완화해 급성 기관지염에 효과를 보인다. 성분으로는 1정당 ‘숙지황, 목단피, 오미자, 천문동, 황금, 행인, 백부근 연조엑스(1.4~1.7→1), 옥수수전분 혼합건조물(4 8:1)’ 300 mg을 포함한다. 브론패스정의 유효성분인 생약 연조엑스는 기관지염에 사용되어 온 청상보하탕(淸上補下湯)으로부터 한약재를 선별하고, 기관지에 좋다고 알려진 백부근을 첨가해 복합 생약 추출법을 이용해 얻어냈으며 생약 연조엑스의 주성분 중 백부근에 대한 기허가 사용례가 없어 허가심사에서‘신약’으로 검토되었다(식품의약품안전처, 2020b) 브론패스정은 국내 신속심사 제도를 이용해 허가된 의약품으로, 2020년 12월 24일 품목허가를 신청해 2021년 4월 9일 최종 허가되어, 허가까지 약 4개월가량 소요되었다. 브론패스정을 개발한 한림제약㈜는 2012년부터 혁신형 제약기업 인증을 통과했으며, 혁신형 제약기업 현황23 의 43개 기업 중 하나이다(보건복지부, 2022b). 따라서 브론패스정은 혁신형 제약기업 개발 신약으로 분류되어 신속심사 대상으로 지정되었다 동일 적응증을 두는 기존 치료법이 존재하고 기존 치료법과 유효성 측면에서 유사하긴 하지만, 시간이 지남에 따라 의약품 효과가 감소하거나 더 이상 기존 치료법에 반응하지 않는 환자들에게 다양성을 제공하는 의약품으로서 기대되는 점이 고려된 것으로 사료된다 핵심 임상시험으로 급성 기관지염을 앓고 있는 성인 환자를 대상으로 활성대조약과 비열등성을 입증하기 위한 임상 3상 시험을 진행했다 활성대조약으로는 급성 기관지염을 적응증으로 품목허가 되어있는 움카민정24 을 사용했다. 1차 평가변수로 투여 전 대비 투여 후 7일 시점의 기관지염 중증도 점수(BSS) 총점 변화량을 사용했으며, 브론패스정은 활성대조약인 움카민정 대비 비열등성을 만족하여 급성 기관지염에서 유효성을 입증했다 핵심 임상시험에서 중대한 이상반응도 관찰되지 않았으며 시험군, 대조군에서의 경증 이상반응 차이는 통계적으로 유의하지 않았다. 유효성 측면에서 활성대조약 대비 비열등성과 안전성 프로파일이 허용할 수준으로 판단되어 허가 신청이 인정되었다. 국내에서 신속심사 제도를 이용하여 허가된 의약품 중 FDA의 허가를 받지 못한 의약품은 브론패스정이 유일하다 천연물의약품의 경우 FDA에서 성분 규명이 제대로 되지 않은 것으로 판정되므로 미국 시장에 진출하기 어렵다 마찬가지의 이유로 유럽 시장의 진출도 어려우며, 이는 글로벌 제약시장 진출이라는 혁신형 제약기업 제도의 목적과는 거리가 있다 또한, 유효성 및 안전성을 확인하는 임상시험은 단순히 활성대조약인 움카민정에 대해 기관지염 중등도 점수(BSS)의 비열등성 한계치를 23 2022년 6월 29일 개정안 24 주성분은 펠라고니움시도이데스 11% 에탄올 추출물(1→8~10) 말토덱스트린 혼합물 (1:4.56) 이다
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 67 초과함을 입증하고, 이상반응을 관찰하였다 이는 신속심사의 본 목적인‘생명을 위협하거나 중대한 질병의 치료 분야에서 의학적 미충족을 빠르게 해결하는 것’에 부합한다고 보기 어렵다 급성 기관지염은 세균성 혹은 바이러스성 감염에 의해 주로 발생하며, 천식이나 만성 폐쇄성 폐질환(COPD) 등의 기도 질환을 동반하지 않은 경우 시간이 지나면 호전되는 경우가 많다 또한 급성 기관지염 환자에게 처방될 수 있는 기존 치료법이 충분히 개발되어 있고 복용에 영향을 줄 정도의 이상반응은 흔하지 않으므로 의학적 미충족 상태에 놓여있는 질환이 아니라고 판단된다 혁신형 제약기업 개발 신약이라는 이유만으로 신속심사 대상으로 지정 받기에는 제도의 취지에 부합하지 않을 수 있다는 예시가 될 수 있다 3.2. 일반승인 의약품과의 허가 절차 비교 의료제품에 대한 신속심사 담당부서인 신속심사과가 2020년 8월 31일 신설됨에 따라, 국내의 신속심사 제도가 실행되었다 일반적인 의약품 허가 과정에서, 신속심사를 통해 의약품 허가를 받기 위해서는 허가신청 이전에 신속심사 지정 신청서를 신속심사과에 제출하여 지정되어야 한다. 반면 혁신형 제약기업 개발 신약의 경우 의료제품 허가신청과 동시에 신속심사 대상 지정을 신청할 수 있다 허가신청 이전에 신속심사의 결과를 받기 위해 최대 30일까지 소요되기 때문에 혁신형 제약기업은 이 기간을 단축할 수 있다 신속심사 지정 결정된 경우 신속심사 혜택을 받을 수 있으며 혜택은 다음과 같다. 일반승인 의약품의 허가심사 기간 목표는 120일인 반면, 신속심사를 받는 의약품은 90일을 목표로 한다 추가로, 신속심사로 지정된 의료제품이 허가신청을 하면 타 의료제품보다 우선적으로 심사를 거친다 또한 허가신청 자료에 대해 신속심사과와 사전상담 및 사전검토가 가능해 허가에 필요한 자료를 효율적으로 준비할 수 있다 이러한 이점으로 인해, 본론 2절의 2.1에서 서술된 셀루메티닙의 경우 6개월만에, 위 문단에서 서술된 브론패스정의 경우 4개월만에 국내 의약품 허가를 받을 수 있었다 3.3. 국내 신속심사 제도에 대한 제언 본론 1절의 3.2에서 서술된 국내 신속심사 제도의 대상이 되는 6가지 조건 중 하나는 혁신형 제약기업이 개발한 신약이다. 혁신형 제약기업의 신약은 허가와 함께 신속심사 지정 신청을 할 수 있어 신속심사 제도에서 분명한 이점을 가지고 있다 그러나 혁신형 제약기업 지정은 해당 제약기업이 개발하는 의약품 개개의 특성을 반영하기보다, 연 일정 금액 이상의 R&D 투자가 이루어지는지와 리베이트와 같은 결격 사유에 해당하지 않는지를 중심으로 고려하기 때문에 혁신형 제약기업의 목적과 신속심사 제도의 목적으로부터 다소 벗어난 결과를 초래할 위험이 있다 일례로, 브론패스정은 천연물의약품으로서 국내 시장에서 통용되는 의약품이며 급성 기관지염에 대한 기존 치료법이 시장에 공급되어 있음에도 신속심사를 통해서 허가되었다 이는 혁신형 제약기업이 개발하는 신약이라고 해서 반드시 신속심사 제도 목적에 부합하는 것은 아님을 보여주는 예시라고 할 수 있다 앞서 말했듯이, 혁신형 제약기업의 목표는 1. 국내 제약기업이 복제약(generic), 리베이트 위주의 영업 관행에서 벗어나 글로벌 신약개발 역량을 갖추는 것과 2. 수출 경쟁력을 제고할 수 있도록 제약기업을 선정해 지원하여 제약산업 선진화의 유도하는
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 68 것으로 설정되어 있으므로, 이에 맞추어 세계시장에 도입될 수 있는 의약품의 R&D 투자를 유도해야 할 것이다. 천연물 의약품의 경우에도 성분을 정확히 규명하고 치료적 확증 임상실험을 통해 FDA 승인이 된 사례도 존재하는 만큼, 세계시장을 겨냥한 R&D 투자는 하나의 기준이 될 수 있을 것이다. 신속심사가 이루어지는 목표인 1. 중대한 질환에 대한 치료 및 2. 의학적 미충족 상태의 해결에 부합하기 위해서는 제약회사가 개발중인 의약품이 중대한 임상증상에 대한 것인지, 또한 기존 치료제가 미비한 점이 있는지를 확인해야 할 필요성이 있다. 이는 또한 신속심사의 기준 문제이기도 하다 신속심사의 기준 중 중대한 증상에 대한 기준은 ‘생존, 일상적 기능 수행, 또는 치료하지 않고 방치했을 때 질환의 상태가 악화될 가능성 등과 같은 인자들에 미치는 영향을 고려하여 임상적 판단에 따라 판정한다’고 서술되어 있지만, 이때 필요한 임상적 판단은 바이오마커 등 측정 가능한 지표에 대한 정확한 가이드라인이 존재하지 않아 판단하기 모호하다. 브론패스정의 사례 역시 급성 기관지염을 어떠한 기준에 따라 중대한 질환으로 판정하여 신속심사 대상으로 지정되었는지 허가심사 서류에 서술되지 않아 그 이유를 정확히 알 수 없다. 코로나19 대유행을 시작으로 코로나 백신 및 치료제 뿐 아니라 알츠하이머와 같이 의학적 미충족 상태에 놓여있는 중대한 질환에 관한 신속한 허가심사의 필요성이 끊임없이 대두되고 있는 만큼, 혁신형 제약기업의 R&D 투자 방향을 제시하거나 신속심사 대상 의약품의 기준을 구체적으로 명시하는 등의 방법으로 허가 받고자 하는 의약품의 특성을 충분히 고려하여 신속심사 대상이 지정되도록 개정이 필요할 것이다. 제3장 결론 제1절 요약 및 정리 본 연구는 해외 신속 프로그램의 현황 및 사례 분석을 바탕으로 국내 신속심사 제도의 개선 및 발전 방향에 대해 알아보았다 1절에서는 해외 각국의 신속 프로그램 제도에 대해 소개한 후, 미국의 신속 프로그램 제도와 한국의 신속심사 제도를 구체적으로 정리하여 비교하였다. 특히 미국의 네 가지 신속 프로그램 제도가 도입된 배경과 진행 과정, 프로그램별 이점에 대해서 구체적으로 알아보았다. 미국은 신속 프로그램이 처음 도입된 1970년대 이후로 활발한 의약품 개발과 임상 개발이 이루어졌고, 이 과정에서 필요에 따라 현대의 네 가지 신속 프로그램 제도인 Priority Review, Accelerated Approval, Fast Track, Breakthrough Therapy 가 법으로 성문화되어 제도로 사용되게 되었다 세분화된 각 제도가 궁극적 목적을 다르게 하기에, 각 제도에 따라 절차나 지원하는 자원이 어떻게 차이를 보이는지 살펴보았다 또한 미국의 경우 신속 프로그램의 오랜 역사로 다수의 의약품이 신속 프로그램의 수혜를 받아온 만큼, 신속 프로그램 선정 기준이나 신속 프로그램의 의약품 허가 기준에 대해 비판적, 그리고 옹호적인 견해가 모두 존재함을 설명하였다 신속 프로그램을 통해 승인된 약물들이 일반적인 허가 과정을 거치는 약물보다 높은 치료적 가치를 가진다는 연구 결과도 존재하나, 한편에서는 신속 프로그램으로 인해 일반 허가
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 69 과정보다 치료적 가치가 낮고 이상반응의 위험이 큰 약물들이 더 높은 빈도로 승인되었다는 주장 역시 존재한다. 따라서 미국의 경우 신속 프로그램에 대한 다양한 논의와 보완을 바탕으로 치료적 가치가 높은 약물들을 선별적으로 지정하여 승인하기 위한 노력을 이어가고 있다. 한국의 경우 코로나19를 계기로 2020년 최초로‘의료제품 신속심사 운영 방안’을 제정 후 신속심사과를 신설하였는데, 신속심사 대상 분류에 따라 분류한 후의 차별화된 제도를 두고 있지는 않으며, 대상에 따라 동일한 신속심사 대상 지정 절차와 신속심사 절차를 거치고 있다는 특징이 있다 국내의 신속심사는 신속심사과의 신설 이후 주로 FDA에서 먼저 승인된 의약품에 대한 회고적인 심사를 바탕으로 승인이 이루어졌기에, 아직까지 식약처와 제약사 간의 긴밀한 협의를 통해 임상시험의 설계나 진행, 연구 분석이 이루어진 경우는 거의 존재하지 않는다 2절에서는 신속 프로그램으로 승인된 의약품의 치료적 가치 평가를 통해 신속 프로그램의 진행 현황을 분석하였고, 사례를 바탕으로 국내 신속심사 제도에 대해 제언하였다. 2절의 1항에서는 선행연구의 방법론을 바탕으로, 2018년에서 2020년 사이에 미국에서 신속 프로그램을 통해 승인된 의약품의 치료적 가치를 평가하여 그 결과를 분석하였다 이를 통해 FDA의 신속 프로그램은 일반 허가에 비해서 높은 치료적 가치를 갖는 약물을 승인할 가능성이 크나, 여전히 신속 프로그램을 통해 허가 받은 약물의 과반수 이상은 낮은 치료적 가치를 가질 가능성이 크다는 결론을 도출할 수 있다 이러한 결론을 바탕으로 신속 프로그램을 통해 승인 받은 의약품의 확증적 임상 연구나 시판 후 안전관리의 중요성이 높다는 시사점을 얻을 수 있었다 2절의 2항에서는 국내와 해외에서 모두 신속 프로그램을 바탕으로 허가 받은 약물인 ‘셀루메티닙’과 ‘프레토마니드’의 두 사례를 바탕으로 FDA와 식약처의 신속 프로그램 지정 및 허가, 허가 후 과정을 비교하여 서술하였다. 두 의약품의 신속 프로그램을 통한 허가 과정에서 제도적 차이를 보인 부분은 우선, Priority Review는 국내의 신속심사와는 다르게 지정 대상에 대한 구체적인 적응증 혹은 기준이 존재한다는 것이다 둘째로, 셀루메티닙과 프레토마니드의 임상시험의 설계 및 진행 과정에서 FDA의 긴밀한 조력이 이루어졌다. 셀루메티닙의 허가 과정에서 FDA는 신속 프로그램의 진행 과정에서 제약사에게 임상시험에서 이용된 대체 평가변수의 검증에 대해 조언하며 임상시험의 설계를 도왔으며, 프레토마니드의 경우 FDA가 일부 연구를 직접 지원하였음을 알 수 있었다 마지막으로, 신속 프로그램을 통해 승인된 약물의 후속 확증 연구를 의무화하려는 FDA의 노력과 함께, 필요하다면 신속 프로그램으로 허가된 의약품의 허가를 취소하는 방향으로 FDA의 권한을 확대하려는 미국의 현황을 살펴보았다 이를 바탕으로, 2절의 2항에서는 한/미 신속 프로그램에 대한 주된 차이점과 이를 통해 국내 제도를 보완할 수 있는 쟁점을 네 가지로 제시하였다. 우선, 국내 신약 개발과 임상 연구의 활성화를 위하여 식약처는 제출 자료를 단순히 우선적으로 검토하는 것을 넘어서 제약사의 연구 설계 및 실행에 대해 적극적으로 지원해야 한다 둘째로, 신속심사 지정 대상을 구체화하여 해당 적응증에 대한 제약사의 신약 개발을 독려하고 신속심사 지정의 당위성을 보완할 필요가 있다. 셋째로, 신속 프로그램을 바탕으로 허가된 의약품에 대하여 후속 확증 연구가 성실하게 이루어지고 있는지 확인하고, 그렇지 못한다면 규제기관에서 강제적으로 허가를 취소할 수 있어야 한다 마지막으로, 신속 프로그램에 지정된 약물에 대하여 심사 과정에서 제약사의
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 70 불성실한 대응으로 인해 심사가 계속해서 지연된다면 신속 프로그램의 지정을 취소할 수 있도록 제도를 정비해야 한다. 2절의 3항에서는 FDA가 아닌, 국내에서만 허가를 받은 국내 신속승인 의약품인‘브론패스정’의 사례를 통해 혁신형 제약기업 제도의 첫 허가 과정과 보완점을 살펴보았다. 브론패스정은 FDA에서는 허가 받지 않고, 국내에서는 신속심사를 통해 허가 받은 최초의 의약품이다 하지만 브론패스정은 천연물의약품으로 현재로써 그 성분 규명이 완전히 이루어지지 않아 미국이나 유럽 시장의 진출에 어려움이 있으며,‘급성 기관지염’이라는 브론패스정의 적응증이 의학적 미충족 상태라는 근거가 충분하지 못하기에 신속심사 지정 대상으로서 부족함이 있다고 판단하였다 따라서 국내 제약기업이 글로벌 신약개발 역량을 갖추고, 제약산업의 선진화를 유도하자는 기존의 혁신형 제약기업 제도의 목적을 실천하기 위해서는 혁신형 제약기업 제도의 선정 기준을 보완해야 한다. 또한 브론패스정과 같은 천연물의약품의 경우 성분의 일정 비율 이상을 규명한다거나, 해외 진출을 염두에 둔 임상시험의 설계를 지원하는 등 혁신적 제약기업이 세계시장을 겨냥한 R&D에 투자할 수 있도록 독려하는 제도적 보완이 필요할 것이다 마지막으로 국내 신속심사의 대상 기준을 명확히 하려는 노력 역시 필요하다 제2절 연구의 의의 본 연구는 해외 신속 프로그램의 현황 및 사례 분석을 바탕으로 국내 신속심사의 개선 및 발전 방향에 대해 알아보았다 해당 연구는 다음과 같은 의의를 가진다 첫째, 본 연구는 국내의 신속심사 제도의 전반적인 내용을 법령, 식약처의 가이드라인, 식약처의 허가 사례 및 학술논문 등 다양한 참고문헌을 바탕으로 사례 중심으로 정리하였다. 식약처의 신속심사과가 2020년 8월에 신설된 바 있지만, 국내의 신속심사 제도에 대한 연구는 2020년의 선행 연구(박지혜, 2020) 이후로 전무한 상황이다. 더불어, 소수의 국내 신속심사 제도에 대한 연구는 주로 코로나19를 적응증으로 한 약물에 대해 한정적으로 진행되고 있다 따라서 식약처의 신속심사 대상과 과정, 그리고 신속심사를 통해 허가된 사례를 다양한 적응증을 바탕으로 정리한 본 논문은 충분한 의미를 가진다 둘째, 특히 해당 논문은 한국의 신속심사 제도를 거쳐 허가된 셀루메티닙, 프레토마니드의 사례를 미국에서의 신속심사 프로그램 허가 과정과 비교, 분석하여 국내의 신속심사 허가 사례에 대한 시사점을 도출하였다 그 결과로 신속심사 대상 지정에 있어서 FDA의 Priority Review와 같은 구체적인 기준을 마련해야 한다는 점, 식약처가 제약사의 임상시험 설계와 진행을 적극적으로 조력해야 하며 제약사의 불성실한 이행 시 지정 취소가 가능하게 해야 한다는 점, 제약사의 후속 확증 연구 의무화를 위한 제도적 조치가 필요하다는 점 등 구체적인 보완점을 제시하였기에 타 연구와 차별화 된다 셋째, 본 연구는 비교적 최근인 2018~2020년간 FDA의 신속 프로그램을 통해 허가된 의약품의 치료적 가치를 조사하고 일반 허가 의약품과 그 값을 비교 분석하였다. 최근 FDA의 신속 프로그램이 임상적 효과를 증명해주지 못한다는 비판이 제기되는 상황에서, FDA의 신속 프로그램 전반에 대하여 치료적 가치 평가를 분석하는 연구는 2017년도 이후에 존재하지 않으며, 유사한 분석 기법을 사용하였더라도 주로 Accelerated
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 71 Approval에 한정하여 분석이 진행되었다 따라서, 2018년에서 2020년 사이에 FDA의 신속 프로그램을 통해 허가된 약물에 대하여 연도별, 그리고 신속 프로그램별로 치료적 가치 평가를 분석한 본 연구는 충분히 의미를 가진다 국내 신속심사 제도의 특징과 보완점을 사례 중심으로 분석한 연구는 매우 제한적이므로 본 연구는 선행 연구로서 가치가 있으며, 식약처에서 신속심사에 대한 보완 및 개정을 진행할 때 도움이 될 것이다 또한 제약사는 본 연구를 통해 국내의 신속심사 제도를 보다 심도 있게 이해하고, 해외의 신속 프로그램에 대한 사례 중심의 서술을 바탕으로 해외 진출을 위한 전략을 수립할 수 있을 것이다 제3절 연구의 한계 및 발전 방향 본 연구에서 의약품의 치료적 가치 평가를 진행할 때, 허가 받은 모든 의약품에 대해 치료적 가치가 평가되지 않았으므로 치료적 가치 평가 자료가 존재하는 일부 의약품에 대해서만 분석이 이루어졌다 또한, 치료적 가치 평가를 진행한 프랑스, 독일, prescrire 등의 평가 기관에서 구체적인 평가 기준을 제공하지 않았기에 평가 기준에 대한 의문이 가능하다 마지막으로 본 연구는 신속 프로그램을 통한 초기 승인 시 평가된 치료적 가치를 바탕으로 분석하였으며 추가적인 적응증에 대한 치료적 가치는 달라질 수 있다 추후에 평가 기관에서 치료적 가치 평가 결과가 축적되면, 본 연구에서 사용한 결과에서 더 나아가 데이터를 확장해 볼 수 있다.
식품의약품안전처. (2021a). 의약품 품목허가 보고서 부광프레토마니드정 식품의약품안전처 (2021b) 의약품의 신속심사 적용기준에 대한 가이 라인 (20 ) 승 정보집 식품의약품안전처 신속심사과 (2020a) 신속심사과 소개 및 운영 안내 식품의약품안전처 신속심사과. (2020b). 의료제품 신속심사 운영방안 식품의약품안전처 신속심사과 (2021a) 의료제품의 신속심사에 대한 업무 절차 식품의약품안전처 신속심사과 (2021b) 해외 주요국 신속심사 사례집(민원인 안내서) 식품의약품안전처 제품화전략지원단 (2022) 식품의약품안전처 제품화전략지원단 업무설명회(의약품, 바이오의약품)
질병관리청 (2021) 결핵관리지침 정보
FDA (2016) Tropical Disease Priority Review Vouchers Guidance for Industry
FDA. (2019). Pretomanid sponsor briefing document
FDA (2020) Guidance for Industry Expedited Programs for Serious Conditions Drugs and Bio logics
PMDA (2020) Zolgensma_Novartis Pharma K K _review report
WHO. (2021). Global tuberculosis report 2021 2. 학술논문 박지혜. (2020). 코로나19 감염증 치료제·백신 개발과 신속심사(Fast Track)제도. 생명윤리정책연구, 14(1), 45 74 https://doi org/10.38046/apjhle.2020.14.1.002 Beaver, J A., Howie, L J., Pelosof, L., Kim, T., Liu, J., Goldberg, K B., Sridhara, R., Blumenthal, G. M., Farrell, A. T., Keegan, P., Pazdur, R., & Kluetz, P. G. (2018) A 25 Year Experience of US Food and Drug Administration Accelerated Approval of Malignant Hematology and Oncology Drugs and Biologics: A Review JAMA Oncol, 4(6), 849 856 https://doi org/10.1001/jamaoncol.2017 5618 Casey, D., Demko, S., Sinha, A., Mishra Kalyani, P. S., Shen, Y. L., Khasar, S., Goheer, M A., Helms, W S., Pan, L., Xu, Y., Fan, J., Leong, R., Liu, J., Yang, Y., Windsor, K., Ou, M., Stephens, O., Oh, B., Reaman, G H., . . . Singh, H (2021) FDA Approval Summary: Selumetinib for Plexiform Neurofibroma Clin Cancer Res, 27(15), 4142 4146. https://doi.org/10.1158/1078 0432.CCR 20 5032 Erin E Kepplinger (2015) FDA’ s Expedited Approval Mechanisms for New Drug Products. 34 Biotechnology Law Report 15 Number 1, 2015 Fleming TR. Surrogate endpoints and FDA's accelerated approval process. Health Aff (Millwood). 2005 Jan Feb;24(1):67 78 doi: 10.1377/hlthaff.24.1.67 PMID: 15647217. Hwang, T J., Ross, J S., Vokinger, K N., & Kesselheim, A S (2020) Association between FDA and EMA expedited approval programs and therapeutic value of new medicines: retrospective cohort study BMJ (Clinical research ed ), 371, m3434 https://doi.org/10.1136/bmj.m3434 J A DiMasi, et al (1991) Cost of Innovation in the Pharmaceutical Industry” 10(2) j health econ 107 142, 123
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 72 참고문헌 1. 보고서 보건복지부 (2021) 혁신형 제약기업 인증현황 고시 개정 2021 12. 24 보건복지부고시 제2021 318호 보건복지부 (2022a) 혁신형 제약기업 인증 등에 관한 규정 개정 공고 보도자료 보건복지부. (2022b). 혁신형 제약기업 인증현황 고시 개정 2022. 6. 29. 보건복지부고시 제2022 162호 보건복지부 보건산업진흥과. (2022). 제약산업 육성 및 지원에 관한 특별법 [법률 제18902호] 식품의약품안전처 (2015) 의약품 허가, 심사분야 자주 묻는 질의응답집(2010 2015년 6월) 식품의약품안전처. (2018). 세포치료제 조건부 허가를 위한 임상시험 설계 및 분석 시 고려 사항 식품의약품안전처 (2020a) "식약처, '신속심사대상 의약품' 최초 지정" 보도자료 식품의약품안전처 (2020b) 허가심사결과 정보공개보고서 브론패스정
드
식품의약품안전처.
22
. 코로나19 백신 신속 국가출하
인
Kerstin N. V., Aaron S. K., Camille E. G. & Thomas J. H. (2022). Therapeutic Value of Drugs Granted Accelerated Approval or Conditional Marketing Authorization in the US and Europe From 2007 to 2021. JAMA Health Forum, 3(8):e222685 https:// doi org/10.1001/jamahealthforum.2022.2685
Lam, C., Meinert, E., Halioua Haubold, C. L., et al. (2019). Systematic review protocol: an assessment of the post approval challenges of autologous CAR T therapy delivery, BMJ Open, 9, e026172. https://doi org/10.1136/bmjopen 2018 026172 Liu, K. Y., Howard, R. (2021). Can we learn lessons from the FDA’ s approval of aducanumab?, Nature Reviews Neurology, 17, 715 722. https://doi.org/10.1038/s41582 021 00557 x Markham, A., & Keam, S J (2020) Selumetinib: First Approval Drugs, 80(9), 931 937 https://doi.org/10.1007/s40265 020 01331 x Montotsugu T et al (2021) Achievements and challenges of the Sakigake designation system in Japan. Brit Jnl Clinical Pharma, 87, 4027 4035. https:// doi org/10.1111/bcp.14807 Michael D Greenburg (2012) AIDS, Experimental Drug Approval, and the FDA New Drug Screening Process. 3 N.Y.U.J. legis. & pub. Senior, M (2022) Fresh from the biotech pipeline: too much, too fast? Nature biotechnology, 40(2), 155 162. https://doi org/10.1038/s41587 022 01208 2 Thomas J H., Joseph S R., Kerstin N V & Aaron S K (2020) Association between FDA and EMA expedited approval programs and therapeutic value of new medicines: retrospective cohort study BMJ, 371:m3434 https://doi org/10.1136/bmj m3434 Vokinger, K N., Hwang, T J., Glaus, C., & Kesselheim, A S (2022) Therapeutic Value Assessments of Novel Medicines in the US and Europe, 2018 2019 JAMA network open, 5(4), e226479. https://doi.org/10.1001/jamanetworkopen.2022.6479
3 인터넷 자료 권선미. (2015.6.29.). 혁신형 제약 인증 실패기업 살펴보니. 중앙일보헬스미디어.
https://jhealthmedia joins com/_inc/pop_print asp?pno=15166 백성주. (2021.9.2.) 희귀난치 신경섬유종증 1형 '첫 치료제' 등장. 데일리메디.
https://www dailymedi com/news/news_view php?wr_id=873714 성은아. (2022.1.13.) FDA는 왜 바이오젠 ‘아두카누맙’을 치매약으로 승인했나. 팜뉴스.
https://www pharmnews com/news/articleView html?idxno=200218 양현덕. (2021.6.12.) 아두카누맙의 개발, 미국 FDA의 허가, 그리고 이어지는 논란. 디멘시아뉴스 https://www dementianews co kr/news/articleView html?idxno=3913 이경숙 (2022.05.14 ) 미국 FDA, 신속승인 보완… 더 깐깐한 허가제도 만든다 메디소비자뉴스 https://www.medisobizanews.com/news/articleView.html?idxno=87360 이슬비 (2022.4.29) '보험 제한' 유
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 73
美
럽 '승인 철회' 치매 신약 아두카누맙 '주춤' 데일리메디 https://www dailymedi com/news/news_view php?wr_id=883393 약학정보원 항결핵제 https://www health kr/researchInfo/disease_detail asp?idx=24 코셀루고캡슐10밀리그램(셀루메티닙황산염). (2021.5.2.). 검색일 8월 23일. 출처 식품의약품안전처 의약품안전나라: https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetail?itemSeq=202104242 최윤수 (2021.10.25) 해외 주요국 신속심사 신청방법① FDA편 약업신문 https://www.yakup.com/news/index.html?mode=view&nid=262245 홍숙 (2021.8.27 ) 3천명 중 1명 꼴 신경섬유종증 대증치료 넘어야 히트뉴스 http://www hitnews co kr/news/articleView html?idxno=35593 Drug approval package: KOSELUGO (selumetinib). Drugs@FDA. Silver Spring, MD. U.S. Food and Drug Administration Available from: https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2020/213756Orig1s000ltr pdf Haute Autorité de Santé. https://www.has sante.fr/jcms/pprd_2986129/en/home IQWiG de: Institute for Quality and Efficiency in Health Care https://www iqwig de/en/
National Library of Medicine (U.S.). (2015) A Phase 3 Study Assessing the Safety and Efficacy of Bedaquiline Plus PA 824 Plus Linezolid in Subjects With Drug Resistant Pulmonary Tuberculosis Identifier NCT02333799 https://clinicaltrials gov/ct2/show/NCT02333799?term=Nix TB&draw=2&rank=1
National Library of Medicine (U.S.). (2015) MEK 1/2 Inhibitor Selumetinib (AZD6244 Hydrogen Sulfate) in Adults With Neurofibromatosis Type 1 (NF1) and Inoperable Plexiform Neurofibromas Identifier NCT02407405 https://clinicaltrials.gov/ct2/show/NCT02407405
Prescrire https://english prescrire org/en/Summary aspx
TB alliance. Pretomanid and the BPaL Regimen. https://www tballiance org/access/pretomanid and bpal regimen
US Food&Drug Administration. (2014). FDA website > Regulatory information > Search for FDA guidance documents > Expedited Programs for Serious Conditions Drugs and Biologics. https://www.fda.gov/regulatory information/search fda guidance documents/expedited programs serious conditions drugs and biologics
US Food&Drug Administration (2017) FDA website > News & Events > FDA Newsroom > Press Announcements < FDA approval brings first gene therapy to the United States. https://www fda gov/news events/press announcements/fda approval brings first gene therapy united states
US Food&Drug Administration (2018a) FDA website > For Patients > Learn About Drug and Device Approvals > Fast Track, Breakthrough Therapy, Accelerated Approval, and Priority Review> Accelerated Approval https://www fda gov/patients/fast track breakthrough therapy accelerated approval priority review/accelerated approval
US Food&Drug Administration (2018b) FDA website > For Patients > Learn About Drug and Device Approvals > Fast Track, Breakthrough Therapy, Accelerated Approval, and Priority Review> Breakthrough Therapy https://www fda gov/patients/fast track breakthrough therapy accelerated approval priority review/breakthrough therapy
US Food&Drug Administration. (2018c). FDA website > For Patients > Learn About Drug and Device Approvals > Fast Track, Breakthrough Therapy, Accelerated Approval, and Priority Review> Fast Track. https://www.fda.gov/patients/fast track breakthrough therapy accelerated approval priority review/fast track
US Food&Drug Administration. (2018d). FDA website > For Patients > Learn About Drug and Device Approvals > Fast Track, Breakthrough Therapy, Accelerated Approval, and
Priority Review> Priority Review. https://www.fda.gov/patients/fast track breakthrough therapy accelerated approval priority review/priority review
US Food&Drug Administration (2021) FDA website > Drugs > News & Events for Human Drugs > FDA’ s Decision to Approve New Treatment for Alzheimer’ s Disease. https://www fda gov/drugs/news events human drugs/fdas decision approve new treatment alzheimers disease
US Food&Drug Administration (2022) FDA website > Drugs > Development & Approval process
| Drugs > New Drugs at FDA: CDER’ s New Molecular Entities and New Therapeutic Biological Products https://www fda gov/drugs/development approval process drugs/new drugs fda cders new molecular entities and new therapeutic biological products . 20 .
[허가팀] 국내 신속심사 제도의 현황 및 시사점 서울대학교 약학정책연구회 74
4
법령 보건복지부 (
22. 6
10 개정) 제약산업 육성 및 지원에 관한 특별법 법률 제18902호 보건복지부(보건산업진흥과), 식품의약품안전처(혁신진단기기정책과). (2021. 8. 17. 타법개정) 의료기기산업 육성 및 혁신의료기기 지원법 법률 제18446호 식품의약품안전처(의료기기정책과). (2014. 1. 28. 일부 개정) 의료기기법. 법률 제12392호 FD&C Act (21CFR314.500) Accelerated approval of new drugs for serious or life threatening illness
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 75 [서울대학교 약학정책연구회 정책1팀 연구] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학대학 약학정책연구회 3기 정책1팀 김재희, 우상준, 유승주, 이재희
[주제어] 원격의료, 비대면 진료, 의약품 배송, 전자처방전, 복약지도, 약물 오남용
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 76 <초록> 정보통신 기술의 발달에 따라 원격의료는 의료접근성을 높일 수 있는 방법으로 부상하였다 코로나19 사태 이후 법 개정을 통해 감염병 위기 상황에서 한시적으로 비대면 진료가 허용되면서 원격의료가 활성화되었다. 또한 정부차원에서 비대면 진료 제도화를 국정과제로 지정하는 등 원격의료의 제도화를 위해 노력하고 있다 이러한 과정에서 원격의료에 대해서는 많은 논의가 이루어졌지만, 원격의료 중 약사와 관련된 처방전, 복약지도, 의약품의 배송 등의 사항들은 논의가 부족한 상황이다. 이에 본 연구에서는 국내의 원격의료와 관련된 법, 제도를 살펴보고 원격의료에 따른 사용현황과 문제점을 분석해 보았다. 의료법과 약사법 그리고 감염병의 예방 및 관리에 관한 법률 중 원격의료와 관련 있는 조항들을 보며 국내의 원격의료 제도를 분석하고, 이를 미국과 일본의 관련 제도와 비교하였다. 또 의약품 배송 서비스를 중심으로 원격의료가 이루어지는 방식을 살펴보았다 그리고 한시적 비대면 진료 허용 이후 국내의 데이터를 분석하여 원격의료가 이루어진 실태를 분석하였다. 이를 통해 전자처방전, 복약지도, 의약품 배송 과정의 문제점인 복약지도의 미흡, 의약품 오남용 우려, 의약품 취급 관리 문제와 개인정보 유출 우려를 지적하였다 이에 대한 제도적 개선점을 다음과 같이 제시하였다 첫째, 민간플랫폼을 관리하는 기구를 통해 안전한 비대면 진료와 의약품 배송이 이루어지도록 하고, 방문약료 서비스를 통해 올바른 의약품 사용을 유도한다 또 마약류 관리사업을 통해 오남용 우려가 큰 의약품을 관리한다 둘째, 전자처방전 제도를 도입하며 공적 전자처방전 제도 혹은 감시 기관을 통해 개인의료정보의 보호를 도모한다. 셋째, 원격의료 관련 법규의 개선을 통해 의약품 배송이 가능한 상황 혹은 대상 등 원격의료에서 약사에 관한 규정이 필요하다. 관련된 세부사항인 비대면 의약품 서비스에 대한 수가 설정, 본인확인, 의료사고 시 책임소재, 시스템 및 기기들의 보안에 관한 규정을 만들기 위한 논의가 필요하다고 보았다. [주제어] 원격의료, 의료접근성, 의약품 배송, 전자처방전, 비대면 진료
2.3 전화진료 이용 환자현황 91
2.4 약처방 현황 92 2.5 주요질환 현황 92 정리 93 의약품 배송으로 인해 발생할 수 있는 문제점 94 국내 94 해외 97 제3절 개선방안 97 의약품
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 77 <목차> 제1장 서론 78 제1절 연구 배경 및 목적 78 제2절 연구 내용 및 방법 .................................................... 79 제2장 본론 79 제1절 원격의료와 관련된 기존 법률 .......................................... 79 1. 국내의 원격의료 관련 법률 79 2. 해외의 원격의료 관련 제도 82 2.1 미국 ..................................................................................................................... 82 2.2 일본 ..................................................................................................................... 83 2.3 시사점 84 제2절 의약품 배송 시장 현황 및 변화 84 1. 의약품 시장의 변화 84 1.1 국내 84 1.2 해외 87 2. 코로나 19 이후 의료인 환자 원격의료 및 처방 현황 분석 88 2.1 전화상담 의료기관 제공현황................................................................................. 88 2.2 진료과목별 전화상담 및 처방 현황 90
......................................................................................................
2.6
.....................................................................................................................
3.
3.1
3.2
1.
배송과 관련한 약료서비스 개선 방안 97 1.1 민간 플랫폼 관리 기구 신설 & 약국 시스템 개선 98 1.2 약료서비스 활용 방안 방문 약료를 통한 다제약물 관리, 마약류 관리사업 .......... 99 2. 전자처방전의 문제점 및 개선 방안 100 3. 원격의료 관련 법규의 개선 101 제3장 결론 103 제1절 요약 및 정리 ........................................................ 103 제2절 의의 및 한계점 ...................................................... 105 참고문헌 106
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 78 제1장 서론 제1절 연구 배경 및 목적 코로나19 유행으로 미국과 일본 등 선진국을 중심으로 원격 의료 시행 규정이 완화되었다. (김희선, 2022). 우리나라도 코로나19 1차 대유행 시기 의료기관 대면 접촉 최소화를 위해 전화상담 및 처방을 한시적으로 허용하는 복지부의 공고(제2020 177호/20. 02.24)로 비대면 진료가 허용되었다 그러면서 ‘배달약국’을 표방한 플랫폼 업체들이 등장했다. 코로나 사태가 지속되며 비대면 진료와 처방 발행에 대한 구체적 조항을 감염병 예방법에 신설하고 전화상담에 따른 한시적 진료비도 추가(제2020 889호/20.12.14)했다 그러나 전화상담에 따른 처방전 발행 이후 처방약 조제와 수령에 대한 것은 환자와 약사가 개별 협의하도록 하였다. 2021년 6월 10일 김부겸 국무총리는 △비대면 진료 및 의약품 원격조제 규제 개선 △약 배달 서비스 제한적 허용 등 15개를 규제개선 대상으로 선정하였고(정수연, 2021) 복지부는 2022년 8월 4일 <한시적 비대면 진료 중개 플랫폼 가이드라인>을 마련하며 비대면 진료와 의약품 배송 법제화에 박차를 가하고 있다 우리나라에서 원격의료 도입 주장은 2002년부터 존재했으며, 2002년 의료법 개정으로 의료인 간의 협진을 위한 원격의료가 허용됐고 관련된 수가가 개발됐다. 이후 18, 19, 20대 국회에서 의료인과 환자 간의 원격진료를 하는 내용의 의료법 개정안이 발의됐지만, 관련 단체와 시민사회의 우려가 있었고 통과되지 못했다(정수연, 2021). 원격의료 도입에 있어서 찬성 입장과 반대 입장이 대립 중이다. 찬성 측은 ①국민 편의의 증진, ②의료 사각지대 해소(정수연, 2021), ③ 의료 접근성 강화 ④의료 서비스 다양성 확대 ⑤ 만성질환자 관리 개선 등을 이유로 원격 의료의 확대를 주장하고 있다. 또한 코로나 19와 같은 팬데믹 상황으로 인해 비대면 의료에 대한 수요가 높아지는 상황이다(김지연, 2020). 실제로 비대면 진료와 약 배달 서비스를 제공하는 주요 어플의 사용자 수는 계속 증가하며 관련 시장도 활발하게 성장 중이다. 그러나 단점 또한 명확하다. 환자안전 우려, 개인정보 유출 문제 등이 있다(정수연, 2021). 그리고 편의성과 이익만을 좇아 원격의료가 도입된다면 약사가 의약품 오남용을 막기 어려워질 수 있다. 하지만 어떻게 하면 부작용을 줄일 수 있는지 그리고 비대면 시대에 약사의 역할에 관한 논의는 아직 부족한 실정이다 그로 인해 실제로 국내에서 환자의 안전을 위협할 수 있는 문제들이 사례를 통해 나타나고 있다. 따라서 필요한 환자들에게 안전한 치료를 제공하고 미래 약사들의 방향을 제시할 수 있는 연구가 필수적이다 따라서 본 연구는 비대면 진료 및 의약품 배송 서비스의 본격적인 도입이 예상됨에 따라 국내외 원격의료 정책과 제도를 분석한다. 국내 원격의료 현황과 국내외 원격의료 시장의 현황 및 변화를 알아보고 문제점을 사례를 통해 분석한다. 그 후 분석한 문제점을 보완하여 편의성 뿐만 아니라 환자가 중심이 되고 약사의 직능을 발전시킬 수 있도록 하는 정책 개선방안을 제안한다.
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 79 제2절 연구 내용 및 방법 본 연구에서는 우선 원격의료에 관한 선행연구들과 국내 원격의료에 관련된 의료법, 약사법, 감염병예방 및 관리에 관한 법률을 살펴보고 대법원 및 헌법재판소 판례들과 이들을 분석한 논문들을 조사하여 원격의료에 대한 기존의 제도를 분석한다 또한 우리나라보다 앞서 원격의료를 시행한 미국과 일본의 법, 제도를 살펴보고 추후 원격의료의 제도화 과정에서 시사점을 도출한다 국내에서 원격의료가 활용되는 현황을 살펴보기 위해 비대면 의료 플랫폼의 운영방식을 조사하고 최근 발표된 한시적 비대면 진료 중개 플랫폼 가이드라인을 살펴본다 그리고 해외에서 원격의료가 이루어지는 방식을 조사한다 코로나1 9 이후 국내에서 원격의료가 시행된 현황을 살펴보기 위해 건강보험심사평가원과 의료 정책 연구소에서 2020년 이후 전화상담 및 처방 자료를 활용한 보고서를 활용하였다 다음으로 국내와 해외에서 비대면 진료 및 의약품 배송과 관련해 발생한 문제점들을 조사한다 앞에서 분석한 내용을 토대로 의약품 배송에 따른 문제점을 개선하기 위한 약료서비스와 전자처방전, 관련 법규의 개선방안을 제시한다 연구에 필요한 자료를 얻기 위해 DBpia, KISS, RISS, PubMed 등의 학술 데이터베이스를 활용하여 선행연구를 분석하는 질적연구를 수행하고, 건강보험심사평가원, 의료정책연구소, 한국과학기술기획평가원 등의 보고서를 이용하였다 원격의료는 현재 활발한 사회적 논의가 이루어지고 있는 만큼 정책 추진과 관련한 최신 정보를 얻기 위해 보건복지부 고시 내용과 ‘약사공론’, ‘메디컬타임즈’ ‘히트뉴스’ 등의 보건의료 전문미디어 사이트의 보도자료를 참조하였다. 본 연구에서 사용되는 원격의료 용어의 의미는 의료제공자가 서로 떨어져 있는 의료 수요자에게 정보통신기술을 이용하여 의료서비스를 제공하는 것을 의미한다 (윤효영 202 1). 진단과 처방을 내리는 비대면진료 혹은 원격진료와 의약품 배송 서비스는 원격의료에 포함되는 개념으로 보았다. 제2장 본론 제1절 원격의료와 관련된 기존 법률 1. 국내의 원격의료 관련 법률 <의료법> 제17조(진단서 등) ①의료업에 종사하고 직접 진찰하거나 검안(檢案)한 의사[이하 이 항에서는 검안서에 한하여 검시(檢屍)업무를 담당하는 국가기관에 종사하는 의사를 포함한다], 치과의사, 한의사가 아니면 진단서ㆍ검안서ㆍ증명서를 작성하여 환자(환자가 사망하거나 의식이 없는 경우에는 직계존속ㆍ비속, 배우자 또는 배우자의 직계존속을 말하며, 환자가 사망하거나 의식이 없는 경우로서 환자의 직계존속ㆍ비속, 배우자 및 배우자의 직계존속이 모두 없는 경우에는 형제자매를 말한다) 또는 「형사소송법」 제222 조제1항에 따라 검시(檢屍)를 하는 지방검찰청검사(검안서에 한한다)에게 교부하지 못한다. 후략 <개정 2009. 1. 30., 2016. 5. 29., 2019. 8. 27.>
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 80 제33조(개설 등) ①의료인은 이 법에 따른 의료기관을 개설하지 아니하고는 의료업을 할 수 없으며, 다음 각 호의 어느 하나에 해당하는 경우 외에는 그 의료기관 내에서 의료업을 하여야 한다. <개정 2008. 2. 29., 2010. 1. 18.> 제34조(원격의료) ①의료인(의료업에 종사하는 의사ㆍ치과의사ㆍ한의사만 해당한다)은 제3 3조제1항에도 불구하고 컴퓨터ㆍ화상통신 등 정보통신기술을 활용하여 먼 곳에 있는 의료인에게 의료지식이나 기술을 지원하는 원격의료(이하 “원격의료”라 한다)를 할 수 있다. ②원격의료를 행하거나 받으려는 자는 보건복지부령으로 정하는 시설과 장비를 갖추어야 한다 <개정 2008. 2. 29., 2010. 1. 18.> ③원격의료를 하는 자(이하 “원격지의사”라 한다)는 환자를 직접 대면하여 진료하는 경우와 같은 책임을 진다 ④원격지의사의 원격의료에 따라 의료행위를 한 의료인이 의사ㆍ치과의사 또는 한의사 (이하 “현지의사”라 한다)인 경우에는 그 의료행위에 대하여 원격지의사의 과실을 인정할 만한 명백한 근거가 없으면 환자에 대한 책임은 제3항에도 불구하고 현지의사에게 있는 것으로 본다 원격의료 중 비대면 진료를 명시적으로 금지하는 법안은 없으나 관련된 법으로 의료법 17 조 1항과 의료법 34조가 있다 의료법 17조와 17조의2에서는 의사의 직접 진찰 원칙이 규정되어 이에 관한 논란이 있으나 이를 대면진료 원칙의 근거로 보는 경향이 있다. 헌법재판소는 이를 의사의 대면진료 원칙의 근거로 보는 반면(헌법재판소 2012. 3. 29. 선고 2010헌바83 전원재판부) 대법원은 의사의 대면진료를 규정하지 않는다고 판단하였다 (대법원 2013 4. 11. 선고 2010도1388 판결.) 그러나 코로나19 사태 이전에 비대면 진료는 급여항목으로 규정 되어있지 않아 비대면 진료 이후 대면진료를 한 것처럼 진찰료를 청구할 경우 사기죄에 해당되었다 그리고 비급여로 진찰료를 청구할 경우 임의 비급여 진료행위로 심사의 대상이 된다(이얼 2014). 이처럼 원격진료는 의료법 상에서 명시적으로 금지되지는 않았으며 코로나19 사태 이전에는 건강보험 급여상의 이유로 현실적으로 시행되지 못했다 의료법 34조에는 원격의료가 규정되어 있으나, 원격지의 의사가 환자와 대면하는 의료인에게 자문을 해주는 형식의 원격자문만이 허용되어 있을 뿐, 환자에 대해 비대면 방식으로 진찰, 처방하는 비대면 진료는 허용되지 않았다 따라서 현재 법률에 따르면 감염병 대응을 위한 예외적인 상황이 아니면 비대면 진료는 허용되지 않는다. <약사법> 제24조(의무 및 준수 사항) ④약사는 의약품을 조제하면 환자 또는 환자보호자에게 필요한 복약지도(服藥指導)를 구두 또는 복약지도서(복약지도에 관한 내용을 환자가 읽기 쉽고 이해하기 쉬운 용어로 설명한 서면 또는 전자문서를 말한다)로 하여야 한다. 이 경우 복약지도서의 양식 등 필요한 사항은 보건복지부령으로 정한다 <개정 2014. 3. 18.> 제50조(의약품 판매) ①약국개설자 및 의약품판매업자는 그 약국 또는 점포 이외의 장소에서 의약품을 판매하여서는 아니 된다. 다만, 시장ㆍ군수ㆍ구청장의 승인을 받은 경우에는 예외로 한다.
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 81 의약품 배송과 관련된 법률을 보면 약사법 제50조 1항에 의해 의약품을 판매할 수 있는 장소는 약국 또는 점포로 한정된다. 보건복지부 유권해석과 판례에서 온라인상의 약국은 이 조항에 해당하지 않는 것으로 판단되었으며, 헌법 재판소는 이 조항을 합헌으로 판단하였다 (헌법재판소 2008. 4. 24. 2005헌마373 전원재판부). 또 대법원과 헌법재판소에서 택배를 통한 의약품 배송은 의약품 판매를 약국으로 제한하는 약사법 제50조 1항을 위반하는 것으로 판단하였다. 대법원 및 헌법재판소 판례에 따르면 약국 또는 점포 이외의 장소에서 의약품을 판매하여서는 안되며, 비대면 방식의 복약지도와 판매, 배송은 허용되지 않는다 판결문에 따르면 이 법 조항의 취지는 의약품의 주문, 조제, 인도, 복약지도 등 의약품 판매를 구성하는 행위의 전부 또는 주요 부분이 약국 또는 점포 내에서 이루어지게 하여 약사의 관리를 받게 함으로써 안전한 의약품의 사용을 증진하고 국민건강을 증진하는 것이다 (대법원 2008. 10. 23. 선고 2008도3423 판결). 헌법재판소에 따르면 의약품의 판매장소를 약국으로 제한하는 법의 목적은 “약사가 환자를 직접 대면하여 충실한 복약지도를 할 수 있게 하고, 보관과 유통과정에서 의약품이 변질·오염될 가능성을 차단하며, 중간 과정 없는 의약품의 직접 전달을 통하여 약화사고시의 책임소재를 분명하게 함으로써 국민보건을 향상·증진시키기 위함”이다. 그리고 환자에게 약사가 직접 의약품을 전달하는 것이 위 조항의 예외로 인정되어 가능하므로 의약품의 배송이 필요한 경우는 상정하기 어려우며, 또 약사가 아닌 자에 의한 의약품의 조제와 판매 행위를 규제하기 위해 판매장소의 제한이 필요하다고 보았다 (헌법재판소 2008. 4. 24. 2005헌마373 전원재판부). 이와 관련하여 하급심의 판결에서 약사법 제24조 4항의 복약지도 규정과 50조 1항에 따라 의약품과 복약지도서를 배달하는 것은 약국에서 대면 복약지도를 하는 것과 동일하게 볼 수 없다고 하였다 (진보영 2019). <감염병의 예방 및 관리에 관한 법률> 제49조의3(의료인, 환자 및 의료기관 보호를 위한 한시적 비대면 진료) ① 의료업에 종사하는 의료인(「의료법」 제2조에 따른 의료인 중 의사ㆍ치과의사ㆍ한의사만 해당한다 이하 이 조에서 같다)은 감염병과 관련하여 「재난 및 안전관리 기본법」 제38조제2항에 따른 심각 단계 이상의 위기경보가 발령된 때에는 환자, 의료인 및 의료기관 등을 감염의 위험에서 보호하기 위하여 필요하다고 인정하는 경우 「의료법」 제33조제1항에도 불구하고 보건복지부장관이 정하는 범위에서 유선ㆍ무선ㆍ화상통신, 컴퓨터 등 정보통신기술을 활용하여 의료기관 외부에 있는 환자에게 건강 또는 질병의 지속적 관찰, 진단, 상담 및 처방을 할 수 있다 ② 보건복지부장관은 위원회의 심의를 거쳐 제1항에 따른 한시적 비대면 진료의 지역, 기간 등 범위를 결정한다 코로나19 사태 이후 2020년 3월 보건복지부 공고로 전화상담, 처방 한시적 허용방안이 시행되고(보건복지부 공고 제2020 177호), 2020년 12월 개정된 감염병의 예방 및 관리에 관한 법률 제49조의3을 통해 감염병 위기 단계가 ‘심각’ 단계 이상일 경우 비대면 진료가 허용되도록 법제화되었다. 한시적 비대면 진료 초기에는 원격의료를 통해 처방되는 의약품에 대한 제한이 없었으나, 이후 2021년 10월 마약류 및 오남용 우려 의약품에 대해서는 비대면 진료를 통한 처방을 금지하는 조치가 취해졌다(보건복지부 공고 제2021 7 80호). 보건복지부는 한시적 비대면 진료 허용 방침에 따라 의약품 배송 또한 현행법상 허용된다고 판단하여 여러 원격의료 플랫폼을 통한 의약품 배송이 이루어지고 있다
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 82 보건복지부가 공고한 ‘한시적 비대면 진료 허용방안’에 따르면 비대면 진료 이후 환자가 지정하는 약국에 팩스 또는 이메일로 처방전을 전송하고 이후 약국에서 환자에게 복약지도 (유선 및 서면) 후 의약품을 조제, 교부하며 수령 방식은 환자와 약사가 협의하여 결정한다 (보건복지부 공고 제2020 889호). 따라서 현재 약사와 환자가 의약품 배송에 합의하면 의약품의 배송이 가능하다 그러나 비대면 진료와 달리 의약품 배송에 관해 규정하는 법률이 없으며, 최근 발표된 한시적 비대면 진료 가이드라인에 따라 비대면 진료 플랫폼에 대해 다음과 같은 내용들이 규정되었다 ▴환자가 의료기관과 약국 선택, ▴특정 의약품의 처방을 광고하는 행위의 금지, ▴의료기관과 약국 선택 시 환자 유인행위의 금지 ▴플랫폼 가입 약국과 약국 개설자에 대한 정보제공 ▴개인정보의 관련법령에 따른 보호, ▴환자 본인 확인 그리고 ▴플랫폼이 처방 의약품의 명칭, 효과, 가격 등의 정보를 환자에게 알리는 것을 금지 (보건복지부 공고 제2022 576호). 이처럼 가이드라인이 마련되었지만 강제성 있는 법령을 통한 의약품 배송에 대한 명확한 규정이 부족해 약사법 위반을 주장하는 소송이 제기되면 법원이 판단에 따라 의약품 배송에 대한 시행이 달라질 수 있다. 현재 비대면 진료 후 처방전을 약국으로 팩스 등을 통해 전송한 이후 약국에서 조제하고 환자에게 배송하는 방식에서는 의약품 판매의 과정 중 조제만이 약국에서 이루어질 뿐이어서 의약품 판매의 전부 또는 주요 부분이 약국에서 이루어진다고 보기 어려워 위법의 소지가 있다 이처럼 의약품의 배송을 규정하는 법률이 없음에도 한시적으로 의약품의 배송이 허용되었으며 처방전의 전송, 복약지도, 의약품 배송 등 약사에 관한 법제가 부족한 상황이다. 2. 해외의 원격의료 관련 제도 우리나라의 비대면 진료와 의약품 배송 관련 법을 개정하고 제도화를 이루기 위해 과거부터 원격의료를 폭넓게 시행하던 국가들의 제도와 결과를 참고할 필요가 있다 원격의료에 대한 규제가 적고 온라인 약국 등이 폭넓게 허용되는 미국과 비대면 진료에 관한 법률이 없으나, 정부 지침 등을 통해 비대면 진료를 허용하는 일본의 사례를 통해 국내 원격의료 법제화에 시사점을 얻을 수 있을 것이다 2.1 미국 미국은 비대면 진료와 의약품 배송을 금지하는 법이 없으며 주별로 적용되는 제도를 통해 원격의료를 관리하고 있으며, 원격의료의 보험 적용 여부가 원격의료의 확대에 영향을 미치고 있다. 65세 이상 고령자와 장애인을 위한 연방 차원의 의료보험인 Medicare는 의료인이 부족한 지역에서만 원격의료에 대해 진료비를 보험회사/기관에서 받을 수 있도록 (reimbursement) 적용하였으나, 코로나19 이후 지역에 관계없이 보험적용이 허용되었다. 저소득층을 위한 연방 의료보험 제도인 Medicaid는 주마다 관련 법제가 독립적으로 적용되어 이 보험이 적용되는 원격의료 서비스는 주마다 다르다. 민간의료보험에서는 주에 따른 parity law의 유무가 영향을 미치는데 parity law는 원격진료와 대면진료의 급여(reim bursement)를 동일화 하는 규정이다. 이러한 parity law의 유무에 따라 원격의료 진료비의 급여가 달라지게 되며, 이 또한 코로나19 이후 parity law의 적용이 확대되었다 (김지연 20 20). 연방차원의 법령으로는 HIPPA(Health Insurance Portability and accountability Act)를 통해 의료정보를 보호하고 있다 이 법에서는 원격의료를 위해 사용되는 전자적으로 보호되는 건강정보 (electronic protected health information, eHPI)에 대한 접근을
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 83 규제하고 보안통신시스템의 구축과 보안규칙의 준수를 규정하고 있다 (백경희, 박성진 202 0). 또한 미국 정부는 코로나19 팬데믹 상황에서 원격의료의 필요성이 높아짐에 따라 불가피하게 대면진료 대신 원격의료를 사용하여 발생하는 의료과실에 대해서는 의료인에게 법적 책임을 묻지 않겠다고 발표하였다 (백경희 2020). 또한 미국 정부는 팬데믹 상황에서 원격의료를 위한 홈모니터링 기기에 관한 규제를 완화하였다 기존에는 원격모니터링에 사용되는 장비가 의료기기로 간주되어 미국 식품의약국의 엄격한 통제를 받았으나 이를 완화하여 이러한 기기들이 쉽게 사용될 수 있도록 하였다 환자는 이를 활용하여 건강정보를 의료인에게 전달하고 의료인이 건강상태를 모니터링할 수 있게 된다. 그러나 원격의료에 사용되는 측정기기의 안전성과 유효성을 제대로 검증하지 못할 위험이 있으며, 이들 기기를 환자가 잘못 사용하거나 수치를 의사에게 잘못 전달하여 오진이 발생할 수 있다는 우려가 있다 (백경희, 박성진 2020). 미국은 온라인 약국이 허용되어 온라인상에서 의약품을 유통하여 조제하고 배달하는 것이 허용된다 미국약국협회(National Association Boards of Pharmacy, NABP)에서는 자율인증제도를 실시하여 온라인 약국 운영에 대한 규정을 제시하고 이를 지키는 온라인 약국에 대하여 인증마크(Verification of Internet Pharmacy Practice Sites, VIPPS)를 수여한다. 해당 규정에 따르면 온라인 약국을 운영하기 위해 ▴약국의 운영을 위한 면허를 보유할 것 ▴전문의약품의 경우 처방전 발급 권한이 있는 자에게서 처방전을 수령한 경우에만 조제하고 주법상 허용된 원격의료가 아닌 이상 조제하지 않을 것 ▴관련 법령에 의해 요구되는 개인정보 보호 기술을 사용할 것 등의 내용이 규정되어 있다 (이원복 2015). 또 연방법을 통해 온라인 약국을 등록하고 정보를 공개할 것 등을 규정하며 위험 약물(contr olled substance)의 경우 최소 1회 이상의 대면진료를 통한 처방을 받을 것을 규정하였다 (김재선 2016). 2.2 일본 일본은 원격의료에 관한 법률 없이 정부 부처인 후생노동성에서 지침을 만들어 이를 따를 경우 의사의 직접 진찰을 규정한 의사법에 저촉되지 않는다고 규정하였다. 일본에도 우리나라처럼 의사법 제20조에 ‘자신이 진찰한’이라는 문구가 있어 처방전 발급을 위해 직접 진찰해야 한다는 조항이 있지만, 1997년 후생노동성의 통지를 통해 이 법에 저촉되지 않고 원격진료가 허용되는 범위를 정하였다 이 통지를 개정하고 온라인 진료의 적절한 실시에 관한 지침을 발표하며 준수사항과 권장사항을 규정하고 원격의료를 점차 확대해 나갔다 또 코로나19 사태 이후 초진부터 온라인 진료가 가능하도록 하는 특례조치를 시행하였다(윤효영 2021). 2018년부터 의료보험을 통해 원격진료 급여가 적용되었고, 같은 해 발표된 온라인진료 시행 지침을 살펴보면 다음과 같은 내용이 규정되었다. 원격진료와 진료계획에 대해 의사와 환자간 사전합의가 필요하며 급성 질환, 돌발사고 환자와 초진, 새로운 질환에 대한 처방을 하는 경우 대면진료를 원칙으로 한다. 또한 실시간으로 원격진료를 하여 서비스의 품질을 보장하도록 한다 (김지연 2020). 일본의 경우 일반의약품은 온라인 판매가 가능하며 이중 약사에 의해서만 판매되며 복약지도가 필요한 제1류 의약품은 다른 의약품과 구분되는 절차를 갖춰야 한다 전문의약품의 경우 처방을 온라인으로 전달할 수 있지만 약국에서 조제가 이루어져야 하고 약사가 대면하여 복약지도가 이루어져야 한다 (박지혜, 배현아 2019).
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 84 2.3 시사점 미국과 일본의 제도를 통해 향후 우리나라의 원격의료에서 의약품 서비스 제도 마련에 대해 살펴볼 요소들이 존재한다. 원격의료의 이용량을 결정하는데 수가 혹은 급여 여부가 큰 영향을 미칠 것으로 예상된다 앞으로 원격의료를 통한 과다한 의료소비와 의약품의 남용을 막으면서 환자의 의료접근성을 높이기 위한 급여정책이 필요하다. 원격의료 과정에서 개인의료정보를 보호하기 위해 엄격하게 관리할 필요가 있으며, 원격의료에 사용되는 기기들의 안전성과 유효성을 검증하고 환자가 올바르게 사용하도록 안내해야 한다. 미국과 일본처럼 의약품 배송이 이루어지는 경우 약국이 지켜야할 사항들을 규정할 필요가 있다 그리고 의약품의 부작용 우려와 오남용 위험 정도에 따라 의약품에 대한 분류를 세분화하여 의약품 배송이 가능한 품목을 한정하는 것도 고려해 볼 수 있다 제2절 의약품 배송 시장 현황 및 변화 1. 의약품 시장의 변화 1.1 국내 1.1.1 국내 비대면 서비스 비대면 진료와 약 배달 서비스를 제공하는 주요 어플들의 일간 이용자 수의 평균이 2022 년 3월 총 9만3539명으로 집계되었다. 이는 2월에 비해 59.2% 늘어난 것으로 나타났다. 20 20년 2월 24일 한시적 허용으로 약 배달 앱들이 등장하면서 앱 일간 이용자수가 지난해 12 월을 기점으로 상승하고 있고 비대면 진료를 담당하는 앱들이 속속 등장하며 관련시장도 활발하게 성장 중이다(김경애, 2022). 코로나19의 발생과 확산으로 의료기관 내 감염원 유입의 방지를 위해 2020년 2월 한시적으로 전화 상담·처방을 허용하게 되어, 임상적 위험도가 낮고 보호자와의 동반 생활이 필요하며, 격리 치료에 대한 어려움이 있는 환자는 재택치료를 적용하게 되었다. 전화 상담 처방을 위해 환자가 직접 의료기관에 전화해 진료를 받을 수 있지만, 민간 원격의료 서비스 플랫폼이 제공하는 처방약에 대한 배송 서비스로 인해 환자들은 플랫폼을 사용하는 경우가 많다 닥터나우는 국내 최초로 비대면 진료와 처방약 배달 서비스를 모두 제공하는 원격의료 서비스 제공 플랫폼이다. 닥터나우는 1500 여 곳의 의료기관과 제휴하여 20개의 진료 가능 과목에 대한 비대면 진료 및 처방 서비스를 제공하고 있다 (김진숙, 2022). 닥터나우를 통해 의약품을 배송 받을 수 있는 방법은 요일, 위치, 시각에 따라 다양하다.
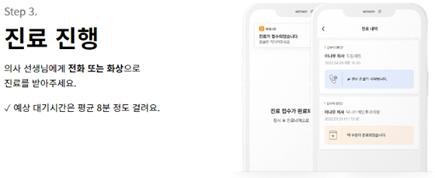
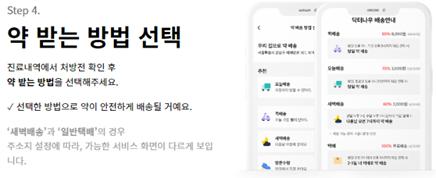

[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 85 그림1. 닥터나우의 의약품 배송서비스 표1. 닥터나우의 의약품 배송서비스 배송방법 퀵배송 오늘배송 새벽배송 택배배송 방문수령 도착시간 3시간이내 자정 전까지 다음날 오전 7 시까지 2~3일 내 접수마감 평일 오후 9시 주말 오후 8시 평일/토요일 오후 3시 30 분 평일 오후 7시 주말 오후 4시 평일 오전 9시 ~오후 9시 약국 별 상이 배송비 8000원 3000원 2000원 무료 배송 권역 전국 당일 배송(일부 지역 제외) 서울, 경기, 인천 일부 지역 전국 굿닥은 병원 예약 및 실시간 비대면 진료, 병원 및 약국 찾기, 다양한 시술 상품 정보 제공 및 상담 신청 서비스를 제공한다. 비대면 진료 서비스에서는 코로나19, 감기, 소아과, 고혈압, 당뇨 등 다양한 질환에 대한 서비스를 제공한다 증상을 입력하면 의사와 매칭되어 진료를 받을 수 있으며 처방전이 발행되고 약 배송 방법을 선택할 수 있다. 처방약은 직접 수령할 수 있고 퀵, 택배의 배송 수단을 활용할 수 있다 직접수령을 위해서는 약국에 약이 있는지 유선으로 확인 후 처방전을 약국에 전송해야 한다. 굿닥 앱에서는 처방전 팩스 전송을 무료로 제공한다. 퀵은 서울과 일부 경기 지역에서만 사용할 수 있다. 바로필은 비대면 진료, 조제약 배달 서비스, 맞춤 영양제 설계 서비스를 제공하는 앱이다 다른 서비스 플랫폼과 마찬가지로 빠른 배달(퀵), 약 배송(택배 배송)을 통해 약 배달을 제공하고 있다. 빠른 배달은 서울, 경기, 인천, 대구, 정읍 지역이 가능하고 약 배송은 전국이
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 86 가능하다 다른 플랫폼과 차별적으로 미국, 캐나다, 영국, 스코틀랜드, 말레이시아, 태국의 재외국민들을 위한 배송 서비스를 제공하고 있다. 그림2 바로필 사용 방법 2022년 8월 4일 발표된 보건복지부 공고 제2022 576호에서는 「한시적 비대면 진료 중개 플랫폼 가이드라인」을 공고하였다 가이드라인은 처방전 재사용 금지 관리, 병원 약국 담합 금지 등의 사항을 명시하고 있고 플랫폼의 의무사항과 업무 세부 준수 사항을 포함하고 있다 환자가 비대면 진료 서비스 이용 시 환자가 선택한 의료인에게 진료받을 수 있어야 하며 반드시 환자가 선택한 약국에 처방전을 전송할 수 있도록 하고 있다. 하지만 비대면 진료 중개 플랫폼을 고객들이 이용하는 중요한 이유 중 하나가 플랫폼이 약 배송 서비스를 제공하고 있기 때문임에도 이 가이드라인은 의약품 배송서비스와 관련된 가이드라인을 제시하고 있지 않다. 의료계에서는 공개된 가이드라인이 원론적인 수준에 그치고 그조차 산업계의 시각이 묻어난다고 평가했다 (고정민, 2022). 약사사회는 가이드라인 자체가 모호하며 이로 인해 의료서비스 및 의약품의 오남용을 조장할 수 있다고 지적했고, 확진자도 대면진료 및 대면투약을 기본으로 하도록 정책을 변경한 상황에서 비대면 진료 한시적 허용 공고를 유지하는 것은 본래 취지와 맞지 않고 플랫폼에 특혜를 주는 것으로 보인다는 우려를 표했다 (강혜경, 2022). 1.1.2 전자 처방전 본 논문에서는 의약품 배송에 필수적인 처방전의 발급, 복약지도, 의약품의 수령 단계를 다루고 있다. 비대면 진료가 한시적으로 허용되면서 그에 따라 전자처방전 정책에 대한 관심도 높아지고 있으며 보건복지부는 2022년 3월 ‘안전한 전자처방 협의체’를 구성하여 여러 단체의 의견을 수렴하여 합리적인 방안을 모색하고 있다. 우리나라에서는 이미 의료법에서 전자처방전을 명시하고 있지만 민간업체의 개입이나 수수료 등 비용 부담의 문제로 전자처방전 제도가 정부 주도로 활성화되어 있지는 않으며, 최근 대형병원을 중심으로 전자처방을 제공하려는 움직임이 보이고 있다 한시적으로 허용된 비대면진료 시 처방전 발급에 관해서 보건복지부는 진료한 환자의 전화번호를 포함하여 팩스 또는 이메일 등으로 환자가 지정하는 약국에 처방전을 전송하도록 안내하였다. 전자처방전을 활용한다면 의료기관에서 약국으로 편리하게 처방전을 송부할 수 있어 팩스나 이메일을 활용하는 불편을 줄일 수 있을 것이다 (백경희, 2021). 전자처방전과 관련한 조문은 의료법 제17조의2, 의료법 제18조 1항, 3항에서 규율하고 있다.
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 87 의료법 제17조의2 ① 의료업에 종사하고 직접 진찰한 의사, 치과의사 또는 한의사가 아니면 처방전[의사나 치과의사가 「전자서명법」에 따른 전자서명이 기재된 전자문서 형태로 작성한 처방전 (이하 “전자처방전”이라 한다)을 포함한다. 이하 같다]을 작성하여 환자에게 교부하거나 발송(전자처방전에 한정한다 이하 이 조에서 같다)하지 못하며, 의사, 치과의사 또는 한의사에게 직접 진찰을 받은 환자가 아니면 누구든지 그 의사, 치과의사 또는 한의사가 작성한 처방전을 수령하지 못한다 의료법 제18조 ① 의사나 치과의사는 환자에게 의약품을 투여할 필요가 있다고 인정하면 「약사법」에 따라 자신이 직접 의약품을 조제할 수 있는 경우가 아니면 보건복지부령으로 정하는 바에 따라 처방전을 작성하여 환자에게 내주거나 발송(전자처방전만 해당된다)하여야 한다. ③누구든지 정당한 사유 없이 전자처방전에 저장된 개인정보를 탐지하거나 누출ㆍ변조 또는 훼손하여서는 아니 된다 1.2 해외 1.2.1 미국 미국은 우리나라보다 먼저 의약품 배송이 이루어진 국가로 약 배달을 통한 의약품 유통이 정착된 국가이다. 미국은 온라인 유통을 통해 일반의약품 뿐만 아니라 전문의약품도 접할 수 있을 정도로 온라인 유통 가능한 의약품의 범위가 넓으며, 의료인의 대면진료 없이도 의약품을 처방 받을 수 있다. 미국은 이처럼 환자들의 편의성을 중점으로 하여 다양한 형태의 의약품 유통 사업을 선도해 나가고 있다 (박지혜, 배현아 2019). 코로나19 사태 이전의 경우 온라인 플랫폼을 통해 의약품 구매가 가능했지만 CVS, Walgr eens와 같은 대형 의약품 소매업체들을 통한 오프라인 구매가 대세였다 그러나 코로나 사태 이후 의약품 시장이 변화하기 시작했다 2020년 11월 17일 출범한 Amazon Pharmac y는 일부 주를 제외한 45개 주에서 18세 이상 성인을 대상으로 하며, 이 서비스를 통해 사람들은 온라인 웹사이트와 모바일 앱으로 처방약을 주문해 집으로 배송 받을 수 있게 되었다 미국 경제전문 매체 CNBC 방송에 따르면 미국인들은 코로나 19에 노출되는 것을 피하기 위해 우편으로 약을 받는 것에 점점 더 익숙해지고 있고, 이번 아마존의 진출은 의약품 유통산업 전반을 흔들 것이라 전망했다 Amazon 뿐만 아니라 비대면이 확산됨에 따라 미국 IT 기업들이 처방 의약품 배송에 진출하고 있다. 대표적으로 Uber Health가 있는데 2020년 8월에 처방약 배송 사업에 뛰어들었다 Uber의 서비스의 경우 코로나19로 인해 약국이나 병원을 직접 방문할 수 없는 환자를 위한 주문형 처방약 배송 사업이다 (박성우, 2020). 기존 약국 체인인 CVS와 Walgr eens는 코로나 펜데믹을 맞닥뜨리며 약 배송, 드라이브 스루 서비스를 시작하였다 특히 Wa lgreen의 경우 드론으로 상비약 배송 시범서비스를 출범하였다 미국의 ‘메들리 파머시’도 주목해볼 만하다 오프라인 약국으로 출범해 디지털 기술을 접목하여 성공한 약국 케이스로 처방전을 갖고 있는 일부 주의 거주자에게 직접 조제한 약을 처방 당일 환자의 집까지
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 88 무료로 배송해준다 이들은 기존 체인 약국들을 위협할 정도로 빠르게 성장 중이다 (김지은, 2022). 1.2.1 일본 일본은 1997년 원격의료를 허용하였고, 미국과는 다르게 더 보수적인 형태로 의약품 거래가 이루어졌다 일본의 경우 국민의 안전을 해치지 않을, 안전성이 높은 의약품인 일반의약품에 대해서만 온라인 의약품 유통을 허용하였다. 일본은 1998년 말부터 팩스에 의한 환자와 약국 간의 의약품 거래를 허용해 왔다 따라서 약국 방문이 곤란한 소비자는 의사로부터 받은 처방전을 약국에 팩스로 송신하면 약사는 해당 처방전에 따라 약을 조제하여 환자의 집을 방문하여 원본을 확인하고 전달하였다 (박지혜, 배현아 2019). 코로나19 이후 원격 진료 대상을 재진환자에서 초진환자로 확대하였고 기존에는 처방전이 환자에게 배송되는 방식이었지만 코로나19 이후 의약품 배달 또한 허용되었다 그 결과 관련 서비스 이용량이 2~3배 급증한 것으로 나타났다. 또한 2019년 말에 네이버(Nav er)는 일본 자회사 라인(LINE)을 통해 ‘라인헬스케어’를 출시하며 원격 의료 사업에 뛰어들었다 (고광본, 2020). 이처럼 코로나19로 인해 우리나라 뿐만 아니라 전세계의 의약품 시장 현황도 빠르게 변화하는 중이며, 의약품의 배송은 막을 수 없는 흐름으로 보인다. 2. 코로나 19 이후 의료인 환자 원격의료 및 처방 현황 분석 원격의료에 따른 안정적이고 효율적인 의약품 배송을 위해선 국내 원격의료 기록을 활용하여 환자들의 의료/약료 빅데이터를 분석하는 것이 필요하다. 특정 지역과 나이대별로 원격의료, 의약품 배송이 이루어지는 경향이 상이할 수 있고, 이에 따라 알맞은 정책 수립과 가이드라인 구축이 필요하다. 이에 본격적으로 의료인 환자 간의 원격의료가 활성화된 202 0년 이후의 전화상담 및 처방 자료를 활용하여 원격의료 현황을 분석하고자 한다. 데이터 분석을 위해 건강보험심사평가원에서 제공하는 ‘코로나19 전화상담 병∙의원 정보’ 및 의료 정책 연구소에서 발간된 연구보고서를 바탕으로 분석을 진행한다. 2.1 전화상담 의료기관 제공현황 의료기관 별로 전화상담 현황을 보았을 때, 상급종합병원은 42개 의료기관 중 32개가 참여해 76.2%의 참여비율을 보였고, 종합병원은 55.9%, 병원 26.2% 의원은 19.8%로 그 뒤를 따랐다 그러나 순 진료횟수의 경우 의원수준이 초진과 재진을 합쳐 532,974회로 가장 높았고 종합병원 174,795회, 상급종합병원 115,272회, 병원 55,449회로 그 뒤를 따랐다 의료기관 모두에서 재진 비율이 초진보다 높았으며, 이는 전화진료가 지속적으로 약을 처방 받아야 하는 질환들에 있어 주를 이루고 있음을 의미한다. 또한 의원 수준에서 특이적으로 초진 비율(75.2%)이 높았는데, 이는 초진의 경우 감기와 같은 경증질환이 주를 이루고 있다는 점과, 또한 코로나 의심증상으로 인한 초진 등이 그 이유로 예측된다. 소재지에 따른 의료기관 분포를 보면, 2021년 3분기까진 경북 지역과 대구 지역이 기관수 대비 참여기관 비율이 평균값인 12%보다 유의미하게 높음을 볼 수 있다 이는 대한민국에서 코로나19 확산세가 경북 및 대구 지역으로부터 시작된 결과로 예측된다. 2020년 3분기에 전화상담을 실시하는 의료기관 참여기관 비율은 12%였지만, 2022년 2분기에는 13.5%로
치과병원 238 5 2.1 133 0.0 21 146 병원 357 8 2.2 170 0 0 11 243 32,665 6,459 19.8 350,230 56.9 59,270 473,704
치과의원 18,051 93 0.5 284 0.0 96 219
한의원 14,414 1,010 7.0 15,707 2.6 7,307 20,633
서울 17,713 1,796, 10.1 147,927 24.2 17,926 185,784
부산 5,219 529 10.1 30,180 4.9 4,928 43,935
대구 3,782 815 21.5 92,887 15.2 12,071 135,823
인천 3,337 394 11.8 21,031 3.4 4,002 28,014
광주 2,166 240 11.1 15,543 2.5 2,054 22,843
대전 2,251 294 13.1 13,906 2.3 1,792 19,726
울산 1,371 166 12.1 10,266 1.7 1,358 15,025
세종 363 53 14 6 3,968 0 6 728 5,265
경기 15,317 1,835 12.0 122,491 20 0 16,779 164
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 89 상승했음을 볼 수 있다 또한 코로나 확산세가 수도권을 중심으로 진행됨에 따라, 서울(10. 1% > 11.9%) 및 경기 지역(12.0% >15.3%)에 전화진료 참여기관 비율이 상승하였다. 한편 대구(21.5% > 12.5%)와 경북(16.5% >14.3%)은 그 비율이 줄어 든 것을 확인할 수 있었다. 전국 소재지역별로 절대적인 의료기관 수의 차이는 존재하지만, 기관의 참여비율은 큰 차이가 나지 않는 것을 통해 전화진료에 있어 지역간 격차는 크지 않은 것으로 보인다 표2 전화상담 의료기관 제공현황 (2020년 3분기) 구분 전체 의료기 관 수 기관수 참여 기관 비율 (%) 환자수 환자수 비율(%) 진료횟수 초진 재진 전체 69,161 8,273 12.0 609,500 100 0 78,797 839,016 의 료 기 관 종 별 상급종합 병원 42 32 76.2 88,501 14 4 2,992 112,280 종합병원 315 176 55 9 121,487 19 7 5,872 168,923 병원 1,495 391 26.2 33,001 5 4 2,981 52,468 요양병원 1,584 99 6.3 5,695 0 9 247 10,400
한방
의원
소 재 지 역
,080 강원 1,628 152 9.3 8,551 1.4 961 9,491 충북 1,826 239 13.1 16,891 2.8 1,765 22,052 충남 2,319 268 11.6 18,348 3.0 2,388 24,926 전북 2,450 285 11.6 15,272 2.5 1,680 21,791 전남 2,015 192 9 5 9,626 1.6 756 15,624 경북 2,824 465 16 5 49,208 8 0 6,224 73,116 경남 3,693 462 12.5 32,297 5.3 3,062 47,084 제주 887 91 10.3 3,577 0 6 323 4,437 (임선미 외 3인, 2021)
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 90 표3. 소재지역에 따른 전화상담 의료기관 제공현황 (2022 2분기) 구분 전체 의료기관 수 기관수 참여기관 비율 (%) 전체 71812 9674 13.5% 서울 18430 2191 11.9% 부산 5376 546 10.2% 대구 3912 489 12.5% 인천 3533 498 14.1% 광주 2223 240 10.8% 대전 2305 247 10.7% 울산 1379 126 9.1% 세종 405 58 14.3% 경기 16313 2501 15.3% 강원 1681 251 14.9% 충북 1889 285 15.1% 충남 2327 331 14.2% 전북 2489 389 15 6% 전남 2048 416 20.3% 경북 2813 404 14.3% 경남 3757 592 15 6% 제주 932 110 11.8% 2022 2분기 OpenAPI; 건강보험심사평가원 코로나19 전화상담 병의원 정보, 건강보험심사평가원 기관수현황|보건의료빅데이터개방시스템 (hira.or.kr) 2.2 진료과목별 전화상담 및 처방 현황 의료정책연구소 보고서에 따르면, (임선미 외 3인, 2021) 전화상담 및 처방진료를 제공한 전체 진료횟수 889,073(치과, 한방진료 제외)중 내과 비율이 60.2% (535,240회)로 가장 높았다 다음으로 신경과 6.0%(53,042회), 정신건강의학과 4.8%(42,254회), 가정의학과 3. 8%(33,860회)가 그 뒤를 따랐다 이는 만성질환 및 정신질환에 대한 전화상담 재진율이 높음을 의미한다 초진 진료 횟수 71,350건 중에서는 내과가 52.2%(37,724회)로 가장 높았으며, 다음으로 이비인후과 12.2%(8,706회), 소아청소년과 5.1%(3,610회), 정형외과 4.9%(3,479회)가 그 뒤를 따랐다. 이는 코로나 상황으로 인해 대면 진료가 불가능한 상황에서 코로나 증상과 관련된 진찰을 받기 위한 초진 결과로 보인다 의료기관 종별로 진료과목의 차이 역시 존재하였다. 4개의 수준으로 구분되는 의료기관 모두 내과의 전화진료비율이 가장 높은 것이 확인되고, 특이적으로 의원 수준에 내과진료가 높음을 확인할 수 있다 이는 감기 등의 경증 질환을 다루는 내과의원의 특성이 반영된 것이다. 표4. 의료기관 종별 전화상담 진료과목 5순위 구분 1순위 2순위 3순위 4순위 5순위
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 91 전체 내과 60.2% (535,240회) 신경과 6 0% (53,042회) 정신건강의학과 4 8% (42,254회) 가정의학과 3.8% (33,860회, ) 정형외과 3.6% (31,638회,) 전체 (초진) 내과 52.2% (37,724회), 이비인후과 12.2% (8,706회) 소아청소년과 5.1% (3,610회) 정형외과 4 9% (3,479회) 소아청소년과 4 6% (3267회) 상급종합 병원 내과 44 7% (51,511회) 신경과 11.4% (13,179회) 외과 7 6% (8,792회) 산부인과 7 0% (8,043회) 소아청소년과 6 7% 7,688회) 종합병원 내과 47.7% 83,253회 신경과 14.5% 25,312회 정신건강의학과5 .4% 9,434회 신경외과 5.2% 9,162회 가정의학과 4.6% 8,058회 병원 내과 44.3% 24,589회 정신건강의학 과 18.3% 10,131회 소아청소년과 6 4% 3,562회 외과 6.1% 3,399건 신경과 5 4% 3,003회 의원 내과 70.0% 373,008회 이비인후과가4 .7% 25,173회 가정의학과 3.9% 21,009회 정형외과 3.9% 20,983회 정신건강의학과 2.6% 13,962회 (임선미 외 3인, 2021) 2.3 전화진료 이용 환자현황 코로나 19 사태 이후 2020년도 3분기까지 전화진료를 이용한 환자는 609,500명, 총 진료횟수는 917,813건으로 환자 1인당 1.5회의 전화상담을 이용한 것을 확인할 수 있다. 2 022년 2분기가 지난 시점에서, 그 횟수는 더 높아졌을 것으로 예상된다. 남성보다 여성의 전화진료 수가 더 높았고, 나이대별로는 70대 이상의 고령층이 가장 많았으며, 50 70세 사이의 중장년층이 그 뒤를 따랐다. 특이적으로 각 연령대의 초진 비율은 나이가 적을수록 높아지는 경향을 보였으며, 이는 높은 연령대의 만성질환 재진율이 높음을 의미한다 연령대별 진료과목별 이용 현황은, 19세 이하는 소아청소년과가 가장 높았으며, 나머지 연령대는 내과의 이용 비율이 가장 높았으며 정신건강의학과, 신경과 등이 그 뒤를 따랐다. 표5. 성별, 나이대에 따른 전화의료 환자 수와 초진 비율 구분 전체 남성 여성 환자 수 609,500 263,011 346,489 초진비율 8 6 8 6 8 6 구분 19세 이하 20 29 30 39 40 49 50 59 60 69 70세 이상 환자 수 48,067 24,714 41,250 75,928 121,427 131,478 166,636 초진비율 20 5 21.8 15 0 10 7 7 0 5 8 5 0 (임선미 외 3인, 2021)
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 92 2.4 약처방 현황 2020년 3분기까지 총 처방횟수는 676,611회 총 처방일수는 30,856,155회였다. 1인당 평균 처방횟수는 1.5회였으며, 1인당 평균 처방일수는 71일이었다. 의료기관 종별로 처방 현황을 비교한 결과, 처방일수가 높으면 처방 횟수는 낮은 반비례의 관계를 가졌다 평균 처방 일수는 상급종합병원이 128일로 가장 높았고, 종합병원이 86일, 병원이 56일, 의원이 50일로 그 뒤를 따랐다 환자 당 평균 의약품 처방횟수는 평균 1.5회였고, 의원이 1.6회로 유일하게 평균보다 높았다. 전체 진료과목들의 의약품 처방 현황을 비교해 본 결과, 처방일수와 처방 횟수가 반비례하는 경향을 찾을 수 있었다 2.5 주요질환 현황 가 주요 질환 전화진료를 이용하는 환자들의 다빈도 질환을 살펴보면, 높은 빈도를 보이는 10개의 질병이 전체 전화진료에서 43.4%를 차지하고 있었고, 본태성 고혈압이 가장 높은 빈도를 가졌으며 2형당뇨병, 지질증, 급성기관지염 등이 그 뒤를 이뤘다. 이와 같이 만성질환에 대한 진료가 주를 이루고 있었고, 높은 재진비율을 차지하고 있음을 볼 수 있다 한편 높은 초진 비율을 보이는 것으로 급성기관지염, 혈관운동성 및 앨러지성 비염, 위염 및 십이지장염, 급성비인두염 등을 볼 수 있으며 이는 모두 급성질환으로, 즉각적인 대처가 중요한 질환들이다. 2.2.3절의 전화진료 이용 환자 현황에서 연령대가 낮은 환자들은 초진 비율이 높은 것을 확인할 수 있었으며, 이는 급성질환으로 전화진료를 이용하는 젊은 환자들 또한 비대면 진료 법제화에 있어 고려해야 하는 요소임을 시사하고 있다. 환자 1인당 평균 진료횟수가 가장 높았던 것은 조현병 (3.1회)이였다. 이 외에도 1인당 평균 진료횟수인 1.5회를 넘는 질병 중 알츠하이머병에서의 치매(1.7회), 수면장애(1.7회), 우울에피소드(1.6)회 등 상당수가 정신과적 질환에 해당함을 확인할 수 있다. 표6. 질병에 따른 전화진료 현황 순위 질병명 진료횟수 1인당 평균 진료횟수 질환별 초진비 초율 진 재진 1 본태성(원발성)고혈압 4,394 153,054 1.6 2.8 2 2형 당뇨병 1,646 86,631 1.5 1.9 3 지질단백질대사장애 및 기타 지질증 1,552 28,863 1.3 5.1 4 급성기관지염 8,204 19,424 1.4 29 7 5 위 식도역류병 2,734 17,035 1.3 13.8 6 알츠하이머병에서의치매 294 17,229 1.7 1.7 7 혈관운동성 및 알러지성비염 4,479 11,754 1.4 27 6 8 뇌경색증 240 13,924 1.3 1.7 9 협심증 294 13,282 1.2 2.2 10 기타갑상선기능저하증 369 12,929 1.3 2.8 11 전립선증식증 615 10,987 1.3 5.3
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 93 12 위염및십이지장염 1,921 8,688 1.3 18.1 13 조현병 21 8,224 3.1 0.3 14 만성바이러스간염 239 7,830 1.3 3.0 15 급성비인두염[감기] 2,397 5,494 1.4 30.4 (임선미 외 3인, 2021) 나 만성질환 환자의 이용 현황 연구보고서에 따르면 연령대별 만성질환자는 20대까지는 ‘정신 및 행동장애’의 진료 빈도가 가장 높았다. 30대는 갑상선 장애 및 정신과적 질환, 40대부터 60대까지는 고혈압 및 당뇨병, 60세 이상부터는 심장과 신경계질환 환자들의 전화진료 이용 빈도가 높았다 전화진료를 4회 이상 사용한 다빈도 환자군에서 가장 많은 비율을 차지하는 연령대는 70 대 이상이었으며, 진료기관으로는 의원이 높은 비율을 차지하였다. 또한 전화의료를 사용한 만성질환자 중 2개 이상의 만성질환을 동시에 앓고 있는 환자의 비율은 76%였으며, 대부분이 초진이 아닌 재진 대상 환자들이었다 이는 동시에 여러 만성질환을 다룰 수 있는 원격의료 시스템의 필요성을 의미하고, 이에 따른 협동 진료 및 다제약물 관리 등의 약료서비스가 필요할 것으로 보인다 2.6 정리 건강보험심사평가원에서 제공하는 ‘코로나19 전화상담 병의원 정보’ 및 의료 정책 연구소에서 발간된 연구보고서를 바탕으로 의료인 환자 원격의료를 분석하였다. 우선 의료기관 종별 및 소재지역별 분석 결과, 의원급의 진료 횟수가 가장 많았고, 지역별 의료 격차는 크지 않았다. 2020년에 비해 2022년에 전화의료를 시행하는 의료기관이 많아졌으며, 수도권을 중심으로 그 수가 증가함을 알 수 있었다 진료과목별로는 내과가 60. 2%로 가장 많았고, 그 뒤를 신경과 및 정신건강의학과가 뒤따랐다. 환자는 1인당 평균 1.5 회 전화진료를 이용하였다. 2022년 발표된 건강보험심사평가원의 자료에 따르면 2021년 1 분기까지 전화 진료를 이용한 환자 수는 약 94만명, 164만 건으로 환자 수와 진료 횟수가 늘어났으며, 1인당 평균 진료횟수도 1.74회로 증가하여 재진률이 더욱 높아지는 경향을 보인다 (조민호, 2022). 한편 50대 이상의 중장년층 및 노년층의 이용 비율이 높았고, 연령대가 낮아질수록 초진비율이 높아짐을 확인했다 질환별로는 만성질환이 주를 이룸을 알 수 있었고, 급성질환의 경우 초진율이 매우 높았다. 또한 정신과적 질환의 1인당 진료횟수가 높은 경향을 나타냈다. 분석 결과, 전화의료를 활용하는 주 환자층이 만성질환을 앓고 있는 노년층임을 확인했으며, 이에 만성질환 관리를 중심으로 한 효과적인 비대면 의료 시스템의 발전 방향을 논해야 할 것이다. 2020년 3분기까지의 자료에선 1인당 평균 진료횟수가 1.5회였으나 202 1년도 1분기에는 1.74회로 증가한 것을 통해서도 재진율 및 원격의료 사용 빈도가 높아짐을 확인할 수 있었다. 또한 급성질환으로 전화의료를 사용하는 젊은 층의 환자들은 초진율이 높았으며 정신과 진료를 받는 환자들의 평균 진료 횟수가 가장 높았다 이에 전화상담 및 처방을 일회성으로 사용하는 환자군과, 지속적으로 사용하는 재진환자들을 구분하여, 향후
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 94 각 그룹에 대한 분석 및 시스템 구축이 필요할 것이다 이에 본 연구에서는 ‘제3절 개선방안’ 에서 약료시스템을 중심으로 이에 대한 제언을 하고자 한다. 3. 의약품 배송으로 인해 발생할 수 있는 문제점 3.1 국내 의약품 배송으로 의료 사각지대를 해소할 수 있는 점, 국민 편의를 증진시킬 수 있다는 점 등 다양한 장점이 있지만 우려되는 부작용 또한 존재한다. 의약품 배송의 문제는 크게 다음 4가지가 존재한다 (1)복약지도의 미흡, (2)무분별한 의약품 오남용 우려, (3)의약품 취급 관리, (4)개인정보 유출 우려. 이러한 문제들을 국내에서 일어난 실제 사례를 통해 알아보고자 한다. 3.1.1 복약지도의 미흡 복약지도가 대면으로 진행되는 것보다 비대면으로 진행될 시 상대적으로 미흡할 수밖에 없다 의약품의 적절한 복용을 위하여 약사에 의한 전문적이고 적절한 복약지도가 필요하다 그러나 현 의약품 배송 서비스에서는 그러한 복약지도가 제대로 이루어지지 않는 것으로 알려졌다 어떤 약 배달 서비스의 경우 약사와의 직접 상담이 불가하고 약사가 아닌 일반 약 배달 업체 상담원을 통해 상담이 이루어진다는 점은 대면으로 이루어질 때보다 복약지도 과정이 복잡하며, 그로 인해 복약지도가 미흡할 수 있다는 것을 알려준다 더욱이 환자가 임의로 선택한 약을 보내줄 때, 증상 관련 약사의 사전질의는 전무하고 복용법이나 주의사항 관련 약사의 자세한 안내 역시 배제돼 의약품 배송 시 복약지도가 문제점으로 지적되고 있다 (이정환, 2021). 또한 약준모(약사의미래를준비하는모임)에서 2022년 5월 24일부터 6월 8 일까지 비대면진료 앱 경험자 1018명을 설문한 결과, 42%만이 유선 복약지도를 받고 46% 가 서면 복약지도를, 11%가 안내를 받지 못한 것으로 알려져 부실한 복약지도가 실제로 나타나고 있는 상황이다. 이는 복약 순응도의 감소로 환자의 안전에 문제가 될 수 있어 (정흥준, 2022) 관련 대책 마련이 필수적이다 3.1.2 무분별한 오남용 우려 보건당국은 이전부터 의약품 배송을 반대하였다 그 이유로는 과거에도 인터넷을 통한 향정신성의약품, 발기부전치료제 등의 불법판매사례가 성행하였는데, 비대면 플랫폼이 허용될 경우 의약품의 무절제한 유통과 복용에 따른 문제가 심화될 가능성이 있으며, 위조처방전을 이용한 불법적 의약품 거래가 증가될 수 있기 때문이었다 (이종인, 이승신 20 12). 실제로 플랫폼들이 오남용 우려 약물을 유인하는 광고를 하는 문제가 있었다 다이어트, 탈모, 발기부전치료제 등 비급여 의료행위를 초진없이 배달이 가능하다는 광고가 성행했다. 이는 의약품의 잘못된 사용을 유도할 위험이 크다.


[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 95 그림3 오남용 우려 약물 유인 광고 (장보현, 2021) 3.1.3 의약품 취급 관리 보건당국에서는 의약품은 일반공산품과는 달리 보관 및 운송 과정에서 특별한 관리가 필요하며, 따라서 일반 택배 등에 의존하여 안전성을 보장받을 수 없는 온라인 거래를 허용할 수 없다는 입장이었다 (이종인, 이승신 2012). 실제로 약사회가 의약품 배달 서비스를 이용했을 때 다음 그림과 같이 본인에게 전달되지 않고 약이 변질될 수 있어 사고가 일어날 수 있음을 확인했다. 이러한 사고가 일어날 시 책임 소재가 불분명하다는 것도 문제이다 또한 주사제 등과 같은 의약품의 제제에 따른 취급 관리에 대한 구체적인 가이드라인이 필요하다. 보통 의약품의 경우 직사광선을 피해 보통 온도 25도 서늘하고 건조한 곳에 보관하면 되지만 당뇨병 주사제와 같이 보관온도에 신경을 써야 하는 의약품도 존재하기 때문이다(신은진, 2022). 그림4 본인에게 전달되지 않은 약배달 (약사회 정책건의서) 3.1.4 개인정보 유출 우려 개인정보 유출 문제 또한 이를 다루는 가이드라인이 없는 상황이다 이에 관한 실제 사례로는 2022년 7월 30일 한 비대면 진료 플랫폼 업체가 환자들의 진료 데이터를 활용하여 자체 쇼핑몰을 개설한 사례가 있다 업체 측은 비대면 진료 빅데이터를 통한 소비자의 니즈를 건강관리 상품과 매칭해 판매하는 헬스케어 쇼핑몰이라고 설명했다 그러나 이는 개인의 민감 정보를 상업적 목적으로 활용한 것으로 문제가 될 수 있다 (김이솔, 2022). 따라서 개인정보 유출 방지를 위한 수칙이 마련되어야 한다
•업무정지 15일 유예 비대면 진료 플랫폼 통해 약국 외 장소 일반의약품 판매 약국 1개월 진료 플랫폼 통해 약국 외 장소 의약품 판매 약국
•업무정지
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 96 이외에도 원격 조제만을 집중하는 공장 약국, 기업형 대형 약국으로 인한 지역 약국 몰락이나 현재 약 배달 서비스가 대도시에 집중되어 있다는 문제점도 존재한다 (정수연, 20 21). 한편 더불어민주당 신현영 위원이 ‘원격의료와 비대면 진료의 올바른 정착을 위한 정부의 신속한 대책 마련 촉구’ 기자회견에서 발표한 2022년 7월 18일까지의 비대면 진료의 약사법 위반 사례는 다음과 같다 표7 비대면 진료 약사법 위반 사례 위반 사항 일자 업체 구분 조치사항 사실관계 무자격자의 조제 22.03 약국 •기소 의견 송치 비대면 진료 처방전을 무허가 수입의약품으로 무자격자가 조제 의약품 불법 판매 일선 21.08 플랫폼 •수사 의뢰 비대면 진료 플랫폼 통해 일반의약품 약국 외 판매 일선 약국 외 장소 의약품 판매 21.03 약국 •벌금 1,500만원 카카오톡 메시지로 전문의약품 퀵배송 22.02 약국
•기소
22.03
•업무정지
•고발 비대면
22.05
1개월 •고발 약국 외 장소 의약품 판매 대체 조제 •자격정지 15일 •고발 약효동등성을 인정받지 못한 의약품으로 대체조제 22.04 약국 •자격정지 15일 •고발 대체 조제 사실 의사에게 미통보 22.04 약국 •자격정지 15일 •고발 대체 조제 의사 동의 절차 관련 근거자료 없음 (신현영, 2022) 관련 정책이나 규제가 없는 상황 속에서 이루어진 비대면 진료는 보건의료체계에 혼란을 일으켰고(장보현, 2021) 환자의 안전을 고려하지 못하고 있다 따라서 비대면 진료에 있어서 위와 같은 문제점을 예방할 수 있는 약사의 개입이 필요하며 민간차원에서 이루어지는 플랫폼을 관리할 수 있는 정책이 필요하다
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 97 3.2 해외 앞서 해외 의약품 시장과 마찬가지의 이유로 미국에서의 의약품 배송 서비스의 문제를 살펴볼 것이다. 미국에서 일어나는 문제로는 크게 3가지가 있는데 (1) 접근성이 떨어진다는 점, (2)약물 오남용의 우려, 마지막으로 (3)디지털 프라이버시 침해 관련 문제가 있다 3.2.1 접근성 원격 의료의 주 사용층은 거동이 불편하여 병원이나 약국을 이용하기 나이 든 사람이다 그러나 미국의 경우 기술적인 문제로 노인 환자들이 이용하기 힘든 것으로 밝혀졌다. 65세 이상의 성인의 3분의 1은 팬데믹 기간 동안 비디오를 사용하여 다른 사람들과 이야기해 본 적이 없고 75세 이상 메디케어의 수혜자들의 4분의 1은 인터넷에 접속하기 힘든 것으로 나타났다(G. Gonzalez, 2021). 따라서 이를 통해 주 이용층인 노인 환자들이 원격의료에 접근하기 힘들고 원격의료 플랫폼은 노인 환자들에게 친화적이지 않음을 알 수 있다 따라서 나이 든 환자들이 쉽게 접근할 수 있는 원격의료 정책이 필요하다. 3.2.2 약물 오남용 2007년 미국의 한 고등학생 라이언 하이트(Ryan Haight)이 부모의 신용카드를 사용하여 온라인 약국에서 1년간 약을 처방받아 약물 중독으로 인하여 사망한 사건이 있었다 그로 인해 온라인 의약품의 유통의 안전을 강화하는 일명 Ryan Haight Online Pharmacy Consu mer Protection Act (21.U.S.Code 802(53))이 입법되었다 따라서 위험 약물로 지정된 의약품을 처방하기 위해서는 처음에는 대면진료가 이루어져야 한다 (박지혜, 배현아 2019). 그러나 한 번의 직접 방문 이후에는 후속적인 대면 진료를 요구하지 않는다는 점에서 여전히 약물 오남용의 문제는 남아있다 (PRMS, 2021). 3.2.3 디지털 프라이버시 의료 산업 내 사이버 보안 공격의 위협은 지난 몇 년 동안 꾸준히 증가했다 The Departm ent of Health and Human Services(HHS)에 따르면 2020년 2월부터 5월까지 의료 기관들의 사이버 보안 공격이 증가하였는데 이는 코로나 19 범유행 때문일 것이라고 보고했다 (Sarah A. Cole et al, 2020). 의약품 배송의 경우 인터넷을 통해 개인 및 건강 관련 정보를 전송한다 이러한 방대한 데이터 전송을 통제할 수 있어야 하기 때문에 보안 시스템은 필수적이다 (Arjun poudel, Lisa M Nissen 2016). 그 외의 문제로는 의료 품질과 의사 환자 사이 관계의 저하, 대면으로 했을 때보다 비대면으로 진행 시 약사의 관여가 줄었다는 점이 문제로 뽑혔다 또한 디지털 프라이버시 뿐만 아니라 약사가 개인 원격 상담을 진행할 수 있는 물리적인 공간을 찾기 힘든 점도 하나의 어려움으로 포함되었다 (Elizabeth J. Unni et al 2021). 제3절 개선방안 1. 의약품 배송과 관련한 약료서비스 개선 방안 앞서 본론에서 살펴본 바와 같이 현재 의약품 배송 시스템에는 법률문제를 비롯하여 약화사고 및 의약품 배송 사고 등 다양한 문제점이 존재하였다. 또한 전화의료 및 처방은 본태성 고혈압, 당뇨병, 지질증 등 만성질환 환자들의 이용이 주를 이룬다는 점과 이 외에도
의료, 약료 빅데이터는 민간 플랫폼에서 가공되어 공중 보건 증진을 위해 활용되어야 한다. 그러나 앞서 살펴본 바와 같이 의료 빅데이터를 상업적인 목적으로 이용할 수 있다는 문제점 역시 존재한다 이에 민간 플랫폼에는 관리 약사 및 공무원을 의무적으로 배치하여 의약품 배송과 관련한 빅데이터를 처리하는 업무를 담당하여야 한다. 관리 약사들은 약학 전문지식을 바탕으로 보건복지부 및 비대면 의료 관리 기관과 소통하며 의료/약료 빅데이터 처리 업무를 수행한다. 일례로 온라인약국을 운영하고 있는 미국 Amazon Pharmacy와 같은 경우 의무적으로 관리 약사를 두어 전문지식을 바탕으로 약료데이터를 관리하고 있다 (박지혜, 배현아 2019). 그러나 이 경우 약사 역시 민간플랫폼에 속해 있는 한 개인이기에, 이를 감
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 98 경증질환 및 급성 질환에 대한 초진, 정신과 질환의 지속처방 등 다양한 행태를 띄고 있다는 점도 확인하였다. 이에 원격의료와 의약품 배송에 관련하여 약국 수준에서 약료서비스를 개선함으로써 문제점에 대한 개선 방안을 제시하고자 한다 1.1 민간 플랫폼 관리 기구 신설 & 약국 시스템 개선 의약품 배송 시스템 정착화 및 맞춤 약료서비스 제공을 위해서는 국가 차원에서 운영, 감시가 가능한 플랫폼들로 비대면 진료 인프라를 구성해야 한다. 현재 비대면 진료 플랫폼들은 영리를 추구하는 민간기업에서 운영되어 상업적 색깔이 짙다. 일례로 모 플랫폼은 이용자들의 비대면 진료 데이터를 무단으로 사용하여 개인 맞춤형 건강식품 홍보에 나섰다 (김이슬 2022). 개인의 민감정보, 특히 의료정보를 상업적 영역에 활용하는 것은 국가 차원에서 규제되고 있으며, 공중보건에 위해가 되는 행위이다 비대면 진료 및 의약품 배송의 규모를 생각해보았을 때 현실적으로 국가 차원의 공공기관을 신설하여 운영하는 것에는 무리가 있다 이에 보건복지부 산하에 공공기관을 신설하여 의료법, 약사법에 의거하여 민간 플랫폼에 대한 관리 및 감시를 지속할 필요성이 존재한다. 그렇지 않는다면 국민건강을 다루는 의료서비스에 자본의 원리가 개입되어 현재 플랫폼들이 만들어내는 다양한 문제가 반복될 것이다 일례로 일본에는 정부 부처인 후생노동성을 중심으로 온라인 진료의 실시와 관련한 지침을 발표하고 권장사항을 규정하고 있다 (윤효영 2021).
시하고 빅데이터의 악의적 이용 가능성을 차단하는 공무원 파견이 수반되어야 한다 이는 앞서 말했던 신설 기관에서 이루어질 것이다 또한 일차의료기관 중심으로 약국의 시스템화를 이루어 민간 플랫폼과 지속적인 관계를 유지할 필요성이 있다. 지역 약국이 조제 및 복약지도만을 하는 단순 약료서비스에서 벗어나, 민간 플랫폼과 제휴를 맺어 상호간의 정보를 교류해야 한다 의약품 배송에 대해 시스템화된 약국들은 비대면 진료 및 약처방과 관련하여 플랫폼에서 제공하는 빅데이터를 활용하여 약력관리 및 개인 맞춤 약료서비스를 제공할 수 있다 다제약물을 원격 처방 받는 만성질환 환자들은 지속적으로 건강상태를 살필 수 있으며 개인맞춤 약료 서비스를 제공받을 수 있을 것이다 이때 담합 문제 등을 방지하기 위해 정부 차원의 규제 역시 필수적이다. 일례로 일본의 단골약국은 정보통신기술을 활용하여 환자의 복약정보를 파악하고 약사가 개인별로 고도의 약력관리를 제공하는 서비스를 운영하고 있어 지속적인 모니터링 상담이 이루어지고 있다. 또한 영국은 Structured medication review를 통해 일차 의료 네트워크를 구성해 통합 의료서비스를 제공하고 있다 (이정근, 2022) 이를 의약품 배송에 적용하여 민간위탁 플랫폼을 통해 원격으로 개인별 복약지도가 가능하다면 비대면 의료의 문제점으로 꼽히는 약물 오남용을 방지할 수 있으며, 개인약료 시대를 여는
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 99 효과적인 방법이 될 수 있다 그 예로 항생제의 올바른 복약지도와, 만성질환 치료제 등의 지속 모니터링이 계속된다면 치료기간 단축 및 부적절한 치료에 의한 합병증 발생 가능성을 감소시켜 치료비용을 감소시킨다 이는 비대면 진료의 문제점 중 하나인 무분별한 의료 서비스 이용으로 인한 건강보험재정 악화에도 긍정적인 영향을 줄 수 있다. 이처럼 약국 시스템 개선, 민간 플랫폼의 관리 약사, 비대면 의료 관리 신설기관이 서로 상생, 견제하며 의약품 배송의 정착화에 노력해야 한다 약사 전문인력이 직접 투입되어 이를 관리하면 비대면 진료 및 의약품 배송의 부작용을 막고 공중보건 증진에 기여할 수 있으며, 약사직능 향상에도 기여할 수 있다 1.2 약료서비스 활용 방안 방문 약료를 통한 다제약물 관리, 마약류 관리사업 1.2.1 방문약료를 통한 다제약물 관리 의약품 배송의 가장 큰 문제점으로 뽑히는 복약지도 미흡과 약물 오남용의 위험성을 방문 약료를 통해 개선할 수 있다 ‘방문약료’라는 개념은 지역 약사가 처방약을 조제하는 것에 그치지 않고, 노인, 장애인, 만성질환자 가정을 직접 방문하여 다제약물 관리, 약물 부작용 케어, 복약지도 및 상담을 진행하는 홈 헬스케어의 일종이다 전세계적으로 방문 약료는 새로운 약료서비스로 정착화되고 있으며, 약사의 약물 중재를 통해 환자의 복약안전성 증가, 삶의 질 개선, 의료비 절감 등의 효과를 보이고 있다. 2019년 경기도 방문약료 서비스 결과 (김성남, 2022) 방문약료 대상자들은 평균 4개의 질병을 보유했으며, 11개의 처방의약품을 복용하고 있었다. 이 중 같은 유효성분을 가진 약물을 평균적으로 2개씩 중복투여하고 있었으며 대상자의 40%가 부작용을 경험하고 있었다. 이는 만성질환으로 인한 다제약물 투여시의 위험성을 보여주는 예시이다. 방문약료를 통한 헬스케어 결과, 약의 효능과 용법 등의 인지도가 높아졌고, 복약순응도가 개선되는 결과를 얻었다 또한 일별 평균 복용 의약품 수가 11개에서 10개로 감소하였으며, 부작용을 나타내는 비율도 40%에서 18%로 감소하였다 앞서 살펴본 바와 같이 원격의료의 주요 대상환자는 만성질환자이며, 이를 앓고 있는 노년층은 청각과 인지기능이 약화되었을 가능성이 높다. 이에 초진으로 원격의료 서비스를 이용하는 경우 약사가 방문 약료 서비스를 제공할 수 있다 또한 이는 본래 원격의료 및 의약품 배송의 순기능인 의료사각지대 해소에도 기여한다. 건강보험공단의 다제약물 관리사업, 지자체 의료급여자 대상 방문 약료사업 등을 통해서 이미 국내에 그 필요성과 약사들의 수용성이 검증되어 있는 상태이므로, 방문약료는 의약품 배송과 함께 신상대가치 도입이 수월할 것으로 예상된다. 비록 방문 약료가 재진비율이 높은 만성질환자에 국한된다는 한계가 있지만, 전화진료를 이용하는 노년층의 비율이 높다는 점과, 건강보험재정의 큰 축을 차지하고 있는 만성질환자의 약료서비스 개선을 고려하면 합리적인 서비스로 사료된다 약료서비스 개선을 통하여 의약품 배송에 부수적인 문제점도 해결이 가능하다 비대면 진료에 따라 약사직능 저하에 대한 우려가 나오고 있는데, 이러한 약료서비스 개선을 통해 상대가치 항목을 개발한다면 이를 해결할 수 있다 이를 위해선 비대면 진료와 관련한 법률개선과 함께 약사 수가 개선 및 공식화를 통해 약사들의 참여 의지를 고무하여 사업 효과를 제고해야 한다
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 100 또한 방문 약료는 폐의약품 수거가 가능하다는 장점을 가진다 비대면 진료로 처방되는 약물은 복약지도가 부실한만큼 처리 곤란 문제가 존재할 것이다. 이에 약사들이 직접 가정에 방문하여 폐의약품을 수거한다면 환경 문제와 오남용을 방지할 수 있다 선행연구에 따르면 방문 약사들이 가정 내 폐의약품을 확인하여 수거된 환자는 전체 환자의 60.5%에 달했으며, 다제약물을 복용하는 만성 질환자일수록 수거되지 않은 폐의약품이 많다는 점을 확인했다 (황지원, 2021). 폐의약품을 복용하지 않은 이유는 정해진 용법과 기간대로 복약을 진행하지 않았거나, 환자 임의로 임상증상이 개선된 것으로 판단, 부작용 등의 이유가 존재하였다. 이에 방문 약료를 통해 올바른 복약지도가 지속된다면 폐의약품의 발생률도 줄일 수 있으며, 이를 회수할 수 있다는 장점이 존재한다 1.2.2 마약류 관리사업 한시적으로 비대면 진료가 허용된 현 시점에서 보건복지부는 2021년 10월 마약류 및 오남용 우려 의약품에 대한 비대면 처방을 금지하는 조치를 취했다 이처럼 마약류 의약품 오남용은 원격의료의 대표적인 부작용으로 이에 대한 제도를 법제화할 때 각별한 주의가 필요하다 그러나 원천적으로 마약류 의약품의 배송을 금지할 경우, 정신과질환을 앓고 있는 환자들의 의료접근성이 떨어지는 문제가 발생한다. 2절 2.5에서 확인한 바와 같이 개인 당 처방 횟수가 가장 많았던 질환은 정신과 질환이므로, 마약류 관리사업을 통해 부작용을 방지하고 환자들에게 알맞은 의약품을 제공할 수 있는 방침이 필요하다. 마약류 의약품에 대한 마약류 의약품(마약성 진통제, 식욕억제제, 수면제, ADHD 치료제 등)을 사용하는 잠재적 중독 위험군 환자들을 대상으로 비대면 진료가 이루어질 시, 약사에 의한 추가적인 중재가 필요하다 특히 정신과 처방약을 초진으로 처방 받는 경우 조기에 개입하여 안전한 약물사용 방법과 습관을 안내해야 한다 실제 호주는 NSW 마약치료프로그램을 통해 약사들이 직접 마약류 의약품을 사용하는 가이드라인을 제시하고 있다. 이에 의약품 배송에 맞춰 개인별 복약지도 및 방문 약료를 통해 마약류 의약품은 특이적인 관리를 추가해 중독위험성을 낮추어야 한다 폐의약품 분석 연구 (황지원, 2021) 에 따르면 방문 약료시 향정신성의약품으로 lorazepam, zolpidem, etizolam, 등의 폐의약품이 다수 확인되었다 향정신성 약물에 대한 약물 남용 및 중독의 관점에서, 비대면 의료가 진행될 시 가정 내 마약류 의약품에 대한 관리가 필요함을 알 수 있다. 또한 2절 3.1. 2에서 살펴본 바와 같이 민간플랫폼에서 마약류 의약품을 상업적으로 악용할 가능성이 매우 높기에, 이에 대한 감시도 동시에 이루어져야 하며 본 업무는 민간플랫폼 파견 공무원이 수행하게 될 것이다 2. 전자처방전의 문제점 및 개선 방안 전자처방 시스템을 성공적으로 운영하기 위해서는 정부 주도의 공적 전자처방전의 운영 혹은 민간기업 운영 시 감시 기관의 철저한 운영이 필요하다. 전자처방전은 인터넷 등 네트워크 상으로 전송되는 처방전이다 전자처방전의 활성화로 환자의 편의성이 증대될 수 있지만 처방전이 환자의 처방 정보 등 민감한 개인 정보를 다루는 만큼 이와 관련한 우려의 목소리도 끊임없이 제기되고 있다 여러 단체의 의견을 살펴보면 전자처방전 본격 도입 시 개인정보를 안전하게 관리할 수 있는 시스템을 도입해야 한다는 주장은 모두 동일하지만 시스템 구축 방식에 대해서는 이견을 보이고 있다 의사 및 병원 단체에서는 민간기업 여러 곳이 전자처방전 시스템을 운영하도록 해야 한다고 주장한다. 그 근거로 민간기업 여러 곳이
전자처방 시스템을 성공적으로 위한 법제화 전자처방전 제도를 구축하여 활성화였고 전자처방 제도의 운영주체를 결정하는 과정에서 정부 주도의 공적 전자처방전 제도로 방향을 결정하였다. 이는 사업의 연속성, 시스템의 안정성, 상호운영성의 확보 및 의료기관, 약국에 대한 인증, 전자판 약수첩의 휴대폰과의 연계, 전자처방 운용에 대한 문의 대응의 용이성에 근거하였으며 공기관인 사회보험 진료보수 지불기금 및 국민건강보험중앙회가 운영주체로 결정되었다 (백경희, 20 21). 우리나라도 해외 전자처방제도의 운영 사례를 참고하여 개인의료정보의 보호
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 101 관리하는 것이 운영을 효율적으로 할 수 있게 하고 정부의 단일 중앙서버로 관리한다면 모든 데이터가 한꺼번에 유출될 가능성이 있다는 것을 제시한다. 약사단체에서는 정부가 전담하여 공적 전자처방 시스템을 운영해야 한다고 주장한다 민간기업이 전자처방 시스템을 운영하면 환자의 개인정보가 민간기업을 통해 사유화될 수 있다는 의견이다 (최정석, 2022).
운영 중인 여러 국가의 사례를 살펴봄으로써 앞으로 우리나라에서도 전자처방전의 활성화를
시 고려해야할 사항을 찾을 수 있을 것이다 스웨덴과 호주는 효과적인 전자처방 시스템을 정착시킨 국가이다 스웨덴의 전자처방전달시스템에서는 처방전이 병원에서 국가 저장고를 거쳐 약국에서 요청 및 다운을 받을 수 있는 시스템을 갖추고 있다 조제한 처방 내역을 15개월 저장하는 등록체계 (국민조제등록)를 통해 의사와 약사는 정보를 검색하고 환자는 보안 적용된 전자서명으로 등록체계에 접근한다. 호주는 전자 처방 및 조제 시스템을 갖추고 있으며 처방의 모든 단계와 의약품의 공급 및 과정 요청을 전자상으로 완료 가능하게 한다 의사가 입력한 처방이 전자 서명을 통해 법적 인증되며 약국이 메디케어에 요청 시 전자처방전이 전송되어 조제를 완료할 수 있게 한다 이와 같이 정부 주도의 관리 시스템 운영을 통해 약물부작용사고를 감소시키고 의료서비스를 향상시킬 수 있게 되었다 (김동숙, 2014). 또한, 일본은 공적
등 여러 문제점을 방지할 수 있는 공적전자처방전을 운영하거나 감시 기관을 개설해야 할 것이다. 3. 원격의료 관련 법규의 개선 원격의료 중 비대면 의약품 제공 방안에 대한 법규가 부재하여 이에 대한 개선이 필요하다. 보건복지부의 판단과 달리 과거 대법원과 헌법재판소의 판결에서는 의약품의 배송을 금지하고 있다 따라서 지금처럼 법 개정 없이 의약품의 배송을 허용하는 것은 향후 재판에서 위법으로 판단될 소지가 있다. 현재처럼 의약품 배송 서비스를 허용하기 위해서는 감염병의 예방 및 관리에 관한 법률만이라도 개정하여 예외적으로 감염병 위기 상황에서 의약품의 배송을 허용하는 조항을 마련할 필요가 있다 동법의 개정으로 의사들의 한시적 비대면 진료를 허용한 것과 달리 약사의 비대면 의약품 판매에 대해서는 규정하지 않아 위법 여부에 대한 판단이 불명확하고 현재와 미래의 감염병 사태에서 약국이 감염 위험에 노출될 위험이 있다 따라서 감염병 위기 상황이 아닐 때의 비대면 진료와 의약품 배송 허용 문제와는 별개로, 최소한 코로나19 등의 감염병 위기 사태 속에서 의약품의 안전한 배송과 사용을 보장하며 안전한 의약품 사용을 규정하는 법률과 시행령의 개정 및 신설이 필요하다. 코로나19 사태 이전 비대면 진료와 의약품 배송은 명시적 금지조항이 아닌 건강보험법 등 관계 법률, 법률의 해석과 적용에 의해 금지되었다. 이에 대해 한시적 비대면 진료 허용을 위해서 명시적 법 조항이 만들어진 것처럼 의약품의 배송에 관한 조항 또한 신설하여 관련 법률을 보완할 필요가 있다.
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 102 의약품 배송에 따른 약화사고의 책임소재에 대한 규정이 필요하다 새로운 형태의 의약품 제공 방안의 도입에 따라 약화 사고 시 책임 소재 관련 갈등이 발생할 수 있어 의약품 배송 과정에 대해 충분히 설명하고 약사가 충실히 복약지도를 하고 의약품의 변질을 막기 위한 조치를 취했을 경우 약사의 책임을 감면해 주는 조치가 필요하다. 국회의 의료법 개정안 등을 통해 원격의료에서 의료인이 충분한 주의의무를 다하였음에도 의료사고가 발생한 경우 책임을 감면하는 것에 대한 논의가 이루어지는 것(백경희, 박성진 2020)과 마찬가지로 약사의 복약지도와 의약품 조제 및 배송에서도 책임에 관한 조항이 필요하다 새로운 법률의 신설 없이 현행 의료법 등 관련 법률로 규제가 가능하다는 의견도 있으나(이원복 2021) 구체적 상황에서 약사가 취해야할 행동을 안내하여 의료분쟁을 막고 안전한 의약품 사용이 이루어지도록 해야 한다 원격의료의 적용은 비대면 진료 및 의약품 배송에 대한 국민건강보험의 급여여부와 밀접한 관련이 있다. 추후 비대면 진료의 제도화를 위해서는 한시적 비대면 진료 시행 결과에 따른 비용효과성과 임상적 유용성을 평가하여 급여 허용조건과 보험수가를 결정해야 한다 (김대중 2015). 복약지도에 대해서도 마찬가지로 비대면 복약지도에 대한 건강보험 적용과 수가 설정에 대한 논의가 필요하다 보험재정 관리와 비대면 상담의 편의성을 고려할 때 수가를 낮게 설정할 수도 있지만 이 경우 원격의료를 이용할 유인이 떨어지고 정보통신망 구축과 배송에 따른 비용 문제로 의사와 약사가 비대면 서비스 제공을 기피하게 될 수 있다 따라서 경제성 평가와 사회적 논의를 통해 비대면 진료 및 의약품 배송과 비대면 복약지도에 대한 적절한 수가 설정이 필요하다 이원복(2021) ‘원격진료 실시에 수반되는 법적 쟁점들에 대한 고찰’ 연구에서는 원격의료 도입 시 다음과 같은 법적 쟁점이 발생할 것이라고 예상하였다. 1) 수가정책, 2) 환자 본인 확인, 건강보험 부정수급, 3) 의약품 비대면 구매 (약사법 50조 제1항, 제24조 4항의 정비 필요), 4) 진료장면 녹화, 5) 시설 기준, 6) 의료인의 책임, 7) 개인정보 보호 그리고 이 연구에서 수가정책, 본인확인, 의약품 비대면 구매, 진료장면 녹화에 대해서는 입법을 통한 정비가 필요하다고 보았다 이러한 쟁점들을 약사(藥事) 측면에서도 살펴보면 위에서 언급한 내용과 더불어 앞으로 논의가 필요한 사항들이 존재한다. 1) 우선 비대면 복약지도와 의약품 배송이 이루어질 경우 이에 대한 적절한 수가 설정이 필요하다. 2) 비대면 복약지도와 의약품 배송이 이루어질 때 환자의 본인확인과 건강보험 적용 대상 여부에 대한 확인을 할 수 있는 시스템을 구축하고 이를 검증할 필요가 있다 그리고 의약품 오남용을 막기 위해 처방전을 중복해서 사용하거나 타인의 처방전을 위조하는 등의 행위를 막을 수 있는 규제가 필요하다. 현재는 팩스 혹은 이메일로 처방전을 약국에 전송한 이후 조제를 거쳐 의약품 배송이 이루어지는데 이는 보안성이 떨어지며, 전자처방전 등 안전을 보장할 수 있는 시스템 구축이 필요하다. 3) 처방전 전송과 복약지도, 의약품 배송에 사용되는 온라인 시스템과 기기들의 보안과 이들이 효과적으로 작동됨을 인증하는 절차가 필요하다 이를 통해 개인정보의 유출과 악용을 방지해야 한다. 4) 비대면 의약품 구매에 관한 법제의 개선이 필요하다 의약품 배송이 이루어지기 위해서는 약국에서의 의약품 판매를 규정한 약사법 50조 제1항 그리고 복약지도 의무를 규정하였고 대면판매 의무를 규정한 것으로 해석되는 동법 제24조 4항을 정비하거나(이원복 2021), 감염병 등의 상황이나 특정한 경우에 의약품 배송을 허용하는 특별법의 제정이 필요하다. 이처럼 원격의료의 논의 과정에서 의사의 진료행위에 대한 논의와 더불어 약사의 복약지도 및 의약품 배송에 관한 여러 쟁점들에 대한 논의와 사회적 합의가 필요하다.
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 103 제3장 결론 제1절 요약 및 정리 코로나 사태 이후 발표된 ‘한시적 비대면 진료 허용 공고’를 시작으로 본격적인 원격의료 시대의 막이 열렸다 이에 본 연구는 본격적으로 원격의료가 법제화되기에 앞서, 이에 대한 부작용을 최소화하고 환자들에게 올바른 의약품 서비스를 제공하기 위한 요소들을 살펴보았다 1절에서는 현존하는 국내외 원격의료 관련 법률 조항들을 점검했다. 국내에선 원칙적으로 의료인 환자 간 비대면 진료는 허용되지 않으며, 코로나 사태가 지속중인 현재 예외적으로 감염병 예방 및 관리에 관한 법률 개정을 통해 한시적인 비대면 진료가 허용되고 있다. 본래 비대면 복약지도 및 의약품 배송 역시 약사법 50조 1항에 따라서 위법하나, 한시적 비대면 진료 허용 이후 원격의료 플랫폼을 통해 의약품 배송이 이루어지고 있다. 그러나 판례에 따르면 안전한 의약품 사용 및 국민건강 증진을 위하여 약국 이외에서 의약품 판매과정이 일어나는 것은 금지되었고, 현재 의약품 배송과 관련한 법률은 전무한 상황이다. 이에 전자처방전 전송, 비대면 복약지도, 의약품 배송 등 약국 및 약사와 관련한 법제의 보충이 필요한 실정이다 해외의 의약품 배송 현황과 관련해서는 미국과 일본의 사례를 살펴보았고, 모두 국내에 비해 원격의료가 활성화되어 있었으며 이 경향은 코로나 사태 이후 더욱 가속화되었다 미국은 주별로 Parity law를 적용하여 Medicare, Medicaid등의 제도를 운영하고 있다 연방차원의 법령으로는 HIPPA를 통해 의료정보를 보호하며 비대면 진료의 문제점인 건강정보 유출에 대한 예방책을 강구하였다 한편 미국은 온라인 약국이 허용되어 활발히 운영되고 있으며 주법, 연방법을 통해 규제되고 있다. 일본과 같은 경우 원격의료법률은 따로 존재하지 않으나, 정부 부처인 후생노동성에서 지침을 만들어 이를 관리하고 있다 일본 역시 원격의료가 점차 확대되는 경향을 가지며 코로나 사태 이후 온라인 진료, 의약품 배송과 관련한 특례조치를 시행하였다 2절에서는 의약품 배송 현황을 3개의 파트로 나누어 시장 중심, 문제점 중심, 국내 진료현황 중심으로 분석하였다 파트 1에서는 의약품 시장의 변화 동태를 국내외로 살펴보았다 현재 국내에서 진행되는 비대면 진료 과정은 주로 민간 원격의료 서비스 플랫폼을 통해 진행되고 있다 중개 플랫폼은 의료기관과 제휴하여 환자가 직접 병원과 의사를 골라 전화 또는 화상으로 진료를 진행한다. 이후 약국에 처방전이 전송되고, 배송 드라이버가 이를 수령하여 환자가 원하는 곳으로 의약품을 배송한다 닥터나우는 국내최초의 비대면 진료 플랫폼이며 가장 많은 이용자수를 보유하고 있고 이 외에도 굿닥, 바로필 등의 중개 플랫폼들이 존재한다. 2022년 8월 4일 보건복지부는 이러한 비대면 진료 중개 플랫폼이 준수해야 할 가이드라인을 제시하였다. 그러나 이 역시 의약품 배송서비스와 관련된 조항은 미미하여 그 한계를 보이고 있다 한편 의약품 배송에는 전자처방전의 발급이 필수적이고, 이와 관련된 정책에 관하여 보건복지부에서는 협의체를 구성해 방안을 모색 중에 있다 현재 전자처방전의 발급은 정부 주도로 활성화되어 있지 않으며 대형병원을 중심으로 확장되는 중이다
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 104 해외의 의약품 배송 시장의 경우, 미국과 일본의 사례를 살펴보았고 국내와 비교하여 훨씬 큰 규모의 시장 규모를 가졌다. 미국은 대면진료 없이 의약품 처방이 가능하며, 전문의약품 배송이 가능하는 등 다양한 형태의 의약품 유통 사업을 선도하고 있다 오프라인 구매가 주류였던 코로나 이전 세대와 달리, 코로나 이후 온라인 플랫폼의 강세가 두드러지며 현재 A mazon Pharmacy, Uber Health, Medly Pharmacy 등 온라인 약국을 중심으로 의약품 시장이 재구성되고 있다. 일본은 이보다 보수적으로 의약품 배송을 허용하여 비교적 안전성이 높은 일반의약품만이 유통이 가능하다 미국과 일본 모두 마찬가지로 코로나 시대 이후 의약품 배송 시장의 규모가 훨씬 커진 것을 확인할 수 있었다. 파트2에서는 국내에서 한시적으로 비대면 진료가 허용된 이후 실제 시행된 전화상담을 바탕으로 국내 의료인 환자 원격의료를 분석하였다 의료기관 종별, 소재지별, 진료과목별, 환자별, 질환별로 전화진료 및 약처방에 대해 분석하였고, 그 결과 비대면 진료를 활용하는 주 환자층이 만성질환을 앓고 있는 노년층임을 확인하였다. 또한 급성질환으로 비대면 진료를 사용하는 젊은 층의 환자들은 초진율이 높았다 한편 2020년 3분기에 비해 2021년 1분기의 전화진료 이용 환자 수, 건수 모두 증가하였고, 1인당 전화진료 평균 이용 횟수 역시 늘어났다 이에 비대면 진료를 일회성으로 사용하는 환자군, 지속적으로 사용하는 재진환자들을 구분해, 각 그룹에 대한 알맞은 비대면 진료 활용 가이드라인을 제시할 필요성을 확인했다 파트3에서는 의약품 배송으로 인해 발생할 수 있는 문제점을 국내와 해외 실제 사례를 바탕으로 제시하였다. 크게 4가지의 문제점으로 복약지도의 미흡, 무분별한 오남용 우려, 의약품 취급 관리의 문제, 개인정보 유출 우려를 제시했다 실제 비대면진료 앱 경험자 설문 결과 유선 복약지도를 받은 환자는 42%에 불구하였다 또한 비대면진료의 상당수를 차지하는 것이 다이어트, 탈모, 발기부전 치료제 등의 비급여 의약품들이기에 약물 오남용에 대한 우려가 크다 오남용 이외에도 의약품을 취급함에 있어 특별한 관리가 필요한데 배송 과정에서 이를 관리하기에 한계가 있고, 이에 대한 가이드라인조차 없는 실정이다. 한편 비대면 진료 앱에 기록되는 개인정보 문제를 관리하는 가이드라인 또한 부재하다 해외의 사례 역시 국내와 비슷한 양상을 띄었다. 온라인 약국이 활성화되어 있는 미국에서도 의약품 배송의 주 이용자인 노년층의 정보통신 기술 접근성 문제가 존재한다 또한 약물 오남용으로 인해 한 소년이 약물중독으로 사망한 사례가 존재하였고, 의료 산업 내의 사이버 보안 공격의 위협도 수차례 존재하였다 3절에서는 올바른 의약품 배송 시스템을 구축하기 위한 개선 방안을 약료서비스 개선, 전자처방전 개선, 법규 개선의 측면에서 살펴보았다 약료 서비스의 경우 비대면 진료 플랫폼 규제 및 약국 산업화 / 방문 약료를 통한 다제약물, 마약류 관리를 제시하였다 민간 비대면 진료 플랫폼에서 기인하는 다양한 문제들을 보건복지부 산하에 정부기관 신설을 통해 관리해야 할 필요성이 있다. 약국, 정부기관, 민간플랫폼이 서로 견제하고 상생하는 관계가 형성되어야 올바른 의약품 배송 시스템을 구축할 수 있다 또한 방문 약료라는 약료서비스를 활성화화여 비대면 진료의 한계점을 돌파할 수 있다. 약물 오남용 방지 및 복약지도 개선의 효과를 가질 수 있으며 다제약물 관리사업 및 마약류 관리사업을 동시에 진행해 질환별로 효과적인 약료서비스를 제공할 수 있다. 전자처방전 개선의 경우, 정부 주도의 공적 전자처방전을 운영하거나 민간기업에 대한 철저한 감시 기관의 존재가 중요하다. 성공적으로 전자처방 시스템을 정착화한 여러 국가의 사례를 참고할 때, 정부
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 105 주도의 관리 시스템 운영을 통해 약물부작용 사고를 감소시키고 의료서비스를 향상시킬 수 있었다. 법규의 개선에서는 의약품 배송에 관한 명시적 조항 및 법규 신설의 중요성을 강조했다. 감염병 위기 상황이 아닐 때와 위기 사태 각각의 법률과 시행령 개정이 필요하다 또한 의약품 배송에 따라 약화사고가 일어날 시의 책임소재를 규정하여야 한다. 의약품 배송에 있어 약화사고는 자연스레 따라오는 부작용이고, 이에 따라 복약지도와 의약품 조제 및 배송에도 책임에 관한 조항이 필요하다. 이에 의료 분쟁을 막고 안전한 약물 사용이 이루어지도록 해야 한다 이 외에도 급여 허용조건, 보험수가 및 보험재정 관리 등에 대한 현실적인 부분을 비롯하여 여러 쟁점들에 대한 논의 및 사회적 합의가 필요하단 점을 언급하였다 제2절 의의 및 한계점 본 논문은 코로나19 사태 이후 한국의 원격의료 제도화 과정에서 나오고 있는 최신 자료를 분석하였으므로 원격의료 제도화 과정에서 발생할 수 있는 시사점을 도출하였다는 가치를 가진다. 또한, 원격의료 관련 법률 및 제도의 분석, 해외의 제도에 대한 고찰 및 관련 논문 탐구를 종합적으로 수행함으로써 원격의료 제도화 과정에서 의미 있는 자료로 사용될 수 있을 것이다. 특히, 국내에서는 원격의료 정책이 가이드라인 수준으로 발표되었고 법제화 이전 단계이다 이러한 상황에서 원격의료 정책에 관한 법률의 발전 방향을 제시했다는 의의가 크다. 원격 의료 및 의약품 배송, 전자처방전으로 인해 발생할 수 있는 문제점을 분석하고 개선 방안을 제시하여 올바른 원격의료를 위한 적절한 정책 판단에 본 논문이 도움이 될 것이라 생각된다. 또한, 의약품 서비스 정책 전반에 관한 연구가 부족한 실정에서 올바른 의약품 제공을 위한 연구 자료가 될 것이다 본 논문은 문헌 조사를 통해서만 연구를 진행했다는 한계가 있지만, 가이드라인, 보고서, 법률 등 다양한 형태의 자료를 수집하여 연구의 타당성 향상에 기여하고자 하였다. 또한, 현재 활발하게 논의가 이루어지고 있는 분야이기 때문에 본 논문이 발표된 이후 변화되는 정책이 매우 많을 것이라 예상된다. 이 때문에 후속 연구를 통하여 최신화된 제도 및 법률의 분석이 필요하고 추가되어 발생하는 문제점에 대한 방안을 탐구해야 할 것이다. 더욱이, 원격의료에 관한 법률 및 정책이 구체적으로 어떤 단계를 통해서 도입될 수 있고 개선될 수 있는지에 대해 자세하게 분석하는 후속 연구가 필요하다. 또한, 본 논문에서는 원격의료에 사용되는 기기의 허가, 사용 및 온라인 약국에 대한 분석을 포함하고 있지 않으므로 추가적인 연구의 필요성이 있다. 약료서비스 개선방안과 관련하여 본 논문에 제시되지 않은 신규의약품 상담 서비스, DUR 사후 관리 등 원격의료의 개선을 위해 사용 가능한 약료서비스에 대한 내용을 포함하지 않았다는 한계가 있다. 마지막으로, 원격의료 및 처방 현황 분석에 사용된 데이터는 현재도 계속해서 변화하고 있으므로 최신화된 데이터를 사용하여 분석한 후속 연구가 필요하다
보고 지연. (2020). 비대면 시대, 비대면 의료 국내외 현황과 발전방향. KISTEP Issue Paper, 통권 제2 88호
서동철, 이정근, 김성남. (2022). 지역약국 약료서비스 모델 및 상대가치항목 개발을 위한 정책토론회 경기도약사회 임선미 ,유승현, 김진숙, 지성인 . (2021). ‘코로나 19 이후 시행된 전화상담, 처방 현황 분석’ 의료정책연구소
OpenAPI; (2022) 건강보험심사평가원 코로나19 전화상담 병의원 정보, 건강보험심사평가원 기관수현황|보건의료빅데이터개방시스템 (hira.or.kr) 조민호. (2022) 한시적 비대면 진료(전화상담 처방) 시행에 따른 효과 평가 연구 건강보험심사평가원 학술논문 김대중. (2015). 주요국의 원격의료 추진 현황과 시사점: 미국과 일본을 중심으로. 보건복지 Issue & Focus, 270, 1 8. 김재선. (2017). 처방의약품의 온라인 거래에 관한 미국의 규제체제와 시사점: 처방의약품의 ‘처방’ 개념 논의를 중심으로 공법학연구, 18(3), 529 553. 박지혜, & 배현아. (2019). 정보통신 기술 발전에 따른 의약품 유통 체계 변화 가능성: 온라인 의약품 유통정책에 관하여 생명, 윤리와정책 , 3(2), 59 83. 백경희, & 박성진. (2020). 펜데믹 (Pandemic) 기간 동안의 원격의료 허용 여부 및 그 범위에 관한 고찰. 법학논총 , 48, 341 369. 백경희. (2020). 포스트 코로나 시대의 원격의료에 관한 법제의 개정 방향에 관한 고찰 법제 , 691, 1 53 184.
윤효영. (2021). 비대면 시대 원격의료의 정착을 위한 법제도 개선 방안 법학논총, 45(1), 449 498. 이얼. (2014). 의료법상 직접진료 원칙과 그 예외에 관한 소고. 법학연구, 22(2), 173 196. 이원복. (2021). 원격진료 실시에 수반되는 법적 쟁점들에 대한 고찰 의료법학, 22(1), 57 90. 이원복. (2015). 의약품 온라인 판매 규제의 새로운 접근 생명윤리정책연구, 9(2), 201 221. 이종인, & 이승신. (2012). 의약품 거래규제에 관한 일고찰: 온라인약국 허용여부에 관한 정책적 논의를 중심으로 소비자문제연구 , (41), 51 65. 장보현(2021) ‘닥터나우’ 어떻게 바라봐야 하나 서울약사회지 . 7월호. 14 16 정수연(2021). 누구를 위한 원격진료 약배달인가 대한약사회지 . summer. 5 8 황지원, 이민경, 서용훈, & 김광준. (2021). 방문약료를 통해 수거한 가정 내 폐의약품 분석. Yaghag hoi ji, 65(6), 413 423. Poudel, A., & Nissen, L. M. (2016). Telepharmacy: a pharmacist's perspective on the clinical benefits and challenges. Integrated pharmacy research & practice, 5, 75 82. Sarah A. Cole, Kimberly R. Cusson, Candice M. Moschell. (2020). Telehealth Risks During CO VID 19 and beyond. Association of Healthcare Internal Auditors. 3, 4 Unni, E. J., Patel, K., Beazer, I. R., & Hung, M. (2021). Telepharmacy during COVID 19: A Sc oping Review. Pharmacy(Basel, Switzerland) , 9(4), 183. Professional Risk Management Services. (2021). 5 Things to know about the ryan haight act
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 106 참고문헌
서 김
인터넷 기사 강혜경(2022). '플랫폼 특혜' 재검토 요구에도 원안 공고 허탈한 약사들 데일리팜 http://www.dail ypharm.com/Users/News/NewsView.html?ID=290669 고광본(2020). 코로나19로 탄력받은 해외 원격의료 서비스 현황. 50+리포트. 5. (23) https://50plu s.or.kr/detail.do?id=10140494 고정민(2022). 정부 가이드라인에 비대면진료 찬성 측도 "급한 불 끄기" 시큰둥 청년의사 https://w ww.docdocdoc.co.kr/news/articleView.html?idxno=2025728 김희선(2022.06.13). 비대면 의료 정책 동향 후생신보 http://www.whosaeng.com/136706 김지은(2022. 06. 04). 코로나에 해외도 비대면진료가 대세… 약국 지형도는? 데일리팜 http://www.dailypharm.com/Users/News/NewsView.html?ID=288727
Georgina gonzalez. (2021.12.13). 6 challenges for patients using telehealth. Becker’ s Hospital Review. https://www.beckershospitalreview.com/telehealth/6 challenges f or patients using telehealth.html
인터넷 자료 닥터나우 이용 방법[닥터나우]. (2022.09.10). URL: https://doctornow.co.kr/services/ 바로필[바로필]. (2022.09.10). URL: https://www.baropill.com/
판례
대법원 2008. 10. 23. 선고 2008도3423 판결
대법원 2013 4. 11. 선고 2010도1388 판결 헌법재판소 2008. 4. 24. 선고 2005헌마373 전원재판부 헌법재판소 2012. 3. 29. 선고 2010헌바83 전원재판부
정부 공고
보건복지부 공고 제2020 177호
보건복지부 공고 제2021 780호
보건복지부 공고 제2020 889호
보건복지부 공고 제2022 576호
[정책1팀] 원격의료에 따른 올바른 의약품 제공에 관한 고찰 서울대학교 약학정책연구회 107 박성우(2020.11.27). 코로나19 이후 미국 온라인 의약품 유통시장 변화. kotra 해외시장 뉴스 신은진(2022.07.14). 약은 냉장보관 안된다? 필요한 약도 있다! 헬스조선 https://m.health.chosun com/svc/news view.html?contid=2022071402114 이정환(2021.08.20). 직접 약 배달 받아본 약사회, 증거 내밀며 문제점 성토 데일리팜 http://www. dailypharm.com/Users/News/NewsView.html?ID=279479 정흥준(2022.07.12). 비대면 진료앱 이용자 42%만 유선 복약지도 받아 데일리팜http://www.dailyp harm.com/Users/News/NewsView.html?ID=289889&dpsearch=%BA%F1%B4%EB% B8%E9%20%C1%F8%B7%E1 진보영. (2019 03 18). [칼럼] 판례로 알아보는 의약품 약국외 판매 데일리팜. 2020년 8월 23일 검색, http://www.dailypharm.com/Users/News/NewsView.html?ID=250426
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 108 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 해외 사례를 중심으로 서울대학교 약학대학 약학정책연구회 3기 정책2팀 배한경, 안이진, 윤경민, 이민주, 조재현
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 109 <초록> 안전상비의약품은 의사의 처방전 없이 구입할 수 있는 일반의약품 중 가벼운 증상에 시급하게 사용하기 위해 환자 스스로 판단해 사용할 수 있는 의약품이다 안전상비의약품 약국외 판매 제도는 '접근성 제고'와 '안전성 확보' 달성을 목표로 20 12년 11월 15일부터 시행되었다. 본 제도는 국민의 건강에 직접적인 영향을 주는 만큼 안전성 확보가 필수적이다 그러나 제도 도입 후 10년이 되어가는 현재까지도 이에 관한 연구와 노력은 매우 부족한 실정이다. 본 논문에서는 국내 안전상비의약품 약국외 판매 제도의 문제점을 시행상의 문제점과 본질적 문제점으로 나누어 분석하였다. 시행상의 문제점으로 판매자의 제도 미준수, 품목 조정 논의에 대한 정부의 태도를 제시하였으며, 본질적 문제점으로는 판매자에 대한 교육, 안전상비의약품 분류 체계를 제시하였다. 이후 유사한 제도를 시행하고 있는 해외의 사례를 참고하여 국내 제도의 개선 방향을 제시하였다 첫째, 판매자에 대한 현장점검이 정기적으로 이루어지도록 조항을 신설해야 한다 스웨덴의 OTC(Over the c ounter)의약품 관련 법안을 바탕으로 정보를 문서화하여 판매를 체계적으로 관리하는 방법을 제안한다 둘째, 일본의 등록판매자 제도에서 착안하여 시험을 통해 판매 자격을 부여하는 제도의 도입을 제안한다. 이는 판매자가 안전상비의약품 관련 지식을 충분히 갖출 수 있게 하여 안전한 관리에 도움이 될 것이다 셋째, 품목 수 제한 해제 및 성분 중심의 선정 기준을 마련하고, 의약품재분류 제도를 도입하여 소비자의 선택권을 보장할 것을 제안한다 마지막으로, 스웨덴의 OTC의약품 관련 법안에서 착안하여 주류를 취급하는 업소에 대한 판매 제한 규정을 신설함으로써 건강상의 잠재적 위험을 줄일 수 있도록 한다. [주제어] 안전상비의약품, OTC 의약품, 스웨덴, 영국, 일본
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 110 목 차 제 1 장 서론 ........................................................... 111 제 1 절 연구 배경 및 목적 ................................................... 111 제 2 절 연구 내용 및 방법 114 제 2 장 본론 114 제 1 절 국내 안전상비의약품 약국외 판매 제도의 문제점 ....................... 114 1. 제도 시행 상의 문제 ...................................................................................................... 114 2. 제도의 본질적 문제 ....................................................................................................... 118 제 2 절 의약품 약국외 판매 해외 사례 ........................................ 120 1. 영국 ............................................................................................................................... 121 2. 스웨덴 ............................................................................................................................ 124 3. 일본 ............................................................................................................................... 127 4. 기타 ................................................................................................................................ 129 제 3 절 국내 안전상비의약품 약국 외 판매 제도의 개선 방안 131 1. 안전상비의약품에 대한 규제 강화 ................................................................................. 131 2. 안전상비의약품 약국외 판매를 위한 자격증 제도 도입방안 .......................................... 131 3. 성분명 선정 및 의약품재분류 제도 도입 133 4 주류 판매업 또는 음주행위가 허용된 업소에서의 안전상비의약품 판매 제한에 대한 법률 신설 134 제 3 장 결론 ........................................................... 135 제 1 절 요약 및 결론 ........................................................ 135 제 2 절 연구의 의의 및 한계점 136 참고문헌 ............................................................... 137
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 111 제 1 장 서론 제 1 절 연구 배경 및 목적 2012년 11월 15일, 약사법 제44조제2항에 따라 ‘안전상비의약품’이라는 이름으로 일반의약품이 약국외 장소에서 판매되기 시작하였다 안전상비의약품은 의사의 처방전 없이 구입할 수 있는 일반의약품 중 가벼운 증상에 시급하게 사용하기 위해 환자 스스로 판단해 사용할 수 있는 의약품을 의미한다 해당 품목의 성분, 부작용, 함량, 제형, 인지도, 구매의 편의성 등을 고려해 20개 품목 이내의 범위에서 보건복지부장관이 고시한다 제도가 시행되기 전에는 약사법 제44조 제1항에 따라 약국 개설자가 아니면 의약품을 판매하거나 판매할 목적으로 취득할 수 없었고, 약사법 제20조 제1항은 약국 개설자를 약사 또는 한약사로 한정하였다 그러나 제도가 시행됨에 따라 일반의약품 중 일부를 약사 및 한약사가 아닌 24시간 연중 무휴 점포의 운영자도 판매할 수 있게 된 것이다 안전상비의약품 약국외 판매 제도는 약국이 문을 닫는 공휴일, 심야 시간대 의약품 구입 불편을 해소하기 위한 목적으로 도입되었으며, 구체적으로 ‘접근성 제고’와 ‘안전성 확보’를 목표로 한다 (김원종, 2012). 평일과 비교하였을 때 안전상비의약품 판매량이 토요일은 35.7%, 일요일은 79.1% 높은 점, 일반적으로 약국 운영이 끝나는 18 시 이후부터 24시 사이의 판매량이 가장 높은 점 (최상은 외, 2016), 조사 대상자 중 6 9 8%가 편의점에서 안전상비의약품을 구입한 이유로 공휴일과 심야 시간에 약이 필요했기 때문이라고 응답한 점 (고대균 & 여정성, 2017) 등은 제도 도입의 필요성에 정당성을 부여한다 국내에서‘안전상비의약품’이라는 개념에 대한 논의는 김영삼 정부 시절 한약 분쟁을 계기로 시작되었다. 한약분쟁으로 인해 전국 약국이 휴업하는 일이 발생하였고 약사에 대한 국민들의 감정이 악화되어 이는 결국 약국 외의 장소에서 의약품 판매를 허용해달라는 건의서를 보건사회부에 제출하는 상황으로 이어졌다 (박형욱, 2012). 뒤 이은 김대중 정부와 노무현 정부에서는 안전상비의약품 약국외 판매 제도를 적극적으로 추진하지 않았으나 이에 대한 국민들의 관심과 요구는 지속되었다. 이러한 상황 속에서 의약분업이 이루어졌고, 의약분업 이후 약국이 의료 기관의 운영시간에 맞추어 운영을 하게 되는 경우가 많다 보니 공휴일, 심야시간대에 의약품을 구입하는 것이 어려워졌다 (최상은 외, 2016). 이에 이명박 정부는 취임 직후부터 일반의약품의 약국외 판매를 허용하려는 움직임을 보였으나 안전성 문제 및 약사 단체의 반발 등으로 인해 무산되기도 하였다 (이호준, 2011). 그러나 2011년 6월 청와대가 안전상비의약품 약국외 판매를 재추진하겠다고 발표한 것을 계기로 (안용수, 2011) 약사법 개정 절차가 신속하게 진행되었고, 2022년 7월 현재 안전상비의약품은 해열 진통제 5종, 감기약 2종, 소화제 4종, 파스 2종 총 13개의 의약품이 허가되어 판매되고 있다. 도입 과정에서도 알 수 있듯 안전상비의약품 약국외 판매 제도는 사회적으로 큰 이슈이며, 안전상비의약품 시장은 안전상비의약품 약국외 판매 제도 도입 이후부터 현재까지 꾸준하게 성장하는 추세이다 (그림 1).
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 112 그림9. 안전상비의약품 총 공급금액 2013년부터 2021년까지의 안전상비의약품 총 공급금액으로, 단위는 백만원이다 (건강보험심사평가원, 2014 2022) 코로나19 자가검사키트의 편의점 판매는 안전상비의약품의 약국외 판매 제도의 공적 기능을 부각시켰고 (유선희, 2022), 코로나19 증상과 관련된 기침, 발열, 인후통에 복용 가능한 제품 매출의 급증 (이지영, 2022, 그림 2)은 제도와 관련된 논의가 재점화되는 계기가 되었다. 그림10 안전상비의약품 효능군별 공급금액 2013년부터 2021년까지의 안전상비의약품 효능군별 공급금액으로, 단위는 백만원이다 (건강보험심사평가원, 2014~2022).
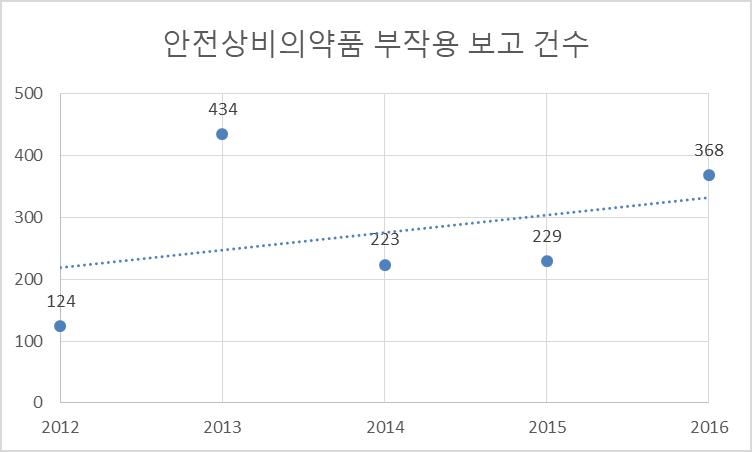
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 113 안전상비의약품 약국외 판매 제도는 시행으로 인해 발생하는 의약품 오남용 등의 부작용이 국민의 건강 및 안전과 직결된다는 점이 특징적이다. 의약품이 무분별하게 시장에 유통될 경우 약물의 오남용 문제가 발생할 수 있고, 의약품이 부패 또는 변질될 시 큰 위험을 초래할 수 있다 (백경희, 2011). 실제로 안전상비의약품에 대한 부작용 보고건수가 증가하고 있다는 연구 결과는 안전성 문제에 대한 걱정이 기우가 아님을 보여준다. 2012년 보고된 124건의 부작용 사례는 2016년 368건으로 증가하였고 (그림 3), 특히 해열·진통·소염제로 분류되는 특정 제품의 경우 보고된 부작용 건수가 2012 년 55건에서 2016년 107건으로 1.9배 증가하였다 (엄태선, 2017). 이와 같은 결과는 안전상비의약품 약국외 판매 제도의 경우 철저한 제도적 장치 마련, 시행, 모니터링, 제도 보완이 필요함을 뒷받침한다 그림11. 안전상비의약품 부작용 보고 건 제도 시행 이후부터 2016년까지 부작용 보고 건수가 증가하는 추세를 보였다. 2013년의 경우 어린이타이레놀 현탁액 회수 조치 문제로 인해 부작용 보고가 급증한 것으로 추정된다 (엄태선, 2017). 그러나 안전상비의약품 약국외 판매 제도가 시행된 지 10년이 지났음에도 불구하고 제도의 사회적 영향에 비해 제도 시행 후 이와 관련된 구체적 논의나 연구는 미비한 실정이다 안전상비의약품 품목조정에 관여하는 안전상비의약품 지정심의위원회가 2018 년 제6차 회의를 끝으로 더 이상의 회의를 진행하지 않았다는 사실은 이를 단적으로 보여준다 (보건복지부, 2018). 안전성 확보를 위한 판매자 교육 및 준수사항 명시, 한국의약품 관리원의 안전상비의약품 길라잡이 발간, 부작용 신고센터 운영 등 제도적 장치들이 일부 마련되어 있지만 (김원종, 2012) 실제 제대로 시행되고 있는지, 실효성이 있는지는 의문이다 이에 본 연구에서는 안전상비의약품 약국외 판매 제도와 해외 유사 제도의 현황, 도입 목적과 필요성, 위험성과 한계점을 다각도에서 심도 있게 분석하고자 한다. 본 연구와 유사하게, 국내 안전상비의약품 약국외 판매 제도의 현황 및 문제점을 제시하고 해외 사례를 분석한 연구들이 존재한다. 그 예로는 명칭 및 정보 표시기재 등을
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 114 중심으로 안전상비의약품의 안전성을 분석한 윤해진과 명순구의 연구(윤해진 & 명순구, 2018)와 소비자 인식 조사를 포함하여 제도 시행 현황을 구체적으로 분석한 최상은의 정부 용역 연구(최상은, 2016) 등이 있다 그러나 이들의 연구에서 해외 사례에 대한 분석은 대부분 분류 체계에 대한 논의에서 그친다는 한계점이 있다. 따라서 본 연구에서는 판매 및 관리 형태, 판매자 규제 등 실제 판매 과정에서 적용되는 다양하고 구체적인 해외 사례들을 분석하여 안전상비의약품 약국외 판매 제도가 나아가야 할 방향을 제시하고자 한다 제 2 절 연구 내용 및 방법 본 논문의 1절에서는 국내 안전상비의약품 약국외 판매 제도의 문제점을 크게 두 가지로 나누어 살펴보았다. 첫번째 문제에서는 제도의 시행에 주목하였고, 두번째 문제에서는 제도가 본래의 취지대로 시행되었음에도 나타나는 한계, 즉 제도의 본질적 문제를 다루었다. 2절에서는 해외 국가들의 의약품 약국외 판매 사례를 알아보았다 영국, 스웨덴, 일본을 비롯한 국가들의 차별화된 제도적 특징에 대한 조사 바탕으로 개선 방안 수립에 참고할 수 있는 아이디어를 얻고자 하였다. 3절에서는 2절의 의약품 약국외 판매 해외 사례를 참고하여 1절에서 명시한 국내 제도의 문제점에 대한 개선방안을 네 가지로 구분하여 제시하였다. 본 연구에서는 국내 안전상비의약품 약국외 판매 제도의 구체적 내용과 시행 현황을 객관적으로 파악하기 위해 법령을 조사하고, 보건복지부, 건강보험심사평가원, 대한약사회, 한국보건사회연구원 등의 보고서와 통계자료를 분석하였다 또한, 국내에서 시행되고 있는 제도의 문제점을 파악하기 위해 여러 국내 학술 논문과 인터넷 기사를 조사하였다 의약품 약국외 판매와 관련된 해외 제도 분석을 위해 해외 법령 및 국내외 학술 논문을 조사하였다 이를 바탕으로 국내 안전상비의약품 약국외 판매 제도의 개선 방안을 제시하였다. 제 2 장 본론 제 1 절 국내 안전상비의약품 약국외 판매 제도의 문제점 1. 제도 시행 상의 문제 1.1. 판매자의 안전상비의약품 약국외 판매 제도 미준수 약사법 및 약사법 시행규칙에 안전상비의약품 관리가 명시되어 있음에도 불구하고, 현장에서는 준수사항이 잘 지켜지지 않는 것이 현실이다 안전상비의약품 관리 소홀을 보여주는 대표적인 예가 2013년 어린이타이레놀현탁액 회수 조치 문제이다 식품의약품안전처는 주성분 함량 초과를 이유로 2013년 4월 26일 어린이타이레놀현탁액에 대해 강제 회수 폐기 명령을 내렸다 (황재용, 2013). 이에 따라 한국얀센은 5일 이내에 회수계획서 제출 후, 회수 시작일로부터 30일 이내에 회수를 완료해야 했다 (황재용, 2013). 그러나 녹색소비자연대의 조사 결과에 따르면 20 13년 7월말까지도 조사 대상 업소 중 25.7%(125개소)에서 어린이타이레놀현탁액을 그대로 판매하고 있었다 (김지은, 2013). 당시 편의점 본사에서는 POS 장치를 통해 해당
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 115 품목에 대한 판매를 제한하고 반품 조치를 진행하고 있다고 설명했지만, 이러한 조치가 제대로 시행되지 않은 것이다 그림12. 안전상비의약품 판매업소 준수사항 실태조사 안전상비의약품을 판매하는 837개소 업소를 대상으로 조사를 한 결과이다. 업소가 24시간 연중무휴 운영되는지 (24시간 운영), 안전상비의약품 진열상태의 오염 훼손이 없는지 (진열상태), 사용기한을 위반한 품목을 판매하는지 (사용기한), 동일품목을 1회 1개 포장단위만 판매하는지 (포장단위), 안전상비의약품 외 의약품을 판매하는지 (안전상비의약품외), 안전상비의약품 가격표시를 게시했는지 (가격표시), 안전상비의약품 사용상 주의사항을 게시했는지 (주의사항), 안전상비의약품 판매자등록증을 게시했는지(판매자등록증)을 조사하였다 (대한약사회 & 의약품정책연구소, 2018) 그림 4를 통해서도 안전상비의약품 관리가 완벽히 이루어지지 않고 있다는 것을 알 수 있다. 대한약사회 & 의약품정책연구소(2018)에 따르면, 조사 대상 업소 중 1.8%(15 개소)는 사용기한을 넘긴 안전상비의약품을 판매하였다. 또한, 3.1%(26개소)는 안전상비의약품에 먼지가 쌓이거나, 안전상비의약품의 포장이 찌그러지게 방치하는 등 진열상태를 제대로 관리하지 않았다. 안전상비의약품 관리 외의 규정들도 지켜지지 않는 경우가 많았다. 안전상비의약품 판매자등록증 게시, 안전상비의약품 사용상 주의사항 게시, 안전상비의약품 가격표시 게시, 동일품목 1회 1개 포장단위 판매의 경우 미준수 비율이 상당히 높았다 (그림 4). 특히 의약품 오남용 방지와 직결된 동일품목 1회 1개 포장단위 판매를 준수하는 업소가 29.3%(245개소)에 불과하다는 것은 주목할 만한 사항이다. 이 외에도 24시간 연중무휴 운영하지 않는 업소가 6.5%(54개소), 안전상비의약품 외 의약품을 판매하는 업소가 0.4% (3개소)였다.
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 116 그림13 응답자에 따른 안전상비의약품 교육 여부 편의점주와 종업원을 대상으로 안전상비의약품 교육을 이수했는지 조사한 결과이다 각 조사대상에서 2013년 조사 결과는 위쪽, 2016년 조사 결과는 아래쪽에 위치한다 (최상은 외, 201 6) 약사법 제44조의3에 따르면 안전상비의약품 판매자는 안전상비의약품의 안전성 확보 및 품질관리에 관한 교육을 사전에 받아야 한다 (약사법, 2022). 그러나 2016년 조사 결과 편의점주의 2.2%, 종업원의 29.3%는 안전상비의약품 관련 교육을 받지 않은 것으로 드러났다 (최상은 외, 2016). 특히 안전상비의약품 제도가 시행된 직후와 비교했을 때, 시간이 지날수록 교육을 이수하지 않은 비율이 늘어나는 것을 볼 수 있다 (그림 5). 같은 년도의 또 다른 연구에서는 편의점 아르바이트의 26.9%만이 안전상비의약품 관련 교육을 받은 것으로 나타났다. 그 중에서도 재고관리 및 폐기 교육은 전혀 수행되지 않았다 (김보환, 2016). 이를 통해 안전상비의약품 판매자, 그 중에서도 종업원에 대한 교육이 제대로 이루어지지 않고 있다고 판단할 수 있다. 이처럼 안전상비의약품 제도가 제대로 준수되지 않는 원인 중 하나로 단속 및 점검의 미비를 꼽을 수 있다. 2012년 제도 첫 시행 당시 정부는 편의점 취급 외 품목을 취급하거나 무자격자가 안전상비의약품을 판매하는 사례에 대해 강력한 현장점검 및 단속을 실시할 것이라고 예고했다 (김원종, 2012). 그러나 제도 시행 이후 많은 지차체들은 판매자의 자율점검에 의존하였고, 단속으로 인한 행정 처분을 받을 가능성이 희박하다는 점은 제도 준수에 대한 의지를 떨어뜨리는 요인으로 작용하였을 것이다. 1.2. 품목 조정 논의에 대한 정부의 소극적 태도 안전상비의약품 약국외 판매 제도의 시작과 함께 선정된 13개의 안전상비의약품 품목은 제도가 시행된 2012년 11월 이후로 변하지 않았다. 약사법 시행규칙 제19조에 따르면, 보건복지부장관은 약사법 제44조의2제1항에 따라 안전상비의약품을 정하여 고시할 때 보건의료 또는 약사(藥事)에 관한 학식 및 경험이 풍부한 사람, 공익을 대표하는 사람 등의 의견을 들을 수 있다 (약사법 시행규칙, 2022). 이에 따라 보건복지부는 2012년 7월 5일 안전상비의약품 지정심의위원회를 열어 안전상비의약품
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 117 품목을 결정하였다 약사법 제44조를 보면 안전상비의약품 선정에는 성분, 부작용, 함량, 제형, 인지도, 구매의 편의성 등이 고려되었음을 알 수 있다 (약사법, 2022). 특히 인지도가 크게 고려되었는데, 이는 소비자들이 의약품에 대한 정보를 스스로 알고 선택할 수 있도록 하기 위함이었다 (보건복지부, 2012b). 안전상비의약품 품목 재조정에 관한 논의는 제도 시행 초기부터 언급되었다 (보건복지부, 2012b). 보건복지부는 안전상비의약품 지정심의위원회의 의견에 따라 제도 시행 6개월 후 소비자들의 안전상비의약품 사용실태 등을 점검하고, 시행 1년 후 품목을 재조정하기로 결정했다 (보건복지부, 2012a). 또한 추후에도 안전상비의약품 품목 조정을 위한 검토와 논의를 지속해 나가기로 하였다. 정부가 안전상비의약품 품목 선정 및 조정에 대한 논의의 필요성을 이미 인지하고 있던 것이다. 그러나 약 3년 후 이루어진 정부 주도 연구에서 품목 조정 및 검토와 관련한 규정의 부재가 제도의 문제점으로 꼽힌 것은 주목할 만하다 (최상은 외, 2016). 비슷한 시기인 2016년 8월에 안전상비의약품 지정에 관한 고시가 시행되었다 (안전상비의약품 지정에 관한 고시, 2016). 해당 고시는 안전상비의약품의 품목을 정하고, 지정된 안전상비의약품을 고시하는 것을 목적으로 한다 제3조에 이 고시에 대하여 2016년 1월 1일을 기준으로 매 3년이 되는 시점(매 3년째의 12월 31일까지를 의미한다)마다 그 타당성을 검토하여 개선 등의 조치를 취해야 한다고 명시되어 있다 (안전상비의약품 지정에 관한 고시, 2016). 이에 기반하여 안전상비의약품 지정심의위원회는 총 6회에 걸쳐 안전상비의약품 품목조정에 대해 심의하였다. 아쉬운 점은 이러한 정부 차원의 품목 재조정 논의가 제도 시행 시작 약 5년이 지난 후인 2017 년이 되어서야 진행된 것이다. 안전상비의약품 품목조정 심의 날짜 및 회의 결과는 표 1 에 나타나 있다. 표1 안전상비의약품 지정심의위원회 회의 결과 회차 및 날짜 회의 결과 제1차 (2017 03 15) 안전상비의약품 품목조정에 대한 위원별 입장을 서로 공유함 해외 사례, 부작용 보고 자료 등 향후 품목조정 심의를 위한 위원별 추가 자료 요청이 있었음 제2차 (2017 04 21) 해열진통제, 감기약, 소화제, 파스 등 4개 효능군으로 구성되어 있는 현행 안전상비의약품에 대해서 효능군을 그대로 유지하는 방안을 논의함. 설문조사(안전상비약품 제도개선방안 검토를 위한 기초연구(고려대 최상은 교수, ’16.6˜11월)로 나타난 소비자 요구 효능군을 대상으로 보건복지부가 안전성 검토와 해외사례 조사 등을 실시하고, 신규 추가를 검토할 수 있는 휴능군을 위원회에서 다시 논의키로 함. 제3차 (2017 08 30) 설문조사에서 제시된 소비자 요구 효능군 중에서 우선적으로 제산제, 지사제, 항히스타민제, 화상연고를 대상으로 안전성과 해외사례 등을 심도있게 검토하고, 위원별 입장을 공유함 제4차 (2017 10 23) 지난 제3차 회의에 이어 제산제, 지사제, 항히스타민제, 화상연고를 대상으로 의약품 안전성과 접근성 등을 심도 깊게 검토함 제5차 (2017 12 04) 그간 1차부터 4차까지의 회의 결과를 바탕으로 정부에 건의할 안전상비의약품 품목조정(안) 등에 대한 논의를 하였으나, 위원회의 단일 의견을 정리할 필요가 있어 추가적으로 회의를 개최키로 함
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 118 제6차 (2018 08 08) 제산제 효능군, 지사제 효능군에 대하여 추가가 필요하다는 것으로 나옴. 개별 품목 선정과 관련하여 안전상비의약품 안전성 기준의 적합 여부등을 차후에 검토하기로 함 안전성 기준은 의약전문가의 검토를 받아 정하기로 함 기존의 품목선정 안건(제산제, 지사제 신규지정 및 소화제 2품목 지정해제) 대한약사회의 타이레놀 500mg 제외 제안 등 (보건복지부, 2017~2018) 별다른 성과를 내지 못한 2018년 8월 8일 제6차 회의를 끝으로 현재까지 안전상비의약품 지정심의위원회는 심의를 진행하지 않았다. 이는 안전상비의약품 지정에 관한 고시 제3조를 위배한다는 점에서 문제가 된다. 제도 첫 시행 당시 선정한 13개의 품목이 여전히 국민의 편의성이라는 제도 시행 목적에 부합하는지, 부작용, 인지도, 공급량 등의 안전상비의약품 선정기준에 부합하는지, 소비자 요구 품목 중 선정기준에 부합하는 다른 의약품은 없는지 검토할 필요가 있다. 그러나 안전상비의약품 지정심의위원회가 정상적으로 작동하지 않는다면 검토 자체가 불가능해진다. 또한 안전상비의약품 약국외 판매 제도 시행 이후 점차 규모가 커진 의약품 시장에서, 현재의 안전상비의약품 품목은 특혜 의혹을 낳을 수 있다는 시각도 존재한다 (최상은 외, 201 6). 따라서 제도 시행 취지와 현시대의 사회적 요구를 만족시키기 위해 정부의 보다 적극적인 논의가 필요하다. 2. 제도의 본질적 문제 2.1. 안전상비의약품 판매자에 대한 교육 부실 약사법 시행규칙 제26조에 따르면 안전상비의약품 판매자 교육은 집합 또는 사이버 교육의 방식으로 4시간만 진행하면 된다. 교육에는 안전상비의약품의 종류·보관·관리 및 종업원 감독, 안전상비의약품 판매자의 준수사항, 위해의약품 회수·폐기 절차 및 방법, 의약품 부작용 등의 내용이 포함된다 이와 같이 다양한 분야의 내용을 현재처럼 일회성 교육만으로 습득하기에는 어려움이 있다. 최상은 외 (2016)에 따르면, 편의점주의 안전상비의약품 판매 관련 주의사항 인지율은 100%에 달하지 않는 경우가 많았다 (그림 6). 12세 미만 아동에게는 안전상비의약품 판매가 제한된다는 사항(나이 제한)과 개봉판매가 금지된다는 사항(개봉판매)에 대해서는 모든 편의점주가 인지하는 양상을 보였다 (그래프 윤3). 그러나 가격이 표시되어 있어야 한다는 사항(가격 표시)과 등록증 및 사용상 주의사항을 게시해야 한다는 사항(등록증 외)에 대해서는 각각 99.2%, 95.2%의 인지율을 보였다. 준수되지 않을 경우 의약품 오남용으로 이어질 수 있는 안전상비의약품별 1회 1개 포장단위 판매(포장단위)의 경우 95.2%의 인지율을 보였다 소비자의 부작용 신고 시 의사 또는 약사에게 문의하도록 안내해야 한다는 사항(부작용) 에 대해서는 94.4%의 편의점주만이 인지하였다. 소비자의 증상을 듣고 안전상비의약품을 추천하는 행위 또는 안전상비의약품의 효능·효과를 안내하는 행위가 제한된다는 사항 (추천/안내)에 대해서는 91.2%의 가장 낮은 인지율을 보였다
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 119 그림 14 응답자에 따른 안전상비의약품 판매 관련 주의사항 인지 여부 편의점주와 종업원을 대상으로 안전상비의약품 판매 주의사항을 인지하고 있는지 조사한 결과이다 '12세 미만 아동은 안전상비의약품 판매가 제한된다' (나이 제한), '개봉판매가 금지된다' (개봉판매), '가격이 표시되어 있어야 한다' (가격 표시), '안전상비의약품별 1회 1개 포장단위만 판매해야 한다' (포장단위), '부작용 신고 시 의사 또는 약사에게 문의하도록 안내해야 한다' (부작용), '등록증 및 사용상 주의사항을 게시해야 한다' (등록증 외), ' 안전상비의약품을 추천하거나 효능 효과를 안내하는 행위는 제한한다' (추천/안내)의 항목을 인지하고 있는지 조사하였다 (최상은 외, 2016). 판매자로 등록되지 않는 편의점 종업원의 경우 교육을 받을 법적 의무 없이 자발적인 참여로 교육이 이루어지기 때문에 더욱 심각한 상황이다 그림 6을 보면 편의점주에 비해 종업원의 주의사항 인지율이 낮은 것을 확인할 수 있다 '나이 제한'에 대해서는 86.7%의 종업원이 인지하였고, '개봉판매'에 대해서는 87.3%의 종업원이 인지하였다 '가격 표시'와 '포장단위'에 대한 종업원의 인지율은 각각 81.6%와 78.5% 였다 '부작용'과 '등록증 외'에 대해서는 상대적으로 인지율이 낮았다 특히 '추천/ 안내'에 대한 인지율이 낮았는데, 이 경우 62.7%의 종업원만이 인지하는 것으로 나타났다 약사법 제44조의4에 안전상비의약품 판매자가 종업원을 철저히 감독해야 한다고 명시되어 있지만, 대부분의 편의점 종업원은 근속기간이 짧고 근무시간도 일정하지 않기 때문에 판매자에 의한 감독 및 교육이 제대로 이루어지지 않는 것으로 보인다 (김보환, 2016). 소비자들 또한 안전상비의약품 판매자에 대한 교육이 충분하지 않다는 것을 인지하고 있다. 2013년 보건사회연구원의 설문조사 결과, 안전상비의약품 제도 정착을 위한 보완점으로 ‘판매자에 대한 안전조치 강화’가 39 9%의 가장 높은 비율을 차지했다 (이상영, 윤강재 & 이정아, 2013). 2017년에 시행된 소비자 통계조사 결과도 이와 유사하다. 고대균 & 여정성(2017)에 따르면 안전상비의약품 제도의 보완점으로 ‘판매자 안전조치 강화’가 28 8%의 가장 높은 빈도로 나타났다
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 120 2.2. 안전상비의약품 분류 체계의 한계점 안전상비의약품 선정 기준 중 하나인 인지도는 추후 품목 재조정 과정에서 논란을 일으킬 가능성이 있다. 동일한 성분과 효능을 가진 의약품임에도 불구하고, 단순 인지도의 문제로 선정되지 못한 품목들이 존재하기 때문이다 (윤해진 & 명순구, 2018). 대부분의 안전상비의약품이 단일 성분으로 구성되어 있다는 점을 고려하면, 현재의 품목이 고유의 역할을 하는지에 대해서 의문일 수밖에 없다 (황재선, 2022). 이는 안전상비의약품 품목에 포함되지 않은 의약품에 대한 수요가 계속해서 존재해왔다는 사실을 통해 짐작 가능하다 (최상은 외, 2016). 또한, 안전상비의약품 품목 수가 부족하므로 확대해야 한다는 의견을 낸 응답자가 전체의 43.4%나 되는 것으로 드러났다 (최상은 외, 2016). 품목 수 확대 의견을 가진 응답자 중 ‘다른 치료목적의 의약품을 추가해야 한다’는 40.2%, ‘현재 안전상비의약품과 동일한 치료목적을 갖지만 제품을 다양하게 해야 한다’는 11.7%, ‘두 가지 모두 필요하다’는 47.6%로 조사되었다 (최상은 외, 2016). 그러나 현재는 안전상비의약품 품목을 20개로 제한하고 있어 동일한 효능을 가진 의약품을 모두 선정할 수 없다는 걸림돌이 있으므로 (약사법, 2022), 이를 위한 법률 개정안이 마련될 필요가 있다. 제 2 절 의약품 약국외 판매 해외 사례 제 2 절에서 다루게 될 의약품 약국외 판매 해외 사례는 아래 표 2에 나타내었다 이때 OTC는 ‘Over the counter’를 의미하며, OTC의약품의 경우 의사의 처방전 없이 구입할 수 있다 표2. 의약품 약국외 판매 해외 사례 요약 국가 약국외 판매 의약품 명칭 의약품 약국외 판매 제도 특징 영국 자유판매용 의약품 (GSL) 규제 다수 철폐 의약품재분류 제도 스웨덴 OTC의약품 다양한 규제 존재 일본 제2류 의약품 제3류 의약품 등록판매자 제도 기타 프랑스 존재하지 않음 의약품 약국외 판매 엄격히 금지 스위스 OTC의약품 세분화된 의약품 분류 기준 및 drogisten 덴마크 OTC의약품 OTC의약품 자체를 세분화
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 121 1. 영국 1.1. 해당 국가 선정 이유 본 고에서는 (1) OTC의약품 약국외 판매 제도 시행기간에 따른 정책적 안정성, (2) 국내와 유사한 의약품분류체계, (3) 비슷하지만 정책의 기조가 다른 의약품재분류 제도를 이유로 영국을 선정하였다. 1.2. 해당 국가 정책 도입 시기 및 이유 영국은 The Medicines Act 1968와 The Humans Medicines Regulations 2012를 통해 OTC 의약품 약국외 판매를 제정하고 있다 (Lind et al., 2016). 이에 따라 유럽국가들 중 OT C의약품 약국외 판매 제도를 비교적 오랫동안 운용한 베테랑 국가에 속한다 (Lind et a l., 2016, as cited in 한국보건사회연구원, 2018). 제도가 처음 도입됐을 때와 비교하면 현재 규제가 많이 철폐되어 있는데, 이는 다른 국가에 비해 시장이 성숙해진 결과로 볼 수 있다 (Lind et al., 2016). 또한 안전성을 주된 판단 기준으로 삼는 의약품재분류 제도를 운용하고 있다 (MHRA, 2022a). 의약품재분류 제도는 의약품의 접근성을 최대화하되 부적절한 사용으로 인한 위험성은 최소화하는 것을 목적으로 한다 (MHRA, 2022a). 1.3. 해당 국가 정책 정리 1.3.1 의약품 분류 및 약국외 판매 의약품 선정 기준 영국의 의약품은 처방여부에 따라 처방용의약품(POM; Prescription only medicine) 과 OTC의약품으로 나눌 수 있다 (MHRA, 2022a). OTC의약품은 판매 장소 및 판매 주체에 따라 약국에서 약사에 의해 판매 가능한 약국판매용 의약품(P; Pharmacy medicines)과 편의점 등에서도 전문가의 조언없이 널리 판매할 수 있는 자유판매용 의약품(GSL; Gener al sales list medicines)으로 나눌 수 있다 (MHRA, 2022a; 한국보건사회연구원, 2018). 각 분류에 대한 추가적인 설명은 아래 표 3에 나타내었다. 표3 영국의 의약품 분류 기준 처방용 의약품 (POM; prescription only medicine) 약국판매용 의약품 (P; pharmacy medicines) 자유판매용 의약품 (GSL; general sales list medicines) 정의 의사의 처방전에 의해서만 약국에서 조제 또는 판매할 수 있는 의약품 약사에 의해서만 약국에서 판매할 수 있는 의약품 약국이나 편의점에서 판매할 수 있는 의약품
어느 정도 안전성이
안전성이 인정되어 약사가
확보되었지만 효과 및 포장량 기준으로 약사가
판매 및 감독할 필요성이 있는 의약품
3) 약물의 작용 또는 부작용에 대한 추가적 조사가 필요한 경우
4) 의사나 치과의사에 의하여 주사제로 투여되는 경우
판매를 감독할 필요가 없 외, 2016, p 47)
1.3.2. 자유판매용 의약품 약국외 판매 관련 법률과 규제 정리 자유판매용 의약품은 대중의 접근을 배제하기 위해 잠긴 장소 또는 자동 판매기 내에 보관되어야 하며, 반드시 원본 포장으로만 판매되어야 한다 (The Stationery Offic e, 2020a). 필수 구비 품목에 대한 규정이 없으므로 판매처들은 자유판매용 의약품을 자유롭게 선택하여 판매할 수 있지만, 포장량, 유효성분의 강도, 투약단위 등에 대한 제한이 있다 (Lind et al., 2016, as cited in 한국보건사회연구원, 2018). 특히 Aloxip rin, Aspirin, Paracetamol을 유효성분으로 포함하는 의약품에 대하여 제형, 제형 별 유효성분의 강도와 최대 포장량을 엄격히 제한하고 있으며 Paracetamol 액상제제는 연령에 따른 유효용량도 제한하고 있다 (The Stationery Office, 2020a, as cited in Ol eszkiewicz et al., 2021). Ibuprofen을 유효성분으로 포함하는 경우도 제형과 그에 따른 최대 포장량을 제한하고 있다
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 122 분류 기준 다음의 항목 중 하나 이상에 해당되는 의약품 1) 의사의 감독 없이 사용하면 건강에 직접적, 간접적 위험을 초래할 수 있는 경우 2) 빈번하게 오용되어 건강에 직접적, 간접적 위험을 초래하는 경우
는 의약품 전문가 조언 없이 사용하여 발생 가능한 위험성보다 구입의 편리성이 더 중요한 경우 자유 판매약으로 분류 판매장소 약국 (처방전 필요) 약국 약국 및 편의점 등 목록 http://www medicines org uk/emc 예외상황 동일성분이라 하더라도 최대 1회 투여량이나 최대 1일 용량, 단위함량, 제형, 포장 등에 따라 비처방약이 될 수도 있으며 처방약 성분이라도 처방약으로서의 사용조건 범위에 해당되지 않으면 약국약으로 분류됨 (최상은
(The Stationery Office, 2020a). 그러나 GSL 약국외 판매자의 정보 제공 제한, 판매 연령 제한과 관련 푯말(Signpost) 표시, 배송 확인 방법, 판매 통계 보고 등에 대해서는 규제하고 있지 않다 (Lind et al., 2016). 자유판매용 의약품 약국외 판매 관련하여 법률에서 규제하거나, 규제하지 않는 항목들은 아래 표 4에 나타내었다. 표4 영국의 자유판매용 의약품 약국외 판매 관련 규제 및 규제하지 않는 항목 정리 규제 항목 규제하지 않는 항목 보관 조건, 원본 포장, 판매 제한 조건 (포장량/유효성분의 강도/투약 단위) 등 필수 구비 품목, 정보 제공, 판매 연령 제한 및 관련 푯말, 배송 확인 방법, 판매 통계 보고 등
MHRA는 재분류된 의약품에 대하여 재분류 일자, 재분류 유형, 상품명, 유효성분, 용량, 제형, 적응증 등을 기술한 표를 6개월 마다 업데이트 하며, 현재 2022년 3월 31 일자로 업데이트된 파일이 최종본이다 (MHRA, 2022b). 1991년부터 2015년까지는 적응증 확대, 포장량
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 123 1.3.3. 의약품재분류 제도 2002년 영국의 규제당국인 Medicines and Healthcare products Regulatory Agency(M HRA)가 주도한 법률 개정을 통해 판매 허가 수정만으로도 특정 품목의 의약품재분류가 가능해졌다 (MHRA, 2014). 이는 국민건강보호 목적 하에 의약품분류변경 절차를 신속• 투명하게 진행함으로써 적절한 안전성 증거가 있는 일반의약품을 광범위하게 도입하고자 진행되었다 (최상은 외, 2016). 의약품 시판 허가는 5년간 유효하므로, 개별 의약품의 분류는 5년마다 재평가된다 (최상은 외, 2016). 일반적으로 의약품은 최초 허가 시 처방용의약품으로 분류되는데, 적절한 안전성 증거가 있다면 약국판매용 의약품으로 재분류될 수 있으며, 약국판매용 의약품도 같은 맥락에서 자유판매용 의약품으로 재분류가 가능하다 (최상은 외, 2016). 반대로 자유판매용 의약품을 약사의 확인 없이 사용 시 안전성이 보장될 수 없다면 약국판매용 의약품으로 재분류될 수 있으며, 약국판매용 의약품도 새로운 위험성이 확인될 경우 처방용의약품으로 재분류될 수 있다 (최상은 외, 2016). 의약품 분류 변경을 뒷받침하는 적절한 안전성 증거로는 임상 시험 결과, 수용가능한 수준의 부작용을 분별할 수 있을 만큼의 광범위한 임상적 사용, 보건의료 전문가의 조언 및 견해, 의약품 사용 관련 공공단체 및 개인의 견해까지 모두 아우를 수 있다 (MHRA, 2022a). 의약품재분류는 Major, Standard, Simple로 구분할 수 있다 Major는 기존 제품의 치료 분류 또는 치료 대상을 변경하는 재분류로, 반드시 전문가 위원회에게 자문을 받아야 한다 (MHRA, 2022a). Standard는 반드시 전문가 위원회에게 자문을 받을 필요는 없는 재분류로, 기존에 약국판매용 의약품 또는 자유판매용 의약품으로 분류된 의약품의 포장량을 증가시키는 것 등이 해당된다 (MHRA, 2022a). Simple은 재분류 전례가 있는 제네릭의약품에 기반하는 재분류이다 (MHRA, 2022a).
확대, 용량 확대 등의 추가적인 확장을 제외한 최초의 재분류에 대해서만 기술해두었고, 2016년 이후로는 제네릭의약품을 제외한 Major와 Standard 재분류에 대해 모두 기술해두었다. 2015년을 기점으로 전후의 재분류 유형, 유효성분 종류에 따라 분류해보았고 그 결과를 아래 표 5에 나타내었다 표5. 1991년부터 2022년 3월 31일까지 영국의 의약품재분류 현황 POM to P P to GSL POM to GSL 유효성분 종류 1991 2015 59 35 0 73 2016~2022.03.31 20 16 3 29 계 79 51 3 133
POM to P로 재분류되고 시간이 흘러 P to GSL로 추가 재분류된 경우도 있다. 예를 들어, 유효성분 Hyoscine butyl bromide는 1991년 POM to P으로 재분류되었으며, 2004년 IBS로 진단된 환자의 위장관 연축 완화 적응증에 대하여 P to GSL로 재분류되었다. 또한, 유효성분이 동일해도 적응증이 다르면 의약품 재분류를 별도로 수행하기 스웨덴은 Act (2009:730) (일부 비처방의약품의 판매에 관한 법령)과 Ordinance (20 09:929) (일부 비처방의약품의 판매에 관한 조례)가 제정된 이래 OTC의약품의 약국외 판매를 시작하였다 (Lind et al., 2016). 관련 법률들은 OTC의약품의 접근성 증가 및 경쟁 촉진을 통한 가격 조절 목적으로 도입되었다 (Ministry of Health and Social Affa irs, 2008, as cited in Håkonsen et al., 2016). 스웨덴은 유럽국가들 중 비교적 최근인 2009년에 OTC의약품의 약국외 판매 제도가 시행되었다 (Lind et al., 2016, as cited in 한국보건사회연구원, 2018). 스웨덴의 규제당국인 Swedish Medical Products Agency(MPA)는 영국의 규제당국인 MHRA보다 규제를 광범위하면서도 세세하게 두고 있으며, OTC의약품 약국외 판매처들의 의무에 대하여 서술하는 경우가 많다 (Lind et al., 2016). 스웨덴은 영국에
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 124 재분류 유형은 처방용 의약품에서 약국판매용 의약품으로(POM to P), 약국판매용 의약품에서 자유판매용 의약품으로(P to GSL), 처방용 의약품에서 자유판매용 의약품으로(POM to GSL)로 나눠진다
때문에 유효성분 종류보다 실제 의약품재분류 건수가 더 많다. 2. 스웨덴 2.1. 해당 국가 선정 이유 본 고에서는 (1) OTC의약품 약국외 판매 제도 시행 시점의 유사성, (2) 안전성을 목적으로 하는 규제의 다양성, (3) 의회의 법률 도입 근거를 다룬 문서 존재를 이유로 스웨덴을 선정하였다 2.2. 해당 국가 정책 도입 시기 및 이유
비해 비교적 최근에 제도가 도입된 신입 국가이다 이에 따라 OTC의약품 약국외 판매 제도가 시행되었음에도 불구하고 OTC의약품의 판매가 국가의 통제에서 완전히 자유롭지 못하는 모습이 보이며, 국가가 안전성에 관하여 보수적인 입장을 고수하고 있다는 시각이 존재한다 (Lind et al., 2016). 2.3. 해당 국가 정책 정리 2.3.1. 의약품 분류 스웨덴의 의약품은 처방여부에 따라 처방의약품과 비처방의약품으로 나눌 수 있으며, 비처방의약품은 오프라인 판매 장소에 따라 약국 내에서만 판매가능한 약국판매 가능 비처방의약품과 약국, 약국외 판매처 판매 가능 비처방의약품으로 분류할 수 있다 (Vogler et al., 2012, as cited in 한국보건사회연구원, 2018). 이는 아래 표 6에 나타내었다
b 의약품을 사용하는 동안 심각한 부작용이 물어야(rare) 한다 환자의 안전성과 공공 보건 보호 관점에 적합해야 한다. 원칙 (Principle) 기준 c의 해석 보충 시간적 측면 부작용 오남용 내성 유발 처방 의약품 위조 세 기준 중
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 125 표6. 스웨덴 의약품의 처방 여부 및 오프라인 판매 장소에 따른 분류 처방여부 오프라인 판매 장소 처방의약품 (POM; Prescription Only Medicine) 약국 내 비처방의약품 (NPM; Non Prescription Medicine 또는 OTC; Over the counter Medicine) 약국 내. (Pharmacy Only) 약국 내 또는 약국외 판매 모두 가능 (General sale medicine) 2.3.2. 약국외 판매 의약품 선정 기준 MPA는 약국외 판매 가능한 OTC의약품 선정 기준을 크게 3가지로 분류하고 있으며 (M PA, 2020a), 이는 아래 표 7에 나타내었다. 표7 MPA의 약국외 판매 가능한 OTC의약품 선정 기준(Criteria)과 원칙(Principle) 기준 (Criteria) a 의약품은 자가투약(self medication)에 적합해야 한다.
드
c
기준 a)와 b)는 반드시 충족시켜야 하며, 기준 c)는 해석의 여지가 있다 따라서 기준 c)의 해석을 명확히 하고자 6가지 원칙이 부가적으로 존재한다 (MPA, 2020a). MPA는 현재 판매 중인 약국외 판매 가능 OTC의약품의 용도, 제품번호, 상품명, 용량, 제형, 포장 내 최대 개수, 유효성분, ATC코드 등을 기술한 표를 웹사이트에 고시해 두었다 (MPA, 2022a). 단, 의약품이 허가되었으며 해당 표에 고시되어 있더라도 당국의 시장 판매 결정에 따라 스웨덴 시장에서 이용할 수 없는 경우도 있다 (MPA, 2022 b). 이에 해당되는 의약품 중 하나가 Paracetamol이다 Paracetamol은 유효성분으로써 약국외 판매 가능한 OTC의약품 목록에 고시되어 있다 그러나 250 mg 정제, 500 mg 정제, 250 mg 장용정, 500 mg 장용정 등 일부 제형은 안전성 관점에서 Paracetamol의 간독성을 고려하여 약국 내에서만 판매하도록 MPA가 규제하였다 (MPA, 2018a). 2.3.3. OTC의약품 약국외 판매 관련 법률 및 규제 정리 스웨덴의 OTC의약품 약국외 판매 관련 정책은 (한국보건사회연구원, 2018)과 (Lind et al., 2016)의 분류를 참조하여 스웨덴의 Act (2009:730)과 Ordinance (2009:929), Re
자체 실사 프로그램 다양한 규제 항목을 포함하는 자체 실사 프로그램을 운용해야 하며, 수행 기록을 문서화해야 한다 자체 실사 프로그램은 다음과 같은 내용을 포함해야 한다. ※ 중요한 변화의 통지 방법, 의약품 구매 보증 방법, 택배 수령과 확인, 의약품 전시 및 보관 방법, 의약품 공급 방법, 의약품 판매 제한 시 처리
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 126 gulation (LVFS 2009:20) 및 그 외 MPA 웹사이트 고시 내용을 관련이 있는 제도끼리 재구성하여 아래 표 8에 나타내었다 표8. OTC의약품 약국외 판매 관련 법률 및 규제 항목 정리 규제 항목 내용 연령 제한 18세 미만에게 니코틴의약품을 포함하는 OTC의약품을 판매해서는 안 된다. 18세 미만을 판매자로 고용해서는 안 된다 판매 장소 주류를 판매하는 곳에서 의약품을 판매해서는 안 되나, 니코틴의약품 판매는 예외이다 추적성(Traceability) 사업자는 의약품 조달 관련 모든 내용을 문서화해야 한다. 해당 문서는 다음과 같은 내용을 포함해야 한다 ※ 의약품 도착 날짜, 포장 수, 포장량, 상품명, 제형, 용량, 사업자에게 의약품을 판매한 자의 이름과 주소 불만사항, 철회 관련 모든 처리와 조치 관련 내용을 문서화해야 한다 해당 문서는 폐기, 파괴, 기타 이유로 회수된 의약품에 대해서도 작성해야 한다 위 두 문서는 분실 및 파괴 위험이 없도록 보관하며, 관리감독과 통제를 위해 3년 간 의무적으로 보관해야 한다 통계 수집 E Health당국에 판매 지점별, 개별 판매 거래 별 통계를 달이 바뀌고 7일 이내에 전자적으로 보고해야 한다 통계 보고 시에 다음과 같은 내용을 포함해야 한다. ※ 상품명, 제형, 용량, 포장량, pre sold 포장 수, 판매 일자, 판매 가격
방법, 의약품 관련 불만사항/철회 처리 방법, 의약품 환수 후 재배포 제한 및 처리 방법, 문서화 및 문서 보관 방법, 자체 실사 프로그램 운용 및 현행 규제 숙지 여부 확인 방법, 연령 제한 확인 방법, E health 당국에 통계 정보를 제공하는 방법 등 [용어 정의] 철회 사업자로부터 의약품 회수. 원본 포장 제조업자나 판매 허가 보유자에 의해 포장된 의약품의 포장 사업자 OTC의약품의 소매업에 관여하는 사람 불만사항 의약품에서 품질 결함 또는 오차로 의심되는 혐의 (The Swedish Parliament, 2009a; The Swedish Parliament, 2009b; MPA, 2018b) 스웨덴은 Act(2009:730) 제11조에 주류를 판매하는 업소에서 니코틴 제제를 제외한 다른 OTC의약품을 판매해서는 안 된다고 명시하고 있다 (The Swedish Parliament, 2009 a). 소비자가 음주로 인해 취한 경우, 판단력 저하로 인해 합리적인 의약품 구매 결정 능력은 물론 의약품 관련 정보 이해 능력이 감소하게 된다. 또한 아세트아미노펜(Acetam inophen 또는 Paracetamol), 아스피린(Aspirin 또는 Acetylsalicylic acid) 등을 술과
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 127 함께 복용할 경우 건강에 위해를 끼칠 수 있으므로 판매를 제한하고 있다 (Ministry of Health and Social Affairs, 2009). 단, 스웨덴 정부는 주류를 판매하는 업소에서의 OTC 의약품 판매 제한에 불합리한 점이 있을 수 있기에 호텔의 경우를 예로 들어 설명을 보충하고 있다. 호텔 내에 레스토랑처럼 주류판매가 허용되는 장소가 있다 하더라도 지정된 공간 내에서만 주류를 판매한다면, 호텔로비 등과 같이 주류를 판매하지 않는 장소에서는 OTC의약품을 판매할 수 있다고 설명하고 있다 (Ministry of Health and Soci al Affairs, 2009). 3. 일본 3.1. 해당 국가 선정 이유 본 고에서는 (1) 우리나라와 같이 동아시아권에 속하여 문화적 유사성이 있고, 오랜기간 약국외 의약품 판매 제도를 유지하고 있는 점과 (2) 등록판매자 제도 운용을 이유로 일본을 선정하였다. 3.2. 해당 국가 정책 도입 시기 및 이유 일본의 비처방약 소매점 판매는 1998년의 개혁에서 시작되었다. 1994년 체인스토어협회에서 감기약 등의 자유로운 판매를 요구한 것이 그 시작이고, 후생노동성은 처음에는 반대하였으나 경제단체연합과 소비자단체의 연계에 의한 규제완화 촉구에 따라 1998년 15개 품목을 의약부외품으로 전환하여 소매점 판매를 허용하였다 (이상영, 2012). 이후 2004년 당시 일본 총리인 고이즈미가 ‘편리성과 안정성 확보에 대해 연내에 충분히 검토하여 안전상 문제가 없는 의약품에 대해서는 약국 및 약점에 한정하지 않고 판매할 수 있도록 한다’는 내각결의를 통과시켜 의약품의 약국 외 판매를 강력하게 추진함으로써 ‘안전상의 문제가 없는 의약품’을 기준으로 15개 제품군, 371개 품목이 의약부외품으로 분류되는 개혁이 이루어졌다. 그리고 2009년에는 비처방약을 위험정도에 따라 3가지로 분류하고, 등록판매자제도를 신설하여 95%에 해당하는 비처방약을 소매점에서 판매 가능하게 하였다 (이상영, 2012). 2014년에는 의료용과 일반용 의약품으로만 분류되던 2분류 체계에서, 요지도 의약품을 추가하여 3분류 체계로 변화하였다. 3.3. 해당 국가 정책 정리 3.3.1. 의약품 분류 및 약국 외 판매 의약품 선정 기준 일본의 의약품은 우선 의료용 의약품, 요지도 의약품, 일반용 의약품 3가지로 분류되며 아래 표 9에 나타내었다. 의료용 의약품은 의사나 치과의사의 처방이 필요한 의약품, 요지도 의약품은 처방이 필요하진 않지만 안전성의 확보가 완전히 이뤄지지 않았거나 극약이기 때문에 약사의 지도가 필요한 의약품이다. 일반용 의약품은 안전성 확보가 잘 이뤄진 약품들로, 약사만 판매 가능한 제1류 일반용 의약품과 등록판매자도 판매 가능한 제2류, 제3류 일반용 의약품으로 분류되며 이는 표 10에 나타내었다
대면 판매하며 제공한
정보를 기반으로
소비자가 선택하여 이용할 수 있는 의약품
의약품 중에서 효능 효과에
있어서 인체에 대한 작용이
현저하지 않은 것으로서
약제사, 그 밖의 의약
관계자로부터 제공된 정보에
기하여 수요자의 선택에
따라 사용되는 것을
목적으로 하는 것 (전적으로
동물을 위해서 사용되는
것을 목적으로 하는 것은 제외)
분류 기준 제품의 특성에 비추어 사용상
주의가 필요한 의약품(마약, 각성제, 원료, 요지시 약품, 독약, 극약 등)이나 제형,
약리작용 등으로 판단하여
이미 장기간동안 사용되어
의약품에 표시된 용법이나
용량대로 복용하면 그
안전성이 높은 의약품
오남용의 우려가 없는
의약품, 건강의
의사, 치과의사가 직접 사용하거나 이들의 지도· 감독하에서 사용하지 않으면 의료장애를 초래할 우려가 있는 질환을 적 질환이나 적응증에 사용됨
유지증진이나 경미한 질병의
초기 치료 또는 병인이
확실한 만성적 증상의
완화를 목적으로 사용하는 의약품 약국 약국, 점포판매업허가 (최상은 외, 2016)
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 128 표9. 일본의 의약품 분류체계 의료용 의약품 요지도 의약품 일반용 의약품 정의 의사 혹은 치과의사에 의해서 사용되거나 또는 이러한 자의 처방전에 의해서 사용되는 것을 목적으로 하여 공급되는 의약품 후생노동성에서 지정한 의약품으로 처방의약품보다 효과가 크지 않고 약사에 의해
응증으로 갖는 의약품 등 기존의 제1류 일반용 의약품 중 최근에 일반용 의약품으로 분류되었거나 극약에 해당하는 경우 처방은 필요 없지만 약사가 대면판매를 해야 구매 가능 경미한
판매 장소
약국
표10. 일본의 일반용 의약품 분류 의약품 리스크 분류 기준 효능/부작용 등 정보 제공 관련 인력 제1류 일반용 의약품으로 많이 사용되지 않고, 안전성 측면에서 특히 주의가 필요한 성분이 포함되어 있는 것(예: H2 blocker 함유약, 일부 모발용 약) 의무(서면) 구입자가 상담을 요청하는 경우에는 의무 약사 제2류 리스크가 비교적 높은 의약품으로 드물게 입원 동등 이상의 건강 피해를 일으킬 수 있는 성분이 포함된 약(예: 주요감기약, 해열진통약, 위장 진통진경제 등) 노력 의무 약사 또는 등록판매자 제3류 리스크가 비교적 낮은 의약품으로, 일상 생활에 지장을 줄 정도는 아니나 컨디션이 변하거나 나빠질 우려가 있는 성분이 포함된 것(예: 비타민 B/ C 함유약, 주요 정장제, 소화제) 규정 없음 (최상은 외, 2016)
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 129 3.3.2. 등록판매자 제도 일본은 제2류, 제3류 의약품을 약국 외에서 팔 수 있는 자격으로서 등록판매자 제도를 운영하고 있다. 등록판매자 제도는 약사만 약을 판매할 수 있다는 규제를 완화하는 것으로 볼 수도 있지만, 약물을 판매할 때 요건을 만족한 사람이 상주하게 하여 전문가가 항시 관여하게 끔하는 규제를 강화하는 측면으로도 볼 수 있다 (이승탁, 2009). 등록판매자가 되기 위해서는 일본 각지의 도도부현에서 실시하는 시험을 봐야하는데, 시험의 응시를 위해서는 고졸 이상이며 약품을 판매하는 상점 등에서 실무를 경험한 자여야 한다는 조건이 있다 (박실비아, 2018). 등록판매자 자격시험은 5 과목(의약품의 공통 속성과 기본적 지식, 인체의 기능과 의약품, 주요 의약품과 작용, 의약품 업무에 관한 법규와 제도, 의약품의 적정한 사용과 안전대책) 총 120문제로 이뤄져 있으며, 합격조건은 70% 이상의 문제를 맞추는 것(84개 이상)이고, 각 과목마다 35% 혹은 40% 이상의 문제를 맞추는 것이다. 최근의 합격률은 약 50%로, 2021년(레이와 3년)에는 61,070명이 시험에 응시하여 30,082명이 합격하였다 (후생노동성, 2022). 등록판매자는 합격 이후에도 「등록 판매자 자질 향상을 위한 외부 연수에 관한 지침(약국 개설자 및 점포 판매업자 및 배치 판매업자가 위탁해 실시하는 외부연수에 대해)」에 따라 매년 연수를 받아야 한다 또한 등록판매자는 약사와는 다른 자격이고, 판매물품의 범위가 약사와 다르기 때문에 약사와 구분되어야 한다 이를 위해 약사와 등록판매자는 명찰 등을 다르게 이용하여 구분 가능해야 한다 또한 해당 구별법도 점포 내 보기 쉬운 곳에 게시하여야 한다. 등록판매자는 약물에 관한 사항에 대한 시험을 통과하였고, 약물 판매 관련 업무경험이 있는 만큼 약물의 정보 제공에는 큰 어려움을 겪지는 않는 것으로 보인다 그러나 소비자가 부작용이 생기는 경우, 처방약과 일반약을 병용해야하는 경우, 노인 및 소아의 OTC 사용, 임부 및 수유부의 OTC 약물 사용 등 전문적인 정보의 제공에 대해서 많은 우려를 표하는 것으로 조사되었으며 (Kizaki, 2021, Table5), 이런 경우 약사와의 협력이 필요하다고 응답한 비율도 많았다 (Kizaki, 2021, Table6) (Kizaki, 2021). 또한 만성콩팥병의 일반용 의약품 사용에 관한 비약사 판매원의 지식과 인식을 조사한 결과에서, 콩팥의 기능과 관련된 약물의 사용에 관한 지식뿐만 아니라 콩팥의 기능과 약물의 사용 사이에 연관성이 있다는 사실조차 모르는 경우가 있었다 (Kondo, 2012, Fig 1). 4. 기타 앞서 소개한 영국, 스웨덴, 일본 외에 차별화된 제도적 특징을 갖는 국가로 프랑스, 스위스, 덴마크가 있다. 프랑스는 의약품의 약국외 판매가 엄격하게 금지되어 있는 대표적인 국가로서 의의를 가진다. 프랑스에서는 의약품을 처방약과 비처방약으로 구분하며, OTC 의약품을 포함한 모든 약은 오직 약국에서만 구입이 가능하다 환자들이 스스로의 판단에 따라 약을 선택하여 구입할 수 있는 Self service pharmacies가 보편화되어 있으나, 의약품 구입 전에 약사와의 상담을 의무화하고 있다 (Olivier Lantres, 2022).
A on the basis of a repeat pre scription in the pharmacy 반복 처방되어 리필이 가능한 약들이 이에 해당하며, 약국에서만 조제 및 구입 가능하다.
B without a prescription in th e pharmacy 처방전은 필수가 아니지만 약국에서만 조제 및 구입이 가능하다.
D Without a prescription in a pharmacy or non pharmacy out lets 처방전이 필요하지 않지만 전문가의 지도가 필요한 약들이 이에 해당한다 약국과 약국 외 장소에서도 구입 가능하며, OTC 의약품이 카테고리 D에 해당한다.
E available in non pharmacy ou tlets 별도의 제한 또는 주의사항 없이 구입이 가능하며, 주로 천연물 의약품이 이에 해당한다. 스위스에는 드럭스토어에서 의약품을 판매하는 사람인 ‘drogisten (druggist)’이 존재한다. Drogisten은 약사 (pharmacist)와는 다르나 의약품 판매와 관련된 자격을 갖춘 사람을 말한다. Drogisten은 4년간 약과 관련된 기본적인 지식을 교육받아 고용된다. Drogisten으로서의 자격을 갖추지 않은 개인은 오직 천연물 의약품 (herbal m edicines)만 판매 가능하며, 구체적인 품목은 Swiss Agency for Therapeutic Products 홈페이지에서 확인 가능하다 (Oleszkiewicz et al., 2021). 덴마크의 경우 OTC 의약품 자체를 세분화하였으며, 각 기준에 따른 판매 규정이 구
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 130 스위스의 경우 세분화된 의약품 분류 기준과 의약품 판매 자격을 부여하는 방식이 주목할 만하다. 스위스에서는 의약품을 ‘조제 가능한 장소’와 ‘의약품 조제를 위한 의사의 처방전 필요 여부’에 따라 다섯 개의 카테고리로 분류하며, 자세한 내용은 아래 표 11에 나타내었다 표11. 스위스의 의약품 분류체계 분류체계 설명 A+ only prescription in a pharm acy 처방전이 필요하며 약국에서만 조제 및 구입 가능하다 예로 마약류가 카테고리 A에 해당된다
체화되어 있다는 점이 특징적이다. 덴마크에서는 2001년에 의약품 약국외 판매가 허용되었으며, OTC 의약품의 분류체계는 아래 표 12에 나타내었다. 표12. 덴마크의 OTC의약품 분류체계 분류체계 설명 HF 원하는 만큼 구입이 가능하다 HX 약국 밖에서는 1개의 패키지만 구입이 가능하다 HX18 HX와 동일하지만 18세 이상만 구입 가능한 의약품으로 진통제, 멀미약을 포함한다 HV 동물용의약품이다
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 131 HX, HX18을 보면 Danish Medicines Agency가 특정 성분에 대해서는 약국외 판매 시 하루에 한 사람당 1개의 패키지만 판매하도록 제한하고 있음을 알 수 있다. 제도의 실효성을 확보하고 약의 과다 복용을 방지하기 위해 HX, HX18에 해당하는 약의 경우 최대 포장량이 고정되어 있다 (dispensing group HX or HX18). 패키지가 그 이상의 함량을 갖는 경우에는 dispensing group HA 혹은 B로 분류하며, 약국에서만 판매 가능하도록 제도가 마련되어 있다 (한국보건사회연구원, 2018). 제 3 절 국내 안전상비의약품 약국 외 판매 제도의 개선 방안 1. 안전상비의약품에 대한 규제 강화 2012년 안전상비의약품 약국외 판매 제도가 처음 시행될 당시 정부는 제도를 위반하는 사례에 대한 강력한 현장점검 및 단속을 예고했다 (김원종, 2012). 약사법 제6 9조제1항에 따르면 보건복지부장관, 식품의약품안전처장, 시 도지사, 시장 군수 구청장은 관계 공무원이 안전상비의약품 판매 업소에 출입하여 검사를 하도록 지시할 수 있다 (약사법, 2022). 그러나 이에 대한 구체적인 정보를 담은 약사법 시행규칙이 존재하지 않기 때문에 정부가 예고한 강력한 현장점검은 이루어지지 않는 실정이다 현재처럼 지자체에서 자율 점검표를 배포하는 것만으로는 안전상비의약품 판매자의 준수사항 위반 여부를 파악하기 어렵다 따라서 정기적인 현장점검이 이루어지도록 조항을 추가하고, 준수사항 위배 시 엄격하게 단속하도록 조치할 필요성이 있다 더불어 스웨덴처럼 자체 실사 프로그램을 운영하여 안전상비의약품 판매자 및 종업원이 준수사항에 익숙해지도록 해야 한다 안전상비의약품의 관리, 소비자 부작용 보고 시 행동 수칙 등을 상세히 정하여 이에 따라 안전상비의약품을 판매한다면 제도가 보다 안전하게 운영될 수 있을 것이다 나아가 프로그램 수행내역을 문서화하여 수행 여부, 변동 사항 등을 한 눈에 알 수 있게끔 한다면 안전상비의약품이 체계적으로 관리될 것으로 예상된다. 어린이 타이레놀 현탁액 사건과 같은 문제 발생 시 해당 제품을 빠르게 폐기 처리해야 안전상비의약품으로 인한 부작용을 줄일 수 있다. 스웨덴의 법률에서 착안해 안전상비의약품 도착 날짜, 상품명, 포장 수, 안전상비의약품을 공급한 자의 이름과 주소 등 조달 관련 내용을 문서화한다면 안전상비의약품의 빠른 폐기에 도움을 줄 것이다 약사법 제47조의3제2항에 따르면 의약품 품목허가를 받은 자, 수입자 혹은 의약품 도매상은 의약품관리 종합정보센터에 공급 내역을 제출해야 한다 (약사법, 2022). 안전상비의약품 판매자가 정보를 제공해야 하는 경우는 약사법 제68조의7에 따라 의약품안전관리원장이 요청할 때뿐이다 (약사법, 2022). 제한된 정보만이 수집되는 상황에서 안전상비의약품 판매 현황을 정확히 파악하기란 불가능하다. 판매 현황을 파악해야 제도 개선 시 근거 자료로 사용하거나, 문제 발생 시 빠르게 대처할 수 있다. 따라서 각 판매 업소에서 안전상비의약품 상품명, 판매 일자, 판매 가격 등을 달마다 의약품관리 종합정보센터에 제출하게끔 조항을 추가해야 한다 2. 안전상비의약품 약국외 판매를 위한 자격증 제도 도입방안 현재 국내에서는 안전상비의약품의 판매과정에서 안전성을 확보하고 품질을 관리하기 위해서 안전상비의약품 관련 교육을 진행하고 있다 해당 교육은
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 132 안전상비의약품 판매점의 업주에 대해서만 의무이고 종업원에 있어서는 의무가 아니며, 심지어는 안전상비의약품 판매점주의 교육도 완전히 이뤄지지 않는 점 (대한약사회 & 의약품정책연구소, 2018)을 고려하면 안전상비의약품의 안전성 확보와 품질관리에 관한 사항들이 제대로 지켜지지 않는다는 점을 알 수 있었다 편의점주나 점원이 안전상비의약품 제도를 준수하도록 하기 위해서는 빈도 높은 점검뿐만 아니라, 판매자들의 안전상비의약품제도에 대한 인식을 높이는 것도 중요한데, 인식을 높이기 위해 간단한 시험 제도를 도입할 수 있을 것이다. 단순한 교육이수가 아니라, 시험을 통해 안전상비의약품을 판매하고자 하는 자가 관련된 지식을 충분히 인지하고 있는지 검증한 뒤 의약품을 판매할 수 있도록 하는 것이다. 시험의 방식으로는 간단한 방식부터 고난도의 방식까지 단계별로 고려하여 적절히 도입할 필요가 있다. 현재 국내에서 약국 외에서 판매하는 의약품의 수가 일본과는 달리 종류가 한정되어 있는 점을 고려하면 일본과 같이 높은 난도의 시험까지는 필요하지 않으며, 의약품 공통의 특성이나 인체의 기본지식 보다는 안전상비의약품 판매 시 지켜야 할 법규/제도와 지금의 안전상비의약품들의 특성들 위주의 시험이 적절할 것이다. 약국 외에서 판매할 수 있는 약품의 범위와 판매자의 권한에 따라 적용 가능한 시험의 난이도는 여러 단계로 나눌 수 있는데, 시험을 봐야 하는 자와 해당 시험의 수준에 따라 나누어 표 13에 나타내었다. 표13. 각 단계별 시험의 응시자와, 응시자가 봐야 할 시험의 난이도 시험 단계 시험 대상자 판매점주 판매 종업원 1단계 시험 난이도 낮은 난이도 2단계 낮은 난이도 3단계 높은 난이도 낮은 난이도 4단계 높은 난이도 낮은 난이도의 시험은 검증해야할 지식의 범위가 적은 경우를 위한 시험, 높은 난이도의 시험은 검증해야할 지식의 범위가 많은 경우를 위한 시험을 뜻한다. 높은 난이도의 시험은 일본과 같이 등록판매자가 판매할 수 있는 의약품의 종류가 많고 각각의 의약품에 대한 설명 및 추천을 해야하는 경우가 많은 경우에 해당한다. 일본의 경우 의약품의 공통 속성과 기본적 지식, 인체의 기능과 의약품, 주요 의약품과 작용, 의약품 업무에 관한 법규와 제도, 의약품의 적정한 사용과 안전대책 총 다섯과목에 대한 시험을 본다 앞서 언급한 바와 같이 일본 등록판매자 자격시험의 전체 시험 문제 수는 120문제로, 총 70%인 84문제를 맞아야 하고 각 과목별로 최소 35% 내지 40%를 맞춰야만 등록판매자 시험에 합격할 수 있다. 높은 난이도의 시험에서는 일본과 유사하게 약물이 작용하는 인체의 기본적 지식, 약물의 성질 등 약물의 기본적 지식, 의약품 판매에 있어
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 133 지켜야할 법규, 약물의 오/남용 방지를 위한 적절한 사용법과 안전대책과 관련된 지식을, 총 100개 이상의 문제로 약물을 판매할 자격을 검증해야할 것이다 적은 양의 의약품을 판매하고, 구매자에게 약물에 관한 많은 설명을 하지 않는 경우를 생각한다면 약물의 판매자는 약물의 관리와, 특수한 응급상황에서의 간단한 대처 및 안내정도를 인지하고 있어야 할 것이다. 현재 우리나라의 상황은 보건복지부장관이 1 3개의 품목만을 안전상비의약품으로 지정해둔 상황이므로, 약국 외에서 판매하는 각 약품의 기본적인 특성, 적응증, 부작용들과 의약품의 안전성과 품질관리를 위한 제도를 기반으로 낮은 난이도의 시험을 보면 될 것이다. 또한 단순히 시험만을 통과하는 것이 아니라, 약국 외에서 의약품 판매업에 지속적으로 종사하고자 하는 자는 주기적으로 의약품의 품질유지 및 관리에 관한 연수를 받아 지식을 유지하고 변화하는 제도에 대응할 수 있어야 할 것이다. 낮은 난이도의 시험만을 보는 경우에는, 판매자는 약품과 관련하여 상담을 하기보다는 관리 업무를 주로 하며 구매자가 도움이 필요한 경우에는 주변 병원이나 상담 가능한 연락처를 안내하는 정도의 업무를 볼 수 있을 것이다. 만약 높은 난이도의 시험을 보는 경우에는, 의약품의 특성에 관한 지식을 검증받은 만큼 편의점에서 일하는 점원도 구매자가 약물과 관련된 상담을 원하는 경우 약품에 대한 설명을 할 수 있어야 하며, 점원이 갖고 있는 지식만으로 응대가 어렵거나 병원에 들러야만 하는 경우(예를 들어 복용자가 너무 어리거나 고령인 경우, 임산부인 경우 등)로 생각된다면 주변의 병원 및 응급실을 파악해두어 구매자가 제대로 된 처치를 받을 수 있도록 유도해야 할 것이다. 3. 성분명 선정 및 의약품재분류 제도 도입 안전상비의약품은 그 품목수가 20개로 제한되며, 현행되는 의약품 2분류 체계내에서 예외적인 일반의약품으로 보는 경향이 강하다 안전상비의약품 약국외 판매 제도의 품목 선정에 관한 문제점을 해결하기 위해서는 품목 수를 제한하고 특정 제품을 나열하는 형태를 벗어나 효능군 별 안전성이 확보된 성분을 법으로 지정하고 제형 등을 고려하여 구체적인 제품명과 복용량을 하위법령에 제시하는 것이 바람직하다 (윤해진 & 명순구, 2 018). 나아가 안전상비의약품 지정심의위원회가 3년마다 일반의약품의 안전성을 검토하여, 기준을 충족하는 제품은 안전상비의약품으로 재분류하는 방안을 도입할 수 있다 대부분의 안전상비의약품은 단일 성분으로 구성되기 때문에, 영국의 의약품재분류 제도 중 Simple과 유사한 방식으로 재분류를 진행하면 된다 이때 심의를 받는 일반의약품이 기존 안전상비의약품과 유효 성분, 용량, 용법이 동일한지 검토하는 과정이 필요하다 이러한 안전상비의약품 선정 방식은 제품간 경쟁을 촉진시킬 것이다. 따라서 소비자는 약가 인하의 혜택을 가질 수 있고, 의약품 선택의 폭이 넓어지는 효과 또한 경험할 수 있다. 의약품 제조 업체는 홍보·매출 증가 등 부가적 혜택을 받을 수 있을 것으로 예상된다(황재선, 2022). 스웨덴은 안전상비의약품 정책 도입 목표 중 하나로 경쟁 촉진을 통한 가격 재조정을 삼은 만큼, 이는 중요한 고려사항으로 여겨진다.
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 134 4. 주류 판매업 또는 음주행위가 허용된 업소에서의 안전상비의약품 판매 제한에 대한 법률 신설 스웨덴은 법률 Act(2009:730) 제11조에 주류를 판매하는 업소에서 니코틴 제제를 제외한 다른 OTC의약품을 판매해서는 안 된다고 명시하고 있으나, 국내 안전상비의약품 관련 법률에는 해당 내용이 규정되어 있지 않다. 국내의 주된 판매처인 편의점에서는 안전상비의약품과 주류를 한 매장에서 동시에 판매하고 있다. 스웨덴은 안전상의 이유로 판매를 제한하고 있는데, 안전성 확보를 목표로 관련 법률을 도입한 우리나라가 판매 장소에서의 주류 판매 관련 규정을 어떠한 이유로 법제화하지 않았는지 의문을 갖게 된다. 그러한 측면에서 스웨덴의 사례를 참고로 한다면, 제도의 목표에 걸맞게 법률을 개정할 수 있을 것으로 사료된다 스웨덴 법률 Act(2009:730) 제11조의 주류를 판매하는 업소에 대한 정의는 주류 판매업만을 수행하는 곳과, 주류 판매업과 음주행위가 모두 허용되는 곳으로 나누어 해석할 수 있다. 만약 해당 법률이 규정하는 장소가 주류 판매업만을 수행하는 곳이라면, 해당 관점에서 편의점에서의 안전상비의약품 판매는 제한될 가능성이 높다. 왜냐하면 편의점은 주류면허법 제5조제2항제2호와 주류면허법 시행령 제9조제5항제1 호가목(目)에 따라 주류를 판매하기 때문이다 (주류면허법, 2022; 주류면허법 시행령, 2 022). 주류판매업과 음주행위가 모두 허용되는 장소를 기준으로 한다면, 앞의 경우보다 복잡해지는 것처럼 보이나 여전히 편의점에서의 판매가 제한될 수 있다 식품위생법 시행령 제21조제8호가목에 따르면 휴게음식점영업은 “주로 다류(茶類), 아이스크림류 등을 조리ㆍ판매하거나 패스트푸드점, 분식점 형태의 영업 등 음식류를 조리ㆍ판매하는 영업으로서 음주행위가 허용되지 아니하는 영업이다 다만, 편의점, 슈퍼마켓, 휴게소, 그 밖에 음식류를 판매하는 장소(만화가게 및 「게임산업진흥에 관한 법률」 제2조제7 호에 따른 인터넷컴퓨터게임시설제공업을 하는 영업소 등 음식류를 부수적으로 판매하는 장소를 포함한다)에서 컵라면, 일회용 다류 또는 그 밖의 음식류에 물을 부어 주는 경우는 제외한다 ”라고 정의하고 있다 (식품위생법 시행령, 2022). 법률에 따르면 휴게음식점은 음주행위가 허용되지 않는다 편의점에서 컵라면, 일회용 다류, 또는 그 밖의 음식류에 물을 부어주는 경우는 휴게음식점 영업에 해당하지 않는다 따라서 편의점 측에서 휴게음식점 영업신고를 별도로 하지 않았다면, 구매한 주류에 대한 음주행위가 가능하다 단, 음주 후 난동 및 소란 등은 별개의 문제이므로, 이를 이유로 편의점의 음주행위 자체를 제재할 수는 없을 것이다 따라서 해당 관점에서도 편의점에서의 안전상비의약품 판매는 제한될 가능성이 높다 이와 같이 스웨덴 법률 Act(2009:730) 제11조를 도입할 경우 편의점에서의 안전상비의약품 판매는 엄격히 제한될 필요가 있다. 그러나 스웨덴과의 문화적 차이는 물론 판매되는 OTC의약품 종류 등의 제도적 차이가 있는 것은 현실이므로, 국내 실정에 맞게 해당 제도를 수정할 필요가 있다. 적어도 안전상비의약품 판매업소에서의 주류 판매 장소와 안전상비의약품 판매 장소가 현재보다 엄격하게 공간적 분리가 되도록 해야 한다 추가적으로 주류와 안전상비의약품의 동시 구매를 제한하는 것도 하나의 방법이 될 수 있을 것이다
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 135 따라서 편의점에서의 안전상비의약품 및 주류판매에 대한 제한요건을 강화하는 방향으로 법안 개정을 추진해야 할 것이다. 이와 관련하여 해당 법안 개정 추진 시 참고할 수 있는 방안은 두가지 방향으로 진행할 수 있다 첫째는 조항 자체를 신설하는 것이고, 둘째는 기존 법률에 추가 조항을 신설하는 것이다. 그러한 예시 법안을 아래와 같이 구성할 수 있겠다. [예시 법안 1]. 안전상비의약품 판매업소 내에서 주류 판매 장소와 안전상비의약품 판매 장소의 엄격한 공간적 분리 제○○조(안전상비의약품 판매장소) ① 안전상비의약품의 판매는 주류 판매 영업허가를 받거나 영업신고를 한 업소에서는 제한되어야 한다. ② 단, 동일한 판매업소 내에서 주류를 판매하는 장소와 안전상비의약품을 판매하는 장소에 대하여 엄격한 공간적 분리가 이루어질 경우 판매를 할 수 있다 1. 엄격한 공간적 분리란 주류의 판매가 지정된 장소에서만 이루어지고, 주류 구매자의 동선과 안전상비의약품 구매자의 동선이 완전히 분리되는 것을 의미한다 [예시 법안 2] 안전상비의약품과 주류의 동시 구매 제한 약사법 시행규칙 제28조(안전상비의약품 판매자의 준수사항) ① 법 제44조의4제3호에서 “판매 시 안전관리에 관하여 보건복지부령으로 정하는 사항”이란 다음 각 호의 사항을 말한다. 3. 주류와 안전상비의약품을 동시에 구매하려는 자에게 안전상비의약품을 판매하지 말 것 제 3 장 결론 제 1 절 요약 및 결론 안전상비의약품 약국외 판매 제도는 '접근성 제고'와 '안전성 확보' 달성을 목표로 2012년 11월 15일부터 시행되었으나 도입 이후 제도의 실효성 제고를 위한 노력은 거의 이루어지지 않았다. 이에 본 연구는 국내 안전상비의약품 약국외 판매 제도의 문제점을 파악하고 이와 관련된 해외 사례를 분석하여 국내 제도의 개선 방안을 제시하고자 하였다 국내 안전상비의약품 약국외 판매 제도의 문제점으로는 첫째, 판매자가 안전상비의약품 약국외 판매 제도를 준수하지 않는 경향이 높은 점, 둘째, 정부가 판매 품목 조정 논의에 있어 소극적인 태도를 취하는 점, 셋째, 현행 제도의 문제점으로 안전상비의약품 판매자에 대한 교육이 부실한 점, 넷째, 안전상비 의약품 분류가 체계화되어 있지 않은 점이 있다.
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 136 국내 제도의 개선 방안을 제시하기에 앞서 해외 국가들에서 시행되고 있는 의약품 약국외 판매 제도들과 사례를 조사 및 분석하였다. 의약품 약국외 판매 제도가 오래전부터 시행되어 제도가 안정되게 운영되고 있는 영국, 비교적 최근에 제도가 도입되어 관련 규정이 세분화되어 있는 스웨덴, 문화적 요인을 포함하여 우리나라와 여러 면에서 유사한 일본을 중점적으로 분석하였다. 해외 국가의 제도 중에서는 의약품 분류 제도, 판매 자격에 관한 규정에 주목하였으며, 구체적으로 영국의 의약품재분류 제도, 스웨덴의 OTC의약품 약국외 판매 관련 법률 및 규제, 일본의 등록판매자 제도를 핵심적으로 살펴 보았다. 의약품 약국외 판매 해외 사례를 참고하여 국내 제도의 문제점에 대한 개선방안 네 가지를 제시하였다. 첫째, 제도 이행률이 낮은 문제를 해결하기 위한 방법으로 제도 이행 과정을 명문화하고 감시 체계를 강화한다. 둘째, 안전상비의약품 약국외 판매를 위해 자격증 제도를 도입하여 판매자 교육 부실 문제를 해결한다. 셋째, 품목 수 제한 해지, 성분명 기반의 판매 의약품 선정, 의약품재분류 제도의 도입을 통해 현행 제도의 실효성을 확보한다.넷째, 현행 제도로 인해 발생할 수 있는 중대한 부작용을 방지하기 위해 주류 판매업 또는 음주행위가 허용된 업소에서의 안전상비의약품 판매 제한에 대한 법률을 신설한다. 제 2 절 연구의 의의 및 한계점 도입 초기부터 사회적으로 큰 이슈가 되었던 안전상비의약품 약국외 판매 제도는 사회적 영향 및 중요도에도 불구하고 제도 도입 후 10년간 보완을 위한 노력이 부족하게 이루어졌다 최근 코로나19의 영향으로 인한 해열진통제 편의점 판매 급증, 자가진단키트 편의점 판매가 계기가 되어 안전상비의약품 약국외 판매 제도의 변화에 대한 요구의 목소리가 커지고 있다 제도의 개선을 위해서는 기존 제도를 분석하여 문제점을 파악하는 것이 선행되어야 한다 본 연구는 최근의 통계와 자료를 종합하여 분석하고, 이를 바탕으로 보완이 필요한 부분을 제시하고 있다는 점에서 의의를 가진다. 또한 의약품 약국외 판매 해외 사례를 조사한 후 국내에 도입 가능한 부분을 선별하여 기술하고 있다는 점에서 차별성을 가진다 안전상비의약품 약국외 판매 제도와 관련되어 발생하는 문제는 법률은 존재하지만 잘 지켜지지 않아 생기는 문제와 적절한 법률이 마련되어 있지 않아 생기는 문제로 나눌 수 있다 미준수와 관련된 문제는 보건당국의 규제나 처벌을 강화하는 방식으로 개선할 수 있을 것이다 그러나 법률 제정 미비로 인한 제도적 한계는 법안을 신설하지 않는 한 해소되기 어렵다 이에 해외의 제도와 법률을 기반으로 국내 안전상비의약품 관련 법률의 공백을 파악하고 개선 사항을 제시한 본 논문은 제도적 한계 해소에 기여할 수 있을 것으로 생각된다.더 나아가, 국내 안전상비의약품 약국외 판매 제도 자체뿐 아니라 이행 정도도 종합적으로 분석하여 개선방안을 제시하였다는 점에서 실제 제도를 보완할 때 도움이 될 것으로 기대된다 본 연구에서는 개선 방안을 제시할 때 근거로 해외 사례를 이용하였다. 이와 관련하여 국가 별 사회문화적 특징, 의료 및 경제 수준의 차이에 대한 고려가 부족한 점이 한계가 될 수 있을 것이다 또한 현행 제도의 개선에 초점을 맞추고 있는데 안전상비의약품 약국외 판매 제도의 대안으로 제시되고 있는 공공심야약국에 대한 논의를 추가하여 연구를 진행할 수 있을 것이다.
건강보험심사
건강보험심사
건강보험심사 가원 (2021) 2020 완제의약품 유통정보 통계집
건강보험심사평가원 (2022) 2021 완제의약품 유통정보 통계집
대한약사회, 의약품정책연구소 (2018) 안전상비의약품 판매업소 준수사항 실태조사 박실비아, 김수진, 정연, 이나경 (2018) 외국의 OTC 의약품 판매 및 관리제도 현황과 시사점 이상영, 박실비아, 김남순, 윤강재, 백소혜, 정지원 (2011) 일부 일반의약품 약국외 판매도입 방안 연구 이상영, 윤강재, 이정아 (2013) 안전상비의약품 판매 전후 의약품 사용 및 인식변화 연구 최상은, 배은미, 강대원, 신경선, 임재옥 (2016) 안전상비의약품 판매제도 시행 실태조사 연구 보고서.
Ministry of Health and Social Affairs (2008) Omreglering av apoteksmarknaden(SOU 2008: 4). Huvudbetänkande av ApoteksmarknadsutredningenDel 1 & 2 [[[nl]Re regulation of th e pharmacy market reportfrom the inquest of the pharmacy market] English summary av ailable online: http://www regeringen se/contentassets/f2990e583ef44add8866fc67ae1ca 253/sammanfattning av omreglering av apoteksmarknaden pa engelska (accessed on 07 A ugust 22) [in Swedish].
Ministry of Health and Social Affairs. (2009). Regeringens proposition 2008/09:190 Handel med vissa receptfria lakemedel [Government Bill 2008/09:190 Sale of Certain Non pres cription Medicinal Products] [Internet] Stockholm: Social Departementet Available online: https://www regeringen se/49bbda/contentassets/1c6b681aae2c4014a99c1a9e442ce 1f3/handel med vissa receptfria lakemedel prop. 200809190; (accessed on 11 August 20 22) [in Swedish]
Swedish Pharmacy Association. (2022a). Sector report. Swedish Pharmacy Association. Availa ble online: http://www sverigesapoteksforening se/wp content/uploads/2022/05/ENG_SVA
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 137 참고문헌 1. 보고서 건강보험심사평가원 (2014) 2013 완제의약품 유통정보 통계집 건강보험심사평가원 (2015) 2014 완제의약품 유통정보 통계집 건강보험심사평가원 (2016) 2015 완제의약품 유통정보 통계집 건강보험심사평가원 (2017) 2016 완제의약품 유통정보 통계집
평가원 (2018) 2017 완제의약품 유통정보 통계집
평가원 (2019) 2018 완제의약품 유통정보 통계집 건강보험심사평가원 (2020) 2019 완제의약품 유통정보 통계집
평
Kizaki, H., Mochizuki, M., Yoshida, Y et al Information provision and retrieval by regis tered salespersons from consumers during over the counter drug sales a questionnai re survey BMC Health Services Research 21, 1333(2021)
Kondo, Y., Ishitsuka, Y., Kawabata, N., Iwamoto, N., Takahashi, R., Narita, Y., Kadowaki, D., Hirata, S., Uchino, S., & Irie, T (2019) Knowledge and awareness of nonpharmac ist salespersons regarding over the counter drug use in patients with chronic kidney disease in Japan PloS one, 14(3)
Lind, J., Schafheutle, E., Hägg, A., & Sporrong, S (2016) General sale of non prescripti on medicinal products: Comparing legislation in two European countries Research in Social and Administrative Pharmacy, 12(1), 68 77.
Oleszkiewicz, P., Krysinski, J., Religioni, U., & Merks, P. (2021). Access to medicines vi a non pharmacy outlets in european countries a review of regulations and the influen ce on the self medication phenomenon Healthcare (Basel), 9(2), 123.
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 138 P Apoteksf%C3%B6reningen_%C3%A5rsrapport_2022_Korr1.pdf (accessed 07 August 2022) [i n English] Vogler, Sabine & Arts, Danielle & Sandberger, Katharina. (2012). Impact of pharmacy deregu lation and regulation in European countries Available online: https://repository pu blisso de/resource/frl:4589355 1/data (accessed on 07 August 2022) 2. 학술논문 고대균, 여정성 (2017) 안전상비의약품 약국 외 판매에 관한 소비자 평가 소비자정책교육연구, 13(2), 51 78. 김보환 (2016) 편의점 판매자의 안전상비의약품 관련 지식 수준 평가 [인제대학교 보건대학원]. 박형욱. (2012). 안전상비의약품 약국 외 판매의 의의와 과제. 대한의학회, 55(9), 843 851. 백경희. (2011). 의약품의 분류에 따른 약사의 주의의무와 일반의약품 약국외 판매(OTC 판매)의 허용가능성 법학연구, 14(2), 333 366 윤해진, 명순구 (2018) 안전상비의약품의 안전성 관련 이슈와 법적 대안 위기관리 이론과 실천, 14(8), 57 72.
3. 인터넷 자료 보건복지부 (2012a) 11월 편의점 판매 안전상비의약품, 13개 품목으로 출발 보건복지부 (2012b) 안전상비의약품 약국외 판매 안내 보건복지부 (2017, 03.15) 안전상비의약품 지정심의위원회 제1차 회의 결과 보건복지부 (2017, 04.21) 안전상비의약품 지정심의위원회 제2차 회의 결과
보건복지부.
보건복지부.
보건복지부. (2017, 12.04). 안전상비의약품 지정심의위원회 제5차 회의 결과
보건복지부. (2018, 08.08). 안전상비의약품 지정심의위원회 제6차 회의 결과 후생노동성, 2022, 令和3年度登録販 者試験 施状況, Retrieved from https://www mhlw go jp/s tf/seisakunitsuite/bunya/0000086214 html 2022.07.30
Association of the European Self Care Industry (2022) OTC ingredients: Search by paramet er. Available online: https://otc.aesgp.eu/#by parameter (accessed on 15 August 202 2) [in English]
Lantres, O. Distribution and Marketing of Drugs in France: Overview. Available online: htt ps://uk practicallaw thomsonreuters com/2 618 6699?__lrTS=20201201102042070&transit ionType=Default&contextData=(sc Default)&firstPage=true (accessed on 15 January 202 1)
Medicines and Healthcare products Regulatory Agency (2015) Nexium Control 20mg Tablets n ow available for general sale. Available online: https://www.gov.uk/government/news/ nexium control 20mg tablets now available for general sale (accessed on 13 August 20 22) [in English]
Medicines and Healthcare products Regulatory Agency (2022a) Medicines: Reclassify your p roduct Available online: https://www gov uk/guidance/medicines reclassify your prod uct (accessed on 13 August 2022) [in English]
Medicines and Healthcare products Regulatory Agency. (2022b). Approved reclassifications t o 31 March 2022. Available online: https://assets.publishing.service.gov.uk/governme nt/uploads/system/uploads/attachment_data/file/1066156/Reclassifications_approved_19 91 31st_March_2022 xlsx (accessed on 13 August 2022) [in English]
Swedish Medical Products Agency (2018a) Description of certain products: Paracetamol Av ailable online: https://www lakemedelsverket se/48f5c3/globalassets/dokument/handel med lakemedel/otc substansrapporter/paracetamol otc 2018 09 25.pdf (accessed on 08 August 2022) [in English]
Swedish Medical Products Agency (2020a) Grounds for assessment Available online: https: //www lakemedelsverket se/en/trading pharmaceuticals/retail sale of otc medicines/me dicines which may be sold/grounds for assessment (accessed on 07 August 2022) [in En glish]
Swedish Medical Products Agency. (2020b). Herbal medicinal products, traditional herbal me dicinal products, natural remedies and certain medicinal products for external use. Available online: https://www lakemedelsverket se/en/trading pharmaceuticals/retail
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 139
(2017, 08.30). 안전상비의약품 지정심의위원회 제3차 회의 결과
(2017, 10.23). 안전상비의약품 지정심의위원회 제4차 회의 결과
sale of otc medicines/medicines which may be sold/herbal medicinal products (accesse d on 07 August 2022) [in English]
Swedish Medical Products Agency. (2022a). Listor med receptfria läkemedel som får säljas u tanför apotek Available online: lhttps://www lakemedelsverket se/49f49d/globalasset s/dokument/handel med lakemedel/receptfrihet utanfor apotek/receptfria lakemedel som far saljas utanfor apotek22.xlsx (accessed on 07 August 2022) [in Swedish]
Swedish Medical Products Agency. (2022b). Medicines which may be sold. Available online: h ttps://www lakemedelsverket se/en/trading pharmaceuticals/retail sale of otc medicin es/medicines which may be sold (accessed on 08 August 2022) [in English]
Swedish Medical Products Agency (2022c) Outlets for over the counter medicines Availabl e online: https://www lakemedelsverket se/4a2935/contentassets/bb87dad3a5284dbc950c9 679dab2dc5c/anmalda forsaljningsstallen receptfria lakemedel xlsx (accessed on 10 Au gust 2022) [in English]
The Swedish Parliament. (2015). Constitutional Register: Förordning (2009:929) om handel m ed vissa receptfria läkemedel. Availiable online: https://rkrattsbaser.gov.se/sfsr?b et=2009:929 (accessed on 13 August 2022) [in English]
The Swedish Parliament (2019) Constitutional Register: Lag (2009:730) om Handel med Viss a Receptfria Läkemedel Available online: https://rkrattsbaser gov se/sfsr?bet=2009: 730https://rkrattsbaser.gov.se/sfsr?bet=2009:730 (accessed on 13 August 2022) [in En glish] 01
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 140
4 법령 식품위생법 시행령 제21조 제8호 (가)목 안전상비의약품 지정에 관한 고시, (2
6). 약사법 시행규칙, (2022). 약사법, (2022). 주류면허법 시행령 제9조 제5항 제1호 가목 주류면허법 제5조 제2항 제 2호 Swedish Medical Products Agency. (2018b). Läkemedelsverkets föreskrifter (LVFS 2009:20) om handel med vissa receptfria läkemedel Available online: https://www lakemedelsverke t se/sv/lagar och regler/foreskrifter/2009 20 konsoliderad (accessed on 12 August 20 22) [in English] The Human Medicines Regulation Statutory Instrument 1916 Norwich: The Stationery Office; 2012. Available online: https://www legislation gov uk/uksi/2012/1916?timeline=false (accessed on 13 August 2022) [in English]
The Medicines Act 1968. The Stationery Office. Available online: https://www.legislation.g ov uk/ukpga/1968/67/body (accessed on 17 August 2022) [in English]
The Swedish Parliament. (2009a). Lag (2009:730) om Handel med Vissa Receptfria Läkemedel.. Available online: http://www riksdagen se/sv/dokument lagar/dokument/svensk forfattn ingssamling/lag 2009730 om handel med vissa receptfria_sfs 2009 730 (accessed on 30 July 2022). [in English]
The Swedish Parliament. (2009b). Förordning (2009:929) om handel med vissa receptfria läke medel Availiable online: https://www riksdagen se/sv/dokument lagar/dokument/svensk forfattningssamling/forordning 2009929 om handel med vissa_sfs 2009 929 (accessed o n 07 August 2022) [in English] (20 11.1 ://www korea / policyBriefingView 148752 (2013, 11.1 `슈퍼 판매' 재추진. 연합뉴스. https://n.news.nav er com/mnews/article/001/0005103719?sid=100 엄태선. (2017, 10.10). 안전상비약 부작용, 작년 368건으로 급증... "공공약국 절실" . 케이 팜뉴스 https://www kpanews co kr/article/medipharm/show asp?category=C&idx=187735 유선희 (2022, 05.11) 팬데믹에 돋보인 ‘편의점 상비약’ 공적기능 규제완화 물꼬 트일까 한겨레 https://www hani co kr/arti/economy/consumer/1042408 html 이승탁 (2009 01.22) 새 자격
[정책2팀] 국내 안전상비의약품 약국외 판매 제도의 문제점 및 개선 방향 제언 서울대학교 약학정책연구회 141
5. 기사 김원종
12,
4) 안전상비의약품 약국외 판매 시행 정책브리핑 https
kr
n ews/
do?newsId=
674 김지은.
5). 편의점 "안팔아도 그만"…약국 "매출영향 미미" . 데일리팜. http://www. dailypharm.com/News/177567?ID=177460 안용수. (2011, 06.08). 청와대, 가정상비약
‘등록판매자’ 태풍의 눈 한국 의약통신 http://www kmpnew s.co.kr/news/articleView.html?idxno=2394 이지영 (2022, 05.19) 코로나19 재택치료에 안전상비약 매출↑ 편의점업계 방긋 서울파이낸스. https://www.seoulfn.com/news/articleView.html?idxno=45586 이호준. (2011, 04.03) 가정상비약 약국외 판매 또 무산, 공정위 개선안서 빠져. 경향신문. http s://www.khan.co.kr/economy/economy general/article/201104032118475 황재선. (2022, 07.25). 수많은 아세트아미노펜 중 타이레놀만 편의점 붙박이, 왜요? 히트뉴스. http://www hitnews co kr/news/articleView html?idxno=40351 황재용 (2013, 04.26) '어린이타이레놀현탁액' 167만병 강제 회수·폐기 명령 청년의사 htt p://www docdocdoc co kr/news/articleView html?idxno=132534
