













ISBN 978-91-47-15424-1
© 2025 Anna Johansson, Cecilia Stenberg, Sten-Åke Sundkvist, Niklas Wästeby och Liber AB. Text- och datautvinning ej tillåten.
Projektledare och redaktör: Cecilia Söderpalm-Berndes
Formgivare: Eva Jerkeman
Bildredaktör: Mikael Myrnerts, Marie Olsson
Sjätte upplagan 1
Repro: Repro 8 AB, Stockholm
Tryck: People Printing, Kina 2025
Kopieringsförbud
Detta verk är skyddat av upphovsrättslagen. Kopiering, utöver lärares och elevers begränsade rätt att kopiera för undervisningsbruk enligt BONUS-avtal, är förbjuden. BONUS-avtal tecknas mellan upphovsrättsorganisationer och huvudman för utbildningsanordnare, t.ex. kommuner och universitet.
Intrång i upphovsrättshavarens rättigheter enligt upphovsrättslagen kan medföra straff (böter eller fängelse), skadestånd och beslag/förstöring av olovligt framställt material. Såväl analog som digital kopiering regleras i BONUS-avtalet. Läs mer på www.bonuscopyright.se.
Liber AB, 113 98 Stockholm
Kundservice tfn 08-690 90 00 Kundservice.liber.@liber.se www.liber.se
Bokens pedagogiska tanke – experimentet i centrum
För att väcka elevernas intresse för ämnen och deras kemiska reaktioner, och för att eleverna ska förstå kemi på en djupare nivå, utgår resonemangen i Kemiboken 1 från experiment. På många ställen i boken finns det förslag och instruktioner till demonstrationsexperiment som du som lärare kan använda för att resonera om och förklara kursens centrala innehåll.
I slutet av boken finns instruktioner till 19 elevlaborationer. I flera av dem gäller att eleverna, ensamma eller i grupp, ska planera utförandet av dem och välja den utrustning som krävs. Det finns även ett tjugotal laborationer i lärarhandledningen som hör till boken, och där fi nns kommentarer och riskbedömningar till alla laborationer.
Bokens upplägg
Kemiboken 1 är anpassad till ämnesplanen och det centrala innehållet i Gy25. De olika kapitlen i boken bygger på varandra. Förutom kemins arbetsmetoder handlar kapitel 2 om riskbedömning och kemi och etik, där principerna för grön kemi ingår. Analytisk kemi har inget eget kapitel. Vi beskriver istället olika typer av analyser i deras sammanhang, som kromatografi i kapitel 4 om kemisk bindning och titrering i kapitel 6 om syror och baser.
Varje kapitel inleds med en sammanställning över den teori och de viktiga begrepp som eleverna bör lära sig. Sist i varje kapitel finns en sammanfattning samt ett stort antal uppgifter. Uppgifterna är indelade i två nivåer, varav de svårare är rödmarkerad.
I slutet av boken ligger svaren till uppgifterna. Ett utförligt facit finns som nedladdningsbar fil på liber.se. Allra sist i boken finns ett sakregister.
Författarna
1 ÄMNEN, FASER OCH REAKTIONER 4
Vad är kemi? 8
Ämnen och partiklar 10
Rena ämnen och blandningar 23
Analyser 29
Grundämnen och kemiska föreningar 31
Materians indelning 34
Uppgifter 36
2 KEMINS ARBETSMETODER 38
Vetenskap 40
Den naturvetenskapliga metoden 43
Kemi, miljö och etik 51
Uppgifter 54

3 ATOMER OCH DET PERIODISKA
SYSTEMET 56
Atomteorin 58
Det periodiska systemet 75
Uppgifter 90
4 KEMISKA BINDNINGAR 92
Kemiska bindningar 94
Metaller och deras egenskaper 94
Jonbindning 98
Kovalent bindning 112
Polär kovalent bindning 117
Bindningar mellan molekyler 124
Bindningar ger ämnen deras egenskaper 132
Uppgifter 144
Organiska föreningar innehåller kol 150
Organiska ämnen delas in i ämnesklasser 151
Alkaner – kolväten med enkelbindningar 152
Fossila bränslen och biobränslen 158
Alkener – kolväten med dubbelbindning 161
Alkyner – kolväten med trippelbindning 164
Cykliska kolväten 165
Arener – aromatiska kolväten 166
Funktionella grupper 168
Alkoholer 168
Karboxylsyror 174
Estrar 177
Uppgifter 180

6
KEMISKA BERÄKNINGAR 182
Vågen används för att räkna atomer 184
Olika partiklars massor 184
Massa, molmassa och substansmängd 190
Sammansättning av föreningar och lösningar 194
Koncentration i lösningar 199
Räkna på kemiska reaktioner 207
Reaktionsformeln – reaktionens recept 213
Gaser och gasblandningar 223
Uppgifter 229

7 SYROR OCH BASER 234
Syror 236
Baser – syrornas motsats 241
Syror och baser – hemma och i industrin 243
Mer om protolyser 252
Neutralisation – en protolysreaktion 261
Buffertlösningar stabiliserar pH-värdet 266
Uppgifter 269

8 ENERGI OCH KEMI 272
Energi 274
Varför sker kemiska reaktioner? 290
Uppgifter 294
9 REDUKTION OCH OXIDATION 296
Reaktioner med fullständig elektronövergång 298
Reaktioner med ofullständig elektronövergång 306
Spontana redoxreaktioner avger energi 314
Batterier 322
Bränslecellen ger elektrisk energi 327
Elektrolyser kräver energi 329
Korrosion 333
Uppgifter 339
LABORATIONER 340
SVAR TILL UPPGIFTERNA 355
SAKREGISTER 371


Om du kastar upp kokande vatten i luften när det är riktigt kallt fryser vattnet till is innan det faller till marken. Vatten, liksom andra ämnen, kan förekomma som gas, vätska och i fast form. Vatten kan också reagera med andra ämnen i kemiska reaktioner så att det bildas nya ämnen. Allt i vår omgivning är resultat av kemiska reaktioner. Många av de material vi använder i vardagen består av komplicerade molekyler som har tagits fram genom kemiska reaktioner i flera steg.
Men vad är egentligen ett ämne, ett material och en kemisk reaktion? Det går vi igenom i det här inledande kapitlet, liksom de olika faser som ett ämne kan befinna sig i.



NÄR DU HAR LÄST KAPITLET SKA DU HA KUNSKAP OM
■ hur man kan använda partikelmodellen för att beskriva faser och fasomvandlingar
■ vilka energiomsättningar som sker vid fasomvandlingar
■ att energin inte kan förstöras eller förbrukas
■ hur man kan använda formler för att beskriva fasomvandlingar
■ hur materien kan delas in i rena ämnen och blandningar
■ hur blandningar kan separeras

■ skillnaden mellan kvalitativ och kvantitativ analys
■ hur rena ämnen kan delas in i grundämnen och kemiska föreningar
■ skillnaden mellan en kemisk reaktion och en fysikalisk förändring.


VIKTIGA BEGREPP
aggregationsform analys avdunstning blandning densitet dekantering destillation energiprincipen fas fasgräns fast form fast lösning fasövergång
filtrering
flytande form frysning fryspunkt fällning gasform

grundämne heterogen homogen indunstning karaktäristisk egenskap kemisk förening kemisk reaktion kokning kokpunkt kondensation kvalitativ analys kvantitativ analys legering lösning materia material partikel produkt

reagens reaktant rent ämne sammansatt ämne sedimentering separation smältning smältpunkt stelning stelningspunkt sublimering värmerörelse utgångsämne
ånga ångbildning ämne

Analys – undersökning av vilka ämnen, eller hur mycket som finns av olika ämnen i ett prov.
Separation – uppdelning av en blandning i rena ämnen.
Syntes – genom kemiska reaktioner sätts hela eller delar av olika ämnen samman till nya ämnen.
Kemi är vetenskapen som studerar vilka egenskaper ämnen har, vad de består av och hur de omvandlas till nya ämnen i kemiska reaktioner. Vi och vår omgivning består av kemiska ämnen som kan förändras genom kemiska reaktioner. Alltså är allt vi använder och gör kopplat till kemin. Många verksamheter kräver goda kemikunskaper, exempelvis för att utveckla de olika materialen i en mobiltelefon och uppladdningsbara batterier i mobiler och elfordon. Några andra områden där kemikunskaper behövs är miljövård och sjukvård.
Analys, separation och syntes är viktiga arbetsmetoder för kemister. En analys innebär att man undersöker vilka ämnen som finns i ett prov eller hur mycket som finns av olika ämnen. Vid en separation delas en blandning av ämnen upp i flera delar. Råolja, till exempel, kan separeras (delas upp) i bland annat bensin och fotogen. En syntes innebär att man framställer ett nytt ämne. Från enkla råvaror kan man exempelvis syntetisera läkemedel, färgämnen, fibrer till textilier och plasten till skalet på en mobiltelefon.
Kemin har länge delats upp i olika områden. Kemister är ofta specialister inom något av dessa delområden, som organisk kemi, oorganisk kemi eller biokemi. För att få fram delar till en produkt, exempelvis en mobiltelefon, krävs att olika specialister samarbetar.
ORGANISK KEMI är kolföreningarnas kemi. Fram till 1800-talets början trodde man att det krävdes en speciell livskraft för att framställa de ämnen som organismer bildar eller består av. Denna del av kemin kallades därför organisk kemi. Men år 1828 lyckades Friedrich Wöhler framställa det organiska ämnet urea av enkla råvaror, utan att ta hjälp av någon levande organism. Man har ändå kvar beteckningen organisk kemi för kolföreningarnas kemi. Organiska ämnen är huvudbeståndsdelar i många produkter, som syntetiska fibrer, färgämnen, plaster och läkemedel.
OORGANISK KEMI är den del av kemin som handlar om egenskaper och reaktioner hos kemiska föreningar som inte innehåller kolatomer. Av tradition räknas dock koldioxid, kolsyra och några andra enkla kolföreningar som oorganiska föreningar. De fl esta oorganiska ämnen utvinns ur mineral i jordskorpan. Många av dessa har fått stor betydelse för utveckling och produktion av tekniker som används för att minska
Upplösning före 2013
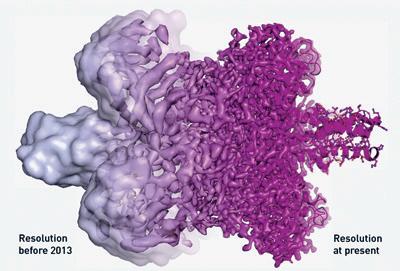
Med elektronmikroskop (EM) kan man få detaljerade bilder på hur atomerna sitter i exempelvis ett protein. Nobelpriset i kemi 2017 delades mellan tre forskare som, inom olika områden, har bidragit till utveckling av EM-tekniken.
Nuvarande upplösning
klimatpåverkan, som batterier och solceller. Samtidigt har brytningen av olika mineral ofta stor lokal miljöpåverkan.
BIOKEMI är biomolekylernas kemi, ett delområde som har utvecklats i gränslandet till biologin. Kolhydrater, proteiner och fetter är exempel på biomolekyler. De finns i alla organismer och livsmedel.
Inom högre utbildning, forskning och näringsliv används ofta andra indelningar av kemin, som utgår mer från tillämpningar där kemikunskaper från flera olika områden behövs. Några exempel är miljökemi, life science, nanoteknik, ytkemi och materialkemi.
Biologi, fysik, geologi och kemi är fyra naturvetenskapliga ämnesområden som överlappar varandra och som har utvecklats tillsammans. Många av grundämnena upptäcktes av geologer som undersökte olika mineral. När man undersöker ett vattenprov ur havet krävs det kunskaper i både fysik och kemi för att det ska gå att genomföra och utvärdera mätningen, och i biologi för att kunna bedöma havets tillstånd. UPPGIFTER 1:1–1:2
EXPERIMENT
Föremål, material och ämnen
1. Låt eleverna undersöka några föremål och några ofarliga ämnen. Diskutera begreppen material, ämne och utseende utifrån föremålen och ämnena.
Ett föremål består av ett eller flera material.
Ett material består av ett eller flera ämnen.
Föremål kan skilja sig åt när det gäller utseende och material. En porslinsmugg, en plastmugg och en stålmugg kan vara ganska lika varandra, men de består av tre olika material. Varje föremål har ett visst utseende och består av minst ett material.
Ett material kan i sin tur bestå av ett eller flera ämnen. Stål är en blandning av minst två ämnen: järn och kol. Porslin och plast är oftast blandningar av flera ämnen. Kopparflis och några kopparrör har olika utseenden, men består av samma material – koppar.

Materia och partiklar

Materia är allt som har volym och massa.
Partiklar – ett samlingsnamn för små enheter, till exempel atomer, joner och molekyler.
UPPGIFTER 1:3–1:5
Kemister använder begreppet materia. Materia är allt som har volym och massa. Kemister talar också om partiklar, små enheter. All materia består av partiklar, som kan vara atomer, molekyler eller joner. Dessa består i sin tur av ännu mindre partiklar, som protoner, neutroner och elektroner. Det är sammanhanget som visar vad man menar när man använder ordet ”partikel”. När man talar om vilka partiklar vatten består av menar man vanligtvis vattenmolekyler.

Vatten är ett mycket vanligt ämne på jorden. På bilden förekommer vatten i tre olika aggregationsformer: is, flytande vatten och vattenånga. Ånga, alltså gasformigt vatten, syns inte. Dimman är en blandning av luft, vattenånga och små vattendroppar.
Vattnet på bilden befinner sig i tre aggregationsformer (aggregationstillstånd) – fast, flytande och gas. Isen är i fast form. Vattnet under isen är i flytande form. Den tredje formen är vattenångan, vatten i gasform, som befinner sig ovanför isen och vattnet. Aggregationsformen anger hur partiklarna i ett ämne sitter ihop, och den ändras med temperaturen.
Fast form
Varje partikel sitter på en bestämd plats i ett fast ämne, men partiklarna är inte stilla utan rör sig hela tiden lite grann – de vibrerar. Ett annat ord för den här typen av vibration är värmerörelse. Partiklarnas värmerörelser ökar med stigande temperatur.
Flytande form
Partiklarna i en vätska (flytande form) rör sig mer än i ett fast ämne. Värmerörelsen i vätskan är så stor att partiklarna inte längre har fasta platser, men de har fortfarande kontakt med varandra.
Det finns tre aggregationsformer –fast, flytande och gas.
Värmerörelse – partiklar är i ständig rörelse och rör sig mer ju högre temperaturen är.
Teckningen visar ämnen i tre olika aggregationsformer: is (fast form), vatten (flytande form) och luft (gas).
Den visar också hur man kan föreställa sig partiklarna i respektive aggregationstillstånd, med partiklarna som kulor.
fast (s) flytande (l) gas (g)
UPPGIFTER 1:6–1:8
Gasform
Värmerörelsen i en gas är så stor att partiklarna rör sig fritt och mycket fortare än i en vätska. Partiklarna tar därför mycket större plats i gasform än i flytande form. I gasform har de inte längre kontakt med varandra, förutom när de krockar.
En gas anpassar sig efter behållaren, och partiklarna fördelar sig jämnt i hela volymen.

När vattnet kokar bildas bubblor med vattenånga. Eftersom partiklarna i gasform tar större plats än i vätskeform har bubblorna lägre densitet och stiger därför upp till ytan.
2. Mät temperaturen på is från frysskåpet respektive is blandat med vatten. Blanda och mät temperaturen under en längre tid.
3. Lägg några jodkristaller i en bägare, helst en utan pip, på en värmeplatta. Ställ en delvis vattenfylld rundkolv ovanpå bägarens öppning. Värm försiktigt. Diskutera begreppet fysikalisk förändring.
Faser
När det är minusgrader bildas en hinna av is på vatten. Isen och det flytande vattnet är då två olika faser – isen är en fas och vattnet en annan fas. En fas är en enhetlig del, vilket innebär att det ser likadant ut överallt i den.
Begreppen aggregationsform och fas betyder olika saker. En blandning av vatten och olja får visa skillnaden. Vatten och olja har samma aggregationsform, de är flytande. De bildar däremot två olika faser som inte blandar sig med varandra. Oljefasen fl yter ovanpå vattenfasen. En fas kan innehålla flera ämnen. Havsvatten, till exempel, innehåller ämnen som gör vattnet salt. Ett annat exempel är luft, som mest består av kväve och syre.
I en parfymflaska finns en flytande fas, som är en blandning av alkohol och olika doftämnen, och en gasfas, utrymmet ovanför parfymen.
Vätskeytan är gränsen mellan de två faserna.
En doft sprider sig genom rummet när parfymen avdunstar. Partiklar i parfymens flytande fas (lösningen i flaskan) övergår då till gasfas (luften i och utanför flaskan). I gasfasen får man en blandning av luftens partiklar och parfymens partiklar. Parfymer består av fl era olika ämnen som tillsammans ger den önskade doften. De olika ämnena i parfymer avdunstar i regel olika snabbt. Gammal parfym doftar därför annorlunda mot ny parfym. Fasövergången kan alltså leda till en förändring av fasernas sammansättning.

I parfym består den flytande fasen av flera komponenter (beståndsdelar), bland annat alkohol och olika doftämnen. När doftämnena avdunstar lämnar de vätskefasen och övergår till gas.

Olja och vinäger bildar två olika faser eftersom de inte blandar sig med varandra. Dressingen måste blandas innan den hälls över salladen.
Fasövergång – ett ämne övergår från en aggregationsform till en annan.
Stelningspunkt – temperaturen då ett ämne stelnar, alltså när ett flytande ämne övergår till fast form.
Fryspunkt – ett annat uttryck för stelningspunkt
Smältpunkt – temperaturen då ett ämne smälter.
Övergångar mellan olika aggregationsformer Vatten är en vätska vid rumstemperatur, så när man pratar om vatten menar man vanligtvis vatten i flytande form. Men vatten finns i både fast och flytande form, och som gas.
Vatten övergår till is när temperaturen sjunker under 0 °C – man säger att vattnet fryser. När andra ämnen än vatten övergår från flytande form till fast form säger man att ämnena stelnar. Temperaturen vid vilken ett ämne stelnar kallas stelningspunkt eller fryspunkt.
När ett fast ämne övergår till flytande form säger man att det smälter. Temperaturen vid vilken ett ämne smälter kallas för ämnets smältpunkt Is smälter vid 0 °C, som alltså är vattnets smältpunkt. Temperaturen är densamma för vattnets fryspunkt och smältpunkt. Detsamma gäller för andra ämnen – deras stelningspunkt och smältpunkt ligger vid samma temperatur. För att gjuta guld värmer man det till dess smältpunkt, 1064°C, och sedan häller man det i en form. Därefter får guldet stelna, och resultatet blir ett guldföremål.


Boliden AB utvinner på Rönnskärsverken cirka 11 ton guld per år. Två tredjedelar av guldet kommer från Bolidens gruvor, resten kommer från elektronikåtervinning. Man smälter en del av guldet och gjuter det till guldtackor.

Kokpunkt - den temperatur vid vilken ett ämne kokar.
Avdunstning – ångbildning vid en temperatur som är lägre än kokpunkten
När flytande vatten övergår till gasform säger man att det förångas och blir till vattenånga. Vid normalt lufttryck kokar vatten vid 100 °C. Temperaturen vid vilken ett ämne kokar kallas kokpunkt. När vatten övergår från flytande form till gasform vid lägre temperaturer än kokpunkten säger man att det avdunstar. Ren vattenånga syns inte. Det som finns ovanför vattenytan i en gryta med kokande vatten är en blandning av varm luft, vattenånga och små vattendroppar. Dessa har bildats när vattenångan har övergått från gasform till flytande form. När ett ämne övergår från gasform till
ångbildning
flytande
sublimering sublimering stelning smältning kondensation
Övergångar mellan de tre aggregationstillstånden. Förångning (ångbildning) innefattar både kokning och avdunstning. Kokning sker vid ett ämnes kokpunkt medan avdunstning även sker vid lägre temperaturer.
flytande form säger man att det kondenserar. De små vattendropparna bildar det lilla ”molnet” som vi ser över kokande vatten. Dropparnas ytor är fasgränser mellan den flytande fasen och gasfasen.
Vissa ämnen kan övergå direkt från gas till fast form, eller från fast form till gas. I båda fallen säger man att ämnet sublimerar. Här använder man alltså samma begrepp för de motsatta händelserna.
När det är kallt kan det bildas rimfrost, iskristaller. Det är vattenångan i fuktig luft som sublimerar, det vill säga övergår direkt från vattenånga till fast form, is. På så sätt bildas rimfrost i en frys som öppnas ofta, eftersom fuktig luft då kommer in i frysen. När luften kyls sublimerar vattenångan i den och iskristaller bildas på allt som är kallt. Man måste därför frosta av frysen ibland, annars fylls den med is.

Under kalla dagar, sublimerar vattenångan i luften till små iskristaller.
kokpunkt
smältpunkt
Kolven på bilden är kall eftersom den innehåller en blandning av is och vatten. Under kolven syns jodkristaller som har bildats när jodångor har kommit i kontakt med det kalla glaset. När gasformig jod kyls sublimerar den till fast jod.

Vatten från den frysta maten kan sublimera, alltså gå från is till ånga. Man brukar lägga maten i gastäta påsar för att förhindra att vattenångan kommer ut. Annars torkar maten och iskristaller bildas på allt i frysen. Även grundämnet jod kan sublimera. Vid rumstemperatur är jod mörkvioletta kristaller. När kristallerna värms upp bildas jodånga som har violett färg. Joden övergår då direkt från fast form till gasform – den sublimerar. Om man låter ångan svalna återgår den till fast form – den sublimerar alltså igen.
temperatur energi
kristallint ämne
det fasta ämnet smälter vätska
vätskan kokargas (ånga)
Diagrammet visar hur temperaturen av ett ämne ändras när man tillför energi (värme). När det fasta ämnet smälter är temperaturen konstant (smältpunkten). Även när vätskan kokar är temperaturen konstant (kokpunkten). Både vid smältning och kokning används den tillförda energin för att övervinna attraktionskrafterna mellan partiklarna.

FRYSNING Vatten övergår från flytande form till is (fast form).
STELNING Ett ämne övergår från flytande form till fast form.
SMÄLTNING Ett ämne övergår från fast form till flytande form.
ÅNGBILDNING/ FÖRÅNGNING Ett ämne övergår från flytande form till gasform.
KOKNING Ett ämne övergår vid kokpunkten från flytande form till gasform.
AVDUNSTNING Ett ämne övergår från flytande form till gasform utan att koka.
KONDENSATION Ett ämne övergår från gasform till flytande form.
SUBLIMERING Ett ämne övergår från gasform till fast form, eller tvärtom.
Smältning kräver värme
För att smälta ett fast ämne behöver man tillföra så mycket värme att smältpunkten uppnås. Det tyder på att det finns attraktionskrafter mellan partiklarna i ett fast ämne. Så länge ett ämne befinner sig i fast form håller attraktionskrafterna ihop partiklarna och hindrar dem från att lämna sina fasta platser. När man tillför värme stiger ämnets temperatur. Partiklarna vibrerar mer och mer tills krafterna inte längre räcker till för att hålla kvar partiklarna på deras bestämda platser. Då börjar partiklarna röra sig i förhållande till varandra, och ämnet smälter.
Att isen håller beror på krafterna mellan vattenmolekylerna.
UPPGIFTER 1:9–1:13

Smältning kräver energi. En glaciär blir större om all snö som faller på vintern inte smälter bort helt under den varma årstiden. För varje år blir det ett nytt snölager. Om en glaciär växer eller krymper beror därför på omgivningens temperatur. Att många glaciärer minskar i storlek tyder på att medeltemperaturen i omgivningen ökar.
Energiomsättning – energi avges eller upptas.
När omgivningen har lägre temperatur än ett flytande ämne, avger ämnet värme till omgivningen. Ämnet svalnar och partiklarnas rörelser avtar. Krafterna mellan partiklarna räcker då för att hålla kvar dem på en bestämd plats – ämnet stelnar. När ett ämne avger eller tar upp energi säger man att det sker energiomsättning.
Kokning kräver värme
När man värmer en vätska börjar partiklarna i den att röra sig mer. Temperaturen stiger tills vätskan börjar koka – då har kokpunkten uppnåtts. Det innebär att krafterna inte längre kan hålla ihop partiklarna som därför frigörs från varandra. Det bildas ånga hela tiden som vätskan kokar, så när all vätska har kokat bort finns ämnet enbart i gasform. När en gas kyls ned rör sig partiklarna allt långsammare. Vid den temperatur som ämnet kokade räcker krafterna för att åter binda partiklarna till varandra. Gasen kondenserar. Vid kondensering frigörs värme. Då avges alltså energi till omgivningen.
ÄMNE
1. Vilken aggregationsform har
a) svavel vid 200 °C?
b) jod vid 60 °C?
LEDTRÅD
Använd tabellen ovan, eller en formelsamling.
SVAR
a) flytande b) fast.
2. Vilken fasövergång sker?
a) Natriumklorid har från början temperaturen 1 300 °C. Ämnet
svalnar sedan till rumstemperatur, 20 °C.
b) Temperaturen på syre ändras från −230 °C till −190 °C.
c) Temperaturen på kväve ändras från −200 °C till 60 °C.
SVAR
a) Stelning. Temperaturen är från början under kokpunkten, men över smältpunkten. b) smältning c) kokning
3. Normalt lufttryck råder. Vid vilken temperatur
a) kondenserar svavel
b) smälter kväve c) stelnar järn?
SVAR
a) 445 °C, b) −210 °C, c) 1 535 °C
Smältpunkt och kokpunkt för några ämnen vid normalt lufttryck, 101,3 kPa.
Aggregationsformer
Fasövergångar
Kondensations-, smält- och stelningspunkter ÖVA
Temperaturen är ett mått på partiklarnas medelhastighet.
För att torka våta kläder brukar man hänga upp dem på en lina. Våt disk låter man stå att torka i ett diskställ. Efter en stund har kläderna respektive disken torkat, även vid rumstemperatur. Våt tvätt kan till och med torka om det är nollgradigt! I de här fallen säger man att vattnet avdunstar. Vid avdunstning övergår vätskan till gasform vid en lägre temperatur än kokpunkten.
Temperaturen är ett mått på hur mycket partiklarna i ett ämne rör sig, men de rör sig olika mycket. När två partiklar i en vätska stöter ihop, kan därför den ena partikeln bromsas medan den andra accelereras. Även vid låg temperatur finns det därför alltid några partiklar i vätskan som rör sig tillräckligt mycket för att kunna lämna vätskefasen.
Gasen (ångan) har högre temperatur än vätskan hade från början. När en del av vätskan avdunstar och övergår till gasform sjunker temperaturen i den kvarvarande vätskan. Det beror på att de partiklar som är kvar i vätskefas har lägre medelhastighet. Det var ju de partiklar som rörde sig mest som lämnade vätskan och övergick till gasfas.
Fryst tvätt som hänger utomhus torkar trots extrem kyla. Det går långsamt men även vid mycket låg temperatur sublimerar isen till vattenånga.

Du har säkert upplevt att du fryser efter ett bad, trots att luften är varm. Det beror på att temperaturen i vattnet som är kvar på huden sjunker vid avdunstningen. Vattnet kommer då att ta upp värme från huden, som blir kallare. Ju fortare avdunstningen sker, desto kallare blir huden. Om man får en vätska på händerna som avdunstar snabbt, känns det kallt. Bensin, nagellackborttagningsmedel och parfym är exempel på sådana vätskor. Att de avdunstar snabbt redan vid rumstemperatur märks även tydligt genom att doften sprider sig när man öppnar en fl aska med något av dessa ämnen.
Varje ämne kondenserar vid en viss temperatur som kallas kondensationspunkt. Ett ämnes kondensationspunkt är samma temperatur som dess kokpunkt. Men precis som att ett ämne avdunstar även under sin kokpunkt, kan ett ämne kondensera under sin kondensationspunkt. På så sätt bildas kondensvatten på en kall yta. Det är vatten i luften som kondenserar. Det avger värme till den kalla ytan och övergår från gasform till flytande form.
Om man vill förhindra att en vätska avdunstar, ska man hälla vätskan i en flaska och skruva på ett lock. Om flaskan inte är helt fylld kommer partiklar att börja lämna vätskefasen. Antalet partiklar i gasfasen ovanför vätskan ökar då med tiden. Om partiklar med låg energi i gasfasen kolliderar med partiklar i vätskeytan kan de gå tillbaka till vätskefasen. Ångan kondenserar då. En stund efter det att man har skruvat på locket infinner sig jämvikt. Det betyder att det lika ofta övergår partiklar från gasfasen tillbaka till vätskefasen som från vätskefasen till gasfasen.
När temperaturen höjs övergår fler partiklar till gasfasen ovanför vätskeytan. Det beror på att det då finns fler partiklar med tillräckligt hög hastighet för att lämna vätskefasen. Samtidigt är det färre partiklar i gasfasen som rör sig så långsamt att de kondenserar, det vill säga övergår till vätska. Om vätskan (som i den stängda flaskan) finns i ett begränsat utrymme, kommer det efter ett tag att bli så mycket gas att nettoavdunstningen upphör. Då infinner sig ett nytt jämviktsläge, med fler partiklar i gasfasen än vid den lägre temperaturen.
Kondensationspunkten för ett ämne är samma temperatur som dess kokpunkt.
Kondensvatten är vatten i luften som kondenserar på en kall yta.
UPPGIFTER 1:14–1:18
Jämvikt vid fasövergång betyder att det under en viss tid passerar lika många partiklar åt båda håll över gränsen mellan faserna.
ÖVA
Fasövergångar
UPPGIFT
1:19
ÖVA
Formler för
fasövergångar
4. Avges energi till omgivningen eller tas energi från omgivningen vid
följande fasövergångar?
a) Vatten övergår från gasform till vätskeform.
b) Jod övergår från fast form till gasform.
c) Vatten fryser.
SVAR
a) Energi avges. Partiklarna har lägre rörelseenergi i flytande vatten än i vattenånga.
b) Det krävs energi. Partiklarna i gasfasen får större rörelseenergi än partiklarna hade i den fasta fasen.
c) Energi avges. I vätskefasen hade partiklarna större rörelseenergi än de har i den fasta fasen.
Om ämnen förändras, kan förändringarna beskrivas med reaktionsformler. Det är då vanligt att ange den aggregationsform som ämnena har. Aggregationsformerna betecknas i formler på följande sätt:
(s), solidus, betyder fast form (l), liquidus, betyder flytande form (vätska) (g) betyder gasform
Övergångarna mellan aggregationsformerna kan också beskrivas med formler. Ett exempel på detta är när vatten fryser till is.
vatten(l) → vatten(s)
5. Skriv med ord formeln för följande händelse.
a) Jod sublimerar.
b) Svavel kondenserar.
c) Rimfrost bildas.
d) Regndroppar bildas.
SVAR
a) jod(s) → jod(g), eller jod(g) → jod(s)
b) svavel(g) → svavel(l)
c) vatten(g) → vatten(s)
d) vatten(g) → vatten(l)
4. Blanda en liten mängd natriumklorid och vatten inför eleverna. Rör om och visa dem den klara lösningen. Blanda 2 g svavelpulver och 2g natriumklorid. Låt eleverna ge förslag på hur blandningarna kan separeras i sina beståndsdelar.
I naturen hittar man sällan rena ämnen var för sig, utan de flesta ämnen förekommer i blandningar. En blandning består av två eller flera ämnen. Ett exempel är havsvatten, som är en blandning av vatten och flera olika salter, varav natriumklorid (vanligt bordssalt) är ett. Vattnet och de olika salterna är var för sig rena ämnen. Ett rent ämne har konstanta egenskaper och kan beskrivas med en kemisk formel. Blandningen har andra egenskaper än de rena ämnena var för sig.
Precis som rent vatten, kan även en blandning av natriumklorid och vatten övergå från flytande form till fast form. Men blandningen har inte samma fryspunkt som de rena ämnena. Saltvatten fryser vid lägre temperatur än vad både vatten och natriumklorid gör var för sig. Både vattnet och natriumkloriden får tillbaka sina typiska egenskaper om ämnena separeras.
Ett rent ämne har konstanta egenskaper – det stelnar exempelvis alltid vid samma temperatur. Blandningars egenskaper, däremot, varierar beroende på sammansättningen. Exempelvis så fryser vattnet i polarhaven vid ungefär −2 °C, medan havsvatten med en annan salthalt fryser vid en annan temperatur.
En blandning består av minst två rena ämnen.
Ett rent ämne har konstanta egenskaper.
Blandningars egenskaper beror på sammansättningen.
Havsvatten är en blandning av vatten och olika salter lösta i vattnet. Havsvatten har andra egenskaper än kranvatten.

Även icke-metaller kan ingå i legeringar. I stål ingår kol som legeringsämne. De små kolatomerna ligger inbäddade mellan järnatomerna

I en homogen blandning syns inte beståndsdelarna.
En lösning är en homogen blandning.
En legering är en fast lösning där en metall ingår.
Homogen blandning
I saltvatten är saltet uppdelat i så små partiklar att de inte går att se. Man säger att saltvatten är en homogen blandning av natriumklorid och vatten. En homogen blandning kallas även lösning. Blåsinstrument som tuba, trombon och trumpet tillverkas ofta av mässing. Mässing bildas när flytande koppar och zink blandas och sedan får stelna. I mässing syns varken koppar eller zink. De båda metallernas atomer är så väl blandade med varandra att man inte kan se att det är flera ämnen. Mässing är alltså en homogen blandning av fasta ämnen, en fast lösning. En fast lösning med metalliska egenskaper som till exempel mässing, kallas legering. I en legering är minst ett av ämnena en metall. Mässing är hårdare än både koppar och zink var för sig. Genom att blanda ämnen får man nya material.
Stål är ett annat exempel på en legering. Huvudbeståndsdelen i stål är järn, men det innehåller även små mängder av andra metaller. Vissa förhindrar rostangrepp, andra gör stålet hårdare. Förutom olika metaller innehåller stål även kol.
En lösning kan vara flytande, fast eller gasformig.
Luft är ett exempel på en gasformig lösning. Blandningar av gaser är alltid homogena. Huvudbeståndsdelarna i luft är kväve och syre, men luft innehåller även argon, koldioxid och ett stort antal andra ämnen i små mängder.
Heterogen blandning
En mycket vanlig bergart i Sverige är granit, som är en blandning av de tre mineralen fältspat, svart glimmer och gråvit kvarts. De tre mineralen kan urskiljas och därför är granit en heterogen blandning. I en sådan kan man alltså se beståndsdelarna, till skillnad från i en homogen blandning.
Mjölk är en blandning som mest består av vatten, men som även innehåller kolhydrater, proteiner och fetter. Eftersom mjölk är vit och ogenomskinlig är det svårt att se olika faser. Men om man tittar på mjölken i mikroskop kan man urskilja små fettdroppar. Mjölk är alltså en heterogen blandning som består av två flytande faser – en vattenfas och en fettfas.

När man tittar på mjölk i ett mikroskop kan man se att det är en heterogen blandning. De små runda dropparna består av fett som omges av vatten. Det är alltså två flytande faser.
Karaktäristiska egenskaper
De egenskaper som gör det möjligt att identifiera ett visst rent ämne kallas ämnets karaktäristiska egenskaper. Vissa kan man uppfatta med sinnena, exempelvis lukt, färg, kristallform eller aggregationsform. Vätesulfid är en gas som luktar som ruttna ägg. Lukten är en karaktäristisk egenskap som gör att man lätt känner igen gasen. Andra egenskaper kan bara undersökas med någon form av mätutrustning. Exempelvis så kan ett ämnes smältpunkt eller kokpunkt bestämmas med hjälp av en termometer, och ett ämnes ledningsförmåga med ett batteri, några sladdar och en lampa.
I en heterogen blandning kan man se beståndsdelarna.

Granit är en heterogen blandning, med tydliga korn av röd fältspat, svart glimmer och gråvit kvarts.
UPPGIFTER 1:20–1:21
Karaktäristiska egenskaper är sådana som tillsammans är typiska för ett ämne.
Separation av järn och svavel
Järn och svavel har olika karaktäristiska egenskaper. Om ämnena blandas behåller båda sina karaktäristiska egenskaper. Tabellen visar egenskaper för järn och svavel.
EGENSKAP JÄRN SVAVEL
aggregationstillstånd vid rumstemperatur fast fast färg grå citrongul
densitet 7,87 g/cm3 2,07 g/cm3 elektrisk ledningsförmåga? ja nej magnetisk? ja nej böjbar? ja, formbart utan att brytas sönder. nej, sprött; svavelkristaller bryts lätt sönder.
smältpunkt
Järn är magnetiskt, men det är inte svavel.
Separation – uppdelning av en blandning i rena ämnen
1 535 °C

En blandning av pulveriserat järn och svavel är grågul. När man tittar på nära håll eller med ett förstoringsglas syns grå och gula korn. Blandningen är alltså heterogen.
Järn är magnetiskt, men det är inte svavel. Magnetism är en karaktäristisk egenskap för järn, och med hjälp av en magnet separerar man lätt de två ämnena. En blandning av två eller flera ämnen kan alltså separeras, delas upp, i de rena ämnen som den består av. Metoden kallas separation, och det är de rena ämnenas olika egenskaper som gör det möjligt att separera dem.
EXPERIMENT
5. Blanda noga 5 g järnpulver med 3 g pulveriserat svavel i en mortel. Häll blandningen på ett papper. Håll en magnet under papperet och rör försiktig magneten fram och tillbaka. Dela upp blandningen i tre provrör. Tillsätt 10 ml vatten i provrör 1. Fäst provrör 2 i ett stativ i ett dragskåp. Upphetta bottnen med en brännare och se efter vad som händer. Undersök både den bildade produkten i provrör 2 och blandningen i provrör 3 med en magnet. Sätt några droppar 4 mol/dm3 saltsyra till provrör 2 och 3. Utför momentet i dragskåp.
Några separationsmetoder
I alla separationsmetoder utnyttjar vi det faktum att ämnen i blandningar har olika karaktäristiska egenskaper. Tabellen visar några exempel på blandningar och separationsmetoder.
Blandningar och separationsmetoder
EXEMPEL (BLANDNING)
EGENSKAP SOM SKILJER ÄMNEN ÅTSEPARATIONSMETOD
svavel / vatten kornstorlek filtrering
järn / sand / lera densitet sedimentering*
sand / vatten densitet dekantering**
bensin / vatten densitet / löslighet separation med separertratt
blodkroppar / blodplasma***densitet centrifugering
jod / sand aggregationsform vid uppvärmningsublimering
salt / vatten kokpunkt indunstning
etanol / vatten kokpunkt destillation
*Sedimentering innebär att fasta partiklar sjunker till botten.
**Dekantering är när en vätska försiktigt hälls av.
***Blodplasma är vätskan som blir kvar när alla celler har separerats från blodet.


Havssalt utvinns ur havsvatten med hjälp av solenergi, genom att man låter vattnet i grunda bassänger avdunsta. Metoden kallas indunstning.

Separationsmetoder

fällning av olösta ämnen
Filtrering av en heterogen blandning av fasta, olösta ämnen och en vätska. Blandningen separeras av ett filter som håller kvar korn av olösta ämnen. Vätskan som har passerat genom filtret kallas filtrat.

Büchnertratt
slang till vattensug
filtrerkolv (sugflaska)
Sugfiltrering av en heterogen blandning av fasta, olösliga ämnen och en vätska. Här skyndar man på filtreringen genom att använda en vattensug. Vätskan sugs genom filtret.
termometer
destillationshuvud
kylvattenutgång
Två vätskor som inte är blandbara kan separeras med hjälp av en separertratt. Man öppnar kranen och låter den nedre vätskan rinna ur.
kylare (kondenserare)
rundkolv med den vätska som ska destilleras
bunsenbrännare
kylvatteningång
kolv för uppsamling av destillatet
Indunstning används för att koka bort en del eller hela vätskan från en blandning av en vätska och fasta ämnen. Blandningen finns i en värmetålig skål och värms med en gasbrännare eller annan värmekälla.
Destillation är en metod för att separera en flytande blandning av ämnen med olika kokpunkter. Blandningen värms upp i en rundkolv. Vätskan med lägst kokpunkt förångas. Ångan leds till en kylare där den kondenserar till en vätska. Vätskan som lämnar kylaren kallas destillat.
UPPGIFTER 1:22–1:26
Kranvatten får inte innehålla några föroreningar eller giftiga ämnen. Därför analyseras vårt dricksvatten regelbundet på vattenverken. Man undersöker då vilka ämnen som finns lösta i vattnet och i hur stor mängd per volymenhet.
Undersökningar som innebär att man tar reda på vilka ämnen ett prov innehåller kallas kvalitativa analyser. Kvalitativ betyder då inte hur bra ett prov är, utan vad provet består av. Ordet analys kommer från grekiskan och betyder ”dela upp”. När man undersöker om det finns salter lösta i vattnet gör man alltså en kvalitativ analys av vattenprovet.
För att ta reda på hur mycket som finns av ett visst ämne i ett prov, gör man en kvantitativ analys. En sådan kan göras med extremt hög noggrannhet. Vissa kvantitativa analyser kräver avancerad utrustning, men även en så enkel metod som att väga ett prov är en kvantitativ analys. Vid kemiska reaktioner är alltid massan av de bildade ämnena samma som massan av de ämnen som reagerar. Den kunskapen använde kemister redan i början av 1800-talet när de genom att väga ämnen och blandningar före och efter reaktioner kunde räkna ut grundämnenas relativa massor och identifiera nya ämnen. Att analysera ett prov genom vägning kallas gravimetri.
Som vi redan har nämnt, kan vi använda en magnet för att ta reda på om en blandning innehåller järn. Vi gör då en kvalitativ analys. För att ta reda på hur mycket järn som finns i blandningen måste vi separera allt järn från övriga ämnen i provet, vilket vi alltså lättast gör med en magnet. Därefter väger vi järnet, och då gör vi en kvantitativ analys.
Ett reagens är ett ämne eller en metod som används för att undersöka om ett visst annat ämne eller vissa joner (laddade partiklar) finns närvarande. Att påvisa ett ämne med hjälp av reagens är alltså en form av kvalitativ kemisk analys.
Om en glödande trästicka förs ner i en kolv med syrgas flammar stickan upp. Den andel syrgas (21 %) som finns i luften räcker inte för att stickan ska brinna, men om koncentrationen av syrgas är högre än 30 % brinner stickan lättare. Att använda en glödande trästicka är en metod för att ta reda på om gasen innehåller en hög halt av syre. Den glödande stickan är ett reagens på syrgas.
För att påvisa att vätgas har bildats använder man också en brinnande trästicka. Om vätgasen är blandad med luft antänds gasblandningen.
Kvalitativ analys – att undersöka vad ett prov består av.
Kvantitativ analys – att undersöka hur mycket av ett ämne som finns i ett prov.
Vid kemiska reaktioner är massan av bildade ämnen alltid densamma som massan av ämnena som reagerar. Vid gravimetri analyseras ett prov genom vägning.
Ett reagens används för att påvisa om ett visst ämne finns närvarande.




En lösning med silverjoner kan användas för att påvisa kloridjoner.
Fällning = fasta partiklar
UPPGIFTER 1:27–1:29




joner i lösningen
fällning av silverklorid, AgCl(s)
Koldioxid kan också påvisas med reagens. Om man leder ner koldioxid i en lösning av kalciumhydroxid, kalkvatten, blir lösningen grumlig av svårlösligt kalciumkarbonat. Kalkvatten är alltså reagens på koldioxid. På motsvarande sätt kan man påvisa kloridjoner genom att hälla en lösning av silvernitrat i en lösning av natriumklorid. Då bildas en vit fällning av silverklorid.
För att påvisa sulfatjoner använder man bariumjoner. Ämnet bariumnitrat är lättlösligt. Men om man blandar en bariumnitratlösning med en lösning som innehåller sulfatjoner, bildas fasta, vita partiklar av svårlösligt bariumsulfat. Bariumjoner är alltså reagens på sulfatjoner. På samma sätt är silverjoner reagens på kloridjoner. Silverklorid är, liksom bariumsulfat, ett mycket svårlösligt ämne. I kapitel 4 får du läsa mer om fällningar.
Några vanliga reagens
ÄMNE/PARTIKLAR
syrgas glödande stickaStickan börjar brinna.
vätgas brinnande stickaEn knall hörs.
koldioxid kalkvatten Kalkvattnet blir grumligt.
sulfatjoner bariumnitratlösningDet bildas en vit fällning. kloridjoner silvernitratlösningDet bildas en vit fällning.
Grundämnen kan inte sönderdelas i andra ämnen
Både järn och svavel är grundämnen. Ett grundämne består av en enda sorts atomer, och kan därför inte sönderdelas i andra ämnen med kemiska metoder.
Bara några få grundämnen finns som rena ämnen i naturen, bland annat syre, kväve, argon, guld, svavel och kol. De flesta grundämnen reagerar så lätt med andra ämnen att de enbart finns som beståndsdelar i kemiska föreningar. Natrium, kalium, fluor och klor är reaktiva grundämnen som framför allt finns i salter. Fluor och klor tillhör en grupp grundämnen som kallas för saltbildare (halogener).
Järn och svavel reagerar till en kemisk förening
Järn och svavel har väldigt olika smältpunkter; järn 1 535 °C och svavel 115 °C. Trots att svavel har mycket lägre smältpunkt än järn, går det inte att separera en blandning av järn och svavel genom att smälta svavlet. När den grågula blandningen hettas upp i ett provrör händer nämligen något annat. Den börjar glöda, och glöden sprider sig genom hela blandningen, även om man tar bort brännaren. När provröret har svalnat igen, kan man undersöka vad som finns i provröret. Men man måste slå sönder röret för att komma åt innehållet, eftersom det har stelnat till en gråsvart klump.
För att ta reda på om den gråsvarta klumpen innehåller järn, krossar man den i en mortel och undersöker pulvret med en magnet. Det visar sig då att det inte längre är magnetiskt. Det gråsvarta pulvret är alltså ett nytt ämne som har andra egenskaper än järn och svavel. Av den här enkla undersökningen kan man dra slutsatsen att det har skett en kemisk reaktion. I en kemisk reaktion omvandlas ämnen, och ämnet som har bildats i det här fallet är järnsulfid. I en kemisk reaktion förbrukas minst ett ämne, och minst ett nybildas. De nya ämnena har andra karaktäristiska egenskaper än de ämnen som reagerade.
Reaktionen kan beskrivas med hjälp av följande formel.
järn(s) + svavel(s) → järnsulfid(s)
Reaktionsformeln visar att järn och svavel är fasta ämnen. De reagerar till järnsulfid som också är ett fast ämne. Järn och svavel är de ämnen
Ett grundämne kan inte sönderdelas i andra ämnen med kemiska metoder.

Exempel på en kemisk reaktion. En blandning av järn (grått) och svavel (gult) värms med brännarlågan och börjar glöda – ett gråsvart ämne har bildats.
Kemisk reaktion – en ämnesomvandling där minst ett nytt ämne bildas.
Reaktanter – utgångsämnen
Produkter – ämnen som bildas
Vid en kemisk reaktion reagerar reaktanter till produkter.
En kemisk förening är ett sammansatt ämne som består av minst två olika atomslag.
som reagerar, och därför kallas de utgångsämnen eller reaktanter. Järnsulfid är produkten av reaktionen, alltså det ämne som bildas.
Järnsulfid är en kemisk förening, som är sammansatt av två atomslag. Järnsulfid har bildats genom att två ämnen har reagerat med varandra. En kemisk förening är ett rent ämne som har bildats genom en kemisk reaktion. Det är alltså inte en blandning av olika ämnen. En kemisk förening kan beskrivas med en kemisk formel, och den har konstanta egenskaper som skiljer sig från reaktanternas.
Kemiska föreningar kan sönderdelas i andra ämnen
Vid en kemisk reaktion kan en kemisk förening sönderdelas i minst två ämnen.
Syrgas leds ned i den smälta järnmalmen. Föroreningar bildar då oxider som går lätt att få bort.
Eftersom järnsulfid är en kemisk förening, ett rent ämne, kan den inte delas upp i järn och svavel igen med någon separationsmetod. För att sönderdela en kemisk förening krävs att det sker en eller flera kemiska reaktioner.
Flera reaktioner måste ske för att utvinna järn ur järnsulfid. I den första reaktionen upphettas järnsulfid tillsammans med syre till så hög temperatur att ämnet smälter. Järnsulfid och syre reagerar då till järnoxid och svaveldioxid.
järnsulfid(l) + syre(g) → järnoxid(l) + svaveldioxid(g)
I den andra reaktionen får den smälta järnoxiden reagera med kol. Då bildas järn och koldioxid.
järnoxid(l) + kol(s) → järn(l) + koldioxid(g)

Svavelbrytningen vid vulkanen Kawah Ijen på Java sker i närheten av en kratersjö som innehåller stora mängder saltsyra och svavelsyra. Därför innehåller luften vid sjön giftiga gaser. Luften är också frätande.

Genom de två reaktionerna har man alltså lyckats utvinna järn ur järnsulfid. Vid industriell produktion av järn och stål utgår man inte från järnsulfid, utan från de järnoxider som finns i järnmalm. Järnoxider är kemiska föreningar av järn och syre. För att minska utsläppen av växthusgasen koldioxid har den svenska stålkoncernen SSAB börjat använda vätgas som ersättning för kol. Då bildas järn och vatten istället för järn och koldioxid.
Man skiljer på fysikaliska förändringar och kemiska reaktioner. I en kemisk reaktion bryts och bildas bindningar mellan atomer. Det innebär att det bildas nya ämnen med andra kemiska egenskaper än utgångsämnena. Vid en fysikalisk förändring förändras inte själva ämnet. När ämnen blandas utan att det sker en kemisk reaktion, eller när en blandning av olika ämnen separeras, sker alltså bara en fysikalisk förändring. Ett annat exempel på en fysikalisk förändring är när ett ämne byter aggregationsform eller fas.
Energiprincipen
Som vi beskrev tidigare omsätts alltid energi vid kemiska reaktioner, precis som vid fasövergångar. Energi avges av vissa ämnen och tas upp av andra. Dessutom kan energi avges till omgivningen i form av värme. Energin kan omvandlas till många olika energiformer, men den totala mängden energi förändras inte. Att energin är oförstörbar kallas för energiprincipen.
Fysikalisk förändring – ett ämne övergår i en annan form utan att dess egenskaper förändras.
Energiprincipen – energi kan omvandlas men inte skapas eller förstöras.
UPPGIFTER
1:30–1:34
Materia
I det här kapitlet har vi beskrivit olika sätt att dela in materian. Det kan sammanfattas så här:
All materia kan delas in i rena ämnen och blandningar. Ett rent ämne är antingen ett grundämne eller en kemisk förening.
En blandning består av minst två ämnen. Om det syns att blandningen består av olika ämnen är den heterogen. Om det inte syns är den istället homogen.
En homogen blandning kallas även lösning. Den kan vara gasformig, flytande eller fast. En fast lösning med metalliska egenskaper kallas legering.
Homogena blandningar Kemiska föreningar Grundämnen
Blandningar av ämnen
Heterogena blandningar
Lösningar (flytande lösningar)
Legeringar (fasta lösningar)
Gasblandningar
• Materia är allt som har volym och massa.
• Ämnen befinner sig i någon av tre aggregationsformer: fast, flytande eller gas.
• Smältning och kokning kräver värme.
• Vid ett ämnes smältpunkt blir det fasta ämnet flytande. Vid samma temperatur stelnar ämnet. Ett ämnes smältpunkt och fryspunkt/ stelningspunkt är alltså vid samma temperatur.
• Vid ett ämnes kokpunkt övergår det flytande ämnet till gasform. Vid samma temperatur kondenserar ämnet, vilket innebär att det övergår från gasform till flytande form. Kokpunkten och kondensationspunkten är alltså vid samma temperatur.
• Sublimering innebär att ett ämne övergår från fast form direkt till gasform, eller tvärtom.
• I en heterogen blandning kan man se minst två beståndsdelar.
• I en homogen blandning kan man inte se beståndsdelarna.
• Kvalitativ analys innebär att man tar reda på vilka ämnen som ingår i ett prov.
• Kvantitativ analys innebär att man tar reda på hur mycket det finns av ett visst ämne i ett prov.
• Ett reagens är ett ämne som används för att påvisa förekomsten av ett visst annat ämne.
• Ett grundämne är uppbyggt av en enda sorts atomer.
• En kemisk förening är uppbyggd av minst två sorters atomer.
• En kemisk förening är ett rent ämne.
• Vid kemiska reaktioner bildas nya ämnen med andra kemiska och fysikaliska egenskaper än utgångsämnena. Utgångsämnena kallas reaktanter. Ämnena som bildas kallas produkter.
• Vid en fysikalisk förändring bildas inga nya ämnen.
• Energin är oförstörbar men kan omvandlas.
Använd en formelsamling eller Internet för att hitta svar på frågor som du inte kan svara på direkt eller med hjälp av boken.
1:1 a) För att läsa till brandingenjör krävs att man har läst Kemi 1. Varför tror du att en brandingenjör har nytta av kemikunskaper? Jämför dina förslag med förslag från andra i klassen.
b) För att utbilda sig till apotekare krävs att man har läst både Kemi 1 och 2. Varför tror du att den utbildningen kräver djupare kemikunskaper än utbildningen till brandingenjör? Jämför dina förslag med förslag från andra i klassen.
1:2 Vilket atomslag finns i alla organiska föreningar?
1:3 En kaffemugg kan bestå av porslin. Porslin är ett material. I Kemi 1 ska du lära dig mera om materia, som betyder något annat. Vad är det för skillnad mellan material och materia?
1:4 Materialet koppar består av ett enda ämne. Ge två exempel på material som består av två eller flera ämnen.
1:5 Vad är en partikel?
1:6 Tänk dig att du har tre stängda burkar som innehåller samma ämne men i olika aggregationsform. Rita tre kvadrater (A, B och C), cirka 3 x 3 cm stora, som ska föreställa de tre burkarna. Rita ämnets partiklar som små cirklar inne i burkarna. Burk A ska innehålla ämnet i fast form, burk B i flytande form och burk C i gasform.
1:7 Ett avgränsat område som man undersöker kan kallas ett system. Föreslå ett system som består av a) tre faser: en fast fas, en flytande fas och en gasfas, b) två flytande faser, c) en flytande fas som är en blandning av två ämnen, d) en gasfas som innehåller flera ämnen.
1:8 Använd begreppen system, fas och beståndsdel för att beskriva a) en blandning av vatten och olja, b) innehållet i en sluten flaska som är fylld till hälften med saltvatten, c) luft.
1:9 Vad kallas det när ett ämne övergår: a) från fast till flytande form b) från flytande till gasform c) från flytande till fast form?
1:10 Vad kallas det när ett ämne övergår från flytande form till gasform vid temperaturer under kokpunkten?
1:11 Vad betyder följande ordformler? a) vatten(g) → vatten(s) b) vatten(g) → vatten(l) c) järn(s) → järn(l) d) etanol(l) → etanol(g).
1:12 Vilken är skillnaden mellan förångning och kokning?
1:13 Vatten består av vattenmolekyler.
Vattenmolekylerna binds olika starkt till varandra beroende på vilken aggregationsform vattnet har. Använd begreppet vattenmolekyler för att beskriva vad som händer när a) is smälter, b) det bildas rimfrost på en kall fönsterruta, c) vatten fryser till is.
1:14 Sök reda på och ange smältpunkt och kokpunkt för vatten, glycerol och etanol. Vilken aggregationsform (vid vanligt lufttryck) har ämnena vid 10 °C respektive 120 °C?
a) vatten, b) glycerol, c) etanol.
1:15 a) Vilka av ämnena argon, kväve, metan, propan, syre och väte är grundämnen?
b) Sök reda på och ange smältpunkt och kokpunkt för ämnena. Vilka av ämnena är flytande vid −230 °C, c) gasformiga vid −100 °C, d) fasta vid −70 °C?
1:16 Krävs det värme (alltså tillförsel av energi) för att vattenånga ska kondensera? Förklara ditt svar.
1:17 Tar aceton upp värme (sker energitillförsel) när det avdunstar? Förklara ditt svar.
1:18 Du fryser när du har gått omkring i våta kläder en stund. Förklara med hjälp av partikelmodellen hur det kommer sig.
1:19 För att förhindra att vattnet avdunstar i en flaska bör man sätta lock på den. Efter en stund uppstår jämvikt i flaskan. Vad innebär det?
1:20 Vilka av följande ämnen är rena ämnen respektive blandningar? Glas, koppar, mässing, fruktsocker, schampo, nagellack, mascara.
1:21 Är blandningen homogen eller heterogen? a) utspädd hallonsaft, b) luft, c) granit, d) rostfritt stål, e) lerigt vatten, f) salladsdressing (innehåller vatten, olja och örtkryddor), g) saltvatten.
1:22 Vad menas med karaktäristiska egenskaper?
1:23 Vilken skillnad i ämnenas egenskaper skulle man kunna använda för att separera en blandning av a) vatten och salt, b) sand och salt, c) bensin och vatten, d) vatten och olja?
1:24 Vad innebär a) separation, b) dekantering, c) sugfiltrering, d) sedimentering, e) destillation, f) gravimetri?
1:25 Avdunstning sker när vatten övergår från flytande form till gasform vid en lägre temperatur än kokpunkten. Vad är indunstning?
1:26 Beskriv en lämplig metod att separera a) olja och vatten, b) sand och socker, c) järnspån och kolpulver. Jämför med förslag från andra i klassen.
1:27 Hur skiljer sig en kvalitativ analys från en kvantitativ analys?
1:28 Är följande analyser kvantitativa eller kvalitativa? a) Att föra ner en glödande trästicka i en behållare för att se om trästickan flammar upp, b) att mäta glukoshalten (sockerhalten) i blodet, c) att väga det socker som har separerats i en sand-sockerblandning.
1:29 Föreslå en undersökning som kan kallas a) kvalitativ analys, b) kvantitativ analys. Jämför dina förslag med vad andra i gruppen har föreslagit. Gör gärna analyserna, om det är möjligt, och beskriv resultaten.
1:30 Avgör om det sker en kemisk reaktion och förklara ditt svar. a) Ett glas krossas. b) Vanligt salt hälls i kokande vatten. c) Is smälter.
d) Snöflingor bildas i luften. e) Spenat växer. f) En sockerbit läggs i en kopp med varmt kaffe. g) Kokande vatten rinner igenom kaffepulver i en kaffebryggare. h) Järn rostar.
1:31 Vilken är skillnaden mellan en fysikalisk förändring och en kemisk reaktion?
1:32 a) Föreslå en metod för att göra blockljus av gamla stumpar av stearinljus. b) Sker det en kemisk reaktion eller en fysikalisk förändring när blockljuset tillverkas? c) Sker det en kemisk reaktion eller en fysikalisk förändring när blockljuset brinner?
1:33 Är natriumklorid (vanligt salt) en homogen blandning av natrium och klor? Förklara ditt svar.
1:34 a) Man kan sönderdela natriumklorid i andra ämnen. Men det går inte att på kemisk väg sönderdela natrium. Varför?
b) Man kan ändra sammansättningen i en vattenlösning av natriumklorid, men inte i en natriumkloridkristall. Varför?
Bildförteckning
Foton:
Omslagsfoto: Power and Syred/Science Picture Library/TT
Martin Högbom/The Royal Swedish Academy of Science 9
Stefan Berg/Boliden 14 (PD)
Ingela Nyman/Scandinav/TT 15
Charles D Winters/SPL/TT 16
Henrik Trygg/Johnér 17
Anders Modig/Johnér 18
Martin Diebel/fStop/Getty Images 20
Peter Scoones/SPL/TT 23
South West Images Scotland/Alamy/TT 24
SPL/TT 25 (1), 26
Martyn F Chillmade/SPL/TT 31
Maximilian Stock LTD/SPL/TT 32
Konstantin Trubavin/Aurora Photo/Getty Images 33
Mathieu Lewis-Rolland/Getty Images News/Getty Images 38–39
Manfred Börner 40
Okänd konstnär ur Camille Flammarions
L’Atmosphere 1888. Wikimedia Commons (PD) 45
© Solvatten 47
Kemikalieinspektionen, UNCE 51, 55
SPL/TT 59, 60
Christine Olsson/TT 63
Martin Bond/SPL/TT 65
Augustin Ochsenreiter/AP Photo/TT 67
SPL/TT 71
Science & Society Picture Library/Getty Images 75
SPL/TT 78
Heritage Images/Hulton Archive/Getty Images 80
Olof Johan Södermark. Bridgeman Images/TT 84 (1)
Deepbluemedia/Mondadori Portfolio/ Getty Images 84 (2)
A.M. Ahad/AP/TT 85
Marcelo Silva/iStock/Getty Images 87
Mikael Andersson/Bildhuset/TT 88
Jens Lindström/Scandinav/Johnér 92–93
SPL/TT 97
Sten-Åke Sundkvist 98
SPL/TT 100 (1, 2)
Bosse Nilsson/Kristianstadsbladet/TT 102
mariusFM77/Getty Images 103 (1)
Dr. Jeremy Burgess/SPL/TT 103 (2)
Power and Syred/SPL/TT 106
SPL/TT 108
Manfred Börner 110
SPL/TT 111
Nina Rökaeus 114
AP Photo/TT 119
Cecilia Söderpalm-Berndes 122
Jupiterimages/Getty Images 136
SPL/TT 139 (2, 3)
Grant Heilman Photography/Alamy Stock Photo/TT 140
P_Wei/iStock/Getty Images 142 (1)
Veja/Shutterstock.com 151
SPL/Getty Images 153
Motala Site Zero 163
Leif R Jansson/TT 167
Wirestock Creators/Shutterstock.com 182–183
Kern 185 (2)
JLPPA/Lucara Diamond Corp/Best Image/TT 186
Elliot Elliot/Johnér 187 (1)
Ofianto wahyudhi/ Shutterstock.com 187 (2)
SPL/TT 188
Sigvard Åkerman/Nasoteket, Lund 189
SPL/TT 190, 191 anythings/Shutterstock.com 197
SPL/TT 198 (1)
Fredrik Sandberg/TT 198 (3)
SPL/TT 199
Nitor 206 (1)
Martyn F Chillmade/SPL/TT 215
Patrick Landmann/SPL/TT 221 (1)
Andrew Lambert Photography/SPL/TT 221 (2)
Helena Karlsson/Wermlandsmjölk 225
Cary Yeowell/DigitalVision/Getty Images 234–235
SPL/TT 237 (1, 2)
Martyn F Chillmade/SPL/TT 237 (3)
Connect Images/Johnér 238
Sten-Åke Sundkvist 239
SPL/TT 244 (1)
David Taylor/SPL/TT 246 (1)
Spiroview Inc/Shutterstock.com 246 (2)
Martyn F Chillmade/SPL/TT 247 (1)
aquaArts studio/Getty Images 249
Ture Hellström/Sydsv/TT 250
Carolina Byrmo/AB/TT 251
Adam Ihse/TT 255
Nina Rökaeus 258, 262
Plainpicture/Johnér 267
Westend61/Getty Images 272–273
Manfred Börner 276
Cecilia Berndes-Söderpalm 282
Marie Linnér/Scandinav/Johnér 289
Bernd Weißbrod/DPA/TT 291
Jeppe Gustafsson/TT 296–297
Nina Rökaeus 299, 300
Andrew Lambert Photography/SPL/TT 302
Nina Rökaeus 304
Andrew Lambert Photography/SPL/TT 309
SPL/TT 312
Plattform/Johnér 314
A Ganot (1887). Universal History Archive/UIG/REX /TT 316
Pictorial Press Ltd/Alamy Stock Photo/TT 316
Nina Rökaeus 322
ChristianLphoto/Shutterstock.com 326
Funtay/iStock/Getty Images 332
Nina Rökaeus 334
Swerea KIMAB 336 (PD)
Övriga foton: Shutterstock.com
Illustrationer:
Cecilia Frank: s. 12, 15, 16, 28, 30, 41:2, 62, 54, 65, 68, 69:1, 70, 73, 101:2, 102, 104:2, 111, 112, 128, 138, 160, 188, 239:1, 251, 254:1, 257, 259, 262, 263, 284, 307, 316, 318, 328, 353
Cicci Lorentzson: s. 25, 59, 66, 69:2, 72:1, 74, 94, 95:3, 98–100, 101:1, 104:1, 109, 110, 115:1, 115:3, 117:2, 119, 121:1-2, 125:1-2, 134, 147, 159, 164:1, 170, 200, 201, 203, 209–211, 239:2, 249, 256, 275, 276, 278, 282, 285, 292, 331, 334, 335, 344, 354, 355
Per Werner Schulze: s. 41, 95:2, 114, 115:2, 116, 117:1, 118, 121:3, 122, 123, 125:3, 126, 130, 135, 139, 140, 164:2, 171, 196, 238, 241, 244, 245, 254:2, 280
Cecilia Stenberg: struktur- och skelettformler
KEMIBOKEN 1 är anpassad till kemi nivå 1 enligt Gy25, och kan därmed användas även på Komvux och naturvetenskapligt basår.
KEMIBOKEN 1 innehåller all den teori som nya ämnesplanen föreskriver. Efter ett inledande kapitel om ämnen och reaktioner följer ett om kemins arbetsmetoder, där även riskbedömning, kemi och etik samt principerna för grön kemi ingår. Analytisk kemi har inget eget kapitel, utan metoderna tas upp i de olika kapitel där de hör hemma. Kemitekniska tillämpningar för hållbar utveckling tas främst upp i kapitlen om kolföreningar, energi respektive reduktion och oxidation.
Varje kapitel inleds med en sammanställning över den teori och de viktiga begrepp som eleverna bör lära sig. Sist i kapitlen finns en sammanfattning samt ett stort antal uppgifter i två svårighetsgrader. Svaren finns i slutet av boken; ett utförligt facit kan kostnadsfritt laddas ner från liber.se.
Texterna har bearbetats för att passa alla elever. Som extra stöd finns både ordförklaringar och begrepp som marginaltexter.