Triệu vàcộngsự.JExpClin CancerRes(2022)41:330
https://doi.org/10.1186/s13046-022-02528-6

NGHIÊN
CỨU Truy cập mở bấm vào để cập nhật
UBR7 ức chế quá trình tạo khối u HCC bằng cách nhắm mục tiêu Keap1/Nrf2/Bach1/HK2 và glycolysis
Lương Triệu1† , Min Kang1† , Tiểu Mạnh Lưu1† , Trấn Nhiên Vương1† , Yến Vương1 , Hải Cường Trần1 , Văn Huy Lưu1 , Lưu Thạch Thiên1 , Lý Bạch Bắc1 , Chung Lý2 , Antao Chang3* và Bồ Tăng1*
Tóm tắt
Lý lịch: Chuyển hóa đường phân là mục tiêu hấp dẫn trong điều trị ung thư Lập trình lại các con đường trao đổi chất có thể cải thiện khả năng của các chất ức chế chuyển hóa để ngăn chặn bệnh ung thư với các lựa chọn điều trị hạn chế Hệ thống ubiquitin-proteasome tạo điều kiện thuận lợi cho sự luân chuyển của hầu hết các protein nội bào với E3 ligase mang lại sự lựa chọn mục tiêu và tính đặc hiệu Ubiquitin protein ligase E3 thành phần N-recognin 7 (UBR7), trong số các dây chằng E3 ít được nghiên cứu nhất, nhận ra cơ chất của nó thông qua một fnger miền nội địa thực vật (PHD). Ở đây, chúng tôi tập trung vào vai trò ức chế của nó trong quá trình phân hủy đường và khối u HCC, phụ thuộc vào hoạt động ligase E3 ubiquitin của nó đối với quá trình đơn hóa histone H2B ở lysine 120 (H2BK120ub).
Phương pháp: Trong nghiên cứu này, chúng tôi đã tiến hành sàng lọc RNAi thông lượng cao để xác định các ứng cử viên biểu sinh trong việc điều chỉnh axit lactic và nghiên cứu các vai trò có thể có của nó trong quá trình tiến triển HCC.
Kết quả: Mất UBR7 thúc đẩy quá trình tạo khối u HCC cả in vitro và in vivo UBR7 ức chế quá trình glycolysis bằng cách gián tiếp nhấn vào biểu thức HK2, mục tiêu hạ nguồn của trục
Nrf2/Bach1. Về mặt cơ học, UBR7 điều chỉnh H2BK120ub để liên kết với Keap1bộ khởi động thông qua quá trình đơn hóa H2BK120ub, từ đó điều chỉnh biểu thức Keap1 và tín hiệu Nrf2/Bach1/HK2 xuôi dòng Sự ức chế dược phẩm và di truyền của các enzyme glycolytic làm giảm tác dụng thúc đẩy sự thiếu hụt UBR7 đối với sự phát triển của khối u Ngoài ra, methyltransferase ALKBH5, được điều hòa giảm trong HCC, điều chỉnh biểu hiện UBR7 theo cách phụ thuộc m6A Kết luận: Những kết quả này cùng nhau thiết lập UBR7 như một chất điều chỉnh tiêu cực quan trọng của quá trình glycolysis hiếu khí và sự hình thành khối u HCC thông qua việc điều
gen được coi là dương tính nếu nó được ít nhất hai siRNA cho điểm.
WT và Alb-Cre 8 tuần tuổi;UBR7f/f chuột được sử dụng, đầu tiên là mổ xẻ mô gan chuột, sau đó cắt
Phân tích RNA-seq
Triệu vàcộngsự.JExpClinCancerRes(2022)41:330Trang 3 trên
18 mô gan thành từng mảnh nhỏ, cuối cùng tiêu hóa và chiết xuất các tế bào gan nguyên phát
Thuốc thử Te TRIzol RNA sau đó được sử dụng để tách tổng số RNA từ các tế bào gan nguyên phát. Việc xây dựng và giải trình tự thư viện
cDNA đã được thực hiện trên nền tảng Illumina
HiSeq. Bow tie2 được sử dụng để so sánh kết quả đọc chất lượng cao với bộ gen tham chiếu của con người (GRCh38). Các gen khác biệt
được phân tích bằng phần mềm DESeq2
Xét nghiệm Lactate, Xét nghiệm hấp thu
Glucose và Xét nghiệm ATP Bộ xét nghiệm
Lactate (ab65330), Xét nghiệm hấp thu Glucose (ab136955) và xét nghiệm ATP (ab83355) đã
được mua từ Abcam Việc phát hiện nồng độ lactate, glucose và ATP được thực hiện theo phương pháp được bộ sản phẩm khuyến nghị.
Khối u in vivo
Các tế bào HepG2 biểu hiện quá mức hoặc loại bỏ UBR7 đã được tiêm dưới da vào chuột trần. Khối lượng khối u xenograft được đo hàng tuần. Sau 32 ngày, khối u xenograft được lấy ra và cân
MTT và sự hình thành thuộc địa
Lượng tế bào HCC thích hợp được gieo vào
các đĩa 96 giếng 0,5 mg/ml MTT được thêm
vào khi tế bào được nuôi cấy ở 12 giờ, 24 giờ, 48 giờ và 72 giờ Sau khi ủ trong 4 giờ, 150 μl
DMSO được thêm vào và trộn Đo giá trị OD của từng thời kỳ bằng quang kế quang phổ Một lượng tế bào HCC thích hợp được gieo vào các
đĩa 6 giếng, nuôi cấy trong 14 ngày và môi trường được thay đổi hai lần một tuần. Khả năng hình thành bản sao tế bào được chụp ảnh qua kính hiển vi và số lượng dòng vô tính lớn hơn 25 m được đếm
qPCR tăng cường miễn dịch RNA đã methyl hóa (MeRIP‑qPCR) Xét nghiệm Te
MeRIP-qPCR đã được thực hiện để xác định
m6Cấp độ UBR7 Tổng số RNA nội bào được
chiết xuất bằng thuốc thử TRIzol Chống
m6Kháng thể hoặc kháng globulin miễn dịch G
(IgG; Công nghệ tín hiệu tế bào) (3 µg) lần đầu
tiên được liên hợp với các hạt từ tính protein
A/G và trộn với 100 µg tổng số RNA trong đệm
IP có chứa chất ức chế RNase/protease.
tôi6A-sửa đổi
(Xem hình ảnh ở trang tiếp theo )
RNA được rửa giải hai lần với 6,7 mM
N6-methyladenosine 5'-monophosphate muối
natri ở 4 oC trong 1 giờ
Phân tích thống kê
Phân tích thống kê được thực hiện bằng phần
mềm SPSS Ý nghĩa thống kê giữa giá trị trung
bình của một bà mẹ nhỏ gồm ba nhóm được
xác định bằng cách sử dụng bài kiểm tra t của
Sinh viên hai đuôi không ghép đôi, ANOVA hai
chiều hoặc phân tích hồi quy tuyến tính. Dữ liệu
Te được biểu thị dưới dạng độ tuổi trung bình ±
SD P<0,05 được coi là có ý nghĩa thống kê.
Tất cả các kết quả đều đại diện cho ít nhất ba thí nghiệm độc lập
Kết quả
Sàng lọc RNAi xác định các ứng cử viên biểu sinh trong việc điều hòa axit lactic
Để khám phá các yếu tố điều chỉnh biểu sinh
của quá trình glycolysis trong các tế bào HCC, chúng tôi đã thực hiện sàng lọc RNA kẹp tóc nhỏ (shRNA) thông lượng cao dựa trên tế bào trong các tế bào MHCC-97L bằng cách sử dụng
bộ xét nghiệm lactate để đo sự thay đổi của axit lactate trong chất nổi sau 3% O2 điều trị trong 12 giờ Thư viện sàng lọc bao gồm 1 122 shRNA duy nhất biểu hiện lentivirus, nhắm mục tiêu 561 gen ứng cử viên mã hóa bộ điều biến cấu trúc nhiễm sắc thể và chức năng
hoạt động (Hình 1MỘT) Theo những thay đổi trong việc tiết axit lactate sau khi truyền shRNA, 9 gen đã được xác định trong sàng lọc chính, bao gồm UBR7, việc làm im lặng giúp tăng
siRNA (Hình bổ sung 2). 1B-D). Các nghiên
cứu trước đây đã báo cáo tầm quan trọng của việc phối hợp kẽm His163 và His166 trong hoạt động xúc tác của UBR7, đột biến của chúng sẽ ảnh hưởng đến hoạt động ligase E3 ubiquitin
đối với quá trình đơn hóa của histone H2B [9]
Để xác nhận rõ hơn vai trò của UBR7 trong quá trình đường phân HCC, các tế bào BEL-7402 biểu hiện UBR7 kiểu hoang dã (UBR7-WT) và UBR7 đột biến phân tử ở mèo H163S/H166S (UBR7-CM) đã được chế tạo và thực hiện sàng lọc chức năng. Rõ ràng, sự biểu hiện quá mức của UBR7-WT, chứ không phải UBR7-CM, đã ức chế đáng kể sự tiết axit lactate trong các tế bào BEL-7402, cho thấy tác dụng ức chế của UBR7 đối với nồng độ axit lactate có lẽ phụ thuộc vào hoạt động ligase E3 ubiquitin của nó đối với quá trình đơn hóa của histone H2B (Hình bổ sung 1MỘT)
Hơn nữa, bằng cách so sánh mức độ mRNA của UBR7 trong các mô HCC (N=20) và mô gan bình thường (N= 20), chúng tôi thấy rằng biểu hiện của UBR7 ở các khối u nguyên phát thấp hơn đáng kể so với các mô bình thường (Hình 2). 1D), phù hợp với số lượng bản sao gen giả định thấp hơn của UBR7 trong các mẫu
khối u từ GIS
Cơ sở dữ liệu TIC (Hình 2) 1Đ) Ngược lại với
các mô lân cận bình thường, nồng độ protein
UBR7 thấp hơn đáng kể trong các mô khối u
nguyên phát, ngụ ý hoạt động ức chế khối u
tiềm tàng của UBR7 trong HCC (Hình 2) 1F)
Kết hợp lại với nhau, những dữ liệu này cho
thấy UBR7 đóng vai trò mạnh mẽ trong việc
điều chỉnh nồng độ axit lactate trong HCC, điều này có thể góp phần ức chế khối u.
UBR7 ức chế sự tăng sinh HCC và sự hình
thành khối u Để mô tả ảnh hưởng của UBR7
đến sự tăng sinh tế bào, chúng tôi đã so sánh
mức độ im lặng và biểu hiện quá mức của
UBR7 trong các dòng tế bào HCC Các tế bào HepG2 và Huh-7 đã được thay thế bằng các vec tơ lentivirus mã hóa các phần chèn UBR7
hoặc shRNA của con người và biểu hiện của UBR7 được đo bằng phương pháp miễn dịch (Hình bổ sung. 2MỘT, 3B). Sự biểu hiện quá mức của UBR7 rõ ràng đã ức chế khả năng tồn tại và hình thành khuẩn lạc của các tế bào HCC, như được xác định bằng các thử nghiệm hình thành khuẩn lạc và MTT; trong khi sự thiếu hụt UBR7 dẫn đến tăng khả năng tồn tại và hình
thành khuẩn lạc trong các tế bào HCC (Hình 2).
2MỘT, Hình bổ sung 2C-F). Điều quan trọng là, những ức chế như vậy gây ra bởi sự biểu hiện quá mức của UBR7 là không rõ ràng trong các tế bào HCC được thay thế bằng UBR7-CM, điều này một lần nữa nhấn mạnh tầm quan
trọng của hoạt động xúc tác của UBR7 đối với
chức năng ức chế khối u của nó (Hình 2) 2G, 2H) Sự biểu hiện quá mức của UBR7 đã ức
chế đáng kể sự xâm lấn tế bào trong khi việc hạ
gục UBR7 làm tăng sự xâm lấn tế bào trong các
tế bào HepG2 và Huh7 (Bổ sung
Quả sung. 2TÔI, 2 J). Hơn nữa, sự biểu hiện quá mức của UBR7 đã thúc đẩy quá trình tự
hủy của tế bào, nhưng việc làm im lặng UBR7
lại có tác dụng ngược lại (Hình bổ sung 2 K)
Phù hợp với các quan sát in vitro ở trên, chuột xenograft được cấy tế bào HepG2 mang khối chèn UBR7 cho thấy khối lượng và trọng lượng khối u giảm so với mod đối chứng
els, trong khi sự hình thành khối u vượt quá đã
được tìm thấy trong xenograft được thiết lập
bằng cách tiêm tế bào HepG2 thiếu UBR7 (Hình 2). 2B). Kết hợp lại với nhau, những dữ liệu này
ngụ ý rằng UBR7 có thể ngăn chặn sự hình thành khối u HCC bằng cách ức chế
ảnh hưởng đến khả năng sống sót của tế bào, hình thành khuẩn lạc, tăng sinh và xâm lấn tế bào
Để khám phá thêm chức năng của UBR7 đối với nguyên nhân khối u HCC, chúng tôi đã tạo ra chuột tiêu diệt UBR7 dành riêng cho gan (Alb-Cre; UBR7f/f chuột) bằng cách vượt qua UBR7f/f những con chuột có chuột albumin-Cre và sự im lặng của UBR7 trong gan đã được xác nhận bằng phương pháp miễn dịch và nhuộm IHC (Hình bổ sung. 3MỘT, 3B). Lúc 9 tháng tuổi, Alb-Cre; UBR7f/f chuột đã phát triển các khối u có thể nhìn thấy được, hầu như không được nhìn thấy ở những người bạn cùng lứa
WT của chúng (Hình 2) 2C) So sánh với những người bạn cùng lứa kiểm soát của họ, Alb-Cre; UBR7f/f những con chuột có tỷ lệ sống sót ngắn hơn đáng kể (Hình 2) 2Đ) Về mặt logic, nhuộm H&E của gan từ Alb-Cre 9 tháng tuổi; Chuột UBR7f/f cho thấy các đặc điểm HCC rõ ràng như chứng loạn sản tế bào rõ ràng. (Quả sung. 2Đ). Ngoài ra, Alb-Cre; UBR7f/f chuột biểu hiện bệnh tiến triển nhanh hơn với số lượng khối u, diện tích khối u, kích thước tối đa và biểu hiện Ki67 tăng lên (Hình 2) 2F) Nói chung, các phát hiện trên cho thấy
rằng sự suy giảm UBR7 thúc đẩy quá trình tạo khối u HCC cả in vitro và in vivo.
UBR7 ức chế quá trình đường phân bằng cách điều chỉnh tiêu cực HK2 Để hiểu rõ hơn
về các cơ chế tiềm năng góp phần tạo ra khối u gan bị ức chế UBR7, các phân tích phiên mã trình tự RNA (RNA-seq) đã được thực hiện với các tế bào gan phân lập từ WT và Alb Cre; UBR7f/f chuột. Kết quả là, tổng cộng 104 gen
được điều hòa tăng đáng kể và 369 gen bị điều hòa giảm ở gan của Alb-Cre; UBR7f/f chuột (Hình. 3MỘT). Như thể hiện trong hình. 3B, trong số 10 con đường Gene Onology (GO)
được làm giàu hàng đầu, cả con đường trao đổi chất và quá trình ly giải glyco đều nổi bật là một trong những con đường được làm giàu đáng kể
nhất, cho thấy vai trò thiết yếu của UBR7 trong
việc điều hòa quá trình trao đổi chất và quá trình glycolysis. Bên cạnh bộ gen lõi metab olism
được quy định bởi phiên mã phụ thuộc UBR7 trong HCC, Phân tích làm giàu bộ gen (GSEA)
cũng phát hiện ra dấu hiệu dựa trên HK2 theo quy định của UBR7 Cho rằng HK2 được biểu hiện cao trong HCC và là dạng đồng phân hiệu quả nhất của hexokinase trong quá trình thúc
đẩy quá trình glycolysis hiếu khí, tiếp theo chúng tôi điều tra xem liệu UBR7 có thể điều hòa biểu hiện HK2 trong HCC hay không. Rõ ràng, sự biểu hiện gia tăng của HK2 đã được quan sát thấy trong các tế bào gan của Alb-Cre; UBR7f/f chuột so với WT của chúng
khác biệt đáng chú ý nào về mức độ phổ biến
của HK2 giữa
các tế bào xáo trộn và biểu hiện quá mức
UBR7, hỗ trợ rằng HK2 có thể không phải là
mục tiêu trực tiếp của UBR7 (Hình bổ sung
tary. 4VÀ).
Vì cả quá trình trao đổi chất và quá trình đường phân đều được xác định là con đường bị thay đổi đáng kể nhất trong UBR7
Huh-7 với biểu hiện quá mức của UBR7 (Hình 2) 4B) Trong khi đó, khả năng di chuyển tế
bào và hình thành khuẩn lạc của các tế bào
Huh-7 cũng bị đảo ngược đáng kể do biểu hiện quá mức HK2 trong nền UBR7 (Hình 2). 4ĐĨA CD). Các kết quả tương tự cũng thu được ở
các tế bào BEL-7402 được thay thế bằng các
phần chèn tương tự (Hình bổ sung. 5). Như thể
hiện trong (Hình 4VÀ), kích thước khối u, trọng
lượng khối u, tỷ lệ di căn hạch và kích thước
hạch được đánh giá trong xenograft chuột được
tiêm tế bào Huh-7 được chuyển nhiễm kép
Bằng chứng te in vivo cũng tiết lộ rằng sự biểu
hiện quá mức của HK2 đã loại bỏ tác dụng ức
chế tăng trưởng do biểu hiện quá mức của
UBR7 gây ra.
Tương tự như vậy, các dòng tế bào HepG2 ổn
định được thay thế bằng cả shRNA UBR7 và HK2 cũng được thiết lập để kiểm tra vai trò của
trục UBR7-HK2 trong quá trình đường phân, cũng như sự tăng sinh tế bào và gây ung thư (Hình 2) 4F) Đúng như dự đoán, sự suy giảm
Triệu vàcộngsự.JExpClinCancerRes(2022)41:330Trang 8 trên 18 tế bào gan bị loại bỏ, tiếp theo chúng tôi đã kiểm tra xem liệu UBR7 có phải là yếu tố quan trọng trong việc điều chỉnh quá trình chuyển hóa HCC hay không, đặc biệt là quá trình đường phân. Tế bào gan nguyên phát từ WT và Alb-Cre; UBR7f/f Do đó, chuột được phân tích về hiệu quả phân hủy gly, về tốc độ tiêu thụ oxy (OCR), sự hấp thu glucose và mức độ tiết lactate Đúng như dự đoán, tốc độ phân giải đường và sự hấp thu glucose tăng cao đã được tìm thấy ở UBR7f/f tế bào gan chuột Hơn nữa, UBR7f/f tế bào gan chuột biểu hiện giảm đáng kể OCR và bài tiết lactate (Hình 2) 3Đ) Các kết quả tương tự cũng được tìm thấy trong các tế bào HepG2 và BEL 7404 thiếu UBR7 (Hình 2). 3F, Hình bổ sung. 4G), trong khi xu hướng ngược lại được quan sát thấy khi biểu hiện quá mức UBR7 trong các tế bào BEL-7402 và BEL-7404 (Hình 2) 3E, Sup bổ sung Hình 4F)
Những phát hiện này hoàn toàn ngụ ý rằng
UBR7 có thể ức chế quá trình đường phân bằng cách gián tiếp ức chế biểu hiện HK2 trong HCC
Quá trình glycolysis được kích thích bởi HK2 làm trung gian cho sự di căn do thiếu UBR7 gây ra và kiểu hình xâm lấn Tác dụng
ức chế của UBR7 đối với biểu hiện HK2, quá trình glycolysis hiếu khí và sự hình thành khối u trong tế bào gan đã thôi thúc chúng tôi khám phá sâu hơn về mối liên hệ cơ bản Vì UBR7 điều chỉnh tiêu cực HK2, một loại enzyme giới hạn tốc độ tới hạn trong quá trình đường phân hiếu khí, do đó chúng tôi bắt đầu kiểm tra xem liệu UBR7 có phát huy chức năng của nó hay không phụ thuộc vào HK2 trong HCC. Cuối cùng, các dòng tế bào Huh-7 ổn định thể hiện cả phần chèn UBR7 và HK2 đã được thiết lập (Hình 2). 4MỘT). Rõ ràng, sự biểu hiện cưỡng bức của HK2 gần như đã giải cứu hoàn toàn tốc độ glycolysis và mức ATP trong các tế bào
HK2 cũng đã loại bỏ thành công các kích thích lý thuyết ảnh hưởng đến tốc độ đường phân, nồng độ ATP, sự di chuyển tế bào và sự hình thành khuẩn lạc trong các tế bào HepG2 thiếu UBR7 (FTôig. 4G-I). Phù hợp với các phát hiện trước đó, việc điều hòa giảm biểu hiện HK2 đã loại bỏ hoàn toàn kiểu hình tăng sinh và glycolytic trong các tế bào BEL-7404
được thay thế bằng các shRNA UBR7 và HK2 (Hình bổ sung 6) Hơn nữa, các quan sát trùng hợp đã đạt được bằng mô hình xenograft, cho thấy tác động thúc đẩy sự suy giảm của UBR7
đối với sự phát triển của khối u và bệnh di căn
đã bị suy giảm do làm im lặng HK2 (Hình 2) 4J) Nhìn chung, những quan sát này chỉ ra rằng HK2 là chất không thể thiếu trong việc điều hòa quá trình chuyển hóa glucose và hình thành khối u bởi UBR7 trong HCC.
UBR7 thúc đẩy biểu hiện Keap1 bằng
cách phổ biến H2BK120ub trên Keap1
UBR7 đã được báo cáo là điều chỉnh các kiểu
phổ biến của histone H2B ở lysine120
kể bởi UBR7
biểu hiện quá mức trong các tế bào Huh-7 và BEL-7402 (FTôigs. 5I, Hình bổ sung. 7C, 7Đ).
Để mô tả rõ hơn vai trò của UBR7 trong việc
điều chỉnh biểu thức Keap1, UBR-WT và UBR CM có chiều dài đầy đủ đã được chuyển vào các ô Huh-7 và BEL-7402.
Triệu vàcộngsự.JExpClinCancerRes(2022)41:330Trang 10 trên 18
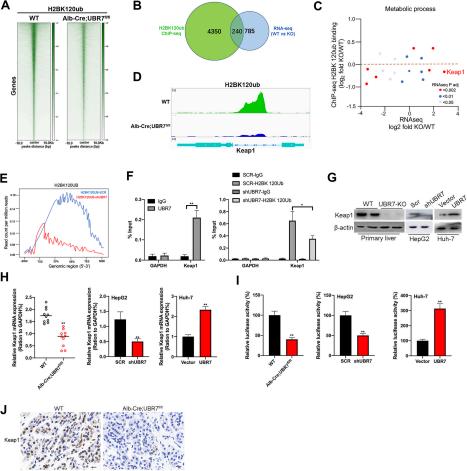
Hình 5 UBR7 thúc đẩy mức độ biểu hiện Keap1 bằng cách phổ biến H2BK120ub trên Keap1 MỘT Sơ đồ nhiệt tóm tắt dữ liệu về kích thích miễn dịch nhiễm sắc thể (ChIP) -seq cho H2BK120ub, so sánh các tế bào gan từ WT và Alb-Cre;UBR7f/f chuột B Biểu đồ Venn cho thấy 240 gen kết hợp với H2BK120ub trong phân tích ChIP-seq và các gen được điều chỉnh trong phân tích RNA-seq trùng lặp C Sơ đồ các gen của quá trình trao đổi chất trục x, biểu hiện gen từ dữ liệu RNA-seq; trục y, mức liên kết H2BK120UB được xác định trong dữ liệu ChIP-seq. D Đỉnh gen Keap1 trong tế bào gan từ WT và Alb-Cre;UBR7f/f chuột. VÀ Bản đồ mật độ gen trung bình của các vị trí gắn kết H2BK120Ub trong các tế bào Huh-7 biểu hiện Control (SCR) và UBR7-shRNA. F Bên trái: Biểu đồ dạng vạch để làm giàu PCR định lượng (qPCR) của phương pháp kích thích miễn dịch nhiễm sắc thể UBR7 (ChIP) trong các tế bào Huh-7 cho Keap1 GAPDH đã được sử dụng làm đối chứng âm Phải: Biểu đồ dạng thanh làm giàu qPCR của
trên 18
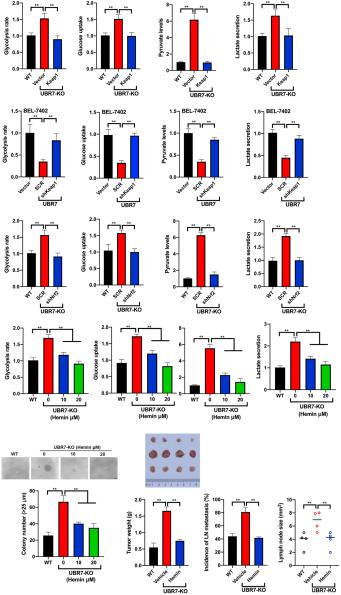
Hình 6 (Xem chú thích ở trang trước.)
với các mẫu bệnh phẩm (Hình 2). 8Đ). Thật
vậy, mức độ biểu hiện của UBR7 có mối tương
quan thuận với biểu hiện Keap1 ở các loài lâm
sàng này, nhưng nó tương quan nghịch với biểu
hiện HK2 và Nrf2 (Hình bổ sung 2) 15) Ngoài
ra, nồng độ protein của UBR7 trong mô HCC
thấp hơn đáng kể, khác biệt theo giai đoạn phát
triển khối u (Hình 2) 8Đ) Phân tích bệnh lý lâm
sàng được xây dựng thêm để chứng minh ý
nghĩa lâm sàng của UBR7, đặc biệt là về đường
kính và sự khác biệt của khối u (Bảng bổ trợ 1).
Nhìn chung, các kết quả thu được từ bộ dữ liệu
của con người và các mẫu lâm sàng đã hỗ trợ
mạnh mẽ cho khả năng UBR7 hoạt động như
một chất ức chế khối u trong HCC bằng cách
điều chỉnh trục Keap1/Nrf2/Bach1/HK2 (Hình 2) 8F)
Cuộc thảo luận
Do tính đặc hiệu cơ chất cao, máy móc ligase E3 ubiquitin đã nổi lên như một mục tiêu trị liệu
hấp dẫn để điều trị ung thư. Những năm gần
đây đã chứng kiến sự ra đời của keo phân tử
hoặc chất phân hủy PROTAC chiếm quyền điều
khiển hoạt động xúc tác E3 để nhắm mục tiêu cụ thể và làm suy giảm các protein gây bệnh nội
bào, điều này nhấn mạnh tầm quan trọng của
việc hiểu cấu trúc liên kết cơ chất và chức năng
tế bào của dây chằng E3 [27] Trong số bảy thành viên thuộc họ UBR ở người, UBR7 là
thành viên khác biệt nhất hoạt động cụ thể trong
đường dẫn quy tắc N-end và sở hữu fnger PHD
với các mẫu Cys và phần dư của His tương tự như của miền RING [28]. Trong nghiên cứu này, chúng tôi báo cáo vai trò bảo vệ của UBR7 đối
với quá trình gây ung thư HCC bằng cách ngăn
chặn sự gặp phải
lập trình lại quá trình đồng hóa theo hướng
glycolysis hiếu khí Về mặt cơ học, UBR7 cản
trở quá trình glycolysis hiếu khí bằng cách trung gian
Trang 14
trên 18
kích hoạt phiên mã của Keap1 và tín hiệu Nrf2/Bach1/HK2 xuôi dòng của nó thông qua việc đơn hóa âm H2B của anh ấy
Các dây chằng E3 hộp UBR như UBR1, UBR2, UBR4 và UBR5 là các N-recognin chính, có nhiều chất nền sinh lý khác nhau và đóng vai trò điều hòa thiết yếu trong nhiều con đường truyền tín hiệu, chẳng hạn như apoptosis, truyền tín hiệu G-protein, gây viêm, kiểm soát chất lượng ty thể và căng thẳng sao chép, trong các cơ chế đặc trưng [8]. Mối liên kết giữa họ UBR và colysis gly là khó nắm bắt, mặc dù UBR5 đã được báo cáo là thúc đẩy quá trình glycolysis hiếu khí trong PDAC và thúc đẩy sự phát triển của khối u [29] UBR3, UBR6 và UBR7 không liên kết với N-degron và chức năng của chúng phần lớn vẫn chưa được biết đến Tuy nhiên, trong nghiên cứu này, lần đầu tiên chúng tôi đã xác định được vai trò ức chế của UBR7 trong quá trình đường phân ở các tế bào MHCC-97L bằng xét nghiệm sàng lọc chức năng của chúng tôi trong các tế bào HCC im lặng bằng UBR7. Đáng chú ý, tác dụng của
UBR7 đối với nồng độ axit lactate phụ thuộc vào hoạt động ligase E3 ubiquitin của nó đối với
H2BK120ub, được hỗ trợ bởi sự ức chế vô hiệu của đột biến xúc tác UBR7 của H163S/H166S
Bằng chứng ngày càng tăng đã nhấn mạnh tầm quan trọng của sự phổ biến rộng rãi như một trong những sửa đổi dịch mã lớn nhất sau histone Không giống như hiện tượng đa hồng cầu, đánh dấu sự phân hủy protein thông qua proteasome, hiện tượng đơn sắc đề cập đến sự gắn kết cộng hóa trị của một ubiquitin đơn lẻ với các lysine cụ thể của đuôi histone. Sự biến đổi sau dịch mã trên histone có liên quan đến nhiều quá trình cơ bản của tế bào bao gồm kéo dài phiên mã, phản ứng phá hủy DNA, biệt hóa tế bào gốc và phát sinh ung thư [30, 31] Sự đơn hóa ở lysine 120 trên histone H2B có vai trò ức
chế khối u vì mức độ toàn cầu của H2BK120ub thấp đến không có trong các loại hộp tiên tiến Hơn nữa, các thuốc ức chế khối u cổ điển, chẳng hạn như p53, BRCA1 hoặc RING fnger
E3 ubiquitin dây chằng RNF20 và RNF40, được
báo cáo là đối tác của H2BK120ub inter Actomes [32]. Sự điều hòa giảm UBR7 ở bệnh nhân HCC phụ thuộc vào sự điều chỉnh m6A
qua trung gian ALKBH5, điều này có thể ảnh hưởng đến sự ổn định của mRNA. Nhất quán, sự mất UBR7 đã được quan sát thấy trong cả
cơ sở dữ liệu GISTIC và các mẫu khối u gan
nguyên phát, cho thấy chức năng ức chế khối u giả định Để giải quyết khả năng này, các thử nghiệm tăng và giảm chức năng đã được thực hiện trong các dòng tế bào HCC và xenograft tương ứng, và chuột bị loại UBR7 đặc hiệu ở
gan (Alb-Cre; UBR7f/f chuột) biểu hiện sự tiến
triển bệnh nhanh hơn nhiều, cho thấy tác dụng
ức chế của UBR7 đối với sự hình thành khối u HCC. Những quan sát tương tự đã được tìm
thấy trong bệnh ung thư vú rằng UBR7 hoạt
động như một ligase H2BK120ub và một chất
ức chế khối u 9] Ngoài ra, các sản phẩm tự
nhiên manumycin polyketide (asukamycin và manumycin A) có chức năng như chất keo phân
tử giữa UBR7 và p53 để tương tác p53 và ức chế ung thư vú [33] Rõ ràng, kiến
thức tổng hợp về H2BK120ub và tương tác của nó như UBR7 có thể mang lại cơ hội mới cho
mục tiêu điều trị bệnh ác tính. Mặc dù có chức năng chống ung thư trong các khối u rắn như ung thư vú và HCC, UBR7 được xác định là mục tiêu phiên mã của NOTCH1 và đóng vai trò gây ung thư trong bệnh bạch cầu lymphoblastic cấp tính tế bào T [12] Tus, cần phải điều tra thêm để làm sáng tỏ đầy đủ vai trò gây tranh cãi của UBR7 trong bệnh ung thư H2BK120ub đã được chứng minh là có tác dụng thúc đẩy quá trình thư giãn nhiễm sắc thể cục bộ, thúc đẩy cấu
trúc nhiễm sắc mở hơn mà các yếu tố phiên mã có thể tiếp cận được. Ở đây, chúng tôi đã chứng minh rằng Keap1 là mục tiêu chính của UBR7 và việc làm giàu H2BK120ub trên bộ khởi động của nó được trung gian bởi UBR7 Việc làm giàu H2BK120ub qua trung gian UBR7 đã thúc đẩy quá trình kích hoạt phiên mã của Keap1, hạn chế tín hiệu Nrf2/ Bach1/HK2 xuôi dòng Ngoài ra, sự phổ biến hóa H2BK120 đã
được báo cáo là đóng vai trò trung tâm trong quá trình trao đổi chéo histone, ảnh hưởng đến các sự kiện methyl hóa trên histone H3 bằng cách tuyển dụng các phức hợp methyltransferase, bao gồm H3K4 di- và tri-methyl hóa (H3K4me3), cũng như H3K79 tri-methyl hóa (H3K79me3) [32] Các sửa đổi biểu sinh, chẳng hạn như làm giàu H3K4Me3 và H3K27Ac trên chất kích thích KEAP1, được biết
là có tác dụng điều chỉnh biểu hiện KEAP1 trong
ung thư đại trực tràng [34]. Fur thermore, UBR7
liên kết với các histone H3K4me3 và H3K9me3
sau nucleosome thông qua hộp UBR và PHD fn ger, kích hoạt sự tái hợp nhất các phức hợp H3
sau nucleosome như một người đi kèm histone [11] Sự suy giảm UBR7 làm giảm đáng kể
H3K79Me2, chất chủ yếu hiện diện cùng với
H2BK120ub [9] Trước hết, nhiễu xuyên âm
chức năng giữa sự phổ biến của H2B ở Lys120
(H2BK120ub) và quá trình methyl hóa H3 theo quy định của UBR7 trên biểu hiện Keap1 đòi hỏi phải khám phá thêm, điều này có thể hỗ trợ phát triển thuốc biểu sinh trong tương lai.
Phần kết luận
Nghiên cứu của chúng tôi minh họa rằng UBR7
ức chế sự hình thành khối u HCC thông qua
quá trình glycolysis nhắm mục tiêu, vai trò bảo
vệ của nó phụ thuộc vào hoạt động xúc tác của nó đối với H2BK120ub. H2BK120ub có thể
hình thành cấu trúc nhiễm sắc thể lỏng lẻo để
tạo ra sự phiên mã của Keap1 điều chỉnh tiêu
cực tín hiệu Nrf2/Bach1/HK2 xuôi dòng Sự ức
chế dược phẩm và di truyền của các enzyme glyco lytic làm giảm tác dụng kích thích của sự thiếu hụt UBR7 đối với sự phát triển của khối u Mức độ UBR7 giảm được quan sát thấy trong
HCC là do tính ổn định của mRNA giảm, điều này được điều hòa bởi sự điều chỉnh m6A phụ thuộc ALKBH5 của các adenosine cụ thể trong
UBR7. Những phát hiện của chúng tôi nâng cao khả năng nhắm mục tiêu glycolysis đến UBR7 trong HCC có thể là một chiến lược điều trị tiềm năng
Triệu vàcộngsự.JExpClinCancerRes(2022)41:330Trang 17 trên 18
Lời cảm ơn
Không áp dụng được.
Chữ viết tắt
UBR7: Ubiquitin protein ligase E3 thành phần N-recognin 7; PHD: Tên miền nội địa thực vật; H2BK120ub: Sự phổ biến đơn sắc của histone H2B ở lysine 120; HCC: Ung thư biểu mô tế bào gan; UBR: Ubiquitin protein ligase E3 thành phần N-recognin; HK: Hexokinase; shRNA: RNA kẹp tóc nhỏ; siRNA: RNA can thiệp nhỏ; UBR7-WT: Các ô BEL-7402 biểu thị kiểu hoang dã; UBR7-CM: đột biến xúc tác H163S/ H166S; RNA-seq: giải trình tự RNA; GO: Bản thể gen; GSEA: Phân tích làm giàu bộ gen; OCR: Tốc độ tiêu thụ oxy; ChIP-seq: Giải trình tự tăng cường miễn dịch nhiễm sắc thể; Nrf2: Yếu tố liên quan đến NF-E2 2; Bach1: Miền BTB và tương đồng
CNC 1; 2-DG: 2-Deoxyglucose; LND: Amin Lonid; DCA: Dicholoroaxetat; PDK: Pyruvate dehydrogenase kinase; TCGA : Bản đồ bộ gen ung thư; RIP: Kích thích miễn dịch protein gắn với RNA; H3K4me3: H3K4 di- và tri-methyl hóa; H3K79me3: tri-methyl hóa H3K79
Thông tin bổ sung
Phiên bản trực tuyến có chứa tài liệu bổ sung có sẵn tại https://doi. org/10.1186/s13046-022-02528-6.
Tệp bổ sung 1.
Đóng góp của tác giả
B T đã đóng góp vào việc thiết kế ý tưởng của nghiên cứu và giám sát tất cả các công việc L
Z , M K , ZR W và XM L đã hoàn thành các thí nghiệm chính và phân tích dữ liệu; YW, WH.L, SQ. L., BB.L, HQ. C. và C. L. đã cung cấp một số tài liệu và hướng dẫn thí nghiệm; L. Z. và A. C. đã viết và biên tập bản thảo với sự đóng góp của tất cả các tác giả khác. (Các) tác giả đã đọc và phê duyệt bản thảo cuối cùng
Tài trợ
Nghiên cứu này được hỗ trợ một phần bởi Quỹ Khoa học Tự nhiên Quốc gia Trung Quốc (số 81871938, 82173118), Quỹ Khoa học Tự nhiên
Quảng Tây cho Chương trình Nghiên cứu & Phát triển Trọng điểm (GuiKe AB21075003), Quỹ Khoa học Tự nhiên Quảng Tây cho
Chương trình Thống nhất Quảng Đông-Quảng
Tây (2021GXNSFDA075014)
Sự sẵn có của dữ liệu và tài liệu
Dữ liệu ChIP-Seq và RNA-Seq có thể được truy cập tại GEO với số đăng nhập
GSE173454 và GSE173501 Tất cả các dữ
liệu liên quan có thể được lấy từ tác giả theo yêu cầu
Tuyên bố
30. DJ Marsh, Dickson KA. Viết sự phổ biến của Histone ở người Bệnh ác tính-Vai trò của dây chằng Ubiquitin E3 ở ngón đeo nhẫn. Gen (Basel). 2019; 10.
31 Marsh DJ, Mã Ý, Dickson KA Sự đơn sắc hóa Histone ở Chromatu sửa thiếc: Tập trung vào tương tác Histone H2B và ung thư Ung thư (Basel) 2020; 12
32 Cole AJ, Clifton-Bligh R, DJ Marsh Histone H2B monoubiquitinavấn đề: vai trò trong bệnh ác tính của con người Ung thư liên quan đến nội tiết 2015;22:T19-33
[ Bài viết miễn phí của PMC ] [ PubMed ] 33 Isobe Y, Okumura M, McGregor LM, Brittain SM, Jones MD, Liang X, 2002. và cộng sự. Manumycin polyketide hoạt động như chất keo phân tử giữa UBR7 và P53. Nat Chem Biol. 2020;16:1189–98.
34. Gao L, Yuan F, Che G, Xiao X, Nie X, Wang Y, et al. Sửa đổi biểu sinh nhưng đa hình di truyền không điều chỉnh biểu hiện KEAP1 ở đại trực tràng bệnh ung thư Hóa sinh tế bào J 2019;120:12311–20
Ghi chú của nhà xuất bản
Springer Nature vẫn trung lập đối với các khiếu nại về quyền tài phán trong công bốbản đồ và liên kết thể chế
Sẵn sàng để gửi và gửi nghiên cứu của bạn? Hãy chọn BMC và hưởng lợi từ:
• nộp hồ sơ trực tuyến nhanh chóng, tiện lợi
• đánh giá ngang hàng kỹ lưỡng bởi các nhà nghiên cứu có kinh nghiệm trong lĩnh vực của bạn
• công bố nhanh chóng về sự chấp nhận
• hỗ trợ dữ liệu nghiên cứu, bao gồm các loại dữ liệu lớn và phức tạp
• truy cập mở vàng thúc đẩy cộng tác rộng hơn và tăng cường trích dẫn
• khả năng hiển thị tối đa cho nghiên cứu của bạn: hơn 100 triệu lượt xem trang web mỗi năm
Tại BMC, nghiên cứu luôn được tiến hành.
Tìm hiểu thêm biomedcentral.com/submissions
