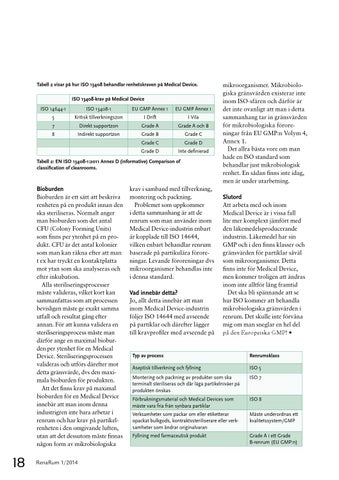
Tabell 2 visar på hur ISO 13408 behandlar renhetskraven på Medical Device. ISO 13408-krav på Medical Device ISO 14644-1
ISO 13408-1
EU GMP Annex 1
EU GMP Annex 1
5
Kritisk tillverkningszon
I Drift
I Vila
7
Direkt supportzon
Grade A
Grade A och B
8
Indirekt supportzon
Grade B
Grade C
Grade C
Grade D
Grade D
Inte definierad
Tabell 2: EN ISO 13408-1:2011 Annex D (informative) Comparison of classification of cleanrooms.
Bioburden Bioburden är ett sätt att beskriva renheten på en produkt innan den ska steriliseras. Normalt anger man bioburden som det antal CFU (Colony Forming Units) som finns per ytenhet på en produkt. CFU är det antal kolonier som man kan räkna efter att man t ex har tryckt en kontaktplatta mot ytan som ska analyseras och efter inkubation. Alla steriliseringsprocesser måste valideras, vilket kort kan sammanfattas som att processen bevisligen måste ge exakt samma utfall och resultat gång efter annan. För att kunna validera en steriliseringsprocess måste man därför ange en maximal bioburden per ytenhet för en Medical Device. Steriliseringsprocessen valideras och utförs därefter mot detta gränsvärde, dvs den maximala bioburden för produkten. Att det finns krav på maximal bioburden för en Medical Device innebär att man inom denna industrigren inte bara arbetar i renrum och har krav på partikelrenheten i den omgivande luften, utan att det dessutom måste finnas någon form av mikrobiologiska
18
RenaRum 1/2014
krav i samband med tillverkning, montering och packning. Problemet som uppkommer i detta sammanhang är att de renrum som man använder inom Medical Device-industrin enbart är kopplade till ISO 14644, vilken enbart behandlar renrum baserade på partikulära föroreningar. Levande föroreningar dvs mikroorganismer behandlas inte i denna standard.
Vad innebär detta? Jo, allt detta innebär att man inom Medical Device-industrin följer ISO 14644 med avseende på partiklar och därefter lägger till kravprofiler med avseende på
mikroorganismer. Mikrobiologiska gränsvärden existerar inte inom ISO-sfären och därför är det inte ovanligt att man i detta sammanhang tar in gränsvärden för mikrobiologiska föroreningar från EU GMP:n Volym 4, Annex 1. Det allra bästa vore om man hade en ISO standard som behandlar just mikrobiologisk renhet. En sådan finns inte idag, men är under utarbetning.
Slutord Att arbeta med och inom Medical Device är i vissa fall lite mer komplext jämfört med den läkemedelsproducerande industrin. Läkemedel har sin GMP och i den finns klasser och gränsvärden för partiklar såväl som mikroorganismer. Detta finns inte för Medical Device, men kommer troligen att ändras inom inte alltför lång framtid Det ska bli spännande att se hur ISO kommer att behandla mikrobiologiska gränsvärden i renrum. Det skulle inte förvåna mig om man sneglar en hel del på den Europeiska GMP! •
Typ av process
Renrumsklass
Aseptisk tillverkning och fyllning
ISO 5
Montering och packning av produkter som ska terminalt steriliseras och där låga partikelnivåer på produkten önskas
ISO 7
Förbrukningsmaterial och Medical Devices som måste vara fria från synbara partiklar
ISO 8
Verksamheter som packar om eller etiketterar opackat bulkgods, kontraktssteriliserare eller verksamheter som ändrar originalvaran
Måste underordnas ett kvalitetssystem/GMP
Fyllning med farmaceutisk produkt
Grade A i ett Grade B-renrum (EU GMP:n)