
Curso continuo de actualización en Pediatría CCAP
Volumen 24 Número 3 Septiembre - Diciembre 2025




Curso continuo de actualización en Pediatría CCAP
Volumen 24 Número 3 Septiembre - Diciembre 2025


Junta Directiva Nacional 2024 - 2026
Presidente
Vicepresidente
Secretario
Vocal
Vocal
Vocal
Vocal
Vocal
Vocal
Vocal
Fiscal
Vocal Representante de Capítulos
Expresidente
Dra. Eliana Zemanate Pediatra Intensivista (Editora)
Dra. Nury Mancilla Pediatra Neuróloga
Dr. Víctor Mora Pediatra
Dr. Mauricio Javier Guerrero Román
Dra. Eliana Zemanate Zúñiga
Dr. Alberto José Esmeral Ojeda
Dra. Claudia Patricia Beltrán Arroyave
Dr. Jerónimo Zuluaga Vargas
Dra. Ángela María Giraldo Mejía
Dr. Víctor Manuel Mora Bautista
Dra. Liliam María Macías Lara
Dr. Mauricio Hernández Cadena
Dr. Iván Alejandro Villalobos Cano
Dra. Iliana Francineth Curiel Arizmendi
Dra. Nury Isabel Mancilla Gómez
Dra. Marcela María Fama Pereira
Comité Editorial
Dr. Mauricio Fernández Pediatra Intensivista (Editor Ejecutivo)
Dr. Jürg Niederbacher Pediatra Neumólogo
Sociedad Colombiana de Pediatría www.scp.com.co
Subdirección de Programas Dirigidos al Pediatra
Calle 83 n.o 16A-44, Oficina 701
Edificio Cima. Bogotá, D.C.
Teléfonos: (601) 6495352 - 7464706/07 precop@scp.com.co

Producción editorial
Grupo Distribuna Carrera 9 B # 117 A-05
Barrio Santa Bárbara Central Bogotá, D.C., Colombia
Teléfonos: (571) 6202294 - 2158335 (571) 2132379 www.libreriamedica.com

Tumores óseos en pediatría: claves radiológicas para un diagnóstico sistemático desde la semiología
Nathalie Yepes-Madrid
José-Fernando Gómez-Urrego
Romel Segura-Galvis
Alergia a la leche de vaca: nuevos consensos, nuevos retos y mejores decisiones
María del Carmen Castillo Montalvo
Daniela Montoya Rua
Catalina Ortiz Piedrahita
Enfermedades autoinflamatorias en pediatría: avances y perspectivas desde la evidencia actual
Erika Jhohanna Arenas Contreras
Jeymi Andrea Natera Fernández
Cristina Muñoz Otero
Errores innatos de la inmunidad en pediatría: un nuevo panorama clínico y diagnóstico
Diego Gerardo Prado-Molina
Alejandro Restrepo C.
Manuela Olaya Hernández
Abordaje multidisciplinario del traumatismo craneoencefálico pediátrico: una revisión con enfoque actual
Rafael José Orozco Marun
Deivis Barrios Andrades
Carlota Valentina Ovalle Villadiego
Julieth Daniela Figueredo Arce
María Fernanda Torres Organista


Nathalie Yepes-Madrid1
José-Fernando Gómez-Urrego2
Romel Segura-Galvis3
Los huesos, de origen mesenquimal o ectomesenquimal, forman el esqueleto de los vertebrados, que permite la locomoción y protege órganos vitales. Son tejidos vivos, vascularizados y sujetos a remodelación continua. Se componen de osteocitos, células maduras que permanecen atrapadas en la matriz mineralizada y se comunican entre sí y con las células del revestimiento óseo. También participan los osteoblastos, que forman hueso nuevo, y los osteoclastos, que lo degradan. Existen dos tipos de osificación: intramembranosa, en la que el hueso se forma directamente del mesénquima (por ejemplo, huesos planos); y endocondral, que implica una etapa cartilaginosa previa (por ejemplo, huesos largos). Este proceso requiere diferenciación de condrocitos, mineralización

de la matriz, vascularización, y reemplazo del cartílago por hueso.
Esta dinámica hace del hueso un lugar propicio para la formación de lesiones, la mayoría benignas, cuyo diagnóstico diferencial con las lesiones malignas requiere un diagnóstico precoz y oportuno para el médico de atención primaria con el fin de mejorar la supervivencia en estos pacientes.
El presente artículo muestra un enfoque sistemático para priorizar la derivación a medicina especializada ante la sospecha de una lesión ósea maligna.
Los tumores óseos constituyen alrededor del 6% de todas las neoplasias pediátricas, y son más frecuentes en niños y adolescentes.
1. Especialización en Pediatría, Universidad Libre seccional Cali, Colombia. Grupo de Investigación en Pediatría (GRINPED). ORCID: http://orcid.org/0000-0002-2740-2072
2. Pediatra, epidemiólogo, Fundación Clínica Infantil Club Noel; coordinador de posgrado de Pediatría, Universidad Libre seccional Cali. ORCID: https://orcid.org/0000-0003-4708-7759 Grupo de Investigación en Pediatría (GRINPED)
3. Pediatra. Hematología y oncología, Universidad Libre seccional Cali, Colombia; Fundación Clínica Infantil Club Noel. Grupo de Investigación en Pediatría (GRINPED).
El osteosarcoma es el tumor óseo maligno más común en esta población, seguido por el sarcoma de Ewing, ambos con mayor incidencia entre los 10 y 20 años, lo que coincide con el crecimiento puberal. El osteosarcoma representa entre el 55% al 56% de los tumores óseos malignos en menores de 20 años, con una incidencia global de 3,5 a 8,8 casos por millón al año; predomina en varones y se localiza en las metáfisis de huesos largos como el fémur distal y la tibia proximal. El sarcoma de Ewing, compuesto por células pequeñas y redondas, constituye hasta el 36% de los casos, con mayor frecuencia en adolescentes varones caucásicos, y afecta principalmente el esqueleto axial. En contraste, los tumores óseos benignos, como el osteocondroma o el quiste óseo unicameral, son más comunes en la infancia y suelen diagnosticarse incidentalmente.
En Latinoamérica, los datos sobre tumores óseos pediátricos son limitados, aunque las proporciones se asemejan a las de países desarrollados. En Colombia, el Registro Poblacional de Cáncer de
Segura-Galvis
Cali reportó una incidencia ajustada por edad y sexo de 4,2 casos por millón en menores de 15 años para tumores óseos malignos, con el osteosarcoma como el más frecuente. Se proyecta un aumento significativo de todas las neoplasias malignas hacia 2040. Entidades no neoplásicas como la histiocitosis de células de Langerhans y la enfermedad de Legg-CalvéPerthes afectan entre 2 y 9 niños por millón, especialmente menores de cinco años, y pueden simular lesiones tumorales. En general, las lesiones óseas benignas son mucho más frecuentes que las malignas en pediatría y es necesaria una evaluación clínica e imagenológica cuidadosa.
La Figura 1 muestra las regiones anatómicas generales de un hueso largo normal.
Existen tres tipos de lesiones principales identificables en las imágenes óseas.
Figura 1. Regiones anatómicas generales de un hueso largo normal. Adaptada de: Skalski M. Bone terminology (diagram). Case study, Radiopaedia.org. https://doi.org/10.53347/rID-29729
Epífisis proximal
Cuello femoral
Metáfisis proximal
Metáfisis distal
Epífisis distal

Fisis proximal
Meta diáfisis proximal Apófisis
Periostio
Hueso compacto/ Cortical Endostio
Medula ósea y hueso esponjoso
Meta-diáfisis distal
Fisis distal

También conocidas como líticas o radiolúcidas, son áreas donde el hueso ha perdido su estructura y densidad normal, y es reemplazado por tejido blando, líquido o incluso graso. Este cambio puede reflejar procesos de origen neoplásico, inflamatorio o metabólico, y suele deberse a un desequilibrio en la remodelación ósea, donde los osteoclastos, estimulados por células tumorales o inflamatorias, generan una excesiva resorción ósea.
En las imágenes diagnósticas, estas lesiones aparecen como zonas claras en radiografías simples o como áreas hipodensas en tomografía. Su análisis radiológico incluye la evaluación de patrones de destrucción (como el geográfico, apolillado o permeativo), los márgenes (bien o mal definidos), la afectación de la cortical ósea, la presencia de reacción perióstica, el tipo de matriz tumoral y otros signos como trabeculaciones o septaciones internas. Estos elementos son esenciales para establecer un diagnóstico diferencial, apoyado por nemotecnias clínicas y tablas complementarias ( Tablas 1 y 2).
Lesiones óseas escleróticas
Las lesiones óseas escleróticas, también llamadas osteoescleróticas u osteoblásticas, se reconocen
Tabla
Criterio radiológico
porque muestran una densidad aumentada en radiografías o tomografías, comparadas con el hueso trabecular circundante. Aunque estas imágenes revelan áreas más blancas o densas, no existe un valor específico de atenuación que defina claramente este tipo de lesión. Desde el punto de vista clínico, es importante considerar ciertos aspectos prácticos: si la lesión presenta características agresivas, puede ser necesario derivar al paciente a oncología o realizar una biopsia; en personas con antecedentes de cáncer, se recomienda ampliar el estudio con imágenes adicionales y seguimiento estrecho ( Tabla 3). Estas lesiones pueden tener múltiples orígenes, los cuales se resumen con la nemotecnia en inglés HOMELIFE ( Tabla 4).
Lesión ósea de densidad mixta
Las lesiones óseas de densidad mixta se caracterizan por la coexistencia de componentes líticos (radiolúcidos) y escleróticos (radiopacos) dentro o alrededor del hueso esponjoso. Esta combinación produce una apariencia heterogénea en las imágenes, sin un criterio rígido sobre cuánta proporción de cada tipo debe haber. Su interpretación requiere una visión integradora que contemple varios elementos clínicos y radiológicos. Entre ellos, se incluyen los signos de agresividad de la lesión, los antecedentes oncológicos del paciente, la presencia de grasa
Descripción
Patrón de destrucción ósea Geográfico, apolillado o permeativo; indica agresividad del proceso.
Márgenes de la lesión Bien definidos, mal definidos, zona de transición estrecha o amplia; orienta sobre benignidad o malignidad.
Afectación cortical
Expansión de la cortical o destrucción completa.
Reacción perióstica Si está presente en patrón lamelado, espiculado, sol naciente o triángulo de Codman sugiere agresividad.
Mineralización de la matriz tumoral

Otros signos asociados
Tabla elaborada por los autores.
Condroide, osteoide o fibrosa; útil para clasificar el tipo de tumor.
Septaciones internas, trabeculaciones; aportan información adicional sobre la naturaleza de la lesión.
Tabla 2. Diagnóstico diferencial en lesiones osteolíticas
Lesión osteolítica solitaria bien definida Lesión osteolítica solitaria mal definida
Geodas o quistes subcondrales
Ganglio intraóseo
Tofo intraóseo (gota)
Quiste óseo unicameral
Quiste óseo aneurismático
Glomangioma
Encondroma
Quiste de inclusión epidermoide
Condroblastoma
Fibroma no osificante
Fibroma desmoplásico
Osteoblastoma
Tumor de células gigantes
Plasmocitoma (mieloma múltiple)
Tumor pardo (hiperparatiroidismo)
Metástasis
Granuloma eosinofílico
Infarto óseo
Displasia fibrosa
Sarcoidosis
Tabla elaborada por los autores.
Hemangioma intraóseo
Condroblastoma
Osteoblastoma
Tumor de células gigantes
Fibrosarcoma de hueso
Histiocitoma fibroso maligno
Condrosarcoma
Osteosarcoma
Sarcoma de Ewing
Angiosarcoma
Mieloma múltiple
Metástasis ósea
Linfoma óseo
Histiocitosis de células de Langerhans (granuloma eosinofílico [EG])
Pseudotumor hemofílico
Osteonecrosis (infarto óseo)
Osteomielitis
Sarcoidosis esquelética
Tabla 3. Diferencias generales imagenológicas claves
Característica Tumores benignos
Bordes
Tumores malignos
Bien definidos, escleróticos Mal definidos, permeativos o moteados
Reacción perióstica Ausente o suave
Afectación de partes blandas Ausente
Destrucción ósea Limitada
Patrón de crecimiento Lento, expansivo
Tabla elaborada por los autores.
Intensa, en capas de cebolla, sol radiante, triángulo de Codman
Presente, con masas que atraviesan el hueso
Extensa
Rápido, infiltrativo

dentro de la lesión, las zonas de atenuación tipo vidrio esmerilado, la identificación de matriz cartilaginosa y, por supuesto, si se trata de una entidad típicamente benigna. Estas pistas guían la evaluación radiológica y permiten afinar el diagnóstico diferencial.
En función de esos hallazgos, las posibles causas varían desde lesiones agresivas como metástasis mixtas, osteosarcoma o infección, hasta condiciones benignas como infartos óseos, lipomas intraóseos y displasias fibrosas. La presencia de
grasa intralesional sin otros signos de alarma suele indicar un proceso benigno, mientras que los pacientes con antecedentes de cáncer o lesiones con destrucción cortical e invasión de tejidos blandos deben ser valorados con estudios adicionales o referidos a oncología. La combinación de estos factores clínicos con el análisis estructurado de la imagen permite tomar decisiones más seguras en el abordaje de estas lesiones. Una visión detallada de estas posibilidades diagnósticas se resume en la Tabla 5.
H Healed non-ossifying fibroma (NOF)
O Osteoma
M Metastasis
E Ewing sarcoma
L Lymphoma
I Infection or infarct
F Fibrous dysplasia
E Enchondroma
Tabla elaborada por los autores.
Fibroma no osificante cicatrizado
Osteoma
Metástasis
Sarcoma de Ewing
Linfoma
Infección o infarto óseo
Displasia fibrosa
Encondroma
Tabla 5. Diagnósticos diferenciales para las lesiones óseas de densidad mixta
Categoría de hallazgo
Rasgos agresivos
Antecedentes de malignidad
Grasa intralesional
Atenuación en vidrio esmerilado
Matriz cartilaginosa

Entidades benignas típicas
Tabla elaborada por los autores.
Diagnósticos diferenciales
Metástasis mixtas, condrosarcoma, osteosarcoma, osteomielitis, granuloma eosinofílico
Metástasis mixtas, mieloma múltiple (raro)
Lipoma intraóseo, hemangioma intraóseo, enfermedad de Paget, infarto óseo, displasia fibrosa, fibroma no osificante
Displasia fibrosa
Encondroma, condrosarcoma, condrosarcoma de células claras, condroblastoma
Fibroma no osificante, infarto óseo
El diagnóstico de los tumores óseos se apoya en dos pilares fundamentales: la lectura cuidadosa de las radiografías convencionales y la edad del paciente. Estos dos elementos, cuando se interpretan de forma conjunta, ofrecen una base sólida para orientar la sospecha diagnóstica con mayor precisión.
El enfoque sistemático que se sugiere debe hacerse para encontrar la naturaleza y diagnóstico de una lesión ósea comprende diferentes aspectos, que se mencionan a continuación.
Edad del paciente
La edad del paciente es uno de los elementos más valiosos para orientar el diagnóstico de los tumores óseos. Muchas lesiones óseas son típicas de determinadas etapas del desarrollo, por lo que tener en cuenta la edad puede acortar significativamente el diagnóstico diferencial. En la práctica, se suele clasificar a los pacientes en dos grandes grupos: menores y mayores de 30 años. La mayoría de los tumores óseos primarios se presentan antes de los 30; mientras que, en pacientes mayores, siempre deben considerarse metástasis y mieloma como parte del diagnóstico diferencial.
Sin embargo, existen excepciones importantes. Las infecciones óseas, que pueden simular tumores, pueden presentarse a cualquier edad y adoptar patrones radiológicos variables: desde lesiones osteolíticas bien o mal definidas hasta imágenes escleróticas. En menores de 20 años, entidades como el granuloma eosinofílico o infecciones deben estar siempre en la lista de posibilidades diagnósticas. Además, muchas lesiones escleróticas que vemos en adultos jóvenes son en realidad lesiones benignas que antes fueron osteolíticas y se han osificado con el tiempo, como los NOF, EG, quiste óseo simple (SBC), quiste óseo aneurismático (ABC) o condroblastomas curados.
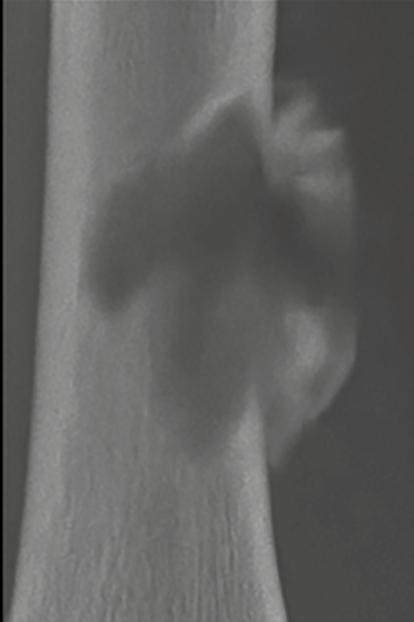
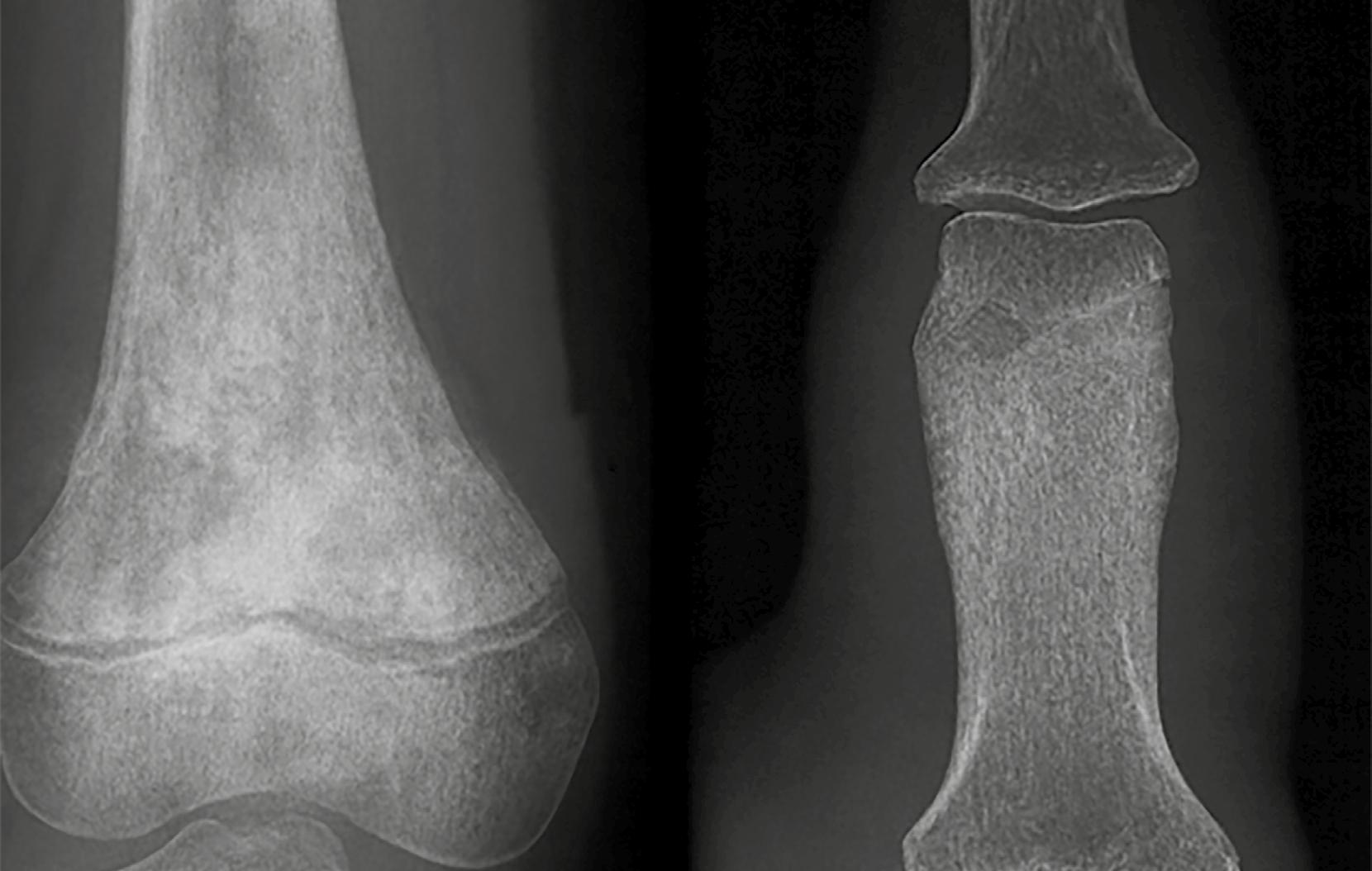
Se refiere al límite entre el hueso sano y la lesión. Una transición bien definida suele asociarse con lesiones benignas, mientras que los márgenes mal definidos tienden a sugerir comportamiento agresivo o maligno. Para interpretar correctamente una lesión osteolítica, uno de los aspectos clave es evaluar la zona de transición entre la lesión y el hueso sano circundante. Esta zona actúa como un indicador fundamental para diferenciar entre procesos benignos y malignos. Las lesiones bien definidas, con bordes nítidos y una transición estrecha, suelen indicar un crecimiento lento y comportamiento biológico no agresivo. En algunos casos, incluso se puede observar un borde esclerótico, lo que refuerza la idea de una lesión inactiva. Sin embargo, en pacientes mayores de 30 años, y especialmente en mayores de 40, no se puede descartar la posibilidad de metástasis o plasmocitoma, incluso si las imágenes sugieren benignidad. En la Figura 2 , por ejemplo, se muestran tres lesiones con zona de transición estrecha en pacientes pediátricos, cuyas placas de crecimiento aún no se han cerrado, lo cual refuerza el diagnóstico de lesiones benignas.
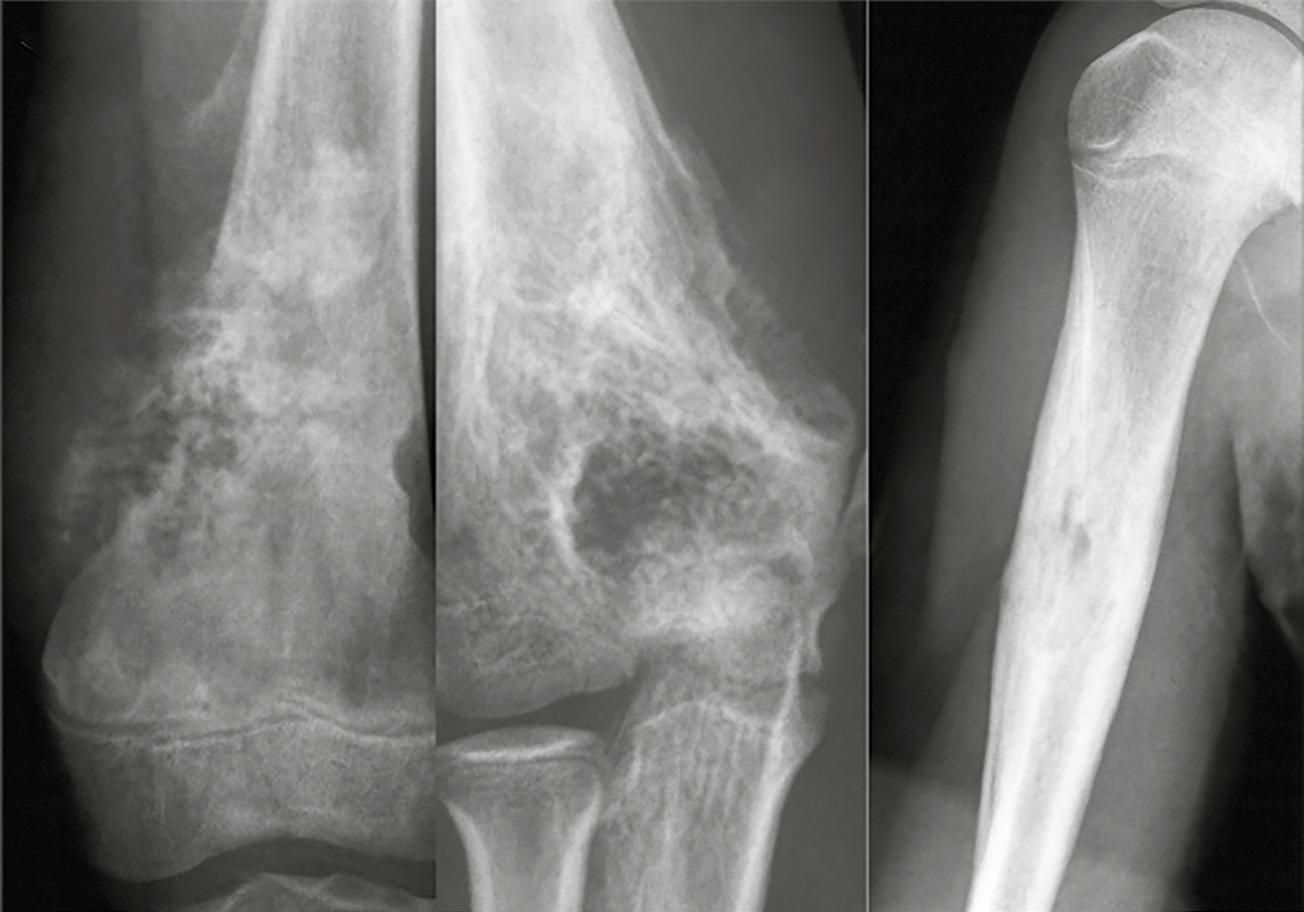
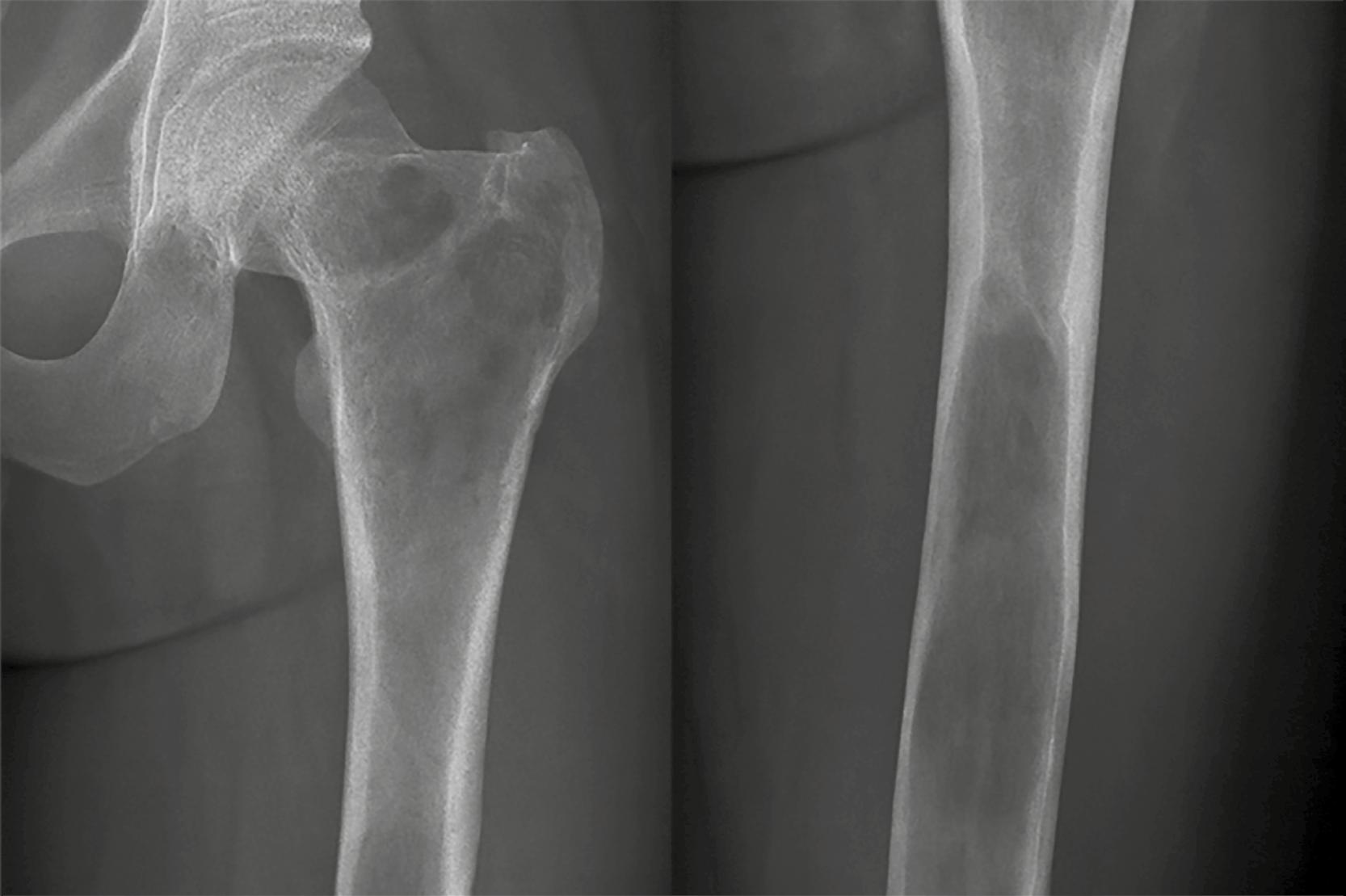
En contraste, una zona de transición amplia, mal definida y con márgenes imprecisos suele indicar un crecimiento óseo rápido y agresivo. Este patrón es característico de muchos tumores óseos malignos, como los sarcomas primarios o las metástasis en adultos mayores. No obstante, es fundamental recordar que algunas lesiones benignas también pueden presentar un comportamiento radiológico agresivo. Tal es el caso de las infecciones óseas y el granuloma eosinofílico, dos condiciones que deben incluirse en el diagnóstico diferencial de lesiones con márgenes mal definidos. A pesar de su naturaleza no neoplásica, pueden simular tumores malignos por su capacidad de destruir la cortical ósea o generar reacciones periósticas llamativas. En la Figura 3 se muestran ejemplos de estas presentaciones agresivas pero benignas.

Figura 2. Zona estrecha de transición. 1. Fibroma no osificante. 2. Quiste óseo simple. 3. Quiste óseo aneurismático. Tomada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https://radiologyassistant.nl/ musculoskeletal/bone-tumors/differential-diagnosis

Figura 3. Una zona de transición amplia indica malignidad o infección o granuloma eosinofílico. 1. Osteosarcoma. 2. Osteomielitis. 3. Granuloma eosinofílico. Tomada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https://radiologyassistant.nl/musculoskeletal/bone-tumors/differential-diagnosis


Reacción perióstica
La reacción perióstica es una respuesta inespecífica del periostio ante cualquier irritación, ya sea por un tumor —benigno o maligno—, una infección o un traumatismo. La presencia y el tipo de reacción del periostio ante la lesión —ya sea sólida, lamelada, espiculada o en cáscara de cebolla — pueden dar pistas sobre la velocidad de crecimiento y el carácter de la lesión (Figura 4).
Existen dos patrones principales: uno benigno, que se presenta en procesos de crecimiento lento como tumores no agresivos o lesiones postraumáticas; y otro agresivo, característico de tumores malignos o lesiones benignas con comportamiento invasivo, como algunas infecciones o el granuloma eosinofílico. Algunas lesiones frecuentes como la displasia fibrosa, el encondroma, el NOF o el SBC no suelen mostrar reacción perióstica, a menos que haya una fractura subyacente.
Identificar una reacción perióstica benigna es de gran utilidad clínica, ya que su presencia prácticamente excluye la posibilidad de una neoplasia maligna. Este tipo de reacción se manifiesta como un callo óseo grueso, ondulado

Benigna
y uniforme, resultado de una irritación persistente. En lesiones benignas de crecimiento lento, el periostio tiene tiempo suficiente para formar y remodelar hueso nuevo, lo que da lugar a una capa cortical organizada, con una apariencia más normal y estructurada en las imágenes radiográficas (Figura 5).
En cambio, la reacción perióstica agresiva presenta un patrón más caótico y desorganizado. Puede manifestarse como una formación ósea laminada, espiculada o perpendicular a la cortical, y frecuentemente aparece interrumpida. Un hallazgo típico en estos casos es el triángulo de Codman, que representa el despegamiento del periostio formando un ángulo característico entre la cortical y la nueva capa ósea. Este patrón se asocia a procesos de rápida progresión donde el periostio no logra estabilizarse y sugiere una posible malignidad o una inflamación agresiva (Figura 6).
Destrucción cortical
La pérdida de continuidad de la cortical ósea es otro indicio que puede sugerir una lesión de comportamiento agresivo. La destrucción cortical es un hallazgo común en las imágenes
Reacción perióstica


Espiculada
Codmán

Figura 5. Reacción perióstica benigna en un osteoma osteoide. La flecha indica una reacción perióstica sólida. Adaptada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https://radiologyassistant.nl/ musculoskeletal/bone-tumors/differential-diagnosis

Figura 6. Reacción perióstica agresiva. 1. Osteosarcoma con interrupción de la retracción perióstica y triángulo de Codman proximalmente (flecha amarilla). Se observa formación de hueso perióstico perpendicular al hueso cortical y una extensa formación de matriz ósea por el propio tumor. 2. Sarcoma de Ewing con reacción perióstica laminada y focalmente interrumpida (flechas azules). 3. Infección con reacción perióstica multicapa. Observe que la periostitis es agresiva, pero no tanto como en los otros dos casos (flecha verde); se observa que la periostitis es agresiva, pero no tanto como en los otros dos casos. Adaptada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https://radiologyassistant.nl/musculoskeletal/bone-tumors/differential-diagnosis 1 2 3

óseas, pero por sí sola no siempre permite distinguir entre lesiones benignas y malignas. Aunque la destrucción completa de la cortical suele asociarse con tumores malignos de alto grado, también puede observarse en entidades benignas agresivas como el EG o la osteomielitis (Figura 7 ). Por otro lado, una destrucción más uniforme y menos invasiva puede presentarse tanto en lesiones benignas como en tumores de bajo grado. En casos como la displasia fibrosa o el condrosarcoma de bajo grado, es típico observar un aspecto festoneado de la cortical.
Un patrón particular de afectación cortical es el abombamiento, donde la destrucción del hueso endóstico y la formación de hueso nuevo en la superficie externa se dan al mismo ritmo (Figura 8). Este proceso produce una expansión del hueso con una corteza nueva, neocórtex, que puede lucir lisa y continua. No
Romel Segura-Galvis
obstante, en lesiones más agresivas, como el tumor de células gigantes (TCG), esta nueva capa puede mostrar interrupciones focales. El abombamiento es típico de lesiones que crecen lentamente, pero con suficiente fuerza como para remodelar la arquitectura ósea.
En tumores malignos de células pequeñas y redondas, como el sarcoma de Ewing, el linfoma óseo o el osteosarcoma de células pequeñas, el aspecto de la cortical puede engañar. En la radiografía, la cortical puede parecer casi intacta, pero en realidad estos tumores infiltran el hueso a través de los canales de Havers, mostrando un patrón permeativo (Figura 9). A menudo, se acompañan de masas de tejido blando significativas; mientras que los signos de destrucción ósea pueden ser mínimos o incluso imperceptibles en una evaluación inicial, lo que hace necesario un análisis más detallado y contextual.
Figura 7. Destrucción cortical. 1. Osteosarcoma con destrucción cortical irregular (flecha amarilla). 2. Sarcoma de Ewing con destrucción cortical (flecha roja) y reacción perióstica agresiva (rombos azules). Adaptada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https:// radiologyassistant.nl/musculoskeletal/bone-tumors/differential-diagnosis 1 2


Figura 8. El abombamiento. 1. Fibroma condromixoide: una lesión benigna, bien definida y expansiva con destrucción regular del hueso cortical y una capa periférica de hueso nuevo (flecha roja). 2. Tumor de células gigantes: Una lesión localmente agresiva con destrucción cortical, expansión y una capa periférica delgada e interrumpida de hueso nuevo; observar la amplia zona de transición hacia la cavidad medular, lo cual indica un comportamiento agresivo (flecha amarilla). Adaptada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https://radiologyassistant.nl/ musculoskeletal/bone-tumors/differential-diagnosis

Figura 9. Destrucción cortical. Sarcoma de Ewing con crecimiento permeativo a través de los canales de Havers acompañado de una gran masa de tejido blando. 1. La radiografía no muestra signos de destrucción cortical. Tomada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https:// radiologyassistant.nl/musculoskeletal/bone-tumors/differential-diagnosis


Yepes-Madrid; José-Fernando Gómez-Urrego; Romel Segura-Galvis
Ubicación en el cuerpo y dentro del hueso largo
Determinar si la lesión se encuentra en la epífisis, metáfisis o diáfisis contribuye a delimitar el espectro de posibilidades diagnósticas. La ubicación anatómica de una lesión ósea dentro del esqueleto puede ofrecer pistas valiosas en el diagnóstico diferencial. Algunos tumores tienen afinidad por ciertas regiones óseas, lo cual, junto con la edad y el patrón radiológico, puede orientar al clínico. Por ejemplo, en zonas como el húmero o alrededor de la rodilla, es común encontrar una amplia variedad de tumores. La Figura 10 y la Tabla 6 agrupan las localizaciones tumorales óseas más frecuentes, lo que permite relacionar patrones de presentación con diagnósticos probables.
La Tabla 7 nos muestra las localizaciones anatómicas más frecuentes.
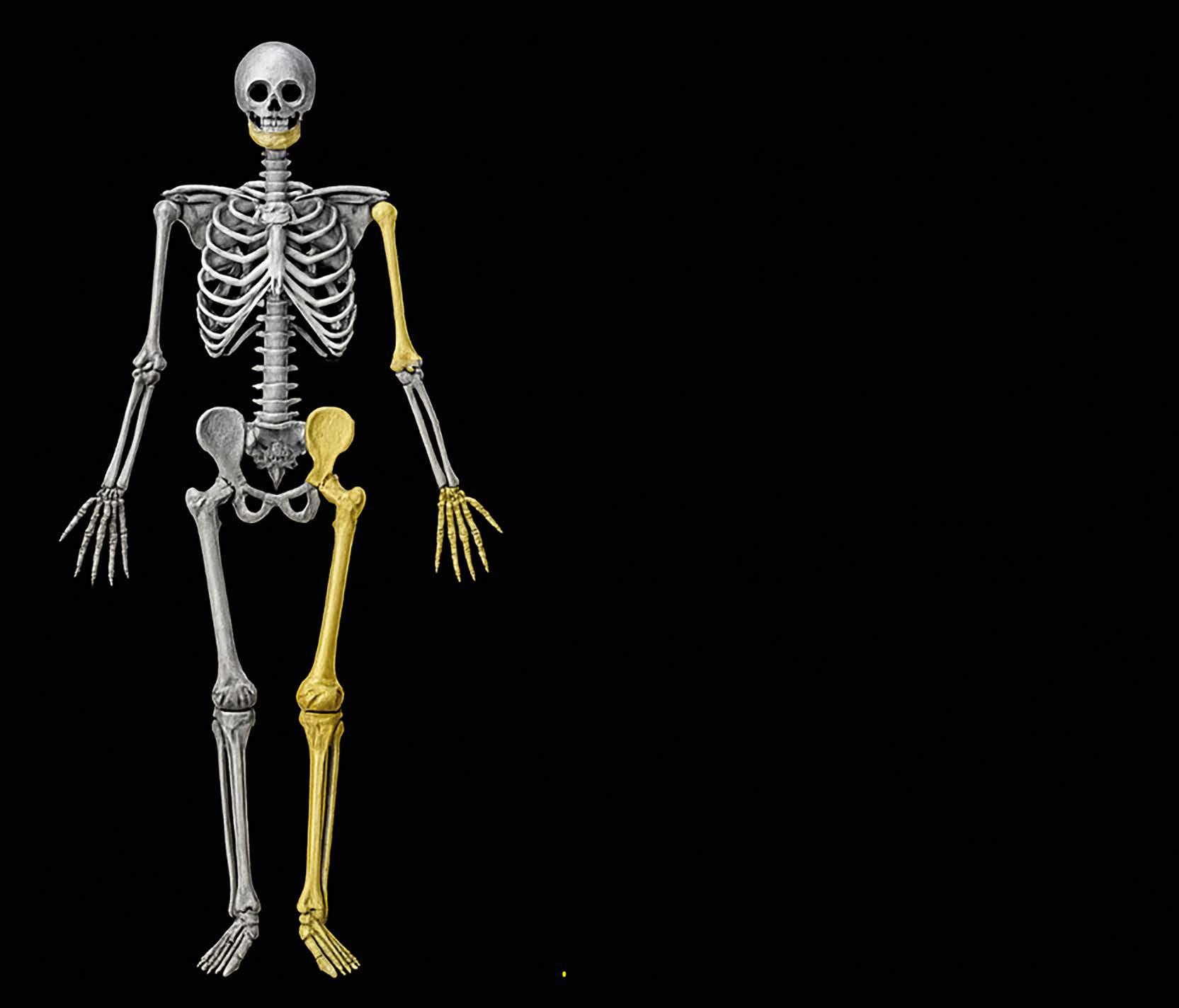
El hueso largo se divide en tres secciones principales, como se muestra en la Figura 11. En los extremos encontramos las epífisis, estructuras redondeadas que participan activamente en la formación de las articulaciones. Están separadas de la metáfisis por la fisis, también conocida como placa de crecimiento. A diferencia de las apófisis, que son zonas de inserción para tendones y ligamentos, las epífisis tienen un rol directo en el movimiento articular. Con el tiempo, tras el cierre de la fisis en la edad adulta, la epífisis se fusiona con la metáfisis, y forma una unidad ósea continua y funcional.
Cráneo: granuloma eosinofílico, metástasis, mieloma
Mandíbula: adamantinoma, quiste dentógeno
Húmero: quiste óseo simple, todos los tumores
Costillas: metástasis, encodroma, condrosarcoma, sarcoma de Ewing
Columna: metástasis, mieloma, osteoblastoma, cordoma, vertebral hemangioma, quiste óseo aneurismático, osteoma osteoide
Pelvis: osteosarcoma, condrosarcoma, quiste óseo simple, linfoma, sarcoma de Ewing, cordoma
Radio distal: tumor de células gigantes, Granuloma eosinofílico
Manos: encondroma
Fémur: quiste óseo simple, displasia fibrosa, encodroma, sarcoma de Ewing, granuloma eosinofílico
Rodilla: todos los tumores, osteosarcoma, sarcoma de Ewing
Tibia: fibroma no osificante, displasia fibrosa, adamantinoma, osteoma osteoide
Calcáneo: quiste óseo simple, sarcoma de Ewing, osteoblastoma, condroblastoma

Región
Tabla 6. Región y tumor óseo asociado
Tumores asociados
Cráneo Granuloma eosinofílico (EG), metástasis, mieloma
Mandíbula Adamantinoma, quiste dentógeno
Húmero Todos los tumores, quiste óseo simple (SBC)
Costillas Metástasis, encondroma, condrosarcoma, sarcoma de Ewing
Columna vertebral Metástasis, mieloma, osteoblastoma, cordoma, hemangioma, quiste óseo aneurismático (ABC), osteoma osteoide
Pelvis Osteosarcoma, condrosarcoma, quiste óseo simple (SBC), linfoma, Ewing, EG, cordoma
Radio distal Tumor de células gigantes (GCT), EG
Manos Encondroma
Fémur proximal SBC, displasia fibrosa (FD), encondroma, Ewing, EG
Alrededor de la rodilla Todos los tumores, osteosarcoma, Ewing
Diáfisis de la tibia Fibroma no osificante (NOF), displasia fibrosa (FD), Adamantinoma, osteoma osteoide
Calcáneo SBC, Ewing, osteoblastoma, condroblastoma
Adaptada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https://radiologyassistant.nl/musculoskeletal/bone-tumors/ differential-diagnosis
Tabla 7. Principales localizaciones de tumores óseos en orden alfabético
Tumor óseo
Adamantinoma
Condroblastoma
Condrosarcoma
Diáfisis de la tibia, mandíbula
Localizaciones
Fémur, húmero, tibia, hueso del tarso (calcáneo), rótula
Fémur, costilla, hueso ilíaco, húmero, tibia
Cordoma Sacrococcígea, esfeno-occipital, cervical, lumbar, torácico
Displasia fibrosa Fémur, tibia, costilla, cráneo, húmero
Encondroma Falanges de manos y pies, fémur, húmero, metacarpianos, costilla
Fibroma condromixoide Tibia, fémur, hueso del tarso, falange del pie, peroné
Fibroma no osificante Tibia, fémur, peroné, húmero
Granuloma eosinofílico Fémur, cráneo, hueso ilíaco, costilla, vértebra
Hemangioma Columna, costillas, huesos craneofaciales, fémur, tibia
Linfoma Fémur, tibia, húmero, hueso ilíaco, vértebra
Metástasis Vértebras, costillas, pelvis, fémur, húmero
Osteoblastoma
Osteocondroma
Columna, hueso del tarso (calcáneo), fémur, tibia, húmero
Fémur, húmero, tibia, peroné, pelvis
Osteoma osteoide Fémur, tibia, columna, hueso del tarso, falange
Osteomielitis
Osteosarcoma
Fémur, tibia, húmero, peroné, radio
Fémur, tibia, húmero, peroné, hueso ilíaco
Quiste óseo aneurismático Tibia, fémur, peroné, columna vertebral, húmero
Quiste óseo solitario

Húmero proximal, fémur proximal, hueso calcáneo, hueso ilíaco
Sarcoma de Ewing Fémur, hueso ilíaco, peroné, costilla, tibia
Tumor de células gigantes
Tabla elaborada por los autores.
Fémur, tibia, peroné, húmero, radio distal
Yepes-Madrid; José-Fernando Gómez-Urrego; Romel Segura-Galvis
Figura 11. Regiones del hueso largo. Adaptada de: Skalski M. Bone lesion differential diagnosis - illustrations. Case study, Radiopaedia.org. https://doi.org/10.53347/rID-79247

Epifisis
Metafisis
Diafisisis
Displasia fibrosa
Osteocondroma
Pediculado
Sesil
Coliflor
Islote óseo/enostosis
Osteomielitis o otras lesiones agresivas
Quiste simple unicameral
Quiste óseo aneurismático
Osteoma osteoide, si >2 cm = osteoblastoma
La localización anatómica de una lesión ósea puede ofrecer pistas valiosas para orientar el diagnóstico (Figuras 12 y 13). En la epífisis, pocas lesiones se presentan de forma típica, por lo que encontrar una allí puede ser un hallazgo clave. En pacientes jóvenes, los principales diagnósticos incluyen el condroblastoma o una infección. En adultos jóvenes mayores de 20 años, debe considerarse el tumor de células gigantes, mientras que en pacientes de edad más avanzada es importante incluir una geoda (quiste subcondral degenerativo), especialmente si hay signos de artrosis en las imágenes.
La metáfisis es una región frecuente para múltiples tumores óseos, tanto benignos como malignos. Entre las lesiones más comunes en esta zona se encuentran el fibroma no osificante

Sarcoma de Ewing
Encondroma
Condroblastoma
Osteosarcoma
Fibroma no/osificante, si > 2.5 cn + defecto fibroso cortical

Figura 13. Mayores de 30 años. Elaborada por los autores.

Mieloma Múltiple
Lesiones en sacabocado
Endosteum festoneado
Fibroma no osificante, curado
Tumor de células gigcantes
Osteomielitis crónica. con secuestro óseo e involución ósea
Enfermedad de Paget
Blástico o mixta con fase litica
Enfermedad de Paget en fase litica con signo de la llama u hoja de pasto
(NOF), el quiste óseo simple (SBC), el fibroma condromixoide (CMF), además de tumores como el osteosarcoma, condrosarcoma y encondroma. También es una zona propensa a infecciones óseas, lo que puede dificultar el diagnóstico si no se correlaciona con la clínica del paciente.
La diáfisis, por su parte, es el sitio preferente para lesiones como el sarcoma de Ewing, el quiste óseo simple, el ABC, el encondroma, la displasia fibrosa y el osteoblastoma. Sin embargo, distinguir entre una lesión diafisaria y metafisaria no siempre es sencillo, especialmente en tumores grandes que se extienden desde una zona hacia otra o en lesiones que cambian de localización con el crecimiento. Muchas de estas patologías pueden ocupar ambas regiones, lo que exige una interpretación cuidadosa de las imágenes.

Osteosarcoma del periostio
Lesion agresiva metástasis lítica u osteomielitis
Linfoma o lesion blástica metastásica
Geode o quiste subcondral o ganglion intraóseo
Enostosis o islote óseo
Fractura por estrés
Condrosarcoma
Fractura por estrés o absceso de Brodie intracortical
Localización transversal
Saber si la lesión es céntrica, excéntrica o yuxtacortical también aporta información útil para entender su naturaleza. La ubicación transversal de un tumor óseo, es decir, si se encuentra en el centro del hueso, hacia un lado o en la superficie (céntrica, excéntrica, yuxtacortical), también ofrece información diagnóstica útil ( Figura 14 ). Las lesiones céntricas, como el granuloma eosinofílico, la displasia fibrosa, el quiste óseo aneurismático y el encondroma, suelen estar localizadas en el interior del canal medular de los huesos largos. Por otro lado, tumores como el osteosarcoma, el fibroma no osificante, el condroblastoma, el fibroma condromixoide, el tumor de células gigantes y el osteoblastoma tienden a presentarse de forma excéntrica, desplazados hacia la periferia ósea.
Existen también tumores que afectan la superficie del hueso. Por ejemplo, el osteoma osteoide puede localizarse dentro de la corteza y es importante distinguirlo de una osteomielitis, ya que pueden compartir hallazgos similares. En casos yuxtacorticales, el osteocondroma aparece como una proyección que debe mostrar continuidad de la corteza y la médula con el hueso de origen. Finalmente, el osteosarcoma periostial es una variante que surge directamente del periostio, lo que le da una apariencia particular que puede ser clave para el diagnóstico.
Tipo de matriz tumoral
La presencia de matriz condroide, osteoide o fibrosa ayuda a identificar el tipo específico de
Segura-Galvis
tumor. La mineralización dentro de una lesión ósea es un hallazgo clave que puede orientar el diagnóstico diferencial. Al analizar una imagen, la presencia de calcificaciones o matriz mineralizada sugiere el tipo de tejido tumoral. Existen principalmente dos tipos de matriz: la condroide, característica de tumores cartilaginosos como los encondromas y condrosarcomas; y la osteoide, propia de tumores formadores de hueso, como el osteoma osteoide o el osteosarcoma. Reconocer estos patrones puede ser decisivo para guiar el enfoque clínico.
En los tumores condroides, la mineralización suele adoptar formas muy características (Figura 15). Podemos encontrar patrones descritos como en anillos y arcos, en forma de palomitas de maíz o como calcificaciones punteadas. Estos
Figura 14. Ubicación transversal. 1. SBC: diafisario central. 2. NOF: metafisaria excéntrica. 3. SBC: diafisario central. 4. Osteoma osteoide: cortical. 5. Quiste subcondral degenerativo: epifisario. 6. ABC: diafisario céntrico. Adaptada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https:// radiologyassistant.nl/musculoskeletal/bone-tumors/differential-diagnosis
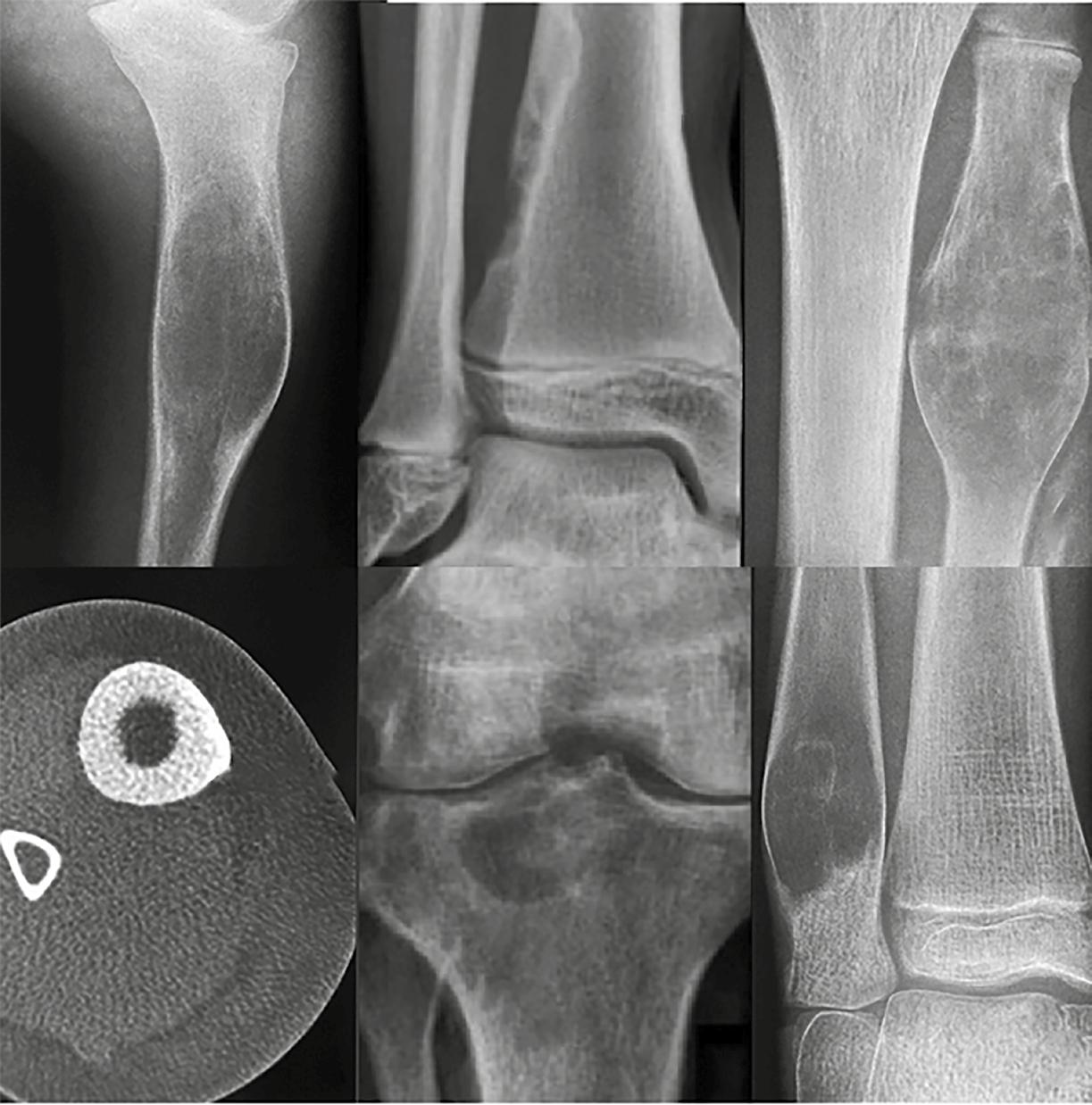

detalles, aunque sutiles, permiten diferenciar tumores benignos como el encondroma de lesiones más agresivas como el condrosarcoma, especialmente cuando se combinan con otros hallazgos clínicos y radiológicos.
Por otro lado, en la matriz osteoide, la mineralización en tumores benignos tiende a mostrar un patrón más organizado y trabecular, como se ve en lesiones formadoras de hueso (Figura 16). En contraste, en tumores malignos como el osteosarcoma, el patrón suele ser amorfamente denso, similar a una nube o con bordes mal definidos. Es importante también considerar que la esclerosis no siempre indica formación ósea primaria, ya que puede ser reactiva, como ocurre en el sarcoma de Ewing o el linfoma óseo.
Cuando se observan múltiples focos óseos afectados, es importante considerar entidades como displasias o enfermedades sistémicas. En la mayoría de los casos, los tumores óseos se presentan como lesiones solitarias, lo que facilita su evaluación y diagnóstico. Sin embargo, cuando se identifican lesiones múltiples o poliostóticas, el enfoque clínico debe ajustarse, ya que el espectro de posibilidades se amplía. Este patrón puede indicar entidades específicas que tienden a afectar varios sitios del esqueleto de manera simultánea, lo cual cambia el curso del estudio diagnóstico y muchas veces requiere pruebas complementarias más específicas.
Figura 15. Matriz condroide. 1. Encondroma, la lesión más frecuentemente encontrada de las falanges. 2. Condrosarcoma periférico, que surge de un osteocondroma (exostosis). 3. Condrosarcoma de la costilla. Adaptada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https:// radiologyassistant.nl/musculoskeletal/bone-tumors/differential-diagnosis
1 2 3


Figura 16. Matriz osteoide. Izquierda: osteosarcoma. Formación ósea nubosa en el osteosarcoma con reacción perióstica agresiva e interrumpida (flecha roja). Derecha: osteoma osteoide. Patrón de osificación trabecular derecha en un osteoma osteoide con el nido osteolítico (flecha verde). Adaptada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https:// radiologyassistant.nl/musculoskeletal/bone-tumors/differential-diagnosis
Entre las lesiones poliostóticas más comunes se encuentran el fibroma no osificante, la displasia fibrosa, la osteomielitis multifocal, los encondromas múltiples, el osteocondroma; así como enfermedades hematológicas como la leucemia o el sarcoma de Ewing metastásico. En condiciones más específicas, los múltiples encondromas pueden asociarse con la enfermedad de Ollier, mientras que su combinación con hemangiomas es típica del síndrome de Maffucci; ambos con presentaciones clínicas peculiares que requieren seguimiento estrecho.
En pacientes mayores de 30 años, las causas más frecuentes de lesiones poliostóticas incluyen metástasis óseas, mieloma múltiple y encondromas múltiples (Figura 17 ). Otras entidades menos comunes, pero posibles, son
la displasia fibrosa, los tumores pardos por hiperparatiroidismo y los infartos óseos. En el diagnóstico diferencial deben considerarse también enfermedades como el granuloma eosinofílico, infecciones crónicas, y procesos metabólicos como el hiperparatiroidismo. Reconocer estos patrones puede ser decisivo para orientar al paciente hacia el tratamiento adecuado.
Lesiones en localizaciones especiales
Algunas zonas como la columna vertebral o el pie requieren especial atención, ya que suelen estar relacionadas con ciertas patologías específicas. En resumen, el enfoque sistematizado mejora no solo la precisión diagnóstica, sino también la capacidad del profesional para plantear hipótesis adecuadas desde la primera imagen.

Figura 17. Lesiones poliostóticas o múltiples Izquierda: displasia fibrosa poliostótica. Derecha: múltiples lesiones osteolíticas en la diáfisis femoral. Adaptada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https://radiologyassistant.nl/musculoskeletal/bone-tumors/differential-diagnosis
Como dato importante, conviene recordar que la mayoría de los tumores óseos son de tipo osteolítico, es decir, producen pérdida de densidad en el hueso.
Uno de los indicadores más confiables para diferenciar una lesión benigna de una maligna es precisamente la apariencia de la zona de transición entre la lesión y el hueso adyacente. Una vez que se ha determinado si se
trata de una lesión osteolítica o esclerótica, y si sus márgenes son bien o mal definidos, la siguiente gran pregunta es: ¿cuántos años tiene el paciente? La edad, sin duda, es una de las pistas clínicas más importantes que tenemos a nuestra disposición.
La Tabla 8 presenta el enfoque sistemático para el diagnóstico diferencial de las principales lesiones óseas.

Edad Lítica bien definida Lítica mal definida Esclerótica



0-10
10-20
20-40
EG, Quiste óseo simple EG, Sarcoma de Ewing, osteosarcoma, leucemia
Fibroma no osificante, osteoblastoma, displasia fibrosa, EG, quiste óseo simple, quiste aneurismático, condroblastoma, fibroma condromixoide
Tumor de células gigantes, encondroma, condrosarcoma (bajo grado), tumor pardo por hiperparatiroidismo, osteoblastoma
Ewing, granuloma eosinofílico, osteosarcoma
Tumor de células gigantes
≥ 40 Metástasis, mieloma, geoda Metástasis, mieloma, condrosarcoma (alto grado)
Osteosarcoma
Osteosarcoma, displasia fibrosa, granuloma eosinofílico, osteoma osteoide, osteoblastoma
Encondroma, osteoma, isla ósea, osteosarcoma periostial, lesiones curadas: NOF, EG, SBC, ABC, condroblastoma
Metástasis, isla ósea
Todas las edades Infección Infección Infección
CMF: Fibroma condromixoide; EG: Granuloma eosinofílico; GCT: Tumor de células gigantes; FD: Displasia fibrosa; HPT: Hiperparatiroidismo con tumor marrón; NOF: Fibroma no osificante; SBC: Quiste óseo simple. Traducida por los autores. Adaptada de: Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https://radiologyassistant.nl/musculoskeletal/bonetumors/differential-diagnosis
• Blumer MJF. Bone tissue and histological and molecular events during development of the long bones. Ann Anat. 2021;235:151704. doi: 10.1016/j.aanat.2021.151704
• Bravo LE, García LS, Collazos P, Carrascal E, Ardila EKG, Millan E, et al. Cancer epidemiology in Cali, 60 years of experience. Colomb Med (Cali). 2022;53(1):e2005050. doi: 10.25100/cm.v53i1.5050
• Cederberg KB, Iyer RS, Chaturvedi A, McCarville MB, McDaniel JD, Sandberg JK, et al. Imaging of pediatric bone tumors: A COG Diagnostic Imaging Committee/SPR Oncology Committee White Paper. Pediatr Blood Cancer. 2023;70 Suppl 4(Suppl 4):e30000. doi: 10.1002/pbc.30000
• Daniel MacManus. Bone tumors (overview) [Internet]. 2025 [citado el 11 de abril de 2025]. Disponible en: https://radiopaedia.org/articles/bone-tumors-overview
• Özkan EA, Göret CC, Özdemir ZT, Yanık S, Doğ an M, Gönültaş A, et al. Pattern of primary tumors and tumorlike lesions of bone in children: retrospective survey of biopsy results. Int J Clin Exp Pathol. 2015;8(9):11543-8.
• Fondo Colombiano de Enfermedades de Alto Costo. Situación del cáncer en la población pediátrica atendida en el SGSSS de Colombia [Internet]. Cuenta de Alto Costo. 2016 [en línea] [consultado 2025 oct 13]. Disponible en: https://www.ins.gov.co/TyS/ programas-de-calidad/Documentos%20Programa%20

EEDDCARIO/Situacion_del_cancer_en_la_poblacion_pediatrica_Colombia_2016.pdf
• Jan van der Woude R, Smithuis R. Bone tumors. Differential diagnosis [Internet]. 2010 [consultado 2025 oct 13]. Disponible en: https://radiologyassistant. nl/musculoskeletal/bone-tumors/differential-diagnosis
• Martín JCA, Manzarbeitia Arroba P. Tumoraciones óseas más frecuentes. Pediatría Integral. 2024;XXVIII(4):260–5.
• Martínez Beltrán L, Eidelman DO, González Suárez NL. Caracterización de los niños con osteosarcoma no metastásico quienes recibieron tratamiento con mifamurtida en dos instituciones de Bogotá (Colombia) entre 2014 y 2017. Universitas Médica. 2019;60(4):1–8. doi: 10.11144/Javeriana.umed60-4.oste
• McCarville MB. The child with bone pain: malignancies and mimickers. Cancer Imaging. 2009;9 Spec No A(Special issue A):S115-21. doi: 10.1102/1470-7330.2009.9043
• Padwal J, Baratto L, Chakraborty A, Hawk K, Spunt S, Avedian R, et al. PET/MR of pediatric bone tumors: what the radiologist needs to know. Skeletal Radiol. 2023;52(3):315-328. doi: 10.1007/s00256-022-04113-6
• Rodríguez-Rodríguez EI, Taura-Suárez L. Tumores óseos en edad pediátrica. AMC. 2019;23(5).
• Traoré O, Chban K, Hode AF, Diarra Y, Salam S, Ouzidane L. [Interest of imaging in tumors benign bone in children]. Pan Afr Med J. 2016;24:179. doi: 10.11604/ pamj.2016.24.179.9920


Daniela Montoya Rua2
Catalina Ortiz Piedrahita3
La alergia a la proteína a la leche de vaca (APLV) es la alergia alimentaria más frecuente durante los primeros meses de vida, por ser la primera proteína extraña que se incorpora en la alimentación del lactante. Esta se desencadena por una respuesta inmunomediada ante las exposiciones a las proteínas de la leche. Tiene varios mecanismos inmunitarios involucrados, mediados por inmunoglobulina E (IgE), no mediados por IgE o mixtos; secundario a estos, en un tiempo variable, se producen diversos síndromes clínicos.
A nivel mundial, la prevalencia de la APLV es del 1,9% al 4,9%; sin embargo, en Colombia se desconoce. Se considera que este bajo porcentaje se debe, en muchas ocasiones, a que no existe la sospecha por parte del personal de salud dada la amplia gama de manifestaciones clínicas y signos, al igual que la gran variabilidad en los criterios diagnósticos y terapéuticos descritos en América Latina.
Los antecedentes como la exposición a la proteína y la presencia de atopia en los familiares ante la presencia de las manifestaciones clínicas asociadas nos hacen sospechar. El diagnóstico oportuno y el manejo adecuado son imprescindibles para evitar el efecto negativo de la enfermedad.
El pilar del tratamiento es la dieta de exclusión, con el fin de revertir las manifestaciones clínicas que produce la APLV. Sin embargo, puede resultar difícil eliminar la proteína de la leche de la dieta, ya que es un alimento presente en muchas culturas y dietas, o bien es un ingrediente en diferentes productos y sustitutos. En quienes no son alimentados mediante lactancia materna, se deberá tratar con fórmulas lácteas de proteínas extensamente hidrolizadas (FEH) o a base de aminoácidos (FAA). Luego de la recuperación clínica y nutricional del paciente, se debe realizar una prueba de provocación oral.
1. Residente de pediatría, Universidad del Sinú, Montería, Colombia. mariaccastillomontalvo@gmail.com
2. Residente de pediatría, Universidad CES, Medellín, Colombia.
3. Departamento de Pediatría, Servicio de Gastroenterología Infantil, Hospital Pablo Tobón Uribe, Medellín, Colombia.

Alergia a la proteína de la leche de vaca: una actualización basada en el consenso de la Sociedad Latinoamericana de Gastroenterología, Hepatología, Nutrición y las directrices de la Organización Mundial de Alergia (DRACMA XII)
La tolerancia es la respuesta inmune habitual ante la ingesta de un alimento. En algunos individuos, esta respuesta es modificada generando una reacción de hipersensibilidad. Es ahí donde se ven involucrados distintos factores que podrían desarrollar la alergia alimentaria, como los factores genéticos, ambientales, el sexo masculino, la raza (asiática o negra), la predisposición hereditaria (asociación familiar, HLA, genes específicos), la dermatitis atópica, la deficiencia de vitamina D, un bajo consumo de ácidos grasos omega-3 poliinsaturados, la ingesta limitada de antioxidantes, la obesidad.
Existen varios factores relacionados tanto con el individuo como con el antígeno que pueden favorecer la tolerancia o la sensibilización. Los factores relacionados con el individuo y el antígeno se mencionan en la Tabla 1.
La leche de vaca se obtiene de la glándula mamaria de las vacas; cada 100 mL contienen 3 gramos de proteína dentro de las cuales se pueden identificar más de 40 distintas. La composición de la leche en relación con sus proteínas se describe en la Tabla 2 . Estas proteínas son resistentes al calor, pero la β -lactoglobulina es la más termolábil y luego de un calentamiento por más de 20 minutos puede incrementar su capacidad alergénica al generar estructuras inmunológicamente más activas; a temperaturas más altas y prolongadas, como por ejemplo los productos horneados, disminuyen esta característica, lo que genera una mayor tolerabilidad. Es importante recordar que se pueden generar reacciones cruzadas con la leche de otros mamíferos como la cabra, oveja, vaca. La sensibilización más frecuente es hacia la caseína.
Tabla 1. Factores relacionados con el individuo y el antígeno que pueden favorecer la tolerancia o la sensibilización
Dosis de antígeno Las dosis bajas inducen la producción de células T reguladoras que promueven la tolerancia a través de un mecanismo de supresión. Este mecanismo también actúa frente a dosis altas de antígeno.
Forma de antígeno Los alimentos sólidos sensibilizan más que los solubles. Además, los alimentos procesados o sometidos a ciertas condiciones de temperatura pueden aumentar la respuesta del tipo Th2.
Edad de exposición Introducir un alimento de manera temprana y en cantidades adecuadas generalmente induce tolerancia.
Vía de entrada La exposición extraintestinal (por ejemplo, vía cutánea) tiende a aumentar la sensibilización.
Edad La sensibilización a alimentos es más común en la infancia, posiblemente debido a una maduración retrasada de los mecanismos protectores intestinales.
Factores genéticos Existe una predisposición genética que facilita el desarrollo de alergias alimentarias.
Microbiota El entorno microbiano en el intestino puede facilitar la respuesta de tolerancia; los recién nacidos por cesárea tienen un mayor riesgo.

Factores que afectan al tracto intestinal
La lactancia materna favorece la tolerancia, mientras que el tratamiento con antiácidos puede favorecer la sensibilización.
Modificada de: Lapeña López de Armentia S, et al. Pediatr Integral 2018;22(2):76-86.
Tabla 2. Características de las principales proteínas presentes en la leche de vaca
Caseína (80%) Bos d 8 98%
α-S1-caseína
α-S2-caseína
β-caseína
κ-caseína
Proteínas de suero (20%)
α-lactoalbúmina
β-lactoglobulina
Seroalbúmina
Bos d 9 98%
d 10 94%
- Principal alérgeno - Termoestable
>85% leche de cabra y oveja
d 6 43% 15%-20% carne de ternera
Modificada de: Lapeña López de Armentia S, et al. Pediatr Integral 2018;22(2):76-86.
Las proteínas de la leche de vaca, como antígenos, atraviesan el lumen intestinal y son detectadas por las células M de la mucosa intestinal, que luego transmiten la información a las células presentadoras de antígenos, generalmente las células dendríticas en la submucosa. Estas células presentadoras de antígenos exponen el antígeno al linfocito T ayudador (TH 0), que activa una respuesta inmune a través de una sobreproducción de linfocitos T ayudadores tipo 2 (TH2), mediante la secreción de citocinas como las interleucinas 4 y 13. Los Th2, a su vez, estimulan los linfocitos B para que produzcan IgE específica contra el antígeno.
En el caso de las reacciones no mediadas por IgE, algunas citocinas como la IL-5 y el factor de necrosis tumoral alfa (TNF- α), secretadas por los Th 0, promueven el reclutamiento de neutrófilos y la activación de eosinófilos, lo que puede causar edemas, dolor y disfunción de los órganos. Así, cuando el niño se expone
Alérgeno mayor
- Alérgeno mayor - Termolábil
- No está presente en la leche humana
nuevamente al antígeno, se desencadena una reacción de antígeno-anticuerpo, que activa los linfocitos B previamente sensibilizados o la desgranulación de mastocitos y eosinófilos, lo que genera síntomas en diferentes sistemas.
Las manifestaciones clínicas en lactantes con APLV van a depender del mecanismo inmunológico asociado: mediado por IgE, donde los síntomas aparecen en minutos o hasta 2 horas posterior de la ingesta del alérgeno, las manifestaciones son principalmente cutáneas (70%-75%), gastrointestinales (13%-34%) y respiratorias (1%-8%); en menor proporción, pero más grave, la anafilaxia (1%-4%) (Figura 1). En el no mediado por IgE, los síntomas aparecen de forma más tardía, entre 48 horas y algunas semanas después de la ingesta, son principalmente digestivos e incluyen tres síndromes: proctocolitis, enteropatía y síndrome de enterocolitis inducida por proteínas alimentarias

Alergia a la proteína de la leche de vaca: una actualización basada en el consenso de la Sociedad Latinoamericana de Gastroenterología, Hepatología, Nutrición y las directrices de la Organización Mundial de Alergia (DRACMA XII)
Figura 1. Manifestaciones clínicas de la APLV según el mecanismo inmunológico involucrado.
Modificada de: Toca MC, et al. Rev Gastroenterol Méx. 2022; 87:235-250.
Piel: urticaria, angioedema, prurito, edema
Cardiovascular: taquicardia, hipotensión, mareo, fatiga.
Anafilaxia.
Enterocolitis inducida por proteínas de los alimentos (FPIES): vómitos y diarrea intensos, deshidratación profunda, letargo y choque.
Respiratorio: asma, rinitis, prurito, estornudos, congestión nasal.
Gastrointestinal: alergia oral, dolor abdominal, diarrea, náuseas, vómitos.
Enteropatía inducida por PLV (EPA): diarrea prolongada, retraso en el crecimiento y síndrome malabsortivo.
Alergia a la proteína de la leche de vaca
Proctocolitis/proctitis inducida por PLV (FPIAP): heces blandas, mucosas y con vetas de sangre, ocasionalmente diarrea.
Gastroenteritis eosinofílica: adema, ascitis, obstrucción, pérdida de peso.
Dermatitis atópica: lesiones moderadas-graves.
provocadas por la PLV; también pueden estar presentes síntomas que se asemejan a trastornos gastrointestinales funcionales, como regurgitación, estreñimiento y cólico del lactante. Por último, aquella causada por mecanismos mixtos, se presenta con síntomas relacionados con la piel, dermatitis atópica y, más raramente, esofagitis y gastroenteritis eosinofílica.

El diagnóstico es clínico, usualmente por exclusión o provocación. Se debe individualizar en cada paciente, a través de las siguientes pruebas.
Esofagitis eosinofílica: impactación alimentaria, vómitos, reflujo, desórdenes alimentarios. - ERGE - Estreñimiento - Cólico del lactante.
Prueba de provocación oral alimentaria
Es el estándar de oro, dado que la provocación alimentaria requiere de mucho tiempo y conlleva riesgo de anafilaxia. No se utiliza de forma rutinaria, debe ser realizada por médico experto (gastroenterólogo o alergólogo).
La prueba de provocación con leche de vaca confirma la APLV.
Una prueba que deriva en una reacción clínica se define como positiva o provocación fallida e indicará la dosis tolerada y permitirá la planificación de dieta de exclusión parcial o completa de PLV. Una prueba sin reacción
clínica se define como provocación negativa o aprobada.
Paraclínicos básicos
Hemograma, extendido de sangre periférica, ferritina, proteínas totales y diferenciales.
Evaluación nutricional
Todo paciente requiere evaluación nutricional para determinar el riesgo nutricional de ingesta de alérgenos.
Prueba intradérmica
Confirma la sensibilización, pero no determina el diagnóstico de APLV.
Niveles de IgE específicos
Para leche de vaca tiene un punto de corte de >5 KU/L en <1 año y >15 KU/L en >1 año; indican mayor probabilidad de alergia clínica, pero valores más altos no se correlacionan con la gravedad de la reacción tras la exposición a la proteína alimentaria.
Prueba dérmica de sensibilización
No se recomienda en pacientes con alergia alimentaria mediada por IgE. En pacientes con clínica compatible con reacciones mediadas por IgE o mixtas y en los que tienen clínica no mediada por IgE sin adecuada respuesta al tratamiento, se solicita IgE específica (prueba RAST o ImmunoCAP) y prueba de punción para leche de vaca y se remite a gastroenterología o alergología.
Otro recurso disponible es la realización de endoscopia digestiva superior que se considera según la sintomatología del paciente y si se sospecha esofagitis eosinofílica o pacientes con proctocolitis alérgica, asociada a anemia, distensión abdominal, vómito persistente.
Las indicaciones para realizar endoscopia a pacientes con APLV son signos de malabsorción, deficiencia de micro- o macronutrientes y poca ganancia de peso o desnutrición, sospecha de gastroenteropatía eosinofílica; anemia e hipoalbuminemia en pacientes alérgicos; dolor abdominal persistente, distensión e hiporexia; inapetencia persistente y sospecha de esofagitis eosinofílica; hemorragia del tracto digestivo alto o bajo; diagnóstico de síndrome de enterocolitis inducida por proteínas alimentarias (Food ProteinInduced Enterocolitis Syndrome, FPIES); sospecha de enfermedad inflamatoria intestinal; control durante el tratamiento o el postratamiento (por ejemplo, esofagitis eosinofílica).
Los hallazgos endoscópicos para diagnóstico de APLV en muchas ocasiones son inespecíficos, pueden ser normales en un 7% a un 32% de los casos; cuando se sospecha de esofagitis eosinofílica se pueden encontrar surcos lineales y anillos circulares, alteración del patrón valvular, pápulas blanquecinas, estenosis parciales y completas. Siempre se debe tomar biopsias proximales y distales del esófago, antro y cuerpo del estómago el duodeno y el bulbo; en el colon e íleon, ciego y todos los cuadrantes para efectuar el estudio de gastroenteropatía eosinofílica, enfermedad celíaca, presencia de Helicobacter pylori
TRATAMIENTO
Nutrición
El manejo se debe realizar por un equipo multidisciplinario, incluyendo un profesional de nutrición especializado en APLV. Se recomienda una dieta de exclusión de mínimo 6 meses en pacientes menores de 1 año; esta debe ser estricta, efectiva y completa, además evitar contacto o inhalación de productos que contengan trazas de PLV. Se debe mantener un adecuado estado nutricional del paciente con el fin de garantizar un adecuado crecimiento y desarrollo.

Alergia a la proteína de la leche de vaca: una actualización basada en el consenso de la Sociedad Latinoamericana de Gastroenterología, Hepatología, Nutrición y las directrices de la Organización Mundial de Alergia (DRACMA XII)
En pacientes con APLV alimentados con lactancia materna, se requiere la estricta eliminación de la PLV en la dieta de la madre, se indica dieta de supresión de todos los alimentos que contienen PLV y se suplementa con calcio. Se debe informar a los padres sobre las formas de sensibilización del paciente y la revisión cuidadosa de etiquetas para verificar que los productos no tengan en sus componentes PLV.
Además, se debe motivar a los padres a continuar con la lactancia materna; si se hace una buena dieta de exclusión en la madre, la sintomatología gastrointestinal mejorará en 2 semanas y las dermatológicas a las 6 semanas de restricción. Si no mejoran con la restricción, se debe remitir a gastroenterología antes de suspender la lactancia materna.
En aquellos pacientes no amamantados, se recomienda utilizar una fórmula extensamente
hidrolizada o una fórmula hidrolizada a base de arroz como primera opción para tratar a los bebés con APLV mediada por IgE y no mediada por IgE. Como alternativas, se podrían considerar una fórmula a base de aminoácidos o una fórmula de soya en segundo y tercer lugar, respectivamente. Además, se sugiere utilizar una fórmula sin probióticos o una fórmula extensamente hidrolizada a base de caseína que contenga Lacticaseibacillus rhamnosus GG (LGG). Cuando no se puede garantizar el consumo de un volumen 500 cc de fórmula, es necesaria la suplementación con calcio, hierro y vitamina D.
La alimentación complementaria en estos pacientes se puede introducir entre 4 y 6 meses de edad, puesto que hay mayor riesgo de alergias si se introduce antes de los 4 meses. Se debe evitar el consumo de leche de cabra, puesto que tiene alto riesgo de reacciones cruzadas ( Tabla 3).
Tabla 3. Fórmulas hipoalergénicas (90% de tolerancia clínica en niños con APLV comprobada)
Fórmula extensamente hidrolizada
Fórmulas de soya
Fórmulas de aminoácidos libres

La fuente de la proteína es suero o caseína.
La palatabilidad depende del tipo de proteína, del grado de hidrólisis y de la presencia o ausencia de lactosa.
Las FEH son fórmulas de inicio para el tratamiento de la APLV (DRACMA) y dan una solución a más del 90% de los pacientes con manifestaciones clínicas leves a moderadas.
Las FEH de arroz son una alternativa cuando no hay respuesta a otras FEH. No se consideran una primera opción. Los estudios realizados con estas fórmulas son a corto plazo y es incierto si pueden desencadenar sensibilización al arroz.
Están indicadas en la APLV mediada por IgE, cuando no hay tolerancia (palatabilidad) o si no existe respuesta con las FEH o las FAA.
No son adecuadas para la administración en <6 meses de edad por su composición nutricional y la posibilidad de reacción cruzada.
Se recomiendan cuando:
No hay respuesta con el uso de las FEH.
- Existe una alergia alimentaria múltiple.
- Hay APLV con sintomatología grave: anemia, hipoalbuminemia, desnutrición.
- Existe presencia de manifestaciones clínicas graves de la APLV, cuando los síntomas no mejoran en un paciente con lactancia exclusiva y no mejora con las restricciones realizadas a la madre. La mayoría de los pacientes responden a una alimentación mixta.
- Se presenta esofagitis eosinofílica.
- FPIES.
- Anafilaxia.
Síndrome de Heiner.
Adaptada de: Toca MC, et al. Rev Gastroenterol Méx. 2022;87:235-250.
El primer reto terapéutico se recomienda realizarlo después de 6 meses a un año del diagnóstico si el paciente tiene síntomas leves. En casos de síntomas graves como anafilaxia, el tiempo mínimo para realizar el reto es de 1 año; se debe realizar bajo estricta vigilancia y monitorización, idealmente en un centro hospitalario. No se recomienda realizar este reto al mismo tiempo de la introducción de la alimentación complementaria, puesto que puede haber confusiones si la sintomatología es por el reto o por la alimentación complementaria.
Farmacológico
No hay tratamiento farmacológico específico para la APLV. En reacciones leves, se puede implementar el uso de antihistamínicos; en casos de reacciones graves de IgE mediadas como la anafilaxia, se utiliza la adrenalina como elección. En Colombia, se usa de manera intrahospitalaria, por lo que en caso de presentar esta reacción deben asistir al servicio de urgencias. La dosis de adrenalina es 0,15 mg intramuscular (IM) sin diluir en menores de 25 kg o 0,3 mg en mayores de 25 kg. Se recomienda aplicación con aguja corta recambiable en tercio medio y lateral del muslo, y repetir dosis de 10 a 15 minutos si no hay respuesta. En ocasiones, pueden requerir reanimación hídrica y oxígeno suplementario y antihistamínicos H1 y H2 , glucocorticoides y broncodilatadores como adyuvantes. En anafilaxia refractaria a la adrenalina, se podría considerar el uso de glucagón.
Inmunoterapia
Se realiza con el objetivo de desensibilizar, es decir, aumentar el umbral de reactividad del paciente a un alérgeno y buscar una tolerancia sostenida durante meses o años sin tratamiento adicional, pero esto no siempre se logra. Lo deseable es que no se genere una reacción grave ante una exposición accidental.
Tipos de inmunoterapia utilizadas en la alergia a la proteína a la leche de vaca
• Inmunoterapia sublingual (extracto líquido del alérgeno sublingual). Solo se utiliza para investigación en alergia alimentaria. En APLV, en el primer reporte de Boissieu, mostró el 70% de desensibilización. Al parecer es más segura.
• Inmunoterapia oral. Se expone al paciente al alérgeno, a dosis escalonadas por vía oral. No está aprobada por la FDA en el tratamiento de alergia alimentaria. Presenta efectos adversos frecuentes (20%). Las guías españolas de inmunoterapia oral la recomiendan para el tratamiento de alergias a la leche y el huevo.
• Inmunoterapia epicutánea. En estudio. Se hace aplicación de PLV en forma de parches. Las reacciones en la piel son frecuentes. No hay reacciones graves.
La APLV es la alergia alimentaria más frecuente durante los primeros meses de vida. Se puede desencadenar por varios mecanismos, ya sea IgE mediados, no IgE mediados o mixtos; y dependiendo de estos mecanismos pueden tener diferentes manifestaciones clínicas cutáneas, gastrointestinales y respiratorias, y graves como anafilaxia. El diagnóstico es clínico y se apoya con prueba de provocación oral que es el estándar de oro para el diagnóstico.
El pilar de tratamiento es la dieta de exclusión de la PLV de la dieta. Si el paciente recibe lactancia materna, la madre debe realizar una dieta de exclusión estricta de la PLV; en formas muy graves, se apoya de fórmulas lácteas hipoalergénicas como FEH y FAA. Se debe hacer seguimiento por equipo multidisciplinario que incluya gastroenterólogos, alergólogos y especialistas en nutrición.

Alergia a la proteína de la leche de vaca: una actualización basada en el consenso de la Sociedad Latinoamericana de Gastroenterología, Hepatología, Nutrición y las directrices de la Organización Mundial de Alergia (DRACMA XII)
1. Bognanni A, Fiocchi A, Arasi S, Chu DK, Ansotegui I, Assa’ad AH, et al. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow’s Milk Allergy (DRACMA) guideline update - XII - Recommendations on milk formula supplements with and without probiotics for infants and toddlers with CMA. World Allergy Organ J. 2024;17(4):100888.
2. Burris AD, Burris J, Järvinen KM. Cow’s Milk Protein Allergy in Term and Preterm Infants: Clinical Manifestations, Immunologic Pathophysiology, and Management Strategies. Neoreviews. 2020;21(12): e795-e808.
4. Lapeña López de Armentia S, Hierro Delgado E. Alergia a proteínas de leche de vaca. Pediatr Integral 2018;22(2):76-86.
5. Toca MC, Morais MB, Vázquez-Frias R, Becker-Cuevas DJ, Boggio-Marzet CG, Delgado-Carbajal L, et al. Consenso sobre el diagnóstico y el tratamiento de la alergia a las proteínas de la leche de vaca de la Sociedad Latinoamericana de Gastroenterología, Hepatología y Nutrición. Rev Gastroenterol Méx. 2022;87:235-250.
6. Valdesoiro Navarrete L, Boné Calvo J, Plaza Martín AM. Alergia IgE mediada a proteínas de leche de vaca. Protoc. diagn. ter. pediatr. 2019;2:207-15.
7. Vitaliti G, Cimino C, Coco A, Praticò AD, Lionetti E. The immunopathogenesis of cow’s milk protein allergy (CMPA). Ital J Pediatr. 2012;38:35.
3. Espín Jaime B, Díaz Martín JJ, Blesa Baviera LC, Claver Monzón Á, Hernández Hernández A, García Burriel JI, et al. Alergia a las proteínas de leche de vaca no mediada por IgE: Documento de consenso de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP), la Asociación Española de Pediatría de Atención Primaria (AEPap), la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP) y la Sociedad Española de Inmunología Clínica, Alergología y Asma Pediátrica (SEICAP). An Pediatr (Barc). 2019;90(3):193.e1-193.e11.


autoinflamatorias en pediatría: avances y perspectivas desde la evidencia actual
Erika Jhohanna Arenas Contreras1
Jeymi Andrea Natera Fernández2
Cristina Muñoz Otero3
El término de enfermedades autoinflamatorias (EAS) se utilizó por primera vez en el año 1999 por el doctor Daniel Kastner para describir al grupo de enfermedades caracterizadas por una desregulación del sistema inmunitario innato que genera episodios de inflamación sistémica en ausencia de infecciones. En el año 2018, la Organización Internacional de Ensayos de Reumatología Pediátrica (PRINTO) la definió como el grupo de trastornos clínicos causados por defecto(s) o desregulación del sistema inmune innato, caracterizados por la inflamación recurrente o continua y la falta de un papel patogénico primario para el sistema inmune adaptativo.
La fisiopatología es compleja, se conoce hasta la fecha que muchas son causadas por mutaciones en genes involucrados en la inmunidad innata; otras, por el contrario, son poligénicas,
asociadas a factores ambientales en pacientes genéticamente susceptibles. Se diferencia de las enfermedades autoinmunes en que estas últimas están asociadas a un mal funcionamiento del sistema inmune adaptativo, que estará mediado por linfocitos B y T.
El 90% de los pacientes tienen debut de la enfermedad durante la infancia o niñez y alrededor del 10% presentan sus primeras manifestaciones clínicas después de los 30 años (Figura 1).
Las enfermedades autoinflamatorias deben sospecharse en pacientes con episodios de fiebre recurrentes o periódicas, con manifestaciones inflamatorias durante períodos prolongados, compromiso cutáneo, articular e incluso en el sistema nervioso, duración variable de intervalos libres de síntomas, sin causa infecciosa o neoplásica identificable. Estas pueden ser desencadenadas por diversos factores, entre los que se encuentran estrés,
1. Médico residente de Pediatría, Universidad del Norte; Barranquilla, Colombia. ORCID: 0009-0006-6389-1121. E-mail: erikaarenas@uninorte.edu.co.
2. Médico residente de Pediatría, Universidad Libre de Barranquilla, Colombia.
3. Medicina interna pediátrica, Hospital Universidad del Norte. Docente de posgrado, Universidad Libre y Universidad del Norte.

Figura 1. Edad común de presentación de los trastornos autoinflamatorios sistémicos. Tomada de: Borges T, et al. Reumatismo. 2020;71(4):177-188
FMF
TRAPS
DITRA
PAPA, PAPASH*, PAC*
CAPS FCAS2
Majeed* Blau* PFAPA*
compuestos orgánicos volátiles (VOC) y estimulación antigénica después de la vacunación o infecciones virales.
La EAS incluye trastornos monogénicos y poligénicos, como fiebre mediterránea familiar (FMF), artritis idiopática juvenil sistémica (AIJ), síndrome PFAPA (fiebre periódica, estomatitis aftosa, faringitis, adenitis), enfermedad de Behçet, osteomielitis multifocal recurrente crónica (CRMO), entre otros.
MOLECULAR DE LA INFLAMACIÓN Y AUTOINFLAMACIÓN
El sistema inmune innato es la primera línea de defensa que proporciona una amplia gama de receptores de señalización, llamados receptores de reconocimiento de patrones (PRR). Los receptores se pueden encontrar a nivel de membrana, como receptores tipo Toll (TLR) y los receptores de lectina tipo C (CLR), caracterizados por su dominio de unión a carbohidratos.
De igual manera, se encuentran los sensores intracelulares, como los receptores con dominio de oligomerización de unión a nucleótidos (NOD) (NLR), los receptores tipo ausencia en melanoma 2 (AIM2) (ALR) y la pirina que

Dehcet Sweet PG Schnitzler`s
SpA
SAPHO Crohn,s IgG4-RD Gout
Crohn´s
Pseudogout AOSD
forman parte de los andamiajes proteicos multiméricos denominados inflamasomas. Todos estos receptores tienen la función de detectar y responder a patógenos, reconociéndolos a través de los patrones moleculares asociados a patógenos microbianos (PAMPP) o los patrones moleculares asociados a daños no microbianos (DAMP), que son estructuras concretas en los agentes patógenos, que realmente son activadores microbianos de la respuesta inmune innata.
El inflamosoma es un complejo multiproteico que promueve la oligomerización , maduración y activación de caspasa-1 para posterior liberación de citocinas como IL-1β y IL-18, lo que desencadena una respuesta inflamatoria con producción de reactantes de fase aguda, elevación de la temperatura y activación de neutrófilos. Cuando las proteínas reguladoras del inflamasoma se alteran, cambian su funcionamiento normal, lo que da lugar a un estado anormal de hiperinflamación.
Las enfermedades autoinflamatorias están dominadas por tres vías inflamatorias, entre las que se encuentran:
• Síndromes relacionados con el inflamasoma. Son los más frecuentes; entre ellos se encuentra la FMF, el síndrome de hiperinmunoglobulina D (HIDS) y los síndromes periódicos
asociados a la criopirina (CAPS). Provocan una excesiva señalización de interleucina 1 (IL-1) y su bloqueo será crucial para el tratamiento.
• Interferonopatías Se caracterizan por una producción excesiva y desmesurada de interferones de tipo I (IFN tipo I), mediadores claves para el control de virus y otros patógenos, lo que provoca inflamación crónica y daño a órganos, como el Aicardi-Goutières y el síndrome de vasculopatía inducida por interferón con necrosis (SAVI).
• Desregulación en la señalización de la activación del factor nuclear kappa B (NFκB) del factor de necrosis tumoral (TNF). Abarca un grupo de patologías en las que la inflamación crónica se presenta sin la participación directa del inflamasoma, como alteraciones en el control de TNF (en el síndrome periódico asociado al receptor del factor de necrosis tumoral [TRAPS]), desórdenes en la activación del NF- κB (síndrome de Blau y querubismo) y en la activación de los macrófagos (querubismo).
Fiebre mediterránea familiar
La FMF es la enfermedad autoinflamatoria hereditaria más común en el mundo. Se presenta de forma habitual por episodios recurrentes de fiebre e inflamación de las serosas. Tiene un patrón de herencia autosómica recesiva, con mutaciones en el gen MEFV (gen de la fiebre mediterránea), localizadas en el cromosoma 16; este gen codifica una proteína de 781 aminoácidos llamada pirina, proveniente de la palabra griega pyros, que significa fiebre. La pirina tiene un papel clave en el control de la inflamación a través de su relación con otras proteínas que conforman el inflamasoma, produciéndose un aumento de la activación de caspasa-1 y producción de IL-1β.
Suele debutar en la infancia, con una edad media de inicio de los síntomas a los 9 ± 8,6 años. La fiebre puede ser a veces la única manifestación, especialmente en niños pequeños. Se caracteriza por una aparición brusca, que alcanza hasta los 40 °C y suele estar presente durante todo el episodio inflamatorio (2 a 3 días). Los síntomas abdominales suelen acompañar a la fiebre y se presentan en casi el 90% de los pacientes. Se manifiesta desde dolor abdominal leve hasta simular un abdomen agudo (Figura 2). Asimismo, las manifestaciones articulares se pueden presentar hasta en el 70% de los pacientes y pueden ser el síntoma primordial de enfermedad, manifestándose con artralgias, especialmente a nivel de los tobillos. También puede aparecer artritis, mono-, oligo- o poliarticular que puede llevar a la confusión con una AIJ. De igual forma, el dolor muscular es una de las manifestaciones clásicas, sobre todo en los períodos de fiebre más elevada. Aparece después del esfuerzo físico y disminuye con el descanso o antiinflamatorios no esteroides (AINE).
Los pacientes con FMF presentan una inflamación subclínica continúa; esta situación puede predisponer al desarrollo de amiloidosis sistémica, la complicación más grave de la enfermedad y causa de mortalidad en estos pacientes.
Diagnóstico
El diagnóstico se realiza a partir de los síntomas clínicos y en ocasiones es respaldado por los antecedentes familiares. Durante los ataques, se evidencia un aumento de reactantes de fase aguda como la proteína C-reactiva (PCR), velocidad de sedimentación globular (VSG), amiloide A sérico (SAA) y complemento. También se puede encontrar leucocitosis con neutrofilia.
Recientemente, PRINTO ha propuesto unos criterios clasificatorios para la FMF; unos con

Figura 2. Manifestaciones clínicas de la FMF. Adaptada de: Bittermann V, et al. Protoc Diagn Ter Pediatr. 2020;2:379-389.
Fiebre
Derrame pleural Disnea
Proteinuria
Amiloidosis
Escroto agudo
Mono-, oligo- o poliartritis
Artralgias
Sacroilitis

criterios solo clínicos y otros combinados para aquellos pacientes con un genotipo confirmatorio y otro para pacientes con genotipo no confirmatorio ( Tabla 1). Estudios informaron que este nuevo conjunto de criterios es más sensible (96%) y menos específico (73,1%) que los criterios de Tel Hashomer y YalcinkayaOzen. No obstante, es fundamental recordar que el diagnóstico de FMF se basa en la clínica. Si el cuadro fenotípico coincide con FMF, el diagnóstico no debe descartarse incluso en ausencia de confirmación genética.
Tratamiento
Tiene como objetivo prevenir las recurrencias y prolongar los períodos intercrisis, reducir la gravedad de los ataques y controlar las secuelas a largo plazo de la enfermedad, como la amiloidosis. El pilar del tratamiento es la colchicina, que es eficaz no solo para controlar los ataques, sino también para prevenir la

Cefalea
Meningitis aséptica
Pericarditis
Esplenomegalia
Dolor abdominal
Estreñimiento
Peritonitis estéril
Inflamación apendicular
Mialgia
Eritema erisipeloide
Vasculitis cutánea (vasculitis IgA, poliarteritis nodosa)
amiloidosis secundaria. La dosis recomendada de colchicina es 0,5 mg/día en menores de 5 años, 0,5-1 mg/día en pacientes de 5 a 10 años y de 1-1,5 mg/día en mayores de 10 años y en adultos; es necesario su ajuste en función de la respuesta clínica y los niveles de PCR o SAA intercrisis. La dosis máxima recomendada en niños es de hasta 2 mg/día.
Se describe entre el 5% al 10% de resistencia a pesar de un tratamiento correcto. La resistencia a la colchicina se define como >1 ataque por mes en pacientes que cumplen la dosis máxima tolerada durante >6 meses. En pacientes con FMF, dado que es una enfermedad autoinflamatoria mediada por IL-1, se ha demostrado que los fármacos inhibidores de IL-1 son efectivos. Aquellos pacientes tratados con estos biológicos suelen lograr remisión tanto clínica como analítica. En todos los casos, se recomienda mantener el tratamiento con colchicina, y es posible reducir su dosis si la
Tabla 1. Nuevos criterios de clasificación Eurofever/PRINTO para FMF
Criterios de clasificación.
Presencia de genotipo MEFV confirmatorio y al menos uno de los siguientes:
- Duración de los episodios 1-3 días.
- Artritis.
- Dolor torácico.
- Dolor abdominal.
O presencia de genotipo MEFV no confirmatorio y al menos dos de los siguientes:
- Duración de los episodios 1-3 días.
- Artritis.
- Dolor torácico.
- Dolor abdominal.
Adaptada de: Yıldız M, et al. Balkan Med J. 2020;37(5):236-246.
Criterios clínicos
Al menos seis de los siguientes nueve:
Presencia de
- Etnia mediterránea oriental.
- Episodios de 1 a 3 días de duración.
- Dolor en el pecho.
- Dolor abdominal.
- Artritis.
Ausencia de
- Estomatitis aftosa.
- Urticaria.
- Erupción maculopapular.
- Linfadenopatía dolorosa.
respuesta clínica es adecuada. Por otro lado, la artritis en estos pacientes debe manejarse con fármacos modificadores de la enfermedad (FAME), como el metotrexato, infiltraciones articulares o tratamiento biológico.
En un paciente que solo presenta genética positiva para FMF, pero se encuentra totalmente asintomático, no es preciso iniciar el tratamiento. No obstante, se recomienda llevar a cabo un control clínico y analítico estrecho para detectar de forma temprana la posible aparición de amiloidosis secundaria.
Síndrome periódico asociado al receptor del factor de necrosis tumoral
Denominado anteriormente como fiebre hiberniana familiar, el TRAPS es un trastorno poco frecuente, con una prevalencia de aproximadamente un caso por millón de habitantes. Se presenta por una mutación en el gen que codifica el receptor para el TNF, conocido como TNFR1 (miembro 1A de la superfamilia del receptor de TNF), con una herencia autosómica dominante.
Clínica
La mayoría de los pacientes debutan con síntomas en la infancia, con una media de 4 años, y es poco común en adolescentes o adultos.
Se caracteriza por fiebre recurrente durante meses o años, sin infecciones identificables. Los episodios ocurren cada 5 a 6 semanas, sin factores desencadenantes claros, sin embargo, algunos pacientes o sus cuidadores identifican que el estrés físico o emocional podría predisponer a la aparición de los ataques. Son frecuentes las mialgias migratorias, dolor abdominal con vómitos, erupciones eritematosas en extremidades, linfadenopatía, artritis monoarticular, hepatomegalia y esplenomegalia.
Diagnóstico
Es de exclusión, luego de haber descartado otras causas de fiebre recurrente. Entre las características claves para sospechar de TRAPS se incluyen episodios de larga duración (al menos seis días, aunque típicamente más), mialgias, erupción migratoria y edema periorbitario. La

Tabla 2 enumera los criterios diagnósticos. No existen pruebas de laboratorio específicas, fuera de las pruebas genéticas, que puedan establecer el diagnóstico.
Tabla 2. Criterios diagnósticos de TRAPS
Presencia de variantes patógenas (o probablemente patógenas) de TNFRSF1A (heterocigotos) y al menos uno de los siguientes:
1. Duración de los episodios >7 días.
2. Mialgia.
3. Erupción migratoria.
4. Edema periorbitario.
5. Familiares afectados.
o
Presencia de una variante de significado incierto de TNFRSF1A y al menos dos de los siguientes:
1. Duración de los episodios >7.
2. Mialgia.
3. Erupción migratoria.
4. Edema periorbitario.
5. Familiares afectados.
Adaptada de: Yıldız M, et al. Balkan Med J. 2020;37(5):236246.
Tratamiento
El manejo dependerá de la frecuencia y la intensidad de la presentación. En pacientes con brotes leves, caracterizados por fiebre y malestar tolerable, se recomienda el uso exclusivo de un AINE por un período de tres a cinco días. No obstante, si los síntomas se intensifican, se aconseja añadir un glucocorticoide oral al tratamiento.
En pacientes que presentan un ataque clásico, caracterizado por fiebre, mialgia, erupción migratoria, edema periorbitario o dolor abdominal, se sugiere iniciar manejo con glucocorticoides orales, como prednisona con una dosis inicial de 1 mg/kg/día hasta un máximo de 60 mg/día administrado al inicio del cuadro y se debe disminuir de manera progresiva hasta suspender en un plazo de 7 a 10 días.

En caso de que el paciente presente ataques frecuentes (más de tres o cuatro ataques por año), respuesta inadecuada a los corticoides, elevación persistente de los marcadores inflamatorios o mutaciones de TNFR1 clasificadas como patógenas o probablemente patógenas, se sugiere terapia profiláctica con canakinumab, un anticuerpo monoclonal anti-IL-1β
Deficiencia de mevalonato quinasa
También conocida como síndrome de hiperinmunoglobulina D (HIDS), la deficiencia de mevalonato cinasa (MKD) presenta una herencia autosómica recesiva causada por mutaciones en el gen responsable de codificar la enzima mevalonato cinasa, fundamental para la vía de síntesis del colesterol, que desempeña un papel crucial en diversos procesos celulares. Estas mutaciones provocan una disminución del producto de la vía del mevalonato cinasa, lo que provoca la secreción de IL-1β con la consiguiente autoinflamación.
Clínica
Se presenta típicamente durante el primer año de vida y muchas veces los episodios son desencadenados por las vacunas, traumatismos menores y estrés. Se caracteriza por fiebre persistente que dura varios días acompañados de linfadenopatía, esplenomegalia, compromiso articular, dolor abdominal y exantema, que van atenuando con el cese de la fiebre. No obstante, las manifestaciones cutáneas y articulares son la excepción, ya que suelen persistir, aunque generalmente resuelven antes de que comience el siguiente episodio. Los períodos intercrisis suelen ser de cuatro a ocho semanas, en las que el paciente se encuentra completamente asintomático.
Diagnóstico
Se sospecha a partir de una clínica sugestiva y hallazgo de laboratorios, en los que se
encuentran neutrofilia y elevación de IgD sérica ( Tabla 3). Sin embargo, en ausencia de datos clínicos sugerentes de HIDS, las posibles causas de aumento de IgD se encuentran linfoma de Hodgkin, sarcoidosis, tuberculosis, aspergilosis, ataxia-telangiectasia o infección por el virus de la inmunodeficiencia humana (VIH).
Tratamiento
El uso de corticosteroides sistémicos en ciclos cortos es eficaz para reducir los síntomas. En presentaciones leves, el paciente puede responder al manejo antiinflamatorio con AINE. En caso de refractariedad, se debe considerar el tratamiento con un agente biológico como los agentes antiIL-1 o anti-TNF.
Artritis idiopática juvenil
Dentro de sus subtipos, la AIJ sistémica es considerada una enfermedad autoinflamatoria debido a su predominante activación del
sistema inmune innato. Se caracteriza por la producción excesiva de citocinas proinflamatorias como la IL-1, la IL-6 y la IL-18, comparada con otros subtipos como la oligoarticular y la poliarticular, que están mediadas por respuestas adaptativas, incluyendo activación de células T autorreactivas.
Clínica
Entre las manifestaciones clínicas se encuentran la artritis, fiebre periódica, linfadenopatías, pericarditis y peritonitis. Entre las complicaciones potencialmente mortales se encuentra el síndrome de activación macrofágica (SAM). Dentro de los hallazgos de laboratorio, los leucocitos la mayoría de las veces estarán elevados, habrá marcada trombocitosis reactiva; los marcadores de respuesta inflamatoria como PCR y VSG suelen estar aumentados. Los anticuerpos antinucleares y el factor reumatoide son casi siempre negativos.
Tratamiento
El objetivo del manejo se basa en controlar la inflamación, prevenir complicaciones y mejorar
Tabla 3. Características del síndrome de hiperinmunoglobulina D
General
- IgD alta (>14 mg/dL), medida en 2 ocasiones, con al menos 1 mes de diferencia.
- IgA elevada (>260 mg/dL).
- Ataques recurrentes.
- Mutaciones en el gen MVK (HIDS clásico).
- Disminución de la actividad de MVK (HIDS clásico).
Durante los ataques
- Marcadores inflamatorios elevados (VSG, PCR, SAA y leucocitosis).
- Aparición repentina de fiebre (>38,5 °C o 101,3 °F).
- Linfadenopatía (predominantemente cervical).
- Malestar abdominal (vómitos, diarrea, dolor).
- Manifestaciones cutáneas (máculas eritematosas variables, pápulas, petequias y púrpura).
- Artralgias/artritis.
- Esplenomegalia.
- Concentración de ácido mevalónico urinario levemente elevada (HIDS clásico).
IgA: inmunoglobulina A; IgD: inmunoglobulina D; MVK: mevalonato cinasa; PCR: proteína C-reactiva; SAA: amiloide sérico A; VSG: velocidad de sedimentación globular. Adaptada de: Yıldız M, et al. Balkan Med J. 2020;37(5):236-246.

la calidad de vida del paciente. En presentaciones leves, se recomienda manejo con AINE. El uso de agentes biológicos como los inhibidores de interleucinas como anakinra y canakinumab ha demostrado ser altamente efectivo para controlar la inflamación y reducir la dependencia de corticoides.
Síndrome de fiebre periódica, estomatitis aftosa, faringitis y adenitis cervical
El síndrome de PFAPA se presenta principalmente en niños menores de 5 años, con una edad media a los 11 meses. Su etiología y base genética siguen sin estar claras y no se ha podido determinar un gen causal en estudios de secuenciación de exoma. Sin embargo, se ha sugerido que esta patología está relacionada con la herencia poligénica o compleja de varios factores genéticos y ambientales.
Algunos estudios han reportado mutaciones en el gen MEFV en un 8% a un 66%. Estos pacientes se caracterizan por tener episodios más cortos, intervalos interepisódicos más largos y un menor requerimiento de dosis de corticosteroides para el cese de los ataques de la enfermedad. Asimismo, se ha reportado diferentes mutaciones genéticas que se encuentran cerca de los genes de IL-12A, transductor de señales y activador de la transcripción 4 (STAT4), IL 10 y receptor de quimiocinas CC 1- CC 3 (CCR1-CCR3), generando una producción elevada de IL-12, una expresión elevada de STAT4, una producción reducida de IL-10 y una expresión reducida de CCR1, respectivamente; lo que provoca una mayor activación de las células presentadoras de antígenos y de las células T CD4+.
Clínica
Entre las manifestaciones clínicas se encuentra la fiebre periódica que puede alcanzar los 41 °C, que normalmente no responde a los antipiréticos, acompañada de estomatitis

aftosa, faringitis y adenitis cervical a menudo bilateral y dolorosa. Los episodios tienen una duración aproximada de siete días y rara vez duran más de una semana; se repiten cada 2 a 8 semanas. Los episodios cesan alrededor de los 10 años. No obstante, una minoría de pacientes continúa teniendo episodios hasta la edad adulta. Los niños afectados crecen y se desarrollan normalmente y no experimentan secuelas a largo plazo.
Diagnóstico
El Ρ FAPA es un diagnóstico de exclusión que se realiza con base en la historia clínica del paciente y los hallazgos al examen físico. Durante el curso de la enfermedad, se puede presentar leucocitosis moderada (14 ± 4,5 × 10 9 células/L) y elevación de la velocidad de sedimentación globular y de la PCR. Los criterios de diagnóstico más utilizados para el síndrome PFAPA son los criterios de Marshall modificados de 1999; sin embargo, en el 2019, Eurofever/PRINTO sugirió nuevos criterios de clasificación para el síndrome PFAPA con una sensibilidad del 97% y una especificidad del 93% ( Tabla 4).
Tratamiento
El abordaje del síndrome PFAPA se enfoca principalmente en aliviar los síntomas y mejorar la calidad de vida de los niños afectados y de sus familias. Los glucocorticoides, como la prednisona, en dosis única 1-2 mg/kg por vía oral suele aliviar los síntomas rápidamente, al reducir la fiebre y mejorar los síntomas sistémicos en pocas horas. Sin embargo, no se recomienda su uso a largo plazo debido a que algunos estudios sugieren que el uso frecuente de esteroides podría acortar el intervalo entre episodios en un 19% a un 50% de los pacientes. La mayoría de los pacientes resuelven el episodio con una dosis de glucocorticoide, pero aproximadamente del 20% al 25% requiere una segunda dosis de 12 a 24 horas después.
Criterios de Marshall modificados (1999) Criterios Eurofever/PRINTO (2019)
- Fiebre recurrente a intervalos regulares (inicio <5 años de edad)
- Síntomas constitucionales con uno de los siguientes tres:
- Estomatitis aftosa.
- Adenitis cervical.
- Faringitis.
- Ausencia de neutropenia cíclica
- Intervalos asintomáticos entre episodios
- Ausencia de retraso en el desarrollo o restricción en el crecimiento
Adaptada de: Yıldız M, et al. Balkan Med J. 2020;37(5):236-246.
Al menos siete de los siguientes ocho: Presencia de
- Faringoamigdalitis.
- Episodios de 3-6 días de duración.
- Adenitis cervical.
- Periodicidad.
Ausencia de
- Diarrea.
- Dolor torácico.
- Exantema.
- Artritis.
Las terapias alternativas incluyen profilaxis con colchicina o tonsilectomía. Se ha demostrado que la colchicina (dosis objetivo de 0,5 a 1,2 mg/día en niños de cuatro a seis años y de 1 a 1,8 mg/día en niños mayores de seis años) es eficaz para reducir la frecuencia de los episodios, con un efecto más destacado en pacientes con mutación MEFV. Para algunos pacientes con PFAPA, especialmente aquellos con episodios muy frecuentes y de difícil manejo, la amigdalectomía puede ser efectiva para reducir o incluso eliminar los episodios de fiebre recurrente, con una eficacia descrita en la literatura de hasta 92%. Sin embargo, esta intervención no es necesaria en todos los casos y debe considerarse en función de la gravedad y la frecuencia de los episodios, así como del impacto en la calidad de vida.
Osteomielitis multifocal recurrente crónica
También conocida como osteomielitis no bacteriana crónica, la CRMO es un trastorno inflamatorio crónico en niños que afecta principalmente huesos, lo que genera destrucción ósea en caso de no tratarse a tiempo. Tiene una edad de aparición entre los 8 a 12 años, y el sexo femenino se ve ligeramente más
afectado comparado con el masculino. Es poco frecuente la presentación antes de los 3 años; en caso de ocurrir, es necesario descartar una enfermedad autoinflamatoria monogénica, como el síndrome de Majeed o el síndrome PAPA (artritis piógena, pioderma gangrenoso y acné) con base genética.
Se desconoce la patogenia exacta de la enfermedad; sin embargo, se reconoce una predisposición genética en un patrón poligénico, especialmente, cuando se encuentra asociado a otras enfermedades poligénicas como la enfermedad inflamatoria intestinal y la psoriasis. Los monocitos/macrófagos presentan una hiperreactividad con liberación de citocinas proinflamatorias como IL-1, IL-6, TNF-α e IL-20, con escasa producción de moléculas antiinflamatorias; en consecuencia, generan activación del inflamosoma que contiene el dominio de pirina 3 de la familia NLR (NLRP3), que a su vez aumenta IL-1β e induce osteoclastogénesis a través de la vía del ligando activador del receptor del NF- κB (RANK).
Clínica
Se caracteriza por ataques recurrentes de dolor óseo acompañados algunas veces con

inflamación. La osteomielitis puede ser recurrente (episódica) o persistente (crónica); puede afectar cualquier hueso, y afecta solo una zona (unifocal) o varios huesos (multifocal), en un promedio de tres a cuatro. Los sitios frecuentes de afectación incluyen metáfisis de huesos largos de las extremidades inferiores, seguido de pelvis, clavícula, mandíbula y cuerpos vertebrales. La afectación del cráneo es rara, por lo que se deben buscar diagnósticos diferenciales.
Puede presentarse manifestaciones extraóseas con compromiso cutáneo (psoriasis, aftosis recurrente, hidradenitis supurativa, acné grave), articular (sacroileitis, entesitis, artritis) o intestinal como (colitis). En raras ocasiones, puede presentarse compromiso renal, con proteinuria asociada o compromiso ocular con uveítis anterior.
Diagnóstico
Como ocurre con la mayoría de las enfermedades autoinflamatorias, el diagnóstico es de exclusión. Este proceso implica descartar infecciones y procesos neoplásicos mediante la evaluación de laboratorios, estudios de imágenes y, en algunos casos, biopsia ósea. En niños con sospecha de CRMO, es fundamental solicitar hemograma completo, PCR y VSG.
En la mayoría de los casos, los niños presentan un hemograma normal, con niveles de PCR y VSG normales o ligeramente elevados. En cuanto a los estudios imagenológicos, las radiografías convencionales pueden mostrar lesiones inespecíficas, como osteólisis o esclerosis, aunque en ocasiones no revelan alteraciones. Por ello, la resonancia magnética de cuerpo entero es considerada el estándar de oro para el diagnóstico por imágenes y el seguimiento de la enfermedad. Este método tiene alta sensibilidad para detectar lesiones, incluidas aquellas “silenciosas” o asintomáticas. Además, permite diferenciar el edema óseo agudo del crónico e identificar el mejor sitio

para realizar la biopsia ósea, lo que optimiza así su eficacia.
La biopsia ósea es útil para descartar diagnósticos diferenciales como osteomielitis infecciosa y procesos neoplásicos. Sin embargo, en niños con una presentación clásica caracterizada por un estado general adecuado, parámetros de laboratorio normales, lesiones múltiples y simétricas en sitios típicos como las metáfisis de los huesos largos, o la presencia de condiciones asociadas puede considerarse innecesaria antes de iniciar el tratamiento.
Existen dos propuestas principales de criterios diagnósticos para CRMO: los criterios de Jansson y los de Bristol. Estos criterios se basan en los hallazgos clínicos y paraclínicos descritos anteriormente ( Tabla 5).
Tratamiento
Debe ser multidisciplinario; el objetivo estará enfocado en aliviar el dolor y evitar la progresión de la enfermedad. Los medicamentos de primera línea serán los AINE. Hasta el 50% de los pacientes logran la remisión clínica dentro del primer año de comenzar con un AINE, pero la recaída es común y pueden desarrollarse nuevas lesiones. A pesar de ello, en ocasiones son necesarios tratamientos adicionales que incluyan FAME, inhibidores del TNF o bifosfonatos. Entre los inhibidores del TNF- α , el infliximab ha demostrado una mejoría en muchos pacientes, especialmente con curso concomitante de enfermedad inflamatoria intestinal; asimismo, el etanercept ha mostrado resultados significativos en mejoría de manifestaciones cutáneas, sumado a su buena tolerancia. Entre los bifosfonatos, el pamidronato es el de elección para población pediátrica.
Enfermedad de Behçet
La enfermedad de Behçet es una enfermedad inflamatoria caracterizada por vasculitis, que
Tabla 5. Criterios diagnósticos CRMO
Criterios de Jansson (2007)
Criterios mayores
- Lesión ósea osteolítica/esclerótica comprobada radiológicamente.
- Multifocalidad de las lesiones óseas.
- Dermatosis palmoplantar.
- Biopsia ósea estéril con signos de inflamación y/o fibrosis, esclerosis.
Criterios menores
- Recuento sanguíneo normal y buen estado general de salud.
- PCR y VSG niveles leves a moderados.
- Tiempo de observación superior a 6 meses.
- Hiperostosis.
- Asociado con otras enfermedades autoinmunes aparte de la PPP o la psoriasis.
- Antecedentes familiares de I o II grado con enfermedad autoinmune o autoinflamatoria o con osteomielitis no bacteriana.
Diagnóstico: ≥2 criterios mayores o 1 criterio mayor más 3 menores.
Requerido
Criterios de Bristol
1. Presencia de hallazgos clínicos típicos (dolor óseo +/– hinchazón localizada sin características locales o sistémicas significativas de inflamación o infección).
2. Presencia de hallazgos radiológicos típicos (preferiblemente resonancia magnética STIR que muestra edema de médula ósea +/– expansión ósea, áreas líticas y reacción perióstica o radiografía simple que muestre una combinación de áreas líticas, esclerosis y formación de hueso nuevo).
Más uno de los siguientes
a. Más de un hueso (o solo clavícula) afectado sin PCR significativamente elevada (PCR <30 g/L).
b. Enfermedad unifocal distinta a la de la clavícula, o PCR >30 g/L, con biopsia ósea que muestra cambios inflamatorios (células plasmáticas, osteoclastos, fibrosis o esclerosis) sin crecimiento bacteriano mientras no se recibe terapia con antibióticos.
Diagnóstico: tanto 1 como 2, más A o B.
STIR: recuperación de inversión con tiempo de inversión corto. Adaptada de: Sergi CM, et al. Front Immunol. 2022;13:959575.
afecta tanto a vasos pequeños como grandes, con mayor compromiso de las venas, clasificándose como una vasculitis de vaso variable. Se ha demostrado una predisposición genética de tipo poligénica. Alrededor del 50% al 70% de los pacientes con Behçet resultaron positivos para el alelo de histocompatibilidad HLA-B51. Sin embargo, actualmente se ha identificado una asociación entre la enfermedad y varios genes no HLA, entre ellos, genes involucrados en la respuesta inmune innata, como en la producción, función y señalización de citocinas, como es el caso de los genes IL-10, IL-23R y STAT. De esta manera, se considera que la enfermedad tiene tanto una faceta autoinflamatoria como autoinmune.
El mecanismo patogénico de la enfermedad no está claro y se propone una susceptibilidad genética asociada a factores ambientales que, a través de un desencadenante externo (virus, bacterias, polución), lleva a la activación descontrolada
del sistema inmune, a través de un mecanismo de mimetismo molecular que desencadenan producción de proteínas de choque térmico con la posterior activación del sistema inmune innato. Esta respuesta inflamatoria lleva a un aumento en los niveles circulantes de citocinas como IL-1β, IL-6, IL-8 y TNF- α . Los neutrófilos activados son capaces de mejorar la quimiotaxis y su respuesta efectora, aumento de la fagocitosis y secreción de citocinas capaces de inducir una respuesta inmune mediada por Th1. Asimismo, hay un incremento en la producción de especies reactivas de oxígeno, capaces de generar disfunción endotelial y, a través de la modificación de la estructura del fibrinógeno, al desarrollo de trombosis.
Clínica
La enfermedad se caracteriza por presentar úlceras orales recurrentes, úlceras genitales e inflamación ocular; también se ha reportado

en la literatura casos de compromiso neurológico, gastrointestinal y articular. Los síntomas mucocutáneos no son específicos, sin embargo, el carácter recurrente de una lesión tiene significancia clínica. Se presenta en una edad media de 8 a 9 años. Las úlceras orales más frecuentes se caracterizan por ser de menos de un centímetro de diámetro, localizadas en el revestimiento mucoso de mejillas labios lenguas y encías y desaparecen sin dejar cicatriz, sin embargo, también se pueden presentar úlceras orales mayores o herpetiformes. Las úlceras genitales son muy específicas para el diagnóstico, a pesar de que son menos comunes que en los adultos. En la infancia, las niñas tienen una tasa más alta de aftas genitales que los niños, estas se pueden localizar en región escrotal como en los labios mayores, en niños como en niñas, respectivamente. Se han descrito lesiones en región perineal en el 7% de los pacientes y deben diferenciarse de la aftosis anal que se puede encontrar en la enfermedad inflamatoria intestinal (EII).
Las manifestaciones cutáneas son frecuentes, entre ellas se encuentran eritema nodoso, frecuente en mujeres y lesiones papulopustulosas, foliculitis necrótica con mayor frecuencia en varones. Es importante mencionar que las lesiones tipo acné no solo se limitan a áreas típicas como cara y parte superior del tronco, sino que también se pueden encontrar en las extremidades inferiores.
Dentro de la presentación musculoesquelética, se ubica la artritis que puede ser monoarticular como oligoarticular no deformante. La afectación poliarticular de pequeñas articulaciones puede ser predominante en aproximadamente el 5%.
Otras presentaciones clínicas con las que puede cursar el paciente son el compromiso ocular, que es una de las manifestaciones más problemáticas, con peor pronóstico debido a que ambos ojos se pueden afectar en corto tiempo. Alrededor del 70% de los niños pueden presentar uveítis y su afectación puede

conducir a una pérdida grave de la visión en el 25% de los casos. El compromiso neurológico se caracteriza por hemiplejía, parálisis de nervios craneales, meningoencefalitis y trastornos neuropsiquiátricos. Finalmente, la afectación vascular con trombosis es secundaria al proceso inflamatorio.
Diagnóstico
El diagnóstico se basa en la recopilación de signos y síntomas clínicos que hagan sospechar de la entidad. En 2014, el Equipo Internacional para la Revisión de los Criterios Internacionales para la Enfermedad de Behçet (ITR-ICBD) propuso nuevos criterios basados en un sistema de puntuación, con el fin de aumentar la sensibilidad de criterios previos ( Tabla 6), donde las aftas orales recurrentes no son obligatorias y no se incluye la prueba de patergia.
Las imágenes y ayudas diagnósticas pueden ayudar a identificar el grado de afectación de órganos en el síndrome de Behçet, entre las que se encuentra la ecografía Doppler en la que se puede realizar diagnóstico de trombosis venosa y aneurismas arteriales en las extremidades; angiografía y tomografía de abdomen y tórax para diagnóstico de afectación de vasos proximales más grandes; y ecocardiografía para trombosis intracardiaca.
Tratamiento
El manejo farmacológico dependerá de los mecanismos patogénicos subyacentes y las manifestaciones individuales de la enfermedad. Los corticosteroides constituyen una alternativa efectiva tanto en la fase aguda como en las recaídas de la enfermedad, lo que ha demostrado ser útil en el abordaje de las manifestaciones mucocutáneas y de la monoartritis, a través de la artrocentesis infiltrativa. Por otro lado, los corticosteroides sistémicos, frecuentemente en combinación con otros agentes inmunosupresores (azatioprina), se recomiendan para pacientes que presentan uveítis posterior,
Tabla 6. Criterios diagnósticos de enfermedad de Behçet pediátrica
Manifestación clínica
Aftas orales recurrentes Al menos tres episodios durante 1 año 1
Ulceración genital Generalmente con cicatriz 1
Compromiso cutáneo Foliculitis necrótica, lesiones acneiformes, eritema nodoso 1
Compromiso ocular uveítis anterior, uveítis posterior, vasculitis retiniana 1
Signos neurológicos Con excepción de dolores de cabeza aislados 1
Signos vasculares Trombosis venosa, trombosis arterial, aneurisma arterial 1
Se requieren tres de seis elementos para clasificar a un paciente como portador de la enfermedad de Behçet pediátrica.
Adaptada de: Costagliola G, et al. Ther Clin Risk Manag. 2020;16:495-507.
trombosis venosa profunda aguda, trombosis venosa cerebral, compromiso arterial y compromiso gastrointestinal grave.
Se recomienda como tratamiento de primera línea para pacientes con artritis el uso de colchicina. Este fármaco ha demostrado eficacia como terapia preventiva para limitar la recurrencia de las manifestaciones mucocutáneas y reducir la frecuencia de exacerbaciones de las úlceras genitales.
De igual modo, los biológicos han mostrado eficacia en casos específicos, el uso de antiTNF- α , como infliximab y adalimumab, útiles
1. An J, Marwaha A, Laxer RM. Autoinflammatory Diseases: A Review. J Rheumatol. 2024;51(9):848-861.
2. Bittermann V, Antón López J. Fiebre mediterránea familiar. Protoc Diagn Ter Pediatr. 2020;2:379–389.
3. Borges T, Barbosa A, Silva S. Adult-onset systemic autoinflammatory disorders: a clinical approach. Reumatismo. 2020;71(4):177-188.
en el tratamiento de la uveítis y la enfermedad gastrointestinal grave; mientras que estudios aleatorizados respaldan el uso de etanercept para manejar las manifestaciones mucocutáneas.
Las enfermedades autoinflamatorias pueden ser un desafío clínico dada su baja prevalencia como su heterogeneidad tanto en la presentación como su etiología, que no debemos pasar por alto y se debe sospechar ante hallazgos clínicos de fiebre recurrente en la infancia y manifestaciones inflamatorias específicas.
4. Costagliola G, Cappelli S, Consolini R. Behçet’s Disease in Children: Diagnostic and Management Challenges. Ther Clin Risk Manag. 2020;16:495-507.
5. Krainer J, Siebenhandl S, Weinhäusel A. Systemic autoinflammatory diseases. J Autoimmun. 2020;109:102421.
6. Llobet Agulló MP, Moure González JD. Diagnóstico y manejo de las enfermedades autoinflamatorias en pediatría. Protoc Diagn Ter Pediatr. 2019;2:453–469.

7. Nigrovic PA, Lee PY, Hoffman HM. Monogenic autoinflammatory disorders: Conceptual overview, phenotype, and clinical approach. J Allergy Clin Immunol. 2020;146(5):925-937.
8. Sergi CM, Miller E, Demellawy DE, Shen F, Zhang M. Chronic recurrent multifocal osteomyelitis. A narrative and pictorial review. Front Immunol. 2022;13:959575.
9. Verbsky JW. Síndromes hereditarios con fiebre periódica y otras enfermedades autoinflamatorias sistémicas. En: Kliegman RM, editor. Tratado de pediatría. 21.ª edición. Elsevier; 2020. p. 1292-1304.
10. Yıldız M, Haşlak F, Adrovic A, Barut K, Kasapçopur Ö. Autoinflammatory Diseases in Childhood. Balkan Med J. 2020;37(5):236-246.


Diego Gerardo Prado-Molina1
Alejandro Restrepo C.2
Manuela Olaya Hernández3
Los errores innatos de la inmunidad (EII), previamente conocidos como inmunodeficiencias primarias, corresponden a trastornos congénitos asociados a variantes o mutaciones genéticas que codifican para diferentes componentes del sistema inmune que dan como resultado una mayor susceptibilidad a infecciones, autoinmunidad, enfermedades autoinflamatorias, alergias y neoplasias.
En la década de 1950, se identificaron los primeros EII. Kostmann describió los primeros pacientes con neutropenia congénita grave, pero fue Bruton en 1952 quien describió la primera inmunodeficiencia primaria con su alteración genética, una variante en la tirosina quinasa de Bruton (BTK), ubicada en el brazo largo del cromosoma X que produce niveles bajos de inmunoglobulinas, que recibe el nombre de agammaglobulinemia ligada al X.
Aproximadamente 550 entidades clínicas se clasifican como EII y este número va en aumento. La incidencia y prevalencia pueden variar significativamente entre regiones y defectos genéticos. Se estima que a nivel mundial se presentan entre 1:1000 a 1:5000 nacidos vivos. En el Medio Oriente y África del Norte se estima una tasa de incidencia entre 0,02 a 7,58 por 100.000 habitantes; mientras que en Europa oscila entre 1:16.000 a 1:50.000; y en Estados Unidos oscila entre 1-6:10.000 habitantes, y las más comunes son las deficiencias predominantes de anticuerpos.
En Latinoamérica, en el año 2009, se consolidó la Sociedad Latinoamericana de Inmunodeficiencias (LASID), a la cual pertenecen 18 países, y recopilan hasta la fecha actual un total de 9789 casos, con Argentina, México, Brasil y Colombia como los países con mayor número de casos registrados, como se describe en la Figura 1. No obstante, se considera que existe un
1. Residente de Pediatría. Facultad de Ciencias de la Salud, Universidad Icesi; Cali, Colombia.
2. Residente de Pediatría. Facultad de Ciencias de la Salud, Universidad Icesi; Cali, Colombia.
3. Departamento de Pediatría, Servicio de Alergología e Inmunología Pediátrica, Fundación Valle de Lili, Cali, Colombia.

importante subregistro, que podría ser explicado por la gran diversidad de patologías que están incluidas dentro de los EII y su retraso en el diagnóstico.
Figura 1. Total de pacientes con EII registrados por país a septiembre del 2024. Adaptada de: Registro LASID [Internet]. LASID. [citado el 7 de noviembre de 2024]. Disponible en: https://lasidregistry.org/view/ statistics/general/2024-10 Argentina México Brasil Colombia
En 1970, se conformó el Comité de EII de la Unión Internacional de Sociedades Inmunológicas (IEI-IUIS), integrado por expertos en el área encargados de clasificar y mantener una nomenclatura actualizada, que ayudando con la identificación, diagnóstico y tratamiento; además de brindar asesoramiento a entidades gubernamentales incluyendo la Organización Mundial de la Salud (OMS), entre otras funciones alrededor de la promoción de los EII. En 2024, se realizó la última actualización de los EII que los clasificó en 10 categorías basándose en el tipo de defecto inmunológico y el mecanismo patogénico; cada una de ellas con características propias respecto a los tipos de infección, autoinmunidad o inflamaciones asociadas.

Sistema inmune innato
La inmunidad innata constituye la primera línea de defensa del organismo frente a patógenos, y opera de manera rápida y no específica. Tiene la capacidad de reconocer patrones moleculares comunes a muchos microorganismos invasores, denominados patrones moleculares asociados a patógenos (PAMP), mediante receptores específicos en las células inmunitarias, como los receptores de reconocimiento de patrones (PRR). Este sistema está compuesto por barreras físicas y químicas (como la piel, las mucosas, pH y las secreciones antimicrobianas), células especializadas como los macrófagos, neutrófilos, células dendríticas y células natural killer (NK), así como proteínas plasmáticas como el sistema de complemento y los interferones.
Los macrófagos y neutrófilos fagocitan y destruyen microorganismos, mientras que las células dendríticas ayudan en la activación de la inmunidad adaptativa al presentar antígenos a las células T. A su vez, el sistema del complemento contribuye a la destrucción directa de patógenos por lisis y facilita la opsonización al marcar los patógenos para su posterior eliminación.
Sistema inmune adaptativo
La inmunidad adaptativa tiene la capacidad de reconocer características específicas de los agentes patógenos, lo que permite una respuesta más eficiente en encuentros posteriores. Está compuesta por dos tipos de células: los linfocitos B y los linfocitos T. Estos últimos se dividen en T helper (Th), que coordinan la respuesta inmune mediante la liberación de citocinas, y T citotóxicas (Tc),
El sistema inmunológico está constituido por una red de células, tejidos y órganos que funcionan en conjunto para defender al cuerpo de patógenos como bacterias, virus, hongos y parásitos. Sus principales componentes son los órganos linfoides primarios (médula ósea y timo), órganos linfoides secundarios (ganglios linfáticos, bazo, y tejido linfoide asociado a mucosas [MALT]), células inmunitarias (células T, células B, macrófagos, neutrófilos, células dendríticas) y moléculas como anticuerpos y citocinas. A su vez, la respuesta inmune se divide en respuesta inmune innata y adaptativa.
que eliminan células infectadas o tumorales mediante mecanismos de citotoxicidad. Por otro lado, están los linfocitos B, responsables de la producción de anticuerpos que se unen a antígenos específicos en los patógenos, para marcarlos para su destrucción, representando la memoria inmunológica.
Al entrar en contacto con un patógeno, los linfocitos B y T se activan generando clones de células específicas para ese agente infeccioso. Los linfocitos B secretan anticuerpos que pueden neutralizar el patógeno o activar el sistema de complemento para su eliminación. Mientras tanto, los linfocitos T citotóxicos destruyen directamente las células infectadas. La memoria inmunológica, generada principalmente por linfocitos B y T de memoria, garantiza una respuesta más rápida y potente ante futuras exposiciones al mismo patógeno. Este sistema no solo es clave en la defensa frente a infecciones, sino que también juega un rol en la protección contra células tumorales y en la respuesta a la vacunación, donde se generan respuestas inmunes específicas sin causar enfermedad.
El comité IEI-IUIS actualizó y clasificó en 2024 los EII en 10 categorías, basándose en el tipo de defecto inmunológico y el mecanismo patogénico, de la siguiente forma:
1. Inmunodeficiencias que afectan la inmunidad celular y humoral.
2. Inmunodeficiencias combinadas asociadas con hallazgos sindromáticos.
3. Deficiencias predominantemente de anticuerpos.
4. Enfermedades de disregulación inmune.
5. Defectos en fagocitos en número función o en ambos.
6. Defectos en la inmunidad intrínseca e innata.
7. Desórdenes autoinflamatorios.
8. Deficiencias del complemento.
9. 9Falla en la médula ósea.
10. Fenocopias de inmunodeficiencias primarias.
Las más comunes son las deficiencias predominantemente de anticuerpos, dentro de las que se encuentra con mayor frecuencia la deficiencia selectiva de inmunoglobulina A; en segundo lugar, se ubica la inmunodeficiencia común variable.
Inmunodeficiencias que afectan la inmunidad celular y humoral
Este grupo incluye dos subcategorías: inmunodeficiencias combinadas graves (SCID) e inmunodeficiencias combinadas no tan graves (CID). En ambas existe una disfunción combinada de los linfocitos T o linfocitos B, que predispone a infecciones recurrentes y graves, bacterianas, virales, fúngicas y protozoarias. Generalmente, se manifiestan a través de infecciones recurrentes, ya sea del tracto respiratorio, gastrointestinal u otras localizaciones. También presentan una mayor susceptibilidad a infecciones por microorganismos oportunistas. Ambos subgrupos se diferencian principalmente por el grado de afectación del sistema inmune. En las SCID existe un compromiso grave con ausencia o reducción grave de los linfocitos T (CD3+) inferior a 300/uL; y se relaciona con una muerte más temprana debido a infecciones por microorganismos oportunistas durante los primeros dos años de vida. Por otro lado, las CID son menos graves, con un grado de deficiencia de células T que suele ser menos profundo con una mejor supervivencia.
Inmunodeficiencias combinadas asociadas con hallazgos sindromáticos
Estas inmunodeficiencias combinadas no se limitan solo a la disfunción del sistema inmunológico. Se presentan también con características adicionales como problemas en el desarrollo, malformaciones congénitas, alteraciones en el crecimiento o defectos metabólicos. Se clasifican nueve subgrupos: trombocitopenia

congénita, defectos de reparación del ADN, defectos tímicos con anomalías congénitas adicionales, displasias inmunoóseas, síndromes de hiper-IgE, defectos en el metabolismo de la vitamina B12 y del folato, displasia ectodérmica anhidrótica con inmunodeficiencia, CID debido a defectos en los canales de calcio, y otros. Es importante recalcar el síndrome de DiGeorge como una patología común en este grupo que siempre se debe descartar.
Deficiencias predominantemente de anticuerpos
Son las más frecuentes entre los EII con un espectro clínico grande que puede variar desde una reducción grave de las inmunoglobulinas séricas y de linfocitos B como en la agammaglobulinemia de Bruton, incluso puede ser más leve y afectar de manera selectiva cierto tipo de anticuerpos, como en la deficiencia selectiva de inmunoglobulina A (IgA). Este grupo de inmunodeficiencias se divide en diferentes subtipos: déficit selectivo de IgA, inmunodeficiencia común variable, agammaglobulinemia ligada al cromosoma X (enfermedad de Bruton), agammaglobulinemia autosómica recesiva, deficiencia de subclases de IgG, deficiencia de anticuerpos específicos con niveles normales de inmunoglobulinas, hipogammaglobulinemia transitoria de la infancia; con los tres primeros como los más frecuentes.
Si bien tienen ciertas características distintivas entre cada subtipo, entre todas comparten un fenotipo clínico con rasgos similares, y pueden presentar infecciones bacterianas recurrentes de las vías respiratorias superiores e inferiores, como infecciones de oído, senos paranasales y neumonía recurrente, generalmente asociadas a bacterias encapsuladas como Streptococcus pneumoniae, Neisseria meningitidis o Haemophilus influenzae. También son comunes las infecciones gastrointestinales recurrentes por Giardia o Salmonella; infecciones en piel como impétigo o celulitis; así como también sepsis, meningitis y osteomielitis. Hay que tener en cuenta el retraso

en el crecimiento y neurodesarrollo, historia familiar de inmunodeficiencias o enfermedades autoinmunes, y respuesta inadecuada a vacunas.
En ocasiones, las primeras manifestaciones no son necesariamente las infecciones: la dermatitis recurrente o un asma de difícil control, que no responde a los manejos convencionales, puede ser la primera manifestación; en estos casos, ocurre un retraso diagnóstico importante de los EII.
El déficit selectivo por IgA es el EII con mayor prevalencia, se caracteriza por una reducción del nivel sérico de IgA por debajo de 7 mg/dL con concentraciones normales de las otras inmunoglobulinas con recuento de anticuerpos normales. Pueden presentar infecciones recurrentes respiratorias y gastrointestinales, alergias y alteraciones autoinmunes; sin embargo, la gran mayoría de los pacientes suelen ser asintomáticos y su diagnóstico puede ser casual.
La inmunodeficiencia común variable es la inmunodeficiencia primaria grave de mayor frecuencia en diagnóstico. Es de origen poligénico, se caracteriza por presentar reducción sérica de IgG, IgA o IgM, con alteración en la diferenciación de los linfocitos B y en la producción de anticuerpos. Se suele presentar con mayor frecuencia en adolescentes y adultos jóvenes, pero también puede diagnosticarse en la edad pediátrica, cuando el paciente tiene más de 4 años, por lo que existen unos criterios clínicos de la Sociedad Europea de Inmunodeficiencias (ESID) que intentan reunir variables para poder definir esta entidad.
En la agammaglobulinemia ligada al X, de orden monogénico, hay un defecto en la tirosina quinasa de Bruton, que se asocia a una reducción sérica de los linfocitos B por debajo del 2%.
Comúnmente, presentan infecciones respiratorias por microorganismos encapsulados y gastrointestinales como Giardia lamblia, así como también hay riesgo de presentar infecciones virales por enterovirus. Se asocia también a
neutropenias y se presenta en pacientes masculinos en el primer año de vida, usualmente con cursos graves.
Defectos congénitos del número o la función de los fagocitos, o de ambos
En este grupo se ven afectadas las células fagocíticas, las cuales actúan como primera línea de defensa para proteger al organismo de bacterias y hongos. Se dividen en cuatro subgrupos:
• Neutropenia congénita. Presentan neutropenia congénita grave e infecciones, por ejemplo, neutropenia cíclica o congénita grave.
• Defectos de la motilidad. Presentan neutrofilia grave e infecciones, pero también presentan características sindrómicas de la enfermedad, como dismorfias, retraso del desarrollo y otras características clínicas no inmunitarias.
• Defectos del estallido respiratorio. Sufren infecciones recurrentes debido a una reducción del estallido oxidativo de los neutrófilos,
Defecto inmunitario
Inmunodeficiencias combinadas (linfocitos T y B)
por ejemplo, enfermedad granulomatosa crónica.
Otros defectos no linfoides. Tienen una función fagocítica defectuosa, pero la prueba de estallido oxidativo de neutrófilos (ensayo DHR) es normal, por ejemplo, proteinosis alveolar pulmonar.
Enfermedades de disregulación inmune
Se caracterizan por presentar una respuesta inmunitaria anormal que puede llevar a autoinmunidad, inflamación y susceptibilidad a infecciones. Se dividen en siete subgrupos: síndromes de linfohistiocitosis hemofagocítica familiar (FHL), síndrome de FHL con hipopigmentación, defectos de las células T reguladoras, autoinmunidad con o sin linfoproliferación, desregulación inmunitaria con colitis y síndrome linfoproliferativo autoinmune. Cada uno de estos cuenta con características clínicas particulares, pero pueden sospecharse si hay presencia de fiebre persistente, hepatoesplenomegalia, citopenias, exantema, retraso en el crecimiento, historia familiar de trastornos inmunológicos.
Subtipos Tipo de patógeno
SCID (ligada al X, autosómica recesiva
Deficiencia de JAK3
Deficiencia de adenosina deaminasa
Deficiencia de ZAP 70)
Deficiencia de RAG1/2
Disgénesis reticular
- Micobacterias
- Pneumocystis jirovecii
- Citomegalovirus refractario al tratamiento
- Epstein-Barr Virus (EBV)
- Enterovirus
- Candidiasis mucocutánea extensiva y sistémica
- Varicela complicada
Historia y manifestaciones clínicas
- Trombocitopenia
- Hipocalcemia del recién nacido
- Enfermedad injerto contra huésped
- Eccema moderado a grave desde el nacimiento
- Infecciones graves y oportunistas
- Pobre ganancia de peso y talla
- Diarrea crónica intratable
Otros hallazgos
Comienzo desde pocos meses después del nacimiento (2 a 6 meses).

Tabla 1. Características de las inmunodeficiencias más frecuentes dentro de la clasificación IUIS (continuación)
Defecto inmunitario
Asociadas a síndromes bien definidos
Inmunodeficiencia humoral
Subtipos Tipo de patógeno
Síndrome Wiskott-Aldrich
Ataxiatelangiectasia
Síndrome de Bloom
Síndrome de DiGeorge
Síndrome de CHARGE
Hipoplasia cartílago pelo
Displasia de Schimke
Síndrome hiper IgE
Defectos de vitamina B12 y folatos
Agammaglobulinemia congénita
Hipogammaglobulinemia transitoria de la infancia
Déficit de subclases de IgG
Déficit selectivo de anticuerpos polisacáridos
Síndrome de hiper IgM.
Déficit de la cadena alfa.

- Staphylococcus aureus
- Aspergillus
- Pneumocystis jirovecii
Historia y manifestaciones clínicas
Trombocitopenia con plaquetas pequeñas, disentería, eczema, infecciones bacterianas y virales recurrentes, linfoma, enfermedad autoinmune, y nefropatía por IgA
Otros hallazgos
Según cada síndrome
Ataxia, telangiectasias, hipoparatiroidismo, discapacidad intelectual, malformación cardíaca conotruncal, insuficiencia velopalatina, facies anormal
Inmunodeficiencia común variable
Déficit selectivo de IgA
- Streptococcus spp.
- Staphylococcus spp.
- Haemophilus spp.
- Campylobacter spp.
- Giardia Lamblia
- Cryptosporidium
- Infecciones respiratorias recurrentes
- Infecciones del tracto gastrointestinal recurrentes
- Artritis séptica
- Meningoencefalitis
Relación con neoplasias y enfermedades autoinmunes.
Inicio después de los 6 meses
Pico en la edad preescolar, adolescencia y adultez temprana
Diego Gerardo Prado-Molina; Alejandro Restrepo C.; Manuela Olaya Hernández
Tabla 1. Características de las inmunodeficiencias más frecuentes dentro de la clasificación IUIS (continuación)
Defecto inmunitario
Defecto de fagocitos
Defectos en la disregulación
Subtipos Tipo de patógeno
Neutropenias congénitas (cíclica frente a grave)
Defectos en la motilidad de los leucocitos
Síndrome SchachmanDiamond
Enfermedad granulomatosa crónica
- Staphylococcus spp.
- Pseudomonas spp.
- Serratia
- Klebsiella spp.
- Cándida spp.
- Nocardia spp.
- Aspergillus spp.
Historia y manifestaciones clínicas
Dermatitis crónica grave
Impétigo de difícil manejo
Celulitis
Adenitis supurativa
Abscesos
Osteomielitis
Retardo en la caída del cordón umbilical
Dificultad en la cicatrización
Neumonías de difícil manejo infecciones micóticas
Otros hallazgos
Inicio precoz dependiendo del defecto (meses - años)
Elaboración propia.
Linfohistiocitosis hemofagocítica familiar (FHL)
Linfohistiocitosis hemofagocítica con hipopigmentación (HLH)
IPEX (poliendocrinopatía con inmunodeficiencia y enteropatía)
Síndromes linfoproliferativos autoinmunes (ALPS)
Autoinmunidad con o sin linfoproliferación
Asociado a colitis
Streptococcus pneumoniae
Staphylococcus aureus
Mycobacterium tuberculosis
Salmonella spp.
Neisseria meningitidis
Epstein-Barr Virus (EBV)
Cytomegalovirus (CMV)
Herpes Simplex Virus (HSV)
Varicela-Zóster Virus (VZV)
Influenza (virus de la gripe)
Fiebre prolongada
Hepatoesplenomegalia
Citopenias
Exantema cutáneo
Hipertrigliceridemia
Infecciones recurrentes
desde recién nacido hasta años

Defectos en la inmunidad intrínseca e innata
Los defectos en estas vías de la inmunidad afectan la capacidad de reconocer y responder a patógenos de manera efectiva, lo que ocasiona una susceptibilidad mayor a infecciones bacterianas y fúngicas, pero en especial a infecciones virales. Estas se clasifican en nueve grupos que se muestran en la Tabla 2
Desórdenes autoinflamatorios
En este grupo de trastornos existe una alteración y sobreactivación de las vías inflamatorias
innatas, con una liberación excesiva de citocinas proinflamatorias, que causa fiebre recurrente y daño en los tejidos sin que se pueda evidenciar otra causa. Se clasifican en tres grupos:
1. Interferonopatías tipo 1 con un patrón inflamatorio asociado a un aumento en la producción de interferón, que suelen caracterizarse por tener compromiso neurológico, dentro de los que se encuentran el síndrome de Aicardi-Goutières, deficiencia en ADN polimerasa alfa 1, la proteinosis alveolar y deficiencia de adenosina deaminasa 2.
2. Los defectos del inflamasoma están asociados a una sobreexpresión de citocinas
Susceptibilidad mendeliana a infecciones micobacterianas
Epidermodisplasia verruciforme
Predisposición a infecciones virales graves
Encefalitis por herpes simple
Predisposición a enfermedades fúngicas invasoras.
Predisposición a candidiasis mucocutánea
Predisposición a infecciones bacterianas invasivas con deficiencia en la vía de señalización TLR
Otros errores innatos de la inmunidad con tejidos no hematopoyéticos.
Pueden ser graves como es el caso de la enfermedad diseminada por Bacilo Calmette-Guérin y micobacterias no tuberculosas; pero también puede ser moderada, como en el caso de la deficiencia del receptor de IL-12 y IL-23 y deficiencia de tirosina quinasa.
Mutaciones en genes implicados en la inmunidad de los queratinocitos, lo que provoca susceptibilidad a infecciones por betapapilomavirus humano como el VPH, que desencadena la aparición de verrugas planas, máculas escamosas hipo o hiperpigmentadas que inician en la infancia.
Se deben a la disminución en producción de interferones tipo 1. Se caracteriza por infecciones virales graves como influenza, varicela, herpes, citomegalovirus, entre otros.
Existe una marcada disminución por parte de los fibroblastos para producir interferón alfa y beta en respuesta a la infección por el virus herpes simple tipo 1.
Principalmente hay una predisposición a presentar infección particularmente en el sistema nervioso central.
Existe un defecto en la inmunidad de las mucosas, como en ganancia de función de STAT1, deficiencia de IL-17F, y deficiencia de IL-17RA.
Existe una predisposición a sufrir infecciones bacterianas invasivas como artritis, sepsis, meningitis, osteomielitis, o abscesos. Los patógenos más comunes son S. pneumoniae, S. aureus y Pseudomonas aeruginosa
Asplenia congénita aislada, encefalopatía necrotizante aguda, osteoporosis e hidradenitis supurativa. Puede haber susceptibilidad a infección parasitaria como tripanosomiasis.

Otros errores innatos relacionados con los leucocitos.
Elaboración propia.
Hepatitis viral fulminante, enfermedad de Whipple.
proinflamatorias como TNF, IL-8, IL-1β.
Estos se caracterizan por presentar fiebre, artralgias, artritis, erupción cutánea, dolor abdominal; por ejemplo, fiebre mediterránea familiar.
3. Las alteraciones no asociadas al inflamasoma en las que no hay una alteración directa del inflamasoma; su patrón inflamatorio se debe a diversos impactos en la biología celular, por ende, su clínica es variada. Las lesiones en la piel como las psoriasis son más comunes en este grupo. Dentro de estos se encuentran el PAPA (artritis piógena, pioderma gangrenoso, y acné), síndrome de Blau, cierto tipo de psoriasis, enfermedad inflamatoria intestinal, pustulosis palmoplantar, síndrome H.
Deficiencias del complemento
El sistema del complemento es crucial para el control de enfermedades mediadas por patógenos bacterianos, principalmente los extracelulares encapsulados, dado que los controla a través de diversos mecanismos como la opsonización y el complejo de ataque a la membrana. El lupus eritematoso sistémico y las microangiopatías trombóticas presentan consumo de estas proteínas. Clínicamente, los pacientes presentan susceptibilidad a bacterias encapsuladas (deficiencia en proteínas C1q, C1r, C1s, C2, C4, C3); existe también la susceptibilidad aumentada a infección meníngea por Neisseria (deficiencias en las proteínas C5, C6, C7, C8, C9), el fenotipo de síndrome hemolítico urémico atípico; y susceptibilidad a infecciones por Neisseria (eficiencia en factor H y factor I), el angioedema hereditario y el lupus like.
Falla en la médula ósea
En este grupo de patologías se presenta una disminución de uno o más componentes hematopoyéticos, generalmente de manera progresiva y larvada. Se pueden manifestar de diversas formas; por lo general, suele haber anemia macrocítica. Dentro de estos trastornos se encuentran la anemia de Fanconi, disqueratosis
congénita, síndromes de insuficiencia de la médula ósea, entre otros.
La anemia de Fanconi se caracteriza por una insuficiencia medular, ocurre cerca de los 7 años, se asocia además a anomalías óseas congénitas y predisposición a leucemia mieloide aguda y tumores sólidos. La disqueratosis congénita presenta una alteración en el mantenimiento de los telómeros, no solamente puede ocasionar una insuficiencia medular, sino también distrofia ungueal, alopecia, alteraciones de la pigmentación en piel, fibrosis pulmonar y enteropatía. Los síndromes de insuficiencia de la médula ósea se pueden expresar con falla medular y sordera congénita, o pueden presentarse también con hipoplasia eritroide, deficiencia de linfocitos B, microcefalia, retraso en el desarrollo y convulsiones.
Fenocopias de inmunodeficiencias primarias
En estos trastornos, las variantes pueden presentarse en la línea somática o también pueden asociarse a autoanticuerpos frente a citocinas u otros componentes de las vías inmunitarias. Se presentan con mayor frecuencia en adultos y se pueden dividir en síndrome linfoproliferativo autoinmune, criopirinopatía (inmunodeficiencia de la edad adulta con susceptibilidad a micobacterias), síndrome hipereosinofílico, síndrome VEXAS (vacuolas, enzima E1, XL, autoinflamatorio, somático) y mutación en receptor tipo toll 8.
El diagnóstico de los EII representa un reto, dada su amplia gama de etiologías, que hacen que el panorama clínico sea extremadamente variado. Cada uno de ellos cuenta con diferentes signos y síntomas incluyendo síndromes asociados. Con el objetivo de aumentar la probabilidad diagnóstica, se han realizado estudios para determinar la frecuencia de diferentes signos y

síntomas que pueden estar presentes en mayor o menor proporción en las EII.
De estos estudios de frecuencia clínica, sumado a la acción combinada de múltiples fundaciones y grupos de estudios, nacen los signos de alarma de inmunodeficiencias primarias, signos de alarma de la Fundación Jeffrey Modell, que han cambiado conforme hay nuevas entidades clínicas. Se debe recordar que inicialmente solo se consideraban las patologías de susceptibilidad a infecciones, pero al ampliar el espectro a la autoinmunidad, las neoplasias y atopia grave aparecen nuevos signos de alarma que se resumen en la Tabla 3.
La sospecha de un paciente con un error innato de la inmunidad se puede presentar en varios escenarios: desde pacientes críticos hasta pacientes con una larga historia de infecciones y otros trastornos del sistema inmune que llegan a la consulta externa. Existen una serie
de estudios que debemos ir realizando para lograr orientar el diagnóstico en estos pacientes. Tradicionalmente, se ha hablado de líneas diagnósticas, para así optimizar los recursos.
La primera línea se ha considerado el hemograma completo, cultivos, estudios imagenológicos y estudios dirigidos específicamente a los errores innatos de la inmunidad, entre estos están los niveles de inmunoglobulinas.
Cuando encontramos niveles alterados de inmunoglobulinas, usualmente dos desviaciones estándar por debajo de lo normal para la edad, se orienta a las inmunodeficiencias por deficiencias predominantes de anticuerpos, pero también a las entidades combinadas de inmunidad celular y humoral y tendrán relevancia
o candidiasis cutánea después del año de vida

Adaptada de: Peinador M, et al. Niño con infecciones recurrentes [Internet]. Asociación Española de Pediatría de Atención Primaria. 2016 [citado el 15 de octubre de 2025]. Disponible en: https://aepap.org/wp-content/ uploads/2024/02/Nino-con-infecciones-recurrentes.-GPI-2017.pdf
según la edad del paciente. Se debe realizar una valoración completa del paciente en diferentes momentos en el tiempo para una aproximación diagnóstica más certera
En el escenario de niveles normales de inmunoglobulinas ( Tabla 4), pero que la sospecha clínica se sostiene, consideramos una segunda línea de estudios para tener en cuenta, dentro de los que se incluyen las subclases de IgG, la respuesta vacunal proteica y polisacárida, las subpoblaciones de linfocitos (niveles en la Tabla 5) y los estudios del complemento, cuando el diagnóstico nos orienta más a una entidad autoinmune.
Existen estudios con alta sensibilidad y especificidad para unas entidades únicas, como el estudio de estallido respiratorio de los neutrófilos, también llamado estudio de dihidrorodamina, donde se evalúa la función destructora de los neutrófilos después de fagocitar microorganismos; que se ve alterada en la enfermedad granulomatosa
El abordaje terapéutico de estas patologías debe ser transversal y multidisciplinario, comenzando por un buen soporte nutricional con adecuado seguimiento en crecimiento y desarrollo, ya que muchas de estas patologías, principalmente aquellas que conllevan a infecciones graves o a manifestaciones autoinmunes, pueden generar desórdenes malabsortivos como diarrea crónica y fácilmente llegar a la desnutrición.
Un pilar importante en el tratamiento de estas patologías es el uso de profilaxis antibiótica como se muestra en la Tabla 6 . Esta depende de la patología, las infecciones a las que está asociada y la epidemiología local debido a que no hay consensos por la gran variabilidad de entidades clínicas a tratar.
99 (43-196) 68 (25-154) 2-307
6 - 8 años 915 (633-1280) 107 (48-207) 90 (33-202) 2-403
9 - 10 años 1007 (608-1572)
Adaptada de: Martins TB, et al. J Allergy Clin Immunol. 2014;133(2):589-91. crónica, por alteraciones genéticas de la función de la mieloperoxidasa de los neutrófilos.

Neonatos 0-6500 (28%-76%)
Hasta 2 meses
7000 (60%-85%)
(17%-52%)
(41%- 68%)
2-5 meses 2300-6500 (48%- 75%) 1500-5000 (33%- 58%)
5-9 meses
(50%- 77%)
9-15 meses 1600-6700 (54%- 76%)
meses
2-5 años
5-10 años
10-16 años
(39%- 73%)
(43%- 76%)
(55%- 78%)
(52%- 78%)
(33%-58%)
(31%- 54%)
(25%- 50%)
(23%- 48%)
(27%- 53%)
(25%- 48%)
(10%-41%)
(9%-23%)
(11%- 25%)
(13%- 26%)
(12%- 28%)
(11%- 32%)
(14%- 33%)
(19%- 34%)
(9%-35%)
(4%-26%)
(14%- 39%)
(13%- 35%)
(15%- 39%)
(17%- 41%)
(14%- 44%)
(10%- 31%)
(3%-23%)
(2%-14%)
(2%-10%)
(3%-17%)
(3%-16%)
(4%-23%)
(4%-26%)
(6%-27%) Adultos
(55%- 83%)
(28%- 57%)
(10%- 39%)
Adaptada de: Comans-Bitter WM, et al. J Pediatr. 1997;130(3):388-93.
Nombre del antibiótico
Amoxicilina
Trimetoprima/sulfametoxazol
Azitromicina
Claritromicina
10-20 mg/kg/día una o dos veces al día
5 mg/kg una vez al día
10 mg/kg dosis semanal
7,5 mg/kg/día una o dos veces al día
Doxiciclina 25-50 mg al día en mayores de 8 años
Elaboración propia.
En formas leves de hipogammaglobulinemia transitoria o déficit de IgA, el uso de profilaxis antibiótica es suficiente junto al manejo de soporte; no obstante, para patologías como la agammaglobulinemia ligada al X o los déficits predominantes de anticuerpos, la profilaxis antibiótica ayuda en períodos cortos de tiempo, mientras el paciente alcanza niveles adecuados con la terapia de reemplazo de inmunoglobulinas.

Las terapias que mayor impacto han tenido en la supervivencia de estos pacientes han sido las terapias de reemplazo con inmunoglobulinas con dosis entre 400-800 mg/kg/mes, ya sean subcutáneas o endovenosas. Esta estrategia disminuye ostensiblemente los eventos de infecciones graves como la neumonía y meningitis, al igual que la inflamación persistente, con mayor impacto en morbimortalidad en los pacientes. Su vía de administración, sus componentes y su periodicidad dependen mucho de las preferencias del paciente, acorde a su vivencia y actividades, siempre considerando las indicaciones médicas respectivas para cada patología.
Otra terapia muy importante es la terapia inmunomoduladora, principalmente en los desórdenes de la regulación inmune; que utiliza medicamentos como los inhibidores de la calcineurina, los inhibidores de Janus cinasa (JAK) y los esteroides. Sin embargo, estos tratamientos son terapia puente para llevar a estos pacientes a las opciones de tratamiento curativo.
Las opciones curativas para los EII dependen de la entidad clínica, pero principalmente es el trasplante de progenitores hematopoyéticos en las inmunodeficiencias combinadas, los desórdenes de la fagocitosis y los desórdenes de la regulación inmune en los que los estudios han demostrado que entre más temprano y en mejores condiciones nutricionales se encuentre el paciente, mejores desenlaces con vida libre de
eventos tendrá. La terapia génica se encuentra actualmente en estudios que son alentadores para evitar los efectos adversos y complicaciones del trasplante como la enfermedad injerto contra huésped y los desórdenes metabólicos y neoplásicos asociados al trasplante: no obstante, aún hay camino por recorrer para su implementación clínica.
La vacunación en estos casos entra en la categoría de situaciones especiales debido a que existen restricciones del uso de vacunas con agente vivo atenuado en ciertas entidades. También se difieren algunos agentes vacunales si el paciente se encuentra en terapia de reemplazo de inmunoglobulinas, principalmente de aplicación endovenosa, debido a que perderán efectividad. Es importante hacer asesoramiento con los grupos de infectología para lograr esquemas de vacunación acordes por cada enfermedad específica.
Los EII son un grupo heterogéneo de trastornos que representan una causa importante de comorbilidad en pediatría, e incluso en la población adulta, con un amplio espectro de fenotipos clínicos que hacen que su diagnóstico sea difícil y que en muchas ocasiones sea tardío; de ahí la importancia de hacer hincapié en puntos clave como los signos de alarma que le permitan al médico general y al pediatra en contacto con el paciente sospechar de estas entidades y realizar un diagnóstico precoz que pueda impactar en el pronóstico.

1. Abbas AK, Pober JS, Lichtman AH. Inmunología celular y molecular. McGraw-Hill; Interamericana de España: 1995.
2. Aghamohammadi A, Rezaei N, Yazdani R, et al. Consensus Middle East and North Africa Registry on Inborn Errors of Immunity. J Clin Immunol. 2021;41(6):1339-1351.
3. Baloh CH, Chong H. Inborn Errors of Immunity. Prim Care. 2023;50(2):253-268.
4. Comans-Bitter WM, de Groot R, van den Beemd R, Neijens HJ, Hop WC, Groeneveld K, et al. Immunophenotyping of blood lymphocytes in childhood. Reference values for lymphocyte subpopulations. J Pediatr. 1997;130(3):388-93.
5. IUIS. Inborn Errors of Immunity Committee (IEI) [Internet]. IUIS. 2019 [citado el 7 de noviembre de 2024]. Disponible en https://iuis.org/committees/iei/
6. Kim VHD, Upton JEM, Derfalvi B, et al. Inborn errors of immunity (primary immunodeficiencies). Allergy Asthma Clin Immunol. 2025;20(Suppl 3):76.
7. Martins TB, Bandhauer ME, Bunker AM, Roberts WL, Hill HR. New childhood and adult reference intervals for total IgE. J Allergy Clin Immunol. 2014;133(2):589-91.
8. Notarangelo LD, Bacchetta R, Casanova JL, et al. Human inborn errors of immunity: An expanding universe. Sci Immunol. 2020;5(49):eabb1662.
9. Peinador M, Jiménez R, Suárez A, Berghezan A, Morillo B, Morales D. Niño con infecciones recurrentes [Internet]. Asociación Española de Pediatría de Atención Primaria. 2016 [citado el 15 de octubre de 2025]. Disponible en: https://aepap.org/wp-content/ uploads/2024/02/Nino-con-infecciones-recurrentes.GPI-2017.pdf
10. Registro LASID [Internet]. LASID. [citado el 7 de noviembre de 2024]. Disponible en: https://lasidregistry. org/view/statistics/general/2024-10
11. Rider NL, Truxton A, Ohrt T, et al. Validating inborn error of immunity prevalence and risk with nationally representative electronic health record data. J Allergy Clin Immunol. 2024;153(6):1704-1710.
12. Tangye SG, Al-Herz W, Bousfiha A, et al. Human Inborn Errors of Immunity: 2022 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 2022;42(7):1473-1507.


Rafael José Orozco Marun1 Deivis Barrios Andrades2
Carlota Valentina Ovalle Villadiego3
Julieth Daniela Figueredo Arce4
María Fernanda Torres Organista5
INTRODUCCIÓN
El traumatismo craneoencefálico (TCE) es definido como cualquier alteración estructural o funcional del encéfalo producida por una fuerza física externa. Es considerado una de las causas más frecuentes de consulta en los servicios de urgencias y hospitalización en pediatría y representa la primera causa de muerte por trauma en niños de 1 a 14 años. El TCE constituye un problema de salud pública que afecta a todos los estratos socioeconómicos y se asocia con una alta carga de morbilidad y mortalidad.
El TCE en niños debe entenderse en el contexto de las particularidades anatómicas y fisiológicas propias del desarrollo infantil. Los lactantes y preescolares tienen una mayor masa
craneofacial en relación con el total corporal, lo que contribuye a una mayor frecuencia de TCE en esta etapa. Por otro lado, la inmadurez del sistema nervioso central y la tendencia a la hiperemia cerebral aumentan el riesgo de edema cerebral difuso. Las fontanelas y suturas abiertas actúan como un mecanismo protector frente a la hipertensión intracraneal (HIC). El cerebro en desarrollo es más flexible, pero también más sensible a daños por sobreestimulación y procesos importantes para el desarrollo cerebral, como la formación de las conexiones nerviosas, lo que afecta la respuesta a una lesión. Aunque la mortalidad por este tipo de trauma es menor en niños que en adultos, la forma en la que el cuerpo y el cerebro reaccionan es diferente y requiere un cuidado especial.
1. Pediatra intensivista, Universidad del Rosario. Docente Universidad del Norte.
2. Pediatría, Unidad de Cuidados intensivos Pediátricos.
3. Residente de Pediatría, Universidad del Norte. ORCID: https://orcid.org/0009-0000-2179-6034
4. Médica general, Universidad del Norte. ORCID: https://orcid.org/0009-0005-3189-9519
5. Médica general, Universidad del Norte. ORCID: https://orcid.org/0009-0003-8968-2625

Las lesiones cerebrales causadas por traumatismos no solo provocan daño físico, también pueden generar discapacidades que afectan profundamente la vida social y familiar de los niños. Por esta razón, el manejo en pediatría debe incluir un proceso de rehabilitación individualizado que tenga en cuenta las características del desarrollo infantil y apoye a los pacientes al adaptarse y convivir con las secuelas. Durante la infancia, diversos factores como la edad, el estado nutricional, el consumo de sustancias en adolescentes, el nivel socioeconómico y la presencia de enfermedades previas influyen en la gravedad del daño y en las posibilidades de recuperación. Finalmente, los avances en técnicas diagnósticas y terapéuticas han mejorado el manejo clínico, pero estas lesiones todavía son un desafío importante en la salud pública pediátrica.
DEL TRAUMATISMO CRANEOENCEFÁLICO
El trauma craneoencefálico se clasifica en leve, moderado y grave. En dicha clasificación se tiene en cuenta el mecanismo de lesión y la evaluación del nivel de conciencia.
Los mecanismos de lesión se deben usualmente a caídas (baja o gran altura) y accidentes de tránsito. En menores de 6 años, predominan las caídas, y en los lactantes la más común es la caída de baja altura. Por el contrario, en mayores de 6 años, los accidentes de tránsito son la principal causa de TCE, responsables del 60% de los casos graves debido a la elevada energía cinética que se presenta y que suele acompañarse de politraumatismos.
La evaluación del nivel de conciencia se realiza por medio de la escala de coma de Glasgow (GCS), que mide la respuesta ocular, motora y verbal. En niños menores de 5 años o sin lenguaje verbal desarrollado, se evalúa la

respuesta verbal como sonidos/llanto/balbuceo y la respuesta motora como movimientos espontáneos y respuesta a estímulos dolorosos. Dependiendo de la respuesta del paciente se asigna un puntaje, y de esta manera se logra clasificar.
Se debe tener en cuenta que, dependiendo de la causa del TCE, se puede sospechar de una lesión neurológica grave a pesar de que se tenga un valor leve en GCS, por lo que siempre se debe realizar una tomografía computarizada si la causa es un traumatismo de alta energía.
Con base en lo mencionado previamente, el TCE se puede dividir en leve, moderado o grave.
• Leve: GCS 14-15 puntos.
- Impacto débil o moderado.
- Sin pérdida del conocimiento o menor a 5 minutos.
- Ausencia de síntomas.
- Ausencia de fractura o fractura simple.
- Ausencia de vómitos o menos de 3 en 24 horas.
• Moderado: GCS 9-13 puntos o impacto violento.
- Menores de 2 años
• Pérdida de conciencia mayor a 5 segundos.
• Tres o más vómitos o vómito en chorro.
• Actitud anormal referida por los padres/ somnolencia progresiva
• Mayores o igual a 2 años
- Pérdida de conocimiento o que no recuerde lo sucedido (amnesia).
- Cefalea progresiva/grave.
- Tres o más vómitos o vómito en chorro.
• Grave: GCS menor de 8 o que disminuya 2 puntos su puntaje al ingreso
- Convulsiones.
- Signos de localización.
- Fractura con hundimiento o lesión craneoencefálica.
- Fontanela tensa.
- Trastornos de la hemostasia.
El maltrato infantil todavía es una causa de TCE, especialmente en menores de 1 año; es el responsable del 40% de las muertes y suele estar asociado a hematomas subdurales, por lo que se deben evaluar lesiones que puedan sugerir maltrato o abuso y sospechar en caso de no haber congruencia entre las lesiones, lesiones geométricas, otro tipo de fracturas o hemorragias retinianas, actitud inadecuada del cuidado y conducta inhabitual del lactante.
El TCE es una de las principales causas de muerte accidental en la infancia y constituye un motivo frecuente de consulta en los servicios de urgencias. Su incidencia y gravedad dependen de diferentes factores como la edad y el sexo. Se ha visto que los pacientes menores de un año presentan un riesgo de mortalidad de aproximadamente el doble que los niños de 1 a 6 años y de hasta tres veces mayor que el de los de 6 a 12 años.
A su vez, el TCE es una de las causas principales de morbilidad y mortalidad en niños a nivel mundial. Según datos de la Organización Mundial de la Salud, el TCE es responsable de un gran porcentaje de hospitalizaciones y muertes en menores de 15 años. La incidencia varía según la región, pero se estima que cada año ocurren millones de casos de TCE pediátricos, y son más frecuentes en niños menores de 5 años debido a su mayor vulnerabilidad por la inmadurez motora y el desarrollo neurológico.
En países de ingresos medios y bajos, como Colombia, las causas principales del TCE en niños son las caídas y los accidentes de tránsito. Las caídas constituyen aproximadamente el 60% al 75% de los casos, y predomina en niños menores de 5 años, especialmente lactantes y preescolares; mientras que los accidentes de tránsito tienen mayor impacto en niños mayores y adolescentes (13,3%). Además, es importante considerar la sospecha de maltrato
infantil en casos de TCE sin una causa clara o con historia inconsistente, ya que representa un porcentaje significativo de lesiones en lactantes y niños pequeños.
DEL TRAUMATISMO CRANEOENCEFÁLICO
De acuerdo con Serpa y colaboradores, la fisiopatología del TCE en niños está fuertemente influida por las características únicas del cerebro en desarrollo. En las primeras etapas de vida, el cerebro utiliza tanto cetonas como glucosa como fuente de energía, y durante la infancia alcanza un pico de consumo de glucosa y flujo sanguíneo. Después de un TCE, este metabolismo se deprime temporalmente, pero, si ocurre una segunda lesión en este período vulnerable, la caída es más profunda y prolongada.
Además, el trauma provoca una entrada excesiva de calcio en las neuronas, lo que altera su equilibrio y aumenta la demanda de energía.
Aunque en los cerebros jóvenes esta alteración tiende a resolverse más rápido, la menor presencia de proteínas que regulan el calcio los hace más vulnerables al daño. Tanto la edad como la gravedad de la lesión determinan la magnitud y duración de estos cambios, lo que hace necesario un manejo clínico adaptado a la población pediátrica.
El TCE en pediatría se divide en lesión cerebral primaria y secundaria. La lesión primaria ocurre en el momento del impacto y corresponde a la disrupción del tejido cerebral por fuerzas de aceleración-desaceleración, que causa daño focal o difuso y ruptura de la barrera hematoencefálica, con lesiones como contusiones, laceraciones, fracturas de cráneo y hemorragias intracraneales. Un componente clave de esta lesión primaria es el daño axonal difuso, que afecta la conectividad neuronal y se asocia con déficits neurológicos a largo plazo.

Por otro lado, la lesión secundaria es consecuencia de procesos bioquímicos y fisiológicos que se inician tras la agresión primaria, lo que afecta a células inicialmente intactas. Entre estos mecanismos destacan la hipoxia, la isquemia, el edema cerebral, la hipoglucemia y el daño mediado por radicales libres y disfunción mitocondrial, que generan cascadas de excitotoxicidad, entrada masiva de calcio, muerte neuronal y desconexión axonal.
En los niños, el flujo sanguíneo cerebral es más variable que en los adultos. Depende de la presión de perfusión cerebral (PPC) y de la presión intracraneal (PIC); si esta última aumenta, ya sea por inflamación o sangrado y no hay mecanismo de compensación, la llegada de sangre y oxígeno al tejido nervioso disminuye y el daño se exacerba. La teoría de Monro-Kellie explica que el cráneo es un compartimento no expansible que contiene parénquima cerebral, líquido cefalorraquídeo y sangre; el aumento de volumen en uno de estos componentes, sin compensación, incrementa la PIC y reduce la PPC. Finalmente, alteraciones en el metabolismo cerebral, como el consumo elevado de oxígeno y glucosa por la sustancia gris, hacen que el tejido nervioso sea altamente vulnerable a la hipoperfusión y a la hipoglucemia, las cuales pueden desencadenar daño neuronal irreversible.
EVALUACIÓN INICIAL Y DIAGNÓSTICO
La evaluación inicial del paciente pediátrico se debe hacer de manera sistemática y su objetivo es identificar de manera temprana aquellos pacientes con lesiones intracraneales (LIC), TCE grave, identificar situaciones clínicas que comprometen la vida, prevenir daño neurológico y prevención de lesión secundaria. El paciente no debe permanecer más de diez minutos en el área de emergencias; se debe realizar una primera revisión en no más de 120 segundos.

Inicialmente, se recomienda realizar el Triángulo de Evaluación Pediátrica, el cual tiene en consideración tres parámetros: apariencia, respiración y circulación. En esta etapa, es fundamental la monitorización de signos vitales y la búsqueda de signos clínicos, entre ellos, la tríada de Cushing (bradicardia, hipertensión arterial y respiración irregular), que nos indicará HIC.
Posteriormente, se debe realizar el ABCDE, el cual busca la estabilización del paciente y minimizar el daño cerebral.
a. Airway. Evaluación y aseguramiento de la vía aérea, teniendo control de la columna cervical.
b. Breathing. Evaluación de la ventilación y oxigenación.
c. Circulation . Evaluación hemodinámica y manejo de hemorragias.
d. Disability. Evaluación neurológica inicial, que incluye:
- Valoración del nivel de alerta (AVDN). La ausencia de respuesta indica aseguración de la vía aérea mediante intubación.
- GCS/escala de Glasgow pediátrica
- Reactividad pupilar: La presencia de pupilas midriáticas arreactivas sugiere lesión del tronco cerebral
- Posturas anómalas o focalidad neurológica.
e. Exposure. Exposición del paciente.
Una vez se hace el ABCDE, se debe realizar una evaluación neurológica completa donde se evalúen los pares craneales, reflejos tendinosos profundos y evaluación de la cabeza; por ejemplo, la presencia de hematomas, fracturas, fontanelas tensionadas, lesión del cuero cabelludo y fondo de ojo.
Durante la valoración, se realizan principalmente tres escalas que ayudan a determinar el estado clínico del paciente, guiar el manejo y evaluar el posible pronóstico.
1. GCS: nivel de conciencia.
a. Leve 14 - 15 puntos.
b. Moderado 9-13 puntos.
c. Grave 3-8 puntos.
2. Escala AVDN: nivel de alerta.
a. Paciente alerta.
b. Respuesta a órdenes verbales.
c. Respuesta a estímulos dolorosos.
d. Sin respuesta.
3. Escala de Marshall: se basa en los hallazgos de la tomografía computarizada (TAC) para predecir el pronóstico de HIC y guiar el manejo. Se usa como referencia la compresión de las cisternas basales.
a. Lesión difusa I: no se observa patología craneal visible.
b. Lesión difusa II: cisterna presente + línea media centrada o desplazada <5 mm. Se puede presentar:
• Lesiones hiperdensas o mixtas <25 mL.
• Cuerpos extraños.
• Fragmento óseo.
c. Lesión difusa III (swelling): cisterna comprimida o ausente + línea media desplazada <5 mm. Se puede presentar:
• Lesiones hiperdensas o mixtas <25 mL.
d. Lesión difusa IV: desplazamiento de la línea media >5 mm + ausencia de lesiones focales hiperdensas >25 mL.
e. Lesión focal evacuada: cualquier lesión evacuada quirúrgicamente.
f. Lesión focal no evacuada: lesión hiperdensa >25 mL no evacuada.
Las pruebas de neuroimagen son de gran importancia, dado que permiten identificar lesiones cerebrales. Están indicadas en pacientes en los cuales se busque identificar la localización, origen y extensión de la lesión primaria; identificar lesiones que puedan generar lesión secundaria; o identificar el pronóstico neurológico.
Existen diferentes pruebas como radiografía de cráneo y cervical, resonancia magnética, tomografía computarizada craneal y de columna cervical, evaluación de vasos sanguíneos. La radiografía de cráneo no se recomienda de
rutina, sin embargo, puede ser útil en la evaluación de cefalohematoma en pacientes menores a 2 años en los que se sospecha de maltrato infantil con fractura ósea o cuerpo extraño.
En pacientes con TCE + dolor o sensibilidad en el cuello que no tengan indicación de TAC de columna cervical, se debe realizar radiografía de columna cervical en tres proyecciones antes de evaluar rango de movimiento.
La resonancia magnética nuclear (RMN) toma más tiempo y es más costosa, por lo que se prefiere, si se tiene disponible, la tomografía computarizada. Además, no provee información que conlleve a un cambio significativo en el tratamiento del paciente en su etapa aguda. Por otro lado, la serie T1, T2 y FLAIR evalúan en mejor medida las hemorragias extraaxiales. Las secuencias T1 y T2 son útiles para saber el tiempo de la hemorragia y la T2 + FLAIR para la evaluación del edema e isquemia. Se considera su realización en pacientes que presenten un TAC normal, pero con sintomatología persistente.
La TAC es la imagen de elección (estándar de oro) y se debe realizar en el paciente estable, ya que tiene alta sensibilidad para hemorragias agudas, y la LIC más común en población pediátrica es el hematoma epidural. No requiere de contraste en las fases agudas. Tiene la desventaja de que no es sensible para las lesiones axonales difusas, tallo cerebral, cerebelo y superficie orbitaria inferior del lóbulo frontal (se prefiere RMN en esos casos).
La TAC craneal está indicada en los siguientes pacientes, independientemente del puntaje de GCS.
1. Alteración del estado de conciencia o neurológica previa que implica la valoración del paciente.
2. TCE grave.
3. Sospecha de fractura de base de cráneo.
4. Fractura deprimida o compuesta.
5. Lesión penetrante del sistema nervioso central (SNC).

6. Fontanela abombada.
7. Asimetría pupilar >1 mm.
8. Alto riesgo o intermedio de LIC.
9. Edad <3 meses.
10. Politrauma.
11. Factores predisponentes de sangrado (coagulopatías).
12. Sospecha de maltrato.
13. Portador de válvula de derivación ventricular.
14. Consumo de drogas/alcohol.
15. Sospecha de lesión cervical.
16. Pérdida de conciencia no visualizada.
La TAC de columna cervical se recomienda dentro de la primera hora en pacientes con GCS <13, intubados, con signos neurológicos periféricos focales y con parestesia de extremidades.
La angio-TAC, angiorresonancia o angiografía se recomienda en caso de sospecha de lesión vascular intracraneal.
TRATAMIENTO DEL TRAUMATISMO CRANEOENCEFÁLICO
LEVE A GRAVE
El manejo inicial del TCE se debe realizar con un equipo multidisciplinario y tiene como objetivo buscar y tratar las posibles complicaciones que pongan en riesgo la vida del paciente, dentro de las cuales encontramos las respiratorias, circulatorias y neurológicas. Se prefiere realizar una intervención medicalizada, ya que reduce de manera significativa la mortalidad, especialmente por TCE grave con lesiones cerebrales.
Lo primero que se realiza es el ABCDE y se establece si el paciente se encuentra o no estable hemodinámicamente, en caso de que no lo esté se prioriza su estabilización. Posteriormente, se debe realizar un examen físico cefalocaudal completo incluyendo columna, mediante el cual se deben evaluar posibles fracturas, fondo de ojo, evaluación neurológica completa que incluya la evaluación de pares craneales, reflejos

osteotendinosos, fuerza y sensibilidad. Se debe tener en cuenta que en las etapas tempranas del TCE se pueden presentar crisis diencefálicas por estimulación simpática y parasimpática.
Dependiendo de la clínica del paciente, se tienen criterios de hospitalización u observación de urgencias:
1. GCS moderado.
2. Estado neurológico alterado.
3. Intolerancia a la vía oral.
4. Lesiones extracraneales graves.
5. Sospecha de maltrato.
6. Cuidador no adecuado para vigilar al niño.
7. Hematoma no epidural <1 cm.
8. Progresión de síntomas.
9. Fractura de cráneo.
10. Cefalohematomas de cuero cabelludo grandes.
11. Impacto de alta energía.
12. Comorbilidades.
Como criterios de ingreso a unidad de cuidados intensivos, se tienen GCS <8, focalidad neurológica y lesión intracraneal.
El TCE se clasifica según la gravedad mediante la GCS y de esta manera se guiará el manejo médico.
TCE leve - puntaje >14
El paciente permanece en observación en el servicio de urgencias por un período de 8-12 horas. Durante el servicio de urgencias se debe:
1. Monitorizar signos vitales.
2. Colocar collar Philadelphia si se considera necesario.
3. Considerar toma de TAC si cumple criterios.
4. Reevaluar.
Si en este tiempo no presenta deterioro neurológico u otros signos, se da egreso con recomendaciones y signos de alarma para acudir nuevamente al servicio de urgencias:
1. Cefalea intensa o irritabilidad.
2. Vómitos a repetición.
3. Salida de líquido o sangre por oído o nariz.
4. Alteración del comportamiento, equilibrio, visión, habla.
5. Dificultad para levantarse o permanecer despierto.
6. Convulsiones.
7. Pérdida de fuerza.
En caso de empeoramiento o progresión de síntomas, se debe hospitalizar al paciente y realizar una tomografía computarizada.
En estos pacientes se puede aplicar el PECARN (Pediatric Emergency Care Applied Research Network), que es una herramienta de predicción para decidir si un niño menor o mayor de 2 años con un TCE leve requiere de la toma de una tomografía computarizada.
TCE moderado - puntaje 9-13
El paciente debe permanecer en observación por 48 horas. Se debe tener en cuenta:
1. Monitorización continua de signos vitales: frecuencia cardíaca, presión arterial, pulso, llenado capilar y diuresis.
2. Colocar collar Philadelphia, se puede retirar una vez se descarte lesión cervical.
3. Colocar oxígeno suplementario de alto flujo, ya que los períodos de hipoxia se han relacionado con mayor morbimortalidad neurológica a los 6 meses.
4. Colocar acceso vascular con calibre 20 G, para proporcionar hidratación, analgesia y medicamentos, por dos vías periféricas. En caso de no ser posible, se puede realizar una vía femoral o vía intraósea con el fin de mantener la euvolemia con líquidos isotónicos.
5. Toma de TAC.
6. En caso de sangrado visible, se debe de controlar con presión directa al igual que
hacer reserva de glóbulos rojos si se considera pertinente.
En caso de que la TAC no presente ninguna lesión y se tenga un desenlace clínico favorable, se da egreso una vez cumplido el tiempo estipulado con recomendaciones y signos de alarma en casa. En caso de presentar lesiones, se debe mantener en observación por mínimo 72 horas con evaluaciones neurológicas periódicas.
La hipertensión arterial y la hipoxemia son dos factores que se asocian con un desenlace desfavorable, ya que cuadruplican el riesgo de mortalidad, por lo que se debe intentar la prevención de demandas anormales de oxígeno y mejorar el transporte de oxígeno. Si se presenta estado de choque, se debe descartar lesiones diferentes al TCE o trauma medular.
TCE grave - puntaje <8
Estos pacientes deben ser ingresados a la unidad de cuidados intensivos, dado que se deberán implementar diferentes medidas de monitorización.
1. Monitorización de signos vitales: frecuencia respiratoria y cardíaca, presión arterial.
2. Colocación de catéter venoso central, diuresis, llenado capilar, PCO2
3. Toma de TAC, que se recomienda repetir a las 48 horas para descartar nuevas lesiones.
4. Realizar intubación orotraqueal por secuencia rápida, para mantener una saturación de I2 mayor o igual al 90% y PaO2 >80 mm Hg. En caso de sospechas de lesión de columna cervical, se realiza tracción de la mandíbula. Si es posible, se realiza bajo sedación + uso de hipnóticos En caso de hipotensión, se puede utilizar lidocaína 1 mg/kg. Si es menor de 2 años, se prefiere el uso de ketamina y, en mayores de 2 años, se prefiere el uso de etomidato 0,2 – 0,3 mg/kg. Si el paciente se encuentra normotenso se prefiere usar lidocaína. Se puede usar midazolam en bolo

inicial de 0,1-0,2 mg/kg, infusión continua 0,1-0,4 mg/kg/h, fentanilo infusión continua 1-2 µg/kg/h. En caso de ser necesario, se debe realizar parálisis neuromuscular.
5. Acceso vascular para colocación de líquidos intravenosos y mantener estado euvolémico. Está contraindicado el uso de soluciones hipoosmolares, ya que pueden agravar el edema cerebral.
6. Se busca mantener una presión arterial media (PAM) entre 65-85 mm Hg o presión arterial sistólica (PAS) >P 5, pero preferiblemente mayor al P50. En caso de hipotensión, se pueden pasar bolos de cristaloides a razón de 20 cc/kg hasta llegar a metas. Si a pesar del manejo con bolos persiste la hipotensión, se inicia manejo con ionotrópicos, con preferencia por la noradrenalina, ya que aumenta la PPC sin aumentar la PIC.
La monitorización de la PPC está indicada en todo paciente con GCS menor o igual a 8 posterior a una cirugía prolongada, paciente con riesgo hemorrágico o seguimiento de niños con insuficiencia circulatoria. Se puede realizar mediante la ubicación de la monitorización intraventricular, intraparenquimatoso, subaracnoideo, subdural y epidural; sin embargo, el preferido en la población pediátrica es el intraventricular, ya que se puede manejar la HIC. Se puede extraer alrededor de 2-10 mL de líquido cefalorraquídeo (LCR). Tiene como problema el riesgo de infección, especialmente en pacientes que permanecen por más de cinco días.
La monitorización debe estar acompañada de una medición invasiva de la PAM, para calcular la PPC. Se considera que con una PIC de 20 mm Hg se requiere iniciar manejo de HIC y se buscan metas de perfusión cerebral entre 40-80 mm Hg para prevenir isquemia cerebral secundaria y reducir el riesgo de mortalidad.

El manejo de la HIC busca favorecer el retorno venoso yugular y disminuir el consumo
metabólico cerebral. Esto se logra al tener la cabecera a 30°, disminuir la presión intratorácica e intraabdominal y sedación; que tiene como objetivo favorecer la ventilación, reducir la PIC, prevenir actividad convulsiva y optimizar el flujo sanguíneo cerebral, por lo que limita la lesión cerebral secundaria. Se puede utilizar bloqueo neuromuscular, ya que también puede disminuir la presión de vía aérea e intratorácica y facilitar las demandas metabólicas.
En ciertos casos, se puede optar por la hiperventilación, ya que esta logra disminuir la PIC alrededor de un 25%. Se realiza como medida de rescate, por lo que no se recomienda la hiperventilación profiláctica. Se busca una PaCO2 <30 mm Hg, principalmente en las primeras 48 horas.
Se ha demostrado que el dolor puede duplicar o triplicar la tasa metabólica cerebral de oxígeno y aumenta el tono simpático, lo que puede llevar a hipertensión y hemorragia cerebral; por lo que se requiere de analgesia, principalmente con opioides como el remifentanilo, ya que se hidroliza rápidamente. Se ha visto que el uso de otros opioides a altas dosis puede llevar al aumento de la PIC, descenso de perfusión cerebral o causar convulsiones.
La profilaxis de convulsiones se hace mediante benzodiacepinas o fenitoína. Se prefieren las benzodiacepinas a 20 mg/kg/día durante los primeros 7 días del TCE, dado que previene las convulsiones tempranas; sin embargo, no se ha demostrado que prevenga convulsiones tardías.
Se debe evitar la hipertermia y, en caso de que se presente, manejarla con antipiréticos y medios físicos. No se recomienda la hipotermia.
Se buscan niveles de hemoglobina (Hb) 7-10 g/dL + hematocrito (Hto) >21 con estabilidad hemodinámica y de 9 g/dL en paciente inestable, para tener una adecuada perfusión cerebral.
Se recomienda retomar la nutrición a partir de las 24 horas posteriores al ingreso mediante vía parenteral si el paciente se encuentra estable hemodinámicamente. En caso de que no se pueda, se opta por sonda nasogástrica. Se busca manejar valores de glicemia mayor o iguales a 75-189 mg/dL, ya si se tiene una hiperglucemia se relaciona con un peor pronóstico. No se recomienda el uso de dextrosa, principalmente en las primeras 48 horas, a menos que se tengan valores de glucemia <75 mg/dL, ya que puede agravar el edema cerebral.
En pacientes con TCE con signos tempranos de deterioro neurológico, herniación o con HIC refractaria al manejo, se puede optar por craniectomía descompresiva.
Una vez el paciente presente mejoría, se puede considerar el egreso teniendo en cuenta las siguientes consideraciones:
1. GCS de 15 puntos.
2. No hay signos neurológicos focales.
3. No hay deterioro neurológico o progresión de los síntomas en las 2 horas previas.
4. No hay sospecha de lesión intracraneal.
5. No hay alteración hemodinámica o respiratoria.
6. Tolerancia oral.
7. Cuidadores que entienden las recomendaciones y signos de alarma para acudir a urgencias.
8. No hay lesiones extracraneales significativas.
Siempre se deben dar recomendaciones y signos de alarma para acudir nuevamente al servicio de urgencias y se debe asegurar que el cuidador entienda.
DEL TRAUMATISMO
CRANEOENCEFÁLICO
El TCE en pediatría puede generar complicaciones inmediatas y tardías que comprometen la vida y la funcionalidad del paciente. Entre las complicaciones neurológicas agudas más relevantes se encuentran las convulsiones postraumáticas, el edema cerebral, la herniación y la HIC. Las convulsiones postraumáticas pueden ocurrir en la fase temprana (primeros 7 días) o tardía (posterior a una semana).
En pediatría, las convulsiones tempranas son más frecuentes que en adultos debido a la mayor excitabilidad neuronal y la menor mielinización, lo que aumenta el riesgo de daño cerebral secundario. Su control temprano es esencial para prevenir la exacerbación de la lesión cerebral. El edema cerebral, producto de la disrupción de la barrera hematoencefálica y el aumento de la permeabilidad vascular, incrementa la PIC y puede conducir a diferentes tipos de herniación cerebral, como la uncal, central o tonsilar; todas con alto riesgo de mortalidad.
La HIC en pediatría se define como una PIC >20 mm Hg mantenida y requiere monitorización continua en pacientes de alto riesgo. Es considerada una de las principales causas de mortalidad y deterioro neurológico en el TCE grave. Se debe controlar mediante medidas como la elevación de la cabeza, optimización de la perfusión cerebral, el uso de terapias hiperosmolares o monitorización invasiva; y, en casos refractarios, descompresión quirúrgica. Dichas medidas son clave para prevenir la progresión del daño secundario.
Además de las complicaciones agudas, el TCE en la infancia puede originar alteraciones

endocrinas, neurológicas y cognitivas a largo plazo. El daño a estructuras como el hipotálamo y la hipófisis puede generar disfunciones hormonales, incluyendo déficit de hormona de crecimiento, hipotiroidismo central y alteraciones puberales. Desde el punto de vista neuropsicológico, los pacientes pueden presentar dificultades en el aprendizaje, problemas de memoria, déficit de atención y cambios conductuales persistentes. Estas secuelas dependen de la edad al momento del trauma, la gravedad de la lesión y la calidad de la rehabilitación.
A largo plazo, muchos pacientes pediátricos con TCE desarrollan secuelas cognitivas y conductuales que afectan su rendimiento escolar, interacción social y autonomía. Estas incluyen dificultades en la memoria, atención, funciones ejecutivas y control emocional, y pueden pasar desapercibidas inicialmente y manifestarse meses o incluso años después del evento. Numerosos estudios han demostrado que estos déficits pueden ser persistentes y de amplio espectro, por lo que se recomienda un seguimiento neuropsicológico prolongado. Un análisis sistemático comparó a niños con TCE frente a controles y evidenció que los afectados presentaban un rendimiento significativamente inferior en funciones como atención, memoria de trabajo, velocidad de procesamiento y razonamiento perceptual, así como una peor calidad de vida.
Después de la fase aguda del TCE en niños, comienza la fase subaguda, en la cual se inicia una rehabilitación intensiva y estructurada con el objetivo de prevenir complicaciones secundarias y optimizar la recuperación funcional. Esta etapa es crítica para aprovechar la plasticidad cerebral infantil y establecer bases sólidas para la recuperación. El inicio temprano

de la rehabilitación, idealmente dentro de las primeras 48 horas tras la hospitalización, ha demostrado mejorar los resultados funcionales, por lo que se recomienda la evaluación e intervención precoz por parte de fisioterapeutas, terapeutas ocupacionales, fonoaudiólogos y médicos especialistas en rehabilitación.
Durante esta fase subaguda, el abordaje debe ser completamente multidisciplinario, combinando intervenciones físicas, cognitivas y conductuales para abordar integralmente las necesidades del paciente. Se recomienda diseñar un plan personalizado de rehabilitación a partir de una evaluación que incluya el nivel de conciencia, funciones motoras, lenguaje, memoria, cognición, habilidades sociales y emocionales, así como factores ambientales y familiares. Según una revisión sistemática publicada en Frontiers in Neurology, las intervenciones deben adaptarse en frecuencia, intensidad y tipo, considerando la gran variabilidad entre los pacientes pediátricos con TCE. Asimismo, según el consenso internacional publicado en Developmental Medicine & Child Neurology, es fundamental integrar variables como fatiga, sueño, estado emocional y estímulos sensoriales para planificar adecuadamente la rehabilitación durante esta etapa.
Por otro lado, el papel de la familia es esencial durante todas las fases del proceso de rehabilitación. El entorno familiar puede influir significativamente en la recuperación funcional, emocional y social del paciente pediátrico. Debido a esto, se recomienda brindar apoyo psicológico, educación sobre el proceso de rehabilitación y estrategias de manejo conductual a los cuidadores, con el fin de promover un entorno estable y estimulante. Un enfoque integral que involucre activamente a la familia y al entorno escolar mejora considerablemente las probabilidades de reintegración social, escolar y el desarrollo de la autonomía en los niños con TCE.
La prevención del TCE en niños es esencial para reducir la incidencia y gravedad de estas lesiones. Según datos de los CDC, los asientos de seguridad para niños reducen el riesgo de lesiones entre un 71% y 82%, mientras que los booster seats lo hacen en un 45%. A su vez, el uso adecuado de cascos en actividades recreativas como ciclismo y deportes de contacto reduce el riesgo de TCE hasta en un 88%, mientras que el uso de cinturones de seguridad en vehículos disminuye considerablemente las lesiones graves y muertes. Dichas medidas, junto con leyes que regulan su uso obligatorio, han demostrado aumentar la adherencia y disminuir la tasa de lesiones en población pediátrica. Debido a esto, la promoción constante del uso de estos dispositivos y la implementación de normativas legales son pilares fundamentales en la prevención del TCE.
La educación preventiva complementa las estrategias de seguridad al aumentar el conocimiento y las prácticas seguras entre niños, padres, entrenadores y profesionales de la salud. Programas como Heads Up del CDC y Think First Boston combinan la enseñanza con la entrega gratuita de cascos, incrementando significativamente su uso. Sin embargo, aunque la educación mejora la conciencia sobre el riesgo de TCE, estudios muestran que por sí sola tiene un impacto limitado en cambios conductuales y reducción de lesiones, por lo que debe ser parte de un abordaje integral que incluya legislación y apoyo comunitario.
Finalmente, las medidas legislativas y comunitarias han probado ser eficaces para prevenir el TCE en pediatría. Leyes que exigen el uso de cinturones de seguridad, sistemas de retención infantil y cascos para ciclistas, acompañadas de campañas masivas como Click It or Ticket, han logrado aumentar significativamente el cumplimiento y reducir la incidencia y gravedad
de las lesiones. Además, la prevención en el hogar mediante modificaciones del entorno, como barandillas y superficies antideslizantes, es crucial para evitar caídas, una de las causas principales de TCE en niños pequeños. Estas acciones combinadas, desde políticas públicas hasta intervenciones educativas y modificaciones del entorno, conforman una estrategia integral para la prevención del TCE en la infancia.
El TCE en la edad pediátrica constituye un problema de salud pública con implicaciones clínicas, familiares y sociales de gran alcance. Su abordaje requiere una visión integral que abarque desde la estabilización inicial y el manejo de las complicaciones agudas hasta el seguimiento prolongado orientado a prevenir, detectar y tratar las secuelas neurológicas, cognitivas, conductuales y emocionales. Las características anatómicas y fisiológicas del cerebro en desarrollo condicionan tanto la presentación clínica como la evolución de la lesión, por lo que se requieren estrategias diagnósticas y terapéuticas adaptadas a esta población.
La fase subaguda y crónica ofrece un límite de tiempo crítico para la intervención mediante la evaluación neurológica y funcional que debe realizarse periódicamente con el fin de permitir la identificación de alteraciones susceptibles de abordaje temprano. Debido a esto, la neurorrehabilitación, entendida como un proceso continuo y multidisciplinario, resulta esencial para optimizar la neuroplasticidad, potenciar la recuperación funcional y favorecer la reintegración social y escolar del paciente. El éxito de este proceso depende de la disponibilidad de recursos especializados, la formación del personal sanitario y la participación de la familia como parte del equipo terapéutico.
A futuro, la investigación del TCE pediátrico debe centrarse en el desarrollo de

Abordaje
biomarcadores pronósticos, herramientas diagnósticas más precisas y protocolos de rehabilitación personalizados, considerando no solo la lesión cerebral, sino también el contexto social y emocional del niño. De esta manera, se podrá avanzar hacia un modelo de atención que no solo salve vidas, sino que garantice el máximo desarrollo funcional y la mejor calidad de vida posible para los pacientes y sus familias.
1. Carreón-González H. Repercusión social en la persona con traumatismo craneoencefálico. Rev Enferm Inst Mex Seguro Soc. 2017;25(2):133-8.
2. CDC. MV PICCS Intervention: Bicycle Helmet Laws for Children [Internet]. CDC Transportation Safety. 2025 [citado 2025 agosto 13]. Disponible en: https://www.cdc. gov/transportation-safety/calculator/bike-helmet.html
3. Donohue SJ. The National Pediatric Acquired Brain Injury Plan [Internet]. BrainLine. 2009 [citado el 13 de agosto de 2025]. Disponible en: https://www.brainline. org/article/national-pediatric-acquired-brain-injury-plan
4. Fatuki TA, Zvonarev V, Rodas AW. Prevention of Traumatic Brain Injury in the United States: Significance, New Findings, and Practical Applications. Cureus. 2020;12(10):e11225.
5. Gálvez Gálvez MG. Caracterización clínica-epidemiológica de pacientes con trauma craneoencefálico en unidad de emergencia del Hospital Nacional de Niños Benjamín Bloom, 01 marzo 2023–01 marzo 2024 [Internet]. San Salvador. 2024 [citado el 13 de agosto de 2025]. Disponible en: https://docs.bvsalud. org/biblioref/2025/05/1594076/caracterizacion-clinicaepidemiologica-trauma-craneoencefalico.pdf
6. Gmelig Meyling C, Verschuren O, Rentinck I, van der Steen I, Engelbert R, Gorter JW. High-intensive physical rehabilitation approach in children and adolescents with acquired brain injury during subacute phase (REHABILITY): a feasibility study protocol. BMJ Open. 2025;15:e087768.

7. Gmelig Meyling C, Verschuren O, Rentinck ICM, Wright V, Gorter JW, Engelbert RH, et al. Development of
expert consensus to guide physical rehabilitation in children and adolescents with acquired brain injury during the subacute phase. J Rehabil Med. 2023;55:jrm12303.
8. Gmelig Meyling C, Verschuren O, Rentinck IR, Engelbert RHH, Gorter JW. Physical rehabilitation interventions in children with acquired brain injury: a scoping review. Dev Med Child Neurol. 2022;64(1):40-48.
9. González Balenciaga M. Traumatismo craneal. En: Sociedad Española de Urgencias de Pediatría (SEUP), editor. Protocolos diagnósticos y terapéuticos en urgencias de pediatría. 4.ª edición. Vizcaya: SEUP; 2024 [citado el 13 agosto de 2025]. Disponible en: https://seup.org/wpcontent/uploads/2024/04/18_Trauma_craneal_4ed.pdf
10. Lee LK, Flaherty MR, Blanchard AM, Agarwal M; Council on Injury, Violence, and Poison Prevention. Helmet Use in Preventing Head Injuries in Bicycling, Snow Sports, and Other Recreational Activities and Sports. Pediatrics. 2022;150(3):e2022058877.
11. Linden MA, Glang AE, McKinlay A. A systematic review and meta-analysis of educational interventions for children and adolescents with acquired brain injury. NeuroRehabilitation. 2018;42(3):311-323.
12. López Pérez JJ, Lancheros Naranjo F, Puentes LN, Daza Coronado AM. Manejo del trauma craneoencefálico en pediatría [Internet]. Documento de trabajo. Subred Integrada de Servicios de Salud SUR E.S.E. 2020 [citado el 13 de agosto 2025]. Disponible en: https:// www.subredsur.gov.co/wp-content/uploads/2023/10/ Manejo-del-trauma-craneoencefalico-en-pediatria.pdf
13. Maya Hijuelos LC. Evaluación y tratamiento de niños con traumatismo craneoencefálico [Internet]. Bogotá:
PRECOP SCP ASCOFAME; 2020 [citado el 13 de agosto de 2025]. Disponible en: https://issuu.com/precopscp/ docs/precop_ano3_mod2_traumatismo
14. National Highway Traffic Safety Administration. Occupant Protection. Highway Safety Program Guideline No. 20 [Internet]. Washington, DC: NHTSA; 2025 [citado el 13 de agosto de 2025]. Disponible en: https://www.nhtsa. gov/uniform-guidelines-state-highway-safety-programs/ occupant-protection
15. Neira P, Gattari AH. Traumatismo de cráneo severo. En: Sociedad Latinoamericana de Cuidados Intensivos Pediátricos, editor. Manual de la Sociedad Latinoamericana de Cuidados Intensivos Pediátricos [Internet]. Sociedad Latinoamericana de Cuidados Intensivos Pediátricos; [citado el 13 de agosto de 2025]. Disponible en: https://slacip.org/manual-slacip/descargas/ SECCION-12/12.8-TEC.pdf
16. Niedzwecki CM, Seymour ML, Hermes E, Lewis B, DeMarco K, Wade SL, et al. Early initiation of rehabilitation therapies in children with severe traumatic brain injury: An algorithm based on expert panel recommendations. J Trauma Acute Care Surg. 2025;98(5):824-829.
17. Oliva Meza Hernández OM, Maya Bautista DK. Traumatismo craneoencefálico grave en pediatría. Anales Médicos. 2016;61(4):261-70.
18. Orliaguet G, Uhrig L. Traumatismo craneoencefálico del niño. EMC - Anestesia-Reanimación. 2016;42(4):1-15.
19. Serpa RO, Ferguson L, Larson C, Bailard J, Cooke S, Greco T, et al. Pathophysiology of Pediatric Traumatic Brain Injury. Front Neurol. 2021;12:696510.
20. Serrano González A, Martínez de Azagra Garde A, Cambra Lasaosa FJ. Traumatismo craneoencefálico grave. Protoc Diagn Ter Pediatr. 2021;1:763-777
21. Serrano González A, Martínez de Azagra Garde A, Cambra Lasaosa FJ. Protocolo de actuación en el traumatismo craneoencefálico grave [Internet]. SECIP Sociedad y Fundación Española de Cuidados Intensivos Pediátricos; 2020 [citado el 13 de agosto de 2025]. Disponible en: https://secip.info/images/uploads/2020/07/ Traumatismo-craneoencef%C3%A1lico-grave.pdf
22. Silverman A, Petersen NH. Physiology, cerebral autoregulation [Internet]. StatPearls. National Library of Medicine; 2023 [citado el 13 de agosto 2025]. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK553183/
23. Sociedad Colombiana de Anestesiología y Reanimación. Trauma craneoencefálico, lo esencial [Internet]. Bogotá: Sociedad Colombiana de Anestesiología y Reanimación; 2019.
24. Volpe DSJ, Konell HG, Salmon CEG, Santos ACD, Carlotti APCP. Neuropsychological outcome, magnetic resonance imaging findings, and health-related quality of life of pediatric victims of traumatic brain injury: a prospective study. J Neurosurg Pediatr. 2025;36(4):457-464.


1. ¿Cuál es el tumor óseo maligno más frecuente en la población pediátrica?
a. Sarcoma de Ewing.
b. Tumor de células gigantes.
c. Osteosarcoma.
d. Linfoma óseo.
2. ¿Qué patrón de destrucción ósea sugiere una mayor agresividad tumoral en las imágenes?
a. Patrón geográfico.
b. Patrón apolillado.
c. Patrón permeativo.
d. Patrón esclerótico.
3. ¿Qué característica radiológica diferencia típicamente a una lesión benigna de una maligna?
a. Presencia de matriz condroide.
b. Zona de transición bien definida.
c. Ubicación epifisaria.
d. Zona de transición amplia.

4. ¿Cuál de las siguientes localizaciones anatómicas se asocia con mayor frecuencia con el osteosarcoma?
a. Vértebras.
b. Fémur distal.
c. Mandíbula.
d. Costillas.
5. ¿En cuánto tiempo aparecen las manifestaciones clínicas en la alergia a la proteína de la leche de vaca (APLV) no mediada por inmunoglobulina E (IgE)?
a. En los primeros minutos luego de la ingesta.
b.1 a 2 horas luego de la ingesta.
c. No aparecen manifestaciones clínicas.
d.48 horas y algunas semanas después de la ingesta.
6. ¿Cuál de las siguientes no forma parte de las manifestaciones clínicas de la APLV no IgE mediada?
a. Enterocolitis inducida por proteínas de los alimentos (FPIES).
b. FPIAP.
c. Dermatitis atópica.
d. Enteropatía inducida por PLV (EPA).
7. ¿Cuál es el parámetro de referencia para el diagnóstico de la APLV?
a. Hemograma.
b. Prueba de provocación oral alimentaria.
c. Prueba dérmica de sensibilización.
d. PCR.
8. Escoja cuál de las siguientes es considerada una indicación para realizar endoscopia de vías digestivas en pacientes con APLV.
a. Constipación de novo.
b. Sospecha de esofagitis eosinofílica.
c. Dolor abdominal.
d. Inapetencia.


9 ¿Qué criterio clínico es fundamental para sospechar una enfermedad autoinflamatoria en la infancia?
a. Fiebre persistente con linfadenopatías.
b. Compromiso multiorgánico desde el nacimiento.
c. Episodios recurrentes de fiebre con síntomas inflamatorios específicos.
d. Presencia de autoanticuerpos.
10. ¿Cuál es la citocina clave en la fisiopatología de la mayoría de las enfermedades autoinflamatorias?
a. Interleucina 8 (IL-6).
b. IL-10.
c. IL-1.
d. Factor de necrosis tumoral alfa (TNF-α).
11. ¿Cuál de las siguientes es una manifestación clínica clásica de la enfermedad de Behçet?
a. Artritis migratoria.
b. Úlceras orales recurrentes.
c. Eritema nodoso exclusivo.
d. Osteólisis de huesos largos.
12. ¿Cuál de las siguientes características no es típica de PFAPA?
a. Fiebre recurrente.
b. Estomatitis aftosa.
c. Linfadenopatía cervical.
d. Respuesta a antibióticos.
13. ¿Qué son los errores innatos de la inmunidad?
a. Un grupo heterogéneo de trastornos genéticos que afectan en grado variable el desarrollo o la función del sistema inmunitario con una amplia gama de fenotipos clínicos.
b. Trastornos inmunológicos causados por virus y/o bacterias.
c. Respuesta exagerada del sistema inmunitario frente a sustancias extrañas.
d. Enfermedades infecciosas adquiridas durante la infancia.
14. ¿Qué país de Latinoamérica ha reportado un mayor número de casos de EII?
a. Colombia.
b. México.
c. Argentina.
d. Brasil.
15. Según el Comité IEI-IUIS, en 2024, ¿en cuántas categorías actualizó y clasificó a los EII?
a. 10 categorías.
b. 8 categorías.
c. 7 categorías.
d. 5 categorías.
16. ¿Cuál es el tipo de EII más frecuente en la edad pediátrica?
a. Inmunodeficiencia predominantemente de anticuerpos.
b. Defectos del complemento.
c. Inmunodeficiencias combinadas.
d. Defectos en la función o migración de los neutrófilos.


17. ¿Cuál es la escala más utilizada para evaluar el nivel de conciencia en un niño con TCE?
a. Escala de Apgar.
b. Escala de Silverman.
c. Escala de Glasgow y Glasgow modificada.
d. Escala de Ballard.
18. ¿Cuál es el principal motivo para realizar una tomografía computarizada (TC) en un niño con traumatismo craneoencefálico (TCE) leve?
a. Todos los niños con TCE leve deben tener TC.
b. Para evaluar edema cerebral en todos los casos.
c. Ante la presencia de vómitos persistentes, pérdida de conciencia o signos neurológicos.
d. Como parte del protocolo de urgencias, sin importar los síntomas.
19. ¿Cuál es el objetivo principal del tratamiento en un niño con TCE moderado a grave?
a. Prevenir infecciones.
b. Disminuir la presión intracraneal y mantener la perfusión cerebral.
c. Iniciar terapia física temprana.
d. Administrar antibióticos empíricos.
20. ¿Cuál es la principal prioridad en el manejo inicial del TCE grave en pediatría?
a. Solicitar neuroimagen urgente.
b. Administrar sedantes para controlar la agitación.
c. Asegurar la vía aérea y estabilizar la respiración.
d. Colocar un catéter vesical.
Volumen 24 Número 2
Clave de respuestas 1: b 2: a 3: b 4: d 5: c 6: c 7: c 8: d 9: d 10: b 11: b 12: b 13: b 14: b 15: b 16: a 17: b 18: a 19: c 20: d
un paso más hacia la recertificación, la actualización y el reconocimiento.

Quiero ser parte de PRECEP
