Curso continuo de actualización en Pediatría CCAP
Volumen 24 Número 2 Mayo - Agosto 2025




Curso continuo de actualización en Pediatría CCAP
Volumen 24 Número 2 Mayo - Agosto 2025


Junta Directiva Nacional 2024 - 2026
Presidente
Vicepresidente
Secretario
Vocal
Vocal
Vocal
Vocal
Vocal
Vocal
Vocal Fiscal
Vocal Representante de Capítulos
Expresidente
Dra. Eliana Zemanate Pediatra Intensivista (Editora)
Dra. Nury Mancilla Pediatra Neuróloga
Dr. Víctor Mora Pediatra
Dr. Mauricio Javier Guerrero Román
Dra. Eliana Zemanate Zúñiga
Dr. Alberto José Esmeral Ojeda
Dra. Claudia Patricia Beltrán Arroyave
Dr. Jerónimo Zuluaga Vargas
Dra. Ángela María Giraldo Mejía
Dr. Víctor Manuel Mora Bautista
Dra. Liliam María Macías Lara
Dr. Mauricio Hernández Cadena
Dr. Iván Alejandro Villalobos Cano
Dra. Iliana Francineth Curiel Arizmendi
Dra. Nury Isabel Mancilla Gómez
Dra. Marcela María Fama Pereira
Comité Editorial
Dr. Mauricio Fernández Pediatra Intensivista (Editor Ejecutivo)
Dr. Jürg Niederbacher Pediatra Neumólogo
Sociedad Colombiana de Pediatría www.scp.com.co
Subdirección de Programas Dirigidos al Pediatra
Calle 83 n.o 16A-44, Oficina 701
Edificio Cima. Bogotá, D.C.
Teléfonos: (601) 6495352 - 7464706/07 precop@scp.com.co
Producción editorial
Grupo Distribuna Carrera 9 B # 117 A-05
Barrio Santa Bárbara Central Bogotá, D.C., Colombia
Teléfonos: (571) 6202294 - 2158335 (571) 2132379 www.libreriamedica.com


Meningococo en pediatría: epidemiología y desafíos actuales en el marco de derrotar la meningitis para el 2030
Luisa María Hincapié Marulanda, MD
Claudia Beltrán, MD
Manifestaciones clínicas de la enfermedad meningocócica invasora
Wilfrido Coronell, MD, PhD
Andrea Geraldine Orozco Pinzón, MD
Enfermedad meningocócica: desafíos y estrategias en cuidados críticos
Andrés Felipe Romero Andrade
Iván José Ardila Gómez
Clara Jimena Vargas Vega
Meningococo: más allá de la enfermedad aguda
Miguel Ángel Luengas Monroy, MD
Jerly Maybelline Díaz Herrera, MD
Juan Esteban Luengas Melgarejo, MD
Vacunas contra el meningococo, ¿cuáles y cómo indicarlas?
Jhon Sebastián Villabona Reyes, MD
Iván Felipe Gutiérrez, MD
Andrés Arias, MD


Luisa María Hincapié Marulanda, MD1
Claudia Beltrán, MD2
La meningitis bacteriana es una infección grave y potencialmente mortal que afecta a personas de todas las edades y regiones del mundo. Puede ocasionar epidemias, muerte rápida en menos de 24 horas o, en su defecto, dejar secuelas y discapacidad. Aunque desde 1993 la Organización Panamericana de la Salud (OPS) impulsó programas regionales de vigilancia epidemiológica para la estimación de la carga de esta enfermedad y, con ello, la creación de estrategias de prevención, aún existen múltiples retos para la disminución de la morbimortalidad relacionadas a esta enfermedad. Desde el año 2020, la hoja de ruta Derrotar la meningitis para el 2030 surge como una iniciativa de la Organización Mundial de la Salud (OMS) que pretende abordar la meningitis no solo como una enfermedad infecciosa que puede prevenirse y tratarse oportunamente y disminuir la incidencia y mortalidad, sino también para visibilizar la necesidad de
apoyo y atención a las personas que padecen sus secuelas.
Según datos de la OMS, en 2017 se presentaron aproximadamente 5 millones de nuevos casos y 290 000 muertes por meningitis a nivel mundial. La mayoría corresponde a meningitis bacteriana ocasionada principalmente por cuatro microorganismos: Streptococcus pneumoniae (neumococo), Neisseria meningitidis (meningococo), Haemophilus influenzae y Streptococcus agalactiae (SGB). A pesar de que el desarrollo e implementación de vacunas ha cambiado la epidemiología de la meningitis bacteriana en el último siglo con una disminución de los casos por H. influenzae, existe una tendencia al aumento de casos por neumococo y meningococo. En Latinoamérica, datos recientes reportan que el meningococo es el agente etiológico más frecuente (35%) en meningitis bacteriana en pediatría.
1. Residente de Pediatría, Universidad de Antioquia. Medellín, Colombia.
2. Pediatra especialista en Infectología. Docente del Departamento de Pediatría, Universidad de Antioquia. Infectóloga, Clínica el Rosario Medellín, Colombia.

En el mundo, después de la pandemia de la infección por coronavirus de 2019 (COVID-19), se ha observado que la incidencia de enfermedad meningocócica invasiva (EMI) ha aumentado y superado los niveles prepandémicos, lo que posiblemente se relaciona con las brechas de la vacunación, la deuda inmunitaria derivada del confinamiento y la mayor variabilidad epidemiológica de la EMI. En Colombia, según datos del Instituto Nacional de Salud, la incidencia de EMI ha oscilado entre 0,1 y 0,22 por 100 000 habitantes en los últimos cinco años. Por su parte, de forma similar al resto del mundo, los lactantes menores de un año son el grupo con mayor riesgo de presentar la infección y fallecer, con predominancia de los serogrupos B y C, seguidos por el serogrupo Y.
Se estima que, en el mundo, una de cada seis personas con meningitis por meningococo muere y que una de cada cinco personas tendrá secuelas y discapacidad, lo que constituye una carga económica para los sistemas de salud, pero también una problemática social, pues se ha asociado a una mayor probabilidad de abandono escolar, imposibilidad de cursar estudios superiores, pobreza, desigualdad de recursos y desigualdad de género; sin embargo, la vigilancia de secuelas en Colombia es limitada.
Por la importancia y el impacto de la meningitis a nivel global, la OMS ha planteado en su hoja de ruta, Derrotar la meningitis para el 2023, varios objetivos estratégicos con base en cinco pilares, teniendo en cuenta desafíos actuales (Tabla 1). En estos, se evidencia la importancia de considerar la implementación de las vacunas meningocócicas, ampliamente disponibles y eficaces, mantener coberturas adecuadas en la población, mejorar el diagnóstico oportuno y preciso, promover sistemas de vigilancia robustos y establecer políticas en educación, prevención, promoción y rehabilitación.
L a mayoría de los casos de meningitis meningocócica ocurre en personas previamente sanas. Algunos factores de riesgo descritos incluyen el t abaquismo, consumo de alcohol, entornos universitarios como dormitorios escolares, contacto estrecho con un caso, hacinamiento, viajes a zonas hiperendémicas o epidémicas y trastornos de la inmunidad como defectos en la vía del complemento, asplenia, hipogammaglobulinemia y virus de la inmunodeficiencia humana (VIH), entre otros.
Pilar
Prevención y control de epidemias
Diagnóstico y tratamiento
Objetivo
Desarrollo de nuevas vacunas asequibles, alta cobertura de inmunización y mejoría de la respuesta a epidemias, incluidas la quimioprofilaxis y vacunación.
Aumentar la velocidad de confirmación de los casos y su tratamiento adecuado
Vigilancia Promoción de sistemas de vigilancia nacionales de la meningitis
Apoyo y cuidado
Promoción y compromiso social
Mayor acceso a sistemas de salud, apoyo de las secuelas incluida la rehabilitación

Promoción de planes nacionales que garanticen el derecho a la prevención, atención oportuna y rehabilitación.
Tabla elaborada por los autores.
Desafío
Bajas coberturas de vacunación
Portafolios incompletos de vacunas
Pruebas diagnósticas subóptimas
Tratamiento tardío o incorrecto
Subregistro
Sistemas de vigilancia limitados
Secuelas y discapacidad no abordadas
Falta de priorización de la enfermedad.
N. meningitidis es un diplococo gramnegativo aerobio encapsulado, tiene al menos 12 serogrupos, cada uno con una cápsula distinta, de los cuales seis (A, B, C, X, Y y W) son los principales y tienen potencial epidémico. Se transmite por contacto y gotas, y el periodo de incubación varía entre 2 y 10 días, con un promedio de 3 a 4 días. Para que pueda ocurrir la transmisión, es necesario el estado de portador nasofaríngeo, que globalmente es del 1% al 35%, con una mayor proporción en adolescentes y adultos jóvenes. En algunos hospederos susceptibles, la bacteria ingresa por medio de las mucosas al torrente sanguíneo y, una vez en la sangre, la cápsula de polisacáridos inhibe la fagocitosis y la vía clásica del complemento. La invasión meníngea se ve facilitada por la duración y el grado de la bacteriemia, y la proteína de membrana externa porina A es la que favorece el proceso de adhesión. Posteriormente, esta bacteria utiliza el pili tipo IV para prevenir la lisis y facilitar la apertura de las uniones endoteliales que permiten la migración paracelular desde el torrente sanguíneo hacia el líquido cefalorraquídeo.
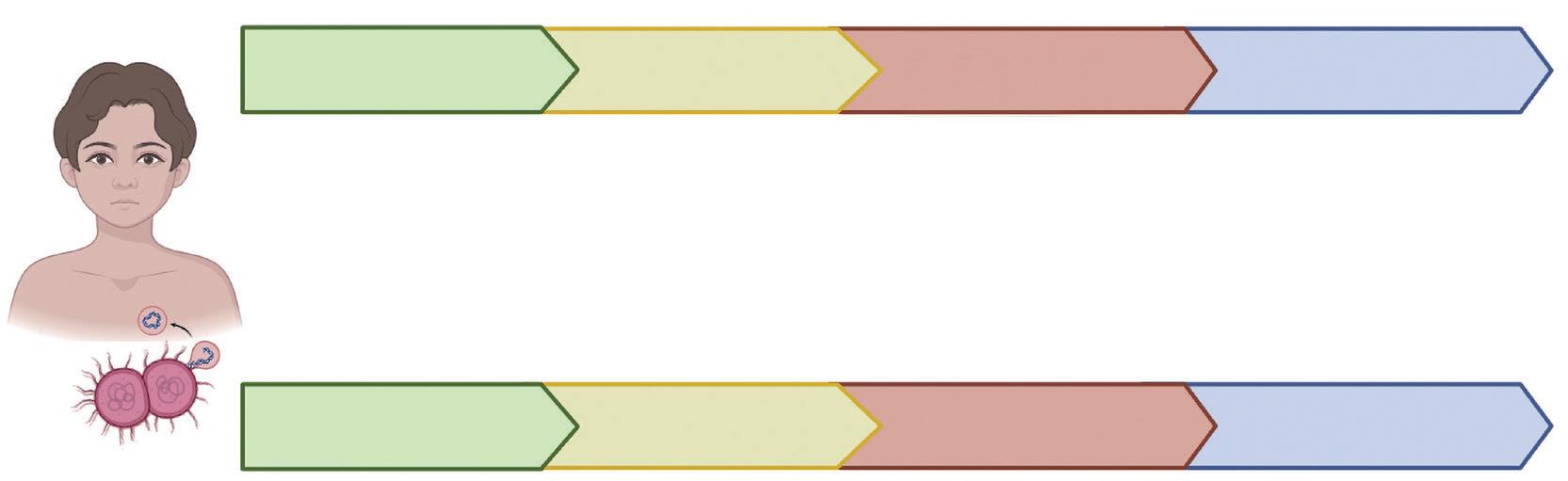
Uno de los retos que se establecen para el control de la meningitis es aumentar el índice de sospecha diagnóstica; sin embargo, los síntomas en las primeras horas son inespecíficos. La EMI puede manifestarse como meningococemia fulminante con o sin choque, meningococemia con meningitis o meningitis como presentación única hasta en un 50%. Sin embargo, también se han reportado casos de artritis séptica, purpura fulminans, neumonía bacteriana e incluso con síntomas gastrointestinales como patrón dominante. Al comienzo del cuadro clínico, la mayoría de los niños presentan síntomas inespecíficos leves que pueden durar desde 4 horas en niños pequeños hasta 8 horas en adolescentes, como fiebre, decaimiento e irritabilidad, con una evolución a síntomas moderados a graves como fontanela abombada, llanto continuo o rechazo al alimento, náuseas, vómito, mialgias (principalmente en los miembros inferiores) y letargia. La
inespecificidad del cuadro inicial con síntomas similares a otras infecciones virales comunes y autolimitadas dificultan la sospecha diagnóstica y hasta el 50% de los pacientes pueden ser redirigidos de los servicios de urgencias a casa.
Dependiendo de la edad hay ciertos hallazgos clínicos, aunque en todas las edades la fiebre es el signo predominante. En neonatos y lactantes menores, el exantema puede ser el primer signo y se caracteriza porque en sus primeras etapas es maculopapular con progresión casi siempre a erupciones petequiales, rojas, marrones o púrpuras que no desvanecen con la presión. En general, los menores de dos años tienen una progresión más rápida, mientras que los adolescentes pueden tener una fase prodrómica más larga con predominio de síntomas gastrointestinales.
A pesar de que la EMI se caracteriza por la triada clásica de exantema hemorrágico, rigidez nucal y alteración del estado de conciencia, estos hallazgos son tardíos y pueden demorarse en aparecer de 13 a 22 horas después del inicio de síntomas, a diferencia del dolor en las extremidades inferiores (31 %-63 %), frialdad (35 %-47 %) y alteración del llenado capilar (17 %-21 %), que se manifiestan en menos de 8 horas y deben aumentar la sospecha diagnóstica ante cuadros inespecíficos.
Otro de los retos es la caracterización y determinación de las secuelas en la carga de enfermedad de la EMI. Las complicaciones y secuelas pueden ser estéticas o funcionales; en algunos reportes se estima que se presentan en aproximadamente el 20% de los casos, pero pueden estar presentes hasta en el 70% cuando se trata de niños menores de un año. Las más frecuentes son las neurológicas (72%), pérdida auditiva (32%) y osteoarticulares (24%). Las secuelas neurológicas incluyen retraso del desarrollo psicomotor, trastorno del habla y del lenguaje, convulsiones, hiper- o hipotonía, trastornos del comportamiento y lesiones en los nervios periféricos. Es imprescindible ofrecer un abordaje multidisciplinario a los pacientes con EMI que incluya el seguimiento de pacientes con secuelas y su vinculación con estrategias de rehabilitación.

El parámetro de referencia actual para el diagnóstico de la meningitis bacteriana es la identificación del microorganismo en muestras de líquido cefalorraquídeo (LCR) por aislamiento en medios de cultivo sólidos o líquidos, o por detección en pruebas de diagnóstico molecular, que se recomiendan incluso como POCT (point of care test). Ante cualquier caso sospechoso, siempre se debe ordenar la punción lumbar para estudios del LCR preferiblemente antes del inicio de antibióticos; sin embargo, si no es posible realizar el procedimiento oportunamente, no se debe retrasar el inicio del tratamiento. Esto constituye una limitación, pues en la mayoría de centros asistenciales, especialmente en niveles de menor complejidad, no se cuenta con los insumos necesarios para la realización de estos procedimientos, o no existe la disponibilidad de pruebas moleculares, por lo que muchos casos no se diagnostican de forma correcta y en la hoja de ruta se establece la necesidad de mejorar el diagnóstico a partir de una mayor realización de pruebas lumbares y con disponibilidad de pruebas moleculares. El diagnóstico microbiológico incluye:
• Cultivos: los hemocultivos y cultivos de LCR est án indicados para pacientes con sospecha de EMI Los cultivos de una lesión petequial o purpúrica , líquido sinovial y otros líquidos corpor ales gener almente estériles pueden ser útiles para el diagnóstico.
• Tinción de Gram: puede revelar diplococos gr amnegativos.
• Citoquímico de LCR: se puede observar pleocitosis, hipoglucorraquia y proteinorraquia; sin embargo, tempranamente podría arrojar un citoquímico normal.
• Pruebas moleculares para la detección de múltiples patógenos en LCR.

Debe tenerse en cuenta que un resultado negativo en los cultivos no descarta la enfermedad, en especial si se ha recibido tratamiento antibiótico previamente. Igualmente, aunque el
LCR puede tener hallazgos sugestivos de meningitis bacteriana como pleocitosis, hipoglucorraquia y aumento de la concentración de proteínas, en etapas tempranas de la enfermedad existe la posibilidad de que las meninges aún no estén lo suficientemente inflamadas como para demostrar alteraciones en el LCR. Específicamente para la meningitis por meningococo se ha estimado que hasta un 12% de los casos pueden no presentar pleocitosis en el citoquímico. Por lo anterior, y teniendo en cuenta la disponibilidad rápida del resultado y el mejor rendimiento diagnóstico (sensibilidad y especificidad >95%), las pruebas de diagnóstico molecular múltiple por reacción en cadena de la polimerasa se recomiendan siempre que exista la sospecha clínica de meningitis y así optimizar el diagnóstico.
En los diagnósticos diferenciales de meningitis se encuentran los abscesos cerebrales, el empiema subdural, las meningitis y encefalitis virales, la sífilis del sistema nervioso central (SNC), la meningitis tuberculosa, la meningitis fúngica, la endocarditis bacteriana, las infecciones por rickettsias, las neoplasias del SNC y la vasculitis cerebral, entre otros.
Ante la sospecha de meningitis bacteriana, los antibióticos parenterales deben administrarse en lo posible en la primera hora desde el diagnóstico; no debe postergarse su inicio bajo ningún concepto, ya que esto condiciona el pronóstico. Se debe seleccionar un antibiótico bactericida con buena penetración de la barrera hematoencefálica, teniendo en cuenta la sensibilidad a los agentes causales según la edad y la epidemiología local. Se recomienda en todo paciente con sospecha de meningitis el uso de una cefalosporina de tercera generación, como ceftriaxona o cefotaxima, combinado con ampicilina si hay riesgo de Listeria monocytogenes y vancomicina cuando hay alta prevalencia de neumococo a cefalosporinas de tercera generación en aislamientos de LCR. En la Tabla 2 se especifica el tratamiento dirigido a meningococo según la concentración inhibitoria mínima (CIM).
Con respecto al uso de esteroides, estos se inician en todo paciente con sospecha de meningitis bacteriana y continúan en caso de tratarse de meningitis por Neumococo o H. influenzae tipo b; para meningococo no se usa de forma
rutinaria. La quimioprofilaxis se le debe administrar a los contactos estrechos por su alto riesgo de contraer la enfermedad meningocócica y hace parte de las estrategias de prevención de brotes y control de la enfermedad (Tabla 3).
Microorganismo meningococo
Susceptibilidad a la penicilina (CIM < 0,1 µg/mL)
Resistencia a la penicilina (CIM > 0,1 µg/mL)
Tratamiento de primera línea
Penicilina o amoxicilina/ ampicilina
Ceftriaxona o cefotaxima
Adaptada de: Duarte C , et al Bogotá: Ministerio de Salud; 2018.
Tratamiento alternativo
Duración
Ceftriaxona, cefotaxima, cloranfenicol 5-7 días
Cefepima, meropenem, 5-7 días
- Contactos familiares, especialmente niños menores de dos años.
- Contactos de guardería o escuela en cualquier momento en los últimos siete días antes del inicio de la enfermedad.
- Exposición directa a las secreciones del paciente índice a través de besos, compartiendo cepillos de dientes o utensilios de alimentos, en cualquier momento durante los siete días previos al inicio de la enfermedad.
- Reanimación boca a boca, contacto sin protección durante la intubación endotraqueal.
- Pasajeros sentados directamente al lado del caso índice en un vuelo de más de ocho horas de duración.
Rifampicina
< 1 mes
> 1 mes
Ceftriaxona
< 15 años
> 15 años
Azitromicina
> 1 mes
5 mg/kg, vía oral cada 12 horas
10 mg/kg (máximo 600 mg), vía oral cada 12 horas
125 mg intramuscular
250 mg intramuscular
10 mg/kg vía oral (máximo 500 mg)
20 mg/kg (máximo 500 mg)
2 días
Dosis única
Dosis única

PR EV E NCIÓN
Actualmente, el Programa Ampliado de Inmunización (PAI) no incluye la vacunación contra el meningococo para ningún grupo poblacional excepto en brotes; sin embargo, las sociedades científicas recomiendan la vacuna conjugada tetravalente MenACYW y meningococo B desde los dos meses de edad. El esquema recomendado para Nimenrix® y Menveo® consta de dos dosis a los dos meses, otra a los cuatro meses y una tercera dosis a los 12 meses; sin embargo, en Menveo®, podría optarse por una tercera dosis a los seis meses y una cuarta dosis a los 12 meses. En el caso de Menactra®, se recomiendan dos dosis espaciadas por 12 semanas, que se pueden colocar entre los 9 y los 12 meses. Para la vacuna del serogrupo B, Bexsero®, el esquema recomendado para niños menores de 5 meses consiste en una primera dosis a los dos meses de edad y una segunda dosis a los cuatro meses de edad, con un refuerzo en el segundo año de vida. Si se inicia la administración en otros grupos etarios, el esquema debe ser el que
corresponda según lo indicado en la información para prescribir aprobada en Colombia.
La meningitis bacteriana es una enfermedad que afecta a millones de personas en el mundo y que causa una alta mortalidad. N. meningitidis es responsable de una cantidad importante de los casos de meningitis en pediatría en todo el mundo. Sus manifestaciones clínicas son variables, pueden ser atípicas con síntomas gastrointestinales o clásicas como meningitis o choque séptico fulminante. El diagnóstico se debe optimizar con la realización de pruebas lumbares para el estudio del líquido cefalorraquídeo con pruebas de diagnóstico molecular y el inicio del tratamiento temprano y oportuno para mejorar los desenlaces. Las secuelas del meningococo pueden ser funcionales o estéticas. La vacunación ampliada a los serogrupos más prevalentes y a temprana edad es una herramienta fundamental en la prevención de la enfermedad con esquemas recomendados desde los 2 meses de edad.
LECT UR A S R ECOME NDA DA S
1. Alderson MR , Ark wright PD, B ai X , B lack S , B orrow R , C au g a n t DA , e t a l . S ur ve ill a n ce a nd co n t ro l of meningococcal dise ase in the COVID -19 er a: A Global Meningococcal Initiative review J Infect 2022;84(3):289296 doi: 10 1016/j jinf 2021 11 016
2 A m er i c a n A c a d e my o f Pe d i a t r i c s Me n i n g o c o c c a l infections En: Kimberlin DW, B arnet t E D, Lynf ield R , S aw yer M H (editores) Red B ook : 2021–2024 Repor t of the Commit tee on Infectious Dise ases 32 a edición
American Academy of Pediatrics; 2021 p 519 - 531
3 Ar teta-Acosta C , Villena Mar tínez R , Santolaya de Pablo
ME Sequelae at Hospit al Discharge in 61 Children With I nv a sive M e ningococc al Dise a se , Chile , 2 0 0 9 -2 019

Pediatr Infect Dis J 2022;41(8):607- 613 doi: 10 1097/ IN F 00000000000 03560
4. B loom DE , B onanni P, M ar tinón -Torres F, Richmond
PC , S af adi MAP, S alisbur y DM , et al. Meningococcal
Disease in the Post- COVID -19 Er a: A Time to Prepare Infect Dis Ther 2023;12(12):26 49 -2663 doi: 10 10 07/ s4 0121- 023 - 0 0 88 8 -w
5 B osis S , M ayer A , Esposito S Meningococcal dise ase in childhood: epidemiolog y, clinical fe atures and prevention J Prev Med Hyg 2015;56(3): E121- 4
6 B r yant PA , Li HY, Z aia A , Grif f ith J , Hog g G , Cur tis N , et al Prospective study of a re al-time PCR that is highly se nsit ive , spe cif ic , and clinic ally u se ful for d i a g nos i s o f m e n i n g o c o c c a l d i s e a s e i n c hi l d r e n . J
C l i n M i c ro b i o l . 2 0 0 4 ; 42 ( 7 ): 2919 -2 5 . d o i : 10 .112 8 / JCM .42 .7. 2919 -2925. 20 0 4.
7 Coronell- Rodriguez W, Caceres DC , Cintr a O, Guz man - Holst A Epidemiolog y of Invasive Meningococcal Dise ase in Colombi a : A Retrospec tive Sur veill ance Dat abase Analysis Infect Dis Ther 2023;12(12):27092724 doi: 10 10 07/s4 0121- 023 - 0 0 8 8 6 -y
8 Coureuil M , Join- Lamber t O, Lécuyer H , Bourdoulous S , Marullo S , Nassif X Pathogenesis of meningococcemia
Cold S pring H arb Perspect Med 2013;3(6): a012393 doi: 10.1101/cshperspect . a012393.
9. Cuastumal M E , Veg a LD, Mosquer a M , Rojas J P, Día z
A . Ne i s ser ia meni ngi t id i s e n p ed i at r í a . P re co p S C P.
2020 ;19(2):16 -27
10 Di Pietro GM , B if f i G , Castella z zi M L , Tagliabue C , Pinz ani R , B osis S , e t al Me ningococc al dise a se in pediatric age: A focus on epidemiolog y and prevention
Int J Environ Res Public He alth 2022;19( 7 ):4 035 doi:
10 339 0/ijerph19 074 035
11 D í a z A , To r re s C , C o ro n e l l W P reve n c i ó n d e l a enfermedad meningocócica invasiva [Internet] Sociedad L atinoamericana de Infectología Pediátrica; 2024 [consult ado el 12 de abril de 2025] Disponible en: h t t p s : //s l i p e o r g / we b / w p - con t e n t /u p l o ads / 2 0 24 /10 / S LI PE - prevencion - enfermedad- meningococica pdf
12
D u a r t e C , S a n a b r i a O M , S a l a s H P, M a r q ui ñ o W, Coronell W, Cor tés JA , et al Line amientos par a la atención clínica integr al de pacientes con enfermedad meningocócica en Colombia . B ogot á: Ministerio de S alud; 2018 .
13. Eliz alde J M , Hernández TC . Protocolo de vigilancia en salud pública Meningitis bacteriana aguda y enfermedad meningocócica [Internet] Instituto N acional de S alud; 2024 [consult ado el 12 de abril de 2025] Disponible en: https://ww w ins gov co/buscador-eventos/Lineamientos/ Pro Meningitis%202024 pdf
14 Institute for Health Metrics and Evaluation GBD Results [Internet] I M HE [consult ado el 12 de abril de 2025] Disponible en: ht tps://vizhub healthdata org /gbd-results
15. Org aniz ación Mundial de la S alud. Derrot ar la menin gitis par a 2030 : una hoja de rut a mundial [Internet].
OM S; 2021 Disponible en: ht t ps: //ww w who int /es/ publications/i/item/978924 0 026 4 07
16 Presa J , S pit z D, Palmer P, Snow V, Dooling K P-1299 Epidemiolog y of Invasive Meningococcal Disease in the United St ates: Review of Recent Dat a and Identif ied
Risk Factors Open Forum Infect Dis 2025;12(Suppl 1): of ae 631.14 8 0. doi: 10.1093/of id/of ae 631.
17. S adar ang ani M , Scheifele DW, H alperin SA , Vaudr y W, Le S aux N , Tsang R , et al. Outcomes of invasive meningococcal disease in adults and children in Canada between 20 02 and 2011: a prospective cohor t study Clin Infect Dis 2015;60(8): e27-35 doi: 10 1093/cid/civ 028
18 T h o m p s o n M J , N i n i s N , Pe r e r a R , M ayo n -W h i t e R , Phillips C , B ailey L , et al Clinical recognition of meningococc al dise ase in children and adolescent s L a n c e t 2 0 0 6 ; 3 67( 9 5 0 8 ) : 3 9 7- 4 0 3 d o i : 10 1016 / S 014 0 - 6736(0 6)67932- 4
19. v an de B eek D, B rouwer M , H asbun R , Koedel U, Whitney CG , Wijdicks E . Community-acquired bacterial meningitis. N at Rev Dis Primers. 2016; 2:16074. doi: 10.1038/nrdp. 2016 .74.
20 Van E t tekoven CN , Liechti FD, B rouwer MC , B ijlsma MW, Van De B eek D Global Case Fat alit y of B acterial Meningitis During an 8 0 -Ye ar Period: A Systematic Review and Meta-Analysis JAMA Netw Open 2024;7(8): e24248 02 doi: 10 10 01/jamanet workopen 2024 248 02
21 Zimmermann P, Cur tis N B acterial Meningitis in the A b se n ce o f P l e o c y t os i s i n C hi ld re n: A Sy st e m at i c Review Pediatr Infect Dis J 2021;4 0(6):582- 587 doi: 10 1097/IN F 00000000000 030 8 5
22 Havlin KM , Woods CR , Rowin ME Central ner vous system infections and related conditions En: Zimmerman J J , Clark RS B , Fuhrman B P, Rot t a AT, Kudchadk ar S R , Relvas M , et al (editores) Fuhrman and Zimmerman’s Pediatric Critical Care Elsevier; 2022 p 823 - 836 e15
23. M árquez L . Meningococcal Dise ase . En: Cherr y JD, K a p l a n S L , H a r r i so n G J , S te i n b a c h W J , H o t e z P J , Williams JV (editores). Feigin and Cherr y ’ s Text book of Ped i at r ic I nfe c t iou s D i se a se s . E l sev ie r ; 2 02 5 . p. 914 -929 e5

P r e c op
24 McN amar a L A , Pot ts C , B lain AE , Retchless AC , Reese N , Swint S , et al Detection of Ciprof loxacin- Resist ant , β - L act amase - Producing Neisseria meningitidis Serogroup Y Isolates - United St ates , 2019 -2020 M MWR
M or b M or t al W k ly Re p 2 02 0 ; 69(24):735 -739 dio: 10 1558 5/mmwr mm6924 a 2
25 M e n i n g i t i s ( b a c ter i a l ) a n d m e n i n go co c c a l d i s e a s e :
r e c o g n i t i o n , d i a g n o s i s a n d m a n a g e m e n t L o n d o n :
N at ion al I n s t it ut e for H e al t h a nd C are E xce lle nce
(N ICE ); 2024 M ar 19
V o l u m en 24 N ú m e r o 2

26 Wor ld H e a l t h O r g a niz at io n Me ning i t i s [ I n te r ne t] WHO; 2019[consult ado el 22 de septiembre de 2022]
D i s p o n i b l e e n : h t t p : // ww w w h o i n t /e m e r g e n c i es / dise ases/meningitis/en/
27 World Health Organization. WHO guidelines on meningitis diagnosis, treatment and care [Internet]. WHO; 2025. Disponible en: https://www.who.int/publications/i/item/9789240108042.

INTRODUCCIÓN
Wilfrido Coronell, MD, PhD1
Andrea Geraldine Orozco Pinzón, MD2
ETAPA TEMPRANA
1.
2.


DE LA ENFERMEDAD MENINGOCÓCICA




Andrés Felipe Romero Andrade1
Iván José Ardila Gómez2
Clara Jimena Vargas Vega3
I N TRODUCCIÓN

1. Pediatra infectólogo, Hospital Universitario Hernando Moncaleano Perdomo, Clínica Uros; docente, Universidad Surcolombiana.
2. Pediatra intensivista, Clínica Uros, Hospital Universitario de Neiva; docente de posgrado en Pediatría, Universidad Surcolombiana.
3. Residente de Pediatría de III año, Universidad Surcolombiana.
Y NO INVASIVA

Enfermedad meningocócica: desafíos y estrategias en cuidados críticos








Enfermedad meningocócica: desafíos y estrategias en cuidados críticos
A N TI BIÓTICOS

Terapia endocrina
Terapia nutricional

Enfermedad meningocócica: desafíos y estrategias en cuidados críticos
Terapias con hemoderivados


Enfermedad meningocócica: desafíos y estrategias en cuidados críticos
Manejo del sistema nervioso central en meningitis bacteriana


Miguel Ángel Luengas Monroy, MD1
Jerly Maybelline Díaz Herrera, MD2
Juan Esteban Luengas Melgarejo, MD3 I N TRODUCCIÓN
1. Infectólogo Pediatra, Hospital Militar Central, Fundación HOMI. Correo electrónico: miguelluengas@gmail.com, miguelluengas2@hotmail.com
2. Residente de Pediatría, Universidad Militar Nueva Granada. Correo electrónico: dra.jerlydiaz@gmail.com
3. Médico interno, Pontificia Universidad Javeriana. Correo: juanestebanluengas@gmail.com, luengas.juanes@ javeriana.edu.co

Meningococo: más allá de la enfermedad aguda

Miguel Ángel Luengas Monroy, Jerly Maybelline Díaz Herrera, Juan Esteban Luengas Melgarejo


Meningococo: más allá de la enfermedad aguda
Miguel Ángel Luengas Monroy, Jerly Maybelline Díaz Herrera, Juan Esteban Luengas Melgarejo


Meningococo: más allá de la enfermedad aguda
TRATAMIENTO Y SEGUIMIENTO
Miguel

Meningococo: más allá de la enfermedad aguda



INTRODUCCIÓN VACUNAS

Jhon Sebastián Villabona Reyes, MD1
Iván Felipe Gutiérrez, MD2
Andrés Arias, MD3
1. Residente de Pediatría, Universidad Militar Nueva Granada.
2. Pediatra especialista en infecciones, Clínica Infantil Santa María del Lago, Clínica Infantil Colsubsidio.
3. Pediatra especialista en infecciones, Infectoped, Hospital Universitario Erasmo Meoz. Docente, Universidad de Santander (UDES).
p re se nc i a d e co m p l e m e n t o. E s t a ac t iv id ad bactericida se cuantif ica mediante el ensayo de actividad bactericida sérica (S BA), utiliz ando complemento humano o de cría de conejo
Se consider a que los títulos ≥1:4 (humano) o ≥1:8 (conejo) indican protección inmunológica conferida de maner a secundaria a la vacuna
E xisten varias vacunas tetravalentes conjugadas disponibles en Colombia y en L atinoamérica:
• MenACW Y-D, vacuna conjugada con toxoide dif térico (Menactr a®);
• MenACW Y- CRM , conjugada con la proteína dif térica modif icada CRM197 (Menveo ®);
• MenACW Y-T T, que utiliza toxoide tet ánico (Nimenrix ®);
• MenACW Y-T T (MenQuadf i ®), próxima a llegar.
L a vacuna conjugada MenACW Y- D (Menactr a®) ha demostr ado ser inmunogénica en el r ango poblacional de 9 meses a 55 años, y se ha evidenciado una disminución de anticuerpos entre los 3 y 5 años posteriores a la vacunación primaria , por lo que la administr ación de una dosis de refuer zo en el adolescente induce una respuest a inmunit aria más potente.
las seis semanas de vida) y adolescentes sin límite de edad. El uso de toxoide tetánico como proteína transportadora le confiere una mayor estabilidad térmica y un área amplia de conjugación. Estudios clínicos de fases II y III (más de 20 investigaciones) han demostrado su inmunogenicidad en todos los grupos etarios, con títulos de anticuerpos en rangos protectores. Los datos poscomercialización evidencian la persistencia de anticuerpos por al menos 10 años, con una respuesta robusta a la dosis de refuerzo. Su perfil de seguridad es favorable, con reactogenicidad aceptable, y puede administrarse concomitantemente con otras vacunas.
L a vacuna MenQuadf i (MenACW Y-T T ) es una vacuna conjugada indicada para la prevención de la enfermedad meningocócica invasiva causada por los serogrupos A , C , W y Y. Tiene autoriz ación de la Administr ación de Alimentos y Medicamentos (FDA) para su uso en pacientes a par tir de los 12 meses de edad sin límite de edad, con un adecuado per f il de seguridad y ef icacia evaluado en ensayos clínicos. Los estudios de fase II y III demostraron su no inferioridad frente a otras vacunas meningocócicas cuadrivalentes en cuanto a par ámetros inmunológicos, mostr ando t asas de serorrespuest a compar ables par a los cuatro serogrupos incluidos
del 85% -10 0% contra los cuatro serogrupos en
Los estudios demuestran una eficacia protectora lact antes y adolescentes.
La vacuna MenACWY-CRM197 (Menveo®) está aprobada para la prevención de la enfermedad meningocócica en niños a partir de los dos meses de edad, adolescentes y adultos sin límite de edad de acuerdo con la indicación aprobada en Colombia, aun cuando existen datos limitados en individuos de edades entre 56 y 65 años. No existen datos para individuos mayores de 65 años. Está demostrado que puede administrarse de manera segura junto con otras vacunas, sin interacciones significativas. Además, ha mostrado respuestas inmunitarias adecuadas en todas las edades evaluadas.
L a vacuna MenACW Y-T T (Nimenrix ®) est á i n d i c ad a p a r a p o b l a c i ó n p e d i á t r i c a (d e s d e
El per f il de seguridad de todas est as vacunas es adecuado L as reacciones adversas locales más frecuentes incluyen dolor y eritema en el sitio de inyección; en cambio, los efectos sistémicos varían según la edad: en lact antes y niños predominan la somnolencia e irrit abilidad, mientr as que en adolescentes y adultos son más comunes las mialgias, cefalea y fatiga .
VACUNACIÓN POR VACUNOLOGÍ A
R EV E RSA PA R A SE ROGRUPO B
L as vacunas contr a el meningococo B emplean diversos componentes de la membrana externa, desarrollados mediante vacunología reversa aplicada al serogrupo B Este enfoque par tió d e l a se c u e nc i ac i ó n co m p l e t a d e l g e n o m a

P
bacteriano, que identif icó 60 0 posibles genes codif icantes de proteínas de super f icies amplif icadas por reacción en cadena de la polimer asa (PCR) y clonación en vectores de expresión de E scherichia coli, con más de 350 proteínas re co m bi n a n t e s p u r i f i c ad a s y ev a l u ad a s e n modelos murinos, y se seleccionaron aquellas que demostr aron expresión en la super f icie y capacidad de inducir anticuerpos bactericidas Los antígenos f inalmente seleccionados como más promisorios fueron:
• N adA (adhesión neisserial A),
• f Hbp (proteína de unión al factor H),
• N HBA (antígeno de unión a heparina de Neisseria).
E xisten 2 vacunas:
• Vacuna MenB - 4C (Bexsero ®),
• Vacuna MenB -f Hbp ( Trumenba ®)
L a Vacuna MenB - 4C (Bexsero®) est á aprobada en población pediátrica desde los dos meses de edad, con diferentes esquemas:
• Esquema de tres dosis antes de los 2 años;
• Esquema de dos dosis después de los 2 años
Cada dosis de 0, 5 mL contiene 50 µg de tres antígenos proteicos clave, los cuales son NadA , NHBA y f Hbp.
Estudios clínicos han demostrado que induce una respuesta inmunitaria efectiva y muestra un perfil de seguridad adecuado para la población pediátrica y compatibilidad con otras vacunas, además de que su administración no tiene límite de edad de acuerdo con la indicación aprobada en Colombia, aún si la seguridad y eficacia de su administración en individuos mayores de 50 años no ha sido establecida.

L a vacuna MenB -f Hbp ( Trumenba ®), por el momento no disponible en Colombia , es una
vacuna recombinante bivalente que represent a un avance único en la protección contr a el meningococo B , al dirigirse específ icamente a ambas subfamilias (A y B) de la proteína de unión al factor H (f Hbp). L a selección de este antígeno como blanco se fundament a en su presencia en más del 99% de las cepas de N. meningitidis B y su papel clave en la evasión de la respuest a inmunit aria del hospedero. Est á autoriz ada par a su uso en población mayor o igual a 10 años y sin límite de edad, y su ef icacia se ha est ablecido mediante estudios que demuestr an la inducción de anticuerpos bactericidas contra cuatro cepas representativas del serogrupo B .
E xisten t ambién en el mundo vacunas pent av ale nte s (A BCY W ) cont r a me ningococo, que represent an un impor t ante avance en la prevención de la EMI En 2023, la FDA aprobó Penbr aya®, que se convir tió en la primer a vacuna pent avalente indicada específ icamente par a la población de 10 a 25 años Penbr aya® combina estr atégicamente los componentes d e d o s v a c u na s p rev i a m e n t e e s t a b l e c i d a s : Trumenba ® y Nimenrix ® E st a combinación permite una cober tur a más amplia y complet a en compar ación con las vacunas tr adicionales disponibles. Est a vacuna por el momento no est á disponible en Colombia .
El esquema de vacunación recomendado consiste en la administr ación de dos dosis, con un inter valo de seis meses entre dosis simplif icando la implement ación en los progr amas de inmuniz ación y mejor ando la adherencia vacunal.
La vacuna MenFive™ no está disponible en todo el mundo, es una vacuna conjugada que proporciona protección contra cinco serogrupos meningocócicos (A , C, Y, W y X), y se destaca como la primera en incluir el serogrupo X, una causa emergente en África subsahariana La OMS concedió su preaprobación en julio de 2023, reconociendo su potencial para abordar las necesidades de salud pública en regiones afectadas
Las vacunas meningocócicas conjugadas ofrecen una adecuada cober tur a par a todos los grupos et arios con esquemas ad apt ados a la epidemiología local, entendiendo que la vacunación debe ser una estr ategia disponible par a tod as las edades L a estr ategia de vacunación óptima combina protección tempr ana en lac t antes , dado que son la población de mayor incidencia , el refuer zo de la vacunación en adolescentes y ad ul t os p ar a se rogr u pos AC Y W, lo cu al t ambién cobr a relevancia porque elimina el est ado de por t ación nasof arínge a y un efec to rebaño, e indud ablemente la vacunación en el adulto mayor de 60 años , que cuent a con una incidencia elevad a y mayor riesgo de morbimor t alid ad. Al consider ar que el serogrupo B representa un serogrupo frecuente en Colombia , t ambién se recomiend a el uso de vacuna re co m b i n a n t e p a r a a se g ur a r l a p ro t e cc ió n frente a este serogrupo
De forma rutinaria se deben indicar vacunas fre nt e a me ningo co co p ar a indiv id uos considerados de alto riesgo, como:
1 Asplenia anatómica o funcional, incluida la anemia de células falciformes.
2 . 3 4. 5.
Inmunodeficiencias o errores innatos de la inmunidad, que incluye deficiencias del complemento, properdina, factor D, inmunodeficiencias de células T y B combinadas o déficit primario de producción de anticuerpos. Usuarios crónicos de inhibidores de C5-a como eculizumab (Soliris ® ) o ravulizumab (Ultomiris ® ).
Pacientes viviendo con el virus de la inmunodeficiencia humana (VIH).
Personal de laboratorio que tiene exposición continua a N. meningitidis
Estos pacientes descritos en los puntos 1 a 4 se consideran de alto riesgo. Los acuerdos de
las sociedades científicas recomiendan considerar la revacunación cada 3 a 5 años con vacunas conjugadas tetravalentes
ACYW de acuerdo con la edad de inicio del esquema inicial, de la siguiente manera:
1 dosis cada 3 años en quienes reciben su esquema primario antes de los 7 años.
1 dosis cada 5 años en quienes reciben su esquema primario después de los 7 años.
Otras condiciones que aumentan el riesgo de infección por meningococo donde se debe priorizar su prescripción, pero que no tienen evidencia a la fecha de la necesidad de revacunación o refuerzos, son:
Pacientes oncológicos, postrasplante
Pacientes con implante coclear
Fístula de LCR
Uso de terapias inmunosupresoras
Enfermedad renal crónica
Diabetes mellitus
Cardiopatías
Prematuridad (< 37 semanas), cuya administración se debe garantizar de acuerdo con la edad cronológica
Los progr ama s n acion ale s de inmuniz ación (PNI) deben consider ar la incidencia local par a la toma de decisiones:
• En áreas con > 10 casos/10 0 00 0 habit antes se recomienda la vacunación masiva universal
• Entre 2 y 10 casos/10 0 00 0 habit antes, las campañas selectivas por edad o región que incluyan población de riesgo
• Con < 2 casos/10 0 00 0 habit antes, un enfoque centr ado en grupos de riesgo como i n m u n o d e f i c i e nc i a s , a s p l e n i a , p a c i e n t e s con ter apias anticomplemento, viajeros a zonas endémicas y personal de labor atorio expuesto.
En Colombia, en el contexto de brotes, se encuentra indicado el uso de la vacuna de meningococo MenACWY-CRM, conjugada con la proteína diftérica modificada CRM197 (Menveo®)

en la población objeto descrita en el lineamiento desde el 2016. Los esquemas de vacunación sugeridos, que también se pueden consultar en la
página de la Sociedad Colombiana de Pediatría (SCP) (https://scp.com.co/calendario-vacunal-scp/) se encuentran en la Tabla 1.
Tabla 1. Esquemas de vacunación recomendados por la SCP, calendarios vacunales de 2025
Vacuna Edad mínima y máxima
MenACWYTT que utiliza toxoide tetánico (Nimenrix®)
6 semanas sin límite de edad
Primovacunación (esquema primario) + refuerzo (si aplica): las dosis varían de acuerdo con la edad de inicio
6 semanas a 6 meses: esquema de 3 de dosis (2 + 1)
7 a 11 meses: esquema de 2 dosis (1 + 1)
Esquema sugerido
2 a 4 y 12 meses
Esquema de 2 dosis, la segunda dosis debe ser dos meses después de la primera y administrada en el segundo año de vida.
Refuerzo en personas con factor de riesgo*
MenACWYCRM197 (Menveo®)
Desde los 2 meses sin límite de edad**
MenACWY-TT (MenQuadfi®)
MenACWY-D (Menactra®)
Desde los 12
≥ 1 año: esquema de 1 dosis única
2 a 6 meses: esquema de 3 dosis
7 a 23 meses: esquema de 2 dosis
≥ 2 años: esquema de 1 dosis
A partir de los 12 meses: 1 dosis única
1 dosis única.
2 a 4 y 12 meses
Esquema de 2 dosis, la segunda dosis debe ser dos meses después de la primera y administrada en el segundo año de vida.
1 dosis única
1 dosis única meses sin límite de edad**
Desde los 9 meses hasta los 55 años**
Vacuna MenB4C (Bexsero®)

Desde los 2 meses sin límite de edad**
De 9 a 23 meses: esquema de 2 dosis (1 + 1)
De 2 a 55 años: esquema de 1 dosis
< 2 años: 3 dosis (2 + 1)
9 y 12 meses (mínimo 3 meses de primera dosis)
1 dosis única
Luego de completar el esquema primario con vacunas conjugadas, la postura de las sociedades científicas es aplicar el primer refuerzo a los 3 años si la persona tenía <7 años en ese momento, y a los 5 años si tenía ≥7 años, y luego cada 5 años (ver referencias en el texto).
Iniciar en los meses 2, 4 y 12 o iniciar en los meses 3, 5 y 13
No hay evidencia a la fecha que se requiera* > 2 años: 2 dosis (1 + 1)
*Factores de riesgo: asplenia funcional o anatómica, uso de inhibidores de C5-a (eculizumab/ravulizumab), personal de laboratorio que tiene exposición continua a N. meningitidis, errores innatos de la inmunidad. **Los datos de eficacia y seguridad por encima de los 50 años son limitados, y para mayores de 65 años o son limitados o no existen para algunas de las vacunas conjugadas ACYW y recombinante B. Adaptada de: Sociedad Colombiana de Pediatría (SCP). Calendario vacunal SCP. Disponible en: https://scp.com.co/calendariovacunal-scp/
1 B orrow R , Alarcón P, Carlos J , Caug ant DA , Christensen H , Debbag R , et al The Global Meningococcal Initiative: global epidemiolog y, the impact of vaccines on meningococcal dise ase and the impor t ance of herd protection E xper t Rev Vaccines 2017;16(4):313 -28 doi :10 10 8 0/1476058 4 2017 125830 8
2 Cast añeda Car vajalino AC , Forest Duque B N , Ojeda Jur ado CE , B ocanegr a Cer ver a CL , Palacios Gonz ález J , Corr al Castillo J , et al Lineamientos par a el abordaje integr al de brotes de enfermedad meningocócica en el contexto de la atención integr al en salud [Internet] Colombia: Ministerio de S alud; 2016 [consult ado el 28 de mar zo de 2024]. Disponible en: ht t ps: //w w w. minsalud.gov.co/sites/rid/Lists/B ibliotecaDigit al/RIDE / VS/PP/PAI/lineamientos-enfermedad-meningococica.pdf
3 Centers of Disease and Control. Meningococcal vaccine recommendations [Internet]. CDC; 2025. Disponible en: https://www.cdc.gov/meningococcal/hcp/vaccine-recommendations/index.html
4 5 Collins JP, Crowe SJ, Ortega-Sanchez IR, Bahta L, Campos-Outcalt D, Loehr J, et al. Use of the Pfizer Pentavalent Meningococcal Vaccine Among Persons Aged ≥10 Years: Recommendations of the Advisory Committee on Immunization Practices - United States, 2023. MMWR Morb Mortal Wkly Rep. 2024;73 (15):345 350. doi: 10.15585/mmwr.mm7315a4.
Department of Health and Aged Care. Table. Recommendations for MenACWY vaccine for people with a specified medical condition that increases their risk of invasive meningococcal disease [Internet]. Australia: Department of Health and Aged Care; 2022. Disponible en: https://immunisationhandbook.health.gov.au/resources/tables/table-recommendatio ns-for-menacwy-vaccine-for-people-with-a-specifiedmedical-condition-that-increases-their-risk-of-invasiv e-meningococcal-disease
e m a e uro p a e u /e n /d ocume nt s /prod uc t - infor m at ion / bexsero - epar- product-information _en pdf
7 Europe an Medicines A gency Nimenrix powder and solvent for solution for injection in pre -f illed syringe Meningococcal groups A , C , W-135 and Y conjug ate vaccine [Internet] E MA ; 2024 [consult ado el 28 de m ar zo d e 2 024] D i s po ni b le e n: h t t p s: // ww w em a
e u r o p a e u / e n / d o c u m e n t s / p r o d u c t - in f o r m a t i o n / nimenrix- epar- product-information en pdf
8 E u r o p e a n M ed i c i n e s A g e n c y Tr u m e n b a s u s -
p e n s i o n f o r i n j e c t i o n i n p r e - f i l
d s y r i n g e M e n i n g o c o c c a l g r o u p B v ac c i n e (r e c o m bi n a n t , adsorbed) [Internet] E MA ; 2023 [consult ado el 28 d e m a r z o d e 2 0 24] Di s p o n i b l e e n : h t t p s : // ww w e m a e uro p a e u /e n /d ocume nt s /prod uc t - infor m at ion / trumenba- epar- product-information _en pdf
9 F i n d l ow J , K n u f M I m m u n o g e n i c i t y a n d s a f e t y o f meningococcal group A , C , W and Y tet anus toxoid conjug ate vaccine: review of clinical and re al -world evidence . Future Microbiol. 2019;14( 7 ):563 - 8 0. doi: 10. 2217/fmb -2018 - 0343.
10 Gla xoSmithKline Highlights of prescribing information B exsero [Internet] FDA gov; 2024 [consult ado el 28 de mar zo de 2024] Disponible en: ht t ps: //w w w fda gov/media /9 0996/download
11 Harrison LH Epidemiological prof ile of meningococcal dise ase in the United St ates Clin Infect Dis 2010 ;50 Suppl 2(S2):S37- 4 4 doi: 10 10 8 6/6 4 8963
12 Harrison LH Prospects for vaccine prevention of meningococcal infection Clin Microbiol Rev 20 06;19(1):1426 4 doi: 10 1128/cmr 19 1 142-16 4 20 0 6
13 Kimberlin DW S panish Red B ook 2018: informe del comité de enfermedades infecciosas 2018 -2021 31 a edición American Academy of Pediatrics; 2018
n t , adsorbed) [Internet] E MA ; 2023 [consult ado el 28 d e m a r z o d e 2 0 24] Di s p o n i b l e e n : h t t p s : // ww w
14 M asignani V, Piz z a M , Moxon ER The development of a vaccine ag ainst meningococcus B using reverse