FACULTAD DE POSGRADO
MAESTRÍA EN EDUCACIÓN DE BACHILLERATO
MENCIÓN CIENCIAS NATURALES
ASIGNATURA:
EVALUACIÒN PARA EL APRENDIZAJE
TEMA:
ELABORACIÒN DE UN LIBRO
DIGITAL (EBOOK)
AUTOR:
GUANANGA PUJOS PAOLA ELEVACIÒN
DOCENTE:
MSc. DARWIN ARMANDO AGUALSACA CALLE
MILAGRO - ECUADOR
AÑO LECTIVO: 2024 -2025
2.- Análisis de contenidos
1ero. BGU Biología
• Glúcidos.
• Monosacáridos
• Realizar la evaluación en la plataforma digital Quizizz
2do. BGU Biología
• El ADN
• Introducción genética Molecular
• Realizar la evaluación en la plataforma Froggy Jumps
1ero. BGU Química
• Sistemas dispersos
• Soluciones o disoluciones.
• Realizar la evaluación de base estructurada.
3ero. BGU Química
• Alcoholes
• Fenoles
• Realizar la evaluación de base estructurada.
OBJETIVOS
O.CN.Q.5.9. Reconocer diversos tipos de sistemas dispersos según el estado de agregación de sus componentes y el tamaño de las partículas de su fase dispersa, sus propiedades y aplicaciones tecnológicas y reparar diversos tipos de disoluciones de concentraciones conocidas en un entorno de trabajo colaborativo utilizando todos los recursos físicos e intelectuales disponibles.
O.CN.B.5.2 Desarrollar la curiosidad intelectual para comprender los principales conceptos, modelos, teorías y leyes relacionadas con los sistemas biológicos a diferentes escalas, desde los procesos subcelulares hasta la dinámica de los ecosistemas, y los procesos por los cuales los seres vivos persisten y cambian a lo largo del tiempo, para actuar con respeto hacia nosotros y la naturaleza.
Destrezas con criterio Desempeño.
CN.Q.5.1.6 Examinar y clasificar las características de los distintos tipos de sistemasdispersos según el estado de agregación de sus componentes y el tamaño de las partículas de la fase dispersa.
CN.Q.5.3.10. Examinar y explicar la importancia de los alcoholes, aldehídos, cetonas y éteres en la industria, en la medicina y la vida diaria (solventes como la acetona, el alcohol, algunos éteres como antisépticos como el peligro de su empleo no apropiado (incidencia del alcohol en la química cerebral, muerte por ingestión del alcohol metílico).
CN.B.5.1.11. Usar modelos y describir la función del ADN como portador de la información genética que controla las características de los organismos y la transmisión de la herencia, y relacionar el ADN con los cromosomas y los genes.
CN.B.5.1.5. Usar modelos y describir la estructura, diversidad y función de las biomoléculas que constituyen la materia viva, y experimentar con procedimientos sencillos.
INTRODUCCION
En la era digital, los libros electrónicos, o ebooks, han revolucionado la forma en que las personas acceden y consumen información. La posibilidad de llevar consigo una biblioteca completa en un dispositivo portátil ha transformado la experiencia de la lectura, ofreciendo ventajas como la accesibilidad, el ahorro de recursos y la capacidad de personalización.
El presente trabajo tiene como objetivo documentar el proceso de elaboración de un libro digital, abordando cada una de las etapas fundamentales, en la realización de este libro digital se exploraron herramientas tecnológicas, estrategias de diseño necesarios para garantizar una experiencia de lectura atractiva y funcional para el usuario, sino que también reforzó la importancia de la creatividad, la planificación y el compromiso en el desarrollo de un producto que responda a las expectativas del lector.
3.- Analiza los contenidos relacionados con el tema seleccionado, identifica conceptos claves (conceptuales) y procedimientos específicos (procedimentales) que los estudiantes deben comprender y aplicar.
1ero Bachillerato
Asignatura: Biología
Biomoléculas orgánicas. Glúcidos.
Los glúcidos, también conocidos como carbohidratos o hidratos de carbono, son biomoléculas formadas principalmente por carbono, hidrógeno y oxígeno. Constituyente de las principales fuentes de energía para los seres vivos y tienen funciones diversas biológicas.
Importancia
• Los glúcidos deben representar entre el 45% y el 65% del aporte calórico total.
• Las principales fuentes son cereales, frutas, verduras, legumbres y productos lácteos.
CLASIFICACIÒN DE LOS GLÙCIDOS
.
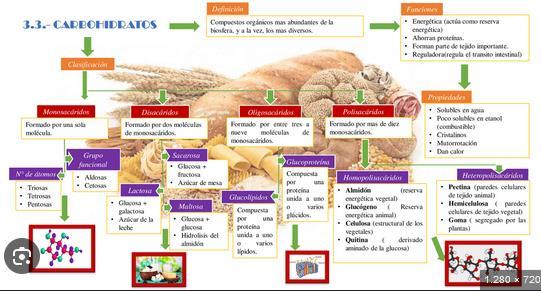
Funciones de los Glúcidos
1. Energética:
o Los glúcidos son la principal fuente de energía rápida para el organismo.
o Cada gramo proporciona 4 kcal.
o La glucosa es el combustible principal para el cerebro y los músculos.
2. Reserva:
o En forma de glucógeno en animales y almidón en plantas.
3. Estructural:
o La celulosa en plantas y la quitina en animales que se desempeñan funciones estructurales.
4. Señalización y reconocimiento celular:
o Forman parte de glucoproteínas y glucolípidos, esenciales para procesos de comunicación celular.
5. Precursores de otras moléculas:
o Sirven como base para la síntesis de nucleótidos, ácidos nucleicos y algunas vitaminas.
Digestión y metabolismo
• La digestión de los glúcidos comienza en la boca con la amilasa salival y continúa en el intestino delgado con enzimas como la maltasa, lactasa y sacarasa.
• Los monosacáridos se res absorben en el intestino y se transportan al hígado, donde se metabolizan para obtener (a través de la glucólisis) o se sisa como glucógeno.
Monosacáridos
Son glúcidos más simples también conocidos como azúcares simples, son la base estructural de carbohidratos más complejos como disacáridos, oligosacáridos y polisacáridos. Son la unidad fundamental de los carbohidratos y funciones esenciales en los seres vivos.
Características Principales
Fórmula general:
(CH2On ) (Donde n es el número de carbonos). Ejemplo una Triosa
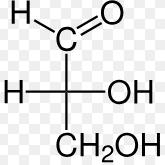
Tipos según el grupo funcional:
o Aldosas: Contienen un grupo aldehído (-CHO). Ejemplo: glucosa.

o Cetonas: Contienen un grupo cetona (-CO-). Ejemplo: fructosa.

Número de carbonos:
Triosas (3C): Gliceraldehído
Formula Química: C3H6O3
Pentosas (5C): Ribosa, desoxirribosa.
Fórmula Química: C5H10O5

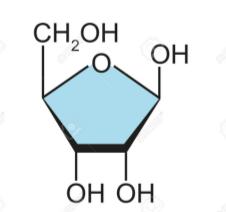
Hexosas (6C): Galactosa.
Fórmula Química: C6H12O6
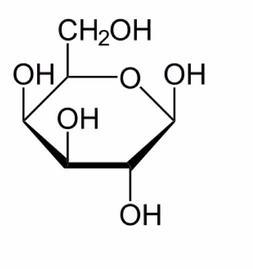
Monosacáridos más comunes.
1. Glucosa: Principal fuente de energía en el metabolismo.
2. Fructosa: Azúcar más dulce, presente en frutas y miel.
3. Galactosa: Forma parte de la lactosa.
4. Ribosa y Desoxirribosa: Componentes de ARN y ADN, respectivamente.
Importancia Biológica y Nutricional
• Son esenciales para funciones celulares como la obtención de energía (glucosa).
• Absorbidos en el intestino.
• Alteraciones en su metabolismo, como la galactosemia o intolerancia a la fructosa, afectan la salud.
El monosacárido más representativo es la glucosa, formado por seis átomos de carbono y es utilizado como fuente de energía básica por muchos seres vivos es el monosacárido más abundante en la naturaleza y se encuentra en la fruta y en la miel y otros monosacáridos son importantes son la ribosa, la fructosa o la galactosa.
Instrumentos Digitales Herramientas Tecnológicas
Link de la evaluación digital
https://quizizz.com/join/quiz/67954d0d01477dad3b29b14a/start?studentShare=true
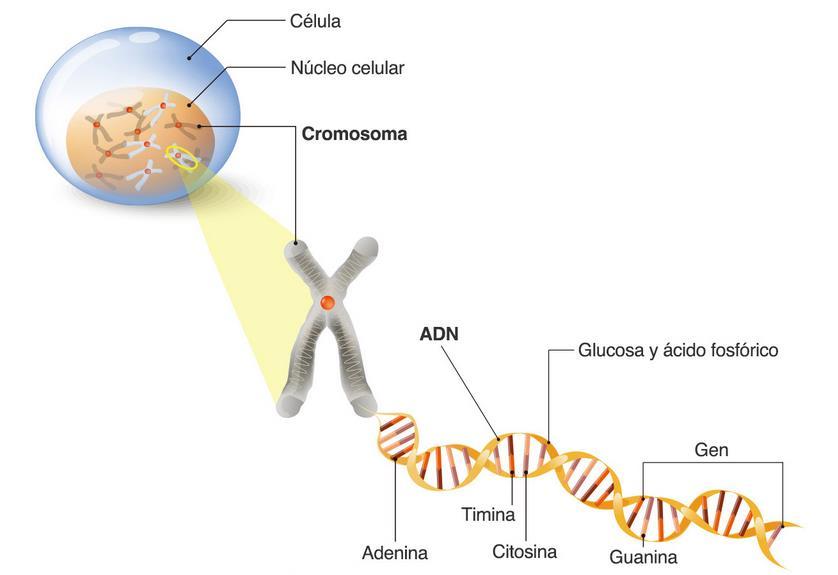
ADN como base de la vida
ADN
El ácido desoxirribonucleico (ADN) es considerado la molécula fundamental para la vida en la Tierra debido a su papel como portador de la información genética. Esta teoría se basa en su capacidad para almacenar, transmitir y determina las características y las funciones de los organismos vivos.
Base de la teoría del ADN como base de la vida.
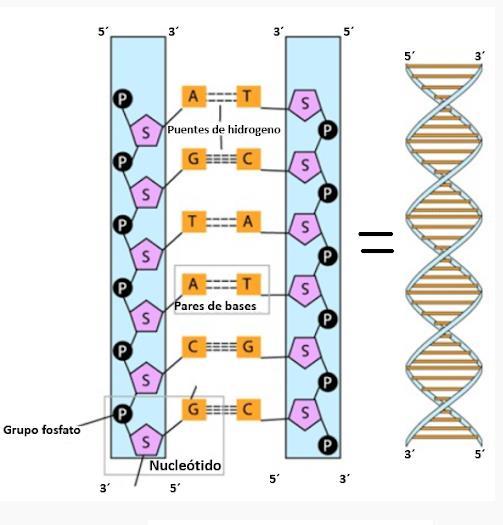
Estructura única del ADN
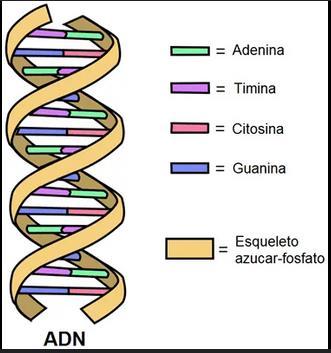
• El ADN tiene una estructura de doble hélice, descubierta por Watson y Crick en 1953.
• Está compuesto por: una columna vertebral de fosfato y desoxirribosa, bases nitrogenadas emparejadas: adenina (A) con timina (T) y guanina (G) con citosina (C).
• Formula química: C5H6N2O2
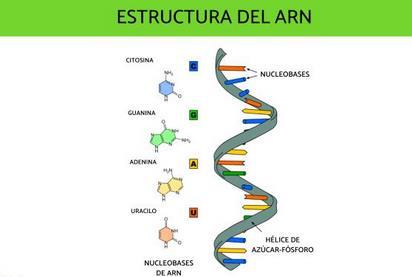
Estructura del ARN:
• Cadena simple de nucleótidos.
• Su azúcar es la ribosa y contiene uracilo en lugar de timina.
Capacidad de información
• El ADN contiene las instrucciones necesarias para la síntesis de proteínas, que son esenciales para la estructura y función celular.
• La información genética está organizada en genes, que codifican proteínas específicas.
Replicación precisa
• Antes de que una célula se divida, el ADN se replica con gran precisión, asegurando que sea en la célula que se veía una copia idéntica.
• La replicaciónse basa en el apareamientocomplementario de las bases (A con T,G con C).
Expresión genética.
• El ADN dirige la síntesis de proteínas a través de dos procesos fundamentales:
➢ Transcripción. -El ADN se copia en ARN mensajero (ARNm).
➢ Traducción. - El ARNm se utiliza para ensamblar aminoácidos en proteínas.
Capacidad para mutar y evolucionar
• El ADN puede sufrir mutaciones (cambios en su secuencia).
• Estas mutaciones son la base de la variación genética, permitiendo la evolución de las especies a través de la selección natural.
ADN Función
• Los análisis químicos del ADN obtenidos de levaduras, bacterias y médula ósea, demostraron que las unidades del fosfato y la desoxirribosa se encuentran, aproximadamente siempre en la misma proporción. Además, aunque la proporción de las bases nitrogenadas sea diferente en cada organismo vivo analizado, ciertos pares se encuentran siempre en proporciones aproximadamente iguales A-T y G-C
Experimentos de Frederick Griffith (1928)
Los experimentos de Frederick Griffith marcaron un hito en la biología molecular, ya que fueron los primeros en sugerir la existencia de un "principio transformante" que puede transferir características genéticas de una célula a otra. Aunque Griffith no identificó el ADN como el material genético, su trabajo envió las bases para descubrimientos posteriores.
• En otros experimentos, Griffith observó que los ratoncillos inyectados con una cantidad pequeña del cultivo R (serotipo II), junto con un inóculo grande de la cepa L (serotipo III), previamente inactivada por calor, morían frecuentemente por la infección. Sin embargo, en la sangre obtenida por punción cardíaca de los animales moribundos se recuperaba sólo el neumococo tipo L en cultivo puro. Eso le hizo pensar que no todas las células de la cepa L habían muerto, y fue necesario repetir el experimento. Después de haber obtenido el mismo resultado, concluyó que las bacterias muertas L, habían conservado cierta capacidad para transmitir su aptitud de producir cápsulas-viscosas, y esa capacidad transformadora se transmitió a los descendientes de la cepa R. Algún tipo de información o sustancia química procedente de células L, muertas, literalmente "transformaba" las bacterias R, haciéndolas virulentas y generadoras de cápsulas.
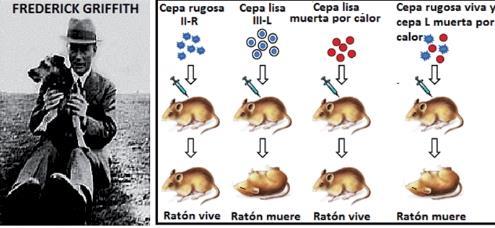
Las conclusiones de Griffith fueron sorprendentes, otros investigadores confirmaron los mismos resultados, y no pasó mucho tiempo para que los resultados de Griffith hubiesen sido replicados in vitro, o sea, fuera del cuerpo del animal. Evidentemente, alguna sustancia presente en las bacterias muertas actuaba como un regulador potente de las células bacterianas vivas.
2.-Introduccion genética Molecular.
La información del ADN esta codificada en la secuencia de sus bases nitrogenadas. Esta información fluye y se transmite en dos sentidos diferentes.
• A partir del ADN se obtienen nuevas moléculas de ADN por Replicación y Transcripción.
• Replicación durante la división celular, las células hijas reciben una copia de la información genética de la madre, por lo que es necesario que en la célula madre se sinteticen dos copias exactas de su ADN, a este evento se le conoce como la replicación celular.
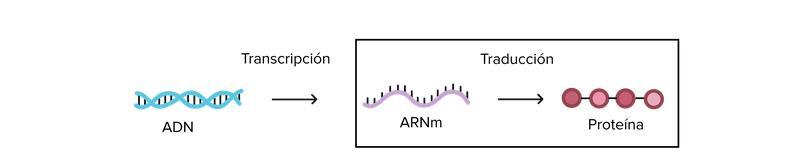
• Transcripción es el primer paso de la expresión génica, el proceso por el cual la información de un gen seutiliza para generarun productofuncional,como una proteína. El objetivo de la transcripción es producir una copia de ARN de la secuencia de ADN
de un gen. Enel caso de los genes codificantes, la copia de ARN, o transcrito,contiene la información necesaria para generar un polipéptido (una proteína o la subunidad de una proteína). Los transcritos eucariontes necesitan someterse a algunos pasos de procesamiento antes de traducirse en proteínas.
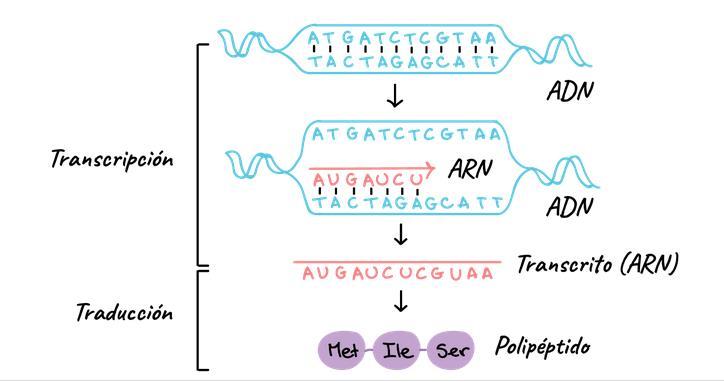
• Traducción. - En esta etapa el ARNm se "decodifica" para construir una proteína (o un pedazo/subunidad de una proteína) que contiene una serie de aminoácidos en específico.
Conceptos en Genética Molecular
• Material Genético. - El ADN (ácido desoxirribonucleico) es la principal molécula que almacena la informacióngenética encasi todos los organismos vivos. Enalgunos virus, el ARN (ácido ribonucleico) actúa como material genético.
• Gen.-Es una unidad de información hereditaria formada por una secuencia específica de nucleótidos en el ADN. Contiene las instrucciones para la síntesis de proteínas y moléculas funcionales.
• Código Genético. - Es el conjunto de reglas que se relacionan la secuencia de nucleótidos en el ADN o ARN con la secuencia de aminoácidos en las proteínas. Es universal para la mayoría de los organismos, lo que sugiere un origencomún de la vida.
• Expresión Génica. - Implica dos procesos principales: Transcripción el ADN se transcribe en ARN mensajero (ARNm), Traducción el ARNm dirige la síntesis de proteínas en los ribosomas.
• Mutación. - Uncambio en la secuencia denucleótidosdel ADN. Puede serbeneficiosa, perjudicial o neutra, dependiendo de su impacto en la función génica.
Instrumentos Digitales Herramientas Tecnológicas
Link ingreso a la evaluación
https://es.educaplay.com/recursoseducativos/22132991adn_como_base_de_la_vida.html

Química de disoluciones y sistemas dispersos.
Sistemas dispersos
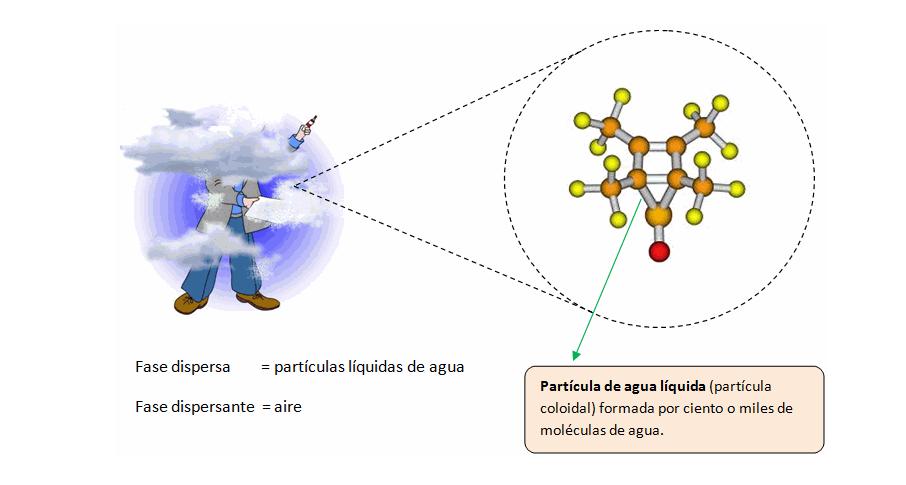
Los sistemas dispersos son mezclas de dos o más sustancias en las que existe una fase dispersa y una fase dispersante que, generalmente, interviene en mayor proporción. Pueden ser de dos tipos: heterogéneos y homogéneos; en este último es importante medir la concentración.
Son mezclas formadas por dos o más componentes, donde una sustancia (fase dispersa) se distribuye en otra sustancia (fase dispersante o continua). Estos sistemas pueden variar en sus propiedades físicas y químicas dependiendo del tamaño de las partículas de la fase dispersa y su interacción con la fase dispersante.
Materia
La materia es todo lo que ocupa un espacio y posee masa, forma, peso y volumen por lo tanto es observable y medible.
Clasificación de la materia

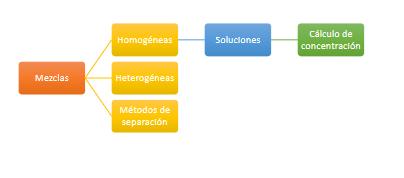
Sustancias Puras.
Las sustancias puras están formadas por uno o varios componentes que presentan un aspecto homogéneo. Si solo existe un componente, de manera exclusiva son los llamados elementos químicos (carbono, oro, nitrógeno, calcio, azufre, etc.) y si en cambio existen varios componentes, son los llamados compuestos químicos
Mezcla
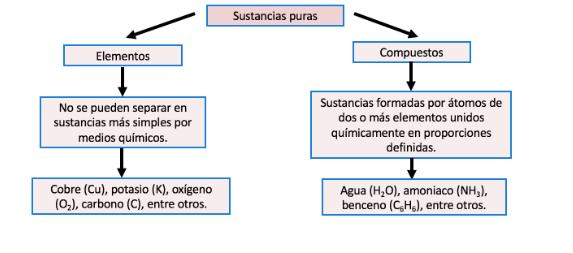
Una mezcla se define como la unión física de dos o más sustancias en proporciones variables, que a pesar de estar unidas conservan sus propiedades originales. Las mezclas se clasifican en función del número de fases que se presentan en ellas. Cuando el resultado de la mezcla presenta una sola fase, es decir, a los ojos del ser humano sólo es visible una fase, ya que su apariencia es uniforme, será una mezcla homogénea. El aire, el bronce y el suero, son ejemplos de mezclas homogéneas. Por el contrario, si al efectuarse la mezcla se distinguen los diversos componentes, son visibles dos o más fases, no es uniforme su composición ni en sus propiedades tenemos una mezcla heterogénea, como la que puede observarse cuando mezclamos arena con agua del mar.
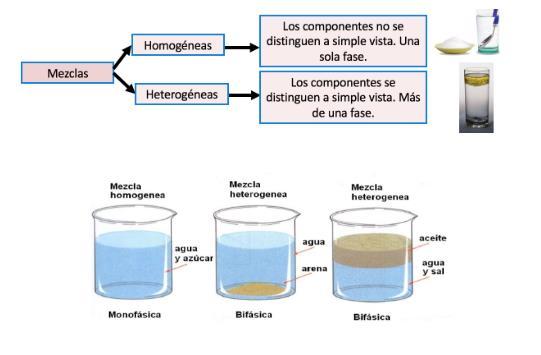
Sistemas dispersos: Soluciones, suspensiones y coloides. Los sistemas dispersos o dispersiones son una mezcla de dos o más sustancias que se produce cuando una sustancia se distribuye en el seno de otra u otras. En un sistema disperso se definen dos fases: una dispersa y otra dispersante. Se denomina fase dispersa a aquella que se encuentra distribuida en el seno de otra, esta otra recibe a su vez el nombre de fase dispersante. Los sistemas dispersos pueden clasificarse en tres tipos: soluciones, coloides y suspensiones. El tamaño de la partícula de la fase dispersa es el criterio que se utiliza para efectuar la clasificación.

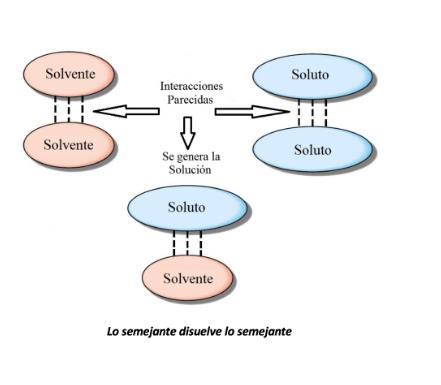
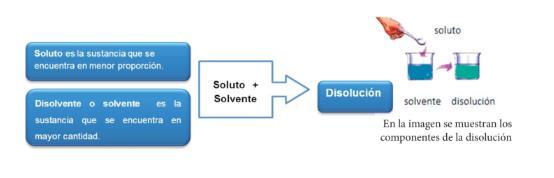
Soluciones
Una solución es una mezcla homogénea de dos o más sustancias en una sola fase. Al ser una mezcla homogénea indica que a simple vista no se distinguen sus componentes y el que presente una sola fase indica que, dependiendo del estado de agregación de la fase dispersora, la solución será líquida, sólida o gaseosa.
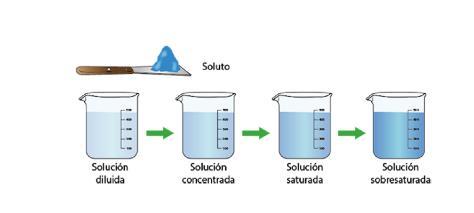
La siguiente imagen nos muestra el proceso de disolución:
Coloides. - Cuando el tamaño de la partícula que constituye la fase dispersa tiene un tamaño mayor al molecular, pero no excede 10,000 veces este tamaño; es decir, que no es mayor de 200 μ, tenemos un coloide.
Suspensiones
En una suspensión las partículas de la fase dispersa son mayores que en las disoluciones y en los coloides. Aproximadamente, el tamaño de una partícula en 62 suspensión va de las 10000 veces el tamaño molecular en adelante, lo cual equivale a tener un tamaño próximo, igual o superior a 200 mμ. En consecuencia, en una suspensión es fácil a simple vista distinguir las partículas que constituyen la fase dispersa y si se dejan reposar por tiempo suficiente llegan a asentarse en el fondo del recipiente por la acción de la gravedad. Las suspensiones son las mezclas heterogéneas más comunes, en ocasiones son conocidas como emulsiones porque se mezclan dos líquidos inmiscibles
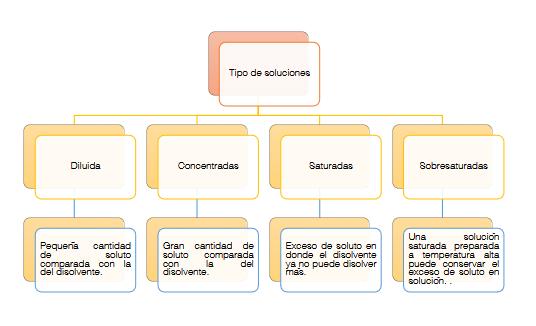
Concentración de soluciones se le llama concentración a la cantidad de soluto disuelto en una cantidad dada de disolución. Tomando en cuenta la cantidad de soluto en un disolvente, las disoluciones se pueden clasificar como cualitativas y cuantitativas. Las cualitativas se consideran soluciones empíricas y se clasifican en soluciones diluidas, concentradas, saturadas y sobresaturadas.
INSTRUMENTO PARA APLICAR EN EL AULA

➢ DATOS INFORMATIVOS:
ESTUDIANTE:
ASIGNATURA: QUIMICA
UNIDAD EDUCATIVA “PIO LÒPEZ”
CÓDIGO AMIE: 18H00313
COORDINACIÓN ZONAL: 3
DISTRITO: 18D02
RESOLUCIÓN: 900-CZE3-2013
CIRCUITO: 18D02C10 email: 18h00313@gmail.com
SANTA ROSA AMBATO ECUADOR
INSTRUMENTO DE EVALUACIÓN DE SEGUNDO TRIMESTRE 2024 – 2025
Aprobado por junta de coordinadores 25/01/2025
DOCENTE: Ing. Paola Guananga
GRADO O CURSO Y PARALELO: PRIMERO
JORNADA: MATUTINA
➢ INSTRUCCIONES:
• Lea detenidamente cada pregunta antes de contestar.
• No se aceptan tachones ni enmendaduras.
➢ OBJETIVO:
CALIFICACIÓN
PARALELO: A - B
FECHA:
•Determinar el nivel de logro alcanzado en el rendimiento académico de los estudiantes, durante el proceso de enseñanza aprendizaje correspondiente al segundo trimestre, mediante la aplicación del instrumento de evaluación.
➢ INDICADOR DE EVALUACIÓN:
• CN.Q.5.7.1. I.CN.Q.5.13.2
➢ CUESTIONARIO DE BASE ESTRUCTURADA
I. BLOQUE DE VERDADERO O FALSO. 1 PUNTO
1.- Instrucción. - Escriba VERDADERO O FALSO según corresponda. SI es falso escriba la respuesta correcta. (Cada literal VALE 0,25 punto s) VALE 1 PUNTO
a. Los sistemas dispersos son mezclas de dos o más sustancias …………….
b. En los sistemas dispersos existen dos fases que son dispersa y dispersante. …………..
c. Estos sistemas tienen propiedades físicas y químicas que son totalmente iguales.
d. La materia es todo lo que ocupa un espacio y posee masa, forma, peso y volumen por lo tanto es observable y medible ………………
II.- BLOQUE DE SELECCIÓN. - (CADA PREGUNTA BIEN CONTESTADA VALE 1 PUNTO ). TOTAL, Vale 3 puntos
2.- Instrucción. - Pintar el círculo que corresponde a la respuesta correcta. (cada literal vale 0,5 puntos). VALE 1 PUNTO
a) ¿Cuál de las siguientes opciones corresponde a un sistema disperso coloidal?
Aire
Gelatina
Agua destilada
Sal en estado sólido
Oxido metálico
b) ¿Una solución está formada por ?:
Mezcla homogénea de dos o más sustancias
Enlace Covalente
Una sustancia
Gaseosa
Varias sustancias
3.- Instrucción. - Pintar el círculo que corresponde a la respuesta correcta respecto al tamaño de partículas de los sistemas dispersos (cada literal vale 0,5 puntos). VALE 1 PUNTO
Coloides
20.000 veces al tamaño molecular
50.000 veces al tamaño molecular
15.000 veces al tamaño molecular
10.000 veces al tamaño molecular
30.000 veces al tamaño molecular
Diluida
Gran cantidad de soluto comparada con la del disolvente.
Mínima cantidad de soluto comparada con la del disolvente.
Cantidad de soluto comparada con la del disolvente.
Escasa cantidad de soluto comparada con la del disolvente.
Pequeña cantidad de soluto comparada con la del disolvente.
4.- Instrucción. - Completa las oraciones con la palabra o frase correcta. Valor 1 punto
En una disolución, él __________ es la sustancia que se disuelve en el solvente.
Los coloides tienen partículas con un tamaño entre __________ y __________ nanómetros.
Un ejemplo de solución gaseosa es __________.
La __________ es una mezcla heterogénea en la que las partículas sedimentan si se dejan en reposo.
III.- BLOQUE DE CORRESPONDENCIA.
5.- Instrucción. – De las estructuras que se exponen a continuación relacione con qué tipo de compuesto que corresponde. (C/U VALE 0,50) Vale 2 punto
A Es la sustancia que se encuentra en mayor cantidad.
B Gran cantidad de soluto comparada con la del disolvente.
C Es la sustancia que se encuentra en menor proporción.
D Soluto + Solvente
SOLUTO
DISOLVENTE
DISOLUCION
CONCENTRADA
IV.- BLOQUE DE SELECCIÓN. (CADA PREGUNTA BIEN CONTESTADA VALE 1 PUNTO). TOTAL, VALE 5 PUNTOS
6.- Instrucción. – Seleccione la respuesta correcta sobre los tipos de soluciones. VALE 1 PUNTO
Si se añade azúcar a un té hasta que ya no se disuelve más, la solución se clasifica como: a) Insaturada
b) Saturada
c) Sobresaturada
d) Coloidal
7.- Instrucción. - Seleccione la respuesta correcta sobre los tipos de mezclas VALE 1 PUNTO
¿Qué tipo de mezcla es la mayonesa?
a) Solución verdadera
b) Mezcla heterogénea
c) Coloide
d) Suspensión
8.- Instrucción. - Seleccione la respuesta correcta sobre los disolventes VALE 1 PUNTO
¿Cuál de las siguientes sustancias se disuelve mejor en agua?
a) Aceite
b) Sal de mesa
c) Arena
d) Plomo
9.- Instrucción. - Seleccione la respuesta correcta sobre la solución. VALE 1 PUNTO
¿Cómo se llama el componente que se encuentra en mayor cantidad en una solución?
a) Soluto
b) Dispersión
c) Solvente
d) Fase dispersa
ELABORADO POR:
Docente:
Ing. Paola Guananga
FIRMA:
REVISADO POR: Coordinador de área:
FIRMA:
APROBADO POR: VICERRECTORA
FIRMA:

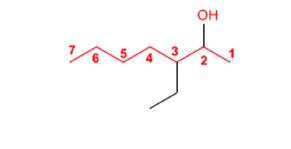
Compuestos Oxigenados
Alcoholes y Fenoles
Loscompuestosoxigenadossonaquellosquecontienenunenlacecarbono-oxígeno.Estepuede ser sencillo o doble. Entre los compuestos oxigenados más habituales podemos distinguir: Alcoholes y Fenoles
1. Enlace sencillo C-O.
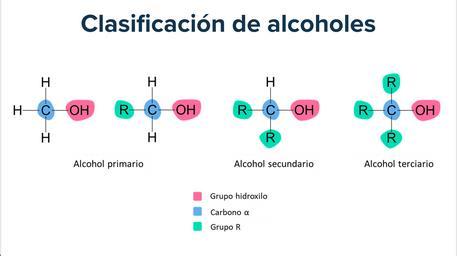
Alcoholes.
Su estructura es similar a la de los hidrocarburos, en los que se substituye uno o más átomos de hidrógeno por grupos "hidroxilo", -OH. Su fórmula general es R-OH.
Ejemplo: metanol (CH3OH) y 2-propanol.
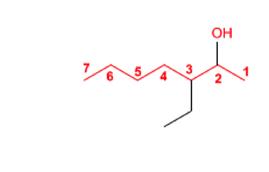
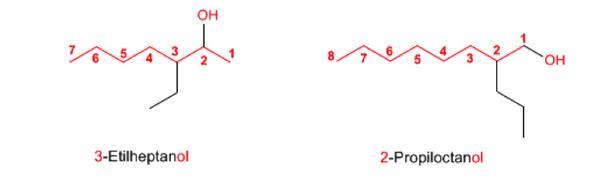
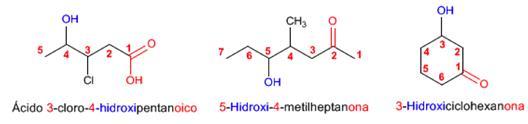
Regla 1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH y se numera dándole el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.

Regla 2. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por -ol.
Regla 3. El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.
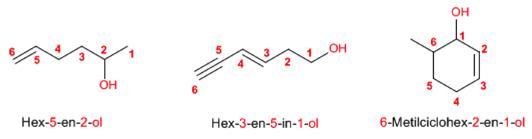
Regla 4. Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a ser un mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas.
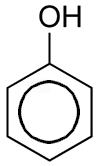
Fenoles
Son derivados aromáticos que presentan grupos "hidroxilo", -OH. Los fenoles tienen cierto carácter ácido y forman sales metálicas. Se encuentran ampliamente distribuidos en productos naturales, como los taninos.
Ejemplos: Fenol (C6H5OH) y p-hidroxifenol (HOC6H4OH)
Modo de Nombrarles.
Regla 1. Se nombran como los alcoholes, con la terminación "-ol" añadida al nombre del hidrocarburo,cuando el grupoOHesla funciónprincipal.Cuandoel grupoOHnoesla función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo.
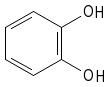
1,2-bencenodiol o orto-dihidroxibenceno
Regla 2. Si el benceno tiene varios sustituyentes, diferentes del OH, se numeran de forma que reciban los localizadores más bajos desde el grupo OH, y se ordenan por orden alfabético. En caso de que haya varias opciones decidirá el orden de preferencia alfabético de los radicales.
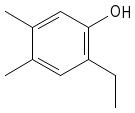
2-etil-4,5-dimetilfenol
Ejercicios.
¿Cuál serían las fórmulas correspondientes a los compuestos:
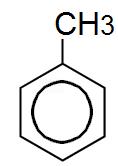
1.- 4-etil-3-metil-1-bencenol o 4-etil-3-metil-1-hidroxibenceno
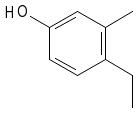
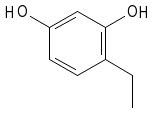
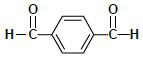
2.- 4-etil-1,3-bencenodiol
1.Cadena principal: benceno
2. Numeración: comienza en OH y se sigue hasta conseguir el OH de menor numeración.
3. Sustituyentes: etilo en 4.