6.3. Choroby tarczycy
Wydzielana przez podwzgórze tyreoliberyna (TRH) pobudza produkcję tyreotropiny (TSH) przez przysadkę, a ta z kolei stymuluje syntezę hormonów tarczycy. Wzrost stężenia hormonów tarczycy hamuje wydzielanie TRH i TSH, wpływając tym samym na ograniczenie produkcji hormonów tarczycy.
Uwolnione do krwi hormony tarczycy są transportowane do tkanek docelowych, w większości w połączeniu z białkami nośnikowymi (głównie z globuliną wiążąca tyroksynę –TBG); tylko 0,05% T4 i 0,15% T3 występuje w postaci wolnej.
Hormony tarczycy wpływają na funkcje wszystkich tkanek i narządów organizmu. Są niezbędne do prawidłowego wzrostu, dojrzewania i różnicowania komórek, zwiększają termogenezę, regulują metabolizm białek, lipidów i węglowodanów.
6.3.2. Zaburzenia funkcji tarczycy
Wprowadzenie
Nadczynność tarczycy (hipertyreoza) może mieć charakter pierwotny lub wtórny. Nadczynność pierwotna jest spowodowana chorobą tarczycy (tab. 6.8), natomiast wtórna – nadmiernym pobudzaniem syntezy hormonów tarczycy przez wydzielany w nadmiarze przez przysadkę TSH w przebiegu gruczolaka przysadki wydzielającego TSH lub z powodu nadmiernej produkcji tyreoliberyny – TRH (trzeciorzędowe zaburzenie czynności tarczycy). Najczęstsze objawy nadczynności tarczycy przedstawiono w tabeli 6.9.
Niedoczynność tarczycy (hipotyreoza) może mieć charakter pierwotny lub wtórny. Niedoczynność pierwotna jest spowodowana chorobą tarczycy (tab. 6.8), a wtórna –niedostatecznym pobudzeniem syntezy hormonów tarczycy w wyniku niedoboru TSH (niedoczynność przysadki) lub niedoboru tyreoliberyny (TRH). Najczęstsze objawy niedoczynności tarczycy przedstawiono w tabeli. 6.9.
TABELA 6.8.
Najczęstsze przyczyny pierwotnej nadczynności i niedoczynności tarczycy
NAJCZĘSTSZE PRZYCZYNY PIERWOTNEJ NADCZYNNOŚCI TARCZYCY
• Choroba Gravesa Basedowa
• Wole guzkowe toksyczne
• Przejściowa nadczynność towarzysząca zapaleniom tarczycy (np. hashitoxicosis, podostre zapalenie tarczycy, poporodowe zapalenie tarczycy)
NAJCZĘSTSZE PRZYCZYNY PIERWOTNEJ NIEDOCZYNNOŚCI TARCZYCY
• Przewlekłe autoimmunologiczne zapalenie tarczycy (choroba Hashimoto)
• Po usunięciu tarczycy lub po leczeniu jodem radioaktywnym –131I
• Przedawkowanie leków przeciwtarczycowych
6. Diagnostyka laboratoryjna chorób układu wewnątrzwydzielniczego
TABELA 6.9.
Najczęstsze objawy nadczynności i niedoczynności tarczycy
OBJAWY NADCZYNNOŚCI TARCZYCYOBJAWY NIEDOCZYNNOŚCI TARCZYCY
• Tachykardia
• Osłabienie
• Spadek masy ciała mimo zwiększonego apetytu
• Nadpobudliwość
• Bezsenność
• Drżenia rąk
• Biegunki
• Zaburzenia koncentracji, spowolnienie, senność, apatia
• Bradykardia
• Nadwrażliwość na zimno
• Przyrost masy ciała
• Suchość skóry
• Zaparcia
• Obrzęki twarzy i dłoni
Diagnostyka laboratoryjna
Badania laboratoryjne wykonywane w diagnostyce chorób tarczycy obejmują oznaczenie w surowicy:
• stężenia tyreotropiny (TSH);
• stężenia hormonów tarczycy;
• miana przeciwciał przeciw receptorowi TSH, peroksydazie tarczycowej, tyreoglobulinie;
• stężenia tyreoglobuliny;
• stężenia kalcytoniny.
Ocena funkcji tarczycy
Diagnostyka zaburzeń funkcji tarczycy polega na oznaczeniu w surowicy stężenia TSH oraz stężenia wolnej tyroksyny (free T4 [fT4]) i (rzadziej) stężenia wolnej trijodotyroniny (free T3 [fT3]). Pobranie krwi nie musi odbywać się na czczo. Jeśli pacjent jest leczony L-tyroksyną, zazwyczaj zaleca się, aby pobrać krew przed przyjęciem przez pacjenta leku.
Podstawowym testem diagnostycznym wykorzystywanym do rozpoznawania zaburzeń funkcji tarczycy jest ocena stężenia TSH w surowicy. U osób z prawidłową funkcją podwzgórza i przysadki mózgowej w zakresie wydzielania TRH i TSH zmiany stężenia TSH w surowicy są najczulszym wskaźnikiem zmian wydzielania hormonów przez tarczycę. Wynika to z faktu, że nawet niewielkie zmiany stężenia wolnych hormonów tarczycy powodują duże zmiany w wydzielaniu TSH. W tych warunkach prawidłowe stężenie TSH wyklucza w większości przypadków zaburzenia funkcji tarczycy, podwyższenie stężenia TSH oznacza niedobór hormonów tarczycy, natomiast obniżenie stężenia TSH – ich nadmiar.
Choroby tarczycy
Związana z zasadą ujemnego sprężenia zwrotnego zależność między zmianami stężenia
TSH i hormonów obwodowych nie występuje w przypadku wtórnych zaburzeń czynności tarczycy. We wtórnej niedoczynności tarczycy, z powodu upośledzenia czynności podwzgórza i/lub przysadki, niskie stężenie TSH będzie się utrzymywało pomimo niskich stężeń hormonów tarczycy. We wtórnej nadczynności tarczycy spowodowanej nadmiernym autonomicznym wydzielaniem TSH przez gruczolaka przysadki wysokie stężenie TSH utrzymuje się pomimo wysokiego stężenia hormonów tarczycy (nie ma zwrotnego hamowania przez hormony obwodowe).
Przy interpretacji wyniku stężenia TSH należy pamiętać, że u każdego człowieka istnieje genetycznie zdeterminowany „punkt regulacyjny” (set point) stężenia fT4, powyżej i poniżej którego wydzielanie TSH ulega zmianie. W niektórych przypadkach fizjologiczne stężenia fT4 i TSH mogą nie mieścić się w ustalonych zakresach wartości referencyjnych.
Interpretując wyniki oznaczeń TSH i hormonów obwodowych, należy także pamiętać, że zmiana stężenia TSH spowodowana zmianą stężenia hormonów obwodowych jest opóźniona i dochodzi do niej w pełni po 4–6 tygodniach (zjawisko opóźnienia przysadkowego – pituitary lag). W praktyce klinicznej jest to szczególnie ważne podczas monitorowania leczenia substytucyjnego w niedoczynności tarczycy i tyreostatycznego w nadczynności tarczycy. Zmiany stężenia TSH zachodzą wolno i nie odzwierciedlają szybkiego wzrostu lub spadku stężenia hormonów obwodowych, jakie występują w trakcie leczenia. Z tego powodu w monitorowaniu leczenia w ciągu pierwszych dwóch miesięcy (oraz w takim samym okresie po zmianie dawek leków) należy posługiwać się oznaczeniami fT4 lub czasem fT3, a dopiero w późniejszym okresie TSH.
Przy interpretacji wyników badań należy ponadto pamiętać, że na wysokość stężeń TSH i całkowitych T4 i T3, poza aktualnym stanem czynnościowym tarczycy, może mieć wpływ wiele różnych czynników (tab. 6.10).
Wykorzystanie do oznaczenia stężenia TSH superczułych testów III i IV generacji pozwala na odróżnienie bardzo niskiego stężenia TSH, które występuje w nadczynności tarczycy, od stężeń nieznacznie obniżonych obserwowanych zwykle z przyczyn pozatarczycowych. W celu uniknięcia pomyłek diagnostycznych badaniem przesiewowym stosowanym w ocenie stanu czynnościowego tarczycy powinno być jednoczesne oznaczenie stężenia TSH i fT4.
W przypadku nieprawidłowego stężenia TSH oznaczenie stężenia fT4 jest konieczne w celu oceny nasilenia zaburzeń funkcji tarczycy.
Ze względu na wpływ stężenia białek transportujących na wyniki oznaczeń nie zaleca się obecnie wykonywania oznaczeń całkowitego stężenia hormonów tarczycy. Zalecanym badaniem są oznaczenia stężeń wolnych hormonów tarczycy (fT4, fT3).
6. Diagnostyka laboratoryjna chorób układu wewnątrzwydzielniczego
TABELA 6.10.
Przyczyny wzrostu lub spadku stężenia tyreotropiny w surowicy
PRZYCZYNY NISKIEGO STĘŻENIA TYREOTROPINY
• Pierwotna nadczynność tarczycy
• Wtórna i trzeciorzędowa niedoczynność tarczycy (w chorobach podwzgórza i przysadki)
• Ciężkie ostre i przewlekłe choroby ogólnoustrojowe
• Ostre zaburzenia psychiczne
• Niedożywienie
• Podeszły wiek
• Leki: amiodaron, glikokortykosteroidy, fenytoina, somatostatyna, dopamina
PRZYCZYNY PODWYŻSZONEGO STĘŻENIA TYREOTROPINY
• Pierwotna niedoczynność tarczycy
• Wtórna nadczynność tarczycy – gruczolak przysadki wydzielający tyreotropinę
• Zespoły oporności na hormony tarczycy
• Pierwotna niedoczynność kory nadnerczy
• Okres zdrowienia po ciężkich chorobach
• Zaburzenia psychiczne
• Marskość wątroby
• Fizjologicznie u noworodków bezpośrednio po urodzeniu
• Początkowy okres leczenia amiodaronem
Badaniem o większej przydatności klinicznej w ocenie nasilenia zaburzeń funkcji tarczycy oraz monitorowania skuteczności leczenia jest zwykle oznaczenie stężenia fT4. Badanie stężenia fT3 jest wykonywane rzadziej i zalecane głównie przy podejrzeniu T3-toksykozy (T3-thyrotoxicosis), tzn. w sytuacji, gdy u pacjenta z objawami nadczynności tarczycy niskiemu stężeniu TSH towarzyszy prawidłowe stężenie fT4. Badanie to jest także przydatne w celu potwierdzenia rozpoznania nadczynności tarczycy indukowanej amiodaronem. W tabeli 6.11 przedstawiono zmiany stężenia TSH, fT4 i fT3 w różnych zaburzeniach funkcji tarczycy.
Test stymulacji wydzielania TSH hormonem uwalniającym (test z TRH) polega na ocenie stężenia TSH przed dożylnym podaniem 200 μg TRH, a następnie po podaniu: w 20., 30. i 60. minucie. Po podaniu TRH stężenie TSH wzrasta 2–5 razy w stosunku do wartości wyjściowych i zawiera się w przedziale 5,0–30,0 mU/l. Największe stężenie TSH obserwuje się w 20. lub 30. minucie testu.
Test z TRH stosuje się obecnie przy podejrzeniu zaburzeń czynności tarczycy pochodzenia centralnego. Pozwala na różnicowanie między gruczolakiem przysadki mózgowej produkującym TSH a opornością przysadki na hormony tarczycy.
We wtórnej niedoczynności tarczycy stężenie TSH po stymulacji TRH nie wzrasta w sposób istotny. W trzeciorzędowej niedoczynności (niedobór endogennego TRH) wzrost stężenia TSH jest umiarkowany i opóźniony. W nadczynności tarczycy pochodzenia centralnego TSH nie wzrasta istotnie po podaniu TRH. W oporności przysadki na hormony tarczycy odpowiedź TSH na TRH jest prawidłowa.
7. Diagnostyka laboratoryjna niepłodności
7.1. Diagnostyka laboratoryjna męskiej niepłodności
Jolanta Słowikowska-Hilczer, Katarzyna Marchlewska, Renata Walczak-Jędrzejowska
7.1.1. Wprowadzenie
Według definicji Światowej Organizacji Zdrowia (WHO – World Health Organization) za niepłodną uznaje się parę, u której w ciągu 12 miesięcy współżycia płciowego, bez stosowania antykoncepcji, nie doszło do zapłodnienia. W Europie około 15% par poszukuje pomocy medycznej z powodu niemożności uzyskania ciąży. Przyczyna po stronie mężczyzny jest stwierdzana u około 20% niepłodnych par, a u kolejnych 25% stanowi przyczynę współwystępującą.
Diagnostykę przyczyn niepłodności pary rozpoczyna się zwykle po 12 miesiącach bezskutecznych starań o uzyskanie ciąży. Diagnostykę rozpoczyna się wcześniej u pacjentów, u których występują dodatkowe zaburzenia, potencjalnie zmniejszające płodność, oraz w przypadku gdy partnerzy mają ponad 30 lat. Diagnostyka powinna być prowadzona równocześnie u kobiety i mężczyzny.
Lekarz przeprowadza dokładny wywiad medyczny i badanie fizykalne, ze szczególnym uwzględnieniem gonad i narządów płciowych, aby stwierdzić obecność chorób lub wpływ czynników środowiskowych, które mogą zaburzać płodność. Następnie kieruje mężczyznę na badanie nasienia.
7.1.2. Diagnostyka laboratoryjna
Badanie nasienia
Podstawowe (ogólne) badanie nasienia jest pierwszym zlecanym badaniem laboratoryjnym. Ma ono na celu ogólną ocenę ejakulatu oraz jakości plemników.
Badanie nasienia wykonuje się metodą manualną według rekomendacji WHO (ostatnie rekomendacje wydano w 2010 roku). Niektóre laboratoria oferują wykonanie badania
7. Diagnostyka laboratoryjna niepłodności
nasienia za pomocą analizy wspomaganej komputerowo (CASA – computer-assisted sperm analysis). CASA daje precyzyjne i porównywalne z analizą manualną wyniki dla większości parametrów nasienia, jednak konieczne jest zachowanie odpowiednich standardów w przygotowaniu próbek ejakulatu oraz umiejętne posługiwanie się aparaturą.
Aby uzyskane wyniki były wiarygodne i porównywalne między laboratoriami, badanie nasienia powinno być wykonywane według rekomendacji WHO przez przeszkolonych diagnostów.
Wymagane jest spełnienie następujących warunków wstępnych:
• Okres wstrzemięźliwości płciowej (czas od ostatniego wytrysku nasienia) przed oddaniem nasienia do badania powinien wynosić co najmniej 48 godzin, ale nie dłużej niż 7 dni. Informacja o okresie abstynencji powinna znaleźć się na wyniku. Długość abstynencji płciowej wpływa na wartości takich parametrów, jak objętość ejakulatu oraz liczba, żywotność, ruchliwość i morfologia plemników.
• W przypadkach kolejnego badania nasienia okres wstrzemięźliwości płciowej powinien być podobny jak przy pierwszym badaniu.
• Nasienie powinno być oddane w pomieszczeniu blisko laboratorium, w warunkach zapewniających intymność, drogą masturbacji, do specjalnego jednorazowego pojemnika, nietoksycznego dla plemników. Naczynie powinno być ogrzane do temperatury pokojowej, ponieważ obniżenie temperatury ujemnie wpływa na ruchliwość plemników i może być źródłem fałszywych wyników.
• Nasienie powinno być oddane w całości, przy zachowaniu podstawowych zasad higieny.
• W przypadku problemów z oddaniem nasienia w laboratorium możliwe jest jego oddanie w warunkach domowych (do odpowiedniego pojemnika lub przy użyciu specjalnych prezerwatyw pozbawionych środka plemnikobójczego) i dostarczenie do laboratorium w czasie nie dłuższym niż 60 minut, gdyż analiza parametrów przyżyciowych plemników powinna być wykonana tuż po upłynnieniu próbki w czasie do 1 godziny od ejakulacji. Nasienie powinno być transportowane w temperaturze 20–37°C. Czas dostarczenia próbki do laboratorium (czas od ejakulacji) powinien być zanotowany przez personel laboratorium.
• Wiarygodne dane o jakości nasienia uzyskuje się po wykonaniu co najmniej 2 lub 3 badań w odstępie od 7 dni do 3 tygodni.
Podczas badania jest przeprowadzana analiza makroskopowa ejakulatu oraz ocena mikroskopowa preparatów nasienia przyżyciowych i barwionych.
Ocena makroskopowa obejmuje takie parametry ejakulatu, jak:
• Czas upłynnienia. Po oddaniu nasienie jest półpłynną, skoagulowaną masą, która ulega procesowi upłynnienia. Koagulacja nasienia zależy od białka seminogeliny wydzielanego przez pęcherzyki nasienne. Za trawienie seminogeliny i upłynnienie nasienia odpowiada enzym proteaza serynowa, czyli tzw. swoisty antygen sterczowy (PSA – prostate specific antygen) produkowany przez gruczoł krokowy. W temperaturze
pokojowej nasienie powinno się upłynnić w ciągu 60 minut (zwykle około 15 minut). Po upłynnieniu nasienie staje się homogenne i płynne. Brak upłynnienia może świadczyć o zaburzeniach czynności gruczołu krokowego.
• Objętość. Objętość ejakulatu < 1,5 ml może być spowodowana: utratą części próbki, zablokowaniem dróg wyprowadzających nasienie (np. gęstą wydzieliną w przebiegu zapalenia w układzie płciowym, mukowiscydozy), wrodzonym obustronnym brakiem nasieniowodów, niedorozwojem lub zaburzoną czynnością pęcherzyków nasiennych, niedorozwojem lub zaburzoną czynnością gruczołu krokowego, częściowym wytryskiem wstecznym, niedoborem androgenów.
• Lepkość. W przypadku zwiększonej lepkości nasienie nie wypływa z pipety kroplami, ale tworzy nici o długości > 2 cm. Przyczyny zwiększonej lepkości nasienia to m.in.: zaburzenia czynności prostaty, stan zapalny w układzie płciowym, odwodnienie, mukowiscydoza.
• pH. Wartość pH nasienia < 7,0 może świadczyć m.in. o niedorozwoju lub zaburzeniu czynności pęcherzyków nasiennych, niedrożności dróg wyprowadzających wydzielinę pęcherzyków nasiennych. pH nasienia > 8,5 i mała objętość nasienia mogą świadczyć m.in. o niedorozwoju/zaburzeniu czynności gruczołu krokowego oraz o niedrożności dróg wyprowadzających wydzielinę gruczołu krokowego.
• Kolor. Kolor nasienia jest szaroopalizujący, mlecznoszary. Nasienie powinno być nieprzezroczyste – jego przezroczystość świadczy o tym, że plemników nie ma lub że jest ich bardzo mało. Żółtawy kolor nasienia jest efektem zapalenia, żółtaczki, stosowania niektórych leków (np. witamin z grupy B) lub przedostawania się moczu z pęcherza moczowego do cewki moczowej w trakcie ejakulacji. Kolor czerwonobrunatny jest spowodowany obecnością krwinek czerwonych.
• Zapach. Nasienie ma zapach określany jako zapach kasztanów lub chloru. Podczas infekcji bakteryjnych pojawia się zapach odmienny, często nieprzyjemny.
Ocena mikroskopowa ejakulatu obejmuje:
• Wstępną ocenę preparatu przyżyciowego, która umożliwia obserwację m.in. agregacji i aglutynacji plemników, pasm śluzu oraz innych elementów morfotycznych występujących w nasieniu (np. komórek okrągłych, erytrocytów, komórek nabłonkowych, kryształów sperminy itp.).
Agregacja jest to zjawisko polegające na tym, że zarówno nieruchome, jak i ruchome plemniki przylegają do siebie oraz do pasm śluzu, innych komórek lub ciałek resztkowych, tworząc skupiska.
Aglutynacja jest to zjawisko polegające na tym, że ruchome plemniki przylegają do siebie, tworząc skupiska. Wyróżnia się następujące stopnie aglutynacji:
• stopień 1. < 10 plemników tworzących skupiska; wiele plemników wolnych;
• stopień 2. 10–50 plemników tworzących skupiska; obecne wolne plemniki;
• stopień 3. > 50 plemników w skupiskach; obecne pojedyncze wolne plemniki;
• stopień 4. wszystkie plemniki tworzą skupiska; poszczególne skupiska łączą się ze sobą.
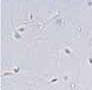
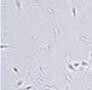

RYCINA 7.1.
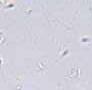
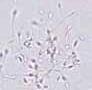
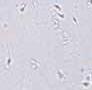


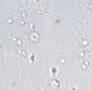
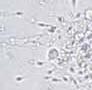
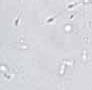
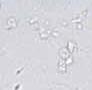
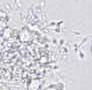

Aglutynacja plemników (a) oraz agregacja plemników (b) obserwowane w preparacie przyżyciowym w mikroskopie świetlnym (powiększenie 400 ×).


Wyróżnia się ponadto 5 typów aglutynacji: główka-główka, witka-witka, koniec witki-koniec witki, główka-witka i splątany. Obecność aglutynacji może wskazywać na obecność przeciwciał przeciwplemnikowych.
• Ocenę całkowitej liczby plemników (liczba plemników w ejakulacie) i koncentracji plemników (liczba plemników w 1 ml ejakulatu). Jeśli przy wstępnej ocenie w preparacie przyżyciowym w dwóch powtórzeniach nie znaleziono plemników, próbkę nasienia odwirowuje się. Powstały osad rozprowadza się na szkiełku podstawowym i ogląda w mikroskopie świetlnym w poszukiwaniu plemników.
Przyczynami braku plemników w nasieniu (azoospermii) mogą być m.in.: zaburzenia rozwoju jąder (najczęściej zespół Klinefeltera, dysgenezja jąder), zanik jąder (np. po zapaleniu, niedokrwieniu), mutacje genów odcinka AZF chromosomu Y, uszkodzenie nabłonka plemnikotwórczego substancjami toksycznymi (np. niektórymi chemioterapeutykami przeciwnowotworowymi) lub po radioterapii, hipogonadyzm hipogonadotropowy (niedoczynność podwzgórza lub/i przysadki), niedrożność przewodów wyprowadzających plemniki (np. spowodowana stanem zapalnym w układzie płciowym, obustronnym brakiem nasieniowodów, mukowiscydozą).
Przyczynami zmniejszonej liczebności plemników w nasieniu (oligozoospermii) mogą być m.in. mutacje genów odcinka AZF chromosomu Y, stan zapalny w układzie płciowym, żylaki powrózków nasiennych, obniżenie stężenia testosteronu, stres,
12.2. Stosowanie diagnostyki molekularnej w identyfikowaniu punktów uchwytu…
kwalifikowani chorzy, których nowotwory nie wykazują mutacji w genach KRAS, NRAS (mutacje w eksonach 2-4) i BRAF (mutacja BRAF V600E)6. Obecność tych mutacji wskazuje na brak wrażliwości na przeciwciała anty-EGFR, gdyż produkty białkowe zmutowanych genów KRAS, NRAS i BRAF powodują ciągłą aktywację szlaku MAPK, co z kolei sprawia, że blokowanie EGFR, będącego pierwszym ogniwem wymienionego szlaku, jest nieskuteczne. Diagnostykę omawianych mutacji wykonuje się na materiale pooperacyjnym (guz pierwotny i materiał z przerzutów do narządów odległych) z wykorzystaniem sekwencjonowania nowej generacji (NGS) (ryc. 12.5) lub sekwencjonowania sangerowskigo (ryc. 12.3) bądź qPCR (ryc. 12.2).
W celu poznania dokładnej sekwencji nukleotydów w określonym amplikonie można zastosować
SEKWENCJONOWANIE METODĄ SANGERA
PCR 1: (1) Polimeraza, (2) dNTP, (3) startery. itd.
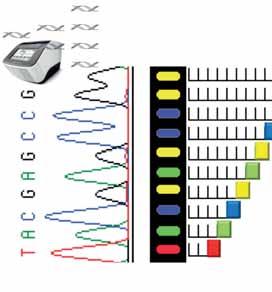
PCR 2: (1) Polimeraza, (2) dNTP, (3) startery. Do drugiej reakcji PCR oprócz dNTP domiareczkowywane są ddNTP wyznakowane różnego koloru fluorochromami. ddNTP są wbudowywane w syntetyzowaną nić DNA przez polimerazę, jednak ich wbudowanie doprowadza do TERMINACJI, czyli uniemożliwia dalszą syntezę DNA.
Podczas drugiej reakcji
PCR zarówno dNTP, jak i ddNTP są wbudowywane w syntetyzowany łańcuch DNA losowo, zaś terminacja następuje tylko przy wbudowaniu ddNTP.

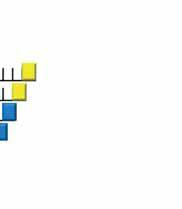
Dzięki temu powstają fragmenty DNA różnej długości, każdy z nich zakończony ddNTP wyznakowanym odpowiednią fluorescencją i komplementarnym do DNA matrycy.

Ostatecznie podczas elektroforezy kapilarnej następuje rozdział fragmentów i odczytanie sekwencji nukleotydów w badanym DNA.
RYCINA 12.3. Sekwencjonowanie metodą Sangera – ogólna zasada działania.

6 Wykazano, że u pacjentów, u których nie stwierdzono mutacji w eksonie 2 KRAS i u których jednocześ‑ nie w analizie retrospektywnej wykryto mutacje w innych eksonach KRAS lub NRAS, leczenie przeciwciała‑ mi anty‑EGFR przyspieszało rozwój choroby.
