Jiří Charvát, Vendelín Chovanec, Viktor Maňásek, Jaroslav Čutora, Kateřina Lisová a kolektiv
Cévní vstupy



Děkujeme společnostem, které v této publikaci inzerují nebo její vydání jiným způsobem podpořily (v abecedním pořadí):
Amgen s.r.o.
AstraZeneca Czech Republic s.r.o.
B. Braun Medical s.r.o.
Baxter CZECH spol. s r.o.
Becton Dickinson Czechia, s.r.o.
Electric Medical Service s. r. o.
HELAGO-CZ, s.r.o.
Ipsen Pharma s.r.o.
Medisyner s.r.o.
Merck Sharp & Dohme s.r.o.
PROMEDICA PRAHA GROUP, a.s.
Sabrix s.r.o.
3M HC EMEA EXPORT LIMITED – Solventum
Stargen EU s.r.o.
Teleflex Medical s.r.o.
VYGON Czech Republic s.r.o.
Jiří Charvát, Vendelín Chovanec, Viktor Maňásek, Jaroslav Čutora, Kateřina Lisová a kolektiv
Cévní vstupy
Grada Publishing
Upozornění pro čtenáře a uživatele této knihy Všechna práva vyhrazena. Žádná část této tištěné či elektronické knihy nesmí být reprodukována a šířena v papírové, elektronické či jiné podobě bez předchozího písemného souhlasu nakladatele. Neoprávněné užití této knihy bude trestně stíháno. Automatizovaná analýza textů nebo dat ve smyslu čl. 4 směrnice 2019/790/EU a použití této knihy k trénování AI jsou bez souhlasu nositele práv zakázány
prof. MUDr. Jiří Charvát, CSc.; MUDr. Vendelín Chovanec, Ph.D.;
MUDr. Viktor Maňásek, Ph.D.; MUDr. Jaroslav Čutora; Mgr. Kateřina Lisová a kolektiv
CÉVNÍ VSTUPY
Editoři:
prof. MUDr. Jiří Charvát, CSc.
Centrum cévních vstupů Fakultní nemocnice v Motole, Praha
MUDr. Vendelín Chovanec, Ph.D.
Kanylační středisko a Angiointervenční oddělení Radiologické kliniky Lékařské fakulty v Hradci Králové Univerzity Karlovy a Fakultní nemocnice Hradec Králové
MUDr. Viktor Maňásek, Ph.D.
Komplexní onkologické centrum a Kanylační centrum Nemocnice Agel Nový Jičín, a.s.
MUDr. Jaroslav Čutora
II. Klinika pediatrickej anestéziológie a intenzívnej medicíny Slovenskej zdravotníckej univerzity, Detská fakultná nemocnica s poliklinikou Banská Bystrica
Mgr. Kateřina Lisová
Centrum cévních vstupů Fakultní nemocnice v Motole, Praha
Kolektiv autorů:
doc. MUDr. David Astapenko, Ph.D., MBA
MUDr. Vanda Bínová
MUDr. Tomáš Brožek, Ph.D.
Bc. Iveta Constantine, MSc.
MUDr. Jaroslav Čutora
Mgr. Martina Douglas
doc. MUDr. Jitka Fricová, Ph.D.
Mgr. Růžena Houžvičková Zvelebilová
MUDr. Štěpán Hrabovský, Ph.D.
prof. MUDr. Jiří Charvát, CSc.
MUDr. Vendelín Chovanec, Ph.D.
MUDr. Jan Kaván, Ph.D.
MUDr. Jakub Kletečka, Ph.D.
MUDr. Oliver Kuchař, Ph.D.
MUDr. Maroš Kunderlík
Mgr. Kateřina Lisová
MUDr. Jan Máchal
MUDr. Viktor Maňásek, Ph.D.
Mgr. Tereza Matějčková
prof. MUDr. Pavel Michálek, Ph.D., D.E.S.A., M.Sc., FEAMS, MBA
MUDr. Dana Mokrá
doc. MUDr. Barbora Nedomová, PhD.
MUDr. Pavlína Nosková, Ph.D.
Bc. Kateřina Pavelková
MUDr. Martin Polák
MUDr. Adéla Prchlíková
MUDr. Martin Rázus
PharmDr. Petra Rozsívalová
doc. MUDr. MgA. Kateřina Rusinová, Ph.D.
MUDr. Ladislav Sopko, MPH, PhD.
doc. MUDr. Tomáš Szotkowski, Ph.D.
MUDr. Michal Šenkyřík
Petra Šimková, DiS.
MUDr. Petr Šmahel, Ph.D.
MUDr. Martin Troubil, Ph.D.
MUDr. Štěpán Tuček, Ph.D.
Mgr. Adéla Vlasáková
Recenzenti:
Dr. h.c. prof. MUDr. Karol Králinský, PhD. II. Detská klinika Slovenskej zdravotníckej univerzity, Detská fakultná nemocnica s poliklinikou Banská Bystrica
doc. MUDr. Martin Stříteský, CSc. Klinika anesteziologie, resuscitace a intenzivní medicíny 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze
PhDr. Marie Zvoníčková Ústav ošetřovatelství 3. lékařské fakulty Univerzity Karlovy a Oddělení vzdělávání nelékařských zdravotnických pracovníků Ústřední vojenské nemocnice – Vojenské fakultní nemocnice Praha
Kapitoly 1.4, 12.6, 15.3 byly podpořeny grantem Univerzity Karlovy SVV 260 785.
Vydání odborné knihy schválila Vědecká redakce nakladatelství Grada Publishing, a.s.
Obrázky dodali autoři. Obrázek 9.3 nakreslila MUDr. Vanda Bínová, obrázek 12.14 nakreslil
MUDr. Petr Šmahel, Ph.D. Obrázky 1.11a–c, 1.13, 1.15, 3.1, 8.2, 9.1, 14.1, 14.4, 18.2, 18.4, 18.7, 18.8 překreslil a upravil Jiří Hlaváček. Protokoly RaCeVA, RaFeVA, RaPeVA podle MUDr. Vandy Bínové překreslil Jiří Hlaváček. Obrázek 12.46 byl otištěn na základě licence CC BY-NC z článku Maňásek V, Zapletalová J, Olosová L, et al. Aetiology and management of persistent withdrawal occlusion in venous ports in oncology patients. Sci Prog. 2024;107:368504241260374.
Cover Photo © Michal Hospodár, 2025
Cover Design © Grada Publishing, a.s., 2025
© Grada Publishing, a.s., 2025
Vydala Grada Publishing, a.s.
U Průhonu 22, Praha 7 jako svou 10 106. publikaci
Šéfredaktorka lékařské literatury MUDr. Michaela Lízlerová
Odpovědná redaktorka Eva Frašková, Mgr. Klára Procházková
Jazyková korektura a redakce Jindřiška Bláhová, Mgr. Agáta Urbanová
Sazba a zlom Monika Vejrostová
Počet stran 528
1. vydání, Praha 2025
Vytisklo TISK CENTRUM s.r.o., Moravany u Brna
Názvy produktů, firem apod. použité v knize mohou být ochrannými známkami nebo registrovanými ochrannými známkami příslušných vlastníků, což není zvláštním způsobem vyznačeno.
Postupy a příklady v této knize, rovněž tak informace o lécích, jejich formách, dávkování a aplikaci jsou sestaveny s nejlepším vědomím autorů. Z jejich praktického uplatnění však pro autory ani pro nakladatelství nevyplývají žádné právní důsledky.
ISBN 978-80-271-8105-6 (pdf)
ISBN 978-80-271-5349-7 (print)
Editoři
prof. MUDr. Jiří Charvát, CSc.
Centrum cévních vstupů Fakultní nemocnice v Motole, Praha
MUDr. Vendelín Chovanec, Ph.D.
Kanylační středisko a Angiointervenční oddělení Radiologické kliniky Lékařské fakulty v Hradci Králové Univerzity Karlovy a Fakultní nemocnice Hradec Králové
MUDr. Viktor Maňásek, Ph.D.
Komplexní onkologické centrum a Kanylační centrum Nemocnice Agel Nový Jičín, a.s.
MUDr. Jaroslav Čutora
II. Klinika pediatrickej anestéziológie a intenzívnej medicíny Slovenskej zdravotníckej univerzity, Detská fakultná nemocnica s poliklinikou Banská Bystrica
Mgr. Kateřina Lisová
Centrum cévních vstupů Fakultní nemocnice v Motole, Praha
Kolektiv autorů
doc. MUDr. David Astapenko, Ph.D., MBA
Klinika anesteziologie, resuscitace a intenzivní medicíny Lékařské fakulty v Hradci Králové Univerzity Karlovy a Fakultní nemocnice Hradec Králové
Fakulta zdravotnických studií, Technická univerzita v Liberci Department of Anaesthesia, Dalhousie University, Halifax, Nova Scotia, Canada
MUDr. Vanda Bínová
Oddělení zobrazovacích metod, Nemocnice Jihlava
MUDr. Tomáš Brožek, Ph.D.
Kanylační centrum Kliniky anesteziologie, resuscitace a intenzivní medicíny 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze
Bc. Iveta Constantine, MSc. PICC tým Fakultní nemocnice Ostrava
MUDr. Jaroslav Čutora
II. Klinika pediatrickej anestéziológie a intenzívnej medicíny Slovenskej zdravotníckej univerzity, Detská fakultná nemocnica s poliklinikou Banská Bystrica
Mgr. Martina Douglas
Kanylační tým, Klinika kardiovaskulární a transplantační chirurgie, Fakultní nemocnice Olomouc
doc. MUDr. Jitka Fricová, Ph.D.
Centrum pro léčbu bolesti, Klinika anesteziologie, resuscitace a intenzivní medicíny 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze
Mgr. Růžena Houžvičková Zvelebilová
Centrum cévních vstupů Fakultní nemocnice v Motole, Praha
MUDr. Štěpán Hrabovský, Ph.D.
Interní hematologická a onkologická klinika Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno
prof. MUDr. Jiří Charvát, CSc.
Centrum cévních vstupů Fakultní nemocnice v Motole, Praha
MUDr. Vendelín Chovanec, Ph.D.
Kanylační středisko a Angiointervenční oddělení Radiologické kliniky Lékařské fakulty v Hradci Králové Univerzity Karlovy a Fakultní nemocnice Hradec Králové
MUDr. Jan Kaván, Ph.D.
Angiografické oddělení Radiodiagnostické kliniky 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze
MUDr. Jakub Kletečka, Ph.D.
Centrum cévních vstupů, Klinika anesteziologie, resuscitace a intenzivní medicíny Lékařské fakulty v Plzni Univerzity Karlovy a Fakultní nemocnice Plzeň
MUDr. Oliver Kuchař, Ph.D.
Centrum cévních vstupů, Interní klinika 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Bulovka, Praha
MUDr. Maroš Kunderlík
Onkologický ústav sv. Alžbety, Bratislava
Mgr. Kateřina Lisová
Centrum cévních vstupů Fakultní nemocnice v Motole, Praha
MUDr. Jan Máchal
Oddělení dětské hematologie a biochemie Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno
MUDr. Viktor Maňásek, Ph.D. Komplexní onkologické centrum a Kanylační centrum Nemocnice Agel Nový Jičín, a.s.
Mgr. Tereza Matějčková
Centrum cévních vstupů Fakultní nemocnice v Motole, Praha
prof. MUDr. Pavel Michálek, Ph.D., D.E.S.A., M.Sc., FEAMS, MBA
Kanylační centrum Kliniky anesteziologie, resuscitace a intenzivní medicíny 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze
MUDr. Dana Mokrá
Centrum cévních vstupů Fakultní nemocnice v Motole, Praha
doc. MUDr. Barbora Nedomová, PhD.
Detská klinika anestéziológie a intenzívnej medicíny, Národný ústav detských chorôb, Bratislava
MUDr. Pavlína Nosková, Ph.D.
Kanylační centrum Kliniky anesteziologie, resuscitace a intenzivní medicíny 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze
Bc. Kateřina Pavelková
Centrum cévních vstupů Fakultní nemocnice v Motole, Praha
MUDr. Martin Polák
Interní oddělení Klaudiánovy nemocnice, Mladá Boleslav
MUDr. Adéla Prchlíková
Interní hematologická a onkologická klinika Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno
MUDr. Martin Rázus
Kanylačný tím Národného onkologického ústavu, Bratislava
PharmDr. Petra Rozsívalová
Oddělení klinické farmacie, Nemocniční lékárna, Fakultní nemocnice Hradec Králové
Katedra sociální a klinické farmacie, Farmaceutická fakulta v Hradci Králové Univerzity Karlovy
doc. MUDr. MgA. Kateřina Rusinová, Ph.D.
Klinika paliativní medicíny 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze
MUDr. Ladislav Sopko, MPH, PhD.
Klinika hematológie a transfuziológie Lekárskej fakulty Univerzity Komenského, Slovenskej zdravotníckej univerzity a Univerzitnej nemocnice Bratislava
doc. MUDr. Tomáš Szotkowski, Ph.D.
Hemato-onkologická klinika Lékařské fakulty Univerzity Palackého v Olomouci a Fakultní nemocnice Olomouc
MUDr. Michal Šenkyřík
Interní gastroenterologická klinika Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno
Petra Šimková, DiS.
Centrum cévních vstupů Fakultní nemocnice v Motole, Praha
MUDr. Petr Šmahel, Ph.D.
Jednotka intenzivní péče Chirurgické kliniky Lékařské fakulty v Hradci Králové
Univerzity Karlovy a Fakultní nemocnice Hradec Králové
MUDr. Martin Troubil, Ph.D.
Klinika kardiovaskulární a transplantační chirurgie Lékařské fakulty Univerzity
Palackého v Olomouci a Fakultní nemocnice Olomouc
MUDr. Štěpán Tuček, Ph.D.
Interní hematologická a onkologická klinika Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno
Mgr. Adéla Vlasáková
Centrum cévních vstupů, Klinika anesteziologie, resuscitace a intenzivní medicíny Lékařské fakulty v Plzni Univerzity Karlovy a Fakultní nemocnice Plzeň
Recenzenti
Dr. h.c. prof. MUDr. Karol Králinský, PhD.
II. Detská klinika Slovenskej zdravotníckej univerzity, Detská fakultná nemocnica s poliklinikou Banská Bystrica
doc. MUDr. Martin Stříteský, CSc.
Klinika anesteziologie, resuscitace a intenzivní medicíny 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze
PhDr. Marie Zvoníčková Ústav ošetřovatelství 3. lékařské fakulty Univerzity Karlovy a Oddělení vzdělávání nelékařských zdravotnických pracovníků Ústřední vojenské nemocnice – Vojenské fakultní nemocnice Praha

1 Základní informace
(Viktor Maňásek, Jiří Charvát, Jitka Fricová, Vendelín Chovanec, Petra Rozsívalová, Martina Douglas, Martin Troubil, Adéla Prchlíková, Jan Máchal, Štěpán Hrabovský)
1 1 Historie cévního vstupu
1 .2 Význam a vlastnosti cévních vstupů
1 .3 Základní rozdělení cévních vstupů
1 .4 Vlastnosti léčiv pro nitrožilní podání
1 .5 Pacient s DIVA
1 .6 Volba žilních vstupů u poruch koagulace a při antikoagulační a antiagregační léčbě
2 Základní principy ultrazvuku pro zavádění cévních vstupů (Vendelín Chovanec, Jaroslav Čutora)
2 .1 Základy ultrazvukové anatomie
2 2 Využití ultrazvuku při kanylaci
3 Metody pro umístění katétru (Dana Mokrá, Vendelín Chovanec, Viktor Maňásek, Jakub Kletečka)
3 .1 Techniky pro umístění distálního konce centrálního katétru
3 .2 Tunelizace žilních katétrů
4 Cévní tým, PICC tým (Jiří Charvát, Kateřina Lisová)
4 .1 PICC tým
4 2 Cévní (kanylační) tým
4 .3 Výhody a výzvy cévního (kanylačního) týmu
5 Ekonomika cévních vstupů (Martin Polák, Iveta Constantine)
5 .1 Analýza nákladů – statický model
5 .2 Analýza nákladů – dynamický model
6 Periferní žilní vstupy (Kateřina Lisová, Kateřina Pavelková, Tereza Matějčková)
6 .1 Definice a klasifikace periferních žilních vstupů
6 .2 Indikace periferních žilních vstupů .
6 3 Zavedení a ošetření periferních žilních vstupů
6 .4 Komplikace a jejich prevence .
6 .5 Odstranění periferního žilního vstupu
7 Centrálně zavedený centrální katétr a centrální katétr zavedený z femorální oblasti. Tunelizovaný CICC a FICC
(Jiří Charvát, Martin Troubil, Tomáš Brožek, David Astapenko)
7 .1 Definice a indikace CICC a FICC
7 .2 Zavedení CICC a FICC
7 .3 Komplikace při zavádění CICC, FICC, tunelizovaného CICC a FICC
8 Periferně zaváděný centrální žilní katétr
(Maroš Kunderlík, Viktor Maňásek, Iveta Constantine, Martina Douglas, Adéla Vlasáková, Jakub Kletečka)
8 .1 Definice a indikace PICC
8 .2 Zavedení PICC
8 .3 Komplikace při zavádění PICC
9 TIVAD (intravenózní porty)
(Pavlína Nosková, Vendelín Chovanec, Viktor Maňásek, Oliver Kuchař, Maroš Kunderlík)
9 .1 Definice, rozdělení a indikace portů
9 .2 Zavedení TIVAD
9 3 Komplikace
10 Atypické žilní přístupy
(Pavel Michálek, Jan Kaván)
10 .1 Komplexní radiologické mapování
10 .2 Volba alternativní žíly
10 .3 Pravá (levá) zevní jugulární žíla
4 Kolaterální a ostatní malé žíly
10 .5 Chirurgická preparace (punkce) vena cephalica
10 .6 Translumbální přístup
10 7 Vnitřně-zevní kanylace horní duté žíly
10 .8 Transhepatální přístup
11 .4 Bezjehlové konektory
11 .5 Ošetřování tunelizovaného katétru s manžetou
11 .6 Ošetřování intravenózního portu
Závěr
12 Komplikace v průběhu zavedení cévního vstupu
(Jiří Charvát, Vendelín Chovanec, Petr Šmahel, Jakub Kletečka, Štěpán Hrabovský, Michal Šenkyřík, Viktor Maňásek, Martina Douglas, Iveta Constantine, Petra Rozsívalová)
12 .1 Mechanické komplikace
12 2 Infekční komplikace cévních vstupů
12 .3 Trombotické komplikace cévních vstupů
12 .4 Okluze katétrů a možnosti řešení
12 .5 Kožní komplikace spojené se žilními vstupy
12 .6 Extravazace léčiv
13 Extrakce portů a permanentních katétrů (Pavel Michálek, Vendelín Chovanec)
13 .1 Rutinní extrakce žilního vstupu
13 .2 Komplikovaná extrakce
13 .3 Extrakce fragmentů katétru
13 4 Protokol
14 Cévní vstupy v intenzivní péči (Jiří Charvát, Dana Mokrá, Jakub Kletečka, David Astapenko, Tomáš Brožek, Pavel Michálek)
14 .1 Definice a indikace cévních vstupů v intenzivní péči
14 .2 Výběr cévního vstupu v intenzivní péči a jeho zavedení
14 .3 Zajištění optimálního cévního vstupu u operovaného pacienta a v perioperační péči
14 .4 Přístup k řešení komplikací cévního vstupu v průběhu intenzivní péče .
14 .5 Arteriální kanylace v perioperační a intenzivní péči
15 Žilní vstupy v onkologii a hematoonkologii (Viktor Maňásek, Maroš Kunderlík, Štěpán Tuček, Petra Rozsívalová, Štěpán Hrabovský, Adéla Prchlíková, Tomáš Szotkowski, Ladislav Sopko, Martin Rázus)
15 .1 Specifika onkologického pacienta
15 .2 Volba žilního vstupu u konkrétních malignit
15 .3 Extravazace cytostatik (viz kapitola 12 .6 Extravazace léčiv)
15 .4 Specifika žilního vstupu u hematoonkologického pacienta . Indikační kritéria pro volbu žilního vstupu v hematoonkologii
15 .5 Volba žilních vstupů u leukemií, transplantace krvetvorných kmenových buněk
15 .6 Volba žilních vstupů u lymfomů
15 .7 Volba žilních vstupů u dalších hematoonkologických diagnóz
16 Cévní vstupy u parenterální výživy
(Michal Šenkyřík, Jiří Charvát) .
16 .1 Typy parenterální výživy a výběr vstupu
16 .2 Parenterální výživa v nemocničním prostředí
16 .3 Domácí parenterální výživa .
16 .4 Komplikace žilních katétrů pro parenterální výživu .
17 Cévní vstupy v paliativní péči (Martin Polák, Viktor Maňásek, Kateřina Rusinová)
17 .1 Příklady onemocnění, u kterých je prokazatelný přínos ze zapojení paliativní péče
17 .2 Vhodné způsoby podávání léků v paliativní péči
18 Venózne vstupy u pediatrického pacienta (Jaroslav Čutora, Barbora Nedomová)
18 .1 Venózne vstupy u pediatrického pacienta – klasifikácia a indikácie
18 .2 Periférne venózne vstupy u detí (SPC, LPC, midline) a pacient s DIVA
18 .3 Periférne zavedený centrálny katéter (PICC) u detí
18 4 Centrálne a femorálne zavedené centrálne katétre
18 .5 Tunelizovaný centrálne zavedený centrálny katéter (tunelizovaný CICC bez manžety – tnc-CICC) a plne implantovaný centrálny venózny vstup (port a PICC port)
Seznam zkratek
Medailonky autorů
Souhrn
Rejstřík
Předmluva
V současnosti je cévní, především žilní vstup využíván prakticky ve všech medicínských oborech. Z toho vyplývá, že jde o multioborovou problematiku. Bez nadsázky lze tvrdit, že pokroky, kterých moderní medicína dosáhla, by byly bez cévních vstupů nemožné. Cévní vstupy umožňují řadu vyšetření, která jsou nezbytná pro stanovení správné diagnózy. Od krevních odběrů pro biochemické nebo hematologické vyšetření až po sofistikované výkony, jako je například CT nebo MR angiografie. Bez žilních vstupů není možná aplikace mnoha léků a infuzních roztoků. Jsou naprosto nezbytné v intenzivní péči, a to jak při podávání nezbytných, život zachraňujících léků, tak při akutních invazivních výkonech. Specifické vstupy jsou potřeba pro eliminační metody, na kterých je závislá celá řada našich nemocných. Prakticky u všech operačních výkonů je zajištění vstupu do krevního řečiště jejich integrální součástí. Podávání protinádorových léčiv a domácí parenterální výživy je podmíněno zavedením žilního vstupu.
V průběhu hospitalizace je u většiny nemocných nějaký typ žilního vstupu zaveden, ale i v ambulantní péči je jeho využití často podmínkou úspěšné léčby. V USA je ročně zavedeno 150 milionů žilních vstupů. Lze předpokládat, že v České a Slovenské republice bude relativní četnost zavedení podobná, což odpovídá 5 milionům žilních vstupů v České a 2,5 milionům ve Slovenské republice.
S žilními vstupy se tak setkáváme dennodenně v každém zdravotnickém zařízení. Nezřídka jsou zaváděny téměř automaticky bez předchozí úvahy o jejich významu u daného pacienta. Tento problém je celosvětový a v odborné literatuře se setkáváme s poměrně vysokým procentem vstupů, které byly zavedeny zbytečně. Tato praxe nejenom zatěžuje pacienty, ale je i ekonomicky nevýhodná. Zavedení jakéhokoliv cévního vstupu má být provedeno po předchozím zvážení jeho indikace. Vždy je potřeba posoudit nejen jeho výhody, ale i riziko komplikací, které se mohou vyskytnout.
Komplikace, s nimiž se setkáváme v souvislosti s jejich zavedením, představují vždy iatrogenní poškození, které může být i velmi závažné. Četnost a závažnost těchto komplikací závisí na komplexním přístupu k dané problematice – od správné indikace cévního vstupu a optimální techniky zavedení až po ošetřování podle definovaných standardů.
Na přelomu druhého a třetího tisíciletí byly žilní vstupy děleny na krátkodobé a dlouhodobé. Krátkodobým vstupem byla periferní žilní kanyla a netunelizovaný centrální žilní katétr, které se využívaly výhradně v průběhu hospitalizace. Periferní kanylu zaváděly sestry, centrální katétry lékaři, většinou intenzivisté a anesteziologové. Mezi dlouhodobé vstupy patřil Broviacův katétr pro domácí parenterální výživu, permanentní katétr pro dlouhodobou eliminaci a intravenózní port, indikovaný většinou pro onkologické pacienty. Tyto vstupy zaváděli chirurgové, radiologové, v některých případech i intenzivisté a anesteziologové. Dlouhodobé vstupy byly určeny pro ambulantní péči a byla na ně uplatňována mnohem přísnější kritéria při zavedení i používání. U těchto vstupů se již v té době prováděla tunelizace.
Začátkem tohoto století vznikají v České republice odborné společnosti, které se věnují problematice dlouhodobých vstupů. V rámci Společnosti klinické výživy a intenzivní metabolické péče byla vytvořena skupina, jež se věnuje problematice domácí parenterální výživy včetně zajištění cévním vstupem. V roce 2007 založilo pět lékařů
Cévní vstupy
Společnost pro porty a permanentní katétry (SPPK) s cílem optimalizovat cévní vstup především u onkologických nemocných. Po roce 2010 vznikla ještě Česká společnost pro cévní přístup, která se zabývá zajištěním cévního vstupu pro pacienty s chronickým selháním ledvin. SPPK v prvních letech pořádala několik konferencí a kongresů, kde vystoupili i zahraniční lékaři – experti v oblasti cévního vstupu, kteří v roce 2010 byli u zrodu Světové organizace cévního vstupu (WoCoVA). V roce 2012 se členové SPPK zúčastnili II. světového kongresu WoCoVA v Amsterdamu. Na podkladě informací tam získaných došlo v roce 2012 k vzniku 1. PICC týmu v České republice a v roce 2014 ke změně náplně činnosti společnosti. Základním cílem se stalo zajištění optimálního cévního vstupu pro každého pacienta bez ohledu na typ onemocnění, typ cévního vstupu a dobu jeho zavedení. Tato nová orientace SPPK se projevila v činnosti společnosti – organizování vlastních konferencí, účast na kongresech dalších odborných společností, aktivní účast na kongresech WoCoVA od roku 2014, pořádání workshopů, podpora vzniku PICC a kanylačních týmů. Dalším významným počinem byla publikace Žilní vstupy vydaná v roce 2016.
SPPK se stala národní společností spolupracující s WoCoVA v roce 2018. V roce 2019 byla přijata do České lékařské společnosti Jana Evangelisty Purkyně. SPPK uspořádala 8. kongres WoCoVA v dubnu 2024 v Praze.
WoCoVA, a tedy i SPPK reflektuje změny, ke kterým došlo v oblasti cévních vstupů od začátku našeho století.
Zavedení ultrazvuku do problematiky cévního vstupu vedlo k velmi významnému snížení rizik komplikací. V současnosti nelze zavedení centrálního žilního vstupu bez iniciálního ultrazvukového (UZ) vyšetření a následné UZ navigace v reálném čase považovat za postup lege artis. UZ vyšetření je nezbytné i při výběru vhodného periferního žilního vstupu v případě, že povrchový žilní systém na horní končetině je insuficientní. I v našich zemích periferní žilní vstupy zavádějí sestry – nelékařští zdravotničtí pracovníci, a proto je žádoucí, aby byli ultrazvuk schopni v této souvislosti využít.
Problematika zavedení žilního vstupu je tedy nejenom multioborová, ale i multiprofesní.
Další významnou změnou v minulém desetiletí byl definitivní průkaz, že periferně zaváděné centrální žilní katétry (PICC) jsou indikovány u hospitalizovaných nemocných jako elektivní centrální vstup první volby. Tyto katétry v řadě zemí zavádějí nelékaři – sestry. I v České republice je od roku 2016 díky členům SPPK nelékař oprávněn vstup zavést po absolvování certifikovaného kurzu Ministerstva zdravotnictví.
Významné bylo i zavedení nových typů periferních žilních vstupů – dlouhých periferních katétrů, které mají významně delší životnost než klasické periferní kanyly.
Technika tunelizace se v současnosti využívá i u centrálních žilních katétrů v průběhu hospitalizace.
Celá řada dalších inovací snížila rizika komplikací souvisejících s cévním vstupem:
1. Byly definovány oblasti těla, kde je nejmenší mikrobiální osídlení a kde je optimální místo výstupu katétru na povrchu z kůže a jeho fixace.
2. Zavedení tzv. mikropunkční techniky při zavedení vstupů, protože snižuje riziko poranění endotelu a následných komplikací.
3. Zavedení tkáňového lepidla, nových typů zátek do katétrů, způsobu fixace a krytí.
4. Definování způsobu a četnosti převazů v průběhu využívání cévního vstupu.
5. Časná monitorace komplikací podle definovaných škál a jejich řešení atd.
Uvedené pokroky umožnily definování současných protokolů zavedení a ošetřování cévních vstupů, které jsou spojeny s významným snížením rizika komplikací.
Problematika cévního vstupu se neustále vyvíjí a v současnosti vyžaduje, aby se této problematice věnovali specialisté, kteří mají v problematice komplexní znalosti a dovednosti. Dělení na krátkodobé a dlouhodobé žilní vstupy je víceméně historické, přístup ke všem typům cévních vstupů má reflektovat současné poznatky tak, aby u všech bylo riziko komplikací maximálně omezeno.
Doporučuje se vytvářet týmy specialistů – lékařů i nelékařů, kteří péči o cévní vstup zajišťují v plném rozsahu.
Uvedené změny a další relevantní údaje jsou obsaženy podrobně v publikaci, kterou čtenář dostává do ruky.
Vedle respektování všech odborných poznatků je nutné důvod zavedení cévního vstupu vždy pacientovi podrobně vysvětlit. Zdravotnický personál, který vstup indikuje, zavádí a ošetřuje, má k pacientovi přistupovat tak, aby měl důvěru, že všechny výkony jsou prováděny v jeho zájmu. Ošetřující personál by měl být empatický, mít vždy dostatek času s pacientem komunikovat a reagovat na jeho případné otázky a rozmělnit jeho obavy. Teprve spojení odborných vědomostí a etického přístupu k pacientovi je předpokladem optimálního výsledku jakékoliv intervence. Právě to je hlavní důvod, proč členové SPPK vytvářejí na pracovištích týmy lékařů a sester, které se setrvale v problematice vzdělávají a vzájemně i vytvářejí optimální pracovní vztahy, které se projeví ve vysoké kvalitě poskytované péče. Jak již bylo zmíněno, cévní, a zejména žilní vstupy jsou využívány téměř ve všech medicínských oborech. Z tohoto důvodu jsme se rozhodli, aby byla kniha napsána celou řadou kolegů a kolegyň, lékařů i sester. Čtenář si jistě všimne, že některé informace se opakují v kapitolách, které psali autoři různých specializací. Domnívám se, že tato skutečnost není na škodu, protože jen podtrhuje jejich význam.
Kniha byla napsána mnoha autory, a proto bylo potřeba, aby navzdory různorodosti specializací autorů měla jednotný charakter. Jsem toho názoru, že se to úspěšně zdařilo díky velkému úsilí editorů – MUDr. Jaroslava Čutory, MUDr. Vendelína Chovance, Ph.D., MUDr. Viktora Maňáska a Mgr. Kateřiny Lisové.
Rovněž musím poděkovat za přínosné recenzní posudky recenzentům Dr. h.c. prof. MUDr. Karolu Králinskému, PhD., doc. MUDr. Martinu Stříteskému, CSc., a PhDr. Marii Zvoníčkové.
Od založení SPPK letos uplyne 18 let. Věk, kdy se skládá maturitní zkouška. Věřím, že předkládaná publikace prokáže, že ji naše společnost složila úspěšně.
prof. MUDr. Jiří Charvát, CSc.
1 Základní informace
Viktor Maňásek, Jiří Charvát, Jitka Fricová, Vendelín Chovanec, Petra Rozsívalová, Martina Douglas, Martin Troubil, Adéla Prchlíková, Jan Máchal, Štěpán Hrabovský
1.1 Historie cévního vstupu
Viktor Maňásek, Jiří Charvát, Jitka Fricová
Souhrn
Názory na vlastnosti a funkci cévního systému se vyvíjely od starověku, první pokusy s kanylacemi započaly v 17. století n. l. V kapitole jsou shrnuty stěžejní milníky, které vedly k rozmachu medicíny cévních vstupů. Zmiňujeme počátky vývoje jednotlivých druhů cévních vstupů. Na konci rozvoje tohoto druhu medicíny pak stojí vznik národních i mezinárodních společností, které se zabývají danou problematikou a jejichž aktivity vedou ke zlepšování techniky zavádění i ošetřování cévních vstupů.
Ve starověku byl významu cévního systému věnován velký zájem. Již v 27. století před naším letopočtem se Imhotep v Egyptě domníval, že v těle je systém kanálků, kterými cirkuluje krev, vzduch a odpadní látky až do doby, než jsou z těla vyloučeny přes konečník. V oblasti Mezopotámie byla játra vzhledem k hustotě cévního zásobení považována za centrum oběhové soustavy. Stejnou představu sdílel i známý řecký lékař Galén (obr. 1.1). Poměrně detailní popis cévního systému je uveden ve staročínských učebnicích (3. století př. n. l.), ve kterých je srdce považováno za orgán, jenž řídí a zajišťuje cirkulaci krve. Již předtím Aristoteles (ve 4. století př. n. l.) poprvé předpokládal, že krev se tvoří v srdci a poté je odtud vedena do celého těla. Ve starověkém Řecku a Římě byla známa metoda „pouštění žilou“, což se dochovalo i ve formě vyobrazení na keramických nádobách. Podle řecké mytologie první intravenózní injekci provedla čarodějnice Medea, která podřízla žílu na krku Jasonova otce, aby do ní vstříkla svůj omlazující kouzelný lektvar.
Až do 17. století ale lékaři a vědci nerozuměli fyziologii oběhového systému a tělních tekutin. Zásadní význam pro pochopení činnosti oběhového systému měla práce Williama Harveye (obr. 1.2), který v roce 1616 představil svoji koncepci krevního oběhu. Ve svém spise Anatomická pojednání o pohybu srdce a krve vyvrátil Galénovo tvrzení, že krev je vedena v žilách střídavě tam a zpět.
Jeho práce byla podnětem k experimentům, které byly popsány ještě v 17. století Percivalem Christopherem Wrenem a Johannem Danielem Majorem. Wren byl první

Obr. 1.1 Řecký lékař Galén

Obr. 1.2 William Harvey
vědec, který zkoumal žilní kanylaci u zvířat. Naplnil prasečí žlučník tekutinou (víno, opium, moč, pivo atd.) a pomocí brka aplikoval látku do psí žíly. Major v roce 1662 poprvé aplikoval intravenózní injekci opioidu u člověka. Krátce poté, v roce 1665, Richard Lower provedl první úspěšnou transfuzi z krční arterie do jugulární žíly mezi dvěma psy. První úspěšná transfuze u člověka byla popsána v roce 1818 u rodičky umírající na těžké poporodní krvácení.
Centrální žílu u zvířete poprvé kanyloval Sheppard Stephen Hales. V roce 1733 zavedl skleněnou trubičku do pravé vnitřní jugulární žíly kobyly, posunul ji do horní duté žíly a změřil centrální žilní tlak. Claude Bernard poprvé kanyloval současně jak centrální žílu, tak karotickou tepnu v roce 1844 a popsal komplikace, které s kanylací centrálních cév mohou být spojeny, jako je perforace srdečních komor.
Na další zájem o využití periferního žilního systému mělo vliv objevení krevních skupin začátkem 20. století a zavedení léků, které bylo možné aplikovat intravenózně. Z hlediska využití centrálního žilního systému u člověka byla zcela zásadní práce Wernera Forssmanna (obr. 1.3), který v roce 1929 publikoval v časopise Klinische Wochenschrift sdělení Sondáž pravého srdce, kdy popisuje pokus na vlastní osobě s tenkou gumovou hadičkou, kterou si zasunul žilou z loketního ohbí do pravé srdeční síně bez komplikací (obr. 1.4). Po zasunutí do hloubky 65 cm se konec katétru dostal do pravé srdeční síně, což Forssmann zachytil na rentgenovém snímku. Jeho práce ale nebyla pochopena a byl za ni svými nadřízenými kritizován. V následujících letech se této problematice již nevěnoval.
Nicméně ve třicátých a čtyřicátých letech 20. století na Forssmanna navázali v USA André Fréderic Cournand a Dickinson Woodruff Richards, kteří zavedli

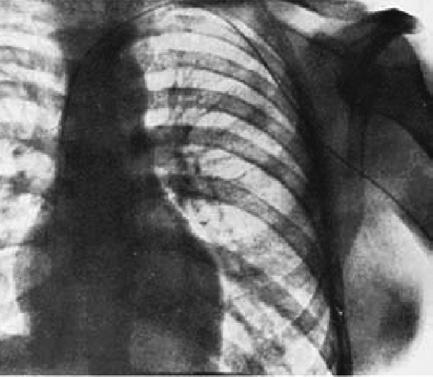
Obr. 1.4 Skiagram první katetrizace z loketního ohbí do pravé srdeční síně W. Forssmannem v roce 1929 (Wake et al.)
metodu srdeční katetrizace jako zlatý standard při hodnocení srdeční fyziologie a patofyziologie. Zaváděli speciální radiokontrastní katétry s hladkým povrchem, vyrobené ze zpracovaného hedvábí. V roce 1956 jim společně s Wernerem Forssmannem byla udělena Nobelova cena.
Po druhé světové válce se začínají cévní vstupy stále více využívat a dochází k pokrokům v jejich zavádění a využívání. Někteří autoři tuto skutečnost interpretují tak, že tehdy skončila historická etapa a začíná současnost v oblasti cévního vstupu.
V roce 1945 se začala využívat polyetylenová kanyla, která byla zavedena skrze jehlu do žíly. V roce 1952 francouzský lékař Aubaniac poprvé perkutánně kanyloval podklíčkovou žílu pro rychlou aplikaci transfuze. Ve stejném roce popsal Seldinger metodu zavedení katétru po flexibilním vodiči, jenž byl zaveden do cévy skrze punkční jehlu. Inspiraci získal ve chvíli, kdy pozoroval svého syna hrajícího na kytaru. Supraklavikulární přístup ke kanylaci podklíčkové žíly byl popsán Yoffou v roce 1965.
V roce 1960 Wilson poprvé využil centrální žilní katétry k monitorování centrálního žilního tlaku. O šest let později Brescia poprvé vytvořil arteriovenózní fistulu na předloktí, ve které byl minutový průtok 250–300 ml za minutu, což bylo nezbytné pro hemodialyzační léčbu. Dudrick v roce 1968 využil infraklavikulárně zavedený katétr pro dlouhodobou parenterální výživu.
V roce 1973 byl vyvinut Broviacův silikonový katétr s dakronovou manžetou k zavedení do horní duté žíly s tunelizací podkožím na hrudník. V roce 1979 tento katétr modifikoval Hickman zesílením a zvětšením jeho lumen. Do dnešní doby je tento katétr využíván jako zlatý standard pro aplikaci domácí parenterální výživy. Dudrick v roce 1984 popsal translumbální a transhepatální přístup do dolní duté žíly.
V roce 1982 Niederhuber představil nový typ dlouhodobého žilního vstupu s anglickým označením TIVAD (totally implantable vascular access device), pro který se vžil termín port.
Snaha o zavedení centrálního vstupu z horní končetiny byla lákavá pro svoji bezpečnost, ale byla dlouho zatížena omezenou úspěšností zavedení a vysokou četností

Obr. 1.5 Logo WoCoVA/GloVANet
komplikací. V roce 1975 se objevují periferně zavedené centrální katétry (PICC) vyrobené ze silikonu, které byly sice kvalitnější než dříve zkoušené polyetylenové katétry (drum), ale teprve zavedení ultrazvuku při zavádění cévních vstupů koncem minulého století umožnilo jejich využití v klinické praxi.
Výrazným pokrokem bylo zavedení mikrozaváděcí techniky a modifikované Seldingerovy metody, které významně snižují riziko poškození cévy při kanylaci. Až v tomto století se objevují katétry z kvalitního materiálu (nové generace polyuretanu) s potenciálem vysoké odolnosti k tlaku při podávání kontrastní látky během vyšetření výpočetní tomografií (tzv. power katétry).
Vývoj v oblasti cévního vstupu ve světě probíhal v minulosti asymetricky. Potřeba vzájemného předávání informací a zkušeností vedla v roce 2010 k vytvoření Světové organizace cévních vstupů (World Congress of Vascular Access, WoCoVA), která pořádá pravidelně mezinárodní kongresy v oblasti cévních vstupů.


Obr. 1.7 Posterová prezentace na mezinárodní konferenci WoCoVA 2024 v Praze
Obr. 1.6 Předseda SPPK prof. MUDr. Jiří Charvát, CSc., a prezident WoCoVA Ton van Boxtel na mezinárodní konferenci WoCoVA 2024 v Praze

Obr. 1.8 Česko-slovenský tým zástupců SPPK na konferenci WoCoVA 2022 v Aténách
V rámci ČR a SR je aktivní Společnost pro porty a permanentní katétry (SPPK), která sdružuje lékaře a zdravotní sestry věnující se dané problematice. Je součástí České lékařské společnosti J. E. Purkyně. Ve vedení SPPK je jedenáctičlenný multioborový a multiprofesní výbor a tříčlenná revizní komise. SPPK pořádá pravidelné konference a workshopy, členové prezentují výsledky své práce v odborných tuzemských i zahraničních časopisech.
V roce 2019 byla vytvořena zastřešující organizace Global Vascular Access Network (GloVANet), jejíž největší a nejdůležitější aktivitou jsou sice kongresy WoCoVA, ale v jejím rámci probíhají další vzdělávací akce a školení, výzkum a další projekty (obr. 1.5). Členové SPPK se pravidelně aktivně zúčastňují mezinárodní konference WoCoVA, která je pořádána každé dva roky a je příležitostí setkat se s mezinárodně uznávanými odborníky a prezentovat vlastní výsledky (obr. 1.6–1.8). GloVANet si klade za cíl být mezinárodní sítí pro zvýšení celosvětového povědomí o cévním přístupu a zlepšení péče o pacienty.
Literatura
Aubaniac R. Subclavian intravenous injection: advantages and technic. Press Med. 1952;60: 1456.
Brescia MJ, Cimino JE, Appel K, et al. Chronic hemodialysis using venepucture and surgically created arteriovenous fistula. N Engl J Med. 1966;275:1089–1092.
Broviac JW, Cole JJ, Schribner BH. A silicone rubber atrial catheter for prolonged parenteral alimentation. Surg Gynecol Obstet. 1973;136:602–606.
Dudrick SJ. History of vascular access. JPEN J Parenter Enteral Nutr. 2006;30(1 Suppl): S47–56. Dudrick SJ, Wilmore DW, Vars HM, et al. Long-term total parenteral nutrition with growth, development, and positive nitrogen balance. Surgery. 1968;64:134–142.
Forssmann W. Experiment on mysem: memoirs of surgeon in Germany. New York, NY: St. Martin’s Press, 1974.
Forssmann-Falck R. Werner Forssmann: a pioneer of cardiology. Am J Cardiol. 1997;79: 651–660.
Gibson WC. The biomedical pursuits of Christopher Wren. Med Hist. 1970;14:331–341.
Harvey W. Exercitatio anatomica de motu cordis et sanguinis in animalibus. Francofurti: Guilielmi Fitzeri, 1628.
Hicman RO, Buckner CD, Clift RA, et al. A modified right atrial catheter for access to the venous system in marrow transplant recipients. Surg Gynecol Obstet. 1979;148:871–875.
Konner K. History of vascular access for haemodialysis. Nephrol Dial Transplant. 2005;20: 2629–2635.
Niederhuber JE, Ensminger W, Gyves JW, et al. Totally implanted venous and arterial access system to replace external catheters in cancer treatment. Surgery. 1982;706–712.
Sandrucci S, Mussa B. Peripherally inserted central velus catheters. Berlin: Springer-Verlag, 2014.
Smith IB. The impact of Stephen Hales on medicine. JR Soc Med. 1993;86:349–352.
Tan SY, Holland P. Claude Bernard (1813–1978): father of experimental medicine. Singapore Med J. 2005;30:420–421.
Wake R, Yoshiyama M, Iida H, et al. History of coronary angiography [online]. In: Advances in the diagnosis of coronary atherosclerosis. InTech, 2011. Online. Dostupné z: http://dx.doi. org/10.5772/22578. [citováno 2025-01-14].
1.2 Význam a vlastnosti cévních vstupů
Jiří Charvát, Vendelín Chovanec
Souhrn
Cévní vstupy jsou nezbytné pro využití současných poznatků ve většině klinických oborů. Na druhou stranu mohou vést ke komplikacím, které zhoršují stav nemocných. Správný výběr cévního vstupu je základním předpokladem jejich prevence. V současné době jsou využívány zejména polyuretanové katétry, které jsou asociovány s komplikacemi méně než dříve používané materiály. Výhodné je zavedení tzv. power katétrů, které umožňují aplikaci do katétru pod vysokým tlakem. V některých situacích je vhodné zvážit využití katétrů impregnovaných antibakteriální nebo antitrombotickou látkou.
1.2.1 Význam cévních vstupů
Zavedení cévního vstupu patří mezi invazivní výkony, kdy je zaveden katétr (tenká trubička či hadička vyrobená ze speciálního materiálu) do cévního systému. Podle typu cévy, ve které je katétr umístěn, dělíme cévní vstupy na žilní a arteriální. Alternativou žilního vstupu je intraoseální přístup.
Žilní vstupy jsou využívány nejčastěji, prakticky ve všech medicínských oborech. Arteriální vstup je využíván u závažných stavů a ve speciálních indikacích, především v kardiologii a radiologii. Rovněž intraoseální vstup je indikován u kritických stavů, kdy není možné zavést katétr do žilního systému.
Cévní vstupy jsou nezbytné při řadě diagnostických vyšetření, při léčebných intervencích jak v intenzivní péči, tak u dlouhodobě nemocných. Většinu současných poznatků medicíny není možné bez zajištění cévního vstupu využít.
Na druhou stranu zavedení cévního vstupu je spojeno s rizikem komplikací, které mohou pacienta závažně ohrozit a mít i negativní ekonomické důsledky. Mezi nejzávažnější komplikace patří především infekce, ale také mechanické nebo trombotické komplikace.
Riziko komplikací je ovlivněno správnou indikací, způsobem zavedení katétru a kvalitou ošetřování po dobu zavedení vstupu. Z tohoto důvodu je při indikaci, zavedení, využívání a ošetřování cévního vstupu nutné respektovat doporučené postupy – algoritmy, které maximálně redukují riziko komplikací, uvedené v následujících kapitolách.
Optimální žilní vstup je definován jako vstup, jenž zajistí všechny požadované funkce a zároveň má u daného pacienta nejmenší riziko vzniku komplikací.
1.2.2 Materiál pro výrobu katétrů
Ve 20. století byly katétry vyráběny z polyetylenu nebo polyvinylchloridu. Uvedené materiály byly zatíženy vysokým rizikem komplikací, především trombotických
a infekčních. Postupně se vyvinuly materiály, které byly kvalitnější – teflon, silikon a polyuretan. Polyuretanové a silikonové katétry mají ve srovnání s dříve používanými materiály menší riziko výskytu uvedených komplikací.
Teflon je pevný materiál, jenž se dobře zavádí. V současnosti je využíván při výrobě periferních kanyl. Vedle teflonových kanyl jsou dnes k dispozici kanyly z vialonu (typ polyuretanu), které po zavedení při tělesné teplotě změknou. Klinické srovnání obou materiálů vyznívá příznivě pro polyuretan, jenž má menší riziko vzniku flebitid a doba zavedení vstupu bez komplikací je delší. Teflonové katétry mají větší riziko trombózy.
Silikon je materiál, který je biokompatibilní, protože vykazuje teplotní, chemickou a enzymatickou stabilitu. Je proto vhodný pro výrobu portů a katétrů.
Polyuretan patří k termoplastickým polymerům, při tělesné teplotě změkne, což sníží riziko mechanického poškození endotelu. V současnosti je k dispozici již několik generací polyuretanových katétrů.
Silikon je ve srovnání s polyuretanem jemný materiál s omezenou pevností. Následkem toho má silikonový katétr při stejném průsvitu větší zevní průměr. Pro dosažení stejného průtoku tak musí mít silikonový katétr širší stěnu. V minulosti uváděné riziko významnějšího zalamování polyuretanových katétrů ve srovnání se silikonovými neplatí pro nové a v současnosti užívané typy polyuretanu.
Z hlediska výskytu infekční nebo trombotické komplikace nebyl zjištěn mezi těmito materiály významný rozdíl.
Řada studií v posledním desetiletí ukázala, že ve srovnání s polyuretanovými katétry jsou silikonové spojené při dlouhodobém používání s častějšími mechanickými komplikacemi. V současné době je proto většina katétrů vyráběna z polyuretanu.
Nicméně silikon je kvalitní materiál a stále najdeme indikace pro využití silikonových katétrů. Typickým představitelem silikonového katétru je Broviacův katétr, který je často využíván u pacientů za účelem podávání domácí parenterální výživy.
Recentní generace polyuretanových katétrů jsou velmi pevné a snesou vysoký tlak (300 psi). Nazývají se power katétry a je možné do nich aplikovat infuzi rychlostí až 5 ml/s. Některé střednědobé (midline a PICC – peripherally inserted central catheter, z periferie zavedený centrální katétr) a dlouhodobé žilní vstupy (porty) jsou vyráběny právě z polyuretanu, který má uvedenou vlastnost. V současnosti jsou vyráběny i krátkodobé centrální žilní katétry, které mají alespoň jednu linku s touto vlastností. Na katétru je vždy jasně označeno, že se jedná o power vstup. Obava, že používání alkoholových dezinfekčních prostředků vede k biodegradaci, nemá u polyuretanových katétrů využívaných v současné době již opodstatnění.
1.2.3 Velikost katétrů
Katétry mohou mít různý průměr a délku. Průměr se uvádí buď v jednotkách French (zkratka Fr), kdy 1 Fr je 0,33 mm. Katétr velikosti 3 Fr má tedy zevní průměr 1 mm (tab. 1.1). Někdy (například u jehel a krátkých periferních katétrů) se používá jiný systém v jednotkách gauge (zkratka G), kde platí nepřímá úměra, tedy rostoucí hodnota v gauge odpovídá menšímu průměru jehly nebo kanyly. Jak bude uvedeno dále, minimální kalibr žíly, do které bude zaváděn katétr, by měl v milimetrech odpovídat velikosti katétru v jednotkách Fr (tedy pro katétr kalibru 4 Fr je nutné vybrat žílu kalibru alespoň 4 mm).
Tab. 1.1 Přepočet jednotky French na milimetry
Délka katétru se udává v centimetrech. V případě periferních žilních vstupů délka katétru definuje typ katétru. Centrální žilní vstupy jsou pochopitelně delší než katétry periferní. Běžné centrální žilní katétry, zaváděné supra- nebo infraklavikulárně, případně do femorální žíly, měří 15–30 cm. Délka nejčastěji periferně zaváděného centrálního katétru (PICC) je 60 cm.
1.2.4 Počet cest (linek) katétru
U periferního vstupu je většinou jedna cesta s výjimkou midline katétru, který může mít cesty dvě. PICC mají od jedné do tří cest (obr. 1.9). Více cest než tři mají pouze klasické centrální žilní katétry. Hemodialyzační katétry jsou dvoj- až trojcestné.
Stále přetrvává názor, že se zvětšujícím se počtem cest (linek) narůstá riziko infekční komplikace. Podle recentních studií je však uvedené tvrzení zpochybněno a uvádí se, že rozhodující pro riziko infekce je kvalita zavedení vstupu a ošetřovatelské péče. Na druhou stranu, čím více cest má katétr, tím větší má průměr, čímž narůstá riziko trombotické komplikace.
1.2.5 Typy katétrů
Většina katétrů má neodpojitelnou zevní koncovku. Některé typy střednědobých a dlouhodobých vstupů mají odpojitelnou zevní koncovku – portové systémy, některé PICC katétry, některé dlouhodobé hemodialyzační katétry.
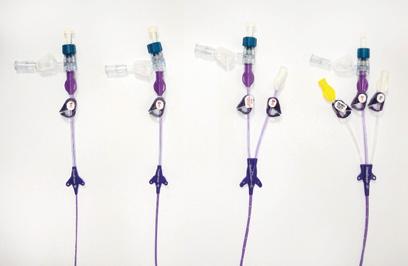
Obr. 1.9 Polyuretanové jedno- až trojcestné PICC (archiv PICC týmu, Fakultní nemocnice Ostrava)

Obr. 1.10 Dakronová manžeta Broviacova katétru (archiv Mgr. H. Kličkové, Fakultní nemocnice Brno)
Cévní katétry mohou být opatřeny chlopní, která reaguje na tlak. To je poměrně časté u zavádění kanyl v rámci modifikované Seldingerovy metody, což je vhodné jako prevence vzduchové embolie a krvácení. Dříve to byl tzv. Groshongův katétr, který se v současnosti již nepoužívá pro větší riziko vzniku infekčních komplikací.
Katétry pro dlouhodobé využití mohou mít tzv. dakronovou manžetu (obr. 1.10), která je po zavedení umístěna v podkoží, kde po několika týdnech proroste vazivovou tkání a tím se fixuje, což zajistí stabilitu katétru, a navíc slouží jako bariéra proti zavlečení infekce podél katétru (obr. 1.11a–c). Typickým představitelem je již zmíněný tzv. Broviacův katétr nebo permanentní hemodialyzační katétry.
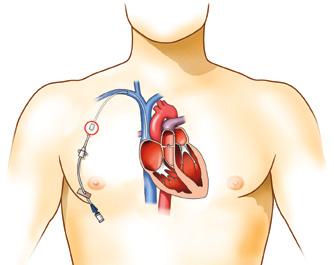
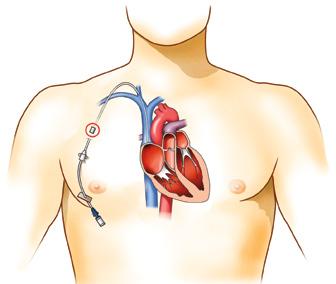
Obr. 1.11a–c Nákres tunelizovaného centrálně zavedeného centrálního katétru (CICC) s dakronovou manžetou. a – Prinicip tunelizovaného katétru s manžetou – 1: dakronová manžeta, 2: výstup katétru z podkoží, b – tunelizace do podklíčku z punkce provedené v nadklíčku, c – tunelizace do podklíčku z punkce vena axillaris (podle archivu MUDr. P. Šmahela, Ph.D., Fakultní nemocnice Hradec Králové, překreslil Jiří Hlaváček)
1.2.6 Úprava katétrů
Jak již bylo zmíněno, při zavedení a po zavedení cévního vstupu se mohou objevit komplikace. Ve snaze snížit riziko infekční a trombotické komplikace byly již od minulého století na katétru prováděny specifické úpravy. Katétry byly impregnovány různými látkami, u kterých byl předpoklad, že by snížily riziko trombózy a formování biofilmu. K impregnaci se používají různé materiály – chlorhexidin, stříbro, sulfadiazin, 5-fluorouracil, heparin. Rovněž byla testována některá antibiotika (monocyklin, rifampicin). Výsledky některých studií prokázaly, že takto potažené katétry snižují výskyt infekcí krevního řečiště, nicméně mortalita kritických pacientů nebyla ovlivněna. Využití těchto katétrů je stále diskutováno. V současné době je jejich zavedení doporučováno u pacientů v průběhu hospitalizace na pracovištích s vysokým výskytem katétrových infekcí.
Literatura
Braun U, Lorenz E, Weimann C, et al. Mechanic and surface properties of central-venous port catheters after removal: A comparison of polyurethane and silicon rubber materials. J Mech Behav Biomed Mater. 2016;64:281–291.
Busch JD, Vens M, Herrmann J, et al. Material failure of silicone catheter lines: a retrospective review of partial and complete ruptures in 553 patients. AJR Am J Roentgenol. 2017;208: 464–469.
Busch JD, Vens M, Mahler C, et al. Complication rates observed in silicone and polyurethane catheters of totally implanted central venous access devices implanted in the upper arm. J asc Interv Radiol. 2017;28:1177–1183.
Gołębiowski T, Kusztal M, Letachowicz K, et al. Difficulties with tunneling of the cuffed catheter: a single-centre experience. Sci Rep. 2018;8:3314.
Gomes de Souza NM, Silveira Rocha R, Pinheiro Ferreira R, et al. Comparing the use of silicone and polyurethane peripherally inserted central catheters in newborns: A retrospective study. J Clin Nurs. 2021;30:3439–3447.
Kojima S, Hiraki T, Gobara H, et al. Fracture of totally implanted central venous access devices: a propensity-score-matched comparison of risks for Groshong silicone versus polyurethane catheters. J Vasc Access. 2016;17:535–541.
LaRusso K, Dumas MP, Schaack G, et al. Prolonged use of ethanol lock prophylaxis with polyurethane catheters in children with intestinal failure: a single-center experience. JPEN J Parenter Enteral Nutr. 2021;45:1425–1431.
Ong CK, Venkatesh SK, Lau GB, et al. Prospective randomized comparative evaluation of proximal valve polyurethane and distal valve silicone peripherally inserted central catheters. J Vasc Interv Radiol. 2010;21:1191–1196.
Pittiruti M, Capazzoli G. Venous access A practical textbook. Roma: Antonio Delfino editore. Medicina-scienze, 2018.
Saijo F, Mutoh M, Tokumine J, et al. Late fracture of Groshong ports: A report of the three cases. J Vasc Access. 2019;20:563–566.
Seckold T, Walker S, Dwyer T. A comparison of silicone and polyurethane PICC lines and postinsertion complication rates: a systematic review. J Vasc Access. 2015;16:167–177.
Shashi KK, Callahan MJ, Tsai A. Diagnostic challenges with central venous catheter studies. Pediatr Radiol. 2022;52:1581–1591.
Schults JA, Kleidon T, Charles K, et al. Peripherally inserted central catheter design and material for reducing catheter failure and complications. Cochrane Database Syst Rev. 2024; 6:CD013366.
Yaxley J. Haemodialysis catheters – a review of design and function. Expert Rev Med Devices. 2022;19:757–762.
Weber MD, Woods-Hill C, Resendiz K, et al. Safety and efficacy of ethanol for catheter salvage and central line-associated bloodstream infection prophylaxis in polyurethane catheters in the PICU. Pediatr Crit Care Med. 2024;25:e232–e238.
Wildgruber M, Lueg C, Borgmeyer S, et al. Polyurethane versus silicone catheters for central venous port devices implanted at the forearm. Eur J Cancer. 2016;59:113–124.
1.3 Základní rozdělení cévních vstupů
Jiří Charvát, Viktor Maňásek
Souhrn
Cévní vstupy jsou využívány v řadě indikací. Jedná se často o zásadní diagnostické a léčebné intervence. Základní dělení je na vstupy žilní a arteriální. Žilní vstupy se poté dělí na centrální a periferní. U každého jednotlivého pacienta je třeba definovat, jaké funkce má cévní vstup splnit, ještě před jeho zavedením a podle toho vybrat příslušný optimální vstup, který současně respektuje zásadu maximálního omezení případné komplikace. Základní rozdělení cévních vstupů má význam při praktické implementaci uvedené zásady.
Cévní vstupy dělíme podle typu cévy, do které je katétr zaveden, na žilní a arteriální. Žilní vstupy dělíme na dvě velké skupiny – periferní a centrální.
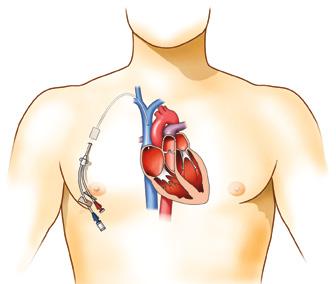
Centrální žilní vstup je arbitrárně definován umístěním distálního konce katétru v horní nebo dolní duté žíle nebo v horní části pravé síně. V případě, že distální konec katétru v žilním řečišti není umístěn v těchto uvedených lokalizacích, cévní vstup nesplňuje kritérium pro centrální žilní vstup. Takový vstup je per exclusionem definován jako periferní (obr. 1.12), a to i v případě, že byl původně zaváděn jako vstup
Tab. 1.2 Velikost krevního průtoku v žilním řečišti
Žíla Průměr (mm) Průtok (ml/min)
metakarpální žíly 2–5 10
vena cephalica na paži
vena basilica na paži
vena axillaris
vena cava superior
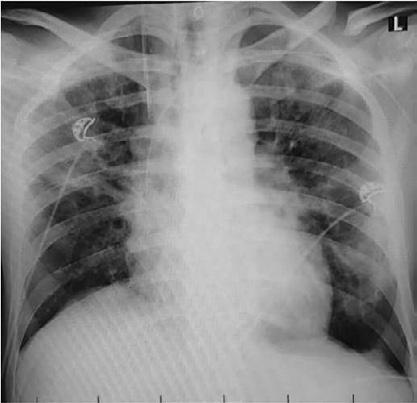
Obr. 1.12 PICC jako centrální žilní katétr zleva, CICC zavedený zprava nesplňuje kritéria pro centrální žilní katétr (archiv prof. MUDr. J. Charváta, CSc., Fakultní nemocnice v Motole)
centrální. Na podkladě řady klinických studií je v současné době za správné uložení distálního konce centrálního žilního katétru považována oblast horní nebo dolní kavoatriální junkce nebo oblast horní části pravé síně (obr. 1.13). Umístění v této oblasti je spojeno s významně nižším výskytem poruchy funkce katétru a trombotické komplikace. Definice optimálního centrálního žilního vstupu není z tohoto pohledu identická s výše uvedenou definicí. Průtok v horní a dolní duté žíle je významně větší než v jakékoliv části periferního řečiště (tab. 1.2). Čím větší je průtok v žíle, tím větší je naředění podané látky. Z tohoto důvodu je možné podávat do centrálního žilního katétru i agresivní léky a roztoky s vysokou koncentrací, které by v periferním řečišti vedly k poškození endotelu a z toho vyplývajícím komplikacím. Uvedené rozdělení žilních vstupů je založeno na množství krevního průtoku v žíle, ale nezohledňuje rizika případných komplikací. V tabulce 1.3 jsou uvedeny indikace pro periferní a centrální žilní katétr.
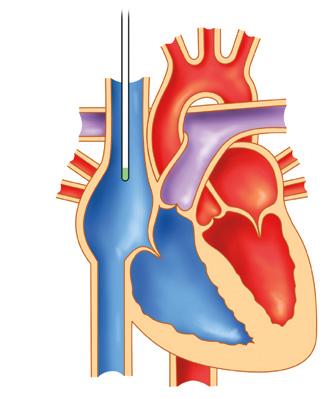
Obr. 1.13 Optimální uložení distálního konce katétru v horní kavoatriální junkci (podle archivu MUDr. P. Šmahela, Ph.D., Fakultní nemocnice Hradec Králové, překreslil Jiří Hlaváček)
Tab. 1.3 Indikace léčiv a roztoků do periferního a centrálního žilního systému
Periferní vstup
pH < 5–9
osmolarita < 600 mOsm/l
Centrální vstup
pH < 5 a pH > 9
osmolarita > 600 mOsm/l léky neiritující endotel aplikace léků iritujících endotel
potřeba častých krevních odběrů hemodynamické monitorování dlouhodobý žilní vstup vazoaktivní léky vezikanty eliminační metody
Zavedení periferního katétru je jednodušší než zavedení katétru centrálního, je spojeno s menším rizikem komplikací a je ekonomicky výhodné. Zavedení periferního žilního vstupu je proto vždy třeba zvážit na prvním místě a centrální žilní vstup rezervovat pro skutečně indikované situace.
Periferní žilní vstupy (peripheral venous access device, PVAD) jsou zaváděny z horní končetiny, výběr místa vstupu do žíly závisí na typu periferního katétru a kvalitě žilního řečiště. V současné době jsou k dispozici tři typy periferních žilních katétrů:
1. Klasická periferní kanyla, která dnes nese oficiální název krátký periferní katétr (short peripheral catheter, SPC).
2. Dlouhý periferní katétr (long peripheral catheter, LPC).
3. Midline katétr (midline catheter, MC).
Definice, indikace a využití jednotlivých PVAD jsou uvedeny v tabulce 1.4.
Mezi centrální žilní vstupy (central venous access device, CVAD) v současné době řadíme tři typy katétrů:
1. Centrálně zavedený centrální katétr (centrally inserted central catheter, CICC), kdy je do žíly vstoupeno z oblasti supra- nebo infraklavikulární. Na podkladě indikace a ultrazvukového (UZ) nálezu je možné zavést vstup do vena axillaris, vena cephalica, vena jugularis interna, vena subclavia, vena brachiocephalica, vena jugularis externa.
2. Periferně zavedený centrální katétr (peripherally inserted central catheter, PICC), kdy je do žíly vstoupeno v oblasti střední části paže, případně z její horní části s tunelizací do střední části. Podle UZ nálezu lze katétr zavést do vena basilica, vena brachialis nebo vena cephalica.
3. Z femorální oblasti zavedený katétr (femorally inserted central catheter, FICC) je katétr, kdy je do žíly vstoupeno v oblasti stehna. Podle indikace a UZ nálezu lze katétr zavést do vena femoralis, vena saphena magna a vena femoralis superficialis.
Žilní katétry se tradičně dělí na krátkodobé, střednědobé a dlouhodobé. Rozdělení je podle doporučované maximální doby zavedení. V tomto kontextu je třeba zdůraznit, že katétry řazené v současnosti mezi střednědobé jsou využívány i v průběhu hospitalizace.
Tab.
1.4 Periferní cévní katétry (PVAD)
Krátký periferní katétr (SPC) Dlouhý periferní katétr (LPC) Midline katétr (MC)
Délka < 6 cm 6–15 cm > 15 cm
Materiál teflon, polyuretan polyuretan polyuretan, silikon
Způsob zavedení bez navigace, palpačně, vizuálně bez navigace nebo UZ UZ
Technika zavedení přímá kanylace přímá kanylace nebo Seldingerova metoda přes zaváděcí sheath
Vhodné pro urgentní situaci ano ano ne
Doba zavedení dny týdny týdny až měsíce
„Power“ aplikace ano, je-li 20G a větší ano ne vždy
Ambulantní použití ne ano (krátkou dobu) ano
Mezi krátkodobé vstupy řadíme SPC (doba zavedení 2–7 dní), LPC (doba zavedení do jednoho měsíce) a netunelizovaný centrální žilní katétr (CICC do 14 dní, FICC do 48 hodin).
Mezi střednědobé vstupy patří z periferních vstupů MC (do 3–4 měsíců), z centrálních PICC (doba zavedení až jeden rok) a tunelizovaný CICC a FICC (více měsíců).
Mezi dlouhodobé patří TIVAD (totally implantable venous access device, totálně implantabilní žilní vstup) a tunelizované katétry s dakronovou manžetou s takřka neomezenou dobou zavedení.
Mezi TIVAD řadíme hrudní port (CICC port), femorální port (FICC port) a pažní (brachiální) port, tzv. PICC port.
CVAD je možné tunelizovat, v nomenklatuře označujeme pomocí „t“, tedy například t-PICC, t-CICC apod. V případě, že je tunelizován CVAD s manžetou, označuje se někdy pomocí „tc“, tedy „cuffed“ (např. tc-CICC, tc-PICC, tc-FICC). U tunelizovaných CVAD bez manžety se užívá pouze označení „t“, případně „tnc“ – „non-cuffed“. Terminologie CVAD je uvedena v tabulce 1.5.
Tab. 1.5 Terminologie centrálních žilních vstupů (CVAD)
CVAD – centrální žilní vstupy
PICC z periferie zavedený centrální katétr
CICC centrální katétr zavedený z žil v oblasti nadklíčku nebo podklíčku
FICC femorálně zavedený centrální katétr
TIVAD – totálně implantabilní žilní vstup (port)
CICC port hrudní port
FICC port femorální port
PICC port pažní (brachiální) port
Tunelizované CVAD
tc tunelizované katétry s manžetou (tc-CICC, tc-PICC, tc-FICC)
tnc tunelizované katétry bez manžety (tnc-CICC, tnc-PICC, tnc-FICC)
první volba: PICC
elektivní vstup
druhá volba: CICC do axilární žíly
centrální žilní vstup v průběhu hospitalizace
třetí volba: CICC supraklavikulárně, doporučena tunelizace
čtvrtá volba: FICC do femorální žíly s tunelizací
emergentní vstup
CICC nebo FICC (vhodné odstranit do 48 hodin)
Obr. 1.14 Algoritmus indikace centrálního žilního vstupu v průběhu hospitalizace
CICC – centrální katétr zavedený z nadklíčku nebo podklíčku, FICC – femorálně zavedený centrální katétr, PICC – z periferie zavedený centrální katétr
Obrázek 1.14 znázorňuje algoritmus výběru centrálního žilního vstupu v průběhu hospitalizace, obrázek 1.15 pak u ambulantních nemocných.
Arteriální katétry jsou zaváděny u závažně nemocných do arteria radialis nebo arteria femoralis k invazivnímu monitorování krevního tlaku, krevním odběrům pro vyšetření acidobazické rovnováhy a arteriálních krevních plynů.
Arteriální vstup je také nezbytný u řady speciálních diagnostických a léčebných postupů. Podrobně bude problematika probrána ve speciální kapitole.
dlouhodobá potřeba žilního vstupu u ambulantních nemocných
střednědobý (< 4–6 měsíců)
první volba: PICC
druhá volba (je-li PICC kontraindikován): tunelizovaný CICC do HDŽ
třetí volba (obstrukce HDŽ): tunelizovaný CICC z VF
dlouhodobý (> 4–6 měsíců)
pro využití (< 1/týdně):
• TIVAD
• PICC port
pro využití (> 1/týdně):
• tc-CICC
• tc-PICC
v případě obstrukce HDŽ přístup přes VF
Obr. 1.15 Algoritmus indikace centrálního žilního vstupu u ambulantních nemocných
CICC – centrální katétr zavedený z nadklíčku nebo podklíčku, FICC – femorálně zavedený centrální katétr, HDŽ – horní dutá žíla, PICC –z periferie zavedený centrální katétr, tc-CICC – tunelizovaný centrální katétr zavedený z nadklíčku nebo podklíčku s manžetou, tc-PICC – z periferie zavedený centrální katétr s manžetou, TIVAD – portový systém, VF – vena femoralis
Literatura
Cotogni P, Pittiruti M. Focus on peripherally inserted central catheters in critically ill patients. World J Crit Care Med. 2014;3:80–94.
Dugan S, Le J, Jew RK. Maximum tolerated osmolarity for peripheral administration of parenteral nutrition in pediatric patients. JPEN J Parenter Enteral Nutr. 2014;38:847–851.
Charvat J, a kol. Žilní vstupy dlouhodobé a střednědobé. Praha: Grada Publishing, 2016.
Chopra V, Flanders SA, Saint S, et al.; Michigan Appropriateness Guide for Intravenouse Catheters (MAGIC) Panel. The Michigan Appropriateness Guide for Intravenous Catheters (MAGIC): Results from a multispecialty panel using the RAND/UCLA appropriateness method. Ann Intern Med. 2015;163(6 Suppl):S1–40.
Maezawa T, Sakuraya M, Yoshida K. The safety of peripherally inserted central venous catheters in critically ill patients: A retrospective observational study. J Vasc Access. 2024;25:1479–1485.
Manrique-Rodríguez S, Heras-Hidalgo I, Pernia-López MS, et al. Standardization and chemical characterization of intravenous therapy in adult patients: a step further in medication safety. Drugs R D. 2021;21:39–64.
Pinelli F, Little A, Kokotis K, et al. Assessment of the MAGIC recommendations in context of evolving evidence based on the use of PICC in ICU. J Vasc Access. 2023;24:836–847.
Pittiruti M, Capazzoli G. Venous access. A practical textbook. Roma: Antonio Delfino Editore, 2018.
Teja B, Bosch NA, Diep C, et al. Complication rates of central venous catheters: a systematic review and meta-analysis. JAMA Intern Med. 2024;184:474–482.
Tripathi S, Gladfelter T. Peripheral intravenous catheters in hospitalized patients: Practice, dwell times, and factors impacting the dwell times: A single center retrospective study. J Vasc Access. 2022;23:581–588.
1.4 Vlastnosti léčiv pro nitrožilní podání
Viktor Maňásek, Petra Rozsívalová
Souhrn
Cílem této kapitoly je nabídnout ucelený přehled aktuálních poznatků a doporučení pro výběr optimálního způsobu aplikace parenterálně podávaných léčiv, která mohou být potenciálně riziková při nesprávném podání pacientovi. Faktory, které zásadně ovlivňují bezpečnost a účinnost intravenózní farmakoterapie, vyplývají z klíčových vlastností léčiv, jakými jsou fyzikálně-chemické charakteristiky, tj. chemická struktura, pH, osmolarita či vazoaktivní účinky. Mechanismy poškození tkáně v důsledku extravazace zahrnují přímou buněčnou toxicitu, osmotický tlakový gradient přes buněčnou membránu, ischemickou nekrózu (způsobenou vazopresory a kationtovými roztoky), mechanickou kompresi, bakteriální kolonizaci a superinfekci.
Úvod
Je odhadováno, že pro více než 80 % hospitalizovaných pacientů je nitrožilní podání hlavní cestou aplikace léčiv. Tato cesta podání je preferována v situacích, kdy je potřeba rychlá a cílená terapeutická odpověď a perorální způsob podání není volbou. Parenterální podání léčiv má své výhody: rychlý nástup účinku, vyšší biologickou dostupnost, možnost podání pacientům, kteří nemohou přijímat léčiva perorální cestou (intenzivní péče, chirurgický pacient, poruchy střevní pasáže, nauzea a zvracení), či zajištění konstantního terapeutického účinku při kontinuální infuzi. Nejčastěji jsou podávány infuzní roztoky tekutin a elektrolytů, parenterální výživa, transfuzní a krevní deriváty, cytostatika, monoklonální protilátky, léčiva typická pro intenzivní péči (vazopresory, antiarytmika aj.).
Řada léčivých přípravků má nevyhovující vlastnosti pro podání do periferního žilního řečiště. Hodnotíme především pH, osmolaritu, chemickou strukturu látky a vazoaktivní potenciál (míru vazokonstrikce, která je léčivem navozena).
• Infiltrace představuje nechtěný únik intravenózně podávaných léčiv či infuzních roztoků do extravaskulární tkáně z intravenózního cévního přístupu (periferního nebo centrálního žilního katétru). Výsledné poškození bývá zpravidla menšího rozsahu.
• Iritanty jsou léčiva způsobující zánět, podráždění nebo bolest v místě extravazace. Pouze některá léčiva z této skupiny mají potenciál způsobovat ulceraci, avšak dochází k ní pouze v případě, když dojde k úniku velkého množství léčiva do okolní tkáně. Poškození ale není závažné.
• Pokud však léčivo působí jako vezikant, způsobuje bolest, zánět a vede k tvorbě puchýřů na kůži. Poškození je klasifikováno jako extravazace, protože zde existuje vysoké riziko poškození tkáně a vážných zranění. Mezi vezikanty patří cytotoxická léčiva (např. antracykliny), léčiva s nefyziologickým pH (< 5 a > 9), vazopresory (adrenalin, noradrenalin, dopamin) a hyperosmolární roztoky (> 600 mOsm/l).
Je třeba pomýšlet rovněž na riziko extravazace u CT kontrastních látek a dále na komplikace způsobené podáním parenterálních přípravků s železem, kdy může dojít i k permanentnímu zabarvení kůže.
Podle zprávy NHS Resolution z roku 2022 jsou ve Velké Británii nejčastěji hlášené případy infiltrace a extravazace zejména při poskytování zdravotní péče v souvislosti s aplikací necytotoxických léčiv ze skupiny vezikantů.
Klinický výzkum prokázal, že léčiva s extrémní hodnotou pH (< 5,0 a > 9,0) způsobují endoteliální poškození. K poškození endotelu cév může dojít rovněž při aplikaci roztoků hypotonických (< 200 mOsm/l) či hypertonických (≥ 600 mOsm/l). Ke tkáňovému poškození dojde mezibuněčnými přesuny tekutiny při rozdílné osmolaritě, zvýšený osmotický tlak navíc komprimuje cévy, nervy a svalovou tkáň.
Léčivé přípravky pro parenterální výživu mají kyselé pH (≈ 5,6–6,4), což může působit poškození tkáně. Kromě vyvolání vazokonstrikce vápníkem mohou vápenaté ionty z kalcium glukonátu nebo kalcium chloridu v tkáních vytvářet sraženiny ve spojení s fosforem, a to i ve větší vzdálenosti od místa extravazace. V místě infuzní aplikace se obvykle během několika hodin až dnů objeví makulární erytém. Toxické účinky se poté šíří do hlubších tkání, což může vést ke vzniku dekubitálních vředů do 48–72 hodin a následně k nekróze během několika týdnů. Může dojít i ke kalcifikacím
v cévách, papulám a podkožním induracím, což může ztížit diagnózu, protože kalcifikace bývají mylně zaměňovány za osteomyelitidu, celulitidu nebo vaskulární onemocnění. Mírné léze se obvykle spontánně hojí během několika měsíců.
V případě podání vazoaktivních léčiv je prohloubena lokální tkáňová ischemie, navozená vazokonstrikcí. Periferní žíly reprezentují nízkoprůtokové řečiště, a proto může podání iritačních látek vést k poškození endoteliální vrstvy intimy s rozvojem trombózy. Zánětlivý proces může přecházet na medii s výskytem edému a rizikem ruptury cévní stěny. Je důležité si uvědomit, že nežádoucí působení vezikantů nenastává jen při jejich evidentní extravazaci (např. dislokací kanyly), ale rovněž při postižení permeability žilní stěny vyvolaném zánětlivým procesem. U těchto léčiv je jasně doporučeno podání do centrální žilního katétru. Mezi riziková léčiva patří především cytostatika ze skupiny vezikantů, z necytotoxických léčiv protiinfekční látky (některá antibiotika a antivirotika či antimykotika), dále sympatomimetika, antiepileptika, anestetika, roztoky parenterální výživy a roztoky elektrolytů.
Recentní doporučení Infusion Nurses Society (INS) z roku 2024 uvádějí následující léčiva jako příčinu možného rozvoje chemické flebitidy: amiodaron, nikardipin, noradrenalin, dobutamin, levetiracetam, glukóza > 10%; protinádorová cytostatika (tab. 1.6), antibiotika (např. flukloxacilin a vankomycin); roztoky s chloridem draselným, roztoky o extrémních hodnotách pH a osmolarity.
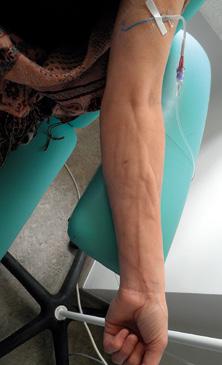
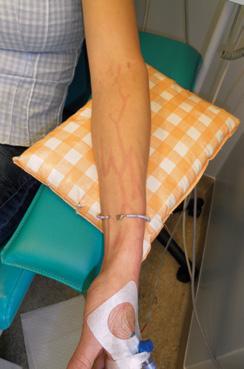
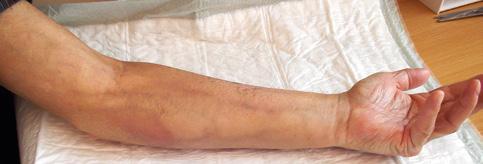
Podávání rizikových léčiv může vést ke vzniku chronických změn, které zvlášť při opakované a dlouhodobé aplikaci do periferie vedou k rozvoji devastace periferního žilního systému (obr. 1.16a–d).
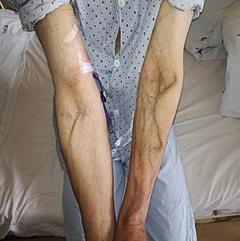
Obr. 1.16 Devastace žilního systému podáváním léčiv nevhodných k aplikaci do periferního řečiště (a – archiv J. Kalodové Hadačové, Fakultní nemocnice Brno, b, c – archiv E. Vykoukalové, Masarykův onkologický ústav Brno, d – archiv Mgr. L. Šeflové, Fakultní nemocnice Olomouc)
Tab. 1.6 Příklady cytotoxických léčiv vyvolávajících lokální kožní reakce a chemické flebitidy
Lokální kožní reakce
Chemická flebitida
asparagináza amsakrin
cisplatina karmustin
daunorubicin cisplatina
doxorubicin dakarbazin
epirubicin epirubicin
fludarabin fluorouracil (v kontinuální infuzi)
melfalan gemcitabin vinorelbin
Poznámka: Lokální reakce podobná extravazaci (zarudnutí, svědění, urtika) se může u některých cytostatik vyskytnout i při správné aplikaci.
1.4.1 pH léčiv
Nitrožilní léčiva můžeme dělit podle hodnoty pH na kyselá a zásaditá. pH značí záporný dekadický logaritmus koncentrace vodíkových iontů. Za neutrální označujeme pH 7,0. pH pod 7,0 reprezentuje kyselou koncentraci, pH nad 7,0 pak koncentraci zásaditou. Fyziologické pH lidské plazmy se pohybuje v rozmezí 7,38–7,42.
Změny pH ovlivňují buněčnou homeostázu tím, že mění konformaci proteinů, enzymatické reakce a intracelulární i mezibuněčnou komunikaci. Alkalické látky způsobují rozpouštění proteinů, destrukci kolagenu a saponifikaci mastných kyselin, což vede k lýze membrán a buněčné smrti. Po erytému a edému dochází k denaturaci extracelulární matrix, která umožňuje pronikání hydroxidových iontů do hlubších tkání, což může vést k poškození podobnému kolikvační nekróze. Poškození způsobené alkalickými látkami je obecně závažnější než u kyselin. Kyselé látky způsobují vazokonstrikci, edém, rozpad a ulceraci kůže. Dehydratace buněk a následná nekróza v důsledku koagulace proteinů mohou vést ke vzniku vředů. Závažnost poškození tkáně závisí na délce expozice, pH látky a titrační rezervě, což je teoretické množství exogenní neutralizační látky potřebné k návratu na fyziologické pH.
Některá běžně užívaná léčiva mají pH mimo relativně bezpečné rozmezí 5,0–9,0 (tab. 1.7). Příkladem léčiv s velmi nízkým pH jsou například některá antibiotika (vankomycin, gentamicin, ciprofloxacin aj.). Je dobré si uvědomit, že jejich pH se blíží úrovni pH citronové šťávy (pH 2,0) nebo octa (pH 3,0). Vysoce alkalický je oproti tomu ampicilin, z antivirotik aciklovir a ganciklovir, jejichž pH se blíží úrovni amoniaku (pH 11,0). Při indikaci látek o pH pod 5,0 a nad 9,0 je doporučeno zvážit podávání do centrálního žilního řečiště, neboť rizika při periferní aplikaci by mohla převyšovat nad riziky, která přináší centrální žilní kanylace. Nicméně se ukazuje, že pH samo o sobě není jediným faktorem, který by měl rozhodnout o indikaci centrální kanylace. Je nutno přihlédnout k dalším faktorům, jako je délka trvání nitrožilní léčby, lokalizace periferní kanyly (kalibr žíly, vyhnutí se ohbím končetiny), velikost katétru, stav periferních žil a preference pacienta.
Tab. 1.7 Příklady pH různých intravenózních léčiv (upraveno podle NIVAS, infiltration and extravasation: A toolkit to improve practice, 2024; Smolders et al., 2020, Ballesteros-Peña et al., 2022)
žaludeční kyselina
kola
ocet 2,9
pomerančový džus 3,5
glukagon pH 2,5–3,0
vankomycin pH 2,4–4,5
adrenalin pH 2,5–4,0
isavukonazol pH 2,8–2,9
posakonazol pH 2,3–2,9
gentamicin pH 3,0–5,5
anidulafungin pH 3,5–5,5
glyceroltrinitrát pH 3,5–6,5
haloperidol pH 3,7
metoklopramid pH 3,0–5,0
amiodaron pH 3,5–4,5
labetalol pH 3,5–4,5
ciprofloxacin pH 3,9–4,9
esmolol pH 4,5–5,5
glukóza 5% pH 4,0–4,2
kalium chloratum pH 4,0
paracetamol pH 5,0
piperacilin/tazobaktam pH 5,0–7,0
tramadol pH 6,1
Ringerův roztok pH 6,0–7,5
fyziologický roztok 0,9% pH 7,0 čistá voda
furosemid pH 8,7–9,3
voda
jedlá soda
mýdlo
bělicí prostředek 12,5
aminofylin pH 8,8–10,0
propofol pH 8,0
hydrogenuhličitan sodný pH 8,4
pantoprazol pH 9,4
dantrolen pH 9,5
kotrimoxazol pH 9,5–11 epoprostenol pH 9,5 aciklovir pH 10,0–11,0 fenobarbital pH 10,0–11,0 thiopental pH 10,0–11,0
fenytoin pH 10–12,3
1.4.2 Osmolalita a osmolarita léčiv
Osmolalita představuje množství osmoticky aktivních látek v jednotce hmotnosti rozpouštědla. Obvykle se vyjadřuje v osmolech na kilogram (Osm/kg). Osmolalita je rovna součinu molality a počtu částic vzniklých disociací jedné molekuly. Osmolarita značí množství všech osmoticky aktivních látek v daném objemu, nejčastěji v jednom litru (Osm/l). U silně naředěných vodných roztoků se hodnoty osmolarity a osmolality téměř neliší, protože 1 litr vody se přibližně rovná 1 kilogramu vody a množství rozpuštěných látek je možné zanedbat. Fyziologické rozmezí je 285–310 mOsm/l. Hranice pro hypotonický roztok je 250 mOsm/l a nižší. Příkladem takového hypotonického
Tab. 1.8 Příklady rizikových intravenózních léčiv s ohledem na osmolaritu či osmolalitu (upraveno podle Le A, Patel S, 2014, David et al., 2020, a Trissel’s Handbook on injectable drugs)
Léčivo (ředění)
Osmolarita (mOsm/l)/osmolalita (mOsm/kg)
L-arginin hydrochlorid (50 mg/ml v G10) 1200
calcium gluconicum 10 % /660
diazepam 5 mg/ml /1832
glukóza 10% 555
glukóza 20% 1110
glukóza 40% 2200
gadobutrol (Gadovist) /1603
fenytoin sodný 50 mg/ml > 2000
kalium chloratum 7,45 % (1 mmol/ml)* 2000
kalium chloratum 0,4 mmol/ml v AQ 800
kalium chloratum 0,04 mmol/ml v G5 358
kalium chloratum 0,04 mmol/ml ve FR 388
kalium chloratum 0,02 mmol/ml v G5 318
kalium chloratum 0,02 mmol/ml ve FR 340
levetiracetam 100 mg/ml 969
mannitol 20% 1099
natrium hydrogencarbonicum 8,4% 1575
natrium chloratum 0,45% 154
natrium chloratum 2,7% 924
natrium chloratum 30% 9500
oxacilin 59 mg/ml v G5 /530
oxacilin 59 mg/ml ve FR /519
oxacilin 20 mg/ml v G5 /329
oxacilin 20 mg/ml ve FR /356
SmofKabiven infuzní emulze 1500/1800
valproát sodný 400 mg/4 ml v AQ /1400
AQ – voda pro injekci, FR – fyziologický roztok 0,9%, G5 nebo G10 – glukóza 5% nebo 10%
Poznámka: Různé ředění léčivého přípravku v různých nosných roztocích může výrazně změnit konečnou osmolaritu.
* Kalium chloratum je vezikant/iritant při koncentracích > 100 mmol/l (0,1 mmol/ml). Konečná koncentrace při podání do periferní žíly je obvykle 40–60 mmol/l (0,04–0,06 mmol/ml); v urgentních případech má být ≤ 80 mmol/l (0,08 mmol/ml)!
roztoku je voda o osmolaritě 0 mOsm/l. V tabulce 1.8 a 1.9 lze vidět rozdíly v osmolaritě/osmolalitě i s ohledem na koncentraci a volbu ředicího či nosného roztoku. Například pro oxacilin je pro podání cestou periferního žilního vstupu popisována jako vhodná maximální koncentrace ≤ 20 mg/ml v G5% či FR. Hypotonické látky snižují osmotický tlak, intravaskulární voda vstupuje do buněk, v extrémních případech dochází k ruptuře buněčné stěny. Jsou popsány případy
Tab. 1.9 Iritační potenciál podle pH a osmolarity u nejčastějších parenterálních antibiotik (upraveno podle Ballesteros-Peña et al., 2022)
Léčivo pH Rekonstituce v 10 ml
(bolus) Další ředění ve FR (infuze) Iritační potenciál
amoxicilin/klavulanát 1 g/200 mg
cefazolin 2 g
cefepim
368 extrémní (bolus) střední riziko (infuze)
328 vysoké riziko (bolus) nízké riziko (infuze)
vysoké riziko (bolus) nízké riziko (infuze)
(bolus) střední riziko (infuze) cefotaxim 1 g
vysoké riziko (bolus) nízké riziko (infuze) ceftazidim 2
ceftriaxon
1,5
(bolus) střední riziko (infuze)
vysoké riziko (bolus) nízké riziko (infuze)
347 vysoké riziko (bolus) nízké riziko (infuze)
ciprofloxacin 2 mg/ml 4,0 274 vysoké riziko (bolus)
gentamicin 3 mg/ml 4,5 294 střední riziko (infuze)
imipenem/cilastatin
500/500 mg 7,1 5/5 mg/ml 324 nízké riziko (infuze)
klindamycin 600 mg/4 ml 6,5 6 mg/ml 302 střední riziko (infuze)
levofloxacin 5 mg/ml 4,8 310 střední riziko (infuze)
meropenem 2 g 7,9 200 mg/ml 922 20 mg/ml 326 extrémní (bolus) nízké riziko (infuze)
metronidazol 5 mg/ml 4,9 280 střední riziko (infuze)
piperacilin/tazobaktam 5,2 400/5 mg/ml 1719 40/5 mg/ml 434 extrémní (bolus) střední riziko (infuze)
FR – fyziologický roztok
* Léčiva jako imipenem/cilastatin, meropenem a některé cefalosporiny mají potenciální toxicitu k vaskulárnímu endotelu i přes příznivé parametry pH či osmolarity!!!
Vysoké riziko: pH < 4,5 nebo > 9 a/nebo > 500 mOsm/l (extrémní, pokud > 900 mOsm/l).
Střední riziko: pH mezi 4,5–6,9 nebo 8–9 a/nebo 350–500 mOsm/l.
Nízké riziko: pH mezi 7,0–7,9 a/nebo < 350 mOsm/l (CAVE hypoosmolární roztoky).
Tab. 1.10 Přehled nejčastějších vezikantů a iritantů používaných nejenom v pediatrii (upraveno podle Hackenberg RK et al., 2021)
Skupina léčiv Vezikant
antiinfektiva aciklovir
Iritant
Potenciální iritant
amoxicilin/klavulanát ampicilin/sulbaktam amikacin amfotericin B cefalosporiny
ganciklovir cidofovir klindamycin
gentamicin ciprofloxacin karbapenemy
kotrimoxazol fosfomycin piperacilin/tazobaktam
oxacilin metronidazol remdesivir vankomycin
aminokyseliny ≥ 10 %
parenterální výživa
vazopresory
arginin
aminokyseliny < 10 %
glukóza <12,5 %
glukóza ≥ 12,5 % lipidy
parenterální výživa > 800–950 mOsm/l parenterální výživa ≤ 800* mOsm/l
noradrenalin dobutamin
adrenalin dopamin
terlipressin
různé
i. v. roztoky s glukózou
aminofylin esmolol heparin
vápenaté soli
kalium chloratum < 60 mmol/l inzulin
kofein citrát ketamin imunoglobuliny
dantrolen mykofenolát mofetil morfin diazepam thiopental sufentanil digoxin ibuprofen
fenytoin labetalol
fenobarbital levetiracetam
fosforečnanové soli krevní deriváty furosemid
kalium chloratum > 60 mmol/l
magnesium sulfát mannitol ≥ 20% midazolam
natrii hydrogencarbonici natrium chloratum > 3%
propofol
radio/rentgen-kontrastní látky
valproát sodný
* Poznámka: 800–950 mOsm/l může být přechodně tolerováno u parenterální výživy, která je podávána pomalu a v all-in-one vaku je tuková emulze. Je nutná opatrnost.
intoxikace vodou s úmrtím. Z tohoto důvodu nejsou užívány k tekutinové náhradě, jejich účinek spočívá v diluci extrémně hypertonických látek, což vede k lepší hemokompatibilitě a snížení rizika rozvoje chemické flebitidy. Krev je izotonická tekutina o osmolaritě 285 mOsm/l. Obecně je izotonický roztok definován rozmezím 250– 350 mOsm/l. Roztoky o vyšší osmolaritě označujeme jako hypertonické. Typickým příkladem je roztok parenterální výživy. Vysoce hyperosmolární je i mannitol a koncentrované roztoky elektrolytů. Podání hypertonických látek do drobných periferních žil může vést k rozvoji chemické flebitidy. Buňky tunica intima se snaží ochránit žilní stěnu před poškozením procesem, který vede k zachování izotonicity. V důsledku přesunu tekutiny dochází k buněčné dehydrataci, rozvoji flebitidy a tromboflebitidy, je vyšší riziko extravazace a rozvoje sklerózy. Extravazace hyperosmolárních roztoků (osmolarita > 290 mOsm/l) do měkkých tkání způsobuje únik vody z cévního a buněčného kompartmentu do intersticiálního prostoru. Tento fyziologický mechanismus, který vede k vyrovnání koncentrace, způsobuje vznik edému, jenž může utlačovat a poškozovat podkladové nervové a cévní struktury a vést ke kompartment syndromu. Depolarizace hladkých svalových buněk vlivem vysoké koncentrace elektrolytů vyvolává jejich kontrakci, což vede k ischemickému fenoménu. Nakonec dochází k celkové buněčné dysfunkci, která způsobuje oxidační stres a následně zánět a nekrózu. Pacient vnímá tento proces bolestivě. V případě podávání roztoků o osmolaritě vyšší než 600 mOsm/l je doporučena aplikace do centrálního žilního řečiště. Souhrnný přehled rizikových intravenózních léčiv s ohledem na osmolaritu či osmolalitu shrnuje tabulka 1.8, v tabulce 1.9 je uveden iritační potenciál podle pH a osmolarity u nejčastějších parenterálních antibiotik. Přehled nejčastějších vezikantů a iritantů je uveden v tabulce 1.10.
1.4.3 Antiinfekční léčiva
Patří celosvětově mezi nejužívanější léčiva. Rostoucí rezistence bakterií k antibiotikům vedla k rozvoji nových molekul, z nichž většina je určena k nitrožilnímu podání. Nesprávná volba optimálního žilního vstupu může vést k rozvoji tromboflebitidy po podání protiinfekčních léčiv. Recentní systematická rešerše z roku 2023 zahrnula 232 publikovaných prací, kde za riziková antibiotika byla označena ta s pH ≤ 5 nebo ≥ 9, osmolaritou ≥ 600 mOsm/l a dále antibiotika s hlášeným výskytem periferní tromboflebitidy s incidencí ≥ 5 % nebo s vlastnostmi vezikantů. Celkem bylo hodnoceno 82 protiinfekčních léčiv – relevantní léčiva jsou uvedena v tabulkách 1.11–1.14
Antibiotika
Rizikové vlastnosti (incidence flebitidy ≥ 5 %, vysoké/nízké pH, vysoká osmolarita, vlastnosti vezikantů) byly popsány u 37 antibiotik. U 14 bylo zjištěno extrémní pH, u 10 vysoká incidence flebitidy, u 12 obě tyto charakteristiky. Jako vezikant byl označen pouze vankomycin. U žádného z antibiotik nebyla zjištěna osmolarita ≥ 600 mOsm/l (tab. 1.11).
Je třeba zvlášť upozornit na vankomycin, široce používané antibiotikum, které podle recentní publikované literatury vyvolává obavy ohledně extravazací. Studie in vitro i na zvířatech ukazují, že vankomycin způsobuje poškození endotelu, dříve přisuzované kyselému pH, nyní spojené s jeho cytotoxicitou. Při koncentraci 5 mg/ml
Tab. 1.11 Přehled fyzikálně-chemických vlastností antibiotik a incidence flebitidy (upraveno podle Borgonovo F et al., 2023)
ANTIBIOTIKA
amikacin 3,5–5,5 312–383 ne FR/G5
amoxicilin/klavulanát 8,9 290–442 ne FR ampicilin 8–10 238–372 ano FR
ampicilin/sulbaktam 8–10 320–400 ano FR azitromycin 6,4–6,8 280–321 ano FR/G5 aztreonam 6 315–352 ne FR/G5 cefazolin 6 315–352 ne FR cefepim 4–6 362–396 ne FR/G5
cefiderocol 5,2–5,8 NA ano FR cefoperazon 6–8 265–335 ne FR/G5 cefotaxim 5,2–5,4 339–411 ne FR/G5
cefoxitin 4–7,5 240–360 ne FR/G5
265 ano FR/G5 ceftazidim/avibaktam 6,7 335–386 ne FR/G5 ceftriaxon 6,6–6,7 423 ne FR
ceftolozan/tazobaktam 5,9–6,1 307–520 ne FR/G5
cefuroxim 5,2–8,5 270–357 ne FR/G5
ciprofloxacin 3,3–4,6 285 ano FR/G5
cotrimoxazol 8,6 316–417 ano FR/G5
dalbavancin 4,5 246 ne G5
daptomycin 4,7–6,8 263–364 ne FR
delafloxacin NA NA ano FR/G5
doripenem
4,5–5,5 NA ano FR/G5
doxycyklin 1,8–3,3 292–310 ne FR/G5
eravacyklin NA NA ano FR
erytromycin
6,5–7,7 266–305 ano FR
ertapenem 7,5 293–395 ne FR
fosfomycin 7,7 501–579 ne G5
flukloxacilin 4,5–6,5 NA ne FR/G5
gentamicin 3–5,5 280–318 ne FR/G5
chloramfenikol 7–8,5 600 ne FR/G5
imipenem/cilastatin/ relebaktam 6,5–7,5 310–396 ano G5
Tab. 1.11 Přehled fyzikálně-chemických vlastností antibiotik a incidence flebitidy (upraveno podle Borgonovo F et al., 2023) – konec
ANTIBIOTIKA
klaritromycin 5,2–5,4 275–301 ne FR/G5 levofloxacin
3,8–5,8 250–323 ano FR/G5 linezolid
ne FR/G5
ano FR/G5
6–8,5 270–398 ano FR piperacilin/tazobaktam
235–300 ano FR/G5
Flebitida: ano = incidence ≥ 5 %, ne = incidence < 5 %; FR – chlorid sodný 0,9%, G5 – 5% glukóza, NA – nedostupné.
Varování – léčivo se chová jako vezikant: červená: preferován centrální přístup, zelená: možný periferní přístup.
způsoboval až 50% úmrtnost buněk po 24 hodinách a téměř 100% po 48 hodinách. Intermitentní infuzní podávání bylo spojeno s menším rizikem poškození než kontinuální infuze. Studie kontinuální infuze vankomycinu přes dlouhou periferní kanylu (8 cm „mini-midline“) byla zastavena kvůli asymptomatické trombóze. Přestože kazuistická sdělení naznačují zhojení bez trvalého funkčního postižení, je vankomycin na seznamu necytotoxických léčiv z roku 2024 uveden jako vezikant se středním rizikem. Doporučuje se zavést centrální vstup pro podávání vankomycinu při koncentracích nad 5 mg/ml a při prodloužených či kontinuálních infuzích.
Antivirotika
Celkem sedm antivirotik splňuje výše uvedená kritéria pro zvláštní opatření (tab. 1.12). Zanamivir je rizikový kvůli nízkému pH, foskarnet představuje vysoké riziko flebitidy (při indukci i udržovací terapii), ganciklovir a oseltamivir mají extrémní pH a vysoké riziko flebitidy. Remdesivir vykazuje extrémní pH a vlastnosti vezikantu a aciklovir obsahuje všechny rizikové charakteristiky. Aciklovir a foskarnet lze ředit buď
Tab. 1.12 Přehled fyzikálně-chemických vlastností antivirotik a incidence flebitidy (upraveno podle Borgonovo F et al., 2023)
ANTIVIROTIKA
Léčivo
(≥ 5 %)
aciklovir 10,5–11,6 285–323 ano FR/G5
cidofovir 7.4–8.5 290 ne FR foskarnet 7,4 271–315 ano FR/G5
ganciklovir 11 290–320 ano FR oseltamivir 4 NA ano FR remdesivir 3 NA na FR zanamivir
4,5–6,5 NA ne FR
Flebitida: ano = incidence ≥ 5 %, ne = incidence < 5 %; FR – chlorid sodný 0,9%, G5 – 5% glukóza, NA – nedostupné.
Varování – léčivo se chová jako vezikant: červená: preferován centrální přístup, zelená: možný periferní přístup.
G5, nebo FR, zatímco zbývající antivirotika by měla být podávána pouze s FR. Doba infuze se pohybuje od minimálně 30 minut do 2 hodin.
Antimykotika
Všechna antimykotika jsou riziková a měla by být aplikována do centrálního řečiště (tab. 1.13). Amfotericin B má navíc vlastnosti vezikantu.
Tab. 1.13 Přehled fyzikálně-chemických vlastností antimykotik a incidence flebitidy (upraveno podle Borgonovo F et al., 2023)
ANTIMYKOTIKA
amfotericin B
amfotericin B (liposomální)
anidulafungin
3,5–5,5 209–269 ano FR/G5 kaspofungin 6,6 256–298 ano FR
flukonazol 4–8 299–316 ne FR isavukonazol
1,9–2,6 NA ano FR/G5
4,8 315 ano FR/G5
micafungin
4,3–5,9 281–307 ano FR/G5 posakonazol 2,6 281–292 ano FR
vorikonazol
4,4–5,5 191–242 ne FR/G5
Flebitida: ano = incidence ≥ 5 %, ne = incidence < 5 %; FR – chlorid sodný 0,9%, G5 – 5% glukóza, NA – nedostupné.
Varování – léčivo se chová jako vezikant: červená: preferován centrální přístup, zelená: možný periferní přístup.
Tab. 1.14 Přehled fyzikálně-chemických vlastností antiprotozoik a incidence flebitidy (upraveno podle Borgonovo F et al., 2023)
ANTIPROTOZOIKA Léčivo
eflornitin
Flebitida: ano = incidence ≥ 5 %, ne = incidence < 5 %; FR – chlorid sodný 0,9%, G5 – 5% glukóza, NA – nedostupné.
Varování – léčivo se chová jako vezikant: červená: preferován centrální přístup, zelená: možný periferní přístup.
Antiprotozoika
Z antiprotozoik je třeba opatrnosti u eflornitinu pro popisovaný častý výskyt flebitid a u chininu z důvodu extrémního pH (tab. 1.14).
1.4.4 Vazoaktivní léčiva
Mezi sympatomimetika způsobující vazokonstrikci prostřednictvím α-adrenergní dráhy patří především katecholaminy – dopamin, dobutamin, adrenalin a noradrenalin. Všechna tato léčiva mají navíc kyselé pH. Tato vazokonstrikce snižuje průtok krve, zvyšuje hydrostatický tlak a vede k lokální ischemii, edému a zánětu. V počáteční fázi ischemie způsobuje lokální hypotermii, bolest a bledost kůže. Po 48 hodinách se mohou objevit puchýřky. Bez léčby může extravazace vést k nekróze a amputaci. Vazokonstrikce je výraznější při pomalé infuzi vazopresoru periferním vstupem. Proto je vhodné tato léčiva podávat centrální žilní cestou s vyšším průtokem krve, čímž se snižuje akumulace vazopresoru a jeho lokální farmakologický účinek („flush“ efekt).
S ohledem na indikace vazopresorické podpory lze předpokládat, že klinický stav nemocného vyžaduje i podávání další parenterální terapie, případně hemodynamické monitorování a centrální žilní vstup je potřebný. Dosud publikovaná data o tkáňovém poškození nebo extravazaci periferně podávaných vazopresorů vycházejí dominantně z kazuistických sdělení a je potřeba dalších studií, které by jasně prokázaly rizikovost nebo bezpečnost periferní aplikace. V metaanalýze byl prokázán malý výskyt komplikací (u 7 % nemocných), naprostá většina z nich byla nízké klinické významnosti. Dostupné recentní prospektivní observační kohortové studie naznačují, že periferní podání noradrenalinu je bezpečné v případě, že má pracoviště jasně definovaný protokol aplikace do periferní žíly.
Kapitola 1.4 byla podpořena grantem Univerzity Karlovy SVV 260 785.
Literatura
Atay S, Üzen Cura Ş, Efil S. Nurses’ knowledge and experience related to short peripheral venous catheter extravasation. J Vasc Access. 2023;24:848–853.
Ballesteros-Peña S, Fernández-Aedo I, Vallejo-De la Hoz G, et al. Identification of potentially irritating intravenous medications. Enferm Intensiva (Engl Ed). 2022;33:132–140.
Borgonovo F, Quici M, Gidaro A, et al. Physicochemical characteristics of antimicrobials and practical recommendations for intravenous administration: a systematic review. Antibiotics (Basel). 2023;12:1338.
David V, Christou N, Etienne P, et al. Extravasation of noncytotoxic drugs. Ann Pharmacother. 2020;54:804–814.
Gorski LA, Hagle ME, Bierman S. Intermittently delivered IV medication and pH: reevaluating the evidence. J Infus Nurs. 2015;38:27–46.
Gorski LA, Ong J, Van Gerpen R, et al. Development of an evidence-based list of non-antineoplastic vesicants: 2024 update. J Infus Nurs. 2024;47:290–323.
Hackenberg RK, Kabir K, Müller A, et al. Extravasation injuries of the limbs in neonates and children – development of a treatment algorithm. Dtsch Arztebl Int. 2021;118:547–554.
Hadaway L, Gorski LA. Infiltration and extravasation risk with midline catheters: a narrative literature review. J Infus Nurs. 2024;47:324–346.
Kilian S, Surrey A, McCarron W, et al. Vasopressor administration via peripheral intravenous access for emergency department stabilization in septic shock patients. Indian J Crit Care Med. 2022;26:811–815.
Le A, Patel S. Extravasation of noncytotoxic drugs: a review of the literature. Ann Pharmacother. 2014;48:870–886.
Loubani OM, Green RS. A systematic review of extravasation and local tissue injury from administration of vasopressors through peripheral intravenous catheters and central venous catheters. J Crit Care. 2015;30:653.e9–e17.
Medusa NHS Injectable Medicines Guide. Online. Dostupné z: https://www.medusaimg.nhs.uk. [citováno 2025-05-07].
National Infusion and Vascular Access Society: Infiltration and extravasation. A toolkit to improve practice, v. 1.2.2024. Online. Dostupné z: https://nivas.org.uk/contentimages/main/ NIVAS-Infiltration-and-Extravasation-toolkit-version-1-Feb-2024.pdf. [citováno 2025-0706].
Nickel B, Gorski L, Kleidon T, Kyeso A, et al. Infusion therapy standards of practice. 9th ed. J Infus Nurs. 2024;47(1S Suppl 1):S1–S285.
Scarano M, D’Arrigo S, De Letteriis S, et al. Risk of thrombophlebitis associated with continuous peripheral infusion of vancomycin: The effect of dilution. J Vasc Access. 2024;25:107–112.
Shenoi RP, Timm N; Committee on Drugs; Committee on Pediatric Emergency Medicine. Drugs used to treat pediatric emergencies. Pediatrics. 2020;145:e20193450.
Smolders EJ, Benoist GE, Smit CCH, Ter Horst P. An update on extravasation: basic knowledge for clinical pharmacists. Eur J Hosp Pharm. 2020;28:165–167.
Tran QK, Mester G, Bzhilyanskaya V, et al. Complication of vasopressor infusion through peripheral venous catheter: A systematic review and meta-analysis. Am J Emerg Med. 2020;38: 2434–2443.
Trissel’s IV compatibility. Lexicomp Online, Hudson, Ohio: UpToDate, Inc. (navštíveno 23. 9. 2024).
Yerke JR, Mireles-Cabodevila E, Chen AY, et al. Peripheral administration of norepinephrine: a prospective observational study. Chest. 2024;165:348–355.
1.5 Pacient s DIVA
Martina Douglas, Martin Troubil
Souhrn
Vzhledem k narůstajícím nákladům na zdravotní péči a zvyšujícímu se počtu přežívajících chronicky nemocných, onkologických pacientů a stárnutí populace bude nezbytné přistupovat k pacientům s DIVA s respektem. Je žádoucí cíleně vyhledávat rizikové pacienty a zajistit jim adekvátní žilní vstup již na počátku terapie. Ve zdravotnických zařízeních bude nezbytné implementovat nejen škálovací systémy, ale rovněž podpořit zdravotnický personál materiálně, personálně a technicky.
Úvod
Zavedení periferního žilního katétru – krátké periferní kanyly (SPC) je invazivní zákrok, který podstoupí více než 50 % hospitalizovaných pacientů. V reálné praxi selhává 35–40 % prvních pokusů o zavedení SPC. Opakované venepunkce a neadekvátní podávání léčiv (určených k aplikaci cestou centrální žíly) do periferního žilního řečiště vedou k postupnému zhoršování kvality žilního systému v průběhu života pacienta. Další zavádění SPC se tak stává stále obtížnějším. Tyto nemocné pak zařazujeme do kategorie pacientů s obtížným žilním přístupem, známým pod pojmem DIVA (difficult intravenous access).
Úspěšné zajištění SPC na první pokus je proto zásadní pro prevenci zbytečných komplikací a zamezení plýtvání spotřebním materiálem, personálem i zdravotnickými zdroji.
Ke zlepšení péče o pacienty s DIVA byla vytvořena klinická doporučení založená na důkazech, jejichž základem je včasná identifikace těchto nemocných a následná možnost eskalace kanylačního postupu. To znamená provedení standardizovaných opatření, která se používají v případě, že se nedaří úspěšně zavést SPC tradičním způsobem (viz dále).
1.5.1 Definice pacienta s DIVA
Pacient s DIVA je nemocný s insuficientním periferním žilním systémem, s omezeným počtem viditelných nebo palpovatelných periferních žil dostatečného kalibru, vhodných ke kanylaci.
Takových pacientů je v dospělé populaci přibližně 30 %, v praxi jsou obvykle definováni dvěma nebo více neúspěšnými zavedeními SPC.
Přestože je často známo, že má pacient obtížně kanylovatelný žilní systém, bývá tato skutečnost mnohdy ignorována. Opakované neúspěšné pokusy vedou ke zbytečné mutilaci pacienta a v konečném důsledku k plýtvání finančních zdrojů zdravotnického zařízení (podrobně viz kapitola 5 Ekonomika cévních vstupů). Neúspěšné