Vlastimil Válek jr. a kolektiv
a gastrointestinální radiologie
TENKÉ STŘEVO
Poděkování
Část obrazové dokumentace v knize pochází z Oddělení radiologie Masarykova onkologického ústavu v Brně, Radiodiagnostického oddělení Uherskohradišťské nemocnice, Nemocnice Vyškov, Nemocnice Břeclav, Nemocnice AGEL Prostějov, Oddělení radiologického a zobrazovacích metod Nemocnice Znojmo, Oddělení zobrazovacích metod Krajské nemocnice Tomáše Bati Zlín, Oddělení radiodiagnostiky Nemocnice Blansko, Nemocnice Třebíč, Pardubické nemocnice, Oddělení zobrazovacích metod SurGal Clinic, Radiologického oddělení Nemocnice Nové Město na Moravě, Nemocnice Milosrdných bratří v Brně, Nemocnice Boskovice a Kliniky zobrazovacích metod Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice u sv. Anny v Brně.
Všem těmto pracovištím, stejně jako kolegyním a kolegům z radiologických oddělení těchto pracovišť patří dík za poskytnutou obrazovou dokumentaci.
Děkuji firmě Bracco Imaging Czech s.r.o. za finanční podporu, bez níž by tato kniha nemohla vyjít, a též za dlouhodobou podporu vzdělávání. Většina vyšetření, která jsou součástí obrazové dokumentace v této monografii, byla provedena kontrastními látkami firmy Bracco.
Vlastimil Válek, editor
Vlastimil Válek jr. a kolektiv
Abdominální
a gastrointestinální radiologie
TENKÉ STŘEVO
Grada Publishing
Upozornění pro čtenáře a uživatele této knihy Všechna práva vyhrazena. Žádná část této tištěné či elektronické knihy nesmí být reprodukována a šířena v papírové, elektronické či jiné podobě bez předchozího písemného souhlasu nakladatele. Neoprávněné užití této knihy bude trestně stíháno. Automatizovaná analýza textů nebo dat ve smyslu čl. 4 směrnice 2019/790/EU a použití této knihy k trénování AI jsou bez souhlasu nositele práv zakázány.
MUDr. Vlastimil Válek jr. a kolektiv
Abdominální a gastrointestinální radiologie
TENKÉ STŘEVO
Hlavní autor: MUDr. Vlastimil Válek jr., Klinika radiologie a nukleární medicíny Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno
Editor: prof. MUDr. Vlastimil Válek, CSc., MBA, EBIR, Klinika radiologie a nukleární medicíny Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno
Autoři:
MUDr. Daniel Bartušek, Ph.D.1
MUDr. Alexandra Litavcová1
MUDr. Hana Petrášová, Ph.D.1
MUDr. Tomáš Rohan, Ph.D.1
MUDr. Markéta Smělá, Ph.D.1
MUDr. Jakub Stulík1
Doc. MUDr. Ilja Tachecí, Ph.D.2
1 K linika radiologie a nukleární medicíny Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno
2 I I. interní gastroenterologická klinika Lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Hradec Králové
Recenzenti:
Prof. MUDr. Zdeněk Krška, DrSc.
Prof. MUDr. Hana Malíková, Ph.D., MHA
Vydání odborné knihy schválila Vědecká redakce nakladatelství Grada Publishing, a.s.
© Grada Publishing, a.s., 2025
Cover Design © Grada Publishing, a.s., 2025
Obrázky na obálce a v knize pocházejí z archivu hlavního autora, editora a radiologických pracovišť v ČR (výčet viz s. 2).
Vydala Grada Publishing, a.s. U Průhonu 22, Praha 7 jako svou 10145. publikaci
Odpovědná redaktorka Mgr. Viola Těšínská
Sazba a zlom Jan Šístek
Počet stran 296
1. vydání, Praha 2025
Vytiskla tiskárna TNM PRINT s.r.o., Nové Město.
Názvy produktů, firem apod. použité v knize mohou být ochrannými známkami nebo registrovanými ochrannými známkami příslušných vlastníků, což není zvláštním způsobem vyznačeno.
Postupy a příklady v této knize, rovněž tak informace o lécích, jejich formách, dávkování a aplikaci jsou sestaveny s nejlepším vědomím autorů. Z jejich praktického uplatnění však pro autory ani pro nakladatelství nevyplývají žádné právní důsledky.
ISBN 978-80-271-8076-9 (pdf)
ISBN 978-80-271-5863-8 (print)
I OBECNÁ ČÁST
1
2
II SPECIÁLNÍ
Úvod
Možností vyšetřovat tenké střevo pomocí rentgenového záření se lékaři zabývali již v roce 1898, kdy Cannon referoval o fluoroskopickém vyšetření tenkého střeva u koček. V roce 1911 užívají Morse a Cole vodní suspenzi barium sulphuricum. První pokusy využít duodenální sondu k podávání kontrastní látky shrnul Pesquara v roce 1929. V roce 1932 Crohn a jeho spolupracovníci publikují rentgenologický popis regionální ileitidy. V roce 1971 se objevuje první monografie a Selink v ní používá pro speciální vyšetření tenkého střeva termín „enteroclysis“. Další autoři na něj navazují a postupně dochází k rozvoji metod dvojkontrastního vyšetření tenkého střeva pomocí enteroklýzy. Spolu s enteroklýzou dochází v této době k rozvoji dalších zobrazovacích metod (UZ, CT a MR) a také metod endoskopických. Snižování radiační zátěže CT vyšetření, zlepšení rozlišení UZ, rostoucí dostupnost MR a vývoj nových endoskopických přístrojů vedly k tomu, že enteroklýza byla postupem času těmito metodami nahrazena a objevuje se nejprve termín CT enteroklýza a posléze MR enteroklýza. V současné době se s enteroklýzou v její původní podobě již prakticky nesetkáme.
Zobrazovací metody jsou nedílnou součástí diferenciální diagnostiky patologií tenkého střeva. K využití jejich potenciálu je potřeba znát jejich možnosti a limitace. Spolu s anatomií tenkého střeva jsou charakteristiky zobrazovacích metod a vyšetření používaných u tenkého střeva probrány v obecné části této knihy.
Další kapitoly shrnují patologické stavy tenkého střeva, včetně některých vzácnějších onemocnění. Vyjma obecných charakteristik je u každé patologie uveden typický nález na zobrazovacích metodách, většinou doplněný obrazovou dokumentací.
Podstatné informace týkající se patologií tenkého střeva, se kterými se setká každý radiolog, jsou shrnuty v poslední kapitole pomocí příkladů a modelových situací s návodem, jak k jednotlivým nálezům správně přistupovat.
Věříme, že kniha bude cenným pomocníkem nejen radiologů v jejich každodenní praxi, ale že z následujících stránek budou čerpat všichni lékaři, které problematika onemocnění tenkého střeva zajímá. autoři
I OBECNÁ ČÁST
1 Anatomie, histologie a radiologická anatomie
1.1 Anatomie tenkého střeva
Tenké střevo začíná u prvního lumbálního obratle duodenem a končí v pravé jámě kyčelní Bauhinovou chlopní. Chirurgická anatomie vymezuje tenké střevo až od ligamentum duodenojejunale. Dvanáctník je vzhledem k anatomickému uložení a funkci popisován zvlášť. Tenké střevo je u živého jedince dlouhé 2,5–3 m (enteroklýza), na kadáveru pak 5–7 m. Leží ve střední a dolní části peritoneální dutiny a je uměle rozdělováno na orálně umístěné jejunum – lačník a distálně lokalizované ileum – kyčelník. Jejunum tvoří asi dvě pětiny délky tenkého střeva, má více slizničních řas, a tím relativně větší plochu sliznice. Šířka lumen tenkého střeva se pohybuje při vyšetření enteroklýzou od 4–5 cm (jejunum) do 3 cm (v oblasti terminálního ilea). Šířka stěny tenkého střeva činí až 3–4 mm (CT, UZ). Řasy jsou široké 1–2 mm. Jejunum a ileum jsou zavěšeny na mezenteriu – peritoneální duplikatuře s cévami, nervy a lymfatickými uzlinami. Mezenterium odstupuje ze zadní stěny břišní radixem (kořenem) mezenteria (místem vstupu cév a nervů), který probíhá od levého okraje druhého bederního obratle směrem doprava dolů k pravé sakroilické syndesmóze.
Stěna tenkého střeva se skládá ze čtyř vrstev (zvnějšku dovnitř):
1. Tunica serosa – je pokračováním mezenteria, jehož peritoneální listy obalují střevo.
2. Tunica muscularis – vnější vrstva podélně probíhajících vláken hladké svaloviny –stratum longitudinale a vnitřní, silnější vrstva tvořená vlákny cirkulárními – stratum circulare. Mezi nimi je nervová pleteň (Auerbachův myenterický plexus).
3. Tela submucosa – řídká fibroelastická tkáň obsahující nervy a cévy. V submukóze proximálního duodena jsou uloženy Brunnerovy žlázy, které ústí do lumen tenkého střeva a vylučují zásaditý hlen. Je zde také umístěna autonomní nervová pleteň (Meissnerův submukózní plexus). Submukóza vybíhá do řas. Od sliznice je oddělena tenkou, ale pevnou lamina muscularis mucosae. Tato vrstva je velmi důležitá při sutuře tenkého střeva a nesmí být nikdy stehem vynechána.
4. Tunica mucosa – vrstva důležitá pro trávení, s plochou zvětšenou cirkulárními řasami – plicae circulares Kerckringi a klky – villi intestinales. Mezi klky jsou ve sliznici tubulózní střevní žlázky – glandulae intestinales (Lieberkühnovy krypty). Řasy tenkého střeva jsou tvořeny sliznicí a submukózou a neobsahují svalovinu. Vlastní epitel sliznice je cylindrický, lze v něm rozeznat buňky resorpční a sekreční. Na dně Lieberkühnových krypt jsou Panethovy buňky s enzymatickou sekrecí. Mezi cylindrickým epitelem jsou i pohárkové buňky s hlenotvorbou a endokrinní buňky systému APUD (amine precursor uptake and decarboxylation). Mezi epitelem a lamina muscularis mucosae je lamina propria mucosae obsahující cévy, nervy a lymfatické folikuly.
Tunica mucosa je zobrazitelná při UZ vyšetření (hypoechogenní linie) a při postkontrastním CT vyšetření (hyperdenzní linie). Při CT i UZ vyšetření ubývá směrem
k ileu viditelných řas. Střední vrstva – submukóza – je při ultrazvukovém vyšetření hyperechogenní, při CT vyšetření postkontrastně hypodenzní (až na výjimky, jako je tuková degenerace při idiopatických střevních zánětech). Zevní svalová vrstva –muscularis propria – je při UZ vyšetření hypoechogenní, při postkontrastním CT vyšetření hyperdenzní.
1.2 Krevní zásobení tenkého střeva
Arteriální krev přivádějí z arteria mesenterica superior (AMS), odstupující z aorty, cestou svých větví arteriae jejunales a arteriae ileales, které se ve svém průběhu mezenteriem vícenásobně spojují do oblouků (arteriálních arkád), z nichž vystupují přímé větve zásobující stěnu střevní. Arkády tvoří bohatý kolaterální oběh, v jejunu v jedné řadě, v ileu ve 2–4 řadách. Cévy vstupují na mezenteriálním okraji střeva, probíhají submukózou a větví se na opačné straně. Vény probíhají spolu se stejnojmennými arteriemi, spojují se do vena mesenterica superior a vytvářejí jeden z kořenů vena portae.
1.3 Lymfatická drenáž tenkého střeva
Lymfatická drenáž tenkého střeva začíná lymfatickými folikuly lokalizovanými na hranici mukózy a submukózy (podél lamina muscularis mucosae). Především v distálním ileu se folikuly shlukují do Peyerových plaků. Z nich vycházející lymfatické cévy se vlévají do uzlin v mezenteriu, následně do intestinálního mízního kmene ústícího do cisterna chyli, vedoucí do ductus thoracicus a levé podklíčkové žíly.
1.4 Inervace tenkého střeva
Inervace je autonomní. Jednak parasympatická, kdy preganglionární vlákna přicházejí cestou nervus vagus, jednak sympatická – preganglionární vlákna z IX. a X. hrudního segmentu míchy. Vlákna se spojují do plexus mesentericus superior a vytvářejí plexus subserosus, plexus myentericus Auerbachi s mnoha ganglii ve svalovině, plexus submucosus Meissneri, taktéž s ganglii, a plexus mucosus
1.5 Topografická anatomie
Anatomicky lze dutinu břišní rozdělit do dvou hlavních oddílů – na peritoneální dutinu a retroperitoneální prostor. Retroperitoneální prostor je fasciemi rozdělen na prostor perirenální (obsahuje ledviny a nadledviny), přední pararenální (slinivka břišní, část dvanáctníku, vzestupný a sestupný tračník) a zadní pararenální. Vlastní peritoneální dutinu rozdělujeme na supramezokolický a inframezokolický prostor a pánevní dutinu. Supramezokolický prostor je uložen mezi bránicí a mesocolon transversum. Dělí se na čtyři intraperitoneální oddíly a extraperitoneální prostor jater. Vpravo je to suprahepatální – subfrenický a subhepatální prostor, vlevo subfrenický prostor a bursa omentalis.
Subhepatální prostor můžeme rozdělit na oddíl přední, dole ohraničený mesocolon transversum, a zadní, označovaný jako recessus posterior (Morrisonův vak). V poloze na zádech je Morrisonův vak nejnižším oddílem pravého supramezokolického prostoru. Pravý subhepatální prostor je anatomicky spojen se subfrenickým prostorem přes volný okraj jater. Pravý a levý subfrenický prostor jsou od sebe odděleny ligamentum falciforme hepatis. Levý subfrenický prostor má tři recesy (gastrohepatální, gastrosplenický a splenorenální). Omentální burzu kaudálně ohraničuje mesocolon transversum, ventrálně zadní stěna žaludku a malá/velká předstěra, vzadu slinivka břišní a nahoře bránice. Ligamentum hepatogastricum (v němž probíhají arteriae et venae gastricae) rozděluje burzu na větší, laterální oddíl (vlevo dole) a menší, mediální část (vpravo nahoře). Její kraniální výchlipka zasahuje až k bránici. Inframezokolický prostor sahá od mesocolon transversum až po pánevní dutinu.
Podél laterálního okraje vzestupného a sestupného tračníku popisujeme pravý a levý parakolický prostor, vlevo uzavřený ligamentum phrenicocolicum. V infrakolickém prostoru jsou uloženy kličky tenkého střeva a mezenterium, ventrálně před kličkami tenkého a tlustého střeva je lokalizována velká předstěra (omentum majus). Kličky tenkého střeva jsou uspořádány do smyček s konkávním (mezenteriálním) a konvexním (antimezenteriálním) okrajem. Odlišení mezenteriálního a antimezenteriálního okraje tenkého střeva má velký praktický význam, protože některé patologické procesy mají specifickou lokalizaci. Vlevo nahoře jsou za normálního stavu uloženy kličky jejuna, vpravo dole kličky ilea. Radix mesenterii rozděluje inframezokolický prostor na pravý horní a levý dolní.
V subperitoneálním a peritoneálním prostoru můžeme identifikovat anatomicky (často i při CT vyšetření) devět řas (a-ch).
Arteria hepatica propria, arteria gastrica dextra et sinistra, jim odpovídající žíly a lymfatické cévy jsou obklopeny tkáněmi, které zpočátku jako ligamentum hepatogastricum (a) a dále pod peritoneem jako capsula Glissoni obkružují intrahepatální kořen těchto cévních struktur. Ligamentum hepatogastricum pokračuje jako ligamentum hepatoduodenale (obě ligamenta jsou součástí omentum minus) (b), probíhající od porta hepatis k pars superior duodeni a chránící extrahepatální žlučovody, vena portae a arteria hepatica propria.
Ligamentum hepatoduodenale tvoří pravý volný okraj omentum minus, překračuje duodenum (mezi D1 a D3) a je součástí předního okraje foramen Winslowi. Velká předstěra – omentum majus (zadní list ligamentum gastrocolicum a přední list ze žaludku) – vzniká jako peritoneální duplikatura na velké křivině žaludku, směřuje kaudálně před příčný tračník, kličky tenkého střeva a v zadním listu se vrací jako ligamentum gastrocolicum (c) k tenia omentalis příčného tračníku. Pravý volný okraj je u gastroduodenálního přechodu, levý kraniální pokračuje jako ligamentum gastrolienale.
Ligamentum gastrolienale (d) probíhá od kraniolaterální části velké křiviny žaludku ke slezině. Nachází se v něm arteria lienalis a její větve určené pro žaludek. Pokračování ligamentum gastrolienale od žaludku kraniálně k bránici se nazývá ligamentum gastrophrenicum (e). Od hilu sleziny pokračuje ligamentum gastrolienale dorzálně k bránici a pankreatu jako ligamentum phrenicolienale (f).
Mesocolon transversum tvoří závěs příčného tračníku. Jeho úpon vpravo začíná v úrovni D2– D3, směrem doleva překračuje hlavu, dolní část těla a ocas pankreatu, horní polovinu levé ledviny a konec je spojen s ligamentum phrenicocolicum. Mesocolon
transversum jako široká řasa volně fixuje příčný tračník k zadní stěně břišní a pevně fixuje jeho lienální a hepatální flexuru.
Ligamentum phrenicocolicum (g) je v CT obraze indentifikovatelné při dostatku tuku v blízkosti dolního pólu sleziny a anatomické lienální flexury.
Ligamentum splenorenale (h) překračuje ocas slinivky břišní a slezinnou žílu.
Ligamentum duodenocolicum (ch) spojuje vzestupný tračník a D2–D3.
Mezenteria jsou duplikatury peritonea, odstupující ze zadní břišní stěny a fixující jednotlivé oddíly trávicí trubice. Popisujeme mesocaecum (mezocékum), mesocolon transversum (příčné mezokolon), mezosigmoideum a mezorektum. Mezenterium začíná v oblasti duodenojejunální flexury jako Treitzův vaz a jeho úpon (radix mesenterii) jde dolů, doprava do ileocekální krajiny. Subperitoneální prostor mezosigmoidea je v přímé návaznosti se subperitoneálním prostorem mesocolon transversum a úzkou oblastí vzestupného tračníku. Vpravo od radix mesenterii je pole, kudy probíhají arteria mesenterica superior, vena mesenterica superior a jejich větve, vlevo probíhají větve arteria mesenterica inferior (AMI) a vena mesenterica inferior. Jsou zde četné lymfatické cévy, nervové pleteně, uzliny a různé množství vazivové a tukové tkáně.
Literatura ke kapitole 1
DeMeo JH, Fulcher AS, Austin RF Jr. Anatomic CT demonstration of the peritoneal spaces, ligaments, and mesentermesenteries: normal and pathologic processes. Radiographics 1995; 15(4): 755–770.
Tirkes T, Sandrasegaran K, Patel AA, Hollar MA, Tejada JG, Tann M, Akisik FM, Lappas JC. Peritoneal and retroperitoneal anatomy and its relevance for cross-sectional imaging. Radiographics 2012; 32(2): 437–451.
Válek V. Tenké střevo – radiologická diagnostika patologických stavů. První vydání. Samostatná monografie. Brno, NCONZO: Národní centrum ošetřovatelství a nelékařských zdravotnických oborů, 2003. 288 s. ISBN 80-7013-383-X.
2 Radiologické metody vyšetření tenkého střeva
2.1 Prostý RTG snímek
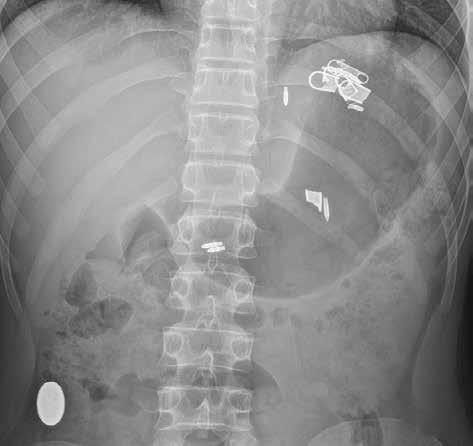
Prostý snímek břicha je stále jednou z nejlevnějších a nejdostupnějších zobrazovacích metod, využívaných při vyšetření nemocných s náhlou příhodou břišní. I když jeho význam klesá a dnes toto vyšetření nelze považovat za „metodu první volby“, má přesto i v době výpočetní tomografie (CT), ultrazvuku (UZ) a MR (magnetické rezonance) využití při podezření na střevní obstrukci či perforaci trávicí trubice, při hodnocení polohy drénů nebo detekci rentgenkontrastního tělesa (obr. 1).
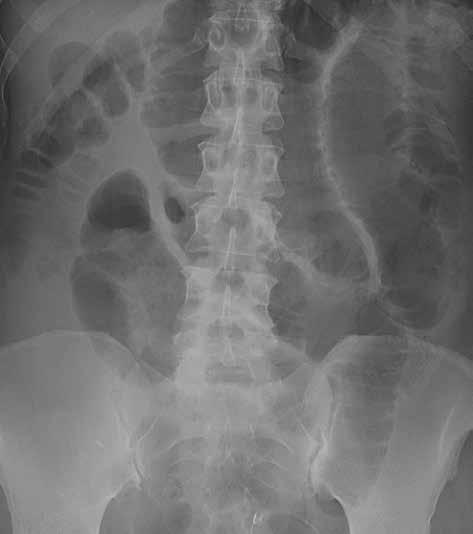
Můžeme provést předozadní snímek vleže na zádech a/nebo zadopřední snímek vestoje v závislosti na indikaci vyšetření. U nemocných ve vážném stavu lze snímkování provádět přímo na lůžku, ovšem za cenu jeho nižší kvality. Prostý snímek břicha vleže na zádech má větší výpovědní hodnotu a standardně i vyšší kvalitu. Přesněji na něm můžeme posoudit šířku lumen tenkého i tlustého střeva. Vzduch tvoří negativní kontrast, který umožní částečně hodnotit šíři střevní stěny i řas. Lépe než u snímku vestoje lze také zhodnotit rozložení plynné náplně střev, a tím i snáze lokalizovat přechodové zóny (obr. 2).
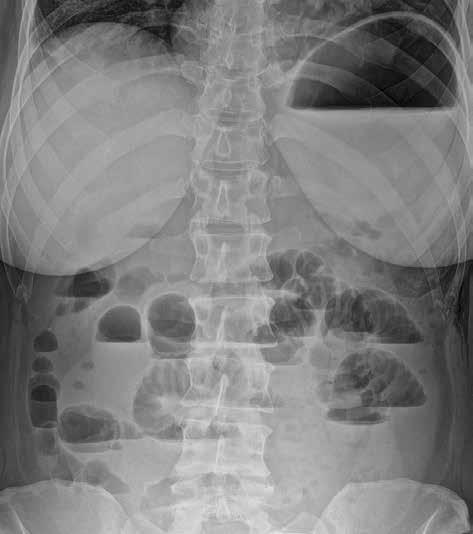
Snímek břicha horizontálním paprskem vestoje se provádí s cílem zobrazit hladinky a volný vzduch v dutině břišní. Jako hladinky označujeme tzv. hydroérický fenomén neboli rozhraní mezi tekutinou a plynem v lumen střeva (obr. 3). Fyziologicky obsahuje tenké střevo cca 200 ml vzduchu a 2000 ml tekutiny, která však stále cirkuluje. Hladinky, které se na hranici tekutina/plyn ve střevních kličkách tvoří, můžeme zachytit i u zdravého jedince, u pacientů s malasimilačním syndromem a u nemocných s paralytickým ileem. Nejčastěji se s hladinkami setkáváme u nemocných s mechanickou překážkou střevní průchodnosti. Někdy lze podle lokalizace a tvaru hladinek odhadnout místo a příčinu poruchy střevní pasáže. Při akumulaci tekutiny a vzduchu v lumen střeva dochází k jeho dilataci na 3,5–4 cm (někdy až 5 cm i více). K distenzi trávicí trubice dochází orálně od místa obstrukce.
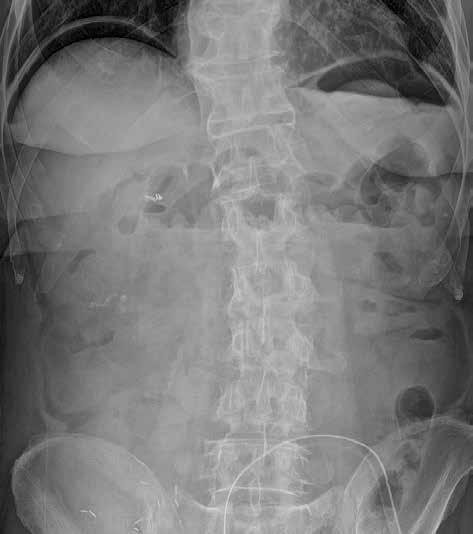
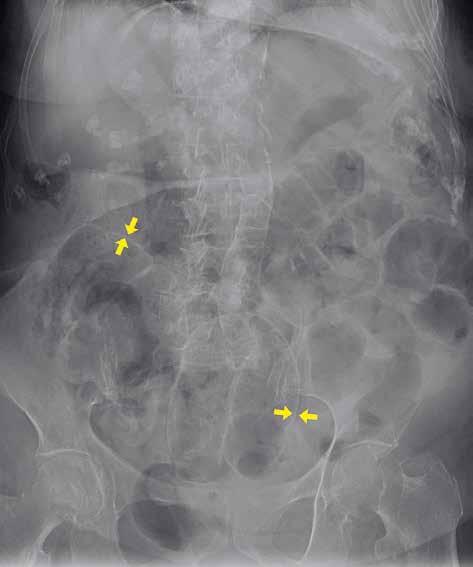
Volný vzduch v peritoneální dutině je většinou známkou patologické komunikace trávicí trubice s volnou dutinou břišní (obr. 4). Pravidelně ho vídáme po břišních operacích, zejména po laparoskopii. U prostého snímku břicha horizontálním paprskem je centrální paprsek zaměřen do středu spojnice hřebenů lopat kyčelních, a subdiafragmatický prostor je tak zobrazen zespodu šikmo, a ne tangenciálně. Výsledkem je superpozice s masou celých jater a sumace především s dorzálním diafragmatickým recesem, vyplněným vzdušnou plicní tkání. Větší diagnostický význam při detekci plynu pod bránicí má proto prostý snímek hrudníku vestoje. Volný plyn je detekovatelný i na snímku břicha vleže na zádech (znamení dvojité stěny – „double wall“ sign) (obr. 5). Malé množství volného plynu v dutině břišní je však takto nezobrazitelné. Také srůsty mohou bránit migraci plynu do podbráničních prostor, a tím zvyšovat falešnou negativitu vyšetření. Nejčastějšími příčinami pneumoperitonea jsou perforace trávicí trubice (vředová choroba gastroduodenální, komplikovaná divertikulitida, traumatické či iatrogenní příčiny). Kromě trávicí trubice
a volného plynu hodnotíme na prostém snímku břicha též struktury retroperitonea (přítomnost možné urolitiázy, kalcifikace v různých lokalizacích a kontury psoatů).
Literatura ke kapitole 2.1
Bartušek D, Válek V, Kala Z, Procházka V, Andrašina T, Janeček P, Kunovský L. Zobrazovací metody u neúrazových náhlých příhod břišních. Gastroent Hepatol 2020; 74(6): 520–532.
Denham G, Smith T, James D, McKiernan S, Evans TJ. Exploring the evidence-practice gap in the use of plain radiography for acute abdominal pain and intestinal obstruction: a systematic review and meta-analysis. JBI Evidence Implementation 2020; 18(2): 159. Doi: 10.1097/XEB.0000000000000218.
Jain SN, Shah RS, Modi T, Varma RU. ICRI White Paper: An update on role of conventional radiography in imaging of pediatric gastrointestinal tract. Indian J Radiol Imaging 2022; 33(2): 218–229. Doi: 10.1055/s-0042-1759481.
Loo JT, Duddalwar V, Chen FK, Tejura T, Lekht I, Gulati M. Abdominal radiograph pearls and pitfalls for the emergency department radiologist: a pictorial review. Abdom Radiol 2017; 42(4): 987–1019. Doi: 10.1007/s00261-016-0859-8.
Maglinte DD, Reyes BL, Harmon BH, et al. Reliability and role of plain film radiography and CT in the diagnosis of small-bowel obstruction. Am J Roentgenol 1996; 167(6): 1451–1455.
Válek V. Tenké střevo – radiologická diagnostika patologických stavů. První vydání. Samostatná monografie. Brno, NCONZO: Národní centrum ošetřovatelství a nelékařských zdravotnických oborů, 2003. 288 s. ISBN 80-7013-383-X.
Obrázky ke kapitole 2.1
Obr. 1: RTG snímek břicha vleže. Stíny několika cizích těles – pružinka, hroty propisovací tužky a úlomky zipu v žaludku. Oválný stín (knoflíku podle anamnézy) v colon ascendens.
Obr. 2, 3: RTG snímek břicha vleže a vestoje. Ileus tenkého střeva. Vleže je dobře patrná dilatace kliček tenkého střeva nad 3 cm (2). Tenké střevo odlišíme od tlustého přítomností plicae circulares, které obkružují celý obvod lumen střeva. Vstoje vidíme v tenkém střevě hladinky (3).
Obr. 4: RTG snímek břicha vestoje. Pneumoperitoneum. Srpovité projasnění volného plynu pod pravou brániční kopulí.
Obr. 5: RTG snímek břicha vleže. Pneumoperitoneum. Žluté šipky označují místa, na kterých je střevní stěna ohraničena jednak plynem v lumen střeva, jednak volným plynem v okolí. 1
2.2 Ultrazvuk
Ultrazvukové vyšetření tenkého střeva je dnes široce využívané v diagnostice postižení trávicí trubice. Uplatňuje se především u pacientů s Crohnovou nemocí, ale také u pacientů s dalšími enteropatiemi.
Mezi benefity UZ vyšetření můžeme zařadit absenci radiační zátěže, dostupnost vyšetření v reálném čase, možnost sledovat dynamiku patologického procesu, možnost vyšetření u lůžka, možnost využití přenosných přístrojů, rychlost a neinvazivitu. Nezanedbatelná je i cena jak samotného vyšetření, tak přístrojů, ve srovnání např. s CT a MR.
Sonograficky můžeme hodnotit šířku a echogenitu střevní stěny, postižení jejích jednotlivých vrstev, patologické změny v okolí střeva a komplikace (absces, pseudotumor, píštěle, konvolut kliček apod.). Sledování dynamiky onemocnění a opakované kontroly přitom pacienta nepoškozují radiační zátěží, proto je vyšetření výhodné zvláště pro děti a adolescenty. Pacient nemusí být nijak speciálně připravován, nemusí být lačný a vyšetření lze libovolně opakovat.
Technika ultrazvukového vyšetření střev zahrnuje použití dvou různých sond: nízkofrekvenční konvexní sondy (3–5 MHz) a vysokofrekvenční lineární sondy (5–17 MHz). Nemocné vyšetřujeme v poloze na zádech nejprve pomocí nízkofrekvenční konvexní sondy, abychom vizualizovali hlouběji uložené struktury a detekovali výraznější patologie, jako například signifikantní ztluštění střevní stěny, dilataci střevních kliček, přítomnost markantních fistulací nebo abscesů. Vyšetření nízkofrekvenční konvexní sondou je vhodné také u obézních pacientů, u nichž vyšetření vysokofrekvenční lineární sondou nemusí být výtěžné. Po vstupním vyšetření břicha nízkofrekvenční sondou přistupujeme k vyšetření pomocí vysokofrekvenční lineární sondy, která nám umožní detailnější vizualizaci jednotlivých vrstev střevní stěny
Mukóza se zobrazuje jako hypoechogenní, submukóza jako hyperechogenní, svalovina je hypoechogenní a seróza hyperechogenní. Lumen střeva většinou obsahuje vzduch, který při ultrazvukovém vyšetření vytváří hyperechogenní odraz s akustickým stínem. Jednotlivé vrstvy střevní stěny a vzduch v lumen jsou dobře viditelné i u zdravých jedinců. Normální šíře stěny se pohybuje v rozmezí 2–3 mm.
Poněkud obtížnější vyšetřovací podmínky jsou u pacientů po operačním zákroku na tenkém či tlustém střevě. I v těchto případech však lze detekovat postižené oddíly trávicí trubice a většinou i anastomózu.
Ultrazvukové vyšetření střeva má i nevýhody. Většinou lze posuzovat pouze přední stěnu střevní, zatímco zadní stěna je krytá hyperechogenními odrazy způsobenými vzduchovou náplní (což platí především pro hodnocení tlustého střeva). U nemocných s atypickým průběhem střeva je topografická orientace a lokalizace patologického postižení velmi obtížná. Otevřená zůstává otázka senzitivity a specificity této subjektivní metody. V rukách zkušeného sonografisty je však silným diagnostickým nástrojem.
2.2.1
UZ
vyšetření střev s kontrastní látkou
UZ vyšetření střev s kontrastní látkou (CEUS) je zobrazovací metoda, která umožňuje hodnotit sycení střevní stěny v reálném čase. Využití nachází zejména u pacientů s idiopatickými střevními záněty (IBD) při hodnocení zánětlivé aktivity onemocnění, monitoraci průběhu a efektivity léčby. Ačkoli může v některých situacích u této
Radiologické metody vyšetření tenkého střeva
skupiny pacientů napomoci také ke stanovení správné diagnózy, standardně se zatím v klinické praxi nepoužívá.
U pacientů s IBD umožňuje tato metoda posoudit mikrocirkulaci v segmentech tenkého střeva pomocí kvalitativních a kvantitativních parametrů, čímž pomáhá odlišit aktivní zánět od pozánětlivých změn. Na základě přesných a reprodukovatelných kritérií vycházejících z kontrastního sycení přispívá k redukci míry subjektivity nativního UZ vyšetření a zvyšuje specificitu v hodnocení patologických procesů.
Mikrobublinové intravenózní kontrastní látky využívané u této zobrazovací metody nepronikají do extravaskulárního prostoru, a napomáhají tak zobrazení mikrovaskularizace střeva. Částice plynu jsou menší než plicní kapiláry (do 10 µm), a tudíž schopné proniknout i do levostranného krevního řečiště. Plynná složka mikrobublin je stabilizována kapsulou tvořenou fosfolipidovou membránou. K vyšetření je nutný kvalitní ultrazvukový přístroj dovolující specifické kontrastní zobrazení. Při vyšetření je důležité nastavení nízkého mechanického indexu, aby nedošlo k rychlé destrukci mikrobublin.
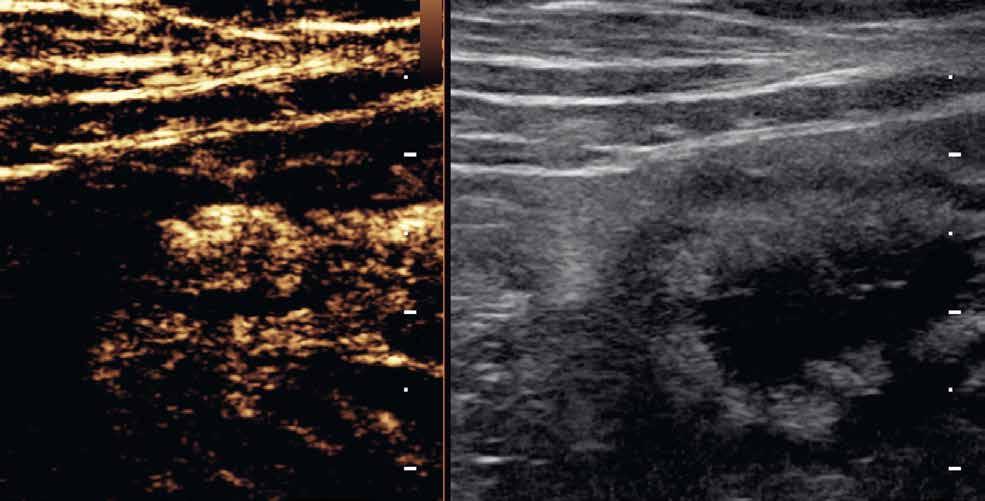
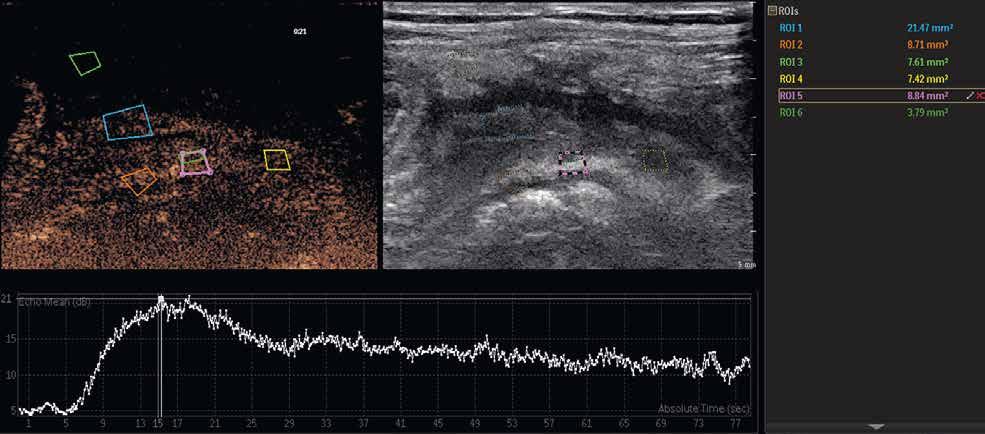
Při vyšetření střev by měl být mechanický index nižší než 0,1. Využíváme lineární sondy o frekvencích 7,5–12 MHz. V závislosti na použité sondě aplikujeme také množství kontrastní látky, obvykle okolo 3 ml. Výhodou je, že s odstupem několika minut lze kontrastní látku použít znovu, například na jiném patologicky změněném úseku střeva. Po aplikaci kontrastní látky sledujeme při duálním zobrazení sycení postiženého úseku střeva. Jde o dynamické vyšetření, během něhož pořizujeme videozáznam, který můžeme kvantitativně zpracovávat pomocí dedikovaných softwarů. Následným postprocesingovým zpracováním získáme křivku sycení, která může napovědět, o jakou fázi IBD se jedná (obr. 1–3).
2.2.2 Elastografie
Elastografie je metoda sloužící k hodnocení tuhosti studované tkáně. V radiologii pro tyto potřeby využíváme magnetickou rezonanci nebo sonografii. V současné době jsou tyto metody využívány především při vyšetřování jater, prsů a štítné žlázy.
Princip metody
Metody sonoelastografie můžeme rozdělit do dvou základních skupin, na tzv. strain elastografii a shear-wave elastografii. Při strain elastografii vyšetřující vyvíjí sondou mechanický tlak, čímž dochází k deformaci studované tkáně. Druhou možností, jak této deformace dosáhnout, je využití fyziologických pohybů, například dechových pohybů nebo srdeční akce. Následně je zhodnocena informace o deformaci tkáně před aplikací a po aplikaci mechanického tlaku. Ta je nakonec kódována do barevné mapy (podle míry tuhosti) vyšetřované oblasti v klasickém B-módu. Alternativou je tzv. ARFI (acoustic radiation force impulse) metoda, která k deformaci tkáně využívá akustického pulzu. Vyhodnocení probíhá stejným způsobem jako při aplikaci mechanického tlaku. Princip shear-wave elastografie (elastografie střihové vlny) spočívá ve vyslání akustického impulzu sondou do vyšetřované tkáně. Tento pulz způsobí deformaci tkáně, která generuje tzv. střihové vlny, jež se šíří ve směru kolmém na směr šíření původního impulzu (u bodové shear-wave a 2D shear-wave elastografie), respektive podélně ve směru původního impulzu (u tranzientní elastografie). Následně je vypočtena rychlost šíření takto vzniklé střihové vlny. Matematickou úpravou může přístroj přepočítat
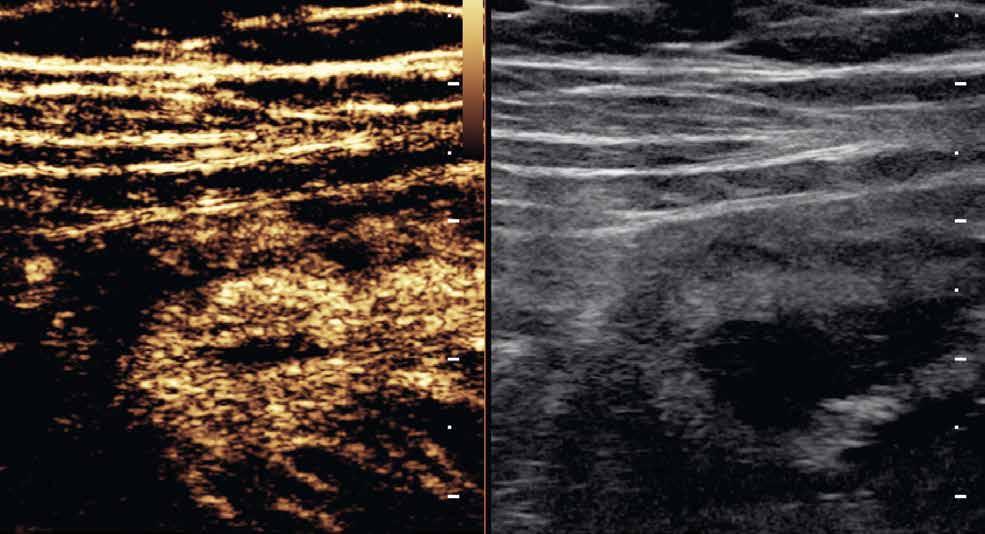
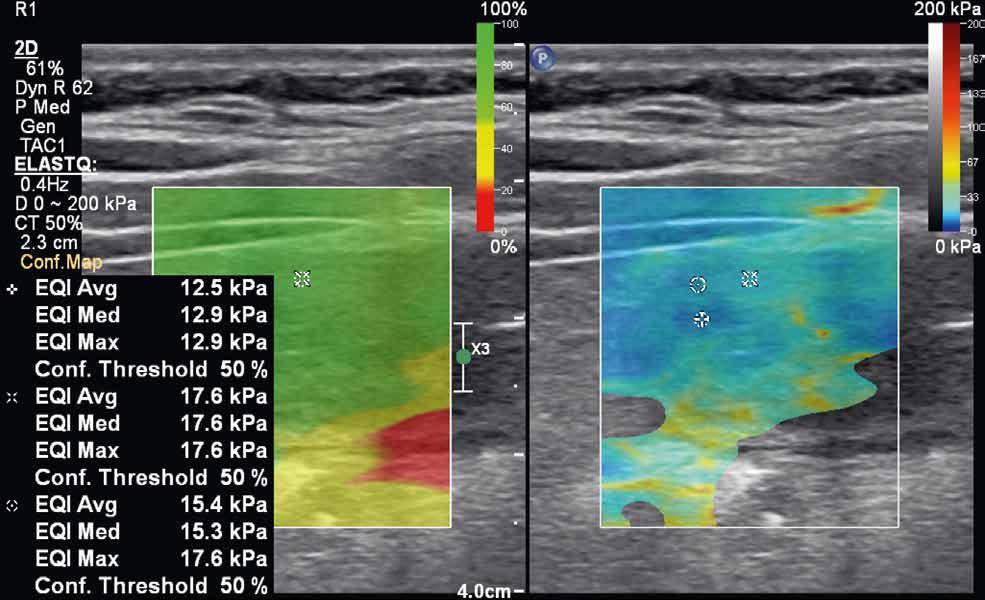
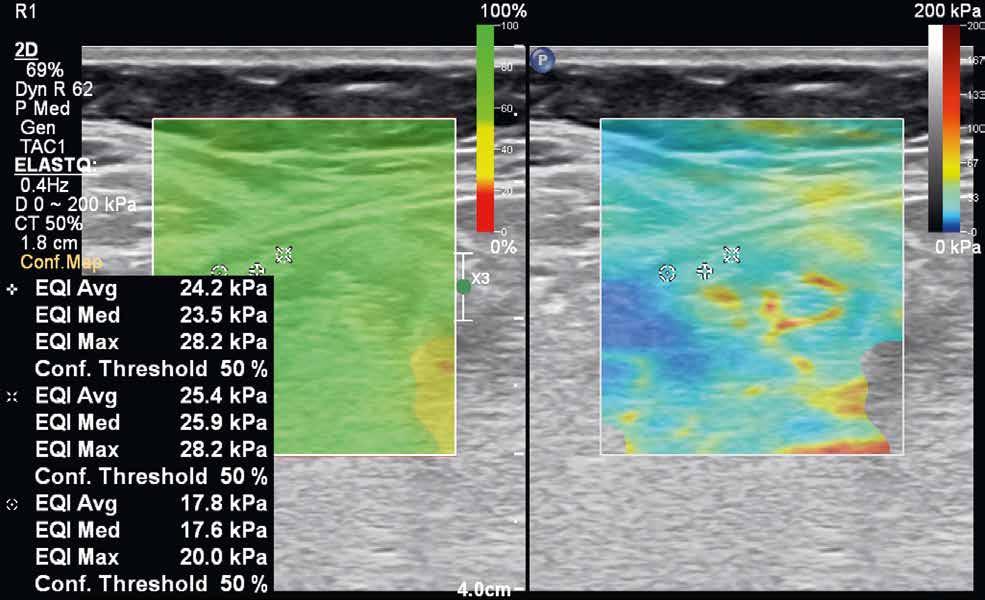
rychlost na hodnoty tlaku v kilopascalech. Výsledná informace je opět kódována do barevné mapy (v klasickém B-obraze), zachycující škálu tuhosti vyšetřované tkáně. Tranzientní elastografie využívá k vyslání pulzu mechanických vibrací sondy, bodová shear-wave elastografie využívá výše popisovanou techniku ARFI ke generování pulzu do jednoho bodu. Nevýhodou tranzientní elastografie je absence klasického B-módu, a tedy nemožnost morfologického zhodnocení vyšetřované tkáně. Nejnovější technikou je 2D shear-wave elastografie (obr. 4–7). Iniciálně je v krátkém časovém intervalu vysláno několik akustických pulzů, následovaných vznikem střihových vln ve více bodech. Výhodou této techniky je možnost sledovat tuhost tkáně v reálném čase. Některé moderní přístroje využívající 2D shear-wave elastografii mají nástroj označovaný „confidence map“. Mapa se zobrazí ve druhém okně na displeji přístroje a pomocí barevné škály hodnotí úroveň, s jakou se v daném místě propagují střihové vlny. Na základě těchto informací pak může vyšetřující zvolit optimální místo k měření tuhosti tkáně.
Využití v praxi
Ačkoli sonoelastografie střev není v současné době běžně využívanou metodou, má potenciál v hodnocení změn střevní stěny u pacientů s Crohnovou nemocí. Crohnova nemoc je charakterizována transmurální povahou chronického zánětu s významnou fibroprodukcí a rizikem vzniku nejprve zánětlivých a následně vazivových stenóz především v oblasti tenkého střeva. U zhruba 5 % nemocných jsou striktury přítomny již v době stanovení diagnózy, u dalších 50–70 % se tato závažná komplikace onemocnění objeví v průběhu deseti let. U dětí je incidence striktur ještě vyšší. Jejich výskyt má zásadní význam pro další management onemocnění. Přestože mohou být u části pacientů asymptomatické, relativně často vyžadují endoskopickou nebo chirurgickou intervenci.
Někteří autoři využívají k hodnocení povahy striktur u Crohnovy nemoci klasifikaci, kterou navrhli Fufezan et al. v roce 2015. Na základě vyhodnocení barevných map získaných během sonoelastografického vyšetření, podle převážného zastoupení konkrétní barvy, rozlišují tři stupně změn ve střevní stěně: remise, převážně zánětlivé a převážně fibrotizující změny. Výsledky dostupných studií se nicméně často liší a jsou rovněž ovlivněny technikou, která je při vyšetření použita (strain/shear-wave elastografie). V současné době neexistuje jedna uniformní klasifikace, která by byla schopna rozlišit stupně fibrózních změn. Z těchto důvodů tak potenciál sonoelastografie tenkého střeva u pacientů s Crohnovou nemocí spočívá spíše v kombinaci s klasickým B-módem a kontrastním UZ.
Významnou limitací sonoelastografie střev je obtížné měření při přítomné peristaltice a u obézních nemocných.
Zajímavou a rozvíjející se metodou je MR elastografie, která se používá především k hodnocení jaterní fibrózy. Limitace jejího využití při vyšetření střev jsou obdobné jako u klasické MR enterografie, je to především peristaltika tenkých kliček.
Literatura ke kapitole 2.2
Andrzejewska M, Grzymisławski M. The role of intestinal ultrasound in diagnostics of bowel diseases. Prz Gastroenterol 2018; 13(1): 1–5.
Bartušek D, Petrášová H, Válek V. Idiopatické střevní záněty. První vydání. Praha: Mladá fronta, 2018.
Bettenworth D, Bokemeyer A, Baker M, et al. Assessment of Crohn’s disease-associated small bowel strictures and fibrosis on cross-sectional imaging: a systematic review. Gut 2019; 68(6): 111521126. Doi: 10.1136/gutjnl-2018-318081.
Fleischer AC, Muhletaler CA, James AE. Sonographic assessment of the bowel wall. Am J Roentgenol 1981; 136: 887–891.
Fleischer AC, Muhletaler CA, James AE. Detection of bowel lesions during abdominal and pelvic sonography. JAMA 1980; 244: 2096–2099.
Fufezan O, Asavoaie C, Tamas A. Bowel elastography – a pilot study for developing an elastographic scoring system to evaluate disease activity in pediatric Crohn’s disease. Med Ultrason 2015; 17(4): 422–430. Doi: 10.11152/mu.2013.2066.174.bwe.
Hayden CK. Ultrasonography of the gastrointestinal tract in infants and children. Abdom Imaging 1996, 21: 9–20.
Hustý J, Bartušek D, Válek V, Smělá M, Zbořil V, Prokopová L. Využití kontrastního ultrazvuku v diagnostice aktivity Crohnovy nemoci. Čes. Radiol 2013; 67(1): 39–45.
Ledermann HP, Borner N, Strunk H, et al. Bowel wall thickening on transabdominal sonography. Am J Roentgenol 2000, 174: 107–115.
Ozturk A, Grajo JR, Dhyani M, Anthony BW, Samir AE. Principles of ultrasound elastography. Abdom Radiol 2018; 43(4): 773–785. Doi: 10.1007/s00261-018-1475-6.
Ripollés T, Martínez-Pérez MJ, Blanc E, Delgado F, Vizuete J, Paredes JM, Vilar J. Contrast-enhanced ultrasound (CEUS) in Crohn’s disease: technique, image interpretation and clinical applications. Insights Imaging 2011; 2(6): 639–652.
Sigrist RMS, Liau J, Kaffas AE, Chammas MC, Willmann JK. Ultrasound elastography: review of techniques and clinical applications. Theranostics 2017; 7(5): 1303–1329. Doi: 10.7150/thno.18650.
Válek V. Tenké střevo – radiologická diagnostika patologických stavů. První vydání. Samostatná monografie. Brno, NCONZO: Národní centrum ošetřovatelství a nelékařských zdravotnických oborů, 2003. 288 s. ISBN 80-7013-383-X.
1
Obrázky ke kapitole 2.2
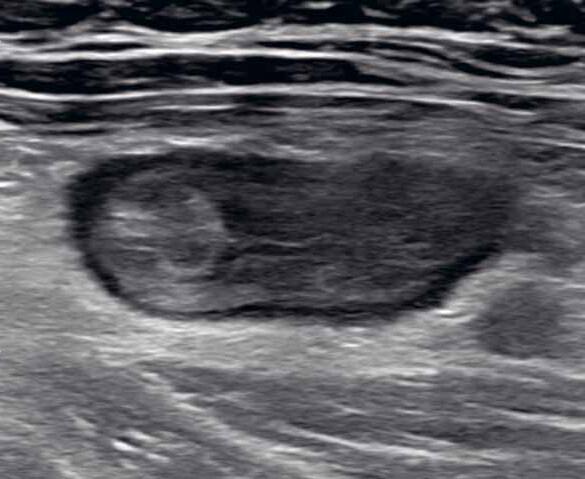
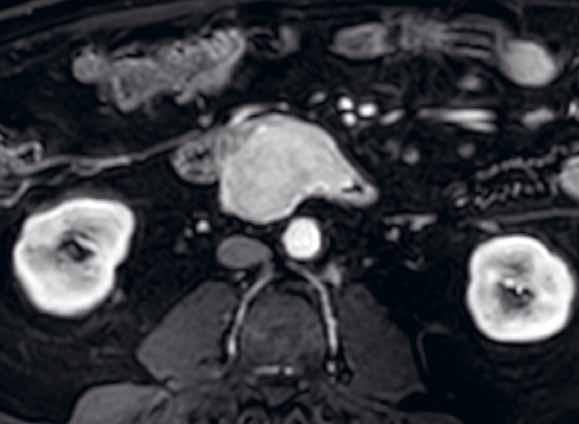
Obr. 1–3: CEUS. Pacient s Crohnovou nemocí ve fázi aktivního zánětu. Po podání kontrastní látky je patrné postupné sycení střevní stěny (1, 2, levá část obrázku), která je výrazně zesílená s akcentovanou hypoechogenní sliznicí (1, 2, pravá část obrázku). Křivka sycení pak svědčí rovněž pro akutní fázi zánětu (3).
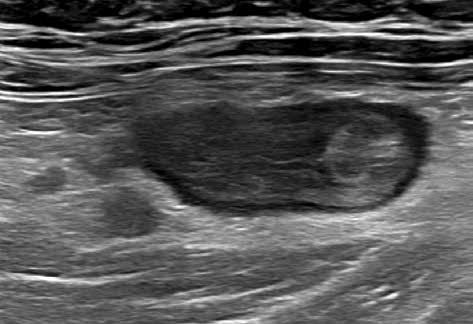
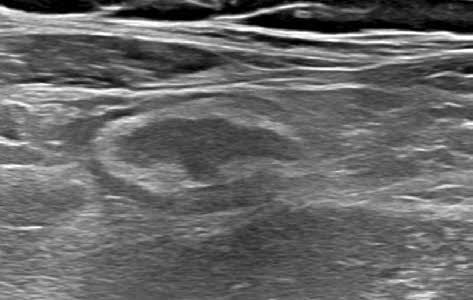
Obr. 4–7: Elastografie. U pacienta s Crohnovou nemocí ve fázi aktivního zánětu vidíme edematózní stěnu s prosáknutím a uzlinami v okolí (5). Elastograficky je stěna „měkčí“ (4) ve srovnání s pacientem s chronickou fází onemocnění (6, 7), u kterého je stěna fibrózně změněná.
2
2.3 CT
V dnešní době je CT vyšetření plně dostupnou metodou v komplexním hodnocení orgánů břišní dutiny, čehož se využívá i pro vyšetření střev.
CT umožňuje zobrazit postižení střevní stěny i změn v okolí trávicí trubice (absces, zánětlivý infiltrát, postižení mezenteria, píštěle, fibróza, lipomatóza atd.). Výhodou současných multidetektorových přístrojů je možnost rychlého náběru dat ze submilimetrových řezů, s možností automatické derivace dat ve více rovinách, a tím i možností multiplanárního zobrazení.
Tenké střevo můžeme hodnotit v CT obraze v rámci cílených vyšetřovacích protokolů i v rámci necíleného vyšetření břišní dutiny. Necílená vyšetření ovšem nemají stejnou senzitivitu a specificitu jako vyšetření cílená. Při necíleném vyšetření nemusí být distenze střevních kliček optimální. Posouzení střevní stěny může ovlivnit také volba perorálně aplikované kontrastní látky, kdy například použití pozitivní kontrastní látky per os snižuje možnost posouzení samotné střevní stěny. U nativně prováděných CT vyšetření (například u ileózních stavů, alergií na kontrastní látku aj.) je hodnocení střevních patologií také značně limitované. Na nativních CT skenech lze posoudit jen výrazněji zesílenou stěnu střevní, dilataci střevních kliček, edém řas, volnou tekutinu v dutině břišní. Pro cílená vyšetření tenkého střeva využíváme speciální vyšetřovací protokoly.
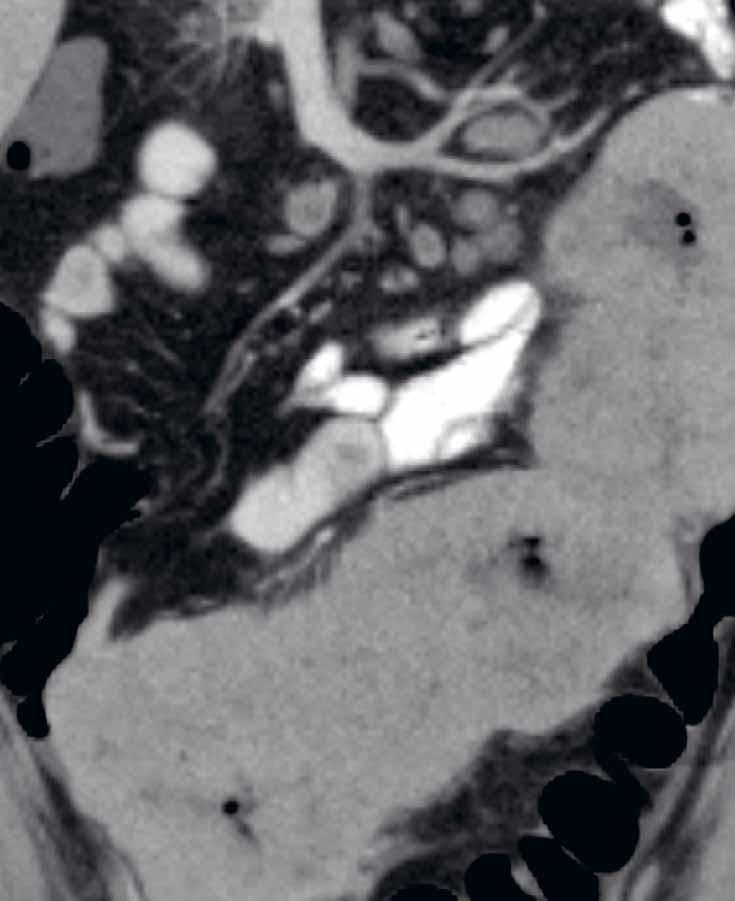
Volba vyšetřovacího protokolu, typ a způsob aplikace kontrastní látky závisí na tom, co chceme daným vyšetřením zjistit. Jiný je způsob vyšetření CT břicha k vyloučení tekutinových kolekcí nebo například pro potvrzení dehiscence anastomóz. Odlišný protokol má taktéž CT enterografie, kdy je podezření na píštěle či abscesy, či je vyšetření prováděno v akutním stavu pro ileus při klinicky významné stenóze. Vyšetřovací protokoly jsou standardizovány. Pracoviště se řídí místními radiologickými standardy, které jsou v souladu s národními radiologickými standardy. Místní radiologické standardy obsahují jednotlivé vyšetřovací protokoly (rozsah vyšetření, způsoby a množství aplikovaných kontrastních látek, jednotlivé fáze vyšetření atd.). Vyšetření dutiny břišní se ve většině případů provádějí s aplikací kontrastní látky – a to orálně, intravenózně, rektálně či instilací do dutinových formací. Kontrastní látky aplikované do trávicí trubice můžeme rozdělit na hyperdenzní (jodové kontrastní látky, baryová suspenze) (obr. 1) a hypodenzní (voda, manitol, vzduch) (obr. 2). Intravenózně se u výpočetní tomografie podává výhradně jodová kontrastní látka. Pro přesné načasování vyšetření v arteriální fázi (CT angiografie) se užívá metoda bolus trackingu, kdy během aplikace kontrastní látky přístroj skenuje nízkodávkovým skenem zvolený objem a vyšetření spustí až po dosažení prahové hodnoty denzit. Perorálně se aplikuje ředěná jodová kontrastní látka, voda či roztok manitolu.
Mezi hlavní nevýhody výpočetní tomografie patří radiační zátěž. Zde se nabízí prostor k většímu využití MR a UZ. Další možností, jak snížit průměrnou dávku u CT vyšetření, je například využití optimalizací jednotlivých protokolů užíváním softwarových iterativních rekonstrukcí CT obrazu, které snižují dávku záření až o desítky procent (tzv. low-dose techniky).
2.3.1 CT enterografie (enteroklýza)
CT enterografie a enteroklýza jsou metody k cílenému posouzení tenkého střeva. Využití mají zejména u pacientů s IBD v akutních i chronických stavech. K dostatečnému posouzení tenkého střeva a jeho případných patologií je u obou metod nutná dostatečná distenze tenkého střeva, kterou docílíme aplikací luminálních kontrastních látek.
U CT enterografie je kontrastní látka podávána orálně, frakcionovaně. Při klasické
CT enterografii volíme pro detailnější hodnocení střevní stěny perorální aplikaci neutrální kontrastní látky (například manitolu). V průběhu 50 minut aplikujeme 1,5–2 litry roztoku kontrastní látky per os. Při cíleném podezření na píštěle, kolekce či dehiscence anastomóz využíváme pozitivní kontrastní látky, například baryovou suspenzi či jodový roztok. Nežádoucí spazmy tenkých kliček eliminujeme intravenózním podáním spazmolytika těsně před vyšetřením.
U CT enteroklýzy je kontrastní látka aplikována nazojejunální sondou a je zde udávána o něco větší senzitivita i specificita v detekci a hodnocení postižených segmentů. Při CT enteroklýze se nejdříve zavede nazojejunální sonda a následně jsou pumpou aplikovány asi 2 litry manitolu.
Rozsah vyšetření u obou metod zahrnuje oblast břicha a malé pánve a provádí se nativně a dále po aplikaci jodové kontrastní látky intravenózně (i.v.). Většinou se zhotovuje jedna postkontrastní fáze, tzv. fáze enterální. Při dalším požadavku, například na zmapování arteriálního řečiště před rozsáhlejšími resekcemi, je nutné provedení i arteriální fáze. Možností multiplanárních rekonstrukcí (MPR) se výrazně zlepšuje hodnocení anatomických vztahů a vztah patologie k okolním strukturám (zobrazení v koronální i sagitální rovině). Další softwarová vybavení umožňují podrobnější postprocesingové zpracování (například „curved MPR“, kterou lze využít ke stanovení délky postižených úseků či délky reziduálního střeva při syndromu krátkého střeva).
Mezi další výhody diagnostické metody patří možnost posouzení extraintestinálních změn a komplikací základního onemocnění, včetně zhodnocení mezenteria a přítomnosti abscesů či píštělí. Samozřejmostí je také možnost hodnocení cévních patologií (trombóza portální žíly či pánevních žil a jiné). Výhodou je i vizualizace urolitiázy jako možné komplikace u pacientů po rozsáhlých resekcích střev. CT má též zásadní postavení v hodnocení intraabdominálních kolekcí. Zároveň slouží jako nástroj k další rozvaze o konzervativní či intervenční léčbě těchto kolekcí, s možností CT-navigované punkce s aspirací či perkutánní drenáží. Drenáže intrabdominálních kolekcí pod kontrolou CT mohou být velice přínosné u pacientů po opakovaných operacích (předpoklad srůstů, obtížná dostupnost při otevřených chirurgických zákrocích a jiné), samozřejmě vše s ohledem na klinický a laboratorní obraz a vývoj při zavedené konzervativní terapii.
Literatura ke kapitole 2.3
Baker ME, Hara AK, Platt JF, Maglinte DD, Fletcher JG. CT enterography for Crohn’s disease: optimal technique and imaging issues. Abdom Imaging 2015; 40(5): 938–952.
Barlow JM, Goss BC, Hansel SL, Kolbe AB, Rackham JL, Bruining DH, Fletcher JG. CT enterography: technical and interpretive pitfalls. Abdom Imaging 2015; 40(5): 1081–1096.