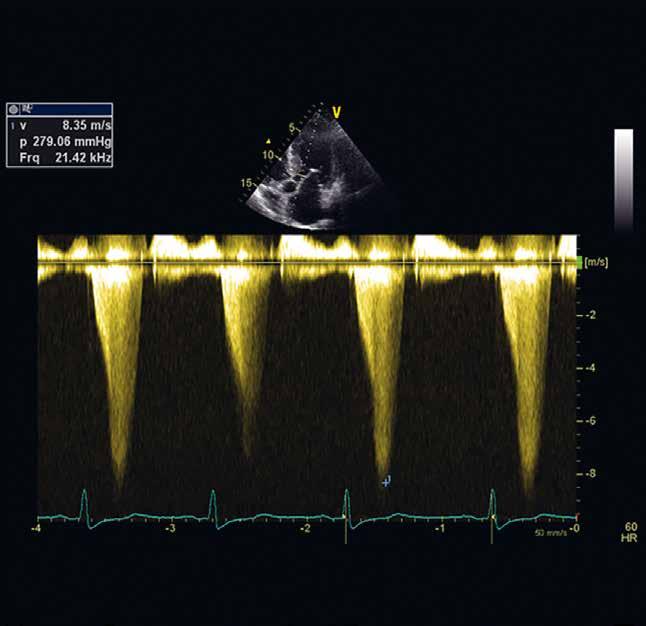
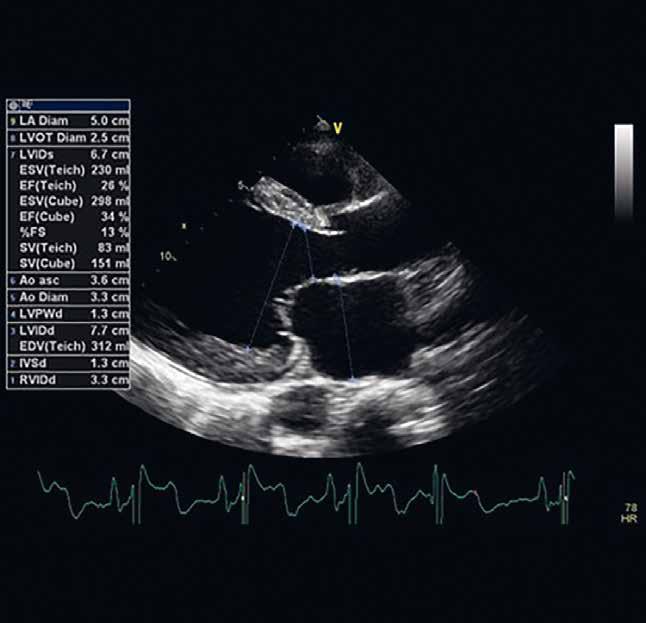
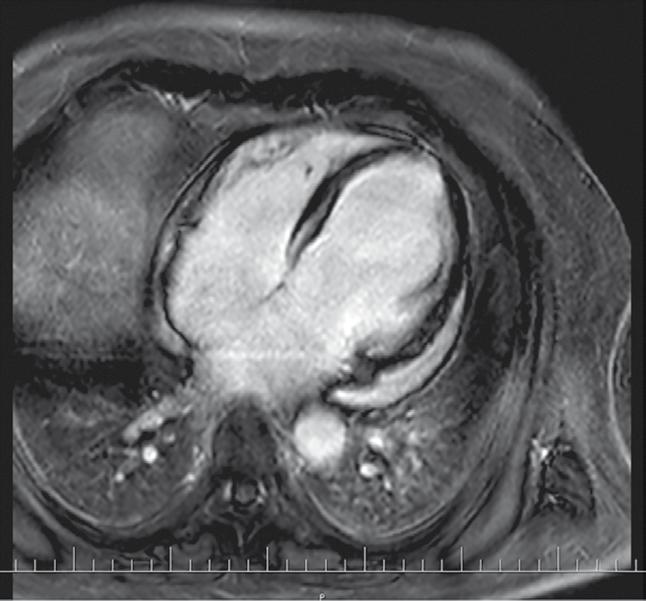
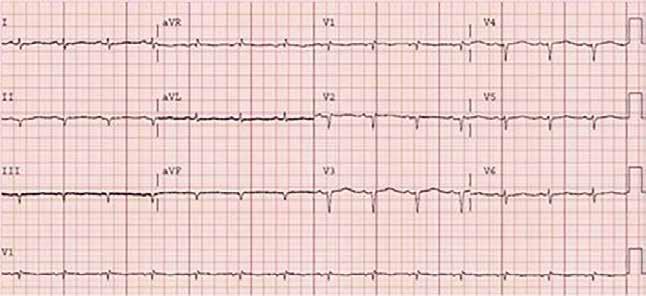
VNITŘNÍ LÉKAŘSTVÍ
2., zcela přepracované vydání
1. díl
Miroslav Souček
Bohuslav Kianička editoři
Upozornění pro čtenáře a uživatele této knihy Všechna práva vyhrazena. Žádná část této tištěné či elektronické knihy nesmí být reprodukována a šířena v papírové, elektronické či jiné podobě bez předchozího písemného souhlasu nakladatele. Neoprávněné užití této knihy bude trestně stíháno.
Automatizovaná analýza textů nebo dat ve smyslu čl. 4 směrnice 2019/790/EU a použití této knihy k trénování AI jsou bez souhlasu nositele práv zakázány.
Prof. MUDr. Miroslav Souček, CSc., prof. MUDr. Bohuslav Kianička, Ph.D. – editoři
VNITŘNÍ LÉKAŘSTVÍ 1. DÍL
2., zcela přepracované vydání
Recenzenti: prof. MUDr. Andrej Dukát, CSc., FRCP, FACP, prof. MUDr. Vlastimil Ščudla, CSc.
Vydání odborné knihy schválila Vědecká redakce nakladatelství Grada Publishing, a.s.
© Grada Publishing, a.s., 2025
Cover Design © Grada Publishing, a.s., 2025
Vydala Grada Publishing, a.s.
U Průhonu 22, Praha 7 jako svou 9937. publikaci
Šéfredaktorka lékařské literatury MUDr. Michaela Lízlerová
Odpovědné redaktorky Jindřiška Bláhová, Mgr. Helena Glezgová Sazba a zlom Jan Šístek
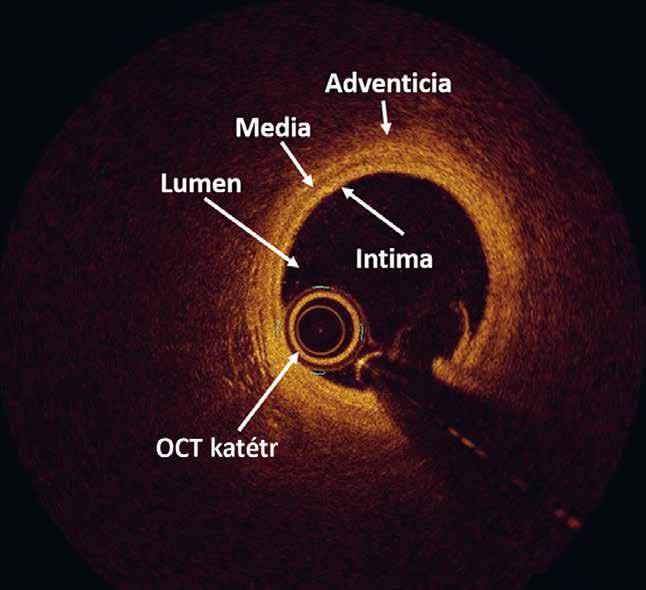
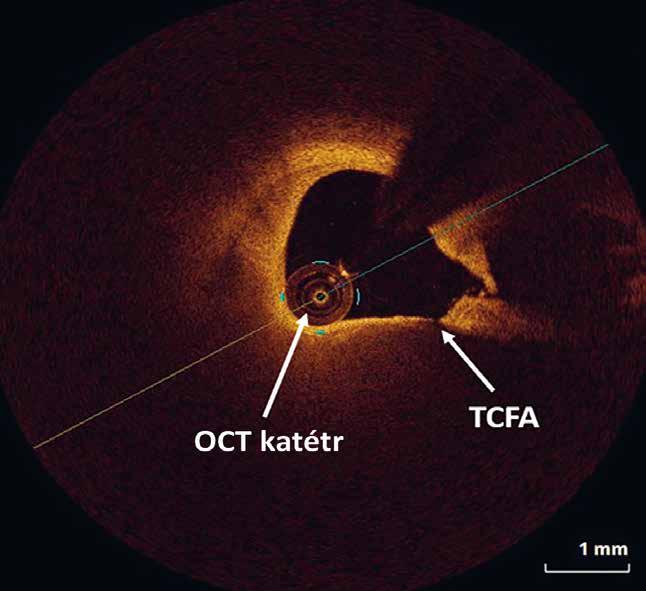
Obrázky 2.47, 2.51, 2.63, 2.87, 2.88 překreslil Jiří Hlaváček, obrázek 5.17 Jana Nejtková (převzat z publikace Tesař V, Viklický O. Klinická nefrologie. 2., zcela přepracované a doplněné vydání. Grada Publishing 2015). Ostatní obrázky dodali autoři.
Kapitoly 2.7 Chronické srdeční selhání, 2.8 Kardiomyopatie a 2.13 Zánětlivá onemocnění srdce byly podpořeny projektem Národní institut pro výzkum metabolických a kardiovaskulárních onemocnění (Program EXCELES, ID: LX22NPO5104) – Financováno Evropskou unií – Next Generation EU.
Počet stran 1532, 666 (1. díl), 866 (2. díl) Praha 2025
Vytiskla D.R.J. TISKÁRNA RESL, s.r.o., Náchod
Názvy produktů, firem apod. použité v knize mohou být ochrannými známkami nebo registrovanými ochrannými známkami příslušných vlastníků, což není zvláštním způsobem vyznačeno.
Postupy a příklady v této knize, rovněž tak informace o lécích, jejich formách, dávkování a aplikaci jsou sestaveny s nejlepším vědomím autorů. Z jejich praktického uplatnění však pro autory ani pro nakladatelství nevyplývají žádné právní důsledky.
ISBN 978-80-271-7820-9 (pdf)
ISBN 978-80-271-5142-4 (print)
Hlavní autoři a editoři
Prof. MUDr. Miroslav Souček, CSc. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Bohuslav Kianička, Ph.D. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Autorský kolektiv
Prof. MUDr. Zdeněk Adam, CSc. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Dagmar Adámková, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Blanka Adamová, Ph.D. – Neurologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Tomáš Andrašina, Ph.D. – Klinika radiologie a nukleární medicíny, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Irena Andršová, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Tomáš Arpáš – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jan Baroš – Ústav imunologie a alergologie, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Doc. Mgr. Ladislav Baťalík, Ph.D. – Katedra fyzioterapie a rehabilitace, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Otakar Bednařík – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Markéta Bednaříková, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jana Bělobrádková – Interní gastroenterologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Beatric Bencsiková, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
MUDr. Eliška Benýšková – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno
MUDr. Katarína Bielaková, Ph.D., MHA – Všeobecná interní klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Lucia Bohovicová – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Tomáš Boušek – I. neurologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Eliška Boženková – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Dagmar Brančíková, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Kristián Brat, Ph.D. – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Monika Bratová, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Adriana Braunová, Ph.D. – Klinika dětských infekčních nemocí, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Milan Brázdil, Ph.D. – I. neurologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Vojtěch Brázdil – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Tomáš Brychta – Kardio Brychta s.r.o., Brno
MUDr. Yvona Brychtová, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Alena Buliková, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Ivan Čapov, CSc. – I. chirurgická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Vladimír Červeňák – Klinika zobrazovacích metod, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Libor Červinek, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Petra Čičátková – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Milan Dastych – Interní gastroenterologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Petr Dítě, DrSc. – Lékařská fakulta, Ostravská univerzita, Ostrava
MUDr. Petra Divácká – Interní gastroenterologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Jiří Dolina, Ph.D. – Interní gastroenterologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Michael Doubek, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Martina Doubková, Ph.D. – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. RNDr. Ladislav Dušek, Ph.D. – Institut biostatistiky a analýz, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Mirka Džingozovová – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Michal Eid – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Lucie Ehrlichová – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Lubomír Elbl, CSc. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Dominik Fabián – Anesteziologicko-resuscitační klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Pavel Fabian, Ph.D – Oddělení onkologické patologie Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Michal Fedorko, Ph.D., FEBU – Urologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Marián Felšőci, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Martin Fiala, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Petra Fialová – I. dermatovenerologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Petr Fila, Ph.D. – Centrum kardiovaskulární a transplantační chirurgie, Brno
MUDr. Blanka Fischerová, Ph.D. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Zdeněk Fojtík, Ph.D. – Interní gastroenterologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. František Folber, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Lenka Foretová, Ph.D. – Oddělení epidemiologie a genetiky nádorů, Masarykův onkologický ústav, Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Renata Gaillyová, Ph.D. – Ústav lékařské genetiky a genomiky, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Roman Gál, Ph.D. – Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Július Godava – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Tereza Gregorová – Všeobecná interní klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Kamila Greplová – Všeobecná interní klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Martin Gryc – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Marek Hakl, Ph.D. – Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Roman Hakl, Ph.D. – Ústav imunologie a alergologie, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Simona Halajová – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Jana Halámková, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Kateřina Helánová, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
†Prof. MUDr. Aleš Hep, CSc. – Interní gastroenterologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Vladimír Herout, Ph.D. – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jiří Hlásenský, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Eva Hlaváčková, Ph.D. – Ústav imunologie a alergologie, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Ivo Hofírek – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Miloš Holánek, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Jan Holčík, DrSc. – Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Lukáš Homola, Ph.D. – Klinika dětských infekčních nemocí, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Alena Hondlová – Endokrinologická ambulance, Uherskohradišťská nemocnice a.s., Uherské Hradiště
MUDr. Tomáš Honek, Ph.D. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Monika Horváthová – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Štěpán Hrabovský, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Ondřej Hrdý – Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jan Hruda, Ph.D. – Anesteziologicko-resuscitační klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Martin Hudec – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Petr Husa, CSc. – Klinika infekčních chorob, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Petr Husa, Ph.D. – Klinika infekčních chorob, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Libuše Husová, Ph.D. – Centrum kardiovaskulární a transplantační chirurgie, Brno
MUDr. Jakub Hustý, Ph.D. – Klinika radiologie a nukleární medicíny, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Anna Chaloupka, Ph.D., FHFA – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Richard Chaloupka, CSc. – Klinika ortopedie a spondylochirurgie, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Zita Chovancová, Ph.D. – Ústav imunologie a alergologie, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Barbora Jakubíčková – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno
Doc. MUDr. Andrea Janíková, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
†MUDr. Zlatava Jirsenská – Klinika dětských infekčních nemocí, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
PharmDr. Milan Juhás, Ph.D. – Farmakologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Andrea Jurečková – Oddělení klinické onkologie, Masarykův onkologický ústav, Brno
MUDr. Ladislav Kabelka, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Tomáš Kabut – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Bohdan Kadlec, Ph.D. – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Petr Kala, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Martin Kameník – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Kateřina Kaňková, Ph.D. – Ústav patologické fyziologie, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jan Kaňovský, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
†Doc. MUDr. Tomáš Kára, Ph.D. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Tomáš Kašpárek, Ph.D. – Psychiatrická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Bohuslav Kianička, Ph.D. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Igor Kiss, Ph.D., MBA – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Eva Klabusayová, DESAIC – Klinika dětské anesteziologie a resuscitace, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Jozef Klučka, Ph.D. – Klinika dětské anesteziologie a resuscitace, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Lumír Koc, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Vladimír Kojecký, Ph.D. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno a Interní klinika, Baťova nemocnice Zlín
MUDr. Jiří König – Oddělení ORL, Fakultní nemocnice Brno
Mgr. Jana Koptíková, Ph.D. – Institut biostatistiky a analýz, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Milan Kozák, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Milan Kratochvíl – Klinika dětské anesteziologie a resuscitace, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Lenka Krbková, CSc. – Klinika dětských infekčních nemocí, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Jan Krejčí, Ph.D. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Marta Krejčí, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Radek Kroupa, Ph.D. – Interní gastroenterologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Darja Krusová, Ph.D. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jan Křístek, Ph.D. – Klinika zobrazovacích metod, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Lubomír Křivan, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Karel Lábr, Ph.D. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Růžena Lábrová, Ph.D. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Radek Lakomý, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Jiří Litzman, CSc. – Ústav imunologie a alergologie, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Radka Lordick Obermannová, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Ondřej Ludka, Ph.D. – Všeobecná interní klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Adam Lukáč – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Miriam Malá, Ph.D. – Klinika dětských infekčních nemocí, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Jan Maláska, Ph.D., EDIC – Klinika dětské anesteziologie a resuscitace, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jan Maňoušek – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Miloslava Matýšková, CSc. – Oddělení klinické hematologie, Fakultní nemocnice Brno
MUDr. Zdeněk Merta, CSc. – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Matúš Mihalčin, Ph.D. – Klinika infekčních chorob, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jozef Michalka – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Marie Miklíková, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Peter Mikolášek – Klinika dětských infekčních nemocí, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Monika Mikolášková – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Luboš Minář, Ph.D. – Gynekologicko-porodnická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Zdeněk Monhart, Ph.D. – Interní oddělení, Nemocnice Znojmo, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Hana Moravcová – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Zuzana Mrkvová – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Václav Musil, Ph.D. – Klinika dětských infekčních nemocí, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
RNDr. Jan Mužík, Ph.D. – Institut biostatistiky a analýz, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jiří Navrátil, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Marta Nedbálková, Ph.D. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Svatopluk Nehyba, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
RNDr. Jana Nechvátalová, Ph.D. – Ústav imunologie a alergologie, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Petr Němec, Ph.D. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Pavel Nesrsta – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jan Novák, Ph.D. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Miroslav Novák, CSc. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Klára Nováková, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
†MUDr. Bronislava Novotná – Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
†MUDr. Ivo Novotný, CSc. – Interní gastroenterologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jan Novotný, Ph.D. – Oddělení klinické hematologie, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Tomáš Novotný, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Věra Olšovská, Ph.D. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně
MUDr. Jindřich Olšovský, Ph.D. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Tomáš Ondrúš, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Lenka Ostřížková – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Martin Pail, Ph.D. – I. neurologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Anna Panovská, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Mgr. Jiří Pařenica, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Martin Pavlík, Ph.D., DESA, EDIC – Ústav lékařské etiky, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Miroslav Penka, CSc. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Sáva Pešák – Ústav imunologie a alergologie, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jiří Petera – Klinika radiační onkologie, Masarykův onkologický ústav, Brno
MUDr. Natália Podstavková – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Tomáš Pokrivčák – Oddělení klinické onkologie, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Martin Poloczek – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Hana Poloczková, Ph.D. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Alexandr Poprach, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Petr Pospíšil, Ph.D. – Klinika radiační onkologie, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
Prof. RNDr. Šárka Pospíšilová, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Luděk Pour, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Denis Princ – Klinika radiační onkologie, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Leona Procházková, Ph.D. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Robert Prosecký, Ph.D. MPH – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Aleš Průcha – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Martin Radvan, Ph.D. – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Silvia Rajecká – Oddělení klinické hematologie, Fakultní nemocnice u sv. Anny v Brně
MUDr. Michal Rezek – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Radoslav Roman – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Gabriela Romanová, Ph.D. – Katedra laboratorních metod, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Zdeněk Řehák, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. RNDr. Michal Řiháček, Ph.D., EuSpLM – Katedra laboratorních metod, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Ing. Eva Řiháčková – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Igor Sas – Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Dagmar Seidlová, Ph.D. – Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Jana Skřičková, CSc. – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Tomáš Skutil – Interní gastroenterologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Ondřej Sláma, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Petr Smejkal, Ph.D. – Katedra laboratorních metod, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Svatava Snopková, Ph.D. – Klinika infekčních chorob, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Dorota Sobotová, CSc. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně
Prof. MUDr. Vladimír Soška, CSc. – Oddělení klinické biochemie, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Filip Souček, Ph.D. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Miroslav Souček, CSc. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Milan Sova, Ph.D. – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Michal Standara – Úsek radiologie, Masarykův onkologický ústav, Brno
Doc. MUDr. Michal Staník, Ph.D. – Klinika operační onkologie, Masarykův onkologický ústav, Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Karel Starý – Interní gastroenterologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jan Stašek – Ústav simulační medicíny, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Roman Stebel, Ph.D. – Klinika infekčních chorob, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Bronislav Stibor – Landesklinik Baden bei Wien/Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Otmar Stránský – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Petra Strnadová – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Ondřej Strýček, Ph.D. – I. neurologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Pavel Suk, Ph.D. – Anesteziologicko-resuscitační klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Erik Hasan Sukar – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Marek Svoboda, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jan Svojanovský, Ph.D. – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Ivo Šabacký – Urologie, Nemocnice Třebíč
MUDr. Martin Ščurek, Ph.D. – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Pavel Ševčík, CSc. – Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Ostrava, Lékařská fakulta, Ostravská univerzita, Ostrava
MUDr. Radim Šimůnek – OCHIR – lůžkové oddělení, Masarykův onkologický ústav, Brno
MUDr. Helena Šiprová – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Pavel Šlampa, CSc. – Klinika radiační onkologie, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Lenka Špinarová, Ph.D. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Monika Špinarová, MSc., Ph.D. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Vladimír Šrámek, Ph.D. – Anesteziologicko-resuscitační klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Nela Šťastná – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Soňa Štěpánková – Centrum kardiovaskulární a transplantační chirurgie, Brno
MUDr. Martin Štork, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Petr Štourač, Ph.D., MBA, FESAIC – Klinika dětské anesteziologie a resuscitace, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Filip Šustr – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Ondřej Toman, Ph.D., MHA – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Jiří Tomášek, Ph.D. – Klinika komplexní onkologické péče, Masarykův onkologický ústav, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Miroslav Tomíška, CSc. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Michaela Ťoukálková – Klinika dětské anesteziologie a resuscitace, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Karel Trnavský – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Štěpán Tuček, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Karola Ulbrychová – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Dalibor Valík, Ph.D., DABCC – Katedra laboratorních metod, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Jiří Vaníček, Ph.D. – Klinika zobrazovacích metod, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Anna Vašků, CSc. – Ústav patologické fyziologie, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Ondřej Venclíček – Klinika nemocí plicních a tuberkulózy, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Petr Vězda, Ph.D. – Hemodialyzační centrum Mendlovy nadace, INNEF, a.s., Brno
Prof. MUDr. Jiří Vítovec, CSc. – I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
Mgr. Marcela Vlková, Ph.D. – Ústav imunologie a alergologie, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Lenka Vojtilová, Ph.D. – Klinika infekčních chorob, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Kamil Vrbica – Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Mária Vyskočilová – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Petra Vysočanová – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Dana Weberová – Všeobecná interní klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. MUDr. Vít Weinberger, Ph.D. – Gynekologicko-porodnická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Barbora Weinbergerová, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Tomáš Zatočil – Interní kardiologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Vladimír Zbořil, CSc. – Interní gastroenterologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
Prof. RNDr. Lenka Zdražilová Dubská, Ph.D. – Ústav laboratorní medicíny, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Assadullah Zharfbin – II. interní klinika, Fakultní nemocnice u sv. Anny v Brně
MUDr. Mária Zvaríková – Oddělení klinické onkologie, Masarykův onkologický ústav, Brno
MUDr. Václav Zvoníček, Ph.D. – Ústav lékařské etiky, Lékařská fakulta, Masarykova univerzita, Brno
Doc. MUDr. Daniela Žáčková, Ph.D. – Interní hematologická a onkologická klinika, Fakultní nemocnice Brno, Lékařská fakulta, Masarykova univerzita, Brno
MUDr. Daniela Žáková – Kardiologická a kardiochirurgická ambulance, Centrum kardiovaskulární a transplantační chirurgie, Brno
Prof. MUDr. Jan Žaloudík, CSc. – Klinika operační onkologie, Masarykův onkologický ústav, Brno, Lékařská fakulta, Masarykova univerzita, Brno
2.2.20 Méně časté příčiny sekundární
Léčba hypertenze u osob ve vyšším věku
2.2.21.3 Obezita a metabolický syndrom
2.2.21.4 Hypertenze a diabetes
2.2.21.5 Hypertenze s přítomností ischemické choroby srdeční a srdečního selhání
2.2.21.7 Hypertenze a cerebrovaskulární onemocnění
2.2.21.8
2.5.1.5
srdeční frekvence
2.6.5
2.6.7 Léčba pacientů s akutní dekompenzací srdečního selhání a plicním
2.6.7.1
2.6.7.4 Nejdůležitější iontové dysbalance asociované se srdečním selháním ........................
2.6.7.5 Oxygenační a ventilační podpora u pacientů s akutním srdečním selháním
2.6.8.1 Echokardiografie, koronarografie, revaskularizace a pravostranná katetrizace
2.6.8.2
2.7.1.6
2.11.2.1
2.11.2.4
septa síní (ASD) a anomální návrat
traktu levé komory
2.11.2.5 Stenóza arteria pulmonalis (PS)
2.11.2.6 Transpozice
2.11.2.7
tepen (TGA)
2.11.2.8 Otevřená tepenná dučej (PDA)
2.11.2.9 Komplexní vady řešené jako jednokomorová (fontanovská) cirkulace
2.13.2.7
2.13.3.4
2.14.3
2.14.4
2.14.5
2.14.6
2.14.7
2.15.2
klasifikace plicní hypertenze
2.15.3.2 Elektrokardiografie, rentgen hrudníku, zhodnocení saturace krve kyslíkem
2.15.3.4 Funkční vyšetření plic, výpočetní tomografie hrudníku
2.15.3.5 Scintigrafie plic, CT angiografie plic a digitální subtrakční angiografie ..................
2.15.3.6 Pravostranná srdeční katetrizace
2.15.3.7 Další vyšetření používaná v diagnostice plicní hypertenze
2.15.3.8 Diagnostický algoritmus a organizace péče o nemocné s plicní hypertenzí v České republice
2.15.4 Plicní arteriální hypertenze (skupina 1 klinické klasifikace plicní hypertenze)
2.15.4.1 Epidemiologie a prognóza
Patofyziologie
2.15.4.3
2.15.4.4 Režimová opatření a podpůrná léčba plicní arteriální hypertenze ............................
2.15.4.5 Specifická vazodilatační léčba
2.15.5 Plicní hypertenze asociovaná s onemocněním levého srdce (skupina 2)
2.15.5.1
2.15.6 Plicní hypertenze asociovaná s onemocněním plic a/nebo s hypoxemií (skupina 3)
2.15.6.1 Poznámky k diagnostice
2.15.6.2 Léčba
2.15.7 Plicní hypertenze asociovaná s obstrukcemi plicní tepny (skupina 4) .......................................
2.15.7.1
Léčba
2.15.8 Plicní hypertenze z neznámých příčin a/nebo s multifaktoriálním mechanismem vzniku (skupina 5)
2.16 Angiologie
2.16.1 Tromboembolická nemoc se zaměřením na žilní trombózu
Úvod a terminologie
Epidemiologie a rizikové faktory tromboembolické nemoci
2.16.1.3 COVID-19 a tromboembolická nemoc
2.16.1.5 Instrumentální vyšetření
2.16.1.6 Diferenciální diagnostika
2.16.1.7 Léčba
2.16.2 Onemocnění aorty a velkých tepen
2.16.2.1 Aneurysmata
Záněty aorty a dalších tepen – vaskulitidy
2.16.3 Onemocnění periferních tepen ....................................................................................................
2.16.3.3 Diagnóza uzávěrových nemocí periferních tepen
2.16.3.4 Klinické vyšetření
2.16.3.5 Instrumentální vyšetřovací metody
2.16.3.6 Diferenciální diagnostika
2.16.6 Choroby žil a mízního systému
2.16.6.1 Chronické žilní onemocnění
2.16.6.2 Aneurysmata žil
2.16.6.3 Onemocnění lymfatického systému
2.17 Základy kardiovaskulární farmakoterapie
2.17.1 Blokátory systému renin-angiotenzin-aldosteron
Inhibitory angiotenzin konvertujícího enzymu (ACEI)
2.17.1.3 Blokátory receptoru 1 pro angiotenzin II (sartany, ARB)
2.17.1.4 Duální inhibitor receptoru 1 pro angiotenzin II a neprilysinu (ARNI)
Betablokátory
Rozdělení
2.17.11.4
2.17.12 Základní problematika lékových interakcí
2.17.12.1 Farmaceutické interakce
2.17.12.4 Problematika lékových interakcí ..............................................................................
2.18 Kardiovaskulární rehabilitace jako součást léčby srdečních chorob ..........................................................
2.18.1 Rehabilitační program u pacientů s ischemickou chorobou srdce
2.18.2 Nežádoucí události během řízené kardiovaskulární rehabilitace
2.18.3
pacientů se srdečním selháním
2.18.4 Alternativní formy řízené rehabilitace založené na digitální medicíně
2.18.5
2.18.6
pacientů s kardiostimulátorem
2.18.7 Pacient se srdečním onemocněním a diabetes mellitus
2.18.8
2.18.9 Závěry a klinická doporučení
2.19 Získané
2.19.8
2.19.9
2.19.10.1 Chlopenní náhrady a antikoagulační léčba
2.19.10.2 Profylaxe infekční endokarditidy
2.20 Kardiovaskulární onemocnění v období těhotenství
2.20.1 Fyziologické změny v těhotenství
2.20.2 Riziko kardiovaskulárních komplikací v těhotenství
Prekoncepční poradenství ...........................................................................................................
2.20.4 Načasování a způsob porodu ......................................................................................................
2.20.5 Tromboembolická onemocnění a antikoagulace v těhotenství
2.21 Kardioonkologie a mezioborová problematika
2.21.1 Kardioonkologie
2.21.1.1 Stanovení kardiovaskulárního rizika pro vznik kardiovaskulární toxicity před zahájením onkologické léčby
2.21.1.2 Diagnostický a monitorovací program před zahájením a v průběhu onkologické léčby .....................................................................................................
2.21.1.3 Monitorovací program po skončené léčbě ................................................................
2.21.1.4 Léčba a kardioprotekce
2.21.1.5 Kardiotoxicita a gravidita
2.21.1.6 Metabolický syndrom v kardioonkologii
2.21.2 Mezioborová problematika: srdce v kontextu ostatních orgánů
2.21.2.1 Srdce a mozek
2.21.2.2 Srdce a játra
2.21.2.3
2.21.2.4 Srdce a žlázy s vnitřní
2.21.2.5 Srdce jako endokrinní
2.21.3 Kardiovaskulární systém a gravidita (viz kap. 2.20)
2.21.3.1
2.21.3.4
změny v těhotenství
2.22 Spánková apnoe a kardiovaskulární onemocnění .......................................................................................
2.22.1 Spánková apnoe a její patofyziologické působení na rozvoj kardiovaskulárních onemocnění ..
2.22.2 Spánková apnoe a arytmie
2.22.3 Spánková apnoe a rozvoj srdečního selhání
3 Bronchopulmonální onemocnění .............................................................................................................................
3.1 Diagnostika onemocnění plic a průdušek
3.1.1 Anamnéza
3.1.2 Hlavní příznaky onemocnění plic a průdušek
3.1.2.1
3.1.2.3 Bolest na hrudi
3.1.3 Rodinná a sociální anamnéza
3.1.4 Farmakologická anamnéza
3.1.5 Pracovní anamnéza
3.1.7
3.1.8.1
3.2 Infekční onemocnění plic
3.2.1
3.2.3
3.2.3.1
3.2.3.3 Průběh tbc infekce
3.2.3.4 Patologicko-anatomický
3.2.4
3.3.3
3.3.4
3.3.2.1 Podle úrovně kontroly
3.3.2.2 Podle tíže
3.3.2.3
3.3.3.1
3.3.4.1
obstrukční plicní
3.4.1 Intersticiální plicní procesy,
3.6.3
3.7.2.2 Vysokoprůtoková oxygenoterapie nosní kanylou (high-flow nasal oxygenotherapy – HFNO)
4.1.3.2
4.1.3.3
4.1.3.4
4.1.3.6
4.2.1
Choroby jícnu
exokrinní funkce pankreatu
4.2.2.1 Anatomie a fyziologie jícnu
4.2.2.2 Funkční vyšetření poruch motility
4.2.2.3
4.2.2.4
4.2.2.5
4.2.2.7
4.2.2.8
4.2.2.10
4.2.3.1
4.2.4
4.2.4.3
4.2.4.6
4.2.5.1
kolitida
4.2.5.4 Mikroskopické kolitidy
4.3.1.3
4.3.1.6
4.3.1.11
4.3.1.12
4.3.1.19
5.1.1.3
5.1.2.1
vyšetření ledvin
5.1.2.2 Vyšetření koncentrační schopnosti ledvin .................................................................
5.1.2.3 Vyšetření zřeďovací schopnosti ledvin .....................................................................
5.1.2.4 Vyšetření acidifikační schopnosti ledvin
5.1.2.5 Vyšetřování tubulárního transportu látek pomocí frakčních exkrecí
5.1.3 Adaptace ledvin na chronické poškození
5.1.3.1
5.1.3.2 Tubulární adaptace
5.1.3.3 Důsledky trvalého snížení rychlosti glomerulární filtrace
5.1.4 Hlavní klinické příznaky při onemocněních ledvin a močových cest
5.1.4.1
5.2.2.1 Akutní glomerulonefritida
5.2.2.2 Rychle progredující glomerulonefritidy (RPGN)
5.2.2.3 Chronické glomerulopatie
5.2.3 Tubulointersticiální onemocnění ledvin
5.2.3.1 Akutní tubulointersticiální nefritida
5.2.3.2 Chronická tubulointersticiální nefritida ....................................................................
5.2.4 Infekce močových cest a pyelonefritida ....................................................................................
5.2.4.1 Nekomplikované infekce močových cest
5.2.4.2 Komplikované infekce močových cest
5.2.4.3 Infekce močových cest v graviditě
5.2.4.4 Tuberkulóza ledvin, parazitární onemocnění, mykotické infekce
5.2.4.5 Prevence infekce močových cest
5.2.5 Vaskulární onemocnění ledvin a systémové vaskulitidy
5.2.5.1 Vaskulární onemocnění ledvin (vaskulární nefropatie)
5.2.5.2 Systémové vaskulitidy ..............................................................................................
5.2.6 Akutní selhání ledvin
5.2.6.1 Prerenální typ akutního poškození ledvin
5.2.6.2 Renální typ akutního poškození ledvin
5.2.6.3 Postrenální typ akutního poškození ledvin
5.2.6.4 Nejčastější akutní poškození ledvin na interních odděleních a interních
5.2.6.5 Léčba akutního poškození ledvin obecně
5.2.6.6
5.2.7.1 Mechanismy progrese
5.2.7.2
5.3
5.4 Těhotenství u pacientek s chronickým onemocněním
5.4.1.2 Infekce močových cest
5.4.1.3 Akutní poškození ledvin
5.4.2 Těhotenství u preexistujícího chronického onemocnění ledvin
5.4.2.1 Primární glomerulonefritida
5.4.2.2 Polycystické onemocnění ledvin
5.4.2.3 Solitární ledvina
5.4.2.4 Diabetická nefropatie
5.4.2.5 Systémový lupus erythematodes
5.4.2.6 ANCA-asociované glomerulonefritidy .....................................................................
5.4.2.7
5.4.2.8
u dialyzovaných
po transplantaci ledviny
5.5 Ledviny a srdeční selhání – kardiorenální
5.7.2
5.9.1
5.9.2
5.9.3
5.10.1
5.10.2
5.9.2.1
5.9.2.2
dialyzační léčby
5.10.1.1 Difuze (prolínání)
5.10.1.2 Konvekce (splavování)
5.10.1.3 Adsorpce
léčení
5.10.2.1
5.10.2.2 Hemodialyzátory a
5.10.2.6
6.1.4.1
6.1.4.2 Význam markerů v průběhu léčby a sledování
6.1.4.3 Prognostický a prediktivní význam markerů
6.1.5 Systémové a paraneoplastické projevy maligních onemocnění
6.1.5.1 Úvod a definice problému
6.1.5.2 Patofyziologie systémových (paraneoplastických) projevů maligního onemocnění ..............................................................................................
6.1.5.3 Obecné příznaky (paraneoplastické) maligních chorob
6.1.5.4 Hematologické paraneoplastické projevy maligních chorob a angiopatie
s nádory
6.1.5.5 Paraneoplastické
6.1.5.6
6.1.5.7
6.1.5.8
6.1.5.9
6.1.6
6.1.7
paraneoplastické příznaky
6.1.5.10 Kloubní a
6.1.5.11
6.1.5.12 Kardiologické a oběhové projevy maligních nádorů
onkologických onemocnění
6.1.6.1 Definice pojmů a obecné informace o prevenci maligních chorob
6.1.6.2
vybraných nádorových onemocnění ve vztahu k vnitřnímu lékařství
6.1.7.1 Místo chirurgické léčby v řešení onkologických případů
6.1.7.2
6.1.7.3 Profylaktické operace předcházející
6.1.11.1
6.1.11.2
6.1.12.3
6.1.12.4
6.1.12.5
6.1.12.6
6.1.12.7
6.1.13.1
6.1.14
6.2.1.2
záření
6.2.2
6.2.3
6.2.4
6.2.5
6.2.6
6.2.3.1
6.2.3.2
6.2.5.3
6.2.5.4
6.2.5.5
6.2.6.2
6.2.6.4
6.2.7
6.2.8
6.2.9
6.3.1.1 Klasifikace myelodysplastického syndromu
6.3.1.2 Léčba – léčebná strategie
6.3.2 Akutní myeloidní leukemie včetně akutní promyelocytární leukemie
6.3.2.1 Akutní promyelocytární leukemie
6.3.3 Akutní lymfoblastická leukemie dospělých
6.3.4 Myeloproliferativní neoplazie Ph negativní
6.3.4.1 Pravá polycytemie
6.3.4.2 Esenciální trombocytemie ........................................................................................
6.3.4.3
6.3.6.2
6.3.7
6.3.8
6.3.8.1
6.3.8.4 NK/T-lymfomy
6.3.9 Chronická lymfocytární leukemie a další lymfoidní leukemie
6.3.9.1 Chronická lymfocytární leukemie
6.3.9.2 Vlasatobuněčná leukemie
6.3.9.3 Prolymfocytární leukemie
6.3.10.1 Monoklonální gamapatie nejasného významu (MGUS) .........................................
6.3.10.2 Mnohočetný myelom ................................................................................................
6.3.10.3 Waldenströmova makroglobulinemie
6.3.10.4 AL-amyloidóza (systémová a lokalizovaná)
6.3.10.5 Solitární plazmocytom kosti a solitární plazmocytom extraoseální
6.3.10.6 Monoklonální gamapatie klinického významu
6.3.10.7 Onemocnění z chladových aglutininů
6.3.10.8 Onemocnění z depozice lehkých řetězců imunoglobulinů
6.3.10.9 Onemocnění z depozice těžkých řetězců imunoglobulinů
6.3.10.10 Onemocnění těžkých řetězců ....................................................................................
6.3.10.11
6.3.11 Histiocytární nemoci
6.3.11.1
6.3.13 Vyšetření krevního obrazu a orgánů krvetvorby
6.3.13.1 Vyšetření krevního obrazu
6.3.13.2 Vyšetření nátěru periferní krve
6.3.14
6.3.15
6.3.15.1 Regulace buněčné homeostázy železa
6.3.15.5
6.3.16
6.3.17.4 Nedostatek folátu
6.3.18 Hemolytické anemie
6.3.18.1 Korpuskulární hemolytické anemie
6.3.18.2 Extrakorpuskulární hemolytické anemie
6.3.19
6.3.20
6.3.21
6.3.23
7.1 Přístup k pacientovi s revmatickým onemocněním
7.1.1 Definice oboru revmatologie
7.1.2 Klasifikace revmatických onemocnění
7.1.3 Vyšetření pacienta s revmatickým onemocněním
7.1.3.1 Anamnéza
7.1.3.2 Klinické vyšetření
7.1.3.3 Diferenciální diagnostika bolesti kloubu ..................................................................
7.1.3.4 Kloubní punkce a vyšetření kloubního výpotku
7.1.3.5 Laboratorní vyšetření v revmatologii
7.1.3.6 Zobrazovací vyšetření v revmatologii
7.2.3
7.2.3.1 Konvenční syntetické chorobu modifikující antirevmatické
7.2.3.2
7.10.3
8.1
8.3
8.3.7
8.4.1.1
8.4.1.6 Další dobře definované imunodeficity
8.4.2 Sekundární imunodeficience
8.4.2.1 Sekundární hypogamaglobulinemie
8.4.2.2
8.5.1 Alergická onemocnění – obecná část
8.5.1.1 Definice základních pojmů
8.5.1.2 Přehled základních alergenů
8.5.1.3 Patofyziologie alergické reakce
8.5.1.4 Diagnostika IgE zprostředkované alergické reakce
8.5.1.5 Epidemiologie alergických onemocnění ...................................................................
8.5.1.6 Genetika a epigenetika alergických chorob ..............................................................
8.5.1.7 Terapie alergických onemocnění
9.2
9.3.4
8.5.2.4
9.4 Poruchy
9.5
9.5.3
Subakutní de Quervainova tyreoiditida
9.3.4.3 Chronická lymfocytární tyreoiditida (chronická autoimunitní tyreoiditida)
Riedlova tyreoiditida
Funkční tyreopatie po amiodaronu
9.6 Poruchy gonád a reprodukčních orgánů
9.6.1 Poruchy varlat a mužských reprodukčních orgánů
9.6.1.1 Mužské hypogonadismy
9.6.1.2 Gynekomastie 817
9.6.2 Poruchy vaječníků a ženských reprodukčních
9.6.2.1 Ženské hypogonadismy ............................................................................................
9.6.2.2 Hyperfunkce ovarií ...................................................................................................
9.6.2.3 Klimakterium a menopauza 821
9.7 Endokrinní tumory trávicího traktu a pankreatu 822
9.7.1 Karcinoidní tumory a karcinoidní syndrom
9.7.2 Neuroendokrinní nádory pankreatu
9.7.2.1 Inzulinom
9.7.2.2 Gastrinom, Zollingerův– Ellisonův syndrom
9.8 Polyglandulární endokrinologické syndromy
9.9.6.2
9.9.6.4 Hypoglykemie a hypoglykemické kóma
9.9.7 Chronické komplikace diabetu
9.9.7.1 Specifické komplikace diabetu
9.9.7.2 Nespecifické komplikace diabetu .............................................................................
9.9.7.3 Diabetická noha ........................................................................................................
9.10 Jiná metabolická onemocnění
9.10.1 Porfyrie
9.10.1.1 Kongenitální erytropoetická porfyrie (CEP) (morbus Günther)
9.10.1.2 Erytropoetická protoporfyrie (EPP)
9.10.1.3 Hepatální porfyrie
9.10.2 Glykogenová střádací onemocnění
9.10.2.1 Glykogenózy
9.10.2.2 Lyzosomální střádací choroby ..................................................................................
Organické acidurie
9.10.3.3 Poruchy detoxikace amoniaku
9.10.4 Poruchy metabolismu železa
9.10.4.1 Hereditární hemochromatóza
9.10.4.2 Sekundární hemochromatózy
9.10.5 Poruchy metabolismu lipidů
Nejčastější geneticky podmíněné dyslipoproteinemie
9.10.5.2 Nejčastější příčiny sekundární dyslipoproteinemie ..................................................
9.10.6 Obezita
10.1 Akutní odezva organismu na poškození .....................................................................................................
10.1.4 Indukce sekundárních efektorů stresové reakce
Časový průběh stresové reakce
stresové reakce ............................................................................................................
10.2 Základy medicíny kritických stavů .............................................................................................................
10.2.1 Medicína založená na důkazech a doporučené postupy (guidelines)
léčba
Další doporučené postupy (se zaměřením
10.9.2.2 Inotropní podpora 926
10.9.2.3 Krátkodobé mechanické srdeční podpory v léčbě akutního srdečního selhání 926
10.9.2.4 Hemoeliminační metody v léčbě kardiogenního šoku a akutního srdečního selhání 927
10.10 Akutní plicní edém 927
10.11 Kardiovaskulární kolaps a srdeční zástava ................................................................................................ 928
10.12 Akutní stavy v neurologii ........................................................................................................................... 932
10.12.1 Porucha vědomí 932
10.12.1.1 Klasifikace poruch vědomí 932
10.12.1.2 Příčiny poruch vědomí 933
10.12.1.3 Zhodnocení závažnosti poruchy vědomí 933
10.12.2 Iniciální opatření při poruše vědomí a rozšířená diagnostika
10.12.3 Cévní onemocnění mozku
10.12.3.1 Ischemická cévní mozková příhoda (iCMP) 935 10.12.3.2 Hemoragická cévní mozková příhoda ......................................................................
10.12.4 Traumatické postižení centrálního nervového systému .............................................................
10.12.4.1 Kraniocerebrální poranění (KCP)
10.12.4.2 Klinické jednotky mozkových poranění
Akutní zánětlivá demyelinizační polyradikuloneuropatie (AIDP)
949 10.13.3.2 Základní předoperační vyšetření
10.13.3.3 Předoperační vyšetření pacientů s komplikujícím onemocněním 949
10.13.3.4 Platnost předoperačního vyšetření ............................................................................
10.13.3.5 Předoperační vyšetření u neodkladných výkonů ...................................................... 950 10.13.3.6 Stratifikace předoperačního rizika 950
10.13.4 Poučení pacienta a informovaný souhlas 950
10.13.5 Předoperační příprava pacienta 950
10.13.5.1 Optimalizace zdravotního stavu 950 10.13.5.2 Předoperační lačnění 951 10.13.5.3 Chronická medikace v perioperačním období 951
10.13.5.4 Antikoagulancia jako chronicky podávaná terapie v perioperačním období 952
Infekční onemocnění
11.1.3.15
11.1.4 Léčba a profylaxe virových infekcí
11.1.4.1 Antivirotika proti herpesvirovým infekcím
11.1.4.2 Antivirotika proti virům chřipky
Antivirotika proti virům hepatitid B, C, D a E .........................................................
11.1.4.5 Antivirotika proti lidskému viru imunodeficience –
11.1.5 Léčba systémových mykotických infekcí
Principy imunizace a použití vakcín
Aktivní imunizace .....................................................................................................
Pasivní imunizace
11.2 Infekce vyvolané grampozitivními bakteriemi
infekce
Spála (scarlatina)
Infekce vyvolané streptokoky některých jiných skupin
Stafylokokový syndrom toxického šoku (Toddův syndrom)
11.2.3.3 Infekce způsobené koaguláza-negativními stafylokoky
Difterie a jiné korynebacilární infekce
Alimentární intoxikace způsobené toxiny Staphylococcus aureus, Bacillus cereus a Clostridium perfringens A
Kolitida vyvolaná Clostridioides difficile
Plynatá gangréna a jiné klostridiové infekce ..............................................................................
Břišní tyfus
Shigelóza (bacilární úplavice, bacilární dysenterie)
Infekce vyvolané Chlamydia trachomatis
Infekce vyvolané Chlamydophilla pneumoniae
11.4.1 Infekce lidskými herpetickými viry
11.4.1.1 Onemocnění vyvolaná viry herpes simplex (herpesvirus hominis 1 a 2)
11.4.1.2 Infekce virem varicelly a zosteru
11.4.1.3 Infekce virem Epsteina–Barrové
11.4.1.4 Infekce cytomegalovirem
11.4.1.5 Šestá nemoc, exanthema subitum, roseola infantum (HHV6) ................................
11.4.1.6 Infekce sedmým lidským herpesvirem (HHV7) .....................................................
11.4.1.7 Infekce osmým lidským herpesvirem (HHV8)
11.4.2 Pátá nemoc (erythema infectiosum)
Infekce způsobené RNA viry
Příušnice (parotitis epidemica)
Spalničky (morbilli)
(poliomyelitis
Primární lymfom mozku
Wasting syndrom (syndrom chřadnutí)
Antiretrovirová terapie
Antiretrovirotika
11.6.5.2 Antiretrovirový režim
11.6.5.3 Simplifikace léčebných režimů ...............................................................................
11.6.5.4 Nežádoucí účinky antiretrovirové terapie ............................................................... 1039
11.6.6 Bezpečnostní pravidla při kontaktu s infekcí HIV
11.7 Virové hepatitidy
11.7.1 Virová hepatitida A
Virová hepatitida B
Virová hepatitida C
11.8.5.1 Viscerální leishmanióza
11.8.5.2 Postkala- azarová kožní leishmanióza
Viscerální leishmanióza u imunokompromitovaných
11.8.5.4 Kožní leishmanióza .................................................................................................
11.8.5.5 Mukokutánní leishmanióza .....................................................................................
11.8.6.1 Africká trypanosomóza (spavá nemoc)
11.8.6.2 Americká trypanosomóza (Chagasova nemoc)
11.9 Helmintózy
11.9.1 Nemoci vyvolané hlísticemi
11.9.1.2 Enterobióza (oxyurióza) .........................................................................................
11.9.1.3 Larvální toxokaróza (syndrom larva migrans visceralis) .......................................
11.9.3 Cestodózy
11.9.3.1 Tenióza prasečí a cysticerkóza
11.9.3.2 Tenióza hovězí (teniarynchóza)
11.9.3.3 Echinokokóza (hydatidóza)
11.10 Nejvýznamnější symptomy infekčních chorob
11.10.1 Diferenciální diagnostika gastroenteritid
11.10.2 Diferenciální diagnostika infekcí nervového systému ..............................................................
11.10.3 Diferenciální diagnostika exantémů
Infekce gramnegativními bakteriemi ......................................................................
11.13.2 Virové infekce u imunosuprimovaných pacientů .....................................................................
11.13.2.1 Infekce cytomegalovirem
11.13.3 Mykotické infekce u imunokompromitovaných pacientů
11.13.3.1 Pneumocystová pneumonie
11.13.3.2 Kandidóza
11.13.4 Parazitární infekce u imunokompromitovaných pacientů 1090 Literatura 1091
PŘÍLOHA Empirické využití antibiotik v klinické praxi v podmínkách České republiky 1092 12 Neurologická onemocnění .......................................................................................................................................
12.1.1 Onemocnění manifestující se typicky závratí 1099
12.1.1.1 Spontánní akutní vestibulární syndrom 1099
12.1.1.2 Epizodický (rekurentní) vestibulární syndrom 1099
12.1.1.3 Chronická závrať 1100
12.2 Záchvatovitá onemocnění
12.2.1 Epileptické záchvaty
12.2.2 Epilepsie ....................................................................................................................................
12.2.3 Další záchvatovité stavy ...........................................................................................................
12.3 Cerebrovaskulární onemocnění
12.3.1 Cévní mozkové příhody
12.3.1.1 Ischemické cévní mozkové příhody
12.3.1.2 Intracerebrální hemoragie
12.3.1.3 Subarachnoidální hemoragie
12.3.1.4 Cerebrální venózní trombóza
12.3.2 Vaskulární encefalopatie
12.3.2.1 Hypoxicko-ischemická encefalopatie .....................................................................
12.3.2.2 Hypertenzní encefalopatie
12.3.2.3 Chronické vaskulární encefalopatie
12.4 Autoimunitní onemocnění CNS
12.4.1 Demyelinizační onemocnění centrálního nervového systému
12.4.1.1 Roztroušená skleróza
12.4.1.2 Neuromyelitis optica a onemocnění jejího širšího spektra
12.4.1.3 Akutní diseminovaná encefalomyelitida (ADEM) 1120
12.4.2 Autoimunitní encefalitidy .........................................................................................................
12.4.3 Zánětlivá onemocnění asociovaná s postižením centrálního nervového systému ....................
12.4.3.1 Steroid-responzivní encefalopatie asociovaná s autoimunitní tyreoiditidou
12.4.3.2 Vaskulitidy centrálního nervového systému
12.4.3.3 Sjögrenův syndrom
12.4.3.4 Neurosarkoidóza
12.4.3.5 Nemoci spojené s glutenovou senzitivitou 1122
12.5 Neurodegenerativní onemocnění
12.5.1 Vybrané nozologické jednotky 1126
12.5.1.1 Alzheimerova nemoc (AN) .....................................................................................
12.5.1.2 Synukleinopatie: Parkinsonova nemoc, demence s Lewyho tělísky a multisystémová atrofie
12.5.1.3 Frontotemporální lobární degenerace (FTLD)
12.5.1.4 Huntingtonova nemoc (HN)
12.5.1.5 Friedreichova ataxie (FRDA) a spinocerebelární ataxie (SCA) 1130
12.5.1.6 Sporadická Creutzfeldtova–Jakobova nemoc (sCJD) 1130
12.6 Nervosvalová onemocnění a onemocnění motorického neuronu
12.6.1 Nervosvalová onemocnění
12.6.2 Onemocnění motoneuronu ........................................................................................................
12.6.6 Poruchy nervosvalového přenosu
12.6.7 Myopatie
12.6.7.1 EMG – základní vyšetření neuromuskulární neurologie 1136 12.7 Neuroonkologie
12.7.1 Klasifikace tumorů nervového systému 1137
12.7.2 Jednotlivé typy tumorů nervového systému .............................................................................
12.7.2.1 Intrakraniální tumory CNS a nádory mozku ........................................................... 1137
12.7.2.2 Syndrom nitrolební hypertenze 1137
12.7.2.3 Tumory páteřního kanálu a míchy 1138
12.7.2.4 Tumory periferních nervů
12.7.3 Paraneoplastický syndrom
12.7.4 Léčba neuroonkologických onemocnění
12.8 Bolesti hlavy
12.8.2
12.8.2.4 Idiopatická intrakraniální hypertenze
12.9.1
12.9.2
12.9.3 Radikulární a pseudoradikulární syndromy
12.9.5 Cervikální spondylogenní myelopatie
12.9.6 Spondylodiscitida
12.9.7 Axiální spondyloartritida
12.10 Metabolická onemocnění nervového systému ..........................................................................................
12.10.1.2 Deficit kobalaminu a folátu
12.10.1.3 Deficit pyridoxinu
12.10.2 Komplikace interních metabolických onemocnění
12.10.2.2 Komplikace jaterního selhání
12.10.2.3 Komplikace ledvinného selhání
Vyšetření před elektrokonvulzivní terapií
13.4 Duševní poruchy – přehled a stručná charakteristika ...............................................................................
13.4.1 Skupiny podle klasifikace MKN ...............................................................................................
13.4.2 Schizofrenie a příbuzné psychotické poruchy
13.4.3 Bipolární afektivní porucha
13.4.6 Obsedantně-kompulzivní porucha
13.4.7 Posttraumatická stresová porucha
13.4.8 Konverzní a disociativní poruchy
13.4.9 Poruchy osobnosti .....................................................................................................................
13.5 Léčba v psychiatrii ....................................................................................................................................
13.5.1 Psychofarmaka
13.5.2 Biologické metody léčby
13.5.3 Psychoterapie
14.1.9 Komplexní geriatrické hodnocení (CGA, comprehensive geriatric assessment)
14.2 Geriatrické syndromy
Inkontinence moči
Inkontinence stolice
14.2.6 Poruchy integrity kůže
14.2.6.1 Dekubity
14.2.7 Syndrom geriatrické deteriorace a paliativní péče
14.3 Léčba vybraných nemocí ve stáří ............................................................................................................
14.3.1 Arteriální hypertenze ve stáří ....................................................................................................
14.4.1.4 Hypoventilace ve spánku ........................................................................................
14.4.1.5 Cheyneovo–Stokesovo
14.4.2 Obstrukční spánková apnoe dospělého věku
14.4.3 Syndrom zvýšeného odporu v horních cestách dýchacích
14.4.4 Centrální spánková apnoe s Cheyneovým–Stokesovým dýcháním
14.4.5 Centrální spánková apnoe vyvolaná somatickou nemocí bez Cheyneova–Stokesova dýchání
14.4.6 Centrální spánková apnoe vyvolaná periodickým dýcháním ve vysoké nadmořské výšce 1199
14.4.7 CSA vyvolaná léčivem nebo chemickou látkou
14.4.8 Primární centrální spánková apnoe
14.4.9 Centrální spánková apnoe vyvolaná léčbou .............................................................................. 1201
14.4.9.1 Nemoci s hypoventilací vázanou na spánek 1202
14.4.10 Syndrom obezita–hypoventilace 1202
14.4.11 Kongenitální centrální syndrom alveolární hypoventilace
14.4.12 Centrální hypoventilace s hypotalamickou dysfunkcí s pozdním začátkem 1203
14.4.13 Idiopatická centrální alveolární hypoventilace 1203
14.4.14 Hypoventilace z léků a chemických látek vázaná na spánek 1204
14.4.15 Hypoventilace ze somatické nemoci vázaná na spánek 1205
14.4.16 Nemoci s hypoxemií vázanou na spánek ..................................................................................
14.4.17
15.1.5
14.4.17.1 Katatrenie (groaning)
14.4.17.2 Chrápání (ronchopatie)
15.1.6 Eliminace otravných látek z krevního kompartmentu
15.1.6.1 Forsírovaná diuréza
15.1.6.2 Hemoperfuze
15.1.6.3 Hemodialýza
15.1.6.4 Hemofiltrace
15.1.6.5 Peritoneální dialýza .................................................................................................
Otravy výrobky chemického průmyslu
15.2.1.1 Organofosfáty
15.2.1.2 Parakvat
15.2.1.3 Dikvat
15.2.1.4 Metylalkohol
15.2.1.5 Etylalkohol
15.2.1.6 Etylenglykol
Tetrachlormetan ......................................................................................................
15.2.1.8 Oxid uhelnatý ..........................................................................................................
16.2 Principy symptomatické léčby akutní a chronické bolesti
16.2.1 Symptomatická léčba akutní bolesti
16.2.2 Symptomatická léčba chronické bolesti
16.2.2.1 Léčebné modality v symptomatické léčbě chronické bolesti
16.3 Onkologická bolest a její léčba ................................................................................................................
16.3.1 Léčba nádorové bolesti .............................................................................................................
16.3.1.1 Protinádorová (kauzální) léčba
16.3.1.2 Radioterapie v léčbě nádorové bolesti 1265
16.3.1.3 Léky k ovlivnění kostní nádorové bolesti 1266
16.3.1.4 Symptomatická léčba bolesti 1266
16.3.1.5 Farmakoterapie nádorové bolesti 1266
16.3.1.6 Adjuvantní analgetika, koanalgetika 1268
16.3.1.7 Anesteziologické (invazivní) postupy v léčbě nádorové bolesti
1268
16.3.1.8 Periferní neurolytické blokády ................................................................................ 1268
16.3.1.9 Neurolytické blokády sympatiku ............................................................................ 1268
16.3.1.10 Intraspinální (neuroaxiální) analgezie 1268
16.3.1.11 Konopí pro léčebné použití (KLP) 1269
16.3.1.12 Neurochirurgické metody v léčbě nádorové bolesti 1269
16.4 Bolesti zad a krční páteře
16.4.1 Klinické syndromy v jednotlivých úsecích páteře 1270
16.4.1.1 Klinické syndromy v oblasti krční páteře 1270
16.4.1.2 Klinické syndromy v oblasti hrudní páteře 1271
16.4.1.3 Klinické syndromy v oblasti bederní páteře ........................................................... 1271
16.5 Bolesti na hrudi a bolesti břicha ...............................................................................................................
16.5.1 Bolesti na hrudi
16.5.1.1 Bolesti kardiálního původu
16.5.1.2 Bolesti plicního původu
16.5.1.3 Ostatní bolesti na hrudi
16.5.2 Bolesti břicha
16.6 Neuropatická bolest
16.6.1 Klasifikace, typy a patofyziologie neuropatické bolesti ..........................................................
16.6.2 Klinické bolestivé syndromy ....................................................................................................
16.6.2.1 Periferní neuropatické bolestivé syndromy
16.6.2.2 Centrální neuropatické bolestivé syndromy
16.6.3 Léčba neuropatické bolesti
16.6.3.1 Farmakologická léčba neuropatické bolesti
16.6.3.2 Nefarmakologické léčebné postupy
16.7 Bolesti dolních končetin
16.7.1 Vertebrogenní bolesti
16.7.2 Bolesti kloubního původu .........................................................................................................
16.7.3 Neuropatické bolesti .................................................................................................................
16.7.4 Komplexní regionální bolestivý syndrom
16.7.5 Ischemické bolesti
16.8 Invazivní metody v léčbě chronické bolesti
16.8.1 Základní dělení invazivních metod
16.8.1.1 Blokády reverzibilní a ireverzibilní
16.8.1.2 Blokády diagnostické, prognostické a terapeutické
16.8.1.3 Blokády jednorázové, opakované a kontinuální
16.8.2 Aplikované látky .......................................................................................................................
16.8.3 Nejužívanější invazivní techniky v léčbě chronické bolesti ....................................................
16.8.3.1 Infiltrace spouštěcího bodu (trigger point)
16.8.3.2 Intraartikulární aplikace
16.8.3.3 Epidurální aplikace kortikoidů 1282
16.8.3.4 Subarachnoidální kontinuální blokády
16.8.3.5 Periferní nervové blokády
16.8.3.6 Sympatikové blokády 1282
16.8.3.7 Neurolýza plexus coeliacus a splanchnických nervů
16.8.3.8 Neurolýza plexus hypogastricus ............................................................................. 1283
16.8.4 Radiofrekvenční léčba ..............................................................................................................
16.8.5 Neuromodulační metody
Výživa nemocných z pohledu vnitřního lékařství
17.1 Proteino- energetická malnutrice
17.1.1 Charakteristika a patofyziologie
17.1.2 Klinický význam PEM ..............................................................................................................
17.2 Diagnóza proteino- energetické malnutrice ...............................................................................................
17.2.1 Ztráta tělesné hmotnosti 1286
17.2.2 Aktuální tělesná hmotnost a index tělesné hmotnosti 1286
17.2.3 Antropometrická měření na paži
17.2.4 Odhad příjmu stravy
17.2.5 Laboratorní hodnocení bílkovin v séru
17.2.6 Vyšetření tělesného složení 1288
17.2.7 Hodnocení funkčního stavu 1288
17.2.8 Celkové hodnocení nutričního stavu .........................................................................................
17.2.9 Stanovení rizika podvýživy .......................................................................................................
17.3 Stanovení nutriční potřeby
Potřeba energie
17.3.2 Potřeba bílkovin a aminokyselin 1291
17.3.3 Potřeba minerálních látek ve výživě 1292
17.3.4 Potřeba mikronutrientů ve výživě 1292
17.4 Způsoby nutriční podpory
17.4.1 Úprava diety a dietní doplňky
17.4.1.1 Dietní rada ...............................................................................................................
17.4.1.2 Sipping ....................................................................................................................
17.4.2 Sondová enterální výživa
17.4.2.1 Sondové přístupy do trávicího traktu
17.4.2.2 Způsoby aplikace výživy sondou
17.4.2.3 Volba nutričního přípravku pro sondovou výživu 1298
17.4.2.4 Zásady podávání enterální výživy sondou
17.4.2.5 Tolerance a nežádoucí účinky sondové enterální výživy 1300
17.4.2.6 Monitorování efektu enterální výživy ..................................................................... 1300
17.4.3 Parenterální výživa ....................................................................................................................
17.4.3.1 Žilní přístup
17.4.3.2 Typy parenterální výživy
17.4.3.3 Základní komponenty parenterální výživy 1301
17.4.3.4 Podávání parenterální výživy 1303
17.4.3.5 Monitorování nemocného s parenterální výživou
17.4.3.6 Nežádoucí účinky a komplikace parenterální výživy
17.5 Zvláštnosti výživy u některých vybraných typů onemocnění
17.5.1 Výživa pacientů s onemocněním trávicího traktu .....................................................................
17.5.1.1 Nespecifické střevní záněty ....................................................................................
17.5.1.2 Akutní a chronická pankreatitida
17.5.1.3 Syndrom krátkého střeva
17.5.1.4 Terminální odvodná ileostomie
17.5.1.5 Střevní píštěle
17.5.2 Zásady výživy při onemocnění jater
17.5.3 Výživa pacientů se selháváním ledvin
17.5.4
Nutriční podpora při pokročilém nádorovém onemocnění
18.1.2 Monogenní nemoci 1320
18.1.2.1 Charakteristika autosomálně dominantní dědičnosti (AD) 1321
18.1.2.2 Charakteristika autosomálně recesivní dědičnosti (AR) 1321
18.1.2.3 Charakteristika X- vázané recesivní dědičnosti (XR) 1321
18.1.2.4 Charakteristika X- vázané dominantní dědičnosti (XD) 1322
18.1.2.5 Mitochondriální dědičnost 1322
18.1.3 Genetické poradenství 1322
18.1.4 Primární genetická prevence ..................................................................................................... 1322
18.1.5 Sekundární genetická prevence ................................................................................................. 1323
18.1.6 Onemocnění s komplexní dědičností (multifaktoriální, multigenní nemoci) 1323
18.1.7 Základní disciplíny pro studium genetické predispozice 1324
18.1.7.1 Strukturální genomika 1324
18.1.7.2 Funkční genomika 1324
18.1.7.3 Proteomika 1324
18.1.7.4 Farmakogenomika 1324
18.1.7.5 Nutrigenomika 1325
18.1.7.6 Metabolomika ........................................................................................................ 1325
18.1.7.7 Metalomika ............................................................................................................ 1325
18.1.8 Studium komplexních nemocí – genetické studie 1325
18.2 Genetika v interní medicíně – speciální část 1326
18.2.1 Genetické poradenství u onemocnění nervového systému 1326
18.2.1.1 Svalové dystrofie 1326
18.2.1.2 Kongenitální myopatie 1327
18.2.1.3 Myotonie 1327
18.2.1.4 Hyperpyrexie 1327
18.2.1.5 Spinální muskulární atrofie ..................................................................................... 1327
18.2.1.6 Hereditární motoricko-senzorická neuropatie ........................................................ 1328
18.2.1.7 Choroby centrálního nervového systému 1328
18.2.2
18.2.3
18.2.4
18.2.5
18.2.1.8 Vrozené vývojové vady centrální nervové soustavy 1329
18.2.1.9 Choroby mentálních funkcí 1330
Genetické poradenství u onemocnění kostí a pojivových tkání 1332
Genetické poradenství u nemocí kraniofaciální oblasti 1332
18.2.3.1 Poruchy dentice 1333
18.2.3.2 Rozštěpy rtu a patra ................................................................................................ 1333
Genetické poradenství u kožních chorob – genodermatózy ..................................................... 1333
Genetické poradenství u chorob kardiovaskulárního systému 1334
18.2.5.1 Vrozené srdeční vady 1334
18.2.5.2 Kardiomyopatie 1334
18.2.5.3 Poruchy srdečního rytmu 1334
18.2.5.4 Koronární srdeční choroby 1334
18.2.5.5 Cévní anomálie 1335
18.2.5.6 Hypertenze 1335
18.2.6 Genetické poradenství u nemocí plic ....................................................................................... 1335
18.2.6.1 Cystická fibróza ...................................................................................................... 1335
18.2.6.2 Asthma bronchiale a atopie 1335
18.2.7 Genetické poradenství u nemocí gastrointestinálního traktu 1336
18.2.7.1 Omfalokéla a gastroschíza 1336
18.2.7.2 Hereditární pankreatitida 1336
18.2.7.3 Zánětlivá onemocnění střevní 1336
18.2.7.4 Celiakie
18.2.7.5 Ulcus ventriculi 1337
18.2.7.6 Atrofická gastritida a perniciózní anemie ...............................................................
18.2.7.7 Hirschsprungova choroba ....................................................................................... 1337
18.2.7.8 Onemocnění jater 1337
18.2.8 Genetické poradenství u nemocí ledvin a močových cest 1338
18.2.8.1 Polycystické onemocnění ledvin 1338
18.2.8.2 Multicystická dysplazie ledvin 1338
18.2.8.3 Vývojové vady ledvin a močových cest 1338
18.2.8.4 Renální tumory 1339
18.2.9 Genetické poradenství u endokrinních chorob a poruch reprodukce 1339
18.2.9.1 Diabetes mellitus .................................................................................................... 1339
18.2.9.2 Kongenitální adrenální hyperplazie ........................................................................ 1340
18.2.9.3 Další endokrinopatie 1340
18.2.9.4 Hypogonadismus 1340
18.2.9.5 Sterilita a opakované reprodukční ztráty – reprodukční genetika 1341
18.2.9.6 Genetické poradenství u poruch reprodukce 1341
18.2.9.7 Opakované reprodukční ztráty 1342
18.2.10 Genetické poradenství u hematologických nemocí 1342
18.2.10.1 Poruchy krevních elementů 1342
18.2.10.2 Poruchy imunitního systému .................................................................................. 1342
18.2.10.3 Poruchy koagulace .................................................................................................. 1343
18.2.10.4 Vrozené trombofilní stavy 1343
18.2.10.5 Faktor V – Leiden (FVL) 1343
18.2.10.6 Varianta G20210A v genu pro FII 1343
18.2.11 Genetické poradenství v onkologii 1344
18.2.11.1 Hereditární nádorová onemocnění 1344
18.2.12 Environmentální rizika v lékařské genetice 1345
18.2.12.1 Vrozené infekce
18.3.3 Česká asociace pro vzácná onemocnění
18.3.4 Centrum provázení 1347
18.3.5
19.1.1 Vymezení cílové skupiny .........................................................................................................
19.1.2 Komunikační aspekty
19.1.3 Osoba blízká
19.1.4 Sdělování špatných zpráv
19.1.5 Psychologické aspekty paliativní péče 1352
19.1.6 Paliativní léčba nejčastějších tělesných symptomů 1353
19.2 Péče o pacienta v terminálním stavu, resp. umírajícího pacienta 1354
19.2.1 Příznaky a klinické projevy umírání ......................................................................................... 1354
19.2.2 Zmírnění tělesného diskomfortu umírajícího pacienta ............................................................. 1355
19.2.2.1 Nejčastější symptomy terminální fáze a jejich řešení 1355
na závěr
19.2.2.2 Paliativní analgosedace 1356
20.1 Multimorbidita ve vnitřním lékařství
20.4
20.5.2
20.6
Úvodní
Kardiovaskulární onemocnění
Vladimír Soška, Miroslav Souček, Filip Souček, Michal Řiháček, Filip Šustr, Tomáš Kára, Miroslav Novák, Růžena Lábrová, Petr Kala, Jan Kaňovský, Lubomír Elbl, Martin Hudec, Vojtěch Brázdil, Kateřina Helánová, Petr Fila, Tomáš Ondrúš, Marie Miklíková, Jan Stašek, Jiří Pařenica, Jan Krejčí, Lenka Špinarová, Jiří Vítovec, Július Godava, Karel Lábr, Hana Poloczková, Anna Chaloupka, Tomáš Honek, Monika Špinarová, Ondřej Toman, Lubomír Křivan, Milan Kozák, Tomáš Novotný, Irena Andršová, Martin Fiala, Tomáš Zatočil, Daniela Žáková, Lumír Koc, Tomáš Brychta, Hana Moravcová, Michal Rezek, Blanka Fischerová, Martin Radvan, Martin Kameník, Martin Poloczek, Jakub Hustý, Marián Felšöci, Svatopluk Nehyba, Ivo Hofírek, Jan Novák, Milan Juhás, Ladislav Baťalík, Jan Maňoušek, Petra Vysočanová, Eva Řiháčková, Mária Vyskočilová, Monika Mikolášková, Jiří Hlásenský
2.1 Ateroskleróza
▶ Definice
Vladimír Soška
Ateroskleróza je chronické zánětlivé onemocnění cévní stěny (především její intimy), jejíž struktura je alterována tvorbou ateromů. Po řadě let či desetiletí asymptomatického průběhu se onemocnění manifestuje ve formě aterosklerotických kardiovaskulárních onemocnění (ASKVO): nejčastěji ischemickou chorobou srdeční (ICHS), méně často ischemickou cévní mozkovou příhodou (CMP), ischemickou chorobou dolních končetin (ICHDK), dále aterosklerotickými pláty na karotidách, vzácněji komplikacemi v jiných lokalizacích (abdominální angina, u mužů poruchy erekce a další).
2.1.1 Patogeneze aterosklerózy, včetně rizikových faktorů
Ateroskleróza je multifaktoriální onemocnění, vzniká jako specifická reakce na nespecifické poškození cévní stěny. Za jediný kauzální faktor je v současné době považován cholesterol, především cholesterol nesený v LDL (low density lipoprotein): cholesterol je vždy základem aterosklerotického ložiska a postulát Aničkova z roku 1913, že „není aterosklerózy bez cholesterolu“, stále platí. Kromě zvýšeného cholesterolu existuje řada rizikových faktorů, které poškozují cévní endotel, navozují endoteliální dysfunkci a více či méně se podílí na iniciaci aterosklerózy, na rychlosti její progrese a na lokalizaci. Rozvoj a progresi aterosklerózy ale ovlivňují i fyzikální faktory, které rozhodují především o lokalizaci aterosklerotického ložiska (viz dále).
▶ Etiologie
Současná teorie vzniku aterosklerózy vychází z předpokladu, že základním krokem je diskrétní lokalizované poškození endotelu (endoteliální dysfunkce), kdy ještě není porušena jeho integrita, ale jsou alterovány jeho funkce. Endoteliální buňky mají zvýšený obrat a zvýšenou propustnost pro některé molekuly a vzniká nerovnováha mezi vazoaktivními
mechanismy (vazokonstrikční vs. vazodilatační) a hemokoagulačními působky (prokoagulační, protrombotické vs. antikoagulační, antitrombotické). Výsledkem je převaha vazokonstričních a protrombotických pochodů s aktivací zánětlivých a proliferačních dějů. Zvyšuje se adheze a agregace trombocytů se zvýšeným uvolňováním růstových a proliferačních faktorů. Lipoproteiny (především LDL) snáze pronikají poškozeným endotelem do subendoteliálních prostor a infiltrují cévní stěnu, v níž jsou oxidovány. Oxidované LDL a další chemotaktické faktory atrahují monocyty, které se transformují v makrofágy, jejichž aktivita je dále udržována především ingescí oxidovaných LDL. Aktivované makrofágy také produkují cytokiny a růstové faktory, které atrahují do intimy hladké svalové buňky: ty mohou syntetizovat kolagenní matrix a vytvářet fibrózní kryt plátu, jenž izoluje jeho trombogení lipidové jádro od cirkulující krve. Aktivované makrofágy naopak produkují enzymy degradující fibrózní kryt. Podle toho, které procesy převažují, je na jejich konci fibroateromová léze nebo ruptura či fisurace plátu s nasedající trombózou. Jsou-li výše uvedené procesy v cévní stěně aktivní, jde o chronický zánětlivý proces, který lze detekovat laboratorně mírným zvýšením CRP (C-reaktivní protein) v rozmezí asi 5–10 mg/litr.
Endoteliální dysfunkci navozuje kromě dyslipidemie řada faktorů, např. kouření, diabetes mellitus, hypertenze, uplatňují se např. i vlivy virů, bakterií, imunitních komplexů, toxinů a léčiv (cytostatika) nebo mechanické poškození endotelu. Navodit endoteliální dysfunkci a rozvoj aterosklerózy i při absenci jiných rizikových faktorů může sama o sobě vysoká koncentrace LDL-cholesterolu. Typickým příkladem je geneticky podmíněná familiární hypercholesterolemie, která je charakterizována velmi vysokou hladinou LDL-cholesterolu a která i bez přítomnosti dalších rizikových faktorů navozuje akcelerovanou aterosklerózu a rozvoj velmi časné ICHS.
▶ Rizikové faktory
Jedná se o faktory, které se podílejí na vzniku a průběhu aterosklerózy.
Rizikové faktory lze rozdělit podle možnosti jejich ovlivnění (modifikovatelné a nemodifikovatelné) nebo podle
jejich významu (hlavní a vedlejší). Hlavní rizikové faktory aterosklerózy jsou příčinou naprosté většiny případů manifestní aterosklerózy a aterosklerotických kardiovaskulárních onemocnění (ASKVO) (tab. 2.1).
Tab. 2.1 Hlavní rizikové faktory aterosklerózy
Modifikovatelné a hlavní rizikové faktory
hypercholesterolemie (především LDL‑cholesterol)
Nemodifikovatelné rizikové faktory
věk > 45 let muži, > 55 let ženy kouření mužské pohlaví hypertenze
diabetes mellitus obezita*
*Obezita někdy nebývá považována za samostatný rizikový faktor, protože je většinou sdružena s jinými hlavními (i vedlejšími) riziko vými faktory, jako je hypertenze, dyslipidemie, diabetes mellitus, obstrukční spánková apnoe…
LDL – low density lipoprotein
Eliminace těch modifikovatelných by dramaticky snížila mortalitu a morbiditu na ASKVO. Cholesterol je jediným kauzálním rizikovým faktorem, ostatní proces aterosklerózy urychlují. Co se týče cholesterolu, je to cholesterol obsazený v lipoproteinech, jež nesou na svém povrchu apolipoprotein B (z nich nejvýznamnější jsou lipoproteiny o nízké denzitě = LDL). Obezita se uplatňuje především prostřednictvím ostatních rizikových faktorů. Nemodifikovatelné hlavní rizikové faktory jsou věk a mužské pohlaví. Dále existuje celá řada tzv. modifikátorů rizika – přídatných rizikových faktorů a klinických situací, které mohou riziko aterosklerózy zvyšovat (tab. 2.2). Snaha o jejich identifikaci u osob, které mají přítomen jeden nebo více hlavních rizikových faktorů, ale nemá zásadní význam.
2.1.1.1 Hypercholesterolemie
Základním kauzálním rizikovým faktorem je zvýšená hladina LDL-cholesterolu (LDL-C). Snížení jeho koncentrace o 1 mmol/l vede k zásadní redukci ASKVO (obr. 2.1). Zvýšená hladina dalších aterogenních lipoproteinů (VLDL –very low density lipoproteins, IDL – intermediate density lipoproteins, zbytky chylomiker) bohatých na triglyceridy i cholesterol se projevuje mírným až středním zvýšením koncentrace triglyceridů v rozmezí asi 1,7–10,0 mmol/l. Markerem přítomnosti všech aterogenních lipoproteinů v krvi je zvýšená hladina apolipoproteinu B-100. Velmi vysoké triglyceridy > 10 mmol/l nejsou rizikem pro aterosklerózu, nýbrž pro akutní pankreatitidu. Riziko ASKVO zvyšuje také snížení HDL (high density lipoprotein) cholesterolu pod 1,0 mmol/l u mužů a pod 1,2 mmol/l u žen (HDL zajišťují eflux cholesterolu z endotelu a periferních tkání zpět do jater, chrání LDL před oxidací, stimulují syntázu NO, tlumí zánětlivou reakce v cévní stěně a adhezi monocytů).
Samostatným atypickým lipidovým rizikovým faktorem je zvýšený lipoprotein(a), který sestává z částice LDL s navázaným řetězcem bílkoviny apolipoproteinu(a). Jeho hladina je determinována z více než 90 % geneticky a není ovlivnitelná stávajícími hypolipidemiky (s výjimkou inhibitorů PCSK9 [proprotein konvertáza subtilisin/kexin typu 9], které snižují Lp(a) o asi 30 %). Jeho zvýšená koncentrace nad 125 nmol/l (resp. nad 50 mg/dl) je považována za nezávislý rizikový faktor ASKVO a jeho velmi vysoká koncentrace > 430 nmol/l (resp. 180 mg/dl) pacienta automaticky řadí do kategorie vysokého rizika ASKVO i v situaci, že nemá žádné další rizikové faktory.
2.1.1.2 Hypertenze
Hypertenze zvyšuje riziko aterosklerotických komplikací ve většině lokalizací – koronárních a cerebrovaskulárních arterií, dále tepen dolních končetin a ledvin. Způsobuje
Tab. 2.2 Aditivní rizikové faktory a klinické situace zvyšující riziko aterosklerózy a komplikací kardiovaskulárních onemoc nění (ASKVO)
Potenciální modifikátory rizika
Klinické situace psychosociální faktory (psychosociální stres) chronické renální onemocnění etnicita (obyvatelé jižní Asie) fibrilace síní, srdeční selhání kalcifikace v koronárních arteriích nádorová onemocnění fragilita pacienta (zvyšuje se s věkem) chronická obstrukční plicní nemoc rodinná anamnéza předčasných ASKVO* obstrukční spánková apnoe expozice vnějšímu prostředí (znečištění ovzduší a půdy a nadlimitní hladiny hluku)
chronická zánětlivá onemocnění (revmatoidní artritida, psoriáza, ankylozující spondylitida, zánětlivé onemocnění střeva…)
nízký sociálně‑ekonomický status infekce (HIV, periodontitida, chřipka) genetické faktory mentální onemocnění (úzkostné poruchy, poruchy nálady, poruchy osobnosti, psychotické poruchy…) preeklampsie, syndrom polycystických ovarií, předčasná menopauza, erektilní dysfunkce…
*Předčasná ICHS je definována jako výskyt ICHS u prvostupňových příbuzných (sourozenci, rodiče), u mužů do 55 let věku, u žen do 65 let věku. HIV – human immunodeficiency virus (virus lidské imunitní nedostatečnosti)
–21 %
–24 %
–24 %
–21 %
–15 %
–13 %
–20 %
studií
všechny cévní příhody
koronární příhody
koronární revaskularizace
CMP (všechny)
ischemická CMP
kryptogenní CMP –12 %
úmrtí na KVO
úmrtí na ICHS –8 %
ostatní KVO úmrtí
Obr. 2.1 Vliv snížení LDL‑cholesterolu na cévní příhody podle CTT metaanalýzy (upraveno podle CTT Collaborators, Lancet 2021; 380: 581)
mechanické poškození endotelu tepen, je porušena endotelium-dependentní relaxace a redukovaná odezva na acetylcholin. Hypertenze indukuje v cévní stěně oxidační stres. Významnou roli hraje i osa renin-angiotenzin-aldosteron, při její zvýšené aktivitě klesá syntéza NO. Endotel poškozuje i angiotenzin II, který způsobuje vazokonstrikci, zvyšuje propustnost endotelu a stimuluje proliferaci vaziva. Při hypertenzi dochází i ke zvýšené expresi cytoadhezivních molekul a ke zvýšené permeabilitě endotelu.
2.1.1.3 Kouření, včetně pasivního
Kouření je jedním z nejvýznamnějších rizikových faktorů, které akcelerují proces aterosklerózy. Ve srovnání s nekuřáky je u kuřáků jedné krabičky/den zvýšeno riziko ICHS asi 3–5krát a riziko náhlého úmrtí asi o 70 %. Kouření zvyšuje riziko aterosklerotických ASKVO ve všech lokalizacích a je hlavním rizikovým faktorem pro rozvoj ICHDK. Kouření zvyšuje LDL-cholesterol a snižuje HDL-cholesterol, zvyšuje riziko náhlé smrti. Předpokládá se přímý toxický vliv zplodin cigaretového kouře na cévní endotel s tvorbou superoxidového radikálu. U kuřáků nedochází k adekvátní dilataci koronárních cév při fyzické aktivitě, zvýšený oxidační stres zvyšuje oxidaci LDL, dále se zvyšuje hemodynamický stres (tachykardie, přechodný vzestup krevního tlaku [TK]), koagulační pohotovost, arytmogenní pohotovost). Kompenzačně k relativní hypoxii (CO redukuje kapacitu hemoglobinu [Hb] pro kyslík) se vyvíjí polycytemie, zvyšující viskozitu krve, a tím riziko trombotické příhody.
2.1.1.4 Diabetes mellitus, inzulinová rezistence, hyperinzulinemie
Rizikovými faktory jsou diabetes mellitus 1. typu, 2. typu i prediabetes, riziko ASKVO zvyšují asi dvojnásobně. Diabetická makroangiopatie postihuje všechny predilekční lokalizace aterosklerózy: arterie koronární, cerebrální i dolních
končetin. Riziko ICHS je u diabetiků 2–4krát vyšší než u nediabetické populace (obr. 2.1). CMP jsou u diabetiků asi 3krát častější, 80 % diabetiků umírá na komplikace plynoucí z aterosklerózy. Diabetici mají zhoršené přežívání po revaskularizačních zákrocích. Vysoké riziko diabetiků je dáno i tím, že s diabetem bývá sdružena hypertenze, dyslipidemie a obezita. Hyperglykemie zvyšuje glykaci proteinů, včetně lipoproteinů LDL, které pak snáze podléhají oxidační modifikaci. Je zvýšená produkce vazokonstrikčních prostaglandinů a narušena endotel-dependentní i independentní vazodilatace.
2.1.1.5 Obezita centrálního typu
S rostoucím BMI (body mass index) se zvyšuje jak mortalita z kardiovaskulárních příčin, tak i celková mortalita. Vzestup mortality je dán především vzestupem ICHS a CMP, ale také nádorových onemocnění a rozvojem diabetu a dyslipidemie. Nejnižší mortalita ze všech příčin je při BMI 20–25 kg/m2. Obezita akceleruje aterosklerózu více u osob do 50 let věku než ve vyšším věku. Riziko zvyšuje především nahromadění intraabdominálního tuku v oblasti pasu. Zvýšený obvod pasu (> 102 cm u mužů a > 88 cm u žen) i BMI jsou kontinuálně asociovány s rizikem ASKVO a diabetu.
Některé aditivní rizikové faktory (modifikátory rizika) a klinické situace zvyšující riziko aterosklerózy
Těchto modifikátorů rizika je řada a není cílem textu této kapitoly se všemi podrobně zabývat. Některé z nich jsou uvedeny v tabulce 2.2. Dříve se k nim řadil také např. zvýšený CRP nebo homocystein. Mírně zvýšená hladina CRP (asi 3–10 mg/l) předpovídá riziko ICHS a také CMP. Je důsledkem aktivace zánětlivých procesů (i v cévní stěně) a není kauzálním rizikovým faktorem, ale indikátorem zánětu. Individuální hodnocení lehkého zvýšení CRP je však velmi problematické, protože jeho koncentraci zvyšuje jakýkoliv jiný zánětlivý proces v organismu bez vztahu
k ateroskleróze. Jeho vyšetřování v detekci aterosklerózy proto není doporučeno. Obdobně již není doporučeno vyšetřovat hladinu homocysteinu, který byl dříve považován za rizikový faktor. Klinické studie prokázaly, že jeho snížení (podáváním kyseliny listové a vitaminů B) neovlivní výskyt ASKVO. Navíc jeho hladinu druhotně zvyšují také některé klasické rizikové faktory, jako kouření, hypertenze, diabetes mellitus. Význam HDL-cholesterolu (HDL-C) jako rizikového faktoru je přehodnocován: jeho snížení může riziko zvyšovat, ale není již považován za nezávislý rizikový faktor. Jeho zvýšená hladina riziko ASKVO nemusí snižovat, někdy ho může naopak zvyšovat.
▶ Rizikové faktory ve vztahu k lokalizaci aterosklerózy
ICHS: riziko zvyšují všechny hlavní rizikové faktory včetně vysoké koncentrace lipoproteinu(a), a to s různou predikční silou.
ICHDK: hlavními rizikovými faktory jsou kouření a diabetes mellitus. Vztah mezi zvýšenou koncentrací LDL-C a rizikem ICHDK je slabý. Na riziku rozvoje ICHDK se může dále podílet hypertenze, nízký HDL-C, hypertriglyceridemie.
Ischemické CMP: riziko navyšuje především hypertenze, fibrilace síní a kouření, teprve poté následuje LDL-C a diabetes mellitus.
O významu jednotlivých rizikových faktorů vzhledem k různým lokalizacím aterosklerózy svědčí i metaanalýzy klinických studií se statiny: snížení LDL-C o 1 mmol/l sníží riziko koronární příhody a revaskularizace o téměř 25 %, cévní mozkové příhody jen o 15 % a snížení výskytu ICHDK není vůbec uváděno.
▶ Fyzikální faktory v rozvoji aterosklerózy
Zvýšená hladina LDL-C ani přítomnost dalších rizikových faktorů nevysvětlují, proč bývá aterosklerózou postiženo pouze několik metrů délky arterií, ačkoliv vlivu rizikových faktorů je vystaveno několik kilometrů cév. Cholesterol neakumuluje v celé délce tepenného řečiště a ateroskleróza nepostihuje difuzně všechny arterie, ale především predilekční místa. V koronárním řečišti jimi jsou hlavní kmeny arterií, zejména segmenty blízko větvení koronárních cév, epikardiální segmenty arterií (v intramurálních částech je ateroskleróza vzácná). V aortě jsou predilekčními místy oblouk aorty, horní okraj Valsalvových sinů, ductus arteriosus a místa odstupu velkých krčních arterií, bifurkace břišní aorty. U femorální, tibiální a popliteální arterie jsou predilekčními místy větvení arterií. Vysoký výskyt ložisek na tepnách dolních končetin kontrastuje s jejich zcela vzácným výskytem na horních končetinách. U karotid je typické okrskovité postižení, nejdříve v karotidách na úrovni mozkové báze, v bazilárních a vertebrálních arteriích.
Predilekční místa lokalizace aterosklerózy jsou zřejmě výsledkem působení fyzikálních faktorů: faktory tlakové a hemodynamické, shear stress, změny v charakteru proudění krve a další. Fyziologickou adaptací na některé fyzikální podněty (krevní tlak, pulzová vlna, rychlost proudění krve) může být difuzní nebo excentrické zesílení intimy se zmnožením buněk hladké svaloviny. To je nejčastěji lokalizované v místě bifurkace arterií, je pozorováno hlavně v karotidách, koronárních, cerebrálních a renálních arteriích (obr. 2.2). A právě v těchto místech adaptivního zesílení
Obr. 2.2 Excentrické zesílení intimy v místech větvení arterií, kde se většinou vyvíjejí aterosklerotické léze
intimy se často vyvíjí z tukových proužků aterosklerotické léze.
Shear stress (střihový stres) je síla způsobená pulzovou vlnou, která působí na endotel kolmo ke směru toku krve. Má přerušovaný charakter v souladu s pulzovou vlnou a je jedním z hlavních stimulů pro syntézu oxidu dusnatého (NO) v endoteliálních buňkách. Zvýšená syntéza NO vede k relaxaci cévní stěny, která se tím přizpůsobí objemu protékané krve. Plynulá pulzová vlna je ale přerušována v místech větvení arterií, takže v těchto místech klesá shear stress i syntéza NO.
Komprese arterií: při systole jsou intramurální části koronárních arterií komprimovány a krev je vytlačena do epikardiálních částí arterií. Kontakt LDL a monocytů s cévním endotelem je tak v intramurálních arteriích omezen a to může být příčinou absence aterosklerózy v této oblasti koronárních arterií.
Proudění krve: vstup LDL a monocytů do cévní stěny je zprostředkován difuzí i aktivním transportem a rychlost vstupu závisí na řadě fyzikálních faktorů:
Charakter proudění krve: laminární proudění, které je v cévách bez větvení, je narušeno v místech ohybu cév, a především v místech jejich větvení (charakteru Y nebo T). V těchto místech separace toku krve vznikají víry se zvýšenou rychlostí krve, krev částečně recirkuluje, naráží na zevní okraje stěny arterie a mechanicky ji poškozuje (obr. 2.3). Lipoproteiny LDL a monocyty jsou zde v delším kontaktu s cévní stěnou a snadněji do ní vstupují.
Rychlost proudění krve: při lineárním proudění je největší v centru cévy a směrem k jejímu okraji se tok krve zpomaluje. Těsně u povrchu endotelu je tzv. přechodná hraniční vrstva kapaliny, tvořená pouze plazmou, která je tím silnější, čím rychlejší je tok krve. Čím silnější je tato přechodná vrstva, tím snáze z ní přecházejí LDL do endotelu.
Povrchová adhezní energie lipoproteinů: k přestupu LDL z plazmy do endotelu je nutná určitá povrchová adhezní energie. Ta je vyšší v místech laminárního proudění, snížená je v místech větvení arterií, v nichž vznikají víry a recirkulace krve. Zde vstupují LDL snadněji do endotelu.
Výše uvedené děje se týkají pouze arterií. V kapilárách a žílách je rozvoj aterosklerózy zásadně redukován z důvodu absence výše uvedených dějů a také proto, že v důsledku pomalého proudu krve zde chybí přechodná hraniční vrstva plazmy. excentrické zesílení intimy krevní proud
směr toku krve
Obr. 2.3 Separace toku krve se vznikem vírů v místech větvení typu Y
2.1.2 Aterosklerotický plát
Aterosklerotický plát je tvořen cholesterolovým jádrem, pokrytým směrem k cévnímu lumen fibrózním krytem. Fibrózní kryt obsahuje mimo jiné hladké svalové buňky a zánětlivé buňky, především makrofágy. Typický zralý aterosklerotický plát se sestává z měkkého jádra bohatého na lipidy a z tvrdé, kolagenem bohaté sklerotické tkáně, která odděluje lipidové jádro od endoteliálních buněk. Obě složky mají u různých plátů různé zastoupení.
2.1.2.1 Stabilní a nestabilní aterosklerotický plát
Stabilní plát: obsahuje větší množství hladkých svalových buněk a velké množství kolagenu ve fibrózní čepičce plátu, malé lipidové jádro a malé množství zánětlivých buněk. Fibrózní čepička (kryt) je poměrně silná a neporušená,
je tvořena kolagenními a elastickými vlákny a hladkou svalovinou, povrch je tuhý (obr. 2.4). Stabilní pláty bývají pláty starší, jsou často hemodynamicky významné a mohou se manifestovat stabilní anginou pectoris. Většinou neohrožují pacienta akutní koronární příhodou: pouze asi 14 % koronárních příhod je způsobeno lézí, která obturuje > 70 % průsvitu arterie.
Vulnerabilní plát: většina akutních koronárních příhod má příčinu v trombóze, která nasedá na hemodynamicky nevýznamný plát, jenž má slabý fibrózní kryt a u kterého může dojít k obnažení subendoteliálních prostor, a tím ke spuštění koagulační kaskády. Tento typ plátu bývá měkký, mívá velké lipidové polotekuté jádro, obsahuje velké množství zánětlivých buněk, tenký fibrózní kryt s malým množstvím kolagenu a málo hladkých svalových buněk (obr. 2.5). Vulnerabilní pláty jsou zodpovědné za většinu akutních koronárních syndromů, bývají často hemodynamicky nevýznamné a jen málo patrné při angiografickém vyšetření.
tenká brózní čepička lipidové jádro
Obr. 2.5 Nestabilní aterosklerotický plát
cholesterolové jádro
silná brózní čepička, bohatá na hladké svalové buňky
Obr. 2.4 Stabilní aterosklerotický plát
2.1.2.2 Aterosklerotický plát a remodelace cévní stěny
Klasická představa rozvoje aterosklerózy předpokládala, že s růstem aterosklerotického plátu se postupně zužuje cévní lumen (obr. 2.6). Je ale prokázáno, že v průběhu rozvoje aterosklerózy dochází velmi často k remodelaci cévní stěny s kompenzatorním rozšířením tepny, takže ani větší aterosklerotická léze nemusí zúžit její průsvit. K prominenci plátu do lumina cévy a k obliteraci dochází často až v pokročilých stadiích vývoje plátu (obr. 2.7). Vyšetření pomocí intravaskulární ultrasonografie ukázalo, že u většiny případů koronární aterosklerózy nedochází k zúžení průsvitu a že patologický angiogram diagnostikuje pouze 1–5 % případů aterosklerózy.
2.1.2.3 Kalcifikace aterosklerotického plátu
Kalciová depozita jsou charakteristická pro pokročilou aterosklerotickou lézi (typ IV až VI). Kvantifikace depozit kalcia v koronárních cévách pomocí ultrarychlé výpočetní tomografie ukázala, že přítomnost kalcifikací signifikantně zvyšuje riziko koronární příhody a osoby s vysokým kalciovým skóre mají až 6krát vyšší riziko koronární příhody než osoby bez kalcifikací.
2.1.3 Prevence a léčba aterosklerózy
▶ Prevence aterosklerózy
Prevence aterosklerózy spočívá v důsledném uplatnění všech zásad zdravého životního stylu již od dětského věku. Zásadní vliv na rozvoj aterosklerózy ale mohou mít i faktory genetické. Typickým příkladem je familiární hypercholesterolemie, která (není-li včas diagnostikována a léčena) vede k velmi časné ICHS i bez přítomnosti jakéhokoliv dalšího rizikového faktoru. U těchto pacientů je prevencí celoživotní agresivní terapie hypolipidemiky.
▶ Léčba (modifikace průběhu) aterosklerózy Prvním krokem jsou postupy ke stabilizaci aterosklerotického (AS) plátu, druhým krokem je pokusit se navodit regresi AS. Podmínkou stabilizace plátu je eliminace hlavních modifikovatelných rizikových faktorů: razantní snížení LDL-cholesterolu, nekouření, úprava krevního tlaku a kompenzace diabetu. Hypolipidemika (statiny, inhibitory PCSK9, inklisiran) stabilizují plát především prostřednictvím snížení koncentrace aterogenních lipoproteinů; přímý účinek hypolipidemik na cévní endotel (tzv. pleiotropní účinky) je spíše podružný. Podmínkou pro navození regrese AS plátu je razantní snížení LDL-cholesterolu pod 1,4 mmol/l nebo lépe pod 1,0 mmol/l. Platí pravidlo „čím níže, tím lépe“.
▶ Modifikace jednotlivých rizikových faktorů Podrobně je léčba jednotlivých rizikových faktorů rozebrána v příslušných kapitolách této učebnice. Léčba hypertenze snižuje riziko ASKVO bez ohledu na věk a snižuje především riziko CMP, dále pak ICHS a srdečního selhání. Dobrá kompenzace diabetu (viz kap. 9.9, 9.10) snižuje výskyt diabetické makroangiopatie i mikroangiopatie. Zanecháním kouření se snižuje riziko náhlé smrti na ASKVO na úroveň nekuřáků asi během jednoho roku. V riziku ICHS se po asi dvou letech nekuřáctví dostává bývalý kuřák na úroveň nekuřáka. Léčba dyslipidemií je popsána v kapitole 9.10.5. Snížení koncentrace LDL-cholesterolu o 1 mmol/l snižuje výskyt všech AS KV příhod, především ale příhod koronárních. Zvýšení HDL-cholesterolu není cílem farmakoterapie, protože jeho zvýšení farmaky nepřineslo v klinických studiích žádný benefit. Doporučit lze pouze postupy nefarmakologické, které (kromě jiných přínosů) mohou jako „bonus“ HDL-cholesterol zvyšovat: zanechání kouření, pravidelná fyzická aktivita. Fyzická aktivita má řadu pozitiv, včetně snížení rizika ICHS. U nemocných s ICHS, kteří po hospitalizaci začnou s pravidelnou fyzickou aktivitou, dochází k poklesu kardiovaskulární i celkové mortality ve srovnání s těmi, kteří nezměnili svůj životní styl. Statisticky významný rozdíl je patrný po 1–3 letech.
Obr. 2.6 Progrese aterosklerózy s postupnou okluzí cévního lumen
Obr. 2.7 Progrese aterosklerózy s remodelací cévní stěny
Závěr
Ateroskleróza je multifaktoriální onemocnění, klíčovým kauzálním rizikovým faktorem je zvýšený LDL-cholesterol. Rychlost progrese aterosklerózy modifikují další hlavní rizikové faktory: kouření, hypertenze, diabetes mellitus, nově i vysoký lipoprotein(a). Naprostá většina případů aterosklerózy je způsobena spolupůsobením uvedených hlavních rizikových faktorů. Prevence ASKVO spočívá v kombinaci přístupu nefarmakologického (zdravý životní styl) s farmakoterapií cílenou na konkrétní rizikové faktory. Klíčové je snižování LDL-cholesterolu jako kauzálního rizikového faktoru.
2.2 Arteriální hypertenze
Miroslav Souček, Filip Souček, Michal Řiháček, Filip Šustr
2.2.1 Definice, prevalence a klasifikace
Jako arteriální hypertenzi označujeme opakované zvýšení krevního tlaku (TK) ≥ 140/90 mmHg, naměřené minimálně při dvou různých návštěvách. V dospělé populaci průmyslově vyspělých zemí má hypertenze velmi vysokou prevalenci (20–50 %) a představuje závažný zdravotní problém. Prevalence v ČR ve věku 25–64 let se pohybuje kolem 50 % u mužů a 34 % u žen se zřetelným nárůstem ve vyšších věkových skupinách. V roce 2021 bylo v České republice léčeno pro hypertenzi 1,9 milionu osob, což je 17,7 % populace. Kolem tří čtvrtin hypertoniků o své nemoci ví. Úspěšná kontrola hypertenze, tj. dosažení cílového TK, se daří u 30–37 % hypertoniků. Současně s kouřením, diabetem, dyslipidemií a obezitou (zejména abdominální) je jedním z nejzávažnějších rizikových faktorů ischemické choroby srdeční (ICHS), srdečního selhání (SS), cévní mozkové příhody (CMP) a ledvinného selhání.
Podle výše TK rozlišujeme hypertenzi 1. stupně (mírnou hypertenzi) s hodnotami TK 140–159/90–99 mmHg, hypertenzi 2. stupně (středně závažnou hypertenzi) s TK 160–179/100–109 mmHg a hypertenzi 3. stupně (závažnou hypertenzi) s hodnotami TK ≥ 180/110 mmHg. Hypertenzi dále klasifikujeme podle toho, která hodnota TK je zvýšená, a to na systolicko-diastolickou, izolovanou systolickou, která je zvláště častá u starších nemocných, a izolovanou diastolickou. Za rezistentní označujeme takovou hypertenzi, při níž se ani při vhodně zvolené trojkombinaci antihypertenziv, obsahující diuretikum, nedaří snížit TK < 140/90 mmHg. Klasifikace jednotlivých kategorií TK je uvedena v tabulce 2.3. Z hlediska etiopatogenetického rozlišujeme primární (esenciální) hypertenzi, u níž známe řadu patogenetických mechanismů, ale neznáme vlastní vyvolávající příčinu, a dále sekundární hypertenzi, u které je zvýšení TK důsledkem jiného, přesně definovaného patologického stavu (renální, endokrinní hypertenze atd.). Diagnózu esenciální hypertenze (EH) stanovíme vyloučením příčiny sekundární hypertenze. EH představuje asi 90 % hypertenzní populace, kdežto sekundární hypertenze představuje přibližně 10 %. Vzájemné odlišení esenciální a sekundární hypertenze je
Tab. 2.3 Definice a klasifikace jednotlivých kategorií krev ního tlaku
Kategorie Systolický tlak (mmHg) Diastolický tlak (mmHg)
optimální < 120 < 80
normální 120–129 80–84
vysoký normální 130–139 85–89
hypertenze 1. stupně (mírná) 140–159 90–99
hypertenze 2. stupně (středně závažná)
hypertenze 3. stupně (závažná)
izolovaná systolická hypertenze
160–179 100–109
≥ 180 ≥ 110
≥ 140 < 90
důležité pro možnosti specifické léčby sekundární formy, která může vést u odstranitelných příčin (primární hyperaldosteronismus, renovaskulární hypertenze, feochromocytom, koarktace aorty aj.) v časných stadiích k vymizení hypertenze. Na možnost sekundární hypertenze pomýšlíme u náhlého zhoršení nebo náhlého začátku těžké hypertenze, u rezistence na léčbu nebo v přítomnosti klinických či laboratorních známek naznačujících možnost sekundární příčiny hypertenze. Za nejčastější formy sekundární hypertenze je považován primární hyperaldosteronismus a renální hypertenze (tab. 2.4).
Hypertenzi můžeme klasifikovat také podle poškození cílových orgánů a přidružených onemocnění. V ČR je stále používána pro posudkové účely (tab. 2.5). Nově je tato upravená klasifikace použita i v evropských doporučeních z roku 2023. Stadium 1: nekomplikovaná hypertenze včetně onemocnění ledvin podle stadia 1 a 2. Stadium 2: hypertenze s reverzibilním poškozením cílových orgánů, CKD stadia 3 nebo přítomným diabetem. Stadium 3: hypertenze s ireverzibilním poškozením cílových orgánů a CKD 4 a 5.
2.2.2
Prognóza arteriální hypertenze
Prognóza hypertenze závisí na výši TK, přítomnosti dalších rizikových faktorů, poškození cílových orgánů a přítomnosti přidružených onemocnění (tab. 2.5). Nemocné s arteriální hypertenzí je nutné považovat obecně za osoby s vyšším kardiovaskulárním rizikem. Nicméně pokud chceme odhadnout celkové riziko fatálních KV příhod, můžeme použít nomogramy evropského projektu SCORE, modifikované na základě vyšetření reprezentačního vzorku české populace a mortalitních dat České republiky, nomogramy jsou umístěny na odkazu www. hypertension.cz.
2.2.3 Diagnostika arteriální hypertenze
Vzhledem k vysokému počtu nemocných v populaci nelze provádět k rozlišení esenciální a sekundární hypertenze všechna vyšetření známá z literatury. Musíme vycházet ze screeningových vyšetření, která provádíme povinně u všech
Tab. 2.4 Příčiny sekundární hypertenze
1. Endokrinní hypertenze
primární hyperaldosteronismus, Cushingův syndrom, feochromocytom, primární hyperparatyreóza, akromegalie, hypertyreóza, hypotyreóza
2. Renální parenchymatózní hypertenze diabetická nefropatie, polycystická choroba ledvin, glomerulonefritidy, chronická tubulointersticiální nefritida
3. Renovaskulární hypertenze
4. Hypertenze u syndromu spánkové apnoe
5. Hypertenze vyvolaná léky a návykovými látkami
6. Koarktace aorty
7. Neurogenní příčiny
Tab. 2.5 Faktory ovlivňující prognózu hypertoniků
Poškození cílových orgánů (reverzibilní) hypertrofie levé komory srdeční EKG
imunosupresiva, kortikoidy, nesteroidní antirevmatika, hormonální antikoncepce, sympatomimetika, drogy (kokain a další)
ztluštění arteriální stěny (USG vyšetření)
aortální (karotidofemorální) rychlost pulzní vlny
echokardiogram – index hmotnosti levé komory
Sokolowův–Lyonův index > 35 mm
Cornellův index (RaVL + SV3) > 20 mm u žen, 28 mm u mužů
muži ≥ 125 g/m2
ženy ≥ 110 g/m2
tloušťka intimy‑medie karotid ≥ 0,9 mm
přítomnost aterosklerotického plátu
absolutní hranice > 10 m/s
poměr kotníkového/brachiálního TK ≤ 0,9
mírný vzestup sérové koncentrace kreatininu
muži 115–133 µmol/l
ženy 107–124 µmol/l
nízká glomerulární filtrace < 90 ml/min/1,73 m2
albuminurie 30–300 mg/24 h
poměr albumin/kreatinin
Poškození cílových orgánů (ireverzibilní), přidružená onemocnění
cévní onemocnění mozku ischemická CMP
mozkové krvácení
TIA
postižení srdce infarkt myokardu
angina pectoris
muži ≥ 2,5 mg/mmol
ženy ≥ 3,5 mg/mmol
koronární revaskularizace chronické srdeční selhání nemocní s renálním postižením (ne)diabetická nefropatie pokles renálních funkcí GF < 60 ml/min/1,73 m2
sérový kreatinin
muži > 133 µmol/l
ženy > 124 µmol/l proteinurie > 300 mg/24 h postižení periferních cév stenózy/uzávěry periferních cév pokročilá retinopatie hemoragie exsudáty
CMP – cévní mozková příhoda, EKG – elektrokardiogram, GF – glomerulární filtrace, TIA – tranzitorní ischemická ataka, USG – ultrasonografie
hypertoniků a doplňujeme je podle další diagnostické úvahy o vyšetření vhodná (tab. 2.6).
2.2.3.1 Měření krevního tlaku
Měření se provádí v ordinaci u sedícího pacienta po pětiminutovém uklidnění na obou pažích, při opakovaných měřeních na paži, na níž jsme zaznamenali vyšší hodnotu. Tlakové rozdíly mezi jednotlivými pažemi do 10 mmHg jsou považovány za fyziologické. Opakovaně zjištěný rozdíl mezi pravou a levou paží nad 20 mmHg vyžaduje vyšetření k identifikaci případného tepenného postižení. Měření provádíme na paži s volně podloženým předloktím ve výši srdce. Podle doporučení ESC/ESH (European Society of Cardiology/European Society of Hypertension) pro léčbu hypertenze bychom měli TK změřit třikrát s odstupem 1–2 minut a zaznamenat jako výslednou hodnotu průměr 2. a 3. měření. Pokud se výsledky měření hodně liší nebo má pacient arytmii, měli bychom měření provést více. TK měříme také vestoje za 1 minutu a za 3 minuty po postavení. U většiny osob systolický TK po postavení o několik mmHg klesá a dTK o několik mmHg stoupá. Pokles systolického TK (sTK) o ˃ 20 mmHg nebo diastolického TK (dTK) o ˃ 10 mmHg svědčí pro ortostatickou hypotenzi a je spojován s častějším výskytem kardiovaskulárních příhod a vyšší mortalitou. Měření vestoje je důležité v případě závratí či slabosti u starších nemocných a diabetiků. Při nepravidelném
Tab. 2.6 Doporučená vyšetření u arteriální hypertenze
Vyšetření nutná u všech hypertoniků
pulzu (např. fibrilaci síní) nemusí být měření automatickými tlakoměry přesné, v tomto případě se doporučuje měřit tlak vždy manuálně s auskultací brachiální arterie. TK se běžně měří nepřímou metodou a jako zlatý standard se používá konvenční rtuťový tonometr nebo nově nertuťový s přiměřeně širokou a dlouhou manžetou. Dolní okraj manžety má být 1–2 cm nad loketní jamkou. TK měříme s přesností na 2 mmHg. Tlak, při kterém se Korotkovovy fenomény poprvé objevují (fáze 1), odpovídá sTK; dTK odečítáme u dospělých, těhotných žen i u dětí při vymizení ozev (5. fáze Korotkovových fenoménů). Výjimečně přestávají být Korotkovovy fenomény slyšitelné během fáze 2 nebo 3 a znovu se objevují při dalším snížení tlaku v manžetě. Toto vymizení zvuků se nazývá auskultační gap neboli auskultační mezera. Bývá přítomna u starších hypertoniků a může způsobit chybu měření. Měření TK pomocí aneroidního manometru je méně přesné. Lze také použít poloautomatické přístroje s manžetou na paži (auskultační nebo oscilometrické), které byly validizovány podle standardních protokolů a jejich přesnost musí být pravidelně kontrolována (porovnáním měřených hodnot zjištěných rtuťovým tonometrem). Digitální přístroje s manžetou přikládanou na prsty nebo zápěstí nejsou z důvodu značné nepřesnosti doporučovány.
V posledních letech vzrostl zájem o měření TK ve zdravotnickém zařízení bez přítomnosti personálu, a to na základě výsledků prospektivní randomizované studie SPRINT, kde tato metoda měření byla poprvé použita; studie byla hlavním argumentem pro snížení hranice hypertenze ve
Vyšetření vhodná u některých skupin anamnéza – včetně rodinné, gynekologické, farmakologické domácí měření a 24hodinová monitorace TK fyzikální vyšetření – včetně palpace a auskultace periferních tepen echokardiografie
TK
vsedě vestoje na obou HK při 1. vyšetření
USG vyšetření extrakraniálních tepen vyšetření aortální rychlosti pulzové vlny sonografické vyšetření ledvin a nadledvin vyšetření moči a močového sedimentu poměr systolického TK kotník/paže laboratorní vyšetření
SNa
SK
SCa
SKreat glykemie kyselina močová v séru odhad glomerulární filtrace (eGFR) albuminurie (poměr albumin/kreatinin) krevní obraz
lipidové spektrum
celkový cholesterol
HDL‑cholesterol
TG
LDL‑cholesterol
EKG
kontrola adherence k léčbě u všech pacientů, u nichž se nedaří dosáhnout cílových hodnot TK (kontrola lékového záznamu pacienta, stanovení hladiny léků či jejich metabolitů v séru/moči, kontrola užití léků před zdravotnickým personálem)
glykemická křivka v případě glykemie nalačno nad 5,6 mmol/l
oční pozadí u závažné hypertenze
základní vyšetření při podezření na nejčastější typy sekundární hypertenze: renin, aldosteron, vyšetření průtoku krve ledvinami (dopplerovské vyšetření renálních tepen), ev. CT angiografie, screening spánkové apnoe
CT – výpočetní tomografie, EKG – elektrokardiogram, HDL – high density lipoprotein, LDL – low density lipoprotein, TG – triglyceridy, TK – krevní tlak, USG – ultrasonografie
Spojených státech. Měření poskytuje u většiny nemocných podstatně nižší hodnoty TK; pokud je TK měřen po pětiminutové pauze v prostředí zcela bez personálu, bez dalších osob a jiných rušivých vlivů, hodnoty jsou v průměru nižší až o 15/8 mmHg oproti řádně provedenému rutinnímu měření. Měli bychom nadále preferovat klasické měření TK v ordinaci.
■ Měření krevního tlaku mimo ordinaci
Zahrnuje jak měření TK v domácím prostředí (HBPM), tak ambulantní 24hodinové monitorování tlaku (ABPM). Volit lze mezi nimi podle indikace, dostupnosti a preferencí pacienta. Obě metody v poslední době nabývají na důležitosti. Hodnoty lépe korelují s poškozením cílových orgánů nebo vznikem KV příhod a přináší lepší prognostické informace.
■ Domácí měření krevního tlaku
Vedle měření TK v ordinaci lékařem nebo sestrou (tzv. příležitostný, kazuální nebo klinický TK) je pro zlepšení přístupu hypertoniků k léčbě doporučováno měření TK v domácích podmínkách. Hodnoty TK v domácích podmínkách ≥ 135/85 mmHg jsou považovány za zvýšené. Pacienti si mají měřit TK validizovaným oscilometrickým tonometrem, nejlépe s manžetou na paži. Nemocnému doporučujeme, aby si měřil TK sedm dní před plánovanou návštěvou lékaře, vždy dvakrát po sobě, a to ráno před užitím léků a večer. Z naměřených hodnot máme posuzovat jejich průměr, ojedinělá odchylka není významná. Jinak doporučujeme změřit si tlak 1–2× týdně. Pokud si nemocný změří TK při jakýchkoliv potížích nebo ve stresu, taková hodnota není směrodatná pro nastavení chronické medikace. Hypertenze bílého pláště a maskovaná hypertenze jsou popsány dále na straně 23.
Ambulantní monitorování krevního tlaku (AMTK) po dobu 24 nebo 48 hodin provádíme v následujících situacích: zvýšená variabilita TK, diskrepance mezi TK doma a ve zdravotnickém zařízení (syndrom bílého pláště a maskovaná hypertenze), rezistence hypertenze k léčbě, podezření na epizody hypotenze (zejména u starších a diabetiků), zvýšení TK v těhotenství a podezření na eklampsii (tab. 2.7).
Nejčastěji se jako normální TK při AMTK udává 24hodinový průměr < 130/80 mmHg, denní průměr < 135/85 mmHg a noční průměr TK < 120/70 mmHg. Ambulantní monitorování umožňuje též měření TK na konci působení dávky léku, tzv. trough hodnoty, a měření TK v době maximálního účinku léku, tzv. peak hodnoty. Jejich poměr, tzv. trough/ peak (T/P) poměr, po odečtení placebového efektu, umožňuje posoudit 24hodinovou účinnost léků na TK. U léků podávaných 1krát denně musí účinek na konci dávkovacího období (trough) činit alespoň 50–66 % účinku léku dosaženého na vrcholu (peak). Výsledky AMTK lépe korelují s přítomností orgánových komplikací oproti kazuálnímu měření TK. Průměrný 24hodinový tlak lépe koreluje s rozsahem hypertrofie levé srdeční komory. Stejných výsledků bylo dosaženo při porovnání AMTK a kazuálního TK ve vztahu k některým dalším komplikacím hypertenze, jako je tloušťka cévní stěny tepen, změny na očním pozadí nebo albuminurie. Ve spánku TK fyziologicky klesá, a to více než o 10 % oproti bdění. Tento fenomén se označuje dipping. Existují jedinci, u nichž pokles TK chybí nebo je menší než 10 % (označují se termínem non-dippers). Chybějící nebo menší pokles TK byl popsán u ledvinného selhání, diabetes mellitus, některých forem sekundární hypertenze a u autonomní neuropatie. Noční pokles TK však není porušen u renovaskulární hypertenze a u nemocných s primárním hyperaldosteronismem. Kromě trvání a tíže hypertenze se na vzniku orgánových změn u hypertenze podílí též variabilita TK – častější orgánové nálezy se zjišťují u hypertoniků
Tab. 2.7 Indikace k provedení ambulantního monitorování krevního tlaku
Účel
Klinická indikace
diagnostika hypertenze bílého pláště hypertenze 1. stupně podle měření TK v ordinaci vysoká variabilita TK během měření v ordinaci vyloučení pseudorezistentní hypertenze vysoké hodnoty TK měřené v ambulanci, bez známek orgánového poškození rozdíl mezi hodnotami TK v ordinaci a domácím prostředí diagnostika maskované hypertenze vysoký normální TK (130–139/85–89 mmHg) normální klinický TK, ale přítomné známky orgánového poškození normální klinický TK u nemocných s vysokým KV rizikem přítomnost RF pro maskovanou hypertenzi, DM, obezita nadměrný příjem alkoholu, kouření rozdíl mezi hodnotami TK v ordinaci a domácím prostředí určení hodnot TK během celého dne u léčených i neléčených pacientů
diagnostika nově zjištěné hypertenze určení kontroly TK během celého dne podezření na ortostatickou nebo lékovou hypotenzi podezření na noční hypertenzi – syndrom spánkové apnoe, chronické onemocnění ledvin, autonomní dysfunkce, diabetes mellitus, endokrinní hypertenze zvýšený TK v těhotenství a podezření na preeklampsii
DM – diabetes mellitus, TK – krevní tlak
Tab. 2.8 Definice hypertenze u různých typů měření krevního tlaku
Krevní tlak (mmHg) Systolický TK
Diastolický TK
kazuální TK (TK v ambulanci lékaře) ≥ 140 ≥ 90
domácí měření TK ≥ 135 ≥ 85
AMTK (24hodinový) ≥ 130 ≥ 80
AMTK (denní, v době bdění) ≥ 135 ≥ 85
AMTK (noční, v době spánku) ≥ 120 ≥ 70
AMTK – ambulantní monitorování krevního tlaku, TK – krevní tlak
s větší variabilitou TK. AMTK má proti kazuálnímu TK tyto výhody: automaticitu, vyšší spolehlivost, reprodukovatelnost, přesnější posouzení 24hodinového monitorování TK včetně jeho cirkadiánního rytmu, posouzení variability TK, těsnější korelaci s orgánovými změnami a prognózou. Ve srovnání s domácím měřením TK má AMTK výhodu v možnosti měřit TK v nočních hodinách, a tak posoudit cirkadiánní rytmus TK. Hodnoty TK používané k definici hypertenze při různých typech měření jsou sumarizovány v tabulce 2.8
Pravidelné klinické kontroly u stabilizovaných hypertoniků provádíme obvykle jedenkrát za tři měsíce. U komplikovaných nebo nevyrovnaných stavů, na počátku léčby a při změně antihypertenziva kontrolujeme nemocné častěji (za 4–6 týdnů). Naopak u pacientů s nízkým celkovým KV rizikem, u nichž postačuje ke kontrole TK monoterapie, lze stanovit interval mezi jednotlivými návštěvami u lékaře až na šest měsíců. Pokud se nedaří medikamentózní léčbou dosáhnout cílových hodnot TK do tří měsíců při léčbě adekvátní dávkou a kombinací antihypertenziv, měl by praktický lékař zvážit konzultaci nemocného s odborníkem na léčbu hypertenze (specializovaný internista, kardiolog, nefrolog, specializovaná hypertenzní poradna).
Biochemická vyšetření kontrolujeme jednou ročně, podobně jako EKG, albuminurii, pokud nejsou klinické známky svědčící pro vznik kardiovaskulárních nebo jiných orgánových změn. Echokardiografické vyšetření by mělo být provedeno především u pacientů s těžší hypertenzí, hypertenzí špatně reagující na léčbu, při její kombinaci s ICHS a při nejistých EKG známkách hypertrofie levé komory. Tato vyšetření nám umožní zásadní diferenciálnědiagnostickou orientaci o druhu a tíži hypertenze. Přítomnost hypertrofie nebo dysfunkce levé komory může napomoci při rozhodování o zahájení léčby. Kontrolní echokardiografické vyšetření provádíme jedenkrát za dva roky, při změnách klinického stavu dříve. Hypertonici s podezřením na sekundární hypertenzi by měli být konzultováni na specializovaném pracovišti s možností podrobnějších hormonálních vyšetření (např. renin, aldosteron, katecholaminy) a zobrazovacích metod (např. USG – ultrasonografie, CT – výpočetní tomografie nebo MR – magnetická rezonance ledvin, nadledvin, arteriografie).
2.2.4 Léčba
2.2.4.1 Cíl léčby
Hlavním cílem léčby hypertenze je zabránit KV komplikacím, resp. je oddálit. Proto kromě snížení TK vždy zvažujeme
režimové či farmakologické ovlivnění dalších rizikových faktorů. Léčbou se snažíme dosáhnout cílové hodnoty TK. Co se týká cílové hodnoty TK v ordinaci, je obecnou zásadou jej snížit pod hodnotu 140/90 mmHg u všech pacientů s hypertenzí ideálně do tří měsíců, přičemž za optimální cíl při léčbě hypertenze lze považovat dosažení hodnoty kolem 130/80 mmHg. V obecné rovině se nejnižší riziko KV příhod při léčbě pohybuje v poměrně širokém rozmezí systolického TK mezi 120 a 140 mmHg. Proto zejména u starších osob a dále u nemocných, kde ani kombinační léčba v maximálních tolerovaných dávkách nevede k dosažení cíle, je možné si stanovit mírnější cíl, a to snížit TK pod hodnotu 140/90 mmHg. Osoby s diabetem, ischemickou chorobou srdeční, po prodělané cévní mozkové příhodě a s chronickým onemocněním ledvin mají větší absolutní riziko KV příhod, a proto dosažení hodnot TK kolem 130/80 mmHg je u nich obzvláště důležité. Předpokládá se, že hodnota systolického TK 130 mmHg zhruba odpovídá TK 120 mmHg při automatickém měření bez přítomnosti personálu tak, jak bylo provedeno ve studii SPRINT, v níž dosažení této hodnoty intenzivní léčbou bylo spojeno s lepší prognózou než standardní léčba. Otázkou zůstává, zda snížením TK na velmi nízké hodnoty můžeme nemocnému zvýšit riziko KV příhod (tzv. fenomén J křivky). Toho se můžeme obávat u nemocných s pokročilou koronární aterosklerózou, kde snížení TK pod 120/70 mmHg může být spojeno s vyšším výskytem KV příhod. Nízký TK dosažený léčbou je často dobře tolerován u mladých jedinců, ale u nemocných ve vyšším věku a s významnými komorbiditami již může být tolerován špatně. Proto jsme u nich při léčbě obezřetní a volíme individuální přístup. Při dosažení nízkého TK se zvyšuje pravděpodobnost nežádoucích účinků léčby, např. výskyt symptomatické hypotenze, což může vyžadovat častější klinické a laboratorní kontroly. Cílový TK při domácím měření nebo 24hodinovém monitorování TK není zcela jasný, protože nebyly provedeny prospektivní studie založené na těchto měřeních. Za minimální požadavek můžeme považovat dosažení hodnot, které jsou ekvivalentem TK v ordinaci < 140/90 mmHg, tj. < 135/85 mmHg pro domácí měření a denní monitorování TK a < 130/80 mmHg při 24hodinovém monitorování.
2.2.4.2 Nefarmakologická léčba hypertenze
Nefarmakologická léčba je součástí léčby všech nemocných s hypertenzí, ať již je cílová hodnota pod 140/90 mmHg, nebo pod 130/80 mmHg. Využíváme ji i u nemocných s vysokým normálním TK, kteří zatím nejsou indikováni k farmakoterapii (tab. 2.9).
Tab. 2.9 Nefarmakologická opatření v léčbě hypertenze
• snížení hmotnosti u osob s nadváhou a obezitou
• abstinence kouření tabáku
• snížení nadměrné spotřeby alkoholu (u mužů do 20 g/den, u žen do 15 g/den)
• omezení soli na příjem kolem 5 g nebo 87 mmol, tj. 2000 mg sodíku/den
• ostatní dietní změny (zvýšení konzumace ovoce a zeleniny, snížení příjmu sacharidů a nasycených tuků)
• dostatečná tělesná aktivita (dynamický aerobní trénink 3–4krát týdně 30–45 min)
• relaxační terapie (dodržování dostatečného množství spánku, snížení stresových faktorů)
• vynechání nebo omezení terapie zvyšující TK (neste roidní antiflogistika, kortikoidy, sympatomimetika, hormonální antikoncepce u citlivých žen)
TK – krevní tlak
2.2.4.3 Farmakologická léčba
Algoritmus zahajování farmakologické léčby hypertenze a vysokého normálního krevního tlaku je sumarizován v tabulce 2.10
V případě středně těžké a těžké hypertenze zahajujeme léčbu ihned, dvojkombinací (nejlépe fixní kombinací) antihypertenzních látek v nízkých dávkách. V případě mírné hypertenze a u starších křehkých nemocných volíme buď
monoterapii, či dvojkombinaci v nízkých dávkách a se zahájením terapie lze čekat 1–3 měsíce. Další terapeutické kroky (navyšování dávky, přidání dalšího preparátu) se provádějí většinou s odstupem 4–6 týdnů s výjimkou urgentních stavů. Pokud se TK pohybuje v pásmu vysokého normálního TK, podáváme antihypertenziva pouze ve specifických indikacích, kde primárním účelem většinou není snížení TK, ale léčba přidružených onemocnění. Jsou to zejména chronické srdeční selhání, sekundární prevence ischemické choroby srdeční, sekundární prevence cévní mozkové příhody a chronické onemocnění ledvin včetně diabetické nefropatie. Výběr léku závisí na konkrétní příčině.
■ Výběr antihypertenziv
Při farmakoterapii hypertenze pro monoterapii i kombinační léčbu užíváme v první řadě přípravky ze skupin, pro které jsou k dispozici data ze studií vyhodnocujících morbiditu a mortalitu na KV příhody. Jsou to inhibitory angiotenzin konvertujícího enzymu (ACEI), blokátory receptorů angiotenzinu II (blokátory AT1-receptorů), dlouhodobě působící blokátory kalciových kanálů, thiazidová diuretika a jejich analoga a betablokátory. Další léky z jiných skupin jsou vhodné teprve tehdy, když se nedaří dosáhnout úspěšné léčby hypertenze pomocí základních antihypertenziv ani při použití jejich kombinací. Při výběru antihypertenziva bereme v úvahu také další vlastnost preparátu, klinické charakteristiky nebo komorbidity pacienta. Preference kombinace základních antihypertenziv při zahajování léčby středně těžké a těžké hypertenze s dalšími kroky je uvedena na obrázku 2.8
Tab. 2.10 Algoritmus zahajování farmakologické léčby u hypertenze
TK ≥ 180/110 mmHg léčbu zahájit ihned (fixní) dvojkombinací v nízkých dávkách
TK 160–179/100–109 mmHg opakovaně léčbu zahájit ihned (fixní) dvojkombinací v nízkých dávkách
TK 140–159/90–99 mmHg opakovaně léčbu zahájit do 1–3 měsíců (v závislosti na KV riziku) monoterapií nebo (fixní) dvojkombinací v nízkých dávkách
TK 130–139/85–89 mmHg opakovaně zahájit léčbu ve specifických situacích
KV – kardiovaskulární, TK – krevní tlak
Krok 1
RAS blokátor + BKK nebo RAS blokátor + diuretikum
při TK 140–159/90–99 mmHg a nízkém KV riziku, příp. u křehkého nemocného, zvážit monoterapii RAS blokátorem nebo BKK
RAS blokátor + BKK + diuretikum
Krok 2
Krok 3
RAS blokátor + BKK + diuretikum + spironolakton nebo další lék (doxazosin, betablokátor)
Betablokátory je možné podávat v kterémkoliv kroku v závislosti na komorbiditách a tepové frekvenci.
Obr. 2.8 Schéma postupu při farmakoterapii hypertenze
Postup by měl být vždy individuální v závislosti na komorbiditách. V případě nedostatečného efektu dvojkombinace pak používáme trojkombinaci sestávající z blokátorů renin-angiotenzinového systému, blokátorů kalciového kanálu a diuretik, tyto tři skupiny mají tvořit základ léčby u většiny nemocných s hypertenzí a jsou dostupné i ve formě fixní trojkombinace. V případě nutnosti přidání dalších látek (rezistentní hypertenze) pak používáme léky přidané k předchozí trojkombinaci, zejména malé dávky spironolaktonu. Co se týká betablokátorů, mohou být podány v kterémkoli kroku v závislosti na komorbiditách a dalších příznacích, zejména při známkách zvýšené sympatické aktivity, zvýšené srdeční frekvence nad 70/min. U dvou- a trojkombinací preferujeme použití fixních kombinací léků, protože nižší počet tablet je spojen s lepší adherencí k léčbě. Monoterapie hypertenze bývá úspěšná maximálně u 30 % nemocných, u ostatních potřebujeme k dosažení normálních hodnot TK kombinaci dvou i více antihypertenziv. Včasné zahájení kombinační léčby vede navíc oproti monoterapii k významnějšímu klinickému benefitu. Optimální je dosáhnout cílového krevního tlaku do tří měsíců, to se daří především u nekomplikované a mírné hypertenze. Na druhou stranu musíme brát v úvahu fakt, že příliš rychlé snížení TK může vést ke špatné toleranci léčby a ve svém důsledku k jejímu odmítání, proto postupujeme individuálně, snížení TK na cílovou hodnotu může u některých nemocných, zvláště se závažnou hypertenzí, trvat déle. Léky na hypertenzi podáváme ráno, nemocný je má užít hned po probuzení, aby bylo co nejdříve dosaženo jejich maximální hladiny, protože během dopoledne dochází k vzestupu TK. Při léčbě velkým počtem léků a jejich nesnášenlivosti při podání najednou, případně na přání nemocného, můžeme uvažovat o podání některého léku večer. Podávání léků večer však nemá oporu ve větších studiích, žádná ze seriózních studií výhodu večerní medikace neprokázala, a to ani u nemocných s noční hypertenzí. Večerní podávání léků vede navíc ve srovnání s ranním dávkováním k nižší adherenci. V horkém letním počasí je možno zvažovat redukci léčby. V drtivé většině je farmakologická léčba hypertenze celoživotní.
Fixní kombinace dvou antihypertenziv může mít v léčbě hypertenze určité výhody (např. zlepšení přístupu a udržení nemocných na terapii).
Kombinační léčbu dvěma antihypertenzivy v nižší dávce anebo fixní kombinaci upřednostňujeme již při zahajování farmakologické léčby, pokud jsou počáteční hodnoty sTK 140 mmHg nebo dTK 90 mmHg a více nebo pokud jsou cílové hodnoty TK 130/80 mmHg. Možné dvojkombinace antihypertenziv jsou uvedeny v tabulce 2.11, trojkombinace používané u těžších forem hypertenze v tabulce 2.12
Kombinace ACEI a AT1-blokátorů nepatří u nekomplikované esenciální hypertenze mezi standardně doporučované. Tato dvojkombinace je vhodná jen u nemocných s renální dysfunkcí a významnou proteinurií. Dříve doporučovaná kombinace betablokátor a thiazidové diuretikum taktéž nepatří mezi základní pro nežádoucí metabolické účinky, především vzestup cholesterolu a diabetogenní efekt.
Při farmakoterapii hypertenze pro monoterapii i kombinační léčbu užíváme následující skupiny antihypertenziv:
• inhibitory ACE (ACEI),
• blokátory receptoru 1 pro angiotenzin II (AT1-blokátory, sartany),
• blokátory kalciových kanálů (BKK),
Tab. 2.11 Dvojkombinace antihypertenziv
Nejčastější logické kombinace
Vhodné užití
inhibitor ACE/ AT1 blokátor + BKK dvojkombinace s nejčastějším použitím, zejména u hypertenze s vysokým KV rizikem, zvláště spojené s manifestní aterosklerózou, nefropatií, metabolickým syndromem a diabetem
inhibitor ACE/ AT1 blokátor + sulfonamidové nethiazidové/ thiazidové diuretikum
inhibitor ACE/ AT1 blokátor + betablokátor
alfablokátor + betablokátor
hypertenze starších osob, st. p. CMP, hypertrofie LK a nefropatie, DM 2. typu s nefropatií
hypertenze + ICHS, hypertenze + chronické srdeční selhání
hypertenze při feochromocytomu
Méně účinné kombinace
BKK + diuretikum
BB + ACEI (vhodné u nemocných po IM a u srdečního selhání)
AT1 blokátor + ACEI (vhodné u renální dysfunkce s významnou proteinurií)
Nevhodné kombinace
BB + BKK s bradykardizujícím účinkem (verapamil, diltiazem)
ACEI – inhibitory angiotenzin konvertujícího enzymu, BB – beta blokátor, BKK – blokátory kalciových kanálů, CMP – cévní mozková příhoda, DM – diabetes mellitus, ICHS – ischemická choroba srdeční, IM – infarkt myokardu, KV – kardiovaskulární
Tab. 2.12 Vhodné trojkombinace antihypertenziv užívané u těžších forem hypertenze
• ACEI nebo AT1‑blokátor + thiazidové diuretikum + BKK
• dihydropyridinový BKK + BB + thiazidové diuretikum
• ACEI nebo AT1‑blokátor + thiazidové diuretikum + BB
• alfablokátor + BB + thiazidové diuretikum
• ACEI nebo AT1‑blokátor + thiazidové diuretikum + centrálně působící látka
ACEI – inhibitory angiotenzin konvertujícího enzymu, BB – beta blokátor, BKK – blokátory kalciových kanálů
• betablokátory (BB),
• diuretika.
Tyto třídy antihypertenziv mají dostatek důkazů o snížení KV i cerebrovaskulární mortality. Alfablokátory a centrálně působící látky používáme kvůli absenci dokladů o příznivém ovlivnění KV mortality převážně pro kombinační léčbu (léky s přímým vazodilatačním působením na stěnu cévní – přímá vazodilatancia – nejsou t. č. v ČR dostupná).
Indikace a kontraindikace hlavních tříd antihypertenziv (diuretika, BB, BKK, ACEI, AT1-blokátory) jsou uvedeny v tabulce 2.13. Přehled indikací a kontraindikací u dalších antihypertenziv (alfablokátory, centrálně působící látky) je sumarizován v tabulce 2.14
Tab. 2.13 Indikace a kontraindikace hlavních skupin antihypertenziv Skupina antihypertenziv Stavy podporující jejich užití Kontraindikace absolutní relativní
diuretika sulfonamidová nethiazidová a thiazidová
diuretika (kličková)
srdeční selhání hypertenze u starších osob izolovaná systolická hypertenze hypertenze u osob afrického původu rezistentní hypertenze
renální insuficience srdeční selhání
chronické srdeční selhání rezistentní hypertenze primární aldosteronismus
dna pokročilá renální insuficience hypokalemie
hypokalemie, dna diuretika (antagonisté mineralokortikoidních receptorů)
betablokátory hypertenze se známkami zvýšené sympatické aktivity, hyperkinetická cirkulace
angina pectoris stavy po infarktu myokardu chronické srdeční selhání* (s postupnou titrací) těhotenství tachyarytmie
renální selhání s hyperkalemií hyperkalemie těhotenství
asthma bronchiale AV blok (stupeň 2 nebo 3) a jiné závažné bradyarytmie
renální selhání
chronická obstrukční plicní nemoc sportovci a fyzicky aktivní pacienti
blokátory kalciových kanálů (dihydropyridinového typu)
blokátory kalciových kanálů (verapamil, diltiazem)
pacienti ve vyšším věku izolovaná systolická hypertenze angina pectoris ischemická choroba dolních končetin aterosklerotické postižení karotid těhotenství tepenné spasmy
stejně jako pro BKK dihydropyridinového typu, navíc supraventrikulární tachykardie
AV blok (stupeň 2 nebo 3) srdeční selhání s nízkou EF inhibitory angiotenzin konvertujícího enzymu
všechny typy hypertenze s výjimkou hypertenze v těhotenství městnavé srdeční selhání systolická dysfunkce levé komory pacienti po infarktu myokardu hypertrofie levé komory srdeční diabetická a nediabetická nefropatie, proteinurie
těhotenství hyperkalemie bilaterální stenóza angioneuropatický edém v anamnéze
těsná aortální stenóza srdeční selhání s nízkou EF (neplatí pro amlodipin a felodipin)
ženy ve fertilním věku bez účinné antikoncepce
blokátory AT1‑receptorů sartany
všechny typy hypertenze s výjimkou hypertenze v těhotenství diabetická a nediabetická nefropatie, proteinurie
CHOPN hypertrofie levé komory srdeční městnavé srdeční selhání systolická dysfunkce levé komory stav po infarktu myokardu zvážit u fibrilace síní kašel při užívání ACEI
těhotenství hyperkalemie bilaterální stenóza renálních tepen
*karvedilol, bisoprolol, retardovaný metoprolol sukcinát ACEI – inhibitory angiotenzin konvertujícího enzymu, AV blok – atrioventrikulární blok, BKK – blokátory kalciových kanálů, CHOPN – chro nická obstrukční plicní nemoc
Tab. 2.14 Indikace a kontraindikace alfablokátorů a centrálně působících látek
Skupina antihypertenziv Stavy podporující jejich užití Kontraindikace absolutní relativní
alfablokátory benigní hypertrofie prostaty rezistentní hypertenze hypertenze při feochromocytomu
centrálně působící látky methyldopa hypertenze v těhotenství
další centrálně působící látky rezistentní hypertenze psychická tenze renální insuficience metabolické odchylky
■ Antihypertenziva – výběr a charakteristika
■ Diuretika
Mezi základní antihypertenziva řadíme především sulfonamidová diuretika, která podle chemické struktury dělíme na thiazidová, např. hydrochlorothiazid, a nethiazidová (též thiazidům podobná diuretika nebo thiazidová analoga), např. indapamid a chlorthalidon. Jde o saluretika s dlouhodobým účinkem, působící v distálním tubulu ledvin. Kromě účinku v ledvinách mají také vazodilatační efekt. Přednost dáváme déle působícím thiazidovým analogům – indapamidu a chlorthalidonu, díky většímu antihypertenznímu účinku a vlivu na snížení KV rizika ve srovnání s hydrochlorothiazidem. Diuretika užíváme výhodně při léčbě hypertenze ve stáří. Jejich největší použití je v kombinační léčbě, protože potencují účinek dalších antihypertenziv. Nežádoucí účinky, především hypokalemie, hyperurikemie a hyponatremie, jsou silně závislé na dávce, a proto používáme menší dávky. U těžké hypertenze jsou však vysoké dávky v rámci kombinační léčby základním předpokladem úspěšné léčby. Indapamid byl úspěšně testován v prospektivní studii u diabetiků. Kličková diuretika (furosemid) se používají jako antihypertenziva pouze při významně snížené glomerulární filtraci (pod 0,5 ml/s/1,73 m2) a dále jako společná léčba hypertenze a závažného městnavého srdečního selhání či renálního selhání. Antagonisté mineralokortikoidních receptorů nepatří mezi základní antihypertenziva a používají se jen ve speciálních situacích. Je to u hypertenze rezistentní na léčbu, kdy ani podávání tří preparátů včetně diuretik nevede k úspěšné kontrole TK. Obvyklá dávka je 25 mg spironolaktonu denně, vhodné je zvážit kvůli nežádoucím účinkům, zejména při zahajování léčby, dávku nižší, tj. 12,5 mg/den, a dále při konzervativní léčbě primárního hyperaldosteronismu, kde se používají vyšší dávky spironolaktonu (25–100 mg denně). V případě intolerance spironolaktonu je vhodné podávat eplerenon v obvyklé celkové dávce 50–200 mg/ den, nově finerenon nebo amilorid připravený magistraliter v dávce 5–15 mg/den (tab. 2.15).
■ Betablokátory
Blokátory betareceptorů je nutno nadále považovat za skupinu základních antihypertenziv, neboť mají data z mortalitních studií, ale jejich postavení je oslabeno vyšším výskytem nežádoucích účinků a menším ovlivněním rizika CMP. Jejich vliv na morbiditu a mortalitu byl studován ve
ortostatická hypotenze srdeční selhání těhotenství
srdeční selhání deprese
těhotenství, srdeční selhání deprese
Tab. 2.15 Přehled nejčastěji užívaných diuretik v léčbě hy pertenze
Typ diuretika/ generický název
thiazidová analoga
Denní dávkování
chlorthalidon 1× 6,25–25 (50) mg indapamid 1× (0,625) 1,25–2,5 mg
metipamid 1× 1,25–2,5 mg thiazidy
hydrochlorothiazid 1× (6,25) 12,5–25 mg bendroflumethiazid 1× 2,5–5 mg
kličková diuretika furosemid 1–3× 20–250 mg
kalium šetřící diuretika
amilorid 1× 5–10 mg
spironolakton 1× 12,5–50 mg (25–100 mg/den u primárního hyperaldosteronismu)
eplerenon 1× 25–50 mg (50–200 mg u primárního hyperaldosteronismu)
velkém počtu studií a byla publikována řada metaanalýz. Velká metaanalýza zkoumající vliv základních antihypertenziv ve srovnání s placebem ukázala, že betablokátory podávané hypertonikům snižují výskyt cévních mozkových příhod o 17 % (diuretika o 27 % a inhibitory ACE o 35 %) a výskyt všech kardiovaskulárních příhod o 11 % (diuretika o 30 % a inhibitory ACE o 24 %). Snížení KV rizika pomocí betablokátorů je tedy menší, přesto je statisticky významné. Mezi známé nežádoucí účinky patří bradyarytmie a dále bronchospasmy, jejichž riziko je vyšší u neselektivních či málo kardioselektivních látek. Z dlouhodobého hlediska je důležité negativní ovlivnění lipidového a glycidového metabolismu. Je však třeba zdůraznit, že betablokátory jsou heterogenní skupinou léků. Ve většině studií byl použit atenolol, který nemá dostatečně dlouhý biologický poločas a vykazuje nejmenší kardioselektivitu. V léčbě proto preferujeme modernější přípravky, např. nebivolol, bisoprolol, metoprolol nebo betaxolol. Těžiště použití betablokátorů


v současné době je v kombinační léčbě, zejména u hypertenze spojené s manifestní ICHS a/nebo chronickým srdečním selháním, případně s významnou dysfunkcí levé srdeční komory. Betablokátory můžeme také použít v monoterapii, jsou relativně účinnější u hypertenze, jejíž patofyziologický podklad souvisí s vysokou aktivitou sympatiku (hyperkinetická cirkulace, typická pro počínající hypertenzi), anxiózní stavy s palpitacemi nebo u pacientů s tremorem. Betablokátory jsou vhodné u hypertoniků s klidovou srdeční frekvencí nad 75/min. Také jsou vhodné ve 2. a 3. trimestru gravidity (tab. 2.16).
Tab. 2.16 Přehled nejčastěji užívaných betablokátorů
Typ betablokátoru/ generický název Denní dávkování
selektivní
atenolol 1–2× 25–100 mg
bisoprolol 1× 5–20 mg
betaxolol 1× 10–20 mg
metoprolol ZOK 1× 25–200 mg
metoprolol SR 1× 50–200 mg
nebivolol 1× 2,5–5 (10) mg
selektivní s ISA
acebutolol 1× 400–800 mg
celiprolol 1× 200–400 mg
neselektivní
metipranolol 2× 5–40 mg
neselektivní s ISA
bopindolol 1× 1–2 mg
s kombinovaným alfa‑ i beta účinkem
karvedilol 2× 12,5–25 mg
labetalol* 2–3× 100–200 mg
*V současnosti v ČR nedostupný.
ISA – intrinsic sympathomimetic activity
■ Inhibitory angiotenzin konvertujícího enzymu (ACEI)
Angiotenzin konvertáza (ACE) katalyzuje přeměnu angiotenzinu I na angiotenzin II. Zároveň štěpí bradykinin na neaktivní fragmenty. Angiotenzin II svým působením na specifickém receptoru (AT1-receptor) působí řadu nežádoucích účinků (poruchu endoteliální funkce, vazokonstrikci, hypertrofii atd.). Zablokováním ACE pomocí ACEI se tvoří méně nežádoucího angiotenzinu II a snižuje se odbourávání bradykininu.
Inhibitory angiotenzin I konvertujícího enzymu mají vedle svého antihypertenzního účinku i kardioprotektivní, vazoprotektivní a renoprotektivní efekt a příznivé účinky na metabolismus cukrů. Zlepšují prognózu u vysokorizikových nemocných s ICHS, CMP, periferní aterosklerózou nebo u diabetiků. ACEI snižují rovněž riziko vzniklého diabetu 2. typu. Jejich nejdůležitější kontraindikací je hypertenze v těhotenství. Proto jsou nevhodné také ve fertilním věku. Nejčastějším nežádoucím účinkem je kašel, který se vyskytuje typicky po ulehnutí. Je dán zpomaleným odbouráváním
bradykininu. Po nasazení ACEI je nutná kontrola hladin draslíku a kreatininu (tab. 2.17).
Tab. 2.17 Přehled ACEI nejčastěji užívaných v léčbě hyper tenze (v abecedním pořadí)
Typ ACEI/ generický název
Denní dávkování
s dlouhým poločasem účinku cilazapril 1× 2,5–5 mg
fosinopril 1× 10–40 mg
imidapril 1× 2,5–20 mg lisinopril 1× 2,5–40 mg
perindopril arginin 1× 2,5–10 mg
perindopril erbumin 1× 2–8 mg quinapril 1× 2,5–20 mg ramipril 1× 1,25–10 mg spirapril 1× 6 mg
trandolapril 1× 0,5–4 mg se středním poločasem účinku enalapril 2× 2,5–20 mg s krátkým poločasem účinku captopril 3× 12,5–50 mg
■ Inhibitory receptorů angiotenzinu II, typ AT1 (AT1‑blokátory, sartany)
AT1-blokátory, na rozdíl od ACEI, blokují přímo receptor AT1 pro angiotenzin II. Znemožňují tak angiotenzinu II jeho specifický účinek na receptoru. AT1-blokátory je možné využít k léčbě hypertenze prakticky ve stejných indikacích jako ACEI. Navíc jsou vhodné u nemocných s CHOPN (chronická obstrukční plicní nemoc). Sartany nevyvolávají kašel jako ACEI. Mají ze všech antihypertenziv nejméně nežádoucích účinků a nemocní léčení sartany vykazují nejlepší dlouhodobou perzistenci k léčbě. Po nasazení je nutné zkontrolovat hladinu draslíku a kreatininu (tab. 2.18).
Tab. 2.18 Přehled AT1‑blokátorů (sartanů) nejčastěji užíva ných v léčbě hypertenze
Generický název Denní dávkování candesartan 1× 4–32 mg eprosartan 1× 600 mg irbesartan 1× 75–300 mg losartan 1–2× 50–100 mg olmesartan 1× 10–40 mg telmisartan 1× 20–80 mg valsartan 1× 80–320 mg
■ Blokátory kalciových kanálů (BKK)
Blokátory kalciových kanálů můžeme zjednodušeně rozdělit na dihydropyridiny a nondihydropyridiny.
Dihydropyridiny snižují TK systémovou vazodilatací. Nemusíme u nich provádět žádné speciální laboratorní kontroly. BKK jsou zvlášť vhodné pro léčbu hypertenze ve stáří a izolované systolické hypertenze. Příznivě ovlivňují regresi hypertrofie levé komory srdeční, průtok krve ledvinou a periferním řečištěm. Nejčastějšími nežádoucími účinky jsou periferní otoky a návaly krve v obličeji. Jsou závislé na dávce a často ustoupí po jejím snížení. Otoky končetin jsou projevem zvýšené propustnosti kapilár, a nikoliv důsledkem zmnožení celkového extracelulárního objemu.
Nondihydropyridiny, typu verapamil a diltiazem, jsou kontraindikované k léčbě hypertenze u srdečního selhání se sníženou ejekční frakcí nebo s poruchami atrioventrikulárního vedení pro svůj negativně inotropní a negativně chronotropní účinek (tab. 2.19).
Tab. 2.19 Přehled blokátorů kalciových kanálů nejčastěji užívaných v léčbě hypertenze (v abecedním pořadí)
Generický název Denní dávka
amlodipin 1× 2,5–10 mg barnidipin 1×10–20 mg diltiazem retard diltiazem SR 2× 90–180 mg 1× 240 mg felodipin 1× 2,5–10 mg
isradipin SRO 1× 5–10 mg lacidipin 1× 2–6 mg
lercanidipin 1× 10–20 mg nifedipin GITS 1× 30–60 mg
nifedipin XL 2× 20–40 mg nisoldipin 1× 17–34 mg nitrendipin 1× 10–20 mg nivaldipin 1× 8–16 mg
verapamil SR 1×120–140 (480) mg
■ Další skupiny antihypertenziv
Centrálně (nebo centrálně i periferně) působící antihypertenziva můžeme použít do kombinační léčby rezistentní hypertenze po vyčerpání základních tříd antihypertenziv. Dále jsou součástí kombinace antihypertenziv k léčbě hypertenze spojené s psychickou tenzí, pro léčbu renální hypertenze, hypertenze s metabolickými odchylkami a u hypertenze při diabetes mellitus. Methyldopa stále zůstává hlavním lékem pro perorální léčbu hypertenze v těhotenství. Centrálně působící agonisté imidazolinových receptorů I1 (moxonidin, rilmenidin) způsobují méně nežádoucích účinků (sedace, sucho v ústech) a při náhlém vysazení nenavozují rebound fenomén.
Látky blokující periferní alfa1‑receptory (doxazosin, terazosin) jsou indikovány v kombinaci s ostatními antihypertenzivy v léčbě těžké nebo rezistentní hypertenze. Vhodnou indikaci představuje hypertenze s hypertrofií prostaty. Hlavními nežádoucími účinky jsou ortostatická hypotenze, inkontinence moči u žen a vazomotorická rýma. Doxazosin by rozhodně neměl být podáván nemocným s manifestním nebo latentním srdečním selháváním. Urapidil je antihypertenzivum s tzv. kombinovaným účinkem.
Selektivní blokádou postsynaptických alfa1-receptorů snižuje periferní cévní rezistenci podobně jako doxazosin, navíc však působí v centrálním nervovém systému jako agonista 5-HT1-receptorů, čímž snižuje centrální tonus sympatiku a způsobuje tak snížení TK.
Antihypertenzní efekt látek s přímým vazodilatačním účinkem (minoxidil) je zprostředkován poklesem periferní cévní rezistence, ale také řadou nežádoucích účinků. Je k dispozici jen magistraliter nebo na mimořádný dovoz.
ARNI (angiotensin receptor neprilysin inhibitor) (sakubitril/valsartan). Jedná se o látku blokující receptory pro angiotenzin II a současně inhibující neutrální peptidázu (NEP, neprilysin). Výsledkem je silný antihypertenzní účinek. V současné době jsou tyto léky indikovány pro léčbu symptomatického chronického srdečního selhání se sníženou EF nereagující na běžnou léčbu.
Glifloziny jsou další skupinou léků, které podobně jako ARNI mají významný antihypertenzní účinek, ale nejsou dosud schváleny pro léčbu hypertenze. Tyto léky navozují vyšší odpady sodíku a glukózy ledvinami a snižují systolický TK během 24hodinového monitorování v průměru o 5 mmHg, a to i u nediabetiků (tab. 2.20).
Tab. 2.20 Přehled centrálně a centrálně i periferně působí cích látek nejčastěji užívaných v léčbě hypertenze
Typ látky/ generický název
alfablokátory
doxazosin doxazosin XL
Denní dávkování
1–2× 1–4 mg 1× 4–8 mg prazosin* 3× 1–3 mg terazosin 1× 1–5 mg agonisté imidazolinových receptorů moxonidin 1× 0,2–0,6 mg rilmenidin 1–2× 1 mg centrální alfa2‑adrenergní agonisté alfa‑methyldopa 2–3× 250–500 mg klonidin* 1–2× 0,25–0,50 mg guanfacin* 1× 1–2 mg přípravky s centrálním a periferním účinkem na receptory urapidil 2× 30–90 mg
*V současnosti nejsou v ČR dostupné.
■ Kombinace antihypertenziv
Dvojkombinace s indikacemi základních látek jsou uvedeny v tabulce 2.11. Nejvíce preferovanou kombinací jsou BKK a ACEI. Vychází to ze studií ASCOT, a především ACCOMPLISH. U kombinace sartanu s BKK nemáme data z prospektivní studie, ale předpokládá se podobný efekt. Kombinace ACEI/AT1-blokátor s diuretikem je vysoce účinná a lze ji použít například u hypertenze ve stáří nebo u diabetiků. Kombinace BKK a diuretika byla úspěšně použita v několika velkých studiích, např. COPE. V současné době nedoporučujeme kombinovat diuretikum a betablokátor v dvojkombinaci pro možnou kumulaci nežádoucích


metabolických účinků obou tříd. Současné podávání ACEI s AT1-blokátorem považujeme za kontraindikované, protože tato kombinace má vyšší riziko nežádoucích účinků léčby, jak ukázala studie ONTARGET. Další nevhodnou kombinací je podávání verapamilu nebo diltiazemu s betablokátorem, protože oba léky zvyšují riziko rozvoje AV bloku III. stupně. U těžké hypertenze je nutné podávat nejméně trojkombinaci, mnohdy i kombinaci 4–7 antihypertenziv. Tuto léčbu vyžaduje minimálně 20 % hypertoniků. Měla by být vyloučena sekundární hypertenze a pseudohypertenze. Vždy má být zastoupeno diuretikum. Za trojkombinaci s nejširším použitím je považováno podání ACEI/AT1-blokátoru, BKK a diuretika. Dostupné jsou fixní kombinace (RAS [renin-angiotensin system] blokátor, BKK a diuretikum), které mohou zlepšit adherenci k léčbě.
■ Přídatná léčba
■ Protidestičková léčba Protidestičková terapie (zejména kyselinou acetylsalicylovou v nízkých dávkách, 75–100 mg) je vhodná u pacientů s již prodělanou KV příhodou (pokud u nich nehrozí zvýšené riziko krvácivých komplikací), neboť bylo prokázáno, že snižuje riziko CMP a infarktu myokardu. Dříve předpokládaný příznivý vliv ASA v primární prevenci na snížení výskytu KV příhod se u populace hypertoniků neprokázal. Všeobecné podávání ASA by nemělo být součástí primární prevence. Jejím základem by mělo být příznivé ovlivnění všech ovlivnitelných rizikových faktorů KV onemocnění. U hypertoniků je vhodné zahájit podávání nízkých dávek ASA až po dosažení uspokojivé kontroly TK.
■ Hypolipidemická léčba
Statiny by měly být podávány hypertonikům s manifestní ICHS, ICHDK, DM, po proběhlé CMP, kdy pacienti jsou ve velmi vysokém riziku a obecným cílem je dosáhnout hodnoty LDL-cholesterolu pod 1,4 mmol/l, současně je třeba jej snížit alespoň o 50 % oproti výchozí hodnotě v případě extrémního KV rizika pod 1 mmol/l. U hypertoniků s vysokým KV rizikem podle tabulek SCORE je cílovou hodnotou LDL-cholesterol pod 1,8 mmol/l, současně je třeba jej snížit alespoň o 50 % oproti výchozí hodnotě. Vzhledem k lepší adherenci k léčbě je vhodné nasazení antihypertenzní a hypolipidemické léčby současně. Sekundární cílovou hodnotou lipidů je non-HDL-cholesterol nebo apo-B, který je sledován především u hypertoniků s vyšší hladinou triglyceridů (TG) nebo s aterogenní dyslipidemií (vyšší TG a/nebo nižší HDL-cholesterol). U těchto pacientů je vhodná kombinovaná hypolipidemická léčba.
■ Prevence
Podle výsledků velkých metaanalýz účinná léčba hypertenze významně přispívá ke snížení kardiovaskulární (o 16 %) a cerebrovaskulární mortality (až o 42 %). Léčba hypertenze příznivě ovlivňuje albuminurii a proteinurii u renálních komplikací esenciální hypertenze a u nemocných trpících diabetes mellitus zpomaluje pokles renálních funkcí.
■ Primární prevence
V primární prevenci arteriální hypertenze se uplatňuje dosažení ideální tělesné hmotnosti, omezení přívodu kalorií a tuků, omezení nadměrného přívodu sodíku a alkoholu, zvýšení fyzické aerobní aktivity. Zároveň intervenujeme i další rizikové faktory ICHS, např. kouření.
■ Sekundární prevence
Sekundární prevence spočívá v časném odhalení nemocných s existující hypertenzí (asi třetina pacientů o své hypertenzi neví). Lze toho dosáhnout nikoliv širokými populačními akcemi, ale měřením TK při každé návštěvě v ordinaci kteréhokoliv lékaře a měřením TK u rizikových skupin (potomci z hypertenzních rodin, diabetici).
■ Další postupy při léčebné prevenci
Pro zlepšení adherence/compliance pacientů prakticky k celoživotní léčbě přispívá edukace pacientů, domácí měření TK a používání dlouhodobě působících antihypertenziv, která jsou podávána jen jedenkrát denně a mají dostatečný účinek po celých 24 hodin. Mohou tak příznivě ovlivnit zvýšený vznik cerebrovaskulárních příhod v pozdních nočních hodinách a koronárních příhod v ranních hodinách. Lázeňská léčba má jen nespecifický účinek daný změnou denního režimu, stravování a fyzické aktivity.
2.2.5 Rezistentní hypertenze, adherence k léčbě
Za rezistentní označujeme takovou hypertenzi, kterou se ani při vhodně zvolené trojkombinaci antihypertenziv, obsahující diuretikum, v maximálně tolerovaných dávkách nepodaří zvládat, tj. snížit TK pod 140/90 mmHg. Nejčastěji se jedná o pseudorezistenci při špatné adherenci nemocného k léčbě. Pokud přidáme dvě různá synergicky působící antihypertenziva a nedojde k žádnému poklesu TK, pacient velmi pravděpodobně léčbu neužívá. Pro nespolupráci pacienta svědčí absence poklesu TF po nasazení betablokátoru. Nejjednodušším způsobem, jak odhalit špatnou adherenci pacienta k léčbě, je nahlédnutí do jeho lékového záznamu, zda si vybírá předepisovanou léčbu. Další možností je podání léku pod kontrolou. Nejspolehlivějším průkazem je stanovení léku v krvi nebo moči. Nezapomínáme provést také ambulantní monitorování TK, protože až třetina nemocných s domnělou rezistentní hypertenzí má průměrný TK za 24 hodin v normálním rozmezí. Rezistence je často spojena s diabetes mellitus (DM) 2. typu a obezitou. V dalším kroku bychom se měli zaměřit na případné sekundární příčiny hypertenze. Rezistence na léčbu je častá u pacientů s renoparenchymatózní hypertenzí. Proto každý hypertonik má mít stanovení sérového kreatininu a vyšetření močového nálezu. Problematičtější může být odhalení primárního hyperaldosteronismu, na který je třeba u mladších pacientů s hypertenzí nereagující na léčbu myslet a doplnit hormonální vyšetření. Při skutečné rezistenci klademe důraz na podávání diuretika v maximální tolerované dávce. Expanze volumu je totiž zdaleka nejčastější příčinou pravé rezistentní hypertenze. Mezi diuretiky preferujeme chlorthalidon a indapamid. Při nedostatečném účinku se osvědčuje posílení diuretické léčby přidáním malé dávky spironolaktonu. Při intoleranci spironolaktonu je vhodné použít eplerenon.
V posledních letech se objevily nefarmakologické postupy při léčbě rezistentní hypertenze. Jednak implantace přístroje, který aktivuje karotický baroreflex, kde problémem je invazivní charakter a denervace renálního sympatiku pomocí katétru v ledvinných tepnách. Zatím není využívána v rutinní praxi. Všechny nemocné, u nichž jsme nuceni podávat troj- a vícekombinaci, je vhodné podrobněji vyšetřit k vyloučení možnosti sekundární etiologie hypertenze ve specializovaných centrech. Přehled příčin vyvolávajících rezistentní hypertenzi uvádí tabulka 2.21
Tab. 2.21 Příčiny rezistentní hypertenze Příčiny obecně Specifikace příčin nízká adherence k léčbě sekundární hypertenze včetně léků zvyšujících krevní tlak, spánkové apnoe a bolesti lékové příčiny nízká dávka antihypertenziv nevhodné kombinace nezařazení diuretika do trojkombinace léky s krátkým účinkem vedlejší účinky léčby nežádoucí interakce léků
alkohol obezita
objemová expanze nadměrné solení renální insuficience s absencí diuretik
pseudohypertenze intenzivní vazokonstrikce Raynaudův syndrom arteriitidy
pseudorezistence hypertenze bílého pláště užití nesprávné (užší) šíře manžety tlakoměru
2.2.6
Hypertenze
bílého pláště
Jde o stav, kdy TK je zvýšený při měření v ordinaci (˃ 140/90 mmHg), ale normální při měření mimo zdravotnické zařízení. Za TK mimo ordinaci považujeme 24hodinový nebo denní průměr TK anebo domácí měření TK. Jedná se o častý jev, který se vyskytuje asi u třetiny osob s hypertenzí. Častěji se vyskytuje u žen a ve věku nad 50 let. Jedinci s hypertenzí bílého pláště mají vysoké riziko rozvoje trvalé hypertenze a také manifestního diabetu. KV riziko je zvýšeno. V léčbě postupujeme empiricky, k léčbě se uchylujeme u nemocného s vyšším KV rizikem, které je dané metabolickými odchylkami nebo přítomností orgánového poškození.
2.2.7 Maskovaná hypertenze
Je opačný jev než hypertenze bílého pláště. Je definována jako normální TK v ordinaci a patologický TK mimo ni. Prevalence je kolem 13–16 %. Maskovaná hypertenze je výrazně častější u mužů, zejména v mladším věku. Typické
je kouření, metabolické odchylky a TK měřený v ordinaci v pásmu vysokého normálního tlaku a také u diabetiků. Jasně se prokázalo, že prognóza je spojena s vysokým KV rizikem příhod, shodným s trvalou hypertenzí. Proto farmakologická léčba je prospěšná.
2.2.8 Hypertenzní krize
Hypertenzní krize je akutní stav spojený s náhlým zvýšením TK (sTK často > 210 mmHg a dTK > 130 mmHg – absolutní výška TK však není rozhodující pro definici hypertenzní krize, důležitý je vzestup TK). Jako emergentní označujeme hypertenzní krizi s poškozením či selháním životně důležitých orgánů. Postižen může být centrální nervový systém, kardiovaskulární aparát a ledviny.
2.2.9 Emergentní stavy
Emergentní stavy představuje hypertenze provázená:
• hypertenzní encefalopatií,
• akutní CMP, intrakraniálním či subarachnoidálním krvácením,
• akutním srdečním selháním,
• akutním infarktem myokardu či nestabilní anginou pectoris,
• aortální disekcí,
• hypertenzní krizí při akutní glomerulonefritidě či systémových onemocněních,
• adrenergní krizí u feochromocytomu,
• eklampsií,
• předávkováním kokainem, amfetaminem či halucinogeny,
• úrazy hlavy,
• dále perioperační hypertenze.
Při emergentních stavech jsou nemocní bezprostředně ohroženi na životě a tyto situace vyžadují hospitalizaci na JIP nebo koronárních jednotkách s monitorací základních životních funkcí. Je preferováno přímé měření TK. Parenterální podávání antihypertenziv je nutné pro rychlý a předvídatelný nástup účinku. Přesné titrování dávky je snazší u léků s krátkým účinkem. Takto vedená léčba snižuje riziko prudkých nekontrolovatelných poklesů TK, které mohou vést ke katastrofickým následkům, např. v podobě iatrogenně vyvolané CMP. Výběr jednotlivých druhů antihypertenziv je podmíněn základním onemocněním, které hypertenzní krizi vyvolalo nebo ji doprovází.
Jako urgentní označujeme hypertenzní krizi, při které zatím nedošlo k poškození cílových orgánů, potíže nemocných jsou dané jen vysokou hodnotou TK.
Urgentní stavy:
• hypertenze spojená s chronickým levostranným srdečním selháním,
• hypertenze spojená s nestabilní anginou pectoris,
• postoperační hypertenze,
• hypertenze po transplantaci ledvin,
• hypertenze při preeklampsii,
• hypertenze u rozsáhlých popálenin.
Urgentní situace lze léčit na běžném oddělení nebo i ambulantně při zajištění pravidelné klinické kontroly.
2.2.9.1 Léčba emergentních stavů
Základním léčebným postupem je u hypertenzní krize snížení TK. Cílové snížení TK (kromě disekce aorty) by mělo v průběhu první hodiny představovat 20–25 % výchozích hodnot, v dalších 2–6 hodinách se snažíme dosáhnout cílových hodnot TK 160–150/110–100 mmHg. Po stabilizaci stavu postupně zahajujeme perorální léčbu s postupným vysazením intravenózních léků. Mezi nejčastější emergentní situace spojené s hypertenzí patří hypertenzní krize s akutním levostranným srdečním selháním nebo akutním koronárním syndromem. Hypertenzi při akutním levostranném srdečním selhání léčíme parenterálními nitráty a furosemidem, zcela výjimečně musíme sáhnout po enalaprilu. U hypertenzní krize doprovázející akutní koronární syndrom podáváme nitráty podle potřeby v kombinaci s esmololem či jinými betablokátory, ev. s urapidilem. U disekce aorty je nutné co nejrychleji snížit TK (během 20 minut). Systolický TK má být snížen pod 100–120 mmHg a srdeční frekvence pod 60/min i při vědomí rizika snížení prokrvení CNS. Limitováni v léčbě jsme až neurologickými symptomy, Podáváme nitráty v kombinaci s betablokátory a ev. dalšími parenterálními antihypertenzivy. U ischemické CMP dochází v prvních dnech ke zvýšení TK, který po několika dnech může klesat spontánně na původní hodnoty. Příliš intenzivní snížení TK v této fázi může být škodlivé pro porušení autoregulační rovnováhy a snížení průtoku krve v okolí ischemického ložiska. Nemáme k dispozici jednoznačný důkaz o prospěšnosti aktivního snížení TK v prvních 3–5 dnech. Pokud to klinický stav dovolí, je vhodné již zavedenou antihypertenzní léčbu nasadit znovu asi 24 hodin od začátku cévní mozkové příhody. Pokud nejsou hodnoty TK výrazně zvýšené (˃ 220 mmHg sTK a/nebo 120 mmHg dTK) a pokud CMP není provázena dalšími závažnými stavy, jako jsou aortální disekce, srdeční selhání nebo akutní koronární syndrom, můžeme s nasazením akutní hypertenzní léčby vyčkat. Je-li plánována trombolýza, je nutno snížit před jejím zahájením TK pod hodnotu 180/110 mmHg a dále ho udržovat pod touto hodnotou. V tomto případě volíme parenterální léčbu, v našich podmínkách s ohledem na dostupnost urapidil, jehož nevýhodou je možný sedativní efekt ve vyšších dávkách. U mozkového krvácení snižujeme TK na hodnoty sTK v rozmezí 140–170 mmHg stejnými léky jako u ischemické CMP. Lepší vyhlídky pak mají pacienti, u nichž se podaří dosáhnout vyššího poklesu TK. Nimodipin je vhodný při subarachnoidálním krvácení, protože brání reflexním spasmům mozkových cév. U hypertenzní encefalopatie je lékem volby urapidil, většinou však extrémní hodnoty vyžadují podávání kombinace parenterálních léčiv. Při feochromocytomové krizi se snažíme zablokovat alfareceptory a navodit systémovou vazodilataci (neselektivní alfa-blokádou fentolaminem). S ohledem na nedostupnost tohoto léku v ČR můžeme použít urapidil nebo nitráty.
Podstatně častější než emergentní stavy jsou situace, kdy vidíme pacienta s výrazným vzestupem TK bez klinických projevů progredujícího akutního postižení cílových orgánů. Jedná se o pestrou směs klinických situací, pro kterou se
v literatuře často používá termín hypertenzní urgentní stavy. Rozhodující je, že tito nemocní nejsou v bezprostředním ohrožení života a neexistuje průkaz, že by jim akutní snížení TK v řádu minut až hodin prospělo. Jsou naopak více ohroženi překotnou léčbou, která může pacienta ohrozit v důsledku hypoperfuze cílových orgánů. Největším rizikem je vznik CMP při prudkém poklesu TK. Nejčastější příčinou vzestupu TK bez progredujícího akutního postižení cílových orgánů je vynechání medikace nebo se jedná o reaktivní vzestup TK (bolest hlavy, velký stres, panická ataka). Proto většinou vystačíme s perorální anxiolytickou léčbou, někdy spolu s posílením chronické antihypertenzní léčby. Tyto stavy lze v drtivé většině případů zvládnout ambulantně. Důležité je nalezení příčiny vedoucí ke vzestupu TK. Před zahájením jakékoliv antihypertenzní terapie je nutné opakované měření TK spolu se zklidněním pacienta a zaléčením vyvolávající příčiny. Pokud máme pochyby u pacienta s extrémní hodnotou TK a nejasnými podezřelými obtížemi, pomůže ve stratifikaci rizika nejvíce vyšetření očního pozadí. Dále můžeme využít EKG a základní laboratorní vyšetření (krevní obraz, kreatinin, Na, K, močový nález). Pacient, který má normální základní laboratorní parametry, na EKG nejsou známky hypertrofie se zatížením levé komory srdeční a na očním pozadí má nález maximálně změn 2. stupně, není jistě bezprostředně ohrožen hypertenzí. Parenterální antihypertenziva uvádí tabulka 2.22
Tab. 2.22 Parenterální antihypertenziva používaná při emergentních stavech (léky dostupné v ČR)
Furosemid bolus 20–40 mg, možno podat dalších 20–40 mg za 30–60 min
Labetalol bolus 50 mg i.v., bolusově maximální dávka za den 200 mg
gravidita: počáteční infuze 20 mg/h, zvyšování po 30 min o dvojnásobek, při absenci efektu do maximální dávky 160 mg/h
hypertenze z jiných příčin: infuze rychlostí 2 mg/min
Metoprolol 1,25–5 mg i.v. bolus, pak 2,5–15 mg každých 3–6 h
Esmolol 250–500 µg/kg bolus během minuty, pak 25–300 µg/kg kontinuálně
Nitroglycerin 0,75–10 mg/h
Isosorbiddinitrát 1–10 mg/h
Enalaprilát bolus (0,5) 1,25 mg, dále 1,25–5 mg/den
Urapidil bolus (10) 25–50 mg, 5–40 mg/h, v průměru 9 mg/h
Nimodipin (0,5) 1 mg/h, při dobré toleranci 2 mg/h jen na mimořádný dovoz
Nitroprusid 0,25–10 µg/kg/min (renální insuficience, aortální disekce)
2.2.10 Sekundární hypertenze
Sekundární hypertenze není příliš častá (asi 5–10 % všech hypertoniků). Výskyt sekundární hypertenze je větší u těžké
hypertenze, zvláště v dětském věku. Je definována jako zvýšení TK na podkladě známé, prokazatelné příčiny. Z praktického hlediska je důležité, že u části nemocných po odstranění vyvolávající příčiny vymizí i zvýšené hodnoty TK. U esenciální hypertenze je léčba většinou trvalá.
2.2.11 Parenchymatózní renální hypertenze
Tato skupina představuje heterogenní skupinu chorob nejrůznější geneze projevujících se unilaterálním nebo bilaterálním postižením. Přítomnost a tíže hypertenze kolísá v závislosti na typu postižení a úrovni renální funkce. Zvýšený TK bývá častější u chronických onemocnění, i když ani u akutních stavů (akutní glomerulonefritidy) není výjimkou. Nejčastějším onemocněním vedoucím k hypertenzi jsou glomerulopatie: primární glomerulonefritidy, sekundární glomerulopatie (diabetická nefropatie, amyloidóza, systémové vaskulitidy). Z primárních glomerulopatií se hypertenze vyskytuje u membranoproliferativní glomerulonefritidy (80–90 %). U sekundární nefropatie typu diabetická nefropatie se vyskytuje asi v 80 % případů. U polycystózy ledvin se hypertenze pozoruje u 60 % všech případů. Mezi další možné příčiny renoparenchymové hypertenze řadíme chronické tubulointersticiální nefritidy. Cílové hodnoty TK by měly být pod 130/80 mmHg. Léčba jednotlivých typů postižení bývá komplexní (dieta, farmakologické přístupy, ev. hemodialýza či peritoneální dialýza) v závislosti na úrovni renální funkce a sodíkové homeostázy. Volba a dávkování jednotlivých antihypertenziv by měly přihlížet ke způsobu eliminace farmak (nejčastěji se používají ACEI nebo AT1-blokátory, ev. v kombinaci s BKK či diuretiky), v případě nadále nedostatečné kontroly TK přidáváme betablokátor nebo centrálně působící antihypertenziva.
2.2.12 Renovaskulární hypertenze
Renovaskulární hypertenze (RVH) patří mezi nejčastější formy sekundární hypertenze s udávanou prevalencí kolem 2–3 % všech forem vysokého TK. Příčinou bývá aterosklerotické postižení (vyšší věk), fibromuskulární dysplazie (častěji ženy mladšího věku). Jiné příčiny jsou vzácné (aneurysma, embolie, arteriitida, hypoplazie aj.). Zvýšení TK je způsobeno ischemií jedné nebo obou (při bilaterálním postižení) ledvin s následnou nadprodukcí reninu a angiotenzinu II. Za signifikantní se pokládají stenózy hlavních větví arteria renalis nad 70 % nebo více než 50% zúžení cévního lumen s poststenotickou dilatací. Renovaskulární onemocnění (RVO) znamená pouze nález jakékoliv stenózy tepny, RVO tak v případě mírnějšího cévního postižení nemusí vést ke zvýšení krevního tlaku. RVO je v klinické praxi mnohem častější než RVH. Nejčastější příčinou stenózy a. renalis je v 90 % ateroskleróza. Zbylých 10 % tvoří fibromuskulární dysplazie, vyskytující se častěji u dětí a žen pod 50 roků. V diagnostice využíváme dopplerovské vyšetření renálních tepen. Lze rovněž provést kaptoprilovou scintigrafii. V případě pozitivity těchto vyšetření využíváme CT nebo MR angiografii. V léčbě se uplatňují tři přístupy – farmakologický, perkutánní transluminální renální angioplastika (PTRA) se stenty nebo bez nich a chirurgický (aortorenální bypass, ev. i náhrada aorty). Farmakologická léčba se opírá
o použití ACEI/AT1-blokátorů, event. v kombinaci s diuretiky. Podávání blokátorů systému RAAS (renin-angiotenzin-aldosteronový systém) může zejména u bilaterálních stenóz vést ke zhoršení renálních funkcí a k hyperkalemii. U bilaterálních stenóz je proto podávání blokátorů RAAS kontraindikováno. V současné době nejsou přesvědčivé důkazy o výhodách PTRA u aterosklerotických lézí ve srovnání s farmakologickou léčbou. U fibromuskulárních lézí se provádí PTRA i bez stentů.
2.2.13 Endokrinní hypertenze
Jsou zapříčiněny nadprodukcí některého z presorických humorálních působků. Patří sem vzácný primární reninismus při nadprodukci reninu nádorem z juxtaglomerulárního aparátu ledvin (Kiharův–Robertsonův syndrom), dále primární hyperaldosteronismus, hyperkortisolismus, feochromocytom. Celkový počet těchto endokrinních hypertenzí nepřevyšuje 1–2 % celé populace hypertoniků. Mají charakteristické klinické a laboratorní příznaky a vyžadují specifickou terapii ve specializovaných poradnách.
2.2.14 Primární hyperaldosteronismus
Primární hyperaldosteronismus (PH) je nejčastější příčina sekundární hypertenze, vyvolaná autonomní nadprodukcí mineralokortikoidů (aldosteronu) kůrou nadledvin, s vysokou hladinou aldosteronu a potlačeným reninem a arteriální hypertenzí. Klinický obraz PH kromě hypertenze je velmi chudý. PH vede často k orgánovým komplikacím typu hypertrofie levé komory srdeční, cévnímu poškození při fibroproliferativním působení aldosteronu, arytmiím, k cévním mozkovým příhodám či infarktu myokardu. Za základní diagnostické vyšetření je považován nález snížené plazmatické reninové aktivity nebo plazmatického reninu, zvýšení plazmatického aldosteronu a zvýšení poměru aldosteron/renin nad 40–50 vyjádřený v (ng/100 ml/)/(mg/ml/h) v séru. Nejcitlivější screeningový marker PH je poměr aldosteron/renin. Nutná je také přítomnost alespoň zvýšeného aldosteronu a přítomnost non-supresibility aldosteronu v konfirmačních testech. Hodnoty plazmatického aldosteronu po supresi 2 litry infuze fyziologického roztoku podaného během 4 hodin nad 75 pg/ml potvrzují PH. Morfologická diagnostika je možná pomocí CT nebo MR. Za nejcitlivější metodu, která může přesně odlišit unilaterální nadprodukci aldosteronu od bilaterální, se pokládá katetrizace nadledvin se separovanými odběry aldosteronu a kortisolu. Léčba u jednostranné nadprodukce aldosteronu se provádí laparoskopickou adrenalektomií. Před operací je vhodné normalizovat TK a event. přítomnou hypokalemii podáváním spironolaktonu v dávce 50–75 mg/den po dobu alespoň čtyř týdnů. Kombinovat je někdy třeba s thiazidovými diuretiky nebo BKK. V případě oboustranné nadprodukce se využívá celoživotní léčba spironolaktonem. Při vedlejších účincích (gynekomastie, poruchy menstruace) je možno využít eplerenon a nově finerenon.


2.2.15 Hyperkortisolismus
(Cushingův syndrom)
Hyperkortisolismus je onemocnění charakterizované autonomní nadprodukcí kortisolu v důsledku různých poruch osy hypotalamus-hypofýza-nadledviny. Klinické známky hyperkortisolismu jsou arteriální hypertenze, centrální obezita, měsíčkový obličej, fialové strie, osteoporóza, svalová slabost, úzkost, deprese, poruchy menstruace, impotence, porucha glukózové tolerance až diabetes mellitus. Nejvhodnějším screeningovým testem je stanovení volného kortisolu ve slinách, moči anebo zkrácený dexametazonový test. V typických případech je 3–4násobné zvýšení volného kortisolu v moči. Dexametazonový test se provádí jednorázovým podáním 1–2 mg dexametazonu kolem 23. hodiny a změřením plazmatického kortisolu druhý den ráno. Hodnoty nad 200 mmol/l jsou vysoce senzitivní. Přínosné je stanovení plazmatického ACTH (adrenokortikotropní hormon). Morfologicky můžeme zobrazit hypofýzu magnetickou rezonancí, zobrazení nadledvin pomocí CT nebo MR. Při postižení hypofýzy se provádí transfenoidální nebo transfrontální resekce. V případě postižení nadledvin lze provést unilaterální adrenalektomii. Radiace hypofýzy se provádí Leksellovým gama nožem u inoperabilních či recidivujících mikroadenomů. Farmakologická léčba má za cíl potlačit steroidogenezi. Používá se kombinace neuromodulační terapie (agonisté dopaminu) a adrenolytická léčba. Farmakologická léčba hypertenze u Cushingova syndromu využívá thiazidová diuretika v kombinaci se spironolaktonem.
2.2.16 Feochromocytom a paragangliom
Feochromocytom je relativně vzácný nádor chromafinní tkáně, který je lokalizován adrenálně (80 %), méně často extraadrenálně (20 %). Paragangliomy (PPGL) jsou buď extraadrenální nádory vycházející z chromafinních buněk sympatiku, anebo pocházejí z parasympatického nervového systému (hlava a krk) a pak jsou vždy hormonálně inaktivní. Nejčastější lokalizací extraadrenálních feochromocytomů (paragangliomů) je krk a paraaortální oblast dutiny břišní. Kritériem pro malignitu je nález metastáz. Etiologie a patogeneze vzniku nejsou do detailů známé. PPGL vede k patologické nadprodukci noradrenalinu (NA) nebo adrenalinu (A), vzácněji i dopaminu. Časté jsou smíšené formy produkující jak NA, tak i A. Klinický obraz je charakterizován změnami krevního tlaku, bolestí hlavy, pocením, palpitacemi, mohou být arytmie, zblednutí, flush, tremor, úzkost, dušnost, hmotnostní úbytek, porucha glukózové tolerance, diabetes mellitus. Asi v 10 % nemusí být žádné symptomy. Nejcitlivější metodou průkazu PPGL je stanovení volných plazmatických metanefrinů. Stanovení volných frakcionovaných metanefrinů anebo volných katecholaminů v moči má o něco nižší diagnostickou výtěžnost. Stanovení plazmatických katecholaminů je ovlivněno velkou variabilitou hladin v cirkulaci. Stanovení kyseliny vanilmandlové v moči je zatíženo nižší senzitivitou. Bylo již popsáno více než 20 genů, které mohou být zodpovědné za vznik PPGL. Morfologická diagnostika spočívá v průkazu zvětšení nadledviny či extraadrenální sympatické tkáně. Využívá se CT břicha a malé pánve. Je preferována i pozitronová emisní tomografie (PET). V léčbě je použita laparoskopická
adrenalektomie nebo exstirpace extraadrenálně uloženého tumoru. Předoperační příprava zahrnuje alespoň 10–14denní podávání blokátorů periferních alfa-adrenergních receptorů s následnou aplikací betablokátorů v druhé době, zejména při sklonu k tachykardii. Používá se doxazosin nebo terazosin. Z betablokátorů dáváme přednost kardioselektivním bez ISA (intrinsic sympathomimetic activity).
2.2.17 Hypertenze u syndromu spánkové apnoe
Syndrom spánkové apnoe (SSA) je definován jako výskyt alespoň pěti epizod apnoe-hypopnoe trvající 10 vteřin a více za 1 hodinu spánku, s následnou denní hypersomnolencí. Výskyt v neselektované populaci je 4 % u mužů a 2 % u žen, častěji u osob s obezitou. Přesná diagnostika se provádí pomocí polysomnografie – simultánní měření respirace, EEG (elektroencefalografie), EMG (elektromyografie), EKG, elektrookulogramu, TK a pO2 během spánku. Prevalence hypertenze u SSA je kolem 50 %. Hypertenze vzniká pravděpodobně při opakované epizodě hypoxemie s aktivací vazomotorických center a vzestupem sympatické nervové aktivity. Syndrom je nejčastěji způsoben obstrukcí horních cest dýchacích. Prakticky všichni nemocní chrápou, ale všichni nemají SSA. Léčbou je aplikace přístroje udržujícího kontinuálně pozitivní tlak v horních cestách dýchacích – CPAP.
2.2.18 Hypertenze vyvolané podáváním léků
Nejčastějšími formami této hypertenze je zvýšení TK po farmakologických dávkách glukokortikoidů a po steroidních kontraceptivech, která obsahují vysoké koncentrace estrogenů. Výskyt hypertenze po steroidních kontraceptivech se udává mezi 0–20 % v závislosti na sledovaném souboru a druhu užitých kontraceptiv. Po vysazení kontraceptiv se TK většinou normalizuje. Pro manifestní hypertoničky je steroidní antikoncepce nevhodná, protože po ní byla popsána těžká zhoršení až maligní zvraty. Rovněž nesteroidní antirevmatika mohou podporovat další vzestup TK a rezistenci na antihypertenziva.
2.2.19 Koarktace aorty
Je provázena hypertenzí na horní polovině těla. Hypertenze je způsobena zúžením aorty v oblasti jejího oblouku. Nacházíme velkou tlakovou diferenci mezi TK na horních a dolních končetinách, systolický šelest na srdeční bázi a na zádech interskapulárně. Na hrudníku bývá patrná uzurace žeber rozšířenými mezižeberními arteriemi. Léčba je chirurgická, pokud možno v dětském věku, lze provést i balonkovou plastiku.
2.2.20 Méně časté příčiny sekundární hypertenze
Na další, méně časté příčiny sekundární hypertenze musíme myslet zejména u nemocných s rezistencí k léčbě: endokrinní
(hypertyreoidismus, hyperparatyreoidismus, akromegalie), neurogenní (mozkové nádory, kvadruplegie, trauma hlavy), akutní stres (psychogenní hyperventilace, operace), polycytemie, časté transfuze krve, transplantace kostní dřeně, transplantace orgánů.
2.2.21 Hypertenze ve speciálních situacích
2.2.21.1 Juvenilní hypertenze
Za juvenilní hypertenzi považujeme vysoký TK ve věku do 35 let. Její výskyt se zvyšuje, zřejmě kvůli nárůstu obezity. Mladší jedinci mají menší znalost této diagnózy, nižší dlouhodobou perzistenci k léčbě a horší kontrolu hypertenze. KV riziko stoupá s výší krevního tlaku. Na rozdíl od starších hypertoniků je diastolický TK lepším prediktorem úmrtnosti než systolický TK, nejnižší riziko má mírná izolovaná systolická hypertenze. U mladších osob je také častější výskyt sekundární hypertenze, proto je namístě zvážit vyšetření k jejímu vyloučení. I přes absenci speciálních terapeutických studií doporučujeme na základě metaanalýz léčit juvenilní hypertenzi antihypertenzivy, pokud jejich TK opakovaně přesahuje hranici 140/90 mmHg, protože léčba zabrání rozvoji těžké hypertenze. Zahájení léčby je zejména vhodné u žen s anamnézou hypertenze v těhotenství nebo u osob s pozitivní rodinnou anamnézou časných komplikací. U jedinců s výraznou aktivací sympatického nervového systému, projevující se vyšší tepovou frekvencí, vyšším tepovým objemem, případně neurovegetativní symptomatologií, je vhodné zvážit léčbu malou dávkou betablokátoru.
2.2.21.2 Léčba hypertenze u osob ve vyšším věku
Ještě v osmdesátých letech 20. století panovaly u některých lékařů obavy z toho, že antihypertenzní léčba může zhoršit prognózu hypertenze starších osob. Na základě výsledků mnoha studií je prokázáno, že z léčby vysokého krevního tlaku mají prospěch v podobě snížené kardiovaskulární morbidity a mortality i pacienti ve vyšším věku, a to bez ohledu na to, zda trpí systolicko-diastolickou nebo izolovanou systolickou hypertenzí. Léčba hypertenze ve stáří snižuje oproti jiným věkovým skupinám nejvýrazněji absolutní počet KV příhod. Antihypertenzní léčba je indikována i v nejvyšších věkových kategoriích, tj. ve věku 80 let a vyšším, jak ukázala studie HYVET. Do této studie, jediné svého druhu, byli zařazeni nemocní se systolickým TK > 160 mmHg; proto nemáme důkaz o prospěšnosti léčby u osob této věkové kategorie, jejichž TK v ordinaci se pohybuje v pásmu hypertenze 1. stupně. U těchto nemocných má být léčba zvažována individuálně s přihlédnutím ke komorbiditám a k hodnotám TK měřeným mimo ordinaci. Pokud je léčba již zavedena, vysoký věk sám o sobě není důvodem k vysazení léčby. Při zahajování antihypertenzní léčby u pacientů ve vyšším věku začínáme malou dávkou, TK snižujeme pomalu, ne více než o 10 mmHg za měsíc, používáme zásadně léky působící 24 hodin, snažíme se omezit počet tablet na minimum, pečlivě sledujeme nežádoucí účinky, především u „křehkých“ osob. U řady starších hypertoniků se současně vyskytují i další rizikové faktory a poškození cílových
orgánů, jimž je nezbytné antihypertenzní léčbu přizpůsobit. Je nutné také měřit TK vestoje, zejména u osob s možnými příznaky ortostatické hypotenze. Za cílový TK v ordinaci obecně považujeme hodnoty kolem 130/80 mmHg, stejně jako u mladších jedinců je pravděpodobné, že cílového TK dosáhneme u většiny nemocných teprve v delším časovém horizontu. Často je však obtížné dosáhnout tohoto cíle, a musíme se pak spokojit se snížením systolického TK pod 140/90 mmHg. Z lékových skupin preferujeme BKK, thiazidům podobná diuretika (indapamid, chlorthalidon) a ACEI/AT1-blokátory. Betablokátory ve stáří mají nižší účinnost ve snížení TK a v prevenci CMP, naproti tomu jsou prospěšné v sekundární prevenci ICHS a při chronickém srdečním selhání.
2.2.21.3 Obezita a metabolický syndrom
Výskyt obezity stoupá v populaci, a především viscerální obezita v kombinaci s hypertenzí představuje vysoké kardiovaskulární riziko. U obézního hypertonika existují problémy související s měřením TK (na silnou kónickou paži se hůře umísťuje i velká manžeta), má několik komorbidit, je léčen řadou léků a hypertenze je velmi často rezistentní. Základem léčby je intenzivní nefarmakologická terapie se snížením hmotnosti a zákazem kouření. Základem farmakoterapie hypertenze je léčba buď ACEI, nebo AT1-blokátory, které dokážou nejen snížit TK, ale i zlepšit inzulinovou rezistenci a oddálit rozvoj diabetu. Do kombinace jsou vhodné BKK, a pokud to nestačí, pak i thiazidy/thiazidům podobná diuretika. Verapamil je vhodný do kombinace s ACEI u pacientů s vyšší tepovou frekvencí, amlodipin nebo jiné dihydropyridiny s dlouhodobým účinkem u pacientů bez zvýšené aktivity sympatiku. TK obézních hypertoniků velmi dobře reaguje na přidání spironolaktonu k základní trojkombinaci antihypertenziv (RAS blokátor, BKK, diuretika). Nemocní s metabolickým syndromem mají vysoké KV riziko, 2–3krát pro aterosklerotická KVO a 5krát vyšší riziko rozvoje diabetu. Mají častá doprovodná onemocnění a časté poškození cílových orgánů. Je nutná intervence dalších rizikových faktorů, především dyslipidemie, kde jsou lékem první volby statiny, dále léčba diabetu. Významné je snížení nadměrné tělesné hmotnosti, pokud nestačí nefarmakologická opatření, zvažujeme podávání antiobezitik.
2.2.21.4
Hypertenze a diabetes
Hypertenze se vyskytuje u diabetiků častěji než v běžné populaci a výrazně zvyšuje riziko KV komplikací. Současný výskyt hypertenze a diabetu narůstá s věkem. Nefarmakologická opatření jsou vhodná zejména u DM 2. typu, zvláště trvalé snížení hmotnosti a příjmu sodíku. Antihypertenzní léčba je vhodná nejen u hypertenze, ale i při vysokém normálním TK. Za rozumné považujeme dosáhnout cílového TK v ordinaci kolem 130/80 mmHg. U pacientů s DM a CMP i níže, ne však pod 120/70 mmHg. U starších pacientů podle jejich individuální tolerance. Lékem první volby je blokáda systému RAS, často je nutná kombinační terapie, v dvojkombinaci preferujeme kombinaci blokátoru RAS s BKK. Albuminurie, ev. proteinurie, je vždy indikací k terapii ACEI nebo AT1-blokátory i u diabetiků bez hypertenze.


U diabetiků s ohledem na vysoké KV riziko provádíme komplexní intervenci všech rizikových faktorů včetně podávání statinů. Zásadní je dobrá kontrola diabetu, neboť se daří lépe kontrolovat TK a je nižší riziko rozvoje hlavně mikrovaskulárních komplikací. V kombinační antidiabetické léčbě u DM 2. typu s hypertenzí je vhodné zvážit podávání gliflozinů vzhledem k jejich významnému antihypertenznímu, kardioprotektivnímu a renoprotektivnímu účinku.
2.2.21.5 Hypertenze s přítomností ischemické choroby srdeční a srdečního selhání
Vysoký TK významně ovlivňuje riziko opakované CMP u pacientů s ICHS. Hypertenze se také často objevuje v anamnéze nebo hraje důležitou roli u pacientů s městnavým srdečním selháním (SS). U nemocných po infarktu myokardu časné podávání kardioselektivních betablokátorů, inhibitorů ACE nebo AT1-blokátorů snižuje riziko recidivy IM, úmrtí a rozvoje srdečního selhání. To může být dáno specifickými vlastnostmi léků nebo vlastním snížením TK. U pacientů s chronickou ICHS a se syndromem anginy pectoris používáme v léčbě hypertenze především betablokátory a dlouhodobě působící BKK. Nemocní s potvrzenou ICHS by měli mít blokátory R AS (ACEI nebo AT1-inhibitory). Téměř dvě třetiny pacientů se SS mají v předešlé anamnéze hypertenzi. Základem léčby je ovlivnění systému renin-angiotenzin-aldosteron pomocí inhibitorů ACE nebo duální inhibitor neprilysinu a AT1 - receptoru sakubitril/valsartan (ARNI), betablokátory a mineralokortikoidní blokátory (MRA), případně diuretika. Do základní léčby srdečního selhání jsou nově doporučeny blokátory SGLT2 (sodíko-glukózový kotrans portér 2) – dapagliflozin nebo empagliflozin. Tyto léky zlepšují prognózu a snižují tíži symptomů. Měla by být snaha titrovat je do maximálních dávek. Úprava životního stylu, jako je snížení hmotnosti, snížený příjem sodíku a přiměřené zvýšení fyzické aktivity, je doplňkovým opatřením. Pokud je nutné další snížení TK, při absenci známek přetížení tekutinami se ukázaly amlodipin a felodipin u srdečního selhání jako bezpečné a lze je zvážit. Diltiazem a verapamil a centrálně působící látky, jako je moxonidin, jsou kontraindikovány, protože jsou spojeny s horšími výsledky. Alfablokátory nemají žádný vliv na přežití, proto nejsou indikovány. Cílové hodnoty krevního tlaku jsou nejisté jak u srdečního selhání se sníženou ejekční frakcí (HFrEF), tak u srdečního selhání se zachovalou EF (HFpEF). Hodnocení věku pacienta a komorbidit (tj. diabetes, onemocnění ledvin, ICHS, cévní mozková příhoda) však může být užitečné pro individuální cílový TK. Mělo by být vynaloženo veškeré úsilí k dosažení cílových dávek léků založených na důkazech u pacientů s HFrEF, i přes mírnou hypotenzi. Naopak u pacientů s HFpEF, s HLK (hypertrofie levé komory srdeční) a omezenou rezervou před zatížením je třeba se hypotenzi vyhnout a snažit se TK udržovat pod 140/90 mmHg, avšak nikoliv pod 120/70 mmHg.
2.2.21.6 Fibrilace síní
Hypertenze, a zejména vysoká hodnota pulzního TK je nejvýznamnějším rizikovým faktorem pro vznik fibrilace
síní. Tato arytmie podstatně zvyšuje riziko kardiovaskulární morbidity a mortality, zvláště v případě embolizační CMP. Měření TK u fibrilace síní je méně přesné a měli bychom vždy provést několik měření. Správná kontrola TK je důležitá u nemocných s chronickou antikoagulační léčbou s ohledem na snížení rizika intracerebrálního a extracerebrálního krvácení. Nižší výskyt nově vzniklé fibrilace síní či jejich recidiv byl popsán při dlouhodobé léčbě AT1- blokátory nebo ACEI, případně betablokátory, především u pacientů po IM a se srdečním selháním. U permanentní fibrilace síní jsou preferovány léky, které zároveň kontrolují frekvenci, buď betablokátory, nebo verapamil.
2.2.21.7 Hypertenze a cerebrovaskulární onemocnění
Hypertenze je nejzávažnějším rizikovým faktorem vzniku první CMP. Mezi další rizikové faktory patří kouření, hypercholesterolemie, diabetes, nadměrný příjem alkoholu a fibrilace síní. Pokles výskytu CMP je nejvýznamnějším výsledkem dlouhodobé antihypertenzní léčby. Ve všech randomizovaných studiích klesá výskyt CMP tím více, čím více je snížen TK, a je pozorován ve všech terapeutických režimech. Metaanalýzy srovnávající jednotlivé skupiny antihypertenziv ukazují, že BKK jsou mírně účinnější, ale tento efekt je vyvážen mírným nárůstem srdečního selhání; betablokátory jsou méně účinné. Antihypertenzní léčba zpomaluje rozvoj kognitivních poruch, nejvíce důkazů je pro dihydropyridinové BKK, zejména pro nitrendipin. Data také existují pro ACEI a AT1-blokátory.
2.2.21.8 Hypertenze a snížená funkce ledvin
V iniciálních fázích esenciální hypertenze se často zjišťuje renální vazokonstrikce, která je při podávání BKK a ACEI reverzibilní. V pokročilých stadiích onemocnění se renální cévní rezistence v důsledku strukturálních lézí ledvinných cév (nefrosklerózy) trvale zvyšuje. Nemocní s poruchou renálních funkcí mají vysoké riziko KV příhod, které stoupá s proteinurií a poklesem glomerulární filtrace. Cílem léčby je nejen snížení TK, ale i snížení albuminurie, ev. proteinurie a zpomalení progrese renální insuficience. Vzhledem k vysokému KV riziku je nutné i ovlivnění všech KV rizikových faktorů. Lékem první volby jsou blokátory RAS (ACEI nebo AT1-blokátory). Léčba ACEI nebo AT1-blokátory je využívána ve všech stadiích chronické renální insuficience včetně nemocných v chronickém dialyzačním programu a je také indikována u normotenzních pacientů s proteinurií > 1 g/24 h. U pokročilých stavů je zapotřebí začít léčbu nízkými dávkami a zvyšovat dávky pozvolna, protože při zahájení léčby může dojít k přechodnému zhoršení renálních funkcí a zvýšení hladiny kalia. Dávkování RAS blokátorů přizpůsobujeme úrovni GF. Při nedostatečné kontrole hypertenze u pacientů s chronickým onemocněním ledvin doporučujeme přidat k blokátorům R AS nejprve BKK a teprve v další linii diuretika. Při glomerulární filtraci < 0,5 ml/s/1,73 m2 jsou preferována kličková diuretika, u jinak nezvladatelné hypertenze mohou mít aditivní efekt i thiazidy/thiazidový analog.
2.2.21.9 Hypertenze a chronická obstrukční plicní nemoc
Hypertenze a CHOPN spolu velice často souvisí. Cílové hodnoty TK jsou stejné jako u osob bez CHOPN. V léčbě preferujeme nefarmakologická opatření, zejména zákaz kouření a redukci tělesné hmotnosti. V léčbě jsou doporučovány AT1-blokátory a blokátory kalciových kanálů, v případě závažné hypertenze je možné podávat i diuretika. Betablokátory s vysokou kardioselektivitou je možno podávat ve specifických situacích, jako je ICHS nebo srdeční selhání.
2.2.21.10 Hypertenze a zvýšená srdeční frekvence
Odhaduje se, že až 30 % hypertoniků má srdeční frekvenci (SF) nad 75/min. Bohužel zvýšená srdeční frekvence zvyšuje riziko celkové úmrtnosti, KVO a ICHS. Podle současných doporučení je zvýšená SF u hypertenze považována za rizikový faktor. Nemáme žádné klinické studie s ovlivňováním zvýšené SF u hypertenze. Přesto je vhodné, zejména u symptomatických osob s tachykardií, zvážit terapii kardioselektivními betablokátory, případně verapamilem. Dobré je udržovat klidovou SF pod 80/min.
2.2.21.11 Hypertenze v těhotenství
Hypertenzi v těhotenství definujeme rovněž pomocí absolutních hodnot TK (sTK ≥ 140 mmHg nebo dTK ≥ 90 mmHg). TK měříme v těhotenství standardně vsedě, v průběhu porodu v poloze na levém boku. Vhodné je AMTK. Při výskytu hypertenze v těhotenství je nutno nejprve zodpovědět otázku, zda se jedná o hypertenzi pokračující v těhotenství z dřívější doby (tzv. preexistující hypertenzi), nebo gestační hypertenzi, která se objevuje obvykle po 20. týdnu těhotenství a buď je provázena proteinurií > 300 mg/den (tzv. preeklampsie), nebo není provázena proteinurií, ev. preeklampsií naroubovanou na dřívější esenciální hypertenzi. Preeklampsie komplikuje zhruba 5 % těhotenství a u žen s preexistující hypertenzí může být přítomna až ve 25 %. Preeklampsie patří i nadále mezi tři nejčastěji uváděné příčiny úmrtí matky. Byla tradičně definována jako gestační hypertenze provázená významnou proteinurií. Nyní je rozšířena definice hypertenze, podle níž není přítomnost proteinurie pro definici preeklampsie podmínkou, nicméně bývá přítomna v 75 % případů. Může být také definována jako gestační hypertenze provázená dysfunkcí jiného orgánu matky. Ženám s vysokým rizikem rozvoje preeklampsie (hypertenze v předchozím těhotenství, chronické ledvinné onemocnění, autoimunitní onemocnění jako např. lupus erythematodes nebo antifosfolipidový syndrom, diabetes 1. nebo 2. typu, preexistující hypertenze) je doporučováno preventivní podávání nízké dávky kyseliny acetylsalicylové (ASA). Nízká dávka ASA je také doporučena ženám se středním rizikem rozvoje preeklampsie (první těhotenství, věk > 40 let, interval mezi těhotenstvími > 10 let, BMI > 35 kg/m2 při prvním vyšetření v těhotenství, výskyt preeklampsie v rodině, vícečetné těhotenství). Podávání nízké dávky ASA (100–150 mg) je třeba zahájit od 12. týdne těhotenství a pokračovat do 36. až 37. týdne těhotenství. Metformin
u žen s gestačním diabetem může snížit riziko rozvoje gestační hypertenze a preeklampsie. Nefarmakologická léčba hypertenze má jen omezený význam s výjimkou fyzické aktivity. Nedoporučuje se omezení soli v potravě. Podobně není v těhotenství doporučována redukce hmotnosti, a to ani u obézních žen (nebezpečí nízké porodní hmotnosti a nižší následný růst). Hodnoty sTK ≥ 170 mmHg nebo dTK ≥ 110 mmHg u těhotných musí být považovány za závažnou situaci s nutností hospitalizace. Z farmakologické léčby by měl být zvažován labetalol i.v. nebo methyldopa či BKK perorálně.
Prahovou hodnotou pro zahájení antihypertenzní léčby jsou hodnoty sTK ≥ 140 mmHg nebo dTK ≥ 90 mmHg s gestační hypertenzí, s gestační hypertenzí naroubovanou na preexistující hypertenzi, s hypertenzí za přítomnosti doprovodných onemocnění, při orgánovém poškození zprostředkovaném hypertenzí nebo u žen, které mají příznaky související s hypertenzí (např. poruchy vidění, bolesti hlavy). V ostatních případech se doporučuje zahajovat medikamentózní léčbu hypertenze při hodnotách sTK ≥ 150 mmHg nebo dTK ≥ 95 mmHg. U preexistující hypertenze, kdy nemocná byla farmakologicky léčena již před těhotenstvím, většinou můžeme pokračovat v dosavadní léčbě s výjimkou blokátorů RAS, které jsou v těhotenství přísně kontraindikovány, a atenololu, jehož podávání rovněž není doporučeno. Základem léčby hypertenze je methyldopa (lék první volby) nebo labetalol. BKK jsou rovněž považovány za bezpečné. Pokud se současně podává magnezium sulfát, který je vhodný k prevenci a léčbě křečí, potenciální synergismus může navodit těžkou hypotenzi. BB jsou považovány za méně účinné, mohou navodit bradykardii u plodu, v pozdější fázi těhotenství lze jejich podávání považovat za bezpečné. Podávání ACEI a AT1-blokátorů (sartanů) je v těhotenství kontraindikováno. Diuretika jsou doporučována v nízkých dávkách u chronické hypertenze, pokud byla podávána i před těhotenstvím. Diuretika jsou rovněž doporučována u pacientek senzitivních k soli. Naopak podávání diuretik není doporučováno u preeklampsie, která je doprovázena snížením plazmatického volumu.
Nemocné s preeklampsií a jejími komplikacemi hospitalizujeme, monitorujeme klinické příznaky, diurézu, tělesnou hmotnost, TK, ev. alteraci plodu. Tento postup vyžaduje komplexní péči porodníka, internisty, ev. kardiologa a v případě, že i přes intenzivní péči a léčbu narůstají příznaky s hrozící eklampsií, těhotenství předčasně ukončujeme.
Jako známky hrozící eklampsie se uvádí zvýšení TK > 160/110 mmHg, bolesti hlavy, poruchy vizu, krvácení do sítnice, exsudáty a edém papily, proteinurie 0,2–2,0 g/24 h, zvyšování kreatininu v plazmě, hyperurikemie. Pokles destiček pod 200 000/ml a zvýšení hepatálních enzymů (ALT –alaninaminotransferáza, AST – aspartátaminotransferáza) jsou již projevy počínajícího HELLP (hemolysis, elevated liver enzymes, low platelet count) syndromu s velmi závažnou prognózou. U žen s gestační hypertenzí nebo mírnou preeklampsií je doporučen porod po 37. týdnu těhotenství.
2.2.21.12 Hypertenze a laktace
Kojení nezvyšuje krevní tlak matky. Všechna antihypertenziva užitá matkou se vylučují do mateřského mléka. Většina z nich se vyskytuje ve velmi nízkých koncentracích, výjimku
představují propranolol a nifedipin, které se vyskytují v obdobných koncentracích jako v plazmě matky.
2.3 Chronická arteriální hypotenze
Miroslav Souček, Tomáš Kára
▶ Definice
Nízký krevní tlak (hypotenze) je definován jako hodnoty pod 90/60 mmHg nebo poklesem větším než 40 mmHg (30 % z výchozí hodnoty u hypertoniků). Někteří lidé mají trvale snížený krevní tlak, který jim nezpůsobuje žádné problémy, a proto nevyžaduje léčbu. Hypotenze však může být spojena také s vážnými nemocemi, a může dokonce vyvolat život ohrožující stavy.
▶ Patogeneze
Hypotenze může být projevem poruchy jakéhokoliv regulačního mechanismu udržujícího adekvátní minutový srdeční výdej a systémovou vaskulární rezistenci, a tím i adekvátní krevní tlak a orgánový průtok.
▶ Klasifikace
Primární (idiopatická) hypotenze. Je podmíněna dysfunkcí autonomního nervstva se sníženou sekrecí vazokonstrikčních a natrium-retenčních působků.
Sekundární hypotenze. Je projevem jiného primárního orgánového postižení. Může být způsobena nejčastěji onemocněními CNS (nádory, sclerosis multiplex, morbus Parkinson), periferního nervového systému (diabetická, uremická nebo alkoholická polyneuropatie), endokrinní chorobou (morbus Addison, hypopituitarismus, hypotyreóza), iatrogenně (léky). Těhotenská hypotenze je způsobena sníženým venózním návratem při tlaku zvětšené dělohy na v. cava inferior a vazodilatačními působky. Hypotenze může postihnout i hypertoniky, kde je důsledkem neadekvátní vazodilatační léčby, snížené senzitivity baroreflexu a neuropatií. Diferenciálnědiagnosticky je třeba odlišit hypotenzi s centralizací oběhu jako projev závažného srdečního selhání.
▶ Klinický obraz
U mírných forem: nízká hodnota krevního tlaku (TK), zvýšená únavnost, bolesti hlavy, zimomřivost, chlad končetin. Náhlá změna polohy – postavení může vyvolat výraznější posturální (ortostatickou) hypotenzi s projevy závratí, mžitky před očima a presynkopální stav. Závažné obtíže vznikají, dojde-li k poklesu perfuzního tlaku mozku, tj. poklesu středního TK pod 60 mmHg (u starých lidí pod 70 mmHg a hypertoniků náhle pod 100 mmHg). Dojde k nevolnosti, hučení v uších až ortostatické synkopě. Po uložení do vodorovné polohy se příznaky rychle upravují. V nejtěžších případech není nemocný schopen vůbec zaujmout vzpřímenou polohu a je upoután trvale na lůžko.
▶ Diagnostika
Vedle klinického obrazu se opíráme o sledování změn TK a pulzové frekvence při vzpřímeném stoji. Využíváme ambulantní monitorování TK. Následně jsou provedena vyšetření k odhalení možné příčiny; laboratorní testy, ultrazvukové vyšetření nebo rentgenové, echokardiografie, zátěžové testy či pozitronová emisní tomografie (PET).
▶ Léčba
Léčba nízkého TK je zaměřena na odstranění příčiny, která ho způsobuje. Při přetrvávání hypotenze doporučujeme tělesné cvičení (izometrická svalová cvičení a plavání), mechanické pomůcky (elastické punčochy), zvýšený přívod tekutin (2,5–3 litry), vyváženou stravu se zvýšeným obsahem soli, minimální konzumaci alkoholu. Sympatomimeticky působící látky s vazokonstrikčním účinkem, např. alfa-mimetikum midodrin. Dále neselektivní betablokátory, které blokují adrenergně zprostředkovanou vazodilataci, nebo indometacin, jenž brání syntéze vazodilatačních prostaglandinů.
2.4 Synkopa
▶ Definice
Miroslav Novák, Růžena Lábrová
Synkopa je definována jako přechodná ztráta vědomí (transient loss of consciousness – TLOC) v důsledku snížení perfuze mozku. Je charakterizovaná náhlým začátkem, krátkým trváním a rychlou spontánní úpravou stavu.
TLOC je možné rozdělit na dvě skupiny:
1. TLOC při úrazu hlavy (samostatně vyčleněn),
2. neúrazová přechodná ztráta vědomí.
Pojem presynkopa popisuje stav, který připomíná prodromy synkopy, ale není následován ztrátou vědomí.
2.4.1 Rozdělení synkop, diagnostická kritéria
Reflexní (neurokardiogenní) synkopa.
Vazodepresorická, kardioinhibiční či smíšená Vazovagální synkopa (VVS):
• ortostatická: vestoje, méně často vsedě,
• emoční: strach, bolest (somatická, viscerální), lékařské zákroky, pohled na krev.
Situační: močení, gastrointestinální dráždění (polykání, defekace); kašel, kýchání; pozátěžová nebo z jiné příčiny (např. smích, hraní na dechový nástroj).
Syndrom karotického sinu.
Synkopa při ortostatické hypotenzi (OH) –ortostatická synkopa
• poléková OH (nejčastější typ OH), např. vazodilatancia, diuretika,
• hypovolemie (diuretika, krvácení, průjem, zvracení),
• primární či sekundární autonomní dysfunkce – neurogenní OH: diabetes, amyloidóza, paraneoplastická autonomní neuropatie, renální selhání…
Kardiální synkopa
• Arytmie jako primární příčina: – bradykardie: syndrom chorého sinusového uzlu (včetně brady-tachy formy), porucha atrioventrikulárního převodu, – tachykardie: supraventrikulární, komorové, – další EKG nálezy: bifascikulární blokáda, preexcitace, dlouhé QT, časná repolarizace, hypertrofie…
• Strukturální srdeční onemocnění: aortální stenóza, akutní ischemie/infarkt myokardu, hypertrofická kardiomyopatie, intrakardiální tumory (síňový myxom, nádory srdce), perikardiální onemocnění/tamponáda, vrozené anomálie koronárních tepen, dysfunkce chlopenní náhrady.
• Kardiopulmonální onemocnění a onemocnění velkých cév: plicní embolizace, akutní disekce aorty, plicní hypertenze.
Stavy, které by mohly být zaměněny za synkopu: epileptické záchvaty, psychogenní pseudosynkopa, kataplexie, TIA (tranzitorní ischemická ataka), subklaviální steal syndrom, metabolické poruchy (hypoglykemie, hypoxie, hyperventilace), intoxikace.
2.4.2 Diagnostika synkopy
• Podrobná anamnéza včetně popisu očitých svědků. Rodinná anamnéza náhlé srdeční smrti (NSS), osobní anamnéza, farmakologická anamnéza.
• Fyzikální vyšetření – TK vleže a vestoje (po dobu 3 minut), symptomatický pokles o více než 20 mmHg systoly (nebo pod 90 mmHg) a více než o 10 mmHg diastoly: ortostatická hypotenze. Postural ortostatic tachycardia syndrom (POTS) při zvýšení srdeční frekvence o více než 30 nebo nad 120/min.
• Masáž karotického sinu nad 40 let (pauza nad 3 sekundy, pokles systolického TK o více než 50 mmHg – diagnóza hypersenzitivního karotického sinu).
• Head‑up tilt test (HUTT) při podezření na ortostatickou či reflexní synkopu, POTS či psychogenní pseudosynkopu. Po 20 minutách stání podání nitroglycerinu 300–400 mg sublingválně či isoprenalinu intravenózně, ev. provést společně s EEG či natočit videozáznam.
• Ambulantní monitorace krevního tlaku: zejména k odhalení noční hypertenze nebo chybění poklesu TK v noci – non-dipping, ev. k odhalení stupně ortostatické hypotenze v běžném životě. V případě situační synkopy reprodukovat vyvolávající situaci.
• EKG, ev. monitorace (při podezření na arytmickou synkopu): za hospitalizace bedside nebo telemetrické monitorování EKG. EKG holterovské monitorování, externí epizodní (aktivace pacientem při obtížích) a smyčkové záznamníky, domácí telemonitorace EKG (bezdrátový přenos v reálném čase). Implantabilní smyčkové záznamníky EKG (implantable loop recorder – ILR).
• Echokardiografie (při srdečním onemocnění či podezření na ně): u malého procenta pacientů odhalí příčinu synkopy – těžká aortální stenóza, srdeční tumor nebo trombus, tamponáda, disekce aorty.
• Zátěžová echokardiografie: k průkazu latentní obstrukce ve výtokovém traktu levé komory, zejména u pacientů s hypertrofickou kardiomyopatií, se synkopou vestoje či při zátěži.
U vybraných pacientů lze zvážit CT a MR srdce. Ergometrii indikujeme u pacientů se synkopou během zátěže nebo krátce po ní.
Videozáznam v nemocnici nebo doma.
Elektrofyziologické vyšetření: především u nemocných se strukturálním onemocněním srdce. Zejména při podezření
na tachykardii – při vyvolání může následovat terapeutická ablace. U raménkové blokády – prodloužený HV interval nad 70 ms nebo indukce AVB II. nebo III. stupně. Dále sinusové bradykardie – vyšetření zotavovacího času sinusového uzlu – SNRT (patologický SNRT nad 2 sekundy).
Biomarkery: BNP/NT-pro BNP (N-terminální fragment prekurzoru natriuretického peptidu B), troponin – k odhalení strukturálního onemocnění srdce.
Koronarografie: je užívána ve stejných indikacích jako u pacientů bez synkopy.
2.4.3 Péče o nemocné na akutním příjmu – riziková stratifikace
Pacienti s nízkým rizikem mohou být propuštěni.
Rizikové pacienty observovat na akutním příjmu nebo jednotce pro vyšetřování synkop (doporučována, pokud je dostupná), vysoce rizikové hospitalizovat.
Nízké riziko: dlouhodobá anamnéza recidivujících synkop stejného charakteru, absence strukturálního onemocnění srdce.
Vysoké riziko: nově vzniklý diskomfort na hrudi, dušnost, bolest. Synkopa při zátěži, vleže či vsedě, bez varovných symptomů. Pozitivní rodinná anamnéza náhlé smrti. Nejasná hypotenze. Přítomnost strukturálního onemocnění srdce. GIT (gastrointestinální) krvácení. Dysfunkce přístroje. Poranění způsobené pádem. Nutnost dalšího urgentního vyšetření (echokardiografie, angiografie, elektrofyziologické vyšetření…).
2.4.4 Léčba pacientů se synkopou
Obecné principy léčby synkopy jsou založeny na rizi kové stratifikaci a určení mechanismu vzniku synkopy, pokud je to možné.
Účinnost léčby je závislá spíše na mechanismu synkopy než na její etiologii. Kardiostimulace je nejúčinnější léčbou bradykardie, ale její účinnost klesá, pokud je doprovázena hypotenzí. Léčba rekurencí synkop je často jiná než léčba základního onemocnění.
2.4.4.1 Léčba synkopy
Edukace pacienta a režimová opatření.
Vysazení hypotenziv či jiných vazoaktivních léků nebo snížení jejich dávky (preference inhibitorů ACE, sartanů x diuretika).
Dostatečná hydratace a příjem soli.
Izometrické manévry: cviky rukou a nohou – zvýší srdeční výdej a TK.
Tilt training: nácvik vzpřímeného stoje v prodlužujících se intervalech.
Břišní kompresivní pás a/nebo kompresivní punčochy u starších nemocných.
Spaní se zvýšenou polohou hlavy snižuje noční polyurii, vede k lepší distribuci intravaskulární tekutiny.
Farmakoterapie: Fludrokortizon vede ke zvýšení renální reabsorpce natria a zvětšení objemu plazmy. Agonisté alfareceptorů s vazokonstričkními účinky – etilefrin, midodrin – výsledky studií jsou ale rozporuplné.
Od betablokátorů s negativně inotropním efektem se očekávalo snížení aktivace mechanoreceptorů v levé komoře. Ve studiích pozitivní účinek nebyl prokázán, proto nejsou vhodné.
Kardioneuroablace: ablace gangliových plexů blízko sinusového a AV uzlu vede k odstranění vagové eferentní stimulace – zatím chybí dostatek dat.
Kardiostimulace: je efektivní tam, kde asystolie je dominujícím mechanismem – tj. u prokázané spontánní či testem indukované asystolie (tj. symptomatická asystolie nad 3 sekundy nebo asymptomatická nad 6 sekund). Dvoudutinová kardiostimulace je indikovaná u kardioinhibičního syndromu karotického sinu u pacientů nad 40 let věku. Programuje se rychlejší stimulace po prudkém poklesu tepové frekvence.
Kardiostimulace při sick sinus syndromu (syndromu chorého sinusového uzlu), pokročilé AV blokádě, pozitivním nálezu při elektrofyziologickém vyšetření nebo na ILR.
Katetrizační ablace nebo antiarytmika při průkazu supraventrikulárních tachyarytmií.
Katetrizační ablace, implantabilní kardioverter-defibrilátor (ICD) nebo antiarytmika po synkopě u komorových arytmií. Při recidivě synkopy pro komorovou arytmii u pacienta s ICD indikujeme katetrizační ablaci jako prevenci recidivy.
2.4.4.2 Synkopa při strukturálním onemocnění srdce
Léčba tohoto onemocnění – významná aortální stenóza, infarkt/ischemie myokardu, HKMP (hypertrofická kardiomyopatie), intrakardiální útvary (myxom, trombus), dysfunkce chlopenní náhrady, plicní embolizace, akutní disekce aorty a plicní hypertenze.
2.4.4.3 Léčba neobjasněné synkopy u pacientů s vysokým rizikem náhlé smrti
Při dysfunkci levé komory srdeční ischemické i neischemické etiologie, u hypertrofické kardiomyopatie, arytmogenní kardiomyopatie a u dědičných syndromů: syndrom dlouhého a krátkého QT, syndrom Brugadových, katecholaminergní polymorfní komorová tachykardie (CPVT): zvážení implantace ICD podle platných guidelines.
2.4.4.4 Specifické skupiny nemocných
Pacienti s četnými přidruženými onemocněními a syndromem křehkosti – frailty syndrom: posouzení kognitivních funkcí, testy fyzické výkonnosti, posouzení compliance a prognózy.
Synkopa u pediatrických pacientů: stejný vyšetřovací postup, u dětí jsou častější afektivní záchvaty.
Psychogenní krátkodobá ztráta vědomí a její vyšetření –pseudosynkopa: pacient většinou na zemi leží déle (15–30 minut), má zavřené oči, nemá rozpoznatelný spouštěcí moment, nepředchází pocení, bledost nebo nauzea, má vysokou četnost záchvatů.
Pořídit videozáznam, ev. HUTT + elektroencefalografii + videozáznam.
Zvážení kognitivně-behaviorální terapie.
Vysvětlení a sdělení této diagnózy pacientovi specialistou.
Neurologické příčiny napodobující synkopu:
Epilepsie: 90 % epileptických záchvatů je doprovázeno tachykardií, 0,3–0,5 % bradykardií. Spouštěčem je nejčastěji blikající světlo. Je přítomna aura. Orální automatismy –žvýkání, mlaskání, svalové pohyby, trvání minuty. Často inkontinence, často otevřené oči a zmodrání obličeje.
Cerebrovaskulární onemocnění: TIA (tranzitorní ischemická ataka), často fokální neurologický deficit bez ztráty vědomí. Vazovagální synkopa a ortostatická intolerance mohou být při migréně. Neurologické vyšetření: EEG, CT nebo MR, vyšetření karotid.
2.4.5 Organizační aspekty – jednotka pro vyšetřování synkop (podle European Heart Rhythm Association z roku 2015)
• Vlastní prostory a vybavení (EKG přístroj a monitor, HUTT, holtery, ambulantní monitorace TK, dostupnost echokardiografie, ergometrie, CT, NMR).
• Pacienti odesílaní od praktických lékařů, z oddělení akutního příjmu, z ambulancí specialistů, z nemocničních lůžek nebo na vlastní žádost.
• Standardizovaný postup při vyšetření pacientů s TLOC, riziková stratifikace.
• Proškolený personál – vedoucí lékař, spolupracovníci, zdravotní sestry. Multidisciplinární přístup. Možnost vyšetření specialistou.
• Výběr vhodných testů (HUTT, smyčkové EKG záznamníky, ILR).
• Poskytnutí základní léčby reflexních a ortostatických synkop, přístup k léčbě kardiálních synkop, psychogenních synkop a epilepsie.
Vyšetření na jednotce pro vyšetřování synkop (Pravidla pro diagnostiku a léčbu TLOC podle doporučení ESC pro léčbu synkopy z roku 2018)
• Anamnéza, fyzikální vyšetření, 12svodové EKG.
• Laboratorní vyšetření – elektrolyty, hemoglobin, troponin, BNP, glykemie, D-dimery, saturace O2, krevní plyny.
• Provokační testy: Valsalvův manévr, masáž karotického sinu, HUTT.
• Různé typy monitorace EKG – bedside, telemetrie, holter, smyčkový nahrávač, implantabilní nahrávač.
• Kardiologické vyšetření: echokardiografie, ergometrie, elektrofyziologické vyšetření, koronarografie.
• Neurologické vyšetření: CT, MR, EEG, video EEG.
• Geriatrické vyšetření: kognice, chůze, rovnováha, vizus, rehabilitace.
• Psychologické nebo psychiatrické vyšetření.
Léčba synkopy
Reflexní synkopa a ortostatická hypotenze:
• Edukace pacienta.
• U mladých s nízkým tlakem zvážit midodrin nebo fludrokortizon.
• Izometrické manévry u mladých s prodromy.
• Vysazení nebo snížení hypotenziv.
• Implantace kardiostimulátoru u starších s dominující kardioinhibiční reakcí.
• U ortostatické hypotenze – režimová opatření, adekvátní hydratace a příjem soli, úprava hypotenziv, izometrické manévry, břišní pás nebo kompresivní punčochy, spánek se zvýšenou polohou hlavy, midodrin nebo fludrokortizon.
• Léčba arytmie a základního kardiologického onemocnění. Implantace ICD u rizikových pacientů.
• Pacienti s reflexní, situační nebo ortostatickou synkopou mohou být propuštěni.
• Okamžitá bedside nebo telemetrická monitorace u rizikových pacientů.
• ILR při pravděpodobnosti rekurence či neobjasnění příčiny synkopy.
• Elektrofyziologické vyšetření, echokardiografie, zátěžový test – viz výše.
2.5 Ischemická choroba srdce
Petr Kala, Jan Kaňovský, Lubomír Elbl, Martin Hudec, Vojtěch Brázdil, Kateřina Helánová, Petr Fila
2.5.1 Chronické koronární syndromy
2.5.1.1 Epidemiologie
Ischemická choroba srdeční (ICHS) je v rozvinutých zemích jednou z hlavních příčin mortality a morbidity obyvatelstva. Mortalita z příčiny ICHS v posledních dekádách setrvale klesá, přesto zůstává v USA zodpovědná za více než třetinu úmrtí ve věku nad 35 let. Současně se zde předpokládá, že u téměř poloviny všech mužů a třetiny všech žen středního věku se během jejich života manifestují klinické projevy ICHS. V České republice byly v roce 2021 nemoci oběhové soustavy zodpovědné za 34,6 % úmrtí u mužů a 38,4 % úmrtí u žen, což je řadí s velkým odstupem na čelné místo příčin (následovány novotvary s asi 18 % úmrtí). Prevalence anginy pectoris (AP) jako hlavního klinického projevu ICHS se zvyšuje s věkem: u skupiny ve věku 45–64 let činí 5–7 % u žen, 4–7 % u mužů, ve věku 65–84 let 10–12 % u žen a 12–14 % u mužů. Roční incidence AP činí 1–4 % podle věku a pohlaví. Počet nových případů ICHS mírně klesá v čase (obr. 2.9).
2.5.1.2 Definice
Chronická, stabilní ischemická choroba srdeční je nejčastěji způsobena obstrukcí koronárních tepen aterosklerotickým plátem. Klinická manifestace stabilní ICHS je vysoce variabilní. Podstatou stanovení diagnózy chronického koronárního syndromu je především vyloučení akutních, nestabilních stavů. Takzvaná nestabilní angina je definována jako angina nová, se zvyšující se frekvencí, intenzitou či trváním, případně projevující se v klidu. Pokud žádný z těchto projevů není přítomen nebo případně neexistuje jiný důvod domnívat se, že se u pacienta jedná o akutní koronární syndrom, můžeme onemocnění klasifikovat jako chronické a podle toho postupovat při diagnostice a léčbě.
Obr. 2.9 Počet pacientů s novou diagnózou ICHS v České republice (2014–2018)
2.5.1.3 Patofyziologie
Angina pectoris jako dominantní symptom chronické ICHS je důsledkem ischemie myokardu, způsobené nedostatečnou dodávkou O2 svalové tkáni v poměru k její aktuální potřebě. Požadavky na zásobování tkáně kyslíkem jsou navýšeny mimo jiné při zrychlené tepové frekvenci, zvýšeném odporu, proti kterému srdce pracuje (tzv. afterload), případně při zvýšené kontraktilitě myokardu. Možnosti dodávky O2 jsou limitovány jednak průtokem krve koronárním řečištěm, jednak jeho obsahem v arteriální krvi. Nejčastější příčinou nedostatečného průtoku krve je významná aterosklerotická léze jedné nebo více koronárních tepen. Příčin nedostatku obsahu O2 v arteriální krvi zásobující myokard může být řada (nejběžněji anemie, respirační selhání apod.).
2.5.1.4 Koronární ateroskleróza a ischemie
■ Koronární ateroskleróza
Pojem ateroskleróza (ATS) vznikl spojením řeckých slov „atheros“ (ovesná kaše) a „skleros“ (tvrdý). To jen dokumentuje dlouhou historii, po kterou se lidstvo aterosklerózou zabývá. Ateroskleróza je ve vyspělých zemích stále primární příčinou kardiovaskulárních onemocnění (KVO). Pod pojem KVO řadíme onemocnění koronárního řečiště (ischemická choroba srdeční), velkých tepen dolních končetin (ischemická choroba dolních končetin), aterosklerotické postižení aorty, mozkových tepen (cévní mozková příhoda) a dalších. Ateroskleróza je dnes definována jako chronické zánětlivé onemocnění postihující cévy. Nejčastěji postiženými jsou koronární tepny, aorta, karotické arterie či bércové tepny. Dochází k akumulaci lipidových částic v cévní stěně a jejich interakci s imunitním systémem. V tomto složitém procesu hrají roli endotel, hladká svalovina cév, proteinová matrix cévní stěny, fibroblasty, leukocyty, makrofágy, řada zánětlivých působků (interleukin [IL]-6, tumor necrosis factor [TNF]-α, CRP, fibrinogen…) a mnoho dalších. Tento děj v konečném důsledku vede k funkčním a morfologickým změnám cévní stěny, které již mají klinický korelát (angina pectoris, klaudikace, mozkové příhody a další).
■ Průběh vzniku
1. Časná fáze: vznik tukových proužků – vyskytují se běžně už v dětském věku v podobě tukových pruhů,
především v aortě. Některé zdroje uvádí jejich přítomnost již u novorozenců. Jejich vznik je podmíněn endoteliální dysfunkcí. Tu ovlivní především přítomnost rizikových faktorů – neovlivnitelné (věk, mužské pohlaví, genetické faktory a rodinná anamnéza) a ovlivnitelné (kouření, nekompenzovaný diabetes a hypertenze, obezita, stres, nedostatek pohybu, alkohol, nevhodná strava, vysoká hladina cholesterolu). Právě těchto devět ovlivnitelných faktorů je zodpovědných za 90 % akutních infarktů myokardu a akumulace i jen čtyř z nich zvyšuje riziko až 20krát. Poškozený endotel ztrácí svou vazodilatační a antitrombogenní funkci, zvyšuje se jeho permeabilita pro lipoproteiny (LDL-cholesterol) a vlivem zánětlivé reakce se hromadí pěnové buňky (makrofágy naplněné degradovanými estery cholesterolu).
2. Pokročilá fáze: aterofibrotické pláty – vznikají další kumulací lipidů, proliferujících buněk hladké svaloviny, fibrocytů, kalcifikovaných hmot, kolagenní matrix, tukových vakuol a zánětlivých buněk v různém počtu a v různém stadiu aktivity. Z klinického pohledu je důležité dělení na pláty stabilní (nízký obsah tuků, malá zánětlivá aktivita a tlustá fibrózní čepička) a pláty nestabilní (četné nekrotické hmoty, bohatý lipidový obsah, zánětlivé buňky a velmi tenká fibrózní čepička na jeho povrchu).
3. Fáze komplikací a klinických projevů: zjednodušeně lze říct, že pláty stabilní způsobují chronickou formu ICHS (stabilní anginu pectoris). U plátů nestabilních dochází k narušení jejich povrchu a částečné či úplné obliteraci lumen cévy nasedajícím destičkovým trombem, společným pro akutní koronární syndrom. Odlišení typu plátů prostou koronarografií je velmi obtížné a vyžaduje detailnější intrakoronární zobrazení cévní stěny (intravaskulárním ultrazvukem či lépe intrakoronární optickou koherenční tomografií) (obr. 2.10 až 2.13).
Obr. 2.10 Příčný řez koronární tepnou na optické koherenč ní tomografii – intravaskulární zobrazení pomocí OCT, na kterém je patrný průřez zdravou koronární tepnou. Můžeme rozlišit všechny tři vrstvy cévní stěny – intimu, medii, adven ticii. Uvnitř cévního lumen je patrný vyšetřovací OCT katétr. OCT – optická koherenční tomografie
■ Ischemie myokardu
Ischemie myokardu je stav, kdy ani při maximálním možném průtoku krve nejsou uspokojeny metabolické nároky myokardu na kyslík. Dochází k hromadění metabolitů anaerobního metabolismu, dráždění chemoreceptorů, což se projeví typickou anginózní bolestí, v některých případech dušností, vegetativní dysbalancí či jejich kombinací.
Obr. 2.11 Intravaskulární zobrazení pomocí OCT, na kterém je patrný průřez koronární tepnou s nestabilním plátem (TCFA – thin cap fibrous atheroma) s tenkou fibrózní čepičkou, u které je vysoké riziko ruptury s nasednutím trombu a úplnou obstrukcí cévního lumen.
OCT – optická koherenční tomografie, TCFA – thin cap fibrous athe roma
Obr. 2.12 Intravaskulární zobrazení pomocí OCT, na kterém je patrný průřez koronární tepnou s patologicky změněnou stěnou, na které již není možné rozeznat tři vrstvy cévní stě ny. Ta je změněna aterosklerotickým plátem, v místě šipky s jeho natržením, a zbytky destičkového trombu v pravé části cévního lumen.
Obr. 2.13 Intravaskulární zobrazení pomocí OCT, na kterém je patrný průřez koronární tepnou s aterosklerotickým plá tem, který zužuje lumen cévy. V pravém horním rohu (v místě šipky) je nasedající trombus.
Krevní zásobení myokardu a jeho regulace jsou charakteristické řadou zvláštností oproti kosterním svalům. K pochopení je zásadní, že při klidovém průtoku dokáže myokard extrahovat většinu kyslíku z krve. Proto je při zvýšených nárocích myokardu na kyslík (např. při fyzické námaze) potřeba zvýšit průtok krve koronárním řečištěm –vazodilatací koronárního řečiště. Fyziologicky dokáže zvýšit průtok až pětkrát, tato schopnost se nazývá koronární průtoková rezerva (CFR)
V případě hemodynamicky významného zúžení ko‑ ronární cévy aterosklerotickými pláty dochází ke snížení CFR, při kterém je omezeno další zvyšování průtoku postiženou tepnou. Průtok krve, tedy nabídka kyslíku, je pak pro uspokojení metabolických potřeb nedostatečný, hromadící se metabolity dráždí chemoreceptory a dochází k anginózním bolestem. Obecně pláty, které snižují CFR, redukují diametr lumen cévy minimálně o 40–50 % a více (k přesnějšímu posouzení procenta stenózy by bylo nutné znát zdravý referenční segment tepny, což bývá zvláště u pacientů ve vyšším věku a diabetiků prakticky nemožné). Hemodynamická či funkční významnost koronární stenózy je však dána nejen redukcí diametru lumen, ale i jeho délkou a velikostí zásobovaného myokardu.
2.5.1.5 Klasifikace
■ Stabilní angina pectoris
Většina chronických forem ICHS se manifestuje stabilní anginou pectoris (AP) klasifikovanou podle systému CCS (Kanadské kardiovaskulární společnosti) do čtyř tříd (tab. 2.23). Podrobnější hodnocení AP je pak možné ve formě dotazníků, umožňujících objektivní srovnání tíže obtíží a optimální nastavení léčby (SAQ – Seattle Angina Questionnaire).
Tab. 2.23 Klasifikace CCS anginy pectoris
Třída CCS Popis obtíží
0 žádná angina pectoris
I angina při těžké, intenzivní a protrahované námaze
II mírná limitace běžné činnosti
III výrazná limitace běžných aktivit (chůze několik set metrů, vyjití jednoho patra)
IV angina v klidu
CCS – Kanadská kardiovaskulární společnost
■ Vazospastická angina
Historicky nazývaná také tzv. variantní (Prinzmetalova) angina, obvykle se manifestuje u mladších pacientů, nejvýraznějším rizikovým faktorem je kouření. Příčinou AP je zvýšený vazomotorický tonus koronárních tepen a vazospasmus. Anginózní bolest je typicky velmi silná a může být doprovázena také synkopou při atrioventrikulární blokádě, asystolii či maligních arytmiích. K diagnostice se používají invazivní provokační testy (využívající aplikaci ergonovinu, methylergometrinu či acetylcholinu). Dominantní složkou léčby je dlouhodobé podávání kalciových blokátorů. Ve vzácných případech je možné ošetřit segment tepny s tendencí k opakovaným spasmům implantací stentu.
■ Mikrovaskulární angina
Jak stabilní AP, tak vazospastická AP mají podklad v patofyziologických procesech, které se odehrávají na úrovni epikardiálních koronárních tepen, zobrazitelných při angiografii. Ty jsou však pouze malou, přestože velmi důležitou částí koronární cirkulace. Úroveň arteriol a kapilár, jejichž systém nazýváme koronární mikrocirkulací, je hlavním místem regulace koronárního průtoku. O mikrovaskulární angině mluvíme v případě, kdy je vyloučena obstrukce toku na úrovni epikardiálních tepen. Jako příčinu potíží je možné ji potvrdit pomocí invazivního vyšetření koronární fyziologie a zhodnocení tzv. indexu mikrovaskulární rezistence (IMR). Patofyziologickým podkladem je pak nejčastěji endoteliální dysfunkce a dysfunkce hladké svaloviny cév. Kauzální léčba neexistuje, důležitou součástí terapie je optimální životospráva, kompenzace přidružených chorob (hypertenze, diabetes), aby dále nedocházelo k progresi onemocnění.
■ Němá ischemie
Podstatným problémem při diagnostice je fakt, že významná chronická ICHS může být přítomná i bez manifestace jakýchkoliv symptomů. Fenomén popisovaný jako němá ischemie (ev. pak němý infarkt myokardu) je obvykle detekován různými způsoby (zátěžové zobrazovací vyšetření, testování tolerance zátěže, EKG holter monitorace). V populaci bez známého kardiovaskulárního postižení se předpokládá ve skupině do 60 let věku výskyt němé ischemie okolo 3 %, s věkem však prevalence strmě stoupá a nad 80 let již lze předpokládat výskyt u více než 15 % asymptomatických osob. Němá ischemie se vyskytuje u 30–40 % pacientů
s anamnézou ICHS či předchozího infarktu myokardu, mísí se s epizodami typické či méně typické AP. Rozpoznání této jednotky je důležité pro nastavení optimální antiischemické léčby.
2.5.1.6 Diagnostika
Diagnostika chronické ICHS nemusí být vždy jednoduchá, a proto využíváme řadu diagnostických metod. V případě pacientů s nízkou nebo střední pravděpodobností ICHS je doporučeno vyšetření neinvazivní, ať už zátěžové, či pomocí CT koronarografie, a teprve na základě jejich výsledků bychom měli pacienta směrovat k invazivní selektivní koronarografii (SKG). Naopak v případě pacientů s vysokou pravděpodobností ICHS je na prvním místě doporučeno provedení invazivní SKG s možnou katétrovou či bypassovou revaskularizací.
1. Základní vyšetření
• Anamnéza: zaměříme se na přítomnost především typic kých anginózních bolestí splňujících tři kritéria – ostrá bolest za hrudní kostí s propagací do končetin nebo krku, vazba na fyzickou zátěž či stres a vymizení po podání nitrátu. Dále pátráme po rizikových faktorech ICHS (rodinná anamnéza, kouření, hypertenze, diabetes mellitus, renální insuficience, obezita, tělesná inaktivita aj.).
• EKG: pátráme po Q kmitech (známky proběhlého infarktu) či patologických denivelacích ST segmentu nebo změny T vlny. EKG změny musíme dávat vždy do kontextu s klinickými potížemi (asymptomatická inkompletní, a dokonce ani kompletní ramínková blokáda u zcela zdravého sportovce jistě nevyžaduje SKG).
• Fyzikální vyšetření: mohou napomoci odhalit jinou příčinu bolestí na hrudi.
2. Echokardiografie
Neinvazivní metoda, jejíž výsledek nás může přiblížit k finální diagnóze. Zachycenými patologiemi jsou především klidové poruchy kinetiky, snížená kontraktilita levé komory srdeční, významné chlopenní vady, patologie v perikardu, známky přetížení v plicním řečišti či jiné. Pokud nám žádná z těchto metod nedokáže určit jasnou příčinu bolestí na hrudi (ať už ischemickou, nebo jinou), měli bychom si na základě pravděpodobnosti ICHS (podle věku, pohlaví a symptomů) zvolit vhodný diagnostický test.
3. Diagnostické testy Jedná se o neinvazivní vyšetřovací metody, jejichž cílem je průkaz ischemie myokardu. V případě jejich pozitivity by pacient měl podstoupit SKG. Každá z metod je jinak časově (objednací termín) či finančně náročná, má různou míru přesnosti, dobu trvání i celkové zatížení pacienta. Všechny tyto aspekty by měly být při výběru zohledněny. Kaskáda detekovatelných ischemických projevů je znázorněna na obrázku 2.14
• CT koronarografie: CT vyšetření za pomoci kontrastní látky zaměřené na koronární cévy. Je limitováno kalcifikacemi v koronárním řečišti, které mohou ovlivnit výsledek. Hlavní výhodou je vysoká negativní prediktivní hodnota (tedy při negativním výsledku je přítomnost významné stenózy velmi nepravděpodobná).
ischemická kaskáda
EKG změny (zátěžové EKG)
porucha kontraktility (DYZE)
porucha metabolismu (PET)
porucha perfuze (SPECT)
ischemie myokardu (čas trvání)
Obr. 2.14 V grafu je tzv. ischemická kaskáda. Vyjadřuje změny na myokardu v závislosti na trvání ischemie. V závorce jsou poté uvedeny diagnostické metody, které danou poru chu dokáží detekovat. Jak je z grafu patrné, časně můžeme zachytit změny perfuze myokardu, naopak EKG změny či klinické symptomy jsou až na opačné straně časové osy. DYZE – dynamická zátěžová echokardiografie, PET – pozitrono vá emisní tomografie, SPECT – jednofotonová emisní tomografie myokardu
• SPECT myokardu (jednofotonová emisní tomografie myokardu): v dnešní době velmi rozšířená metoda k průkazu ICHS. Výhodou je vysoká senzitivita i specificita. Principem je porovnání perfuze myokardu v klidu a při zátěži (fyzická či farmakologicky navozená). Ve vrcholu zátěže je aplikováno radiofarmakum (nejčastěji 99mtechnecium MIBI) a jeho zátěžová distribuce v myokardu se porovná s klidovou (pořízenou jiný den). Pokud tato distribuce není totožná – při zátěži dojde k regionálnímu výpadku v alespoň 10 % myokardu – je přítomnost ICHS pravděpodobná.
• DYZE (dynamická zátěžová echokardiografie): porovnání kontraktility myokardu v klidu a při zátěži v předem definovaných zobrazovacích projekcích. V případě zátěží navozených poruch kontraktility (hypokineze daného segmentu) je ICHS pravděpodobná.
• Zátěžové EKG: k průkazu ICHS v dnešní době již není doporučováno, především pro vysoký počet falešně pozitivních a negativních výsledků. Principem je hodnocení EKG změn při zátěži (nejčastěji bicyklová ergometrie). Typickými znaky ischemie jsou horizontální/descendentní ST deprese s anginózními potížemi.
• Zátěžová magnetická rezonance: dostupnost vyšetření je omezená. Farmakologicky (obvykle adenosinem) je navozena zátěž, při které se porovnává distribuce gadolinia v myokardu (v porovnání s klidovým zobrazením).
• Pozitronová emisní tomografie (PET): k průkazu ischemie se využívá zcela výjimečně, preferenčně k průkazu viability myokardu. Principem je průkaz poruchy metabolismu myokardu za pomoci fluorodeoxyglukózy. anginózní bolesti
2.5.1.7 Diferenciální diagnostika
Bolest na hrudi je jednou z nejčastějších diagnóz, se kterými se na urgentním příjmu či v ambulancích lékařů setkáme. Udává se, že je důvodem 5–10 % všech vyšetření v medicíně. Kardiovaskulární příčina z tohoto počtu tvoří asi 45 % vyšetřených, proto musíme pomýšlet i na jiné možné příčiny. Některé zdroje uvádí 30–40 jiných možných příčin thorakalgií, diferenciální diagnostika je tedy velmi široká (tab. 2.24).
2.5.1.8 Léčba
■ Režimová opatření a rizikové faktory
Etiologicky se na vzniku chronických koronárních syndromů nejčastěji podílí ateroskleróza epikardiálních koronárních tepen, z toho vyplývá, že i rizikové faktory jsou oběma společné. Tyto faktory dělíme na ovlivnitelné a neovlivnitelné. Mezi neovlivnitelné faktory patří věk pacienta, mužské pohlaví a genetická predispozice. Mezi hlavní ovlivnitelné rizikové faktory pak řadíme kouření, hypertenzní nemoc, hyperlipidemii, diabetes mellitus a obezitu.
Režimová opatření představují důležitou součást primární prevence ICHS a vycházejí z výše uvedených rizikových faktorů. Mezi hlavní body patří zanechání kouření, které snižuje mortalitu pacientů až o 36 %. Dále pak redukce hmotnosti s cílovým BMI (body mass index) pod 25 a taktéž s tím související dietní opatření a pohyb. Vhodné je navýšení příjmu ovoce a zeleniny (nad 200 g/den), snížení příjmu nasycených tuků, omezení příjmu soli (5–6 g/den) a taktéž omezení příjmu alkoholu (maximálně 20 g/10 g za den u mužů/žen). Doporučena je dostatečná fyzická aktivita, a to 30–60 minut aerobní aktivity minimálně 4× týdně. Důležitá je také kompenzace přidružených onemocnění souvisejících s ischemickou chorobou srdeční, tedy kompenzace hypertenze, diabetu a hyperlipidemie.
■ Optimální medikamentózní terapie
Terapie chronické ICHS si klade za cíl zlepšit prognózu pacientů a zároveň ulevit od symptomů, tzn. zlepšit kvalitu života. Pro dosažení těchto cílů je zapotřebí individualizovaná medikamentózní terapie v kombinaci s úpravou životního stylu.
Tab. 2.24 Diferenciální diagnostika bolestí na hrudi
1. Medikamentózní léčba zlepšující prognózu pacientů
• Antiagregační (protidestičková) terapie – cílem je zamezit tvorbě destičkových trombů. Nejčastěji užívaným zástupcem je kyselina acetylsalicylová –ASA (100 mg/den, dlouhodobě). Podle výsledků recentních studií se zdá, že v budoucnu bude preferovaným preparátem klopidogrel (75 mg/den). U nejrizikovějších pacientů stran ischemických komplikací můžeme využít i moderní kombinace ASA s tikagrelorem (60 mg 2krát denně) či redukovanou dávkou (tzv. cévní dávkou) rivaroxabanu (2,5 mg 2krát denně).
• Hypolipidemická terapie – nejčastěji užívanými preparáty jsou statiny, případně kombinovaná léčba s ezetimibem. Moderními preparáty s velmi dobrým účinkem jsou inhibitory PCSK9 či inclisiran, ovlivňující transkripci RNA pro LDL receptory na buněčné úrovni. Jejich cena zatím omezuje užití pro nejrizikovější pacienty s vysokou hladinou LDL. Nově je na českém trhu dostupná také kyselina bempedoová.
• Betablokátory – snižují celkovou mortalitu pacientů a zároveň působí i jako účinná antianginózní léčiva. Vždy by měly být podávány v maximálně tolerovaných dávkách (s ohledem na tepovou frekvenci a tlak krve). Zástupci jsou např. metoprolol, bisoprolol, betaxolol či nebivolol
• Inhibitory ACE – v praxi se užívají u pacientů s nedostatečně kompenzovanou hypertenzí po nasazení plné antianginózní terapie. Zástupci skupiny jsou např. perindopril, ramipril, trandolapril
2. Medikamentózní léčba symptomatická (cílem je ovlivnit anginózní symptomatologii)
• Nitráty – svým vazodilatačním efektem zvyšují průtok koronárním řečištěm a zároveň snižují metabolické nároky myokardu (snížení nitrokomorového a systolického tlaku). Existují ve formě perorální (dlouhodobě působící – isosorbiddinitrát či iso‑ sorbidmononitrát) nebo pohotovostní sublingvální formě (nitroglycerin).
• Blokátory kalciových kanálů – podporují vazodilataci koronárních cév a snížení kontraktility myokardu (a tím metabolických nároků). Dihydropyridinové preparáty (amlodipin, felodipin, nit rendipin) mají především vazodilatační účinek,
Kožní Muskuloskeletální Plíce Srdce Gastrointestinální Cévní Jiné
herpes zoster kontuze svalu pneumonie akutní koronární syndrom ezofagitida disekce aorty vertebrogenní
jiná kožní onemocnění
fraktura kosti pleuritida angina pectoris reflux jícnu vyhřez ploténky
Tietzův syndrom pneumotorax perikarditida vředová choroba panická ataka plicní embolie myokarditida cholecystitida
astmatický záchvat aortální stenóza pankreatitida
exacerbace CHOPN tachy‑/ bradyarytmie
CHOPN – chronická obstrukční plicní nemoc
hiátová hernie
nondihydropyridinové verapamil a diltiazem působí také na snížení TF (tepová frekvence).
• Ostatní – trimetazidin (ovlivňuje metabolismus myokardu), ivabradin (zpomalení TF) či molsido min (ovlivňuje syntézu oxidu dusnatého).
■ Revaskularizace
Indikací k revaskularizaci myokardu u pacientů se stabilními, chronickými koronárními syndromy včetně němé ischemie jsou přetrvávající symptomy i přes podávanou léčbu, případně zlepšení prognózy. Symptomatická indikace je dána limitujícími obtížemi, nereagujícími na optimální farmakologickou terapii. Prognostické indikace jsou definovány v doporučených postupech pro revaskularizaci myokardu (tab. 2.25). Jednou z metod diagnostiky ischemie je invazivní vyšetření koronární fyziologie s měřením průtoku (klidového nebo hyperemického, nejčastěji s použitím aplikace adenosinu). Hyperemický průtok je podkladem určení tzv. frakční průtokové rezervy (FFR), pomáhající odlišit funkčně významné stenózy epikardiálních tepen (obr. 2.15).
Tab. 2.25 Indikace revaskularizace myokardu u stabilní ICHS pro zlepšení prognózy
• stenóza kmene ACS > 50 %
• stenóza proximální RIA > 50 %
• nemoc dvou nebo tří tepen se stenózami > 50 % a se sníženou funkcí LK (EF LK ≤ 35 %)
• rozsáhlá oblast ischemie detekovaná funkčním testováním (> 10 % LK) nebo abnormální invazivní FFR či klidovými indexy
• jediná zbývající průchodná koronární tepna se stenózou > 50 %
ACS – a. coronaria sinistra, EF – ejekční frakce, FFR – frakční průtoková rezerva, LK – levá srdeční komora, RIA – ramus interventricularis anterior
Cílem revaskularizace myokardu je snaha minimalizovat reziduální ischemii. Metodou volby pro revaskularizaci může být buď perkutánní koronární intervence (PCI), nebo
Obr. 2.15 Křivka hyperemického průtoku koronární tep nou při měření frakční průtokové rezervy (FFR), prokazující limitaci průtoku pod hranicí významnosti 0,80, vycházející z dostupných klinických dat
kardiochirurgická revaskularizace pomocí aortokoronárního bypassu. Rozhodování o způsobu revaskularizace je dáno lokalizací lézí, komplexností postižení, očekávanou chirurgickou mortalitou a možnostmi kompletní revaskularizace. U komplexnějších nálezů vychází obvykle společné rozhodnutí o doporučení nejlepšího postupu pro pacienta z diskuse tzv. heart teamu, který zahrnuje jak kardiochirurgy, tak lékaře se specializací v kardiologii a intervenční kardiologii, event. doplněné o další specialisty u pacientů se závažnými komorbiditami.
2.5.1.9 Komplikace
Chronické koronární syndromy mají velmi heterogenní klinické projevy od asymptomatických forem přes stabilní anginu pectoris až po rozvoj ischemické kardiomyopatie se známkami srdečního selhání. Mezi hlavní komplikace u těchto pacientů patří progrese anginózních potíží vyžadující koronární revaskularizaci, rozvoj akutního koronárního syndromu, dekompenzace chronického srdečního selhání, arytmie či náhlá srdeční smrt. Výskyt těchto komplikací je u každého pacienta individuální a závisí na rozsahu postižení koronárních tepen, systolické funkci levé komory a na výskytu rizikových faktorů ischemické choroby srdeční.
2.5.1.10 Prognóza
Chronická ICHS má obecně relativně dobrou prognózu. Podle recentních dat se u pacientů s chronickými koronárními syndromy pohybuje pravděpodobnost významné kardiovaskulární příhody v rozmezí 1,2–2,4 % ročně. Je zřejmé, že skupina chronické ICHS bude poměrně heterogenní v závislosti na dalších faktorech. Konvenční rizikové faktory (hypertenze, diabetes, kouření, hyperlipidemie, obezita, rodinná anamnéza aj.) významně zvyšují riziko další progrese onemocnění. Prognóza je výrazně zhoršena také u pacientů s poklesem ejekční frakce levé komory, ev. s projevy srdečního selhání. Důsledná diagnostika a sledování pacientů s chronickou ICHS jsou důležitými body pro rizikovou stratifikaci pacientů a správně vedenou léčbu v sekundární prevenci.
2.5.2 Akutní koronární syndrom (AKS)
V České republice je hospitalizováno více než 18 000 nemocných s akutním infarktem myokardu (AIM) ročně, a přičteme-li nemocné s nestabilní anginou pectoris (NAP) a nemocné s náhlou srdeční smrtí často způsobenou akutně probíhající ischemií myokardu, dá se předpokládat, že celkový počet nemocných s AKS v ČR přesahuje 20 000 ročně. Jedná se o onemocnění s vysokým rizikem úmrtí, a to především v akutní fázi onemocnění do 30 dnů (asi 5–10 % u nemocných s AIM léčených koronární intervencí – PCI) a v prvním roce (8–12 % u nemocných s AIM léčených PCI), ale zvýšené riziko je dlouhodobé (asi 3 % ročně u nemocných s AIM s elevacemi ST úseku léčených pomocí primární koronární intervence). V případě konzervativní léčby bez možnosti revaskularizace je mortalita ještě výrazně vyšší.
Systém léčby AIM včetně poskytování non-stop 24/7 invazivní léčby všem nemocným v České republice v síti 22 PCI center (cathlab) pokrývající všechny kraje/regiony slouží dlouhodobě jako dobrý vzor v mezinárodním srovnání.
2.5.2.1 Definice, patofyziologie a typy akutního infarktu myokardu
Akutní koronární syndrom (AKS) zahrnuje poměrně široké spektrum pacientů s náhle vzniklými klinickými obtížemi charakteru bolestí na hrudi s možnou iradiací, dušností a/nebo vegetativní dysbalancí, se změnami nebo i beze změn ST úseku (obr. 2.16) na 12svodovém EKG se záchytem či bez záchytu závažných arytmií a s akutním zvýšením či bez akutního zvýšení dynamiky vysoce senzitivního troponinu (hsTn).
Po stanovení dynamiky hsTn je pak stanovena diagnóza akutního infarktu myokardu (AIM) s elevacemi ST úseku na EKG (STEMI – obr. 2.17, 2.18) či bez elevací (NSTEMI) nebo diagnóza nestabilní anginy pectoris (NAP). NAP je definována ischemií myokardu v klidu nebo při minimální zátěži bez vzniku nekrózy kardiomyocytů a s následnými charakteristikami: trvání klidových potíží/ischemie > 20 minut, nově vzniklá AP nebo AP s progresí obtíží či AP po nedávno proběhlém IM.
V případě nevýznamných změn ST úseku na 12svodovém EKG a trvajícího klinického podezření na AKS by měly být natočeny zadní svody, tzn. svody V7–V9 (v těchto případech se může jednat o zadní AIM při postižení povodí ramus circumflexus).
Klinický průběh je různorodý a závisí na poskytnuté péči – od nekomplikovaných stavů (u STEMI léčených mechanickou reperfuzí – primární PCI v 70–80 %) přes závažné arytmie až po kardiogenní šok (u STEMI léčených primární PCI v 7–10 %).
Stanovení diagnózy je založeno na přítomnosti elevace a dynamiky biomarkerů – nejlépe hsTn (T nebo I) v kombinaci s minimálně jedním kritériem: a) symptomy ischemie myokardu, b) nové ischemické EKG změny, c) vznik nových Q kmitů na EKG, d) průkaz poruchy kinetiky myokardu v odpovídající oblasti krevního zásobení, e) průkaz přítomnosti intrakoronárního trombu.
Nejčastějším typem AIM je typ 1 charakterizovaný rupturou, ulcerací, erozí nebo fisurací aterosklerotické‑ ho koronárního plátu, na který nasedá trombus a který ve většině případů ovlivňuje koronární flow (obstruktivní postižení), ale až u 10 % nemocných se můžeme setkat s postižením neobstruktivním.
Obr. 2.17 EKG s obrazem STEMI dolní stěny (a) – elevace II, III, aVF, (b) – kontralaterální deprese aVL, V1–V3. Pacientka několik hodin od vzniku bolestí – již naznačeny Q kmity v končetinových svodech nad dolní stěnou.
Obr. 2.18 EKG s obrazem STEMI přední stěny (elevace I, aVL)
AIM typu 2 vzniká v důsledku velké dysbalance mezi potřebami myokardu na O2 a jeho dodávkou, která může provázet hypotenzi/hypertenzi, brady/tachyarytmie, anemii, spontánní koronární disekci, koronární embolizaci nebo dysfunkci koronární mikrocikulace.
B C E F D
A – norma
B – zvýšení amplitudy vlny T – nastává ve velmi časné fázi AIM a na EKG nebývá běžně zachyceno
C – elevace ST úseku (Pardeeho vlny) – charakteristická EKG známka, jejíž rozeznání je pro diagnostiku zcela zásadní
D – inverze vlny T – v případě časné reperfuze se takto invertovaná vlna T postupně normalizuje a EKG je poté zcela fyziologické
E – inverze vlny T a vznik Q kmitu – v situacích, kdy pacientovi není provedena časná, typicky perkutánní koronární intervence, se začíná vyvíjet Q kmit
F – prohloubení Q kmitu a normalizace vlny T – je důkazem transmurální nekrózy a jizvy myokardu, kdy nedošlo k časné reperfuzi
Obr. 2.16 Přirozený vývoj EKG změn v průběhu ischemie v případě, že nedojde k časné reperfuzi myokardu
AIM typu 3 je spojen s kardiálním úmrtím a symptomy se suspekcí na AIM nebo prokázané při autopsii.
AIM typu 4, resp. 5 jsou spojeny s revaskularizací pomocí PCI, resp. bypassové operace.
2.5.2.2 Diagnostika – pomocná vyšetření
■ Elektrokardiogram (EKG)
Dvanáctisvodové EKG s možností rozšíření o svody V7–V9 viz výše a V3R–V4R k posouzení postižení pravé srdeční komory je základním pomocným vyšetřením. Posouzení přítomnosti ischemických změn (elevací nebo depresí ST úseku) na EKG je obtížné v případě nálezu kompletní raménkové blokády, a to bez ohledu na délku jejího trvání, nebo stimulovaného srdečního rytmu. Pokud se jedná o nemocného s vysokým klinickým podezřením na pokračující ischemii myokardu, léčebný postup by měl být podobný jako u STEMI (obr. 2.19).
V případě ST elevací (STE) se za významné považují elevace STE v bodě J, které jsou přítomné nejméně ve dvou sousedících svodech a mají tyto charakteristiky:
• STE V2–V3 ≥ 2,5 mm u mužů < 40 let,
• ≥ 2 mm u mužů ≥ 40 let,
• ≥ 1,5 mm u žen bez ohledu na věk,
• a/nebo ≥ 1 mm v ostatních svodech (v případě nepřítomnosti hypertrofie LK nebo kompletní blokády levého raménka Tawarova).
U nemocných bez trvajících elevací ST úseku (NSTE-AKS) může být EKG obraz poměrně bohatý na změny – od normálního (až u 30 % nemocných) přes invertované či bifázické vlny T, deprese ST úseku v oblasti bodu J až po klasické horizontální/descendentní ST deprese.
■ Biomarkery
Vysoce senzitivní troponin (hsTn) má v časné detekci myokardiální nekrózy prakticky nezastupitelnou roli, která je spojena s vysokou negativní a až v případě pětinásobného zvýšení koncentrace i vysokou pozitivní prediktivní hodnotou. Jedná se tedy o test s velmi vysokou senzitivitou, ale nižší specificitou, se kterou „bojujeme“ často v praxi.
klinické vyšetření EKG
Má-li pacient příznaky/symptomy naznačující AKS, je nutný záznam EKG do 10 minut od PLK prvního kontaktu s lékařem.
pracovní diagnóza
následná vyšetření
hs-cTn hodnoty
angiogra e
zobrazovací metody
konečná diagnóza STEMI
nestabilní angina pectoris
AKS není diagnostikována
Obr. 2.19 Klasifikace pacientů s podezřením na akutní koronární syndrom: od pracovní po konečnou diagnózu. Funkční diagnózu AKS lze na základě dostupných klinických informací a nálezu AKG klasifikovat jako STEMI nebo NSTE ASC. To umožňuje počáteční třídění a hodnocení. Konečná diagnóza je založena na příznacích, EKG a troponinu pro diagnostiku MI a také na výsledcích dalších testů (např. zobrazovací metody, angiografie) a může ji usnadnit pochopení mechanismů a klasifikace typu MI. Pacienti, kterým byla původně stanovena pracovní diagnóza STEMI nebo NSTE ACS, mohou nakonec dostat diagnózu bez AKS.
AKS – akutní koronární syndrom, EKG – elektrokardiogram, FMC – první kontakt s lékařem, hs cTn – kardiální srdeční troponin, MI – infarkt myokardu, NSTE AKS – akutní koronární syndrom bez ST elevace, NSTEMI – infarkt myokardu bez ST elevace, STEMI – infarkt myokardu s elevací ST
Vedle AIM typu 1 je mnoho dalších příčin zvýšených hodnot hsTn:
• kardiální – důvody zmíněné výše u AIM typu 2, srdeční selhání, myokarditida, kardiomyopatie, takotsubo syndrom, kontuze myokardu, bypassová operace srdce, PCI, katétrová léčba arytmií, elektrická kardioverze, biopsie myokardu, intervence na srdečních chlopních,
• nekardiální – sepse, závažné infekce, chronická renální insuficience, cévní mozková příhoda ischemická či hemoragická, plicní embolie, infiltrativní onemocnění, kardiotoxická farmakoterapie, hypo-/hyperfunkce štítnice, rhabdomyolýza, ale i extrémní fyzická zátěž.
Nejen na urgentních příjmech se u nemocných s podezře ním na NSTE‑AKS velmi často využívá hsTn v „rule‑in“ a „rule‑out“ protokolech. Nesmí se však zapomínat na to, že tyto protokoly se týkají pouze diagnózy NSTEMI a samotné nemohou být podkladem pro odeslání nemocných do domácího ošetřování a vedle „rule-in“ a „rule-out“ je třetí možností observace.
Protokol > 3 hod. – diagnóza NSTEMI může být vyloučena u nemocných, kteří mají obtíže v trvání > 3 hodiny před vyšetřením a velmi nízké hodnoty hsTn v čase 0, a naopak potvrzena při hodnotách zvýšených.
Protokol 0/1 hod., 0/2 hod., resp. 0/3 hod. – diagnóza NSTEMI může být vyloučena u nemocných, kteří mají nízkou hodnotu hsTn bazálně a hodnota se významně nezvýší s časovým odstupem, a naopak potvrzena při jejich výrazném zvýšení.
Specifické cut-off hodnoty byly dosud stanoveny pouze pro hsTn T (3 hod. < 15 ng/l a 0 hod./3 hod., absolutní změna < 4 ng/l za 3 hod.). V případě hsTn I jsou cut-off hodnoty individuálně závislé na výrobcích jednotlivých sad a jejich využití musí být předem validováno.
Rutinní využití dalších biomarkerů, jako je myokardiální kreatinkináza (CK-MB), kopeptin aj., je při využívání hsTn velmi nízké.
■ Neinvazivní zobrazovací metody
Echokardiografie transtorakální (TTE) hraje v diagnostice
AKS velmi důležitou roli a může pomoci nejen při detekci regionálních poruch kinetiky včetně posouzení lokální či
globální deformace myokardu (globální nebo longitudinální strain), ale i celým spektrem poskytovaných informací o funkci a morfologii nejen srdečních struktur. Zvláště v případě klinických nejasností a pro diferenciální diagnostiku je echokardiografie zásadní – např. u plicní embolie nebo disekce aorty. TTE je akutně indikována u všech pacientů v kardiogenním šoku a při podezření na mechanickou komplikaci AIM.
Další zobrazovací metody, jako je magnetická rezonance srdce (cMR), jednofotonová emisní tomografie (SPECT), CT koronarografie nebo zátěžová echokardiografie, nemají pro diagnostiku AKS větší význam a indikují se spíše s časovým odstupem. Výjimkou, ne však pro diagnostiku AKS, je indikace akutního CT hrudníku.
2.5.2.3 Diferenciální diagnostika
Akutně vzniklé symptomy AKS (bolesti na hrudi, dušnost, vegetativní dysbalance) se mohou vyskytovat u mnoha dalších postižení a někdy mohou velmi věrně imitovat AKS. Jejich výčet je uveden v tabulce 2.26
2.5.2.4 Léčba
■ Přednemocniční léčba
Zásadní je podání medikace, která zajistí zastavení narůstání destičkového trombu v koronárním řečišti, hemodynamickou stabilizaci pacienta a symptomatickou terapii podle aktuálních příznaků, a to již při prvním kontaktu s lékařem a stanovením diagnózy AKS. Neméně důležitý je převoz pacienta na monitorovaném lůžku do nemocnice/PCI centra. 1. Protidestičková léčba k ovlivnění průvodní aterotrom bózy, kde hlavní roli hrají krevní destičky s podáním kyseliny acetylsalicylové (ASA) preferenčně v i.v. podání v dávce 250 mg (150–300 mg p.o. v případě, že i.v. forma není dostupná). Pouze v případě, kdy nemocný není indikován k transportu do PCI centra v průběhu prvních 24 hodin, je rutinně indikována léčba pomocí silných inhibitorů P2Y12 receptorů destiček – tikagreloru v sytící dávce 180 mg nebo prasugrelu v sytící dávce 60 mg nebo, v případě jejich kontraindikací nebo
Tab. 2.26 Diferenciální diagnostika akutního koronárního syndromu
Kardiální Plicní Cévní Gastrointestinální Ortopedické Jiné myokarditida/perikarditida, kardiomyopatie plicní embolie disekce aorty ezofagitida, reflux nebo spasmus muskuloskeletální onemocnění anxieta tachyarytmie (tenzní) pneumotorax symptomatické aneurysma aorty ulcus, gastritida trauma hrudníku herpes zoster akutní srdeční selhání bronchitida, pneumonie cévní mozková příhoda pankreatitida svalové trauma/ zánět anemie hypertenzní krize pleuritida cholecystitida kostochondritida aortální stenóza patologie krční páteře takotsubo syndrom
koronární spasmus srdeční trauma
nedostupnosti, klopidogrelu v sytící dávce 300–600 mg (u nemocných se STEMI může být předléčba pomocí P2Y12 zvážena, ale v praxi se preferuje její podání až v cathlabu).
2. Antikoagulační léčba – nefrakcionovaný heparin v dávce 70–100 IU/kg (většinou 4000–5000 IU) i.v., eventuálně nízkomolekulární heparin, enoxaparin,
3. Nitráty sublinguálně k ovlivnění ischemie, a to v případě, že nemocný nemá hypotenzi, významnou brady- či tachykardii, infarkt pravé komory, známou významnou aortální stenózu nebo nevzal v průběhu posledních 24–48 hodin inhibitor fosfodiesterázy 5.
4. Oxygenoterapie v případě, že pacient má saturaci O2 < 90 %.
5. Anodyna k tlumení bolesti.
začátek příznaků typ FMC
místo FMC
určení léčebné strategie
6. Betablokátory indikujeme v praxi velmi obezřetně s ohledem na možné zhoršení i subklinicky probíhajícího srdečního selhání, které se v čase může velmi rychle měnit – preferenčně je doporučeno podání i.v. metoprololu u pacientů se STEMI indikovaných k primární PCI.
7. U STEMI s dlouhým transportním časem nad 120 minut k primární PCI je indikováno podání farmakologické reperfuze, tzn. fibrinolýzy, a transport do primárního PCI centra – v ČR k této situaci dochází výjimečně, u méně než 1 % nemocných.
8. U nemocných se STEMI nebo NSTEMI s velmi vy sokým rizikem je zásadní přímý transport do PCI centra.
9. Symptomatická léčba případných komplikací AIM –srdečního selhání, arytmií, oběhové zástavy aj.
celkový ischemický čas a zdroje zpoždění reperfuze
pacient s příznaky AKS a s příznaky STEMI na EKG
pacient se sám dostavil do nemocnice
pacient volá na EMS (PLS?)
centrum PCI mimo PCI centrum záchranná služba
celkový čas ischemie
pacient se sám dostavil
pacient volal EMS
okamžitý převoz do PCI centra na primární PCI po brinolýze okamžitý převoz do PCI centra zpoždění u pacienta zpoždění EMS systémové zpoždění celkový čas ischemie ne
reperfuze
Obr. 2.20 Způsoby a cesty příchodu pacienta k invazivnímu zákroku a revaskularizaci myokardu u pacientů s diagnózou STEMI
ACS – akutní koronární syndrom, EKG – elektrokardiogram, EMS – pohotovostní lékařská služba, FMC – první kontakt s lékařem, PCI – per kutánní koronární intervence, PPCI – primární perkutánní koronární intervence, STEMI – infarkt myokardu s elevací ST
Algoritmus léčby STEMI a NSTEMI je znázorněn na obrázku 2.20
■ Nemocniční léčba
Vedle základní farmakologické léčby uvedené výše v přednemocniční fázi (v cathlabech je navíc možné zvážit podání i.v. preparátů: P2Y12i – kangreloru a/nebo blokátoru glykoproteinových receptorů destiček IIb/IIIa) je nemocniční léčba doplněna o další medikaci.
• Duální antiagregační terapie (DAPT) – pokračuje se v již v RZP (rychlá zdravotnická pomoc)/katetrizačním sále zavedené terapii ASA + inhibitory P2Y12. Jejich hlavním úkolem je inhibice krevních destiček, a tedy zabránění tvorby trombů v místě implantovaných stentů, a to do doby, než dojde k reepitalizaci kovové mřížky stentu.
• Hypolipidemická terapie statiny – atorvastatin (80 mg) či rosuvastatin (40 mg) v maximálních dávkách k optimalizaci hladiny LDL-cholesterolu (dlouhodobý cíl pod 1,4 mmol/l).
• Betablokátory – bisoprolol, metoprolol, karvedilol –jsou indikovány u všech pacientů, především však u pacientů s dysfunkční LK, bez hypotenze či bradykardie. U této skupiny pacientů jednoznačně zlepšují dlouhodobou prognózu.
• ACEI/sartany – ramipril, lisinopril, enalapril, valsartan, losartan, candesartan – jsou indikovány u pacientů se známkami srdečního selhání s dysfunkcí LK, bez hypotenze. Jejich titrace do maxima vede ke zlepšení prognózy. U pacientů se srdečním selháním bývají po iniciální terapeutické fázi nahrazeny moderními preparáty ze skupiny ARNI (sakubitril-valsartan).
• Další terapie podle potřeby – terapie srdečního selhání u trvající dysfunkce LK, úprava antidiabetické terapie (přechodné vysazení metforminu u pacientů s dysfunkční LK) či nastavení kombinace DAPT + orální antikoagulační terapie u indikovaných pacientů (např. fibrilace síní).
Nemocniční léčba je však především doplněna invazivním vyšetřením a reperfuzní/revaskularizační léčbou. Ta je v naprosté většině případů intervenční pomocí PCI (obr. 2.21).
U nemocných s NSTEMI, kteří jsou oproti STEMI v průměru starší, mají rozsáhlejší koronární postižení a více závažných komorbidit, je PCI také dominantním způsobem revaskularizace, ale relativně častěji je u těchto nemocných indikována bypassová operace (obr. 2.22, 2.23).
Na rozdíl od všech nemocných se STEMI je indikace nemocných s NSTE-AKS k okamžité invazivní strategii (do 2 hodin) založena na následných kritériích: 1. přítomnost hemodynamické nestability nebo kardiogenní šok, 2. opakované nebo trvající stenokardie refrakterní na farmakoterapii, 3. akutní srdeční selhání, 4. život ohrožující arytmie nebo oběhová zástava (v souvislosti s AKS), 5. mechanické komplikace, 6. opakované dynamické EKG změny svědčící pro ischemii myokardu.
K časné invazivní strategii (do 24 hodin) jsou indikováni nemocní s NSTE-AKS splňující tato kritéria: 1. s potvrzenou diagnózou NSTEMI, 2. GRACE rizikové skóre > 140 (GRACE ACS Risk and Mortality Calculator, mdcalc. com), 3. přechodné elevace ST úseku, 4. dynamické změny ST úseku nebo T vln. U ostatních nemocných je invazivní přístup individuální po domluvě s PCI centrem.
Antikoagulační léčba za hospitalizace (preferenčně nízkomolekulární heparin – enoxaparin nebo fondaparinux) je indikována u nemocných konzervativně léčených nebo upoutaných na lůžko po delší dobu.
V případě nemocných na chronické antikoagulační léčbě se v této léčbě pokračuje a kombinuje se s DAPT (klopidogrel + ASA), a to po dobu minimálně prvních sedmi dnů. U těchto nemocných individuálně hodnotíme ischemické a krvácivé riziko podle kritérií ARC-HBR (Academic Research Consortium on High Bleeding Risk), dostupných i pro mobilní aplikace – ARC Portal on the App Store (apple.com).
Stanovení délky a kombinace antitrombotické léčby je tedy individuální a mělo by být jasně deklarované v propouštěcí zprávě. Zvláště to pak platí u nemocných s vysokým
Obr. 2.21a–d Pacient s akutním infarktem myokardu s ST elevacemi nad spodní stěnou. Pacient volá RZP několik minut od vzniku bolestí. Celkový čas od vzniku bolestí do zprů chodnění infarktové tepny je kolem 60 minut. Jedná se tedy o ideální scénář, kdy je prognóza pacienta nejpříznivější. a) angiografie pravé koronární tepny před primární PCI, b) in trakoronární zobrazení pomocí OCT, c) implantace lékového stentu, d) finální výsledek na angiografii a OCT
Obr. 2.21a Selektivní koronarografie pravé věnčité tepny: Ve střední části tepny ukazuje bílá šipka na ulcerovanou lézi s prosvětlením (aterosklerotický plát s nasedajícími zbytky trombu). Tato léze je důvodem STEMI a je nutné její okamžité ošetření. Modrá šipka ukazuje elektrodu EKG nalepenou na hrudi pacienta.
Obr. 2.21b Podrobné intravaskulární zobrazení z lumen cévy: v tomto případě pomocí optické koherenční tomografie (OCT). Na obrázku vlevo je ulcerovaný aterosklerotický plát jako podklad pro vznik destičkového trombu, obrázek vpravo zachycuje měsícovitý destičkový trombus, který obturuje asi 2/3 lumen cévy
Obr. 2.21c Implantace koronárního stentu (bílá šipka): Guiding (zaváděcí) katétr (černá šipka) v ústí pravé koronární tepny (modrá šipka) a koronární vodič v periferii pravé koro nární tepny (hnědá šipka).
Obr. 2.21d Finální výsledek po implantaci stentu: Jedná se o moderní lékový stent, který je při běžné angiografii jen těžko rozeznatelný. V levém obrázku šipka ukazuje na místo implantace. Pravý obrázek je OCT zobrazení z lumen cévy – bílé šipky ukazují na struty (kostru) implantovaného stentu, které vytvářejí četné tmavé stíny po obvodu cévy.
Obr. 2.22a–g Nemocný s NSTEMI a onemocněním tří koronárních tepen léčený funkční revaskularizací (FFR‑guided PCI – koronární intervence vedená měřením frakční průtokové rezervy): a) angiografie levé koronární tepny před stentin gem infarktové léze, b) angiografie levé koronární tepny po ošetření infarktové léze, c) postižení ramus interventricularis anterior, d) FFR RIA, e) výsledek po PCI RIA, f) angiografické postižení pravé koronární tepny, g) FFR pravé koronární tepny
Obr. 2.22a Pacient s NSTEMI. Na obrázku selektivní koro narografie levé věnčité tepny. Černě zvýrazněna culprit léze ramus circumflexus, která je důvodem akutního infarktu myokardu a je nutné její akutní ošetření s implantací koro nárního stentu.
Obr. 2.22c Stejný pacient, jehož koronární cévy jsou difuzně postiženy. V této projekci je černě zvýrazněna hraniční 60% stenóza ve střední části ramus interventricularis anterior. Angiograficky není jasně indikována k ošetření. Proto jsme indikovali invazivní stanovení frakční průtokové rezervy (FFR). Podle ní dokážeme odlišit funkčně nevýznamné stenózy od významných, vyžadujících další ošetření.
Obr. 2.22b Ramus circumflexus po implantaci koronárního lékového stentu. Místo implantace je černě zvýrazněno.
Obr. 2.22d Obrázek z měření FFR. V prostřední části tla kové křivky měření (červená – tlaková křivka z aorty/ústí koronární tepny; zelená – tlaková křivka měřená speciálním intrakoronárním vodičem s tlakovým čidlem umístěným za stenózou ve střední RIA, v levé horní části hodnoty měřených tlaků). V červeném rámečku výsledná hodnota FFR (hodnoty pod 0,80 jsou považovány za funkčně významné – vyžadují ošetření).
Obr. 2.22e Černě znázorněna střední RIA po implantaci lékového stentu. Indikací byla hodnota FFR menší než 0,8.
Obr. 2.22g Frakční průtoková rezerva distální pravé ko ronární tepny. V tomto případě je výsledná hodnota FFR (červeně zvýrazněno) 0,92, což značí funkčně nevýznamnou lézi. Ta v tuto chvíli není indikována k dalšímu ošetření.
rizikem krvácivých komplikací, u kterých je možné zvážit zkrácení standardní 12měsíční délky duální protidestičkové léčby na kratší dobu 1, 3 nebo 6 měsíců, eventuálně je možné zvážit tzv. deeskalaci tikagreloru/prasugrelu na klopidogrel (v kombinaci s kyselinou acetylsalicylovou).
Minimálně u nemocných s vysokým rizikem gastrointestinálního krvácení je po dobu kombinované antitrombotické léčby nutné zahájit léčbu inhibitorem protonové pumpy.
Další farmakologická léčba je uvedena dále v části sekundární prevence.
Obr. 2.22f Stejný pacient s hraniční 50% stenózou distální pravé koronární tepny. Funkční významnost této stenózy byla také verifikována pomocí FFR.
V případě revaskularizační léčby je cílem dosažení maximálně možné kompletní revaskularizace, která může být anatomická s ošetřením všech lézí/tepen s morfologicky významnou stenózou nebo tzv. funkční s ošetřením lézí/ tepen s průkazem funkčně významné koronární stenózy (viz obr. 2.22, 2.23). Dosažení kompletní revaskularizace je spojeno se zlepšením prognózy nemocných a mělo by být dokončeno nejlépe za hospitalizace u velmi významných nálezů a nejpozději do 45 dnů od vzniku AIM. U části nemocných je možné zvážit tzv. hybridní formu revaskularizace kombinující PCI s arteriálním graftem LIMA-RIA (levá mamární arterie našitá na ramus interventricularis anterior) (obr. 2.24).
Vedle mnoha poměrně sofistikovaných přístupů má u akutních pacientů stále zásadní roli echokardiografie včetně ultrazvukového vyšetření hrudní a břišní dutiny a velkých cév.
Akutní echokardiografie (ECHO) srdce slouží k zobrazení části myokardu postižené infarktem. Takto postižená svalovina se oproti té zdravé kontrahuje daleko méně (hypokineze), vůbec (akineze) anebo se naopak vyklenuje na opačnou stranu (dyskineze). Využití nalezne akutní ECHO u odhalení mechanických komplikací AIM (viz kap. 2.5.2.5), dále při odhadu celkové funkce levé komory či posouzení známek srdečního městnání. Toto vše jsou informace velmi důležité, které mohou nastínit další prognózu či periprocedurální/nemocniční vývoj klinického stavu.
Důležitou roli hraje ECHO také v rámci diferenciální diagnostiky. Dokáže odhalit řadu patologií, jež mohou imitovat pacienty s AKS (tab. 2.27) a navést k dalším metodám, které podezření potvrdí.
a b
Obr. 2.23 Bypassová revaskularizace: a) distální anastomózy LIMA‑RIA, tzn. levá mamární tepna našitá na ramus in terventricularis anterior a tři žilní grafty našité na další koronární tepny, b) Y bimamární arteriální graft k plné arteriální revaskularizaci
Tab. 2.27 Akutní echokardiografie
Diagnóza
Nález ECHO
Definitivní diagnostická metoda plicní embolie cor pulmonale
CT angiografie plicnice či V/P sken disekce aorty
myokarditida
takotsubo kardiomyopatie
aortální regurgitace, perikardiální výpotek, dilatace aorty, intimální flap
difuzní hypokontraktilita bez regionálních změn kinetiky
CT angiografie aorty, jícnová echokardiografie
negativní SKG + odloženě MR srdce
akineze apikálních segmentů negativní SKG a typický nález na RLVG perikardiální/pleurální výpotek tekutina v perikardu/dutině hrudní rtg či CT hrudníku u fluidotoraxu těsná aortální stenóza definitivní kvantifikace vady
CT – výpočetní tomografie, ECHO – echokardiografie, MR – magnetická rezonance, RLVG – levostranná ventrikulografie, SKG – koronární angiografie, V/P scan – ventilačně perfuzní scan
2.5.2.5 Komplikace
Riziko komplikací AIM se s moderními přístupy celkově velmi snížilo, přesto však trvá a často je spojeno se závažnými komorbiditami, jako jsou vyšší věk, křehkost (frailty), anemie, chronická renální insuficience, diabetes mellitus, nádorové onemocnění, autoimunitní onemocnění, trombocytopenie a v některých případech ženské pohlaví. Nejvíce ohroženi jsou nemocní s jejich kombinovaným výskytem.
■ Mimonemocniční srdeční zástava (OHCA – out‑of‑hospital cardiac arrest)
AKS je nejčastější příčinou OHCA, zároveň je výskyt OHCA velmi nízký. Akutní léčba vychází z doporučení European Resuscitation Council a v některých cathlabech může být rozšířena o zavedení ECMO. Pro prognózu nemocných, která je většinou dána rozsahem mozkového poškození, je zásadní délka zdržení od účinné kardiopulmonální resuscitace, v laickém případě od srdeční masáže, optimálně telefonicky asistované dispečerem zdravotnické záchranné služby (TANR – telefonicky asistovaná neodkladná resuscitace). Lepší prognózu mají nemocní s defibrilovatelným rytmem oproti asystolii a nemocní s kratší dobou do návratu


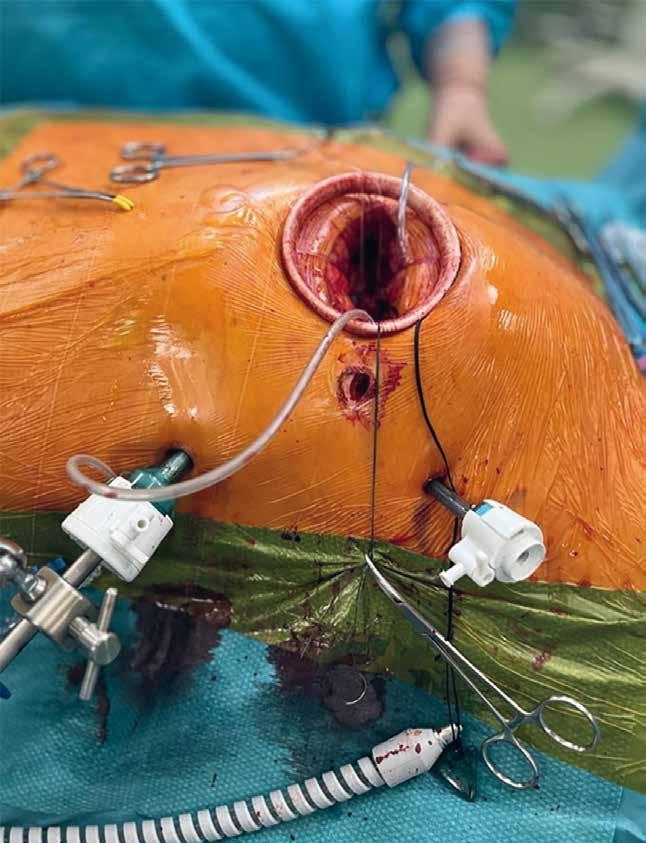
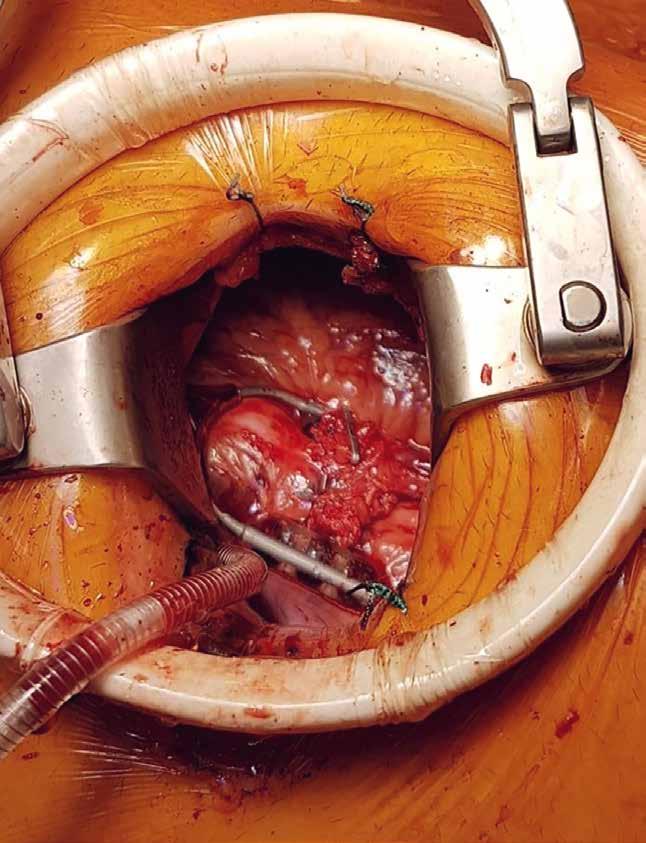
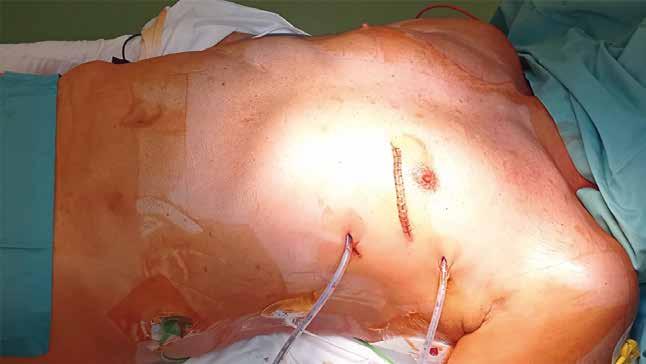
spontánní cirkulace (ROSC – return of spontaneous circulation). Nemocní s OHCA a trvajícími ST-elevacemi jsou léčeni stejně jako nemocní se STEMI bez OHCA a po prvním zaléčení mají být transportováni přímo do cathlabu 24/7 primárního PCI centra. Nemocní, u kterých na EKG nejsou ST elevace, by měli být směrováni na urgentní příjmy ke stanovení příčiny OHCA a k vyloučení mozkové hemoragie, plicní embolie, disekce aorty aj. Provedení urgentní echokardiografie je součástí vyšetřovacího procesu. U části těchto nemocných je indikována koronarografie, která může být provedena s časovým odstupem, a to bez zhoršení prognózy.
Neurologickou prognózu nemocných v kómatu je možné posoudit s odstupem nejméně 72 hodin od přijetí a nezřídka se setkáváme se situacemi, kdy se podaří rychle stabilizovat srdeční funkci, ale mozek je těžce poškozen. Jedinou šancí na návrat nemocných s OHCA do kvalitního života je tedy bezodkladné zahájení a správné provádění resuscitace a aktivace integrovaného záchranného systému na telefonním čísle 155 v ČR nebo 112 v ČR i v zahraničí (jistě v zemích Evropské unie).
Obr. 2.24 MIDCAB LIMA‑RIA bez mimotělního oběhu (našití levé mamární tepny – LIMA na ramus interventricularis ante rior – RIA z minitorakotomie): a) minitorakotomie, b) našitý graft LIMA‑RIA, c) uzávěr minitorakotomie
■ Kardiogenní šok a srdeční selhání
Kardiogenní šok (KŠ) se vyskytuje u 7–10 % nemocných se STEMI, přibližně v polovině případů již iniciálně, a jeho vznik dramaticky zhoršuje prognózu s 30denní mortalitou blížící se, i přes veškerou péči, 50 %. Invazivní přístup k nemocným v kardiogenním šoku je indikován bez ohledu na časový odstup od vzniku příznaků a vedle farmakologické léčby se stále častěji v léčbě využívají i mechanické srdeční podpory. Zvláště u nemocných s rozsáhlou akutní ischemií a premorbidní postiženou levou komorou je riziko vzniku KŠ relativně vysoké a tito nemocní vyžadují maximální pozornost a péči. Klasifikace a léčba KŠ, stejně jako akutního srdečního selhání je uvedena v kapitole 2.6.
■ Mechanické komplikace Četnost mechanických komplikací AIM se dramaticky snížila s mechanickou reperfuzní a časnou revaskularizační léčbou (0,27 % u STEMI a 0,06 % u NSTEMI). I nadále se však jedná o komplikace s vysokou nemocniční mortalitou (42 % u STEMI a 18 % u NSTEMI). Jedná se o rupturu
papilárního svalu se vznikem akutní mitrální insuficience, rupturu mezikomorového septa s akutním přetížením pravé komory či rupturu volné stěny s rizikem vzniku srdeční tamponády. Léčba těchto stavů ve většině případů vyžaduje komplexní kardiochirurgickou léčbu buď akutně, nebo s časovým odstupem, a to s ohledem na hemodynamický stav nemocných. Část nemocných je možné oběhově stabilizovat pomocí mechanických srdečních podpor (balonková kontrapulzace, Impella, V-A ECMO – kap. 2.6).
■ Trombus v levé komoře
Trombus v levé komoře je relativně častým nálezem především u nemocných s rozsáhlým předním infarktem (u více než 9–10 % případů) a výrazně méně často u ostatních. Detekce trombu v LK pomocí echokardiografie je oproti CMR méně přesná a tomu je potřeba přizpůsobit diagnostický algoritmus u nejasného echokardiografického obrazu. Nejčastěji trombus vzniká v průběhu prvních dvou týdnů od vzniku AIM. Léčba je konzervativní – antikoagulační, a to po dobu 3–6 měsíců s ověřením její účinnosti.
■ Perikarditida
Většinou se jedná o benigní časnou perikarditidu se vznikem do čtyř dnů nebo pozdní, Dresslerův syndrom, vznikající pravděpodobně na podkladě hypersenzitivní reakce 1–2 týdny od AIM. Léčba je u naprosté většiny nemocných konzervativní podáním vyšších dávek ASA (někdy nesteroidních antiflogistik, případně kolchicinu).
■ Arytmie
Nejčastější arytmií je nově vzniklá nebo nově zachycená fibrilace síní. V závislosti na jejím případném hemodynamickém dopadu a také oběhovém stavu nemocného a funkci LK se volí léčba – od farmakoterapie zahrnující betablokátor, přes digoxin a amiodaron až po elektrickou kardioverzi se zvážením nasazení chronické antikoagulační léčby.
Sporadicky se vyskytují atrioventrikulární blokády vyššího stupně, které jsou ve většině případů přechodné, mohou však vyžadovat podávání pozitivně chronotropních léků (atropin, isoprenalin, vazopresin či adrenalin), dočasnou kardiostimulaci a jen velmi zřídka je při trvání nad 5 dnů nutná trvalá kardiostimulace.
Komorové arytmie (komorová tachykardie – KT, fibrilace komor – FK) se vyskytují u 6–8 % nemocných se STEMI. Léky volby u komorové tachykardie jsou betablokátory a amiodaron, v případě fibrilace komor defibrilace. Výskyt těchto arytmií v průběhu prvních 48 hodin nezhoršuje prognózu, naopak setrvalá KT nebo FK v pozdější fázi > 48 hodin od AIM je indikací k implantaci ICD v sekundární prevenci náhlé srdeční smrti. Primárně preventivně je indikace k implantaci ICD v případě trvající těžké systolické dysfunkce s EF LK ≤ 35 % po uplynutí minimálně 6 týdnů od AIM.
■ Krvácení
Krvácení obecně zhoršuje prognózu nemocných a mechanismus krvácivých komplikací je komplexní a multifaktoriální, od akutně život ohrožujících velkých nebo mozkových
krvácení až po krvácení akutně ohrožující méně, ale vyžadující hospitalizaci, léčebný zákrok nebo krevní transfuze. Primárním cílem je tedy prevence krvácení a cílená léčba v případě jeho vzniku. Vzhledem k riziku ischemie, trombózy ve stentu a dalších trombotických komplikací je zásadní individuální přístup k úpravě nebo vysazení antitrombotické léčby, vždy po domluvě s kardiologickým pracovištěm.
2.5.2.6 MINOCA – AIM bez obstrukce hlavních koronárních tepen
Četnost MINOCA se v literatuře pohybuje v širokém rozmezí 1–14 % a je definována průkazem AIM s postižením diametru hlavních koronárních tepen < 50 %. Z hlediska příčin se může jednat o postižení koronárních tepen (embolizace, dysfunkce mikrocirkulace, spasmus, trombóza, svalový můstek, ruptura/eroze plátu, spontánní koronární disekce), kardiální nekoronární příčinu (srdeční trauma, kardiomyopatie, kardiotoxiny, myokarditida, extrémní fyzická zátěž, takotsubo kardiomyopatie, rejekce transplantovaného srdce) nebo nekardiální etiologii (akutní respirační distress syndrom, alergická/hypersenzitivní reakce, pokročilé renální selhání, zánět, plicní embolie, sepse, cévní mozková příhoda).
Vyšetřovací algoritmus nemocných s MINOCA je individuální a může zahrnovat využití invazivních technik, intrakoronárního zobrazení a posouzení mikrocirkulace, i neinvazivních – magnetické rezonance srdce, eventuálně další se snahou o stanovení příčiny a odpovídající nastavení další léčby.
2.5.2.7 Sekundární prevence a fyzická zátěž po akutním infarktu myokardu
Každý pacient po proběhlém infarktu myokardu by měl být po propuštění z nemocnice sledován kardiologem, který bude zajišťovat jeho další léčbu.
Cílem dlouhodobé péče o pacienty po infarktu myokardu je zlepšit jejich prognózu, snížit riziko další kardiovaskulární příhody a zlepšit jejich kvalitu života. K tomu, abychom těchto cílů dosáhli, využíváme jak režimová opatření, tak farmakoterapii. Z patofyziologického pohledu se snažíme o zpomalení progrese aterosklerózy, pozitivní ovlivnění remodelace myokardu a zvýšení tolerance k ischemii.
■ Nefarmakologická opatření v sekundární prevenci po infarktu myokardu
Zcela zásadním opatřením v rámci sekundární prevence po infarktu myokardu je úprava životního stylu, která zahrnuje zdravý způsob života, nekouření, optimalizaci tělesné hmotnosti, dodržování zásad zdravé výživy, pravidelnou fyzickou aktivitu a udržování duševní rovnováhy.
Dietní opatření
Celková energetická hodnota stravy by měla být upravena s cílem udržet BMI v normálním rozmezí (18–25 kg/m2). Preferována je konzumace pestré stravy, s dostatečným množstvím ovoce, zeleniny a vlákniny, se sníženým množstvím soli (≥ 5–6 g/den). Dále je vhodné snížení příjmu
tuku do 30 % celkového příjmu energie a zvýšení podílu rostlinných olejů (zejména řepkový a olivový) na úkor tuků živočišných. Upřednostňujeme libové maso a ryby. Dostatečným pitným režimem se rozumí 1,5–2 l vhodných tekutin denně.
Ideální je úplná abstinence alkoholu, nicméně dá se tolerovat omezený příjem alkoholu do 20 g/den pro muže (přibližně 250 ml vína nebo 0,5 l piva) a 10 mg/den pro ženy (125 ml vína, 0,3 l piva).
Kontrola tělesné hmotnosti
Je prokázáno, že pacienti s nadváhou (BMI > 25 kg/m2) nebo obezitou (BMI > 30 kg/m2) mají zvýšené riziko rozvoje ICHS. Optimalizace tělesné hmotnosti příznivě ovlivňuje i ostatní rizikové faktory rozvoje aterosklerózy, jako jsou krevní tlak, hladina glykemie i hodnoty krevních lipidů.
Závislost na tabáku
Kouření významně zhoršuje prognózu a přestat kouřit je to neúčinnější opatření po infarktu, které pacient může udělat. K dispozici jsou speciální odvykací programy i farmakologická léčba (další informace např. na www.slzt.cz).
Fyzická (tělesná) aktivita
Pokud je pacient po proběhlém infarktu myokardu hemodynamicky i elektricky stabilní, pak je vhodná poměrně rychlá mobilizace. Další úroveň i typ doporučené zátěže velmi závisí na fyzické kondici pacienta před IM a na rozsahu infarktu a stavu koronárního řečiště.
K posouzení fyzické výkonnosti lze provést zátěžový test a následně podle výsledku doporučit vhodný typ zátěže.
V ČR lze pacienta zařadit do kontrolovaného rehabilitačního programu s ambulantně řízeným tréninkem nejméně 3× týdně 30–60 minut. V domácím prostředí je doporučován aerobní trénink se střední zátěží po dobu 30 minut alespoň 5× týdně. Postupně je vhodné zařazení i silového tréninku a součástí cvičení by měl být i trénink flexibility a rovnováhy. Sexuální aktivity by měly odpovídat fyzické výkonnosti jedince.
■ Farmakologická léčba
Antiagregační (protidestičková) léčba Je jedním ze základních pilířů sekundární prevence po IM. Optimální antiagregace se určuje podle individuálního posouzení rizika ischemické příhody a rizika krvácení.
U pacientů léčených perkutánní koronární intervencí (PCI) se podává duální antiagregační terapie (DAPT) v kombinaci kyselina acetylsalicylová (ASA 1× 100 mg) a inhibitor P2Y12 (tikagrelor 2× 90 mg, prasugrel 1× 10 mg –u nemocných s váhou pod 60 kg nebo ≥ 75 let, eventuálně klopidogrel 1× 75 mg) po dobu 12 měsíců.
U pacientů léčených fibrinolýzou se doporučuje klopidogrel podávat spolu s ASA po dobu jednoho měsíce, pokud nebyla provedena PCI; u pacientů s fibrinolýzou a následnou PCI se doporučuje podávat DAPT po dobu 12 měsíců (nemocní léčení fibrinolýzou pro IM jsou v ČR zcela vzácní).
U nemocných léčených konzervativně je doporučeno podávat DAPT – ASA + tikagrelor nebo ASA + klopidogrel po dobu 12 měsíců.
U pacientů s vysokým a velmi vysokým rizikem kr vácení lze uvažovat o zkrácení DAPT na dobu jednoho až
šesti měsíců a poté pokračovat v léčbě pouze jedním antiagregačním lékem (nejčastěji ASA, eventuálně klopidogrel).
U pacientů s nízkým rizikem krvácení a vysokým rizikem ischemických komplikací, kteří dobře tolerovali 12měsíční podávání DAPT, lze zvážit prodloužení DAPT např. kombinací ASA plus tikagrelor 60 mg 2× denně na déle než jeden rok (až na tři roky). U těchto pacientů je možné uvažovat také o kombinaci ASA a nízké dávky rivaroxabanu (2× denně 2,5 mg), zvláště je-li současně přítomen diabetes mellitus (DM), renální insuficience či onemocnění periferních tepen.
U pacientů se zvýšeným rizikem krvácení do gas trointestinálního traktu (anamnéza krvácení z trávicího traktu, antikoagulační léčba, chronické užívání nesteroidních antirevmatik/kortikoidů a přítomnost dvou a více z následujících položek: věk ≥ 65 let, dyspepsie, refluxní choroba jícnu, infekce Helicobacter pylori a chronická konzumace alkoholu) se doporučuje po dobu léčby DAPT gastrointestinální trakt chránit podáváním inhibitoru protonové pumpy; inhibitory protonové pumpy jsou podle některých guidelines doporučeny dokonce u všech pacientů s DAPT.
Hypolipidemika
Pacientům po AIM musí být co nejdříve a bez ohledu na koncentraci LDL-cholesterolu nasazena intenzivní statinová léčba specifikovaná jako 20–40 mg rosuvastatinu nebo 40–80 mg atorvastatinu. Za 4–6 týdnů po IM je třeba provést kontrolu lipidogramu, a pokud není dosaženo cílové hodnoty LDL-cholesterolu (< 1,4 mmol/l a současně snížení LDL-C minimálně o 50 % hodnoty před léčbou), je indikováno přidání ezetimibu. Pokud ani kombinací statin + ezetimib není dosaženo cílových hodnot, je doporučeno kombinaci doplnit o inhibitory PCSK9 (proprotein konvertáza subtilisin/kexin typu 9).
Antihypertenziva
Nejčastějším rizikovým faktorem rozvoje ischemické choroby srdeční je arteriální hypertenze. Dosažení cílového rozmezí krevního tlaku je tedy velmi důležité. Pro pacienty s ICHS je doporučován TK 120–129/70–79 mmHg (pokud jsou pacientem tolerovány), pro starší nemocné nad 65 let věku jsou cílové hodnoty systolického TK 130–140 mmHg. Pokud má pacient současně srdeční selhání se sníženou funkcí levé komory, antihypertenzní léčba má být zahájena při TK nad 140/90 mmHg. Upřednostňujeme betablokátory a blokátory systému renin-angiotenzin, které mohou zlepšovat prognózu po infarktu myokardu.
2.6 Akutní srdeční selhání
Tomáš Ondrúš, Marie Miklíková, Jan Stašek, Petr Kala, Jiří Pařenica
2.6.1 Definice, epidemiologie, klasifikace akutního srdečního selhání
Akutní srdeční selhání je klinický syndrom, který zahrnuje řadu různých patofyziologických mechanismů a klinických diagnóz, pro který jsou charakteristické společné klinické symptomy (zejména dušnost a otoky) a který je většinou doprovázen klinickými známkami srdečního selhání (městnání
na plicích od nepřízvučných chrůpků až po vlhké chropy při plicním edému, vyskytují se periferní otoky až anasarka, zvýšená náplň krčních žil, srdeční cval). Na rozdíl od chronického je pro akutní srdeční selhání charakteristický rychlý nástup symptomů a známek srdečního selhání. Z patofyziologického hlediska srdeční selhání vzniká v důsledku strukturálních nebo funkčních srdečních abnormalit, které vedou ke zvýšenému plnicímu tlaku levé nebo pravé komory (selhání dozadu) a/nebo neadekvátně nízkému srdečnímu výdeji (selhání dopředu).
Akutní srdeční selhání (ASS) je život ohrožující diagnóza a prognóza těchto pacientů je závažná. V České republice je ročně hospitalizováno asi 30 tisíc pacientů s hlavní diagnózou srdečního selhání. Hospitalizační mortalita se v posledních deseti letech pohybuje kolem 10,5 %, výrazně narůstá s věkem nad 80 let. Do dvou let po propuštění zemře dalších asi 37 % pacientů. Dále je mnoho pacientů rehospitalizováno pro akutní srdeční selhání, během dvou let to činí asi 30 % pacientů. Pacienti s akutním srdečním selháním mají řadu komorbidit, které dále výrazně zhoršují
jejich dlouhodobou prognózu, fibrilace síní, anemie, renální insuficience a diabetes mellitus jsou ty nejdůležitější. Klasifikace pacientů s akutním srdečním selháním z různých klinických pohledů je uvedena v tabulce 2.28. Z pohledu léčby je nejdůležitější tíže srdečního selhání, etiologie srdečního selhání, vyvolávající faktor (trigger) (tab. 2.29) a ejekční frakce levé komory. Většina farmakologických studií, podle nichž jsou pacienti po propuštění dlouhodobě léčeni, byla doposud založena na ejekční frakci levé komory.
2.6.2 Diagnostika akutního srdečního selhání
Diagnostika akutního srdečního selhání je založena na zhodnocení subjektivních symptomů, objektivních známek a výsledků laboratorních a zobrazovacích vyšetření. Časné stanovení diagnózy akutního srdečního selhání a odlišení od jiných příčin dušnosti je klíčové pro časné zahájení adekvátní terapie. Diagnostický algoritmus by měl být zahájen
Tab. 2.28 Klasifikace akutního srdečního selhání podle klinicky významných kritérií
Podle vzniku – de novo srdeční selhání (první manifestace srdečního selhání); akutní dekompenzace chronického srdečního selhání.
Podle tíže srdečního selhání – mírné srdeční selhání/akutní dekompenzace chronického srdečního selhání; plicní edém; kardiogenní šok.
Podle ejekční frakce levé komory: srdeční selhání se sníženou ejekční frakcí (heart failure with reduced ejection fraction –HFrEF) s EF ≤ 40 %; srdeční selhání s mírně redukovanou ejekční frakcí (heart failure with mildly reduced ejection fraction –HFmrEF) s EF 41–49 %; srdeční selhání se zachovalou ejekční frakcí (heart failure with preserved ejection fraction – HFpEF) s EF ≥ 50 %.
Srdeční selhání se zlepšenou EF (HF with improved EF – HFimpEF) s EF iniciálně < 40 % a posléze došlo ke zlepšení EF o > 10 %, přičemž EF je při druhém měření > 40 %.
Podle etiologie srdečního selhání: akutní koronární syndrom (AKS); chronická ischemická choroba srdeční (ICHS); hypertenze; chlopenní vady (zejména aortální stenóza/insuficience, mitrální insuficience/stenóza a trikuspidální regurgitace); vrozené srdeční vady; dilatační kardiomyopatie; hypertrofická kardiomyopatie; restriktivní kardiomyopatie; arytmogenní kardiomyopatie; akutní myokarditida; srdeční selhání na podkladě diastolické dysfunkce; peripartální kardiomyopatie; takotsubo syndrom; kardiomyopatie vyvolané toxiny (zejména alkoholem); léky indukované srdeční selhání; infiltrativní onemocnění srdce; střádavé onemocnění srdce; onemocnění perikardu; metabolické onemocnění myokardu.
Podle klinického profilu pacienta podle známek kongesce a periferní perfuze: pacient s přítomností známek kongesce (plicní městnání, ortopnoe/paroxysmální noční dušnost, periferní otoky, dilatace jugulárních žil, kongestivní hepatomegalie, anasarka, hepatojugulární reflux) se označuje jako pacient vlhký (wet), při nepřítomnost kongesce jako suchý (dry); přítomnost periferní hypoperfuze (studené opocené končetiny, oligurie, zmatenost při hypoperfuzi, slabost/vertigo nebo velmi nízký pulzní tlak) se označuje jako studený (cold), naopak absence známek hypoperfuze se označuje jako teplý (warm). Hypoperfuze není synonymem pro hypotenzi, ale často může být hypotenzí provázena. Kombinací těchto dvou parametrů lze pacienty rozdělit do čtyř skupin: teplý‑suchý (warm‑dry), teplý‑vlhký (warm‑wet), studený‑suchý (cold‑dry) a studený‑vlhký (cold‑wet).
Podle rizikovosti pacienta: nízce rizikový a vysoce rizikový pacient. Vysoce rizikové pacienty s akutním srdečním selháním je třeba okamžitě identifikovat a zahájit léčbu. Mezi známky vysokého rizika patří těžká klidová dušnost/hyposaturace, hyperkapnie, respirační acidóza, hypotenze, nízký pulzní tlak (rozdíl mezi systolickým a diastolickým tlakem pod 30–35 mmHg), známky šoku včetně poruchy vědomí, elevace laktátu ≥ 2 mmol/l, studených končetin. Dále sem patří pacienti s akutním koronárním syndromem s běžící ischemií (trvající stenokardie) a známkami srdečního selhání, s hypertenzní krizí, se závažnými arytmiemi nebo akutní plicní embolií.
Podle stupně srdečního selhání (podle Univerzální definice a klasifikace srdečního selhání 2021):
A – (At risk) – pacienti v riziku rozvoje srdečního selhání, bez současných či předchozích symptomů/známek srdečního selhání, bez strukturálních srdečních změn (např. pacienti s diabetes mellitus – DM, s ICHS, s hypertenzí, obezitou)
B – (PRE‑HF) – pacienti bez symptomů/známek srdečního selhání, ale s přítomným strukturálním srdečním onemocněním, abnormální srdeční funkcí nebo elevací natriuretických peptidů a/nebo troponinu
C – (HF) – pacienti se srdečním selháním
D – (ADVANCED HF) – těžké srdeční selhání v klidu, opakované hospitalizace, kandidáti nebo léčení transplantací srdce, mechanickou srdeční podporou nebo na paliativní léčbě
Tab. 2.29 Spouštěče akutní dekompenzace srdečního selhání
• akutní koronární syndrom/ischemie
• tachyarytmie (např. fibrilace síní, komorová tachykardie)
• hypertenze nedostatečně korigovaná
• infekce (nejčastěji respirační infekce, uroinfekce, infekční endokarditida…)
• non‑compliance – vynechání léčby srdečního selhání, zejména diuretik
• bradyarytmie
• nepřiměřený abúzus toxických substancí (alkohol, drogy)
• léky (nesteroidní antiflogistika, kortikoidy, negativně inotropní léky, kardiotoxická chemoterapie)
• akutní exacerbace chronické obstrukční plicní nemoci
• plicní embolie
• metabolická hormonální dysbalance (onemocnění štítné žlázy, dysfunkce nadledvin, těhotenství)
• cévní mozková příhoda (ischemická či hemoragická)
• akutní mechanická komplikace (mechanické komplikace AKS, trauma hrudníku, aortální disekce, akutní poškození chlopní, trombóza arteficiální chlopně)
• chirurgické a perioperační komplikace
ještě přednemocničně s cílem časně identifikovat pacienty s akutním srdečním selháním, posoudit jejich rizikovost a rozpoznat příčinu nebo trigger selhání. Tento postup ovlivňuje mortalitu a délku hospitalizace nemocných.
2.6.2.1 Anamnéza
Při odběru anamnézy se zaměřujeme na přítomnost předchozího srdečního onemocnění a rizikových faktorů kardiovaskulárních onemocnění jak u pacienta samotného, tak v jeho rodině. Pátráme po anamnéze infarktu myokardu, možné koronární aterosklerózy (námahové bolesti na hrudi), hypertenze, diabetu, dyslipidemie, arytmií (nepravidelné bušení srdce) a kouření. Přítomnost chronického srdečního selhání je nejrizikovějším faktorem rozvoje akutního srdečního selhání, nicméně akutní selhání se může vyvinout i de novo, tedy u pacientů bez dosud známé kardiální dysfunkce. Současně pátráme po příčinách a spouštěcích faktorech ASS. Pozor: Pacienti s akutním srdečním selháním jsou často v dechové tísni, pak se soustředíme jen na nejdůležitější údaje!
2.6.2.2 Symptomy
Vedoucím symptomem akutního srdečního selhání je duš nost, námahová nebo až klidová. Ortopnoe je dušnost zvýrazňující se vleže, nemocného nutí vyhledávat polohu vsedě. Objevuje se často v noci, potom ji nazýváme paroxysmální noční dušnost nebo též noční asthma cardiale. Tíže dušnosti by měla být objektivně zhodnocena změřením respirační frekvence a saturace hemoglobinu pomocí pulzního
oxymetru. Dušnost je často doprovázená kašlem, někdy s vykašláváním zpěněného sputa. Progredující slabost, únava a nevýkonnost jsou známky nízkého dopředného srdečního výdeje. Nechutenství, pocit nadmutého břicha, bolest v pravém podžebří vznikají v důsledku městnání v gastrointestinálním traktu a játrech.
2.6.2.3 Objektivní známky/příznaky
Selhávání levé komory vede k městnání v plicním oběhu a/nebo snížené perfuzi orgánů. Klinickým korelátem plicního městnání jsou nepřízvučné chrůpky na plicích, predilekčně se objevují vpravo bazálně, podle tíže selhávání postupují oboustranně a od bází až k plicním apexům. U části pacientů dochází k městnání v plicním intersticiu, poslechový nález nemusí být výrazný, resp. nacházíme jen bazálně zostřené dýchání nebo pískoty a vrzoty, které mohou imponovat jako asthma bronchiale. Pokročilý obraz selhání s přítomností tekutiny v alveolech je charakteristický přítomností vlhkých chropů po celých plicních polích a označujeme jej jako plicní edém. Nízký srdeční výdej selhávajícího srdce vede hypotenzi a k poklesu perfuze orgánů, důsledkem je alterace mentálního stavu, bledost kůže, chladná periferie, periferní cyanóza. Nitkovitý pulz je obrazem hypotenze, důsledkem snížené perfuze ledvin je oligurie Tachykardie a přítomnost 3. ozvy srdeční označujeme jako cval (poslechově připomíná cval koně).
Obrazem selhávání pravé komory je zvýšená náplň krčních žil a pozitivní hepatojugulární reflux. Zvýšenou náplň krčních žil vyhodnotíme u polosedícího pacienta (45°) z boční strany krku změřením vzdálenosti od sternální jamky po horní okraj náplně v. jugularis externa. Náplň více než 3 cm nad sternální jamkou je označována jako zvýšená náplň a odpovídá zvýšenému centrálnímu žilnímu tlaku. Komprese jater zvětšených při pravostranné kongesci vede k přesunu krve z jaterních sinusoidů do dolní duté žíly, zvýšení tlaku v pravé síni a následně zvýšení náplně krčních žil (tzv. abdominojugulární test/hepatojugulární reflux). Oslabené dýchání bazálně je známkou pleurálního výpotku, typicky bývá přítomen bilaterálně, vzácněji jednostranně (převážně vpravo). Markerem zvýšených pravostranných plnicích tlaků může být i výpotek perikardiální. Známkou kongesce v systémovém oběhu jsou otoky dolních končetin, začínající od kotníků a postupující kraniálně. Tekutina v peritoneální dutině (ascites) a difuzní otok podkoží (anasarka) jsou známkou pokročilé retence tekutin spíše u akutní dekompenzace chronického srdečního selhání, u akutního rychle progredujícího selhání mohou chybět.
2.6.2.4 EKG
Dvanáctisvodové EKG je základní paraklinickou vyšetřovací metodou. Nález na EKG bývá často nespecifický (obr. 2.25), nicméně diagnóza akutního srdečního selhání u pacientů se zcela normálním EKG je málo pravděpodobná (pod 2 %). Navíc EKG může ukázat na příčinu/trigger akutního selhání (akutní infarkt myokardu, supraventrikulární nebo komorová tachykardie, bradyarytmie, hypertrofie myokardu…), provedení EKG je proto v diagnostickém algoritmu akutního srdečního selhání doporučeno co nejdříve.
Obr. 2.25 EKG pacienta referovaného pro progredující dušnost, otoky dolních končetin, diagnostikováno bylo akutní srdeční selhání na podkladě dilatační kardiomyopatie. Je přítomna sinusová tachykardie, vektor srdeční osy směřující doprava, nižší voltáž v končetinových svodech, chybí progrese R kmitů ve svodech V1–V4 , ploše negativní diskonkordantní vlny T v anterolaterálních hrudních svodech. EKG nález je nespecifický.
2.6.2.5 Rtg hrudníku
Rtg hrudníku má význam především v diferenciální diagnostice akutně vzniklé dušnosti (pneumotorax, zánětlivá infiltrace, nádorové ložisko). Pro samotnou diagnózu akutního srdečního selhání má pouze konfirmační hodnotu, až u 20 % pacientů s akutním srdečním selháním může být rtg nález normální. Rtg obraz plicního městnání lze rozdělit do tří stadií: 1. stadium: plicní kongesce, tj. redistribuce krve do dilatovaných žil horních laloků; 2. stadium: intersticiální
plicní edém, transudovaná tekutina proniká do intersticia a je patrná ve formě Kerleyho B-linií v mezilobulárních septech, neostrých kontur plicních hilů a lehkého zastření plicních polí (obr. 2.26); 3. stadium: intraalveolární plicní edém, transudát proniká do alveolů a vzniká obraz „motýlka“, symetrické zastření plicních polí nasedající na hily. Kromě obrazu městnání můžeme v rtg obraze najít rozšířený srdeční stín (kardiotorakální index [KTI] > 50 %) nebo pleurální výpotky. Zánětlivá infiltrace je často triggerem akutní dekompenzace u pacientů s chronickým selháním.
Obr. 2.26 Vlevo: rtg obraz u pacienta s de novo srdečním selháním. Dilatace srdečního stínu, akcentace cévní kresby perihilózně, nevelké pleurální výpotky bilaterálně, vpravo: detail na Kerleyho B‑linie (žluté šipky)
2.6.2.6 Natriuretické peptidy
BNP (B – brain; mozkový natriuretický peptid) a NT-proBNP (N-terminální fragment proBNP) hrají významnou roli v diagnostickém algoritmu pacientů s podezřením na akutní srdeční selhání. Nízké hodnoty BNP ˂ 100 ng/l (pg/ml), resp. NT‑proBNP ˂ 300 ng/l (pg/ml) činí diagnózu akutního srdečního selhání vysoce nepravděpodobnou (negativní prediktivní hodnota 0,94–0,98), naopak vysoké hodnoty diagnózu akutního srdečního selhání podporují. Zároveň však zvýšené hodnoty natriuretických peptidů mohou být způsobeny řadou dalších kardiálních i nekardiálních onemocnění (pozitivní prediktivní hodnota pro srdeční selhání je 0,66–0,67) (tab. 2.30). Vyšetření natriuretických peptidů je mimo diagnostiku akutního srdečního selhání přínosné i pro monitoraci efektu léčby a odhad prognózy nemocných. Pozor: U pacientů s pokročilým chronickým srdečním selháním, obezitou či izolovaným pravostranným srdečním selháním mohou být hodnoty natriuretických peptidů falešně snížené.
2.6.2.7 Echokardiografie
Echokardiografie je zobrazovací metodou volby u pacientů s podezřením na akutní srdeční selhání. Umožňuje detekovat strukturální a/nebo funkční abnormalitu srdce, jakožto základní podmínku pro diagnózu akutního srdečního selhání. Při echokardiografickém vyšetření hodnotíme rozměry srdečních dutin, systolickou a diastolickou funkci komor, přítomnost chlopenních vad, posuzujeme stav volumové náplně, resp. levo- i pravostranných plnicích tlaků, dopplerovsky lze měřit srdeční výdej a přítomnost plicní hypertenze, hodnotíme případnou přítomnost a hemodynamickou významnost perikardiálního výpotku. Ultrazvukové vyšetření dolní duté žíly umožňuje posoudit stav intravaskulární tekutinové náplně, dilatovaná dolní dutá žíla > 21 mm, která kolabuje o méně než 50 % při usilovném dýchání, svědčí pro žilní kongesci a zvýšení centrálního žilního tlaku. Okamžité provedení echokardiografie je nutností u pacientů s hemodynamickou nestabilitou nebo pokud předpokládáme život ohrožující komplikace (např. mechanická komplikace infarktu). Echokardiografie pomůže odlišit některé nekardiální příčiny akutních stavů (hyperdynamická cirkulace u sepse, hypovolemie). Výhodou echokardiografie je dostupnost,
neinvazivnost a opakovatelnost, lze ji tak využít při monitoraci efektu terapie (hodnocení stavu kongesce, měření srdečního výdeje) (obr. 2.27).
2.6.2.8 Plicní ultrazvuk
Význam plicního ultrazvuku v diagnostice akutního srdečního selhání v posledních letech stoupá. Typickým nálezem u pacientů s akutním srdečním selháním je přítomnost tzv. B-linií, označovaných též jako komety. Jedná se o vertikálně orientované pruhovité echogenní signály, vznikající na rozhraní vzduch–voda v důsledku zmnožení tekutiny v intersticiu. Za diagnostické kritérium pro ASS s vysokou senzitivitou (94–97 %) a specificitou (97 %) se považuje přítomnost alespoň tří B-linií v minimálně dvou ze čtyř segmentů hrudního pole, a to oboustranně (obr. 2.28). Ultrazvukovým vyšetřením plic lze též zobrazit pleurální výpotky, posoudit jejich lokalizaci, velikost či charakter a zobrazit ideální místo k pleurální punkci. Plicní ultrazvuk lze využít k monitoraci efektu léčby dekongesce (tab. 2.31).
Diagnostický algoritmus pacientů s podezřením na akutní srdeční selhání a hodnoty BNP u pacientů s akutní dušností jsou uvedeny na obrázcích 2.29 a 2.30.
2.6.3 Prehospitalizační fáze akutního srdečního selhání
Stejně jako u akutních koronárních syndromů by pacienti s akutním srdečním selháním měli dostat adekvátní léčbu co nejdříve. V přednemocničním prostředí pacienti s akutním srdečním selháním profitují z neinvazivní monitorace pulzní oxymetrií, měření krevního tlaku, dechové frekvence a kontinuální monitorace EKG. V rámci prvního kontaktu musí být provedeno 12svodové EKG k vyloučení akutní ischemie a život ohrožujících arytmií. Rutinní podání kyslíku nebo neinvazivní plicní ventilaci lze zvážit u pacientů se saturací < 90 % a se známkami respirační tísně (ortopnoe, dechová frekvence nad 25/min, použití akcesorních dýchacích svalů atd.). V případě progredující hyposaturace, známek vyčerpání či poruchy vědomí je indikována umělá plicní ventilace (viz kap. Akutní respirační selhání). Při známkách kongesce (otoky, chrůpky na plicích) mohou být podána diuretika (furosemid v iniciální dávce 40 mg), podání intravenózních
Tab. 2.30 Kardiální a nekardiální příčiny elevace natriuretických peptidů
Kardiální Nekardiální srdeční selhání vrozené srdeční vady věk závažné infekce akutní koronární syndrom tachy‑/bradyarytmie ischemická CMP popáleniny plicní embolie kontuze srdce subarachnoidální krvácení anemie myokarditida kardioverze, výboj ICD renální insuficience metabolické a hormonální (tyreotoxikóza, diabetická ketoacidóza) hypertrofie levé komory plicní hypertenze jaterní insuficience kardiomyopatie kardiochirurgická operace paraneoplastický syndrom chlopenní vady
CHOPN
CMP – cévní mozková příhoda, CHOPN – chronická obstrukční pulmonální nemoc, ICD – implantabilní kardioverter‑defibrilátor
d
Obr. 2.27 Různé příčiny a patofyziologické mechanismy vedoucí ke stejnému syndromu akutního srdečního selhávání: a) výrazně dilatovaná levá komora se sníženou systolickou funkcí, b) významná aortální regurgitace (barevný jet z ascen dentní aorty směřující do levé komory), c) perikardiální výpotek, d) hypertrofie levé komory při aortální stenóze (*), výrazně kalcifikovaná aortální chlopeň (ovál), e) ruptura mezikomorového septa jako následek akutního infarktu myokardu (šipka)
Obr. 2.28 Vlevo: metodika provádění plicního ultrazvuku. Levý i pravý hemitorax jsou rozděleny na čtyři segmenty. Přítom nost alespoň tří B‑linií v minimálně dvou segmentech na každé straně ukazuje na srdeční selhání. Vpravo: plicní ultrazvuk u pacienta s akutním srdečním selháním. Jsou viditelné tři vertikálně orientované echogenní pruhy, tzv. B‑linie (hvězdičky).
Tab. 2.31 Možnosti monitorace kongesce a hypoperfuze u akutního srdečního selhání Kongesce Hypoperfuze otoky DKK, anasarka, ascites studená, chladná periferie, porucha vědomí, prodloužený kapilární návrat, hypotenze hepatomegalie, hepatojugulární reflux, zvýšené hodnoty obstrukčních jaterních testů GGT, ALP
zvýšené hodnoty laktátu > 2 mmol/l elevace náplně jugulárních žil
hypoperfuze jater s nárůstem ALT, AST městnání v plicní cirkulaci (nepřízvučné chrůpky, fluidotorax, B‑linie podle plicního UZV)
hypoperfuze ledvin s oligourií a nárůstem kreatininu dilatace dolní duté žíly podle UZV (průměr > 21 mm, při usilovném nádechu kolabuje < 50 %, svědčí pro zvýšený CŽT 10–20 mmHg)
snížený dopředný srdeční výdej (dopplerovské měření ultrazvukem)
ALP – alkalická fosfatáza, ALT – alaninaminotransferáza, AST – aspartátaminotransferáza, CŽT – centrální žilní tlak, DKK – dolní končetiny, GGT – gama‑glutamyltransferáza, UZV – ultrazvuk
diagnostický postup u nemocných s nově vzniklým akutním srdečním selháním (AHF)
anamnéza, příznaky a známky srdečního selhání
– EKG
– pulzní oxymetrie – echokardiogra e – základní laboratorní vyšetření – rtg hrudníku – ultrazvuk plic – další speci cká vyšetření
stanovení natriuretických peptidů
AHF vyloučeno AHF potvrzeno
podrobné echokardiogra cké vyšetření
Obr. 2.29 Diagnostický algoritmus pacientů s podezřením na akutní srdeční selhání (převzato ze Souhrnu doporučených postupů ESC pro diagnostiku a léčbu srdečního selhání 2021)
BNP (pg/ml)
jiné chřipka plicní embolie pneumonie asthma bronchiale bronchitida chronická obstrukce dýchacích cest arytmie bolest na hrudi akutní koronární syndrom akutní srdeční selhání
(pmol/l)
Obr. 2.30 Hodnoty BNP u pacientů s akutní dušností (upra veno podle Maisel A, et al. J Am Coll Cardiol 2010; 55(19): 2062–2076)
nitrátů indikujeme při absenci hypotenze. Alternativou je podání nitrátu sublinguálně. Pacienti jsou ideálně převáženi na oddělení urgentního příjmu, kde pokračuje diagnostický proces a léčba. Důležitá je časná identifikace vysoce rizikových pacientů a jejich hospitalizace na JIP. Mezi známky vysokého rizika patří těžká klidová dušnost/hyposaturace, hyperkapnie, respirační acidóza, tachypnoe > 25 dechů/min, zapojení pomocných dýchacích svalů, hypotenze se systolickým krevním tlakem < 90 mmHg, nízký pulzní tlak, známky systémové hypoperfuze včetně poruchy vědomí, oligurie, elevace laktátu ≥ 2 mmol/l a studené končetiny. Dále sem patří pacienti s akutním koronárním syndromem s běžící ischemií a známkami srdečního selhání, s hypertenzní krizí, se závažnými arytmiemi nebo akutní plicní embolií.
I v případě příznivé reakce na léčbu již na oddělení urgentního příjmu je třeba vždy zvážit krátkodobou hospitalizaci k vyloučení počínající infekce, zhoršení renálních funkcí, vyloučení arytmií, ke kontrole iontů a titraci léčby srdečního selhání.
2.6.4 Akutní dekompenzace srdečního selhání (mírné srdeční selhání)
Akutní dekompenzace srdečního selhání je nejčastější formou akutního srdečního selhání. Jedná se o srdeční selhání,
které svou tíží nesplňuje definici plicního edému, kardiogenního šoku nebo izolovaného selhání pravé komory. Často se vyskytuje u pacientů s anamnézou chronického srdečního selhání napříč celým spektrem ejekční frakce levé komory. Progrese trvá většinou v řádů dnů, často dochází k postupné retenci tekutin, která je zodpovědná za projevy kongesce, někdy provázené hypoperfuzí. Pacienti se většinou prezentují normálním nebo nízkým systolickým krevním tlakem. Základem léčby je rozpoznat a léčit příčinu nebo trigger selhání a důsledná dekongesce pomocí diuretické léčby, v případě potřeby doplněná léčbou inotropní a vazopresorickou (při známkách nízkého srdečního výdeje a periferní hypoperfuze). Po stabilizaci pacienta by měla následovat postupná titrace léčby chronického srdečního selhání (ACEI/sartany/ sakubitril-valsartan, BB – betablokátory, MRA – antagonisté mineralokortikoidních receptorů a SGLT2i – inhibitory sodíko-glukózových kotransportérů neboli glifloziny) a optimalizace dávky perorálních diuretik podle stavu kongesce.
2.6.5 Akutní plicní edém
Akutní plicní edém vzniká v důsledku plicní kongesce při dysfunkci levostranných plicních oddílů. Klinická kritéria pro plicní edém zahrnují dušnost, ortopnoi, respirační selhání vyjádřené hypoxemií s SpO2 < 90 % s eventuální hyperkapnií, tachypnoí (> 25 dechů/min). Základem léčby je: 1. zajištění adekvátní oxygenace (viz dále), 2. diuretická léčba, 3. vazodilatační léčba – intravenózní nitráty, alternativně sublingvální podání při systolickém TK nad 110 mmHg.
V případě, že je plicní edém spojen s nízkým srdečním výdejem, lze přidat inotropní, případně vazopresorickou podporu k udržení perfuzního tlaku (střední arteriální tlak >65 mmHg). Po stabilizaci pacienta by měla následovat titrace léčby chronického srdečního selhání (ACEI/sartany/ sakubitril-valsartan, BB, MRA a SGLT2i) a optimalizace dávky perorálních diuretik podle stavu kongesce.
2.6.6
Izolované selhání pravé komory
Selhání pravé komory je spojeno se zvýšenými plnicími tlaky pravé komory, pravé síně a systémovou kongescí. Selhávání pravé komory může vést ke sníženému plnění levé komory a tím způsobit systémovou hypoperfuzi. Kličková diuretika jsou lékem volby, v případě systémové hypoperfuze lze zvážit podání vazopresorů a pozitivně inotropní léčbu. V případě inotropní léčby lze preferovat léky snižující srdeční plnicí tlaky (levosimendan, milrinon), jejich použití může vést k hypotenzi a nutnosti současného podání vazopresorů.
2.6.7 Léčba pacientů s akutní dekompenzací srdečního selhání a plicním edémem
2.6.7.1 Diuretická léčba
Intravenózní diuretická léčba je základem léčby akutního srdečního selhání, která má promptně ulevit dušnosti a vést k dekongesci – odstranění plicního městnání a otoků.
Objemové přetížení je u akutního srdečního selhání časté. Diuretika zvyšují exkreci vody i minerálů v renálních tubulech. Tím se snižuje objem plazmy, extracelulární tekutiny, celkové množství vody a sodíku v organismu. Podání furosemidu vede k vazodilataci v žilním řečišti, k poklesu plnicích tlaků levé i pravé komory. Diuretika nejsou vhodná u pacientů, kteří jsou dehydratovaní nebo jsou v kardiogenním šoku bez retence tekutin (fenotyp „cold-dry“).
Otázkou je vhodná iniciální dávka kličkových diuretik. Vysoké dávky kličkového diuretika mohou vést časněji k úlevě, vyšší diuréze a dekongesci, ale zároveň mohou způsobit nadbytečnou neurohumorální aktivaci a iontovou dysbalanci. Pacientům bez předchozí léčby kličkovým diuretikem s normálními ledvinnými funkcemi podáváme iniciálně bolus furosemidu 20–40 mg i.v. 2× denně. V případě chronického užívání furosemidu podáváme iniciálně i.v. 1–2násobek denní p.o. dávky. Za dostatečnou diuretickou odpověď považujeme diurézu > 100–150 ml moči/hod. v prvních šesti hodinách. Pokud je pacient v plicním edému a je důležitá rychlá diuretická odpověď, zvláště pokud pacient užívá chronicky diuretika nebo má již známou renální insuficienci, lze podat jako úvodní dávku 80–125 mg i.v. furosemidu. Pokud je diuretická odpověď nedostatečná, po dvou hodinách zdvojnásobíme dávku a postupně opakujeme až do dávky 300 mg furosemidu. Pokud je dále diuretická odpověď nedostatečná, můžeme podat 500–1500 mg furosemidu kontinuálně/24 hod. Při nedostatečné diuretické odpovědi je možné furosemid kombinovat s antagonisty mineralokortikoidních receptorů (i.v. preparát kalium kanrenoát – Aldactone 200 mg i.v., p.o. Verospiron 25–50 mg) a/nebo thiazidovým diuretikem (p.o. hydrochlorothiazid 25–50 mg nebo 500mg acetazolamid). Příčinou rezistence na diuretickou léčbu může být hypoalbuminemie, hyponatremie, hypovolemie nebo acidóza. V případě hyponatremie byl prokázán pozitivní efekt na zvýšení diurézy při podání malého množství hypertonického roztoku chloridu sodného (150 ml 1,4–4,6% NaCl) společně s furosemidem v dávce 125–250 mg. Přechodný vzestup kreatininu do 44 μmol/l lze považovat při diuretické léčbě za přijatelný. Při diuretické léčbě je nutná monitorace iontů (Na, K, Cl, Mg). Přechod na p.o. léčbu furosemidem je možný u stabilního pacienta po dekongesci s dávkou co nejnižší, která ještě zabrání recidivě kongesce.
2.6.7.2 Vazodilatační léčba
Intravenózně podaná vazodilatancia způsobují dilataci v žilní i arteriální části krevního řečiště. Důsledkem venodilatace klesá žilní návrat, čímž dochází ke snížení předtížení (preloadu), dilatace v arteriální části vede k poklesu krevního tlaku, tj. klesá dotížení (afterload) levé i pravé komory. Působí synergisticky s i.v. diuretiky v úlevě dušnosti. Mohou být užitečná převážně u plicního edému s vyšším systolickým krevním tlakem nebo při hypertenzní krizi, nepodáváme je při systolickém TK < 110 mmHg. Vazodilatační léky mohou zároveň ulevit, pokud je srdeční selhání doprovázeno ischemickou chorobou srdeční. V ČR se využívá v této indikaci nitroglycerin (glyceroltrinitrát; preparát Nitro Pohl) nebo isosorbiddinitrát. Nitroglycerin může být podán jako i.v. bolus 1–2 mg i.v. a dále v kontinuální infuzi v iniciální dávce 2–8 mg/h s úpravou dávky podle tlakové odpovědi.


Isosorbiddinitrát (preparát Isoket) je podáván v počáteční dávce 1–2 mg/h a může se navýšit podle tlakové odpovědi na 10 mg/h. Nejčastějším nežádoucím účinkem je bolest hlavy a riziko hypotenze. Při kontinuálním podání dochází k rozvoji tolerance, po 16–24 hodinách je efekt léčby výrazně oslaben. Dalším lékem s vazodilatačním účinkem je nitroprusid sodný, který se v léčbě akutního srdečního selhání neužívá. Vazodilatační efekt má i neseritid (natriuretický peptid), který není v ČR k léčbě registrován.
2.6.7.3 Inotropní léky
Pozitivně inotropní léky zvyšují srdeční výdej zesílením myokardiální kontrakce a zvětšením tepového objemu. Mechanismus účinku spočívá ve zvýšení koncentrace nitrobuněčných vápníkových iontů v důsledku zvýšení hladin cyklického adenosinmonofosfátu (cAMP), buď zvýšením jeho produkce (agonisté betareceptorů – dopamin, dobutamin), nebo inhibicí jeho degradace (inhibitory fosfodiesterázy 3 – milrinon). Levosimendan působí zvýšením citlivosti myocytárních kontraktilních proteinů, zejména troponinu C, k intracelulárním vápníkovým iontům. Pozitivně inotropní efekt tak není závislý na zvýšení intracelulární koncentrace cAMP. Inotropně pozitivní léky mají částečně i vazodilatační efekt a jejich podání může vést k mírnému snížení krevního tlaku. Z patofyziologického hlediska tak kromě zvýšení srdeční kontraktility vedou ke snížení žilního návratu a plnění levé komory (preload) i k poklesu arteriálního tlaku a snížení dotížení levé komory (afterload). Přestože provedené klinické studie neprokázaly mortalitní benefit, v klinické praxi pozorujeme pozitivní symptomatický efekt a rychlejší stabilizaci pacientů. Tyto léky tak mají místo v léčbě akutního srdečního selhání. Jsou indikovány při léčbě pacientů se sníženou kontraktilitou myokardu. U pacientů při středním arteriálním tlaku (MAP) < 65 mmHg jsou podávány v kombinaci s vazopresory. Pokles krevního tlaku při zahájení léčby pozitivně inotropními léky není kontraindikací jejich podání. Inotropika mohou zvyšovat riziko arytmií, adrenergně působící vedou k sinusové tachykardii. Podání levosimendanu může zvýšit diuretickou odpověď furosemidu. Podobně i dobutamin může být podán společně s furosemidem při rezistenci na diuretika a nízkém srdečním výdeji. Léčbu levosimendanem preferujeme u pacientů s dlouhodobou léčbou betablokátory. Ten pak nevysazujeme, pouze můžeme snížit dávku. V praxi je využíván dobutamin, levosimendan a milrinon. Dobutamin podáváme v dávce 2,5–10 μg/kg/min (tj. 2,1–8,4 ml/min pro 70kg člověka v ředění dobutaminu 250 mg v 50 ml). Levosimendan podáváme v dávce 0,05–0,2 µg/kg/min (tj. 8–34 ml/min pro 70kg člověka v ředění levosimendanu 12,5 mg v 500 ml 5% glukózy). Milrinon podáváme v dávce 0,375 až 0,750 μg/kg/ min (tj. 1,6–3,2 ml/h pro 70kg člověka neředěného milrinonu 1 mg/1 ml). Dříve udávaný renoprotektivní efekt nízkých dávek dopaminu nebyl prokázán, dopamin naopak vykazuje poměrně závažné nežádoucí účinky (proarytmogenní, imunosupresivní, inhibičně neuroendokrinní) a v léčbě akutního srdečního selhání není doporučen.
2.6.7.4 Nejdůležitější iontové dysbalance asociované se srdečním selháním
Elektrolytové poruchy bývají u pacientů se srdečním selháním časté, nejčastěji souvisejí s hladinou iontů draslíku, sodíku a chloru. V některých případech mohou být způsobeny iatrogenně.
Hypokalemie neboli snížení plazmatické koncentrace draslíku pod 3,5 mmol/l je u pacientů s akutním srdečním selháním spojeno většinou s aplikací kličkových diuretik, event. v kombinaci s thiazidovými diuretiky. Nebezpečí hypokalemie je především ve zvýšeném riziku komorových arytmií. Prevencí je podání kličkových diuretik společně s kalium šetřícími diuretiky – antagonisty mineralorkotikoidních receptorů a suplementace kalia perorálními přípravky. V těžkých případech hradíme draslík infuzně.
Hyperkalemie čili hladina draslíku v plazmě nad 5,0 mmol/l může být způsobena léčbou inhibitory renin-angiotenzin-aldosteronového systému (RAAS), kalium šetřícími diuretiky a renální insuficiencí. Těžká hyperkalemie (> 6,0 mmol/l) spojená s EKG změnami vyžaduje rychlou léčbu – intravenózní aplikaci kalcia (10 ml calcium chloratum [CaCl2] 10% nebo calcium gluconicum 10%), inzulinu společně s glukózou (např. 250 ml 10% glukózy + 10 IU rychle působícího inzulinu), s nebulizací 1–2 ml salbutamolu (agonista beta-adrenergních receptorů) spolu s furosemidem i.v. (1 mg/kg). Těžkou hyperkalemii provázenou arytmiemi je nutné výjimečně řešit akutní hemodialýzou. Mírnou hyperkalemii včetně chronických stavů lze řešit orálně podávanými iontoměniči, v ČR je dostupný calcium polystyrensulfonát (calcium resonium); další léky zatím v ČR dostupné nejsou: cyklokřemičitan sodného zirkonia (natrium zirconium cyklosilikát) a patiromer sorbitex calcium.
Při hyponatremii bývá sodík snížen pod 136 mmol/l, příčinou může být hemodiluce při akutní dekompenzaci chronického srdečního selhání. Pokud jsou přítomny příznaky jako zvracení, porucha vědomí či křeče, jedná se o těžkou hyponatremii, která může být provázena edémem mozku a která vyžaduje akutní korekci aplikací koncentrovaného roztoku NaCl nitrožilně s cílem zvýšení natremie o 5–10 mmol/l. V případě chronické hyponatremie u pacientů s mírnými příznaky (nauzea, bolest hlavy) by měla korekce probíhat velmi pomalu, a to rychlostí 0,5–1,0 mmol/l/h, za den by se hodnota natremie neměla zvýšit o více než 8 mmol/l. U asymptomatických pacientů (> 124 mmol/l) se lze suplementaci natria většinou vyhnout a vzestupu natremie docílit pomocí restrikce tekutin (1 litr/den). V léčbě hyponatremie byl účinný selektivní antagonista V2 receptorů vazopresinu (antidiuretického hormonu) tolvaptan, který ale není v ČR běžně dostupný. Ve studiích se neprokázal jeho pozitivní efekt na dlouhodobou prognózu.
Hypochloremie je charakterizovaná koncentrací chloridů pod 96 mmol/l. U pacientů s akutním srdečním selháním je spojena s nepříznivou prognózou. Sérové chloridy hrají důležitou roli v odpovědi na kličková a thiazidová diuretika. Ke korekci izolované hypochloremie lze použít acetazolamid, který koriguje hypochloremii a zvyšuje diurézu u akutního srdečního selhání.
2.6.7.5 Oxygenační a ventilační podpora u pacientů s akutním srdečním selháním
Pacienty s respirační insuficiencí identifikujeme na základě klinického vyšetření a změření saturace periferní krve kyslíkem (SpO2). Při dechové frekvenci nad 25/min a SpO2 pod 90 % použijeme některou z forem oxygenační či ventilační podpory. Oxygenační podpora u srdečního selhání má za cíl udržet saturaci arteriální krve v rozmezí 92–95 %, naopak důležité je se vyhnout hyperoxii! Aplikace kyslíku 2–6 litrů za minutu prostou nazální kanylou v mírnějších případech stačí ke korekci hypoxemie, v případě nutnosti vyšších rychlostí kyslíku (5–15 litrů/min) použijeme buď obličejovou masku, či masku s rezervoárem. Pokud se nedaří zvládnout respirační insuficienci výše uvedenými formami konvenční oxygenoterapie, lze použít neinvazivní, tzv. vysokoprůtokovou oxygenoterapii (high-flow nasal cannula, HFNC), při níž pomocí speciální nazální kanyly aplikujeme ohřátou a zvlhčenou směs vzduchu a definované frakce kyslíku rychlostmi 40–60 litrů/min. Frakce kyslíku (FiO2) se obvykle pohybuje mezi 50 až 100 %. Pozitivem HFNC je obvykle dobrá tolerance pacientem a také geneze určitého pozitivního end-exspiračního tlaku (positive end-expiratory pressure, PEEP) v dýchacích cestách, jenž má u pacientů s levostranným srdečním selháním pozitivní efekt (viz dále).
Při nedostupnosti či nedostatečnosti HFNC musíme použít ventilační podporu ve formě buď neinvazivní (non-invasive ventilation, NIV), nebo invazivní umělé plicní ventilace. Podmínkou NIV je zejména zachované vědomí pacienta, limitací může být horší tolerance těsnicí obličejové masky či k tomu určené speciální helmy. NIV probíhá buď jako prostý kontinuální přetlak v dýchacích cestách (continuous positive airway pressure, CPAP), nebo na připojeném ventilátoru nastavujeme spolu s PEEP i pozitivní tlakovou podporu v inspiriu. Oxygenaci pacienta ovlivňujeme pomocí FiO2 (iniciálně obvykle 60–100 %) a úrovní PEEP (či CPAP). Samotný PEEP má pozitivní účinky zejména díky otevření části atelektatických oblastí plic a také snížení dotížení (afterloadu) levé komory. Zpočátku volíme nižší úroveň PEEP (5 cm H2O) i tlakové podpory (5–7 cm H2O), vyšší tlaky mohou být iniciálně hůře tolerovány.
V případě progrese respiračního selhání, intolerance NIV či přítomnosti poruchy vědomí pacienta je indikovaná inva‑ zivní umělá plicní ventilace (UPV) se zajištěním dýchacích cest nejčastěji endotracheální kanylou. Iniciálně nastavujeme buď objemově, či tlakově řízenou ventilaci, většinou bývá nutná analgetizace a sedace pacienta (kombinace opioidu s propofolem v prvních 72 hodinách, při nutnosti delšího tlumení je ke zvážení změna za midazolam). Oxygenaci pacienta (saturaci arteriální krve) ovlivňujeme pomocí FiO2 a PEEP, eliminaci CO2 zase primárně minutovou ventilací (dechová frekvence a objem).
Pacienty se srdečním selháním a respirační insuficiencí je třeba pečlivě monitorovat pomocí opakovaného klinického vyšetření (subjektivní pocit dušnosti, dechová frekvence, použití pomocných respiračních svalů, poslechový nález na plicích, SpO2) a laboratorních metod (v těžších případech arteriální krevní plyny, laktát). Dynamika těchto parametrů v čase je při rozhodování o indikaci konkrétní formy podpory daleko podstatnější než jednotlivé hodnoty. Nezastupitelnou roli v managementu těchto pacientů také
hraje opakované sonografické vyšetření hrudníku a plic (posouzení výpotků a event. jejich zaměření před drenáží, přítomnost a četnost B-linií). Stručný algoritmus postupu u pacienta s respirační insuficiencí na základě srdečního selhání je uveden na obrázku 2.31
2.6.8 Kardiogenní šok
Kardiogenní šok (KŠ) je stav charakterizovaný hypoperfuzí orgánů v důsledku nízkého srdečního výdeje přes adekvátní náplň vaskulárního řečiště. Nejčastější příčinou je akutní infarkt myokardu, méně často jsou příčinou akutní dekompenzace chronického srdečního selhání a end-stage srdečního selhání, chlopenní vady, akutní myokarditida, takotsubo syndrom, arytmie, akutní dekompenzace hypertrofické KMP, myxom levé síně, intoxikace léky s negativně inotropním efektem nebo postkardiotomický syndrom. Velkou skupinu tvoří pacienti s myokardiálním postižením po kardiopulmonální resuscitaci. V klinické praxi můžeme identifikovat pacienty v riziku rozvoje šoku (stupeň A, bez známek/symptomů šoku), pacienty s počínajícím nebo krátce trvajícím šokovým stavem (stupeň B – hypotenze, tachykardie, nejsou známky rozvinuté hypoperfuze orgánů), skupinu s plně rozvinutým kardiogenním šokem (stupeň C –známky hypoperfuze vyžadující inotropika a vazopresory). Stupeň D jsou pacienti v refrakterním šoku nereagující na iniciální intervenci a stupeň E jsou pacienti v extrémním šoku s probíhající KPR (kardiopulmonální resuscitace) a/nebo na ECMO (extrakorporální mimotělní oběh). Nejčastějšími kritérii pro diagnózu šoku je hypotenze (systolický tlak [sTK] < 90 mmHg) nebo nutnost farmakologické/mechanické podpory k udržení sTK > 90 mmHg a známky hypoperfuze orgánů (oligourie – diuréza < 30 ml/h, chladná periferie, často mramorovaná kůže, alterovaný mentální stav, zvýšená hodnota laktátu > 2 mmol/l). Za pomocné hemodynamické parametry lze považovat nízký srdeční výdej (často je srdeční index CI < 1,8–2,2 l/min/m2). K naplnění definice kardiogenního šoku by měl tento stav hypotenze/hypoperfuze trvat alespoň 30 minut, zároveň musí být adekvátní plnění levé komory (orientačně lze užít tlak v zaklínění PCWP > 15 mmHg nebo při postižení pravé komory enddiastolický tlak pravé komory > 10 mmHg). V diferenciální diagnostice musíme vyloučit hypovolemický šok, disekci aorty, plicní embolii, septický šok, distribuční šok a anafylaktický šok. Výskyt kardiogenního šoku u pacientů s akutním infarktem myokardu s elevacemi ST je 5–8 %. V rámci akutního infarktu myokardu lze z patofyziologického hlediska schematicky rozdělit příčiny rozvoje šoku do šesti skupin, které se mohou vzájemně kombinovat:
1. Rozsáhlá ztráta kontraktilního myokardu s rozvojem těžké systolické dysfunkce levé komory (EF LK většinou < 25 %), vyskytuje se při uzávěru kmene levé koronární tepny, u pacientů po předchozím infarktu myokardu nebo při významném onemocnění tří tepen. Klinicky jsou tito pacienti od počátku charakterizováni nízkým srdečním výdejem, který vede k hypotenzi a kompenzatorní vazokonstrikci s vysokou systémovou vaskulární rezistencí. Mají studenou periferii a obraz mramorované kůže (cold-dry).
2. Významná dysfunkce levé komory, která je potencována rozvojem těžké zánětlivé reakce – SIRS (systemic
neinvazivní UPV – NIV
– iniciálně PEEP 5–7 cm H2O – tlaková podpora 5–7 cm H2O
respirační insu cience – dechová frekvence nad 25/min – SpO2 < 90 %
konvenční oxygenoterapie – nazální kanylou 2–6 l/min – polomaskou 5–10 l/min – maskou s rezervoárem 8–15 l/min monitorace SpO2
cílem SpO2 92–95 %
vysokoprůtoková nazální kanyla – iniciálně průtok 50 l/min, FiO2 50–100 %
pravidelné přehodnocování stavu
progrese stavu odběr arteriálních krevní plynů a laktátu
intubace a invazivní UPV – objemově či tlakově řízená – dostatečná úroveň sedace
Obr. 2.31 Algoritmus léčby pacientů s akutní respirační insuficiencí při akutním srdečním selhání
inflammatory response syndrome) jako reakce na rozsáhlou myokardiální nekrózu. Klinicky sledujeme febrilie > 38 °C, leukocytózu > 12 000/μl, většinou tachykardii > 90/min a teplou periferii. Během 24–72 hodin po infarktu stoupají hladiny zánětlivých působků (C-reaktivní protein, prokalcitonin, interleukin 6), které mají i přímý kardioinhibiční účinek. Zánětlivá odpověď vede ke zvýšené aktivitě inducibilní NO-syntázy (iNOS) s produkcí nepřiměřeného množství oxidu dusnatého (NO). Vysoká hladina NO a jeho derivátů (např. peroxynitrátů) vede k další inhibici kontraktility myokardu, mitochondriální dysfunkci v neischemické části myokardu, snižuje odpověď organismu na katecholaminy a podporuje periferní vazodilataci. Hemodynamicky sledujeme kromě dysfunkce levé komory a nízkého srdečního výdeje normální nebo sníženou periferní vaskulární rezistenci a teplou periferii (warm-dry).
3. Mechanické komplikace infarktu myokardu: a) Ruptura mezikomorového septa se vyskytuje obvykle 2.–8. den po akutním infarktu myokardu, může být provázena rekurentními bolestmi na hrudi bez EKG korelátu a nově vzniklým holosystolickým parasternálním šelestem. Velikost defektu určuje hemodynamickou závažnost levopravého zkratu. V důsledku zkratu dochází k pravostrannému přetížení a rychlému zhoršení stavu v průběhu hodin až dnů pod obrazem pravostranného i levostranného selhání. Ruptura septa, která provází infarkt přední stěny, bývá lokalizována v apikální části septa, infarkt dolní stěny je provázen rupturou v oblasti
bazální části septa a mívá horší prognózu. Diagnóza je stanovena na základě echokardiografického vyšetření s barevným dopplerovským zobrazením levopravého zkratu. V léčbě je doporučována neodkladná chirurgická operace k uzávěru defektu našitím záplaty. U hemodynamicky stabilních pacientů bez selhání je vhodné vyčkat 2–3 týdny od infarktu ke stabilizaci okrajů defektu. U selhávajícího pacienta je indikováno zavedení IABP (intraaortální balonkové kontrapulzace), která dokáže část pacientů hemodynamicky stabilizovat, u těžších průběhů je zvažována implantace krátkodobé mechanické srdeční podpory – systém Impella nebo ECMO.
b) Ruptura volné stěny LK je příčinou až 10 % náhlých úmrtí pacientů s akutním infarktem myokardu během hospitalizace. Zvýšeně rizikový se jeví rozsáhlý přední infarkt v povodí distálního úseku RIA (ramus interventricularis anterior) s dlouhou prodlevou od počátku symptomů k revaskularizaci, bez vytvořených kolaterál, s rozvíjejícím se aneurysmatem, u starších žen a u hypertoniků. Klinicky se prezentuje náhle vzniklým kardiogenním šokem velmi rychle vedoucím k elektromechanické disociaci v důsledku perikardiální tamponády. Mortalita je vysoká, možností léčby je perikardiocentéza, která vede k uvolnění tamponády, podání vazopresorů a emergentní kardiochirurgická operace.
c) Částečná nebo úplná ruptura papilárního svalu vede k akutní mitrální regurgitaci. Nejčastěji je postižen posteromediální papilární sval při infarktu dolní
nebo zadní stěny. Významná mitrální regurgitace je provázena nově vzniklým systolickým šelestem nad hrotem, klinicky vede k rozvoji plicního edému nebo kardiogenního šoku. Komplikace je diagnostikována transtorakální nebo jícnovou echokardiografií nebo při ventrikulografii. K hemodynamické stabilizaci je indikováno zavedení IABP. Načasování kardiochirurgické operace závisí na hemodynamickém stavu pacienta, v případě oběhové nestability je indikován urgentní výkon, v případě stabilního stavu je možno vyčkat 1–3 týdny.
4. Kardiogenní šok při postižení pravé komory, ke kterému dochází nejčastěji při infarktu způsobeném uzávěrem proximálního úseku pravé koronární tepny před odstupem větve zásobující pravou komoru. Infarkt pravé komory se na EKG diagnostikuje elevacemi ST úseku v pravém prekordiu ve svodech V3R–V4R. Pacienti s KŠ v důsledku dysfunkce pravé komory mohou mít vysoký enddiastolický tlak pravé komory (RVEDP), při RVEDP > 20 mmHg dochází k posunutí mezikomorového septa směrem do levé komory a zároveň se zhoršuje plnění levé komory. Změna geometrie rovněž sama zhoršuje systolickou funkci LK. V klinickém obraze převládá hypotenze bez známek levostranného selhání. Echokardiograficky diagnostikujeme abnormní funkci pravé komory a její dilataci, hodnotíme trikuspidální regurgitaci. Časem dochází k částečné úpravě funkce pravé komory. Revaskularizace snižuje hospitalizační mortalitu pacientů s infarktem myokardu pravé komory. V léčbě hypotenze je indikována volumoterapie krystaloidem 1000–2000 ml během první hodiny a dále titrovaně bolusy 200–300 ml do oběhové stabilizace. Enddiastolický tlak pravé komory v rozmezí 10–14 mmHg byl spojen s vyšším srdečním výdejem než vyšší nebo nižší tlaky. V případě, že nedojde k úpravě krevního tlaku volumoterapií, je indikováno podání vazopresorů (noradrenalin) a dobutaminu. Jeho podání u těžké ischemické dysfunkce pravé komory může zvýšit srdeční výdej levé i pravé komory. K vysazení vazopresorů většinou dochází v průběhu několika dnů, nicméně u pacientů může přetrvávat sklon k hypotenzi, který je důvodem nenasazení terapie inhibitory ACE po infarktu myokardu.
5. Kardiogenní šok v důsledku iatrogenního poškození –časné podání nepřiměřené dávky betablokátorů nebo inhibitorů ACE může vést u pacientů s dysfunkcí levé nebo pravé komory, kteří jsou před podáním medikace hraničně tlakově a hemodynamicky kompenzováni, k rozvoji hypotenze a kardiogenního šoku. K léčbě jsou pak nutné vyšší dávky katecholaminů (dobutamin 10 až 20 μg/kg/min). Podání vyšší dávky diuretik u pacienta s akutním infarktem myokardu v plicním edému bez preexistujícího srdečního selhání může vést k výrazné diuretické odpovědi s následnou hypovolemií a hypotenzí špatně reagující na vazopresory. Rovněž podání diuretik u pacientů s infarktem pravé komory může způsobit těžkou hypotenzi a rozvoj kardiogenního šoku.
6. Distribuční šok u pacientů s infarktem myokardu (IM) po kardiopulmonální resuscitaci – až polovina pacientů ve studiích v kardiogenním šoku při IM byla po KPR. Rozvoj šoku je dán kombinací myokardiální dysfunkce/ omráčení, vazoplegie, insuficience nadledvin a hypotalamu při hypoxickém postižení CNS. Dlouhodobé
přežívání je výrazně ovlivněno v této skupině právě proběhlou hypoperfuzí mozku.
2.6.8.1 Echokardiografie, koronarografie, revaskularizace a pravostranná katetrizace u pacientů v kardiogenním šoku
Echokardiografie má zásadní význam při stanovení etiologie kardiogenního šoku a měla by být provedena co nejdříve. Echokardiografické vyšetření posoudí funkci levé a pravé komory, chlopenního aparátu a perikardu, je nezbytné při podezření na mechanickou komplikaci při akutním infarktu myokardu nebo v diferenciálnědiagnostickém algoritmu (pomůže rozlišit disekci aorty, tamponádu, plicní embolii apod.).
Koronarografie by měla být provedena emergentně u všech pacientů s akutním infarktem myokardu (STEMI i NSTEMI) v kardiogenním šoku bez časových omezení od vzniku bolestí. Koronarografie u pacientů v kardiogenním šoku je indikována rovněž při podezření na ischemickou etiologii.
U pacientů v kardiogenním šoku by měla být provedena urgentní revaskularizace pomocí PCI (perkutánní koronární intervence) především na infarktové tepně, revaskularizace neinfarktových tepen, pokud se nejedná o kritickou stenózu, by měla být provedena ve druhé době. Pokud nález nelze řešit pomocí PCI, je vhodné provést operační revaskularizaci koronárním bypassem.
Pravostranná katetrizace může být přínosná pro invazivní hemodynamické vyhodnocení pacienta v kardiogenním šoku. Pravostranná katetrizace Swanovým–Ganzovým balonkovým katétrem je ke zvážení u pacientů v kardiogenním šoku, u kterých se nedaří dosáhnout cílového krevního tlaku. Recentní publikace ukazují, že použití pravostranné katetrizace je spojeno s lepší prognózou pacientů v kardiogenním šoku. Katétr se zavádí převážně cestou centrálního žilního katétru přes v. jugularis nebo v. subclavia, lze ho ale i zavést přes žilní systém na paži. Na konci katétru je malý balonek, který po nafouknutí v pravé komoře pomůže zavést/ zaplavat katétr do plicnice a měřit tlak v zaklínění (PCWP). Po vyfouknutí balonku lze ponechat katétr v plicnici a měřit kontinuálně tlaky v plicnici. Po opětovném měření tlaku v zaklínění je nezbytné stáhnout katétr do pravé komory a balonek nafukovat pouze v komoře! Při nafukování v plicnici hrozí její ruptura! Swanův–Ganzův katétr umožňuje i měření srdečního výdeje termodiluční metodou. Cílová hodnota tlaku v zaklínění (PCWP) je 15–20 mmHg. V případě nižšího PCWP je ke zvážení volumoterapie. Pokud není zaveden Swanův–Ganzův katétr a trvá hypotenze bez výrazné reakce na vazopresory, lze posoudit hemodynamiku pomocí echokardiografie. Při podezření na hypovolemii lze vyzkoušet elevaci DKK – pokud dojde k vzestupu sTK o 10 mmHg, je indikována volumoterapie. Další možností při podezření na hypovolemii je podání tzv. vyzývací dávky 250–500 ml balancovaného krystaloidu. V případě hypotenze v důsledku hypovolemie dojde ke zvýšení krevního tlaku. V případě, že neznáme hodnoty PCWP, lze se orientovat centrálním žilním tlakem (CŽT). Cílová hodnota CŽT u kardiogenního šoku je 10–12 mmHg.


2.6.8.2 Terapie kardiogenního šoku
Cílem terapie je udržení systémového tlaku k zachování perfuze orgánů, zajištění dostatečné oxygenace krve, udržení normálního nebo téměř normálního pH krve a korigování metabolických odchylek vnitřního prostředí včetně hyperglykemie. Důležitou součástí léčby šoku je prevence a léčba komplikací, jako je stresový žaludeční vřed, renální insuficience, infekce dýchacích cest, krvácivých komplikací včetně významné anemie. Léčebné cíle, které pomáhají monitorovat a řídit léčbu pacientů v kardiogenním šoku, jsou uvedeny v tabulce 2.32
Tab. 2.32 Hemodynamické a pomocné cíle při léčbě kar diogenního šoku
• MAP 65–75 mmHg
• diuréza > 0,5 ml/kg/h
• saturace smíšené žilní krve SvO2 > 65 % nebo saturace vena cava superior (ScvO2) > 70 %
• PCWP 15–20 mmHg
• CŽT 8–12 mmHg (při UPV 12–16 mmHg)
• SVR 800–1000 dyn × s × cm‑5
• CI > 2,2 l/min/m2
• TF při s. r. < 110/min
• laktát < 2,2 mmol/l
CI – index srdečního výdeje, CŽT – centrální žilní tlak, MAP – střední arteriální tlak, PCWP – tlak v zaklínění a. pulmonalis, SVR – systé mová vaskulární rezistence, TF – tepová frekvence, UPV – umělá plicní ventilace
■ Farmakologická léčba
Vazopresorická a inotropní léčba titrovaná k udržení dostatečného tlaku a perfuze tkání jsou základem farmakologické léčby kardiogenního šoku. Jako iniciální léčba se v současné době jeví kombinace dobutaminu s noradrenalinem.
Vazopresory jsou indikovány, pokud není možné dosáhnout středního arteriálního tlaku MAP > 65 mmHg. Lékem volby je noradrenalin. Noradrenalin má silný vazokonstrikční α1- a α2-stimulační efekt a mírný β1-stimulační efekt, který se zvyšuje při vysokých dávkách. Noradrenalin podáváme kontinuálně, a jelikož má velmi krátký biologický poločas a široké terapeutické rozmezí, dávka se velmi dobře titruje k dosažení cílového MAP a pohybuje se většinou v rozmezí 0,1–3 μg/kg/min, přechodně lze podat i vyšší dávky k udržení tlaku. U pacientů v kardiogenním šoku prokázal noradrenalin lepší efekt než dopamin včetně nižšího výskytu arytmií. Ke zvážení je podání vazopresorů cestou centrálního žilního katétru a krevní tlak by měl být monitorován kontinuálně pomocí arteriálního katétru. Kardiogenní šok rezistentní na katecholaminy. Příčinou rezistence na podávané vazopresory může být kromě hypovolemie rovněž acidóza, hypoxie, patologicky vysoká tvorba oxidu dusnatého, deplece vazopresinu nebo předchozí terapie vazodilatačními léky a betablokátory. U pacientů v kardiogenním šoku s hypotenzí i přes vyšší dávky noradrenalinu (asi nad 0,5 μg/kg/min) po vyloučení hypovolemie
lze jako rescue terapii podat derivát vazopresin – argipresin. Efekt argipresinu je zprostředkován přes V1 receptory, jejich denzita je větší v systémovém než plicním řečišti, jeho podání nevede k tachykardii, nemá inotropní efekt. Rizikem je, že vazokonstrikční efekt ve splanchnickém řečišti může vést až k ischemii. Argipresin se podává v kontinuální infuzi v dávce 0,01 IU/min, podle klinické odpovědi lze po 15 minutách zvýšit na 0,02 IU/min nebo 0,03 IU/min (při ředění 40 IU do 50 ml je pak rychlost podání 0,75, resp. 1,5, resp. 2,25 ml/h). Příčinou katecholamin-rezistentní hypotenze u pacientů v kardiogenním šoku může být též relativní nadledvinová insuficience. Analogicky jako u pacientů v septickém šoku je ke zvážení při léčbě argipresinem tzv. stresová dávka hydrokortisonu (200 mg/den ve 3–4 dávkách nebo kontinuální infuzí).
Adrenalin je extrémně silný vazokonstriktor. Jeho podání mimo KPR není vhodné, podle některých prací může zvyšovat mortalitu pacientů v kardiogenním šoku. V případě těžké refrakterní hypotenze, například k překlenutí doby do zavedení mechanické srdeční podpory, lze jeho podání zvážit jako přechodnou rescue terapii v dávce 0,01–0,5 µg/kg/min.
■ Inotropní podpora Pozitivně inotropní léky zvyšují srdeční výdej zesílením myokardiální kontrakce a zvětšením tepového objemu. Mechanismus účinku je uveden výše. Lékem první linie je dobutamin v dávce 5–20 μg/kg/min, maximálně 40 μg/kg/ min. Podání levosimendanu u pacientů s akutním infarktem myokardu v kardiogenním šoku je bezpečné, existují práce prokazující jeho pozitivně inotropní efekt. Podání levosimendanu lze zvážit jako inotropní podporu, většinou v kombinaci s noradrenalinem, tak aby se udržel MAP > 65 mmHg. Iniciální dávka je 0,05 μg/kg/min bez úvodního bolusu a dále se zvyšuje podle tlakové odezvy na 0,1–0,2 μg/kg/min. Levosimendan může být preferován u katecholamin-rezistentního šoku před inhibitory fosfodiesterázy 3 (milrinon). Milrinon je selektivní inhibitor fosfodiesterázy 3, který inhibuje degradaci cyklického adenosinmonofosfátu (cAMP) a tím zprostředkovává pozitivně inotropní efekt a zvýšení srdečního výdeje. Inotropní efekt je menší než u dobutaminu. Milrinon může být podán v kombinaci s dobutaminem, nikoliv však společně s levosimendanem pro jejich vazodilatační efekt. U pacientů v kardiogenním šoku nebylo prokázáno snížení mortality při léčbě milrinonem (tab. 2.33). Dopamin není v léčbě kardiogenního šoku doporučen.
Tab. 2.33 Léky s pozitivně inotropním a vazopresorickým efektem používané v léčbě kardiogenního šoku
Rychlost infuze
dobutamin 2–20 (40) µg/kg/min
milrinon 0,375–0,75 µg/kg/min
levosimendan 0,05– 0,2 µg/kg/min
noradrenalin 0,1–3,0 µg/kg/min
argipresin 0,01–0,03 IU/min
adrenalin 0,01–0,5 µg/kg/min
■ Krátkodobé mechanické srdeční podpory v léčbě akutního srdečního selhání
Krátkodobé mechanické srdeční podpory (obr. 2.32) jsou nezbytné u pacientů v kardiogenním šoku k překlenutí kritického období ke zvýšení srdečního výdeje a zajištění perfuze
orgánů, pokud se to nedaří pomocí farmakologické podpory a event. revaskularizace při myokardiální ischemii. Zavedení mechanické srdeční podpory vede k vzestupu krevního tlaku a poklesu laktátu. Přes nespornou hemodynamickou podporu a pozitivní efekt, který sledujeme u pacientů v reálné klinické praxi, nebylo v randomizovaných mortalitních studiích potvrzeno jejich rutinní použití. Časné použití mechanické srdeční podpory před rozvinutím multiorgánového selhání je spojeno s lepšími výstupy.
Extrakorporální membránová oxygenace (extracorporal membrane oxygenation – ECMO) při venoarteriální variantě čerpá krev z pravé síně, která je následně okysličována v oxygenátoru a poté pumpována do arteriálního řečiště pod vysokým tlakem cestou většinou femorální tepny. Okysličená krev se tak dostává k srdci a do mozku retrográdně z ECMO, částečně i z levé komory (pokud je zachována alespoň částečně systolická funkce levé komory a otevírá se aortální chlopeň). ECMO dokáže hemodynamicky stabilizovat pacienta v těžkém kardiogenním šoku, většinou v kombinaci s vazopresorickou podporou. Recentní studie ukázaly, že rutinní použití ECMO u pacientů v kardiogenním šoku nezlepšuje jejich prognózu. Jeho použití je vhodné k hemodynamické stabilizaci pacienta, kde není možná stabilizace farmakologická.
Mikroaxiální pumpa (Impella) je miniaturní čerpadlo zavedené většinou přes femorální tepnu aortou do levé komory, kde nasává krev a kontinuálně ji čerpá do ascendentní aorty. Výkon čerpadla je 2,5–5 l/min. U pacientů v těžkém kardiogenním šoku je použití 2,5 l/min nedostatečné. Použití Impelly vedlo u pacientů se STEMI ke zlepšení hemodynamických parametrů ve srovnání s IABP, ale nezlepšila se 30denní mortalita.
Intraaortální balonková kontrapulzace (IABP) zlepšuje koronární a periferní průtok krve při inflaci balonu v diastole a snižuje práci myokardu a spotřebu kyslíku
Obr. 2.32 a) ECMO – běžící extrakorporální mimotělní oběh u pacienta v kardiogenním šoku zavedený před koronární intervencí na katetrizačním sále, b) miniaxiální pumpa Impella CP „implantovaná“ cestou společné femorální tepny do levé srdeční komory (přibližný obrys levé komory, vtoková část pumpy v LK – jedna šipka, výtoková část pumpy v ascendentní aortě – dvě šipky), c) IABP – intraaortální balonková kontrapulzace (negativní náplň na rentgenu je dána náplní balonu heliem, angiograficky je znázorněna levá koronární tepna – horizontální šipky, kabely EKG – vertikální šipky) a b c
snížením afterloadu rychlou desuflací balonu před zahájením systoly. Její rutinní použití u pacientů v kardiogenním šoku neprokázalo zlepšení prognózy a není indikováno. Je ke zvážení ke stabilizaci pacienta s mechanickou komplikací akutního infarktu myokardu – významnou mitrální insuficiencí nebo rupturou mezikomorové přepážky. Absolutní kontraindikací IABP je významná aortální insuficience a aortální disekce.
■ Hemoeliminační metody v léčbě kardiogenního šoku a akutního srdečního selhání
V případě rozvoje akutního renálního selhání v důsledku kardiogenního šoku je indikováno zahájení hemoeliminačních metod podle obecných doporučení pro intenzivní péči. U hemodynamicky nestabilních pacientů je preferováno použití kontinuálních metod před intermitentními. Absolutní indikací k zahájení hemoeliminačních metod jsou závažné metabolické abnormality (urea > 35,7 mmol/l, hyperkalemie > 6 mmol/l s EKG abnormalitami, hypermagnezemie > 4 mmol/l s anurií, acidóza < 7,15, těžká dysnatremie > 160 mmol/l nebo < 115 mmol/l) či převodnění rezistentní na diuretika. Ovšem i zde platí, že je lépe sledovat trend a eliminaci zahájit dříve, než se uvedené abnormality plně vyjádří. Hemoeliminační metody představují způsob orgánové podpory, ale nikoliv kauzální způsob léčby. Jejich použití může u pacientů v kardiogenním šoku při infarktu myokardu redukovat množství vazopresorů a napomoci k hemodynamické stabilizaci.
2.6.8.3 Rozvoj systémové zánětlivé odpovědi a léčba infekce
Rozvoj systémové zánětlivé reakce (SIRS) provázené febriliemi, leukocytózou a zvýšeným C-reaktivním proteinem je u pacientů s akutním infarktem komplikovaným kardiogenním šokem běžný. Elevace zánětlivých parametrů není automaticky indikací k podávání antibiotik, přestože riziko rozvoje infekce je vysoké. Často u těchto pacientů dochází i k vzestupu prokalcitoninu, hodnota 2 ng/ml je relativně častá, zejména u pacientů s multiorgánovým selháním bez prokázané infekce. Na druhou stranu, u pacientů v kardiogenním šoku jsou infekce časté, zejména respirační (bronchopneumonie) a uroinfekce. Rizikovými faktory pro rozvoj infekce je delší doba na umělé plicní ventilaci, kongesce v malém oběhu a více invazivních vstupů. Proto je nutno aktivně a intenzivně pátrat po možné infekci a terapii antibiotiky zahájit okamžitě při podezření na její rozvoj.
Tab. 2.34 Kategorie srdečního selhání
HFrEF „reduced EF“
HFmrEF „mildly reduced“
Podezření na infekci dýchacích cest budí nově odsávání většího množství sputa nebo hnisavé sputum. Na sepsi je třeba pomýšlet vždy při nově vzniklé orgánové dysfunkci (porucha vědomí, renální poškození, hypotenze, koagulopatie…) nejasné geneze. Rozvoj sepse je nezávislým prediktivním faktorem krátkodobé mortality u pacientů v kardiogenním šoku.
2.7
Chronické srdeční selhání
2.7.1 Úvod do problematiky
2.7.1.1 Definice
Jan Krejčí
Srdeční selhání lze definovat jako stav charakterizovaný přítomností strukturálních či funkčních abnormalit srdce, které vedou k nedostatečnému srdečnímu výdeji nebo je k jeho udržení nezbytné zvýšení intrakardiálních tlaků. Nejde o jedno onemocnění, ale o syndrom, k jehož rozvoji může vést řada příčin, po kterých je vždy nezbytné pátrat.
2.7.1.2 Rozdělení srdečního selhání
Srdeční selhání se dělí podle hodnoty ejekční frakce levé komory (EF LK) na tři kategorie (tab. 2.34): Srdeční selhání se sníženou ejekční frakcí levé komory (tzv. HFrEF) je definováno hodnotou EF LK ≤ 40 %; druhou kategorií je srdeční selhání s mírně sníženou ejekční frakcí levé komory (HFmrEF), kde se EF LK pohybuje v rozmezí 41–49 %. Dnes vnímáme, že tato kategorie je v mnoha ohledech podobná kategorii HFrEF, a do budoucna není vyloučeno, že by se obě tyto kategorie mohly spojit. Třetí kategorií je srdeční selhání se zachovalou ejekční frakcí (HFpEF), u které je EF LK ≥ 50 % a současně jsou přítomny symptomy a známky srdečního selhání spolu s průkazem strukturální a/nebo funkční srdeční abnormality a/nebo zvýšením hodnoty natriuretických peptidů (NP).
2.7.1.3 Epidemiologie
Prevalence srdečního selhání v populaci se postupně zvyšuje. Je to dáno jednak úspěšným zvládnutím akutních stavů v kardiologii, což se s časovým odstupem může projevit
HFpEF „preserved EF“ symptomy srdečního selhání symptomy srdečního selhání symptomy srdečního selhání
EF LK ≤ 40 %
EF LK 41–49 %
Pozn.: Přítomnost strukturálního a/nebo funkčního postižení zvyšuje jistotu diagnózy.
EF LK ≥ 50 %
strukturální/funkční abnormality konzistentní s diastolickou dysfunkcí LK/↑ plnicím tlakem LK zahrnující ↑NP
rozvojem srdečního selhání, a jednak stárnutím populace, protože je známo, že výskyt srdečního selhání (zejména v kategorii HFpEF) se zvyšuje s narůstajícím věkem. Obvykle je udávána prevalence 0,5–2,0 %, nicméně nová data z České republiky dokládají výskyt blížící se 4 %. Srdeční selhání je také nejčastější diagnózou, pro kterou jsou jedinci starší 65 let hospitalizováni.
Prognóza srdečního selhání zůstává přes řadu úspěchů ve farmakologické i nefarmakologické léčbě velmi závažná, až polovina nemocných zemře do pěti let od stanovení diagnózy. Prognóza srdečního selhání je tak horší než u řady onkologických onemocnění.
2.7.1.4 Etiologie
Etiologie je odlišná u jednotlivých kategorií srdečního selhání; obecně lze říci, že nejčastější příčinou je ischemická
choroba srdeční, různé druhy kardiomyopatií, hypertenze, chlopenní či vrozené vady. Identifikace vyvolávající příčiny je zásadní pro možnost kauzální léčby.
2.7.1.5 Klinický obraz
Typickými příznaky, kterými se srdeční selhání manifestuje, jsou dušnost, únava, nevýkonnost a otoky dolních končetin. Dušnost může být nejprve námahová, postupně se může objevovat i v klidu, typická je noční dušnost, která se zmírňuje po posazení. Ekvivalentem dušnosti může být záchvatovitý kašel. Únava a nevýkonnost mají příčinu v nízkém srdečním výdeji, s nímž je spojena periferní hypoperfuze se sníženou dodávkou kyslíku a živin do kosterních svalů a dalších tkání. Hypoperfuze CNS může vést k bradypsychismu, změnám v chování, zmatenosti či spavosti. Periferní otoky mají podklad v retenci tekutin při aktivaci neurohumorálních
NT-proBNP > 125 pg/ml nebo BNP > 35 pg/ml
nebo při silném podezření nebo pokud NT-proBNP/BNP není k dispozici
echokardiogra e
abnormální nálezy
Srdeční selhání potvrzeno. De nuje fenotyp srdečního selhání na základě měření EF LK.
40 % (HFrEF)
podezření na srdeční selhání – rizikové faktory – příznaky a/nebo známky – abnormální EKG 41–49 % (HFmrEF)
etiologie a zahájení léčby
sníženou a zachovalou ejekční frakcí, NT‑pro BNP/BNP – natriuretické peptidy
diagnostický algoritmus pro srdeční selhání
mechanismů (především systému renin-angiotenzin-aldosteron) nebo při městnání krve ve venózním řečišti (systémová žilní kongesce) při dysfunkci pravé komory.
Retence tekutin vede k nárůstu hmotnosti, na druhou stranu nechutenství dané kongescí ve splanchniku či omezeným vstřebáváním živin z gastrointestinálního traktu při jeho snížené perfuzi může vést k hubnutí až do obrazu tzv. kardiální kachexie.
Objektivními příznaky srdečního selhání jsou přítomnost nepřízvučných chrůpků na plicích, zvýšená náplň krčních žil, otoky dolních končetin; zvýšený plnicí tlak levé komory vede ke vzniku cvalového rytmu (přítomnost 3. ozvy), může být přítomna hepatomegalie s hepatojugulárním refluxem, ascites, pleurální výpotek, tachypnoe či tachykardie.
2.7.1.6
Diagnostika
Diagnostika je založena na detekci symptomů a/nebo známek srdečního selhání a objektivním průkazu srdeční dysfunkce. Významnou roli v diagnostice hraje průkaz elevace natriuretických peptidů, resp. algoritmus diagnostiky srdečního selhání je založen na negativní prediktivní hodnotě normálních hladin natriuretických peptidů, zejména u nemocných, kteří dosud nebyli léčeni. Ze zobrazovacích metod hraje klíčovou roli především echokardiografie. Diagnostický algoritmus je na obrázku 2.33
Specifika diagnostiky a léčba jednotlivých typů srdečního selhání jsou uvedeny v separátních podkapitolách. Obecně lze konstatovat, že cílem léčby pacientů se srdečním selháním je zlepšit jejich klinický stav, funkční kapacitu i kvalitu života, zabránit hospitalizacím a snížit mortalitu. Léky, které zlepšují kvalitu života, resp. snižují počet hospitalizací, jsou stejně důležité jako léky s prokázaným efektem na mortalitu. Vedle farmakologické léčby hrají důležitou roli i nefarmakologické přístupy a přístrojová léčba.
Optimální je vůbec zabránit vzniku srdečního selhání, tedy jeho primární prevence. Tou rozumíme prevenci a důslednou léčbu všech chorob, které mohou vést ke vzniku komorové dysfunkce.
Sekundární prevencí srdečního selhání rozumíme zabránění progrese již přítomné komorové dysfunkce do manifestního srdečního selhání a progrese již existujícího srdečního selhání. Prostředky primární a sekundární prevence jsou mnohdy totožné.
2.7.2 Srdeční selhání se sníženou ejekční frakcí levé komory
Jiří Vítovec, Lenka Špinarová
2.7.2.1 Diagnostika a vyšetřovací metody
U všech nemocných s podezřením na srdeční selhání by mělo být provedeno základní laboratorní vyšetření, které by mělo obsahovat: krevní obraz, biochemii včetně HbA1c, TSH (tyreotropní hormon), feritin, vazebnou kapacitu železa a stanovení natriuretických peptidů: NT-proBNP nebo BNP.
Dvanáctisvodové EKG za účelem posouzení rytmu, tepové frekvence, morfologie QRS a dalších abnormalit.
Zátěžové vyšetření (spiroergometrie) je doporučeno u pacientů, kde je zvažována mechanická podpora nebo transplantace srdce; je taktéž cenné k diagnostice němé myokardiální ischemie.
Rentgen srdce a plic je stále důležitý v diferenciální diagnostice řady hrudních patologií, i když v současnosti představuje standard péče vyšetření hrudníku výpočetní tomografií (CT). Rentgen srdce a plic však může prokázat u pacientů se srdečním selháním městnání krve v plicních žilách nebo plicní otok.
Transtorakální echokardiografe (TTE) je metodou volby pro vyšetření systolické a diastolické funkce myokardu levé i pravé komory. Pro stanovení ejekční frakce levé komory (EF LK) se doporučuje použít modifikovanou biplanární metodu s výpočtem podle Simpsonova pravidla. U pacientů s HFpEF je základní patofyziologickou abnormalitou diastolická dysfunkce LK. Žádný izolovaný echokardiografický parametr není natolik přesný, aby bylo možno jej samostatně použít ke stanovení diagnózy diastolické dysfunkce LK. Proto se doporučuje provést komplexní echokardiografické vyšetření zahrnující širokou škálu parametrů, vedle dopplerovských parametrů se jako zásadní ale jeví zhodnocení velikosti levé síně, zbytnění stěn levé komory srdeční a zhodnocení přítomnosti plicní hypertenze. Vyšetření srdce magnetickou rezonancí (cardiac mag netic resonance – CMR) představuje zlatý standard pro měření objemů, hmotnosti i EF jak levé, tak pravé komory.
Magnetická rezonance srdce může být užitečná i pro stanovení etiologie srdečního selhání. Umožňuje tkáňovou charakteristiku myokardu, což je zásadní v diagnostice myokarditidy, infiltrativních či střádavých onemocnění, arytmogenní kardiomyopatie levé komory, dokáže také odlišit ischemickou a neischemickou etiologii dysfunkce levé komory.
Indikace pro koronarografii se zvažuje u pacientů se srdečním selháním a středně vysokou až vysokou předtestovou pravděpodobností ischemické choroby srdeční (ICHS) a přítomnosti ischemie na základě neinvazivních vyšetření s cílem potvrdit ischemickou etiologii a zvážit případnou možnost revaskularizace.
Pravostranná srdeční katetrizace je doporučena u těžkého srdečního selhání a u nemocných indikovaných k mechanické podpoře či srdeční transplantaci, popř. k potvrzení diagnózy HFpEF (může být provedena i při zátěži na lehátkovém ergometru).
Endomyokardiální biopsie se provádí u pacientů s HFrEF k objasnění specifické etiologie (např. při podezření na zánětlivé, infiltrativní nebo střádavé onemocnění myokardu).
2.7.2.2 Léčba
Farmakologická léčba HFrEF se opírá o pět základních lékových skupin (obr. 2.34). První jsou inhibitory systému renin-angiotenzin-aldosteron – sem patří inhibitory ACE, blokátory receptoru AT1 pro angiotenzin II (ARB, sartany) a duální inhibitor angiotenzinových receptorů a neprilysinu (ARNI). Druhou skupinou jsou betablokátory, třetí antagonisté mineralokortikoidních receptorů a čtvrtou skupinou jsou inhibitory SGLT2 (glifloziny). Pátou lékovou skupinou, která sice nemá mortalitní data ani placebem kontrolované
EF LK < 35 % QRS < 130 ms
ICD neischemické (třída IIa) ischemické (třída I)
léčba srdečního selhání se sníženou ejekční frakcí
– ACEI/ARNI – betablokátory – MRA – dapagli ozin/empagli ozin – kličková diuretika při retenci tekutin (třída I)
EF LK > 35 % nebo ICD neindikováno
SR a EF LK < 35 % a QRS > 130 ms
CRT-D/-P
QRS 130–149 ms (třída IIa) QRS > 150 ms (třída I)
pokud symptomy přetrvávají, terapie s doporučením II
Obr. 2.34 Algoritmus léčby srdečního selhání se sníženou ejekční frakcí
ACEI – inhibitory angiotenzin konvertujícího enzymu, ARNI – inhibitory angiotenzinových receptorů a neprilysinu, CRT‑D – resynchronizace s defibrilátorem, CRT‑P – resynchronizace s pacemakerem, EF LK – ejekční frakce levé komory, ICD – implantabilní kardioverter‑defibrilátor, MRA – antagonisté mineralokortikoidních receptorů, SR – sinusový rytmus
studie, a přesto o jejím významu nemáme pochybnosti, jsou diuretika. Dále máme k dispozici léky, které lze podat v některých specifických situacích nebo o jejichž efektu nejsou zcela jednoznačné důkazy.
1. ARB a ARNI (inhibitory ACE [ACEI]/blokátory receptoru AT1 pro angiotenzin II (ARB, sartany) nebo ARNI (inhibitor angiotenzinových receptorů a neprilysinu)
Inhibitory systému renin-angiotenzin-aldosteron, tj. ACEI/ ARB, jsou stále při chronickém srdečním selhání i při asymptomatické systolické dysfunkci levé komory léky první volby. Nyní při jejich klinické nedostatečné odpovědi jsou nahrazovány ARNI (angiotensin receptor neprilysin inhibitor). Vzhledem k individuální hypotenzní odpovědi nemocných a možnému zhoršení renálních funkcí (zejména u starších nemocných s preexistující chronickou renální insuficiencí) je nutné léčbu zahajovat malou, tzv. testovací, dávkou a dávku postupně zvyšovat až do maximální tolerované. Také je nutno pravidelně kontrolovat plazmatickou koncentraci draslíku.
2. Betablokátory (BB)
Betablokátory jsou doporučeny všem symptomatickým nemocným se srdečním selháním (NYHA II–IV) ve stabilizovaném stavu jak ischemické, tak neischemické etiologie a sníženou EF, pokud nemají kontraindikace podávání. Betablokátory podle metaanalýz velkých klinických studií snižují mortalitu především u nemocných se sinusovým rytmem, u nemocných s fibrilací síní je jejich efekt neutrální.
Začínáme s nízkou dávkou, kterou podle tolerance zvyšujeme do maxima. Musíme respektovat absolutní kontraindikace betablokátorů: asthma bronchiale, těžké formy CHOPN, symptomatické bradykardie a hypotenze. U relativních kontraindikací vždy zvažujeme riziko vs. prospěch: diabetes mellitus s možnými hypoglykemickými stavy, lehčí formy CHOPN (zde provést před nasazením spirometrické vyšetření s následným testováním BB), stabilizovaná ischemická choroba dolních končetin (ICHDK). Nutno pamatovat i na to, že jejich nasazení ve fázi akutní dekompenzace je kontraindikované.
3. Antagonisté mineralokortikoidních receptorů (MRA) Léčba nízkými dávkami spironolaktonu či eplerenonu je indikována u nemocných s ejekční frakcí levé komory (EF LK) < 35 %, kteří jsou ve funkční třídě NYHA II–IV nebo měli recentně epizodu oběhové dekompenzace a jsou léčeni kličkovým diuretikem. Kontraindikací jejich nasazení je hyperkalemie.
Základní dávkování spironolaktonu i eplerenonu je 25 mg denně. V případě hyperkalemie má být dávka snížena na polovinu. V případě refrakterního srdečního selhání bez hyperkalemie lze případně zvýšit dávku na 50 mg denně za pečlivé monitorace draslíku.
4. Inhibitory SGLT2 – glifloziny Pozitivní účinky gliflozinů (dapagliflozin, empagliflozin, kanagliflozin, sotagliflozin) na KV systém nelze vysvětlit pouze snížením glykemie. Jejich mechanismus účinku není dosud do všech detailů prozkoumán, ale nepochybně se na
něm podílí ovlivnění řady patofyziologických mechanismů. Zvýšená osmotická diuréza způsobená natriurézou a glukosurií vede ke snížení intravaskulárního objemu a následně i mírnému poklesu krevního tlaku a zvýšení hematokritu. Důležitý je i jejich nefroprotektivní a metabolický efekt. Dávkování je jednoduché, glifloziny není třeba titrovat a podávají se v jedné denní dávce.
5. Diuretika
Diuretika představují symptomatický základ léčby nemocného s městnáním v plicním nebo systémovém oběhu, obvykle v kombinaci s inhibitorem ACE/ARNI, betablokátorem, MRA a gliflozinem. Diuretika jsou indikována jako léčba u plicního městnání nebo periferních otoků, doporučené je použití nejnižší účinné dávky.
Je nutno aktivně sledovat nežádoucí účinky diuretik: hypovolemii, zhoršení renálních funkcí, hypokalemii, hypomagnezemii, hyponatremii, hyperurikemii, poruchu glukózové tolerance, poruchy acidobazické rovnováhy, u amiloridu naopak hyperkalemii. Při nedostatečné diuretické odpovědi zvýšíme dávku na dvakrát denně, kombinujeme kličková a thiazidová diuretika, pátráme, zdali nemocný neužívá nesteroidní antiflogistika či jiné léky snižující diurézu.
Další léky
Vericiguat
Vericiguat je nový lék pro léčbu chronického srdečního selhání určený pro nemocné po epizodě zhoršení chronického srdečního selhání. Účinkuje jako přímý stimulátor sGC (solubilní guanylátcykláza), jehož aktivita není závislá na přítomnosti NO. Je podáván perorálně jedenkrát denně v dávce 2,5, 5 a 10 mg s postupnou titrací nahoru. Jeho nejčastějším nežádoucím účinkem s incidencí kolem 16 % je hypotenze.
Blokátory If kanálu – ivabradin
Ivabradin je indikován u nemocných s kompenzovaným srdečním selháním a sinusovým rytmem, kteří při maximálně tolerované dávce betablokátorů mají klidovou srdeční frekvenci nad 70/min (EMA nad 75/min). Doporučená úvodní dávka je 2× 5 mg, maximální denní dávka 2× 7,5 mg.
Digoxin
Z digitalisových glykosidů se v současnosti u nás používá výhradně digoxin. Možnou indikací k chronickému podávání digoxinu je symptomatické srdeční selhání HFrEF při současné fibrilaci síní s rychlou odpovědí komor. U nemocných se sinusovým rytmem a výraznými symptomy je možné zvážit jeho použití k symptomatickému zlepšení a redukci hospitalizací. Před zahájením léčby digoxinem je třeba stanovit renální funkce a kalemii. Obvyklá denní dávka je 0,125–0,25 mg per os, u starších lidí 0,0625–0,125 mg. Při renální insuficienci je proto nutné denní dávku redukovat. Důležité je kontrolovat sérové koncentrace digoxinu v rozmezí 0,6–1,2 ng/ml, vyšší hladiny jsou proarytmogenní.
I.v. suplementace železa – karboxymaltóza železa (FCM)
Intravenózní suplementace železa ferikarboxymaltózou by měla být zvážena u symptomatických pacientů se srdečním selháním s EF LK ≤ 50 % a deficitem železa (definovaným jako koncentrace feritinu v séru < 100 μg/l nebo koncentrace
feritinu v rozmezí 100–299 μg/l a zároveň saturace transferinu železem < 20 %). Tato léčba může přinést zlepšení symptomů, kvality života a redukovat počet hospitalizací. Stanovení celkové potřebné dávky FCM je vypočteno podle hmotnosti pacienta a hladiny hemoglobinu.
Nefarmakologická léčba HFrEF je založena na režimových opatřeních, která zahrnují omezení soli či redukci příjmu tekutin u akutní dekompenzace, u nemocných ve stabilním stavu je vhodná přiměřená fyzická zátěž. Z přístrojové léčby je třeba zmínit prevenci náhlé srdeční smrti pomocí implantabilních kardioverterů-defibrilátorů (ICD). Ty jsou indikovány jednak v sekundární prevenci po zvládnuté příhodě oběhové zástavy a jednak v primární prevenci u nemocných se sníženou systolickou funkcí levé komory s EF LK pod 35 %. U nemocných s EF LK pod 35 % s přítomnou poruchou nitrokomorového vedení – typicky charakteru blokády levého raménka Tawarova – s rozšířením QRS komplexu nad 130 ms je indikována srdeční resynchronizační léčba (obvykle implantace biventrikulárního stimulátoru či se nově zkouší stimulace převodního systému). Obě tyto modality mohou být součástí jednoho systému/jednoho přístroje. Další možností je využití tzv. modulace srdeční kontraktility (cardiac contractility modulation – CCM), což je specifický způsob elektroimpulzoterapie s pozitivním ovlivněním zátěžové kapacity. Pro pokročilá stadia srdečního selhání jsou u selektovaných nemocných k dispozici implantace dlouhodobých mechanických srdečních podpor (LVAD) či srdeční transplantace.
2.7.3 Srdeční selhání s mírně sníženou ejekční frakcí (HFmrEF)
Július Godava
2.7.3.1 Epidemiologie
Incidence se pohybuje kolem 6–7 případů na 10 000 osob/ rok. Prevalence v populaci pacientů se srdečním selháním se udává 20–25 %. Vzhledem k nižší symptomatologii v porovnání s pacienty s HFrEF a také nejednoznačné a často se měnící definici v klinických studiích i registrech je počet pacientů spíše podhodnocen.
2.7.3.2 Etiologie
Etiologicky se jedná o pestrou škálu diagnóz. Obecně je v této skupině pacientů vyšší výskyt ischemické choroby srdeční, ale častou příčinou jsou i kardiomyopatie anebo chlopenní či vrozené vady.
2.7.3.3 Klinický obraz
Pacienti s HFmrEF jsou obecně méně symptomatičtí než pacienti se sníženou ejekční frakcí (HFrEF), bývají v nižší třídě NYHA, ale zároveň mívají méně komorbidit a přidružených nemocí než pacienti se zachovalou ejekční frakcí (HFpEF). Jsou to spíše muži mladšího věku. Mezi hlavní symptomy patří námahová dušnost, známky kongesce tekutin a únava. Objektivní klinické známky jsou stejné jako
u všech pacientů se srdečním selháním. Rozdíly v charakteristikách a klinickém vyjádření pacientů s HFrEF, HFmrEF a HFpEF znázorňuje tabulka 2.35
Někteří pacienti v pásmu HFmrEF mohou být také ve fázi zhoršování ejekční frakce pod 50 %, ať už je základní onemocnění jakékoliv, a jsou zachyceni v přechodné fázi přirozeného vývoje nemoci k HFrEF. V případech neischemické kardiomyopatie může být ejekční frakce v přechodové fázi – při poklesu do kategorie HFrEF, ale také na vzestupu do kategorie HFpEF. V takových případech můžeme mluvit o srdečním selhání se zlepšenou ejekční frakcí (heart failure with improved ejection fraction – HFimpEF). Současná moderní farmakologická terapie srdečního selhání často navodí tzv. reverzní remodelaci levé komory, která je se zlepšováním ejekční frakce spojena. Pozitivní vliv na remodelaci LK má u vybrané skupiny pacientů srdeční resynchronizační terapie.
2.7.3.4 Diagnostika
Diagnostika je založena na přítomnosti klinických známek srdečního selhání a echokardiografickém vyšetření se stanovením EF LK. Zvýšení hladin natriuretických peptidů nebo evidence strukturálního onemocnění srdce podporuje tuto diagnózu, ale nejsou v této situaci nezbytné. Pacienti s nově diagnostikovanou mírně sníženou EF LK by měli podstoupit koronarografii k vyloučení ICHS. Při negativním nálezu anebo v případě diferenciálnědiagnostických rozpaků je vhodné provedení magnetické rezonance srdce, která poskytne informace i o tkáňové charakteristice myokardu.
2.7.3.5 Prognóza
Prognóza pacientů s HFmrEF je lepší než u skupiny HFrEF. Podle ESC HF-LT registru byla jednoletá celková mortalita 7,6 %, jednoletá kardiovaskulární mortalita 3,8 % a roční riziko hospitalizace pro srdeční selhání 8,7 %. Výskyt kardiovaskulárních příhod je nižší než u HFrEF a výskyt nekardiovaskulárních příhod u těchto pacientů je nižší než u HFpEF. Pro precizní stanovení prognózy je nutné znát základní diagnózu. Riziko se bude zcela jistě lišit u pacientů, kteří jsou ve fázi zhoršování ejekční frakce na cestě k HFrEF, než v případech zlepšování na cestě HFpEF. Riziko náhlé srdeční smrti z důvodu maligní arytmie není u této skupiny pacientů dostatečně zmapované, nápomocná může být genetická diagnostika a také MR srdce se zhodnocením přítomnosti a rozsahu fibrózy myokardu stanovené pomocí pozdního sycení myokardu gadoliniovou kontrastní látkou (late gadolinium enhancement – LGE).
2.7.3.6 Léčba
Ještě donedávna jsme pro léčbu pacientů s HFmrEF neměli žádná přesvědčivá data. Terapie byla založena na podávání diuretik u pacientů s kongescí; ICHS nebo hypertenzi jsme léčili betablokátory a inhibitory ACE. V současnosti jsou hlavním pilířem léčby pacientů s HFmrEF inhibitory SGLT2 (empagliflozin a dapagliflozin). Jsou to jediná farmaka, která u této skupiny nemocných v klinických studiích prokázala snížení rizika hospitalizace pro srdeční selhání a úmrtí z kardiovaskulárních příčin a mají třídu doporučení IA. Ostatní léky jako betablokátory, ACEI/ARB/ARNI či MRA mají na základě post hoc analýz nižší třídu doporučení (IIb/C).
Tab. 2.35 Rozdíly v charakteristikách a klinickém vyjádření pacientů s HFrEF, HFmrEF a HFpEF
Fenotyp
Prognóza
ardiovaskulární riziko
nek ardiovaskulární riziko
Terapie
inhibitor y RAS, betablok átor y, MRA, ARNI, SGLT2i
HFrEF charakteristiky, HFpEF charakteristiky, intermediární charakteristiky
Důležité je zmínit skutečnost, že u pacientů s HFimpEF máme pokračovat v zavedené terapii srdečního selhání. Studie TRED-HF totiž prokázala signifikantně vyšší počet relapsů onemocnění po vysazení léčby.
2.7.4 Srdeční selhání se zachovalou ejekční frakcí levé komory (HFpEF)
Karel
Lábr
HFpEF je definováno jako přítomnost příznaků a symptomů srdečního selhání u jedince s EF LK ≥ 50 % a průkazem strukturálních nebo funkčních srdečních změn odpovídajících diastolické dysfunkci a zvýšeným plnicím tlakům levé komory nebo přítomnost zvýšené hladiny natriuretických peptidů.
2.7.4.1 Epidemiologie
Incidence HFpEF se podle přesnosti diagnostiky pohybuje mezi 1–9 novými případy na 1000 pacientoroků. Prevalence HFpEF u pacientů se srdečním selháním je přibližně 40 %, u žen a starších osob dokonce 50–60 %. V budoucnu se očekává, že se HFpEF stane převládajícím fenotypem srdečního selhání.
2.7.4.2 Klinické profily HFpEF
HFpEF je velmi heterogenní syndrom s mnoha patogenetickými mechanismy. Nejčastější příčinou je porucha relaxace nebo poddajnosti myokardu. Nemusí být způsobena jasně identifikovatelnými příčinami, ale obvykle se rozvíjí v prostředí různých rizikových faktorů či komorbidit. Ty definují různé klinické profily, u nichž se může léčba podstatně lišit.
2.7.4.3 Diagnostika
Diagnostika HFpEF (kromě EF ≥ 50 %) je založena na přítomnosti symptomů (dušnost, otoky kotníků, únava) a známek srdečního selhání a zároveň echokardiograficky hodnoceného průkazu strukturálních nebo funkčních změn či zvýšené hladiny natriuretických peptidů.
Konečná diagnóza HFpEF může být komplikovaná, proto používáme skórovací systémy. Nejčastější a nejjednodušší je klinický H2FPEF algoritmus (tab. 2.36), druhým je na expertní echokardiografii založený HFA-PEFF algoritmus, které určí pravděpodobnost přítomnosti HFpEF.
K základním echokardiografickým parametrům sledovaným u HFpEF patří:
• LAVI = indexovaný objem levé síně,
• pulzní dopplerovské zobrazování průtoku mitrální chlopní – poměr E/A,
• tkáňové dopplerovské zobrazení: e‘ (časná diastolická rychlost mitrálního anulu), poměr E/e´,
• kontinuální dopplerovské zobrazení rychlosti trikuspidální regurgitace s odhadem systolického tlaku v pravé komoře.
Tab. 2.36 Skórovací systém H2FPEF
H2 Heavy – obezita (BMI > 30 kg/m2) 2 Hypertenze ≥ dvě antihypertenziva 1
F Fibrilace síní 3
P Plicní hypertenze (PASP > 35 mmHg podle echokardiografie) 1
E Elder – starší věk > 60 let 1
F Filling pressure (plnící tlak E/e‘ > 9 podle echokardiografie) 1
≥ 6 bodů: vysoce diagnostický pro HFpEF
2.7.4.4 Prognóza
HFpEF má obecně lepší prognózu než HFrEF, pacienti s HFpEF ale mívají větší počet nekardiálních příhod než pacienti s nižší ejekční frakcí levé komory vzhledem ke své věkové struktuře a četným komorbiditám.
2.7.4.5 Léčba
Až donedávna patřila k jediné dostupné léčbě pacientů s HFpEF diuretika indikovaná k odstranění kongesce, nejčastěji podáváme kličková diuretika (furosemid), někdy postačují diuretika thiazidová. Lze je případně kombinovat s antagonisty mineralokortikoidních receptorů (spironolakton nebo eplerenon). Zásadní je také léčba komorbidit, resp. vyvolávajících příčin, podle klinického fenotypu.
Novinkou je podávání SGLT2i i u nemocných s HFpEF; ty jsou účinné při snižování kombinovaného rizika kardiovaskulárních onemocnění – úmrtí nebo hospitalizací pro kardiovaskulární onemocnění, ale také zlepšují symptomy pacientů i jejich kvalitu života. U HFpEF jsou indikovány empagliflozin a dapagliflozin.
Velkou roli hraje edukace pacientů, měli by být poučeni o nezbytných režimových opatřeních, jako jsou změna životního stylu, zdravá strava, optimální tělesná hmotnost, fyzická aktivita a odvykání kouření.
2.8 Kardiomyopatie
Hana Poloczková, Anna Chaloupka, Tomáš Honek
Kardiomyopatie jsou definovány jako onemocnění myokardu, u nichž je srdeční sval strukturálně nebo funkčně abnormní a tyto abnormity nejsou způsobeny jinou vyvolávající příčinou (ischemickou chorobou srdeční, hypertenzí, chlopenní či vrozenou srdeční vadou). Jedná se o heterogenní skupinu onemocnění vedoucích k širokému spektru symptomů s odlišným klinickým obrazem.
Na základě Doporučených postupů Evropské kardiologické společnosti z roku 2023 jsou kardiomyopatie podle fenotypového vyjádření děleny na hypertrofické, dilatační, nedilatované kardiomyopatie levé komory, restriktivní kardiomyopatie a arytmogenní kardiomyopatii pravé komory. Takzvané neklasifikované kardiomyopatie, mezi něž byla řazena nonkompaktní kardiomyopatie a takotsubo
kardiomyopatie, podle současných doporučení již mezi kardiomyopatie řazeny nejsou a pro tyto formy postižení srdečního svalu je doporučeno nové označení. Termín hypertrabekulizace levé komory nyní nahrazuje původní „nonkompaktní kardiomyopatii levé komory“ a takotsubo syndrom nyní označuje původní „takotsubo kardiomyopatii“. U každého typu kardiomyopatie dále rozlišujeme formu familiární (geneticky podmíněnou) a formu získanou. Pod stejným fenotypovým vyjádřením se mohou skrývat etiologicky odlišné formy onemocnění a současně se fenotypové vyjádření může u řady kardiomyopatií v průběhu vývoje onemocnění měnit. Klinicky se kardiomyopatie manifestují především symptomy srdečního selhání, ať s redukovanou, mírně sníženou či zachovalou ejekční frakcí, příznaky plynoucími z řady arytmií nebo projevy extrakardiálními, v některých případech však nemusí být po relativně dlouhou dobu symptomy vyjádřeny. Pokud není onemocnění včas rozpoznáno a léčeno, může vést k významné morbiditě a mortalitě, a to zejména u mladých osob, jež kardiomyopatie často postihují. Díky rozvoji mnoha diagnostických a terapeutických metod došlo v posledních letech k významnému posunu v diagnostice i léčbě řady kardiomyopatií a tím i zlepšení prognózy nemocných. Nově je kladen důraz – vedle vyšetření magnetickou rezonancí – také na genetické testování, které má v současné době v diagnostice kardiomyopatií důležitou roli.
2.8.1 Genetika kardiomyopatií
Anna
Chaloupka
Podle etiologie dělíme kardiomyopatie na dědičné/gene ticky podmíněné a získané (např. zánětlivé, toxické či podmíněné multisystémovými onemocněními). Se zlepšující se dostupností a s technologickými pokroky genetického testování se stále větší část řadí do skupiny geneticky podmíněných onemocnění (~ 40–50 %) a je třeba k nim takto přistupovat. Již při úvodním klinickém zhodnocení pacienta přicházejícího pro symptomy srdečního selhání či arytmii je třeba cíleně pátrat po rodinné anamnéze náhlé srdeční smrti nebo kardiomyopatie u nejbližších příbuzných. Všichni pacienti se suspektní kardiomyopatií by měli mít následně sestaven třígenerační rodokmen ke správnému stanovení diagnózy, etiologie, typu dědičnosti a identifikaci jedinců ve zvýšeném riziku.
2.8.1.1 Genetická architektura kardiomyopatií a jejich dědičnost
Dědičné formy kardiomyopatií jsou zpravidla podmíněny změnou jednoho genu (monogenní, mendeliánská onemocnění) s autosomálně dominantní dědičností. Méně časté formy dědičnosti jsou autosomálně recesivní (Friedreichova ataxie, desminopatie), X-vázaná (Fabryho a Danonova choroba, dystrofinopatie) a mitochondriální. Kardiomyopatie jsou typické genetickou heterogenitou (různé mutace různých genů mohou způsobit stejný fenotyp), nekompletní či věkově vázanou penetrancí a variabilní expresivitou (nositelé stejné mutace mohou mít rozdílně vyjádřený fenotyp). Podrobný popis genetické problematiky kardiomyopatií
přesahuje rámec této kapitoly; zde stručně uvádíme klinicky relevantní informace týkající se genetických specifik jednotlivých typů kardiomyopatií.
Hypertrofická kardiomyopatie je nejčastějším geneticky podmíněným onemocněním srdce s autosomálně dominantní dědičností, tedy 50% rizikem přenosu na potomky. Úspěšnost záchytu kauzální mutace se pohybuje kolem 50 %. Zatímco u dospělých je hypertrofická kardiomyopatie nejčastěji podmíněna mutacemi sarkomerických genů (MYBPC3, MYH7, TNNT2), u dětí se často jedná o metabolická onemocnění, malformační syndromy či neuromuskulární onemocnění.
Dilatační kardiomyopatie je typická genetickou heterogenitou; vždy je nutné také vyloučit získané formy (infekční, toxické, hemochromatóza, endokrinní, nutriční deficience, elektrolytové poruchy, peripartální, autoimunitní a lékové). Záchyt kauzální mutace se pohybuje kolem 30–40 %. U dědičných forem s autosomálně dominantní dědičností patří mezi nejčastěji postižené geny titin (TTN). Trunkující mutace tohoto genu byly popsány v souhře s dalšími etiologickými faktory – např. u peripartální či alkoholické kardiomyopatie i u pacientů s myokarditidou a bývají spojovány s příznivou reverzní remodelací levé komory srdeční. Klinickou významnost mají především geny LMNA, FLNC, TMEM43, PLN, DSP a RBM20, které jsou spojeny s vyšším rizikem náhlé srdeční smrti a maligních arytmií. U nositelů kauzálních mutací v těchto genech je za jistých podmínek, např. současná přítomnost LGE (late gadolinium enhancement, pozdní sycení myokardu gadoliniovou kontrastní látkou) na magnetické rezonanci, indikována primárně preventivní implantace ICD (implantabilní kardioverter-defibrilátor) již při LVEF (left ventricular ejection fraction, ejekční frakce levé komory) pod 45–50 %.
Nedilatovaná kardiomyopatie levé komory je novou nozologickou jednotkou, u které lze čekat výraznou genovou heterogenitu, a jak již z definice této kardiomyopatie vyplývá, je zde jistý překryv s dilatační kardiomyopatií a arytmogenní kardiomyopatií pravé komory. Důležitou roli hrají především mutace v genu pro desmoplakin (DSP) spojované s častým výskytem arytmií, fibrózy myokardu a epizod myokardiálního zánětu.
Arytmogenní kardiomyopatie pravé komory je typicky spojována s mutacemi v desmosomálních genech pro plakofilin PKP2, méně často pak geny DSP, DSC2 a DSG2 Záchyt kauzální mutace je až 60 %, dědičnost je nejčastěji autosomálně dominantní.
Restriktivní kardiomyopatie je vzácné onemocnění se značnou genetickou heterogenitou, nejčastěji postiženým genem je TNNI3 a dědičnost je autosomálně dominantní. Restriktivní fenotyp se může vyskytovat v rodinách, kde byla zachycena hypertrofická či dilatační kardiomyopatie, což naznačuje variabilní expresivitu.
2.8.1.2 Genetické testování a interpretace výsledků
Genetické testování se stalo standardní součástí klinického managementu pacientů s kardiomyopatiemi a jejich rodin. Genetické testování u pacientů s jasným fenotypem kardiomyopatie označujeme jako diagnostické a umožňuje nám potvrdit diagnózu především v případech, kde může být za


daný fenotyp odpovědných více etiologií, může pomoci v prognostické stratifikaci (např. některé varianty v genu LMNA pod obrazem dilatační kardiomyopatie vyžadují častější monitoraci pacientů a nižší hranici pro primárně preventivní implantaci ICD), modifikaci terapeutického přístupu (implantace ICD, specifická molekulární terapie) a v reprodukčním poradenství. Genetické testování rodinných příslušníků pacientů s potvrzenou dědičnou kardiomyopatií s prokázanou kauzální mutací, kteří nemají fenotypové projevy, je označováno jako kaskádové či prediktivní testování. Přínosem tohoto testování je to, že jedinci, kteří nejsou nositeli kauzální dědičné varianty, mohou být propuštěni z dlouhodobé kardiologické dispenzarizace, zatímco jejich nositelé zůstávají v dlouhodobém sledování v 1–3letých intervalech. Pro genetické testování kardiomyopatií v současnosti nejčastěji používáme sekvenování nové generace (NGS) za využití předem definovaných panelů genů. DNA je izolována ze vzorku krve či slin pacienta. Nalezené varianty jsou interpretovány na základě standardizovaných postupů, za klinicky relevantní jsou považovány patogenní a potenciálně patogenní mutace, nutná je však vždy klinická korelace.
2.8.1.3 Genetické poradenství
Nedílnou součástí genetického testování a interpretace výsledků je genetické poradenství, ideálně klinickým genetikem. Genetické poradenství zahrnuje předtestové poradenství, které pomůže rozhodnutí, zda a jaký typ testu provést a jaké mohou být očekávané výsledky testování a jejich dopady; potestové poradenství poté podrobně vysvětlí výsledky a případně navrhne adekvátní kaskádové testování v rodině. Velmi důležité je také poradenství týkající se prenatální či preimplantační diagnostiky.
2.8.1.4 Kaskádový screening rodin
S ohledem na dědičný charakter kardiomyopatií je doporučen kaskádový screening prvostupňových příbuzných pacientů s prokázanou kardiomyopatií. Tento kaskádový screening zahrnuje jak vyšetření klinické zahrnující EKG a zobrazovací metody (typicky echokardiografii), tak genetické, a to v případě, že byla u pacienta s kardiomyopatií (probanda) prokázána kauzální mutace.
2.8.2 Hypertrofická kardiomyopatie
Tomáš Honek
Definice: Hypertrofická kardiomyopatie (HCM) je charakterizována ztluštěním stěn či zvětšením masy myokardu nedilatované levé komory srdeční (LK) bez přítomnosti vyvolávajících hemodynamických příčin (arteriální hypertenze, aortální stenóza a další). Prevalence v neselektované populaci činí 0,2 %.
Etiologie: Patří mezi nejčastější dědičná onemocnění srdce. Dědičnost je autosomálně dominantní s proměnlivou penetrancí a expresivitou. Mutace způsobují poruchy sarkomerických proteinů. Nejčastější mutace jsou v genu pro
těžký řetězec beta-myozinu (MYH7), myozinový vazebný protein C (MYBPC3) a troponin T (TNNT2). Mutace v těchto třech genech zapříčiňují až 80 % všech mutací. Genetická diagnostika, kromě screeningu familiárních forem, pomáhá také identifikovat tzv. fenokopie HCM (střádavá či infiltrativní onemocnění, metabolická onemocnění a další).
Morfologie: Morfologický obraz je charakterizován hypertrofií stěn LK, nejčastěji mezikomorové přepážky, s tloušťkou stěny LK ≥ 15 mm, popř. ≥ 13 mm v přítomnosti mutací v genech typických pro HCM či u prvostupňových příbuzných nemocných s HCM. Na podkladě lokalizace hypertrofie a tvaru dutiny LK rozlišujeme jednotlivé fenotypy HCM (sigmoideální, reverzní, neutrální a apikální). Histologicky nacházíme neuspořádanost, tzv. disarray svalových snopců, myocytů a myofibril a ztluštění intramurálních tepének.
Hemodynamika: Charakteristickým rysem je malý objem dutiny nedilatované LK, normální až supranormální ejekční frakce (EF) LK a zvýšení plnicího tlaku LK při diastolické dysfunkci. Na základě přítomnosti nitrokomorové obstrukce rozeznáváme obstrukční a neobstrukční typ, jejichž hranici tvoří hodnota gradientu ve výtokovém traktu LK (LVOTG) 30 mmHg. Obstrukce vzniká na podkladě hypertrofie bazální části IVS (interventrikulární septum), hypertrofie papilárních svalů s jejich anteroapikálním posunem a přítomnosti dopředného pohybu předního cípu mitrální chlopně (SAM). Charakter obstrukce je dynamický s pozdně systolickým vrcholem a narůstá při zvýšení kontraktility a snížení preloadu či afterloadu. Zhoršuje se proto vestoje, při tachykardii, hypovolemii, postprandiálně, při Valsalvově manévru či po podání pozitivně inotropních látek nebo nitrátů.
Diagnostika: Typickým nálezem při fyzikálním vyšetření nemocných s obstrukcí je přítomnost „crescendo – decrescendo“ mid-systolického šelestu vznikajícího na podkladě turbulentního toku v LVOT, který je nejlépe slyšitelný na srdeční bázi a zesiluje po provokačních manévrech (Valsalvův manévr, extrasystola či aplikace nitrátů). Nepropaguje se do karotid, což jej odlišuje od podobně slyšitelného systolického šelestu vznikajícího při aortální stenóze. U asteniků můžeme vidět zvedavý úder hrotu. EKG obraz může vykazovat známky hypertrofie LK, deviaci osy doleva, amputované R kmity nad přední stěnou, resp. patologické Q kmity imitující stav po infarktu myokardu. Dále pak denivelace ST-T úseku či převodní poruchy.
Definitivní klinická diagnóza HCM je založena na detekci typického fenotypu, nejčastěji pomocí echokardiografie, s obrazem hypertrofie stěn LK (obvykle s maximem na mezikomorovém septu) a nedilatované dutiny LK (obr. 2.35).
Dalším rysem podporujícím diagnózu je přítomnost diastolické dysfunkce. U obstrukčního typu bývá prakticky vždy přítomen SAM a mitrální regurgitace směřující pod zadní cíp mitrální chlopně. Stejně tak echokardiografie zhodnotí přítomnost obstrukce v LVOT a její kvantifikaci (obr. 2.36). Magnetická rezonance (MR) vyjma výše uvedeného umožní zejména tkáňovou charakteristiku myokardu, což je stěžejní v diferenciální diagnostice, tj. k odlišení „prosté“ HCM od jejích fenokopií. Pozdní sycení gadoliniem (LGE) jako jediná neinvazivní možnost zobrazení fibrózy myokardu je důležité především pro prognostifikaci těchto pacientů.
Klinický obraz: V klinickém obraze dominuje námahová dušnost související s diastolickou dysfunkcí (zvýšené
Obr. 2.35 Echokardiografický nález u nemocného s hyper trofickou obstrukční kardiomyopatií. V apikální čtyřdutino vé projekci je patrná výrazná hypertrofie mezikomorové přepážky.
Obr. 2.36 Kontinuálně dopplerovský záznam u nemocného s hypertrofickou obstrukční kardiomyopatií. Je patrný vy sokorychlostní tok dynamické obstrukce výtokového traktu levé komory. Jedná se o obstrukci dynamickou s pozdně systolickým vrcholem.
plnicí tlaky LK) a přítomností nitrokomorové obstrukce. Námahová angina pectoris je dalším symptomem vznikajícím na podkladě mikrovaskulárního postižení či útlakem magistrálních tepen hypertrofickým myokardem. Palpitace souvisejí s častějším výskytem supraventrikulárních arytmií. Zátěží indukovaná synkopa a náhlá srdeční smrt (NSS) jsou méně časté, ale o to závažnější projevy tohoto onemocnění.
U přibližně 5 % pacientů onemocnění progreduje do tzv. burned-out fáze s poklesem EF LK, rozvojem restriktivního fenotypu a symptomy srdečního selhání.
Diferenciální diagnostika: Je potřeba odlišit hypertenzní postižení srdce, atletické srdce či hypertrofii LK při aortální stenóze. Stejně tak je nutné vyloučit jednotlivé fenokopie HCM.
Léčba: U symptomatických pacientů s přítomnou obstrukcí v LVOT zahajujeme terapii jedním z léků s negativně inotropním účinkem (betablokátory, popř. verapamil či disopyramid). Výše zmíněná farmakologická terapie je zaměřena na symptomatickou úlevu potíží, ale jedná se často o nedostatečnou nebo špatně tolerovanou léčbu. Tyto léky navíc neovlivňují základní podstatu onemocnění, tj. patologicky zesílené interakce aktinu a myozinu zodpovědné za hyperkontraktilitu myofilament. Nadějným lékem se nyní jeví mavacamten (selektivní alosterický inhibitor srdeční myozinové ATPázy), jehož účinkem je právě redukce utváření vazeb aktinu a myozinu a tím oslabení kontraktility, zlepšení relaxace a energetiky myokardu. Dalšími používanými léky mohou být antiarytmika (amiodaron) a antikoagulancia.
V případě trvání symptomů a významného gradientu v LVOT i přes adekvátně vedenou farmakoterapii je indikována septální redukční terapie.
Implantace dvoudutinové kardiostimulace s navozením preexcitace a tím inverzní aktivace IVS je prakticky opuštěna a má jen své úzké specifické indikace.
Rozšířená myektomie, která zahrnuje resekci IVS až k bázi papilárních svalů s jejich částečnou resekcí, mobilizací a případně plikací zvětšeného předního cípu mitrální chlopně, je jako metoda první volby používána nejčastěji ve Spojených státech amerických.
Naopak v Evropě (včetně ČR) je metodou volby alkoholová septální ablace, jejíž podstatou je aplikace 96% alkoholu nejčastěji do první septální větve a vytvoření nekrózy v bazální části IVS. Obě metody mají srovnatelný efekt na redukci LVOTG a zlepšení symptomů s mortalitou nižší než 1 %. U pacientů s nevhodnou či suboptimální anatomií septálních větví je možnou eventualitou endokardiální radiofrekvenční ablace septální hypertrofie (ERASH), jejíž podstatou je radiofrekvenční ablace hypertrofického septa z levé komory retrográdním či transseptálním přístupem. Výhodou ERASH je zmapování převodního systému před intervencí, a tudíž nižší riziko výskytu převodních poruch, možnost opakování výkonu v jiné části septa, a v neposlední řadě nezávislost na koronární morfologii.
V případě progrese onemocnění do „end-stage“ fáze lze u části pacientů uvažovat o srdeční transplantaci při splnění indikačních kritérií.
Prognóza: Je celkem příznivá, nemocní většinou nemají zkrácené přežívání, dokonce po redukci LVOTG je doba přežití srovnatelná s běžnou populací. Hlavní riziko představuje NSS způsobená nejčastěji fibrilací komor. Obecně se pacientům nedoporučuje fyzicky náročná práce a vrcholový sport. Z důvodu zlepšení prevence NSS se neustále vyvíjejí nové stratifikační modely s cílem jednoznačně identifikovat jedince ve vysokém riziku a těmto pak nabídnout implantaci kardioverteru-defibrilátoru.
2.8.3 Dilatační kardiomyopatie
Hana Poloczková
Definice: Dilatační kardiomyopatie (DCM) je charakterizována dilatací a systolickou dysfunkcí levé komory, která není vysvětlitelná abnormním zatížením v důsledku arteriální hypertenze, chlopenní nebo vrozené srdeční vady nebo ischemické choroby srdeční. Současně bývá přítomen různý stupeň diastolické dysfunkce, a zejména v pokročilejších fázích onemocnění také dilatace a dysfunkce pravé srdeční komory.
Epidemiologie: Prevalence onemocnění bývala udávána 1 : 2500, novější práce předpokládají skutečnou prevalenci až 1 : 250. Jedná se o nejčastější příčinu srdečního selhání, která vede k srdeční transplantaci, a to zejména u mladých osob. Etiologie a patogeneze: Původ onemocnění je geneticky podmíněný nebo se jedná o získané formy DCM. Fenotypové vyjádření je ovlivněno působením zevního prostředí, způsobem dědičnosti, penetrací, imunitními vlivy a dalšími tzv. modifikujícími geny. V případech získaných forem onemocnění hrají roli zánětlivé a autoimunitní vlivy, endokrinopatie, toxonutritivní vlivy, kardiotoxické působení aplikované chemoterapie nebo se může jednat o důsledek déletrvající tachyarytmie (posttachykardická DCM). Zvláštní jednotkou je peripartální kardiomyopatie vznikající v souvislosti s těhotenstvím. Pokud nejsme schopni příčinu onemocnění ani po vyčerpání dostupných diagnostických metod odhalit, označujeme ji jako idiopatickou dilatační kardiomyopatii. Genetika DCM byla popsána výše. Klinický obraz: V popředí obtíží dominují projevy levostranného srdečního selhání (zpočátku námahová, později i klidová dušnost, únavnost, nevýkonnost, slabost), následně se mohou projevit symptomy pravostranného srdečního selhání (otoky, hepatomegalie, zvýšená náplň krčních žil, zvětšení objemu břicha v důsledku ascitu, dyspeptické potíže). Nemocní mohou pociťovat atypické oprese na hrudi či palpitace, mohou se objevit presynkopy či synkopy, jež mohou být důsledkem řady arytmií. Onemocnění se může manifestovat také náhlou srdeční smrtí, zejména pokud je spojeno s mutací v některých genech (např. mutace v genech LMNA, FLNC, DSP). Naopak řada jedinců může zůstávat poměrně dlouhou dobu asymptomatická.
Při fyzikálním vyšetření zjišťujeme posun srdečního hrotu kaudálně a doleva, bývá slyšitelná 3. nebo 4. ozva, systolický šelest v důsledku mitrální či trikuspidální regurgitace, v případě levostranného selhávání jsou přítomny nepřízvučné inspirační chrůpky na plicích, pravostranné srdeční selhání se projeví otoky, zvýšenou náplní krčních žil, hepatomegalií či ascitem. Na EKG křivce jsou často nespecifické změny ST úseků a T vlny, supraventrikulární či komorové extrasystoly, raménkové blokády, častá bývá sinusová tachykardie nebo fibrilace síní, zaznamenat můžeme ale prakticky jakékoliv supraventrikulární či komorové arytmie. Přítomnost AV blokády by měla vzbudit podezření na diagnózu laminopatie nebo srdeční sarkoidózy. Na rtg snímku bývá patrná dilatace srdečního stínu, různý stupeň městnání, případně fluidotorax.
Součástí laboratorního vyšetření je kromě základních parametrů (zahrnujících ledvinné a jaterní funkce, svalové srdeční enzymy včetně troponinu, kompletní mineralogram včetně kalciofosfátového metabolismu, funkce štítné žlázy,
CRP a natriuretické peptidy) také vyšetření metabolismu železa a přítomnosti proteinurie. Zhodnocen by měl být krevní obraz včetně diferenciálního rozpočtu k posouzení eozinofilie.
V případech familiárního výskytu DCM, jak jsme již uvedli výše, je indikován genetický screening u prvostupňových příbuzných s cílem stanovení diagnózy, stratifikace rizika a zahájení časné léčby u dosud asymptomatických jedinců.
Základní diagnostickou metodou zůstává nadále echokardiografie, jež je také využívána v následném dlouhodobém sledování. Kromě standardního 2D zobrazení provádíme tkáňové dopplerovské hodnocení k posouzení longitudinální funkce levé a pravé srdeční komory a hodnocení globálního longitudinálního strainu (GLS). Tento parametr je schopen detekovat již preklinickou fázi onemocnění a díky dobré reproducibilitě je vhodný pro dlouhodobé sledování nemocných. Echokardiografie rovněž slouží k vyloučení jiné příčiny srdečního selhání. U pacientů s DCM je přítomný různý stupeň dilatace, remodelace a systolické dysfunkce levé komory, případně obou srdečních komor, různý stupeň diastolické dysfunkce, mitrální či trikuspidální regurgitace v důsledku dilatace mitrálního či trikuspidálního anulu, dilatace síní, mohou být také detekovány intrakardiální tromby. Typicky bývá porucha kontraktility difuzního charakteru, přítomná je systolická dysfunkce, EF LK je < 50 % (obr. 2.37).
Zlatým standardem ve stanovování objemů LK, masy LK i EF LK je magnetická rezonance (MR). Postkontrastní metody v rámci vyšetření MR navíc nabízejí možnosti stanovení LGE (late gadolinium ehancement), které je důležité zejména pro zpřesnění prognózy nemocných (obr. 2.38). Obecně je LGE popisováno u zhruba 30–40 % pacientů s dilatační kardiomyopatií. U těchto pacientů byla již dříve zdokumentována horší prognóza související se zvýšeným výskytem komorových arytmií a náhlé srdeční smrti. V současné době je doporučováno, aby všichni pacienti s DCM podstoupili vyšetření magnetickou rezonancí.
Obr. 2.37 Echokardiografický obraz dilatační kardiomyo patie, parasternální projekce na dlouhou osu: významná dilatace levé komory a levé síně.
Obr. 2.38 Pacient s dilatační kardiomyopatií, vyšetření magnetickou rezonancí: nález dilatace všech srdečních od dílů, postkontrastně s přítomným typickým neischemickým midmyokardiálním LGE v oblasti báze interventrikulárního septa a perikardiálním výpotkem
Selektivní koronarografie vyloučí přítomnost významného postižení koronárních tepen jako příčiny systolické dysfunkce. CT vyšetření může být nápomocné v pátrání po perikardiálním postižení nebo k vyloučení koronární nemoci (CT koronarografie).
Endomyokardiální biopsie (EMB) je indikována v případech recentně vzniklého srdečního selhání s významnou dysfunkcí levé komory nereagující na standardní léčbu, např. při podezření na myokarditidu.
V diagnostice DCM je snahou především včasné stanovení diagnózy, ještě před rozvojem těžké dysfunkce LK, která je již často odrazem ireverzibilních změn. Onemocnění probíhá po určitý čas latentně, kdy je ještě zachována EF LK, případně může být přítomný jistý stupeň dilatace LK při dosud zachovalé funkci LK (tzv. izolovaná dilatace levé komory). Pokud je onemocnění diagnostikováno v této fázi, může být jeho další vývoj příznivě ovlivněn změnou rizikových faktorů, doporučeními týkajícími se změn pohybové aktivity či včasným zavedením farmakologické nebo přístrojové léčby.
Léčba: Farmakologická léčba se řídí dostupnými doporučeními pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2021. Základem léčby ovlivňující prognózu jsou betablokátory, inhibitory angiotenzinového receptoru a neprilysinu (ARNI), případně inhibitory angiotenzin konvertujícího enzymu (ACEI) nebo blokátory angiotenzinového receptoru (ARB) v případě intolerance ARNI, dále blokátory mineralokortikoidních receptorů (MRA) a inhibitory sodíko-glukózového kontransportéru 2 (SGLT2i). Vericiguat může být přidán do terapie u nemocných horšících se i přes léčbu ARNI či ACEI. V případě hyperhydratace jsou podávána diuretika, zejména kličková, součástí léčby může být dále digitalis. V případě prokázaného deficitu železa je doporučována jeho intravenózní substituce. V průběhu dvouletého sledování dochází asi u 40–50 % pacientů s nově diagnostikovanou DCM na
optimální farmakoterapii (OMT) k reverzní remodelaci LK, která je spojena s příznivou prognózou. Tato léčba by měla být ponechána i po dosažení reverzní remodelace LK trvale, neboť až u 40 % nemocných po jejím vysazení dochází v průběhu šestiměsíčního sledování k opětovnému poklesu EF LK. Indikace k primárně preventivní implantaci ICD v prevenci NSS by měla být zvážena u nemocných ve funkční třídě NYHA II–III, u nichž i přes optimální farmakologickou léčbu podávanou nejméně po dobu tří měsíců přetrvává EF LK ≤ 35 %. V přítomnosti některých rizikových mutací (např. LMNA) může být indikována implantace ICD časněji. V přítomnosti bloku levého Tawarova raménka (LBBB) a rozšíření QRS komplexu nad 130 ms je doporučována i resynchronizační léčba. V případě významné mitrální regurgitace může být indikována chirurgická nebo perkutánní (implantace MitraClipu) léčba. Pacienti, u nichž dochází i přes výše uvedenou léčbu k další progresi symptomů srdečního selhání, mohou být při splnění indikačních kritérií kandidáty implantace mechanické srdeční podpory nebo srdeční transplantace.
2.8.4 Nedilatovaná kardiomyopatie
levé komory
Hana Poloczková
Definice: Nedilatovaná kardiomyopatie levé komory je v současné klasifikaci kardiomyopatií novou nozologickou jednotkou. Tento fenotyp je definován jako přítomnost neischemického jizvení nebo tukové degenerace myokardu LK bez ohledu na přítomnost poruchy kontraktility nebo jako izolovaná hypokineze LK bez přítomnosti neischemického jizvení. Zahrnuje nálezy dříve popisované jako „dilatační kardiomyopatie“ bez dilatace LK, arytmogenní kardiomyopatie levé komory, ARVC (arytmogenní kardiomyopatie pravé komory) s dominantním postižením LK nebo arytmogenní KMP nesplňující kritéria pro ARVC.
Epidemiologie: Prevalence v populaci není v současné době stanovena.
Diagnostika: V diagnostice může v některých případech napomoci již klidová EKG křivka. Poruchy AV převodu mohou být spojeny s laminopatiemi nebo srdeční sarkoidózou, nízká QRS voltáž může být spojena s mutacemi v genu DSP nebo PLN. Ambulantní monitorace EKG může zachytit paroxysmy supraventrikulárních nebo komorových arytmií, echokardiografie posoudí morfologii a funkci srdečních komor a pokročilejšími echokardiografickými technikami můžeme zachytit již případné subklinické změny. Zásadní vyšetřovací metodou je MR, která podrobněji zhodnotí morfologii a funkci srdečních komor, přítomnost edému či pozdního sycení myokardu s jeho lokalizací charakteristickou pro jednotlivé patologie (subepikardiální lokalizace po prodělané myokarditidě, ve střední části septa u laminopatií apod.). V indikovaných případech může být namístě provedení EMB, jež může potvrdit např. přítomnost zánětlivé infiltrace.
Klinický obraz: Klinicky zůstává většina pacientů po relativně dlouhou dobu asymptomatická, u části se mohou projevit symptomy plynoucí ze supraventrikulárních či komorových arytmií, převodních poruch nebo projevy diastolické nebo systolické dysfunkce.
Léčba: Léčba je založena na terapii srdečního selhání a arytmií, včetně implantace ICD v indikovaných případech. Předpokládá se, že riziko náhlé srdeční smrti je u této skupiny nemocných dáno genotypem, zejména u trunkujících variant PLN, DES, LMNA, FLNC a mutací v genu RBM20, a to i bez přítomnosti těžší systolické dysfunkce levé komory.
2.8.5 Arytmogenní kardiomyopatie pravé komory
Hana Poloczková
Definice: Arytmogenní kardiomyopatie pravé komory (ARVC) je definována jako dominující dilatace a/nebo dysfunkce pravé komory v přítomnosti charakteristických histologických změn a/nebo elektrokardiografických abnormit, které jsou v souladu s publikovanými diagnostickými kritérii z roku 2010. Strukturálně je onemocnění charakterizované progresivní atrofií srdeční svaloviny pravé komory a její náhradou fibrózně-tukovou tkání. Léze mohou být přítomny také ve stěně levé komory. Termín ARVC je vyhrazen pro případy s dominujícím postižením pravé komory (dilatace, poruchy kontraktility) se současným postižením nebo bez postižení levé komory. Jedinci s dominujícím postižením levé komory (dříve označované jako arytmogenní kardiomyopatie s dominantním postižením LK) jsou nyní řazeni do nově vzniklé fenotypové jednotky – nedilatovaná kardiomyopatie levé komory.
Epidemiologie: Prevalence ARVC je 1 : 1000 až 1 : 5000, častěji jsou postiženi muži, v některých oblastech je popisován endemický výskyt onemocnění (oblasti Řecka a Itálie).
Etiologie: Jedná se o převážně autosomálně dominantně dědičné onemocnění, popsány jsou ale i formy s autosomálně recesivní dědičností řady genů, které kódují především desmosomální proteiny (podrobněji byla genetika ARVC popsána výše). Postižení desmosomů, které jsou odpovědné za mechanické a elektrické propojení kardiomyocytů, se projevuje vznikem arytmií. Charakteristická je přítomnost funkčních a morfologických změn (dilatace, ztenčení stěn, porucha kontraktility) v důsledku progresivního úbytku srdeční svaloviny pravé komory nebo obou srdečních komor. Onemocnění je provázeno výskytem komorových arytmií, jež mohou být příčinou náhlé srdeční smrti, zejména u mladých osob. Původně bylo onemocnění považováno typicky za postižení pravé komory, ale díky rozvoji diagnostických metod bylo potvrzeno časté biventrikulární postižení. Diagnostika: Diagnostika onemocnění je často poměrně obtížná a je založena na komplexním přístupu. Důležitý je pečlivý odběr rodinné anamnézy, zhodnocení klidového EKG a 24hodinové EKG monitorace, podrobné echokardiografické vyšetření a provedení magnetické rezonance, která má pro diagnózu zásadní úlohu. Na podkladě těchto vyšetření byla sestavena diagnostická kritéria, původně již v roce 1994 pro ARVC a v roce 2010 byla aktualizována a rozšířena o výsledek genetického vyšetření a magnetické rezonance. Kritéria hodnotí morfologicko-funkční změny, tkáňovou charakteristiku, repolarizační a depolarizační EKG změny, přítomnost komorových arytmií, rodinnou anamnézu a výsledek genetického testování. Každá z kategorií zahrnuje „velká“ a „malá“ kritéria a podle počtu splněných kritérií
je diagnóza považována za možnou, pravděpodobnou nebo potvrzenou. V roce 2020 byla publikována tzv. Padovská kritéria, která berou na základě nových poznatků v úvahu také podtypy s postižením levé komory.
Velmi přínosnou pro diagnózu může být už základní EKG křivka, která je až v 90 % případů patologická. Často je prodlouženo trvání terminální fáze QRS komplexu ve V1–V3 a patrná může být tzv. vlna epsilon. Mohou být zaznamenány negativní T vlny ve svodech z pravého prekordia při absenci blokády pravého Tawarova raménka, četné extrasystoly či tachykardie vycházející z pravé komory.
Echokardiografie zachytí morfologické a funkční změny PK (dilatace, akineze, dyskineze, přítomnost aneurysmat) a současně vyloučí jinou příčinu, jako je např. plicní hypertenze, patologie pulmonální či trikuspidální chlopně apod. Jak již bylo zmíněno, pro diagnózu je nejdůležitější metodou magnetická rezonance, která zhodnotí morfologii a funkci pravé komory a dokáže zachytit strukturální změny ve stěně pravé, případně i levé komory.
Endomyokardiální biopsie není pro diagnózu nezbytná a je vyhrazena pro případy, kdy je nutné vyloučit jiné fenotypově shodné onemocnění, jako je sarkoidóza, myokarditida nebo dilatační kardiomyopatie. Pokud je ale EMB provedena, lze v pozitivním případě prokázat typickou přítomnost fibrózně-tukové přestavby myokardu. Vyšetření je však limitováno ložiskovostí patologického procesu a postižením především subepikardiálních oblastí srdeční stěny, které nemusí být pro EMB přístupné.
Klinický obraz: Pro onemocnění je typický výskyt komorových arytmií. Klinický obraz může kolísat od mírného postižení s asymptomatickým průběhem, přes palpitace, synkopy až po závažný průběh s život ohrožujícími arytmiemi a rozvojem srdečního selhání. Prvním projevem onemocnění může být náhlá srdeční smrt u dosud asymptomatických osob. Symptomy se nejčastěji projevují s nástupem dospělosti a diagnóza bývá stanovena kolem 30. roku života. Symptomy bývají často výraznější u osob s výraznou fyzickou zátěží. V některých případech se může onemocnění manifestovat akutní myokarditidou, projevující se bolestmi na hrudi, vzestupem kardiospecifických enzymů a EKG změnami s normálním koronarogramem.
Léčba: V léčbě jsou důležitá jednak režimová opatření, která nedovolují intenzivní sportovní aktivity u nemocných s potvrzenou diagnózou, toto omezení může být zváženo i u genotyp pozitivních/fenotyp negativních jedinců. Základem farmakoterapie jsou betablokátory, které by měly být v terapii zváženy u všech nemocných s potvrzenou diagnózou, podáván může být také amiodaron. V případě rozvoje srdečního selhání je indikována standardní léčba srdečního selhání podle platných guidelines. Implantace ICD je prognosticky přínosným postupem a je jednoznačně indikována v sekundární prevenci. V primární prevenci potom u nemocných s potvrzenou diagnózou a arytmogenní synkopou, četnými běhy komorových arytmií, u nemocných s významnými strukturálními změnami a systolickou dysfunkcí pravé, popřípadě levé komory. U nemocných s pokročilou formou onemocnění spojenou s refrakterním srdečním selháním nebo nekontrolovatelnými arytmiemi je indikována srdeční transplantace.
Prognóza: Za prediktory nepříznivé prognózy je považována diagnóza v mladém věku, rodinná anamnéza náhlé smrti, výskyt komorových arytmií, anamnéza synkopy či
oběhové zástavy, těžké postižení pravé komory a současné postižení levé komory.
2.8.6 Restriktivní kardiomyopatie
Hana Poloczková
Definice: Restriktivní kardiomyopatie (RCM) je definována jako restriktivní plnění v přítomnosti normálních nebo snížených diastolických a systolických objemů (jedné nebo obou komor), přičemž tloušťka stěn je většinou normální.
Epidemiologie: Přesná prevalence není známa, pravděpodobně je to nejméně častá kardiomyopatie.
Etiologie: Jedná se o poměrně vzácné onemocnění, které se může vyskytovat sporadicky nebo familiárně, dědičnost je převážně autosomálně dominantní (genetika byla popsána výše). Základní patologií je v tomto případě snížená poddajnost myokardu, která vede k redukci objemu jedné nebo obou komor, poruše diastolického plnění se zvýšením plnicích tlaků jedné nebo obou komor. Důsledkem je snížený tepový objem, zvýšený tlak v síních s jejich následnou dilatací a rozvojem plicní hypertenze.
Klinický obraz: Klinicky se RCM projevuje jako srdeční selhání se zachovalou ejekční frakcí (HFpEF), v pozdních stadiích onemocnění dochází také k rozvoji systolické dysfunkce jedné nebo obou srdečních komor, jež je spojena s klinickými projevy HFrEF. Nemocní trpí námahovou dušností, nízký srdeční výdej odpovídá za stavy slabosti, únavnosti, nevýkonnosti, přítomny jsou také projevy pravostranného srdečního selhání.
Diagnostika: V diagnostice je vedle klinického vyšetření, EKG a laboratorních metod základní vyšetřovací metodou echokardiografie. Potvrdí přítomnost restriktivního plnění komor, které nejsou dilatované, typická je významná dilatace síní, nízký srdeční výdej, známky klidové plicní hypertenze, dilatace dolní duté žíly či jaterních žil. MR zhodnotí morfologii a funkci srdečních komor, přítomnost a rozsah fibrózy a je důležitá v diferenciální diagnostice, kdy dokáže přispět k odlišení dalších patologií s restriktivní fyziologií, jako jsou střádavá a infiltrativní onemocnění, může pomoci k odlišení konstriktivní perikarditidy nebo endomyokardiálních postižení.
Endomyokardiální biopsie je indikována, pokud není etiologie stanovena na základě provedených neinvazivních metod, a je také indikována zejména při podezření na střádavá či infiltrativní onemocnění.
Léčba: Terapie je založena na farmakologické a přístrojové léčbě srdečního selhání, v pokročilých případech mohou být nemocní indikováni k srdeční transplantaci. Jelikož je již pro řadu onemocnění, která se projevují jako fenokopie RCM, k dispozici specifická léčba, je nutné v diferenciální diagnostice tyto formy odlišit a umožnit tak cílenou léčbu onemocnění (např. Andersonova–Fabryho choroba, AL-amyloidóza, TTR-amyloidóza, sarkoidóza či hemochromatóza).
Prognóza: Restriktivní kardiomyopatie má obecně nejhorší prognózu ze všech kardiomyopatií. Onemocnění se vyznačuje vysokou mortalitou již v dětském věku. V dalším období trpí více než 75 % nemocných projevy srdečního selhání a v krátké době od stanovení diagnózy progredují až do terminálního stadia.
2.8.7 Syndromické a metabolické kardiomyopatie
Anna Chaloupka
Syndromické a metabolické kardiomyopatie představují širokou škálu dědičných poruch, které se mohou projevovat pod obrazem všech popsaných fenotypů kardiomyopatií a mají heterogenní příčiny. Jejich podrobný popis přesahuje rámec této kapitoly; zde zmíníme pouze základní informace týkající se nejčastějších střádavých, infiltrativních a metabolických kardiomyopatií, jejich nejvýznamnější klinické známky, genetické příčiny a terapii.
RASopatie jsou způsobeny mutacemi genů RAS-MAPK kaskády, typickým příkladem je syndrom Noonanové. Mezi klinické známky patří hypertrofie levé komory projevující se již v dětství, stenóza pulmonální chlopně, růstová retardace a abnormální obličejové znaky, hluchota. Terapie zahrnuje léčbu betablokátory či kalciovými blokátory, plastiku pulmonální chlopně.
Friedreichova ataxie je spojena s hypertrofickou kardiomyopatií progredující do srdečního selhání, progresivní ataxií (nekoordinovanými pohyby) končetin, diabetes mellitus, ortopedickými abnormalitami. Geneticky je podmíněna autosomálně recesivními mutacemi genu FXN. Specifická léčba není známa.
Glykogenózy zahrnují Pompeho chorobu, Danonovu chorobu a PRKAG2 syndrom.
Nejčastější glykogenózou je typ II – Pompeho cho roba. Toto onemocnění je nejčastěji spojeno s fenotypem hypertrofické kardiomyopatie, mezi další klinické známky patří svalová slabost, hepatomegalie se zvýšením jaterních enzymů, zkrácení PQ intervalu na EKG. Diagnostika je genetická (mutace genu GAA) a enzymatická. Existuje specifická léčba – enzymoterapie.
Danonova choroba se nejčastěji projevuje již od časného dětství pod obrazem extrémní hypertrofie levé komory. Mezi další klinické známky, které nás mohou přivést ke správné diagnóze, patří poruchy intelektu, svalová slabost, zvýšení sérové kreatinkinázy a zkrácení PQ intervalu na EKG. Dědičnost je X-vázaná a je způsobena mutacemi genu LAMP2 Specifická léčba není k dispozici, vzhledem k rychlé progresi stavu je indikována časně srdeční transplantace.
PRKAG2 syndrom je spojen s fenotypem hypertrofické kardiomyopatie, svalovou slabostí s elevací kreatinkinázy, arytmiemi a převodními poruchami. Dědičnost je autosomálně dominantní, je postižen gen PRKAG2. Není specifická léčba.
Hemochromatóza se zpravidla projevuje pod fenotypovým obrazem restriktivní kardiomyopatie a je způsobena geneticky podmíněným střádáním železa na podkladě mutací genu HFE. Vzácně může dojít k přetížení železem sekundárně po mnohačetných transfuzích. Další klinické známky zahrnují bronzové zbarvení kůže, diabetes, elevaci jaterních enzymů a feritinu. Diagnostické je zvýšení hodnot T2* na magnetické rezonanci srdce. Mezi terapeutické přístupy patří venesekce, cheláty, v poslední fázi pak kombinovaná transplantace srdce a jater.
2.8.8 Andersonova–Fabryho choroba
Tomáš Honek
Etiologie a klinický obraz: Jedná se o vzácné, geneticky podmíněné (X-vázané) onemocnění způsobené mutací v genu kódujícím alfa-galaktosidázu A (AGALA), jež vede k akumulaci glykosfingolipidů v různých tkáních. Výskyt je přibližně 1 : 40 000. Nejčastěji je postižen periferní a centrální nervový systém, kůže, oči, ledviny, gastrointestinální trakt a srdce.
Pro srdeční postižení je typický obraz blízký hypertrofické kardiomyopatii. Základem diagnostiky je analýza suché kapky krve určující hladinu AGALA. V léčbě existují v současné době dva terapeutické přístupy. Prvním z nich je chaperonová terapie, která pomáhá enzymům stát se funkčními. Druhým přístupem je enzym substituční terapie, jejíž podstatou je dodání enzymu intravenózní infuzí. Cílem obou terapeutických přístupů je zabránit dalšímu poškození orgánů a výrazně zlepšit kvalitu života. Příslibem do budoucna je genová terapie, jejíž podstatou je vpravení „zdravého“ genu, který umožní produkci enzymu AGALA.
2.8.9 Amyloidóza
Hana Poloczková
Definice: Amyloidóza je infiltrativní, v převážné většině případů systémové onemocnění, charakterizované ukládáním amyloidových fibril do extracelulárních depozit tkání a orgánů, což vede k poruše jejich struktury a funkce. Pokud je depozicí amyloidu postižen srdeční sval, dochází k rozvoji kardiomyopatie s fenotypovým vyjádřením hypertrofické kardiomyopatie s restriktivní hemodynamikou. Postižení myokardu je určující pro prognózu a dochází k němu ve více než 95 % případů.
Epidemiologie: Onemocnění bylo považováno za vzácné a dřívější práce uváděly postižení méně než 5 pacientů na 10 000 obyvatel; spíše se ale jedná o onemocnění poddiagnostikované. Podle recentních studií je prevalence udávána podle studované populace kolem 1 % u nemocných podstupujících kostní scintigrafii až po 21 % z autopsií osob vysokého věku.
Etiologie a patogeneze: Z klinického hlediska je podstatné, že většina amyloidóz vzniká v důsledku ukládání dvou typů amyloidních fibril, a to z lehkých řetězců imunoglobulinů (AL-amyloidóza) a z transthyretinu (TTR-amyloidóza), jež jsou podkladem více než 90 % amyloidóz. V rozdělení amyloidóz hraje klíčovou roli identifikace prekurzorové (amyloidogenní) bílkoviny. V případě AL-amyloidózy jsou to lehké řetězce imunoglobulinů κ a λ produkované v nadbytečném množství plazmatickými buňkami s poruchou klonality, jedná se tedy o primárně hematologické onemocnění. Amyloidní fibrily kolující v krevním řečišti se mohou ukládat téměř v každém orgánu, nejčastěji je ale postiženo srdce a ledviny.
Dalším prekurzorovým proteinem je transthyretin, protein syntetizovaný v játrech pro transport thyroxinu a retinol vázajícího proteinu, který způsobuje dva typy amyloidózy –dědičnou a získanou. Nejčastějším typem srdeční amyloidózy vůbec je získaná nebo tzv. divoká forma „wild type“
(ATTRwt), dříve nazývaná senilní, postihující především muže starší 60 let. Druhým, méně častým typem s endemickým výskytem je dědičná (hereditární) forma (hATTR) označovaná také jako variantní (vATTR), u níž lze identifikovat řadu mutací v genu pro transthyretin. U obou forem onemocnění je jeho podstatou nestabilita molekuly transthyretinu, v důsledku které dochází k tvorbě amyloidních fibril. Sekundární (AA) amyloidóza je vzácná a je způsobena depozity sérového amyloidu A, který je produkován u stavů s přítomností chronického zánětu.
Klinický obraz: Klinická manifestace je vzhledem k systémovému postižení poměrně pestrá, některé projevy jsou společné pro oba typy amyloidóz, jiné jsou pro jednotlivé typy specifické. U AL-amyloidózy jsou nejčastěji postiženými orgány ledviny, srdce, játra a periferní nervový systém. Zejména zpočátku jsou přítomny nespecifické symptomy jako únava, slabost, hmotnostní úbytek, dyspepsie a proteinurie se známkami renálního selhávání. Popisována bývá snadná tvorba hematomů, periorbitální purpura či makroglosie, trombotické i krvácivé komplikace. Kardiomyopatie bývá přítomna až v 70 % případů, izolované postižení srdce asi jen u 5 % případů AL-amyloidózy.
U hereditární formy ATTR je klinický obraz závislý na typu mutace. Může se jednat o dominantně neurologické nebo kardiální postižení nebo postižení smíšené. Neurologické projevy mají charakter periferní polyneuropatie, postižen bývá i autonomní nervový systém. U získané „wild type“ amyloidózy je dominující postižení kardiální, přičemž extrakardiální projevy jsou také součástí kliniky a často předcházejí projevům kardiálním. Klinicky se manifestuje symptomy chronického srdeční selhání, arytmiemi – především fibrilací síní a převodními poruchami, kardioembolickými příhodami z důvodu časté intrakardiální trombózy. Frekventně se setkáváme s hypotenzí nebo dekapitovanou hypertenzí. Z extrakardiálních projevů se jedná o syndrom karpálního tunelu (až u 50 % nemocných), spontánní rupturu šlachy bicepsu, stenózu páteřního kanálu nebo projevy periferní a autonomní neuropatie.
Diagnostika: Některé z uvedených příznaků a nálezů jsou pro onemocnění amyloidózou typické a představují varovné příznaky označované jako tzv. red flags. Jedná se o výše zmíněné klinické příznaky (kardiální a extrakardiální), vysoce elevované hodnoty biohumorálních působků, typický obraz na elektrokardiogramu, echokardiografii či magnetické rezonanci. Extrakardiální red flags jsou pro AL a ATTR často odlišné. S diagnózou ATTRwt je vysoce asociován syndrom karpálního tunelu, ruptura šlachy bicepsu a „trigger finger“. U AL-amyloidózy je častá spontánní tvorba hematomů, často kolem očí, tzv. raccoon eyes, a makroglosie. Pro oba typy amyloidózy je společná polyneuropatie a autonomní dysfunkce. Většina kardiálních příznaků je pro obě amyloidózy společná (dušnost, únavnost, otoky, hepatomegalie, ascites, zvýšená náplň krčních žil, hypotenze). U starších pacientů s ATTRwt dříve léčených s hypertenzí může být prvním příznakem zdánlivé „vyléčení vysokého tlaku“ s nutností down-titrace antihypertenziv. Často je přítomna autonomní neuropatie, což vede k ortostatické hypotenzi. Dalším důvodem případných synkop jsou brady- i tachyarytmie.
V laboratorním nálezu je nápadně zvýšená hodnota natriuretických peptidů a trvalá elevace troponinu. Na EKG je typicky nízká voltáž QRS kmitů v končetinových svodech,
která je v kontrastu k hypertrofii srdečních komor na echokardiografii (obr. 2.39). Dále mohou být přítomné pseudoinfarktové změny a arytmie (fibrilace síní a převodní poruchy).
Obr. 2.39 EKG křivka nemocného se srdeční amyloidózou.
Patrná je nízká voltáž QRS komplexů a pseudoinfarktové změny.
Echokardiografie zůstává základní diagnostickou metodou. Typickým nálezem je hypertrofie (či spíše „pseudohypertrofie“) stěn levé komory (≥ 12 mm), papilárních svalů a volné stěny pravé komory, zesílení mezisíňové přepážky a chlopenního aparátu. Diastolická dysfunkce a zvýšené plnicí tlaky LK vedou k dilataci síní a plicní hypertenzi. Často je přítomen perikardiální výpotek. Typické je také postižení longitudinální kontraktility.
Podkladem srdečního selhání je těžká diastolická dysfunkce, v pokročilých stadiích onemocnění, zejména u AL-amyloidózy, dochází i k selhání systolické funkce. Častým nálezem především u pacientů s ATTRwt je low-flow low-gradient aortální stenóza.
MR může napomoci v diagnostice (i když nedokáže odlišit jednotlivé typy amyloidózy), ale také při odhadu prognózy nemocných nebo monitoraci efektu specifické léčby.
Pro zahájení specifické léčby a další prognózu nemocných je zásadní odlišení jednotlivých typů amyloidózy. Diagnostický algoritmus je založený na stanovení volných lehkých řetězců kappa a lambda a poměru jejich koncentrací v séru a imunoelektroforéze séra a moči k průkazu monoklonálního proteinu. V případě negativního nálezu můžeme AL-amyloidózu považovat za vyloučenou. Dalším krokem neinvazivní diagnostiky je provedení tzv. DPD-scintigrafie, za použití techneciem značené difosfonodikarboxylové kyseliny, jejíž vychytávání v myokardu má patognomický význam pro ATTR kardiomyopatii. V případě nejednoznačných nálezů při neinvazivním vyšetření je k potvrzení diagnózy indikováno provedení EMB. Při podezření na AL-amyloidózu je možné provést biopsii extrakardiální.
Vzhledem k pozdnímu věku nástupu projevů onemocnění u dědičných forem by mělo být u všech pacientů s TTR-amyloidózou provedeno i genetické vyšetření.
Léčba: Terapie srdeční amyloidózy zahrnuje jak léčbu nespecifickou k ovlivnění symptomů, tak specifickou terapii, která je zaměřena na příčinu onemocnění. Nespecifická léčba zahrnuje podpůrnou terapii srdečního selhání, léčbu arytmií, poruch vedení vzruchu či tromboembolických komplikací a u jednotlivých podtypů amyloidózy se zásadně neliší. Specifická léčba je cílena proti produkci amyloidního prekurzorového proteinu nebo proti tvorbě amyloidních fibril a liší se podle typu amyloidózy. Terapie AL-A musí
být zahájena co nejdříve a zůstává v rukou hematologa, spolupráce kardiologa zahrnuje především léčbu srdečního selhání, řešení arytmií, popř. dalších kardiovaskulárních komplikací.
Pacienti s ATTRv mohou být kandidáty transplantace jater nebo kombinované transplantace jater a srdce. Pacienti s ATTRwt vzhledem k vyššímu věku v době diagnózy nejsou k transplantaci indikováni. V posledních letech dochází k významnému posunu v oblasti specifické farmakoterapie. V současné době je nejvýznamnějším preparátem tafamidis, stabilizér tetrameru transthyretinu. Řada dalších preparátů, které by mohly najít uplatnění v léčbě amyloidózy, nyní prochází klinickými studiemi.
2.8.10 Specifické endokrinně podmíněné kardiomyopatie
Anna Chaloupka
Endokrinní poruchy mohou být podkladem získaných forem kardiomyopatií, typicky dilatační kardiomyopatie, a je nutné je systematickým přístupem pečlivě odlišit od genetických forem, protože mají často specifickou terapii a mohou být reverzibilní. Mezi typicky endokrinně podmíněné poruchy patří hypo- a hypertyreóza (pod obrazem dilatační kardiomyopatie), dále Cushingova choroba (dilatační či hypertrofická kardiomyopatie) a Addisonova choroba, feochromocytom (při hypertenzi může docházet k hypertrofii levé komory až obstrukci výtokového traktu, fokálním nekrózám myokardu), akromegalie (nadprodukce růstového hormonu je často spojena s hypertenzí a hypertrofií levé komory, arytmiemi, postupně dochází k dilataci a srdečnímu selhání) a diabetes mellitus (často iniciálně spojován s diastolickou dysfunkcí postupně progredující do obrazu dilatační kardiomyopatie).
2.8.11 Neuromuskulární onemocnění a kardiomyopatie
Anna Chaloupka
Mezi nejčastější neuromuskulární onemocnění způsobující kardiomyopatie (typicky dilatační kardiomyopatii) patří Duchennova muskulární dystrofie. Projevuje se v prvních letech života, mezi typické klinické známky patří progresivní svalová slabost a ztráta svalové hmoty postihující v pozdějších stadiích i dechové svalstvo, obraz dilatační kardiomyopatie, převodní poruchy, typické LGE na magnetické rezonanci srdce v posterolaterální subendokardiální lokalizaci, které může být spojeno i s akinezí v této oblasti. Genetickým podkladem jsou mutace v dystrofinu (DMD), dědičnost je X-vázaná. Léčba je symptomatická. Mírnější formou této DMD dystrofinopatie je Beckerova muskulární dystrofie, nástup příznaků a jejich progrese je pomalejší.
Emeryho–Dreifussova muskulární dystrofie je onemocnění, které způsobuje svalovou slabost, typický je časný vývoj kontraktur loktů a Achillových šlach a postižení převodního systému srdce často vyžadující implantaci kardiostimulátoru.
2.8.12 Další rysy a syndromy asociované s fenotypy kardiomyopatií
Anna Chaloupka
2.8.12.1 Hypertrabekulizace levé komory (dříve nonkompaktní kardiomyopatie)
Fenotypický obraz charakterizovaný výraznými trabekulami a hlubokými mezitrabekulárními prohlubněmi levé komory srdeční, dříve samostatná nozologická jednotka označovaná jako nonkompaktní kardiomyopatie, je podle nejnovějších doporučených postupů nazírán jako fenotypový rys, který se může vyskytnout izolovaně či v souvislosti s jinými kardiomyopatiemi, nejčastěji dilatační. Byly popsány i případy přechodné hypertrabekulizace spojené s těhotenstvím nebo intenzivní sportovní aktivitou. Velmi často je možné identifikovat rodinný výskyt a byla popsána řada variant genů ve spojitosti s tímto obrazem.
2.8.12.2 Takotsubo syndrom
Tento syndrom se vyznačuje dočasnou regionální systolickou dysfunkcí způsobující balonovité vyklenování hrotové či méně často midventrikulární části levé komory srdeční. Obvykle se projeví akutně vzniklou anginózní bolestí na hrudi spojenou s ST elevacemi na EKG, následovanými difuzní inverzí T vln a elevací troponinu, přičemž není průkaz obstrukce koronárního řečiště. Etiologicky je jeho vznik přisuzován vlivu excesivně zvýšených hladin noradrenalinu a často této epizodě předchází emoční či fyzický stres. Postihuje nejčastěji postmenopauzální ženy. Obvykle se normalizuje během dnů až týdnů, a proto se nově nedoporučuje klasifikovat jako samostatná kardiomyopatie.
2.9 Ortotopická transplantace srdce
Monika Špinarová, Lenka Špinarová, Jan Krejčí
Ortotopická transplantace srdce (OTS) je zavedená léčebná metoda pacientů v konečné fázi srdečního selhání, u kterých byly vyčerpány všechny farmakologické i nefarmakologické léčebné postupy. Samotná transplantace je chirurgická metoda, nicméně celý postup je výsledkem široké multioborové spolupráce.
První transplantace srdce byla provedena 3. 12. 1967 lékařem Christiaanem Barnardem v Kapském Městě v Jihoafrické republice. V současné době se v ČR provádí OTS v IKEM (Institut klinické a experimentální medicíny) Praha a v CKTCH (Centrum kardiovaskulární a transplantační chirurgie) Brno ve spolupráci s Fakultní nemocnicí u sv. Anny v Brně, v posledních letech v průměru 70krát ročně. Hospitalizační mortalita je pod 5 %. Rok po transplantaci přežívá více než 85 % pacientů, pět let přežívá 70 %, 10 let 50–60 %. Medián přežití je 12,2 let.
2.9.1 Indikace
Vybrat vhodného pacienta k provedení srdeční transplantace a zvolit vhodný okamžik výkonu je velmi komplexní rozhodnutí. Pacient musí splňovat jednak indikační kritéria, tj. prokázat, že jeho kardiální stav je natolik závažný a limitující a současně neexistuje jiný způsob léčby tohoto stavu. Na druhé straně nesmí mít kontraindikace, které by limitovaly jeho další přežívání po výkonu (tab. 2.37). Je samozřejmostí, že pacient musí mít plnou léčbu chronického srdečního selhání.
Mezi objektivní posouzení tíže srdečního selhání patří zátěžové vyšetření – spiroergometrie, kdy hodnota pVO2 < 12 ml/kg/min při užívání betablokátorů nebo < 14 ml/ kg/min při jejich intoleranci představují potenciální indikaci k transplantaci srdce. Pacienti se spotřebou kyslíku 14–18 ml kg–1 × min–1 mohou být indikováni k OTS, pokud mají další přídatná rizika.
Pro některé nemocné se v posledních letech stala alternativou srdeční transplantace implantace dlouhodobé mechanické srdeční podpory.
U pacientů, kteří mají zvýšenou prekapilární komponentu plicní hypertenze, kdy PVR (pulmonary vascular resistence, plicní vaskulární rezistence) je > 3,5 Wj navzdory farmakologickému testování její reverzibility, není transplantace možná z důvodu rizika selhání pravé komory dárcovského srdce. V takovém případě je možné zvážit implantaci levostranné srdeční podpory (LVAD) a následné přehodnocení stavu (tzv. bridge to candidacy). Rovněž pacienti, kteří se klinicky horší či dochází k rozvíjející se poruše funkce dalších orgánů a nemuseli by se transplantace srdce dožít,
Tab. 2.37 Indikace a kontraindikace transplantace srdce
Indikace
1. terminální srdeční selhání s těžkými symptomy, špatnou prognózou a žádnou jinou alternativou v léčbě
2. motivovaný, emočně stabilní a dobře informovaný pacient
3. pacient schopný dodržovat (compliantní) intenzivní léčbu po operaci
1. aktivní infekce
2. těžká periferní nebo centrální ateroskleróza
3. farmakologicky neovlivnitelná plicní hypertenze (může být zvážen LVAD s následným přehodnocením stavu)
4. malignita (spolupráce s onkologem na posouzení rizika rekurence)
5. ireverzibilní ledvinné poškození (GF < 30 ml/min)
6. systémové onemocnění s multiorgánovým postižením
7. jiné závažné komorbidity se špatnou prognózou
8. předtransplantační BMI > 35 kg/m2
9. současné užívání alkoholu nebo drog
10. pacient, který nemá dostatečné sociální zázemí, aby dosáhl compliance s léčbou
BMI – body mass index, GF – glomerulární filtrace, LVAD – implantace levostranné srdeční podpory
Kontraindikace
mají naději v implantaci LVAD v rámci strategie bridge to transplantation. LVAD může být implantován i selektovaným pacientům s terminálním srdečním selháním, kteří nejsou vhodnými kandidáty k OTS. V tomto případě mluvíme o strategii destination therapy. Předpokladem indikace LVAD je dobrá spolupráce s pacientem, sociální zázemí a přijatelná funkce pravé komory srdeční.
2.9.2 Potransplantační sledování
Dárcovský štěp je odebrán od zemřelého bez závažného srdečního onemocnění. Legislativně může být dárcem kdokoliv, kdo není v registru osob nesouhlasících s darováním orgánů, nicméně podle zvyklostí pracovišť je v ČR nutný souhlas rodiny zemřelého (zákon č. 285/2002 Sb.).
V průběhu operace je nahrazeno srdce příjemce srdcem dárce, a to tak, že příjemce dostává od dárce celý srdeční sval, včetně koronárních cév.
Sledování pacientů po OTS zahrnuje v prvních 1–2 letech po operaci plánované endomyokardiální biopsie (EMB) –odběr vzorku srdeční tkáně cestou v. subclavia či v. jugularis z pravé komory k odhalení rejekce, tedy odhojení štěpu. Pravidelně se provádí echokardiografie a laboratorní vyšetření. Dále je doporučováno provést koronarografii, optimálně ve spojení s intravaskulárním ultrazvukem či optickou koherenční tomografií (OCT) v prvním měsíci a dále po prvním roce od transplantace srdce. Další opakování již závisí na nálezu a klinickém stavu pacienta. Důvodem je odhalení přítomnosti či progrese vaskulopatie štěpu.
2.9.3 Imunosupresivní
léčba
Aby nedošlo k rejekci, musí pacient trvale užívat léky na potlačení imunitní reakce organismu, tedy imunosupresiva, která podáváme v kombinaci, abychom zabránili rozvoji rejekce na různých úrovních. Rozlišujeme tyto základní skupiny imunosupresiv:
1. inhibitory kalcineurinu (CNI): cyklosporin a takrolimus, 2. inhibitory mTOR (everolimus), 3. antiproliferativní látky: mykofenolát mofetil a azathioprin, 4. kortikoidy (prednison).
V zásadě platí, že v rámci jedné skupiny léky nekombinujeme. Provádíme kombinaci mezi jednotlivými skupinami. Základní kombinace imunosupresiv uvádí tabulka 2.38 a kombinační léčbu s podáním inhibitorů mTOR tabulka 2.39. Režimy s cyklosporinem jsou spíše historické. Režimy s inhibitory mTOR jsou již speciální a jsou užívány u pacientů s nefropatií, vaskulopatií či malignitami. Součástí léčby jsou také poměrně vysoké dávky kortikoidů, které se při dobrém průběhu postupně snižují. Po prvním roce od transplantace se snažíme ve všech režimech kortikoidy pacientům vysadit a výsledná doživotní léčba je dvojkombinace imunosuprese.
Tab. 2.38 Standardní kombinační imunosupresivní léčba
• cyklosporin + mykofenolát mofetil + prednison (do roku po transplantaci)
• takrolimus + mykofenolát mofetil + prednison (do roku po transplantaci)
• cyklosporin + mykofenolát mofetil (více než rok po transplantaci)
• takrolimus + mykofenolát mofetil (více než rok po transplantaci)
Tab. 2.39 Kombinační imunosupresivní léčba s podáním inhibitorů mTOR
• nízké dávky takrolimu + nízké dávky everolimu
• nízké dávky cyklosporinu + nízké dávky everolimu
• mykofenolát mofetil + everolimus (= calcineurin‑free režim)
2.9.4 Komplikace po srdeční transplantaci
A. Časné – jsou řešeny na chirurgickém pracovišti
1. poruchy funkce štěpu
2. časná rejekce
3. infekce
B. Pozdní – řeší kardiolog v dlouhodobém sledování
1. rejekce
2. vaskulopatie štěpu
3. komplikace imunosuprese
2.9.4.1 Rejekce
Při jakékoli alotransplantaci orgánu může dojít k rejekci, tedy odmítnutí nebo odhojení štěpu. Podle mechanismu vzniku rozeznáváme rejekci celulární nebo humorální, podle rychlosti nástupu ji dělíme na hyperakutní, akutní a chronickou. Akutní celulární rejekce je zprostředkovaná T-lymfocyty a projevuje se lymfocytární infiltrací v myokardu s pozdějším rozpadem buněk a infiltrací polymorfonukleáry. Její mírné formy jsou relativně časté, její frekvence s odstupem od transplantace obvykle klesá. Může mít dramatickou a život ohrožující podobu, nebo naopak proběhnout asymptomaticky. Při dobré adherenci nemocného k léčbě jsou rejekční epizody většinou mírné. Rejekci lze spolehlivě prokázat pouze histologicky v bioptickém vzorku z myokardu. Humorální rejekce neboli protilátkami způsobená rejekce je zprostředkována specifickými cytotoxickými protilátkami. Vyskytuje ve formě hyperakutní, do 24 hodin od transplantace, často provázené srdečním selháváním, a ve formě chronické, která je sdružena se sníženým dlouhodobým přežíváním, neboť je rizikovým faktorem vývoje koronární nemoci štěpu. Metoda detekce zahrnuje barvení C4d ve tkáních, které má větší senzitivitu i specificitu než histologické charakteristiky.


2.9.4.2 Vaskulopatie štěpu
Vaskulopatie štěpu je charakterizována intimálními změnami na věnčitých tepnách. Někdy je také označována jako koronární nemoc štěpu (CAV). Změny na koronárních tepnách se liší od klasické aterosklerózy. Jde o difuzní intimální hyperplastický proces. Lumen cév se však postupně uzavírá, přitom na koronarogramu nemusí být tyto změny vůbec patrné. Spolehlivou metodou k identifikaci vaskulopatie je pak vyšetření optickou koherenční tomografií (OCT) či intravaskulární ultrazvukové vyšetření (IVUS). Etiologie není jasná, předpokládá se kombinace faktorů. Progrese může být velmi rychlá. Léčba je svízelná, kromě režimových opatření jako u ICHS se doporučuje podávání statinů, antiagregačních léků a inhibitorů angiotenzin konvertujícího enzymu. Mezi metody volby patří také změna imunosuprese: switch z takrolimu a mykofenolátu na kombinaci takrolimus a everolimus, který je účinnější antiproliferativní látka. Spíše ve výjimečných případech je možné provést revaskularizaci (obvykle PCI). Pokročilá forma vaskulopatie, která může vést až k dysfunkci štěpu, se řeší retransplantací srdce.
2.9.4.3 Komplikace imunosuprese
Infekce jsou nejčastější příčinou morbidity a mortality v prvním roce po OTS. Možný je výskyt nejen běžných komunitních infekcí, ale v důsledku četných hospitalizací také nozokomiálních nákaz. Často se setkáváme s různými oportunními infekcemi, které bývají spojeny s obtížnější diagnostikou a léčbou. Častými patogeny jsou cytomegalovirus (CMV), herpes viry, Pneumocystis carinii, Legionella a mykózy. V případě nutnosti nasazení antiinfekční terapie je zásadní myslet na možné interakce této léčby s imunosupresivy.
Potransplantační hypertenze je spojena se zvýšením tonu sympatiku a nepřítomností nočního poklesu. Její výskyt se udává 70–90 % u pacientů po srdeční transplantaci. Léčba je svízelná, ve většině případů je třeba kombinační terapie. Ve farmakologické léčbě je základním předpokladem snaha udržet co nejnižší účinnou hladinu cyklosporinu či jeho nahrazení takrolimem a vysadit v průběhu prvního roku kortikoidy. Podávají se kalcioví antagonisté i pro jejich možný preventivní vliv na vznik vaskulopatie, následují inhibitory angiotenzin konvertujícího enzymu, betablokátory a diuretika. V léčbě hypertenze po OTS je doporučováno dosažení stejných cílových hodnot jako u běžné populace.
Nefropatie souvisí s podáváním inhibitorů kalcineurinu: cyklosporinu nebo takrolimu. Proto se snažíme o minimalizaci jejich dávek, resp. o zavedení režimu v kombinaci s inhibitorem mTOR.
Hyperlipoproteinemie se popisuje u 60–80 % pacientů po srdeční transplantaci. Hladiny cholesterolu se zvyšují někdy již v prvních třech týdnech a nejčastěji k tomu dochází v průběhu prvních 6–18 měsíců. V léčbě se uplatňuje dieta, redukce kortikoidů a podávání statinů.
Diabetes mellitus souvisí s podáváním kortikoidů. Zhoršování diabetu také podporuje takrolimus. U pacientů, kteří již diabetes měli, se často přechází na inzulin či jsou jeho dávky zvyšovány. Jako výhodné se jeví podávání metforminu, při jehož podávání byl u pacientů po OTS prokázán i snížený výskyt malignit.
Častá je také prevalence metabolického syndromu, který je i rizikovým faktorem pro výskyt vaskulopatie štěpu. Jaterní poruchy jsou většinou dávány do souvislosti s podáváním cyklosporinu. Je rovněž ovlivněn metabolismus bilirubinu, může docházet k cholestáze a tvorbě žlučových kamenů.
Z gastrointestinálních potíží je častá dyspepsie, kortikoidy mohou aktivovat vředovou chorobu nebo k ní vést. Osteoporóza je dána především vysokými dávkami kortikoidů. Léčba spočívá ve snaze o vysazení kortikoidů, podání vápníku, kalcitoninu, bisfosfonátů, vitaminu D a rehabilitaci.
Poruchy krvetvorby, zvláště pokles bílých a následně i červených krvinek, může způsobit zejména mykofenolát mofetil. Léčba spočívá v jeho vysazení a nasazení jiného imunosupresiva, podání prednisonu, při těžších útlumech se využijí krevní převody, event. růstové faktory.
Pacienti po transplantaci mají mnohonásobně větší riziko vzniku maligních onemocnění než jejich stejně staří vrstevníci. Incidence malignit je udávána 33 % v 10letém přežívání. Nejčastějším případem jsou kožní malignity a dále abnormální proliferace B-lymfocytů. Úmrtí z důvodů malignity přibývá s prodlužujícím se přežíváním pacientů.
Závěr
Přes všechny uvedené možné komplikace představuje transplantace srdce pro pacienty s těžkým srdečním selháním prodloužení života a zlepšení jeho kvality. Nemocní odkázaní často na předchozí několikaměsíční pobyt na lůžku, kontinuální infuze katecholaminů, opakované punkce výpotků apod. mohou po OTS vést zcela normální život. Velká část transplantovaných se vrací do zaměstnání, mohou sportovat, cestovat, řídit motorové vozidlo, žít plnohodnotný kvalitní život.
2.10 Poruchy srdečního rytmu
Ondřej Toman, Lubomír Křivan, Milan Kozák, Tomáš Novotný, Irena Andršová, Martin Fiala Normální srdeční frekvence (SF) je arbitrálně stanovena na 60–100/min. Srdeční frekvence < 60/min je označována jako bradykardie, > 100 jako tachykardie. Samotný pojem bradykardie/tachykardie značí pomalou nebo rychlou SF, avšak neznamená vždy patologii. Srdeční frekvence je ovlivněna věkem, fyzickou aktivitou, působením autonomního nervového systému nebo fyzickým tréninkem. U zdravých, asymptomatických jedinců může ve spánku nebo v klidu poklesnout SF až k hodnotám 40/min. Maximální fyziologická SF je odhadována klasickou rovnicí 220 – věk. K bradykardiím se řadí i chronotropní inkompetence, kdy klidová SF je uspokojivá, ale nedochází k dostatečnému zrychlení při zátěži, což vede k symptomům, jako je například dušnost, nevýkonnost.
Jako arytmie se označují již nefyziologické poruchy srdečního rytmu, s výslednou pomalou (bradyarytmie) nebo rychlou (tachyarytmie) SF nebo jejich kombinací. Arytmie vznikají na podkladě abnormálního vzniku elektrické srdeční aktivity (fyziologický sinusový rytmus vzniká pouze v sinusovém uzlu – SAN) nebo jejího abnormálního šíření
(fyziologicky ze síní pouze přes převodní systém – atrioventrikulární uzel – AVN a dále nitrokomorovým vedením přes funkční Tawarova raménka, Purkyňův systém na myokard komor). Ke vzniku arytmie je tedy nutný arytmogenní substrát a většinou i vnější příčiny – spouštěcí, modulující faktory. Arytmogenní substrát může být vrozený, častěji však bývá získaný v rámci jiných kardiálních i systémových onemocnění, včetně terapeutických intervencí.
2.10.1 Příznaky arytmií
Arytmie nemusí být některými pacienty vůbec vnímány, jsou asymptomatické, jsou pak zjištěny například v rámci preventivních prohlídek, předoperačních vyšetření atd. Nejčastějšími symptomy jsou pocit nepravidelného tepu, bušení srdce (palpitace), dušnost, únava, snížení tolerance námahy, krátké závratě, pocity na omdlení, zmatenost, pocení, nykturie. Závažným symptomem je synkopa. Zástava srdeční akce na dobu > 6 sekund vede téměř vždy ke ztrátě vědomí. Pro bradykardickou synkopu je charakteristický náhlý vznik, bez prodromů, často spojený i s poraněním. Trvání bývá krátké a po probrání je pacient většinou bez potíží. Nejrizikovější jsou synkopy spojené se ztrátou tonu svěračů (pomočením, pokálením), křečovými stavy, synkopy vznikající při námaze. Tyto synkopální stavy vznikají nejčastěji na podkladě setrvalých, hemodynamicky netolerovaných tachyarytmií, s potenciální oběhovou zástavou a eventuálně i náhlou srdeční smrtí.
2.10.2 Diagnostika arytmií
Již důkladnou anamnézou lze zjistit mnoho podstatných údajů pro diferenciální diagnostiku jednotlivých arytmií. Dotazy by měly směřovat na nejčastější symptomy a projevy arytmií, včetně délky trvání, četnosti obtíží, časového průběhu, včetně charakteristicky náhlého nebo naopak pozvolného začátku a ukončení arytmie. Pečlivě by rovněž měly být zjištěny přidružené nemoci, stávající medikace a také rodinná anamnéza.
Základní diagnostickou metodou zůstává standardní 12svodové EKG, jak nativní při sinusovém rytmu (morfologie, převodní intervaly), tak ideálně i s přímo zachycenou arytmií. Pokud se již takto podaří danou arytmii zachytit, je pro případná navazující specializovaná vyšetření nebo
zákroky důležité, aby kopie EKG s arytmií byla součástí příslušné lékařské zprávy. V určitých případech je indikováno i provedení zátěžového EKG vyšetření (bicyklová ergometrie, běhátko) – např. k průkazu tachyarytmií provokovaných sympatikotonií, nebo naopak k průkazu chronotropní inkompetence.
Většina arytmií se minimálně v počátečních stadiích objevuje záchvatovitě, tudíž se v rámci běžného vyšetření zachytit nezdaří. V současné době však existují široké možnosti krátkodobé i dlouhodobé monitorace EKG, počínaje standardním třísvodovým EKG holterovským monitorováním na 24 hodin. Monitoraci však lze prodloužit na 48 hodin, týden i více. Moderní praktické EKG záznamníky velikosti menší než kreditní karta umožňují monitoraci po dobu několika týdnů i měsíců. EKG se takto zaznamenává principem nekonečné smyčky a pacient (nebo přístroj sám automaticky) při potížích uchová záznam natočeného úseku EKG nebo si pacient sám přikládá záznamník na hrudník a nahrává EKG pouze při potížích. To však vyžaduje plný stav vědomí a spolupráci. Jednosvodový záznam EKG již nabízejí i některé „chytré hodinky“. V indikovaných případech lze využít i miniaturní podkožní implantabilní smyčkový záznamník – někteří pacienti mohou mít symptomy (zejména synkopální stavy) pouze zřídka, několikrát do roka. Implantabilní záznamník snímá kontinuálně srdeční rytmus po dobu až tří let a v případě významné arytmie zaznamená událost, kterou poté můžeme verifikovat načtením přes externí programátor. Rekordér má podobu „čipu“, který lze do podkoží snadno zavést injekčně v lokální anestezii (obr. 2.40). Cennou informaci může přinést i absence arytmií v době symptomů, prokazující, že se arytmie na potížích pacienta nepodílí.
Součástí základního vyšetření by mělo být i laboratorní vyšetření (iontogram, renální a jaterní soubor, hormony štítnice, krevní obraz) a echokardiografie. V případě abnormálního morfologického nálezu při echokardiografii jsou již většinou na základě kardiologické indikace doporučována další specializovaná vyšetření (magnetická rezonance srdce, koronarografie atd.). Při nálezu tachykardie se širokým QRS (většinou komorových) je nutno pacienta urgentně směrovat ke komplexní diagnostice přímo do kardiocentra.
Elektrofyziologické vyšetření – katétry invazivně zavedenými transvenózně (nejčastěji femorálním přístupem) do srdce můžeme změřit přesně srdeční převodní časy, charakter prográdního (ze síní na komory) i retrográdního (z komor na síně) vedení, případně vyvolat specifickou arytmii. Součástí
bývá někdy i programovaná stimulace komor – k zjištění typu komorové arytmie nebo stratifikace rizika náhlé srdeční smrti. Samotné elektrofyziologické vyšetření bývá dnes indikováno zřídka, v naprosté většině u pacientů, u nichž předpokládáme navazující katétrovou ablaci.
V rámci diferenciální diagnostiky tachyarytmií lze u hemodynamicky stabilních pacientů s běžící tachyarytmií využít i tzv. vagové manévry (Valsalvův manévr, tlak na stolici, tlak na oční bulby, masáž karotid – za monitorace EKG!) a intravenózní aplikaci adenosinu (rychlým intravenózním bolusem 6 mg, ev. 12–18 mg). Vagové manévry i adenosin zpomalují nebo blokují vedení v AV uzlu. Pokud se arytmie náhle zastaví, jedná se nejspíše o AV nodální reentry tachykardii nebo AV reentry tachykardii. Pokud dojde k postupnému zpomalení a opětovnému zrychlení, může se jednat o sinusovou tachykardii nebo o fokální síňovou tachykardii. Zpomalením vedení v atrioventrikulárním (AV) uzlu se může jen zpomalit odpověď komor při arytmii, demaskují se tak vlnky fibrilace nebo flutteru síní.
2.10.3 Bradyarytmie
2.10.3.1 Příčiny bradyarytmií
■ Vlastní postižení převodního systému – arytmogenní substrát
Vrozený:
• vrozená AV blokáda.
Získaný:
• degenerativní změny – nejčastěji narůstající s věkem pacientů,
• ischemická choroba srdeční (ICHS) – porucha krevního zásobení převodního systému,
• záněty – myokarditida, infekční endokarditida, borelióza, difterie,
• chlopenní vady – anulus aortální chlopně těsně souvisí s AV uzlem; při masivních kalcifikacích, operační nebo katetrizační (TAVI) náhradě chlopně dochází k poškození AV uzlu,
• infiltrativní choroby myokardu – sarkoidóza, amyloidóza.
■ Vnější příčiny (spouštěcí, modulující faktory)
• působení n. vagus – vazovagální reflexní synkopa, hypersenzitivita karotického sinu, zvracení,
• bradykardizující medikace – veškerá antiarytmika, lithium, klonidin,
• porucha elektrolytů – hyperkalemie,
• endokrinní – hypotyreóza,
• hypotermie,
• hypoxie – útlum dýchacího centra, syndrom spánkové apnoe,
• zvýšení intrakraniálního tlaku – úrazy, operace a tumory CNS,
• účinek drog, např. kokain.
2.10.3.2 Porucha funkce sinusového uzlu
Z elektrofyziologického hlediska se rozlišují poruchy vzniku impulzu v uzlu samotném (SA zástavy) a následně poruchy vedení z uzlu na přilehlý síňový myokard (SA blokády). Z klinického pohledu je však toto dělení nepodstatné. Na EKG zaznamenáme bradykardii a/nebo výpadky síňové aktivity (obr. 2.41). Se zvyšujícím se věkem pacientů se častěji setkáváme s tzv. syndromem nemocného sinusového uzlu (sick sinus syndrome – SSS). Typickým nálezem bývá střídání sinusové bradykardie a výpadků v sinusovém rytmu se salvami supraventrikulárních extrasystol, případně paroxysmů fibrilace síní (FS). Pacienti trpí palpitacemi a mohou se objevit i synkopy na podkladě preautomatické pauzy. Po skončení paroxysmu FS trvá nemocnému sinusovému uzlu dlouho, než dojde k obnovení sinusového rytmu. Taková několikasekundová asystolie vede často k synkopě (obr. 2.42).
2.10.3.3 Porucha funkce atrioventrikulárního uzlu (AV)
Poruchy AV vedení se mohou objevit na kterékoliv úrovni od AV junkce až po Tawarova raménka. Vznikají tak AV, raménkové a fascikulární blokády.
AV blokáda (AVB) I. stupně: Vedení ze síní na komory AV uzlem trvá déle než 200 ms (PQ > 200 ms). Nicméně všechny síňové impulzy jsou na komory převedeny 1 : 1. Záchyt AVB I. stupně bývá náhodný, pacient je asymptomatický a nevyžaduje léčbu. Význam nálezu je v informaci o iniciálním postižení AV uzlu s možností progrese do AVB vyššího typu. U pacientů s AVB I. stupně je nutná vyšší obezřetnost při podávání antiarytmik (obr. 2.43).
AVB II. stupně se dále dělí na dva podtypy:
Typ 1. Wenckebachův typ (v cizojazyčné literatuře též Mobitz I) – síňová aktivita je převáděna na komory s postupným prodlužováním PQ intervalu, až dojde k výpadku převodu ze síně na komory. Po pauze způsobené absencí komorové depolarizace je AV uzel „odpočinutý“ a následný PQ interval může být i normální. Dále dochází opět k prodloužení vedení a výpadku. Tento typ blokády svědčí pro suprahisární AV blokádu, nemusí být symptomatický a můžeme jej nalézt i u zdravých jedinců, zejména ve spánku. Typ 2. (Mobitz II) – náhlé výpadky vedení ze síní na komory, kdy nacházíme nejméně jednu a více nepřevedených P vln. Příčinou bývá infrahisální postižení AV uzlu a je zde vysoké riziko přechodu do kompletní AVB. Symptomy jsou výrazně častější než u předešlého typu (obr. 2.44).
AVB III. stupně: Kompletní přerušení vedení mezi síní a komorou. Převodní systém většiny pacientů je schopen vytvořit náhradní (záchranný) rytmus, buď těsně pod úrovní AV blokády (štíhlý QRS, frekvence 40–55/min – obr. 2.45), nebo z oblasti Tawarových ramének (široký QRS s frekvencí < 40/min – obr. 2.46). Na EKG tak můžeme vidět kompletní disociaci, kdy se komory a síně aktivují nezávisle, každá svojí frekvencí. Tato AVB je téměř vždy symptomatická, nejčastěji spojená se synkopou, dušností, hypotenzí a ostatními projevy nízkého srdečního výdeje. Pokud nemocný nemá náhradní centrum automacie pod úrovní AV blokády a ta trvá, dochází k asystolii komor a náhlé srdeční smrti.
Obr. 2.41 Sinusová bradykardie 34/min
Obr. 2.42 Sick sinus syndrom – preautomatická pauza, přechodná asystolie po ukončení paroxysmu fibrilace síní
Obr. 2.43 AVB I. stupně, PQ > 200 ms, převod ze síní na komory 1 : 1
Obr. 2.44 AVB II – Mobitz II 3 : 1
Raménkové a fascikulární blokády: Vedou k tvorbě vzniku bloků pravého nebo levého Tawarova raménka, v případě fasciklů k hemiblokům. Tak dochází k poruše nitrokomorové nebo mezikomorové aktivace a následné dyssynchronii srdečního stahu (jedna komora nebo její část se stahuje opožděně proti druhé). Přítomnost této poruchy na EKG nás informuje o vyšším riziku vzniku kompletního AV bloku. Pokud však nejsou přítomny symptomy a není
dokumentována AV blokáda II. nebo III. stupně, tento stav nevyžaduje léčbu.
2.10.3.4 Léčba bradyarytmií
Farmakoterapie – samozřejmostí léčby je vysazení veškeré antiarytmické a bradykardizující medikace a léčba
Obr. 2.45 AVB III s náhradním junkčním rytmem
Obr. 2.46 AVB III s náhradním komorovým rytmem
případných reverzibilních příčin, jako je hyperkalemie, hypotyreóza. V akutním stavu můžeme podat opakovaně atropin 0,5 mg i.v. nebo isoprenalin v kontinuální infuzi.
Dočasná zevní stimulace – pokud není podání léků efektivní a bradykardie je symptomatická a hemodynamicky netolerovaná, je nutné pacienta zajistit dočasnou stimulací. Většina moderních přenosných defibrilátorů je vybavena i funkcí zevní transtorakální stimulace, kdy je možné s pomocí velkoplošných elektrod nalepených na přední a zadní straně hrudníku stimulovat srdeční sval. Každý elektrický impulz však zároveň stimuluje i svaly hrudníku a způsobuje pacientovi bolestivé záškuby. Proto je zevní stimulace vhodná jen jako krátkodobá, např. na dobu transportu na specializované pracoviště (obr. 2.47).
Transvenózní dočasná kardiostimulace – zavádí se přes centrální žílu (podklíčkovou, jugulární, nebo femorální) do dutiny pravé komory. Umožní překlenout dobu do zavedení trvalého kardiostimulátoru. Protože je použití transvenózní dočasné stimulace zatíženo řadou možných komplikací, je tato metoda vyhrazena pouze pro bradykardie se závažnými hemodynamickými projevy (obr. 2.48).
Trvalá kardiostimulace – principem je zavedení elektrody/elektrod do srdečních oddílů transvenózní cestou, nejčastěji cestou v. subclavia. Na elektrody je napojen stimulátor, který je následně umístěn do podkožní kapsy v podklíčkové oblasti. Stimulátor lze kdykoliv následně odečíst zevním programátorem a upravovat tak jeho parametry.
Základní typy tvoří jednodutinové stimulátory s elektrodou v pravé komoře, typicky užívané u pacientů s permanentní fibrilací síní. U nemocných s poruchami sinusového a AV uzlu jsou preferovány stimulátory dvoudutinové umožňující stimulaci síní i komor (obr. 2.49). U pacientů se srdečním selháním a přítomnou mezikomorovou dyssynchronií implantujeme systémy se třemi elektrodami, z nichž ta třetí je cestou koronárního sinu zavedena epikardiálně nad levou komoru, a umožňuje tak synchronní stimulaci obou komor (cardiac resynchronization therapy – CRT) (obr. 2.50). Jakákoliv forma trvalé stimulace může být vždy v kombinaci
s implantabilními kardiovertery-defibrilátory (ICD) u pacientů s rizikem maligních arytmií.
Indikace: Pro indikaci trvalé kardiostimulace existují rozsáhlé doporučené postupy americké a evropské kardiologické společnosti. Velmi zjednodušeně lze říct, že ke stimulaci jsou indikovaní pacienti s:
• poruchou sinusového uzlu a přítomnou symptomatickou bradykardií,
• AVB II. stupně Mobitz II,
• získanou AVB III. stupně bez ohledu na symptomy,
• nevyjasněnou synkopou a bifascikulárním blokem, případně alternujícím raménkovým blokem,
Obr. 2.48 Transvenózní dočasná kardiostimulace
Obr. 2.47 Umístění elektrod dočasné zevní transtorakální stimulace
Obr. 2.49 Jednodutinový a dvoudutinový stimulátor
Obr. 2.50 Resynchronizační stimulace
• srdečním selháním, EF LK < 35 % a poruchou nitrokomorového vedení s QRS > 130 ms – indikace k resynchronizační terapii.
K označení stimulačního režimu se používají tři základní písmena, která sdělují, který stimulační oddíl je stimulován, který je snímán a jak reaguje stimulátor na zaznamenanou srdeční aktivitu, tedy zda vlastní elektrická aktivita srdce stimulaci inhibuje nebo zda podle snímané aktivity síní je například spouštěna stimulace komor.
Stimulovaná srdeční dutina
Snímaná aktivita Odpověď na vlastní signál
A – atrium A – atrium I – inhibited V – ventricle V – ventricle T – triggered D – dual (A + V) D – dual (A + V) D – dual (inhibited + triggered)
Čtvrté písmeno R potom značí funkci přizpůsobení srdeční frekvence (rate responsive), kdy stimulátory díky zabudovaným senzorům umí zrychlovat srdeční frekvenci při fyzické aktivitě pacienta.
Příklady:
• VAT – stimulace komor, která je spouštěná vlastní síňovou aktivitou,
• DDD, R – sekvenční stimulace síní i komor, s reakcí senzoru na fyzickou aktivitu.
V dlouhodobém sledování nemocných se stimulátorem bylo prokázáno, že u některých pacientů s vysokým procentem komorové stimulace může dojít k rozvoji levostranného srdečního selhání na podkladě dyssynchronie způsobené stimulací v hrotové pozici pravé komory. Protože pouze část pacientů vyžaduje skutečně trvalou komorovou stimulaci, jsou moderní přístroje vybaveny řadou algoritmů minimalizujících stimulaci pravé komory. Tam, kde je komorová stimulace nezbytná a/nebo hrozí rozvoj srdečního selhání, preferujeme stimulaci resynchronizační nebo septální, kdy se zavádí elektroda do mezikomorového septa s cílem uchvátit převodní systém pod Hisovým svazkem, nikoliv pouze pracovní myokard, a zabránit tak rozvoji elektrické dyssynchronie (obr. 2.51).
Moderní metodou stimulace je zavedení bezelektrodového (leadless) stimulátoru přímo do srdce. Přístroj má velikost patrony, zavádí se katétrem přes femorální žílu a po ukotvení v myokardu pravé komory je od katétru odpojen a ponechán na místě. Klinicky je zatím rozšířena pouze jednodutinová varianta této stimulace, ale již jsou testovány i složitější bezelektrodové systémy. Využití je vhodné u pacientů, kde není možné zavádění elektrod přes podklíčkovou žílu (uzávěr žilního systému, přítomnost dialyzačních shuntů, předchozí infekční endokarditida na elektrodách) (obr. 2.52).
Alternativou transvenózní stimulace je epikardiální stimulace zaváděná kardiochirurgem při otevřeném hrudníku nebo torakoskopicky (obr. 2.53). Používá se výjimečně,
Obr. 2.51 Septální stimulace
Obr. 2.53 Epikardiální stimulační elektrody
Obr. 2.52 Bezelektrodový stimulátor
např. při operacích vrozených vad u dětí nebo v případech, kdy z různých důvodů nelze zavést elektrody žilním systémem.
2.10.4 Tachyarytmie
2.10.4.1 Příčiny tachyarytmií
■ Arytmogenní substrát
Vrozený:
• duální vedení v AV uzlu – AV nodální reentry tachykardie,
• přídatné dráhy (akcesorní spojky) – AV reentry tachykardie.
Získaný:
• ischemické jizvy po infarktu myokardu – komorové tachykardie,
• ložiskové postižení, infiltrace myokardu (kardiomyopatie, střádavá onemocnění, myokarditidy) – komorové tachykardie,
• degenerativní postižení, fibróza, remodelace síní – fibrilace síní,
• jizvy po kardiochirurgických zásazích (vrozené srdeční vady) – incizionální síňové makroreentry tachykardie, komorové tachykardie,
• léze po katétrových ablacích (zejména fibrilace síní) –síňové tachykardie, atypický flutter síní.
■ Vnější příčiny (spouštěcí, modulující faktory):
• sympatikotonie (fyzická námaha, stres, horečka atd.),
• endokrinní – hypertyreóza, feochromocytom,
• hyperkinetická cirkulace (gravidita, anemie),
• tachykardizující léky – katecholaminy, sympatomimetika,
• poruchy elektrolytů – hypokalemie, hypomagnezemie,
• účinek drog – amfetamin, kokain.
Tachyarytmie lze klasifikovat podle různých kritérií a pohledů.
Podle patofyziologie:
• abnormální tvorba elektrické aktivity: ektopická fokální aktivita (abnormální automacie kardiomyocytů, spouštěná aktivita): extrasystoly, fokální síňové nebo komorové arytmie,
• abnormální šíření elektrické aktivity: makroreentry nebo mikroreentry tachyarytmie (flutter síní, AV reentry tachykardie, komorové tachykardie, fibrilace síní).
Podle klinického průběhu a závažnosti:
• symptomatické x asymptomatické,
• paroxysmální (záchvatovité) x perzistentní (přetrvávající) x permanentní (trvalé) x ev. incesantní (neztišitelné); setrvalé (˃ 30 s) x nesetrvalé,
• hemodynamicky stabilní x hemodynamicky nestabilní.
Praktická klinická klasifikace je uvedena v tabulce 2.40
2.10.4.2 Léčba tachyarytmií
Při léčbě tachyarytmií se využívají v podstatě tři základní přístupy, které se vzájemně kombinují podle konkrétní arytmie a individuálního pacienta:
1. Farmakoterapie: indikovány jsou léky zpomalující vedení v převodním systému (nejvíce v AV uzlu) s cílem
Tab. 2.40 Klinická klasifikace tachyarytmií
Tachykardie se štíhlým QRS (≤ 120 ms)
snížení a kontroly tepové frekvence (betablokátory, Ca blokátory – verapamil, diltiazem, dále digitalis) a samozřejmě i léky, které působí na základní mechanismy arytmie, tedy ke kontrole rytmu, antiarytmika: nejčastěji propafenon, sotalol, amiodaron, ev. dronedaron, flekainid, ostatní již výjimečně.
2. Intervenční léčba: katétrové ablace (KA) – většinou transvenózně zavedenými katétry je přímo intrakardiálně (ev. epikardiálně) zničen nebo modifikován substrát arytmie nebo vytvořeny bariéry pro její šíření. V současné době jsou katétrové ablace většinou efektivnějším a mnohdy kurativním způsobem léčby oproti běžné farmakoterapii. Využívají se různé druhy energie (radiofrekvenční, kryoenergie, laser, nejmodernější je nyní elektroporace – ablace pulzním polem), moderní technologie (3D mapování, pokročilé zobrazovací metody). Katétrové ablace lze kombinovat i s přístrojovou léčbou (kardiostimulátory/defibrilátory), méně často se provádějí přímo chirurgicky (většinou v kombinaci s jiným kardiochirurgickým výkonem). Ve specializovaných centrech se komplikace těchto výkonů vyskytují zřídka.
3. Podpůrná léčba: komplexní léčba přidružených onemocnění, včetně změny životního stylu (alkohol, kouření, redukce hmotnosti, fyzická aktivita), antikoagulační léčba (zejména u fibrilace síní).
Praktický návod k základní léčbě tachyarytmií je uveden v tabulce 2.41
2.10.5 Síňové arytmie
2.10.5.1 AV nodální reentry tachykardie (AVNRT)
AVNRT představuje asi 60 % pravidelných tachykardií se štíhlým QRS komplexem. Substrátem této tachyarytmie je
Tachykardie se širokým QRS (> 120 ms) AV nodální reentry tachykardie (AVNRT) komorová tachykardie ortodromní AV reentry tachykardie (AVRT) antidromní AV reentry tachykardie (AVRT) fokální síňová tachykardie (ST)
supraventrikulární arytmie s aberací (fixní nebo funkční blok Tawarova raménka) síňové makroreentry tachykardie („flutter“) fibrilace síní
supraventrikulární arytmie převáděné na komory přes antegrádní akcesorní spojku septální komorová tachykardie (vzácně)
fibrilace komor
Tab. 2.41 Praktický návod k základní akutní léčbě tachyarytmií
Tachyarytmie hemodynamicky stabilní
12svodové EKG
Tachyarytmie hemodynamicky nestabilní (hypotenze, srdeční selhání, hypoxie, ztráta vědomí)
12svodové EKG vagové manévry antiarytmika adenosin promptní elektrická kardioverze antiarytmika (ev. elektrická kardioverze) rozšířená KPCR
KPCR – kardiopulmonální resuscitace
funkčně „dvojité“ vedení AV uzlem. Za určitých okolností se tyto vstupy spojí do malého reentry okruhu a spustí se arytmie, přičemž jsou prakticky současně aktivovány srdeční síně i komory. Charakteristický je tedy krátký RP interval na EKG, P vlny jsou skryty v QRS komplexu nebo jsou těsně za ním (i ve formě „pseudo R“ nebo „pseudo S“). Frekvence AVNRT závisí na převodní kapacitě AV uzlu, většinou se snižuje s věkem, může tedy být od asi 120 do 220/min. Při rychlejších frekvencích může docházet k funkční blokádě Tawarových ramének, aberaci, tachyarytmie tedy může mít i široký QRS komplex (obr. 2.54). Záchvaty AVNRT trvají řádově minuty až několik hodin, většinou s náhlým začátkem a náhlým koncem.
K akutnímu přerušení AVNRT lze vyzkoušet vagové manévry, z farmak je nejúčinnější intravenózní bolus adenosinu (12–18 mg) nebo verapamilu (5–10 mg). V dlouhodobé léčbě může být vyzkoušeno podávání perorálního verapamilu podle potřeby při záchvatu (40–80 mg), metodou první volby je však katétrová ablace. Ablace se provádí v oblasti tzv. pomalé dráhy, pomalého vstupu do AV uzlu, v pravé srdeční síni, anteriorně od ústí koronárního sinu. Výkon je vysoce efektivní, kurativní, riziko rekurencí je menší než asi 3 %.
2.10.5.2 AV reentry tachykardie (AVRT)
Asi 30 % pravidelných tachykardií se štíhlým QRS komplexem je na podkladě AVRT. Anatomickým substrátem jsou vrozené přídatné (akcesorní) spojky, tedy snopce svalových vláken, které převádějí elektrickou aktivitu kolem AV chlopní mimo AV uzel (nejčastěji levostranné, kolem mitrálního anulu, méně často pravostranné kolem trikuspidálního anulu a spojky septální). Pokud má spojka prográdní převodní kapacitu (ze síní na komory), je na klidovém EKG tzv. preexcitace (obr. 2.55), kombinace preexcitace se záchvaty AVRT je označována jako WPW (Wolffův–Parkinsonův–Whiteův) syndrom. AVRT vzniká jako makroreentry okruh spojka–vlastní převodní systém. Pokud jsou komory aktivovány
prográdně přes převodní systém a síně retrográdně přes spojku, je AVRT ortodromní a QRS komplex je štíhlý. Pokud je tomu opačně, pak je AVRT antidromní a QRS komplex je široký. Při běžící tachykardii jsou retrográdní P vlny většinou detekovatelné za QRS intervalem, RP interval se liší podle lokalizace spojky, většinou je delší než 90 ms. Podobně jako u AVNRT bývá frekvence asi 120–220/min, s různou délkou záchvatů, také většinou s náhlým začátkem a koncem, na standardním EKG většinou nelze ortodromní AVRT od AVNRT odlišit.
AVRT lze také akutně přerušit vagovými manévry nebo intravenózním bolusem adenosinu (12–18 mg). Již méně je používán verapamil, betablokátory, u známé antidromní AVRT propafenon. Katétrová ablace je u AVRT doporučována jako první volba dlouhodobé a kurativní léčby. Bývá někdy indikována i u asymptomatických jedinců, kteří nemají záchvaty arytmie, ale mají preexcitaci na EKG, rychle vedoucí spojku nebo jiná rizika (např. rizikové povolání). Ablace se provádí po zmapování lokalizace síňové nebo komorové inzerce spojky, v místě nejčasnější aktivace retrográdně z komor na síně nebo opačně. Efektivita výkonu (tedy přerušení spojky, bez dalších rekurencí, tedy vyléčení) je vysoká, nad 90 %.
2.10.5.3 Síňová tachykardie (fokální)
Zbylých asi 10 % tachykardií se štíhlým QRS (tedy kromě flutteru a fibrilace síní, viz níže) jsou fokální síňové tachykardie (ST). Zdrojem tachykardie je ložisková, fokální elektrická aktivita kdekoliv v síních, nejčastěji však v pravé síni v oblasti crista terminalis, ústí koronárního sinu, ale i v levé síni, např. v antrech plicních žil. Převod na komory může být 1 : 1, ale i blokovaný, frekvence tachykardie je pak asi 100–230/min. Na EKG jsou většinou P vlny detekovatelné, je mezi nimi izoelektrická linie, podle jejich polarity lze určit lokalizaci ložiska. RP interval je větší než PR interval. Charakteristický je pozvolný začátek („warm-up“) i konec tachyarytmie („cool-down“).
Obr. 2.54 AV nodální reentry tachykardie s intermitentní aberací (blokem Tawarova raménka), tedy se štíhlým i širokým QRS komplexem: záznam 12svodového EKG i intrakardiálních signálů během elektrofyziologického vyšetření
Obr. 2.55 Preexcitace – 12svodové EKG, delta vlna patrná zejména ve svodech II, III, aVF, V2–V5
ST lze někdy akutně přerušit adenosinem (ev. lze po jeho podání alespoň přechodně zablokovat AV uzel a tím demaskovat vlny P). Méně doporučováno je podání verapamilu, betablokátorů, případně propafenonu nebo amiodaronu. V dlouhodobé léčbě lze využít betablokátory, verapamil, propafenon, ale opět je jako první volba indikována katétrová ablace. Ablace ST se nejčastěji provádějí s využitím 3D mapovacích systémů, které umožní lokalizovat místo nejčasnější aktivace a vzniku arytmie. Efektivita (bez dalších recidiv ST) je celkově udávána asi 85 %.
2.10.5.4 Síňové makroreentry tachykardie
Jako síňové makroreentry tachykardie jsou označovány tachyarytmie, které pro své udržování primárně využívají makroreentry okruh v pravé nebo levé síni. Tento okruh vzniká na podkladě přirozených anatomických bariér (nejčastější – typický flutter síní, kroužící kolem trikuspidálního anulu) nebo bariér, často iatrogenně vytvořených (atypické fluttery síní – levosíňové v jizvách např. po katétrových ablacích fibrilace síní). K makroreentry tachykardiím patří i tzv. IART (incizionální atriální reentry tachykardie), substrátem jsou jizvy po atriotomii, nejčastěji po operacích vrozených srdečních vad. Na EKG jsou většinou pravidelné flutterové vlnky, bez izoelektrické linie, o frekvenci 250–350/min (obr. 2.56). Převod na komory je většinou blokován 2 : 1, tedy s výslednou frekvencí 125–175/min. Může
však dojít i k deblokaci, převodu 1 : 1, flutterové vlnky jsou pak obtížně detekovatelné a může dojít i k hemodynamické destabilizaci. U starších jedinců nebo vlivem farmak může být naopak stupeň blokády vyšší, 3–4 : 1, s potenciálním rizikem bradykardie.
Antiarytmika nejsou pro akutní přerušení flutteru síní příliš účinná. Lze vyzkoušet verapamil (pouze u pacientů hemodynamicky stabilních, bez srdečního selhání!), betablokátory, ev. amiodaron. Iniciálně lze takto většinou alespoň zpomalit tepovou frekvenci, odpověď komor. Mnohem účinnější je provedení elektrické kardioverze, většinou bifázickým výbojem s nižší energií (≤ 100 J). V dlouhodobé léčbě jsou doporučovány betablokátory, verapamil, ev. amiodaron. Metodou první volby je však katétrová ablace, v případě typického flutteru síní se provádí ablace na kavotrikuspidálním isthmu (linie v pravé síni, mezi anulem trikuspidální chlopně a ústím dolní duté žíly), s vysokou účinností (asi 95 %). V případech atypických flutterů se většinou výkony provádějí s využitím 3D mapovacích systémů a ablace je cílena k provedení lineární bariéry v místech šíření arytmie (mitrální isthmus, strop levé síně atd.).
Nedílnou součástí veškeré léčby všech pacientů s flutterem síní by mělo být posouzení individuálního rizika kardioembolie a případná indikace antikoagulační léčby (podobně jako u pacientů s fibrilací síní).
Zjednodušené shrnutí léčby nejčastějších supraventrikulárních arytmií je uvedeno v tabulce 2.42.
Obr. 2.56 Typický flutter síní: dvanáctisvodové EKG, flutterové vlnky („pila“) patrné zejména ve svodech II, III, aVF
2.10.5.5 Fibrilace síní (FS)
Fibrilace síní je vůbec nejčastější poruchou srdečního rytmu. Odhad prevalence v celkové populaci je 2–4 %, výskyt narůstá s věkem, odhadovaný nárůst prevalence v následujících
letech je 2,3násobný. Pacienti s FS mají významně zvýšenou mortalitu, morbiditu, četnost hospitalizací, kvalitu života. Oproti jedincům se zachovalým sinusovým rytmem jsou významně více ohroženi zejména ischemickou kardioembolickou mozkovou příhodou, rozvojem srdečního selhání,
Tab. 2.42 Zjednodušené shrnutí léčby nejčastějších supraventrikulárních tachyarytmií
Akutní léčba
Dlouhodobá léčba
AVNRT vagové manévry, adenosin katétrová ablace verapamil, BB
AVRT • ortodromní • antidromní vagové manévry, adenosin katétrová ablace verapamil, BB propafenon, amiodaron, EKV
Síňové fokální arytmie adenosin, verapamil, BB katétrová ablace propafenon, amiodaron BB, verapamil, propafenon
Síňové makroreentry tachykardie (flutter síní)
EKV katétrová ablace verapamil, BB antikoagulace amiodaron BB, verapamil amiodaron ablace AV uzlu + TKS
AV – atrioventrikulární, AVNRT – AV nodální reentry tachykardie, AVRT – AV reentry tachykardie, BB – betablokátory, EKV – elektrická kardioverze, TKS – trvalý kardiostimulátor
demence, deprese atd. Arytmie se v srdečních síních nekoordinovaně šíří mnohočetnými mikroreentry okruhy, zejména v počátečních stadiích je spouštěna rychlou elektrickou aktivitou spouštěčů z antrálních oblastí plicních žil v levé síni. V pokročilejších stadiích, vlivem komorbidit, se zvyšujícím se věkem dochází již k remodelaci, fibrotizaci síní, arytmie je pak často spouštěna a udržována zdroji z obou síní i mimo plicní žíly.
Pro FS je charakteristická nepravidelná odpověď komor, tedy i nepravidelný tep, s periferním deficitem, na EKG jsou nepravidelné rychlé fibrilační vlnky, v pokročilejších stadiích i izoelektrická linie mezi QRS komplexy (obr. 2.57). Odpověď komor je u neléčených pacientů většinou 100–160/min. Kritériem pro diagnózu fibrilace síní je trvání arytmie alespoň 30 sekund. Podle četnosti a klinického průběhu klasifikujeme FS jako: první epizoda FS x paroxysmální FS (v trvání méně než 7 dnů) x perzistentní FS (v trvání déle než 7 dnů) x dlouhodobě perzistentní FS (v trvání déle než 12 měsíců). Jako permanentní FS klasifikujeme stav, kdy je FS již ponechána jako základní rytmus, pacient je tedy léčen strategií „kontrola frekvence“. Jako klasické symptomy jsou uváděny palpitace, nicméně mnoho pacientů si nepravidelnost tepu nebo bušení srdce neuvědomuje, spíše je trápí dušnost, nevýkonnost, snížení tolerance námahy, únavnost, oprese na hrudi, méně i pocení, návaly, nykturie. Pokud je anamnéza vedena takto správně a cíleně, je zcela „asymptomatických“ pacientů minimum. Tíži symptomů lze klasifikovat podle stupnice EHRA (podobně jako např. klasifikace NYHA u pacientů se srdečním selháním).
Léčba FS je komplexní, podle nejaktuálnějších doporučení ji lze rozdělit do čtyř základních směrů, které se vzájemně prolínají (AF-CARE: C – léčba komorbidit a ovlivnění rizikových faktorů, A – antikoagulace, R – redukce symptomů, E – evaluace, opakované hodnocení aktuálního stavu nemocného).
C (léčba komorbidit a ovlivnění rizikových faktorů, Comorbidity and risk factor management) Základní součástí péče o pacienty s FS je léčba jejich přidružených onemocnění (hypertenze, obezita, srdeční selhání, ischemická choroba srdeční, diabetes mellitus, spánková apnoe atd.) a poradenství ke změně životního stylu (nekouřit, zhubnout, zvýšit fyzickou aktivitu, omezit konzumaci alkoholu). Již změnou životního stylu lze u některých pacientů dosáhnout významného snížení zátěže FS a zlepšit tak kvalitu jejich života.
A (antikoagulace, Avoid stroke and thromboembolism) Kardioembolie při FS je příčinou 20–30 % ischemických mozkových příhod, dále asi 10 % tzv. kryptogenních mozkových příhod. Zdrojem je nejčastěji trombus v oušku levé síně. U každého pacienta s FS (bez ohledu na klinickou formu) by mělo být individuálně posouzeno riziko tromboembolie (CHA2DS2-VA skóre, tab. 2.43). U většiny pacientů s CHA2DS2-VA skóre ≥ 2 je pak indikována antikoagulační léčba, pokud není jasná kontraindikace nebo individuálně nepřevažuje riziko krvácení. Aktuálně jsou nejvíce doporučovaná tzv. přímá antikoagulancia (DOAC): dabigatran,
Obr. 2.57 Fibrilace síní: 12svodové EKG, nepravidelné QRS komplexy, nepravidelné fibrilační vlnky