Innovación y conocimiento para el desarrollo de la química



Innovación y conocimiento para el desarrollo de la química



energía solar que llega a la Tierra en tan solo una hora es suficiente para cubrir las necesidades energéticas de la humanidad durante un año completo Aprovechar eficientemente esta fuente de energía renovable es uno de los desafíos clave para lograr una transición hacia un futuro más sostenible y libre de emisiones de carbono atreves de los conocimientos de termoquímica


José Rafael David Molina Chaparro
Química (T1)




chipude22abora@gmail.com

ingeniería mas que una profesión
Revisado : Julio 2023

José Rafael David Molina
José Jesús Miguel Molina
Ing.



Dra. Jessica Bautista Coordinación Académica CREATEC51.
Ing. Jean Carlo Ramírez

Como creyente principalmente agradezco a dios por permitirme realizar esta revista y darme el conocimiento necesario para poder entender el tema a tratar y permitirme también poder conocer todo sobre este para desarrollarme mucho mas en mi campo laboral y comprender completamente el nivel de importancia que este tema representa no solamente para los interesados en el mismo sino para todos y cada uno de nosotros los cuales directa o indirectamente hemos utilizado y aprovechado durante todos los momentos de nuestra vida por ello el hecho de conocer y poder practicar satisfactoriamente, todos los contenidos aprendidos en esta revista ya que opino que es muy interesante poder tener presente todos y cada uno de los elementos que constituyen la electricidad y esto manos permite poder llegar a aplicarlo en el análisis de nuestro entorno ya que Desde los albores de la humanidad, el estudio de la termoquímica ha sido fundamental para comprender cómo la energía se transforma y se mueve en nuestro universo atreves de las reacciones químicas Esta disciplina, que analiza las leyes que gobiernan los procesos térmicos en cuanto a todo lo relacionado con los cambios de la química dentro de la energía, se ha convertido en la piedra angular de la revolución industrial y ha sentado las bases para la ingeniería y la innovación en la producción y utilización de energía

Finalmente estoy muy agradecido por la ayuda de mi asesor pedagógico y las distintas coordinaciones que han sido parte esencial de mi procesos académicos dentro de la universidad , aconsejándome y ayudándome con todas mis preguntas relacionadas a las diversas unidades vistas dentro de la carrera

Es con gran entusiasmo y orgullo que presentamos el primer número de nuestra revista dedicada a la termodinámica y las energías renovables. En un mundo que enfrenta desafíos energéticos y medioambientales cada vez más apremiantes, creemos firmemente en la importancia de explorar soluciones innovadoras y sostenibles para garantizar un futuro próspero para las generaciones venideras es por ello que vemos a la termoquímica, como una disciplina científica fundamental, que nos proporciona las herramientas necesarias para comprender cómo la energía se mueve y transforma en el mundo que nos rodea En esta revista, nos sumergiremos en los principios y leyes dela termoquímica, desvelando sus misterios y explorando su aplicación práctica en el campo de las energías renovables las cuales se han convertido en una prioridad global en la búsqueda de alternativas limpias y sostenibles a los combustibles fósiles En cada número de nuestra revista, exploraremos en detalle diversas fuentes de energía renovable, como la solar, eólica, hidroeléctrica, geotérmica y de biomasa. Descubriremos cómo estas fuentes pueden aprovecharse para generar electricidad, calefacción y refrigeración, así como para impulsar el transporte y las industrias, reduciendo al mismo tiempo nuestra dependencia de los recursos no renovables y mitigando el impacto ambiental

En resumen, considero que “INOQUIM" tiene como objetivo ser su guía confiable en el fascinante mundo de la termodinámica y las energías renovables. Esperamos que esta revista no solo sea una fuente de información valiosa, sino también una fuente de inspiración para todos aquellos interesados en construir un futuro sostenible y próspero De igual forma también opino que en base a esta revista podremos obtener grandes ideas del mundo y por lo que esta pasando actualmente debido a esas energías contaminantes, por esto es que doy mi veredicto que este proyecto será de gran valor para la coexistencia humana dentro de este mundo en base a mejorar para evitar mas daño que luego no puedan ser reparados, sin mas que agregar los dejo para que lean y analicen el contenido de esta revista y puedan tomar sus propias opiniones acerca de la misma


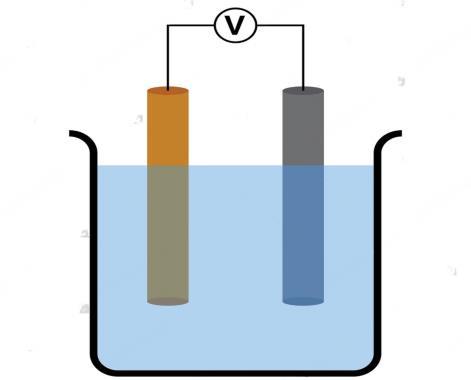
Mediante la presente «revista» estudiaremos la termoquímica es una rama de la química que se enfoca en el estudio de las transferencias de energía en forma de calor en las reacciones químicas En esta sección, exploraremos conceptos clave relacionados con la termoquímica y su aplicación en diversos procesos, comenzando con la electrólisis, como un proceso en el cual una corriente eléctrica se utiliza para descomponer compuestos químicos en sus componentes individuales Analizaremos los principios subyacentes a este proceso, así como sus aplicaciones prácticas

A continuación, nos adentraremos en el proceso de óxido-reducción, el cual implica transferencias de electrones entre especies químicas Examinaremos los conceptos fundamentales de este proceso y exploraremos ejemplos relevantes en diferentes contextos, igualmente Las celdas electrolíticas serán otro tema de interés Estudiaremos las reacciones de media celda, tanto de oxidación como de reducción, así como las reacciones oxido-reducción, exotérmicas y endotérmicas asociadas a estas celdas Además, discutiremos la transferencia de calor en estas reacciones y los calores de reacción implicados, discutiremos luego de ello sobre La entalpía, medida de la energía térmica de un sistema, y la Ley de Hess, que establece que el cambio de entalpía de una reacción es independiente de la ruta seguida, serán temas fundamentales a tratar Analizaremos su importancia en los cálculos termoquímicos y su aplicación en el análisis de reacciones químicas, para ya finalmente hablar sobre la entropía y la energía libre siendo también objeto de estudio, Explorando cómo estos conceptos se relacionan con la espontaneidad de las reacciones químicas y su conexión con la segunda ley de la termodinámica Además, examinaremos las aplicaciones prácticas de la electroquímica, que abarcan desde la generación y almacenamiento de energía hasta la producción de productos químicos

Ya en la segunda parte de la revista nos sumergiremos en el emocionante mundo de la energía renovable. Exploraremos las fuentes más prominentes de energía renovable, comenzando por la energía solar, luego de esta la energía eólica, energía geotérmica y finalmente exploraremos la pila de combustible como una tecnología que transforma la energía química en energía eléctrica y analizaremos sus aplicaciones y ventajas.

La termoquímica es una rama de la química que estudia las relaciones entre el calor y las reacciones químicas Se basa en los principios de la termodinámica y se enfoca en el análisis de las transferencias de energía en forma de calor que ocurren durante las reacciones químicas y los cambios de estado de la materia La misma también busca comprender y cuantificar las cantidades de calor involucradas en las transformaciones químicas, así como predecir y explicar el comportamiento energético de los sistemas químicos Esta disciplina proporciona herramientas y conceptos para medir y calcular el calor de reacción, evaluar la espontaneidad de las reacciones, estudiar la estabilidad de los compuestos y entender las condiciones termodinámicas favorables para diferentes procesos químicos, de igual forma posee numerosas aplicaciones practicas Por ejemplo, es utilizada en la industria para optimizar procesos químicos y determinar las condiciones termodinámicas óptimas para obtener la máxima eficiencia También desempeña un papel crucial en el desarrollo de tecnologías de energía renovable, etc



Electrolisis:
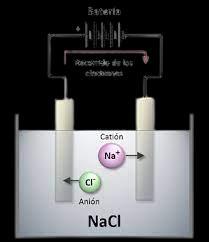
es un proceso químico que utiliza una corriente eléctrica para llevar a cabo una reacción química no espontánea En este proceso, se utiliza una solución acuosa o un compuesto fundido, conocido como electrolito, el cual contiene iones que pueden conducir electricidad La electrólisis se lleva a cabo en un dispositivo llamado celda electrolítica, que consta de un recipiente dividido por una membrana permeable o un puente salino para evitar la mezcla de los reactivos Este mismo es muy importante en diversas aplicaciones industriales y científicas Se utiliza en la obtención de elementos químicos puros a partir de compuestos, como en la producción de metales a través de la electrólisis de sales metálicas También se emplea en la fabricación de productos químicos, la electroplacación de metales, la generación de hidrógeno y la purificación de sustancias
Este también es conocido como reacción redox, es una categoría de reacciones químicas en las cuales ocurre una transferencia de electrones entre especies químicas. Estas reacciones implican cambios en los estados de oxidación de los elementos involucrados, de igual forma dentro de estos existen dos componentes principales: la especie química que se oxida, llamada agente reductor, y la especie química que se reduce, llamada agente oxidante La especie que se oxida pierde electrones, aumentando su estado de oxidación, mientras que la especie que se reduce gana electrones, disminuyendo su estado de oxidación. Ahora bien en este mismo procesos existen varias reglas que se deben seguir.

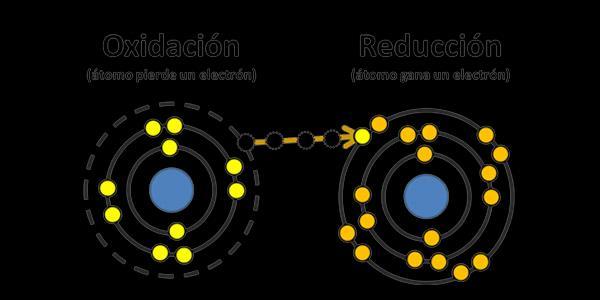
1 Regla de la oxidación: Un átomo o ion se oxida cuando aumenta su estado de oxidación.
2.Regla de la reducción: Un átomo o ion se reduce cuando disminuye su estado de oxidación
3.Conservación de carga: Durante una reacción de óxido-reducción, la suma de las cargas positivas y negativas se mantiene constante, ya que los electrones perdidos por una especie química son ganados por otra

Celdas electrolíticas, reacciones de media celda, reacciones.
Algo que debes conocer: El proceso de óxidoreducción es fundamental en muchas reacciones químicas y tiene una amplia gama de aplicaciones Es esencial en la generación de energía, como en la combustión de combustibles fósiles, y en la obtención de metales a partir de minerales. También es crucial en la bioquímica
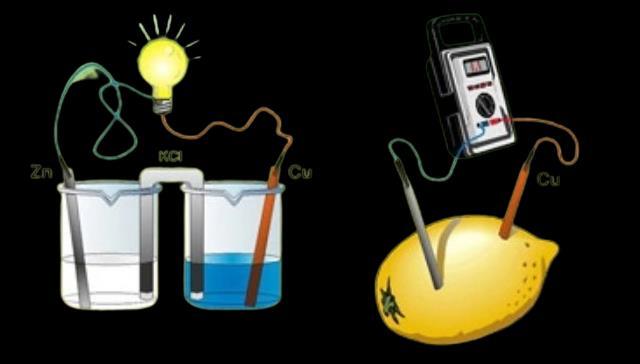
Estos son dispositivos utilizados en la electrólisis, empleándose en procesos que utiliza una corriente eléctrica para llevar a cabo reacciones de óxido-reducción no espontáneas. Estas celdas constan de dos compartimentos llamados celdas o medias celdas, separados por una membrana permeable o un puente salino, en las mismas se colocan dos electrodos: el ánodo y el cátodo El ánodo es el electrodo positivo donde ocurre la oxidación, mientras que el cátodo es el electrodo negativo donde ocurre la reducción. Los electrodos están conectados a una fuente de corriente eléctrica externa y estos podrán llegar a ser tanto exotérmicas y endotérmicas, dependiendo si se es o no liberado energía, de igual forma también tenemos las reacciones de media celda las cuales suceden dentro de los mismos electrodos conocido y que poseen la capacidad, ejemplo de que un ánodo pueda hacer un reacción de oxidación en una especie química y el electrodo pueda tener una reacción de reducción en otra especie química
“Los científicos estudian el mundo como es, los ingenieros crean el mundo que nunca ha existido“
 Theodore Van Karman.
Theodore Van Karman.
Importante agregar: La transferencia de calor es fundamental para comprender y controlar las condiciones termodinámicas en las reacciones químicas, y tiene implicaciones en la eficiencia y el diseño de procesos químicos y tecnologías relacionadas, donde es estudiada y cuantificada mediante mediciones de temperatura y calor

Estos se refieren a la cantidad de energía en forma de calor que se libera o se absorbe durante una reacción química Representan el cambio de energía térmica asociado con una determinada reacción química y se expresan en unidades de energía por mol de sustancia reaccionante, esto se ve mucho durante las reacciones químicas donde los enlaces entre los átomos se rompen en los reactivos y se forman nuevos enlaces en los productos. Estos procesos de ruptura y formación de enlaces están acompañados de cambios en la energía interna del sistema, lo que se manifiesta como una liberación o absorción de energía en forma de calor, el cual mas específicamente se formar por este mismo reactivo y el entorno que posibilite este cambio abrupto dentro de la temperatura

Los calores de reacción pueden ser negativos (exotérmicos) o positivos (endotérmicos), lo que indica si se libera o se absorbe energía térmica durante una reacción química Estas diferencias tienen diversas aplicaciones prácticas y son parte integral de muchos procesos químicos en nuestra vida diaria


Esta es una función termodinámica que se utiliza para describir la energía total de un sistema químico a una presión constante, se es representa como la cantidad de energía térmica que se libera o se absorbe durante una reacción química o un proceso a presión constante, la misma suele ser representada por el símbolo "H" y se expresa en unidades de energía, como julios (J) o kilojulios (kJ), por mol de sustancia. El cambio de entalpía en una reacción química se representa como ∆H, donde el símbolo "∆" indica un cambio Esta también se ve muy relacionada con la ley de Hess debido a que la misma es la que se encarga de establecer los cambio en la entalpia dentro de una reacción química que será independiente de la ruta o secuencia de reacciones que se sigan para llegar a los productos finales, siempre y cuando los estados iniciales y finales sean los mismo, es decir, se puede dividir una reacción química en una serie de etapas o pasos intermedios, el cambio de entalpía total de la reacción será la suma algebraica de los cambios de entalpía de cada una de las etapas individuales.
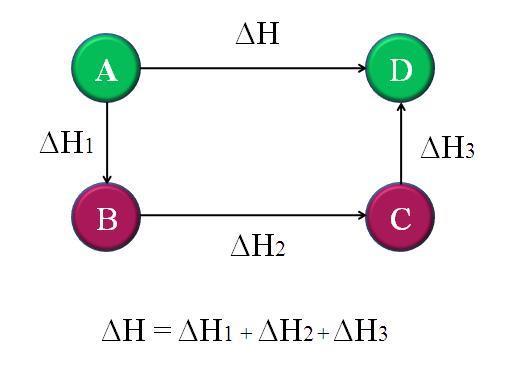

Las principales características de la ley de Hess son:
-Independencia de la ruta: El cambio de entalpía es independiente de la secuencia de reacciones.
-Aplicable a reacciones directas e inversas: El cambio de entalpía se invierte en signo en reacciones inversas.
-Conservación de la energía: Se basa en el principio de conservación de la energía.
-Aplicable a estados iniciales y finales idénticos: Requiere que los estados iniciales y finales sean los mismos.
-Utilidad en cálculos de entalpía: Permite calcular cambios de entalpía de reacciones no medibles directamente.
Capitulo I. Ramas de la ingenieríaEsta es una medida de la distribución de la energía en un sistema y la cantidad de desorden o aleatoriedad presente en dicho sistema. Se denota con la letra "S" y se expresa en unidades de energía divididas por temperatura, como julios por kelvin (J/K),suele estar relacionada con la dispersión de la energía térmica dentro de un sistema y cómo se distribuyen las partículas y las energías entre los estados microscópicos posibles. Ejemplo de ello tenemos la mezcla de dos gases diferentes los cuales están separados y ocupan volúmenes distintos en el recipiente A medida que se permite la mezcla, los gases se distribuyen aleatoriamente en todo el espacio disponible, lo que aumenta la entropía del sistema, debiéndose por que la partículas encuentran otras formas de distribuirse en el espacio mezclado.
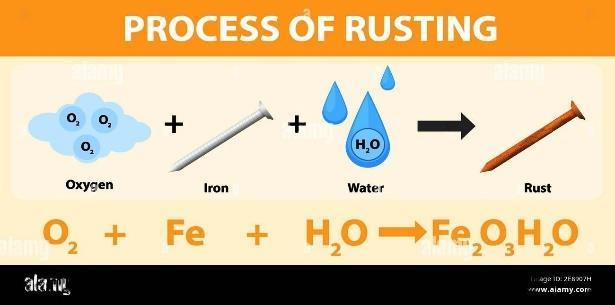
conocida como energía libre de Gibbs, es una función termodinámica que se utiliza para predecir la espontaneidad de una reacción química o de un proceso físico a una temperatura y presión constantes. Se denota con la letra "G" y se expresa en unidades de energía, como julios (J) o kilojulios (kJ). Se forma por la combinación de la entalpía (H) y la entropía (S) de un sistema mediante la siguiente ecuación: G = H – TS. Esta misma nos indica si una reacción química o un proceso físico ocurrirá espontáneamente. Si el valor de G es negativo, la reacción o el proceso es espontáneo y tiende a ocurrir sin necesidad de una aportación externa de energía. Si G es positivo, la reacción o el proceso no ocurrirá espontáneamente y requerirá un aporte externo de energía para llevarse a cabo.
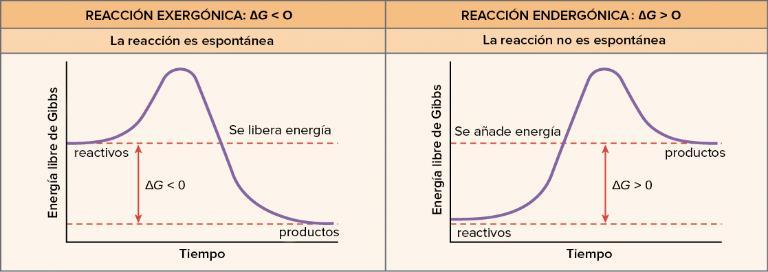

Es una reacción química que ocurre de manera natural y sin requerir un aporte externo de energía, ejemplo de ello tenemos La oxidación del hierro expuesto al oxígeno en el aire es una reacción espontánea El hierro se oxida gradualmente con el oxígeno atmosférico, formando óxido de hierro (más comúnmente conocido como óxido de hierro o herrumbre) Este proceso ocurre sin necesidad de añadir energía adicional, ya que el oxígeno del aire reacciona con el hierro espontáneamente

Estos son dispositivos electroquímicos que almacenan energía química y la convierten en energía eléctrica Son ampliamente utilizadas en dispositivos electrónicos portátiles, como teléfonos móviles, laptops y relojes inteligentes La electroquímica permite el flujo controlado de electrones a través de las reacciones de oxidación y reducción en el interior de la batería, lo que permite el almacenamiento y suministro de energía de manera eficiente
Este posee gran potencial de mejora en termino de sostenibilidad, eficiencia energética y reducciones de emisiones
que estudia las interacciones entre la electricidad y las reacciones químicas Se centra en el estudio de los procesos de transferencia de electrones que ocurren en sistemas químicos y cómo estos procesos están relacionados con la generación de corriente eléctrica Esta se es muy aplicada en distintos objetos utilizados en la vida diaria algunos de estos son
Estos son dispositivos electroquímicos que convierten la energía química directamente en energía eléctrica mediante la reacción de un combustible con un oxidante, como el hidrógeno y el oxígeno. Estas pilas son utilizadas en aplicaciones de generación de energía estacionaria y vehículos eléctricos, ya que ofrecen una alta eficiencia energética y emiten bajos niveles de contaminantes
Para complementar:
Esta es una técnica electroquímica que permite depositar una capa de metal sobre un sustrato mediante la aplicación controlada de corriente eléctrica Esta técnica se utiliza en la industria para la fabricación de recubrimientos protectores, joyería, galvanoplastia y muchas otras aplicaciones que requieren una capa metálica precisa y de calidad
Los sensores electroquímicos se basan en reacciones electroquímicas para detectar y medir la concentración de sustancias específicas en una muestra. Estos sensores se utilizan en una amplia gama de aplicaciones, como monitoreo ambiental, control de calidad en la industria alimentaria y farmacéutica, análisis clínico y detección de contaminantes en el agua
Estas son solo algunas de las numerosas aplicaciones de la electroquímica en nuestra vida cotidiana y en diversos campos científicos y tecnológicos. La electroquímica desempeña un papel crucial en el desarrollo de nuevas tecnologías energéticas, sistemas de almacenamiento y análisis químico, y su continuo avance promete contribuir a soluciones innovadoras en numerosas áreas.

 Pilasde combustible
Pilasde combustible
Estas leyes son dos principios fundamentales que describen la relación entre la cantidad de electricidad pasada a través de un electrolito durante la electrólisis y los productos químicos que se generan en los electrodos Estas leyes fueron formuladas por el científico británico Michael Faraday en el siglo XIX y son de gran importancia en el campo de la electroquímica. Las leyes de Faraday son las siguientes:
1 Primera ley de Faraday (ley de la electrólisis): Esta ley establece que la cantidad de sustancia producida o consumida en un electrodo durante la electrólisis es directamente proporcional a la cantidad de electricidad que pasa a través del electrolito. Matemáticamente, se puede expresar como:
m = zFQ

Donde:
•m es la masa de la sustancia formada o consumida en el electrodo (en gramos).
•z es el número de electrones intercambiados en la reacción de oxidación o reducción
•F es la constante de Faraday, que representa la carga de un mol de electrones (aproximadamente 96,485 C/mol).
•Q es la cantidad de electricidad que pasa a través del electrolito (en culombios).
Esta ley muestra que la cantidad de sustancia producida en un electrodo durante la electrólisis es proporcional a la cantidad de electricidad que fluye a través del sistema.
2 Segunda ley de Faraday (ley de las proporciones de Faraday): Esta ley establece que las masas de diferentes sustancias liberadas o consumidas durante la electrólisis son proporcionales a sus equivalentes electroquímicos. Matemáticamente, se puede expresar como:
m1/m2 = E1/E2
Donde:
•m1 y m2 son las masas de las sustancias liberadas o consumidas en los electrodos.
•E1 y E2 son los equivalentes electroquímicos de las sustancias
El equivalente electroquímico es una cantidad que representa la masa de una sustancia producida o consumida en un electrodo por cada culombio de electricidad que pasa a través del sistema.
Estas son fuentes de energía que se obtienen a partir de fuentes naturales que son inagotables o se renuevan a una velocidad suficientemente rápida para ser consideradas inagotables en términos humanos Estas fuentes de energía incluyen la radiación solar, el viento, el agua en movimiento (hidroenergía), la biomasa, la energía geotérmica y los recursos oceánicos, como las corrientes y las mareas La importancia de las energías renovables radica en varios aspectos clave:
a) Sostenibilidad ambiental: Las energías renovables son una alternativa más sostenible a las fuentes de energía no renovables, como los combustibles fósiles Al utilizar fuentes de energía que se regeneran naturalmente, se reducen las emisiones de gases de efecto invernadero y se disminuye la dependencia de recursos limitados y contaminantes
b) Mitigación del cambio climático: Las energías renovables contribuyen a la reducción de las emisiones de gases de efecto invernadero, que son responsables del calentamiento global y el cambio climático Al reemplazar los combustibles fósiles, que emiten grandes cantidades de dióxido de carbono, con fuentes de energía renovables libres de emisiones, se puede mitigar el impacto ambiental negativo y ayudar a frenar el cambio climático
c) Seguridad energética: La diversificación de la matriz energética a través de las energías renovables reduce la dependencia de fuentes de energía importadas y volátiles, mejorando así la seguridad energética Al aprovechar los recursos naturales disponibles localmente, los países pueden garantizar un suministro de energía más estable y confiable


d) Generación de empleo y desarrollo económico: El sector de las energías renovables crea oportunidades de empleo en áreas como la instalación y el mantenimiento de sistemas solares, eólicos, hidroeléctricos y otros Además, el desarrollo de la industria de las energías renovables estimula la inversión económica, fomenta la innovación tecnológica y promueve la creación de empresas y mercados relacionados
e) Acceso a energía en áreas remotas: Las energías renovables ofrecen una solución para proporcionar acceso a energía en áreas remotas y rurales donde la infraestructura de energía convencional puede ser limitada o costosa de implementar Las tecnologías solares y eólicas, por ejemplo, permiten generar electricidad en lugares remotos sin necesidad de una conexión a la red eléctrica tradicional
Esta es una forma de energía renovable que se obtiene a partir de la radiación solar Se basa en la captación de la luz solar y su posterior conversión en energía utilizable, como electricidad o calor.

Puede ser aprovechada de dos formas.
Energía solar fotovoltaica: Se utiliza la tecnología de paneles solares fotovoltaicos para convertir la luz solar directamente en electricidad Los paneles solares están compuestos por células fotovoltaicas que contienen materiales semiconductores, como el silicio, que generan una corriente eléctrica cuando se exponen a la luz solar Esta electricidad puede utilizarse para alimentar dispositivos eléctricos, cargar baterías o inyectarse en la red eléctrica


Energía solar térmica: En este caso, se utiliza la radiación solar para calentar agua o un fluido térmico. Los paneles solares térmicos capturan la radiación solar y transfieren el calor a un sistema de almacenamiento o directamente a un circuito de agua caliente Este calor puede utilizarse para calentar agua sanitaria en hogares, piscinas, sistemas de calefacción o para alimentar procesos industriales.
Estos usos traen varias ventajas y se pueden definir como. fuente de energía renovable y sostenible que se obtiene a partir de la radiación solar. Es una fuente inagotable, ya que el sol continuamente emite luz y calor. Al aprovechar esta radiación, la energía solar no produce emisiones de gases de efecto invernadero ni contaminantes atmosféricos, lo que la convierte en una opción limpia y respetuosa con el medio ambiente. Además, la energía solar está ampliamente disponible en todo el mundo, aunque su intensidad varía según la ubicación geográfica, de igual forma ofrece resultados rentables en el costo de la electricidad además también siendo muy versátil casi para cualquier aplicación
Capitulo II. Energías renovables.
Esta es una forma deenergía renovable que se obtiene a partir del viento. Se basa en la captación de la energía cinética del viento y su transformación en energía mecánica o eléctrica, poseyendo un funcionamiento el cual se basa en aerogeneradores, que son grandes estructuras equipadas con hélices o turbinas. Cuando el viento sopla, las hélices o turbinas capturan la energía cinética del viento y la convierten en energía mecánica al hacerlas girar. Esta energía mecánica puede utilizarse directamente para actividades como el bombeo de agua o, más comúnmente, para generar electricidad a través de un generador acoplado al aerogenerador ofrece numerosas ventajas como una fuente de energía renovable. En primer lugar, es una fuente inagotable, ya que el viento es una consecuencia natural de los cambios climáticos y siempre estará presente en la atmósfera Además, es una forma de energía limpia, ya que la generación de energía eólica no produce emisiones de gases de efecto invernadero ni contaminantes atmosféricos, lo que contribuye a reducir la huella de carbono y mitigar el cambio climático La energía eólica también es ampliamente disponible en muchas regiones del mundo, tanto en tierra como en áreas marítimas, lo que la convierte en una opción viable para la generación de electricidad. A nivel ambiental, los parques eólicos tienen un impacto bajo en el ecosistema circundante y su construcción y operación generan bajas emisiones de carbono en comparación con otras fuentes de energía Además, la energía eólica puede beneficiar a las comunidades locales al generar empleo en la instalación, operación y mantenimiento de parques eólicos, así como al contribuir al desarrollo económico de la zona
No te olvides: La primera turbinaeólica utilizada para generar electricidad a gran escala fue construida en 1887 por el científico británico James Blyth. La turbina tenía una altura de 18 metros y generaba electricidad para alimentar las luces de su casa en Escocia.

Esta es una forma de energía renovable que aprovecha el calor interno de la Tierra Se basa en la extracción del calor almacenado en el subsuelo para generar electricidad o para su uso directo en aplicaciones de calefacción y refrigeración
El calor geotérmico proviene principalmente del calor residual de la formación de la Tierra y de la desintegración de elementos radiactivos en el núcleo terrestre Este calor se encuentra en diversas formas debajo de la superficie de la Tierra, desde fuentes termales en la superficie hasta reservorios de agua caliente o vapor a mayores profundidades Ahora bien existen dos principelas sistemas geotérmicos
Sistemas de energía geotérmica de alta temperatura: Estos sistemas utilizan aguas termales o vapor geotérmico de alta temperatura, generalmente a profundidades considerables, para generar electricidad en plantas de energía geotérmica. El vapor se dirige hacia una turbina que impulsa un generador para producir electricidad.


Sistemas de bomba de calor geotérmica de baja temperatura: Estos sistemas aprovechan la temperatura constante del suelo, a pocos metros bajo la superficie, para calefacción y refrigeración de edificios. Utilizan bombas de calor geotérmicas que extraen el calor del suelo en invierno para calentar un edificio y, en verano, expulsan el calor al suelo para proporcionar refrigeración.
 Capitulo II. Energías renovables.
Capitulo II. Energías renovables.
Las pilas de combustible son dispositivos electroquímicos que convierten directamente la energía química de un combustible, como hidrógeno, metano o metanol, en energía eléctrica. Estas pilas operan a través de una reacción electroquímica en la cual el combustible se oxida en el ánodo y el oxígeno del aire se reduce en el cátodo, generando así electricidad, agua y calor como subproductos, de igual forma estos mismos procesos de operación en una pila de combustible implican el paso de los iones de hidrógeno (protones) a través de un electrolito y la circulación de los electrones a través de un circuito externo, lo que permite el flujo de corriente eléctrica. Las pilas de combustible pueden operar de manera continua mientras se suministre el combustible y el oxidante, y su eficiencia energética puede ser muy alta, superando a la de otros sistemas de generación de electricidad.
Una de las ventajas principales de las pilas de combustible es que no emiten gases contaminantes durante su funcionamiento, ya que el único subproducto es agua. Además, son más eficientes en términos energéticos que los motores de combustión interna convencionales, lo que las convierte en una opción prometedora para aplicaciones que requieren alta eficiencia energética y bajas emisiones, como vehículos eléctricos y sistemas de generación de energía estacionaria.

Sin embargo, las pilas de combustible también presentan desafíos, como la necesidad de disponibilidad de combustibles compatibles, la gestión y almacenamiento seguro de los mismos, y el costo de fabricación y mantenimiento de las pilas Aunque se han logrado avances significativos en esta tecnología, su adopción a gran escala aún se encuentra en desarrollo y se espera que se sigan realizando investigaciones y mejoras para mejorar su rendimiento y reducir sus costos
En resumen, las pilas de combustible son dispositivos electroquímicos que convierten directamente la energía química en energía eléctrica Son una opción prometedora debido a su alta eficiencia energética y bajas emisiones contaminantes, y se consideran una tecnología clave en la transición hacia una generación de energía más sostenible y limpia
los temas abordados en esta revista sobre termodinámica y energías renovables ofrecen una visión completa y diversa de importantes conceptos y aplicaciones en el campo de la energía, donde pudimos observar en primer lugar, la termoquímica como esta proporciona una comprensión profunda de las reacciones químicas y los cambios de energía asociados, como la electrólisis, los procesos de óxido-reducción, los calores de reacción y la transferencia de calor Estos conceptos son fundamentales para comprender la transformación y el intercambio de energía en diversos sistemas químicos y termodinámicos

Por otro lado, las energías renovables, como la energía solar, eólica y geotérmica, ofrecen alternativas sostenibles y respetuosas con el medio ambiente a las fuentes de energía convencionales Estas energías aprovechan los recursos naturales disponibles, como la radiación solar, el viento y el calor interno de la Tierra, para generar electricidad y calor de manera limpia y eficiente Además, la electroquímica y las pilas de combustible destacan como tecnologías clave en la conversión de energía química en energía eléctrica, con aplicaciones en baterías recargables, sistemas de almacenamiento de energía, vehículos eléctricos y generación estacionaria
En conjunto, estos temas resaltan la importancia de buscar soluciones energéticas más sostenibles y eficientes para abordar los desafíos ambientales y promover un futuro energético más limpio Las energías renovables y la aplicación de principios termodinámicos y electroquímicos desempeñan un papel fundamental en esta búsqueda Al comprender y aprovechar estas tecnologías, podemos avanzar hacia una matriz energética más diversificada, limpia y resiliente, reduciendo nuestra dependencia de los combustibles fósiles y mitigando los impactos negativos en el medio ambiente, por lo tanto tenemos en definitiva, que la revista ofrece una visión integral de los conceptos, aplicaciones y beneficios de la termoquímica y las energías renovables, brindando información valiosa para fomentar el conocimiento y la conciencia sobre el papel crucial de la ciencia y la tecnología en la construcción de un futuro energético sostenible.


EcuRed (2023) Termoquímica Consultado el 15 de Julio en: https://www ecured cu/Termoqu%C3%ADmica


Héctor E. Gsponer (2012) Termoquímica: validez de la definición del cambio de entalpía aplicado a una reacción química. Consultado el 15 de Julio en: https://www scielo org mx/scielo php?script=sci_arttext&pid=S0187-893X2012000100008
David Plaza (2023) Qué es la electrólisis y para qué se utiliza. Consultado el 15 de Julio en: https://www.motor.es/que-es/electrolisis
Ana Zita Fernandes (2023) Reacciones de oxidación-reducción: qué son y ejemplos Consultado el 15 de Julio en: https://www todamateria com/reacciones-de-oxidacion-reduccion/
MANUEL REINA (2023) TEMA 3º: TERMOQUÍMICA. Consultado el 15 de Julio en: https://www.juntadeandalucia.es/averroes/centrostic/14006217/helvia/aula/archivos/repositorio/0/34/html/quimica2temas/TEMA%203Termoquimica pd f
BBVA (2023) ¿Qué tipos de energías renovables existen y qué papel juegan?. Consultado el 16 de Julio en: https://www bbva com/es/sostenibilidad/que-tipos-de-energias-renovables-existen-yque-papel-juegan/
ACCIONA (2020) LA IMPORTANCIA DE LAS ENERGÍAS RENOVABLES. Consultado el 16 de Julio en: https://www.acciona.com/es/energias-renovables/?_adin=02021864894
Innovación y conocimiento para el desarrollo de la química .


UNIVERISDAD BICENTENARIA DE ARAGUA



http://uba.edu.ve/
ingeniería mas que una profesión
