
37 minute read
El tratamiEnto con nanoburbujaS dE
El tratamiento con nanoburbujas de ozono en agua dulce redujo eficazmente las bacterias patógenas de los peces, y es seguro para la tilapia del Nilo (Oreochromis niloticus)
Destacar
Advertisement
• En este estudio se exploró la desinfección de NB-O3 en la acuicultura de agua dulce. • El tratamiento con NB-O3 redujo eficazmente las bacterias patógenas de los peces que se encuentran en el agua. • Una exposición de 10 minutos a NB-O3 (2–3 × 10 7 nanoburbujas / ml) fue segura para la tilapia del Nilo.
• Para mejorar la eficacia de la desinfección, se sugiere un tratamiento repetido para el agua con abundante materia orgánica. • La tecnología NB-O3 es prometedora para reducir las bacterias patógenas en la acuicultura de agua dulce.
Las altas concentraciones de ciertas bacterias patógenas en el agua generalmente dan como resultado brotes de enfermedades bacterianas en los peces de cultivo. Aquí, exploramos la aplicación potencial de una tecnología emergente de nanoburbujas en la acuicultura de agua dulce, específicamente dirigida a reducir las concentraciones de bacterias patógenas de peces en agua dulce, y evaluamos si las nanoburbujas son seguras para la tilapia del Nilo (Oreochromis niloticus). Se estableció un protocolo de tratamiento de nanoburbujas de ozono (NB-O3), basado en el examen del tamaño de las nanoburbujas, la concentración, las propiedades de desinfección y el impacto en la salud de los peces. Un tratamiento de 10 minutos con NB-O3 en 50 L de agua generó aproximadamente 2-3 × 10 7 burbujas / mL, la mayoría de las burbujas tienen menos de 130 nm de diámetro y un nivel de ozono de 834 ± 22 mV potencial de oxidación-reducción (ORP). Un solo tratamiento con agua enriquecida con Streptococcus agalactiae o Aeromonas veronii redujo eficazmente la carga bacteriana en 26 a 48 veces o 96,11 a 97,92%. Este mismo protocolo se repitió tres veces. El resultado fue una reducción de 22.058 a 109.978 veces en las bacterias o una disminución del 99,93 al 99,99%. En comparación, las concentraciones bacterianas en los tanques de control permanecieron sin cambios durante los experimentos. En agua cultivada con tilapia del Nilo con presencia de materia orgánica (p. Ej. Moco, heces, flora bacteriana, alimento, etc.), la propiedad desinfectante del NB-O 3fue reducido; sin embargo, aún observamos una reducción del 59,63%, 87,25% y 99,29% después del primer, segundo y tercer tratamiento consecutivos, respectivamente. Para evaluar la seguridad de NB-O3 en peces, se expusieron juveniles de tilapia del Nilo al tratamiento con NB-O3 durante 10 min. No se observó mortalidad durante el tratamiento o 48 h después del tratamiento. El examen de la histología de las branquias reveló que un solo tratamiento con NB-O3 no provocó alteraciones en la morfología celular. Sin embargo, se notó daño en los filamentos branquiales, como congestión sanguínea, agregados de células basales en las laminillas secundarias o pérdida de la laminilla secundaria en los peces que recibieron dos o tres exposiciones consecutivas en el mismo día. Los resultados de los experimentos realizados en este estudio sugieren que NB-O3 la tecnología es prometedora para reducir las bacterias patógenas en los sistemas de acuicultura y puede ser útil para reducir el riesgo de brotes de enfermedades bacterianas en los peces de cultivo. Palabras clave: Carga bacteriana, Desinfección, NB-O3, Nanoburbujas de ozono y Tilapia El sector de la acuicultura, especialmente en Asia, juega un papel vital en la seguridad alimentaria mundial. Suministra proteínas a aproximadamente 4.500 millones de personas y emplea a 19,3 millones de personas en todo el mundo (Béné et al., 2015; FAO, 2018). Al igual que otros sectores alimentarios, la acuicultura se ha enfrentado a desafíos cada vez mayores con las enfermedades infecciosas. El control de estas enfermedades ha llevado a un aumento en el uso de antimicrobianos (Banco Mundial, 2014; Watts et al., 2017). De particular importancia para la salud pública ha sido el aumento de la resistencia a los antimicrobianos (RAM). Las alternativas a los productos para controlar las infecciones bacterianas en todos los sectores de producción de alimentos han aumentado en los últimos años (Watts et al., 2017; Reverter et al., 2020). Los enfoques anteriores y actuales se centran principalmente en compuestos antibacterianos derivados de productos naturales, probióticos, inmunoestimulantes y vacunas para estrategias de prevención (Watts et al., 2017; Reverter et al., 2020). Otras estrategias de prevención, generalmente utilizadas en sistemas cerrados de recirculación para reducir la concentración bacteriana en el medio acuático, incluyen el tratamiento del agua con ultravioleta (UV) u ozono. Ambos tratamientos tienen problemas logísticos y económicos para las industrias de la acuicultura. Los rayos UV requieren que el agua esté muy limpia cuando se expone a la fuente de luz, lo que la hace menos que ideal en los sistemas de cultivo en estanques que se encuentran comúnmente en Asia. El ozono tiene una baja propiedad de disolución, una rápida descomposición en el agua y puede ser letal para los peces (Huyben et al., 2018; Xia y Hu, 2019). Se necesita una tecnología de tratamiento de agua no químico más eficaz para mejorar la calidad del agua para los sistemas de acuicultura, como los sistemas de cultivo intensivo en estanques. La tecnología de nanoburbujas es una tecnología emergente para el tratamiento de aguas residuales (Yamasaki et al., 2005; Agarwal et al., 2011) y recientemente se ha aplicado en la acuicultura para aumentar las concentraciones de oxígeno disuelto en sistemas de acuicultura intensiva (Agarwal et al., 2011; Mahasri et al., 2018; Anzai et al., 2019; Rahmawati et al., 2020). Esta tecnología implica la inyección de burbujas nano o ultrafinas (<200 nm) con un gas elegido en el agua (Agarwal et al., 2011; Anzai et al., 2019). A diferencia de las macro y microburbujas, estas nanoburbujas tienen una flotabilidad neutra y, por lo tanto, permanecen en el agua durante días (Takahashi et al., 2007; Agarwal et al., 2011). La tecnología es altamente eficiente para disolver gases en la columna de agua debido a la gran relación de superficie a volumen de las burbujas (Gurunga et al., 2016). Esta última propiedad puede mejorar la eficiencia del suministro de oxígeno u ozono a los sistemas de acuicultura.
propiedad de desinfección de las nanoburbujas creadas a partir del ozono (NB-O3) sobre patógenos de animales acuáticos en el agua marina. Kurita y col. (2017) informaron que un tratamiento de 25 minutos con NB-O3 redujo con éxito el 63% de los crustáceos planctónicos parásitos en comparación con el grupo no tratado. Más importante aún, esta condición de tratamiento fue segura tanto para los pepinos de mar (Apostichopus japonicas) como para los erizos de mar (Strongylocentrotus intermedius), que comúnmente están infectados con estos crustáceos patógenos en los sistemas de acuicultura japoneses. En otro estudio, Imaizumi et al. (2018) informó que NB-O3 podría usarse para desinfectar Vibrio parahaemolyticus, una cepa única que causa el síndrome de mortalidad temprana / enfermedad de necrosis hepatopancreática aguda (EMS / AHPND) en el camarón patiblanco (Penaeus vannamei). Sin embargo, en su estudio, el NB-O3 mostró un efecto negativo en los camarones cuando se administró a un nivel alto (ORP de 970 mV). Cuando el agua tratada con NB-O3 se diluyó al 50%, redujo el efecto tóxico del ozono en los camarones y pareció mejorar la supervivencia de los camarones expuestos a V. parahaemolyticus, en comparación con el grupo de control positivo sin NB-O3, que causó una mortalidad del 100% (Imaizumi et al., 2018). Estos hallazgos sugieren que la aplicación de NB-O3 en las concentraciones apropiadas puede ser útil para controlar enfermedades infecciosas en la acuicultura marina.
Existe evidencia científica limitada de los beneficios del NB-O3 en la acuicultura de agua dulce en términos de su efectividad de desinfección, su impacto en la calidad del agua y posible toxicidad para los peces. Estas lagunas de conocimiento resaltan la falta y la necesidad de una mayor comprensión de las posibles aplicaciones del NBO3 en la acuicultura de agua dulce. Por lo tanto, este estudio evaluó el efecto de la tecnología NB-O3 sobre las concentraciones de bacterias patógenas en el agua dulce, los parámetros del agua y el impacto agudo del NB-O3 en los peces en condiciones de laboratorio.
2. materiales y métodos 2.1. Laboratorio configurado de NB-O3
sistema de todos los experimentos de este estudio se llevaron a cabo utilizando 50 L de agua corriente sin cloro en tanques de fibra de vidrio de 100 L, 68 cm (L) × 49 cm (W) × 30 cm (D). La configuración de laboratorio del sistema NB-O 3 en este estudio se muestra en la Fig.1. El sistema se compone de un generador de nanoburbujas (modelo: aQua + 075MO; fabricante: AquaPro Solutions Pte Ltd., Singapur), un concentrador de oxígeno (modelo: JAY-10; Longfian Scitech Co. Ltd., Hebei, China) y un generador de ozono (modelo: CCba15D; Coco Technology Co. Ltd., Chonburi, Tailandia). El sistema se conectó a un tanque que contenía 50 litros de agua. El oxígeno concentrado del aire se alimentó al generador de ozono a un flujo de 1 l / min. El ozono generado se difundió luego con agua dentro del generador de nanoburbujas para formar NB-O3y regresó al tanque. El sistema es flexible, ya que puede generar diferentes tipos de nanoburbujas basadas en la entrada de gas, como nanoburbujas de oxígeno (NB-O 2) o nanoburbujas de aire (NB-Air). Para generar NB-O2, el generador de ozono se apagó para permitir la alimentación de oxígeno directamente al generador de nanoburbujas. Cuando el concentrador de oxígeno y el generador de ozono se desconectaron del generador de nanoburbujas, solo se produjo NB-Air. Los parámetros del agua se midieron utilizando un medidor de calidad de agua multiparámetro (YSI Professional Plus, YSI Incorporated, EE. UU.). como estándares de referencia. La concentración y el tamaño de las nanoburbujas se determinaron por triplicado (300 μL / muestra) utilizando un NanoSight NS300 (Malvern Panalytical Ltd). La medición de nanoburbujas de ozono no se realizó debido a su efecto de oxidación en la máquina NanoSight.
2.3. Efecto del tratamiento con NBO 3 sobre los parámetros del agua
El experimento se realizó en dos tanques separados para evaluar el efecto del NB-O 3 sobre los parámetros del agua. Cada tanque contenía 50 L de agua corriente sin cloro y el generador de nanoburbujas se hizo funcionar durante 10 minutos en cada tanque. La temperatura en grados Celsius (T °), el oxígeno disuelto (OD), el pH y el potencial de reducción de la oxidación (ORP) se midieron utilizando un medidor de calidad de agua multiparámetro (YSI Professional Plus, YSI Incorporated, EE. UU.) Antes del tratamiento, cada 1 –2 min durante los 10 min de ejecución y 15 min después de de-
Figura 1.- Configuración de laboratorio del sistema NB-O 3 en este estudio. El oxígeno del concentrador de oxígeno se alimentó a un generador de ozono con un caudal de 1 l / min. El ozono generado se difundió luego con agua dentro del generador de nanoburbujas y se devolvió al tanque. Los parámetros del agua se midieron utilizando un medidor de calidad del agua con sonda múltiple. 2.2.Determinación de la concentra- tener el generador de nanoburbujas.
ción y el tamaño de nanoburbujas 2.4. Aislamientos bacterianos
Se llevaron a cabo dos ensayos por y condiciones de crecimiento.separado utilizando el sistema de nanoburbujas descrito anteriormen- La bacteria Gram-positiva Streptote para determinar los tamaños de coccus agalactiae cepa 2809, aislas nanoburbujas de aire y oxíge- lada de una granja de tilapia que no. El generador se hizo funcionar estaba experimentando un brote de en tanques de fibra de vidrio de 100 estreptococosis en 2018 (cepa de L que contenían 50 L de agua desti- laboratorio, Centex Shrimp, Mahilada durante 30 min, con aire natural dol University), y la bacteria Gram-u oxígeno gaseoso a un caudal de 1 negativa Aeromonas veronii cepa L / min. Se tomaron muestras de 50 NT-03 asociada con septicemia ml de agua de cada tanque a los 10, hemorrágica en tilapia (Dong et al., 15, 20 y 30 minutos. Las muestras de 2017) se utilizaron en este estudio. agua recolectadas antes de la adi- Antes de los experimentos, los aisción de nanoburbujas se utilizaron lamientos bacterianos se propaga-
ron a partir de reservas bacterianas almacenadas a -80 ° C, utilizando medio agar tríptico de soja (TSA) (Difco, Becton Dickinson, Sparks, EE. UU.), Incubados a 30 ° C. Para preparar el inóculo bacteriano, se inocularon colonias bacterianas individuales en 10 ml de caldo de soja tríptico (TSB) (Difco, Becton Dickinson, Sparks, EE. UU.) Durante la noche a 30 ° C en una plataforma agitadora (150 rpm). Luego, se subcultivaron cinco ml de cultivo bacteriano en 500 ml de TSB, se incubaron con agitación suave (150 rpm) a 30 ° C hasta que la DO 600 alcanzó 0,8 (equivalente a ~ 108 UFC / ml). Para ensayos posteriores, se agregaron 100 mL del cultivo bacteriano a un tanque que contenía 50 L de agua corriente sin cloro.
2.5. Estudio piloto sobre el efecto del tiempo de tratamiento en la propiedad de desinfección de NB-O3
Se llevó a cabo una prueba inicial para investigar el efecto del tiempo de tratamiento sobre la propiedad de desinfección del NB-O3. Streptococcus agalactiae se utilizó como bacteria representativa en este ensayo de curso temporal. El experimento se realizó en dos tanques de fibra de vidrio de 100 L que contenían 50 L de agua corriente sin cloro, cada uno mezclado con 100 mL de cultivo bacteriano (DO 600 = 0,8). Un tanque se trató con NB-O 3 mientras que otro tanque sirvió como control sin NB-O 3. Se tomaron muestras de agua de las cuatro esquinas y del centro del tanque (1 mL por punto). Las muestras se combinaron para el recuento de placas convencional en diferentes puntos de tiempo. Las muestras se recolectaron antes de la inoculación (0 min), durante el tratamiento (5, 10 y 15 min) y después del tratamiento (5, 10 y 15 min). Las muestras se diluyeron en serie 10 veces con solución salina estéril (NaCl al 0,85%), y se sembraron en placa 100 μL de cada dilución en TSA por duplicado y se incubaron a 30 ° C durante 36 h. Se utilizaron diluciones con un número de colonias que variaba de 30 a 300 para la enumeración (solo colonias puntiformes blanquecinas de S. agalactiae) y se calcularon las colonias bacterianas medias de dos placas replicadas y se expresaron como UFC / ml. El porPara evaluar el efecto de NB-O3 sobre patógenos bacterianos de tilapia, se utilizaron S. agalactiae y A. veronii como bacterias Grampositivas y Gram-negativas representativas, respectivamente. Cada conjunto de experimentos estaba compuesto por un tanque de control (con aireación normal) y tres tanques de tratamiento (tratamiento de 10 min con NB-O3 de una a tres veces a intervalos de 15 min). Tenga en cuenta que el tiempo de tratamiento (10 min) se eligió en función del resultado del estudio piloto. Cada tanque que contenía 50 L de agua corriente desclorada se mezcló con 100 ml de suspensión bacteriana (DO 600 = 0,8), como se describió anteriormente. Se tomaron muestras de agua de los tanques de control y tratamiento antes (0 min) y 15 min después del final de cada tratamiento para determinar la concentración bacteriana y el porcentaje de reducción bacteriana mediante el método de recuento en placa. El recuento de colonias se basó en las características morfológicas de las bacterias. Por ejemplo, S. agalactiae crece más lentamente y forma colonias puntiagudas blanquecinas en placas de agar después de 36 a 48 h de incubación. En contraste, A. veronii crece más rápido y forma colonias más grandes de color crema en TSA después de 18 a 24 h de incubación. La temperatura del agua, el pH, el OD y el ORP también se registraron durante el experimento. Para investigar la ultraestructura de las bacterias antes y después del tratamiento con NB-O3, se instalaron dos tanques experimentales de la misma manera que los tanques de tratamiento: un tanque contenía S. agalactiae y el otro contenía A. veronii. Cada tanque se trató con NBO3 durante 10 min. Se recogió agua (200 ml) antes y 15 min después de la NB-O 3 tratamiento, entonces se sedimentaron por centrifugación a 6000 g durante 10 min. A continuación, se resuspendió el sedimento en 0,5 ml de solución salina tamponada con fosfato (PBS). La suspensión bacteriana se untó en cubreobjetos recubiertos con Poly- l-lisina (SigmaAldrich, Missouri, EE. UU.) y se secó al aire durante 3 h. Posteriormente, las muestras se fijaron con glutaraldehído al 2,5% y tetróxido de osmio al 1% antes de la deshidratación con etanol, como describen Thanomsub et al. (2002). La ultraestructura de

Se comparó la reducción de las concentraciones bacterianas en el tanque expuesto a NB-O3 y el tanque de control.
centaje de reducción bacteriana se las bacterias se examinó y fotografió calculó según la fórmula siguiente. bajo un microscopio electrónico de 2.6. Efecto de NB-O3 sobre bac- barrido (SEM) (HITACHI SU8000, terias patógenas Gram positivas y Tokio, Japón) operado a 10 kV.
Gram negativas 2.7. Efecto del tratamiento con NBO3 sobre el total de bacterias en agua de cultivo
La investigación de la propiedad de desinfección del NB-O3 también se evaluó utilizando agua de “cultivo” (agua de los tanques de cultivo de peces que contenían materia orgánica, por ejemplo, heces de pescado, moco, restos de alimento y flora bacteriana acuática desconocida). El agua de cultivo se tomó de tanques que contenían juveniles de tilapia del Nilo (O. niloticus) que se cultivaron durante cinco días sin intercambio de agua. Se llevó a cabo una prueba en tres tanques de fibra de vidrio con 50 L de agua de cultivo de peces con tres exposiciones de 10 min de NB-O3 administradas con 15 min de diferencia. El muestreo de agua para los recuentos bacterianos totales se realizó antes y 15 minutos después del final de cada tratamiento. También se controlaron la temperatura del agua, pH, OD y ORP.
2.8. Efecto del NB-O 3 sobre la salud de los peces y la morfología de las branquias
El uso de animales en este estudio fue concedido por el Comité Institucional de Uso y Cuidado de Animales de Tailandia (Aprobación no. MUSC62–039-503). Para investigar si el tratamiento con NB-O 3 tenía efectos negativos sobre la morfología de las branquias y la vida de los peces, se llevó a cabo una prueba que incluyó dos tanques de control y dos de tratamiento, cada tanque contenía 20 juveniles de tilapia del Nilo aparentemente sanos de 6 a 8 g de peso corporal. Los tanques de fibra de vidrio de 100 L contenían cada uno 50 L de agua del grifo sin cloro. Para los tanques de tratamiento, 10 min NB-O3 las exposiciones se llevaron a cabo tres veces a intervalos de 15 minutos. Los tanques de control se trataron con aireación normal y se tomaron muestras al azar de dos peces de cada tanque cada 10 minutos de tratamiento. Los peces fueron sacrificados con aceite de clavo (200 ppm) y las branquias se recolectaron para su examen en húmedo y estudio histológico. Los peces restantes se controlaron durante 48 h. Para el análisis histológico, los arcos branquiales de un lado de cada pez se conservaron en formalina tampón neutra al 10% con una proporción de 1 muestra / 10 fijador (v / v) durante 24 h antes de colocarlos en etanol al 70% para su almacenamiento. Luego, las muestras se procesaron para histología de rutina y se tiñeron con hematoxilina y eosina (H&E). Se compararon visualmente el comportamiento de los peces y las branquias de los peces tratados y no tratados. En este estudio, múltiples NB-O 3Los tratamientos se diseñaron para la evaluación cualitativa de los cambios histológicos. Nuestro objetivo fue determinar cuándo comienzan a aparecer las lesiones. Entonces, la introducción de NBO3 debe cesar antes de ese punto.
3. Resultados 3.1. Concentración y tamaño de nanoburbujas.
Los resultados de las lecturas de NanoSight de las nanoburbujas de aire (NBAir) (Fig. 2 A) y las nanoburbujas de oxígeno (NB-O2) (Fig. 2 B) fueron similares. La mayoría de las nanoburbujas (o partículas) tenían un tamaño inferior a 130 nn. La concentración de estas burbujas después de un tratamiento de 10 min fue de 2,39 × 10 7 ± 1,01 × 10 7 partículas / ml para NB-Aire y 3,03 × 10 7 ± 1,11 × 10 6 partículas / ml para NB-O 2. El aumento de los tiempos de tratamiento (15, 20 y 30 min) generó burbujas más grandes con cantidades en el mismo orden de magnitud (Fig.2). Los resultados confirmaron que el nanoburbujas utilizado en este estudio produjo nanoburbujas adecuadas, y que una operación de 10 minutos en 50 L de agua generó los nano-tamaños

Figura 2. Concentración y tamaño de las burbujas generadas con aire (A) u oxígeno (B) después del tratamiento durante 10, 15, 20 y 30 min. Los picos representan la concentración de burbujas dominantes con tamaños similares y los números azules indican los tamaños de las burbujas. Las concentraciones totales de burbujas se muestran en la parte inferior de cada gráfico. Los valores se calcularon a partir de 3 experimentos replicados. (Para la interpretación de las referencias al color en la leyenda de esta figura, se remite al lector a la versión web de este artículo).

Figura 3. Parámetros del agua (temperatura, pH, OD y ORP) durante 10 min de tratamiento y 15 min después de la exposición a nanoburbujas de ozo no. El experimento se llevó a cabo en 2 repeticiones.
más uniformes. Así, este esquema también se aplicó para generar nanoburbujas de ozono (NB-O3).
3.2. Efecto del tratamiento con NB-O3 sobre los parámetros del agua sin peces ni bacterias.
Los cambios de los parámetros del agua (T ° , OD, pH y ORP) durante y después del tratamiento con NB-O3 fueron consistentemente similares entre los ensayos ( Fig. 3 ). Se observaron cambios significativos en los valores de OD y ORP, mientras que T o aumentó considerablemente (~ 2 ° C) y el pH permaneció relativamente estable durante y después del tratamiento con NB-O3. Con respecto al OD, el valor aumentó rápidamente, alcanzando 23 a 25 mg / L después de un tratamiento de 10 min y se redujo lentamente a ~ 20 mg / L a los 15 min después del tratamiento. Por el contrario, el ORP aumentó rápidamente, alcanzando más de 700 mV en 6 min y 834 ± 22 mV en 10 min, y volvió al nivel inicial (318 ± 12 mV) 15 min después del tratamiento.
3.3. Un tratamiento con NB-O3 de 10 minutos redujo> 90% las cargas bacterianas en el agua
Como se muestra en la Fig. S1, se utilizaron cargas bacterianas similares (S. agalactiae ) en el punto de partida en el tanque de control (1,17 x 10 6 / mL) y el tanque de tratamiento (1,83 x 10 6 / mL). Sin embargo, tras el tratamiento con NB-O3, la densidad bacteriana se redujo rápidamente durante la exposición. La concentración bacteriana en el grupo tratado a los 5, 10 y 15 minutos se redujo en 62,30, 97,76 y 99,40%, respectivamente, lo que indica que la desinfección ocurrió durante el proceso de tratamiento. Esto equivalió a una reducción de 141 veces en la concentración bacteriana en el tanque de tratamiento. Por el contrario, la concentración de bacterias en el tanque de control se mantuvo estable en ~ 10 6 UFC / mL durante el mismo período de tiempo ( Fig. S1). Con respecto a la calidad del agua, solo se observaron cambios en el tanque de tratamiento. El OD aumentó de 6.2 mg / L (antes del tratamiento) a 21.8 mg / L (a los 5 min), 25.8 mg / L (a los 10 min) y 27.9 mg / L (a los 15 min) y se redujo a 23.3 mg / L a los 15 min post tratamiento. La temperatura del agua aumentó aproximadamente 1 ° C cada 5 min del tratamiento, de 26,5 ° C (antes del tratamiento) a 29,2 ° C (a los 15 min) y permaneció a esta temperatura 15 min después del tratamiento. Relativamente no se observaron cambios en el pH (7,6 a 7,7) y ORP (293 a 306 mV) durante el experimento.
3.4. El tratamiento con NB-O 3 redujo eficazmente las bacterias Gram positivas y negativas patógenas
El ensayo con S. agalactiae comenzó con cargas bacterianas similares:

Figura 4. Recuentos bacterianos de S. agalactiae (A) y A. veronii (B) tras la exposición a NB-O 3 durante 10 minutos, tres veces (líneas naranjas), en comparación con el del agua de control sin NB-O 3 (líneas azules). Las flechas indicaron el% de reducción de las cargas bacterianas en comparación con la concentración bacteriana inicial. Las barras representan la desviación estándar de 3 repeticiones. (Para la interpretación de las referencias al color en la leyenda de esta figura, se remite al lector a la versión web de este artículo). Los cambios en la calidad del agua se muestran en la Tabla 1. Los cambios de temperatura en los tanques de tratamiento de NB-O 3 fueron de 1.9–2.6 ° C después del primer tratamiento, y de 4.3–4.7 ° C después del tercer tratamiento, mientras que los valores de pH fueron relativamente estables entre 7.4 y 8.0. En particular, el OD aumentó bruscamente (de 3,9 a 4,4 a 26,4 a 29,9 mg / L) y se mantuvo en este nivel alto después de cada tratamiento, mientras que los valores de ORP no aumentaron tanto como se observó en el estudio del agua sin bacterias (Fig. 3).

Cuadro 1. Parámetros comparativos del agua en los grupos de control y de tratamiento con NB-O 3 con la presencia de S. agalactiae o A. veronii en el agua.
1,17 x 10 6 UFC / mL en el tanque de control y 3,45 x 10 6 UFC / mL en los tanques de tratamiento (Fig. 4 A ). Un solo tratamiento de 10 minutos con NB-O 3 redujo efectivamente 26 veces o el 96,11% de la carga bacteriana en el tanque. Cuando se repitió el mismo protocolo por segunda y tercera vez, las concentraciones bacterianas se redujeron 1415 y 22,058 veces o 99,93 y 99,99%, respectivamente. La concentración bacteriana en el tanque de control (sin el tratamiento con NBO3) se mantuvo en ~ 10 6 UFC / mL (Fig. 4 A). También se observaron patrones similares en los ensayos con la bacteria Gram-negativa. A. veronii. Los recuentos bacterianos iniciales promedio de A. veronii para los tanques de control y tratamiento fueron 1.03 × 10 6 CFU / mL y 1.65 × 10 a la 6ta potencia CFU / mL, respectivamente. Después de la primera, segunda y tercera exposición a NB-O3, las cargas bacterianas se redujeron 48, 29,176 y 109,978 veces a 3,44 × 10 4 ± 2,78 × 10 4, 56 ± 15 y 15 ± 6 UFC / ml (equivalente a 97,92, 99,99 y 99,99% de reducción), respectivamente (Fig.4 B). No se observaron cambios significativos en los recuentos bacterianos en el tanque de control durante el experimento (Fig. 4 B). T°, temperatura en grados Celsius; DO, oxígeno disuelto; ORP, potencial de oxidación-reducción. Los valores en el tratamiento con NB-O3 se expresan como media ± DE de 3 repeticiones. El examen ultraestructural de la superficie bacteriana mediante SEM reveló que la mayoría de las células bacterianas (tanto S. agalactiae como A. veronii) se colapsaron y destruyeron después del tratamiento con NB-O 3 durante 10 minutos en comparación con la estructura superficial intacta normal de las bacterias antes del tratamiento. (Figura 5).
3.5. Efecto del tratamiento con NB-O 3 sobre el recuento bacteriano total en el agua de los tanques de cultivo de peces
En este ensayo, se comparó la carga bacteriana antes y después del tratamiento. Antes del tratamiento, la concentración bacteriana total en el agua de cultivo de peces era de 8,18 x 10 5 ± 6,77 x 10 5 UFC / ml (Fig. 6 ). Después de la exposición a NB-O 3 durante 10 min, se inactivó el 59,63% de las bacterias. Cuando se repitió el mismo protocolo, el 87,25 y el 99,29% de bacterias se redujeron en estos tratamientos (es decir, una reducción de 141 veces de 8,18 × 10 5 ± 6,77 × 105 a 5,80 × 103 ± 5,20 × 103 UFC / ml) ( Fig. .6 ). Figura 6. Recuentos bacterianos totales del agua de cultivo de peces tras la exposición a NB-O 3. Las flechas indicaron el% de reducción de las cargas bacterianas en comparación con la concentración bacteriana inicial. Las barras representan la desviación estándar de 3 repeticiones. Durante el experimento, el OD aumentó bruscamente, desde muy bajo al principio 0,6 ± 0,1 mg / L a 27,7 ± 0,6 mg / L después de los primeros 10 minutos de tratamiento. El OD fue de 30,8 ± 7,7 mg

Figura 5. Micrografías electrónicas de barrido de S. agalactiae (AC) y A. veronii(DF) antes y después del tratamiento con NB-O 3 durante 10 min. La morfología bacteriana era normal antes del tratamiento, mientras que se observó destrucción celular después del tratamiento con NB-O 3. Barra de escala, 1 μm.

Figura 6. Recuentos bacterianos totales del agua de cultivo de peces tras la exposición a NB-O 3. Las flechas indicaron el% de reducción de las cargas bacterianas en comparación con la concentración bacteriana inicial. Las barras representan la desviación estándar de 3 repeticiones.
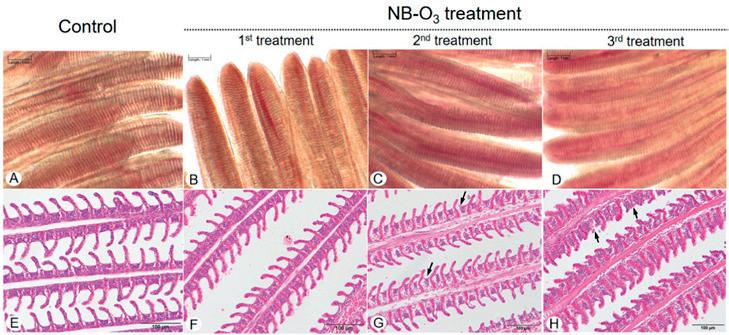
Figura 7. Fotomicrografías de cortes en húmedo (AD) y teñidos con H&E (E -H) de las branquias de tilapia del control y del tratamiento con NB-O 3. No hay diferencia observable en la morfología de las branquias por montaje húmedo entre los grupos de control (A) y primer tratamiento (B). Se observó una leve congestión en los filamentos branquiales en los peces que recibieron el segundo (C) y tercer (D) tratamientos. La tinción de H&E reveló la estructura normal de los filamentos branquiales tanto en el control (E) como en el primer tratamiento con NB-O 3(F). Se observaron daños leves y encogimiento de las laminillas basales (flechas) y congestión sanguínea leve en los peces que recibieron la segunda exposición (G), y un daño creciente de los filamentos branquiales, pérdida de algunas laminillas secundarias (flechas) y congestión sanguínea más severa las laminillas secundarias se observaron en los peces que recibieron la tercera exposición (H).
/ L después del segundo tratamiento de 10 min y de 28,7 ± 7,6 mg / L después del tercer tratamiento con NB-O3. La temperatura del agua aumentó ligeramente de 26,7 ± 0,3 a 28,3 ± 0,4, 29,8 ± 0,3 y 31,2 ± 0,2 ° C después del primer, segundo y tercer tratamiento, respectivamente. Por el contrario, el pH y el ORP se mantuvieron estables durante el experimento (7,5 a 7,6 para el pH, 210 a 250 mV para el ORP).
3.6. Efecto del NB-O3 so bre la salud de los peces y la morfología de las branquias
Ningún pez murió durante los tratamientos con NB-O3 o dentro de las 48 h posteriores al tratamiento. Sin embargo, se observaron signos anormales en las branquias de todos los peces examinados después de recibir el segundo y tercer tratamiento. Los signos predominantes incluyeron enrojecimiento en la base de las aletas, natación errática y la adhesión de burbujas a la superficie del cuerpo. Estas burbujas desaparecieron después de varios minutos de movimiento de peces. El examen en húmedo de las branquias de los peces no reveló diferencias observables entre el control (n = 4) y el primer tratamiento (n = 4) (Fig. 7 A-B). Sin embargo, se observó una leve congestión (4/4) en los filamentos branquiales cuando se repitió el tratamiento (Fig. 7 C-D). No hubo signos clínicos graves de enfermedad de las burbujas de gas. Las secciones de las branquias teñidas con H&E mostraron la estructura de las branquias normal en los peces muestreados después del primer tratamiento (Fig. 7 F) y del grupo de control (Fig. 7 E). Sin embargo, se observaron cambios anormales en los peces expuestos al segundo tratamiento. Los agregados de células basales en la base de las laminillas secundarias (4/4) fueron evidentes con una gravedad creciente correspondiente a la dosis de exposición al ozono (Figura 7 G). Las branquias de 3 peces de 4 peces expuestos al tercer tratamiento con NB-O 3 tuvieron una leve pérdida de la laminilla secundaria (Fig. 7 H) e infiltración de glóbulos rojos (congestión sanguínea) (Fig. 7H). Figura 7. Fotomicrografías de cortes en húmedo (AD) y teñidos con H&E (E -H) de las branquias de tilapia del control y del tratamiento con NB-O 3. No hay diferencia observable en la morfología de las branquias por montaje húmedo entre los grupos de control (A) y primer tratamiento (B). Se observó una leve congestión en los filamentos branquiales en los peces que recibieron el segundo (C) y tercer (D) tratamientos. La tinción de H&E reveló la estructura normal de los filamentos branquiales tanto en el control (E) como en el primer tra-
tamiento con NB-O 3(F). Se observaron daños leves y encogimiento de las laminillas basales (flechas) y congestión sanguínea leve en los peces que recibieron la segunda exposición (G), y un daño creciente de los filamentos branquiales, pérdida de algunas laminillas secundarias (flechas) y congestión sanguínea más severa las laminillas secundarias se observaron en los peces que recibieron la tercera exposición (H). Durante el tratamiento, las fluctuaciones de los parámetros del agua (T°, OD y pH) fueron similares (Tabla 2) al experi-
Cuadro 2. Fluctuación de los parámetros del agua en peceras con y sin tratamiento NB-O3.

mento con agua limpia enriquecida con S. agalactiae o A. veronii y NBO 3 (Tabla 1), con la excepción de que Los tanques expuestos al ozono tenían niveles de ORP de 860 a 885 mV después de cada tratamiento de 10 minutos.
T°, temperatura en grados Celsius; DO, oxígeno disuelto; ORP, potencial de reducción de oxidación; ND, no hecho. Los valores se expresan como media ± DE de 3 réplicas. * El ORP cayó a la normalidad (~ 330 mV) después de 15 minutos de cada tiempo de tratamiento.
4. Discusión
La aplicación de gas ozono en la tecnología de nanoburbujas es relativamente nueva en la acuicultura. Un estudio anterior informó la eficacia de esterilización de NB-O 3 contra V. parahaemolyticus patógeno, una bacteria Gram-negativa que causa enfermedad en camarones marinos (Imaizumi et al., 2018). En este estudio, primero revelamos que el tratamiento con NB-O 3 tiene una eficiencia de desinfección similar contra bacterias patógenas Gram-positivas (S. agalactiae) y Gram-negativas (A. veronii) en agua dulce, y el mecanismo de desinfección parece destruir la pared celular bacteriana, según lo revelado por SEM. Además, descubrimos una breve exposición a NB-O 3(10 min, ORP alcanzó 860 ± 42 mV) no causó un efecto agudo en los peces y fue adecuado para reducir la concentración de bacterias de 26 a 48 veces (> 96%). Aunque el tratamiento con NB-O3 no eliminó las bacterias en el agua por completo, la reducción de bacterias patógenas de 26 a 48 veces puede ser útil para prevenir brotes de enfermedades. Es importante destacar que determinamos que nuestro protocolo de tratamiento de 10 minutos aplicado en este estudio produjo nanoburbujas (<200 nm) con una concentración de aproximadamente 2-3 × 10 7 burbujas / ml, y la mayoría de las burbujas tenían menos de 130 nm de diámetro. Nuestros hallazgos indican que la tecnología NB-O 3 tiene el potencial de reducir los organismos patógenos no solo en los sistemas de acuicultura marinos, sino también de agua dulce. La efectividad de la desinfección del NB-O 3 probablemente dependa de la carga orgánica en el agua. En agua del grifo limpia sin cloro enriquecida con una concentración conocida de S. agalactiae o A. veronii, un solo tratamiento (10 min) con NB-O 3 redujo con éxito más del 96% de las bacterias (matadas 1,62 × 10 6 a 3,31 x 10 6 UFC / ml). Sin embargo, el mismo protocolo aplicado al agua que se tomó de un tanque de cultivo de tilapia, resultó en una reducción en el potencial de desinfección en aproximadamente 1.6 veces. El ozono es conocido como un fuerte agente oxidante (Summerfelt, 2003; Powell y Scolding, 2016); por lo tanto, era posible que la materia orgánica (por ejemplo, heces, moco, etc.) en el agua del tanque sucio compitiera por el potencial de oxidación del NB-O3, lo que ralentizaba la eficacia de la desinfección. Este hallazgo sugiere que un mayor tiempo de tratamiento o una mayor frecuencia de tratamientos, como se evaluó en este estudio, puede ser necesario para el agua con abundante materia orgánica. En comparación con el estudio anterior publicado por Imaizumi et al. (2018), la tasa de esterilización de NB-O3 en este estudio fue menor. Los dispositivos y la configuración experimental de dos estudios podrían explicar algunas de las diferencias. En este estudio, los ensayos se realizaron en agua dulce y las bacterias probadas se añadieron directamente al tanque (50 L) antes del tratamiento, mientras que Imaizumi et al. (2018) probado NB-O3 en agua de mar, y los experimentos de desinfección se realizaron mediante la incubación del agua tratada y las bacterias en un volumen relativamente pequeño (500 mL). Otra posibilidad es que la concentración inicial de bacterias utilizada en este estudio fue aproximadamente 10 veces mayor que en el estudio publicado, lo que hace que la carga orgánica sea más alta y la esterilización más difícil. Debido a la inestabilidad del O3, la medición directa y precisa de la concentración de ozono en el agua es difícil. Por lo tanto, el potencial de oxidación-reacción (ORP) se usa comúnmente para la medición indirecta del ozono en el agua (Suantica et al., 200; Hess-Erga et al., 2008 ; Imaizumi et al., 2018 ). Curiosamente, también notamos que cuando se agregaron bacterias (materia orgánica) al agua, el valor de ORP no aumentó cuando se agregó ozono al sistema, como se observó en el tratamiento inicial sin bacterias. Asimismo, el ORP no aumentó durante el tratamiento con el agua de piscicultura (rica en materia orgánica). Esto pro-
bablemente se debió a la rápida oxidación y degradación del O 3 moléculas en presencia de materia orgánica. En agua limpia, el ORP se redujo relativamente rápido y volvió a la normalidad después de que dejamos de introducir NB-O3, lo que indica que las moléculas de O3 se oxidan con relativa rapidez. Esto fue consistente con los altos niveles de OD mantenidos después del tratamiento con NB-O 3, muy probablemente derivado de la degradación de O 3 en moléculas de O 2 (Batakliev et al., 2014). Si este es el caso, el tratamiento de NB-O3 en las granjas de acuicultura podría tener un doble beneficio: desinfección y mejora del OD en los sistemas de cultivo. La exposición a períodos prolongados de tiempo a altos niveles de OD puede tener un impacto perjudicial en los peces y debe explorarse más antes de que la tecnología se utilice comercialmente. En este estudio, se diseñaron tratamientos repetidos para evaluar el efecto agudo del NBO3 en los peces. Aunque múltiples tratamientos con NB-O3 no mataron a los peces, una mayor exposición causó daños en las branquias de los peces. Si se utilizó más de un tratamiento de 10 min con NB-O3, hubo alguna evidencia de irritación de las branquias, pero no mortalidad aguda. El daño a las branquias probablemente se debió a la exposición al ozono, según otros estudios (Wedemeyer et al., 1979; Good et al., 2011), pero también puede haber sido exacerbado por los altos niveles de oxígeno (es decir, 26,9-28,5 mg / L) en el agua. En un experimento anterior con una configuración similar, los peces fueron tratados con nanoburbujas de oxígeno durante 10 minutos por día durante un período de 26 días y no se observó mortalidad. Además, los peces tratados tuvieron el mismo rendimiento de crecimiento que el control no tratado (datos no publicados), lo que sugiere que el trauma en las branquias observado en este estudio probablemente se debió a la exposición repetida al ozono. En conjunto, los hallazgos sugieren que una sola exposición de 10 minutos a NB-O3, con un nivel de ORP que alcanza los 860 ± 42 mV, es segura para los peces. Hay que destacar que la temperatura del agua aumentó considerablemente durante múltiples tratamientos de nanoburbujas en un volumen relativamente pequeño de agua (50 L). Durante la operación, el generador de nanoburbujas produce una cantidad considerable de calor, que se transfiere al agua. El aumento de temperatura también puede causar estrés a los peces experimentales. Sin embargo, en estanques de peces con grandes volúmenes de agua, esto podría no ser un problema debido al rápido intercambio de temperatura entre el cuerpo de agua y el aire circundante. Si esta tecnología se aplica en estanques de peces, las concentraciones de nanoburbujas utilizadas tendrían que ser mucho más bajas que las que aplicamos en este estudio para minimizar el impacto en las branquias y la salud de los peces. Sin embargo, nuestros hallazgos sobre la eficacia de la desinfección en agua con abundante materia orgánica sugieren que los agricultores también pueden tener que aplicar el tratamiento con más frecuencia para lograr el mismo nivel de reducción bacteriana. Se requiere más investigación en condiciones de campo para establecer la dosificación óptima de NB-O3 en estanques de diferentes tamaños para lograr una reducción deseable en la concentración bacteriana y para asegurar que esta dosis no sea perjudicial para la salud de los peces. Si es así, el tratamiento periódico con la dosis adecuada, durante los períodos de cultivo con alto riesgo de brotes de enfermedades bacterianas, podría ser útil para la prevención de enfermedades. Sin embargo, se requieren investigaciones más profundas antes de ampliar la tecnología NB-O3 para aplicaciones comerciales, particularmente con respecto a los efectos de NB-O3 en la inmunidad de los peces y la respuesta al estrés, el microbioma y el rendimiento del crecimiento. Una de las limitaciones de este estudio fue el tamaño limitado de la muestra en nuestros experimentos. Nuestro número de tanques estaba limitado por el número de generadores de nanoburbujas que teníamos. Además, no pudimos incluir un grupo normal de tratamiento de piedras de aire con ozono debido al problema de seguridad del personal en nuestro laboratorio. Sin embargo, cuando consideramos todos los experimentos juntos, hay evidencia sólida que sugiere que la tecnología NB-O3 no solo es un método de desinfección prometedor, sino que también enriquece el oxígeno disuelto en la acuicultura de agua dulce y en dosis bajas (es decir, 10 min a 1 L / min en un tanque de 50 L) no fue dañino para los peces. Como herramienta de prevención de enfermedades, NB-O3, el tratamiento podría ser una tecnología prometedora para controlar el crecimiento excesivo de bacterias patógenas en el agua, reduciendo así el riesgo de enfermedades bacterianas. Esta tecnología de desinfección no química puede ser una alternativa prometedora a los antibióticos como un medio para reducir el uso de antibióticos en la acuicultura y posiblemente reducir inadvertidamente el riesgo de RAM. Se requiere más investigación para investigar si el NB-O3 se puede utilizar como tratamiento durante los brotes de enfermedades bacterianas.
En resumen, este estudio proporciona evidencia inicial para apoyar que NB-O3 es eficaz para reducir la concentración de patógenos bacterianos S. agalactiae y A. veronii en agua dulce, y son relativamente seguros para la tilapia. Estos hallazgos deberían impulsar a la industria a seguir investigando la aplicación de esta tecnología en condiciones comerciales de campo. Aunque en este estudio se utilizaron dispositivos disponibles comercialmente, persisten varios problemas técnicos con la evaluación de la tecnología. Por ejemplo, la medición directa de la dosis de ozono y los residuos en el agua, la eficiencia energética, el índice de utilización del ozono, la dinámica de descomposición del ozono y su tiempo de desinfección, los posibles subproductos tóxicos, así como la transferencia de masa de ozono durante el NB-O3.de desinfección. Estos problemas deben explorarse en estudios posteriores para una comprensión más completa de la tecnología NB-O3. Responsabilidad: Las opiniones expresadas en este do cumento no representan necesariamente las del IDRC o de su Junta de representantes. Declaración de intereses en competencia: Los autores declaran que no tienen intereses económicos en competencia o relaciones personales que puedan haber influido en el trabajo informado en este documento.
Agradecimientos: Este trabajo se llevó a cabo con el apoyo financiero del gobierno del Reino Unido: el Departamento de Salud y Atención Social (DHSC), el Fondo Global de Innovación AMR (GAMRIF) y el Centro Internacional de Investigación para el Desarrollo (IDRC), Ottawa, Canadá. Los autores desean agradecer a William Chalmers por su ayuda editorial. Referencias: https://www.sciencedirect.com/science/article/ pii/S0044848620339922#f0015 Autores: Chayu da Jhunkeaw a1Nareerat Khongcharoen a1Naruporn Run grueng a1Pattiya SangpoaWattana PanphutaAnat ThapintaaSaengchan Senapin bcSo -










