










Află riscul de cancer pulmonar înainte de a fi prea târziu

Test imunologic pentru screeningul cancerului pulmonar

Nu aștepta să apară simptomele! Depistează riscul de cancer pulmonar cu EarlyCDT® – un test inovator disponibil în premieră la MedLife. Programează-te acum!
„Anul 2025 pentru AMLR este un an cu inițiative speciale pentru tinerii medici“
Interviu cu Dr. Daniela Jitaru 6
„Obiectivul nostru este ca medicul de laborator să devină nu doar un interpret al rezultatelor, ci un lider în integrarea tehnologiilor de diagnostic de ultimă generație în practica medicală”
Interviu cu Prof. Univ. Dr. Minodora Dobreanu 8
Modele prognostice în leucemia limfocitară cronică: busolă clinică sau labirint de acronime
Asist. Univ. Dr. Cristian Barta
Microbiomul endometrial: biomarker emergent în infertilitate și reproducere asistată
As. Univ. Dr. Antoanela Curici
Microbiomul pulmonar – de la ecologie invizibilă la excelență clinică
Biolog Pr. Oana Popescu
Provocări în siguranța tratamentului transfuzional Dr. Georgeta Hanganu

10

14

20
24

Testele farmacogenetice utilizate în scopul reducerii toxicităţii asociate tratamentelor oncologice
Biolog principal Dr. Ecaterina Tătaru 30
Rolul biofilmului și al infecțiilor polimicrobiene în complicațiile infecțiilor pielii și țesuturilor moi: perspective moderne de diagnostic
Dr. Rodica Stela Lumpan, Dr. Constantin Alexandru Albu

Sinergia dintre medicina de laborator și boli infecțioase în practica clinică modernă
Dr. Adrian Neculai, Dr. Ana-Maria Dițu, Dr. Ramona Lucia Vasile

Dr. Rodica Stela Lumpan
Medic specialist Microbiologie medicală - Spitalul de Pediatrie Ploiești
Dr. Constantin Alexandru Albu
Medic specialist Microbiologie medicală - Direcția Complex Multifuncțional Caraiman
Dr. Adrian Neculai
Medic Rezident BI - INBI „Prof. Dr. Matei Balș“, Master în Managementul Serviciilor de Sănătate – ASE București
Ana-Maria Dițu
Medic specialist Boli Infecțioase, Spitalul Județean de Urgență, Ploiești
Dr. Ramona Lucia Vasile
Medic primar Boli Infecțioase, Spitalul Județean de Urgență, Ploiești








Stimată doamnă Dr. Daniela Jitaru, vă rugăm să ne vorbiți despre importanța împletirii celor două evenimente, şi anume: a 32-a Întâlnire a Federației de Laboratoare Clinice Balcanice şi a 16-a Conferință Națională a Asociației de Medicină de Laborator din România.
Împletirea celor două evenimente în perioada 8-11 octombrie 2025 la Sinaia reprezintă o premieră istorică pentru Medicina de Laborator din România. Este o onoare și un privilegiu de a găzdui cea de-a 32-a Întâlnire a Federației de Laboratoare Clinice Balcanice, alături de cea de-a 16-a Conferință Națională a Asociației de Medicină de Laborator din România, deoarece acest eveniment reflectă maturitatea și recunoașterea internațională pe care comunitatea noastră medicală a dobândit-o. Conferința noastră națională capătă astfel o dimensiune internațională amplificată, devine forum de dialog între specialiștii români și cei balcanici și oferă o vizibilitate științifică crescută prin publicații și prezentări cu impact regional. Prin această integrare, România demonstrează că nu este doar participant, ci lider în rețeaua laboratoarelor medicale balcanice.
Progresele în cercetarea medicală pot facilita evoluția medicinei personalizate, astfel încât cercetarea din domeniul sănătății să devină mai semnificativă pentru oameni. Ce progrese în domeniile de vârf ale medicinei de laborator s-au înregistrat în ultima perioadă?
Medicina de laborator traversează o perioadă de transformare rapidă, cu progrese spectaculoase, în care automatizarea și inteligența artificială schimbă deja practica de
În perioada 8 – 11 Octombrie 2025, Sinaia își deschide porțile pentru un eveniment de referință al medicinei de laborator, și anume a 32-a Întâlnire a Federației de Laboratoare Clinice Balcanice și a 16-a Conferință Națională a Asociației de Medicină de Laborator din România. Despre semnificația acestui eveniment precum și despre proiectele AMLR, am discutat cu doamna Dr. Daniela Jitaru, Președinte al Asociaţiei de Medicină de Laborator din România (AMLR).
zi cu zi. În paralel, genomica și proteomica, parte din medicina personalizată devin realitate, tehnologiile de secvențiere de ultimă generație fiind disponibile și în România în multe laboratoare medicale. Avansăm și în identificarea biomarkerilor pentru diagnosticul precoce în cancer, boli cardiovasculare sau neurodegenerative, ceea ce permite intervenții mult mai timpurii. În plus, digitalizarea și telemedicina deschid accesul la servicii moderne chiar și în zonele rurale.
Știința de astăzi se schimbă rapid şi devine mai complexă, astfel încât niciun cercetător sau centru nu poate aduce toată experiența pentru a dezvolta şi valida inovațiile medicale sau pentru a le asigura siguranța. Care este rolul AMLR în schimbul eficient de informații între instituții?
Rolul AMLR este să conecteze și să accelereze transferul de cunoștințe și informații în comunitatea medicilor de laborator, atât la nivel național, cât și în regiunea balcanică. Avem mai multe platforme:
• Revista Română de Medicină de Laborator, indexată internațional, unde publicăm cercetări stiințifice de calitate.
• Rețeaua de laboratoare de referință, la nivel național, care permite transfer rapid de metodologii și programe de control interlaboratoare.
• Parteneriatele noastre internaționale prin IFCC (din 2006) și EFLM (din 2009), care deschid accesul la proiecte comune și ghiduri internaționale.
• Platformele digitale în dezvoltare, ce vor asigura schimb de date, baze colaborative și programe de e-learning.
Unul dintre proiectele AMLR este acela de susținere a tinerilor medici. Ce programe aveți anul acesta pentru stimularea lor?
Anul 2025 pentru AMLR este un an cu inițiative speciale pentru tinerii medici. Ast-
fel, anul acesta AMLR a organizat Școala de Vară AMLR la Sinaia, cu workshop-uri intensive și sesiuni hands-on. De asemenea, AMLR a lansat Programul de Mentorat Generația Viitoare, prin care tinerii sunt ghidați direct de specialiști cu experiență.
Acordăm premii pentru excelență, burse de mobilitate și finanțări pentru proiecte inovatoare. De asemenea, tinerii noștri au acces la rețele internaționale prin EFLM și IFCC, iar prin reprezentanți precum dr. Monica Dugăeșescu sunt conectați direct la forurile europene. În calitate de Preşedinte al AMLR vă rugăm să ne comunicați care sunt obiectivele pe care v-ați propus să le realizați până la sfârşitul acestui an?
Până la finalul lui 2025, obiectivele pe care doresc să le realizez sunt:
• Organizarea impecabilă, cu succes a dublului eveniment de la Sinaia, cu peste 800 de specialiști participanți.
• Consolidarea parteneriatelor internaționale și stabilirea de proiecte comune cu asociațiile de medicină de laborator balcanice.
• Lansarea de noi ghiduri naționale pentru activitățile din laboratoarele medicale.
• Continuarea și extinderea schemei naționale de evaluare externă a calității în laboratoarele medicale prin programe susținute de AMLR.
• Sprijinirea cercetării prin burse și prin programe de formare avansată: cursuri de specializare în tehnologii emergente (genomică, proteomică etc); stagii rotative în laboratoare de excelență din țară și străinătate: proiecte comune cu universitățile medicale pentru integrarea în curriculum-ul academic.
Aceste obiective sunt parte a unei viziuni mai mari: AMLR să devină motorul modernizării medicinei de laborator din România, cu impact direct asupra calității actului medical și sănătății pacienților.
a) Calitatea datelor – algoritmii funcționează corect doar dacă sunt verificați pe seturi de date de calitate, standardizate și reprezentative. În practică, datele provenite din laboratoare pot fi heterogene și greu de uniformizat.
b) Resurse financiare și tehnice – costurile de implementare, necesitatea de infrastructură IT performantă și formarea personalului sunt obstacole reale pentru multe centre medicale.
c) Validarea clinică și reglementarea – fiecare instrument de IA trebuie să treacă printr-un proces riguros de validare și să respecte standardele internaționale (ISO, CE-IVD, FDA). Procedurile sunt complexe și consumatoare de timp.
d) Acceptarea profesională – IA este uneori percepută ca un „înlocuitor“ al specialistului, ceea ce poate genera rezistență. De fapt, rolul ei este de suport decizional, nu de substitut al expertizei umane.
e) Aspecte etice și de responsabilitate – cine răspunde dacă algoritmul oferă
o recomandare eronată? Stabilirea cadrului legal și deontologic este o provocare majoră.
Pe termen lung însă, IA poate deveni un partener esențial, reducând timpul de analiză, detectând tipare ascunse și susținând diagnosticul personalizat.
Având în vedere că diagnosticul de laborator este un domeniu în permanentă şi rapidă evoluție, perfecționarea şi actualizarea cunoştințelor este esențială. Vă rugăm să ne comunicați ce alte proiecte pentru pregătirea medicilor de laborator aveți în viitor?
Într-un domeniu care evoluează rapid, formarea continuă este vitală. Există mai multe direcții de dezvoltare:
1. Programe naționale de educație continuă, organizate de Asociația de Medicină de Laborator din România, care includ workshopuri pe tehnologii
emergente și cursuri postuniversitare.
2. Colaborări internaționale în cadrul Federației Balcanice și al altor societăți europene, ce oferă cursuri online, schimburi de experiență și traininguri în laboratoare de referință.
3. Integrarea modulelor de IA în curricula universitară și de rezidențiat, astfel încât tinerii medici să fie pregătiți pentru utilizarea noilor instrumente.
4. Proiecte de cercetare aplicată care implică echipe mixte (medici, biologi, informaticieni) și oferă rezidenților oportunitatea de a lucra pe proiecte interdisciplinare.
5. Platforme digitale de e-learning, cu acces la baze de date internaționale, cursuri video și simulări interactive, pentru a facilita perfecționarea continuă, indiferent de locație.
Obiectivul este ca medicul de laborator să devină nu doar un interpret al rezultatelor, ci un lider în integrarea tehnologiilor de diagnostic de ultimă generație în practica medicală.

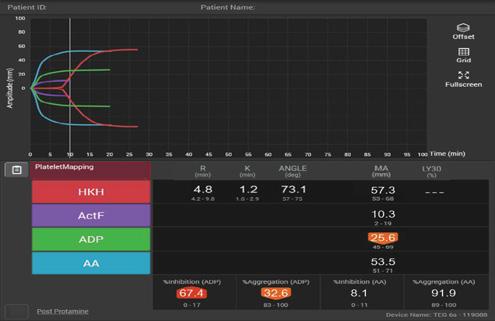
Leucemia limfocitară cronică (LLC) este un neoplasm hematologic caracterizat prin proliferarea necontrolată a unor limfocite maligne, aberante funcțional și acumularea lor în diferite țesuturi precum: sânge, maduvă hematogenă, splină, ganglioni limfatici. Este cea mai frecventă leucemie din emisfera vestică, cu incidență de aproximativ 4.6 la 100.000 de locuitori, în Statele Unite reprezentând între 25-35% din totalul leucemiilor. În cazul Românei există doar date indirecte privind incidența LLC, obținute din studii efectuate în diferite centre universitare din țară (conform proiectului de lege nr. 293 din 3 noiembrie 2022,“ Planul național pentru prevenirea și combaterea cancerului“). Extrapolarea acestor date la întreaga populație a României a permis o estimare a incidenței LLC de aproximativ 4,44-5,55 la 100.000 locuitori, asemănătoare datelor statistice menționate anterior. Reprezintă o afecțiune ce afectează predominant populația vârstnică, cu vârsta medie la momentul diagnosticului fiind 70 ani; LLC afectează însă și populația tânără, 10% dintre pacienți având sub 45 de ani, un număr semnificativ, în contextul incidenței ridicate a acestei boli.

DAsist. Univ.
Dr. Cristian Barta
Medic specialist Medicină de laborator, Asistent Universitar UMF „Carol Davila“, București
iagnosticul se bazează pe persistența limfocitozei >5000 limfocite B per microlitru în sângele periferic, cu clonalitate confirmată prin citometrie în flux (coexpresia CD5+ cu markerii de limfocit B tipic CD 19+, CD20+, CD23+). Clasic, LLC este considerată printre neoplaziile hematologice indolente, cu evoluție posibilă pe parcursul mai multor decade, pacienții având adeseori o viață cvasi-normală. Deși diagnosticul este destul de facil, provocarea în managementul bolii apare prin heterogenitatea deosebită de care poate da dovadă, prin tipare extrem de variate, de la indolență anterior menționată, la evoluții trenante, adeseori însoțite de comorbidități și manifestări paraneoplazice cu complicații diverse. Această heterogenitate intrinsecă adăugată la numărul semnificativ de cazuri crează o ecuație dificil de rezolvat inclusiv pentru sistemele de sănătate moderne. Gestionarea costurilor atât în timp, cât și în resurse financiare asociate urmăririi acestor pacienți pentru o perioada de timp îndelungată reprezintă o provocare semnificativă chiar și pentru sistemele de sănătate bine dezvoltate.
În încercarea de a aduce un grad superior de predictibilitate într-un domeniu marcat de incertitudine și variabilitate, s-a încercat elaborarea a multiple modele prognostice, utilizând biomarkeri diverși, care să permită o stratificare cât mai precisă a riscului acestor pacienți. În acest context, devine esențială înțelegerea unor concepte fundamentale care stau la baza analiza performanței acestor algoritmi. Un astfel de model prognostic este, simplificat spus, un grup de biomarkeri (sau indici prognostici) selectați astfel încât, după integrarea într-un model matematic, generează un scor. Acest scor estimează posibilitatea apariției unui eveniment clinic specific într-un anumit interval de timp. Indicii prognostici variază de la date clinice (vârstă, sex), biochimice (beta-2 microglobulina) la profiluri moleculare (mutația IGHV, mutația TP53) sau citogenetice (del 17p, del 11p). Alegerea lor nu este un proces facil, numărul, precum și dificultatea determinărilor afectează implementabilitatea în diferite cadre, astfel încât există scoruri care pot fi implementate doar în centre care dispun de anumite tehnici de laborator. Drept examplu, modelul German CLL Study Group (GCLLSG) utilizează timidin-kinaza în calcularea scorului, parametru biochimic care nu este disponibil de rutină în majoritatea laboratoarelor clinice. Interesant de menționat este faptul că un număr de markeri mai mare nu înseamnă automat o abilitate
predictivă superioară. Nu doar numărul indicilor incluși este de interes, ci și analiza interacțiunii, precum și a contribuției independente a fiecăruia dintre ei la valoarea prognostică globală. Astfel, ne lovim în practică de o provocare ubicuitară în prognosticul hemato-oncologic: echilibrul dintre acuratețea predictivă și fezabilitatea clinică.
Un concept fundamental în explorarea prognosticului este evenimentul studiat, adesea denumit punctul final al analizei (end-pointul). În cazul LLC cele mai utilizate sunt TTFT (time to first treatment – timpul scurs până la începerea tratamentului, crucial în cazul LLC, mai ales în contextul viabilității clare a strategiei de “watch and wait“) şi OS (overall survival – timpul total de supraviețuire), PFS (progression free survival – timpul scurs fără progresie a bolii).
Evaluarea performanței unui scor prognostic se bazează, în principal, pe două dimensiuni statistice esențiale: putearea de discriminare și calibrarea. Puterea de discriminare, în acest context, evaluează capacitatea modelului de a separa pacienții care urmează să
experimenteze evenimentul de interes (TTFT, PFS, OS) de cei la care acesta nu va surveni deloc sau va apărea după terminarea analizei. Cu alte cuvinte, reflectă cât de precis reușeste modelul să separe pacienții cu risc înalt de cei cu risc scăzut. Pentru a evalua puterea de discriminare se folosește indicele de concordanță - Harrell-c index. Acest index reprezintă probabilitatea ca dintre doi pacienți aleși arbitrar din cohorta analizată, cel la care s-a manifestat evenimentul mai repede să fi fost clasificat drept risc mai înalt. Simplificat spus, indexul C reprezintă capacitatea unui model de a stratifica pacienții din punct de vedere al riscului: o valoarea de 0,5 relevă o discriminare nulă, puterea de predicție este arbitrară, asemănătoare aruncării unei monede, scorul de 1 arată o predictibilitate perfectă, improbabilă medical (posibil să existe date artefactuale), iar valori >0,7 sunt considerate acceptabile, care semnifică o putere predictivă utilă în practica medicală. În acest punct trebuie menționată una dintre observațiile referitoare la vulnerabilitățile modelelor prognostice: faptul că, altfel spus, chiar și în cazul indicelui de discriminare considerat acceptabil, de 0,7, aproximativ 30% dintre datele oferite de model sunt inadecvate. Drept exemplu, unul dintre scrorurile prognostice folosite uzual la nivel internațional CLL-IPI prezintă un indice Harrel-C de 0.73, astfel 73% dintre pacienții ordonați din punct de vedere al riscului sunt clasificați corespunzător.
Calibrarea reprezintă măsura în care riscul estimat de un scor prognostic se suprapune cu riscul observat pe populații reale. Pentru a demonstra această corespondență sunt necesare procese de validare: validarea internă, realizată pe cohorta inițială de dezvoltare a studiului și validarea externă, pe cohorte independente, provenite din alte clinici sau sisteme de sănătate.
În continuare, vor fi prezentate în ordine cronologică principalele modele de stratificare a riscului dezvoltate pentru LLC. Vor fi menționate atât limitările, cât și punctele forte ale fiecăruia dintre ele, reliefând în paralel heterogenitatea bolii pe care încearcă să o transpună într-un cadru predictiv. Trebuie avut în vedere faptul că evoluția continuă a tratamentelor posibile amplifică limitările inerente acestor modele statice, dependente de
momentul în timp al constituirii. Tema principală a evoluției scorurilor prognostice este implementarea progresivă a noi biomarkeri genetici, precum și încercarea de adaptare la noile realități terapeutice.
Primele două astfel de sisteme, Rai și Binet, au fost propuse acum aproape cincizeci de ani și se bazează pe criterii pur clinice (folosesc gradul de anemie, trombocitopenie, limfocitoza, hepatosplenomegalia etc), relativ simple și ușor de implementat, nu necesită tehnică de laborator avansată, au constituit fundamentul tuturor sistemelor predictive ulterioare. Totuși, limitarea lor majoră este faptul că nu integrează date moleculare, prin urmare nu discriminează cu succes pacienții cu risc mediu-înalt, mai ales in contextul teapiilor moderne.
Următorul model a fost realizat de către MDACC (MD Anderson Cancer Center) în anul 2007, scor bazat pe parametri clinici precum vârsta, beta2 microglobulina, stadiul Rai, numărul absolut de limfocite şi numărul de grupe ganglionare afectate. Ulterior, a fost rafinat prin adăugarea unor markeri moleculari cu valoare prognostică independentă: statusului mutațional IGHV şi del 17p. Deşi a fost inițial validat pe o cohortă semnificativă numeric la MDACC, puterea sa prognostică în cohorte independente din alte studii a fost inferioară celorlaltor modele, în prezent rolul acestui model a rămas în exclusivitate istoric şi didactic.
Următoarea etapă în evoluția scorurilor prognostice a fost deja menționat anterior, GCLLSG, în anul 2014, model care integrează următoarele variabile: sexul, vârsta, statusul Eastern Cooperative Oncology Group (ECOG), del 17p, del 11q, statusul mutațional IGHV, beta-2 microglobulina și timidin-kinaza. Limitarea majoră constă în disponibilitatea redusă a dozării timidin-kinazei în afara Germaniei, aspect parțial compensat de
utilizarea unei variante modificate a scorului, care exclude acest parametru. În anul 2016 a fost publicat cel mai utilizat scor prognostic, CLL-IPI (LLCInternational prognostic index), aplicabil și în prezent. Acest model realizează o combinație de 5 indici prognostici, atât parametri clinici, cât și factori citogenetici: statustul mutațional TP53, IGHV, beta-2 microglobulina serica, stadiul clinic și vârsta, reușind separarea în patru grupe de risc distincte. Modelul s-a dovedit util atât în evaluarea TTFT, cât și a OS, fiind evaluat extensiv pe mii de pacienți, din multiple cohorte independente. O meta-analiză Cochrane recentă a demonstrat o putere de discriminare acceptabilă, cu indicele C de 0,73. CLL-IPI este cel mai utilizat scor prognostic din prezent.
În aceeași perioadă a fost elaborat și modelul Barcelona-Brno, o propunere de simplificare a CLL-IPI, cu putere discriminatorie asemănătoare. Scorul integrează doar două variabile cu valoare prognostică independentă: statusul mutațional IGHV și delețiile 11q, respectiv 17p. Simplitatea scorului reprezintă un avantaj practic, însă acesta este contrabalasnat de către numărul redus variabile incluse. În urma validării externe efectuată pe 4 cohorte independente, scorul a obținut un indice C de 0,65, o capacitate de discriminare moderată. Indicele C acceptabil, în ciuda numărului scăzut de markeri utilizați reflectă importanța profilului genetic în evoluția bolii.
Scorurile prognostice sunt validate de regulă pe perioade de timp îndelungate, astfel încât necesită urmărirea pe termen lung a numeroși pacienți din zone și contexte clinice diferite. Însă, ritmul rapid al progreselor terapeutice face dificilă menținerea acestor indici în pas cu realitatea clinică. Apariția a noi posibilități terapeutice, cu impact semnificativ asupra supraviețuirii și evoluției bolii a evidențiat limitările modelelor tradiționale și a impus dezvoltarea unor noi scoruri adaptate compușilor farmacologici contemporani. Ca răspuns la această provocare au fost elaborați algoritmi prognostici precum BALL, acronim pentru beta-2 microglobulina, anemie, lactat dehidrogenază și ultimul tratament (L= last treatment). BALL utilizează indici accessibili în majoritatea contextelor clinice și este elaborat pentru LLC recăzut/refractar (R/R). Este interesant de menționat excluderea a doi

Furnizor de reactivi, echipamente,
şi service pentru laboratoarele de biologie moleculară şi imunologie, aplicând o politică bazată pe calitatea înaltă a produselor şi serviciilor precum şi flexibilitatea în întâmpinarea nevoilor clienţilor.
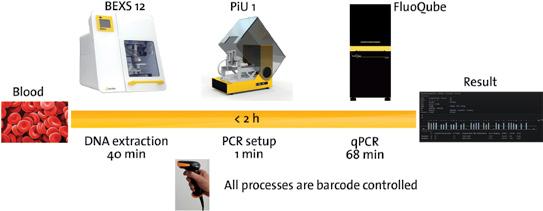
CoDx Box™ (RT-PCR instrument) The CoDx Box™ is cutting-edge magnetic induction technology powering the most advanced qPCR cycler ever, manufactured for Co-Diagnostics by Bio Molecular Systems, the original team behind Rotor-Gene 6000™, X-Tractor Gene™ and CAS-1200™.

Logix Smart ABC (Influenza A_B, SARS-CoV-2)
LogixSmart SARS-CoV-2 DS
ELDON CARD 2521 can easily be divided into two single cards
ELDON ID CARD with your photo. The card can be folded to the format of a credit card.

BIO SUPPLY DEVELOPMENT SRL
București, Sector 3, Str. Vlad Dracu, Nr. 11, Bl. C14, Ap. 58
Tel.: / FAX: 021.322.85.98
E-mail: office@biosupply.ro











oferă o gamă variată de kit-uri și consumabile pentru HLA, secvenţiere, RT-PCR pentru detecţia patogenilor (virusuri, bacterii, fungi și paraziţi) și tehnologia Hi-Res Melting (teste pentru scanarea genelor pentru: cancer, metabolism, markeri cardiaci, hemostază, enzime de transport metabolizante de medicamente, flavine conţinând monooxygenaze, glutathione-S-transferaze, neuronale, familia „solute carrier“. De asemenea comercializează teste pentru monitorizarea gradului de curăţenie în spitale (săli de operaţie, ATI, saloane) cu ajutorul testelor bazate pe tehnologia ATP (Hygiena International-UK).



Microbiomul endometrial a devenit o arie de cercetare esențială în domeniul infertilității feminine. Studiile recente demonstrează că dezechilibrele microbiene la nivelul endometrului pot influența implantarea embrionară, succesul sarcinii și răspunsul la tratamentele de reproducere asistată. Evaluarea acestui ecosistem bacterian prin metode de secvențiere de nouă generație permite o abordare personalizată și predictivă a fertilității. Prezentul articol revizuiește dovezile actuale privind compoziția microbiotei endometriale și relevanța sa clinică în optimizarea tratamentului infertilității.

DMedic primar Medicină de Laborator, Director medical
eși multă vreme cavitatea uterină a fost considerată un mediu steril, dovezile recente oferite de tehnologia Next Generation Sequencing (NGS) au infirmat această paradigmă, revelând prezența unei microbiote endometriale distincte, cu roluri esențiale în reglarea răspunsului imun, în implantarea embrionară și în menținerea sarcinii.
Această descoperire a condus la redefinirea abordării diagnosticului în cazurile de infertilitate idiopatică, reprezentând până la 30% din totalul infertilităților la femei. În contextul medicinei personalizate, microbiomul endometrial a devenit un biomarker emergent cu potențial clinic, în special pentru pacientele incluse în programe de reproducere asistată (ART).
Conform unui studiu publicat recent în Life (2025), alterările compoziției microbiene din tractul genital superior pot influența succesul implantării embrionului, rata de sarcină și riscul de complicații obstetricale. Studiile au arătat că o compoziție dominată de Lactobacillus spp. este asociată cu rezultate ART semnificativ mai bune, în timp ce disbioza endometrială este frecvent întâlnită în cazurile de eșec repetat de implantare (RIF) și avorturi recurente.
Un microbiom endometrial sănătos este, în mod ideal, dominat de Lactobacillus crispatus, L. gasseri, L. jensenii și L. rhamnosus, în proporție de peste 80–90% din totalul bacteriilor identificate. Acești lactobacili contribuie la menținerea unui mediu uterin acid, la protecția împotriva
agenților patogeni și la reglarea inflamației locale. Dezechilibrul acestui ecosistem (disbioză) este asociat cu:
• Infertilitate idiopatică
• Eșec repetat de implantare (RIF)
• Avorturi spontane recurente
• Complicații obstetricale (ex. corioamnionită, naștere prematură)
Studiile din ultimii ani au demonstrat clar că microbiomul endometrial influențează direct implantarea embrionară, răspunsul imun local și succesul reproducerii asistate. Compoziția optimă a acestui ecosistem este dominată (>80%) de specii benefice din genul Lactobacillus, recunoscute pentru proprietățile lor antiinflamatoare și de barieră biologică.
În contrast, o abundență relativă scăzută a lactobacililor, asociată cu prezența unor specii patogene precum Gardnerella vaginalis, Atopobium vaginae, Prevotella spp., Streptococcus spp. sau Klebsiella pneumoniae, poate declanșa un răspuns inflamator cronic subclinic și poate altera receptivitatea endometrială.
Un aspect critic în succesul implantării embrionare este echilibrul imun între toleranța față de antigenul semi-alogen embrionar și apărarea împotriva agenților patogeni. Microbiomul endometrial modulează acest echilibru prin inducerea expresiei citokinelor antiinflamatorii (IL-10, TGF-β) și prin reglarea activității celulelor NK uterine, esențiale pentru remodelarea vasculară. În condiții de disbi-
Compoziție microbiom
Lactobacillus spp. > 80%, fără patogeni
Lactobacillus spp. < 80%, fără patogeni
Lactobacillus spp. < 80% + patogeni
Nicio bacterie detectată
oză, predomină citokinele proinflamatorii (IL-6, TNF-α), ceea ce duce la alterarea receptivității endometriale și creșterea riscului de respingere a embrionului.
Un studiu multicentric publicat în Fertility and Sterility (2024) a demonstrat că pacientele cu un microbiom endometrial dominat de lactobacili (>90%) au avut o rată de implantare de 60%, comparativ cu doar 23% în cazurile de disbioză. În plus, analiza retrospectivă a peste 400 de paciente FIV a confirmat că profilul microbian endometrial poate prezice rata de sarcină clinică independent de vârsta maternă sau calitatea embrionilor. Aceste date susțin rolul testării microbiomului endometrial ca parte integrantă a algoritmului de evaluare în infertilitatea idiopatică.
Evaluarea microbiotei endometriale prin teste NGS permite:
• Administrarea țintită de antibiotice sau probiotice – în funcție de speciile identificate;
• Personalizarea embriotransferului –sincronizat cu un mediu endometrial optim;
• Monitorizarea eficienței tratamentului – pentru pacientele cu istoric de eșec FIV sau avorturi spontane;
• Identificarea infecțiilor subclinice –deseori ignorate de testele uzuale de culturi.
Rezultatele testului care evaluează microbiota endometrială sunt clasificate astfel:
Interpretare clinică
Microbiom fiziologic, mediu favorabil implantării
Dezechilibru ușor – se recomandă probiotice
Disbioză semnificativă – posibilă indicație de tratament antibiotic + probiotice
Microbiom aparent steril – posibilă administrare de probiotice, fără antibiotic
Testele pentru evaluarea microbiotei endometriale sunt recomandate în special în următoarele situații:
• Infertilitate de cauză necunoscută
• Femeilor aflate în programe de fertilizare in vitro (FIV)
• Avorturi spontane recurente
• Suspiciuni de afecțiuni ale mediului endometrial
Pregătirea pacientei presupune întreruperea probioticelor cu cel puțin 7 zile înainte și evitarea recoltării în timpul menstruației sau imediat după proceduri ginecologice invazive. Concluzii
Microbiomul endometrial a trecut de la statutul de „curiozitate științifică“ la cel de biomarker clinic emergent, cu aplicații directe în diagnosticul și tratamentul infertilității. Astfel, microbiomul endometrial nu reprezintă doar un factor de mediu pasiv, ci un determinant activ al succesului reproductiv, cu implicații majore în medicina personalizată a infertilității.
În contextul medicinei personalizate, evaluarea microbiomului endometrial devine un instrument esențial în managementul infertilității și în creșterea șanselor de succes ale procedurilor de reproducere asistată. Interacțiunea microbiomului endometrial cu imunitatea locală
Un aspect critic în succesul implantării embrionare este echilibrul imun între toleranța față de antigenul semi-alogen embrionar și apărarea împotriva agenților patogeni. Microbiomul endometrial modulează acest echilibru prin inducerea expresiei citokinelor antiinflamatorii (IL-10, TGF-β) și prin reglarea activității celulelor NK uterine, esențiale pentru remodelarea vasculară. În condiții de disbioză, predomină citokinele proinflamatorii (IL-6, TNF-α), ceea ce duce la alterarea receptivității endometriale și creșterea riscului de respingere a embrionului. Axa microbiomului genital
Endometrul nu poate fi analizat izolat, ci ca parte a unei axe funcționale ce include microbiomul vaginal și cervical. Studiile comparative au arătat că microbiomul endometrial are o diversitate mai mare și o abundență relativ mai mică de lactobacili decât cel vaginal, dar modificările din tractul genital inferior se pot transmite ascendent. Astfel, vaginoza bacteriană cronică este un factor de risc pentru endometrite cronice și infertilitate, confirmând rolul continuumului microbian.
Dovezi clinice și date recente
Un studiu multicentric publicat în Fertility and Sterility (2024) a demonstrat că pacientele cu un microbiom endometrial dominat de lactobacili (>90%) au avut o rată de implantare de 60%, comparativ cu doar 23% în cazurile de disbioză. În plus, analiza retrospectivă a peste 400 de paciente FIV a confirmat că profilul microbian endometrial poate prezice rata de sarcină clinică independent de vârsta maternă sau calitatea embrionilor. Aceste date susțin rolul testării microbiomului endometrial ca parte integrantă a algoritmului de evaluare în infertilitatea idiopatică. Provocări metodologice
Deși tehnologia NGS a revoluționat analiza microbiomului, există multiple limitări:
• Contaminarea probelor în timpul recoltării transcervicale poate altera rezultatele;
• Lipsa standardizării între laboratoare în ceea ce privește metodele de extracție, secvențiere și analiză bioinformatică;
• Interpretarea clinică rămâne dificilă, întrucât nu există valori „cut-off“ universal acceptate pentru proporția optimă de lactobacili.
Aceste aspecte fac necesară corelarea rezultatelor microbiomice cu datele clinice și histologice, pentru a evita supradiagnosticarea.
Perspective terapeutice emergente În prezent, abordările terapeutice se concentrează pe:
• Antibioterapie personalizată: utilizarea de doxiciclină sau metronidazol pentru eradicarea speciilor patogene identificate;
• Probiotice vaginale/intrauterine: administrarea de Lactobacillus crispatus sau L. rhamnosus a demonstrat o creștere a ratei de implantare în trialuri pilot;
• Transplant de microbiotă vaginală (VMT): o strategie inovatoare, încă experimentală, dar cu rezultate promițătoare în restabilirea eubiozei;
• Terapia combinată (antibiotic + probiotic) urmată de embriotransfer într-un ciclu ulterior, pentru a maximiza șansele de succes.
Concluzii și direcții viitoare
Microbiomul endometrial a trecut de la statutul de „curiozitate științifică“ la cel de biomarker clinic emergent, cu aplicații directe în diagnosticul și tratamentul infertilității. Direcțiile viitoare includ:
• dezvoltarea unor teste standardizate NGS pentru uz clinic;
• definirea unor profiluri microbiene predictive pentru succesul ART;
• integrarea terapiilor probiotice personalizate în protocoalele de reproducere asistată.
Astfel, microbiomul endometrial nu reprezintă doar un factor de mediu pasiv, ci un determinant activ al succesului reproductiv, cu implicații majore în medicina personalizată a infertilității.
1. Moreno, I., et al. (2016). Endometrial microbiota composition is associated with reproductive outcome in infertile patients. Microbiome, 4(1), 23.
2. Moustakli, E., et al. (2025). Behind-the-Scenes Actors in Fertility: A Review of the Female Reproductive Tract Microbiome. Life, 15(4).
3. Gao, H., et al. (2025). Differential endometrial microbiota associated with recurrent implantation failure. Frontiers in Endocrinology.
4. Medina Ruiz, L., et al. (2025). Detection of microbial pathogens in endometrium alters immune status and reduces ART success. Human Reproduction.
5. VFkjbepDVL4J. Lactobacillus iners dominance associated with poor outcomes in FET cycles. Human Reproduction, 2025.
6. Moreno, I., & Simon, C. (2018). Relevance of assessing the uterine microbiota in infertility. Fertility and Sterility, 110(3), 337–343.
7. Cagnacci, A., et al. (2025). Uterine cervix role in microbiota and endometriosis pathogenesis. IJGO.
8. Ou, Y. (2025). Endometriosis-Associated Infertility: Multi-Omics Insights. Frontiers in Endocrinology.
9. Barrea, L., Verde, L., Annunziata, G., et al. (2025). Effectiveness of Medical Nutrition Therapy in the Management of Patients with Obesity and Endometriosis. Current Obesity Reports. https://doi.org/10.1007/s13679-025-00662-8
10. Papakonstantinou, A., Moustakli, E., Potiris, A. et al. (2025). Behind-the-Scenes Actors in Fertility. Life. https://pmc.ncbi.nlm.nih.gov/articles/PMC12193755/
11. Gao, H., Xiao, J., Liang, B., et al. (2025). Main differential endometrial microbiota associated with recurrent implantation failure. Frontiers in Endocrinology. https://doi.org/10.3389/fendo.2025.1504609
12. Medina Ruiz, L., Sarasa, J. et al. (2025). Detection of microbial pathogens in endometrium alters the endometrial immune status. Human Reproduction. https://academic.oup.com/humrep/article/ doi/10.1093/humrep/deaf097.303
13. Ou, Y. (2025). Endometriosis-Associated Infertility: Multi-Omics Insights into Pathogenesis. Frontiers in Endocrinology. https://www.frontiersin.org/articles/10.3389/fendo.2025.1613334
14. Cagnacci, A., Londero, A.P., Scovazzi, U. (2025). A role of the uterine cervix in the pathogenesis of adenomyosis and endometriosis. IJGO. https://doi.org/10.1002/ijgo.70287
15. Kobayashi, T., Okabe-Kinoshita, M. et al. (2025). Lactobacillus iners Dominance in the endometrium is Associated with Poor Pregnancy Outcomes. Human Reproduction. https://academic.oup.com/humrep/article-abstract/40/Supplement_1/deaf097.804


Biolog Pr. Oana Popescu,
Șef laborator, Institutul de Pneumoftiziologie „Marius Nasta“
Multă vreme plămânii au fost considerați organe sterile. Progresele din secvențierea de nouă generație și analiza probelor bronhoalveolare au arătat însă că și plămânii sănătoși adăpostesc o comunitate microbiană discretă. Această comunitate – numită microbiom pulmonar – include bacterii, fungi și virusuri (bacteriom, micobiom, virom) și este menținută în echilibru prin mecanisme naturale precum clearance-ul mucociliar, acțiunea macrofagelor și surfactantul alveolar.
În plămânii sănătoși diversitatea microbiană este moderată și relativ stabilă. Disbioza reprezintă modificarea compoziției normale a microbiomului (scăderea diversității, creșterea bacteriilor oportuniste sau schimbări funcționale) care poate apărea din cauza bolilor cronice, infecțiilor acute, utilizării prelungite de antibiotice sau expunerii la poluanți. Această disbioză este asociată cu afecțiuni precum boala pulmonară obstructivă cronică (BPOC – o boală caracterizată prin îngustarea progresivă a căilor respiratorii), astmul bronșic, bronșiectaziile (dilatarea anormală și inflamația bronhiilor), fibrozele pulmonare interstițiale, infecții acute severe sau chiar cancer pulmonar. În BPOC și astm s-a observat reducerea diversității și predominanța unor bacterii patogene care favorizează exacerbările, iar în fibroze sarcina bacteriană crescută este corelată cu progresia bolii.
Microbiomul intestinal și cel pulmonar comunică bidirecțional prin metaboliți și semnale imune, formând ceea ce cercetătorii numesc „axa intestin–plămân“. Metaboliți benefici precum SCFA (acizi grași cu lanț scurt, ex. acid butiric) produși de bacteriile intestinale pot modula răspunsul imun pulmonar și pot proteja împotriva inflamației sau astmului. În schimb, componente microbiene precum LPS (lipopolizaharidele din peretele bacteriilor Gram-negative) pot activa căi inflamatorii, cum este NF-κB (un factor nuclear ce stimulează expresia genelor pro-inflamatorii), ducând la stres oxidativ și leziuni pulmonare. De asemenea, bacteriile filamentare intestinale pot stimula un răspuns imun de tip Th17 (subset de limfocite T implicate în inflamație) în plămâni. La rândul său, microbiomul pulmonar poate influența flora intestinală, iar bolile respiratorii cronice sunt adesea asociate cu tulburări gastrointestinale precum boala inflamatorie intestinală (IBD) sau sindromul de intestin iritabil (IBS).
Profilarea microbiomului pulmonar ar putea deveni instrument de diagnostic și stratificare a riscului. Se explorează probiotice inhalatorii, antimicrobiene țintite, blocarea colonizării bacteriene și țintirea metaboliților sau citokinelor induse de microbiom. Toate sunt însă la stadiu experimental, necesitând infrastructură, cercetare și colaborare multidisciplinară.
Din laborator
în practica clinică
Această trecere de la cunoaștere la aplicare presupune centre de excelență. În România, Institutul Național de Pneu-
moftiziologie „Marius Nasta“ din București este reperul tradițional pentru bolile pulmonare. Institutul a fost inclus printre centrele românești participante la studiul publicat în Journal of Infection and Public Health (2024) privind capacitatea de diagnostic și tratament pentru infecțiile fungice invazive în Balcani. Aceste date confirmă că Institutul „Marius Nasta“, ca unitate de referință, dispune de infrastructura necesară pentru a integra noile direcții de cercetare și tratament, inclusiv în domeniul microbiomului pulmonar.
Microbiomul pulmonar nu mai este doar o curiozitate de laborator, ci un domeniu cu potențial real pentru diagnostic și tratament personalizat. În România, Institutul „Marius Nasta“ poate fi puntea între cercetarea de ultimă generație și practica medicală, transformând descoperirile despre microbiom în beneficii concrete pentru pacienți.
Referințe (selectiv)
1. Yu J, Li P, Yu Y, Ma Y, Zuo S, Chen H, Guo F, Sun Y, et al. A comprehensive insight of complex interplay of microbiota in pulmonary diseases. Discover Medicine. 2024.
2. [Critical Care] Composition and diversity of the pulmonary microbiome in acute respiratory distress syndrome: a systematic review. 2025.
3. Wang Y, Xiao J, Yang X, et al. Pulmonary microbiology and microbiota in adults with non-cystic fibrosis bronchiectasis: a systematic review and meta-analysis. Respiratory Research. 2025;26:77.
4. The Role of Lung Microbiome in Fibrotic Interstitial Lung Disease — A Systematic Review. Biomolecules. 2024.
5. Pantić N, Barać A, Mano V, et al. Mapping the path to excellence: Evaluation of the diagnostic and treatment tools for invasive fungal infections in the Balkans. J Infect Public Health. 2024;17:102493. doi:10.1016/j.jiph.2024.102493.




Prevalența tot mai mare a agenților patogeni transmiși prin sânge continuă să amenințe siguranța tratamentului transfuzional. În prezent, doar un număr mic de agenți patogeni sunt testați de rutină: VHB, VHC, HIV 1+2, HTLV 1+2, Treponema Palidum. Cu toate acestea, există mulți alții care pot afecta siguranța transfuzională. Lista agenților patogeni este lungă și în creștere și pentru a asigura securitatea transfuzională este nevoie de adăugarea continuă de noi teste specifice costisitoare sau de strategii ample de gestionare a riscurilor, pentru eliminarea sau inactivarea agenților patogeni. Astfel a apărut nevoia inactivării agenților patogeni cu spectru larg.

Strategiile actuale de creștere a securității transfuzionale sunt diverse. Există mai multe bariere pentru controlul siguranței transfuzionale, care se derulează pe întreg lanțul transfuzional începând încă de la recrutarea donatorilor:
În centrele de transfuzie: Proceduri bazate pe criterii riguroase de selecție a donatorului, dezinfectare a pielii și existența unei pungi de deviere, testele de screening viral de rutină al donărilor și screeningul bacterian de rutină al concentratelor de trombocite.
În spitale: Practici transfuzionale adecvate (Conceptul Patient Blood Management) pentru a minimiza tratamentul transfuzional administrat pacienților, etc.
Pentru a minimiza riscul au fost create proceduri de reducere a agenților patogeni prin deleucocitare sau inactivarea agenților patogeni.
Tehnologia de reducere a agenților
Reducerea agenților patogeni este recunoscută ca o strategie eficientă pentru a reduce riscul de infecții transmise prin transfuzie și potențial pentru a reduce riscul de boală grefă contra gazdă asoci-
ată transfuziei. Tehnologia cuprinde procese capabile să elimine agenți patogeni din sânge, de asemenea, să inactiveze leucocitele.
Tehnologia de reducere a agenților patogeni se bazează pe utilizarea unui agent inactivator capabil să distrugă un element funcțional țintit al agentului patogen.
Duce la deteriorarea ireversibilă a membranei agentului patogen, a învelișului sau a acizilor nucleici. Tehnologia de reducere a agenților patogeni produce modificări minime chimice sau biologice componentelor terapeutice. Tehnologia de reducere a agenților patogeni nu este implicată în funcționalitatea componentei sanguine (trombocite, plasmă și globule roșii).
Eficacitatea metodelor de reducere a agenților patogeni adecvate are ca scop:
Reducerea mare a riscului infecțios care este gradul de scădere a riscului de infecție cu transmitere transfuzională în urma utilizării PRT. Într-o estimare realizabilă, reducerea riscului prin reducerea agenților patogeni depinde de capacitatea tehnologiei, de datele epidemiologice din aria geografică în care se aplică, de dinamica agenților patogeni și de măsurile de siguranță utilizate. Capacitatea de reducere trebuie să ajungă la cel puțin 4-6 log10. Fiecare tehnologie de reducere a agenților patogeni este unică în ceea ce privește:
• Amploarea activității antimicrobiene.
• Agenți patogeni afectați.
• Eficacitatea împotriva încărcăturii virale ridicate.
• Gradul de reducere a infecțiozității.
• Eficacitatea componentelor sanguine.
• Posibile reacții adverse
Pentru viruși, este capacitatea metodelor de reducere a agenților patogeni de a preveni transmiterea în timpul stadiului viremic al donatorului.
Pentru bacterii este capacitatea metodelor de reducere a agenților patogeni de a inactiva la un nivel scăzut (10 - 100 UFC pe produs) de contaminare bacteriană, care poate fi de la purtător asimptomatic sau contaminant normal al florei de pe tegumente în timpul donării.
Pentru paraziți și leucocite este capacitatea PRT de a inactiva acești agenți în componentele sanguine recoltate de la persoane infectate sau în componente sanguine nedeleucocitate.
Riscul rezidual de infecție este riscul estimat ca o donare potențial infecțioasă să fie colectată în perioada de fereastră serologic negativă. Riscul rezidual este folosit pentru a monitoriza siguranța tratamentului transfuzional și pentru a evalua politicile în domeniu.
În cursul infecției, există zona care este acoperită de testare, care variază în funcție de sensibilitatea și specificitatea testului, dar cea mai periculoasă și importantă zonă de transmitere a infecției, este “perioada
de fereastră“, în care nici un test nu ar putea detecta nivelul foarte scăzut de agenți patogeni, care ar putea fi acoperit doar de metodele de reducere a agenților patogeni.
Mecanismul de acțiune al metodelor de reducere a agenților patogeni
Reacție fotosensibilă (fotodinamică) PRT utilizează fotosensibilizatori, (moleculele absorb o anumită energie luminoasă), induc o stare de activare a fotosensibilizatorului. Apoi apar două tipuri de reacții:
Reacții de tip I: În absența oxigenului - implică transferul direct de electroni între fotosensibilizator și țintă (ADN), ceea ce duce la formarea radicalilor ionici, care dăunează grav acizilor nucleici și reduc încărcătura agentului patogen.
Reacții de tip II: În prezența oxigenului - duce la formarea de molecule de oxigen, foarte activate și care pot reacționa cu moleculele de ADN, ceea ce duce la reducerea încărcăturii de agenți patogeni.
Reacție nefotosensibilă (fotochimică) - este o altă clasă de agenți de inactivare, care provoacă legături încrucișate covalente ireversibile în acizii nucleici, constând în inactivarea chimică, care impiedică transcripția, și proliferarea agentului patogen. Principalii agenți PRT utilizați în prezent sunt: detergent solvent, Albastru de metilen, Amotosalen și Riboflavină.
I. Reacție fotosensibilă (fotodinamică) cu: Albastru de metilen (MB), UVC (lumină ultravioletă cu unde scurte), Amotosalen, Riboflavină (vitamina B2)
II. Reacție nefotosensibilă (fotochimică) cu: detergent cu solvenți (SD), Nanofiltrare, FRALE (Frangible Anchor Linker Effectors = Efectori de ancorare frangibili)
Albastru de metilen (MB) - procedură fotodinamică de reducere a agenților patogeni folosind MB și lumină vizibilă, este eficientă numai în plasmă. Prin reacție, se poate intercala în acizi nucleici sau se poate asocia cu helixul exterior și, după iluminarea cu lumină vizibilă, se poate genera oxigen care distruge acizii nucleici patogeni. Este mai eficient împotriva bacteriilor Gram-pozitive decât Gram-negative. Nu inactivează agenții patogeni intracelulari. (Nu poate pătrunde în membrana celulară, datorită sarcinii sale pozitive și caracterului hidrofil).
MB rămâne localizat la proteinele și lipidele membranei externe, ceea ce duce la leziuni celulare de fotoactivare.
MB este comercializat în sistemul Theraflex MB Plasma (Macopharma).
Se trece plasma printr-un filtru pentru a reduce reziduurile, apoi dizolvă
pastila MB în plasmă, amestecul este iluminat cu lumină vizibilă (590 - 630 nm), apoi este trecut prin filtrul de eliminare pentru a șterge componentele din MB. UVC (lumină ultravioletă cu unde scurte) - Procesul se bazează doar pe aplicarea luminii ultraviolete cu unde scurte (UVC; interval de lungimi de undă 200-280 nm) ca sursă de inactivare a agentului patogen. Componentele sanguine trebuie trecute prin dispozitive speciale, pentru a forma straturi subtiri care pot fi penetrate de UVC.
Agitația intensă a fost combinată cu lumina pentru a se asigura că componente sanguine sunt expuse omogen. O astfel de metodă este cea mai eficientă în mediu relativ transparent (lungime de undă scurtă a luminii), astfel utilizată pentru a inactiva componentele trombocitare, plasma și concentratele de proteine plasmatice.
Amotosalen - Sistemul Intercept (Cerus) utilizează Psoralen (Amotosalen), pentru a inactiva agenții patogeni în prezența UVA. Este folosit pentru a trata componentele de plasmă și trombocite, apoi urmat de îndepărtarea Amotosalenei și a produselor sale de descompunere printr-o absorbție a compusului filtrant.
Se intercalează reversibil în structura dublă elicoidală a acizilor nucleici, deoarece poartă o sarcină cationică (moleculele de ADN sunt încărcate negativ).
După activarea UVA, se formează legături încrucișate covalente atât în ARN, cât și în ADN. Are activitate împotriva unei varietăți de viruși, atât bacterii Gram-negative, cât și Gram-pozitive, precum și a unor paraziți și inactivează leucocitele reziduale. Amotosalen pătrunde în membrana celulară (datorită proprietăților solubile în apă), permițând astfel să acționeze asupra acizilor nucleici intracelulari ai agenților patogeni. Nu inactivează virusurile neînvelite; hepatita A (HAV), parvovirusul B19 și, de asemenea, spori bacterieni. Nu este utilizat pe eritrocite, deoarece hemoglobina absoarbe UVA și împiedică activarea Psoralenului. Riboflavin (vitamin B2) - Riboflavina este agentul fotosensibilizant din PRT Mirasol (Terumo BCT, SUA), utilizat pentru componente de plasmă și trombocite. Riboflavina este un nutrient natural, toxicitatea este minimă și eliminarea sa înainte de utilizarea clinică nu este necesară. Mecanismul fotochimic al Riboflavinei este mediat de reacții la activarea luminii UV, se leagă de ADN-ul
și ARN-ul microbian, le oxidează prin reacția de transfer direct de electroni și inactivează replicarea ADN-ului patogen. Mirasol este eficient împotriva bacteriilor Gram-negative, unele bacterii Gram pozitive, precum și a unor paraziți. Sporii bacterieni sunt rezistenți la tratarea cu această tehnologie. Inactivează virușii neînveliți; VHA (reducere de 1,8 log10), parvovirusul uman B19 (reducere de >5,0 log10). Inactivează leucocitele reziduale; este utilizat combinat cu deleucocitare pentru a preveni CMV posttransfuzional.
Detergent cu solvenți (SD) - Folosește un agent detergent neionic pentru a perturba membrana lipidică a virușilor înveliți, lizând astfel membrana celulară și învelișul viral, provoacă deteriorarea și perturbarea funcționalității virale. SD are aplicabilitate limitată numai pentru tratarea componentelor plasmatice. SD nu este utilizat pentru tratarea componentelor celulare (ar distruge stratul lipidic celular).
SD este cel mai utilizat și cel mai bine validat PRT în prezent, singura tehnologie actuală utilizată pentru inactivarea virală a poolurilor de plasmă pentru fracționare.
Îndepărtarea SD necesită extracție de ulei și cromatografie.
Este ineficient împotriva virusurilor neînvelite precum HAV, hepatita E și parvovirusul B19.
Nanofiltrare - Conceptul privind utilizarea acestor filtre se bazează pe principiul de excludere a dimensiunii; utilizat la reducerea agenților patogeni cu dimensiunea porilor de 15-40 nm pentru a elimina agenții patogeni.
Este aplicabil numai plasmei, deoarece datorită dimensiunii mici a porilor, trombocitele și celulele roșii ar fi, de asemenea, sechestrate.
Deși există o recuperare de 90-95% a activității proteinelor plasmatice; cu toate acestea, factorul von Willebrand cu greutate moleculară mare este eliminat de filtrele utilizate pentru a elimina virusul.
FRALE (Frangible Anchor Linker Effectors) - efectori frangibili de ancorare utilizează agentul alchilant independent de lumină S-303 (Cerus). Există o
tehnologie pentru tratamentul concentratelor de eritrocite care este în prezent în curs de dezvoltare.
Acționează ca agent antiviral, bacterian și parazitar, prin intercalarea în structura acidului nucleic a ARN-ului și ADN-ului.
Sistemul FRALE constă în incubarea concentratului de celule roșii deleucitat cu glutation și S-303. Soluția de tratament și produsele de descompunere sunt îndepărtate prin centrifugare înainte de stocarea finală.
Metodele de reducere a agenților patogeni oferă o nouă abordare pentru a crește siguranța transfuzionale. Prezintă mai multe avantaje:
• Activitate cu spectru larg împotriva unei mari diversități de agenți patogeni.
• Eficient împotriva virușilor înveliți și neînveliți, bacteriilor Gram-pozitive și Gram-negative, inclusiv unii agenți formatori de spori, paraziți, fungi.
• Oferă ≥ 4 log de inactivare pentru majoritatea agenților patogeni relevanți clinic (nu există niciun proces de inactivare a agenților patogeni pentru care s-a demonstrat că elimină toți agenții patogeni).
așteptată a reducerii agenților patogeni:
• Eliminarea transmiterii infecției,
• Reducerea riscului rezidual al perioadei de infecție virală,
• Inactivarea agenților comuni (CMV, malarie) sau emergenți (dengue, Babesia, virusul Zika) sau altă infecție transmisă prin transfuzie care nu este testată uzual sau nu există în prezent,
• Eliminarea amenințărilor necunoscute și a noilor agenți care apar.
Introducerea PRT - ar putea elimina transmiterea infecțiilor virale, bacteriene și parazitare, în special prin concentratele de trombocite.
• ar înlătura screeningul bacterian (economisire de timp și costuri) sau iradierea gamma necesară în componentele trombocitare tratate PR.
• ar permite creșterea duratei de valabilitate a trombocitelor de la 5 la 7 zile. Deci: rebuturi reduse de trombocite și disponibilitate sporită.
Inactivarea simultană a leucocitelor
reziduale din componentele sanguine poate reduce complicațiile (aloimunizare, boală grefă versus gazdă, microhimerism și modulare imună legată de transfuzii).
Aceste tehnici adaugă substanțe chimice fotoactive la un produs biologic (plasmă sau trombocite) și expune amestecul la lumină ultravioletă.
Dincolo de deteriorarea țintită a materialului genetic al unui agent patogen, pot apărea și diferite grade secundare de deteriorare și toxicitate a proteinelor și membranei celulare, ceea ce duce la o degradare a calității componentelor din sânge.
S-a observat un impact negativ asupra calității din cauza diluției, pierderii activității și reducerii volumului produsului de componente sanguine.
Studiile au raportat că concentrațiile factorilor de coagulare au fost cu 20-35% mai mici în plasma tratată cu TIP redusa de agenti patogen și există o pierdere de 10-15% a randamentului trombocitar după tratamentul trombocitar.
Evenimentele adverse legate de toxicitatea asociată agenților adăugați (reacții imune, toxicitate sau chiar carcinogenitate).
Dezvoltarea unui PRT adecvat pentru sânge și concentrate eritrocitare, care sunt mult mai dificile decât trombocitele și plasma datorită absorbției luminii de către hemoglobină și a duratei de valabilitate mai lungi a concentratelor eritrocitare.
Provocarea este de a identifica procesele care vor funcționa în componentele sanguine opace.
Majoritatea PRT-urilor actuale sunt ineficiente împotriva prionilor, sporilor bacterieni și virusurilor nelipidice.
Implementarea PRT în componentele sanguine ar trebui să fie echilibrată între costurile instituționale și sociale, deoarece costul componentelor tratate cu PRT crește semnificativ.
Crește riscul apariției noilor agenți patogeni emergenti, presiunea costurilor crește, însă dorința de a menține pacienții în siguranță… implică soluții optime.








Pharmacogenetic tests for DPYD and UGT1A1 gene mutations are used in oncology to predict the response to chemotherapy treatment and tailor drug doses in order to prevent possible severe side effects, based on each patient individual genetic profile. DPYD mutations testing identifies genetic variants that affect decomposition of fluoropyrimidines (for example, 5-FU or capecitabine), while UGT1A1 mutation testing identifies genetic variants that could affect irinotecan metabolism. These molecular tests allow oncologists to identify patients at higher risk for toxicities and adjust their treatment accordingly, for improving patient safety and better treatment outcomes.

Testele farmacogenetice pentru mutațiile genelor DPYD și UGT1A1 sunt utilizate în oncologie pentru a prezice răspunsul la tratamentul chimioterapeutic și pentru a adapta dozele terapeutice cu scopul de a preveni posibilele efecte secundare severe, pe baza profilului genetic individual al fiecărui pacient. Testarea mutațiilor DPYD identifică variante genetice care afectează descompunerea fluoropirimidinelor (de exemplu, 5-FU sau capecitabină), în timp ce testarea mutațiilor UGT1A1 identifică variante genetice care ar putea afecta metabolismul irinotecanului. Aceste teste moleculare permit medicilor specialisti oncologi să identifice pacienții cu risc crescut de toxicitate și să ajusteze tratamentul în consecință, pentru îmbunătățirea siguranței pacientului și rezultate mai bune ale tratamentului.
Fluoropirimidinele și irinotecanul sunt utilizate în mod curent în tratamentul mai multor tumori solide, în special tumori ale tractului gastrointestinal, mamare sau localizate la nivelul capului și gâtului. Toxicitatea asociată tratamentului este un factor important, pentru că
pot apărea efecte secundare severe și/sau întreruperea tratamentului. Gena DPYD codifică enzima „dihidropirimidin dehidrogenaza“ (DPD), implicată în metabolismul fluoropirimidinei (ca de exemplu, 5-Fluorouracil, prescurtat 5-FU). În timp ce deficienţa completă de enzimă DPD este rară, purtătorii heterozigoţi sunt mult mai frecvent întâlniţi (la nivel fenotipic se manifestă prin metabolizare intermediară a DPD), cu o frecvenţă estimată la 3–5% în populația europeană și 8% în cele afro-americane. Similar, gena UGT1A1 codifică pentru „UDP glucuronoziltransferaza1A1“ (UGT1A1), enzimă implicată în metabolismul irinotecanului. Frecvenţa în populație a variantei UGT1A1 asociată cu rata slabă de metabolizare a acestuia este estimată la 10%–11%.
Enzima DPD este implicată în metabolizarea bazelor pirimidinice U (uracil) și T (timină), astfel încât unul dintre rolurile sale este catabolizarea agenţilor chimioterapici pe bază de pirimidină, cum sunt 5-FU și capecitabină (astfel că la un pacient oncologic care prezintă varianta normală, WT (wild type), a genei DPYD, se așteaptă ca rata de detoxifiere a acestor chimioterapici să fie de cca. 80%). Persoanele care au cel puțin o alelă DPYD care produce o enzimă deficitară nu vor putea metaboliza normal fluorouracilul. La administrarea 5-FU, activitatea scăzută a enzimei DPD este asociată cu mielo-
supresie severă, diaree severă, neurotoxicitate, uneori putând fi letală.
Agenția Europeană pentru Medicamente (EMA) subliniază faptul că pacienții cu deficit parțial sau complet de DPD prezintă un risc crescut de toxicitate severă în timpul tratamentului cu fluoropirimidine, astfel recomandă testarea fenotipului și/sau a genotipului înainte de începerea tratamentului. Acest tratament este contraindicat la pacienţii cu deficit complet de DPD și se va administra cu precauţie, într-o doză iniţială redusă, la cei cu deficit parțial de enzimă. Ca opţiune de testare, deși există și alte metode pentru evaluarea activității DPD (precum evaluarea nivelului plasmatic de uracil), cel mai frecvent se apelează la genotiparea DPYD, fiind cea mai sensibilă și validată clinic, realizată fie prin metode bazate pe tehnologia PCR, fie prin secvențiere. Există mai multe polimorfisme genice care pot influența activitatea DPD, însă cel mai frecvent investigate sunt: DPYD c.1905+1G>A, c.1679T>G, c.2846A>T, c.1129–5923C>G. c.1236G>A. O abordare bazată pe genotipare constă în testarea SNP-urilor (single nucleotide polymorphisms) în gena DPYD, având acurateţe înaltă, rezultate clare și testul nefiind influenţat de factori de mediu, comparativ cu testări bazate pe fenotip. În plus, testul este ușor de implementat în laboratoarele de genetică uzuale.
Cea mai frecventă mutaţie în gena DPYD, localizată în cromozomul 1 al genei, este DPYD*2A (IVS14+1G>A;




c.1905+1G>A), întâlnită la aproximativ 50% din cazurile cu deficit enzimatic DPD (0.91%-1.8% în populaţia caucaziană). Genotipul homozigot se manifestă fenotipic prin deficit enzimatic complet, iar heterozigotul prin deficit parţial.
Alte variante testate, mai puțin frecvente, sunt DPYD*9B, DPYD*13 și HapB3. Primul polimorfism genic descris de Van Kuilenburg și colab. a fost DPYD c.2846A>T (cunoscută ca D949V). Acest polimorfism este întâlnit la 0.1-1.1% din populaţie și conduce la scăderea activităţii enzimatice cu peste 50% la indivizii homozigoţi, respectiv cca. 25% la cei heterozigoţi, astfel că efectul său nu este comparabil cu DPYD*2A, la care expresia homozigotă se asociază cu nefunctionalitatea completă a enzimei.
Varianta DPYD*13 (DPYD c.1679T>G; I560S) este o variantă rară (0.07-0.1% la populaţia caucaziană). Indivizii homozigoţi pentru această variantă înregistrează o scădere de cca. 75% a activității enzimei DPD, comparativ cu cei “wild-type“.
Polimorfismul c.1236G>A (E412E) de la nivelul exonului 11 este o variantă sinonimă, în linkage, cu variantele: c.483+18G>A, c.680+139G>A, c.959-51T>G, c.1129-5923C>G; astfel, aceste variante sunt cunoscute ca “haplotipul B3“ (HapB3). Polimorfismul intronic c.11295923C>G, raportat la 2.6-6.3%, conduce la splicing aberant și afectează activitatea enzimei DPD. De asemenea, la purtătorii c.1236G>A/HapB3 s-a observat reducerea activității enzimatice a DPD, dar nu
complet (la heterozigoţi se recomandă reducerea dozei terapeutice cu 25%).
Irinotecanul este un tratament aprobat încă din 1996 de către FDA (Food and Drug Administration), dar cu toate acestea rămâne un tratament esenţial în cancerul colorectal, pancreatic sau gastroesofagian. Polimorfismul UGT1A1 reprezintă unul dintre principalii factori de risc ai toxicității la irinotecan. În 2005 a fost revizuit prospectul medicamentului pentru a indica faptul că pacienții cu genotip homozigot UGT1A1*28 ar trebui să primească o doză redusă de irinotecan. Cu toate acestea, testarea UGT1A1*28 nu este utilizată în mod curent în clinică, iar motivele includ lipsa unui consens în ghidurile internaţionale pe această temă. Utilizarea sa a crescut în ultimii ani, în special în combinaţie cu alte terapii în tratamentul adjuvant al cancerului pancreatic. Numeroase studii susțin faptul că genotipul UGT1A1 este un biomarker validat care aduce informaţii cu privire la toxicitatea irinotecanului. Cele mai frecvent studiate variante UGT1A1 sunt UGT1A1*28 și UGT1A1*6, și mai recent se adună dovezi pentru un al treilea polimorfism, UGT1A1*93. Pacienții care metabolizează lent UGT1A1 - pacienții cu genotipuri homozigote sau heterozigote compuse, cum ar fi UGT1A1*28/*28 sau *28/*6 - prezintă o incidență crescută a efectelor adverse severe la doze standard de irinotecan (prezentând un risc de
patru - cinci ori mai crescut de neutropenie severă și de două ori mai crescut de diaree severă).
Anul acesta, ASCO (Societatea Americană de Oncologie Clinică) a pus în lumină testarea farmacogenetică în scopul reducerii toxicităţii asociate tratamentelor oncologice. Printre testările recomandate se numără genotiparea UGT1A1 pentru toţi pacienţii implicaţi și ajustarea dozei de irinotecan în consecinţă, pentru evitarea efectelor adverse severe asociate tratamentului și limitarea toxicităţii de grad 3-4.
Numeroase studii au arătat că genotiparea DPYD pentru pacienţii oncologici poate îmbunătăți semnificativ siguranța acestora, prin scăderea cazurilor de toxicitate severă asociată tratamentului. Similar, mai multe studii au arătat că strategiile de dozare ghidate de genotipare UGT1A1 pot atenua riscul de toxicitate, menținând în același timp nivelurile sistemice ale agentului terapeutic. În concluzie, testările genetice permit identificarea pacienților cu risc crescut de toxicitate severă și să ajusteze tratamentul în consecință, pentru îmbunătățirea siguranței pacientului și rezultate mai bune ale tratamentului.
Referinţe:
1. Laboratory Corporation of America. Directory of Services and Interpretive Guide. DPD 5-Fluorouracil Toxicity; 2010.
2. www.ema.europa.eu/en/news/emarecommendations-dpd-testing-priortreatment-fluorouracil-capecitabinetegafur-flucytosine
3. https://pmc.ncbi.nlm.nih.gov/articles/ PMC11993294/
4. https://pmc.ncbi.nlm.nih.gov/articles/ PMC9014453/
5. www.sciencedirect.com/science/ article/pii/S0923753419353773
6. https://ascopubs.org/doi/10.1200/ OP.21.00624
7. Megan Muldoon & colab. – Real ‐world implementation of DPYD and UGT1A1 pharmacogenetic testing in a community‐based cancer center; Clin Transl Sci.; 2024





















Sistem modular de procesare a probelor LA-60, Dirui
• Module de intrare și ieșire: 700 de probe/oră
• Reduce eficient TAT în 3 tipuri: Tip I, Tip U, Tip L
• Suportă conectarea cu analizatoare DIRUI:
• Analizator chimic automat CS-2000/CS-2000i
• Analizor imunologic cu chemiluminiscență CM-320/CM-320i
• Analizor hematologic BF-7200/BF-7200Plus
• Analizor de coagulare BCA-3000

Toxinometru pentru analiza beta-glucanului
LIMUSAVE MT-7500, Fuji Wako
• 10 poziții de măsurare, extensibile până la 30 prin utilizarea a două module de extensie LIMUSAVE MT-7500
• Acces aleatoriu la pozițiile de măsurare
• Măsurarea începe automat după plasarea probei(e)
• Calibrare prin citirea unui card de calibrare prin cod de bare
• Compatibilitate LIMS
• Timp de măsurare maxim 90 de minute
• Procedura simplă de testare fără a utiliza un banc de lucru cu flux laminar

Sistem automat de preparare a probelor MrLH-96, Genemind
• Stația de lucru automată este concepută pentru automatizarea eficientă a extracției de acid de mare capacitate, a pregătirii bibliotecilor NGS și a procedurii de procesare a lichidelor de laborator.

Avantaje:
Sistemul de stivuire a consumabilelor special conceput este capabil să garanteze automatizarea completă fără intervenția oamenilor în cadrul stației.
• Accesoriile de oscilație cu temperatură controlată Inheco nu numai că asigură stabilitatea oscilației, dar au și acuratețea controlului temperaturii în intervalul 4~70°C, care se potrivește perfect cu procesul de captare a hibridizării NGS.
• Sistemul de proiectare a scenariilor poate fi utilizat pentru a explora aplicații multiple și pentru a personaliza proiectarea fluxului de lucru.
Foarte automatizat, necesită mai puțină forță de muncă. Poziția a 24 de plăci cu funcție de stivuire a plăcilor. Nu este nevoie să adăugați reactivi și consumabile în timpul procesului de secvențiere a ADN-ului, realizându-se complet automatizat. Scanarea automată a codurilor, pre-setarea datelor în baza de date software pentru a citi direct în sistemul LIMS. Compatibil cu modulul de control al temperaturii Inheco Control precis al temperaturii cu instrumentul PCR Inheco și modulul de oscilație cu temperatură controlată.
Sistem complet automat cu microscopie pentru analiza fecalelor IMPROVE 2000R, Sciendox
• Echipamentul este dotat cu un sac de colectare a deșeurilor în condiții de siguranță, fără ca personalul laboratorului să intre în contact direct cu reziduurile de materii fecale.

• Stocare date: 100.000 de rezultate.
• Capacitate de 60 de teste/h.
• Funcții: prelucrarea probelor; examen morfologic; testare imunologică, depozitarea în siguranță a deșeurilor biologice;
• Principiu de prelucrare a probelor: Sciendoxtehnologie de filtrare completă;
• Modalitate de prelucrare: setări automate și setări personalizate;
• Principiu de examinare morfologică: examinare la microscop;

• Principiu de testare imunologică: test imunologic coloidal;
• Meniu testare imunologică: FOB, Helicobacter Pylori, Rotavirus, Adenovirus, Transferină rapidă, Transferină și hemoglobină;
• Încărcare de până la 20 de probe;
• Evacuare gaze reziduale: filtrare multiplă (îndeplinește standardele de filtrare HEPA);
• Evacuare lichide reziduale: automată în container sau prin țeava de scurgere;
• Reziduuri: sortare automată în saci;
• Display: PC incorporate cu LCD color, tastatură și mouse;
• Imprimantă compatibilă conectată prin USB;

Analizor hematologie VSH iSED, Alcor
• Analizor automat VSH;
• Rezultate în 20 de secunde;
• Eșantion 100µl;
• Funcționează în mod direct de pe tuburi EDTA primare;
• Prelevarea de probe se efectuează din recipient închis;
• Complet automat;
• Acces aleator;
• Capacitate de până la 180 teste/oră.
Proton Impex 2000 SRL
Str. Ionel Teodoreanu 5, Voluntari, Ilfov
Tel/Fax: 021.224.52.81;
E-mail: office@proton.com.ro
Website: http://proton.com.ro
Infecțiile pielii și ale țesuturilor moi reprezintă o categorie clinică diversă, cu etiologii multiple, care includ atât microorganisme unicelulare (monomicrobiene), cât și comunități polimicrobiene. Aceste infecții includ ulcere cronice, răni, infecții post chirurgicale, celulită, fasceită necrozantă – constituie un important motiv de morbiditate și mortalitate, precum și de consum de resurse medicale.


BDr. Rodica Stela Lumpan
Medic specialist Microbiologie medicală – Spitalul de Pediatrie Ploiești
Dr. Constantin Alexandru Albu
Medic specialist Microbiologie medicală - Direcția Complex Multifuncțional Caraiman
iofilmul reprezintă o comunitate de microorganisme aderente pe o suprafață, învelite într-o matrice auto-produsă de substanțe polimerice extracelulare (EPS – extracellular polymeric substances), având rol esențial în cronicizarea infecțiilor, rezistența la tratamentul cu antimicrobiene și apariția complicațiilor. Gondil & Subhadra (2023).
Biofilmul și etiologia polimicrobiană complică diagnosticarea și tratamentul, prelungesc durata vindecării, cresc riscul de complicaţii locale și sistemice, și contribuie la rezistenţa la antimicrobiene.
Această sumarizare își propune să sintetizeze date recente privind rolul biofilmului și al polimicrobianismului în infecţiile pielii și ţesuturilor moi cu accent pe complicații și pe metode moderne de diagnostic.
Biofilmul: caracteristici relevante
Biofilmul este o structură microbiană tridimensională, caracterizată prin:
• Aderență inițială a microorganismelor pe suprafețe vii (epidermice, dermice, ţesut conjunctiv) sau superficii inerte.
• Proliferare și formarea microcoloniilor.
• Maturarea biofilmului, cu producere de matrice extracelulară care protejează microorganismele împotriva răspunsului imun local și a tratamentelor antimicrobiene.
• Dispersie sau eliberarea microorganismelor care pot coloniza alte zone (Kalkanci & Güzel Tunçcan, 2019)
Structura EPS constă în polizaharide, ADN extracelular, proteine, lipide și alți compuși, care conferă biofilmului proprietăți de toleranță (nu doar rezistență) față de antibiotice și față de presiunea imună. (Kalkanci & Güzel Tunçcan, 2019)
Infecțiile polimicrobiene ale pielii și țesuturilor moi (IPȚM)
Prevalență și contexte clinice
Infecțiile polimicrobiene sunt frecvent întâlnite în situații de rănire cronică (ulcere diabetice, escare, răni de presiune), arsuri, infecții persistente post-chirurgicale. În aceste cazuri, plaga poate fi colonizată simultan de bacterii aerobe, anaerobe și, uneori, fungi. (Dowd et al., 2008)
Un studiu recent asupra ulcerelor diabetice cronice a demonstrat că toate mostrele examinate au fost po-limicrobiene și prezentau biofilm vizibil prin metode microscopice speciale (SEM, FISH), colorația Gram evidențiind biofilmul în doar două treimi din cazurile pozitive prin metode superioare. Microorganismele frecvent identificate au inclus Pseudomonas aeruginosa, anaerobi precum Finegoldia magna, dar și altele. (Dilhari et al., 2020)
Interacțiuni între specii
Interacțiunile între bacterii (bacterie–bacterie) sau bacterie–fungi într-un biofilm polimicrobian pot fi:
• Sinergice: una dintre specii stimulează virulența sau creșterea celeilalte (ex: Candida albicans favorizează proliferarea și formarea biofilmului Staphylococcus aureus). (Mariani & Galvan, 2023)
• Antagoniste: competiția pentru resurse, inhibiție directă sau prin metabolit. (Mariani & Galvan, 2023)
• Cooperante metabolic: unele specii oferă molecule necesare altora, sau permit supraviețuirea în medii defavorabile (ex: anaerobi în rănile diabetice).(Dowd et al., 2008)
Aceste interacțiuni afectează nu doar evoluția clinică (vindecare întârziată, recurență), dar și răspunsul la tratament antimicrobian. (Mariani & Galvan, 2023)
Rolul biofilmului
și al polimicrobianismului
în complicații
Numărul și severitatea complicațiilor IPȚM cresc în prezența biofilmului polimicrobian. Printre acestea:
1. Vindecare întârziată/cronicizare. Biofilmul menține un produs inflamator persistent și protejează microorganismele de fagocitoză și de antibiotice, ceea ce împiedică progresia normală a reparării ti-sulare. (Wolcott et al., 2013a).
2. Resistență și toleranță la antibiotice. Microorganismele într-un biofilm pot avea toleranță crescută (nu neapărat numai “rezistență“ genetică) la concentrații de antibiotic care ar fi suficiente pentru a eradica infecția. EPS joacă rol protector, și gradientele de oxigen/nutrienți din biofilm pot induce fe-notipuri lente de creștere care sunt mai puțin susceptible (Wolcott et al., 2013a).
3. Risc de infecții recurente sau persistente. Chiar după tratamente antimicrobiene aparent adecvate, microorganismele reziduale în biofilm pot recoloniza plaga, provocând reapariția infecției. De exemplu, studiul “Suture associated biofilm“ implică faptul că eliminarea corpului străin (firului de sutură) a fost necesară pentru vindecare. (Kathju et al., 2009a).
4. Complicații sistemice sau locale severe Deși majoritatea datelor din literatură se referă la complicații locale (necroză, extindere prin contiguitate, osteomielită), prezența biofilmului poate favoriza diseminarea sistemică cu microorganisme oportuniste sau patogene. (Mariani & Galvan, 2023).
Perspective moderne de diagnostic
Diagnosticul infecțiilor pielii și țesuturilor moi complicate de biofilm și etiologie polimicrobiană ridică provocări semnificative, întrucât metodele clasice bazate pe cultură sau examen clinic sunt adesea insuficiente. Iată principalele abordări moderne:
Metodă Avantaje
Cultura aerobă + anaerobă
Microscopie (SEM, microscopie confocală cu laser – CLSM)
FISH (fluorescent in situ hybridization)
Metode moleculare / metagenomice: PCR, secvențiere (shotgun, 16S rRNA, ITS pentru fungi), etc.
Examen histologic / colorări speciale
Indicatori clinici și tera-peutici
Permite identificarea și testarea sensibilității antimicrobiene a unor specii cultivabile.
Vizualizarea microcolonii, EPS, distribuție spațială a microorganismelor; identificare directă a biofilmului. (Kathju et al., 2009b)
Permite detectarea speciilor în contextul biofilmului, vizualizarea poziției relative, distribuției. (Dilhari et al., 2020)
Detectează specii dificil de cultivat, oferă o imagine mai completă a diversității microbiene; posibil să identifice și gene de rezistență. Exemplu: bTEFAP (entire microbial community sequencing) în ulcer diabetic. (Dowd et al., 2008)
Vizualizarea structurii tisulare, inflamației, microcolonii şi EPS după colorări (Gram, PAS etc.).
Eșec terapeutic repetat, recurența, caracteristicile clinice (exudat purulent, septizare, mi-ros, necroză, margini friabile) pot sugera bio-film.
(Percival, 2017)
1. Microscopie (SEM / CLSM) și coloraţii care să evidențieze microcolonii și EPS
• SEM (Scanning Electron Microscopy) reprezintă o metodă de microscopie electronică care furnizează imagini de mare rezoluție ale suprafeţelor, permiţând observarea detaliilor structurale exterioare ale microcoloniilor, ale matricei exopolimerice (EPS), și ale relațiilor spațiale între mi-croorganisme și structurile tisulare.
• CLSM (Confocal Laser Scanning Microscopy) este o tehnică de microscopie fluorescentă care permite obţinerea de imagini tridimensionale (prin scanare în profunzime) ale biofilmului, vizualizând simultan microorganismele și componentele EPS, în combinație cu coloranți fluorescenti specifici.
• Colorații (Gram, HE–Hematoxilin & Eozină, coloranți specifici EPS sau pentru detectarea exopolimerilor) sunt tehnici histologice/microscopice ce permit evidențierea microcoloniei, și în unele cazuri, a matricei exopolimerice.
2. FISH sau sondă moleculară (în special PNA FISH) pentru speciile suspecte
• FISH (Hybridizarea cu fluorescență in situ): metodă moleculară de vizualizare care folo-sește sonde ADN sau ARN marcate fluorescent, care hibridizează cu secvenţe complementare din celulele microbiene într o secţiune tisulară, per-
Limitări
Nu detectează toate speciile, nu oferă informații despre EPS/biofilm, subevaluare a microorganismelor din biofilm.(Wolcott et al., 2013b)
Necesită prelevare de țesut, echipamente specializate, interpretare calificată; nu întotdeauna disponibil în clinică.
Costuri, nevoie de sonda specifică, sensibilitate variabilă.
Nu indică întotdeauna dacă specia este activă sau implicată patogenic; costuri și disponibilitate; pot detecta și contaminante; interpretare bioinformatică necesară.
Inflamația / reacția imună pot varia; EPS nu întotdeauna vizibil în toate secțiunile; biopsia poate fi invazivă.
Lipsește specificitatea; pot fi subtile sau absente la pacienți imunocompromiși.
mitând identificarea și localizarea speciilor într o structură biofilmică.
• PNA FISH (Peptide Nucleic Acid FISH): o variantă în care se folosesc sonde de peptide nucleice, care sunt mai stabile, mai eficiente în penetrare, mai rapide și cu mai puţin fundal nonspecific decât sondele ADN obișnuite.
3. Secvențiere/metagenomică (inclusiv metagenomic next generation sequencing‒mNGS)
• Secvențiere metagenomică: tehnică de biologie moleculară care permite analizarea ADN ului total extras dintr un eșantion biologic (răni, ţesut), fără a fi necesară cultivarea microorgan-ismelor. Acest ADN este secvenţiat cu platforme de „next generation sequencing“ (NGS) sau „metagenomic shotgun„, pentru a afla ce specii sunt prezente, în ce proporție, ce gene de viru-lență sau de rezistență sunt prezente.
• Metatranscriptomică (uneori parte din studiile metagenomice): analiză a ARN urilor expri-mate, pentru a vedea ce microorganisme sunt metabolice active și ce funcţii sunt exprimate.
Propuneri de algoritm diagnostic integrat
Pe baza datelor publicate, se poate propune un algoritm de diagnostic pen-
tru IPȚM suspectate de biofilm + polimicrobianism:
1. Evaluare clinică inițială: caracteristici sugerând infecție cronică/persistență (durată lungă, răspuns slab la tratament, semne locale persistente).
2. Prelevare de mostre:
o Biopsie de țesut (ideal) pentru cultură, microscopie, histologie.
o Mostre multiple, atât pentru germeni aerobi, anaerobi și fungi.
o Dacă biopsia nu este posibilă, se pot preleva aspirate profunde sau tampoane de exsudat, dar cu precauție pentru că este necesar ca proba să fie recoltată din profunzimea țesuturilor.
3. Metode complementare:
o Microscopie (SEM / CLSM) și/sau colorări care să evidențieze microcolonii și EPS.
o FISH sau sondă moleculară pentru speciile suspecte.
o Secvențiere/metagenomică pentru identificarea de specii necultivabile și pentru caractere de rezistență.
4. Evaluare terapeutică concomitentă cu diagnosticul: monitorizarea răspunsului la tratamentul antimicrobian, necesitatea debridării, de îndepărtare a corpilor străini etc.
5. Utilizarea criteriilor combinate: diagnosticul de biofilm/infecții polimicrobiene nu se bazează pe un singur indicator, ci pe asocierea mai multor elemente: prezența biofilmului vizualizat, diversitatea microbiană, eșec terapeutic, confirmare moleculară etc.
Concluzii
• Biofilmul și infecțiile polimicrobiene sunt factori determinanți în agravarea și cronicizarea IPȚM.
• Diagnosticul bazat doar pe cultură tradițională și pe semnele clinice este adesea insuficient pentru a identifica prezența biofilmului sau a comunităților microbiene diverse.
• Metodele moderne – microscopie avansată, sondaje moleculare, metagenomică – oferă informații mai precise, dar trebuie integrate în practica clinică, luând în considerare costurile, accesibilitatea și capacitatea de interpretare.
• Pentru a preveni complicațiile severe, este imperativ ca diagnosticul să fie precoce și cu un caracter multidisciplinar – implicând microbiolog, dermatolog, chirurg și specialist în boli infecțioase.


Medicina de laborator este una dintre cele mai cuprinzătoare specialități medicale și are un rol extrem de important în diagnosticarea, monitorizarea și prognosticul multor patologii, motiv pentru care aceasta se află într-o continuă expansiune. Acest fenomen este întâlnit și în cadrul specialității de boli infecțioase pentru care microbiologia și medicina de laborator sunt vitale.[1]



DAdrian Neculai
Medic Rezident BI - INBI „Prof. Dr. Matei Balș“, Master în Managementul Serviciilor de Sănătate – ASE București
Ana-Maria Dițu
Medic specialist
Boli Infecțioase, Spitalul
Județean de Urgență, Ploiești
Dr. Ramona Lucia Vasile
Medic primar
Boli Infecțioase, Spitalul
Județean de Urgență, Ploiești
upă un sfert de veac scurs din secolul XXI, într-o eră a digitalizării tot mai accelerate, ne vedem încă în postura în care chiar și cele mai avansate laboratoare din perspectiva automatizării necesită resursă umană calificată pentru interpretarea rezultatelor. Microbii suferă tot mai des mutații și nu mai respectă același pattern cu care eram obișnuiți în trecut, acestea putând să scape nedetectate de către softurile utilizate în laboratoarele medicale. Lucrurile capătă un aspect și mai dramatic atunci când clinicianul depinde de aceste rezultate pentru tratarea unui bolnav.[2]
Sepsisul și urmările pe care acesta le are rămân printre principalele cauze de mortalitate în ciuda eforturilor de stabilire promptă a unui diagnostic și inițierea tratamentului. Inițierea tratamentului empiric urmând doar semnele sepsisului, fără confirmarea din partea laboratorului, reprezintă un motiv de îngrijorare în ceea ce privește uzul excesiv al antibioticelor, respectiv selectarea unor tulpini multi-rezistente.
Markerii inflamatori (Proteina C reactivă, Fibrinogenul, Procalcitonina) și formula leucocitară reprezintă probele de laborator care devin indispensabile pentru managementul sepsis-ului sau al administrării antibioterapiei. Deși sunt teste nespecifice și au valori crescute în bolile inflamatorii și cele de natură infecțioasă, formula leucocitară și proteina C reactivă (CRP) sunt testări folosite de rutină în cazul pacienților cu patologie infecțioasă.[5] În ciuda așteptării prelungite a rezultatelor, hemoculturile sunt în continuare considerate standardul de aur în identificarea microorganismelor deoarece oferă informații despre anumite tulpini bacteriene și sensibilitatea la antimicrobiene. În tot acest timp, procalcitonina (PCT), precursorul calcitoninei, este un marker biologic folosit tot mai des în managementul sepsisului. În cazul infecțiilor bacteriene, producția PCT este activată prin intermediul citokinelor (IL-6, TNF-α, IL-1β), iar aceasta se acumulează
la nivelul unor țesuturi care nu sunt capabile să cliveze PCT la calcitonină.[5,6,7,8] Pe de altă parte, în cazul infecțiilor virale se secretă interferon γ care are rolul de a sista producția PCT. Astfel, datorită specificității sale, PCT joacă un rol critic când se suspicionează o infecție bacteriană, fiind mai avantajoasă decât CRP. [5,8]
Administrarea antibioterapiei poate fi influențată de valoarea PCT după cum urmează:
Valoare normală: <0,1ng/mL (în cazul pacienților pediatrici la >72h, respectiv adulților).
Suspiciune de infecție a căilor respiratorii inferioare:
- 0,1 – 0,25ng/mL (posibilități scăzute de infecție bacteriană);
- >0,25ng/mL (posibilități ridicate de infecție bacteriană; este încurajată inițierea antibioterapiei).
Suspiciune de sepsis:
- 0,1 – 0,5ng/mL (risc scăzut de sepsis: nu se recomandă antibioterapia);
Semnele Sepsisului – după “Sepsis. Cleveland Clinic. Published June 2, 2025. https://my.clevelandclinic.org/health/diseases/12361-sepsis“
- >0,5ng/mL (risc de sepsis; antibioterapia este încurajată); - >2ng/mL (risc crescut de sepsis/ șoc septic; antibioterapia este necesară). [9]
Trebuie avut în vedere faptul că intervalele de referință pot varia în funcție de laborator, iar aparatura de laborator modernă poate fi eșalonată în mod diferit. Deoarece medicina este un domeniu vast aflat într-o continuă evoluție, noi biomarkeri sunt în curs de cercetare. Presepsina evidențiază o corelație cu parametri importanți în patologia infecțioasă (Numărul de leucocite, PCT, Lactat, CRP), având un potențial ridicat pentru a deveni criteriu de diagnostic. [10] Teste moleculare pentru PCR multiplex permit detecția patogenilor din sânge în decurs de câteva ore, chiar cu o specificitate ridicată (până la 95%), însă sensibilitatea este una modestă (numai 29%), lăsând astfel loc multor rezultate fals negative. [11] Introducerea markerilor moderni a contribuit la diferențierea etiologiei bolilor infecțioase (virale și bacteriene) și ajustarea terapiei antibiotice. Cu toate acestea, criteriile clinice nu trebuie să fie excluse, datele de laborator fiind practic complementare. Contextul epidemiologic creat de patogenii rezistenți (MDR – multidrug-resistant, XDR – extensively drug-resistant, PDR – pandrug-resistant) a făcut ca un diagnostic cât mai rapid și mai precis să devină o adevărată necesitate. Cu toate că digitalizarea și inteligența artificială devin tot mai prezente în activitatea medicală, acestea nu vor putea înlocui expertiza profesioniștilor din domeniul sanitar întrucât markerii de inflamație sunt probe nespecifice, putând prezenta variații și în contexte diferite (boli reumatice, autoimune, sindroame paraneoplazice) care tind să fie tot mai frecvente.
Examenul bacteriologic cutanat –pe lângă importanța sa în sepsis, examenele microbiologice au rol în diagnosticul afecțiunilor cutanate. După recoltarea secrețiilor de la nivelul leziunilor exsudative prin intermediul unui tampon sau prin aspirat, are loc însămânțarea pe medii bacteriologice precum geloza sânge, diagnosticul etiologic și antibiograma urmâmd să fie orientate de identificarea germenilor patogeni.
Examenul micologic – reprezintă o investigație de bază în diagnosticarea onicomicozelor sau dermatofitozelor. Pentru acesta, se recoltează probe de la nivelul unghiilor afectate, firelor de păr sau
scuamelor (leziuni active). Medii specifice precum Sabouraud sunt necesare pentru realizarea culturilor, iar specia fungică implicată poate fi identificată după o incubație prelungită (până la 4 săptămâni). Totuși, în funcție de agentul patogen, sensibilitatea acestor culturi poate varia considerabil, între 59-100%.[12]
Examenul microscopic direct –microscopia optică este considerată tehnica „gold standard“ pentru confirmarea scabiei, putând identifica multiple aspecte ale acesteia (paraziți, ouă sau fecale ale acestora). Identificarea are loc prin raclarea stratului cornos de la nivelul leziunii și examinarea microscopică în ser fiziologic sau hidroxid de potasiu. Într-un studiu demarat în 2024, 65,2% dintre cazurile examinate au fost pozitive, chiar în absența parazitului.[13]
Culturile bacterienei și micologice pot să confirme și să ofere date esențiale în vederea inițierii terapiei antimicrobiene, pe când examenul microscopic direct permite stabilirea mai timpurie a unui diagnostic, cea din urmă tehnică fiind utilă pentru evitarea administrării unui tratament empiric, de cele mai multe ori nejustificat.
Bibliografie
1. Freedman, DB. Towards better test utilization – strategies to improve physician ordering and their impact on patient outcomes. eJIFCC 2015;26:15–30.
2. Miller JM, Binnicker MJ, Campbell S, et al. A Guide to Utilization of the Microbiology Laboratory for Diagnosis of Infectious Diseases: 2018 Update by the Infectious Diseases Society of America and the American Society for Microbiology. Clin Infect Dis. 2018;67(6):e1-e94. doi:10.1093/cid/ciy381
3. Farooq A, Colón-Franco JM. Procalcitonin and its limitations: Why a biomarker’s best isn’t good enough. The Journal of Applied Laboratory Medicine. 2018;3(4):716-719. doi:10.1373/ jalm.2017.025916
4. Sepsis. Cleveland Clinic. Published June 2, 2025. https://my.clevelandclinic.org/ health/diseases/12361-sepsis
5. Vijayan, AL, Vanimaya, Ravindran, S, Saikant, R, Lakshmi, S, Kartik, R, et al.. Procalcitonin: a promising diagnostic marker for sepsis and antibiotic therapy. J Intensive Care 2017;5:51. https://doi. org/10.1186/s40560-017-0246-8.
6. Kyriazopoulou, E, Liaskou-Antoniou, L, Adamis, G, Panagaki, A, Melachroinopoulos, N, Drakou, E, et al.. Procalcitonin to reduce long-term infection-associated adverse events in sepsis. A randomized trial. Am J Respir Crit Care Med 2021;203:202–10. https://doi. org/10.1164/rccm.202004-1201oc.
7. Hohn, A, Schroeder, S, Gehrt, A, Bernhardt, K, Bein, B, Wegscheider, K, et al.. Procalcitonin-guided algorithm to reduce length of antibiotic therapy in patients with severe sepsis and septic shock. BMC Infect Dis 2013;13:158. https://doi. org/10.1186/1471-2334-13-158.
8. Olver, Pyper, Bohn, Mary Kathryn and Adeli, Khosrow. „Central role of laboratory medicine in public health and patient care“ Clinical Chemistry and Laboratory Medicine (CCLM), vol. 61, no. 4, 2023, pp. 666-673. https://doi.org/10.1515/ cclm-2022-1075
9. Procalcitonin (PCT) guidance. Department of Internal Medicine | University of Nebraska Medical Center. https://www. unmc.edu/intmed/divisions/id/asp/procal.html
10. Sater MS, Almansour N, Malalla ZHA, Fredericks S, Ali ME, Giha HA. Potentials of Presepsin as a Novel Sepsis Biomarker in Critically Ill Adults: Correlation Analysis with the Current Diagnostic Markers. Diagnostics. 2025; 15(2):217. https://doi.org/10.3390/diagnostics15020217
11. Zboromyrska Y, Cillóniz C, Cobos-Trigueros N, et al. Evaluation of the MagicPlexTM Sepsis Real-Time Test for the rapid diagnosis of bloodstream infections in adults. Frontiers in Cellular and Infection Microbiology. 2019;9. doi:10.3389/fcimb.2019.00056
12. Nweze EI, Aghomo HO. Cutaneous fungal infections caused by dermatophytes and non-dermatophytes: An updated comprehensive review of epidemiology, clinical presentations, and diagnostic testing. J Fungi. 2023;9(3):128. doi:10.3390/jof9030128. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10302839/
13. Li W, Li X, Song L, Li H, Wu Y, Li J. Optical microscopic study on a novel morphological classification method of multiple diagnostic features of Sarcoptes scabiei var. hominis. Parasitology. 2023;150(11):1070-1075. doi:10.1017/ S0031182023000938


