



EscuelaProfesionalde Ingeniería Química
Av. Independencia s/n Telefax 054233775
DIRECTORIO
REVISTADE INGENIERÍA QUÍMICA
Dr.HugoRojasFlores
Rector de la UNSA
Dr.LuisCuadrosPaz Vicerrector Académico
Dr.HenryPolancoCornejo Vicerrector de Investigación
Dr. Esequiel Nicolás Collado Cárdenas Decano de la Facultad de Ingeniería de Procesos
REVISTA INGENIERÍA QUÍMICA CONSEJO EDITORIAL
Director
Dr. Pavel Delgado Sarmiento
Director de laEscuela Profesional de Ing. Química
Integrantes
Dr.AlejandroN.SalasBegazo
Dr. Hugo Jiménez Pacheco
Dra.LiliaMaryMirandaRamos
Dra. Silvana M. Z. Vizcarra Núñez
Dra.CatalinaO.RondónSaravia
Mg. Rodolfo R. Perez Mendez
Mg. Jorge Pimentel Frisancho
Dr.MarioRamos Chávez

DOCENTES
Dr. Héctor Terrones Diaz
Dra. Marleni Gonzales Iquira
Dr. Luis Felipe Miranda Zanardi
Dra.EsperanzaMedinaLezama
Dr. Víctor Álvarez Tohalino
Dra. ElizabethMedranode Jara
Dr. Omar Gallegos Jara
Dr. MiguelÁngelCárdenasMálaga
Dr. Félix José Sueros Velarde
Dr. Paulino Zegarra Panca
Dra.CarmenNellyGorritiGallegos
Dra. Iris Aliaga Villafuerte
Dr. Rolando Basurco Carpio
Dra. Mara Linares Pomareda
Dr. Pavel Delgado Sarmiento
Mg.ArmandoSalinasSánchez
Dr. Jorge Arturo Velásquez
Salinas
Dra.MarciaQuequezanaBedregal
Mg. Armando Robles
Fernández
Dr. Mario Otto Paz Zegarra
Dra. Silvana Vizcarra Núñez
Mg. Nidia Pompilla Cáceres
Dr. Alejandro Salas Begazo
Dr. Hugo Jiménez Pacheco
Dra. LiliaMaryMirandaRamos
Mg. Karina Morán Medina
Dr.FranciscoRoque
Rodríguez
Dr. David Urquizo Valdivia
Dra. Teresa Cuadros Castillo
Dra. Evelyn Gutierrez Oppe
Mg. Javier Villegas Aragon
Dra. Catalina Rondón Saravia
Mg. Maria del Carmen Camiña Pachecho
Mg. Sheyla Angulo Vargas
Mg. Rodolfo Perez Mendez
Mg.JorgePimentelFrisancho
Dr. Mario Ramos Chavez
Dra. Frida Delgado Delgado
Mg Victor Tone Gonzales
Mg Luisa Santos Parra
• PRESENTACIÓN CONTENIDO
• NOTA POREL ANIVERSARIO DE INGENIERÍA QUÍMICA
• ARTÍCULOSDE DOCENTES
• INFORMATIVO SOBREEL CAPITULOESTUDIANTILAICHE UNSA
• SPONSOR
NOTASOBREEL ANIVERSARIO DE INGENIERÍA QUÍMICA
La Universidad Nacional de San Agustín de Arequipa (UNSA)aprobó el proyecto deconstrucción dedos modernos edificios de la Escuela Profesional de IngenieríaQuímica, informacióndivulgadadurante la sesiónsolemneporelLXIIAniversariodecreación.
Laceremoniaconmemorativafuepresididaporel Dr. Luis Cuadros Paz, vicerrector académico, acompañado del Dr. Henry Polanco Cornejo, vicerrector de investigación, Dr. Nicolas Collado Cárdenas, decano de la facultad de Ingeniería de Procesos,Dr.PavelDelgadoSarmiento,directordel Programa de Estudio, Dra. Jane Linares Pomareda, directora del departamento Académico, docentes, estudiantes e invitados


Ensuspalabras,elDr.LuisCuadros,destacóqueestaEscuelafuelaprimeraenlaformación deprogramas deingenieros,consideradalahermanamayordetodaslasingenierías y felicitó por esteaniversario alos docentes porel trabajo desarrollado enlacomisión académica dela reforma educativa.


RECURSOS. Encuantoalasobrasdeconstrucción,eldirector delProgramadeEstudios, precisó que son 44 millones desoles destinados parala construcción dedos pabellones de cinco pisos, uno para el desarrollo de la teoría y el otro para laboratorios, ambos completamenteimplementadosconpizarrasinteligentesyequiposdeúltimageneración.
Señalóqueseesperaqueeste28denoviembrese adjudique la buena pro para la realización del expediente técnico y en abril del próximo año iniciarlas obras que durarán aproximadamenteun año por cada edificio, beneficiando a los estudiantes eninvestigación y asimilando nuevos conocimientos con el uso de la tecnología.
PavelDelgado,asimismo,detallóquelograronla certificación en plena pandemia con el modelo de ACACIT por seis años y fue reconocido por el Sistema Nacional de Evaluación, Acreditación y Certificación de la Calidad Educativa (SINEACE),quevenceen2025,porlo queestán presentandoinformesanualesdemejoracontinua.


Ingeniería Química cuenta con cerca de 600 estudiantes, 37 docentes entre nombrados y contratados y2 trabajadores administrativos, enlos últimos años aumentóconsideradamente la cantidad de postulantes a esta carrera profesional que transforma la materia prima en productos a través de la tecnología.


EXTRACCIÓN DE ANTOCIANINA DE MAÍZ MORADO (Zea mays L.)
COMO SUSTITUTO DE COLORANTES ARTIFICIALES USADOS EN PRUEBAS DE TINCIÓN DE MICROORGANISMOS EN LABORATORIO
Nidia Pompilla Cáceres, Sebastián Diego Pino Huanca, Rosangela Kristie Pacheco Rojas
RESUMEN: Este trabajo fue enfocado a la antocianina, se evaluó su aplicación en tinción de microorganismos como una alternativa a la toxicidad de los colorantes comúnmente usados. Se extrajo la antocianina de la coronta del maíz utilizando la técnica de Extracción con Solvente, con un Espectrofotómetro UV-VIS se cuantificó por el método de pH diferencial para lo cual se preparó soluciones de pH 1.0 y 4.5, se midió la absorbancia a 510 y 700 nm obteniéndose 39.9162 mg/g de coronta. Posteriormente, se probó la sensibilidad a las variaciones de pH y afinidad del pigmento con diferentes microorganismos para ello se preparó el colorante con antocianina, ácido acético y glicerina en diferentes proporciones y se aplicó sobre cada muestra de bacterias u hongos en el portaobjetos y se visualizó con un microscopio. Se obtuvieron mejores resultados de tinción con la antocianina sin aditivos. Se concluyó que el colorante natural extraído del maíz morado puede ser utilizado como colorante en técnicas de tinción de laboratorio mostrando más afinidad por bacterias que por hongos.
PALABRAS CLAVE: Antocianina, Tinción, Lactobacillus spp., Saccharomyces cerevisiae
ABSTRACT: This work was focused on anthocyanin, its application in staining of microorganisms was evaluated as an alternative to the toxicity of commonly used dyes. The anthocyanin was extracted from the corn coronta using the Solvent Extraction technique, with a UV-VIS Spectrophotometer, it was quantified by the differential pH method for which solutions of pH 1.0 and 4.5 were prepared, the absorbance was measured at 510 and 700 nm obtaining 39.9162 mg/g of coronta. Subsequently, the sensitivity to pH variations and affinity of the pigment with different microorganisms was tested, for which the dye was prepared with anthocyanin, acetic acid and glycerin in different proportions and applied on each sample of bacteria or fungi on the slide and visualized with a microscope. Better staining results were obtained with the anthocyanin without additives. It was concluded that the natural dye extracted from purple corn can be used as a dye in laboratory staining techniques showing more affinity for bacteria than for fungi.
KEY WORDS: Anthocyanin, Stain, Lactobacillus spp.,
1. INTRODUCCION
El maíz morado es un producto ancestral que, en la actualidad, está presente en gran parte del continente, en el Perú se cultiva en los valles andinos entre los cuales destacan los valles del sur peruano: Arequipa, Moquegua y Tacna. Uno de los productos más reconocidos que se elaboran a partir de este fruto es la chicha morada, característica por su color y sabor la cual se viene desarrollando desde la época colonial, pero su importancia no solo está sustentada en ser un alimento funcional, sino también en que el fruto contiene antocianina, un químico que ha demostrado tener propiedades interesantes y es principalmente usado como colorante de la industria alimentaria junto a otras aplicaciones debido a sus propiedades funcionales, la principal: ser antioxidante. [3]

Figura 1. Estructura de la antocianina descrita como
A: benzopirilo y B: anillo fenólico. [1]
Dentro de los flavonoides tenemos a la antocianina, un pigmento soluble que se encuentra en gran variedad de alimentos en sus colores característicos: rojo - morado. Son glucósidos de antocianidinas, químicamente están compuestas por dos anillos aromáticos (A benzopirilo y B anillo fenólico).
Una de las propiedades fundamentales del colorante es el cambio de color sensible al pH, este cambio del color de la antocianina se da por diferentes factores que no solo afectan su apariencia visual, también lo hacen con respecto a su estabilidad, el compuesto puede llegar a degradarse o transformarse en condiciones extremas debido a la modificación de los factores que determinan su estabilidad, estos factores pueden ser cambios de pH, temperatura y la presencia de químicos externos que interactúan o modifiquen su estructura.
El color de la molécula depende principalmente del número y orientación de los grupos hidroxilo y metoxilo de la molécula, de esta forma si incrementamos los grupos hidroxilo (hidroxilación) tendremos como resultado tonalidades azules mientras que si incrementamos los grupos metoxilo (metoxilación) resultará en coloraciones rojas. [2]
Saccharomyces cerevisiae2. METODOLOGIA
La experimentación se llevó a cabo mediante la comprobacióndel usodelcolorante naturalde maíz morado para pruebas de tinción de microorganismos en laboratorio. El procedimiento experimental se realizó en 3 fases, cada fase tuvo su protocolo de desarrollo:
2.1. Extracción de antocianinas
Se seleccionó las corontas con mayor coloración y se descartaron todasaquellas que presenten daño o desgaste en su estructura, estos factores dependen de la calidad y la fuente de obtención de la materia prima. Una vez seleccionada las corontas fueron molidas en donde se utilizó un molino o procesador, de esta forma se realizó la reducción de partículas.
La metodología aplicada consta de una extracción sólidolíquido en donde se utilizó como solvente orgánico prótico etanol en una proporción determinada con agua. Para aumentar el rendimiento de extracción se optó por constituir la forma más estable de la antocianina por lo que el pH al cual se debe trabajar debe ser aproximadamente 2.5. Para ello, el solvente etanol se debe acidificar con un ácido entre los cuales se tiene como opción el ácido acético, ácido cítrico, ácido clorhídrico, etc. Esta extracción se debe llevar a cabo a una temperatura controlada ya que, a muy altas temperaturas por tiempos prolongados, el pigmento se degrada y el rendimiento total de la extracción disminuiría significativamente por lo que se estimó un óptimo nivel de temperatura según la bibliografía consultada de no más de 70 °C por tiempos prolongados. El tiempo de extracción es variable, pero puede llegar a tomar de 1 a 2 horas. La relación de materia prima y solvente utilizada puede variar desde 1:3 hasta valores bibliográficos de 1:200 según la concentración y pureza que se desee obtener, esto también depende de la calidad de la materia prima y la disponibilidad de los reactivos para las pruebas.
2.2. Cuantificación de la antocianina
Para la cuantificación de las antocianinas del extracto obtenido de la primera fase se aplicó el método de pH diferencial usando un espectrofotómetro UV-Vis para la cual se prepararon varias diluciones con el objetivo de encontrar el factor de dilución adecuado para la medición. Las diluciones se realizaron con soluciones buffer a pH 1 y 4.5 respectivamente las cuales son preparadas antes de realizar la medición en el espectrofotómetro. El factor de dilución debe ser tal que los valores de absorbancia medidos no superen a 2.0 para lo cual se deben preparar diferentes diluciones e ir midiendo absorbancia hasta encontrar el valor correcto.
Para obtener la concentración de la antocianinase aplicó la Ec. (1).
Y para obtener la concentración en función de cianidin-3glucosido se calculó mediante la Ec. (2).
De esta manera, la cuantificación del extracto obtenido de antocianina se realizó mediante el método pHdiferencial para lo cual se prepararon las siguientes soluciones buffer:
• Buffer pH 1.0 → KCl 0.025 M a partir de 0.372 g KCl para 200 mL de solución buffer.
• Buffer pH 4.5 → CH3COONa 0.66 M a partir de 10.886 g CH3COONa para 200 mL de solución buffer.
El factor de dilución fue 200 después de 4 secuencias de dilución a 10, 20, 50 y 100. Las mediciones de absorbancia fueron tomadas a 515 nm como max-vis y 700 nm para la aplicación de la Ec. (1).
Según el factor de dilución elegido, se tomó 1 mL de muestra de extracto de antocianinas y se aforó a 20 mL con solución buffer para cada pH.
2.3. Pruebas de tinción
Para el proceso de tinción de microorganismos se preparó diferentes medios de cultivo como hongos las cuales, llegadasumaduración,fueronexpuestasalextracto de antocianinas y posteriormente llevadas a observación microscópica en donde se procedió con la observación, enfocándose en el comportamiento, sensibilidad y compatibilidad de las especies en cultivo con el colorante natural. Con la finalidad de comprobar su afinidad con el microrganismo de prueba, se aplicó aditivos a la coloración como ácido acético y glicerol.
Finalmente, se realizó las pruebas de tinción de microorganismos para lo cual se seleccionó como muestras:
• Cultivo láctico (Lactobacillus spp. & Streptococcus spp.)
• Escherichia coli
• Saccharomyces cerevisiae
• Cultivo de levaduras
• Penicillium sp.
Las pruebas de tinción se realizaron bajo una variación de la proporción del extracto de antocianina [EA] y los aditivos, para este caso fueron ácido acético [M] como mordiente y glicerol [A] (solo para hongos y levaduras).
3. RESULTADOS Y DISCUSION
En relación a la primera fase experimental, se obtuvieron los siguientes resultados:
Tabla 1. Condiciones de extracción de antocianina de maíz morado.
CONDICIONES DE EXTRACCION DE ANTOCIANINA
Tabla 2. Resultados de extracción de antocianina de maíz morado.
DE EXTRACCION DE ANTOCIANINA
Siguiendo el procedimiento experimental, para la segunda fase se obtuvo:




3. Curva de absorbancia para dilución de extracto
4.5.
Tabla 3. Resultados de absorbancia a longitudes de onda 515 y 700 nm respectivamente.
�� = (2.1183 0.0378) (0.1531 0.0147)= 1.942161
1942161×449.2×200×1000
�� = 26900×1
�������� = 6486.385����⁄��
Se obtuvo un contenido de antocianinas de 39.92����⁄��, aplicando las Ec. (1) y (2).
Finalmente, para la tercera fase experimental, los resultados de tinción se muestran en la Tabla 4.
Tabla 4. Resultados de pruebas de tinción simple usando colorante natural de maíz morado.
Muestra Proporci ón
EA:M:A Pruebade tinción Resultado visual
1:0:0
Positivade color morado
Cultivo láctico Lactobacillus spp. Streptococcu s spp.

1:1:2
1:3:2
1:5:2
Poca variaciónde tonalidad
Misma tonalidad
Muybaja tonalidad, reducción notoriadela coloración.

1:0:0 - -
1:1:2
Escherichia coli
1:3:2
Tinción positiva tonalidad magenta
Reduccióny oscurecimie nto de la tonalidad
1:5:2 - -
1:0:0
Saccharomy ces cerevisiae
1:1:2
Leve tonalidad morada
Reducción de la tonalidad

1:3:2
Reducción casitotalde latonalidad
1:5:2
1:0:0
Cultivode levaduras
1:1:2
Tinción negativa
Tinción positiva bastante leve por acumulación de colorante.
Reducción casitotalde la tinción.

1:3:2 - -
1:5:2 - -
1:0:0
Penicillium sp.
1:1:2
Tinción negativa paramoho.
Tinción positivamuy leve para estructura de esporas decolor morado

1:3:2 - -
1:5:2 - -
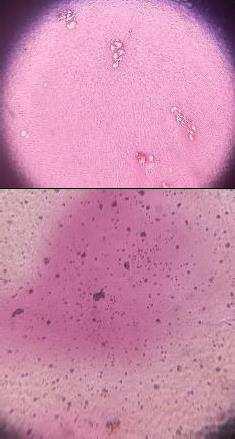
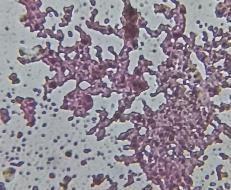
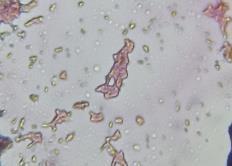
Se obtuvieron mejores resultados de tinción con la antocianina sin aditivos, es un compuesto polar y sus cargas van cambiando a lo largo de la variación del pH lo cual que le permite enlazarse con constituyentes celulares decargapositivaonegativasegúnseasupH(3.3) y el del microorganismo, influyendo también en su color como en su estabilidad teniendo mayor afinidad con unos que con otros.
Las bacterias grampositivas (Lactobacillus spp. y Streptococcus spp.) se tiñeron moradas, su pared celular está constituida principalmente por cadenas de peptidoglucano y son más gruesa para retener el tinte y la bacteria gram negativa (E. coli) se tiñó magenta teniendo similitud con la tinción de Gram. En hongos la levadura Saccharomyces cerevisiae se tiñó purpura y la especie Penicillium sp. de azul verdoso asemejándose a la tinción Azul de Lactofenol, los hongos tienen en su pared glucanos y quitina con enlaces extrapolares de COOH y NH2 lo que permitió tener afinidad solo con el colorante, pero con los aditivos no.
4. CONCLUSIONES
Se llegó a las siguientes conclusiones:
• Se realizó con éxito la extracción y experimentación con antocianinas de maíz morado mediante tres fases: extracción, cuantificación y pruebas de tinción de microorganismos.
• Para las condiciones de relación materia prima y solvente de 1:6 en % peso, además de un proceso de extracción de 1 hora a 70 °C a pH 3, se obtuvo una concentración de antocianina de aproximadamente 6000 ppm.
• El colorante extraído del maíz morado (antocianina) puede ser utilizado como colorante de tinción simple para pruebas de microbiología en laboratorio presentándose como una alternativa de uso simplificado, fácil de obtener y amigable con el medio ambiente.
• El colorante extraído sirve para pruebas de tinción de bacterias incluso pudiéndose notar una clara similitud a la aplicación de la técnica de tinción gram.
• El colorante extraído es poco afín junto a aditivos de tinción para los microorganismos de clase hongo, mostrándose poca o nada afinidad en los diferentes tratamientos.
5. BIBLIOGRAFIA
[1] Garzón, G. (2008). Las antocianinas como colorantes naturales y compuestos bioactivos. Revisión. AA 14490 Bogotá, Colombia. Acta biol., Vol. 13 No. 3, 2008 27 - 36. Disponible en: https://www.redalyc.org/pdf/3190/319028004002. pdf
[2] Gorriti,A.,Quispe,F., Arroyo,J.L.,Córdova, A.,Jurado, B., Santiago, I., & Taype, E. (2009). Extracción de antocianinas de las corontas de Zea mays L. maíz morado. Ciencia e investigación, 12(2), 6474. DOI: https://doi.org/10.15381/ci.v12i2.3395
[3] Gorriti, A; Arroyo, J; Negron, L; Jurado, B; Purizaca, H; Santiago, H; Taype, E. & Quispe, F. (2009). Antocianinas, fenoles totales y actividad antioxidante de las corontas del maíz morado (Zea mays L.). Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 8 (6), 509 –518. BLACPMA ISSN 0717 7917. Método de extracción. Recuperado de: https://www.redalyc.org/pdf/856/85617461006.pdf
EFECTO DEL ION CALCIO SOBRE LAS CARACTERISTICAS REOLOGICAS DE GOMA DE SEMILLA DE TARA (Caesalpinia Spinosa)
Jorge Paul Pimentel Frisancho*
Rodolfo Roque Pérez Méndez**
Julio Cesar Mogrovejo Chávez***
RESUMEN: Se estudió la influencia del ion calcio (Ca+2) en el comportamiento reológico de dispersiones de goma de tara (Caesalpinia spinosa), para lo cual se prepararon dispersiones de goma de tara al 0,25% y 0,50% p/V con pH ajustado a 4.0 sin calcio y con 70 mg/100 ml de ion Ca+2, para cada una de estas condiciones se trabajó con tres perfiles de temperatura 20 ºC, 40 ºC y 60 ºC. Se utilizó un viscosímetro Brookfield modelo DV-III Ultra Programmable Rheometer y un baño termostático de la misma marca. Se determinó el efecto del ión Calcio sobre las características reológicas de la goma de semilla de tara (Caesalpinia Spinosa). Se halló que las dispersiones de goma de semilla de tara a las dos concentraciones estudiadas, con o sin adición de Calcio, para los tres perfiles de temperatura estudiada, se ajustaron al modelo general de la ley de la potencia (Ostwald, lo cual indico que presenta un tipo de flujo no Newtoniano independiente del tiempo de aplicación, del tipo pseudoplástico sin esfuerzo umbral, con coeficientes de correlación mayores al 96% (K>0 y 0<n<1).
PALABRAS CLAVE: Dispersiones, goma de tara, reología, viscosidad.
ABSTRACT: The influence of the calcium ion (Ca+2) on the rheological behavior of dispersions of tara gum (Caesalpinia spinosa) was studied, for which dispersions of tara gum at 0.25% and 0.50% w/V were prepared. with pH adjusted to 4.0 without calcium and with 70 mg/100 ml of Ca+2 ion, for each of these conditions we worked with three temperature profiles: 20 ºC, 40 ºC and 60 ºC. A Brookfield viscometer model DV-III Ultra Programmable Rheometer and a thermostatic bath of the same brand were used. The effect of Calcium ion on the rheological characteristics of tara seed gum (Caesalpinia Spinosa) was determined. It was found that the tara seed gum dispersions at the two concentrations studied, with or without calcium addition, for the three temperature profiles studied, conformed to the general power law model (Ostwald), which indicates that it presents a type of non-Newtonian flow independent of the application time, of the pseudo plastic type without threshold stress, with correlation coefficients greater than 96% (K>0 and 0<n<1)
KEY WORDS: Dispersions, tara gum, rheology, viscosity.
1. INTRODUCCION
Las gomas o hidrocoloides poseen la capacidad de incrementar la viscosidad en solución y/o formar geles cuyos efectos se pueden usar en la industria alimentaria otras industrias como la farmacéutica. La Goma de Tara es un polvo blanco a blanco-amarillento, sin olor y sin sabor. Evita las reacciones indeseables de sinéresis y otras alteraciones, y por ello es considerado un sustituto o complemento ideal de las gomas garrofin, guar, xantana, etc.
Tiene una gran capacidad de absorción de agua y en agua fría se dispersa lentamente; cuando se calienta, se transforma en un gel homogéneo que mantiene sus propiedadesal enfriar. Su comportamiento es más similar a la goma garrofin que a la de guar, impartiendo viscosidad al medio donde se aplique; aparte de otras funciones como la de evitar la formación de cristales de hielo durante la congelación y mantener buena resistencia al choque térmico. Carece de reactividad
con las proteínas lácteas. La goma de tara ofrece sinergismo en su aplicación conjunta con carragenatos, agar y goma xantana, obteniendo geles termorreversibles sin sinéresis. En la actualidad no hay un estudio adecuado ni un aprovechamiento de la goma de tara como aditivo alimentario en nuestro medio, el presente trabajo de investigación trata de llenar este vacío ya que es necesario tener un referente del comportamiento reológico de la goma de tara.
Al seleccionar una goma para su aplicación se deben tener en cuenta aquellos factores que afectan su viscosidad tal como la presencia de iones, en el caso específico de Ca+2 es necesario saber cuál sería su influencia en la viscosidad ya que en el caso de las pectinas se sabe que estas poseen calcio en su composición y al ser parte ambos de una formulación de algún producto alimenticio podrían influir en las características del producto final.
* Ing. Químico, Dpto. Académico de Ingeniería Química, Facultad de Ingeniería de Procesos, Universidad Nacional de San Agustín de Arequipa, e-mail: jpimentelf@unsa.edu.pe **rperezm@unsa.edu.pe, ***La Ibérica, e-mail: juliomch@hotmail.com
2. METODOLOGIA
2.1 Materiales y Equipos
a. Materiales:
- Vasos de precipitados.
- Probetas
- Fiola de 250 ml
- Termómetro
b. Equipos:
- Viscosímetro Brookfield DV-II Ultra
- Agitador magnético
- Baño termostático Brookfield.
- Laptop
- Balanza analítica
- pHmetro Hanna.
c. Reactivos:
- Goma de tara, (Alnicolsa del Perú S.A.C.- Lima)
- HCl

Fotografía 01. Viscosímetro Brookfield DV-II Ultra

Fotografía 02. Baño termostático del Viscosímetro
Brookfield DV-II Ultra de la Facultad de Ingeniería Química – UNAP
2.2 Procedimiento
Se siguió el siguiente procedimiento:
1. Utilizando una dispersión acuosa de goma de tara (Caesalpinia Spinosa) de concentración 0.4% p/v con pH ajustado a 4.0 si calcio y con 70 mg/100 ml de ión Ca+2
2. Utilizando una dispersión acuosa de goma de tara (Caesalpinia Spinosa) de concentración 0.6%p/v con pH ajustado a 4.0 si calcio y con 70 mg/100 ml de ión Ca+2.
3. Para cada uno de los tratamientos anteriores se realizaron pruebas con tres perfiles de temperatura, 20, 40 y 60 ºC.
Se aplicó un diseño multinivel factorial. El diseño experimental se llevó a cabo tomando en cuenta las siguientes variables.
Variables de la investigación
Variables independientes
Concentración de goma de tara (% p/V)
Presencia de ion Ca+2
Temperatura (°C)
Variables dependientes
Índice de consistencia (k)
Índice de comportamiento de flujo (n)
Para realizar un diseño hemos tomado los siguientes niveles para un diseño multinivel Factorial, tal como se aprecia en la tabla 01.
Tabla 01. Factores y niveles

Fotografía 03. Goma de tara
3. RESULTADOS Y DISCUSION
Se obtuvieron los siguientes resultados:
Tabla 02. Matriz de diseño con variables respuesta
Variable Natural Respuestas
Nº Cc. de goma de tara T (ºC) Prese ncia deion Índice de consisten cia (K) Índice de flujo (n)

Grafico 01. Índice de consistencia Vs. Temperatura
En el grafico01.apreciamos como laadición del catión Ca+2 influye significativamente en el índice de consistencia (k), incrementando este valor a las dos concentraciones de estudio, en cambio el incremento en la temperatura influye disminuyendo el valor de índice de consistencia (k) para todos los casos de estudio.
Se observaron índices de flujo (n), 0<n<1, acorde con las propiedadesde unfluidodel tipopseudoplástico, y queeste disminuye con la concentración de la goma de semilla de tara, la adición de Ca+2 también provoca una disminución en el valor de este índice, excepto en el caso de la dispersióna0,25%evaluadoa60ºCdondesenotaunligero incremento y en el caso de la dispersión a 0,50% a 20ºC donde la adición de Ca+2 incrementa el índice de flujo esto nos lleva a inferir que el ion Ca+2 tiene un efecto sobre las características reológicas de la goma de semilla de tara, los resultados de las pruebas los podemos apreciar en la tabla nº 02, y el grafico nº 2.

Grafico 02. Índice de flujo (n) Vs. Temperatura
En el grafico 02 apreciamos como el incremento de temperatura eleva el valor del índice de flujo y la adición del catión Ca+2 disminuye este índice, excepto en el caso de la dispersióna0,25%evaluadoa60ºCdondesenotaunligero incremento y en el caso de la dispersión a 0,50% a 20ºC donde la adición de Ca+2 incrementa el índice de flujo
Acontinuación,presentamos losreogramasdelos distintos tratamientos realizados, en estos observamos la relación entre el esfuerzo cortante (τ)y la gradiente de
velocidad (D). En todos los reogramas se observa un comportamiento del tipo pseudoplástico.
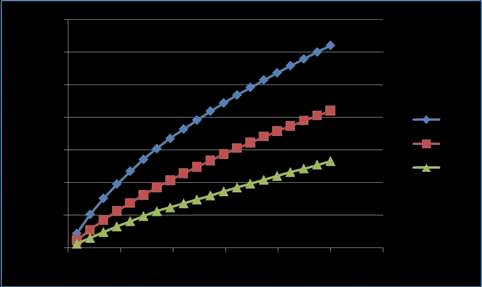
Grafico 03. Reograma entre el esfuerzo cortante (τ) y la gradiente de velocidad (D) para una concentración del 0.25%sin adición de Ca+2 , a los tres perfiles de temperatura de estudio.
En el grafico 03, apreciamos un comportamiento pseudoplástico que se observa mejor a los 20ºC mientras que a 40 y 60ºC se acercan más al comportamiento Newtoniano, ya que la relación τ/D disminuye, asemejándose más a una recta. Además, se observa que alaumentarlatemperaturalosesfuerzoscortantes(τ)van disminuyendo para un mismo valor de gradiente de velocidad (D)
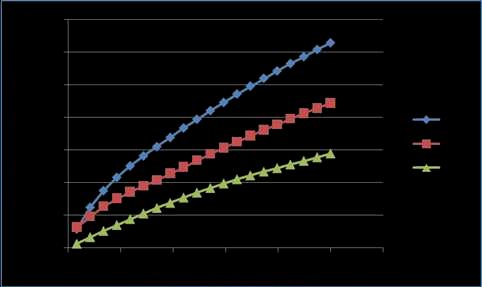
Grafico 04. Reograma entre el esfuerzo cortante (τ) y la gradiente de velocidad (D) para una concentración del 0.25% con adición de Ca+2 , a los tres perfiles de temperatura de estudio.
En el grafico 04, apreciamos un comportamiento pseudoplástico que se observa mejor a los 20ºC mientras que a 40 y 60ºC se acercan más al comportamiento Newtoniano, ya que la relación τ/D disminuye, asemejándose más a una recta. Además, se observa que al aumentar la temperatura los esfuerzos cortantes (τ) van disminuyendo para un mismo valor de gradiente de velocidad (D), se observan valores un poco más altos de
esfuerzo cortante que para dispersiones al 0,25 sin ion Ca+2

Grafico 05. Reograma entre el esfuerzo cortante (τ) y la gradiente de velocidad (D) para una concentración del 0.50%sin adición de Ca+2 , a los tres perfiles de temperatura de estudio.
En el grafico 05, apreciamos un comportamiento pseudoplástico que se observa mejor a los 20ºC mientras que a 40 y 60ºC son muy similares y se acercan más al comportamiento Newtoniano, ya que la relación τ/D disminuye, asemejándose más a una recta. Además, se observa que al aumentar la temperatura los esfuerzos cortantes (τ) van disminuyendo para un mismo valor de gradiente de velocidad (D).
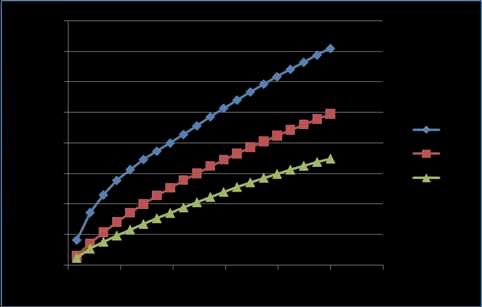
Grafico 06. Reograma entre el esfuerzo cortante (τ) y la gradiente de velocidad (D) para una concentración del 0.50% con adición de Ca+2 , a los tres perfiles de temperatura de estudio.
Apreciamos un comportamiento pseudoplástico que se observa mejor a los 20ºC mientras que a 40 y 60ºC se acercan más al comportamiento Newtoniano, ya que la relación τ/D disminuye, asemejándose más a una recta. Además, se observa que al aumentar la temperatura los esfuerzos cortantes (τ) van disminuyendo para un mismo valor de gradiente de velocidad (D). Se observan valores mucho más altos de esfuerzo cortante que en el caso anterior.
4. CONCLUSIONES
Se determinó que las dispersiones de goma de semilla de tara (Caesalpinia Spinosa) a las dos concentraciones investigadas, con o sin adición de Calcio, para los tres perfiles de temperatura estudiados, se ajustaron al modelo general de la ley de la potencia (Ostwald), lo cual indico que presenta un tipo de flujo no Newtoniano independiente del tiempo de aplicación, del tipo pseudoplástico sin esfuerzo umbral, con coeficientes de correlación mayores al 96% (K>0 y 0<n<1)
No se obtuvo un ajuste adecuado con el modelo matemático de Herschel-Bulkley, ya que, si matemáticamente presenta un índice de correlación muy cercano al 100%, los parámetros no correspondían a lo especificado ya que se obtuvo un límite de fluencia o esfuerzo umbral negativo.
Se observó que el índice de consistencia (k), aumenta con la concentración de la goma de semilla de tara, y la adición de Ca+2 también provoca un incremento de este índice en la dispersiones, en todos los casos un incremento en la temperatura hace que este índice disminuya en forma significativa, los cual nos lleva a concluir que el ion Ca+2 tiene un efecto significativo sobre las características reológicas de la goma de semilla de tara, tal como lo podemos apreciar en la tabla 02, y el Grafico 01.
5. CITAS Y/O REFERENCIAS
[1] ALVARADO, J. & AGUILERA, J., (2001), Métodos para medir propiedades físicas en industrias de alimentos. Ed. Acribia, Zaragoza, España.
[2] BARBOZA – CANOVAS, G.V.; IBARZ, A. & PELEG, M., (1993), Propiedades reológicas de alimentos fluidos. Revision. Alimentaría. pp. 241, 39-89.
[3] BOGER, D.V. & TIU, C. (1974), Rheological properties of food products and their use in the design of flow systems. Food Technol. in Australia pp. 26, 325, y 335.
[4] MOTT L. ROBERT, (1996), Mecánica de Fluidos Aplicada. 4a edición, Ed. Prentice Hall. México D. F. pp. 24, 26, y 27.
[5] MULLER H. G. (1978), Introducción a la Reología de los Alimentos, Dpto. de ciencia de los Alimentos Universidad de Leeds.ansing, U.S.A
Una evaluación comparativa mediante la metodología ICA-PE y OIP en las aguas superficiales del río Chili en la ciudad de Arequipa
Karina Lizette Moran Medina* *kmoran@unsa.edu.peResumen: Los ICA del agua, son herramientas y técnicas usadas para evaluar y diagnosticar la calidad de los cuerpos de agua continentales, siendo sus resultados fáciles de interpretar. El presente trabajo evaluó la comparación de la aplicación de dos metodologías de índices, como son el ICA de agua (ICA-PE) elaborado por la Autoridad Nacional del Agua (ANA) y el índice general de contaminación polución (OIP), en cuatro estaciones de monitoreo ubicados en la parte media del río Chili, realizados evaluados en los años 2017, 2018 y 2019 en las temporadas húmeda y seca; los resultados en la temporada húmeda indicaron una calificación que varía entre excelente a regular con ICA-PE y para el OIP una calificación entre ligeramente contaminado (C3) y contaminado (C4), para la temporada seca obtuvieron una calificación de excelente a bueno con ICA-PE y para OIP fue de ligeramente contaminado (C3) y contaminado (C4). Concluyendo que la calidad del río Chili está siendo afectada por los efluentes industriales sin tratamiento y los residuos sólidos encontrados en sus riberas.
Palabras claves: Cuerpos de agua, índice general de polución, índice de calidad de agua
Abstract: Water quality indices are tools and techniques used to assess and diagnose the quality of freshwater bodies, and their results are easy to interpret. This study evaluated the comparison of two index methodologies, namely the Water Environmental Quality Index (ICA-PE) developed by the National Water Authority (ANA) and the Overall Pollution Index (OIP), at four monitoring stations located in the middle part of the Chili River. The assessments were conducted in the years 2017, 2018, and 2019 during both the wet and dry seasons. The results during the wet season indicated ratings ranging from excellent to fair using ICA-PE, while OIP indicated ratings between slightly polluted (C3) and polluted (C4). During the dry season, ratings ranged from excellent to good using ICA-PE, while OIP indicated ratings of slightly polluted (C3) and polluted (C4). It can be concluded that the quality of the Chili River is being affected by untreated industrial effluents and solid waste found along its banks.
Keywords: Freshwater bodies, overall pollution index, water quality index.
1 INTRODUCCIÓN
La contaminación de los recursos hídricos es un problema mundial, el Programa de las Naciones Unidas para el Medio Ambiente [1], estimó que un tercio de todos los ríos en los países desarrollados presentan una contaminación grave, siendo los nutrientes, pesticidas y metales pesados los principales contaminantes [2], [3].
La calidad del agua superficial es afectada por las actividades industriales de los sectores mineros, hidrocarburos, agrícolas, pesquero, construcción, textil y otros sectores, siendo su gestión un gran desafío [4], [5], Muchos países han adoptado una serie de políticas y directrices para gestionar la calidad del agua con el fin de reducir esta tendencia negativa [6], [7].
El río Chili nace de la unión de los ríos Sumbay y Blanco, atravesando la ciudad de Arequipa, su caudal presenta variaciones entre 5-24 m3/s, su contaminación es un problema que la Autoridad Nacional del Agua (ANA) no ha podido solucionar, encontrándose 45 fuentes puntuales de vertimientos, de los cuales 09 son efluentes industriales, 10agrícolas y 26domésticos [8].
Los modelos de índice de calidad de agua, son una gama de herramientas y técnicas para evaluar y diagnosticar la calidad de los ecosistemas acuáticos,
mediante el uso de algoritmos matemáticos que transforman los datos de monitoreo de cuerpos de agua en números para indicar la calidad del agua, su aplicación y resultados son fáciles de interpretar por profesionales y no expertos [5], [9]–[11]. El índice inicial de Horton (1965) [12] consideró 10 variables como son oxígeno disuelto, cloruros, alcalinidad, pH, coliformes y conductividad eléctrica para EE. UU., después fue adoptado por los países de la unión europea, asiáticos y africanos [13] en la actualidad existen diversos índices, con sus propias características que alcanzaron buenos resultados en los lugares donde se aplicaron [4], [14].
El presente trabajo de investigación evalúa la calidad del agua superficial del río Chili empleada para el riego de plantas y vegetales, mediante el análisis de parámetros fisicoquímicos, a los cuales se les aplicará el índice general de contaminación y el índice de calidad, así conocer la calidad del río en evaluación.
2 METODOLOGÍA
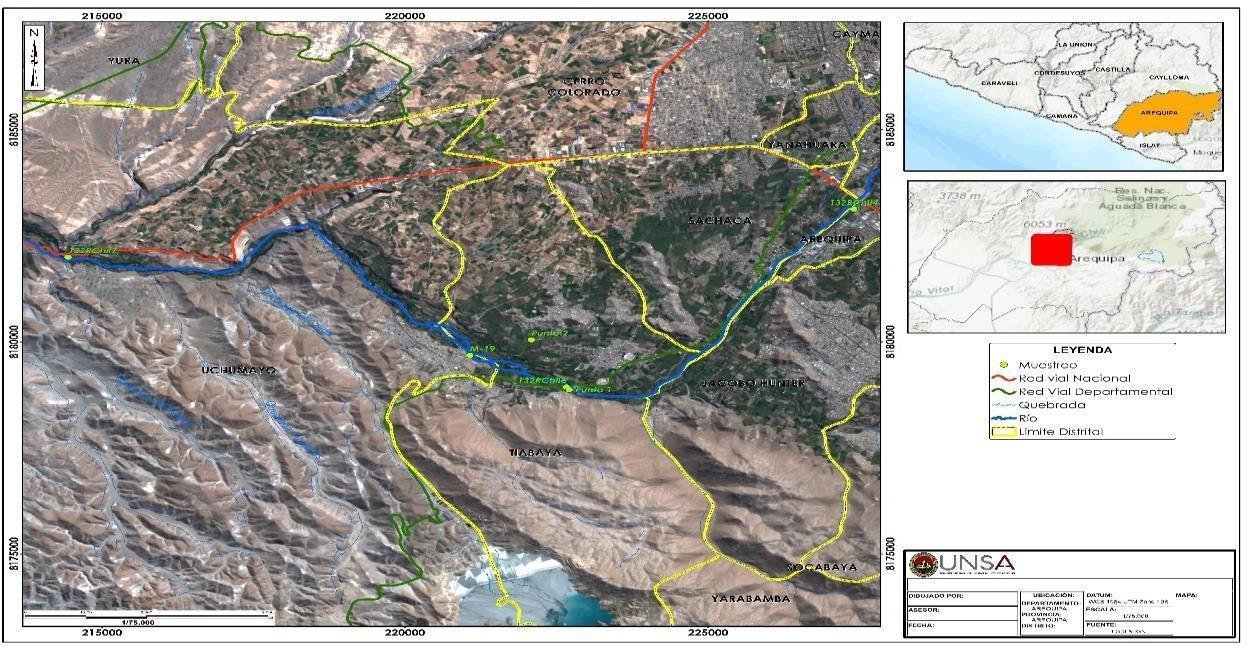
Los puntos de muestreo se geo-referenciaron con el equipo Garmin ETREX 10, los cuales se encuentran ubicados en la parte media de la cuenca Quilca-VitorChili (figura 1), el muestreo se realizó en las épocas húmedas y secas de los años 2017, 2018 y 2019.
2.1 Índice de calidad de agua (ICA-PE)
El ICA-PE, es una herramienta matemática que integra información de varios parámetros para ser transformados en una escala única de medición, con una valoración entre 0-100, donde cero (0) es pésimo y cien (100) es excelente [4].
Para la determinación del ICA-PE, se trabajaron tres factores los cuales son:
F1-Alcance: representado por la cantidad de parámetros que no cumplen con los estándares de calidad ambiental (ECA) para agua Ec. (1).
��
�����������������������������������
��1 = ��°����������������á�������������� ��������������
F2-Frecuencia: representado por la cantidad de datos de los monitoreos que no cumplen con los ECA Ec. (2).
��°������á������������������������������������ ������������������
��2= ��°���������������������������� (2)
F3-Amplitud: son los excesos de todos los datos
Caso 2: cuando el valor de concentración es menor al valor establecido en los ECA, su cálculo se realiza con la siguiente Ec. (6):
���������������� ��������
����
���� = �������������������������������� �������� 1 (6)
Calculados los tres factores (F1, F2 y F3), se procede a calcular el ICA-PE con la siguiente Ec. (7):
El valor calculado es un número adimensional comprendido entre un rango 0-100, dondese estableció cinco rangos.
2.2 Índice General de Contaminación (OIP)
El OIP fue propuesto por Sargaonkar & con respecto al número total de datos Ec. (3).
Deshpande [15] para la evaluación de la calidad de agua superficial, siendo una técnica simple de estimar
��3 ∑��������������������(������) = ∑��������������������(������)+1 ∗100 (3) y flexible para la adición o eliminación de parámetros.
El valor OIP final se estimó con la Ec. (8):
Donde la suma de excedentes (nse) se calcula con la siguiente Ec. (4): 1
������ = �� (8)
∑ = ������������������ ��=1 ��
������= �� 1 �� ������������������������
En la nse se presentan dos casos:
(4)
Caso 1: cuando el valor de concentración del parámetro supera el valor establecido en la norma, su cálculo se realiza con la siguiente Ec. (5):
Donde, Pi = Valor del índice de contaminación para el i-ésimo parámetro, i = i-ésimo parámetro 1.2.3…n, n= número de parámetros.
La puntuación del índice numérico final se utilizó para distribuir la calidad del agua en diferentes clases de contaminación, se muestran en la tabla 5.
Tabla 1: Clasificación del índice general de contaminación (OIP).
Clasificación Excelente Aceptable Ligeramente
contaminado
Muy contaminado
3 RESULTADOS Y DISCUSIÓN
En la figura 2, se observa los resultados de la evaluación del ICA-PE sobre las aguas superficiales del río Chili.

Los resultados obtenidos en la temporada seca, indican que en las estaciones de monitoreo M-19, 132RChil4, 132RChil6 y 132RChil7 tienen una calificación de bueno, estas aguas superficiales están un poco distanciado de su calidad natural, la estación Punto2.1 tuvo una calificación de excelente, siendo sus condiciones muy cercanas a niveles naturales. En la temporada húmeda, las estaciones 132RChil4, M-19 y Punto2.1 obtuvieron una calificación de regular, alejándose de los valores deseables, siendo contaminadas ocasionalmente; las estaciones 132RChil6 y 132RChil7 obtuvieron una calificación de bueno y excelente respectivamente. En comparación con Laura [16], en la parte alta del río Chili obtuvo una calificación entre excelente y bueno, en la parte media del río obtuvo la misma calificación que la parte alta, mientrasque laparte bajadelrío obtuvounacalificación regular, de la misma forma, Velarde [17], evaluó la calidad del río Chili mediante la metodología de la National Sanitation Foundation (NSF) en cuatro
puntos puente San Martin, puente Tingo, puente Tiabaya, puente Huayco, todos pertenecientes a la parte media del río, donde la calificación se encontró entre buena a mala calidad, Zotou et al. [7], evaluaron la calidad de las aguas del río Vosvoriz en el norte de Grecia, los resultados mediante la metodología NSF WQI y el índice de Bhargava clasificaron las aguas en una calidad excelente, mientras que el índice de Prati lo califico como aguas ligeramente contaminadas; Wang et al. [18], evaluaron la calidad del río Citarum en Indonesia, mediante la metodología NSF WQI y OWQI en los meses húmedos y secos durante los años 2011 a 2019, donde las aguas del río Citarum presentaron una calidad de regular a mala durante la época seca y húmeda mediante la metodología NSF WQI y una clasificación de muy mala según la metodología QWQI para las dos épocas del año.
En la figura 3, se observa los resultados de la evaluación de OIP sobre las aguas superficiales del río Chili.

Ligeramente Contaminado Contaminado Muy Contaminado M-19 132Rchil4 132Rchil6
Estaciones de Monitoreo 132Rchil7 Punto
SECA HUMEDA Excelente Aceptable
Figura 3: Resultados de OIP en temporada seca y húmeda del río Chili.
Los resultados en la temporada seca indicaron que las estaciones M-19, 132RChil4 y 132RChil6 obtuvieron una calificación de ligeramente contaminado, mientras que las estaciones 132RChil7 y Punto2.1 obtuvieron una calificación de contaminado, en comparación con la temporada húmeda, donde las estaciones M-19 y 132RChil4 tuvieron una calificación de contaminado y las estaciones 132RChil6, 132RChil7 y Punto2.1 tuvieron una calificación de ligeramente contaminado, esto debido a la presencia de materia orgánica transportada desde la parte alta del río, Matta etal.[19],evaluaronlacalidaddelríoGangesenlaIndia mediante la metodología NSFWQI, OIP y multivariado, los resultados se encontraron en una calificación de medio y buena calidad en los sitios de muestreo seleccionados, identificando residuos agrícolas y efluentes industriales como los principales contribuyentes a la disminución de la calidad de las aguas superficiales del río, Pandit et al. [20], evaluaron los cuerpos de agua de las zonas de Surajkund and Rani Pond, Aurangabad, Bihar en la India, mediante el OIP, los resultados fueron, Surajkund era aceptable (C2), pero Rani Pond y Surajkund durante la temporada de verano estaban ligeramente contaminados (C3). Los valores 74.18–233.89 del Índice de calidad del agua infirieron que el estado promedio del agua de Surajkund y Rani Pond estaba levemente contaminado (C3). Sin embargo, según la estación, la calidad del agua de Surajkund era aceptable (C2), pero el estanque Rani se encontró entre levemente contaminado (C3) ha contaminado (C4), se identificaron efluentes sin tratar de diversas actividades económicas descargando a los cuerpos de agua; mientras que Li et al. [21], evaluaron la calidad de las aguas del río Qu en Sichuan, China durante los años 2006 a 2010 mediante la metodología del OIP mejorado, los resultados mostraron que el río presenta una tendencia a una clase de agua contaminado; Effendi [22], evaluó la calidad de tres cuerpos de agua comosonelríoCihideung,ríoCiapusy el lago de PPHL en Indonesia, donde los resultados mostraron que los cuerpos de agua se encontraron en buen estado de calidad con un índice que oscila entre 0.728 a 0.892 y Wang et al. [18], evaluaron el río Erdao Songhua en China mediante el índice mejorado de contaminación (IWPI) entre los años 2015 a 2020, donde sus resultados mostraron una calidad buena (IWPI<40), donde la época de invierno obtuvo mejor calidad de agua a comparación con la época de verano.
4 CONCLUSIONES
De la evaluación por los dos métodos de índice de calidad se pudo concluir que la calidad de las aguas superficiales del rio Chili según el ICA-PE obtuvo una calificación entre excelente a regular a comparación del OIP el cual lo clasificó entre ligeramente contaminado a contaminado, dichas aguas son afectadas por los vertimientos de efluentes industriales y residuos sólidos presentes en las riberas del río, esto debido a que en la zona de estudio presenta la mayor densidad poblacional de la ciudad de Arequipa.
5 BIBLIOGRAFÍA
[1] PNUD, “Lanzamiento de la Alianza Mundial para la Calidad del agua para abordar la crisis mundial del agua.,” Programa las Nac. Unidas para el Medio Ambient., 2019, [Online]. Available: https://www.unep.org/news-and-stories/pressrelease/world-water-quality-alliance-launchedtackle-global-water-crisis.
[2] I. Bashir, F. A. Lone, R. A. Bhat, S. A. Mir, Z. A. Dar, and S. A. Dar, “Concerns and threats of contamination on aquatic ecosystems,” Bioremediation Biotechnol. Sustain. Approaches to Pollut. Degrad., pp. 1–26, 2020, doi: 10.1007/978-3030-35691-0_1.
[3] M. J. Sagasta, S. M. Zadeh, H. Turral, and J. Nurke, “Contaminación del agua por la agricultura: Una revisión mundial. La Organización para la Agricultura y la Alimentación.,” Organ. las Nac. Unidas para la Aliment. y la Agric., 2017.
[4] ANA, “Metodología para la determinación del índice de calidad de agua ICA-PE aplicado a los cuerpos de agua continentales superficiales.,” Minist. Agric. y Riego, 2018.
[5] M. G. Uddin, S. Nash, and A. I. Olbert, “A review of water quality index models and their use for assessing surface water quality,” Ecol. Indic., vol. 122, p. 107218, 2021, doi: 10.1016/j.ecolind.2020.107218.
[6] P. Carsten Von Der Ohe, A. Prüß, R. B. Schäfer, M. Liess, E. De Deckere, and W. Brack, “Water quality indices across Europe - A comparison of the good ecological status of five river basins,” J. Environ. Monit., vol. 9, no. 9, pp. 970–978, 2007, doi: 10.1039/b704699p.
[7] I. Zotou, V. A. Tsihrintzis, and G. D. Gikas, “Performance of Seven Water Quality Indices (WQIs) in a Mediterranean River,” Environ. Monit. Assess., vol.191, no.8,2019,doi: 10.1007/s10661-019-76524.
[8] J.Falcon, “Identification ySistematizacióndefuentes de contaminación del río Quilca-Vítor-Chili.,” Minist.
del Ambient., pp. 1–5, 2009.
[9] T. Abbasi and S. Abbasi, “Índice de calidad del agua.,” 2012, [Online]. Available: 10.1016/C2010-069472-7.
[10] S. G. Nives, “Evaluación de la calidad de agua por índices en dalmacia.,” Agua Res, vol. 33, pp. 3423–3440, 1999, [Online]. Available: https://doi.org/10.1016/s0043-1354(99)00063-9.
[11] A. D. Sutadian, N. Muttil, A. G. Yilmaz, and B. J. C. Perera, “Development of a water quality index for rivers in West Java Province, Indonesia,” Ecol. Indic., vol. 85, no. November 2017, pp. 966–982, 2018, doi: 10.1016/j.ecolind.2017.11.049.
[12] R. K. Horton, “An index number system for rating water quality.,” J Water Pollut Control Fed., vol. 37, no. 3, pp. 300–306, 1965.
[13] S. Tyagi, B. Sharma, P. Singh, and R. Dobhal, “Evaluación de la calidad del agua en términos de índice de calidad del agua.,” J. Recur. Hídricos, vol. 1, no. 3, pp. 34–38, 2013.
[14] A. K. Chaurasia, H. K. Pandey, S. K. Tiwari, R. Prakash, P. Pandey, and A. Ram, “Evaluación de la calidad del agua subterránea utilizando el índice de calidad del agua (WQI) en partes del distrito de Varanasi, Uttar Pradesh, India.,” J. Geol. Soc. India, vol. 92, no. 1, pp. 76–82, 2018.
[15] A. Sargaonkar and V. Deshpande, “Development of an overall index of pollution for surface water based on a general classificationscheme in Indian context.,” Env. Monit Assess., vol. 89, pp. 43–47, 2003.
[16] J. R. Laura, “Gestión de la calidad del agua del río Chili mediante el empleo de índices físicoquímicos de calidad ambiental, Arequipa.,” Universidad Nacional de San Agustin de Arequipa, 2019.
[17] B.Velarde, “Índicede calidad de agua superficial del
río Chili en el sector de Sachaca-Tiabaya-Huayco.,” Univ. Nac. San Agustín Arequipa, pp. 1–159, 2016, [Online]. Available: file:///Users/andreataquez/Downloads/guia-plan-demejora-
institucional.pdf%0Ahttp://salud.tabasco.gob.mx/con tent/revista%0Ahttp://www.revistaalad.com/pdfs/Gui as_ALAD_11_Nov_2013.pdf%0Ahttp://dx.doi.org/10 .15446/revfacmed.v66n3.60060.%0Ahttp://www.cen etec.
[18] B. Wang, Y. Wang, and S. Wang, “Improved water pollution index for determining spatiotemporal water quality dynamics: Case study in the Erdao Songhua River Basin, China,” Ecol. Indic., vol. 129, p. 107931, 2021, doi: 10.1016/j.ecolind.2021.107931.
[19] G. Matta, A. Nayak, A. Kumar, and P. Kumar, “Water quality assessment using NSFWQI, OIP and multivariate techniques of Ganga River system, Uttarakhand, India,” Appl. Water Sci., vol. 10, no. 9, pp. 1–12, 2020, doi: 10.1007/s13201-020-01288-y.
[20] D. N. Pandit, R. Kumari, and S. K. Shitanshu, “A comparative assessment of the status of Surajkund and Rani Pond, Aurangabad, Bihar, India using overall Index of Pollution and Water Quality Index,” Acta Ecol. Sin.,vol. 42, no. 3, pp. 149–155, 2022, doi: 10.1016/j.chnaes.2020.11.009.
[21] R. Li, Z. Zou, and Y. An, “Water quality assessment in Qu River based on fuzzy water pollution index method,” J. Environ. Sci. (China), vol. 50, pp. 87–92, 2016, doi: 10.1016/j.jes.2016.03.030.
[22] H. Effendi, “River Water Quality Preliminary Rapid Assessment Using Pollution Index,” Procedia Environ. Sci., vol. 33, pp. 562–567, 2016, doi: 10.1016/j.proenv.2016.03.108.
CARACTERIZACIÓN FISICOQUÍMICA DEL MANGO (Mangifera Indica)
PHYSICOCHEMICAL CHARACTERIZATION OF THE MANGO (Mangifera Indica)
Alex Gilver Huicho Ccama1 , Liam Merci Garnica Sonco2 , Luisa Alejandra Rodríguez Loza3 , Pamela Gabriela Pacho Huanacuni4 , Sergio Miguel Caceres Huanca5 & William Toledo Vilca6
Asesores: Ing. Armando Robles Fernández7 , Dra. Catalina Orfelina Rondón Saravia de Zamalloa8
1ahuicho@unsa.edu.pe, 2lgarnica@unsa.edu.pe, 3lrodriguezlo@unsa.edu.pe, 4ppacho@unsa.edu.pe, 5scacereshua@unsa.edu.pe, 6wtoledo@unsa.edu.pe, 7arobles@unsa.edu.pe, 8crondon@unsa.edu.pe
RESUMEN: En el presente trabajo se describe la caracterización fisicoquímica del mago, fruto de interés tanto en el aspecto nutricional y biofuncional, como en el aspecto tecnológico. Desde el punto de vista nutricional, el mango es una rica fuente de carbohidratos, vitaminas y antioxidantes, al residir en la ciudad de Arequipa se tiene de fácil acceso el mango tipo Edward el cual se analizó, se procedió a hacer una estructura en base a la literatura de la caracterización de Mango, se realizaron cinco determinaciones (determinación de humedad, cenizas, proteínas, grasas y azúcares) para dar a conocer si el mango es aceptable para la realización de la fruta confitada de mango según diferentes estándares y normas encontradas. Se obtuvo como resultados que 4 de las 5 determinaciones realizadas, fueron aceptadas en base a las normas nutricionales establecidas y por último se procedió a hacer las observaciones y recomendaciones
Palabras clave: Caracterización Fisicoquímica, Mango, Mango Edward
ABSTRACT: In the present work, the physicochemical characterization of the magician is described, fruit of interest both in the nutritional and biofunctional aspect, as well as in the technological aspect. From the nutritional point of view, the mango is a rich source of carbohydrates, vitamins and antioxidants, residing in the city of Arequipa, the Edward type mango is easily accessible, which was analyzed, a structure was made based on literature on the characterization of Mango, five determinations were made (determination of moisture, ashes, proteins, fats and sugars) to make known if the mango is acceptable for therealization of mangocandied fruitaccordingtodifferent standards and norms found. It was obtained as results that 4 of the 5 determinations made were accepted based on the established nutritional standards and finally the observations and recommendations were made.
Keywords: Physicochemical Characterization, Mango, Mango Edward
INTRODUCCIÓN
La caracterización fisicoquímica es sumamente importante para poder diseñar y controlar el proceso de investigación de la obtención de la fruta confitada a partir del mango.
La presente investigación surge de la necesidad de conocer las características fisicoquímicas del mango, con el propósito de determinar parámetros fisicoquímicos, a través de modelos matemáticos que expliquen el comportamiento de cada una de las variables.
Se haráusoypruebadevariasdeterminaciones como el porcentaje de humedad cenizas la cantidad de grasas, proteínas y azúcares, para poder controlar el proceso de investigación de la obtención de la fruta confitada de mango.
Objetivo Principal
• Obtener la caracterización fisicoquímica del mango.
Objetivos específicos
• Obtener las determinaciones de humedad, grasas, proteínas, cenizas y azúcares del mango
• Determinar la influencia que tienen los diferentes en la obtención de la fruta confitada de mango.
METODOLOGÍA
• Muestra: Pulpa de Mango Edwar
• Procedencia: Departamento de Madre de Dios
Pruebas Realizadas:
• Determinación de Humedad, se pesó 3 gr de muestra (encuadradosde0.5x0.5cmaprox.),secolocóenuncrisol previamente secado en estufa y pesado, dejar en la estufa por un rango de 1 a 2 horas a 150 ºC cuidando de que no se queme, transcurrido el tiempo se deja enfriar, se pesa y con los datos obtenidos se realizan los cálculos.

• Determinación de Ceniza,se pesó 1 gramo de muestra, se colocó en un crisol previamente secado en estufa y pesado, se introdujo en la mufla por 1 hora a 500 °C, transcurrido el tiempo se retiró luego se pasó al desecador, se pesó y se realizaron los cálculos [1].
• La muestra seca, se realizó la Determinaciones de Grasas, se pesa 5gr de muestra, se transfiere el material deshidratado a un cartucho de extracción, dentro del extractor. Se agregó al balón de extracción el disolvente (hexano) y se extrajo durante 3 horas como mínimo. Ya finalizada la extracción separar disolvente de la grasa, se dejó enfriar y se pesó el balón de extracción más grasa, se realizó los cálculos [2]–[4].


Figura 3: Masa del balón más grasa
• Determinación de Proteínas, realizamos las 3 etapas digestión, destilación y titulación. Se pesó 0.2572g de muestra y se introdujo en una fiola para la digestión, se le agregó 4 ml de H2SO4, se procedió con la digestión durante 4 min a 440ºC, luego se añadió 10 ml de peróxido de hidrógeno al 50% hasta que el digesto se aclaró. Se diluyó el digesto con 50 ml de agua destilada y se dejó enfriar por 5 min, se trasvaso el digesto a un balón de destilación y se le añade 13 ml de Hidróxido de Sodio al 50%.
En un vaso de precipitados de 100ml se vierte 12.5ml de Ácido Bórico al 4% y se le agrega el indicador azul de metileno y rojo de metilo. Se conectó el Equipo de Destilación y el destilado (amoniaco) se hizo burbujear en vaso con Ácido Bórico hasta que la solución aumente su volumen aproximadamente 30ml tomando una coloración verdosa. La solución obtenida se valoró con ácido sulfúrico 01.N hasta que la solución viro de verde a violeta. Con los datos obtenidos se realizaron los cálculos[5].
• El jugo del fruto, se realizó la Determinación de Azucares, se dejó caer 3 gotas de jugo de mango en el prisma principal. Se colocó el refractómetro con la muestra hacia la luz y se anotó el dato observado (°Brix).
Figura 1: Muestra húmeda de mango Figura 2: Muestra seca de mango
RESULTADOS Y DISCUSIÓN
Tabla 1: Resultados de las Determinaciones realizadas Tipo de
1. Determinación de Humedad
• El Porcentaje de Humedad obtenido fue de 82.67 %, según [6], nos indican que la pulpa del mango maduro debe encontrarse entre 78.9%
• 82.8%, podemos deducir que el porcentaje de humedad obtenida se encuentra dentro del rango establecido.
2. Determinación de Cenizas
• El Porcentaje de Cenizas obtenido del mango fue de 0.4183% y según [6], nos indican que la pulpa del mango maduro debe encontrarse entre 0.34%
• 0.52%, entonces el % de cenizas se encuentra dentro del rango establecido
3. Determinación de Grasas
• De acuerdo a los resultados, el porcentaje de grasa fue de 1.6416% que difiere del valor de [5]. el cual indica que es de 0.4%.
4. Determinación de Proteínas
Según [5], el porcentaje de proteínas promedio de pulpa de mango(x100g), es de 0.8% y si comparamos con el porcentaje obtenido, que fue de 0.78%, entonces el % se encuentra dentro del rango establecido.
5. Determinación de Azucares La muestra obtenida, arroja un valor de 14.5° Brix , según la CODEX-STAN-
247-2005 [7] nos indica que el valor mínimo en ° Brix para el mango es de 13.5 ° Brix a 20 ºC, al comparar, se encuentra dentro del rango establecido.
CONCLUSIONES
• Se realizó la caracterización fisicoquímica del mango.
• Se realizaron las determinaciones y se realizó la comparación con los intervalos de % encontrados en diferentes trabajos.
• Los valores obtenidos son losadecuados,nuestro mango “EDWARD”esdecalidadyaptoparaconsumo,por ello se puede realizar con éxito la obtención de la fruta confitada.
BIBLIOGRAFÍA
[1] K. Vano H, Y. Jiménez, y M. G. de Núñez, “Evaluación delaincertidumbreenladeterminacióngravimétricade humedad, cenizas, grasa y fibra cruda”, Revista Ingeniería UC, vol. 16, núm. 2, pp. 27–33, 2009, Consultado: el 16 de junio de 2023. [En línea]. Disponible en: https://www.redalyc.org/pdf/707/70717501005.pdf
[2] R. C. Reis, A. M. Ramos, Regazzi A J, V. P. R. Minim, y P. C. Stringueta, “Almacenamiento de mango secado: análisis fisicoquímico, microbiológico, color y sensorial”, Revista Ciencia y Tecnología Alimentaria, vol. 5, núm. 3, pp. 214–225, 2006.
[3] J. L. Serrato, M. A. Beltrán, y Y. M. Zapata, “Physicochemical characterization of the fat contained in the native mango (Mangifera indica) seed”, Revista de Ciencias de la Agroindustria,vol.1,pp.57–60,2019.
[4] F. J. Rojas y F. Burbano, “Efecto de un pretatamiento enzimático en el proceso de obtención de aceite de la semilla de mango (Mangifera Indica L.)”, Trabajo de gradopresentadocomorequisitoparaoptaraltítulode IngenierodeAlimentos, UniversidaddelValle, Santiago de Cali, 2011. Consultado: el 16 de junio de 2023. [En línea]. Disponible en: https://bibliotecadigital.univalle.edu.co/bitstream/handl e/10893/4162/CB0439026.pdf;jsessionid=B47F166A7E7EDC0EF3C0D 00FE903CFBB?sequence=4
[5] A. Wall et al., “El mango: aspectos agroindustriales, valor nutricional/funcional y efectos en la salud”, Revista Nutrición, vol. 31, núm. 1, pp. 67–75, 2015, Consultado: el 16 de junio de 2023. [En línea]. Disponible en: https://www.aulamedica.es/nh/pdf/7701.pdf
[6] R. N. Tharanathan, Yashoda H M, y Prabha T N, “Mango (Mangifera indica L.), ‘The King of Fruits’-An Overview”, Journal Food Reviews International , vol. 22, núm. 2, pp. 95–123, 2006.
[7] ComisióndelCodexAlimentarius, Norma General Para Zumos (Jugos) y Néctares de Frutas (CODEX STAN 247-2005) 2005. Consultado: el 16 de junio de 2023. [Enlínea].Disponibleen: https://www.fao.org/fao-whocodexalimentarius/shproxy/en/?lnk=1&url=https%253A%252F%252Fworks pace.fao.org%252Fsites%252Fcodex%252FStandard s%252FCXS%2B247-2005%252FCXS_247s.pdf
Figura 4: Resultado de azúcares en °BrixSostenibilidad de la Generación Eléctrica en el Perú a partir de Centrales Térmicas de Ciclo Combinado con Gas Natural de Camisea
CarmenNelly, GorritiGallegos1 , Víctor Ludgardo,Álvarez Tohalino2
1cgorriti@unsa.edu.pe, 2vtohalino@unsa.edu.pe
RESUMEN
Las Centrales térmicas de ciclo combinado en el Perú constituyen una alternativa eficiente y viable para la sostenibilidad de la generación eléctrica en nuestro país porque utilizan un valioso recurso natural peruano, es decir el gas de Camisea lo que se ha visto reflejado en un aumento de la competitividad eléctrica en la región. Los ciclos termodinámicos combinados alcanzan rendimientos óptimos de potencia y no son ambientalmente impactantes.
Palabras Clave: Ciclo Combinado, Camisea, rendimiento, turbina.
ABSTRACT
Combined cycle power plants in Peru constitute an efficient and viable alternative for the sustainability of electricity generation in our country because they use a valuable Peruvian natural resource, that is, Camisea gas, which has been reflected in an increase in the electricity competitiveness in the region. Combined thermodynamic cycles achieve optimal power yields and are not environmentally impactful.
Key Words: Combined cycle, Camisea, performance, turbine.
Introducción
Desde que el gas natural de Camisea en nuestro país se ha utilizado como un insumo regular disponible de fuente primaria, se ha incrementado notablemente la eficiencia en la generación de electricidad y reducido sus costos, los cuales son comparativamente inferiores a los de otros países de la región. Esto ha mejorado implícitamentelacompetitividadperuanaeimpulsadoel crecimiento de la demanda de la energía eléctrica Nacional, favoreciendo naturalmente el crecimiento de la economía.
El Perú geopolítica y ambientalmente orienta su políticaNacionalenergéticahaciaunadiversificación de las fuentes generadoras de electricidad en la perspectiva de consolidar una nueva matriz energética que esté sostenida en el suministro de nuestros recursos naturales. Como resultado de un planeamiento estratégico que proyecta el crecimiento de la demanda eléctrica, el país se conduce a la integración de las Centrales Termoeléctricas de Ciclo combinado por su aporte significativo y creciente en el mix energético Peruano.
Las Centrales generadoras termoeléctricas con Ciclos Combinados de gas natural, representan un buen modelo energético, ya que permiten un rendimiento cercano al 60% superior al de las Centrales Eléctricas convencionales
De acuerdo a los datos proporcionados por el SEIN, para el año 2023 las principales fuentes de generación eléctrica son la hidráulica y la térmica principalmente por gas natural, tendencia que se viene observando en los últimos años debido a que las principales empresas generadoras termoeléctricas han optimizado progresivamente los ciclos de potencia convirtiéndolos a combinados.
Por otro lado, según estudios de impacto ambiental de la producción eléctrica y publicado por el estudio para la diversificación y ahorro de energía
(IDEA) la generación de electricidad con gas natural tiene menor impacto sobre el medio ambiente que los sistemas fotovoltaicos, nuclear y los sistemas de generación con carbón petróleo y lignito ,por lo tanto ésta alternativa de generación contribuye a la permanencia de una matriz energética Nacional que se caracteriza por ser ambientalmente limpia
Metodología
CicloCombinado
El Ciclo combinado combina dos ciclos termodinámicos conocidos para el aprovechamiento de energía térmica: Ciclo de Brayton (Ciclo de AireGas) y Ciclo deRankine (Ciclo de Agua-Vapor).
Este ciclo termodinámico utiliza la combustión del gas natural para generar electricidad, además los gases de escape calientes salientes del ciclo de Brayton son aprovechados para producir vapor de agua de alta calidad el cual entrega trabajo a la turbina de vapor generando electricidad. La turbina de gas y vapor se complementan lo que permite un mejor rendimiento energético a la Central generadora ya que se obtiene electricidad en dos etapas utilizando una única fuente de energía
Ciclo de Brayton
El ciclo de Brayton de un ciclo combinado aprovecha la combustión del gas natural transmitiéndolo a la turbina de expansión. Así los gases de escape salientes de la turbina son entregados a la caldera recuperadora de calor, comenzando el ciclo Rankine. La turbina de gas constituye todo el sistema del ciclo Brayton puesto que tiene como partes fundamentales el sistema de admisión de aire, compresor de aire, cámara de combustión y turbina de expansión. El rendimiento energético del ciclo Brayton abierto o cerrado en una Central térmica consigue un valor medio del 37%
Ciclo de Rankine
El ciclo de Rankine de un ciclo combinado aprovecha los gases de escape calientes salidos del ciclo de Brayton para evaporar el agua y elevar su presión, en donde es llevado a una turbina de vapor produciendo electricidad, posteriormente se produce la condensación y el agua es llevada nuevamente a la caldera recuperadora de calor, turbina de vapor, condensador y la bomba de alimentación de agua.
Figura 1.
Fuente: COES-elaborado por SNMPE

Figura 2.
Fuente: COES-elaborado por SNMPE

Figura 3.
Esquema de instalación de ciclo combinado(izquierda) y diagrama T-S derecha
Fuente: Cengel y Boles 2012

Figura 4.
Fuente: adaptado de centrales térmicas: Apuntes de Central de ciclo combinado J A Gonzáles s.f. Universidad Nacional de Tucumán
Resultados y Discusión
La utilización de ciclos combinados para la generación de energía eléctrica ha permitido un aumento integral en la eficiencia de las instalaciones térmicas. Éstos elevados rendimientos con buen factor de carga son el resultado material de disponer de un valioso recurso natural nacional, como es el gas de Camisea. En la misma perspectiva es demostrable técnicamente que los ciclos combinados demandan menores consumos de agua de refrigeración respecto a una Central convencional de igual potencia, asimismo la optimización del diseño por parte de los fabricantes ha posibilitado que hoy sean significativas las ventajas asociadas a la estandarización de componentes con la simplificación de su montaje y mantenimiento
Los ciclos combinados requieren tiempos de arranque de dos a cinco minutos aproximadamente, además como se ha mencionado previamente con el acoplamiento de los ciclos se aprovecha el calor residual de la turbina de gas para producir vapor que alimenta a una turbina de vapor asociada lo que naturalmente incide en el rendimiento del sistema
Finalmente se puede asegurar que los ciclos combinados por las emisiones bajas en NOx debido al uso del gas natural no representan para el país riesgo de contaminación.
Conclusiones
El funcionamiento y uso de Centrales termoeléctricas de ciclo combinado, utilizando como combustible el gas de Camisea es una alternativa viable que garantiza la sostenibilidad de la generación eléctrica en el país, para un límite de tiempo predecible, lo mismo puede asegurarse de la hidroelectricidad constituyéndose así en las dos fuentes generadoras más importantes en el país.
La creciente optimización de los ciclos combinadoslossitúaen rendimientoscercanos al60%.
En las Centrales termoeléctricas de ciclo combinado es el compresor el que realiza el mayor trabajo puesto que tiene que elevar la temperatura y la
presión de la masa de aire proveniente del sistema de admisión de aire.
Las Centrales hidroeléctricas de ciclo combinado facilitan la integración de energías renovables intermitentes y tienen bajo impacto ambiental.
Bibliografía
[1] Boletín estadístico Mensual Sociedad Nacional de Minería y Petróleo abril 2023.
[2] La Industria del Gas Natural en el Perú. Mirando al Bicentenario y perspectivas recientes OSINERGMIN 2021 htpps://www.gob.pe/
[3] Gonzales, J. (s.f.). Centrales Térmicas: Apuntes de Centrales de Ciclo de Brayton. Universidad Nacional de Tucumán.
https://catedras.facet.unt.edu.ar/centraleselectricas/wpcontent/uploads/sites/19/2014/10/Apunte-TG-1.pdf
[4] Inmaculada, D. y Robles, A. (s.f.). Centrales de Generación de Energía Eléctrica. Unidad Didáctica 4: Centrales Térmicas. Universidad de Cantabria. https://ocw.unican.es/pluginfile.php/1160/ course/section/1407/bloque-energia-IV.pdf
[5] DirecciónGeneraldeElectricidad(DGE).InformativoDGE N° 10 octubre 2006. Noviembre de 2006 (Perú).
[6] Paredes, S. (2015). Análisis termodinámico de los ciclos de Rankine. Universitat Politécnica de Catalunya Barcelona tech.
https://upcommons.upc.edu/bitstream/handle/2099.1/259 38/TFG%20 Sergi%20Fuste.pdf
MODELAMIENTO DE LOS PROCESOS DE EQUILIBRIO EN LA ADSORCION DE PLOMO (II) MEDIANTE UN COMPOSITO PIEDRA LAJACERAMICO
Silvana Mercedes Vizcarra Nuñez1 , Jane Mara Linares Pomareda1
1svizcarra@unsa.edu.pe jlinaresp@unsa.edu.pe
Universidad Nacional de San Agustín Escuela Profesional de Ingeniería Química
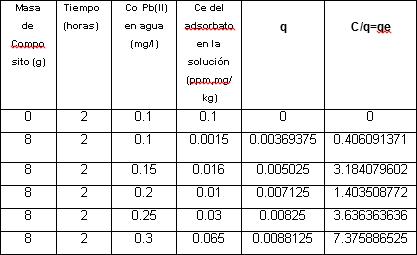
Resumen: La contaminación del agua con metales pesados es un problema crucial en Perú, donde la actividad minera es muy intensa, puntualmente el plomo debido a su alta toxicidad resulta ser de especial interés cuando de descontaminación de agua se trata. La adsorción constituye una metodología viable en la remoción del plomo, su eficacia radica en la eficiencia del adsorbente utilizado, se investigó sobre el aprovechamiento de algunos residuos de los revestimientos de obras civiles, tal como el cerámico y residuos de la explotación de piedra laja, generando de la mezcla de ambos materiales en una proporción de 50% cada uno, un composito. Para identificar la efectividad del composito se modelo sus procesos de equilibrio en la adsorción de Plomo II. En el presente trabajo de investigación se consideró para el análisis de estos modelos, la preparación de soluciones a concentraciones 0.1; 0.15, 0.20, 0.25, 0.30 ppm de Plomo II. Manteniendo constante la masa del adsorbente en 8 g/l y el tiempo de 2 horas, se llevaron las soluciones de las concentraciones indicadas a agitación a 500 RPM. Se logró determinar que el modelo de Langmiur es el que mejor explica la adsorción del plomo.
Palabras claves: piedra laja, cerámico, composito, plomo, adsorción
Abstract The contamination of water with heavy metals is a crucial problem in Peru, where mining activity is very intense. Lead, due to its high toxicity, is of special interest when it comes to decontaminating water. The adsorption constitutes a viable methodology in the removal of lead, its effectiveness lies in the efficiency of the adsorbent used, the use of some residues of the coatings of civil works, such as ceramics and residues from the exploitation of flagstone, was investigated. generating from the mixture of both materials in a proportion of 50% each, a composite. To identify the effectiveness of the composite, its equilibrium processes in the adsorption of Lead II were modeled. In the present research work, for the analysis of these models, the preparation of solutions at concentrations of 0.1 was considered; 0.15, 0.20, 0.25, 0.30 ppm Lead II. Keeping the mass of the adsorbent constant at 8 g/l and the time of 2 hours, the solutions of the indicated concentrations were stirred at 500 RPM. It was possible to determine that the Langmiur model is the one that best explains lead adsorption
Keywords: flagstone, ceramic, composite, lead, adsorption
INTRODUCCION
La adsorción es un fenómeno superficial consistente constituyentes del denominado adsorbato, sobre una superficie en contacte con él, que constituye el adsorbente. En general se trata de un fenómeno dinámico en el que continuamente se produce el choque y retención de las moléculas del fluido sobre la superficie del adsorbente, y la liberación y retorno de dichas moléculas a la fase fluida. Es evidente que la permanencia de las moléculas sobre la superficie del adsorbente determina, en promedio, una concentración superficial mayor que la correspondiente a la fase fluida. Aunque la superficie interfacial pueda ser cualquiera, es habitual que la denominación de adsorción se restrinja al caso de una superficie adsorbente sólida, y un fluido portador del adsorbente gas o líquido. (Orihuela Iranzo, 2015)
El equilibrio en el proceso de adsorción viene explicado por el hecho de que en un momento dado la velocidad con que las partículas del sorbato se adhieren al adsorbente es exactamente igual a la velocidad en que las partículas del
, adsorbato se retiran del adsorbente. Es en ese movimiento de moléculas que se va a ir recubriendo el material adsorbente, es decir llenando los sitios vacíos, lo cual puede explicarse asumiendo diferentes modelos. Dentro de los más utilizados está el modelo de Langmuir y el modelo de Freundlich
Con el fin de poder cuantificar el proceso de adsorción, se recurre al cálculo de los parámetros de capacidad de adsorción y afinidad del adsorbente por un determinado metal, mediante el ajuste de los datos experimentales a una isoterma de adsorción. La isoterma de adsorción puede definirse como la relación de equilibrio entre la concentración del adsorbato en la fase fluida y la concentración de partículas de adsorbente, a una temperatura determinada.
METODOLOGIA
Obtención del Composito a partir de piedra laja y cerámico
Para la obtención del composito se : selecciono la Piedra Laja provieniente de los yacimientos del distrito de Yura y restos de cerámicos utilizados para los acabados en viviendas, y se molieron ambos materiales por separado a malla 200. La dosificación del composito fue a partes iguales, mezclándose y homogenizándose. Seguidamente se activó la mezcla con ácido acético glacial al 25% en masa, y una relación composito con la solución de ácido acético de 1:2 (en masa) (REVISTA PRODUCCIÓN
+ LIMPIA–Vol. 14 No 2–2019–D. Montaño. ARCILLAS
ACTIVADAS PARA EL BLANQUEAMIENTO DEL ACEITE DE PALMA.) con agitación durante 4 horas.
La suspensión del composito activado así obtenida fue lavada repetidamente con agua destilada hasta que el pH del sobrenadante alcanzará 5.5.
El composito fue secado al medio ambiente hasta que el contenido de humedad fuera menos del 8% de su peso. Para determinar características del composito antes y después de la adsorción se le analizo con Microscopía Electrónica de Rastreo SEM – EDX (Scanning Electron
Microscopy - Energy Dispersive X-ray spectroscopy)
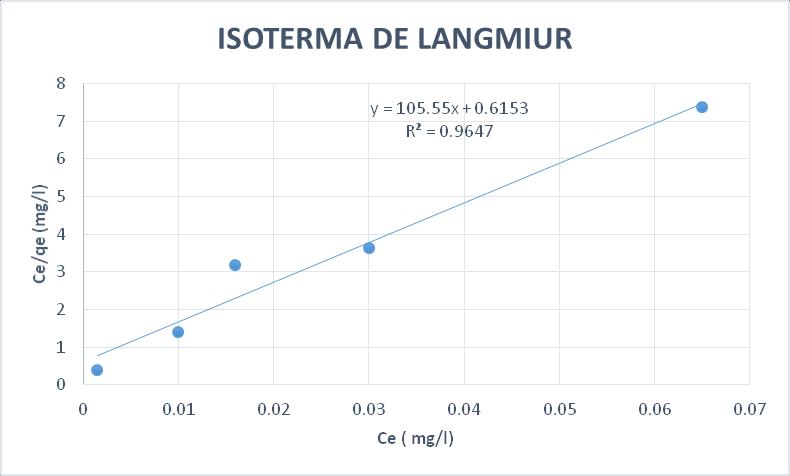
Grafica N° 1 Isoterma de Langmiur
Ecuación del modelo de Langmuir:
���� =���������������� 1+��������
La forma linealizada del modelo: (1)
Para el análisis de los modelo de Langmuir y de Freundlich ���� = ( ���� ��������
se consideró la preparación de soluciones a concentraciones 0.1; 0.15, 0.20, 0.25, 0.30 ppm de Plomo II. Manteniendo constante la masa del adsorbente en 8 g/l y el tiempo de 2 horas, sometiéndose las soluciones de las concentraciones indicadas a agitación a 500 RPM.
RESULTADOS Y DISCUSION
Modelo Langmiur La construcción de la isoterma de Langmuir se realizó con los resultados obtenidos durante el proceso de adsorción de Plomo,
Tabla 1 Isoterma de Langmuir
Calculo de los parámetros KL y qmax
De la ecuación de la isoterma Y = 105.55x + 0.6153
Pendiente = 105.55
Ordenada = 0.6153
Calculo de qmax
1 = 0.6153 �������� = 1.625 mg/g
��������
Calculo de la Constante de Langmiur KL
1 ���� �������� = 105.55 KL = 0.00583
Constante de equilibrio de Langmuir o equilibrio correspondiente al proceso de adsorción (L/mg) es responsable de la fácil captación de los iones metálicos sobre el material adsorbente
Coeficiente de Determinación R2 = 0.9647
El coeficiente de determinación R2 proporciona información sobre el comportamiento del conjunto de datos de la línea de ajuste, expresado también en porcentaje, significa que el 96,47 % de datos están mejor representados por el modelo de Langmiur
Modelo Freundlich
La construcción de la isoterma de Freundlich se realizó de acuerdo a la siguiente Tabla en la cual se muestran los datos obtenidos durante el proceso de adsorción de Plomo, utilizando el composito Piedra Laja -Cerámico como adsorbente, para las distintas concentraciones utilizadas ������������
Tabla 2 Isoterma de Freundlich

Grafico 2 Isoterma de Freundlich
La ecuación de la isoterma
Y = 0.2286x - 1.7769
La expresión matemática de este modelo es:
���� = �������� 1 �� (3)
El ajuste lineal de la expresión en forma logarítmica es:
���������� = 1/�� ���������� + ���������� (4)
CALCULO DE LAS CONSTANTES n y KF
De la ecuación de la Isoterm
Y = 0.2286x - 1.7769
Pendiente = 0.2286x
Ordenada = - 1.7769
Calculo de la cantidad necesaria para formar la
Mono capa
En la ecuación de la isoterma
1
El valor de la constante n representa la intensidad de la adsorción o grado de favorabilidad de adsorción, es siempre mayor que 1.
Calculo de la Constante de Freundlich KF
���������� = - 1.7769
KF = 0.0167
Coeficiente de Determinación
R2 = 0.7843
El coeficiente de determinación R2 indica que solo el 78.43% de los datos están mejor representados por el modelo de Freundlich
CONCLUSIONES
La modelización del proceso de equilibrio mediante las isotermas de Langmiur y Freundlich, permitió concluir que el modelo que mejor se adecua a la adsorción de plomo en el composito es el modelo de Langmiur, con un valor de R2 = 0.9647, frente a un valor R2 = 0.7843 para el modelo de Freundlich
El composito piedra laja cerámico es un adsorbente eficiente en la remoción de Pb II en aguas contaminadas
BIBLIOGRAFIA
[1] Adams, P., & Museum., G. (1961). Geology and Garcia Sanchez, F. (2021). DISEÑO DE UN SISTEMA DE ADSORCIÓN A BASE DE ARCILLA PARA LA REMOCIÓN DE PLOMO”. Aguascalientes.
[2] Corrales Fernandez, L. (2019). ESTUDIO DE LA CONTAMINACIÓN DE LAS AGUAS DEL RÍO TAMBO POR (Cd2+y Pb2+) Y SU REMEDIACIÓN CON SILLAR MODIFICADO, POR EL MÉTODO DE INTERCAMBIO IÓNICO. Arequipa
[3] Roque Ruiz, J. (2020). DESARROLLO DE COMPÓSITOS CERÁMICOS NANOESTRUCTURADOS PARA REMOCIÓN DE METALES EN SISTEMAS ACUOSOS. Ciudad Juarez.
[4] Sanz Villalon, M. (2019). Sistema de secuestro selectivo de metales en aguas mediante biopolímeros. Valladolid: Universidad de Valladolid.Sanz Villalon, M. (2019). Sistema de secuestro selectivo de metales en aguas mediante biopolímeros. Valadolid España: Universidad de Valladolid
OBTENCIÓN DE FRUTA CONFITADA A PARTIR DEL MANGO (Mangifera Indica)
OBTAINING CANDIED FRUIT FROM THE MANGO (Mangifera Indica)
Johan J. Castillo1 , Mercedes A. Chahua2 , Jair H. Delgado3 , Lizbeth L. Huamani4 , Carlos F. Medina5 , Edwin R. Paye6
Asesores: Ing. Armando Robles Fernández7 , Dra. Catalina O. Rondón Saravia de Zamalloa8
1jcastillocoa@unsa.edu.pe , 2mchahuaz@unsa.edu.pe , 3jdelgadocall@unsa.edu.pe, 4lhuamanicon@unsa.edu.pe , 5cmedinavi@unsa.edu.pe , 6epayech@unsa.edu.pe, 7arobles@unsa.edu.pe, 8crondon@unsa.edu.pe
RESUMEN: El presente trabajo de investigación aprovecha el mango tipo Edward utilizado como materia prima para la obtención de fruta confitada a efecto de darle valor agregado a este recurso natural. La unidad experimental fue el mango tipo Edward en el cual se estudió el efecto del estado sin madurar (verde) y el tamaño de corte fueron de 1cm3 60 g, de 1,5 cm3 son 115 g, y de 2 cm3 son 144 g de mango verde que se utilizaron en la experimentación. En la muestra de 1.5cm3 se obtuvo un rendimiento del 73.91%, el cual nos indica que esta puede ser una medida adecuada para la obtención de fruta confitada a partir del mango.
Palabras clave: Fruta confitada, jarabe, mango
ABSTRACT: The present research work takes advantage of the Edward type mango used as a raw material to obtain candied fruit in order to give added value to this natural resource. The experimental unit was the Edward-type mango in which the effect of the unripe state (green) was studied and the cut size was 1cm3 60 g, 1.5 cm3 is 115 g, and 2 cm3 is 144 g. green mango that were used in the experimentation. In the 1.5cm3 sample, a yield of 73.91% was obtained, which indicates that this may be an adequate measure for obtaining candied fruit from mango.
Keywords: Candied fruit, syrup, mango
INTRODUCCIÓN
El confitado es un método que consiste en aplicar dosis de edulcorantesa lasfrutastroceadas[1]. El procesamientode la fruta confitada consiste en aplicar dosis de jarabe, aumentando gradualmente el nivel de azúcar hasta que por transferencia osmótica ésta se incorpore a la fruta cortada la que al mismo tiempo pierde humedad [2], [3].
Radica en el movimiento del solvente a través de una membrana semipermeable, es decir, ingreso del jarabe en la fruta en reemplazo del agua interna que contiene dicho alimento [4].
La confitura es una de las diversas técnicas de agro industrialización de las diferentes variedades de frutas con un elevado contenido en fibra alimentaria [5]. Este producto de confitería utiliza altas concentraciones de azúcar para conservar el fruto por largos periodos de tiempo.
Existen varias frutas que benefician la salud, pero pocas podrían ayudar a desacelerarel proceso de envejecimiento de la piel, tales como el mango [6], [7].
Este fruto cuenta con muchas ventajas para la salud y el organismo humano, además de tratarse de una fruta muy atractiva por su aroma y dulzura que suele gustar tanto a adultos y a niños [7].
METODOLOGÍA
Sujetos de la Investigación
La población lo conforman los mangos verdes. Las muestras utilizadas son de 1cm3 60 g ,de 1,5 cm3 son 115 g , y de 2 cm3 son 144 g de mango verde que se utilizaron en la experimentación.
Métodos y Procedimientos
La recolección de información es tomada a nivel experimental, en el laboratorio de Ingeniería Química.
Materia Prima, Equipos y Materiales
Materia prima
● Pulpa de mango Equipos
● Cocina
● Balanza
Materiales
● Cuchillos de acero inoxidable
● Envases
● Recipientes de Acero Insumos y Reactivos
● Agua potable
● Azúcar blanca
● Ácido cítrico
● Bicarbonato de Sodio
● Sal Domestica
● Colorante amarillo
Procedimiento
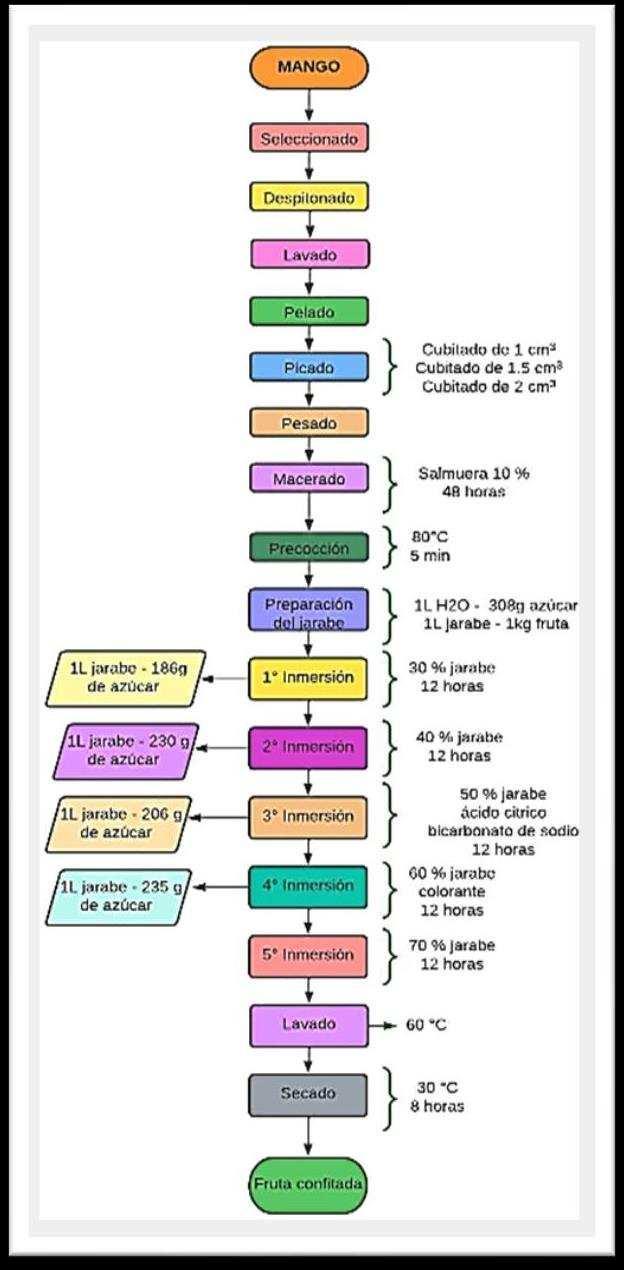
Figura 1: Representación gráfica del procedimiento
Selección
● Se seleccionan los mangos poco maduros (verdes) para la preparación de la fruta confitada.
Lavado
● Se procede a lavar los mangos con agua Del surtidor doméstico para quitar impurezas que puedan afectar a la pulpa carnosa de mango.
Pelado
● Se pela la cáscara del mango, ya que para la elaboración de la fruta confitada se utilizará la pulpa carnosa del mismo.
Picado
● Se realizará en forma de cubos con medidas
aproximadas de 1 cm3 , 1.5 cm3 y 2 cm3 (obviamente pelada y sin la pepa)
Pesado
● Se pesó las 3 muestras con medidas de 1cm3 , 1.5 cm3 y 2 cm3

Figura 2: Representación
Peso de fruta (mango) por cada muestra:
Tabla 1: Peso de las 3 muestras
Macerado
● Se preparó la salmuera en la proporción de 120gr de sal /Lt de agua.
● Una vez preparada la salmuera se procede a colocar el mango que se va a confitar. Este proceso puede durar hasta 48 horas
● Posterior al tiempo transcurrido que son las 48 horas se obtendrálos resultados del maceradoy luegoseprocedió a lavarconaguacorrienteparanocontaminarelalimento.
Tabla 2:Proporción de la salmuera
Tabla 3:Proporción de salmuera de acuerdo a la cantidad de muestra
Primera Inmersión
● Seguidamente se preparó el jarabe con un 30% de concentración deazúcar (por cada litrodeagua secoloca 380 g de azúcar y por cada kilogramo de fruta
un kilogramo de jarabe) lo que se lleva a ebullición.
● Una vez alcanzado el punto de ebullición se coloca la fruta y se dejará en cocción por 5 min.
● Transcurridos los 5 min se deja reposando a temperatura ambiente por 12 horas aproximadamente.
Tabla 4:Volumen para las tres muestras según su peso inicial
Segunda Inmersión
● Transcurridas las 12 horas, para la segunda inmersión al 40 % de jarabe, se procede a colar el jarabe de la concentración residual que se obtuvo en la primera inmersión con el fin de añadir 186 gr de azúcar por litro de jarabe.
Tabla 5:Proporción de azúcar para el jarabe
● El jarabe se lleva al punto de ebullición, se añade la fruta escurrida y se lleva a cocción por 5 minutos. Se retira del fuego, se tapa y se deja reposar por 12 horas.
Tercera Inmersión
● Transcurridas las 12 horas, para la tercera inmersión al 50 % de jarabe, se añade 230 gr de azúcar por litro de jarabe. Además, se agrega 3 gr de ácido cítrico por 10 litros de jarabe.
● El jarabe se lleva al punto de ebullición, se añade la fruta escurrida y se lleva a cocción por 5 minutos.
● Luego, se retira del fuego y se le añadió gr de bicarbonato de sodio por 10 litros de jarabe y 1 gr de colorante por 10 litros de jarabe. Se tapa y se deja reposar por 12 horas.


Tabla 6: Resultados de las muestras para la tercera inmersión
Muestra Peso del mango (g) Cantidad de jarabe residual (ml) Cantidad de azúcar añadida (g)
de ácido cítrico (g)
de bicarbonato de sodio (g)
Cuarta Inmersión
● Transcurridas las 12 horas, comenzamos con la cuarta inmersión al 60 %.
● Se basa en la relación de 206 gramos de azúcar por cada litro de jarabe realizado.
● Además de ello se añade 2 gramos de ácido cítrico y bicarbonato de sodio por 10 litros de jarabe hecho y también 1 gramo de colorante (de ser necesario).
● Una vez disuelto el azúcar en el jarabe, procedimos a esperar que alcance el punto de ebullición y dejamos pasar 5 minutos.
● Pasados los 5 minutos después de la ebullición, agregamos el bicarbonato de sodio y el colorante.
● El bicarbonato de sodio se agregó en una relación de 2 gramos por 10 litros de jarabe realizado y el colorante a 1 gramo por 10 litros de jarabe realizado.
Tabla 7:Resultados de las muestras para la cuarta inmersión
Muestra
Cantidad dejarabe residual (ml)
Cantidad de azúcar añadida (g)
Cantidad deácido cítrico (g)
Cantidad de bicarbonato desodio (g)
Cantidad de colorante (ml)
Quinta Inmersión
● Transcurridas las 12 horas, procedimos a realizar una inmersión de jarabe al 70 % para lo cual 235 gramos de azúcar por cada litro de jarabe.
● Adicionamos por cada 10 litros de jarabe
● 2.5 gramos de bicarbonato de sodio y de ácido cítrico.
● Una vez agregado el ácido cítrico y el azúcar se espera a que se disuelva completamente y se agrega la fruta llevando a ebullición
● Una vez que alcance el punto de ebullición dejaremos que pase 5 minutos y procederemos a agregar Bicarbonato de Sodio.
Lavado De Frutas
● Después del tiempo de inmersión realizaremos el escurrido para luego proceder al lavado de la fruta que se realizará con agua a temperatura a 60 grados[8].
Secado
● Finalmente dejar secar a unos 30ºC por 8h.

DISCUSIÓN Y RESULTADOS
Tabla 8:Resultados de la masa inicial de la muestra y la masa final.
Se pudo evidenciar cambios de la masa inicial respecto a la masa final de cada muestra entre la primera y la quinta inmersión.
En la muestra de 1.5cm3 se obtuvo un rendimiento del 73.91%, el cual nos indica que esta puede ser una medida adecuada para la obtención de fruta confitada a partir del mango.
En las muestras de 1cm3 y 2cm3 , los porcentajes de rendimiento resultaron ser cerca o igual al 50%, lo que demuestra que se puede obtener fruta confitada a partir de esas medidas de corte,pero por la pérdidade materiaprima (mango) no sería conveniente.
Por otro lado,sicomparamos lacantidad de jarabeobtenido luego de cada inmersión, podemos ver que los mililitros del mismo para la muestra de 1cm3 disminuyeron en cada inmersión luego de la tercera inmersión a comparación de los otros. Asimismo, en la prueba del sabor, la muestra de 1cm3 parecía tener un sabor solo a azúcar.
En una comparación general entre las tres muestras, se puede evidenciar que no es recomendable obtener fruta confitada de mango a partir de muestras cortadas en 1cm3 , ya que la cantidad de confitado obtenido será del 50% de la cantidad de fruta inicialmente utilizada, habiendo una gran pérdida.
CONCLUSIONES
● El agregado de ácido cítrico y bicarbonato de sodio le da la consistencia y hace que el azúcar no se adhiera a las paredes de la fruta confitada.
● Se añadió ácido cítrico y bicarbonato de sodio para que el producto sea mucho más natural y mantenga el olor y el saborotorgado porel jarabey el colorante haciéndolo muy agradable en comparación a los que se hace industrialmente en el mercado.
● En la obtención del confitado para cada tamaño, la muestra del corte de 1.5 cm3 fué la que tuvo mejores resultados en tamaño como en forma. Sin embargo, en sabor se destaca a la muestra de 2, ya que su dulzura es menor a las otras dos muestras.
BIBLIOGRAFÍA
[1] “Wikipedia, la enciclopedia libre”, Fruta confitada, 2023. https://es.wikipedia.org/wiki/Fruta_confitada (consultado el 16 de junio de 2023).
[2] Mircea Enachescu Dauthy, Fruit and Vegetable Processing Roma: Food and Agriculture Organization of the United Nations, 1995. Consultado: el 17de juniode 2023. [Enlínea]. Disponible en: https://fdlserver.files.wordpress.com/2008/10/fruit_and_veg etable_processing.pdf
[3] J. Morales, L. Serna, y O. B. Lopez, “Métodos combinados deconservación depapaya hawaiiana”, Revista NOOS, vol. 9, pp. 53–59, 1999.
[4] “turroneydulces.com”, ¿Qué es y cómo se hace la fruta confitada?, 2023. https://www.turronesydulces.com/blog/comercioelectronico/que-es-y-como-se-hace-la-fruta-confitada/ (consultado el 16 de junio de 2023).
[5] J.Y. LustreyJ. M.Cabrera, “Evaluación de laconcentración de colorante natural del Arándano (Vaccinium myrtillus) en la elaboración de fruta confitada de la Cáscara de Sandía (Citrullus lanatus)”, Tesis para Optar el Título de Ingeniero Agroindustrial, Universidad Nacional Hermilio Valdizán, Huanuco, 2021. Consultado: el 16 de junio de 2023. [En línea]. Disponible en: https://repositorio.unheval.edu.pe/handle/20 500.13080/691 2
[6] C. A. F. Santos, La composición química de los frutos Singapur: Longman Scientific & Technical, 1986.
[7] A. E. Stafford, Mango. handbook of tropical foods HTChan, Jr., 1983.
[8] E. L. Díaz y R. E. Medranda, “Elaboración de frutas confitadas a partir de la cáscara de naranja y su incidencia en las características organolépticas del producto en el periodo de abril a octubre del 2013 en la carrera de Ingeniería en Alimentos de la ULEAM extensión chone.”, Tesis previa a la obtención del Título de Ingeniero en Alimentos, Universidad Laica “Eloy Alfaro” de Manabi, Ecuador, 2014. Consultado: el 17 de junio de 2023. [En línea]. Disponible en: https://repositorio.uleam.edu.ec/handle/123456789/1703
Figura 4: Muestra de 2 cm3; 1,5 cm3 y 1cm 3REMOCION DE METALES: MN, FE, AL Y CU DE AGUAS ACIDAS DE MINA CON USO DE METODO ACTIVO Y PASIVO WETLANDS
1 1
Pavel Delgado Sarmiento , Javier Zela Ochochoque1 , Paulino Zegarra Panca , Hugo Jiménez
Pacheco1 , Mario Ramos Chavez1 , Rosario Canahuire Pando1
1 Universidad Nacional de San Agustín de Arequipa, Ingeniería Química, iquimica@unsa.edu.pe, http://fip.unsa.edu.pe/ingquimica
RESUMEN
El mayor problema ambiental derivado de las actividades mineras es la generación de drenaje ácido de mina o DAM, el cualpuedeproducirseen los residuos generados por la industriaminera[1] Lacalidad delefluentetratadode la operación minera en estudio no cumple con la legislación en el Perú para el ECA III, debido al contenido de metales principalmente como el Manganeso, Hierro, Aluminio y Cobre que requiere condiciones específicas para ser removido. Para dar solución a este problema se ha realizado pruebas de reevaluación aplicada principalmente a la etapa de neutralización del efluente. Se utilizo para remediar el DAM la opción, en el cual puede ser dividido en los que usan químicos o mecanismos biológicos para neutralizar el DAM y precipitar los metales de las soluciones [2]. Los sistemas son clasificados como activos (requiere continuamente de recursos químicos al proceso), y pasivos (requiere relativamente recursos una vez iniciada la operación). Este trabajo, contempla en una primera etapa experimental el método activo el de neutralización directa y por etapas y después, en una segunda etapa el método pasivo en el Wetland permitió obtener valores de Manganeso, Hierro, Aluminio y Cobre dentro de los LMP´S y ECA III definido por la normativa peruana.
Palabras clave: Neutralización, DAM, Manganeso, sistema activo, sistema pasivo
ABSTRACT
The biggest environmental problem derived from mining activities is the generation of acid mine drainage or AMD, which can be produced in the waste generated by the mining industry [1]. The quality of the treated effluent from the mining operation under study does not comply with the legislation in Peru for ECA III, due to the content of metals mainly such as Manganese, Iron, Aluminum and Copper that require specific conditions to be removed. To solve this problem,reevaluation tests have been carried out, applied mainly to the effluent neutralization stage. The option used to remediate DAM, in which it can be divided into those that use chemical or biological mechanisms to neutralize DAM and precipitate metals from solutions [2]. The systems are classified as active (continuously requiring chemical resources for the process), and passive (relatively requiring resources once the operation has started). This work contemplates in a first experimental stage the active method of direct neutralization and in stages and then, in a second stage the passive method in the Wetland allowed to obtain values of Manganese, Iron, Aluminum and Copper within the LMP'S and ECA III defined by Peruvian regulations.
Key words: Neutralization, DAM, manganese, active system, passive system
INTRODUCCION
Las aguas ácidas de mina dependiendo de la naturaleza mineralógica de la zona donde se generen llevarán diferente carga metálica, la misma que estará asociada acondicionescomocapacidadácida/basedelos minerales, tamaño y solubilidad de los materiales, capacidad de neutralización de las aguas [3], transporte del oxígeno, accióncatalizadoradelas bacterias, adsorción de metales. Ciertas especies mineralógicas son más reactivas que otras, por ejemplo la marcasita, que tiene la misma fórmula química que la pirita es muy inestable y puede generar rápidamente aguas ácidas, los sulfuros de otros metales (plomo, zinc o cobre), son generalmente menos reactivos que los de hierro en
parte, debido a la mayor estabilidad de su estructura cristalina y también porque forman minerales menos solubles que recubren la superficie de los propios sulfuros impidiendo queprogrese su oxidación[4] por lo que es importante realizar una caracterización adecuada de los efluentes que se generan en los procesos mineros, ya que ello influye en el tipo de tratamiento a emplear para la remediación de las aguas ácidas pudiendo llegar a condicionar las distintas etapas del proceso aplicado para el tratamiento.
En general, las aguas ácidas de mina tienen pH entre 4 a 6, contienen cationes y aniones en disolución, predominando SO4, Fe, Mn, Al, Cu, Pb, Zn, además de Cd, Ca, Na, K, Mg y otros. La caracterización
hidrogeoquímica de los drenajesde mina, incluye la acidez protónica debido a los hidrogeniones libres (H+) más la acidez mineral debido a la disolución de Fe, Al, Mn y otros. Estos metales son considerados ácidos generadores porque mediante oxidación e hidrólisis pueden generar H+ [5].
La formación de aguas ácidas se origina a partir de la oxidación química de sulfuros principalmente de la pirita, acelerada en muchos casos por la acción bacteriana. Los principales elementos que intervienen: sulfuros reactivos, el oxígeno y el agua y como elemento catalizador las bacterias [6]
EXPERIMENTAL
Durante las pruebas experimentales directas y por etapas se realizó el seguimiento a las reacciones de neutralización y construir curvas experimentales del consumo de reactivo requerido para abatir la acidez del agua de mina, el método utilizado fue de neutralización directa y por etapas con pruebas en jarras, balanza Certorius Sar CPA 323 S, agitador magnético Velp, en el método activo y de uso de wetlands con plantas macrofitas como método pasivo [7]. Los ensayos experimentales se realizaron con mediciones directas en campo con equipos portátiles equipo Multiparámetro Modelo HQ40d para realizar medidas de pH, Eh,oxígeno disuelto, conductividad eléctrica, temperatura y caudal, se evaluaron también los valores metálicos, y parámetros fisicoquímicos con laboratorioexterno SGSen Lima –Perú
Tabla 1. Composición de parámetros químicos y fisicoquímicos de mina polimetálica
El reactivo utilizado para el método activo [8] en la neutralización directa y por etapas fue cal de la empresa Calquipa Arequipa- Perú y las diferentes curvas de neutralización construidas evidenciaron las zonas de hidrólisis. En la tabla 1 se realizó una caracterización inicial del agua ácida de mina por ICP de los dos puntos de descarga, de los cuales los que exceden los LMP,s son Cu, Fe, Mn, Al, según ECA Categoría 3 establecidos por Decreto Supremo N° 004-2017- MINAM de Perú, los resultados permitió programar una serie de ensayos experimentales de neutralización directa y por etapas, en las figuras del 1 a la 5 detalla los contenidos de metales (Cu, Fe, Mn, Al) que exceden los LMP,s al igual que valores de sulfatos y solidos totales en suspensión según normativa peruana, la actividad minera desarrollada durante los últimos 30 años, ha ocasionado que los efluentes de mina incrementen su acidez, lo cual trae con consecuente la disolución de metales, siendo el de mayor problema la concentración de manganeso. En la tabla 1. Hace referencia a la unidad minera de socavón ubicada al sur del Perú, donde se obtiene DAM 1 y DAM 2, el cual se refiere a orígenes de distinta labor que se ejecuta en la unidad en estudio, en todos los metales exceden el valor de los LMP´s.

tiene datos de monitoreos en los efluentes del DAM
Figura 1 Concentración de Cu en el DAM 1 y 2
La concentración de Cu presenta valores más altos en el DAM 2 que DAM 1, ambos por encimas de los LMP´S

antes del
con el wetland artificial.
Figura 2 Concentración de Al en el DAM 1 y 2
La concentración de Al es mayor en DAM 1 que el DAM 2, ambos por encima de los LMP´s

Figura 3. Concentración de Fe en el DAM 1 y 2
La concentración de Fe presenta valores más altos en el DAM 1 que DAM 2, ambos por encima de los LMP´S

Figura 5 Concentración de SST en el DAM 1 y 2
La concentración de SST, se encuentran por encima de los LMPs, en el DAM 1 y DAM2
RESULTADOS Y DISCUSION
Método activo
Neutralizacióndirecta
Estas pruebas se aplica la adición continua de cal, conociendo las concentraciones inciales de metales y Mn alrededor de 3.15 ppm (DAM 1) y 1.64 ppm (DAM 2), el pH inicial de 5.15 (DAM 1) y 4.64 (DAM 2), durante la prueba se observó la formación de solidos precipitados a rangos depHespecíficos (formación de sólidos insolubles que corresponden a hidróxidos de Fe, Mn), a medida que se fue aumentando el pHel color de los lodos fue variando. Este ensayo simula el proceso generalizado en las plantas de tratamiento de aguas ácidas instaladas en las diferentes operaciones mineras.
Tabla 2. Parámetros fisicoquímicos después de la neutralización
Figura 4. Concentración de Mn en el DAM 1 y 2
La concentración de Mn presenta valores similares en el DAM 1 y DAM 2, ambos por encima de los LMP´S
Neutralización por etapas
En los ensayos de neutralización con adición de cal por etapas,considerando principalmente loscontenidosde Mn, el objetivo principal es retirar los metales contenidos en las muestras de acuerdo al rango de pH en el que teóricamente forman sólidos insolubles que además de obtener una mejor calidad del efluente, se puede obtener en cada etapa un lodo. El conjunto de ensayos involucró la neutralización en dos etapas, en los cuales la primera etapa consistió en incrementar el pH hasta 5.5, a este pH se formaron fases sólidas correspondiente a Fe principalmente; y la segunda etapa se continuó con el proceso de neutralización hasta llevar el pH a 10 con la obtención de lodos de color café claro que corresponde a las fases sólidas de Mn dependiendo del contenido inicial en el agua. Este procedimiento secuencial permitirá evitar la redisolución de los lodos formados en rangos de pH<5 y minimizar una posible interferencia en la remoción de metales que forman fases sólidas a rangos mayores de pH, así como un menor gasto de reactivos. Los resultados obtenidos en el tratamiento de neutralización por etapas son claros en cuantoalaefectividad delaseparaciónde la carga metálica del agua de mina. En la tabla 2 muestra la concentración de metales luego de cada etapa del tratamiento, consiguiendo remoción total del Mn, la mejora de las concentraciones de Manganeso llegando a valores de 0.2 ppm que es lo estipulado por el ECA 3
Finalmente, las aguas depuradas que se descargan desde los wetlands serán conducidas al rio a través sistemas de ataguías y canal de evacuación. Estas ya cumplen con los límites máximos permitidos, lo que se detalla en la tabla 2 en metales totales, conductividad, solidos totales en suspensión, sulfatos según DS. 010-2010-MINAM.
De las figuras 1 a la 5 al final del proceso de neutralización y con la separación de los lodos muestra los valores de los metales que presentaron mayor problema al momento de precipitarlos a pH de 8.15 (DAM 1) y 8.24 (DAM 2), obteniéndose valores aceptables de todos los metales a excepción del Mn, que no cumple con lo estipulado por la ley.
Tabla 3. Características fisicoquímicas al ingreso del wetland
En la Figura 6 muestra las curvas de consumo de cal y de la evolución redox durante el proceso de neutralización, por la forma de la curva y los resultados obtenidos en los ensayos de laboratorio, para DAM 1 y DAM 2 se confirma que el efluente debe tratarse en dos etapas: la primera etapa hasta alcanzar el pH a 5.5 en donde se retirarían las fases sólidas del Fe principalmente, luego se continuaría con el proceso adicionando cal hasta pH 10, en esta segunda etapa se retirarían los lodos formados principalmente hidróxidos de Mn
DAM 1 DAM 2
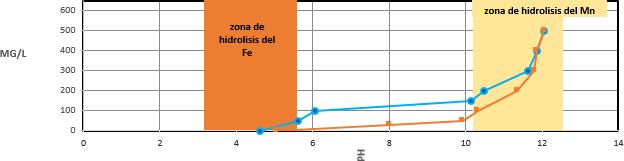


Figura 6. Curva de neutralización y zonas de hidrolisis de Fe, Mn
Método Pasivo
Las aguas tratadas se conducen hacia los wetlands en el cual se han proyectado 6 pozas. La impermeabilización de estas es con material de arcilla con un espesor de 0.20m y compactado hasta alcanzar un 90% de protector modificado.
Esta conformación de los wetland tiene el principio para el tratamiento de efluentes con humedales artificiales y sólo se hizo una modificación conveniente en accesos, detalles de ingresos y salidas de efluentes, para formar parte de la Estación Ecológica del wetland
El agua tratada atraviesa de forma uniforme las pozas y surca las plantaciones de macrófitas, en un tiempo de retención total aproximado de 8 horas.
La conducción de las aguas al siguiente par de pozas se realiza a través de 8 tuberías de HDPE ISO 4427 PN10 de 8’’ de diámetro que atravesarán los accesos o bordos perimetrales de 3.0 metros de ancho. Dichas tuberías, que trabajan como alcantarillas, presentan una pendiente de 2% para evitar la sedimentación en su interior y serán colocadas a una profundidad de 0.30 m desde el nivel del camino de acceso hasta la parte
superior de la tubería, en la sección de menor espesor, a fin de evitar problemas en el eventual paso de maquinara sobre los caminos de acceso. Asimismo, a nivel demostrativo, las aguas depuradas se utilizarán en el riego de las áreas verdes de la estación ecológica del wetland
Al sistema de wetland se adiciona un acuario en terreno natural con la finalidad de demostrar la buena calidad del agua tratada. A partir de los wetland, un canal colector transversal de 0.7 x 0.7 m y una pendiente 0.2%. para ingresar a través de 03 vertederos laterales de ancho 0.5 m y umbral 0.35 m. Este acuario será de sección rectangular, con dimensiones 14 x 140 m y un talud 1:2,cuyofondoy taludeslaterales seránimpermeabilizadas con material de arcilla con un espesor de 0.20m y compactado al 95% protector. Se ubicará, en el extremo final, una ataguía y un canal de distribución a partir del cual se podrá disponer del agua hacia aguas abajo para su uso enáreasverdes, agriculturay/oganadería,etc. EnlaFigura 7 muestra los valores de Manganeso al ingreso y salida de wetland, al juntarse el DAM 1 y DAM 2 con las mejoras tratadas en el método químico, luego de ingresar al wetland permite bajar la concentración de Manganeso cumpliendo con los valores del ECA 3.
En la tabla 3 detalla las características de losparámetros fisicoquímicos al ingreso del wetland, no llegándose a los valores de Mn según lo estipulado en el ECA 3, después de pasar por las macrofitas, la concentración de manganeso cumple con lo estipulado por la normativa peruana
En la figura 7 Detalla el sistema de tratamiento de las aguas ácidas obtenidas en el DAM 1 y DAM2 de la mina polimetalica de Orcopampa, su tratamiento químico con cal y floculante y posteriormente el tratamiento pasivo en el wetland para suvertimiento al río cumpliendo con los ECA 3 de la normativa peruana
DAM 1
DAM 2


CONCLUSIONES
En el tratamiento por etapas, para pasar a fase sólida los contenido de Fe, se requiere alcanzar el pH de 5.5 a 6 y para ello se requiere 0.2 gr de cal/L para DAM 1 y 0.3 gr cal/L para DAM 2, para poder precipitar el Mn, se requiere 0.6 gr de cal/Lpara DAM1 y 1.2 gr de cal/L para DAM 2, adicional. En caso no se retire los lodos de la primera etapa, estos pueden redisolver y pasar nuevamente al agua del sistema, por lo que se habrá que añadir más cal para precipitar por sobresaturación, haciendo más costoso el tratamiento de las aguas ácidas.
Comparando el consumo de cal para un tratamiento en dos etapas representa un 20% menos de consumo de cal en comparación con neutralización directa. La aplicación de un tratamiento por etapas permite consumir menos cal, mejorar la eficiencia del sistema de tratamiento y un mayor control ambiental, así mismo se genera menos lodos en comparación con neutralización directa
Para precipitar Mn se requiere elevar el pH a 10 y posteriormente acificarlo para llevar el pH a 8.5-9, cumpliendo con el ECA 3
Según pruebas metalúrgicas no se requiere sulfidizante debido a que la concentración de metales de DAM 1 y DAM 2 al ingreso no son altas.
BIBLIOGRAFIA
1Akcil A., Koldas, S., 2006. Acid Mine Drainage (AMD); causes, tretament and case studies J. Clean. Prod 14, 1139-1145.
2Fernández Rubio, R, Baquero Úbeda, J.C. Lorca Fernández, D. & Verdejo Serrano, J. (2002): Tratamientos pasivos en humedales, de aguas ácidas con carga en metales pesados. V Congreso Nacional del Agua y el Medio Ambiente.
3León Fábregas, A. & Baquero Úbeda, J.C. (2005): Impacto de las actividades mineras sobre la calidad de las aguas. Medidas de prevención.
4Ford, K.L. (2003): Passive treatment systems for acid mine drainage. Technical Note 409, Bureau of Land Management, 13 pp.
5Skousen, J. (2000): Overview of passive systems for treating acid mine drainage. In Reclamation of Drastically Disturbed Lands (eds. Barnhisel R.I., Darmody R.G., and Daniels W.L.), American Society of Agronomy
6Aduvire, O., López-Jimeno, C. y Aduvire, H. 1997. Evaluación del impacto ambiental en la minería (Parte 1). Latinominería, 23, pp. 59-64.
7Younger, P.L. 1998. Design, construction and initial operation of full- scale compost-based passive systems for treatment of coal mine drainage and spoil leachate in the UK. In proceedings of the international Mine Water Association Symposium on “Mine Water and Environmental Impacts”, Johannesburg, South Africa (volume II) September 1998
8Denedri, J., Iannacone, J. (2020). Acid mine drainage treatment using artificial wetlands. Biotempo, 17(2), 345-369.
Figura 5. Diagrama de sistema de tratamiento activo y pasivo del agua ácida de mina (Wetland)




























 Patrocinadores:
Patrocinadores:
