
28 minute read
Sección MSD
from Suis 174
by Grupo Asís
D. Temple1 , M. Jiménez2 , D. Escribano3 , G. Martín-Valls1 , I. Díaz4 y X. Manteca1 .
1Facultad de Veterinaria. Universidad Autónoma de Barcelona
Advertisement
2Merck Sharp & Dohme Animal Health Spain
3Facultad de Veterinaria. Universidad de Murcia
4CReSA - IRTA
IDAL y bienestar: beneficios de la vacunación intradérmica sin aguja sobre el bienestar de lechones
La vacunación es una de las estrategias más comunes y eficaces para la prevención de las enfermedades infecciosas en porcino. La vacunación intramuscular es el método más frecuente, y es habitual que los animales se sometan a varias vacunaciones durante su vida. Varios estudios han demostrado que la vacunación intramuscular genera dolor, necrosis y lesiones en el punto de inoculación (1), siendo por tanto un procedimiento estresante y doloroso para los animales. Para evitar estas consecuencias negativas, se han desarrollado rutas alternativas, tales como la vacunación intradérmica sin aguja. La piel es un componente altamente eficiente del sistema inmunitario, y por tanto una buena alternativa para la aplicación de vacunas, debido a su elevada densidad de células inmunocompetentes (2). En humanos, los métodos de administración de vacunas intradérmicos y sin aguja han demostrado ser menos dolorosos y generar menos estrés en los pacientes (3). Por analogía, los mismos resultados deberían esperarse en su uso en animales. La vacunación intradérmica aporta adicionalmente otra serie de ventajas, tales como una administración altamente precisa de la dosis, mayor dispersión antigénica y menor volumen de administración. Además, por el hecho de ser sistemas sin aguja, se reduce el riesgo de deposición de agujas o fracciones de estas en las canales, así como de lesiones debidas a aplicaciones inadecuadas. La vacunación sin aguja también elimina la transmisión iatrogénica de virus y bacterias en el momento de la vacunación. El siguiente estudio se realizó con el objetivo de comprobar si la vacunación intradérmica sin aguja es una herramienta útil para mejorar el bienestar de los lechones mediante la reducción de estrés, la reducción de biomarcadores relacionados con el dolor y la mejora de parámetros comportamentales, en comparación con la administración intramuscular clásica.
MATERIALES Y MÉTODOS
La prueba se llevó a cabo en una granja comercial situada en Cataluña. Un total de 339 lechones recién destetados, de 28 días de edad, se dividieron en tres grupos de estudio: ■ Grupo 1 (IDAL). Lechones vacunados vía Intradérmica, con Porcilis® PCV ID con el dispositivo IDAL. ■ Grupo 2 (IM). Lechones vacunados vía intramuscular con Porcilis® PCV. ■ Grupo 3 (Control). Lechones control sin vacunar. Los lechones se repartieron en 15 corrales, alocados en la misma sala de manera aleatoria, y evitando dos corrales consecutivos del mismo grupo. Todos los lechones se manejaron del mismo modo durante la vacunación, independientemente del grupo de estudio al que pertenecían.
Parámetros comportamentales estudiados
En el momento de la vacunación se registraron los intentos de huida y las vocalizaciones agudas. Estos registros se llevaron a cabo en un subgrupo de 84 lechones, 28 por grupo de tratamiento, elegidos de manera aleatoria. El comportamiento social, la actividad general y las posturas de descanso se registraron a nivel de corral vía observación directa 24 h antes y 24 h después de la vacunación, adaptando la metodología descrita por los protocolos de Welfare Quality® (WQ®). Se realizaron tres bloques observacionales por corral. En cada bloque observacional, cada corral se observaba 5 veces con un intervalo de 2,5 minutos entre cada observación. El comportamiento se clasificaba en dos categorías (social positivo y social negativo) y cuatro comportamientos activos (comiendo, bebiendo, explorando el corral-manipulando el material del enriquecimiento y “otros”). Las posiciones de descanso se registraron con el mismo procedimiento observacional, contando el número de cerdos echados (ventral o lateralmente) o sentados.
Parámetros de salud y peso corporal
En los mismos 84 animales que se estudió la reacción comportamental a la vacunación se registraron la temperatura rectal y las lesiones en el punto de inoculación. La temperatura se midió los días -1, 0, +1, +2 y +7 posvacunación. Las lesiones en el punto de inoculación se evaluaron los días 0, +1, +2, +7 y +28. Las lesiones se evaluaron visualmente y a la palpación. Se consideraba presencia de lesión si había un ligero rubor de más de 0,2 cm o cualquier inflamación. Los mismos lechones se pesaron individualmente el día de la vacunación y 21 días más tarde.
Parámetros fisiológicos
De los mismos 84 animales se tomaron muestras de saliva mediante una pequeña esponja, justo antes de la vacunación y 25 minutos más tarde de la misma. Los animales se sometieron a un periodo de adaptación previo de una semana, para evitar cualquier estrés o miedo que el muestreo de saliva pudiera generar. En las muestras de saliva se midieron los niveles de Cromogranina-A (CgA) y de Alpha-amilasa salival (Aas). Adicionalmente se tomaron muestras de sangre el día 0 y 28 h posvacunación, de las cuales se midieron los niveles de las siguientes proteínas de fase aguda: Proteína C-reactiva Porcina (CRP) y Haptoglobina (Hp).
RESULTADOS
La frecuencia de lechones mostrando intentos de huida en el momento de la vacunación fue significativamente mayor en el grupo IM (39 %) que en el grupo IDAL (7 %; p = 0,009) y que en el grupo Control (3 %; p = 0,001) (tabla 1). La frecuencia de lechones mostrando vocalizaciones agudas también fue significativamente mayor en los lechones del grupo IM (32 %) que los del IDAL (7 %; p = 0,04) y Control (3 %; p = 0,02). No se observaron diferencias entre los grupos IDAL y Control (tabla 1). Con respecto al comportamiento social, al día siguiente de la vacunación, los lechones del grupo IM presentaron una reducción significativa del número de interacciones sociales, con respecto a los grupos IDAL y Control (p = 0,001). Los lechones del grupo IM tuvieron significativamente menos conducta exploratoria y una reducción de la actividad general (p = 0,04) que los animales IDAL y Control. Los animales del grupo IM presentaron niveles significativamente mayores de CRP y Hp a las 28 h posvacunación que los animales de los grupos IDAL y Control (tabla 2). AA y CgA en cambio no presentaron diferencias entre los grupos vacunados, y sus niveles no variaron pre y posvacunación. La prevalencia de lechones con alteraciones dérmicas a las 28 h post-vacunación fue del 18 % en el grupo IDAL, un 1 % del grupo IM y 0 % del Control (p < 0,0001). No hubo diferencias entre grupos con respecto a la temperatura rectal, ni con respecto a la Ganancia Media Diaria (tabla 3). Adicionalmente, y para asegurar que ninguno de los cambios observados pudiera tener relación con una diferente respuesta inmunitaria entre grupos, se evaluó la respuesta inmunitaria celular y humoral frente a PCV2 de los animales vacunados. Ambos grupos expresaron una sólida respuesta inmunitaria, sin diferencias significativas entre grupos. El grupo Control no presentó seroconversión alguna frente a PCV2.
DISCUSIÓN Y CONCLUSIONES
Al día siguiente de la vacunación, los lechones vacunados vía IM presentaron una reducción de la acti-
Tabla 1. Porcentaje de cerdos mostrando reacciones de huida o vocalizaciones agudas tras la vacunación.
Control IDAL IM
% lechones con vocalizaciones agudas 7 %b 7 %b 32 %a % lechones con intento de huida 3 %b 7 %b 39 %a
abDiferentes superíndices indican diferencias estadísticamente significativas entre grupos.
Tabla 2. Niveles sanguíneos de las proteínas de fase aguda CRP y Hp
Control IDAL IM
CRP (µg/ml)
t0 12,9 ± 9,12 (70 %) 9,7 ± 12,60 (120 %) 11,1 ± 8,97 (80 %)
t1 (+28 h) 20,0 ± 15,12c (75 %) 38,8 ± 33,13b (87 %) 82,8 ± 29,18a (35 %)
Hp t0 1,8 ± 0,62 (34 %) 1,7 ± 0,72 (43 %) 1,8 ± 0,72 (41 %) (mg/ml) t1 (+28 h) 1,8 ±0,65b (35 %) 1,9 ± 0,71b (37 %) 3,1 ± 0,3a (9 %) abcDiferentes superíndices indican diferencias estadísticamente significativas entre grupos.
Tabla 3. Temperatura rectal y GMD.
Temperatura rectal (°C) GMD (g/d) -1 + 28 h + 42 h + 7 d + 21 d De 0 a 21d
Control 39,3 ± 0,52 39,4 ± 0,47 39,3 ± 0,35 39,4 ± 0,48 39,9 ± 0,35 440
IDAL 39,3 ± 0,39 39,4 ± 0,44 39,1 ± 0,49 39,1 ± 0,72 39,8 ± 0,53 420
IM
39,5 ± 0,53 39,5 ± 0,41 39,2 ± 0,44 39,3 ± 0,59 39,7 ± 0,32 440
vidad en comparación con los vacunados vía IDAL. Datos similares se han detectado en estudios previos, tanto en cerdas como en lechones (4,5), en los cuales la disminución en las conductas activas como las interacciones sociales se asociaron a un menor grado de estrés en los animales. La menor conducta social de los animales del grupo IM puede asociarse con cierto grado de disconfort o dolor relacionado con la vacunación. En cambio, la vacunación intradérmica no parece alterar el comportamiento de los lechones un día tras la vacunación. Los datos obtenidos de intentos de huida y vocalizaciones agudas también sugieren que la vacunación intradérmica reduce el dolor agudo de los lechones en el momento de la vacunación. Los valores de α-amilasa (Aas) y chromogranina-A (CgA) no se vieron alterados en función de los grupos de estudio, ni siquiera con respecto al grupo Control, y los valores de AA obtenidos fueron similares a los referenciados en la literatura como valores bajos obtenidos en situaciones sin estrés. Contrariamente, los niveles obtenidos de CgA, tanto en el momento de la vacunación como 30 minutos después, eran comparables a los obtenidos en animales en estrés tras aislamiento. Es muy probable que, en este caso, el condicionamiento previo realizado en los lechones 1 semana antes de la prueba, les generara excitación positiva, que pudiera haber afectado a los niveles de CgA, por estimulación del sistema simpático adrenal. Las proteínas de fase aguda son un grupo de proteínas sanguíneas cuya concentración cambia tras desafíos tales como infecciones, inflamaciones, trauma y estrés (6). La CRP y la Hp se han usado en varios estudios para evaluar la respuesta inflamatoria posvacunación. En este estudio, los niveles de CRP y Hp fueron significativamente superiores a las 28 h posvacunación en los cerdos vacunados vía IM frente a IDAL y Control, indicando que la inflamación generada en los lechones vacunados vía IM es significativamente superior a la generada en los animales vacunados vía IDAL, probablemente por un mayor trauma muscular tras la inyección IM. Las lesiones cutáneas observadas fueron más prevalentes en el grupo IDAL. En este caso, como las observaciones fueron superficiales, es lógico, pues en la vacunación IM la deposición de la vacuna es muscular, y por lo tanto, cualquier inflamación no será observada excepto tras la realización de necropsias. En cuanto al reporte de temperatura y pesos, no se detectaron diferencias significativas entre grupos. Estos datos coinciden con reportes previos en los cuales también se demostró que la vacunación vía IDAL no inducía reacciones sistémicas ni aumento de temperatura posvacunación (4). Por tanto, con los resultados de este estudio, puede concluirse que la vacunación intradérmica sin aguja con el dispositivo IDAL representa una alternativa menos invasiva y menos dolorosa a la vacunación clásica intramuscular con aguja, mejorando por tanto el bienestar de los lechones vacunados.
Resumen del artículo técnico publicado en la revista Animals: Welfare Benefits of Intradermal Vaccination of Piglets. Animals 220,10, 1898; doi.10.3390/ani10101898.
REFERENCIAS BIBLIOGRÁFICAS
1. Turner, P.V.; Brabb, T.; Pekow, C.; Vasbinder, M.A. Administration of Substances to Laboratory Animals: Routes of Administration and Factors to Consider. J. Am. Assoc. Lab. Anim. Sci. 2011, 50, 600–613. 2. Bangert, C.; Brunner, P.M.; Stingl, G. Immune functions of the skin. Clin. Dermatol. 2011, 29, 360–376 3. Sarno, M.J.; Blase, E.; Galindo, N.; Ramirez, R.; Schirmer, C.L.; Trujillo-Juarez, D.F. Clinical immunogenicity of measles, mumps and rubella vaccine delivered by the Injex jet injector: Comparison with standard siringe injection. Pediatr. Infect. Dis. J. 2000, 19, 839–842 4. Temple, D.; Escribano, D.; Jiménez,M.;Mainau, E.; Cerón, J.J.;Manteca, X. Effect of the needle-free “intra dermal application of liquids” vaccination on the welfare of pregnant sows. Porc. Heal. Manag. 2017, 3, 9 5. Göller,M.; Knöppel, H.P.; Fiebig, K.; Kemper, N. Intradermal vaccine application: Effects on suckling behaviour. In Proceedings of the 24th International Pig Veterinary Society Congress, Dublin, Ireland, 7–10 June 2016; p. 625 6. Murata, H.; Shimada, N.; Yoshioka, M. Current research on acute phase proteins in veterinary diagnosis: An overview. Vet. J. 2004, 168, 28–40.

Iván Hernández, Gisela Girmé, Víctor Rodríguez
Boehringer Ingelhem Animal Health España S.A.U.
Experiencias en España con Enterisol Ileitis® : más de quince años de eficacia demostrada frente a la ileítis porcina
Lawsonia intracellularis (L.i.) es el agente causal de la Enteropatía Proliferativa Porcina (EPP), una enfermedad infecciosa entérica que cursa con diarrea y reduce la ganancia de peso en las fases de transición y cebo1. Actualmente, la EPP afecta a la mayoría de las explotaciones españolas2 y tiene una gran relevancia a nivel económico dado su impacto en el ganado. La infección por L.i. provoca una enfermedad lesional que se caracteriza por el engrosamiento de la mucosa de la porción terminal del intestino delgado (íleon) y, en ocasiones, del colon. Existen tres formas de presentación de la enfermedad: ■ Aguda o enteropatía proliferativa hemorrágica. ■ Crónica o adenomatosis intestinal porcina. En ocasiones, es más grave que la anterior y provoca enteritis necrótica. ■ Subclínica. En el caso de las presentaciones clínicas, la enfermedad se manifiesta por la aparición de diarrea verde-grisácea en los lechones destetados y en el cebo. Sin embargo, en la mayor parte de las ocasiones, la presentación de la enfermedad es subclínica y no se observa diarrea, pero hay repercusión sobre el crecimiento de los cerdos infectados. De ahí que sea difícil de observar y, por lo tanto, de diagnosticar en condiciones de campo. Mediante ELISA, se ha determinado que su prevalencia serológica en las granjas de Europa oscila entre el 70 % y el 100 %3 . A nivel económico se ha descrito un impacto estimado de entre 1,3 y 18,5 € por cerdo afectado1, 4. Uno de los motivos de esa repercusión económica se debe a que, en presentaciones subclínicas de la enfermedad, únicamente se ve afectado el crecimiento de los cerdos infectados, lo que provoca una mayor dispersión de pesos en el lote. El empleo de la qPCR en muestras de heces puede ser una herramienta útil para la evaluación de la repercusión económica de la infección por Lawsonia intracellularis en los lechones en transición5 . En España, la vacunación frente a la Ileítis es una práctica que se va instaurando y afianzando lentamente. No obstante, la ratio de vacunación en nuestro país dista todavía de la de otros países como por ejemplo EE.UU., donde se sitúa en torno al 60 % del
Tabla 1. Resumen de los resultados obtenidos en cada uno de los estudios que forman parte de esta recopilación.
Estudio 17 Estudio 28 Estudio 39 Estudio 410 Estudio 511 Estudio 612 Estudio 713
NVac Vac NVac Vac NVac Vac NVac Vac NVac Vac NVac Vac NVac Vac
nº animales 51.367 52.495 6.611 5.509 3.393 3.375 3.856 3.483 16.692 9.559 10.250 12.850 1.440 1.440 GMD (g/d) 679,7 714,0 654 664 674* 780* 887 998 682* 742* ND ND 639,8 657,8
IC
3,0 2,8 2,53 2,49 2,64* 2,38* ND ND 2,88 2,84 2,6* 2,48* ND ND AB (€) ND ND 1,95* 1,49* ND ND 48 17,1 ND ND 0,38* 0,17* 0,59* 0,15* Mortalidad 8,7 6,1 4,94 4,57 1,90 1,18 9 3 5,03 4,04 1,6* 1,25* 2,6 3,55 NVac: grupo no vacunado. Vac: grupo vacunado. GMD: ganancia media diaria. IC: índice de conversión. AB (€): gasto en antibióticos por animal en la fase de cebo. ND: no determinado. *diferencias estadísticamente significativas entre los grupos de tratamiento.
censo, lo que ha permitido a Enterisol Ileitis® alcanzar un nuevo hito, superando los mil millones de cerdos vacunados alrededor del mundo6 .
MATERIAL Y MÉTODOS
Esta recopilación de estudios recoge algunos de los trabajos de campo realizados en España desde 2007 hasta 20197, 8, 9, 10, 11, 12, 13. Siete trabajos publicados en revistas de divulgación o en congresos internacionales que fueron seleccionados por el tipo de presentación subclínica de la enfermedad. En total, 9 granjas con tamaños de entre 300 y 2.500 madres comprenden este estudio, en el que se evaluaron 182.320 animales: 88.711 vacunados con Enterisol Ileitis® (Vac) y 93.609 no vacunados (NVac). El contacto con la bacteria de campo fue confirmado en todos los casos mediante serología, utilizándose técnicas qPCR en los trabajos más modernos. La unidad experimental fue el cebadero. Los parámetros evaluados y disponibles para la realización de este trabajo fueron la ganancia media diaria (GMD) en 6 de los estudios, el índice de conversión (IC) en 5, el consumo de antibióticos en 4 y la mortalidad en la fase de cebo en los 7 trabajos. La vacunación de los lechones se realizó en edades comprendidas entre las 3 y las 5 semanas. La administración de la vacuna Enterisol Ileitis® fue oral mediante agua de bebida para inmunizar la mucosa intestinal y se aplicó con un dosificador, permitiendo el acceso a la vacuna por espacio de entre 4 y 6 horas. En 5 de los 7 estudios se utilizó el paquete estadístico SPSS v.15.0 (SPSS Inc., Chicago, IL, USA). La evaluación del retorno de inversión de la implantación de la vacuna en estas 9 pirámides fue realizada de manera global mediante la utilización de la herramienta BECAL (Boehringer Ingelheim Economic Calculator).
RESULTADOS Y DISCUSIÓN
Los resultados de todos los parámetros evaluados fueron numéricamente mejores para el grupo de animales vacunados. La ganancia media diaria se mejoró en 57 gramos (702,7 NVac frente a 759,3 Vac), siendo esta diferencia significativa en 2 de los 5 estudios donde se realizó estadística (tabla 1). Esta mejora en GMD se ha visto explicada recientemente, no solo por la reducción de incidencia de la clínica de la enfermedad por la inmunidad de mucosas (IgA principalmente) que la vacuna confiere, sino también por la mejora de la microbiota en animales vacunados. Por poner un ejemplo, la vacunación con Enterisol Ileitis® hace que poblaciones de bacterias productoras de butirato se vean favorecidas14 . En el caso del IC, mejoró en 130 gramos de media (2,728 NVac frente a 2,598 Vac), lo que supuso una diferencia significativa en 2 de los 4 estudios donde se realizó estadística (figura 1). El consumo de antibióticos medio de los estudios, teniendo en cuenta solo la fase de cebo, se redujo en un
Figura 1. Control estadístico de procesos del estudio de Ibáñez
et al., 2016, donde el IC resultó estadísticamente significativo.
2,65
2,55
Índice de conversión alimenticio (kg) 2,45
2,35
Media = 2,60 DE = 0,04
2,65 No vacunados
2,55
Índice de conversión alimenticio (kg) 2,45
2,35
Media = 2,48 DE = 0,05
vacunados
Coste de medicación por animal (€) 0,60
0,40
0,20
0,00
Figura 2. Gráfico del consumo de antibióticos en la fase
de cebo del estudio de Rodríguez et al., 2018.
*muestra diferencias estadísticamente significativas entre los grupos de tratamiento.
No Sí
Vacunados
50 %. Se pasó de 1,2 € en NVac a 0,6 € en el caso del grupo Vac. Esta diferencia fue significativa en 3 de los 3 trabajos en los que se evaluó estadísticamente este parámetro (figura 2). En lo que respecta a la mortalidad, se mejoró de manera numérica un 1,4 % en el global de los 7 estudios pasando de 4,8 en NVac a un 3,4 en Vac. Solo en uno de los 5 estudios en que se realizó análisis estadísticos resultó significativa la diferencia numérica a favor de los Vac (Ibáñez et al., 2016). Estos resultados se explican por las características de la unidad experimental (el cebadero) y por la forma de presentación de la enfermedad que, en estos estudios, fue la subclínica siendo además la más representativa del porcino en España. Al introducir las medias de los parámetros productivos de los 7 trabajos en BECAL obtuvimos un retorno de inversión medio de 3,68 € por cada euro invertido. La prevención mediante la utilización de vacunas frente a enfermedades que merman durante largos periodos de la vida del animal los parámetros de crecimiento, hacen posibles reducciones drásticas en el consumo de antibióticos. Esta circunstancia es ahora más importante que nunca en un contexto internacional de “batalla”, ya no solo por los costes de producción, sino por la imagen de industria eficiente y responsable que el porcino español debe proyectar a la opinión pública de nuestro país y del resto del mundo.
CONCLUSIONES
Para el tratamiento de la EPP se pueden utilizar diferentes antimicrobianos, pero es indudable que el contexto actual requiere de una reducción del uso de antibióticos en animales. Ante esta situación y dados los resultados, la vacunación oral frente a la ileítis se considera una herramienta profiláctica eficaz para controlar los EPP clínicos y subclínicos. El análisis de los datos y estadísticas de los 7 estudios recopilados en este artículo permite ilustrar la mejora significativa de todos los parámetros evaluados: GMD, IC, consumo de antibióticos y mortalidad en fase de cebo. Asimismo, aporta información de gran valor que avala la eficacia de la vacuna en aspectos tan relevantes como el desarrollo de la inmunidad y la mejora de los parámetros de crecimiento y del rendimiento económico de las granjas.
krumanop/shutterstock.com

BIBLIOGRAFÍA
1. McOrist S. et al. (1997). Vet rec 140, 579-581. 2. Salleras et al. (2006). Proc IPVS, p. 174. 3. Arnold et al. (2019). Porc. Health Manag., 5(1), 1-11. 4. Hardge T et al. (2005). Proc. IPVS, p. 114. 5. Seate J et al. (2017). Proc. ESPHM, p. 110. 6. Datos obtenidos internamente a partir de las unidades vendidas de Enterisol Ileitis desde el año 2000. 7. Cano G y Sanmartin J. (2008). Proc. IPVS, P03.055. 8. Figueras-Gourgues S et al. (2016). Proc. IPVS, VO-PC03-015. 9. Hervás R. (2019). Proc. ESPHM, HHM-PP-68. 10. Lorenzo JL y Rosas ML (2007). Av. tecnol. porc. 4 (4): 77 – 82. 11. Palomo A. et al. (2008). Proc. IPVS, P03.058. 12. Ibanez A et al. (2016). Proc. IPVS, p. 227. 13. Rodriguez-Vega V et al. (2017). Proc. ESPHM, p. 229. 14. Leite et al. (2018). Proc. ESPHM, p. 215.

István Kiss1, Edit Kovács1 , Zoltán Zádori2, István Mészáros2, Attila Cságola1 , Pál Bajnóczi3, Preben Mortensen4 y Vilmos Palya1 .
1Ceva-Phylaxia Co. Ltd., Budapest, Hungría.
2Institute for Veterinary Medical Research, Centre for Agricultural Research, Budapest, Hungría.
3Prophyl Ltd., Mohács, Hungría.
4Ceva Animal Health, Libourne, France. Veterinary Medicine: Research and Reports.
Protección vacunal frente al desafío experimental con un Parvovirus porcino genotipo 27a en primerizas gestantes
El Parvovirus porcino (PPV) es el principal agente del síndrome SMEDI (en inglés, stillbirth, mummification, embryonic death, infertility) y se describió por primera vez a finales de la década de 1960. El impacto de PPV depende de su virulencia, cantidad de virus y momento de la gestación en que se produce la infección.
Este virus no se replica ampliamente en tejidos endometriales, no lesiona placenta y tiene una diseminación lenta entre fetos, por lo que las cerdas afectadas no suelen abortar. Lo más típico es que aumenten los mortinatos y momificados de distinto tamaño, aunque también puede causar disminución de prolificidad y aumento de repeticiones.
Las cepas de PPV de menor virulencia requieren una mayor cantidad de virus para afectar a la gestación y alcanzan niveles más bajos de replicación en los diferentes órganos y tejidos1,2. Hasta hace aproximadamente 20 años, el PPV se consideraba muy estable genética y antigénicamente. Sin embargo, estudios más recientes han revelado una considerable diversidad genética, que comprende como mínimo 7 clústers3,4 .
En Alemania, en 2001 se identificó una cepa virulenta de PPV, la PPV-27a, que se ha ido propagando por la cabaña porcina. Esta cepa se tomó como representativa del clúster al que pertenece, que a su vez se engloba dentro del genotipo 25. Las cepas dentro de este genotipo se distinguen por tener una serie de mutaciones características, que les confieren una mayor capacidad de evasión frente a la neutralización de anticuerpos y una rápida replicación en tejidos. La información sobre la efectividad de la protección de las vacunas de PPV frente a las cepasdel clúster PPV-27a es limitada. Sin embargo, datos experimentales recientes concluyen que estas cepas pueden afectar a la efectividad de la vacunación frente a PPV6,7 .
Parvoruvax® es una vacuna inactivada frente a PPV y Mal Rojo basada en la cepa K22, una cepa de PPV de alta virulencia correspondiente al clúster Kresse, perteneciente al genotipo 1. La mayoría del resto de vacunas comerciales de PPV, entre ellas las vacunas B, C y D del estudio que se detallará a continuación, se basan en cepas del clúster NADL-2, que son muy poco virulentas. El objetivo de este estudio fue comparar la eficacia de Parvoruvax® en comparación con la de distintas vacunas comerciales de PPV y Mal Rojo, todas ellas con cepas del genotipo 1 de PPV.
MATERIALES Y MÉTODOS
Los animales incluidos en este estudio fueron cerdas de primer parto gestantes. Estas se distribuyeron en cinco grupos de 5-6 primerizas según el tratamiento administrado: • Grupo 1: Vacunado antes de la cubrición con
Parvoruvax® (cepa tipo K22 y E. rhusiopathiae) • Grupo 2: Vacuna B (cepa NADL-2 y E. rhusiopathiae) • Grupo 3: Vacuna C (cepa tipo NADL, 014 y E. rhusiopathiae) • Grupo 4: Vacuna D (cepa tipo NADL, 014, E. rhusiopathiae y serovares de L. interrogans). • Grupo 5: Control sin vacunación.
El día 40 de gestación, estas cerdas se desafiaron con la cepa incluida en el clúster PPV-27a por vía intranasal e intramuscular.
Al día 90 de gestación fueron eutanasiadas y necropsiadas para pesar y tomar muestras de sus fetos. Se recogieron muestras de sangre y tejidos (pulmones y riñones) para serología y PCR, respectivamente. También se tomaron muestras de sangre de las cerdas al día 0 (antes de la primera vacunación), día 38 (antes de la cubrición), día 86 (antes del desafío) y día 137 (antes de la eutanasia).
RESULTADOS Y DISCUSIÓN
Serología de las cerdas
Los resultados del ELISA mostraron un valor limitado de la respuesta humoral frente a la vacunación, excepto para el grupo inmunizado con la vacuna que contiene la cepa homóloga a la utilizada en la prueba ELISA (NADL2 ambas).
Tras el desafío, la respuesta de anticuerpos fue unánime, independientemente del estado de vacunación de las cerdas. La respuesta humoral de los grupos vacunados no difirió de los no vacunados.
Con la excepción de la vacuna B, el descenso del nivel de títulos de neutralización vírica (NV) antes del desafío fue similar al de estudios anteriores8. Sin embargo, este nivel no se correlacionó con protección, ya que la mayor protección clínica se observó en el grupo con un título de NV relativamente bajo justo antes del desafío.
Estos resultados cuestionan el uso de métodos serológicos como el ELISA y NV para valorar la protección inducida por vacunas frente a PPV y sugieren que deberían emplearse otros mecanismos o indicadores de inmunidad.
Que la respuesta inmunitaria celular específica es un factor diferencial frente a la protección de PPV ya se demostró en un ensayo en el que se midieron las respuestas de IFNγ + células T después de la vacunación de cerdos SPF con Parvoruvax®. Los niveles aumentaron significativamente 4 meses después9 de forma similar a los desencadenados por la infección repetida por PPV10 .
La inmunización con vacunas inactivadas comerciales no pudo prevenir la infección, ya que todos los grupos respondieron al desafío con el aumento del título de anticuerpos. Sin embargo, existe una diferencia entre el grado de preparación del sistema inmunitario proporcionado por las distintas vacunas, que viene determinado por la activación puntual de las células B y T de memoria frente a la infección.
Grado de afectación de la gestación y resultados laboratoriales en fetos
Únicamente Parvoruvax® y la vacuna B redujeron significativamente la mortalidad fetal con relación al grupo control no vacunado (95 % ic). Además, Parvoruvax® superó en este aspecto a todos los demás grupos vacunados (tabla 1).
Al contrario que en estudios anteriores8, se detectó ácido nucleico del virus del desafío por PCR incluso en los fetos de los grupos vacunados. Sin embargo, el aislamiento demostró la presencia de PPV con capacidad infectante en los fetos solo en uno de los grupos vacunados (G4) y en el grupo no vacunado (G5). Por lo tanto, el aislamiento del virus resultó ser menos sensible que la PCR para demostrar la presencia de material genético de PPV en los tejidos fetales.
Hubo una clara correlación negativa entre el tamaño de la camada y la positividad a genoma de PPV de los lechones (R2= 0,8153).
Mapa de epítopos
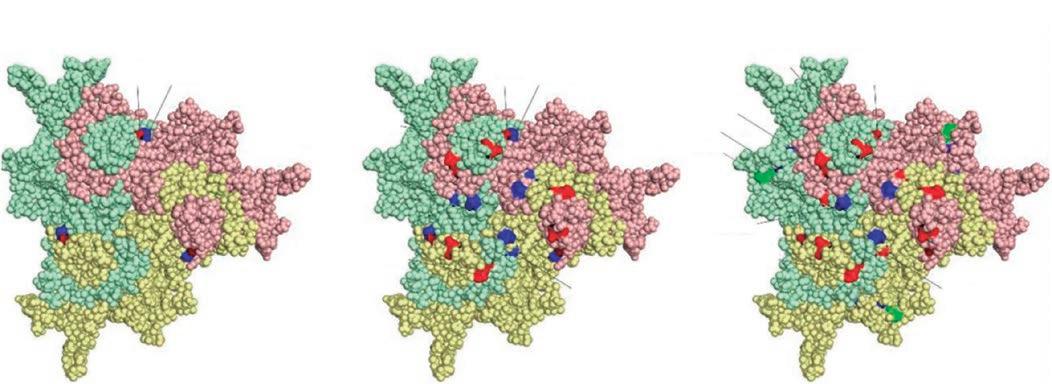
La secuenciación de la cepa K22 de la vacuna Parvoruvax ® reveló una naturaleza distinta al resto de las cepas vacunales de este estudio. Los resultados sugieren que la cepa NADL-2 muestra mayores diferencias antigénicas con relación a las cepas del clúster PPV-27a que la K22, ya que contiene más cambios (8 en vez de 6) y de distinto tipo. Tan solo hay 4 cambios de aminoácidos en común entre las cepas K22 y NADL-2 en comparación con PPV27a. Además, NADL2 contiene mutaciones adicionales en dos zonas específicas del virus (figura 1).
En función de los datos de la literatura6,7 y de los resultados de detección serológica y de virus presentados, se podrían establecer las siguientes categorías en relación con el nivel de protección frente a PPV: • Protección total. Seronegativos, fetos negativos a
PCR y sin excreción de PPV después de la exposición o infección (este parámetro no se midió en este ensayo). • Protección suficiente. Seropositivos y/o PCR positivos, pero fetos negativos al aislamiento del virus y sin reducción en el número de fetos. • Protección insuficiente. Seropositivos y PCR positivos, y aislamiento vírico positivo en fetos y reducción del número de fetos.
CONCLUSIÓN
Parvoruvax®, una vacuna basada en la cepa K22 PPV tipo Kresse, proporcionó una mayor protección frente al desafío con la cepa de tipo PPV-27a en comparación con
Grupo (nº de cerdas)
% de cerdas con camadas afectadas por PPV (muertes o momificados) Media de nacidos vivos Número (%) de fetos vivos
Número (%) de fetos muertos
Número (%) de fetos momificados Peso medio de los fetos vivos (g)
Longitud media de los fetos vivos (cm) % de fetos positivos a Ingezim PPV ELISA
Parvoruvax (7)
Vacuna B (7)
TABLA 1. AFECTACIÓN DE LA GESTACIÓN DE LOS DIFERENTES GRUPOS.
0 13,7 96 (100) 0 (0) 0 (0) 600,1 29,4
43 11,4 80 (89) 0 (0) 10 (11) 609,9 29,4 0
0
Vacuna C (5) 60 11,0 55 (92) 0 (0) 5 (8) 719,8 31,0 0
Vacuna D (5) 80 9,4 47 (64) 0 (0) 26 (36) 555,1 28,8 4
Control no vacunado (5) 100 7,6 46 (40) 5 (4) 65 (56) 663,4 30,4 26
A
I215T P238L
B
Q228E
P436T E419Q I215T P238L
A141S
C
Q228E
D378G H383Q R565K
S436T
E419Q I215T
A141S
Figura 1. Modificaciones en los aminoácidos superficiales de diferentes cepas de PPV. Todos los aminoácidos alterados en la superficie de un trímero de la cápside están resaltados (los tres monómeros idénticos interconectados se muestran en diferentes colores), pero los cambios en una sola cadena están anotados. La numeración se indica según las posiciones de NADL-2 VP2. (A) K22 frente a Kresse. Aminoácidos superficiales vecinos alterados resaltados en rojo y azul. (B) K22 frente a 27a. Los cambios de aminoácidos superficiales se indican con rojo y azul. (C) NADL-2 frente a 27a. Los cambios de aminoácidos de superficie similares a K22 v. 27a se resaltan con rojo, otros cambios de aminoácidos se indican con azul y verde.
las vacunas comerciales basadas en las cepas NADL-2 y NADL. Asimismo, la vacunación con Parvoruvax® redujo el número de cerdas con fetos afectados por la cepa desafío y el porcentaje de lechones y camadas positivas, lo que resultó en un mayor número de lechones vivos por camada.
Quedan por determinar los mecanismos exactos por los cuales Parvoruvax® actúa para proteger a los fetos. Además de la mayor homología antigénica de la cápside K22 con el clúster PPV-27a, otros componentes diferenciadores de la vacuna (como el método de preparación, producción de antígeno, adyuvante y cepa de E. rhusiopathiae) también podrían contribuir a hacerla superior a las otras vacunas testadas.
Adaptado de Vaccine Protection Against Experimental Challenge Infection with a PPV-27a Genotype Virus in Pregnant Gilts
BIBLIOGRAFÍA
1. Mengeling WL, Pejsak Z, Paul PS. Biological assay of attenuated strain NADL-2 and virulent strain NADL-8 of porcine parvovirus. Am J Vet Res. 1984;45(11):2403–2407. 2. Wilhelm S, Zeeuw EJ, Selbitz HJ, Truyen U. Tissue distribution of two field isolates and two vaccine strains of porcine parvovirus in foetal organs after experimental infection of pregnant sows as determined by real-time PCR. J Vet Med B Infect Dis Vet Public Health. 2005;52(7–8):323–326. doi:10.1111/j.14390450.2005.00878.x 3. Milek D, Wozniak A, Stadejek T. The detection and genetic diversity of novel porcine parvovirus 7 (PPV7) on Polish pig farms. Res Vet Sci. 2018;120:28–32. doi:10.1016/j.rvsc.2018.08.004 4. Cui J, Biernacka K, Fan J, Gerber PF, Stadejek T, Opriessnig T. Circulation of porcine parvovirus types 1 through 6 in serum samples obtained from six commercial polish pig farms. Transbound Emerg Dis. 2017;64(6):1945–1952. doi:10.1111/tbed.12593 5. Streck AF, Homeier T, Foerster T, Truyen U. Population dynamics and in vitro antibody pressure of porcine parvovirus indicate a decrease in variability. J Gen Virol. 2013;94(Pt 9):2050–2055. 6. Zeeuw EJ, Leinecker N, Herwig V, Selbitz HJ, Truyen U. Study of the virulence and cross-neutralization capability of recent porcine parvovirus field isolates and vaccine viruses in experimentally infected pregnant gilts. J Gen Virol. 2007;88(Pt 2):420–427. doi:10.1099/vir.0.82302-0 7. Streck AF, Canal CW, Truyen U. Molecular epidemiology and evolution of porcine parvoviruses. Infect Genet Evol. 2015;36:300–306. doi:10.1016/j.meegid.2015.10.007 8. Foerster T, Streck AF, Speck S, Selbitz HJ, Lindner T, Truyen U. An inactivated whole-virus porcine parvovirus vaccine protects pigs against disease but does not prevent virus shedding even after homologous virus challenge. J Gen Virol. 2016;97(6):1408–1413. doi:10.1099/jgv.0.000446 9. Piras F, Cappuccio P, Brun A et al. Characterisation of the parvovirus-specific immune response induced by a swine erysipelas/parvovirus combo vaccine (Parvoruvax®) in pigs. In: Proceedings of the 19th International Pig Veterinary Society Congress, Copenhagen, Denmark. Vol 2. Narayana Press; 2006:10–21. 10. Ladekjaer-Mikkelsen AS, Nielsen J. A longitudinal study of cell-mediated immunity in pigs infected with porcine parvovirus. Viral Immunol. 2002;15(2):373–384. doi:10.1089/08828240260066297





