9 minute read
Alimentación del gatito en crecimiento
from Argos 230
by Grupo Asís
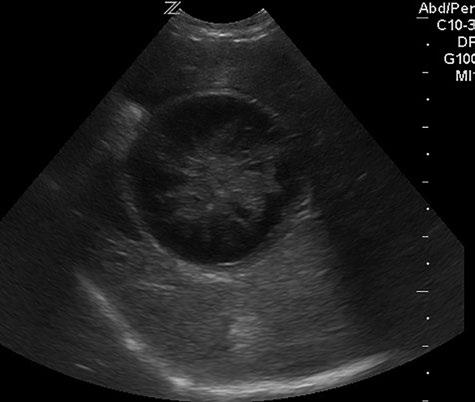
Figura 2. Imagen ecográfica de mucocele biliar tipo III
toma de muestra del parénquima hepático. El estudio prequirúrgico incluye radiografías torácicas, pruebas de coagulación y medición de la tensión arterial. En ninguna de estas pruebas se evidencian alteraciones reseñables.
Advertisement
Se premedica al paciente con 0,3 mg/kg de metadona y 0,15 µg/kg de medetomidina, además de 20 mg/kg de cefazolina y 0,2 mg/kg de meloxicam. La inducción anestésica se realiza con propofol a dosis efecto (1-2 mg/kg). La anestesia se mantiene con isoflurano en una proporción 50 % oxígeno/50 % aire.
Con el animal posicionado en decúbito dorsal, se realiza una laparotomía media ventral en la región craneal del abdomen con escisión del ligamento falciforme de la pared abdominal. Para obtener una mejor visualización y facilitar el acceso a la vesícula biliar, se colocan gasas húmedas en la porción craneal del hígado para desplazarlo caudalmente (figura 3).
Una vez localizada la vesícula biliar, se comienza la disección roma de la misma evitando invadir el parénquima hepático circundante para disminuir el sangrado (figura 4).
Se continúa su disección hasta conseguir una buena visualización del conducto cístico y unión del primer conducto hepático. Se procede seguidamente a realizar una doble ligadura con sutura monofilamento absorbible de polidioxanona 2/0 del conducto cístico a la altura de la unión con el conducto colédoco (figura 5). Se recomienda en este punto dejar un pequeño muñón de conducto cístico para reducir el riesgo de obstrucción del conducto biliar.
Además, se aprovecha para obtener una biopsia del parénquima hepático mediante la técnica de guillotina.
Tras la extracción de la vesícula biliar con el conducto cístico se comprueba la permeabilidad del conducto colédoco mediante la localización de la papila duodenal mayor a través de una enterotomía del duodeno. Con la ayuda de una sonda se cateteriza y se realiza flushing con suero cristaloide estéril observando que no exista presión excesiva (figura 6). En aquellos casos donde haya duda sobre la permeabilidad del conducto, principalmente por inflamación de este, se puede colocar un stent temporal.
Tras cerrar de manera rutinaria la duodenostomía, se realiza un lavado abdominal con suero atemperado y posteriormente se omentaliza tanto la fosa biliar como la incisión intestinal. Se finaliza la intervención con el cierre de la pared abdominal, tejido subcutáneo y piel.
Se recomienda enviar tanto la vesícula extirpada como la muestra de parénquima hepático al laboratorio para hacer cultivo y antibiograma y el estudio histopatológico de las mismas.
Tratamiento posoperatorio
El manejo de la analgesia posoperatoria se basa en la administración de una infusión continua intravenosa de 50 µg/ml de fentanilo + 100 mg/ml de ketamina + 20 mg/ml de lidocaína, para posteriormente continuar con 15 µg/ kg/6 h de buprenorfina hasta el alta médica 48 horas después de la cirugía. A la espera de los resultados del antibiograma, se instaura una terapia antibiótica con amoxicilina con ácido clavulánico a razón de 22 mg/kg/12 h. Además, se añade a la terapia 0,7 mg/kg/12 h de omeprazol y 1 mg/kg/24 h de maropitant como antiemético.
Pasadas seis horas del final de la intervención, se le ofrece agua y comida de manera progresiva observándose una buena aceptación por parte del animal. La evolución es satisfactoria y tras comprobar mediante analítica una mejoría en los parámetros bioquímicos inicialmente alterados se da el alta hospitalaria a las 48 horas.
En el cultivo microbiológico se aísla Streptococcus spp. sensible a la antibioterapia seleccionada, por lo cual se mantiene durante dos semanas más. La evolución clínica en las revisiones posteriores es muy favorable.
El resultado histopatológico de la vesícula revela una hiperplasia mucinosa quística, mientras que la muestra de parénquima hepático biopsiado revela una colangiohepatitis neutrofílica con fibrosis peribiliar y moderada degeneración vacuolar.
El estudio ecográfico abdominal se considera una prueba de gran importancia para el diagnóstico y estimación de la gravedad del mucocele.
Caso clínico 2: colelitiasis biliar
Se presenta en consulta un gato Común Europeo, macho castrado, de 8 años de edad, correctamente vacunado y desparasitado, remitido por su centro veterinario habitual por un cuadro de hiporexia, pérdida de peso y vómitos esporádicos
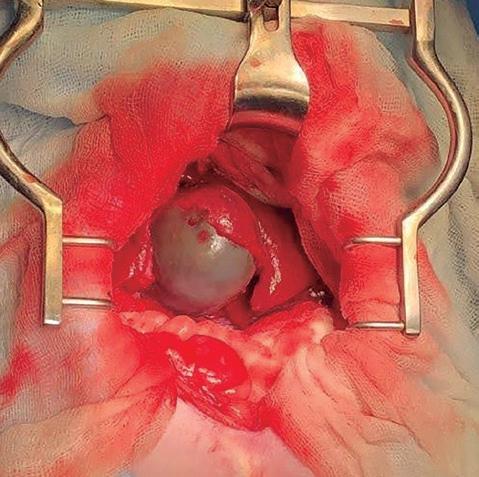
Figura 3. Localización de la vesícula biliar.
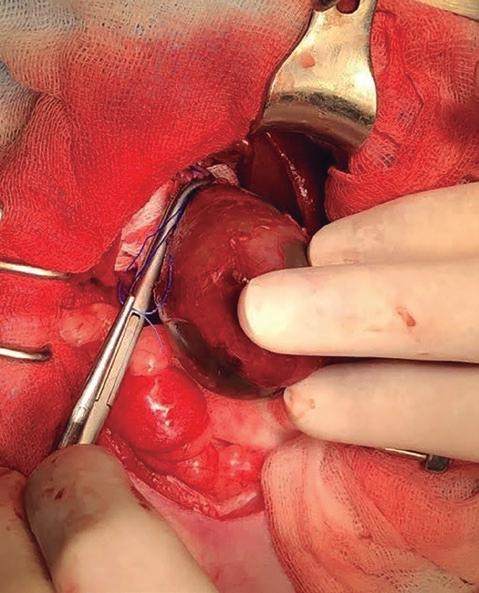
Figura 5. Ligadura del conducto cístico. Figura 4. Disección roma de la vesícula biliar.
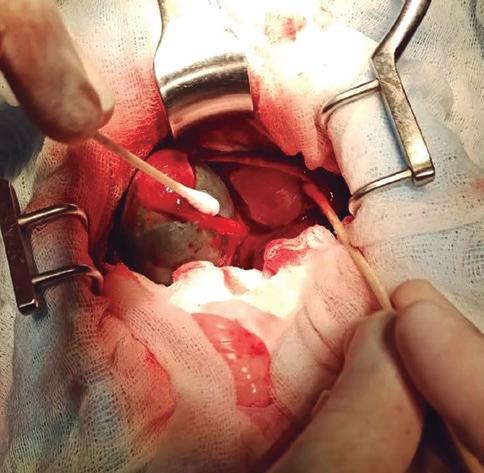
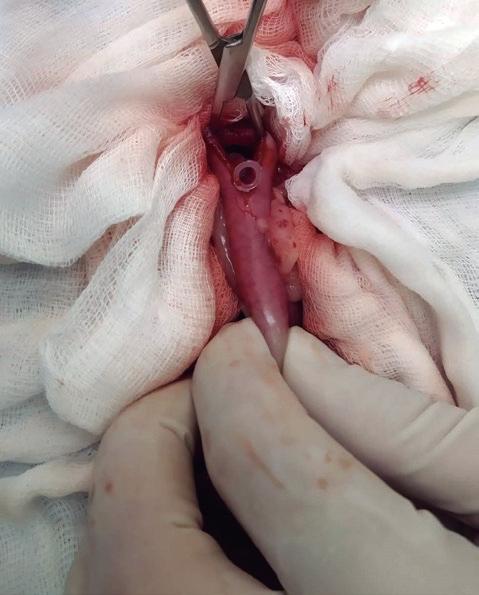
Figura 6. Cateterización de la papila duodenal mayor.
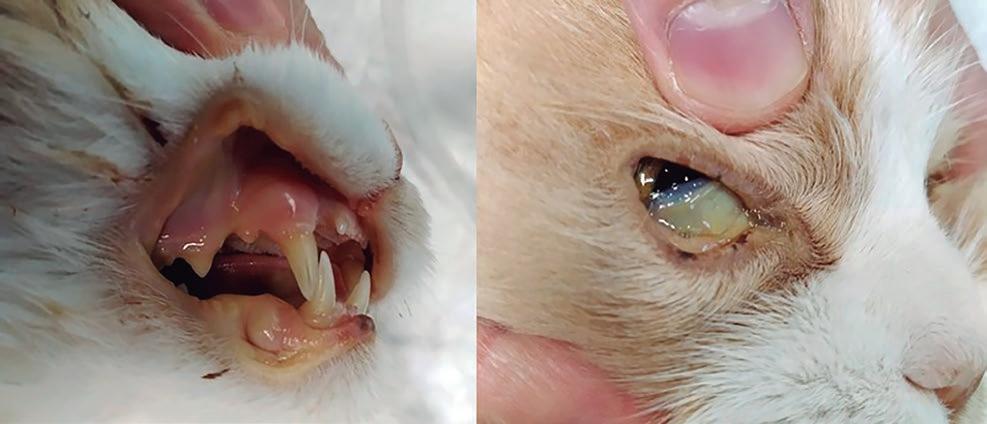

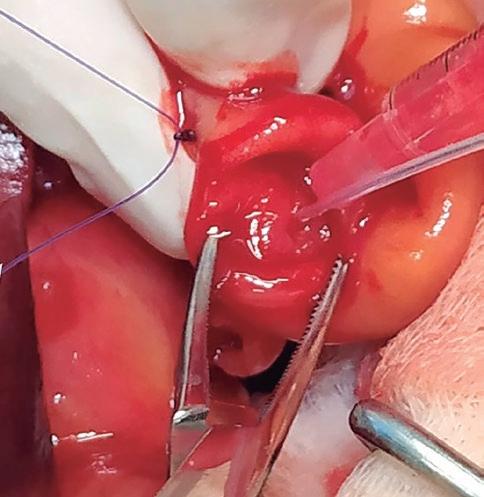
Figura 8. Cálculo en conducto colédoco (flecha). Figura 9. Conducto colédoco obstruido (flecha). Figura 10. Sondaje papila duodenal mayor.

de dos meses de evolución con empeoramiento agudo en las últimas 48 horas.
Exploración física y pruebas diagnósticas
El paciente, de 3,6 kg y una condición corporal 3/9, presenta en la exploración física general un claro estado de deshidratación, mucosas ictéricas (figura 7) y 39,9 °C de temperatura como hallazgos más reseñables.
Se procede a completar la exploración física con una analítica sanguínea completa y una ecografía abdominal. El hemograma revela anemia microcítica e hipocrómica no regenerativa (hematocrito 33,6 %, val. ref. 37-61 %) junto con una leve neutrofilia (13,28 K/µl, val. ref. 2,3-10,29 K/µl). La bioquímica mostró una hiperproteinemia (9,7 g/dl, val. ref. 5,7-8,9 g/dl) con hiperglobulinemia (6,8 g/dl, val. ref. 2,8-5,1 g/dl), leve aumento de la ALT y GGT (235 U/l, val. ref. 12-130 U/l, y 16 U/l, val. ref. 0-4 U/l, respectivamente) e hiperbilirrubinemia moderada (6,3 mg/dl, val. ref. 0,0-0,9 mg/dl). La
ecografía por su parte muestra colecistitis y la presencia de un colelito en el colédoco que produce un cuadro obstructivo asociado a una reacción peritoneal focal y una pequeña cantidad de líquido libre (figura 8). Estos resultados se completan con un estudio radiográfico del tórax, así como con unas pruebas de coagulación sanguínea, todos ellos sin alteraciones reseñables.
Intervención quirúrgica
Dados estos hallazgos se procede a estabilizar al paciente previo a la resolución quirúrgica del proceso obstructivo.
La premedicación del paciente se realiza con 0,3 mg/kg de metadona y 2 µg/kg de dexmedetomidina. La inducción anestésica se realiza con propofol a dosis efecto (1-2 mg/kg) y la anestesia se mantiene con isoflurano en una proporción 50 % oxígeno/50 % aire. Como antibioterapia de cobertura se emplean 22 mg/kg de amoxicilina con ácido clavulánico y 0,1 mg/kg de meloxicam.
En decúbito dorsal se realiza el abordaje de la cavidad abdominal a través de línea media. Tras localizar el conducto colédoco (figura 9), comprueba la permeabilidad del mismo mediante una enterotomía duodenal y sondaje a través de la papila duodenal mayor (figura 10). El flushing a través del catéter confirma la obstrucción completa del conducto y la falta de movilidad del colelito alojado en él, descartando de este modo la posibilidad de eliminar el cálculo biliar por abordaje de la vesícula o mediante una colecistectomía que lo incluyera. De las dos técnicas quirúrgicas posibles: coledocotomía y colecistoduodenostomía, se opta por esta última como técnica de resolución del proceso obstructivo.
Mediante disección roma de la vesícula biliar se procede a desanclarla de la fosa vesical y dotarla de movilidad para así poder realizar una anastomosis de la misma sobre la incisión duodenal realizada. Previo a dicha anastomosis, se realiza la apertura y lavado del interior de la vesícula obteniendo además una muestra de biliar que se remite al laboratorio para realizar un cultivo y un antibiograma. La colecistoduodenostomía se realiza mediante dos líneas de sutura con un patrón continuo simple con sutura monofilamento absorbible 4/0 de polidioxanona (figura 11).
Previo al cierre se realiza la toma de una muestra de tejido hepático que se remite a estudio histopatológico y microbiológico, así como un lavado abundante de la cavidad abdominal y omentalización de las líneas de sutura. El cierre de la pared abdominal se realiza de manera convencional por planos de las diferentes capas.
Por último, y de manera complementaria, se coloca una sonda de alimentación esofágica.
Tratamiento posoperatorio
Se hospitaliza al paciente para mantener el tratamiento antibiótico y antiinflamatorio prequirúrgico cada 8 y 24 horas, respectivamente. Además, se añadie al tratamiento médico metadona a razón de 0,2 mg/kg/4 h, maropitant a razón de 1 mg/kg/24 h y omeprazol a razón de 0,7 mg/kg/24 h, junto con fluidoterapia intravenosa con suero cristaloide a mantenimiento una vez restaurado el estado de hidratación. A través de la sonda de alimentación se retoma la ingestión de alimento partiendo de un 50 y 75 % de las necesidades energéticas diarias durante el primer y segundo día de hospitalización respectivamente.
Tras 48 horas el paciente muestra una evolución clínica favorable, con ausencia de dolor abdominal (tras pauta de reducción analgésica con buprenorfina) y pérdidas digestivas. Además, se repite el valor de la bilirrubina total que se mantiene por encima del rango fisiológico, pero con una mejoría clara con respecto al valor prequirúrgico (1,2 mg/dl, val. ref. 0,0-0,9 mg/dl). Por último, y previo al alta hospitalaria, se revisa ecográficamente la cavidad abdominal donde tan solo se observan cambios propios de la intervención.
Como tratamiento ambulatorio se recomienda mantener la terapia antibiótica, analgésica y antiinflamatoria en casa quedando la monitorización y evolución del paciente en manos de su centro veterinario habitual.
Los resultados obtenidos del cultivo biliar muestran la presencia de Streptococcus grupo viridians sensible al antibiótico en uso. Además, los resultados de la muestra hepática muestran una colangiohepatitis neutrofílica grave con hiperplasia de los conductos biliares y fibrosis incipiente, además de un marcado estasis biliar. Por su parte, en el cultivo hepático no asila ningún patógeno.
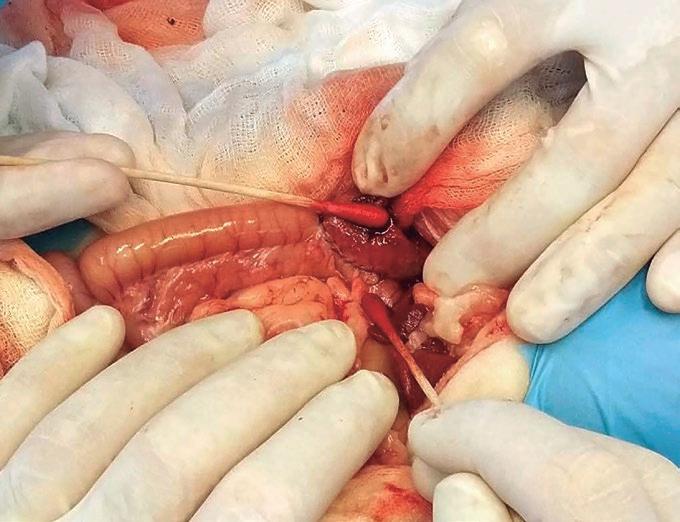
Figura 11. Colecistoduodenostomía.
Bibliografía
1. MaryAnn GR. Surgery of the extrahepatic biliary system. In: Small Animal Surgery. Fifth. ; 2018:618-632. 2. Mayhew PD, Weisse C. Liver and biliar system. In: Veterinary Surgery: Small Animal. Second. ; 2017:1819-1851. 3. Rancano Delgado JJ, Méndez Aguilar RE, Bobadilla JA, Salas Garrido G. Colelitiasis y coledocolitiasis obstructiva en un gato doméstico: Informe de un caso. Vet Méx. 2009;40(3):269-274. 4. Boyden EA. The accessory gall-bladder - an embryological and comparative study of aberrat biliary vesicle occurring in man and the domestic mammals. Am J Anat. 1926;38(2):177-231. 5. Fahie M, Martin RA. Extrahepatic biliary tract obstruction: a retrospective study of 45 cases (1983-1993). J Am Anim Hosp Assoc. 1995;31(November/December):478-482. doi:10.5326/15473317-31-6-478 6. Baker SG, Mayhew PD, Mehler SJ. Choledochotomy and primary repair of extrahepatic biliary duct rupture in seven dogs and two cats. J Small Anim Pract. 2011;52(January):32-37. doi:10.1111/j.1748-5827.2010.01014.x 7. Otte CMA, Penning LC, Rothuizen J. feline biliary tree and gallbladder disease Aetiology , diagnosis and treatment. J fo Feline Med Surg. 2017;(19):514-528. doi:10.1177/1098612X17706465 8. Kook PH, Schellenberg S, Rentsch KM, Reusch CE, Glaus TM. Effects of iatrogenic hypercortisolism on gallbladder sludge formation and biochemical bile constituents in dogs. Vet J. 2012;191(2):225-230. doi:10.1016/j.tvjl.2011.01.004 9. Mayhew PD, Holt DE, McLear RC, Washabau RJ. Pathogenesis and outcome of extrahepatic biliary obstruction in cats. J Small Anim Pract. 2002;43(June):247-253. 10. Eich CS, Ludwig LL. The surgical treatment of cholelithiasis in cats : A study of nine cases. J Am Anim Hosp Assoc. 2002;38:290-296. 11. Gu J, Sukut S, Aoki K, Zwicker L. Extrahepatic biliary duct obstruction secondary to duodenal foreign bodies in 2 dogs. Can Vet J. 2019;60(September):958-989. 12. Mehler SJ, Mayhew PD, Drobatz KJ, Holt DE. Variables Associated with Outcome in Dogs Undergoing Extrahepatic Biliary Surgery: 60 Cases (1988–2002). Vet Surg. 2004;33(September):644-649. doi:10.1111/j.1532-950X.2004.04087.x 13. Amsellem PM, Iii HBS, Macphail CM, et al. Long-term survival and risk factors associated with biliary surgery in dogs : 34 cases ( 1994 – 2004 ). J Am Vet Med Assoc. 2006;229(9):1451-1457. 14. Reyes A, Soler M, Martínez M, et al. Hallazgos ecográficos, clínicos y laboratoriales del mucocele biliar en el perro: 37 casos. Clínica Vet Pequeños Anim. 2016;36:265-272.










