TÀI LIỆU ÔN THI THPT QUỐC GIA MÔN HÓA HỌC - PHẦN VÔ CƠ 12 (CHƯƠNG TRÌNH CHUẨN)
NĂM HỌC 2017-2018
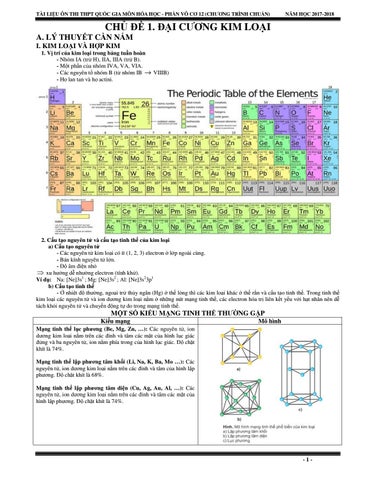
CHỦ ĐỀ 1. ĐẠI CƯƠNG KIM LOẠI A. LÝ THUYẾT CẦN NẮM I. KIM LOẠI VÀ HỢP KIM 1. Vị trí của kim loại trong bảng tuần hoàn - Nhóm IA (trừ H), IIA, IIIA (trừ B). - Một phần của nhóm IVA, VA, VIA. - Các nguyên tố nhóm B (từ nhóm IB → VIIIB) - Họ lan tan và họ actini.
2. Cấu tạo nguyên tử và cấu tạo tinh thể của kim loại a) Cấu tạo nguyên tử - Các nguyên tử kim loại có ít (1, 2, 3) electron ở lớp ngoài cùng. - Bán kính nguyên tử lớn. - Độ âm điện nhỏ ⇒ xu hướng dễ nhường electron (tính khử). Ví dụ: Na: [Ne]3s1 ; Mg: [Ne]3s2 ; Al: [Ne]3s23p1 b) Cấu tạo tinh thể - Ở nhiệt độ thường, ngoại trừ thủy ngân (Hg) ở thể lỏng thì các kim loại khác ở thể rắn và cấu tạo tinh thể. Trong tinh thể kim loại các nguyên tử và ion dương kim loại nằm ở những nút mạng tinh thể, các electron hóa trị liên kết yếu với hạt nhân nên dễ tách khỏi nguyên tử và chuyển động tự do trong mạng tinh thể.
MỘT SỐ KIỂU MẠNG TINH THỂ THƯỜNG GẶP Kiểu mạng
Mô hình
Mạng tinh thể lục phương (Be, Mg, Zn, …): Các nguyên tử, ion dương kim loại nằm trên các đỉnh và tâm các mặt của hình lục giác đứng và ba nguyên tử, ion nằm phía trong của hình lục giác. Độ chặt khít là 74%. Mạng tinh thể lập phương tâm khối (Li, Na, K, Ba, Mo …): Các nguyên tử, ion dương kim loại nằm trên các đỉnh và tâm của hình lập phương. Độ chặt khít là 68%. Mạng tinh thể lập phương tâm diện (Cu, Ag, Au, Al, …): Các nguyên tử, ion dương kim loại nằm trên các đỉnh và tâm các mặt của hình lập phương. Độ chặt khít là 74%.
-1-