
CHỦ ĐỀ 06: TỐC ĐỘ PHẢN ỨNG HOÁ HỌC
TÓM TẮT LÍ THUYẾT CHƯƠNG TỐC ĐỘ PHẢN ỨNG
Khái niệm
Để đánh giá mức độ xảy ra nhanh hay chậm của các phản ứng hóa học, người ta đưa ra khái niệm tốc độ phản ứng hóa học, gọi tắt là tốc độ phản ứng.
Hình 6.1.a. Vụ nổ xảy ra tại triển lãm quân sự ở Nizhniy Tagil, Nga, là rất nhanh. Các khí được tạo ra đột ngột tạo thành sóng xung kích của vụ nổ.
Hình 6.1.b. Một số phản ứng xảy ra rất chậm, như trong quá trình ăn mòn dần dần trên mũi tàu Titanic ở tầng lạnh giá của Đại Tây Dương.

Tốc độ phản ứng là độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm
trong một đơn vị thời gian.
Xét phản ứng tổng quát: aA → + bB cC + dD Biểu thức tốc độ trung bình của phản ứng:
Trong đó:
• : v là tốc độ trung bình của phản ứng.
• 21 : CCC∆=− Sự biến thiên nồng độ.

• 21 : ttt∆=− biến thiên thời gian.
• C1, C2 là nồng độ của một chất tại 2 thời điểm tương ứng t1, t2.
Chú ý: Hệ số tỉ lượng các chất trong phương trình hoá học của một phản ứng thường khác nhau, do đó để qui tốc độ của một phản ứng về cùng một giá trị, trong công thức tính tốc độ phản ứng cần chia thêm hệ số tỉ lượng của chất được lấy để tính tốc độ.
Ví dụ: Phản ứng phân hủy H2O2: H2O2 → H2O + ½ O2. Kết quả thí nghiệm đo nồng độ H2O2 tại các thời điểm khác nhau được trình bày trong bảng.
Bảng 6.1. Sự phụ thuộc nồng độ H2O2 vào thời gian phản ứng

Hãy tính tốc độ phản ứng theo nồng độ H2O2 trong khoảng thời gian từ 3 giờ đến 6 giờ
HOHO 22(6h)22(3h) tb

CC 0,50,707 v 0,069mol/L.h 633 =−=−=
Các yếu tố ảnh hưởng tới tốc độ phản ứng
Ảnh hưởng nồng độ - Định luật tác dụng khối lượng:
Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng
với số mũ thích hợp.

Xét phản ứng đơn giản: aA + bB → cC + dD ab ABvk.C.C =

Trong đó:
• k là hằng số tốc độ phản ứng.
• a và b là các hệ số tỉ lượng của phản ứng đơn giản.
• CA, CB là nồng độ mol . L-1 tương ứng của chất A, B.
Khi nồng độ các chất phản ứng bằng nhau, bằng 1M thì hằng số tốc độ phản ứng bằng tốc độ phản ứng.
Hình 6.2. Phản ứng của đá vôi với các dung dịch HCl có nồng độ khác nhau

Ảnh hưởng nhiệt độ - Hệ số nhiệt độ Van’t Hoff TT21 10 2 1
v v

=γ
Trong đó:
• v2, v1 là tốc độ phản ứng tương ứng tại thời điểm T2, T1.
Ứng dụng của thay đổi tốc độ phản ứng trong đời sống
Nồng độ ban đầu của potassium hydroxide là 0,07 M, sau 30 phút lấy ra 10 mL dung dịch hỗn hợp phản ứng (hỗn hợp A). Trung hòa 10 mL dung dịch A cần vừa đủ 12,84 mL dung dịch hydrochloric acid 0,05 M. Tính tốc độ phản ứng trung bình của phản ứng trong khoảng thời gian trên (mol/L.s).
Bài 4: Phản ứnggiữaNa2S2O3 vàH2SO4 thu đượcmuốisunfate,sulfur,sulfuldioxidevànước, thường
được dùng trong nghiên cứu các yếu tố ảnh hưởng đến tốc độ phản ứng. Tiến hành thí nghiệm với
100 ml dung dịch hỗn hợp Na2S2O3 0,5M và H2SO4 (dư), sau 40 giây, thể tích SO2 thu được ở điều kiện chuẩn là 0,9916 L. Giả sử khí tạo ra đều thoát ra khỏi dung dịch, tính tốc độ trung bình của phản ứng theo Na2S2O3
Bài 5: Dung dịch hydrochloric acid phản ứng với dây magnesium. Thể tích khí hydrogen thoát ra trong 80 giây đầu tiên (khi cho dây magnesium phản ứng với dung dịch hydrochloric acid) được biểu diễn bằng đồ thị sau:

Hình 6.3.a. Ảnh hưởng của nồng độ
Hình 6.3.b. Ảnh hưởng của áp suất
Hình 6.3.c. Ảnh hưởng của diện tích tiếp xúc

Hình 6.3.d. Ảnh hưởng của chất xúc tác
Hình 6.3.e. Ảnh hưởng của nhiệt độ
Hình 6.3.f. Ảnh hưởng của chất xúc tác

Hình 6.3. Ảnh hưởng của một số yếu tố tới tốc độ phản ứng
A. PHẦN BÀI TẬP TỰ LUẬN
Dạng 1: Tính tốc độ trung bình của phản ứng
Bài 1: Cho phản ứng phân hủy N2O5 và nồng độ của N2O5 tại thời điểm t1 = 0 và t2 =100 giây như
sau:
N2O5 N2O4 + 1/2O2
t0: 0 s 2,3 mol/L
t1: 184 s 2,08 mol/L
Bài 2: Giả sử bạn cần HI tinh khiết cao. Bạn có thể điều chế nó bằng cách phản ứng trực tiếp từ
hydrogen và iodine theo phản ứng H2(k) + I2(k) → 2HI(k), với điều kiện phản ứng xảy ra đủ nhanh. -


Trong khoảng thời gian 100 giây, nồng độ của HI tăng từ 3,50 mmol . L-1 đến 4,00 mmol . L-1. Tốc độ trung bình của phản ứng này là bao nhiêu?
Bài 3: Cho phản ứng xảy ra trong dung dịch: C2H5Br + KOH → C2H5OH + KBr
Hình 6.4. Đồ thị sự phụ thuộc thể tích khí hydrogen theo thời gian Tính tốc độ trung bình của phản ứng tạo thành khí hydrogen (cm3.s-1) trong khoảng thời gian 80 giây.
Bài 6: Có thể theo dõi tốc độ phản ứng giữa zinc và hydrochloric acid bằng cách đo thể tích khí hydrogen thoát ra trong phản ứng.


Kết quả
Thời gian (giây) Thể tích khí (cm3) 0 0
Hình 6.5. Sơ đồ thí nghiệm quá trình đo khí hydrogen thoát ra từ phản ứng của Zn và HCl


a) Tính tốc độ trung bình của khí thoát ra (cm3/s) trong 40 giây đầu của phản ứng.

b) Tại sao tăng nồng độ acid sẽ làm tốc độ của phản ứng tăng?
Bài 7: Ở 40 ℃ dung dịch H2O2 phân huỷ theo phản ứng: 2H2O2(aq) → 2H2O(l) + O2(g) Nồng độ của H2O2 tại những thời điểm khác nhau được biểu thị trong bảng 6.2: Thời điểm (giờ) Nồng độ [H2O2] (M) 0 1,000
0,0500
12 0,025
Bảng 6.2 Sự thay đổi nồng độ H2O2 theo thời gian
Tính tốc độ trung bình của phản ứng phân huỷ H2O2 (M/ s) trong những quãng thời gian từ
a) 0 đến 6 giờ. b) 6 giờ đến 12 giờ.
Bài 8: Phản ứngphânhuỷ N2O5 ở trongphakhíxảyranhư sau:
2N2O5 (g) → 4NO2(g) + O2(g)
Tiến hành thí nghiệm nghiên cứu phản ứng trên, kết quả thí nghiệm được mô tả ở bảng 7.
Thí nghiệm [N2O5], mol/L Thời gian, s
1 0,1000 0
2 0,0707 50
3 0,0500 100
4 0,0250 200
5 0,0125 300
6 0,00625 400
Bảng 6.3. Sự thay đổi nồng độ N2O5 theo thời gian
Tính tốc độ trung bình của phản ứng tại thời điểm từ 50 s đến 100 s; từ 100 s đến 400 s.
Bài 9: Tiến hành thí nghiệm phân huỷ NO2 ở 300 oC theo phương trình
2NO2(g) → 2NO(g) + O2 (g)
Kết quả thí nghiệm được biểu diễn ở bảng 8. Thời gian (s) Nồng độ (mol/L) NO2
Na2S2O3 + H2SO4 → Na2SO4 + SO2 + S + H2O

Thể tích khí sulfur dioxide tạo thành được đo sau mỗi khoảng thời gian 10 giây. Giá trị tốc độ trung
bình của phản ứng tương ứng được cho trong bảng sau:
Thời gian (s) 0 10 20 30
Thể tích khí sulfur dioxide (cm3) 0,0 12,5 20,0 26,5 31,0 32,5 33 33
Tốc độ trung bình của phản ứng (cm3 s-1) 0,0 1,25 x 0,65 y z t u
Bảng 6.6. Sự thay đổi thể tích khí sulfur dioxide và tốc độ trung bình của phản ứng theo thời gian
a. Thời điểm đầu, tốc độ phản ứng nhanh hay chậm?
b. Hoàn thành các giá trị x, y, z và u trong bảng.
c. Vẽ đồ thị sự phụ thuộc thể tích khí SO2 vào thời gian phản ứng.
d. Thời điểm kết thúc, đồ thị có hình dạng như thế nào.
e. Nhận xét giá trị tốc độ phản ứng theo thời gian. Giải thích?
Bài 12: Một nhóm học sinh thực hiện hai thí nghiệm sau:
Thí nghiệm 1: Cho zinc viên vào 25 mL dung dịch hydrochloric acid 0,5 M.
Thí nghiệm 2: Cho zinc bột vào 25 mL dung dịch hydrochloric acid 0,5 M.
Biết khối lượng Zn được lấy ở hai thí nghiệm là bằng nhau và lượng dung dịch HCl được lấy dư so
với lượng cần thiết.
a) Viết phương trình phản ứng hóa học xảy ra trong các thí nghiệm trên.
b) Dựa vào đồ thị được cho dưới đây, tính tốc độ trung bình của phản ứng đối với thí nghiệm 1 và thí nghiệm 2. So sánh tốc độ phản ứng giữa thí nghiệm 1 và thí nghiệm 2, giải thích.
Thí nghiệm 1: Đường I. Thí nghiệm 2: Đường II.
Bảng 6.4. Sự thay đổi nồng độ NO2 theo thời gian
a) Tính tốc độ trung bình của phản ứng theo độ giảm nồng độ của NO2 trong 150 giây đầu tiên và trong các mốc 50 giây tiếp theo.
b) Nhận xét về tốc độ trung bình của phản ứng theo thời gian.
Bài 10: Một số phản ứng diễn ra với số mol chất phản ứng cụ thể theo thời gian được thể hiện trong
bảng dưới đây:
Phản ứng Lượng chất phản ứng (mol)
Thời gian phản ứng (s) Tốc độ phản ứng (mol/s)
1 2 30 ?
2 5 120 ?
3 1 90 ?
4 3,2 90 ?
5 5,9 30 ?
Bảng 6.5. Sự phụ thuộc lượng chất phản ứng và tốc độ phản ứng theo thời gian
a. Tính tốc độ trung bình của mỗi phản ứng?
b. Phản ứng nào diễn ra nhanh nhất? Phản ứng nào diễn ra chậm nhất?
Bài 11: Xét phản ứng:
Hình 6.5. Sự phụ thuộc thể tích khí SO2 theo thời gian
Bài 13: Tiến hành khảo sát phản ứng sau ở 25 oC trong dung dịch benzene có chứa pyridine 0,1 M: CH3OH + (C6H5)3CCl → CH3OC(C6H5)3 + HCl
Kết quả khảo sát được đưa ra trong bảng 6. Nồng độ đầu mol/L
t∆ (phút) [CH3OC(C6H5)3] [CH3OH] [(C6H5)3CCl] [CH3OC(C6H5)3]
0,0000 7,5
Bảng 6.7. Kết quả khảo sát
a) Tính tốc độ trung bình của phản ứng ở các khoảng thời gian 7,5 phút, 15 phút, 25 phút.
b) Viết biểu thức tính tốc độ tức thời của phản ứng.
c) Tính hằng số tốc độ của phản ứng.
Bài 14: Xét phản ứng phân huỷ hydrogen peroxide:
Thời gian H2O2 (M)
Tốc độ trung bình của phản ứng (M/s)
1,000 0
120 0,910 7,5.10-4
300 0,780 ?
600 0,590 ?
1200 0,370 ?
1800 0,220 4,3.10-4
2400 0,130 ?
3000 0,082 ?
3600 0,050 ?
Bảng 6.9. Sự biến đổi nồng độ H2O2 và tốc độ trung bình của phản ứng theo thời gian
a. Hoàn thành cột còn lại của bảng trên.
b. Nhận xét về sự thay đổi tốc độ phản ứng theo thời gian? Giải thích?
c. Vẽ đồ thị sự phụ thuộc tốc độ trung bình của phản ứng theo thời gian.
Bài 15: Sự có mặt của enzyme catalase sẽ làm tăng tốc độ phân huỷ

hydrogen peroxide thành oxygen và nước nhanh gấp khoảng 107 lần sự phân huỷ khi không có mặt enzyme này. Giả sử một phản ứng phân huỷ hydrogen peroxide không có chất xúc tác mất 400 ngày, hãy tính thời gian (theo giây) cho sự phân huỷ cùng một lượng hydrogen peroxide đó khi có sử dụng enzyme catalase làm chất xúc tác. Nhận xét về kết quả thu được?
Hình 6.6. Enzyme catalase
Bài 16: Tốc độ phản ứng còn được tính theo sự thay đổi lượng chất (số mol, khối lượng) theo thời gian. Cho hai phản ứng xảy ra đồng thời trong bình (1) và bình (2) như sau:
Mg + Cl2 → MgCl2 (1)
2Na + Cl2 → 2NaCl (2)
Tiếnhành thínghiệm và thấy rằng sau 2 phút có 2,85 gam MgCl2 được hình thành theo phản ứng(1).
a. Xác định tốc độ trung bình của phản ứng (theo đơn vị mol/phút) theo lượng sản phẩm được tạo ra.
b. Giả sử rằng phản ứng (2) xảy ra cùng tốc độ trung bình như phản ứng (1).
• Tính số mol NaCl được tạo thành sau 2 phút theo phản ứng (2).
• Tính lượng sodium cần thiết để tạo ra lượng sodium chloride như trên.
Dạng 2: Định luật tác dụng khối lượng
Bài 17: Cho phản ứng đơn giản: 2CO → CO2 + C
Cần tăng nồng độ của carbon monoxide lên bao nhiêu lần để cho tốc độ phản ứng thuận tăng lên 8 lần?
Bài 18: Cho phản ứng hóa học đơn giản: H2(g) + I2(g) → 2HI(g)
Công thức tính tốc độ của phản ứng thuận trên là v = k.[H2].[I2]. Tốc độ của phản ứng thuận trên sẽ tăng bao nhiêu lần khi tăng áp suất chung của hệ lên 3 lần?
Bài 19: Cho phản ứng hóa học đơn giản: 2NO(g) + O2(g) → 2NO2(g)
Tốc độ phản ứng hóa học trên được tính theo công thức v = k [NO]2[O2]. Hỏi ở nhiệt độ không đổi, người ta phải tăng áp suất chung của hệ lên bao nhiêu lần (bằng cách nén hỗn hợp khí xuống) để tốc
độ của phản ứng tăng 64 lần?
Bài 20: Cho phản ứng hóa học đơn giản có dạng: A + B → C
Tốc độ phản ứng thay đổi như thế nào khi:
a. Nồng độ A tăng 2 lần, giữ nguyên nồng độ B.
b. Nồng độ B tăng 2 lần, giữ nguyên nồng độ A.
c. Nồng độ của cả hai chất đều tăng lên 2 lần.
d. Nồng độ của chất này tăng lên 2 lần, nồng độ của chất kia giảm đi 2 lần.
e. Tăng áp suất chúng của hệ lên 2 lần đối với hỗn hợp phản ứng, coi đây là phản ứng của các chất khí
Bài 21: Cho phản ứng đơn giản: A+ 2B → C
Nồng độ ban đầu các chất: [A] = 0,3 M; [B] = 0,5 M. Hằng số tốc độ k = 0,4.
a) Tính tốc độ phản ứng tại thời điểm ban đầu.
b) Tĩnh tốc độ phản ứng tại thời điểm t khi nồng độ A giảm 0,1 mol/L.
Bài 22: Cho phản ứng đơn giản:
A + 2B → C
Cho biết nồng độ ban đầu của A là 0,8 M, của B là 0,9 M và hằng số tốc độ k = 0,3. Hãy tính tốc độ
phản ứng khi nồng độ chất A giảm 0,2 M.
Bài 23: Xét phản ứng hoá học đơn giản giữa hai chất A và B theo phương trình: A + B → C
Từ thông tin đã cho, hoàn thành bảng dưới đây:
Thực nghiệm Nồng độ chất A (M) Nồng độ chất B (M) Tốc độ phản ứng (M/s)
1 0,20 0,050 0,24
2 0,28 ? 0,20
3 ? 0,28 0,80
4 0,15 0,20 ?
5 0,30 ? 1,000,3
Bảng 6.10. Nồng độ các chất tham gia và tốc độ trung bình của phản ứng ở các lần thí nghiệm
Bài 24 (Nâng cao): Xét phản ứng sau:
HI + C2H5I → C2H6 + I2
Phương tình tốc độ phản ứng có dạng: 25 xy HICHIvk.CC =
Thực hiện phản ứngvớinồng độ đầu khác nhauvà đo tốc độ phản ứngtương ứngthu được kếtquả trong bảng sau:
Thí nghiệm Nồng độ HI (M) Nồng độ C2H5I (M) Tốc độ phản ứng (M/(L.s)
Bảng 6.11. Nồng độ các chất tham gia phản ứng và tốc độ trung bình của phản ứng ở các lần thí nghiệm khác nhau
Dựa trên kết quả thí nghiệm, tính giá trị x, y trong biểu thức tốc độ phản ứng.
Bài 25 (Nâng cao): Kết quả nghiên cứu động học của phản ứng
3I (aq) + S2O8 2 (aq) → I3 (aq) + 2SO4 2 (aq)
được cho trong bảng dưới đây:
[I ], M [S2O8 2 ], M Tốc độ (tương đối) của phản ứng
0,001 0,001
0,002 0,001
0,002 0,002
Bảng 6.12. Nồng độ các chất tham gia phản ứng và tốc độ trung bình của phản ứng ở các lần thí nghiệm khác nhau
Viết biểu thức liên hệ tốc độ phản ứng với nồng độ các chất tham gia phản ứng.
Bài 26 (Nâng cao): Tốc độ phản ứng giữa KMnO4 và H2C2O4 có thể được xác định qua sự thay đổi màu của dung dịch do biến thiên nồng độ của ion MnO4 . Khi tiến hành phản ứng ở nhiệt độ không
đổi 25 ℃, người ta thu được các số liệu sau:
Thí nghiệm [MnO4 ], M [H2C2O4], M Tốc độ biến mất của MnO4 , M.s 1
Bài 31: Hệ số nhiệt độ của một phản ứng bằng 1,8. Để tốc độ của phản ứng
phải tăng nhiệt độ của hệ lên bao nhiêu độ?
Bài 32: Một phản ứng hoá học ở 100 ℃ có hằng số tốc độ phản ứng là 6.10-4; ở 150 oC có hằng số tốc độ phản ứng là 0,1458. Tính hệ số nhiệt độ của phản ứng.
Bài 33: Khi nhiệt độ tăng thêm 50 ℃ thì tốc độ phản ứng hoá học tăng lên 1024 lần. Tính giá trị hệ số nhiệt của tốc độ phản ứng trên?
Bài 34: Tính hệ số nhiệt độ của tốc độ phản ứng biết rằng khi giảm nhiệt độ của phản ứng này xuống 80 ℃ thì tốc độ phản ứng giảm đi 256 lần.
Bài 35: Khi tăng nhiệt độ lên 10 ℃, tốc độ của phản ứng tăng lên 3 lần. Để tốc độ của phản ứng đó (đang tiến hành ở 40 ℃) tăng lên 27 lần thì cần phải thực hiện ở nhiệt độ bao nhiêu?
Bài 36: Ở nhiệt độ 100 ℃, phản ứng thứ nhất có tốc độ gấp đôi tốc độ của phản ứng thứ hai. Hệ số nhiệt độ của phản ứng thứ nhất là 2, của phản ứng thứ 2 là 4. Hỏi ở nhiệt độ nào thì hai phản ứng trên có tốc độ bằng nhau?
Bài 37: Để hoà tan một mẫu aluminum (Al) trong dung dịch acid hydrochloric acid (HCl) ở 20 ℃ cần 27 phút. Cũng mẫu aluminum đó tan hết trong dung dịch acid nói trên ở 40 ℃ trong 3 phút. Tính thời gian (tính theo s) hoà tan mẫu aluminum đó trong dung dịch acid nói trên ở 60 ℃.
Bài 38: Để hoà tan hết một mẫu Zn trong dung dịch acid HCl ở 20 ℃ cần 27 phút. Cũng mẫu Zn đó tan hết trong dung dịch acid nói trên ở 40 ℃ trong 3 phút. Tính thời gian để hoà tan hết mẫu Zn đó trong dung dịch nói trên ở 55 ℃.
v2 : v1 = 3(55 – 20) : 10 . Ta có T1 : T2 = v2 : v1 T2 = 34,64 s
Bài 39: 2,3,7,8-TC DD (dioxin) là chất độc mạnh nhất trong các hóa chất, nó độc gấp 1 triệu lần tất cả các chất độc đã có trong tự nhiên và là tồn tại lâu bền nhất. Một nghiên cứu năm 2002 của trường
Đại học Columbia đã tính rằng chỉ 80 gam dioxin pha vào nước uống sẽ “giết sạch” người dân của 1 thành phố với 8 triệu dân. Dioxin phân huỷ vô cùng chậm trong đất, mất 8 năm để lượng dioxin giảm đi một nửa. Nếu một mảnh đất có chứa 0,128.10-3 gam dioxin thì phải mất bao nhiêu lâu để lượng dioxin đó còn lại là 10-6 gam?
Bảng 6.13. Nồng độ các chất tham gia phản ứng và tốc độ trung bình của phản ứng ở các lần thí nghiệm khác nhau
Xác định bậc phản ứng riêng phần của MnO4 và H2C2O4.
Dạng 3: Hệ số nhiệt Van’t Hoff
Bài 27: Hệ số nhiệt độ của một phản ứng bằng 3. Tốc độ của phản ứng đósẽ biến đổi như thế nàokhi
tăng nhiệt độ từ 80 ℃ lên 130 ℃?
Bài 28: Tốc độ của phản ứng tăng bao nhiêu lần nếu tăng nhiệt độ từ 200 ℃ đến 240 ℃, biết rằng khi tăng 10 ℃ thì tốc độ phản ứng tăng 2 lần.
Bài 29: Khi tăng nhiệt độ lên 10 ℃, tốc độ của phản ứng tăng lên 4 lần. Tốc độ của phản ứng đó sẽ tăng hay giảm bao nhiêu lần khi nhiệt độ của phản ứng giảm từ 70 ℃ xuống 40 ℃?
Bài 30: Nếu muốn tốc độ phản ứng tăng 243 lần thì cần phải thực hiện ở nhiệt độ bao nhiêu? Biết phản ứng đang thực hiện ở nhiệt độ 20 ℃, hệ số nhiệt độ γ = 3.
Hình 6.7. Công thức cấu tạo thu gọn của dioxin
Bài 40: Phản ứng phân huỷ một loạt hoạt chất kháng sinh có hệ số nhiệt độ là 2,5. Ở 27 ℃ sau12 giờ thì lượng hoạt chất giảm đi một nửa.
a. Khi đưa vào cơ thể người (37 ℃) thì mất bao lâu để lượng hoạt chất kháng sinh giảm đi một nửa?
b.Sau bao lâu thìlượnghoạt chất kháng sinh này trong cơ thể người còn lại là 6,25% sovới ban đầu?
Bài 41: Trong thí nghiệm "đồng hồ iodine", tốc độ của phản ứng
2834 3I + SO I + 2SO → có
thể được đo bằng thời gian t (giây) khi dung dịch hồ tinh bột chuyển sang màu xanh lam. Một nhóm
học sinh đã nghiên cứu phản ứng trên ở 20 oC và dữ liệu thu được như sau:
Thời gian
(giây) 88,0 44,0 22,0 44,0 t1

a) Xác định mục đích nghiên cứu của nhóm học sinh trên.
b) Xác định thời gian xuất hiện màu t1.
c) Giả sử phản ứng trên có hệ số nhiệt độ γ = 2. Nếu thí nghiệm 3 được tiến hành ở 40 oC. Tính thời gian t2 để màu xuất hiện.
d) Từ phân tích và so sánh các dữ liệu trong bảng trên, hãy rút ra kết luận của nghiên cứu.
D
ạng 4: Các yếu tố ảnh hưởng tới tốc độ phản ứng.
Bài 42: Cho biết tốc độ phản ứng thay đổi như thế nào trong từng trường hợp sau? Giải thích?
Hình 6.8.a. Khi nấu thức ăn chúng ta thường hay cắt thức ăn thành các miếng nhỏ hơn

Hình 6.8.b. Khi giặt quần áo chúng ta thường cho nhiều bột giặt vào chỗ vết bẩn

Bài 43: Hình ảnh dưới đây minh hoạ ảnh hưởng của yếu tố nào tới tốc độ phản ứng? Giải thích?

Hình 6.10. Các viên than tổ ong
b. Giải thích vì sao khi nhóm lò than người ta phải quạt gió vào lò bằng quạt tay hoặc quạt máy? Còn khi ủ than người ta lại đậy nắp lò than?
Hình 6.9. Ảnh hưởng của yếu tố X tới tốc độ phản ứng
Hình 6.11.a. Nhóm lò than bằng quạt gió Hình 6.11.b Đậy nắp lò than khi ủ than Bài 45: Giải thích tại sao nhiệt độ của ngọn lửa acetylene cháy trong oxygen cao hơn nhiều so với cháy trong không khí.
Bài 44:
a. Vì sao người ta tạo ra những lỗ hổng trong các viên than tổ ong?
Hình 6.12. Đèn xì acetylene cháy trong ngọn lửa giàu oxygen Bài 46: Khi tiếp thêm củi vào bếp lửa để cho lửa mạnh hơn ta nên:



- Phương án 1: Bỏ một thanh củi to vào bếp.

- Phương án 2: Chẻ mỏng nó ra rồi cho vào bếp.
Hãychọnmộttronghaiphươngántrênvà giải thíchcho sự lựa chọn đó.Từ đó,có thể kếtluận tốc độ phản ứng trong trường hợp này phụ thuộc yếu tố nào?
Bài 47: Đồ thị dưới đây biểu diễn sự ảnh hưởng của diện tích tiếp xúc bề mặt tới tốc độ phản ứng:
Hình 6.13. Ảnh hưởng của diện tích tiếp xúc bề mặt tới tốc độ phản ứng
Dựa vào đồ thị cho biết diện tích tiếp xúc bề mặt ảnh hưởng như thế nào tới tốc độ phản ứng?
Bài 48: Bảng dưới đây biểu diễn sự phụ thuộc thời gian phản ứng vào nồng độ chất tham gia phản
ứng:
Số thứ tự Thể tích của dung dịch và nước Thời gian phản ứng
1 5 ml + 5 ml t1
2 4 ml + 6 ml t2
3 3 ml + 7 ml t3
4 2 ml + 8 ml t4
Bảng 6.14. Sự phụ thuộc thời gian phản ứng vào nồng độ chất tham gia phản ứng
So sánh t1, t2, t3 và t4. Giải thích?
Bài 49: Lấy cùng 1 lượng CaCO3 cho phản ứng với cùng một thể tích dung dịch hydrochloric acid
0,1M nhưng ở hai nhiệt độ khác nhau. Thể tích khí sinh ra ở mỗi thí nghiệm theo thời gian được biểu diễn ở đồ thị bên:

d.AlbộttácdụngvớidungdịchHClnhanhhơnAldây.
e. Thép bền hơn nếu được sơn chống gỉ
f. Khicần ủ bếp than, người ta đậybếp lò làm chophản
ứng đốt cháy than bị chậm lại.
g. Khi muối dưa để dưa nhanh chín nên cho thêm một
ít nước dưa chua vào.
Bài 51: Hãy nối các phản ứng xảy ra ở trong các trường hợp ở cột (I) với các yếu tố ảnh hưởng ở cột
(II) sao cho phù hợp (Lưu ý có thể nối nhiều ý ở cột I với một ý ở cột II): Các trường hợp (Cột I) Yếu tố ảnh hưởng (Cột II)
1. Đưa sulfur đang cháy ngoài không khí vào lọ đựng khí oxygen, sự cháy diễn ra mạnh và nhanh hơn.
2. Khi ủ bếpthan, ngườita đậy nắp bếp lò làm chophản ứng cháy của than chậm lại.
3. Phản ứng oxi hóa SO2 thành SO3 diễn ra nhanh hơn khi có mặt V2O5.
4. Đávôidạngbộtphản ứngvớidungdịch HCl nhanh hơn so với đá vôi dạng viên.
5. Người ta chẻ nhỏ củi để bếp lửa cháy mạnh hơn.
6. Để giữ cho thực phẩm tươi lâu, người ta để thực phẩm trong tủ lạnh.
7. Để hầmthức ănnhanhchín,ngườita sử dụng nồi áp suất.
8. Để làm sữa chua, rượu, … người ta sử dụng các loại men thích hợp.
1 - A. Ảnh hưởng của nhiệt độ.
2 - B. Ảnh hưởng của chất xúc tác.
3- C. Ảnh hưởng của diện tích tiếp xúc bề mặt.
4 - D. Ảnh hưởng của áp suất.
5 - E. Ảnh hưởng của nồng độ
6 - F. Ảnh hưởng của thể tích.
7 -
8 -
Hình 6.14. Đồ thị sự phụ thuộc tốc độ phản ứng vào nhiệt độ
a. Viết phương trình hoá học của phản ứng.
b. Giải thích vì sao đồ thị màu đỏ ban đầu cao hơn đầu thị màu xanh.
c. Vì sao sau một thời gian, hai đường đồ thị lại chụm lại với nhau?
Bài 50: Xác định các yếu tố ảnh hưởng tới tốc độ phản ứng (Cột II) trong các trường hợp (Cột I) sau: Các trường hợp (Cột I) Yếu tố ảnh hưởng (Cột II)
a. Sự cháy diễn ra nhanh và mạnh hơn khi được đưa mẩuthangỗ đangcháyngoàikhôngkhívàolọ đựngkhí
O2 nguyên chất.
b. Phản ứng oxi hoá SO2 tạo thành SO3 diễn ra nhanh hơn khi có mặt của V2O5.
c. Đèn xì acetylene cháy trong ngọn lửa giàu O2 có thể cung cấp nhiệt độ lên tới 3000 ℃ dùng để hàn, cắt kim loại.
13
Bài 52: Nêubiệnpháp đã đượcsử dụng(CộtII) để làmtăngtốc độ phản ứnghóa học trongcác trường hợp (Cột I) sau: Các trường hợp (Cột I) Yếu tố ảnh hưởng
1. Rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn…) để ủ rượu.
2. Tạo thành những lỗ rỗng trong viên than tổ ong.
3. Nén hỗn hợp khí nitrogen và hydrogen ở áp suất cao để tổng hợp ammonia (NH3).

4. Nung hỗn hợp bột đá vôi, đất sét, thạch cao ở nhiệt độ cao để sản xuất clinke trong công nghiệp sản xuất xi măng.
5. Dùng phương pháp ngược dòng trong sản xuất sulfuric acid.
Bài 53: Tốc độ phản ứng giữa zinc và dung dịch sulfuric acid
Bảng dưới đây cho biết kết quả của 6 thí nghiệm xảy ra giữa zinc và dung dịch sulfuric acid.
Trong mỗi thí nghiệm, người ta dùng 0,2 gam zinc tác dụng với thể tích bằng nhau của acid, nhưng
có nồng độ khác nhau.
Thí nghiệm
Nồng độ acid Nhiệt độ (oC) Zinc ở dạng Thời gian phản ứng xong (s)
1 1M 25 Lá 190
2 2M 25 Bột 85
3 2M 35 Lá 62
4 2M 50 Bột 15
5 2M 35 Bột 45
6 3M 50 Bột 11
Bảng 6.15. Kết quả thí nghiệm giữa zinc và dung dịch sulfuric acid trong các điều kiện khác nhau

Những thí nghiệm nào chứng tỏ rằng:
a) Phản ứng xảy ra nhanh hơn khi tăng nhiệt độ?
b) Phản ứng xảy ra nhanh hơn khi tăng diện tích tiếp xúc?
c) Phản ứng xảy ra nhanh hơn khi tăng nồng độ acid?
Bài 54: Hãy giải thích vì sao người ta thực hiện các quá trình sản xuất trong các điều kiện sau:
a) Dùng không khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang).
b) Nung đá vôi ở nhiệt độ cao ≈ 900 – 950 ℃ để sản xuất vôi sống miệng lò hở
c) Nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clinke (trong sản xuất xi măng).
Bài 55: Cho hai miếng magnesium có kích thước, khối lượng giống nhau. Một miếng là khối magnesium đặc (A), một miếng có nhiều lỗ nhỏ bên trong và trên bề mặt (B). Thả hai miếng magnesium vào hai cốc đựng dung dịch H2SO4 1 M có cùng thể tích. Theo dõi thể tích khí thoát ra theo thời gian. Đồ thị giữa thể tích khí thoát ra và thời gian phản ứng được biểu diễn tại hình 6.

Hình 6.16. Ảnh hưởng của chất xúc tác tới nồng độ H2O2 theo thời gian
Từ đồ thị cho biết chất xúc tác nào có hiệu quả hơn? Giải thích?
Bài 57: Khí nitrogen và oxygen có thể cùng tồn tại trong cùng một bình kín ở điều kiện bình thường mà không nguy hiểm. Nhưng dưới tác dụng của tia lửa điện hoặc một ít bột kim loại được thêm vào thì có phản ứng hoá học xảy ra và khí tạo thành rất độc.

a. Tia lửa điện có phải chất xúc tác không? Giải thích?.
b. Bột kim loại có phải chất xúc tác không? Giải thích?.
Bài 58: Bộ chuyển đổi xúc tác là một thiết bị kiểm soát khí thải. Thiết bị này hoạt động trên cơ chế chuyển những khí độc và chất ô nhiễm trong khí thải thành những chất thải ít độc hơn hoặc không
độc bằng một phản ứng oxi hóa khử có sử dụng các xúc tác kim loại như platinum, rhodium và palladium. Sự có mặt của các chất xúc tác giúp thúc đẩy quá trình nhường nhận electron của chất trong khí thải giúp chuyển đổi khoảng 98% khí độc hại thành khí ít độc hại hoặc không độc hại cho môi trường. Chẳng hạn khí thải chứa hydrocarbon bị oxygen hoá thành carbon dioxide và nước, carbon monoxide thành carbon dioxide, các oxide của nitrogen bị khử thành nitrogen và oxygen giải phóng ra môi trường. Thiết bị trên vận dụng yếu tố nào để tác động đến phản ứng? Giải thích quá trình trên bằng các phản ứng hoá học?
Hình 6.15. Đồ thị sự phụ thuộc thể tích khí hydrogen vào thời gian phản ứng của miếng magnesium A và B Cho biết đồ thị tương ứng nào mô tả miếng magnesium thoát ra từ thanh magnesium A và B. Giải thích?
Bài 56: Một chất xúc tác được gọi là có hiệu qủa cao khi làm tăng nhanh tốc độ phản ứng. Người ta thấy hai chất xúc tác Fe2O3 và MnO2 đều có khả năng làm xúc tác cho phản ứng phân huỷ H2O2. Sử dụnghaichấtnàylàm xúc tác cho phản ứng phân huỷ H2O2, người ta đo nồng độ H2O2 theo thời gian thu được đồ thị sau:

15
Hình 6.17. Nguyên tắc hoạt động của bộ chuyển đổi xúc tác
Bài 59: Năm 1785, một vụ nổ xảy ra tại nhà kho chuyên làm bột mì tại Giacomelli (Roma, Italia).
Nguyên nhân được xác định là do bột mì bay trong không khí, chạm tới nguồn lửa của chiếc đèn, dẫn tới đámcháyvà đâylà vụ nổ bụi đầutiêntronglịchsử.Sau đólà các vụ nổ bụitronghầmthan,xưởng
xuất sữa bột, dược phẩm, nhựa, kim loại, … có tác nhân tương tự gồm: nguồn oxygen, nhựa, nguồn nhiệt có thể cháy được, nồng độ bụi để đạt được vụ nổ và không gian đủ kín.
Hình 6.18.a. Nguyên nhân cháy gây ra bởi bụi bột mì
Thínghiệmnhư hìnhdưới đâychothấy, bộtmìkhông dễ cháy.Tạisaobộtmìvà mộtsố loại bụikhác có thể gây ra nổ bụi? Để ngăn ngừa và hạn chế nổ bụi có thể can thiệp vào những tác nhân nào?
Bảng 6.16. Sự phục thuộc nồng độ của các chất tham gia phản ứng và tốc độ ph
i gian
(*) Ở điều kiện nàyphản ứng xảyra rấtchậm, trongmôi trườngacid,như điều kiệntrongdạ dày,phản ứng thuỷ phân xảy ra nhanh hơn.
a. Hoàn thành bảng trên?
b. Nhận xét sự thay đổi tốc độ phản ứng theo thời gian. Giải thích?
Bài 61: Nhóm học sinh trường A đã thực hiện dự án "khám phá ảnh hưởng của các yếu tố đến tốc độ phản ứng hóa học", nhóm học sinh sử dụng 4,0 mL dung dịch KMnO4 0,01 M và 2,0 mL dung dịch H2C2O4 0,1 M cho các thí nghiệm, thay đổi các điều kiện như sau:
Thí nghiệm Thể tích dung dịch H2SO4 10% Nhiệt độ (oC) Chất khác (nếu có)
1 2 mL 20 Không
2 2 mL 20 10 giọt dung dịch MnSO4 bão hòa
3 2 mL 30 Không
Hình 6.18.b. Thí nghiệm đốt cháy bột mì
Bài 60: Aspirin (acetyl salicylic acid C9H8O4) là thuốc hạ sốt, giảm đau, có tính kháng viêm, được sử dụng khá phổ biến trên thế giới, khoảng 25000 tấn mỗi năm. Khi uống aspirin, phản ứng thuỷ phân xảy ra như sau:


4 1 mL 20 1 mL nước cất
a) Nếu nghiên cứu ảnh hưởng của chất xúc tác đến tốc độ phản ứng hóa học, sử dụng thí nghiệm ___ và ___; nếu nghiên cứu ảnh hưởng của nhiệt độ đến tốc độ phản ứng hóa học, sử dụng thí nghiệm ___ và ___.
b) So sánh thí nghiệm 1 và 4, có thể nghiên cứu ảnh hưởng của ________ đến tốc độ phản ứng. Mục đích của việc thêm 1 mL nước cất trong thí nghiệm 4 là để _________.
Do có nhiều ứng dụng trong điều trị nên có nhiều nghiên cứu tập trung vào phản ứng thuỷ phân này và các yếu tố ảnh hưởng đến tốc độ phản ứng. Dữ liệu về quá trình thuỷ phân của một mẫu aspirin trong H2O (môi trường trung tính) ở 37 ℃(*) thể hiện trong bảng:

B. PHẦN BÀI TẬP TRẮC NGHIỆM
Dạng 1: Tốc độ trung bình của phản ứng
Câu 1: Để đánh giá mức độ xảy ra nhanh hay chậm của các phản ứng hoá học người ta dùng đại
lượng nào dưới đây?
A. Nhiệt độ
C. Áp suất.
Câu 2: Nhận định nào dưới đây là đúng?
A. Khi nhiệt độ tăng thì tốc độ phản ứng tăng.
B. Khi nhiệt độ tăng thì tốc độ phản ứng giảm.
C. Khi nhiệt độ giảm thì tốc độ phản ứng tăng.
B. Tốc độ phản ứng.
D. Thể tích khí.
D. Sự thay đổi t0 không ảnh hưởng đến tốc độ phản ứng.
Câu 3: Dưới đây là một số hiệntượng xảy ra trong đờisống, hãy sắp xếptheo thứ tự tốc độ phản ứng giảm dần:
(1) Phản ứng cháy của xăng, dầu.
(2) Các thanh thép ở các công trường xây dựng bị oxi hoá bởi các tác nhân trong không khí.

(3) Phản ứng lên men rượu từ trái cây.
(4) Nướng bánh mì.
A. (1) > (4) > (3) > (2). B. (1) > (4) > (2) > (3).

C. (4) > (1) > (2) > (3). D. (1) > (3) > (4) > (2).


Câu 4: Cho phản ứng: 6CH2O + 4NH3 → (CH2)6N4 + 6H2O. Các biểu thức dưới đây biểu diễn tốc độ trung bình của phản ứng:
C. D.
Câu 6: Trong các phản ứng sau, phản ứng nào xảy ra với tốc độ nhanh nhất?
A. Quá trình quang hợp
B. Quá trình gỉ của sắt.
Những biểu thức nào biểu diễn đúng tốc độ trung bình của phản ứng trên?
A. A, B và C. B. B, D và E. C. A, C và E. D. B và D.
Câu 5: Nếu mỗi đồ thị có các chất phản ứng cùng nồng độ và trục thời gian thì tốc độ của chất phản


ứng nào xảy ra nhanh nhất?
C. Quá trình đốt cháy magnesium trong oxygen.


D. Quá trình lên men rượu.
Câu 7: Trong dung dịch phản ứng thuỷ phân ethyl acetate (CH3COOC2H5) có xúc tác acid vô cơ xảy ra như sau: CH3COOC2H5 + H2O CH3COOH + C2H5OH

Chọn phát biểu đúng?
A. Tại thời điểm ban đầu, nồng độ acid tăng dần theo thời gian.
B. Tại thời điểm ban đầu, nồng độ acid trong bình phản ứng bằng 0.
C. Tỉ lệ mol giữa chất đầu và chất sản phẩm luôn bằng 1.
D. Acid HCl chuyển hoá dần thành acid CH3COOH nên nồng độ acid HCl giảm dần theo thời gian.
Câu 8: Thực hiện phản ứng sau: CaCO3 + 2HCl → CaCl2 + CO2 + H2O


Theo dõi và ghi lại thể tích khí CO2 thoát ra theo thời gian, thu được đồ thị như sau (Thể tích khí đo được ở áp suất khí quyển và nhiệt độ phòng).

Hình 6.19. Sự phụ thuộc thể tích khí CO2 theo thời gian
Trong các phát biểu sau, phát biểu nào không đúng?
A. Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
B. Khi phản ứng hóa học xảy ta, tốc độ phản ứng giảm dần theo thời gian.
C. Tốc độ trungbìnhcủaphản ứngtrongkhoảngthờigiantừ thời điểm đầu đến75giâylà 0,33mL/s.
D. Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là như nhau.
Câu9: Đồ thị nàodưới đâybiểudiễn ảnhhưởngcủasự tăngnhiệt độ đếntốc độ phản ứngcủa calcium carbonate với hydrochloric acid loãng?
B.
Câu 10: Cho phản ứng: N2 (g) + 3H2 (g) → 2NH3 (g). Tốc độ mất đi của H2 so với tốc độ hình thành của NH3 như thế nào?


A. Bằng ½. B. Bằng 3/2. C. Bằng 2/3. D. Bằng 1/3.
Câu11: Thínghiệmgiữahydrochloricacidvàcalciumcarbonate đượcbiểudiễnnhư hìnhvẽ.Trường hợp nào tốc độ phản ứng là chậm nhất?
Câu 12: Khi bắt đầu phản ứng, nồng độ một chất là 0,024 mol/L. Sau 10 giây xảy ra phản ứng, nồng
độ của chất đó là 0,022 mol/L. Tốc độ phản ứng là
A. 0,0003 mol/L. s. B. 0,00025 mol/L.s.
C. 0,00015 mol/L.s. D. 0,0002 mol/L.s.
Câu 13: Thực hiệnphản ứng sautrong bìnhkín:H2 (g) + Br2 (g) → 2HBr (g)thu được số liệu như sau:


Thời gian (phút) Nồng độ Br2 (M)
t1 = 0 0,072
t2 = 2 0,048
Bảng 6.17. Sự biến đổi nồng độ Br2 theo thời gian
Tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là
A. 8.10-4 mol/(L.s).
B. 2.10-4 mol/(L.s).
C. 6.10-4 mol/(L.s). D. 4.10-4 mol/(L.s).
Câu 14: Xét phương trình hóa học: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/L. Sau 20 giây, nồng độ của chất X là 0,008 mol/L. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
A. 4,0.10−4 mol/(L.s). B. 1,0.10−4 mol/(L.s).



C. 7,5.10−4 mol/(L.s). D. 5,0.10−4 mol/(L.s).
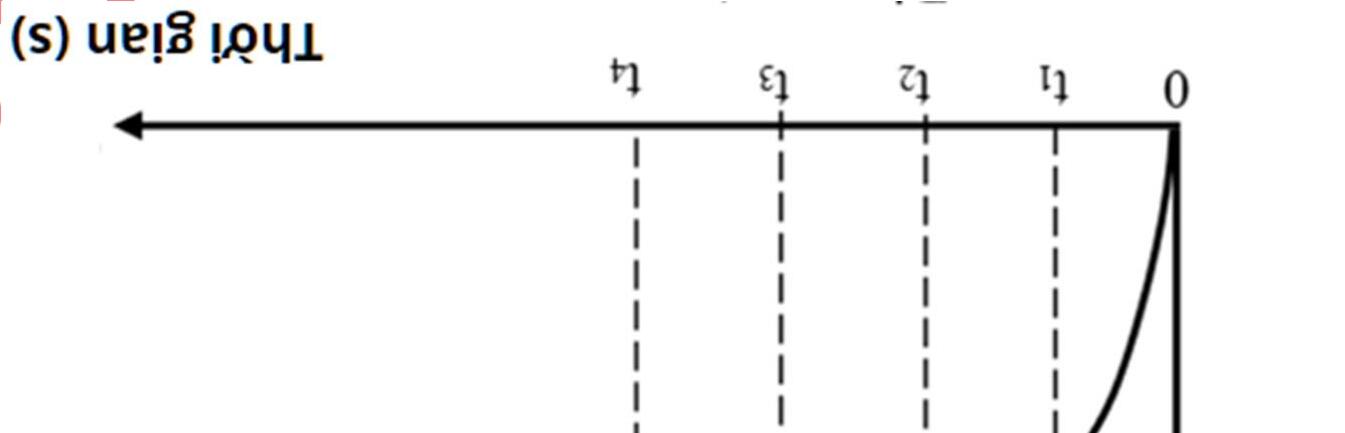
Câu 15: Hình 6.20 biểu diễn thể tích của khí carbonic sinh ra theo thời gian khi cho calcium carbonate phản ứng với dung dịch hydrochloric acid:
Hình 6.20. Thể tích của khí carbonic theo thời gian Vào thời điểm nào thì tốc độ của phản ứng là nhanh nhất?
A. t1 B. t2 C. t3 D. t4 Câu 16: Hình 6.21 biểu diễn thể tích của khí sinh ra theo thời gian khi cho zinc phản ứng với dung dịch hydrochloric acid.
Tốc độ trung bình của phản ứng tính theo N2O5 là
A. 6,80.10-4 mol/(L.s). B. 2,72.10-3 mol/(L.s).
C. 6,80.10-3 mol/(L.s). D. 1,36.10-3 mol/(L.s).
Câu 18: Ở 45oC N2O5 bị phân hủy trong dung môi CCl4 theo phương trình. N2O5 → N2O4 + 1 2 O2
Ban đầu nồng độ của N2O5 là 2,25 M, sau 200 giây nồng độ c
của phản ứng tính theo N2O5 là
A. 2,72.10-3 mol/L.s. B. 1,36.10-3 mol/L.s.
C. 6,80.10-3 mol/L.s. D. 1,15.10-3 mol/L.s.
Câu 19: Thực hiện phản ứng sau trong bình kín có dung tích không đổi 2 L X2(g) + Y2(g) → 2Z(g)
bình
Hình 6.21. Đồ thị biểu diễn sự phụ thuộc của thể tích khí hydrogen theo thời gian Độ dốc của biểu đồ giảm dần theo thời gian vì
A. Chất xúc tác không được sử dụng.
B. Khối lượng hỗn hợp giảm.
C. Nhiệt độ của phản ứng giảm.
D. Nồng độ hydrochloric acid giảm.
Câu 17: Ở 45oC N2O5 bị phân hủy trong dung môi CCl4 theo phương trình. N2O5 → N2O4 + 1 2 O2 Sự thay đổi nồng độ của N2O5 theo thời gian được ghi lại trong bảng 6.18
Thời gian (giây) Nồ
Lúc đầu số mol của khí X2 là 0,6 mol, sau 10 phút số mol của khí X2 còn lại 0,12 mol. Tốc độ trung bình của phản ứng tính theo X2 trong khoảng thời gian trên là:
A. 8.10-4 mol/(L.s) . B. 4.10-4 mol/(L.s).
C. 2,4 mol/(L.s). D. 4,6 mol/(L.s).
Câu 20: Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,7185 ml khí O2 (ở đkc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 2,5.10-4 mol/(L.s). B. 5,0.10-4 mol/(L.s).

C. 1,0.10-3 mol/(L.s). D. 5,0.10-5 mol/(L.s)
Câu 21: Cho phản ứng A + B C. Nồng độ ban đầu của A là 0,1 mol/L, của B là 0,8 mol/L. Sau 10 phút, nồng độ của B chỉ còn 20% nồng độ ban đầu. Tốc độ trung bình của phản ứng tính theo B là
A. 0,064 mol/L.phút. B. 0,016 mol/L.phút.
C. 1,6 mol/L.phút. D. 0,106mol/L.phút
Câu 22: Thông tin về phản ứng: A + B → C được cho trong bảng sau: Thời gian (phút) Nồng độ A (M) Nồng độ B (M) t1 = 0 0,12 0,1 t2 = 10 ? 0,078

Bảng 6.19. Sự biến đổi nồng độ các chất tham gia phản ứng theo thời gian Giá trị thích hợp điền vào dấu “?” là
A. 0,042. B. 0,098. C. 0,02. D. 0,034.
Câu 23: Cho phản ứng: Br2 + HCOOH → 2HBr + CO2
Nồng độ ban đầu của Br2 là a mol/L, sau50giâynồng độ Br2 còn lạilà 0,01 mol/L.Tốc độ trungbình
của phản ứng trên tính theo Br2 là 4.10-5 mol (L.s). Giá trị của a là
A. 0,018. B. 0,016. C. 0,012. D. 0,014.
Câu 24: Ở 30 ℃ sự phân hủy H2O2 xảy ra theo phản ứng: 2H2O2 → 2H2O + O2↑
Dựa trên bảng số liệu, giá trị tốc độ trung bình của phản ứng trong khoảng 120 giây đầu tiên là
Thời gian (s) 0 60 120 240
Nồng độ H2O2 (M) 0,3033 0,2610 0,2330 0,2058
Bảng 6.20. Sự biến đổi nồng độ H2O2 theo thời gian
A. 2,929.10−4 mol/L.s.
B. 5,858.10−4 mol/L.s.

C. 4,667.10−4 mol/L.s. D. 2,333.10−4 mol/L.s.
Câu 25: Xét phản ứng: 4HCl (g)+ O2 (g) 2H2O(g) + 2Cl2 (g). Giả sử ban đầu chỉ có HCl và O2
Sau một thời gian phản ứng, nồng độ của các chất là: HCl = 0,75 mol/L; O2 = 0,42 mol/L; Cl2 = 0,20 mol/L. Nồng độ ban đầu của HCl (mol/L) và O2 (mol/L) lần lượt là

A. 1,15 và 0,52. B. 0,52 và 1,15.
C. 0,26 và 1,25. D. 1,15 và 0,26.
Câu 26: Cho phản ứng:
3A + 2B → 2M + N
Nếu biến thiên nồng độ trung bình của chất M (DCM : Dt) là 1,0 mol/L.s thì tốc độ trung bình của
phản ứng và biến thiên nồng độ trung bình N (DCN : Dt), A (-DCA : Dt) và B(-DCB : Dt) lần lượt là:
A. 2,0 mol/L.s; 4,0 mol/L.s; 6,0 mol/L.s và 8,0 mol/L.s
B. 0,5 mol/L.s; 0,5 mol/L.s; 1,5 mol/L.s và 1,0 mol/L.s.



C. 2,0 mol/L.s; 1,0 mol/L.s; 1,5 mol/L.s và 1,0 mol/L.s.
D. 0,5 mol/L.s; 1,5 mol/L.s; 1,0 mol/L.s và 0,5 mol/L.s.
Câu 27: Đồ thị sau đây cho thấy hai con đường phản ứng khác nhau cho cùng một phản ứng tổng thể
ở cùng một nhiệt độ. Con đường nào chậm hơn và tại sao?
Hình 6.22. Sự khác nhau về tiến trình phản ứng của các phản ứng khác nhau
A. Con đường I, vì năng lượng hoạt hóa lớn hơn
B. Con đường II, vì năng lượng hoạt hóa thấp hơn.
C. Cả hai phản ứng đều diễn biến với tốc độ như nhau.
D. Không đủ thông tin để nhận định.
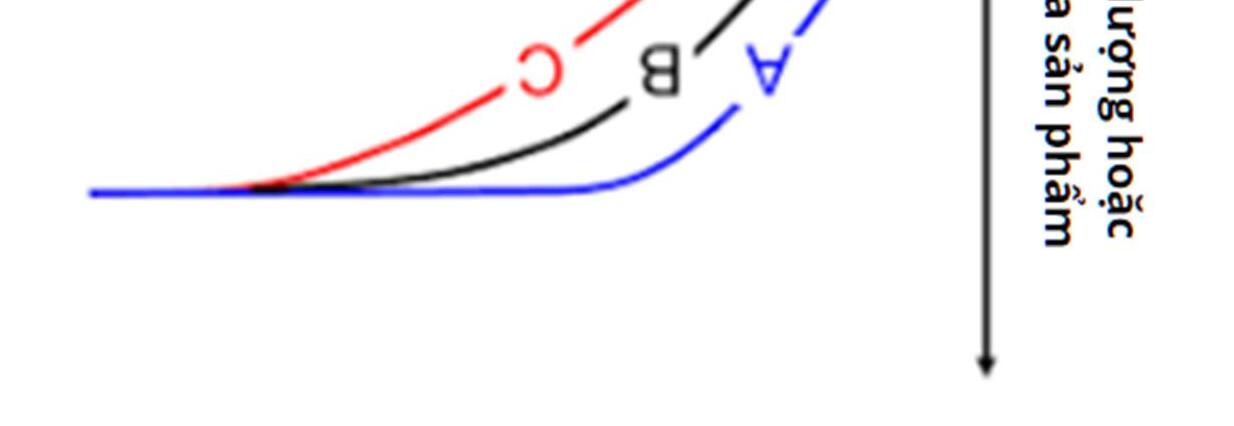
Câu 28: Cho đồ thị thể hiện sự thay đổi tốc độ phản ứng của ba phản ứng A, B, C.
Hình 6.23. Đồ thị biểu diễn sự phụ thuộc lượng sản phẩm theo thời gian
Phản ứng nào có tốc độ phản ứng nhanh nhất?
A. Phản ứng A.
B. Phản ứng B.
C. Phản ứng C.
D. Tốc độ ba phản ứng bằng nhau do gặp nhau tại cùng một vị trí.
Câu 29: Cho đồ thị thể hiện sự thay đổi tốc độ phản ứng của một phản ứng hóa học. Thời điểm nào phản ứng dừng lại?
Hình 6.24. Đồ thị biểu diễn sự phụ thuộc thể tích khí theo thời gian
A. Sau 100 giây.
C. Sau 70 giây.
Dạng 2: Định luật tác dụng khối lượng
B. Sau 50 giây.
D. Sau 80 giây.
Câu 1: Phản ứng đơn giản: A(g) + B(g) → C(g) + D(g) có biểu thức xác định tốc độ phản ứng như sau: v = k.CA.CB 2. Phát biểu nào sau đây là đúng?
A. CA, CB là kí hiệu nồng độ ban đầu của chất A, B.
B. CA, CB là kí hiệu nồng độ lúc cân bằng của chất A, B.
C. CA, CB là kí hiệu nồng độ tại thời điểm xác định tốc độ của chất A, B.
D. Tất cả đều sai.
Câu 2: Tốc độ phản ứng tại một thời điểm của phản ứng đơn giản 2A + B → C được tính bằng biểu thức: 2 ABvk.C.C = . Hằng số tốc độ k phụ thuộc vào
A. Nồng độ của chất. B. Nồng độ của chất B.
C. Nhiệt độ của phản ứng. D. Thời gian xảy ra phản ứng.
Câu 3: Chophản ứngthựchiệntrongbìnhkhícópiston:A(g)+2B(g) → C(g)+D(g).Khinénpiston
làm tăng áp suất chung hỗn hợp đầu lên 2 lần thì tốc độ phản ứng tăng lên
A. 9 lần. B. 8 lần. C. 4 lần. D. 6 lần.
Câu 4: Phosgen (COCl2) là một chất độc hoá học được sử dụng trong chiến tranh thế giới thứ nhất:
D. Tăng nồng độ SO2 và O2 lên 2 lần.
Câu 7: Cho phản ứng: 2X(g) + Y(g) → Z(g) + T(g). Nếu áp suất của hệ tăng 3 lần thì tốc độ phản
ứng tăng hay giảm bao nhiêu lần?
A. Tốc độ giảm đi 3 lần. B. Tốc độ tăng lên 3 lần.
C. Tốc độ giảm đi 27 lần. D. Tốc độ tăng lên 27 lần.
Câu 8: Cho phản ứng A + 2B C. Nồng độ ban đầu của A là 1 M, B là 3 M, hằng số tốc độ k =
0,5. Tốc độ của phản ứng khi đã có 20% chất A tham gia phản ứng là
A. 0,016. B. 2,304. C. 2,704. D. 2,016.
Câu 9: Cho phản ứng: N2(g) + 3H2(g) → 2NH3(g) có biểu thức tốc độ tức thời:
v = k ´ CN2 ´ CH2 3. Nếu nồng độ của H2 giảm 2 lần, giữ nguyên nồng độ của N2 thì tốc độ phản ứng
sẽ:
A. Tăng 8 lần. B. Tăng 2 lần.
C. Giảm 8 lần. D. Tăng 4 lần.
Câu 10: Cho phản ứng đơn giản: H2 + I2 → 2HI
Người ta thực hiện 3 thí nghiệm với nồng độ các chất đầu (Nồng độ của H2 và I2) được lấy khác nhau
và xác định được tốc độ tạo thành HI trong 20 giây đầu tiên, kết quả cho trong bảng sau:
CH2 CI2 DCHI : Dt (M.s-1) 0,10 0,20 5,00 0,20 0,20 10,00 0,10 0,15 3,75
Bảng 6.21. Sự biến đổi nồng độ các chất tham gia phản ứng theo thời gian
Biểu thức định luật tác dụng viết cho phản ứng trên là:
Hình 6.25. Trong chiến tranh thế giới thứ nhất người ta dùng phosgen làm chất độc
Phản ứng tổng hợp phosgen tiến hành như sau: CO + Cl2 → COCl2. Đây là phản ứng đơn giản và
biểu thức tốc độ phản ứng có dạng: v = k.[CO].[Cl2]3/2

Tốc độ phản ứng trên thay đổi như thế nào nếu:
a. Tăng nồng độ CO lên 2 lần và giữ nguyên nồng độ Cl2?
A. Tăng 2 lần. B. Tăng 4 lần.
C. Giảm 2 lần. D. Không đổi.
b. Giảm nồng độ Cl2 xuống 4 lần và giữ nguyên nồng độ CO?
A. Giảm 4 lần. B. Giảm 8 lần.
C. Tăng 4 lần. D. Giảm 6 lần.
Câu 5: Cho phản ứng: 2SO2 + O2 2SO3. Tốc độ phản ứng thuận thay đổi bao nhiêu lần nếu thể tích hỗn hợp giảm đi 3 lần?
A. 3. B. 6. C. 9. D. 27.
Câu 6: Cho phản ứng: 2 SO2 + O2 2SO3. Tốc độ phản ứng thuận tăng lên 4 lần khi
A. Tăng nồng độ SO2 lên 2 lần.
B. Tăng nồng độ SO2 lên 4 lần.
C. Tăng nồng độ O2 lên 2 lần.
Câu 11: Cho các phát biểu sau:
(1) Phản ứng đơn giản là phản ứng xảy ra theo một bước.
(2) Phản ứng đơn giản là phản ứng có các hệ số tỉ lượng trong phương trình hoá học bằng nhau và bằng 1.
(3) Tốc độ của một phản ứng đơn giản tuân theo định luật tác dụng khối lượng.
(4) Tốc độ của mọi phản ứng hoá học đều tuân theo định luật tác dụng khối lượng.

(5)Hằngsố tốc độ của phản ứng là tốc độ của phản ứngkhi nồng độ của tất cả các chất trong hỗnhợp phản ứng đều bằng nhau và bằng 1.
(6) Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
(7) Hằng số tốc độ của phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
(8) Hằng số tốc độ của phản ứng phụ thuộc vào nhiệt độ và bản chất của phản ứng.
Số phát biểu đúng là
A. 3.
B. 4. C. 5. D. 6.
Dạng 3: Hệ số nhiệt độ Van’t Hoff
Câu 1: Biết rằng khi nhiệt độ tăng lên 10 ℃ thì tốc độ của một phản ứng tăng lên 2 lần. Khi tăng nhiệt độ từ 20 ℃ đến 100 ℃ tốc độ phản ứng tăng
A. 16 lần. B. 256 lần. C. 64 lần. D. 14 lần.
Câu 2: Để hoà tan một tấm Zn trong dung dịch acid HCl ở 20 ℃ thì cần 27 phút, cũng tấm Zn đó tan hết trong dung dịch acid HCl nói trên ở 40 ℃ trong 3 phút. Hỏi để hoà tan hết tấm Zn đó trong dung dịch acid HCl trên ở 55 ℃ thì cần bao nhiêu thời gian?
A. 60 s. B. 34,64 s. C. 20 s. D. 40 s.
Câu 3: Khi nhiệt độ tăng thêm 10 ℃, tốc độ phản ứng hoá học tăng thêm 4 lần. Tốc độ phản ứng đó sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70 ℃ xuống 40 ℃?
A. 32 lần. B. 64 lần. C. 8 lần. D. 16 lần.
Câu 4: Khi nhiệt độ tăng thêm 10 ℃, tốc độ phản ứng hoá học tăng thêm 3 lần. Để tốc độ phản ứng
đó (đang tiến hành ở 30 ℃) tăng lên 81 lần thì cần thực hiện ở nhiệt độ nào?
A. 40 ℃. B. 50 ℃. C. 60 ℃. D. 70 ℃.
Câu 5: Khi tăng thêm 10 ℃, tốc độ một phản ứng hoá học tăng lên 2 lần. Tốc độ phản ứng sẽ thay đổi như thế nào khi tăng nhiệt độ của phản ứng đó từ 25 ℃ lên 75 ℃?
A. 5 lần. B. 10 lần. C. 16 lần. D. 32 lần.
Câu 6: Có phản ứng: A + B → C. Biết rằng nếu nồng độ ban đầu của chất A là 0,01 M, của chất B là 0,002Mthìsau 25phútlượngchấtC hình thànhlà 10% khốilượngcủa hỗnhợp.Nếu nồng độ chất
A vẫn như cũ, nồng độ chất B là 0,01 M thì sau bao lâu cũng thu được lượng chất C như trên?
A. 5 phút. B. 10 phút. C. 15 phút. D. 20 phút.
Câu 7: Cho 10 gam đá vôi ở dạng viên ở nhiệt độ phòng (25 ℃) vào cốc đựng 100 gam hydrochloric acid loãng và nhanh chóng cho lên một cân điện tử. Đọc giá trị khối lượng cốc tại thời điểm ban đầu và sau1phút.Lặplạithínghiệmkhinhiệt độ phònglà 35 ℃.Kếtquả thínghiệm được ghitrongbảng
sau:
Số thứ tự Nhiệt độ (℃) Khối lượng cốc Thời điểm đầu Sau 1 phút
1 25 235,40 235,13
2 35 235,78 235,21
Bảng 6.22. Sự biến đổi khối lượng dung dịch hỗn hợp của phản ứng theo thời gian
a. Hệ số nhiệt độ của phản ứng là:
A. 2,11. B. 2,14. C. 2,34. D. 2,21.
b. Giả sử ban đầu cốc chứa dungdịch HCl và đá vôi cókhốilượng 235,40gam. Thực hiện thínghiệm
ở 45 ℃. Sau 1 phút khối lượng cốc là (bỏ qua khối lượng nước bay hơi)
A. 220,34 gam. B. 234,20 gam. C. 238,2 gam. D. 225,20 gam.
Câu 8: Khi để ở nhiệt độ 30 ℃, một quả táo bị hư sau 3 ngày. Khi được bảo quản trong tủ lạnh ở nhiệt độ 0 ℃ quả táo đó bị hư sau 24 ngày.
Hình 6.26.a. Táo để ở ngoài Hình 6.26.b. Táo bảo quản trong tủ lạnh
a. Hệ số nhiệt độ của phản ứng xảy ra khi quả táo bị hư là:
A. 2. B. 4. C. 6. D. 8.
b. Nếu bảo quản ở 20 ℃, quả táo sẽ bị hư sau bao nhiêu ngày?
A. 3 ngày. B. 6 ngày. C. 9 ngày. D. 12 ngày.
Câu 9: Phản ứng phân huỷ ethyl iodide trong pha khí xảy ra như sau: C2H5I → C2H4 + HI
Dựa trên thông tin trong bảng, trả lời một số câu hỏi sau: Nhiệt độ Hằng số tốc độ phản ứng
127 ℃, 1,60.10-7 s-1
227 ℃, 4,25.10-4 s-1
B


ảng 6.23. Sự phụ thuộc hằng số tốc độ của phản ứng theo nhiệt độ
a. Hệ số nhiệt độ của phản ứng trên là
A. 1,2. B. 2,0. C. 2,2. D. 2,4.
b. Hằng số tốc độ của phản ứng trên ở nhiệt độ 167 ℃ là:
A. 3,75.10-6 B. 2,75.10-6 C. 3,75.10-4. D. 2,75.10-4
Câu 10: Thực tế cho thấy, càng lên cao áp suất càng giảm dẫn tới nhiệt độ sôi của các chất giảm. Ở
vùng đồng bằng (độ cao gần mực nước biển), nước sôi ở nhiệt độ 100 ℃. Trên đỉnh núi Fansipan (ở
độ cao 3200 mso với mực nước biển),nước sôi ở 90 ℃. Khi luộc chín một miếngthịt trong nước sôi,
ở vùng đồng bằng mất 3,2 phút, trong khi đó trên đỉnh núi Fansipan mất 3,8 phút.
a. Hệ số nhiệt độ của phản ứng làm chín miếng thịt trên là
A. 0,8421. B. 1,1875. C. 2,2875. D. 1,875.
b. Nếu luộc miếng thịt trên đỉnh núi cao hơn, tại đó nước sôi ở 80 ℃ thì thời gian cần dùng để luộc chín miếng thịt trên là
A. 4,0 phút. B. 4,5 phút. C. 6,0 phút. D. 6,5 phút.
Dạng 4: Các yếu tố ảnh hưởng tới tốc độ phản ứng
Câu 1: Chất làm tăng tốc độ phản ứng hoá học mà không bị biến đổi chất được gọi là
A. Chất xúc tác. B. Chất trung gian.
C. Chất sản phẩm. D. Chất tham gia.
Câu 2: Nhận định nào dưới đây là đúng?
A. Nồng độ chất phản ứng tăng thì tốc độ phản ứng tăng.
B. Nồng độ chất phản ứng giảm thì tốc độ phản ứng tăng.
C. Nồng độ chất phản ứng tăng thì tốc độ phản ứng giảm.
D. Sự thay đổi nồng độ chất phản ứng không ảnh hưởng tới tốc độ phản ứng.
Câu 3: Một phản ứng hoá học được biểu diễn như sau: Các chất phản ứng → Các sản phẩm. Yếu tố nào sau đây không ảnh hướng đến tốc độ phản ứng?
A. Chất xúc tác.
B. Nồng độ các chất phản ứng.
C. Nồng độ các sản phẩm.
D. Nhiệt độ
Câu 4: Sự thay đổi nào dưới đây không làm tăng tốc độ phản ứng xảy ra giữa dây magnesium và dung dịch hydrochloric acid?
A. Cuộn dải magnesium thành một quả bóng nhỏ
B. Nghiền mảnh magnesium thành bột.
C. Tăng nồng độ của hydrochloric acid.
D. Tăng nhiệt độ của hydrochloric acid.
Câu 5: Cho phản ứng hoá học: A(g) + B(g) → C(g) + D(g). Yếu tố nào không ảnh hưởng đến tốc độ phản ứng?



A. Nhiệt độ.
B. Nồng độ chất C và chất D.
C. Chất xúc tác. D. Áp suất.
Câu 6: Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
A. Nhiệt độ B. Chất xúc tác. C. Nồng độ D. Áp suất.
Câu 7: Phát biểu nào sau đây đúng?
A. Khi đốt củi, nếu thêm một ítdầuhỏa, lửa sẽ cháy mạnh hơn. Như vậy dầu hỏa là chấtxúc tác cho quá trình này.
B. Trong quá trình sản xuất rượu (ethanol) từ gạo người ta rắc men lên gạo đã nấu chín (cơm) trước khi đem ủ vì men là chất xúc tác có tác dụng làm tăng tốc độ phản ứng chuyển hóa tinh bột thành rượu.
C. Một chất xúc tác có thể xúc tác cho tất cả các phản ứng.
D. Có thể dùng chất xúc tác để làm giảm tốc độ của phản ứng.
Câu 8: Có hai cốc chứa dung dịch Na3SO3, trong đó cốc A có nồng độ lớn hơn cốc B. Thêm nhanh
cùng một lượng dung dịch H2SO4 cùng nồng độ vào hai cốc. Hiện tượng quan sát được trong thí
nghiệm trên là
A. Cốc A xuất hiện kết tủa, cốc B không thấy kết tủa.
B. Cốc A xuất hiện kết tủa nhanh hơn cốc B.
C. Cốc A xuất hiện kết tủa chậm hơn cốc B.
D. Cốc A và cốc B xuất hiện kết tủa với tốc độ như nhau.
Câu 9: Bảng 6. trình bày các thí nghiệm được thực hiện để nghiên cứu tốc độ phản ứng giữa zinc carbonate và nitric acid.

Thí nghiệm ZnCO3 HNO3
Khối lượng (g) Dạng Thể tích (mL) Nồng độ (M)
I 5 Viên 50 0,1
II 5 Bột 25 0,2
Bảng 6.24. Thí nghiệm ảnh hưởng của nồng độ và diện tích tiếp xúc bề mặt tới tốc độ phản
ứng
Đồ thị nào sau đây biểu diễn hai thí nghiệm trên?
Câu 10: Hai nhóm học sinh làm thí nghiệm nghiên cứu tốc độ phản ứng zinc với dung dịch hydrochloric acid
– Nhóm thứ nhất: Cân 1 gam zinc miếng và thả vào cốc đựng 200 ml dung dịch acid HCl 2M.
– Nhóm thứ hai: Cân 1 gam zinc bột và thả vào cốc đựng 300 ml dung dịch acid HCl 2M
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do
A. Nhóm thứ hai dùng acid nhiều hơn.
B. Diện tích bề mặt zinc bột lớn hơn zinc miếng.
C. Nồng độ zinc bột lớn hơn.
D. Cả ba nguyên nhân đều sai.
Câu 11: Cho phản ứng hoá học: 2KClO3(s) 2KCl(s) + 3O2(g). Yếu tố nào sau đây không ảnh hưởng tới tốc độ của phản ứng trên?
A. Nhiệt độ B. Chất xúc tác.
C. Áp suất. D. Kích thước tinh thể KClO3
Câu 12: Các enzyme là chất xúc tác, có chức năng
A. Giảm năng lượng hoạt hoá của phản ứng.
B. Tăng năng lượng hoạt hoá của phản ứng.
C. Tăng nhiệt độ của phản ứng.
D. Giảm nhiệt độ của phản ứng.
Câu 13: Thực hiện hai thínghiệm lấycùngmộtlượng CaCO3 với dung dịch HCl dư cónồng độ khác nhau. Thể tích khí CO2 thoát ra theo thời gian được ghi lại trên đồ thị sau
Hình 6.27. Đồ thị biểu diễn sự phụ thuộc thể tích khí CO2 theo nồng độ acid Phản ứng nào đã dùng nồng độ HCl cao hơn?
A. Phản ứng (1).
B. Phản ứng (2).
C. Nồng độ hydrochloric acid ở hai phản ứng là như nhau.
D. Không xác định được.
Câu 14: Thực hiện phản ứng: H2 + 2ICl I2 + 2HCl. Nồng độ ban đầu của H2 và ICl được lấy đúng theotỉ lệ hợpthức.Nghiêncứusự thay đổinồng độ cácchấtthamgia vàcácchấttạothànhtrongphản ứng theo thời gian, thu được đồ thị sau
Hình 6.29. Sự phụ thuộc nồng độ các chất theo thời gian
A. Đường cong (1). B. Đường cong (2).
C. Đường cong (3). D. Đường cong (2) hoặc (3).
Câu 16: Khi tăng áp suất của chất phản ứng, tốc độ phản ứng nào sau đây sẽ bị thay đổi?
A. 2Al(s) + Fe2O3 (s) → Al2O3 (s) + 2Fe(s).

B. CaCO3 (s) → CaO(s) + CO2(g).
C. CaCO3 (s) + 2HCl(aq) → CaCl2 (aq) + CO2 (g) + 2H2O(aq).

D. H2(g) + Cl2(g) → 2HCl(g).
Câu 17: Sản phẩm của phản ứng được tạo ra qua các bước theo hình bên dưới:
Hình 6.28. Sự thay đổi nồng độ các chất theo thời gian Chobiết đường(a), (b),(c) và (d) tương ứng với sự thay đổinồng độ các chất nào trong phương trình hoá học trên?
A. HCl, I2, ICl, H2.
B. HCl, I2, H2, ICl.

C. I2, HCl, H2, ICl. D. ICl, H2, HCl, I2.
Câu 15: Đồ thị dưới đây biểu diễn đường cong động học của phản ứng giữa oxygen và hydrogen tạo thành nước: 2H2(g) + O2(g) 2H2O(g). Đường cong nào của hydrogen?
Hình 6.30. Vai trò của chất X đối với việc tạo thành sản phẩm Vai trò của chất X là?
A. Chất xúc tác.
B. Làm tăng năng lượng hoạt hoá của chất tham gia phản ứng.
C. Làm giảm năng lượng hoạt hoá của chất tham gia phản ứng.
D. Làm tăng nồng độ của chất tham gia phản ứng.
Câu 18: Một bạn học sinh thực hiện hai thí nghiệm:
Thí nghiệm 1: Cho 100 mL dung dịch hydrochloric acid vào cốc (1), sau đó thêm vào cốc một mẩu

đá vôi và sau đó đo tốc độ thoát khí theo thời gian.
Thí nghiệm 2 (Lặp lại thí nghiệm tương tự thí nghiệm 1): Cho 100 mL dung dịch hydrochloric acid
khác vào cốc (2), sau đó thêm vào cốc một mẩu đá vôi và sau đó đo tốc độ thoát khí theo thời gian.
Bạn học sinh đó nhận thấy tốc độ thoát khí ở thí nghiệm 2 nhanh hơn tốc độ thoát khí ở thí nghiệm 1. Cho các yếu tố sau đây:
(1) Phản ứng ở cốc (2) nhanh nhờ có chất xúc tác.
(2) Lượng đá vôi ở cốc (2) nhiều hơn lượng đá vôi ở cốc (1).
(3) Lượng acid ở cốc (1) có nồng độ thấp hơn lượng acid ở cốc (2).
(4) Lượng đá vôi ở cốc (2) được nghiền nhỏ hơn lượng đá vôi ở cốc (1).
(5) Dung dịch acid ở cốc (1) được đun nóng hơn dung dịch acid ở cốc (2).
Những yếu tố nào sau đây có thể dùng để giải thích được hiện tượng mà bạn học sinh đó quan sát
được?
A. (1) và (5).
C. (2), (3) và (4).
B. (1), (2) và (3).
D. (2), (4) và (5).
Câu 19: Ở cùng một nồng độ, phản ứng nào dưới đây có tốc độ phản ứng xảy ra chậm nhất:
A. Al + dd NaOH ở 25 ℃.
C. Al + dd NaOH ở 40 ℃.
B. Al + dd NaOH ở 30 ℃.
D. Al + dd NaOH ở 50 ℃.
Câu 20: Khi cho cùng một lượng magnesium vào cốc đựng dung dịch acid HCl, tốc độ phản ứng sẽ lớn nhất khi dùng magnesium ở dạng

A. Viên nhỏ.
C. Lá mỏng.
B. Bột mịn, khuấy đều.
D. Thỏi lớn.
Câu 21: Lấy một chai nước ngọt có ga rót vào cốc thật nhẹ tay, sau đo từ từ cho đường cát trắng vào trong cốc. Hiện tượng xảy ra là
Hình 6.32. Sơ đồ sản xuất gang
Yếu tố nào đã được sử dụng để làm tăng tốc độ phản ứng?
A. Nhiệt độ, áp suất. B. Diện tích tiếp xúc.
C. Nồng độ D. Xúc tác.
Câu 25: Từ thế kỉ XIX, người ta nhận thấy rằng trong thành phần của khí lò cao (lò luyện gang) còn chứa khí CO. Nguyên nhân của hiện tượng này là
A. Lò xây chưa đủ độ cao.
B. Thời gian tiếp xúc của CO và Fe3O3 chưa đủ
C. Nhiệt độ chưa đủ cao.
D. Phản ứng giữa CO và iron oxide là thuận nghịch.
Câu 26: Cho 5 gam zinc viên vào cốc đựng 50 mL dung dịch H2SO4 4 M ở nhiệt độ thường (25 ℃).
Hình 6.31. Rót nước ngọt có gas vào cốc có đường
A. Nước ngọt sủi bọt li ti.
C. Nước ngọt mất bọt khí.
B. Nước ngọt sủi bọt rất nhiều và mạnh.
D. Xuất hiện kết tủa đen.
Câu 22: Khi đốt cháy ethylene, ngọn lửa có nhiệt độ cao nhất khi ethylene
A. Cháy trong không khí.
B. Cháy trong oxygen nguyên chất.
C. Cháy trong hỗn hợp khí oxygen và nitrogen.
D. Cháy trong hỗn hợp khí oxygen và khí carbonic.
Câu 23: Phản ứng phân huỷ hydrogen peroxide có xúc tác được biểu diễn:
2 H2O2 2 MnO,to → 2H2O + O2
Yếu tố không ảnh hưởng đến tốc độ phản ứng là
A. Nồng độ H2O2
C. Nhiệt độ.
B. Nồng độ của H2O.
D. Chất xúc tác MnO2.
Câu 24: Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang) theo sơ đồ
sau:
Trường hợp nào tốc độ phản ứng không đổi?
A. Thay 5 gam zinc viên bằng 5 gam zinc bột.
B. Thay dung dịch H2SO4 4 M bằng dung dịch H2SO4 2 M.
C. Thực hiện phản ứng ở 50 ℃.
D. Dùng dung dịch H2SO4 4 M gấp đôi.
Câu 27: Trong các cặp phản ứng sau, cặp nào có tốc độ phản ứng lớn nhất?
A. Fe + dd HCl 0,1 M. B. Fe + dd HCl 0,2 M.
C. Fe + dd HCl 20%, (d = 1,2 g/mL). D. Fe + dd HCl 0,3 M.
Câu 28: Trong phòng thí nghiệm, có thể điều chế khí oxygen từ muối potassium chlorate (KClO3).

Người ta sử dụng cách nào sau đây nhằm mục đích tăng tốc độ phản ứng?
A. Nung potassium chlorate ở nhiệt độ cao.
B. Nung hỗn hợp potassium chlorate và manganese dioxide ở nhiệt độ cao.
C. Dùng phương pháp dời nước để thu khí oxygen.
D. Dùng phương pháp dời không khí để thu khí oxygen.
Câu 29: Cho các phát biểu sau:
(1) Để phản ứng hoá học xảy ra, các hạt (phân tử, nguyên tử, ion) của chất phản ứng phải va chạm với nhau.
(2) Khi tăng áp suất khí CO thì tốc độ phản ứng: CO(g) + FeO(s) Fe(s) + CO2(g) tăng lên.
(3) Khi nhiệt độ tăng lên 10 ℃ thì tốc độ của các phản ứng hoá học đều tăng lên gấp đôi.
(4) Nếu năng lượng va chạm giữa hai phân tử chất phản ứng nhỏ hơn năng lượng hoạt hoá thì sẽ gây
ra phản ứng hoá học.
(5) Phản ứng có năng lượng hoạt hoá càng thấp thì xảy ra càng nhanh.
Chọn các phát biểu sai:
A. (1), (3) và (4). B. (1), (2) và (3). C. (2), (3) và (4). D. (3) và (4).

Câu 30: Chọn phát biểu sai?
(1) Nhiên liệu cháy ở tầng khí quyển trên cao nhanh hơn khi cháy ở mặt đất.
(2) Nước giải khát được nén CO2 vào ở áp suất cao hơn sẽ có độ chua (độ acid) lớn hơn.
(3) Thực phẩm được bảo quản ở nhiệt độ thấp hơn sẽ giữ được lâu hơn.
(4) Thực phẩm nấu trong nồi áp suất là để giữ được mùi thơm của thức ăn do nồi rất kín.
(5) Nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanh ke (trong sản xuất xi măng), là yếu tố ảnh hưởng của chất xúc tác đến tốc độ phản ứng.
A. 1, 2, 4. B. 1, 2, 3. C. 2, 3, 5. D. 1, 4, 5.
Câu 31: Khi diện tích bề mặt tăng, tốc độ phản ứng tăng với phản ứng có chất nào tham gia?
A. Chất lỏng.
C. Chất rắn.
B. Chất khí.
D. Cả A, B, C đều đúng.
Câu 32: Trường hợp nào sau đây có yếu tố làm giảm tốc độ phản ứng?
A. Đưa sulfur đang cháy ngoài không khí vào bình chứa oxygen.
B. Quạt bếp than đang cháy.
C. Thay hạt aluminum bằng bột aluminum để cho tác dụng với dung dịch HCl.
D. Dùng dung dịch loãng các chất tham gia phản ứng.
Câu 33: Khi ninh (hầm) thịt cá, để thịt cá nhanh chín có thể
A. Dùng nồi áp suất. B. Chặt nhỏ thịt cá.
C. Cho thêm muối vào.
Câu 34: Thực hiện thí nghiệm sau:
(1) Zn (hạt) + 3 mL dd HCl 20%.
(3) Zn (hạt) + 3 mL dd HCl 12%.
Phản ứng nào xảy ra nhanh nhất?
A. 1. B. 2.
Câu 35: Thực hiện 2 thí nghiệm theo hình vẽ sau.
D. Cả 3 đều đúng.
(2) Zn (hạt) + 3 mL dd HCl 10%.
(4) Zn (hạt) + 3 mL dd HCl 23%.
C. 4.
D. 3.
Câu 36: Cho 2 mẫu BaSO3 có khối lượng bằng nhau và 2 cốc chứa 50ml dung dịch HCl 0,1 M như hình sau. Hỏi ở cốc nào mẫu BaSO3 tan nhanh hơn?
dung dịch HCl 0,1M BaSO3 dạng bột BaSO3 dạng khối ............ ...... ...... ......
Cốc 1Cốc 2
Hình 6.34. Ảnh hưởng của diện tích tiếp xúc bề mặt tới tốc độ phản ứng
A. Cốc 1 tan nhanh hơn.
B. Cốc 2 tan nhanh hơn.
C. Tốc độ tan ở 2 cốc như nhau.
D. BaSO3 tan nhanh nên không quan sát được.
Câu 37: Trong các câu sau, câu nào sai?
A. Nhiên liệu cháy ở tầng khí quyển trên cao nhanh hơn khi cháy ở mặt đất.
B. Nước giải khát được nén CO2 và ở áp suất cao hơn sẽ có độ chua (độ acid) lớn hơn.
C. Thực phẩm được bảo đảm ở nhiệt độ thấp hơn sẽ giữ được lâu hơn.
D. Thực phẩm nấu trong nồi áp suất là để có nhiệt độ cao hơn 100 ℃
Câu 38: Cho một viên đá vôi nặng 1 gam vào dungdịch HCl 2 M, ở nhiệt độ 25 ℃. Biến đổi nào sau
đây không làm bọt khí thoát ra mạnh hơn?
A. Tăng thể tích dung dịch HCl lên gấp đôi.
B. Thay viên đá vôi bằng 1 gam bột đá vôi.
C. Thay dung dịch HCl 2 M bằng dung dịch HCl 4 M.
D. Tăng nhiệt độ lên 50 ℃.
Câu 39: Trong thực tế, phản ứng nào dưới đây cần làm tốc độ chậm lại hoặc dừng hẳn?
A. Tổng hợp NH3 từ H2 và N2: N2 (g) + 3H2 (g) 2NH3 (g)
B. Thép bị ăn mòn bởi oxi không khí và môi trường: 4Fe + 3O2 + 2H2O → 4FeO(OH)
C. Phản ứng oxi hoá NH3 có xúc tác, thành NO (từ đó điều chế HNO3): 4NH3 + 5O2 → 4NO + 6H2O
D. Tổng hợp HCl từ H2 và Cl2: H2 + Cl2 → 2HCl.
Câu 40: Cho lần lượt 100 gam đá vôi (CaCO3) phản ứng với dung dịch HCl 2 M dư. Đá vôi được dùng ở dạng hạt kích cỡ được kí hiệu như sau
Hình 6.33. Sự phụ thuộc tốc độ phản ứng vào nồng độ
Ở thí nghiệm nào có kết tủa xuất hiện trước?
A. TN1 có kết tủa xuất hiện trước. B. TN2 có kết tủa xuất hiện trước.
C. Kết tủa xuất hiện đồng thời. D. Không có kết tủa xuất hiện.
Hình 6.35. Ảnh hưởng của diện tích tiếp xúc bề mặt tới tốc độ phản ứng Phản ứng nào xảy ra chậm nhất?
A. 3. B. 1. C. 2. D. 4.
Câu 41: Người ta đã sử dụng nhiệt độ của phản ứng đốt cháy than đá để nung vôi, biện pháp kỹ thuật nào sau đây không được sử dụng để tăng tốc độ phản ứng nung vôi?
Hình 6.36. Nguyên tắc hoạt động của lò nung vôi
A. Đập nhỏ đá vôi với kích thước khoảng 10 cm.
B. Tăng nhiệt độ phản ứng lên khoảng 900 ℃.
C. Tăng nồng độ khí carbon dioxide.

D. Thổi không khí nén vào lò nung vôi
Câu 42: Ngườitanungvôitheophản ứng:CaCO3(s) →CaO(s)+CO2(g). Để làmchovôichóngchín, công nhân tiến hành theo các thao tác là
A. Bít cửa lò dưới, thông cửa lò trên. B. Thông cửa lò dưới, thông cửa lò trên.
C. Thông của lò dưới, bít của lò trên. D. Bít cả hải cửa lò trên và dưới.
Câu 43: Khi tiến hành các thí nghiệm.
a. Zn (hạt) + 3mL dung dịch H2SO4 15%.
b. Zn (hạt) + 3mL dung dịch H2SO4 15% (đun nóng).
c. Zn (bột) + 3mL dung dịch H2SO4 15% (đun nóng).
d. Zn (hạt) + 3mL dung dịch H2SO4 10%.
Tốc độ phản ứng giảm dần theo thứ tự nào:
A. a > c > b > d. B. b > a > c > d.
C. c > b > a > d. D. d > a > b > c.
Câu 44: Cho ba mẫu đá vôi (100% CaCO3) có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ,mẫu 3dạng bộtmịnvàobacốc đựngcùng thể tíchdungdịchHCl (dư,cùngnồng độ, ở điềukiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
A. 321 ttt << .
C. 123 ttt == .
B. 123 ttt << .
D. 213 ttt << .
Câu 45: Thí nghiệm nghiên cứu tốc độ phản ứng zinc với dung dịch hydrochloric acid của hai nhóm học sinh được mô tả bằng hình sau
200 ml dung dịch HCl 2M
1 gam Zn miếng
Hình 6.37.a. Thí nghiệm nhóm thứ nhất
................................ ................ ........
300 ml dung dịch HCl 2M
1 gam Zn bột
Hình 6.37.b. Thí nghiệm nhóm thứ hai
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do :
A. Nhóm thứ hai dùng acid nhiều hơn.
B. Diện tích bề mặt zinc bột lớn hơn zinc miếng.
C. Nồng độ zinc bột lớn hơn.
D. Áp suất tiến hành thí nghiệm nhóm thứ hai cao hơn nhóm thứ nhất..
Câu 46: Có ba cốc chứa dung dịch H2O2 có cùng nồng độ. Tiến hành ba thí nghiệm như hình vẽ sau. bột MnO 2
dung dịch H2O2
Cốc 1 Cốc 2Cốc 3 ..............
Hình 6.38. Một số yếu tố ảnh hưởng tới tốc độ phản ứng
Ở thí nghiệm nào có bọt khí thoát ra chậm nhất?
A. Thí nghiệm 1. B. Thí nghiệm 2.
C. Thí nghiệm 3. D. 3 thí nghiệm như nhau.
Câu 47: Cho iron (hạt) phản ứng với dung dịch hydrochloric 1 M dư. Thay đổi các yếu tố sau:
(1) Thêm vào hệ một lượng nhỏ tinh thể CuSO4.
(2) Thêm dung dịch HCl 1 M lên thể tích gấp đôi.
(3) Nghiền nhỏ hạt iron thành bột iron.
(4) Pha loãng dung dịch HCl bằng nước cất lên thể tích gấp đôi.
Có bao nhiêu cách thay đổi tốc độ phản ứng?
N ỨNG
A. CÂU HỎI TỰ LUẬN Câu1: Hoànthànhcácnội dungsau:
- Tốc độ phản ứng hóa học dùng để đánh giá ...(1)................................... xảy ra nhanh hay chậm của phản ứng.
- Tốc độ phản ứng được xác định bằng ...(2)................................... lượng chất đầu hoặc chất sản phẩm trong một đơn vị ...(3)...................................: giây (s), phút (min), giờ (h), ngày (d),... Lượng chất có thể được ...(4)................................... bằng số mol, nồng độ mol, khối lượng, hoặc thể tích. Ta có công thức tính tốc độ phản ứng: ...(5)...................................; 21 21
CCC ttt ∆=− ∆=− - Theo thời gian, nồng độ các chất phản ứng và sản phẩm thay đổi nên tốc độ phản ứng sẽ thay đổi, vì vậy người ta thường tính ...(6)............................................. của phản ứng. Ngoài ra còn có ...(7)........................................ của phản ứng, là tốc độ phản ứng tại một thời điểm nào đó.
- Đối với phản ứng: aAbBdDeE +→+ , ta có biểu thức tính tốc độ phản ứng trung bình: ...(8)............................................................................................
- Các phản ứng diễn ra với ...(9)................................... tùy thuộc vào nhiều yếu tố: nồng độ, nhiệt độ, áp suất (đối với chất tham gia là chất khí), bề mặt tiếp xúc, chất xúc tác, cường độ ánh sáng, thể của chất, dung môi hòa tan của chất phản ứng,...
- Sự thay đổi nồng độ các chất ...(10)................................... sẽ ảnh hưởng đến tốc độ phản ứng. Nồng độ của các chất phản ứng tăng làm số lần ...(11)................................... tăng nên tốc độ phản ứng tăng.
- Ở nhiệt độ không đổi, tốc độ phản ứng ...(12)................................... với tích số nồng độ các chất phản ứng với số mũ thích hợp. Đối với phản ứng đơn giản (phản ứng chỉ xảy ra qua một giai đoạn), số mũ là hệ số của chất tham gia trong phương trình hoá học. Áp dụng ta có biểu thức tính tốc độ phản ứng 22 2CO(g)O(g)2CO(g) +→ là
...(13)................................... , k là hằng số cân bằng, chỉ phụ thuộc vào nhiệt độ
- Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số ...(14)................................... giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
- Thực nghiệm cho thấy khi tăng nhiệt đỏ lèn 10 °C thì tốc độ phản ứng thường tăng từ 2 đến 4 lần.
- Gọi 12 ttv,v là tốc độ phản ứng tại nhiệt độ 12t,t , khi đó ta có biểu thức:
..(15)...................................
- Trong biểu thức trên, γ được gọi là hệ số nhiệt độ Van’t Hoff (Van-Hốp). Giá trị γ ...(16)................................... thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng mạnh.
- Trong hỗn hợp khí, nồng độ mỗi khí ...(17)................................... với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khí tăng lên. Việc tăng áp suất hỗn hợp khí cũng tương tự như tăng nồng độ, sẽ làm tốc độ phản ứng ...(18)....................................
- Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số ...(19)................................... cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
- Chất xúc tác làm ...(20)................................... của phản ứng hóa học, nhưng vẫn được bảo toàn về lượng và chất khi kết thúc phản ứng.
Câu2: Điềnthôngtincònthiếuvà đánhdấu ٧ (có, đúng) vàoôtrốngthích hợptrongbảngsau: Bảng1
STT Hoạt động/Thaotácthí nghiệm Yếutố ảnhhưởng đến tốc độ phản
1 Đun nóng chất tham gia phản ứng
2 Thổi không khí nén vào lò luyện gang.
3 Pha loãng dung dịch
4 Ngưng dùng enzyme.
5 Trong phản ứng với dung dịch HCl, thay đinh Fe bằng bột sắt
6 Sử dụng nồi áp suất để hầm thức ăn.
7 Để thực phẩm trong tủ lạnh
8 Trong phản ứng với Zn, thay dung dịch HCl 1M bằng dung dịch HCl 2M.
9 Thêm V2O5 vào phản ứng giữa SO2 và O2
11 Duy trì thổi không khí vào bếp than để than cháy đều.
12 Than đá được nghiền nhỏ dùng trong quá trình luyện kim loại.
Bảng2
STT PHƯƠNGTRÌNHHÓAHỌC YẾUTỐ ẢNH HƯỞNG ĐẾN TỐC ĐỘ PHẢN ỨNG Nhiệt độ Nồng độ Áp suất Diện tích bề
1 +→+ 34 2 FeO(s)4CO(g)3Fe(s)4CO(g)
2 +→23 CaO(s)SiO(s)CaSiO(s)
3 +→+ 3252325 CHCOOCH(l)HO(l)CHCOOH(l)CHOH(l)
4 +→++ 3222 CaCO(s)2HCl(l)CaCl(l)HO(l)CO(g)
5 +→+ 22 2KI(aq)HO(aq)I(s)2KOH(aq)
6 +→ 2 2Cu(s)O(g)2CuO(s)
7 +→22 H(g)Br(g)2HBr(g)
8 223 3H(g)N(g)2NH(g) +→
9 2 2 HO(g)C(s)CO(g)H(g) +→+
10 32 CaCO(s)CaO(s)CO(g) →+
11 +→ 2223 SO(g)HO(l)HSO(aq)
12
2232 2NaOH(aq)CO(g)NaCO(aq)HO(l) +→+
13 44 Fe(s)CuSO(aq)FeSO(aq)Cu(s) +→+
14
32 2Al(s)6HCl(aq)2AlCl(aq)3H(g) +→+
15 33 33 Fe(NO)(aq)3NaOH(aq)Fe(OH)(g)3NaNO(aq) +→+
Câu3: Cho a gam kim loại Zn dạng hạt vào lượng dư dung dịch HCl 2M, phương trình hóa học xảy ra như sau:
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Tốc độ khí H2 thoát ra như thế nào khi thay đổi các yếu tố dưới đây:
a. Thay a gam Zn hạt bằng a gam bột Zn.
b. Thay dung dịch HCl 2M bằng dung dịch HCl 1M.
c. Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl.
Câu4: Tốc độ phản ứng sau chịu ảnh hưởng của yếu tố nào?
a. Than củi đang cháy, dùng quạt thổi thêm không khí vào, sự cháy diễn ra mạnh hơn.
b. Phản ứng oxi hóa SO2 thành SO3 diễn ra nhanh hơn khi có mặt xúc tác V2O5
c. Aluminium dạng bột phản ứng với dung dịch hydrochloric acid nhanh hơn so với aluminium dạng lá.
d. Để thực phẩm trong tủ lạnh giúp cho thực phẩm được tươi lâu hơn.
e. Sử dụng nồi áp suất để hầm thức ăn giúp thức ăn nhanh chín.
g. Sử dụng các loại men thích hợp để làm sữa chua, lên men rượu, giấm,...
Câu5: Cho các phản ứng hóa học sau:
(a) Fe3O4 (s) + 4CO (g) → 3Fe (s) + 4CO2 (g)


(b) 2NO2 (g) → N2O4(g)
(c) H2(g) + Cl2 (g) → 2HCl(g)
(d) CaO(s) + SiO2 (s) → CaSiO3 (s)
(e) CaO (s) + CO2 (g) → CaCO3 (s)
(g) 2KI (aq) + H2O (aq) → I2 (s) + 2KOH (aq)
(h) N2(g) + 3H2(g) → 2NH3(g)
(k) CO2(g) + Ca(OH)2(aq) → CaCO3(s) + H2O (l)
(l) SiO2 (s) + CaO (s) → CaSiO3 (s)
(m) BaCl2 (aq) + H2SO4 (aq) → BaSO4 (s) + 2HCl(aq)
Áp suất ảnh hưởng đến tốc độ của những phản ứng nào?
Câu6: Cho các phản ứng hóa học sau:
(a) CH3COOC2H5 (l) + H2O (l) → CH3COOH (l) + C2H5OH (l)
(b) Zn (s) + H2SO4 (aq) → ZnSO4 (aq) + H2(g)

(c) H2C2O4 (aq) + 2KMnO4 (aq) + 8H2SO4 (aq) → 10CO2(g) + 2MnSO4 (aq) + 8H2O (l)
Tốc độ các phản ứng trên sẽ thay đổi thế nào nếu ta thêm nước vào bình phản ứng?
Câu7: Phản ứng tạo NO từ NH3 là một giai đoạn trung gian trong quá trình sản xuất nitric acid:
4NH3 (g) + 5O2 (g) → 4NO (g) + 6H2O (g)
Hãy nêu một số cách để tăng tốc độ phản ứng này.
Câu8: Sục khí CO2 vào bình chứa dung dịch Na2CO3.
a. Tốc độ hấp thụ khí CO2 sẽ thay đổi như thế nào nếu thêm các chất sau đây vào dung dịch:
(1) HCl; (2 NaCl; (3) H2O; (4) K2CO3.
b. Nếu tăng áp suất, tốc độ phản ứng thay đổi như thế nào?
Câu9: Cho các phản ứng hóa học sau:
(1) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl

(2) 3Fe + 2O2 → Fe3O4
(3) 4K + O2 → 2K2O
(4) CH3COOH + C2H5OH → CH3COOC2H5 + H2O
Ở điều kiện thường, phản ứng nào xảy ra nhanh, phản ứng nào xảy ra chậm?
Câu10: Hình ảnh bên minh hoạ ảnh hưởng của yếu tố
nào tới tốc độ phản ứng? Giải thích?
4
Câu11: Xét phản ứng: H2 + Cl2 → 2HCl. Nghiên cứu sự thay đổi nồng độ một chất trong phản ứng theo thời gian, thu được đồ thị sau:
a. Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?
b. Nêu đơn vị của tốc độ phản ứng trong trường hợp này.
Câu12: Thực hiện hai phản ứng phân hủy H2O2: một phản ứng có xúc tác MnO2, một phản ứng không xúc tác. Đo thể tích khí oxygen theo thời gian và biểu diễn trên đồ thị như hình bên: Đường phản ứng nào trên đồ thị dưới đây tương ứng với phản ứng có xúc tác, với phản ứng không có xúc tác?
Câu 13: Có hai miếng iron có kích thước giống hệt nhau, một miếng là khối iron đặc (A), một miếng có nhiều lỗ nhỏ li ti bên trong và trên bề mặt (B). Thả hai miếng iron vào hai cốc đựng dung dịch HCl cùng thể tích và nồng độ, theo dõi thể tích khí hydrogen thoát ra theo thời gian. Vẽ đồ thị thể tích khí theo thời gian, thu được hai đồ thị sau:
Cho biết đồ thị nào mô tả tốc độ thoát khí từ miếng sắt A, miếng sắt B. Giải thích.
Câu14: Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn (a), khi nấu một số loại thực phẩm bằng nồi áp suất sẽ nhanh chín hơn (b), bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình khí oxygen so với từ không khí (c),...
B.HỆ THỐNGCÂUHỎITRẮCNGHIỆM
● Cấp độ nhận biết, thông hiểu, vận dụng
Câu1: Để xác định mức độ phản ứng xảy ra nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
A. Tốc độ phản ứng.
B. Cân bằng hoá học.
C. Phản ứng một chiều. D. Phản ứng thuận nghịch.
Câu2: Sự biến thiên nồng độ của chất tham gia hoặc chất tạo thành trong phản ứng được kí hiệu là
A. H∆ . B. G∆ . C. S∆ . D. C∆ .
Câu3: Trong phản ứng hóa học, sự biến thiên về thời gian diễn ra phản ứng được kí hiệu là
Những yếu tố nào ảnh hưởng đến tốc độ của các quá trình biến đổi trên?
Câu15: Yếu tố nào đã được áp dụng để làm thay đổi tốc độ của các phản ứng trong hình dưới đây?
A. r∆ B. t∆ C. g∆ D. h∆
Câu4: Tốc độ của phản ứng được kí hiệu là
A. v. B. s. C. t. D. r.
Câu5: Tốc độ trung bình của phản ứng được kí hiệu là
A. s B. v C. r D. t
Câu6: Tốc độ phản ứng là:
A. Độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
B. Độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
Câu16: Hai nhân vật được minh họa trong hình bên đang chế biến món gà rán, được thực hiện bằng hai cách.
C. Độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
D. Độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
Câu7: Cho phản ứng: X → Y
Tại thời điểm t1 nồng độ của chất X bằng C1, tại thời điểm t2 (với t2 > t1) nồng độ của chất X bằng C2. Tốc độ trung
bình của phản ứng trong khoảng thời gian trên được tính theo biểu thức nào sau đây?
Một người chọn cách chia ra từng phần nhỏ, người còn lại chọn cách để nguyên, giả thiết các điều kiện đều giống nhau (nhiệt độ, lượng dầu ăn,...). Hãy cho biết cách nào món ăn nhanh chín hơn? Giải thích.
Câu17: Hệ thống phun nhiên liệu điện tử (Electronic Fuel Injection-EFI) được sử dụng trong động cơ ô tô, xe máy giúp tiết kiệm nhiên liệu, xe vận hành êm và giảm ô nhiễm môi trường. Hệ thống sử dụng bộ điều khiển điện tử để can thiệp vào bước phun nhiên liệu vào buồng đốt, nhiên liệu được phun giọt cực nhỏ (1); hệ thống điều chỉnh chính xác tỉ lệ nhiên liệu – không khí trước khi phun vào buông đốt, một cách đồng đều, nhiên liệu được đốt cháy hoàn toàn (2). Khi phương tiện thay đổi vận tốc (tăng hoặc giảm), hệ thống sẽ nhanh chóng thay đổi lượng nhiên

liệu – không khí phù hợp để phun vào buồng đốt (3) nên tiết kiệm được nhiên liệu và giảm lượng khí thải gây ô nhiễm môi trường. Các ý (1), (2), (3) vận dụng yếu tố chính nào ảnh hưởng đến tốc độ phản ứng?

Câu 18: Năm 1785, một vụ nổ xảy ra tại một nhà kho nhà Giacomelli (Roma, Italia) làm nghề nghiền bột mì. Sau khi điều tra, nguyên nhân ban đầu dẫn đến vụ nổ là do bột mì khô. Sự cố xảy ra khi bột mì bay trong không khí, chạm tới nguồn lửa của chiếc đèn, đây là vụ nổ đầu tiên trong lịch sử. Sau đó là các vụ nổ bụi trong hầm than, xưởng sản xuất sữa bột, dược phẩm, nhựa, kim loại,... có tác nhân tương tự gồm: nguồn oxygen, nguồn nhiệt, bụi có thể cháy được, nồng độ bụi để đạt được vụ nổ và không gian đủ kín.
Thí nghiệm như hình trên cho thấy, bột mì không dễ cháy. Tại sao bột mì và một số loại bụi khác có thể gây ra nổ bụi? Để ngăn ngừa và hạn chế nổ bụi, có thể can thiệp vào những tác nhân nào?
A. 12 12
CC v tt =
CC v tt =−
C. 12 21
Câu8: Cho phản ứng: X → Y
CC v tt =−
B. 21 21
CC v tt =
D. 21 21
Tại thời điểm t1 nồng độ của chất Y bằng C1, tại thời điểm t2 (với t2 > t1) nồng độ của chất Y bằng C2. Tốc độ trung
bình của phản ứng trong khoảng thời gian trên được tính theo biểu thức nào sau đây?
A. 12 21
CC v tt = . B. 21 21
CC v tt =− .
C. 12 12
CC v tt =− . D. 21 21
CC v tt = .
Câu 9: Cho phản ứng xảy ra trong pha khí như sau: H2 + Cl2 → 2HCl. Biểu thức tốc độ trung bình của phản ứng là
A. 22 HCl HCl CC C v. ttt ∆∆ ∆ ===
C. 22 HCl HCl CC C v. ttt −∆−∆ ∆ === ∆∆∆
B. 22 HCl HCl CC C v. ttt ∆∆ −∆ ===

D. 22 HCl HCl CC C v. tt2t −∆−∆ ∆ ===
Câu 10: Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O2(g) → 2NO2(g). Viết biểu thức tốc độ tức thời của phản ứng:
A. Công thức tính tốc độ tức thời của phản ứng là: 2NOO vk.C.C. =
B. Công thức tính tốc độ tức thời của phản ứng là: 2NOO v2k.C.C. =
C. Công thức tính tốc độ tức thời của phản ứng là: 2
2 NOO vk.C.C. =
D. Công thức tính tốc độ tức thời của phản ứng là: 2
2 NOO vk.C.C. =

Câu11: Có phương trình phản ứng: +→ 2X(g)Y(g)Z(g) . Tốc độ phản ứng tại một thời điểm được tính bằng
biểu thức: v = k[X]2.[Y]. Hằng số tốc độ k phụ thuộc vào yếu tố nào sau đây?



A. Nồng độ của chất ban đầu.
C. Nhiệt độ của phản ứng.
B. Nồng độ của chất sản phẩm.
D. Thời gian xảy ra phản ứng.
Câu12: Thực nghiệm cho biết tốc độ phản ứng A2 + B2 → 2AB được tính theo biểu thức:
v = k.[A2][B2].
Trong các điều khẳng định dưới đây, khẳng định nào phù hợp với biểu thức trên?
A. Tốc độ phản ứng hoá học được đo bằng sự biến đổi nồng độ các chất phản ứng trong một đơn vị thời gian.
B. Tốc độ phản ứng tỉ lệ thuận với tích số nồng độ các chất phản ứng.
C. Tốc độ phản ứng giảm theo tiến trình phản ứng.
D. Tốc độ phản ứng tăng lên khi có mặt chất xúc tác.
Câu13: Cho phương trình hóa học:
2KMnO4(aq) + 10FeSO4(aq) + 8H2SO4(aq) → 5Fe2(SO4)3 (aq) + K2SO4(aq) + 2MnSO4 (aq) + 8H2O(l)
Với cùng một lượng các chất tham gia phản ứng, chất phản ứng hết nhanh nhất có phân tử khối là
A. 158. B. 152. C. 98. D. 174.
Câu14: Đối với phản ứng: X +3Y → 2Z, phát biểu nào sau đây sai?
A. Tốc độ tiêu hao chất Y bằng 3/2 tốc độ tạo thành chất Z.
B. Tốc độ tiêu hao chất X bằng 1/2 tốc độ tạo thành chất Z.
C. Tốc độ tiêu hao chất Y bằng 3 tốc độ tạo thành chất Z.
D. Tốc độ tiêu hao chất X bằng 1/3 tốc độ tạo thành chất Y.
Câu15: Đồ thị biểu diễn đường cong động học của phản ứng O2(g) + 2H2(g) → 2H2O(g) như sau:
Câu17: Đồ thị dưới đ
Đường cong nào của hydrogen?
A. Đường cong số (1).
B. Đường cong số (2).
C. Đường cong số (3).
D. Đường cong số (2) hoặc (3) đều đúng.
Câu16: Đồ thị dưới đây biểu diễn sự phụ thuộc của tốc độ phản ứng vào nhiệt độ
Từ đồ thị trên, ta thấy tốc độ phản ứng
A. Giảm khi nồng độ của chất phản ứng tăng.
B. Không phụ thuộc vào nồng độ của chất phản ứng.
C. Tỉ lệ thuận với nồng độ của chất phản ứng.
D. Tỉ lệ nghịch với nồng độ của chất phản ứng.
Câu18: Phát biểu nào sau đây đúng? Tốc độ của một phản ứng hóa học
A. chỉ phụ thuộc vào nồng độ các chất tham gia phản ứng.
B. tăng khi nhiệt độ phản ứng tăng.
C. càng nhanh khi giá trị năng lượng hoạt hóa càng lớn.
D. không phụ thuộc vào diện tích bề mặt.
Câu19: Cho phản ứng hóa học xảy ra trong pha khí như sau: N2 + 3H2 → 2NH3. Phát biểu nào sau đây sai khi tăng nhiệt độ của phản ứng?
A. Tốc độ chuyển động của phân tử chất đầu (N2, H2) tăng lên.
B. Tốc độ va chạm giữa phân tử N2 và H2 tăng lên.
C. Số va chạm hiệu quả tăng lên.
D. Tốc độ chuyển động của phân tử chất sản phẩm (NH3) giảm.
Câu20: Khi tăng nồng độ chất tham gia, thì
A. tốc độ phản ứng tăng.
B. tốc độ phản ứng giảm.
C. không ảnh hưởng đến tốc độ phản ứng.
D. có thể tăng hoặc giảm tốc độ phản ứng.
Câu21: Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng:
A. Nhiệt độ chất phản ứng.
B. Thể vật lí của chất phản ứng (rắn, lỏng, kích thước lớn, nhỏ,...).
C. Nồng độ chất phản ứng.
D. Tỉ trọng chất phản ứng.
Câu22: Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do
A. Nồng độ của các chất khí tăng lên.
B. Nồng độ của các chất khí giảm xuống.
C. Chuyển động của các chất khí tăng lên.
D. Nồng độ của các chất khí không thay đổi.
Câu 23: Khi cho cùng một lượng dung dịch axit sunfuric vào hai cốc đựng cùng một thể tích dung dịch Na2S2O3 với nồng độ khác nhau, ở cốc đựng dung dịch Na2S2O3 có nồng độ lớn hơn thấy kết tủa xuất hiện trước.
Từ đồ thị trên, ta thấy tốc độ phản ứng:
A. Giảm khi nhiệt độ của phản ứng tăng.
B. Không phụ thuộc vào nhiệt độ của phản ứng.
C. Tỉ lệ thuận với nhiệt độ của phản ứng.
D. Tỉ lệ nghịch với nhiệt độ của phản ứng.
Điều đó chứng tỏ ở cùng điều kiện về nhiệt độ, tốc độ phản ứng:
A. Không phụ thuộc vào nồng độ của chất phản ứng.
B. Tỉ lệ thuận với nồng độ của chất phản ứng.
C. Tỉ lệ nghịch với nồng độ của chất phản ứng.
D. Không thay đổi khi thay đổi nồng độ của chất phản ứng.
Câu24: Phát biểu nào sau đây là đúng về xúc tác?
A. Xúc tác giúp làm tăng năng lượng hoạt hóa của phản ứng.
B. Khối lượng xúc tác không thay đổi sau phản ứng.
C. Xúc tác không tương tác với các chất trong quá trình phản ứng.
D. Xúc tác kết hợp với sản phẩm phản ứng tạo thành hợp chất bền.
Câu25: Cho phản ứng thủy phân tinh bột có xúc tác là HCl. Phát biểu nào sau đây không đúng?
A. HCl không tác dụng với tinh bột trong quá trình phản ứng.
B. Nếu nồng độ HCl tăng, tốc độ phản ứng tăng.
C. Khi không có HCl, phản ứng thủy phân tinh bột vẫn xảy ra nhưng tốc độ chậm.
D. Nồng độ HCl không đổi sau phản ứng.
Câu26: Các enzyme là chất xúc tác, có chức năng:
A. Giảm năng lượng hoạt hóa của phản ứng.
B. Tăng năng lượng hoạt hóa của phản ứng.
C. Tăng nhiệt độ của phản ứng.
D. Giảm nhiệt độ của phản ứng.
Câu27: Yếu tố nào sau đây làm giảm tốc độ phản ứng
A. Sử dụng enzyme cho phản ứng.
B. Thêm chất ức chế vào hỗn hợp tham gia.
C. Tăng nồng độ chất tham gia.
D. Nghiền chất tham gia dạng khối thành bột.
Câu28: Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây?
A. Thời gian xảy ra phản ứng.
B. Bề mặt tiếp xúc giữa các chất phản ứng.
C. Nồng độ các chất tham gia phản ứng.
D. Chất xúc tác.
Câu 29: Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào đã được sử dụng để làm tăng tốc độ phản ứng ?
A. Nhiệt độ, áp suất.
C. Nồng độ
B. diện tích tiếp xúc.
D. xúc tác.
Câu30: Khi đốt cháy acetylene (axetilen), nhiệt lượng giải phóng ra lớn nhất khi acetylene
A. cháy trong không khí.
B. cháy trong khí oxi nguyên chất.
C. cháy trong hỗn hợp khí oxi và khí nitơ
D. cháy trong hỗn hợp khí oxi và khí cacbonic.
Câu31: Cho bột Fe vào dung dịch HCl loãng và đun nóng hỗn hợp này. Phát biểu sau đây không đúng?
A. Khí H2 thoát ra nhanh hơn.
B. Bột Fe tan nhanh hơn.
C. Lượng muối thu được nhiều hơn.
D. Nồng độ HCl giảm nhanh hơn.
Câu32: Cho phản ứng hóa học sau: Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g) Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
A. Diện tích bề mặt Zn.
B. Nồng độ dung dịch sulfuric acid.
C. Thể tích dung dịch sulfuric acid.
D. Nhiêt độ của dung dịch sulfuric acid.
Câu33: So sánh tốc độ của 2 phản ứng sau (thực hiện ở cùng nhiệt độ, khối lượng Zn sử dụng là như nhau):
Zn (bột) + dung dịch CuSO4 1M (1)
Zn (hạt) + dung dịch CuSO4 1M (2)
Kết quả thu được là:
A. (1) nhanh hơn (2).
B. (2) nhanh hơn (1).
C. như nhau.
D. ban đầu như nhau, sau đó (2) nhanh hơn (1).
Câu34: So sánh tốc độ của 2 phản ứng sau (thực hiện ở cùng nhiệt độ, thành phần Zn như nhau) :
Zn + dung dịch CuSO4 1M (1)
Zn + dung dịch CuSO4 2M (2)
Kết quả thu được là:
A. (1) nhanh hơn (2).
B. (2) nhanh hơn (1).
C. như nhau.
D. ban đầu như nhau, sau đó (1) nhanh hơn (2).
Câu35: So sánh tốc độ của 2 phản ứng sau :
Zn (hạt) + dung dịch CuSO4 1M ở 25oC (1)
Zn (hạt) + dung dịch CuSO4 1M ở 60oC (2)
Kết quả thu được là:
A. (1) nhanh hơn (2).
B. (2) nhanh hơn (1).
C. như nhau.
D. ban đầu như nhau, sau đó (1) nhanh hơn (2).
Câu 36: Cho 5 gam zinc (kẽm) viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25oC). Trường hợp nào tốc độ phản ứng không đổi?
A. Thay 5 gam zinc viên bằng 5 gam zinc bột.
B. Thay dung dịch H2SO4 4M bằng dung dịch H2SO4 2M.
C. Tăng nhiệt độ phản ứng từ 25oC đến 50oC.
D. Dùng dung dịch H2SO4 gấp đôi ban đầu.
Câu 37: Khi cho cùng một lượng aluminum (nhôm) vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ
lớn nhất khi dùng aluminum ở dạng nào sau đây?
A. Dạng viên nhỏ B. Dạng bột mịn, khuấy đều.
C. Dạng tấm mỏng. D. Dạng nhôm dây.
Câu38: Yếu tố nào dưới đây được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín để ủ ancol (rượu)?
A. Chất xúc tác. B. áp suất. C. Nồng độ. D. Nhiệt độ.
Câu 39: Cho ba mẫu đá vôi (100% CaCO3) có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
A. 321 ttt << B. 123 ttt << C. 123 ttt == D. 213 ttt << Câu 40: Trong gia đình, nồi áp suất được sử dụng để nấu chín kỹ thức ăn. Lí do nào sau đây sai khi giải thích cho việc sử dụng nồi áp suất?
A. Tăng áp suất và nhiệt độ lên thức ăn.
B. Giảm hao phí năng lượng.
C. Giảm thời gian nấu ăn.
D. Tăng diện tích tiếp xúc thức ăn và gia vị.
Câu 41: Cho phản ứng: 2KClO3 (r) o 2 MnO,t → 2KCl(r) + 3O2 (k). Yếu tố không ảnh hưởng đến tốc độ của phản
ứng trên là:
A. Kích thước các tinh thể KClO3 B. Áp suất.
C. Chất xúc tác.
D. Nhiệt độ
Câu42: Cho phản ứng phân huỷ hiđro peoxit trong dung dịch: 2H2O2 o 2 MnO,t → 2H2O + O2
Những yếu tố ảnh không hưởng đến tốc độ phản ứng là:
A. Nồng độ H2O2. B. Áp suất và diện tích bề mặt.
C. Nhiệt độ. D. Chất xúc tác MnO2.
Câu43: Trong dung dịch phản ứng thủy phân ethyl acetate (CH3COOC2H5) có xúc tác acid vô cơ xảy ra như sau: CH3COOC2H5 + H2O HCl → CH3COOH + C2H5OH
Phát biểu nào sau đây đúng?
A. Nồng độ acid tăng dần theo thời gian.
B. Thời điểm ban đầu, nồng độ acid trong bình phản ứng bằng 0.
C. Tỉ lệ mol giữa chất đầu và chất sản phẩm luôn bằng 1.
D. HCl chuyển hóa dần thành CH3COOH nên nồng độ HCl giảm dần theo thời gian.
Câu44: Cách nào sau đây làm củ khoai tây chín nhanh nhất?
A. Luộc trong nước sôi.
C. Nướng ở 180 oC.
B. Hấp cách thủy trong nồi cơm.
D. Hấp trên nồi hơi.
Câu45: Nồi áp suất dùng để ninh, hầm thức ăn có thể làm nóng nước tới nhiệt độ 120ºC so với 100ºC khi dùng nồi thường. Trong quá trình hầm xương thường diễn ra nhiều phản ứng hoá học, ví dụ quá trình biến đổi các protein, chẳng hạn như thuỷ phân collagen thành gelatin. Hãy cho biết tốc độ quá trình thuỷ phân collagen thành gelatin thay đổi như thế nào khi sử dụng nồi áp suất thay cho nồi thường.
A. Không thay đổi.
B. Giảm đi 4 lần.
C. Ít nhất tăng 4 lần. D. Ít nhất giảm 16 lần.
Câu 46: Người ta thường sử dụng nhiệt của phản ứng đốt cháy than đá để nung vôi. Biện pháp kĩ thuật nào dưới
đây không được sử dụng để làm tăng tốc độ phản ứng nung vôi?
A. Đập nhỏ đá vôi với kích thước khoảng 10 cm.
B. Tăng nhiệt độ phản ứng lên khoảng 900oC.
C. Tăng nồng độ khí cacbonic.
D. Thổi không khí nén vào lò nung vôi.
Câu 47: Cho phản ứng: 2KClO3 (r) o 2 MnO,t → 2KCl(r) + 3O2 (k). Yếu tố không ảnh hưởng đến tốc độ của phản
ứng trên là:
A. Kích thước các tinh thể KClO3
C. Chất xúc tác.
Câu48: Cho phản ứng nung vôi CaCO3 CaO + CO2
B. Áp suất.
D. Nhiệt độ
Để tăng hiệu suất của phản ứng thì biện pháp nào sau đây không phù hợp?
A. Tăng nhiệt độ trong lò
C. Đập nhỏ đá vôi
Câu49: Thực hiện 2 thí nghiệm theo hình vẽ sau:
B. Tăng áp suất trong lò
D. Giảm áp suất trong lò
Thí nghiệm 1 Thí nghiệm 2
Ở thí nghiệm nào có kết tủa xuất hiện trước?
A. TN1 có kết tủa xuất hiện trước.
C. Kết tủa xuất hiện đồng thời.
B. TN2 có kết tủa xuất hiện trước.
D. Không có kết tủa xuất hiện.
Câu 50: Thí nghiệm nghiên cứu tốc độ phản ứng kẽm với dung dịch axit clohiđric của hai nhóm học sinh được mô
tả bằng hình sau:
200 ml dung dịch HCl 2M
1 gam Zn miếng Thí nghiệm nhóm thứ nhất
300 ml dung dịch HCl 2M
1 gam Zn bột
Thí nghiệm nhóm thứ hai
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do:
A. Nhóm thứ hai dùng axit nhiều hơn.
B. Diện tích bề mặt kẽm bột lớn hơn kẽm miếng.
C. Nồng độ kẽm bột lớn hơn.
D. Áp suất tiến hành thí nghiệm nhóm thứ hai cao hơn nhóm thứ nhất.
Câu51: Cho phản ứng hóa học sau: Na2S2O3 (aq) + H2SO4 (aq) Na2SO4 (aq) + SO2 (g) + S(s) + H2O
Khi thay đổi một trong các yếu tố (các yếu tố còn lại giữ nguyên)
(1) Tăng nhiệt độ
(2) Tăng nồng độ Na2S2O3
(3) Giảm nồng độ H2SO4.
(4) Giảm nồng độ Na2SO4
(5) Giảm áp suất của SO2
Có bao nhiêu yếu tố trong các yếu tố trên khi thay đổi sẽ làm tăng tốc độ của phản ứng?
A. 3. B. 4. C. 2. D. 1.
Câu52: Cho Fe (hạt) phản ứng với dung dịch HCl 1M. Thay đổi các yếu tố sau:
(1) Thêm vào hệ một lượng nhỏ dung dịch CuSO4
(2) Thêm dung dịch HCl 1M lên thể tích gấp đôi.
(3) Nghiền nhỏ hạt sắt thành bột sắt.
(4) Pha loãng dung dịch HCl bằng nước cất lên thể tích gấp đôi.
Có bao nhiêu yếu tố làm thay đổi tốc độ phản ứng?
A. 1. B. 4. C. 3. D. 2.
C. PHÂNDẠNG BÀITẬPTỰ LUẬN
1.Sosánhtốc độ củaphản ứngkhi thay đổi nồng độ cácchất
Ví dụ 1: Cho phản ứng hóa học sau: H2O2 → H2O + 1 2 O2
Biết rằng tốc độ của phản ứng này tuân theo biểu thức của định luật tác dụng khối lượng.
a. Hãy viết biểu thức tốc độ phản ứng.
b. Tốc độ phản ứng tức thời tăng dần hay giảm dần theo thời gian?
Ví dụ 2: Cho phản ứng đơn giản sau: H2 (g) + Cl2 (g) → 2HCl (g)
a. Viết biểu thức tốc độ tức thời của phản ứng trên.
b. Tốc độ phản ứng thay đổi thế nào khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2?
Ví dụ 3: Cho phản ứng đơn giản xảy ra trong bình kín: 22 2NO(g)O(g)2NO(g) +→
a. Viết biểu thức tốc độ tức thời của phản ứng.
b. Ở nhiệt độ không đổi, tốc độ phản ứng thay đổi thế nào khi:
- Nồng độ O2 tăng 3 lần, nồng độ NO không đổi?
- Nồng độ NO tăng 3 lần, nồng độ O2 không đổi?
- Nồng độ NO và O2 đều tăng 3 lần?
Ví dụ 4: Phosgen (COCl2) là một chất độc hóa học được sử dụng trong chiến tranh thế giới thứ nhất.
Phản ứng tổng hợp phosgen như sau: CO + Cl2 → COCl2
Câu6: Cho phản ứng: 2SO2 (g) + O2 (g) 2SO3 (g)
Tốc độ phản ứng thuận thay đổi bao nhiêu lần nếu thể tích hỗn hợp giảm đi 3 lần?
3/2 COClvk.C.C =
Biểu thức tốc độ phản ứng có dạng: 2
Tốc độ phản ứng thay đổi như nào nếu:
a. Tăng nồng độ CO lên 2 lần.
b. Giảm nồng độ Cl2 xuống 4 lần.
Ví dụ 5: Xét phản ứng sau: 2ClO2 + 2NaOH → NaClO3 + NaClO2 + H2O
Tốc độ phản ứng được viết như sau: 2 .. xy ClONaOHvkCC = . Thực hiện phản ứng với những nồng độ chất đầu khác
nhau và đo tốc độ phản ứng tương ứng thu được kết quả trong bảng sau:
STT Nồng độ ClO2 (M) Nồng độ NaOH (M) Tốc độ phản ứng
1 0,01 0,01 2.10-4
2 0,02 0,01 8.10-4
3 0,01 0,02 4.10-4
Hãy tính x và y trong biểu thức tốc độ phản ứng.
Ví dụ 6: Cho phản ứng của các chất ở thể khí: I2 + H2 → 2HI. Biết tốc độ phản ứng tỉ lệ thuận với nồng độ
của các chất tham gia phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hóa học.
a. Hãy viết phương trình tốc độ của phản ứng này.
b. Ở một nhiệt độ xác định, hằng số tốc độ của phản ứng này là 2,5.10-4 L/(mol.s). Nồng độ đầu của I2 và H2 lần
lượt là 0,02M và 0,03M. Hãy tính tốc độ phản ứng:
- Tại thời điểm đầu.
- Tại thời điểm đã hết một nửa lượng I2
● Cấp độ thông hiểu, vận dụng
Bài tập vận dụng
Câu1: Cho phản ứng: A (g) + 2B (g) C (g) + D (g)
Khi tăng nồng độ của chất B lên 2 lần, nồng độ A không đổi, vận tốc phản ứng thuận sẽ tăng lên
A. 2 lần. B. 4 lần. C. 6 lần. D. 8 lần.
Câu2: Cho phản ứng: 2SO2 (g) + O2 (g) 2SO3 (g)
Tốc độ phản ứng thuận tăng lên 4 lần khi:
A. Tăng nồng độ SO2 lên 2 lần.
B. Tăng nồng độ SO2 lên 4 lần.
C. Tăng nồng độ O2 lên 2 lần.
D. Tăng đồng thời nồng độ SO2 và O2 lên 2 lần.
Câu3: Cho phương trình hóa học của phản ứng tổng hợp amoniac: o t,xt 223N(g) + 3H(g) 2NH(g) → ←
Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận:
A. tăng lên 8 lần.
C. giảm đi 2 lần.
B. tăng lên 2 lần.
D. tăng lên 6 lần.
Câu4: Cho hệ cân bằng 2CO (g) + O2 (g) 2CO2 (g) trong bình kín, nhiệt độ không đổi. Nếu áp suất hệ tăng
2 lần, tốc độ phản ứng thuận sẽ tăng lên
A. 2 lần. B. 4 lần.
C. 6 lần.
D. 8 lần.
Câu 5: Cho hệ cân bằng 2CO (g) + O2 (g) 2CO2 (g) trong bình kín, nhiệt độ không đổi. Nếu giảm thể tích của hệ 3 lần, tốc độ phản ứng nghịch sẽ tăng lên
A. 3 lần. B. 6 lần. C. 9 lần. D. 12 lần.
A. 3. B. 6. C. 9. D. 27.
Câu7: Một phản ứng xảy ra trong bình kín: 2NO (g) + O2 (g)
tialöûañieän 2NO2 (g)
Giữ nguyên nhiệt độ, nén hỗn hợp phản ứng xuống còn 1/3 thể tích. Kết luận nào sau đây không đúng?
A. Tốc độ phản ứng thuận tăng 27 lần.
B. Tốc độ phản ứng nghịch tăng 9 lần.
C. Cân bằng dịch chuyển theo chiều thuận.
D. Hằng số cân bằng tăng lên.
Câu8: Trong phản ứng tổng hợp NH3, trường hợp nào sau đây tốc độ phản ứng thuận sẽ tăng 27 lần?
A. Tăng nồng độ khí N2 lên 9 lần.
B. Tăng nồng độ khí H2 lên 3 lần.
C. tăng áp suất chung của hệ lên 2 lần.
D. tăng áp suất chung của hệ lên 3 lần.
Câu9: Phương trình hóa học của phản ứng: CHCl3(g) + Cl2(g) → CCl4(g) + HCl(g).
Khi nồng độ của CHCl3 giảm 4 lần, nồng độ Cl2 giữ nguyên thì tốc độ phản ứng sẽ
A. Tăng gấp đôi.
C. Tăng 4 lần.
B. Giảm một nửa.
D. Giảm 4 lần.
Câu10: Phản ứng giữa hai chất A và B được biểu thị bằng phương trình hóa học sau: A + B →2C
Tốc độ phản ứng này là v = k.[A].[B]. Thực hiện phản ứng này với sự khác nhau về nồng độ ban đầu của các chất:
- Trường hợp 1: Nồng độ của mỗi chất là 0,01 mol/l
- Trường hợp 2: Nồng độ của mỗi chất là 0,04 mol/l
- Trường hợp 3: Nồng độ của chất A là 0,04 mol/l, của chất B là 0,01 mol/l
Tốc độ phản ứng ở trường hợp 2 và 3 lớn hơn so với trường 1 số lần tương ứng là:
A. 16 và 8. B. 13 và 7. C. 16 và 4. D. 15 và 5.
Câu 11: Tốc độ của một phản ứng có dạng: = xy ABvk.C.C (A, B là 2 chất khác nhau). Nếu tăng nồng độ A lên 2 lần, nồng độ B không đổi thì tốc độ phản ứng tăng 8 lần. Giá trị của x là
A. 3. B. 4. C. 6. D. 8.
Câu12: Cho phản ứng: A + xB → ABx. Khi tăng nồng độ các chất lên 2 lần thấy tốc độ phản ứng tăng lên 16 lần. Giá trị của x là
A. 2. B. 3. C. 4. D. 6.
Câu 13: Cho phản ứng X + 2Y Z. Nồng độ ban đầu của chất X là 1M, chất Y là 3M, hằng số tốc độ phản ứng k = 0,5. Tốc độ của phản ứng khi đã có 20% chất X tham gia phản ứng là
A. 0,016. B. 2,304. C. 2,704. D. 2,016.
Câu 14: Đốt cháy hoàn toàn 1 hiđrocacbon X ở thể khí (số nguyên tử C của X không vượt quá 4) bằng oxi trong bình kín. Nếu giữ nguyên nồng độ của X và tăng nồng độ của oxi lên gấp đôi thì tốc độ phản ứng cháy tăng gấp 16 lần. Tìm số công thức phân tử có thể có của X.
A. 1. B. 2. C. 3. D. 4.
Câu 15: Đốt cháy hoàn toàn 1 hiđrocacbon X ở thể khí bằng oxi trong bình kín. Nếu giữ nguyên nồng độ của X và tăng nồng độ của oxi lên gấp đôi thì tốc độ phản ứng cháy tăng gấp 32 lần. Tìm số công thức phân tử có thể có của X.
A. 1. B. 2. C. 3. D. 4.
2.Tínhtốc độ trungbìnhcủaphản ứng
Ví dụ 1: Một số phản ứng diễn ra với số mol chất phản ứng cụ thể theo thời gian được thể hiện trong bảng dưới
đây:
Phản ứng Lượng chất phản ứng (mol) Thời gian (s) Tốc độ phản ứng (mol/s)
1 2 30 ? 2 5 120 ? 3 1 90 ?
4 3,2 90 ?
5 5,9 30 ?
a. Tính tốc độ trung bình của mỗi phản ứng.
b. Phản ứng nào diễn ra với tốc độ nhanh nhất? Phản ứng nào diễn ra với tốc độ chậm nhất?
Ví dụ 2: Thực hiện trong bình kín: aAbBdDeE +→+ . Nồng độ của A tại các thời điểm t = 0, t = 1 phút, t =
2 phút lần lượt là: 0,1563M; 0,1496M; 0,1431M.
a. Tính tốc độ trung bình của phản ứng trong phút thứ nhất và từ phút thứ nhất tới hết phút thứ hai?
b. Vì sao hai giá trị tốc độ tính được không bằng nhau?
Ví dụ 3: Dữ liệu thí nghiệm của phản ứng: SO2Cl2 (g) → SO2 (g) + Cl2 (g) được trinh bày ở bảng sau:
Nồng độ (M)
Thời gian (phút)
SO2Cl2 SO2 Cl2
0 1,00 0 0 100 ? 0,13 0,13
200 0,78 ? ?
a. Tính tốc độ trung bình của phản ứng theo SO2Cl2 trong thời gian 100 phút.
b. Sau 100 phút, nồng độ của SO2Cl2 còn lại là bao nhiêu?
c. Sau 200 phút, nồng độ của SO2 và Cl2 thu được là bao nhiêu?
Ví dụ 4: Xét phản ứng phân hủy N2O5 ở 45oC: N2O5 → N2O4 + 1/2O2 Sau 184 giây đầu tiên, nồng độ của N2O4 là 0,25M. Tính tốc độ trung binh của phản ứng theo N2O4 trong
khoảng thời gian trên.
Ví dụ 5: Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 33,6 ml khí O2 (đktc). Tính tốc
độ trung bình của phản ứng (tính theo H2O2) trong 60 giây.
Ví dụ 6: Cho phản ứng : Br2 + HCOOH → 2HBr + CO2 Nồng độ ban đầu của Br2 là a mol/lít, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10-5 mol(lít.s)-1. Tính giá trị của a.
Ví dụ 7: Trong một thí nghiệm, người ta đo được tốc độ trung bình của phản ứng của zinc (dạng bột) với dung dịch H2SO4 loãng là 0,005 mol/s. Nếu ban đầu cho 0,4 mol zinc (dạng bột) với dung dịch H2SO4 ở trên thì sau bao lâu còn lại 0,05 mol zinc.
Ví dụ 8: Cho phản ứng hóa học sau: Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g) a. Ở nhiệt độ phòng, đo được sau 1 phút có 7,5 ml khí hydrogen thoát ra. Tính tốc độ trung bình của phản ứng theo hydrogen.
b. Ở nhiệt độ thấp, tốc độ phản ứng là 3ml/min. Hãy tính xem sau bao lâu thì thu được 7,5 ml khí hydrogen.
Ví dụ 9: Xét phản ứng 3O2 → 2O3. Nồng độ ban đầu của oxygen là 0,024M. Sau 5 giây nồng độ của oxygen còn lại là 0,02M. Tính tốc độ trung bình của phản ứng trong khoảng thời gian trên.
Ví dụ10 : Xét phản ứng phân hủy khí N2O5 xảy ra như sau: 2N2O5 (g) → 4NO2 (g) + O2 (g)
a. Viết biểu thức tính tốc độ phản ứng theo sự biến thiên nồng độ của chất tham gia và sản phẩm theo thời gian.
b. Sau khoảng thời gian t (s), tốc độ tạo thành O2 là 9,0 x 10-6 (M/s), tính tốc độ của các chất còn lại trong phản
ứng.
Ví dụ 11: Trong quá trình tổng hợp nitric acid, có giai đoạn đốt cháy NH3 bằng O2 có xúc tác. Phản ứng xảy ra trong pha khí như sau: 4NH3 + 5O2 → 4NO + 6H2O. Trong một thí nghiệm, cho vào bình phản ứng (bình kín) 560 ml khí NH3 và 672 ml khí O2 (có xúc tác, các thể tích khí đo ở đktc). Sau khi thực hiện phản ứng 2,5 giờ, thấy có 0,432 gam nước tạo thành.
a. Viết biểu thức tính tốc độ trung bình của phản ứng theo các chất tham gia và chất tạo thành trong phản ứng.
b. Tính tốc độ trung bình của phản ứng theo đơn vị mol/h.
c. Tính số mol NH3 và O2 sau 2,5 giờ.
Ví dụ 12: Xét phản ứng phân hủy hydrogen peroxide: 2H2O2 2MnO → 2H2O + O2. Thể tích khí oxygen tạo thành
được đo sau mỗi 20 giây. Giá trị tốc độ trung bình của phản ứng được tính sau mỗi khoảng thời gian 20 giây được cho trong bảng sau:
Thời gian(s) 0 20 40 60 80 100
Thể tích khí oxygen (cm3) 0 48 70 82 88 88
Tốc độ trung bình của phản ứng (cm3 s-1) 2,4 1,1 x 0,3 0,0 0,0
a. Giải thích cách tính tốc độ phản ứng trung bình trong 20 giây đầu tiên.
b. Xác định giá trị của x trong bảng.
c. Giải thích tại sao tốc độ phản ứng giảm dần theo thời gian.
Ví dụ 13: Thực hiện phản ứng sau: H2SO4 + Na2S2O3 → Na2SO4 + SO2 + S + H2O. Theo dõi thể tích SO2 thoát ra theo thời gian, ta có bảng sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).
a. Vẽ đồ thị biểu diễn sự phụ thuộc thể tích khí SO2 vào thời gian phản ứng.
b. Thời điểm đầu, tốc độ phản ứng nhanh hay chậm?
c. Thời điểm kết thúc phản ứng, đồ thị có hình dạng như thế nào?
d. Tính tốc độ trung bình của phản ứng trong khoảng: từ 0 - 10 giây; từ 10 - 20 giây; từ 20 - 40 giây. Bài tập vận dụng
● Cấp độ thông hiểu, vận dụng
Câu 1: Thực hiện phản ứng sau: CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2O. Theo dõi thể tích CO2 thoát ra theo thời gian, thu được đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).

Trong các phát biểu sau, phát biểu nào không đúng?
A. Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
B. Tốc độ phản ứng giảm dần theo thời gian.
C. Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 0,33 ml/s.
D. Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là như nhau.
Câu 2: Phương trình tổng hợp amonia (NH3), N2(g) + 3H2(g) → 2NH3(g). Nếu tốc độ tạo thành NH3 là 0,345 M/s thì tốc độ phản ứng của H2 là
A. 0,345 M/s. B. 0,690 M/s. C. 0,173 M/s. D. 0,518 M/s.
Câu 3: Khi bắt đầu phản ứng, nồng độ một chất là 0,024 mol/l. Sau 10 giây xảy ra phản ứng, nồng độ của chất đó là 0,022 mol/l. Tốc độ phản ứng trong trường hợp này là
A. 0,0003 mol/(l.s). B. 0,00025 mol/(l.s).
C. 0,00015 mol/(l.s). D. 0,0002 mol/(l.s).
Câu 4: Cho phản ứng: X + Y Z. Nồng độ ban đầu của X là 0,12 mol/l; của Y là 0,1 mol/l. Sau 10 phút, nồng
độ của Y giảm xuống còn 0,078 mol/l. Nồng độ còn lại (mol/l) của chất X là
A. 0,042. B. 0,098. C. 0,02. D. 0,034.
Câu5: Cho phản ứng X + Y Z. Nồng độ ban đầu của chất X là 0,1 mol/l, của chất Y là 0,8 mol/l. Sau 10 phút, nồng độ của Y giảm 20% so với nồng độ ban đầu. Tốc độ trung bình của phản ứng là
A. 0,16 mol/(l.phút).
C. 1,6 mol/(l.phút).
B. 0,016 mol/(l.phút).
D. 0,106 mol/(l.phút).
Câu6: Cho phản ứng: Br2 + HCOOH → 2HBr + CO2 Nồng độ ban đầu của Br2 là a mol/lít, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/lít. Tốc độ trung bình của phản
ứng trên tính theo Br2 là 4.10-5 mol(lít.s)-1. Giá trị của a là
A. 0,018. B. 0,016. C. 0,012. D. 0,014.
Câu 7: Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 33,6 ml khí O2 (đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 5,0.10-5 mol/(l.s). B. 5,0.10-4 mol/(l.s).
C. 2,5.10-5 mol/(l.s).
D. 1,0.10-3 mol/(l.s).
Câu8: Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 45oC : N2O5 → N2O4 + 1 2 O2
Ban đầu nồng độ của N2O5 là 2,33M, sau 184 giây nồng độ của N2O5 là 2,08M. Tốc độ trung bình của phản ứng
tính theo N2O5 là
A. 6,80.10-4 mol/(l.s)
C. 6,80.10-3 mol/(l.s).
B. 2,72.10-3 mol/(l.s).
D. 1,36.10-3 mol/(l.s).
Câu9: Thực hiện phản ứng sau trong bình kín: 22 H(k)Br(k)2HBr(k) +→
Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là
A. 4 410 mol/(l.s) . B. 4 810 mol/(l.s) .
C. 4 210 mol/(l.s) . D. 4 610 mol/(l.s) .
Câu 10: Cho phương trình hóa học của phản ứng: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
A. 4,0.10-4 mol/(l.s).
C. 1,0.10-4 mol/(l.s).
B. 7,5.10-4 mol/(l.s).
D. 5,0.10-4 mol/(l.s).
Câu11: Cho phản ứng: Na2S2O3 + H2SO4 → S + SO2 + H2O + Na2SO4. Trong hỗn hợp phản ứng gồm Na2S2O3 và H2SO4 loãng có thể tích dung dịch là 100 ml, nồng độ ban đầu của Na2S2O3 là 0,5M. Sau thời gian 40 giây, thể tích SO2 thoát ra là 0,9916 lít (đkc). Giả sử khí tạo ra đều thoát hết ra khỏi dung dịch. Tính tốc độ trung bình của phản ứng trong khoảng thời gian sau 40 giây tính theo Na2S2O3
A. 1.10−2 mol/(l.s).
C. 3.10−2 mol/(l.s).
B. 1.10−3 mol/(l.s).
D. 2,5.10−2 mol/(l.s).
Câu 12: Xét phản ứng 3O2 → 2O3. Nồng độ ban đầu của oxygen là 0,024M. Sau 5 giây nồng độ của oxygen còn lại là 0,02M. Tính tốc độ trung bình của phản ứng trong khoảng thời gian trên.
A. 5,33.10−4 mol/(l.s).
C. 10,66−4 mol/(l.s).
B. 8,01.10−4 mol/(l.s).
D. 2,67.10−4 mol/(l.s).
Câu 13: Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 33,6 ml khí O2 (đktc). Tốc độ trung bình của phản ứng trong 60 giây trên là
A. 5,0.10-5 mol/(l.s). B. 5,0.10-4 mol/(l.s).
C. 2,5.10-4 mol/(l.s). D. 1,0.10-3 mol/(l.s).
Câu14: Trong quá trình tổng hợp nitric acid, có giai đoạn đốt cháy NH3 bằng O2 có xúc tác. Phản ứng xảy ra trong pha khí như sau: 4NH3 + 5O2 → 4NO + 6H2O. Trong một thí nghiệm, cho vào bình phản ứng (bình kín) 560 ml khí NH3 và 672 ml khí O2 (có xúc tác, các thể tích khí đo ở đktc). Sau khi thực hiện phản ứng 2,5 giờ, thấy có 0,432 gam nước tạo thành. Tốc độ trung bình của phản ứng theo đơn vị mol/h là
A. 1,6.10−3 mol/h. B. 8,01.10−4 mol/h.
C. 8,10−3 mol/h. D. 2,67.10−4 mol/h.
Câu15: Ở 30 oC sự phân hủy H2O2 xảy ra theo phản ứng: 2H2O2 →2H2O + O2↑
Dựa vào bảng số liệu sau, hãy tính tốc độ trung bình của phản ứng trong khoảng 120 giây đầu tiên.
Thời gian, s 0 60 120 240
Nồng độ H2O2, mol/l 0,3033 0,2610 0,2330 0,2058
A. 2,929.10-4 mol.(l.s)-1 B. 5,858 . 10-4 mol.(l.s)-1
C. 4,667.10-4 mol.(l.s)-1 D. 2,333.10-4 mol.(l.s)-1
3.Tínhtốc độ trungbìnhcủaphản ứng
Ví dụ 1: Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ tăng lên bao nhiêu lần khi nâng nhiệt độ từ 25oC lên 75oC?
Ví dụ 2: Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 4 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70oC xuống 40oC?
Ví dụ 3: Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng lên 3 lần. Để tốc độ phản ứng đó (đang tiến hành ở 30oC) tăng lên 81 lần thì cần thực hiện phản ứng ở nhiệt độ bao nhiêu?
Ví dụ 4: Ở 20 oC, tốc độ một phản ứng là 0,05 mol/(L.min). Ở 30 oC, tốc độ phản ứng này là 0,15 mol/(L.min).
a. Hãy tính hệ số nhiệt độ Van’t Hoff của phản ứng trên.
b. Dự đoán tốc độ phản ứng trên ở 40 oC (giả thiết hê số nhiệt độ γ trong khoảng nhiệt độ này không đổi).
Ví dụ 5: Khi nhiệt độ phòng là 25 oC, cho 10g đá vôi (dạng viên) vào cốc đựng 100 gam dung dịch HCl loãng và nhanh chóng cho lên một cân điện tử. Đọc giá trị khối lượng cốc tại thời điểm ban đầu và sau 1 phút. Lặp lại thí nghiệm khi nhiệt độ phòng là 35 oC. Kết quả thí nghiệm được ghi lại trong bảng sau:
STT Nhiệt độ (oC) Khốilượngcốc(g) Thời điểm đầu Sau1phút
1 25 235,40 235,13
2 35 235,78 235,21
a. Tính hệ số nhiệt độ của phản ứng.
b. Giả sử ban đầu cốc chứa dung dịch HCl và đá vôi có khối lượng 235,40 gam. Thực hiện thí nghiệm ở 45 oC. Hỏi sau 1 phút, khối lượng cốc là bao nhiêu? (Bỏ qua khối lượng nước bay hơi).
Ví dụ 6: Để hoà tan hết một mẫu Al trong dung dịch axit HCl ở 30oC cần 20 phút. Cũng mẫu Al đó tan hết trong dung dịch axit nói trên ở 50oC trong 5 phút. Để hoà tan hết mẫu Al đó trong dung dịch nói trên ở 80oC thì cần bao nhiêu thời gian?
Ví dụ 7: NOCl là chất khí độc, sinh ra do sự phân hủy nước cường toan (hỗn hợp HNO3 và HCl có tỉ lệ 1:3) NOCl có tính oxi hóa mạnh, ở nhiệt độ cao bị phân hủy theo phản ứng hóa học sau: 2NOCl → 2NO + Cl2. Tốc độ phản ứng ở 70 oC là 2.10-7 mol/(L.s) và ở 80 oC là 4,5.10-7 mol/(L.s).
a. Tính hệ số nhiệt độ γ của phản ứng.
b. Dự đoán tốc độ phản ứng ở 60 oC.
Bài tập vận dụng
Câu 1: Tốc độ của phản ứng sẽ tăng lên bao nhiêu lần khi tăng nhiệt độ từ 0oC đến 40oC, biết khi tăng nhiệt độ lên 10oC thì tốc độ phản ứng tăng lên gấp đôi.
A. 2 lần. B. 4 lần. C. 8 lần. D. 16 lần.
Câu 2: Khi nhiệt độ tăng thêm 10oC thì tốc độ phản ứng tăng 3 lần. Khi nhiệt độ tăng từ 20oC lên 80oC thì tốc độ phản ứng tăng lên
A. 18 lần. B. 27 lần. C. 243 lần. D. 729 lần.
Câu3: Hệ số nhiệt độ của tốc độ phản ứng có giá trị nào sau đây? Biết rằng khi giảm nhiệt độ của phản ứng xuống 80oC thì tốc độ phản ứng giảm đi 256 lần.
A. 4,0. B. 2,5. C. 3,0. D. 2,0.
Câu 4: Hệ số nhiệt độ của tốc độ phản ứng là giá trị nào sau đây? Biết rằng khi tăng nhiệt độ lên thêm 30oC thì tốc độ phản ứng tăng lên 64 lần.
A. 2. B. 3. C. 4. D. 5.
Câu 5: Hệ số nhiệt độ của tốc độ phản ứng là giá trị nào sau đây? Biết rằng khi tăng nhiệt độ lên thêm 50oC thì tốc độ phản ứng tăng lên 1024 lần.
A. 2,0. B. 2,5. C. 3,0. D. 4,0.
Câu6: Hệ số nhiệt của phản ứng (g) là 2 (hệ số nhiệt phản ứng cho biết khi nhiệt độ phản ứng tăng lên 10oC thì tốc độ phản ứng tăng lên bao nhiêu lần). Nếu phản ứng phân huỷ axeton được thực hiện ở 600oC thì tốc độ phản ứng thay đổi như thế nào so với tốc độ phản ứng ở 550oC?
A. Tăng 16 lần. B. Giảm 32 lần.
C. Tăng 32 lần. D. Giảm 16 lần. Câu 7: Để hoà tan hết một mẫu Zn trong dung dịch axit HCl ở 20oC cần 27 phút. Cũng mẫu Zn đó tan hết trong dung dịch axít nói trên ở 40oC trong 3 phút. Vậy để hoà tan hết mẫu Zn đó trong dung dịch nói trên ở 55oC thì cần thời gian là
A. 64,00 giây. B. 60,00 giây. C. 54,54 giây. D. 34,64 giây.
Câu8: Để hòa tan một mẩu Zn trong dung dịch HCl ở 25oC cần 243 phút. Cũng mẩu Zn đó tan hết trong dung dịch HCl như trên ở 65oC cần 3 phút. Để hòa tan hết mẩu Zn đó trong dung dịch HCl có nồng độ như trên ở 45oC cần thời gian là
A. 27 phút. B. 81 phút. C. 18 phút. D. 9 phút.
Câu 9: Để hoà tan hết một mẫu Al trong dung dịch axit HCl ở 25oC cần 36 phút. Cũng mẫu Al đó tan hết trong dung dịch axit nói trên ở 45oC trong 4 phút. Hỏi để hoà tan hết mẫu Al đó trong dung dịch axit nói trên ở 600C thì cần thời gian bao nhiêu giây?
A. 45,465 giây. B. 56,342 giây.
C. 46,188 giây. D. 38,541 giây.
Câu 10: Để hoà tan hết một mẫu Al trong dung dịch axit HCl ở 30oC cần 20 phút. Cũng mẫu Al đó tan hết trong dung dịch axit nói trên ở 50oC trong 5 phút. Để hoà tan hết mẫu Al đó trong dung dịch nói trên ở 80oC thì cần bao nhiêu thời gian?
A. 46,5 giây. B. 57,5 giây. C. 26,8 giây. D. 37,5 giây.
