
Năng lượng đóng vai trò quan trọng trong cuộc sống của con người.
a, Thực phẩm cung cấp năng lượng cho con người.
b, Quá trình đốt cháy xăng cung cấp năng lượng cho ô tô.
c, Than cốc cung cấp năng lượng cần thiết để chuyển hóa quặng sắt thành sắt.
I. Một số khái niệm Điều kiện chuẩn: Kí hiệu:

• g (gas): Chất khí.
• s (solid): Chất rắn.
• l (liquid): Chất lỏng.
• aq (aquecous): Chất tan trong nước. Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng năng lượng ra môi trường dưới dạng nhiệt. Biến thiên enthalpy của phản ứng có giá trị âm. Biến thiên enthalpy càng âm, phản ứng càng tỏa ra nhiều nhiệt.

Phản ứng thu nhiệt là phản ứng hóa học hấp thụ năng lượng từ môi trường dưới dạng nhiệt. Biến thiên enthalpy của phản ứng có giá trị dương. Biến thiên enthalpy càng dương, phản ứng càng thu nhiệt.

Nhiệt tạo thành chuẩn ( o f298 H ∆ ) của một chất là lượng nhiệt kèm theo của phản

ứng khi tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
Năng lượng liên kết là năng lượng cần thiết để phá vỡ liên kết đó trong phân tử và
tạo thành các nguyên tử ở trạng thái khí, kí hiệu là Eb và Eb > 0.
Biến thiên enthalpy của phản ứng ở điều kiện chuẩn kí hiệu là o r298 H ∆ .

II. Biến thiên enthalpy của phản ứng

1. Tính biến thiên enthalpy theo nhiệt tạo thành
Biến thiên enthalpy của phản ứng (hay nhiệt phản ứng) bằng tổng enthalpy tạo thành của các sản phẩm trừ tổng enthalpy tạo thành của các chất đầu.


HH(sp)H(cd)
ooo r298f298f298
2. Tính biến thiên enthalpy theo năng lượng liên kết
3. Ý nghĩa của dấu và giá trị o r298 Δ H
- Phản ứng thu nhiệt: o r298 Δ H > 0, o r298 Δ H càng dương, thu vào càng nhiều nhiệt.

- Phản ứng tỏa nhiệt: o r298 Δ H < 0, o r298 Δ H càng âm, tỏa ra càng nhiều nhiệt.
Ý nghĩa của biến thiên enthalpy

Dạng 1: Ôn tập lí thuyết
PHẦN TỰ LUẬN
Bài 1: Hình ảnh dưới đây biểu thị phản ứng là tỏa nhiệt hay thu nhiệt?
Bài 2: Đánh dấu “x” vào ô tương ứng để hoàn thiện bảng sau.
Phản ứng tỏa nhiệt Phản ứng thu nhiệt
a, Quá trình pháo hoa cháy sáng trong không khí.
b, Quá trình quang hợp của thực vật.
c, Quá trình oxi hóa carbohydrate trong cơ thể con người.
d, Đốt magnesium trong không khí.
e, Nhiệt phân magnesium nitrate.
Bài 3: Cho các phản ứng sau, phản ứng nào là phản ứng thu nhiệt, phản ứng nào là phản ứng tỏa nhiệt?
Cho dung dịch silver nitrate phản ứng với sodium chloride (thấy nhiệt độ tăng).




Calcium oxide tác dụng với nước.
Cho dung dịch X phản ứng với dung dịch Y thấy xuất hiện kết tủa trắng, dưới đáy cốc có hiện tượng đóng đá.
Nhiệt phân Cu(OH)2.
Bài 4: Vẽ sơ đồ biểu diễn biến thiên enthalpy cho các phản ứng dưới đây.
a, Quá trình đốt cháy sulfur để tạo thành sulfur dioxide biết nhiệt tạo thành chuẩn của SO2(g) là -296,8 kJ/mol.

Điều chế oxygen theo Joseph Priestly: HgO(s) → Hg(l) + O2(s) biết nhiệt tạo thành chuẩn của HgO(s) là90,5 kJ/mol.
c, Nhiệt phân calcium carbonate biết khi nhiệt phân 1 mol calcium carbonate cần cung cấp 178,49 kJ nhiệt lượng.
Bài 5: Hình 5.1 biểu diễn biến thiên enthalpy của quá trình oxi hóa glucose bởi oxygen. Viết phương trình hóa học của phản ứng trên, cho biết phản ứng xảy ra là phản ứng tỏa nhiệt hay thu nhiệt?
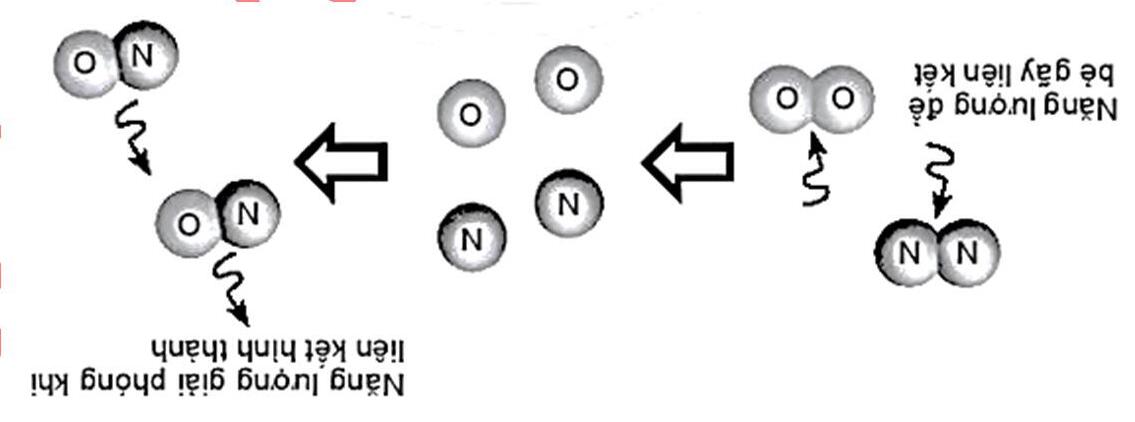
Hình 5.4. Sơ đồ biến thiên enthalpy của phản ứng giữa sulfur và fluorine


Bài 9: Viết phương trình nhiệt hóa học của các quá trình tạo thành những chất sau từ đơn chất.
a, Nước ở trạng thái khí biết rằng khi tạo thành 1 mol hơi nước từ các đơn chất ở trạng thái bền vững nhất trong điều kiện thường giải phóng 214,6 kJ nhiệt.
b, Hydrogen iodide (HI) ở trạng thái khí biết khi tạo thành một mol HI từ các đơn chất ở trạng thái bền vững nhất trong điều kiện thường cần phải cung cấp 26,5 kJ nhiệt lượng.
Hình 5.1. Biến thiên enthalpy của quá trình oxi hóa glucose bởi oxygen
Bài 6: Viết phương trình nhiệt hóa học của các phản ứng có sơ đồ biến thiên enthalpy được biểu diễn trong hình 5.2 Phản ứng nào diễn ra thuận lợi hơn?
c, Ammonia (NH3) ở trạng thái khí biết để tạo thành 2,5 gam ammonia từ các đơn chất ở trạng thái bền vững nhất trong điều kiện thường giải phóng 22,99 kJ nhiệt.
Dạng 2: Tính biến thiên enthalpy của phản ứng theo enthalpy chuẩn tạo thành
Bài 10: Vào giữa những năm 1700, một phương pháp đã được đưa ra để điều chế khí chlorine từ sodium chloride như sau:
NaCl(s) + H2SO4(l) + MnO2(s) → Na2SO4(s) + MnCl2(aq) + H2O(l) + Cl2(g)
Dựa trên giá trị enthalpy tạo thành hãy tính biến thiên enthalpy cho phản ứng trên. Phản ứng là toả nhiệt hay toả nhiệt? Biết enthalpy tạo thành chuẩn của các chất được cho trong bảng sau: NaCl(s) H2SO4(l) MnO2(s) Na2SO4(s) MnCl2(aq) H2O(l) o f298 Δ H
Bài 11: Thạch cao nung (CaSO4.0,5H2O) là hóa chất được sử dụng để đúc tượng, bó bột trong y học.
Hình 5.2. Sơ đồ biểu diễn biến thiên enthalpy của phản ứng
Bài 7: Hình 5.3 biểu diễn biến thiên enthalpy của phản ứng trong lò luyện gang, thép. Phương trình hóa học xảy ra như sau:

Fe2O3 (s) + 3CO (g) → 2Fe(s) + 3CO2 (g) o r298 Δ H = –24,74 kJ

Hoàn thành sơ đồ biểu diễn biến thiên enthalpy của phản ứng trên.
Enthalpy (kJ mol-1)

ΔH
ΔH
ΔH = ………..
Bài 8: Hình 5.4. biểu diễn biến thiên enthalpy của phản ứng giữa sulfur và fluorine theo phương trình hóa học
sau:
S(g) + 2F2(g) → SF4(g) o r298 Δ H = –775 kJ



Hoàn thành sơ đồ biểu diễn biến thiên enthalpy của phản ứng trên.
Hình 5.5. Một số ứng dụng của thạch cao nung
Có thể thu được thạch cao nung bằng cách nung thạch cao sống (CaSO4.2H2O) ở nhiệt độ khoảng 150°C.
Phương trình nhiệt hóa học xảy ra như sau:
CaSO4.2H2O(s) → CaSO4.0,5H2O(s) + 3 2 H2O(g)
a, Tính biến thiên enthanpy chuẩn cho phản ứng nung thạch cao sống. Nhiệt tạo thành chuẩn của các chất được cho trong bảng sau.
Chất CaSO4.2H2O(s) CaSO4.0,5H2O(s) H2O(g)

o f298 Δ H (kJ/mol) –2021 –1575 –241,82
b, Tính lượng nhiệt cần cung cấp để chuyển 10 kg thạch cao sống thành thạch cao nung ở điều kiện chuẩn.
Bài 12: Đá vôi (có chứa CaCO3) là thành phần chính có trong các loại đá được dùng trong xây dựng do có
khả năng chịu nhiệt, chịu lực tốt. Calcium carbonate có thể bị phân hủy theo phản ứng sau: CaCO3(s) o →
CO2(g) + CaO(s). Tính biến thiên enthalpy chuẩn của phản ứng theo enthalpy chuẩn tạo thành. Phản ứng có thuận lợi xảy ra ở điều kiện thường không? Biết enthalpy tạo thành chuẩn của các chất được cho trong bảng sau:
CaCO3(s) CO2(g) CaO(s) o f298 Δ H (kJ/mol) -1207,6 -393,5 -634,9
Bài 13: Để hàn đường ray xe lửa người ta thường sử dụng hỗn hợp tecmit (gồm Al và Fe2O3). Khi tiến hành hàn đường ray bằng hỗn hợp tecmit thì có phương trình phản ứng hóa học như sau:
2Al(s) + Fe2O3(s) o t → Al2O3(s) + 2Fe(s)
Sử dụng giá trị enthalpy tạo thành chuẩn của các chất, tính biến thiên enthalpy chuẩn cho phản ứng trên và giải thích tại sao có thể hàn được đường ray xe lửa theo phản ứng này.
Hình 5.6. Hàn đường ray xe lửa Biết enthalpy tạo thành chuẩn của các chất được cho trong bảng sau:
Fe2O3(s) Al2O3(s)
o f298 Δ H (kJ/mol) -824,2 -1675,7

Bài 14: Phosgene là một loại khí độc đã từng được sử dụng rộng rãi trong Thế chiến thứ nhất như một tác

nhân gây ngạt thở và cản trở quá trình hô hấp của con người. Phản ứng điều chế phosgene xảy ra như sau: CO(g) + Cl2(g) C → COCl2(g)
Tính biến thiên enthalpy chuẩn cho phản ứng trên và giải thích vì sao trinitroglycerin được ứng dụng làm
thành phần thuốc súng không khói. Giá trị enthalpy chuẩn tạo thành của một số chất được cho trong bảng sau:
Chất C3H5O3(NO2)3(s) N2(g) CO2(g) H2O(g) O2(g)
o f298 H ∆ (kJ/mol) -370,15 0 -393,50 -241,82 0
Bài 16: Quá trình đốt cháy hoàn toàn benzene và propane trong khí oxygen đều cho sản phẩm là CO2(g) và H2O(l). Khi đốt cháy hoàn toàn 1 gam propane C3H8(g) và đốt cháy hoàn toàn 1 gam benzene C6H6(l) quá trình nào sẽ giải phóng lượng nhiệt nhiều hơn? Giải thích dựa trên giá trị enthalpy chuẩn (tính theo enthalpy tạo thành) biết enthalpy tạo thành chuẩn của các chất được cho trong bảng sau:

Chất H2O(l) CO2(g) C6H6(l) C3H8(g)
o f298 H ∆ (kJ/mol) -285,84 -393,5 49,00 -105,00
Bài 17: Sử dụng giá trị enthalpy tạo thành chuẩn của một số chất được cho trong bảng sau để tính biến thiên enthalpy phản ứng cho các phản ứng được đưa ra dưới đây: Chất H2O(l) H2O(g) CO2(g) CH4(g) C2H6(g)
o f298 H ∆ (kJ/mol) -285,83 - 241,82 -393,51 -74,81 -84,68
Phản ứng hóa học Biến thiên enthalpy của phản ứng
CH4(g) + 2O2(g) o → 2H2O(g) + CO2(g)
Phản ứng tỏa nhiệt hay thu nhiệt?
Hình 5.7. Cơ chế tác động của phosgen đối với cơ thể người

Tính biến thiên enthalpy chuẩn của phản ứng tạo thành phosgene từ CO(g) và Cl2(g) theo enthalpy tạo thành chuẩn biết enthalpy tạo thành chuẩn của CO(g) = -110,5 kJ/mol. COCl2(g) = -217,43 kJ/mol.
Bài 15: Trinitroglycerin là một thành phần quan trọng có mặt trong nhiều chất
nổ Điều khiến trinitroglycerin đặc biệt hơn các hóa chất gây nổ khác là quá trình nổ không sinh ra khói. Trinitroglycerin bị phân hủy theo phương trình sau.
4C3H5O3(NO2)3(s) →6N2(g) + 12CO2(g) + 10H2O(g) + O2(g).
7
2C2H6(g)+7O2(g) o t → 6H2O(g) + 4CO2(g)
Bài 18: Hydrogen peroxide có thể phân hủy thành nước và oxygen theo phương trình
2H2O2(l) → 2H2O(l) + O2(g) o r298 H ∆ = -196 kJ
Hãy tính nhiệt lượng tỏa ra khi phân hủy 5 gam H2O2 ở áp suất không đổi.
Bài 19: Một xe tải đang vận chuyển đất đèn (thành phần chính là CaC2 và CaO) gặp mưa nên đã xảy ra phản
ứng hóa học và gặp sự cố
a) Viết phương trình hoá học của phản ứng của CaC2 và CaO với nước.
b) Xe tải đã bốc cháy do các phản ứng trên kích thích phản ứng cháy của acetylen:
C2H2(g) + 2,5O2(g) ot → 2CO2(g) + H2O(g).
Tính biến thiên enthalpy phản ứng theo enthalpy tạo thành cho phản ứng trên. Phản ứng là tỏa nhiệt hay thu nhiệt.
Bài 20: Tính biến thiên enthalpy chuẩn của phản ứng theo enthalpy tạo thành chuẩn cho các phản ứng sau.
a, 2CO(g) + O2(g) o t → 2CO2(g)
b, NaOH(s) + HCl(g) → NaCl(s) + H2O(g)
c, 2H2S(g) + 3O2(g) o t → 2H2O(l) + 2SO2(g)
Bài 21: Xăng được cấu tạo chủ yếu từ các hydrocacbon, bao gồm thành phần chủ yếu là C8H18 (octane). Một trong những đồng phân được coi là sạch nhất của octane có mặt trong xăng là 2,3,4-trimethylpentane với công thức cấu tạo như sau.
Liên kết Năng lượng liên kết (kJ/mol)
C≡C 839
C-C 347
C≡H 413
H-H 432
Đốt cháy hoàn toàn 1mol 2,3,4-trimethylpentane sản phẩm tạo thành bao gồm CO2(g) và H2O(g) đồng thời giải phóng -5064,9 kJ nhiệt.
a, Viết phương trình hóa học cho quá trình đốt cháy 1 mol 2,3,4-trimethylpentane.

b, Sử dụng giá trị nhiệt tạo thành chuẩn của các chất và biến thiên enthalpy chuẩn của phản ứng hãy tính enthalpy tạo thành chuẩn của 2,3,4-trimethylpentane.
Chất H2O (g) CO2 (g)
o f298 H ∆ (kJ/mol) -241,82 -393,51
Bài 22: Ethanol C2H5OH được pha trộn với xăng để làm nhiên
liệu do thân thiện với môi trường. Xăng sinh học E5 là sản phẩm thu được khi pha trộn xăng A92 với các nhiên liệu sinh học bioethanol theo tỷ lệ thể tích 95:5. Xăng E5 được sử dụng làm nhiên
liệu cho các loại động cơ đốt trong như xe máy, ô tô… (BioEthanol được sản xuất từ các loại lương thực khô, an toàn tuyệt đối như ngô, sắn, ngũ cốc và củ cải đường lên men).
Hình 5.9. Xăng sinh học E5

Trong quá trình động cơ đốt trong hoạt động, ethanol lỏng bị đốt cháy trong không khí tạo sản phẩm CO2(g)
và H2O(g).
a, Lí do khiến xăng E5 được khuyến khích sử dụng là gì?
b, Dựa trên thông tin trong bài đọc, trong 1 L xăng sinh học E5 sẽ có bao nhiêu mL ethanol?
c, Viết phương trình hóa học xảy ra cho quá trình đốt cháy 1 mol ethanol lỏng trong không khí.
d, Tính biến thiên enthalpy chuẩn của phản ứng biết o f298 H ∆ (C2H5OH) = -1370 kJ/mol.
Dạng 3: Tính biến thiên enthalpy chuẩn của phản ứng theo năng lượng liên kết.
Bài 23: Polypropylene (nhựa PP) là nguyên liệu chính để sản xuất dây cách điện, đồ gia dụng, … Nhựa PP



được sản xuất bằng cách hidrogen hóa propyne sau đó trùng hợp sản phẩm thu được trong điều kiện thích hợp.
Phản ứng tạo thành propene từ propyne như sau:
CH3-C≡CH(g) + H2(g) o 3t,Pd/PbCO → CH3-CH=CH2(g)
Hình 5.10. Các sản phẩm từ nhựa PP
Dựa trên giá trị năng lượng liên kết hãy tính biến thiên enthalpy chuẩn của phản ứng tạo thành propene. Biết
năng lượng liên kết được cho trong bảng sau:
C=C 614
C-H 413
Bài 24: Hình 5.11. Biểu diễn sự tạo thành NO từ N2 và O2. Tính nhiệt tạo thành chuẩn của NO theo năng lượng liên kết.
Hình 5.11. Sự tạo thành NO từ N2 và O2
Biết năng lượng liên kết được cho trong bảng sau:
Liên kết Năng lượng liên kết (kJ/mol)
N≡N 945
O=O 498
N=O 631
Bài 25: Trong ngành công nghiệp hóa dầu, các ankan sẽ được chuyển hóa thành các sản phẩm hydrocarbon khác bằng quá trình dehydro hóa. Tính biến thiên enthalpy chuẩn dựa vào năng lượng liên kết cho các phản
ứng dehydro hóa dưới đây.
a, H3C – CH2 – CH2 – CH3 → CH2=CH-CH=CH2 + 2H2

b, 6CH4 → C6H6 + 9H2 Cho biết công thức cấu tạo của C6H6 như sau
Bài 26: Hãy cho biết ở điều kiện chuẩn H3C-CH2-OH hay H3C-O-CH3 bền hơn dựa vào biến thiên enthalpy chuẩn của phản ứng tính theo năng lượng liên kết. H3C-CH2-OH(l) → H3C-O-CH3(l)
Biết năng lượng liên kết được cho trong bảng sau: Liên kết Năng lượng liên kết (kJ/mol)
C-C 347
C-H 413
C-O 360
O-H 464
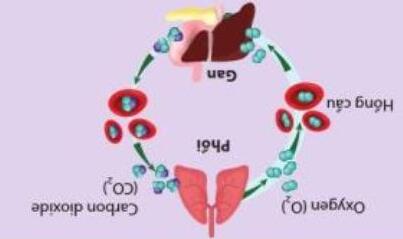
Bài 27: Quá trình chuyển hóa phân tử hemoglobin (Hb) trong máu thành HbO2 để cung cấp O2 cho các hoạt
động sinh hóa trong cơ thể như sau:
Hb + O2 → HbO2 o r298 H ∆ = -33,05 kJ (1)
Hb + CO → HbCO o r298 H ∆ = -47,28 kJ (2)
HbO2 + CO → HbCO + O2 o r298 H ∆ = - 14,23 kJ (3)
HbCO + O2 → HbO2 + CO o r298 H ∆ = 14,23 kJ (4)
Hình 5.12. Phân tử hemoglobin

Khi không khí có lẫn CO sẽ gây ngộ độc cho người hít phải. Từ các giá trị o r298 H ∆ thu được ở trên, hãy liên
hệ giữa mức độ thuận lợi của phản ứng giữa Hb với O2 và Hb với CO.
Bài 28: Tính biến thiên enthalpy chuẩn cho phản ứng sau theo năng lượng liên kết
CH3COCH3 (l) + 4O2 (g) → 3CO2 (g) + 3H2O (l)
Biết propane (CH3COCH3) là chất lỏng, có cấu trúc như sau:
Biết năng lượng liên kết được cho trong bảng sau:
Liên kết Năng lượng liên kết (kJ/mol) C-C
Bài 29: Tính biến thiên enthalpy phản ứng theo năng lượng liên kết cho phản ứng sau và giải thích vì sao
nitrogen (N≡N) chỉ phản ứng với oxygen (O=O) ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide (N=O).
N2(g) + O2(g) → 2NO(g)
Biết năng lượng liên kết được cho trong bảng sau:
Liên kết Năng lượng liên kết (kJ/mol)
N≡N 945
N=O 607
O=O 498
Bài 30: Xác định biến thiên enthalpy của phản ứng sau dựa vào giá trị năng lượng liên kết.
CH4(g) + Cl2(g) a/s → CH3Cl(g) + HCl(g)

Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt?
Biết năng lượng liên kết được cho trong bảng sau:
Liên kết Năng lượng liên kết (kJ/mol)
C-Cl +339
C-C +350
C-H +413
Cl-Cl +243
H-Cl +427
Bài 31: Dựa vào số liệu về năng lượng liên kết, hãy tính biến thiên enthalpy của 2 phản ứng sau: 2H2(g) + O2(g) to →2H2O(g) (1)

C7H16(g) + 11O2(g) to →7CO2(g) + 8H2O(g) (2)
Hình 5.13. Tên lửa cần sử dụng nhiên liệu khi hoạt động
Từ giá trị enthalpy thu được, cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16

có 6 liên kết C- C và 16 liên kết C-H).
Biết năng lượng liên kết được cho trong bảng sau:
Liên kết Năng lượng liên kết (kJ/mol)
H-H 432
O=O 498
O-H 467
C-C 347
C-H 432
C=O 745
O-H 467
Dạng 4: Bài tập tổng hợp
Bài 32: Viết phương trình nhiệt hóa học của phản ứng nhiệt phân đá vôi (CaCO3) biết rằng để thu được 11,2 gam CaO cần phải cung cấp 35,84 kJ nhiệt.
Bài 33: Sucrose (C12H22O11) là loại đường quen thuộc có nhiều trong cây mía và được sử dụng trong chế độ
dinh dưỡng hàng ngày của con người. Khi đi vào cơ thể, dưới tác dụng của acid trong dạ dày và nhiệt độ cơ
thể, sucrose dễ dàng bị thủy phân tạo thành glucose và fructose (cùng có công thức phân tử là C6H12O6). Sau

đó glucose và fructose bị oxi hóa bởi oxygen tạo thành CO2(g) và H2O(l).
a, Viết phương trình phản ứng thủy phân của sucrose và phản ứng oxi hóa đường glucose, fructose bởi oxygen.
b, Phản ứng oxi hóa đường glucose, fructose bởi oxygen là phản ứng tỏa nhiệt hay thu nhiệt dựa trên đồ thị
hình 5.14.
Hình 5.14. Sơ đồ biến thiên enthalpy của phản ứng oxi hóa glucose


c, Nếu đốt cháy 5 gam đường sucrose trong cùng điều kiện trên thì biến thiên enthalpy của quá trình bằng bao nhiêu biết đốt 1 mol surcose giải phóng 5465 kJ nhiệt.
Nhiệt lượng tỏa ra khi đốt 1 gam H2 là: 0,5.(506) 126,5kJ 2 =−

Nhiệt lượng tỏa ra khi đốt 1 gam C7H16 là: 0,01.(3432) 34,32kJ 1 =−
Bài 34: Lactic acid là hợp chất hóa học đóng vai trò quan trọng trong nhiều quá trình sinh hóa. Đặc biệt khi con người tham gia vào các hoạt động mạnh, cơ thể không cung cấp đủ oxygen thì glucose sẽ được chuyển hóa thành acid lactic để cung cấp năng lượng cho cơ thể theo phương trình
C6H12O6(aq) → 2C3H6O3(aq) o r298 H ∆ = -150 kJ.
Hình 5.15. Lactic acid
Nếu một người tham gia chạy bộ trong một khoảng thời gian cần 300kcal thì khối lượng lactic acid được tạo ra từ quá trình chuyển hóa glucose (biết 1 cal = 4,183 J và cơ thể chỉ cung cấp 98% năng lượng nhờ oxygen, năng lượng còn lại nhờ vào quá trình chuyển hóa glucose thành lactic acid).
Bài 35: Một học sinh cho 0,750 gam sodium hydroxide rắn (NaOH) vào 20,00 mL nước ở 25,0 °C trong một nhiệt lượng kế. Nhiệt độ cuối cùng của chất lỏng trong nhiệt lượng kế là 34,6 °C. Biết rằng, khối lượng riêng của nước là 1,0 g mL–1 , để nâng nhiệt độ của 1 gam nước lên 1 oC, cần 4,184 J và nhiệt lượng kế có hiệu suất 100%. Tính biến thiên enthalpycủa quá trình: NaOH (s) → NaOH (aq).
Bài 36: Để tăng độ bền và độ cứng khi rèn dao và lưỡi, thép nóng được "tôi" bằng cách làm nguội nhanh trong nước. Một lưỡi thép nặng 454 gam được nung nóng đến nhiệt độ đồng nhất, và sau đó được "tôi" trong 2000 mL nước ở 25,0 oC. Biết rằng, khối lượng riêng khối lượng riêng của nước là 1,0 g mL–1 , để nâng nhiệt độ của 1 gam nước lên 1 oC, cần 4,184 J và không có nước bay hơi trong quá trình "tôi". Nếu lưỡi thép mất đi 173,7 kJ nhiệt trong quá trình "tôi" thì nhiệt độ cuối cùng của nước là bao nhiêu?
Bài 37: Hình 5. Biểu thị các bước trong một quy trình làm rượu vang tự nho. Sau khi thu hoạch nho chín (nho chín có chứa hàm lượng đường lớn, thuận lợi cho quá trình lên men), trải qua khâu xử lí đơn giản, nho sẽ được tiến hành ép và lên men. Trong giai đoạn này phản ứng hóa học xảy ra như sau:
Hình 5.16. Quy trình sản xuất rượu vang
Trong quá trình làm vang đỏ, khí carbon dioxide được sinh ra trong suốt quá trình lên men. Nó khiến cho vỏ nho được đẩy lên bề mặt, các nhà làm rượu vang phải nhấn chìm phần vỏ đó nhiều lần trong ngày để tăng diện tích tiếp xúc giữa vỏ và nước nho. Một điều quan trọng khác là trong quá trình lên men các nhà sản xuất rượu có thể điều chỉnh được độ rượu, vị của rượu. Nếu như quá trình lên men kém hoặc dừng lại sớm, rượu sẽ còn nhiều đường và có vị ngọt hơn. Sau khi lên men nước nho được lọc và cho vào ủ trong thùng gỗ một vài tháng. Mùi hương của rượu vang bị ảnh hưởng mạnh mẽ bởi thời gian ủ rượu và chất liệu thùng ủ
a, Khí nào được giải phóng trong quá trình lên men?
b, Muốn rượu có vị chua nhiều hơn, giảm bớt vị ngọt có thể làm như thế nào?
c, Quá trình lên men rượu vang có cần cung cấp nhiệt độ hay không? Tính biến thiên enthalpy chuẩn của phản ứng theo nhiệt tạo thành chuẩn của các chất (biết nhiệt tạo thành chuẩn của C6H12O6(s); C2H5OH(l); CO2(g)
có giá trị lần lượt là –1274 kJ/mol; –277,69 kJ/mol; –393,51 kJ/mol).
d, Tính lượng nhiệt tỏa ra hay thu vào khi lên men 3 kg nho (chứa khoảng 7% đường glucose) ở điều kiện chuẩn.
Dạng 1: Ôn tập lí thuyết
Câu 1: Phản ứng thu nhiệt là gì?
PHẦN TRẮC NGHIỆM
A. Là một loại phản ứng hóa học trong đó xảy ra sự truyền năng lượng, chủ yếu dưới dạng giải phóng nhiệt hoặc ánh sáng ra môi trường bên ngoài.
B. Là tổng năng lượng liên kết trong phân tử của chất đầu và sản phẩm phản ứng.
C. Là một loại phản ứng hóa học trong đó xảy ra sự hấp thụ năng lượng thường là nhiệt năng từ môi trường bên ngoài vào bên trong quá trình phản ứng.
D. Là năng lượng cần thiết để phá vỡ liên kết đó tạo thành nguyên tử ở thể khí.
Câu 2: Phản ứng hóa học trong đó có sự truyền năng lượng từ hệ sang môi trường xung quanh nó được gọi là
A. Phản ứng tỏa nhiệt.
C. Phản ứng trao đổi.
B. Phản ứng trung hòa.
D. Phản ứng thu nhiệt.
Câu 3: Phát biểu nào dưới đây là sai khi nói về phản ứng tỏa nhiệt?
A. Phản ứng tỏa nhiệt có giá trị biến thiên enthalpy nhỏ hơn 0.
B. Phản ứng tỏa nhiệt là phản ứng trong đó có sự hấp thu nhiệt năng từ môi trường.
C. Phản ứng tỏa nhiệt thường diễn ra thuận lợi hơn so với phản ứng thu nhiệt.
D. Phản ứng tỏa nhiệt năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm.
Câu 4: Trong phản ứng tỏa nhiệt, biến thiên enthalpy chuẩn luôn nhận giá trị
A. Dương.
C. Có thể âm có thể dương.
B. Âm.
D. Không xác định được.
Câu 5: Trong các quá trình sau, quá trình nào cho giá trị biến thiên enthalpy là dương?
1, Nhiệt độ tăng khi hòa tan calcium chloride vào nước.
2, Đốt cháy acetylen trong đèn hàn xì.
3, Nước sôi.
4, Sự thăng hoa của đá khô.
A. Quá trình 4. B. Quá trình 3 và 4.
C. Quá trình 1. D. Quá trình 2 và 3.
Câu 6: Enthalpy tạo thành chuẩn ( o f298 H ∆ ) được định nghĩa là

A. Lượng nhiệt kèm theo phản ứng khi ngâm 1 mol ion ở thể khí trong nước ở 25oC và 1 bar.
B. Lượng nhiệt kèm theo phản ứng tạo thành 1 mol hợp chất từ các đơn chất bền nhất ở 25oC và 1 bar.
C. Lượng nhiệt kèm theo phản ứng khi 1 mol nguyên tử khí được tạo thành từ các nguyên tố của nó ở 25oC và 1 bar.
D. Lượng nhiệt kèm theo phản ứng khi 1 mol electron bứt ra khỏi 1 mol nguyên tử thể khí ở trạng thái cơ bản ở 25oC và 1 bar.
Câu 7: Điều kiện chuẩn là
A. Áp suất 1 bar, 25oC, nồng độ 1 mol/L.
B. Áp suất 1 bar, 0oC, nồng độ 1 mol/L.
C. Áp suất 0 bar, 0oC, nồng độ 1 mol/L.
D. Áp suất 0 bar, 25oC, nồng độ 1 mol/L.
Câu 8: o r298 H ∆ là kí hiệu cho ...................của một phản ứng hóa học.
A. Nhiệt tạo thành chuẩn.
B. Năng lượng hoạt hóa.
C. Năng lượng tự do.
D. Biến thiên enthalpy chuẩn.
Câu 9: Khẳng định nào sau đây là đúng đối với phản ứng thu nhiệt?
A. Tổng giá trị nhiệt tạo thành chuẩn của các chất phản ứng và sản phẩm bằng nhau.
B. Tổng giá trị nhiệt tạo thành chuẩn của các chất tham gia lớn hơn tổng giá trị nhiệt tạo thành chuẩn của các sản phẩm .
C. Tổng giá trị nhiệt tạo thành chuẩn của các sản phẩm lớn hơn tổng giá trị nhiệt tạo thành chuẩn của các chất tham gia.
D. Tùy vào phản ứng thu nhiệt mà tổng giá trị nhiệt tạo thành chuẩn sản phẩm có thể bằng, nhỏ hơn hoặc lớn hơn nhiệt tạo thành chuẩn của chất tham gia.
Câu 10: Phản ứng của barium hydroxide và ammonium chloride làm cho nhiệt độ của hỗn hợp giảm. Phản ứng của barium hydroxide và ammonium chloride là phản ứng
A. Thu nhiệt. B. Hóa hợp.
C. Tỏa nhiệt. D. Phân hủy.
Câu 11: Khi calcium phản ứng với nước, nhiệt độ thay đổi từ 18°C đến 39°C. Phản ứng của calcium với nước là
A. phản ứng thu nhiệt. B. phản ứng phân hủy.
C. phản ứng tỏa nhiệt. D. phản ứng thuận nghịch.
Câu 12: Một phản ứng có o r298 H ∆ = -890,3 kJ/mol. Đây là phản ứng
A. Thu nhiệt. B. Tỏa nhiệt.
C. Phân hủy. D. Trao đổi.
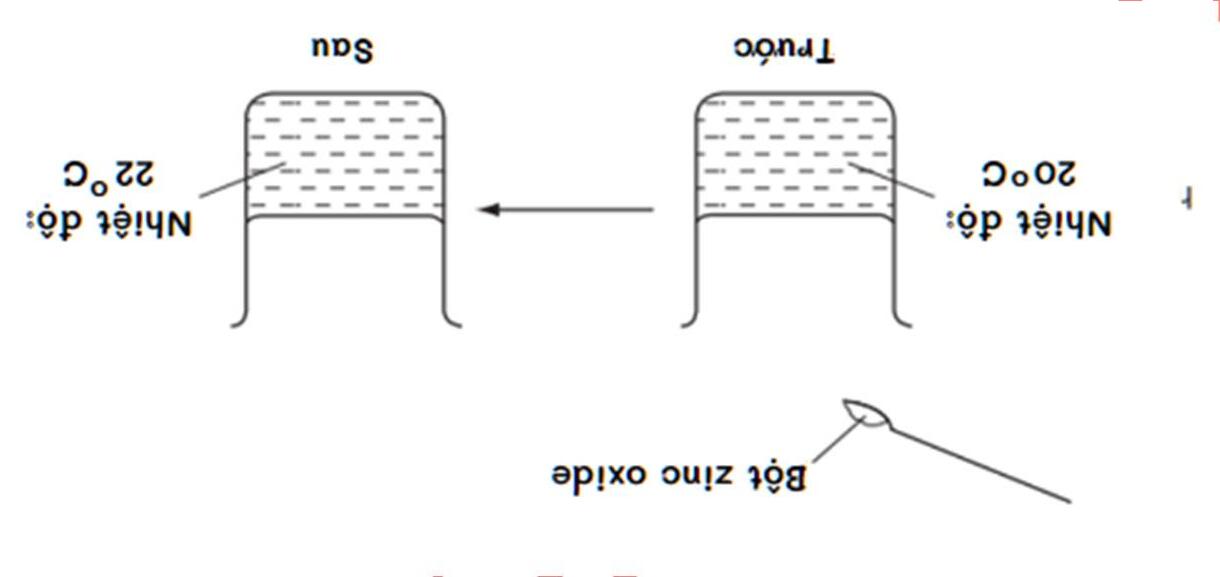
Câu 13: Tiến hành hòa tan zinc oxide vào dung dịch hydrochloric acid như hình vẽ 5.17. Phát biểu nào dưới đây là sai?
Hình 5.17. Quy trình hòa tan zinc oxide vào dung dịch hydrochloric acid
A. Trong quá trình phản ứng, nhiệt độ của phản ứng tăng.
B. Đây là phản ứng tỏa nhiệt.
C. Biến thiên enthalpy của phản ứng có giá trị âm.
D. Năng lượng của các chất phản ứng thấp hơn năng lượng của các chất sản phẩm.
Câu 14: Sự thay đổi nhiệt độ trong phản ứng của calcium oxide với nước được minh họa trong hình 5.18. Phản ứng của calcium với nước là
A. phản ứng thu nhiệt.
B. phản ứng phân hủy.
C. phản ứng tỏa nhiệt.
D. phản ứng thuận nghịch.
Hình 5.18. Sự thay đổi nhiệt độ khi calcium oxide với nước
Câu 15: Hình ảnh nào miêu tả quá trình đang diễn ra sự thu nhiệt?
A. Cây nến đang cháy B. Hòa tan đá vào nước
Câu 16: Phản ứng nào dưới đây là phản ứng thu nhiệt?
A. Quá trình đốt cháy ethanol.
B. Phản ứng phân hủy postassium chlorate.
C. Đốt nhiên liệu trong tên lửa.
D. Hòa tan sodium vào nước.
Câu 20: Cho một số phản ứng hóa học sau:
Methane + oxygen → carbon dioxide + nước
Sodium + nước → Sodium hydroxide + hydrogen
Magnesium + hydrochloric acid → magnesium chloride + hydrogen

Điểm chung của các phản ứng trên là
A. Đều là phản ứng đốt cháy. B. Đều là phản ứng thu nhiệt.
C. Đều là phản ứng tỏa nhiệt. D. Đều là phản ứng trung hòa.
Câu 21: Giản đồ hình 5.19. thể hiện sự biến thiên enthalpy trong một phản ứng hóa học.

C. Phản ứng của hydrochloric acid với sodium hydroxide.
D. Quá trình hô hấp ở thực vật.
Câu 17: Quá trình nào dưới đây là quá trình thu nhiệt?
A. Đốt cháy khí hydrogen.
B. Chưng cất dầu mỏ.
C. Phản ứng potassium với nước.
D. Sử dụng xăng trong động cơ ô tô.
Câu 18: Quá trình nào dưới đây không giải phóng nhiệt?
A. Đốt cháy nhiên liệu hóa thạch.
B. Nung đá vôi để thu được vôi sống.
C. Phản ứng cháy của acetylene với oxygen.
D. Phản ứng hydrogen với oxygen.
Câu 19: Đồ thị nào sau đây thể hiện đúng sự thay đổi nhiệt độ khi dung dịch hydrochloric acid được cho vào dung dịch sodium hydroxide tới dư?

Hình 5.19. Sơ đồ biểu diễn biến thiên enthalpy trong một phản ứng hóa học
Cho các phản ứng sau:
1. CH4 + 2O2 to → CO2 + 2H2O

2. 2H2 + O2 to → 2H2O
3. C + O2 to → CO2
Phản ứng nào phù hợp với giản đồ hình 5.
A. Phản ứng 1 và 2. B. Phản ứng 2 và 3.
C. Phản ứng 1, 2 và 3. D. Không phản ứng nào.
Câu 22: Biến thiên enthalpy chuẩn của một phản ứng được biểu thị tại hình 5.20. Kết luận nào sau đây là đúng với sơ đồ hình 5.

Hình 5.20. Sơ đồ biểu diễn biến thiên enthalpy của một phản ứng hóa học
A. Phản ứng trong hình 5. là phản ứng tỏa nhiệt.
B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng chất sản phẩm.
C. Biến thiên enthalpy của phản ứng là a kJ/mol.


D. Phản ứng trong hình 5. là phản ứng thu nhiệt.
Câu 23: Acetylene (C2H2) có khả năng phản ứng mãnh liệt với oxygen và sinh ra một lượng nhiệt lượng lớn lên đến 3000 oC. Vì vậy người ta có thể dùng acetylene để làm đèn hàn xì, cắt kim loại. Phát biểu nào dưới đây là đúng?

A. Phản ứng giữa acetylene và oxygen là phản ứng tỏa nhiệt.

B. Phản ứng giữa acetylene và oxygen là phản ứng thu nhiệt.
C. Phản ứng giữa kim loại và oxygen là phản ứng tỏa nhiệt.
D. Phản ứng giữa kim loại và acetylene là phản ứng thu nhiệt.
Câu 24: Khi hòa tan ammonium nitrate vào nước, nhiệt độ của nước giảm. Phát biểu nào dưới đây giải thích
đúng cho quá trình được miêu tả ở trên?
A. Ammonium nitrate tan được trong nước và quá trình này là phản ứng thu nhiệt.
B. Ammonium nitrate phản ứng với nước và quá trình này là phản ứng thu nhiệt.
C. Ammonium nitrate tan trong nước và quá trình này là phản ứng tỏa nhiệt.
D. Ammonium nitrate phản ứng với nước và quá trình này là phản ứng tỏa nhiệt.
Câu 25: Cho một ít bột copper (II) sulfate khan màu trắng vào cốc nước và khuấy đều. Dấu hiệu nào dưới đây cho biết đây là một quá trình tỏa nhiệt?
A. Một dung dịch màu xanh lam được tạo thành.
B. Khi sờ tay vào cốc cảm giác mát hơn so với cốc trước khi hòa tan copper (II) sulfate.
C. Khi sờ tay vào cốc cảm giác ấm hơn so với cốc trước khi hòa tan copper (II) sulfate.
D. Bột copper (II) sulfate tan được trong nước.
Câu 26: Cho các phát biểu sau về phản ứng tỏa nhiệt và phản ứng thu nhiệt.
1. Trong một phản ứng tỏa nhiệt, năng lượng giải phóng dưới dạng nhiệt.
2. Nhiệt độ của phản ứng thu nhiệt tăng lên vì nhiệt được thu vào.
3. Đốt methane trong không khí là một phản ứng tỏa nhiệt.
Các phát biểu đúng là
A. 1, 2 và 3. B. Chỉ 1 và 2.
C. Chỉ 1 và 3. D. Chỉ 2 và 3.
Câu 27: Dưới đây là mô tả về hai quá trình hóa học
1. Trong quá trình đốt cháy methane, năng lượng ...... 1 .......
2. Trong quá trình nhiệt phân potassium permanganate, năng lượng ...... 2 .......
Từ nào thích hợp để điền vào khoảng trống 1 và 2?
1 2
A Được giải phóng dưới dạng nhiệt. Được giải phóng dưới dạng nhiệt.
B Được giải phóng dưới dạng nhiệt. Được hấp thụ dưới dạng nhiệt.
C Được hấp thụ dưới dạng nhiệt. Được hấp thụ dưới dạng nhiệt.
D Không giải phóng. Được hấp thụ dưới dạng nhiệt.
Câu 28: Giản đồ biến thiên enthalpy chuẩn của phản ứng giữa magnesium và hydrochloric acid được biểu diễn ở hình 5.21.
B. Các sản phẩm có mức năng lượng thấp hơn mức năng lượng của các chất phản ứng.
C. Đây là phản ứng thu nhiệt.
D. Nhiệt độ tăng lên trong quá trình phản ứng.
Câu 29: Phát biểu nào dưới đây không đúng?
A. Quá trình đốt cháy ethanol, đốt cháy nhiên liệu là quá trình tỏa nhiệt.
B. Toàn bộ các phản ứng hóa học đều là phản ứng tỏa nhiệt.
C. Trong phản ứng tỏa nhiệt, enthalpy tạo thành của sản phẩm có giá trị lớn hơn hơn enthalpy tạo thành
của các chất phản ứng.
D. Phản ứng tỏa nhiệt làm nhiệt độ của môi trường xung quanh tăng lên
Câu 30: Phát biểu nào sau đây đúng với phản ứng sau?
2Fe + 3CO2 → Fe2O3 + 3CO o r298 H ∆ = +26,6 kJ
A. Có 26,6 kJ nhiệt được giải phóng khi một mol Fe tham gia phản ứng.
B. Có 26,6 kJ nhiệt được hấp thụ khi một mol Fe tham gia phản ứng.
C. Có 13,3 kJ nhiệt được giải phóng khi một mol Fe tham gia phản ứng.
D. Có 13,3kJ nhiệt được hấp thụ khi một mol Fe tham gia phản ứng.
Câu 31: Trường hợp nào sau đây là quá trình chuyển hóa từ hóa năng thành nhiệt năng?
A. Than được đốt để đun sôi nước.
B. Nước đá bốc hơi trong phòng kín.
C. Hòa tan đường saccazoro với nước cất.
D. Sử dụng pin mặt trời trong đời sống.
Câu 32: Cho các phát biểu sau:
(1) Nhiệt tạo thành chuẩn của các đơn chất bền đều bằng 0.
(2) o r298 H ∆ đại diện cho tổng năng lượng trao đổi trong phản ứng nên giá trị này có thể dương hoặc âm.
(3) o f298 H ∆ càng âm thì chất đó càng dễ phân hủy.
(4) Phản ứng nhiệt phân CaCO3 là phản ứng thu nhiệt.
(5) Phản ứng tỏa nhiệt xảy ra kém thuận lợi hơn phản ứng thu nhiệt.
Phát biểu đúng là
A. (1), (3), (5). B. (2), (4), (5).
C. (1), (2), (4). D. (2), (3), (4).
Câu 33: Than chì có thể chuyển hóa thành kim cương trong điều kiện nhiệt độ cao, áp suất cao và có chất xúc
tác. Đây là một phản ứng thu nhiệt. Phát biểu nào dưới đây là đúng?
A. Than chì bền hơn kim cương.
B. Năng lượng toàn phần của than chì lớn hơn năng lượng của kim cương cùng khối lượng.
C. Quá trình trên là sự biến đổi vật lý.
D. Phản ứng có biến thiên enthalpy mang giá trị âm.
Câu 34: Phản ứng đốt cháy than xảy ra như sau: C(s) + O2(g)→ CO2(g). Enthalpy hình thành của CO2 là353,61 (kJ/mol). Biến thiên enthalpy (kJ) của phản ứng khi tạo thành một mol CO2 có giá trị

A. -353,61.
C. -707,22.
B. +353,61.
D. +707,22.
Hình 5.21. Sơ đồ biểu diễn biến thiên enthalpy chuẩn của phản ứng giữa magnesium và hydrochloric acid
Phát biểu nào dưới đây không đúng khi nói về phản ứng trong hình 5. ?
A. Phản ứng giải phóng năng lượng dưới dạng nhiệt.
Câu 35: Dựa vào phương trình nhiệt hóa học của các phản ứng sau:
ZnSO4(s) → ZnO(s) + SO3(g)
3H2(g) + N2(g) → 2NH3(g)
o r298 H ∆ = +235,21 kJ (1)
o r298 H ∆ = -91,8 kJ (2)
2H2S(g) + SO2(g)→ 2H2O(g) + 3S(s) o r298 H ∆ = -237 kJ (3)
H2O(g) →H2 + 1/2O2(g) o r298 H ∆ = +241,8 kJ (4)
Cặp phản ứng thu nhiệt là
A. (1) và (4). B. (1) và (2).
C. (1) và (4). D. (2) và (3).
Câu 36: Để phân hủy 1 mol H2O(g) ở điều kiện chuẩn theo phương trình H2O(g) → H2(g) + 1/2O2(g) cần
cung cấp một lượng nhiệt là 241,8 kJ. Giá trị biến thiên enthalpy của phản ứng 2H2(g) + O2(g) → 2H2O(g) là
A. -241,8 kJ.
C. +241,8 kJ.
B. +483,6 kJ.
D. -483,6 kJ.
Câu 37: Nung nóng hai ống nghiệm chứa NaHCO3 và P thấy phản ứng hóa học xảy ra như sau:
2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g) (1)
4P(s) + 5O2(g) → 2P2O5(s) (2)
Khi ngừng đun nóng phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra. Nhận định nào dưới đây là đúng?
A. Phản ứng (1) tỏa nhiệt, phản ứng (2) thu nhiệt.
B. Phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt.
C. Cả 2 phản ứng đều tỏa nhiệt.
D. Cả 2 phản ứng đều thu nhiệt.
Dạng 2: Tính biến thiên enthalpy chuẩn của phản ứng qua nhiệt tạo thành
Câu 38: Khi tạo ra 1 mol HCl từ các đơn chất bền có giải phóng ra một lượng nhiệt là 91,98 kJ/mol. Nếu phân
huỷ 365 gam khí HCl thành các đơn chất thì lượng nhiệt kèm theo quá trình đó là bao nhiêu ?
A. + 459,9 kJ.
C. - 919,8 kJ.
Câu 39: Phản ứng đốt cháy methane xảy ra như sau:
CH4(g) + 2O2(g) o t → CO2(g) + 2H2O(l)
B. - 459,9 kJ.
D. + 919,8 kJ.
Giá trị biến thiên enthalpy phản ứng tính theo enthalpy tạo thành có giá trị là
(biết enthalpy tạo thành chuẩn của các chất CH4(g)= -74,8 kJ/mol; CO2(g)= -393,5 kJ/mol; H2O(l)= -285,8 kJ/mol).
A. - 604,5 kJ.
C. - 997,7 kJ.
B. + 890,3 kJ.
D. - 890,3 kJ.
Câu 40: Đốt cháy 3,6 gam butanol (C4H9OH) thấy có 134 kJ nhiệt được giải phóng. Biến thiên enthalpy của quá trình đốt cháy 1 mol butanol là
A. -134 kJ/mol.
C. -2754,44 kJ/mol.
B. 2754,44 kJ/mol.
D. -268 kJ/mol.
Câu 41: Propane (C3H8) là một hydrocarbon phổ biến thường được dùng làm nhiên liệu do quá trình cháy giải phóng lượng nhiệt lớn. Khi đốt cháy 1 mol propane thì giải phóng −2219,2 kJ nhiệt lượng. Nhiệt tạo thành chuẩn của propane là (biết nhiệt tạo thành chuẩn của H2O(l) = −285,8 kJ/ mol; CO2(g) = −393,5 kJ/mol).
A. +1539,9 kJ.
C. -104,5 kJ.
B. –1539,9 kJ.
D. +212,2 kJ.
Câu 42: Hydrogen peroxide, H2O2 được sử dụng để cung cấp lực đẩy cho tên lửa do dễ dàng bị phân hủy theo phương trình: 2H2O2(l)→ 2H2O(g) + O2(g). Lượng nhiệt được tạo ra khi phân hủy chính xác 1 mol H2O2 ở

điều kiện chuẩn là (biết nhiệt tạo thành chuẩn của H2O(g) = −241,8 kJ/ mol; H2O2(l) = −187,8 kJ/mol).
A. -108 kJ.
C. +54 kJ.
Câu 43: Thực vật sử dụng quá trình quang hợp để chuyển đổi năng lượng
ánh sáng từ mặt trời thành năng lượng hóa học. Trong quá trình quang hợp xảy ra phản ứng giữa khí carbonic và nước theo phương trình hóa học
6CO2(g) + 6H2O(l)→ C6H12O6(aq) + 6O2(g)
Biến thiên enthalpy chuẩn của phản ứng có giá trị là (cho enthalpy tạo thành
chuẩn của CO2(g) = -393,5 kJ/mol; H2O(l) = -285,8 kJ/mol; C6H12O6(aq) = -1271 kJ/mol). Hình 5.22. Quá trình quang hợp
A. –591,7 kJ.
B. –2804,8 kJ.
C. +591,7 kJ. D. +2804,8 kJ.
Câu 44: NO2(g) được hình thành từ sự kết hợp của NO(g) và O2(g) theo phản ứng sau: 2NO(g) + O2(g) → 2NO2(g)
Biến thiên enthalpy chuẩn của phản ứng có giá trị (cho enthalpy tạo thành chuẩn của O2(g): 0 kJ/mol; NO(g): 90,25 kJ/mol; NO2(g): 33,18 kJ/mol).
A. –57,07 kJ. B. –114,14 kJ.
C. +57,07 kJ. D. +114,14 kJ.
Câu 45: Nhiệt lượng tỏa ra từ quá trình đốt cháy 6,44 gam sulfur trong oxygen theo phương trình: 2S(s) + 3O2(g) ot → 2SO3(l) o r298 H ∆ = -791,4 kJ có giá trị là
A. +395,7 kJ.
C. -79,63 kJ.
B. - 395,7 kJ.
D. +79,63 kJ.
Câu 46: Phản ứng giữa hydrogen và bromine xảy ra như sau: H2(g) + Br2(g) → 2HBr(g) cần cung cấp 72,80 kJ nhiệt lượng. Nhiệt lượng cần cung cấp khi lấy 38,2 gam bromine phản ứng với hydrogen là?
A. +36,40 kJ.
C. -36,40 kJ.
B. 8,69 kJ.
D. 17,38 kJ.
Xét phản ứng sau: 2Mg(s) + O2(g) → 2MgO (s) có o r298 H ∆ = -1204 kJ. Dựa trên thông tin thu được từ phản ứng trả lời câu hỏi từ
Câu 47: Phản ứng trên thuộc loại phản ứng
A. thu nhiệt. B. trao đổi.
C. tỏa nhiệt. D. trung hòa.
Câu 48: Nhiệt phản ứng khi đốt cháy 2,4 gam Mg theo phản ứng trên là
A. -60,2 kJ. B. +60,2 kJ.
C. +120,4 kJ. D. -120,4 kJ.
Câu 49: Nếu biến thiên enthalpy của phản ứng là 90,3 kJ thì có bao nhiêu gam MgO được tạo ra?
A. 6 gam. B. 12 gam.
C. 4 gam. D. 16 gam.
Câu 50: Biến thiên enthalpy chuẩn của quá trình hóa hơi của hơi nước H2O(l) → H2O(g) có giá trị o r298 H ∆ = +44 kJ/mol. Sử dụng dữ kiện trả lời các câu hỏi từ
Câu 51: Biến thiên enthalpy khi làm bay hơi 3 mol nước là
A. +132 kJ. B. +44 kJ.
C. -132 kJ. D. -44 kJ.
Câu 52: Biến thiên enthalpy khi làm bay hơi 27 gam nước là
A. +66 kJ. B. +1188 kJ.
C. -66 kJ. D. +132 kJ.
B. –54 kJ.
D. +108 kJ.
21
Câu 53: Khi đốt cháy glucose (C6H12O6) thấy giải phóng -2816 kJ/mol nhiệt lượng ở 25oC. Enthalpy tạo thành chuẩn của C6H12O6 nhận giá trị là (biết enthalpy tạo thành chuẩn của CO2(g) và H2O(l) lần lượt là -393,5 kJ/mol và - 285,9 kJ/mol).
A. +1260,4 kJ. B. -2136,6 kJ.
C. -1260,4 kJ. D. +2136,6 kJ.
Câu 54: Một số khu vực trên thế giới như miền nam California và Ả Rập Saudi đang rơi vào tình trạng thiếu nước ngọt để uống. Một giải pháp khả thi cho vấn đề là đưa các tảng băng trôi khỏi Nam Cực và sau đó làm tan chảy chúng khi cần thiết. Nếu biến thiên enthalpy chuẩn của chuyển hóa băng trôi thành nước là 6,01 kJ/mol đối với phản ứng ở 0°C và áp suất không đổi: H2O(s) →H2O(l). Cần bao nhiêu năng lượng để làm tan chảy một tảng băng lớn vừa phải có khối lượng 1,00 triệu tấn (1.106 tấn)?
A. +6,01.106 kJ.
C. -6,01.106 kJ.
B. -3,34. 1011 kJ.
D. +3,34. 1011 kJ.
Câu 55: Tiến hành đốt cháy 1 mol benzene ở điều kiện chuẩn, phản ứng sinh ra CO2(g), H2O(l) đồng thời giải phóng 3267 kJ nhiệt lượng. Enthalpy tạo thành chuẩn của benzene nhận giá trị là (biết enthalpy tạo thành

chuẩn của CO2(g) và H2O(l) lần lượt là -393,5 kJ/mol; -285,83 kJ/mol).

A. -48,51 kJ/mol. B. -24,5 kJ/mol.
C. +48,51 kJ/mol. D. +24,5 kJ/mol.
Dạng 3: Tính biến thiên enthalpy chuẩn của phản ứng qua năng lượng liên kết.
Câu 56: Hydrogen phản ứng với chlorine để tạo thành hydrogen chloride theo phương trình
H2(g) + Cl2(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng có giá trị là
(Biết năng lượng liên kết E(H-H) = 436 kJ/mol, E(Cl-Cl) = 243 kJ/mol, E(H-Cl) = 432kJ/mol).
A. + 185kJ/mol.
C. + 92,5kJ/mol.
B. −185 kJ/mol.
D. −92,5 kJ/mol.
Câu 57: Giản đồ hình 5.23. thể hiện biến thiên enthalpy của quá trình đốt cháy methane trong không khí. Ý
nào thể hiện đúng thông tin về sơ đồ hình 5.23?
Hình 5.23. Sơ đồ biến thiên enthalpy của quá trình đốt cháy methane trong không khí
Phương trình Biến thiên enthalpy (kJ/mol)
A. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) +891
B. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) -891

C. CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) +891
D. CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) -891
Câu 58: Chlorine phản ứng với ethane để tạo ra chloroethane và hydrogen chloride theo phương trình
Biến thiên enthalpy chuẩn của phản ứng tính theo năng lượng liên kết nhận giá trị nào dưới đây? Biết năng lượng liên kết của một số loại liên kết được cho trong bảng sau.
Liên kết Năng lượng liên kết (kJ/mol)
C-Cl +340
C-C +350
C-H +410
Cl-Cl +240
H-Cl +430
A. +230 kJ/mol. B. −840 kJ/mol.
C. +840 kJ/mol. D. −230 kJ/mol.
Câu 59: Ammonia được tạo ra bằng cách cho nitrogen phản ứng với hydrogen với sự có mặt của chất xúc tác là iron. Phương trình phản ứng tạo ammonia diễn ra như sau:
N2(g) + 3H2(g) → 2NH3(g)
Biến thiên enthalpy chuẩn của phản ứng tính theo năng lượng liên kết nhận giá trị nào dưới đây? Biết năng lượng liên kết của một số loại liên kết được cho trong bảng sau.
Liên kết Năng lượng liên kết (kJ/mol)
N≡N 945
N-H 390
H-H 436
A. –4593 kJ/mol.
C. –959 kJ /mol.
B. –1083kJ/mol.
D. –87 kJ/mol.
Câu 60: Biến thiên enthalpy của phản ứng 2H2(k) + O2(k) → 2H2O(k) tính theo năng lượng liên kết có biểu thức tính là (nếu coi Eb(H-H) = x, Eb(O=O) = y, Eb (O - H) = z)
A. 2x + y - 2z.
B. 4z - 2x – y.
C. 2x + y - 4z. D. 2z - 2x – y.
Câu 61: Nitrogen trifluoride (NF3) là nguyên liệu được sử dụng trong việc sản xuất pin mặt trời. Phương trình hình thành nitrogen trifluoride được biểu diễn như sau:
N2(g) + 3F2(g) → 2NF3(g)
Sử dụng bảng năng lượng liên kết cho biết biến thiên enthalpy chuẩn của phản ứng nhận giá trị nào dưới đây?
Loại liên kết Năng lượng liên kết (kJ/mol) Hình 5.24. Pin mặt trời
N≡N +950
F-F +150
N-F +280
A. -560 kJ/mol. B. -280 kJ/mol.
C. +280 kJ/mol. D. +3080 kJ/mol.
Câu 62: Hydrogen bromide bị phân hủy tạo thành hydrogen và bromine theo phương trình
2HBr(g) → H2(g) + Br2(g). Năng lượng liên kết của các liên kết được cho trong bảng sau. Biến thiên entahlpy
của phản ứng là
Loại liên kết Năng lượng liên kết (kJ/mol)
Br-Br +193
H-Br +366
H-H +436
A. +263 kJ/mol. B. +103 kJ/mol.
C. -103 kJ/mol. D. -263 kJ/mol.
Câu 63: Hydrazine (N2H4) bị phân hủy như sau:

Biến thiên enthalpy chuẩn của phản ứng được xác định là –99 kJ/mol.
Năng lượng liên kết của liên kết N – N là bao nhiêu? Biết năng lượng liên kết của một số loại liên kết được cho trong bảng sau.
Liên kết Năng lượng liên kết (kJ/mol)
N≡N 946
N-H 389
H-H 436
A. 163 kJ/mol.
C. 348 kJ/mol.
B. 315 kJ/mol.
D. 895 kJ/mol.
NG ĐÁP ÁN
CHUYÊN ĐỀ 05: NĂNG LƯỢNG HÓA HỌC
A.CÂUHỎITỰ LUẬN
Câu1:Hoànthànhcácnộidungsau:
- Năng lượng giải phóng khi xảy ra phản ứng hóa học gọi là...............................................
- Phản ứng tỏa nhiệt là ....................................................................................................................................................
- Phản ứng thu nhiệt là ..............................................
- Điều kiện chuẩn là...............................................
- Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất là .......................................................................
............................................................................................................................, kí hiệu là ..........................................
- Biến thiên enthalpy chuẩn của một phản ứng hóa học là .............................................. .................................................., kí hiệu là .............................................
- Phương trình nhiệt hóa học là .....................................................................................................................................
Câu2: Điềnthôngtincònthiếuvà đánhdấu ٧ (có, đúng)vàoôtrốngthíchhợptrongbảngsau:
Bảng1
STT Quátrình Phản ứngtỏanhiệt Phản ứngthunhiệt
1 Phản ứng tạo gỉ sắt
2 Sự tiêu hóa thức ăn.
3 Quá trình chạy của con người.
4 Khí CH4 đốt ở trong lò.
5 Hòa tan KBr vào nước làm cho nước trở nên lạnh.
6 Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên.
7 Gas (hỗn hợp C4H10 và CH4) cháy
8 Nhiệt phân Cu(OH)2 tạo thành CuO.
9 Hàn đường ray xe lửa bằng phản ứng nhiệt nhôm
10 Khi thả viên vitamin C sủi vào cốc nước để giải khát.
11 Nung đá vôi (CaCO3)
12 Nhiệt phân potassium chlorate (KClO3)
13 Cho 5 gam CaO vào cốc chứa 25 ml nước.
14 Đốt cháy than, củi, cồn (C2H5OH)
15 Quá trình quang hợp của cây xanh.
16 Luộc chín quả trứng.
17 Hòa tan muối ăn vào nước thấy cốc nước trở nên mát.
18 Muối kết tinh từ nước biển ở các ruộng muối.
19 Giọt nước đọng lại trên lá cây vào ban đêm.
20 Nước đóng băng
1 0 38222r298 CH(g)5O(g)3CO(g)4HO(l)H2220kJ +→+∆=−
2 o1 22f298 1 2Na(s)O(g)NaO(s)H417,98kJmol
2 +→∆=−
3 o 4222r298 CH(g)2O(g)CO(g)2HO(l)H890,36kJ +→+∆=−
4 →+∆= o 32r298 CaCO(s)CaO(s)CO(g)H178,29kJ
5 o 2r298 NaOH(aq)HCl(aq)NaCl(aq)HO(l)H57,9kJ +→+∆=−
6 o1 22r298 H(g)I(s)2HI(g)H52,96kJmol +→∆=
7 o 26222r298 7 CH(g)O(g)2CO(g)3HO(l)H1559,7kJ 2 +→+∆=−
8 0 o 22r298 1 C(s)O(g)CO(g)H393,5kJ/mol 2 +→∆=−
9 o to 22r298 2S(s)O(g)2SO(g)H296,8kJ/mol +→∆=−
10 0 410222r298 13 CH(g)O(g)4CO(g)5HO(l)H2874kJ 2
11 +→+∆=− o 3222r298 4NH(g)3O(g)2N(g)6HO(l)H1531 kJ
12 →++∆=+ o 32322r298 2NaHCO(s)NaCO(s)CO(g)HO(g)H20,33 kJ
13 +→+∆=− o 2323r298 2AlFeOAlO2FeH851,5 kJ
14 +→∆=− o 24226r298 CH(g)H(g)CH(g)H137,0 kJ
15 o to 22r298 N(g)O(g)2NO(g)H180kJ
Câu 4: Sự hô hấp cung cấp oxygen cho các phản ứng oxi hóa chất béo, chất đường, tinh bột,… trong cơ thể con người. Đó là các phản ứng giải phóng hay hấp thụ năng lượng? Năng lượng kèm theo các phản ứng này dùng để làm gì?
b. Trong phản ứng xác định nhiệt tạo thành của CO2(g): C(s) + O2(g) → CO2(g). Carbon ở dạng kim cương hay graphite?
Câu 12: Thực hiện thí nghiệm sau, nêu hiện tượng xảy ra, rút ra kết luận về sự thay đổi nhiệt độ chất lỏng trong
cốc, giải thích?
- Bước 1: Cho khoảng 25 mL nước cất vào cốc chịu nhiệt, đặt bầu nhiệt kế vào trong lòng chất lỏng, ghi nhận giá trị nhiệt độ
- Bước 2: Cân khoảng 5 gam CaO. Cho nhanh CaO vào cốc, bắt đầu bấm giờ và ghi nhận nhiệt độ, đồng thời dùng
đũa thủy tinh khuấy nhẹ.
- Bước 3: Ghi nhận giá trị nhiệt độ sau khoảng 2 phút.
Câu5:
a. Enthalpy tạo thành của hợp chất là gì?
b. Biến thiên anthalpy trong các phản ứng hóa học là gì?
c. Enthalpy tạo thành khác với enthalpy tạo thành chuẩn ở điểm nào?
d. Tại sao enthalpy tạo thành chuẩn của đơn chất lại bằng không?
Câu6: Cho 2 sơ đồ biểu diễn sự thay đổi nhiệt độ theo thời gian của phản ứng (1) và (2). Sơ đồ nào chỉ quá trình thu nhiệt và sơ đồ nào chỉ quá trình tỏa nhiệt. Giải thích.
B.HỆ THỐNGCÂUHỎITRẮCNGHIỆM
● Cấp độ nhận biết, thông hiểu
Câu1: Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất kí hiệu là
A. o f298 H ∆ B. o t298 H ∆ C. o g298 H ∆ D. o r298 H ∆
Câu2: Biến thiên enthalpy chuẩn của một phản ứng hóa học kí hiệu là
A. o f298 H ∆ . B. o r298 H ∆ . C. o g298 H ∆ . D. o t298 H ∆ .
Câu3: Phản ứng nào sau đây là phản ứng tỏa nhiệt?
A. o 22r298 2S(s)O(g)2SO(g)H296,8kJ +→∆=−
B. →+∆= o 32r298 CaCO(s)CaO(s)CO(g)H178,29kJ .
C. +→∆= o 22r298 H(g)I(s)2HI(g)H52,96kJ
D. o t o 22r298 N(g)O(g)2NO(g)H180kJ
Câu4: Phản ứng nào sau đây là phản ứng thu nhiệt?
A. 0 38222r298 CH(g)5O(g)3CO(g)4HO(l)H2220kJ +→+∆=−
Sơ đồ (1)
Sơ đồ (2)
Câu7: Phân biệt enthalpy tạo thành của một chất và biến thiên enthalpy của phản ứng. Lấy ví dụ minh họa.
Câu8: Khi đun nóng ống nghiệm đựng KMnO4 (thuốc tím), nhiệt của ngọn lửa làm cho KMnO4 bị nhiệt phân, tạo hỗn hợp bột màu đen: 2KMnO4 → K2MnO4 + MnO2 + O2. Phản ứng này toả nhiệt hay thu nhiệt, vì sao?

Câu9: Phản ứng giữa khí nitrogen và oxygen chỉ xảy ra ở nhiệt độ cao (3000oC) hoặc nhờ tia lửa điện:
N2(g) + O2(g) → 2NO(g)
a. Phản ứng trên toả nhiệt hay thu nhiệt?
b. Bằng kiến thức về năng lượng liên kết trong phân tử trong phân tử các chất, hãy giải thích vì sao phản ứng trên khó xảy ra?
Câu10: Phân tử hemoglobin (Hb) trong máu nhận O2 ở phổi để chuyển thành HbO2. Chất này theo máu tới các bộ phận cơ thể, tại đó HbO2 lại chuyển thành Hb và O2 (để cung cấp O2 cho các hoạt động sinh hóa cần thiết trong cơ thể). Nếu trong không khí có lẫn carbon monoxide (CO), cơ thể nhanh chóng bị ngộ độc. Cho các số liệu thực nghiệm sau:
Hb + O2 → HbO2 o r298 H ∆ = - 33,05 kJ (1)
Hb + CO → HbCO o r298 H ∆ = -47,28 kJ (2)
HbO2 + CO → HbCO + O2 o r298 H ∆ = -14,23 kJ (3)
HbCO + O2 → HbO2 + CO o r298 H ∆ = 14,23 kJ (4)
Liên hệ giữa các mức độ thuận lợi các phản ứng (qua o r298 H ∆ ) với những vấn đề thực nghiên nêu trên.
Câu11: Cho phản ứng: C(kim cương) → C(graphite) o r298H1,9kJ∆=− a. Ở điều kiện chuẩn, kim cương hay graphite có mức năng lượng thấp hơn?
B. o 2r298 NaOH(aq)HCl(aq)NaCl(aq)HO(l)H57,9kJ +→+∆=− .
C. o 4222r298 CH(g)2O(g)CO(g)2HO(l)H890,36kJ +→+∆=−
D. o 42r298 ZnSO(s)ZnO(s)SO(g)H235,21kJ
Câu5: Dựa vào phương trình nhiệt hóa học của phản ứng sau: o 2222r298 o 22r298
(1)CS(l)3O(g)2SO(g)CO(g)H1110,21kJ 1
(2)CO(g)CO(g)O(g)H280kJ 2
(3)2Na(s)2HO(l)2NaOH(aq)H(s)H367,5kJ
(4)ZnSO(s)ZnO(s)SO(g)H235,21kJ
o 2 2r298 o 42r298
Cặp phản ứng thu nhiệt là:
A. (1) và (2). B. (3) và (4). C. (1) và (3). D. (2) và (4).
Câu6: Phát biểu nào sau đây sai?
A. Hầu hết các phản ứng thu nhiệt cần giai đoạn khơi mào (đun, đốt nóng,…).
B. Hầu hết các phản ứng tỏa nhiệt cần phải tiếp tục đun hoặc đốt nóng ở giai đoạn tiếp diễn.
C. Hầu hết các phản ứng tỏa nhiệt không cần phải tiếp tục đun hoặc đốt nóng ở giai đoạn tiếp diễn.
D. Tùy phản ứng cụ thể mà các phản ứng tỏa nhiệt có thể cần hoặc không cần giai đoạn khơi mào.
Câu7: Phát biểu nào sau đây đúng?
A. Phản ứng thu vào càng nhiều nhiệt, biến thiên enthalpy càng âm.
B. Phản ứng tỏa ra càng nhiều nhiệt, biến thiên enthaply càng dương.
C. Năng lượng của hệ chất tham gia trong phản ứng tỏa nhiệt cao hơn năng lượng của hệ sản phẩm.
D. Năng lượng của hệ chất tham gia trong phản ứng thu nhiệt cao hơn năng lượng của hệ sản phẩm.
Câu8: Phản ứng nào sau đây cần phải cung cấp năng lượng trong quá trình phản ứng?
A. Phản ứng tạo gỉ kim loại.
C. Phản ứng nhiệt phân.
B. Phản ứng quang hợp.
D. Phản ứng tạo oxit Na2O.
Câu9: Phản ứng nào sau đây không cần cung cấp năng lượng trong quá trình phản ứng?
A. Oxi hóa C bằng O2
C. Oxi hòa Fe bằng S.
Câu10: Phản ứng nào sau đây là phản ứng toả nhiệt?
A. Phản ứng nhiệt phân muối KNO3
B. Phản ứng phân huỷ khí NH3
C. Phản ứng oxi hoá glucose trong cơ thể
D. Phản ứng hoà tan NH4Cl trong nước.
B. Oxi hóa Hg bằng S.
D. Oxi hóa S bằng O2
Câu11: Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
A. Phản ứng nhiệt phân Cu(OH)2
B. Phản ứng giữa H2 và O2 trong hỗn hợp khí.
C. Phản ứng giữa Zn và dung dịch H2SO4
D. Phản ứng đốt cháy cồn.
Câu12: Những quá trình nào sau đây là tỏa nhiệt:
A. Cranking alkane, hô hấp, quang hợp.
B. Phản ứng nhiệt nhôm, phản ứng oxi hóa – khử, băng tan.
C. Phản ứng oxi hóa – khử, phản ứng trung hoà, phản ứng nhiệt nhôm.
D. Nước lỏng bay hơi, phản ứng oxi hóa, phản ứng nhiệt nhôm.
Câu13: Phản ứng nào dưới đây là phản ứng thu nhiệt?
A. Nung NH4Cl tạo ra HCl và NH3
C. Đá vôi tác dụng với dung dịch HCl.
Câu14: Phản ứng nào dưới đây là phản ứng tỏa nhiệt?
A. Hòa tan H2SO4 đặc trong nước.
C. Cranking alkane.
Câu15: Điều kiện nào sau đây là điều kiện chuẩn?
A. Áp suất 1 bar và nhiệt độ 25oC hay 298K.
B. Áp suất 1 bar và nhiệt độ 298K.
C. Áp suất 1 bar và nhiệt độ 25oC.
D. Áp suất 1 bar và nhiệt độ 25K.
Câu16: Phát biểu nào sau đây đúng?
B. Cồn cháy trong không khí.
D. Sự phân hạch hạt nhân.
B. Hòa tan NH4Cl trong nước.
D. Nước lỏng bay hơi.
A. Điền kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol 1 L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K.
B. Điều kiện chuẩn là điều kiện ứng với nhiệt độ 298K.
C. Áp suất 760 mmHg là áp suất ở điều kiện chuẩn.
D. Điều kiện chuẩn là điều kiện ứng với áp suất 1atm, nhiệt độ 0oC.
Câu17: Enthalpy tạo thành chuẩn của một đơn chất bền
A. là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đó với hydrogen.
B. là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đó với oxygen.
C. được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
D. bằng 0.
Câu18: Nung KNO3 lên 550oC xảy ra phản ứng: 322 1 KNO(s)KNO(s)O(g) 2 →+
Phản ứng nhiệt phân KNO3 là:
A. toả nhiệt, có ∆H < 0.
B. thu nhiệt, có ∆H > 0.
C. toả nhiệt, có ∆H > 0. D. thu nhiệt, có ∆H < 0.
Câu19: Phản ứng dưới đây có đặc điểm là o to 222r298 2H(g)O(g)2HO(l)H571,68kJ +→∆=−
A. thu nhiệt.
B. tỏa nhiệt.
C. không có sự thay đổi năng lượng.
D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
Câu20: Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau: o o 22r298 N(g)O(g)2NO(g)H180kJ/mol +→∆=+
Kết luận nào sau đây đúng?
A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
B. Phản ứng tỏa nhiệt.
C. Phản ứng xảy ra thuận lợi ở điều kiện thường.
D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
Câu21: Nung nóng hai ống nghiệm chứa NaHCO3 và P, xảy ra các phản ứng sau:
2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g) (1)
4P(s) + 5O2(g) → 2P2O5(s) (2)
Khi ngừng đun nóng, phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra, chứng tỏ
A. phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
B. phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
C. cả 2 phản ứng đều toả nhiệt.
D. cả 2 phản ứng đều thu nhiệt.
Câu22: Dựa vào phương trình nhiệt hóa học của phản ứng sau: o 22r298 1 CO(g)CO(g)O(g)H280kJ 2 →+∆=+
Giá trị o r298 H ∆ của phản ứng: 22 2CO(g)2CO(g)O(g) →+ là
A. +140 kJ. B. -1120 kJ. C. +560 kJ. D. -420 kJ.
Câu23: Dựa vào phương trình nhiệt hóa học của phản ứng sau: o 2342r298
3Fe(s)4HO(l)FeO(s)4H(g)H26,32kJ +→+∆=+
Giá trị o r298 H ∆ của phản ứng: 3422 FeO(s)4H(g)3Fe(s)4HO(l) +→+ là
A. -26,32 kJ. B. +13,16 kJ. C. +19,74 kJ. D. -10,28 kJ.
Câu24: Cho phản ứng hoá học xảy ra ở điều kiện chuẩn sau: NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có o f298 H ∆ tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
A. toả nhiệt, NO2 bền vững hơn N2O4. B. thu nhiệt, NO2 bền vững hơn N2O4.
C. toả nhiệt, N2O4 bền vững hơn NO2. D. thu nhiệt, N2O4 bền vững hơn NO2.
Câu25: Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn sau đây giải phóng 184,6kJ: 22 H(g)Cl(g)2HCl(g)(*) +→
Những phát biểu nào dưới đây là đúng?
A. Nhiệt tạo thành của HCl là – 184,6 kJ 1 mol.
B. Biến thiên enthalpy phản ứng (*) là 184,6 kJ.
C. Nhiệt tạo thành chuẩn của HCl là – 92,3 kJ 1 mol.
D. Biến thiên enthalpy phản ứng (*) là – 92,3 kJ.


● Cấp độ vận dụng
Câu26: Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới. Kết luận nào sau đây là đúng?
Câu30: Cho các quá trình sau:
(a) Đốt một ngọn nến.
(b) Nước đóng băng.
(c) Hòa tan muối ăn vào nước thấy cốc nước trở nên mát.
(d) Luộc chín quả trứng.
(e) Đổ mồ hôi sau khi chạy bộ
Số quá trình tỏa nhiệt là
A. 3. B. 2. C. 1. D. 4.
Câu31: Cho các quá trình sau:
(a) Hòa tan một ít bột giặt trong tay với nước, thấy tay ấm.
(b) Thực phẩm đóng hộp tự sôi.
(c) Muối kết tinh từ nước biển ở các ruộng muối.
(d) Giọt nước đọng lại trên lá cây vào ban đêm.
(e) Pha loãng axit H2SO4 đặc.
Số quá trình thu nhiệt là
A. 3. B. 2. C. 1. D. 4.
A. Phản ứng tỏa nhiệt.
B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm.
C. Biến thiên enthalpy của phản ứng là a kJ/mol.
D. Phản ứng thu nhiệt.
Câu27: Đồ thị nào say đây thể hiện đúng sự thay đổi nhiệt độ khi dung dịch hydrochloric acid được cho vào dung dịch sodium hydroxide tới dư?



Câu32: Cho các phát biểu sau:
(a) Trong phòng thí nghiệm, có thể nhận biết một phản ứng thu nhiệt hoặc tỏa nhiệt bằng cách đo nhiệt độ của phản
ứng bằng một nhiệt kế
(b) Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng thu nhiệt.
(d) Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng tỏa nhiệt.
(d) Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng tỏa nhiệt.
(e) Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng thu nhiệt.
Số phát biểu không đúng là
A. 4. B. 2. C. 3. D. 5.
Câu33: Cho các phát biểu sau:
(a) Tất cả các phản ứng cháy đều tỏa nhiệt.
(b) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(c) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt.
(d) Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
(e) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng.
Câu28: Cho các phát biểu sau:
(a) Phản ứng nhiệt nhôm là phản ứng tỏa nhiệt.
(b) Quang hợp là phản ứng tỏa nhiệt.
(c) Hô hấp là phản ứng thu nhiệt.
(d) Phản ứng trung hòa là phản ứng tỏa nhiệt.
Số phát biểu đúng là
Câu29: Cho các loại phản ứng sau:
(a) Phản ứng tạo gỉ kim loại.
(b) Phản ứng quang hợp.
(c) Phản ứng nhiệt phân.
(d) Phản ứng đốt cháy.
(e) Phản ứng thủy phân collagen thành gelatin (là một loại protein dễ tiêu hóa) diễn ra khi hầm xương động vật.
Có bao nhiêu loại phản ứng cần cung cấp năng lượng trong suốt quá trình diễn ra phản ứng?
A. 1 B. 2 C. 3 D. 4
8
(g) Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,…) là những ví dụ về phản ứng thu nhiệt vì cần khơi mào. Số phát biểu đúng là
A. 4. B. 2. C. 3. D. 5.
Câu34: Hiệu ứng nhiệt của một phản ứng ở điều kiện đẳng áp bằng:
(a) Tổng nhiệt tạo thành sản phẩm trừ tổng nhiệt tạo thành các chất đầu.
(b) Tổng nhiệt đốt cháy các chất đầu trừ tổng nhiệt đốt cháy các sản phẩm.
(c) Tổng năng lượng liên kết trong các chất đầu trừ tổng năng lượng liên kết trong các sản phẩm.
(d) Nhiệt tỏa ra hoặc thu vào kèm theo phản ứng đó.
Số phát biểu đúng là
A. 2. B. 3. C. 1. D. 4.
Câu35: Cho các phát biểu sau:
(a) Năng lượng giải phóng khi xảy ra phản ứng hóa học gọi lànăng lượng hóa học.
(b) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(c) Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
(d) Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong
dung dịch) và nhiệt độ là 298 K (25oC).
(e) Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất là lượng nhiệt kèm theo của phản ứng tạo
thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, kí hiệu là o r298 H ∆
(g) Biến thiên enthalpy chuẩn của một phản ứng hóa học là nhiệt tỏa ra hoặc thu vào kèm theo phản ứng đó ở điều kiện chuẩn, kí hiệu là o f298 H ∆
(h) Phương trình nhiệt hóa học là phương trình có kèm theo trạng thái các chất và hiệu ứng nhiệt của phản ứng.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
Câu36: Cho các phát biểu sau:
(a) Biến thiên enthalpy chuẩn của một phản ứng hóa học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và 25oC.
(b) Nhiệt (tỏa ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298K là biến thiên enthalpy chuẩn của phản ứng đó.
(c) Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
(d) Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường.
(e) Enthalpy tạo thành chuẩn của một đơn chất bền là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đó với oxygen.
Số phát biểu đúng là
A. 4. B. 2. C. 3. D. 5.
Câu37: Phản ứng của enthanol lỏng với oxygen xảy như sau: C2H5OH(l) + O2(g) → CO2(g) + H2O(l)
Cho các nhận định sau:
(a) Phản ứng không có giai đoạn khơi mào.
(b) Đây là phản ứng oxi hóa – khử với tổng hệ số cân bằng trong phương trình phản ứng là 9.
(c) Biến thiên enthalpy chuẩn của phản ứng sẽ thay đổi nếu nước được tạo ra ở thể khí.
(d) Chất khí tạo thành chiếm thể tích nhỏ hơn chất khí phản ứng.
(e) Đây là phản ứng tỏa nhiệt vì nó tạo ra khí CO2 và nước lỏng.
Số nhận định đúng là
A. 3. B. 2. C. 1. D. 4.
Câu38: Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng
bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện,...) và giúp ngăn cản sự phát triển của một số vi khuẩn và nấm gây hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25°C, phản ứng giữa sulfur với oxygen xảy ra theo phương trình S(s) + O2(g) → SO2(g) và tỏa ra một nhiệt lượng là 196,9kJ. Cho các phát biểu sau:
(a) Phản ứng trên là phản ứng thu nhiệt.
(b) Biến thiên enthalpy chuẩn của phản ứng là 196,9 kJ mol -1
(c) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -196,9 kJ.
(d) Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
(e) 0,5 mol sulfur tác dụng hết với oxygen giải phóng 98,45kJ năng lượng dưới dạng nhiệt.
Số phát biểu đúng là
Câu39: Cho hai phản ứng cùng xảy ra ở điều kiện chuẩn:
(1)N(g)O(g)2NO(g)H 1
o 22r298(1)
(2)NO(g)O(g)NO(g)H
+→∆ +→∆
o 22r298(2)
2
Cho các phát biểu sau:
(a) Enthalpy tạo thành chuẩn của NO là o1 r298(1) 1 HkJmol. 2 ∆
(b) Enthalpy tạo thành chuẩn của NO2 là o1 r298(2)HkJmol. ∆
(c) Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol N2 với 1 mol O2 tạo thành 2 mol NO là o r298(1) 1 HkJ. 2 ∆
(d) Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol khí NO với 0,5 mol khí O2 tạo thành 1 mol khí NO2 là o r298(2)HkJ. ∆
(e) Enthalpy tạo thành chuẩn của NO2(g) là: oo1 r298(1)r298(2) 1 HH(kJmol). 2 ∆+∆
Số phát biểu không đúng là
A. 4. B. 2. C. 3. D. 5.
C.PHÂNDẠNGBÀITẬPTỰ LUẬN
1.Viếtphươngtrìnhnhiệthóahọc
Câu1: Viết phương trình nhiệt hóa học của các quá trình tạo thành những chất dưới đây từ đơn chất:
a. Đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng, tỏa ra nhiệt lượng 571,6 kJ.
b. Nhiệt phân hoàn toàn 1 mol Cu(OH)2 tạo thành 1 mol CuO và 1 mol H2O ở trạng thái lỏng, thu vào nhiệt lượng 9,0 kJ.
c. Đốt cháy 1 mol carbon graphite trong khí oxygen dư (ở điều kiện chuẩn) tạo ra 1 mol CO2, nhiệt lượng tỏa ra là 393,5 kJ.
d. Phản ứng nhiệt phân đá vôi (CaCO3), biết rằng để thu được 11,2 gam vôi (CaO) phải cung cấp 6,94 kcal.
Câu2: Viết phương trình nhiệt hóa học của các quá trình tạo thành những chất dưới đây từ đơn chất:
a. Nước ở trạng thái hơi, biết rằng khi tạo thành 1 mol hơi nước tỏa ra 214,6 kJ nhiệt.
b. Nước lỏng, biết rằng sự tạo thành 1 mol nước lỏng tỏa ra 285,49 kJ nhiệt.
c. Ammonia (NH3), biết rằng sự tạo thành 2,5 gam ammonia tỏa ra 22,99 kJ nhiệt.
2.Vẽ sơ dồ biểudiễnbiênthiênenthalpycủaphản ứng
Câu1: Vận dụng để vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng nhiệt phân CaCO3: o 32r298 CaCO(s)CaO(s)CO(g)H178,29kJ →+∆=+
Câu2: Vận dụng để vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng sau: o 2r298 NaOH(aq)HCl(aq)NaCl(aq)HO(l)H57,3kJ +→+∆=−
Câu3: Hình dưới đây mô tả sơ đồ biểu diễn biến thiên enthalpy của phản ứng. Nhận xét về giá trị của o f298H(sp) ∆ so với o f298H(cñ) ∆


Câu4: Viết phương trình nhiệt hóa học ứng với sơ đồ biểu diễn biến thiên enthalpy của hai phản ứng sau:
3.Tínhenthalpysinhchất(tạothành),enthalpycủaphản ứng
Câu1: Hoàn thành thông tin còn thiếu trong các bảng 1 dựa vào thông tin cho ở bảng 2.
22 N(g)O(g)2NO(g)
2 2NaCl(s)2Na(s)Cl(g)
223 2SO(g)O(g)2SO(g)
38222 CH(g)5O(g)3CO(g)4HO(l)
22 4Na(s)O(g)2NaO(s)
4222 CH(g)2O(g)CO(g)2HO(l)
32 CaCO(s)CaO(s)CO(g)
2 NaOH(aq)HCl(aq)NaCl(aq)HO(l)

410222 13 CH(g)O(g)4CO(g)5HO(l)
22232 4FeS(s)11O(g)2FeO(s)8SO(g)
Câu 3: Em hãy xác định enthalpy tạo thành theo đơn vị (kcal) của các chất sau: Fe2O3(s), NO(g), H2O(g), C2H5OH(l). Biết 1 J = 0,239 cal

Câu4: Thế nào là enthalpy sinh (tạo thành) của đơn chất? Tính o r2983 H(O) ∆ và o r298H(Ckimcöông) ∆ và dự đoán hoạt tính hoá học của chúng từ các dự kiện sau:
(1) C(graphite) + O2(g) → CO2(g) ∆= o r298 393,14kJ H

(2) C (kim cương) + O2 (g) → CO2(g) ∆= o r298 395,03kJ H
(3) 3As2O3(s) + 3O2(g) → 3As2O5(s) ∆= o r298 811,34kJ H
(4) 3As2O3(s) + 2O3(g) → 3As2O5(s) ∆= o r298 1090,98kJ H
Câu5: Tính biến thiên enthapy theo phương trình phản ứng sau, biết nhiệt sinh của NH3 bằng -46 kJ/mol. N2(g) + 3H2(g) → 2NH3(g)
Khi tổng hợp được 1 tấn NH3 thì nhiệt lượng toả ra hay thu vào là bao nhiêu?
Câu6: Cho các phản ứng sau: CaCO3(s) → CaO(s) + CO2(g) (1)
C(graphite) + O2(g) → CO2(g) (2)
Tính biến thiên enthalpy của các phản ứng trên. (Biết nhiệt sinh (kJ/mol) của CaCO3, CaO và CO2 lần lượt là1207, -635 và -393,5).
Câu7: Muối amomonium chloride rắn khi hòa vào nước cất sẽ xảy ra phản ứng: 44 NHCl(s)NHCl(aq) →
Nhiệt phản ứng được ứng dụng rộng rãi trong việc sản xuất các túi chườm, giúp giảm đau, giảm viêm do các chấn thương. Theo em, phản ứng hòa tan trên được ứng dụng làm túi chườm nóng hay túi chườm lạnh? Biết o f298 H ∆ NH4Cl(s) và NH4Cl(aq) lần lượt là -314,43 kJ/mol và -299,67 kJ/mol.
Câu8: Ở điều kiện chuẩn 2 mol nhôm tác dụng vừa đủ với khí chlorine tạo muối aluminium chloride và giải phóng một lượng nhiệt 1390,81kJ.
a. Viết và cân bằng phản ứng phương trình hóa học cửa phản ứng. Đây có phải là phản ứng oxi hóa - khử không?
Vì sao?
b. Biến thiên enthalpy chuẩn của phản ứng bằng bao nhiêu? Phản ứng trên thu nhiệt hay tỏa nhiệt?
c. Tính lượng nhiệt được giải phóng khi 10 gam AlCl3 được tạo thành.
d. Nếu muốn tạo ra được 1,0 kJ nhiệt cần bao nhiêu gam Al phản ứng.
Câu9: Đường sucrose (C12H22O11) là một đường đôi. Trong môi trường acid ở dạ dày và nhiệt độ cơ thể, sucrose
bị thủy phân thành đường glucose và fructose, sau đó bị oxi hóa bởi oxygen tạo thành CO2 và H2O. Sơ đồ thay đổi năng lượng hóa học của phản ứng được cho hình dưới đây:
Tiến trình phản ứng
a. Dựa theo đồ thị, hãy cho biết phản ứng trong đó là tỏa nhiệt hay thu nhiệt.Vì sao?
b. Viết phương trình hóa học của phản ứng thủy phân sucrose.
c. Khi 1 mol đường sucrose bị đốt cháy hoàn toàn với một lượng vừa đủ oxygen ở điều kiện chuẩn tỏa ra một lượng nhiệt là 5645kJ. Xác định biến thiến enthalpy chuẩn của phản ứng oxi hóa sucrose.
d. Nếu 5,00 gam đường sucrose được đốt cháy hoàn toàn ở điều kiện như trên thì biến thiên enthanlpy quá trình
bằng bao nhiêu?
e. Vì sao để duy trì một cơ thể khỏe mạnh, cần một chế độ dinh dưỡng đầy đủ và luyện tập thể dục hợp lí?
Câu10: Xét các phản ứng thế trong dãy halogen ở điều kiện chuẩn:
(1) ½ F2(g) + NaC1(s) → NaF(s) + ½ Cl2 (g)
(2) ½ Cl2(g) + NaBr(s) → NaCl(s) + ½ Br2 (l)
(3) ½ Br2(l) + NaI(s) → NaBr (s) + ½ I2 (s)
(4) ½ Cl2(g) + NaBr(aq) → NaCl(aq) + ½ Br2 (l)
Hay còn viết: ½ Cl2(g) + Br- (aq) → Cl- (aq) + ½ Br2 (l)
(5) ½ Br2(l) + NaI(aq) → NaBr (aq) + ½ I2 (s)
(6) Hay còn viết : ½ Br2(l) + I- (aq) → Br- (aq) + ½ I2 (s)
a. Từ các giá trị của enthalpy hình thành chuẩn, hãy tính biến thiên enthalpy chuẩn của các phản ứng thế trên
Chất/Ion NaF(s) Nal(s) Cl(aq) Br(aq) I(aq)
o f298H(kJ/mol) ∆ -574,0 -287,8 -167,2 -121,6 -55,2
(Các giá trị khác được cho trong Phục lục 3, SGK Hóa học Cánh Diều)
b. Nhận xét sự thuận lợi về phương diện nhiệt của các phản ứng thế trong dãy halogen. Kết quả này có phù hợp với quy luật biến đổi tính phi kim của dãy halogen trong bảng tuần hoàn các nguyên tố hóa học không?
Câu11: Thực nghiệm cho biết năng lượng liên kết, kí hiệu là E (theo kJ.mol-1) của một số liên kết như sau:
Liên kết O – H (ancol) C = O (RCHO) C – H (ankan) C – C (ankan)
E 437,6 705,2 412,6 331,5
Liên kết C – O (ancol) C – C (RCHO) C – H (RCHO) H – H
E 332,8 350,3 415,5 430,5
a. Tính ∆ o r298 H của phản ứng: CH2(CHO)2 + 2H2 → CH2(CH2OH)2 (1)
b. ∆ o r298 H tính được ở trên liên hệ như thế nào với độ bền của liên kết hoá học trong chất chất tham gia và sản phẩm của phản ứng (1)?
Câu12: Cho quá trình sau: 3233 CHCHOH(g))CHOCH(g) −−→−−
Bằng các tính biến thiên enthalpy chuẩn của quá trình trên dựa vào năng lượng liên kết, hãy chỉ ra điều kiện chuẩn H3C-CH2-OH hay H3C-O-CH3 bền hơn.
Câu13: Khi dẫn hơi nước qua than nóng đỏ thu được khí than, là hỗn hợp của cacbon monoxit và hiđro:
22 C(s)HO(g)CO(g)H(g)(1) +→+
a. Tính sự biến đổi enthalpy chuẩn của phản ứng (1) từ những phương trình phản ứng hóa học và sự biến đổi entanpi chuẩn
2C(s)O(g)2CO(g)(2)
4.Tínhlượngchất,nhiệtlượngcungcấpchoquátrìnhphản ứng
Câu1: Một hộ gia đình mua than đá làm nhiên liệu đun nấu và trung bình mỗi ngày dùng hết 1,8 kg than. Giả thiết
loại than đá trên chứa 90% carbon và 1,2% sulfur về khối lượng, còn lại là các tạp chất trơ
Cho các phản ứng: 0t o 22r298 C(s)O(g)CO(g)H393,5kJ/mol
+→∆=−
0t o 22r298 S(s)O(g)SO(g)H296,8kJ/mol +→∆=−
Nhiệt lượng cung cấp cho hộ gia đình từ quá trình đốt than trong một ngày tương đương bao nhiêu số điện (1 số điện = 1 kWh = 3600 kJ)?
Câu2: Một mẫu khí gas X chứa hỗn hợp propane và butane.
Cho các phản ứng: 0 38222r298 CH(g)5O(g)3CO(g)4HO(l)H2220kJ +→+∆=− 0
410222r298 13 CH(g)O(g)4CO(g)5HO(l)H2874kJ 2 +→+∆=−
Đốt cháy hoàn toàn 12 gam mẫu khí gas X tỏa ra nhiệt lượng 597,6 kJ. Xác định tỉ lệ số mol của propane và butane trong X.
Câu3: Khí thiên nhiên chứa chủ yếu các thành phần chính: ethane ( 4 CH ), ethane và một số thành phần khác. Cho các phương trình nhiệt hóa học sau: 0 4222r298 CH(g)2O(g)CO(g)2HO(l)H890,36kJ/mol +→+∆=−
o 26222r298 7 CH(g)O(g)2CO(g)3HO(l)H1559,7kJ/mol 2 +→+∆=−
Gi
ả sử, một hộ gia đình cần 10000kJ nhiệt mỗi ngày, sau bao nhiêu ngày sẽ dùng hết bình gas 13 kg khí thiên nhiên với tỉ lệ thể tích của methane : ethane là 85 : 15 (thành phần khác không đáng kể) với hiệu suất hấp thụ nhiệt khoảng 60%)
Câu4: Nhiệt tỏa ra khi đốt cháy 1 gam khí methane ( 4 CH ) là 55,6475 kJ. Giả thiết rằng toàn bộ lượng nhiệt của quá trình đốt than tỏa ra đều dùng để làm nóng nước với hiệu suất hấp thụ nhiệt khoảng 80%, hãy tính thể tích khí methane (ở điều kiện chuẩn) cần phải đốt để làm nóng 2 lít nước từ o 25C tới o 100C. Biết để làm nóng 1 mol nước thêm o 1C cần một nhiệt lượng là 75,4 J; khối lượng riêng của nước là 1 gam/ml; ở điều kiện chuẩn 1mol khí có thể tích 24,79 lít.
Câu 5: Ethanol sôi ở 78,29 oC Để làm 1 gam ethanol nóng thêm 1 oC cần một nhiệt lượng là 1,44 J; để 1 gam ethanol hóa hơi (ở 78,29 oC) cần một nhiệt lượng là 855 J. Hãy tính lượng nhiệt cung cấp để làm nóng 1kg ethanol tử 20 oC đến nhiệt độ sôi và hóa hơi hoàn toàn ở nhiệt độ đó.
H221,0kJ/mol
2 222
O(g)2H(g)2HO(g)(3)
b. Khí than được dùng làm nhiên liệu:
H483,6kJ/mol
o r298 o r298
2 o r298 222 C ) O(g)H(g)O(g)HO(g)COH ( (4 g)(4) ++→∆ +
Dùng các dữ kiện cho thêm sau đây, hãy xác định sự biến đổi enthalpy cho sự cháy:
Câu 6: Nhiệt tỏa ra khi đốt cháy 1 gam một mẫu than là 23,0 kJ. Giả thiết rằng toàn bộ lượng nhiệt của quá trình đốt than tỏa ra đều dùng để làm nóng nước, không có sự thất thoát nhiệt, hãy tính lượng than cần phải đốt để làm nóng 500 gam nước từ o 20C tới o 90C. Biết để làm nóng 1 mol nước thêm o 1C cần một nhiệt lượng là 75,4 J.
D.BÀITẬPTRẮCNGHIỆM
● Cấp độ thông hiểu, vận dụng
Câu1: Phương trình nhiệt hóa học: o 223r298 3H(g)N(g)2NH(g)H91,8kJ +→∆=−
2 C l (s)O(g)CO(g)(5) H393,5kJ/mo+∆→=−
2 o r298
c. Khí than cũng có thể thực hiện quá trình metan hóa:
Lượng nhiệt tỏa ra khi dùng 9 gam H2(g) để tạo thành NH3(g) là
A. -275,40 kJ. B. -137,70 kJ. C. -45,90 kJ. D. -183,60 kJ.
Câu2: Tiến hành quá trình ozone hoá 100 gam oxi theo phản ứng sau: 3O2(g) (oxigen) → 2O3(g) (ozone)
2 2 3 ) H(g)CO(g)CH(g)HO( H(6 g)(6) +→∆ +
4 o r298
Dùng các dữ kiện cho thêm sau đây, hãy xác định sự biến đổi enthalpy chuẩn của phản ứng metan hóa:
Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành o f298 H ∆ của ozone (kJ/mol)
có giá trị là
422 C l H(g)2O(g)CO(g)2HO(g)(7) H802,7kJ/mo∆=− +→+
2 o r298
A. 142,4. B. 284,8. C. -142,4. D. -284,8.
Câu3: Biết rằng ở điều kiện chuẩn, 1 mol ethanol cháy tỏa ra một nhiệt lượng là 31,3710 × kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng lượng được giải phóng ra dưới dạng nhiệt bởi phản ứng là
A. 0,450 kJ. B. 32,2510 × kJ.
C. 24,510 × kJ.
D. 31,3710 × kJ.
Câu4: Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau: +→∆=− o 22r298 1 CO(g)O(g)CO(g)H851,5kJ 2
Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng toả ra là bao nhiêu kJ?
A. 161,82. B. 212,75. C. 122,35. D. 85,15.
Câu5: Cho phương trình phản ứng sau: 2H2(g) + O2(g) → 2H2O(l) ∆H = -572 kJ
Khi cho 2 gam khí H2 tác dụng hoàn toàn với 32 gam khí O2 thì phản ứng
A. toả ra nhiệt lượng 286 kJ.
C. toả ra nhiệt lượng 572 kJ.
B. thu vào nhiệt lượng 286 kJ.
D. thu vào nhiệt lượng 572 kJ.
Câu 6: Ở một lò nung vôi công nghiệp, cứ sản xuất được 1000 kg vôi sống cần dùng m kg than đá (chứa 80% carbon) làm nhiên liệu cung cấp nhiệt.
Cho các phản ứng: o 22r298
C(s)O(g)CO(g)H393,5kJ/mol +→∆=−
0 32r298 CaCO(s)CaO(s)CO(s)H178,29kJ →+∆=
Biết hiệu suất hấp thụ năng lượng ở quá trình phân hủy đá vôi là 60%. Giá trị của m là
A. 161,82. B. 202,27. C. 355,67. D. 406,98.
Câu 7: Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng: N2(g) + O2(g) → 2NO(g)
A. +225 kJ. B. -346 kJ. C. -225 kJ. D. +346 kJ.
Câu8: Cho phản ứng: 223 N(g)3H(g)2NH(g) +→
Ở điều kiện chuẩn, cứ 1 mol N2 phản ứng hết sẽ tỏa ra 92,22 kJ. Enthalpy tạo thành chuẩn của NH3 là
A. -46,11 kJ/mol.
C. -92,22 kJ/mol.
B. 46,11 kJ/mol.
D. 92,22 kJ/mol.
Câu 9: Điều chế NH3 từ N2(g) và H2(g) làm nguồn chất tải nhiệt, nguồn để điều chế nitric acid và sản xuất phân urea. Xác định nhiệt tạo thành chuẩn của NH3, biết khi sử dụng 7 gam khí N2 sinh ra 22,95 kJ nhiệt.
A. +45,9 kJ/mol.
C. +91,8 kJ/mol.
B. -45,9 kJ/mol.
D. -91,8 kJ.
Câu10: Enthalpy chuẩn của phản của phản ứng sau là bao nhiêu kJ?
4222 11 CH(g)O(g)CO(g)HO(l) 22 +→+
A. +358,9 kJ.
C. -358,9 kJ.
B. +445,18 kJ.
D. -445,18 kJ.
Câu11: Từ số liệu trong sách giáo khoa, hãy xác định biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane: ot 26222 7 CH(g)O(g)2CO(g)3HO(l) 2 +→+
A. -2645 kJ. B. -3496 kJ.
C. -2154 kJ. D. -1559,7 kJ.
Câu 12: Biến thiên enthalpy chuẩn kèm theo quá trình 1 mol enthanol lỏng cháy hoàn toàn trong oxygen là -
1,367x103 kJ. Enthalpy hình thành chuẩn của C2H5OH (lỏng) có giá trị là
A. +277,4. B. -277,4. C. -376,8. D. +376,8.
Câu 13: Đốt cháy hoàn toàn 1 gam C2H2(g) ở điều kiện chuẩn, thu được CO2(g) và H2O(l) giải phóng 49,98 kJ. Biến thiên enthalpy chuẩn của phản ứng đốt cháy 1 mol C2H2 là
A. +1368,35 kJ.
C. -1368,35 kJ.
B. -1299,48 kJ.
D. +1299,48 kJ.
Câu14: Cho các phương trình hiệu ứng nhiệt: o 32r298 o 4222r298
CaCO(s)CaO(s)CO(s)H178,29kJ CH(g)2O(g)CO(g)2HO(l)H890,36kJ
→+∆= +→+∆=−
Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam CH4(g) để cung cấp nhiệt cho phản ứng tạo 1 mol
CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
A. 3,2 gam. B. 4,8 gam. C. 1,6 gam. D. 4 gam.
Câu15: Phản ứng luyện gang trong lò cao có phương trình như sau: Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Từ 1 mol Fe2O3 và 1 mol CO, với hiệu suất 100% thì giả phóng một lượng nhiệt là
A. 8,27 kJ. B. 49,6 kJ. C. 12,4 kJ. D. 74,4 kJ.
Câu16: Cho phương trình nhiệt hóa học sau: o 22r298 HO(s)HO(l)H6020kJ →∆=
Biết rằng để làm cho nhiệt độ của 1 mol nước lỏng thay đổi 1°C cần một nhiệt lượng là 75,4J. Giả sử mỗi viên nước đá tương ứng với 1 mol nước. Số viên nước đá tối thiểu cần tan chảy để có thể làm lạnh 500 gam nước lỏng ở 20°C xuống 0°C là
A. 1. B. 7. C. 14. D. 15.
Câu17: Cho phương trình nhiệt hóa học sau: o 22r298 HO(s)HO(l)H6020kJ →∆=
Biết rằng để làm cho nhiệt độ của 1 mol nước lỏng thay đổi 1°C cần một nhiệt lượng là 75,4 J. Để làm lạnh 120 gam nước lỏng ở 45°C xuống 0°C, một bạn học sinh đã dùng m gam nước đá. Giá trị của m là
A. 60,12. B. 45,09. C. 56,79. D. 67,63.
Câu 18: Từ số liệu trong sách giáo khoa, hãy tính biến thiên enthalpy của phản ứng đốt cháy butane theo năng lượng liên kết, biết sản phẩm phản ứng đều ở thể khí.
A. -2745 kJ. B. -2496 kJ. C. -2017 kJ. D. -2557 kJ.
Câu 19: Trong ngành công nghiệp lọc hóa dầu, các ankan thường được loại bỏ hydrogen trong các phản ứng dehydro hóa để tao ra những sản phẩm hydrocacbon không no có nhiều ứng dụng trong công nghiệp. Hãy tính biến thiên anthalpy chuẩn của phản ứng sau dựa vào năng lượng liên kết.
H3C-CH2-CH2-CH3 → CH2=CH-CH=CH2 + 2H2
A. 256 kJ. B. 341 kJ. C. 116 kJ. D. 419 kJ.
Câu 20: Trong ngành công nghiệp lọc hóa dầu, các ankan thường được loại bỏ hydrogen trong các phản ứng dehydro hóa để tao ra những sản phẩm hydrocacbon không no có nhiều ứng dụng trong công nghiệp. Hãy tính biến thiên anthalpy chuẩn của phản ứng sau dựa vào năng lượng liên kết.
6CH4 → C6H6 (1,3,5- cyclohexatriene)+ 9H2

Cho biết công thức cấu tạo 1,3,5- cyclohexatriene như sau:
A. +569 kJ. B. +467 kJ. C. +654 kJ. D. +739 kJ.
Câu21: Cho phản ứng hydrogen hoá ethylene sau: H2C=CH2(g) + H2(g) → H3C–CH3(g)
Biết năng lượng liên kết trong các chất cho trong bảng sau:
Liênkết Phântử Eb (kJ/mol) Liênkết Phântử Eb (kJ/mol)
C = C C2H4 612 C – C C2H6 346
C – H C2H4 418 C – H C2H6 418
H – H H2 436
Biết thiên enthalpy (kJ) của phản ứng có giá trị là
A. +134. B. -134. C. +478. D. -478.
Câu22: Xác định biến thiên enthalpy ( o r298 H ∆ ) của phản ứng đốt cháy butane:
C4H10(g) + O2(g) → CO2(g) + H2O(g)
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau: Liênkết Phântử Eb (kJ/mol) Liênkết Phântử Eb (kJ/mol)
C – C C4H10 346 C = O CO2 799
C – H C4H10 418 O – H H2O 467
O = O O2 495
A. +2356,5 kJ.
C. +2626,5 kJ.
● Cấp độ vận dụng cao
B. -2356,5 kJ.
D. -2626,5 kJ.
Câu23: Cho phản ứng nhiệt nhôm sau: 2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)
Biết nhiệt tạo thành, nhiệt dung của các chất (nhiệt lượng cần cung cấp để 1 kg chất đó tăng lên 1 độ) được cho trong bảng sau:
Chất o f298 H ∆ (kJ/mol)
Al 0
Fe2O3 -5,14
C (J/g.K)
Chất o f298 H ∆ (kJ/mol) C (J/g.K)
Al2O3 -16,37 0,84
Fe 0 0,67
Giả thiết phản ứng xảy ra vừa đủ, hiêu suất 100%; nhiệt độ ban đầu là 250C, nhiệt lượng toả ra bị thất thoát ra bị thất thoát ra ngoài môi trường là 50%. Nhiệt độ (K) đạt được trong lò phản ứng nhiệt nhôm là
A. 3346. B. 2934. C. 2636. D. 3680.
Câu24: Phản ứng đốt cháy butane diễn ra như sau:
o
410222r298
13 CH(g)O(g)4CO(g)5HO(g)H2626,5kJ 2
Một bình gas chứa 12 kg butane có thể đun sôi bao nhiêu ấm nước? (Giả thiết mỗi ấm nước chứa 2 L nước ở 25oC, nhiệt dung của nước là 4,2 J/g.K, có 40% nhiệt đốt cháy butane bị thất thoát ra ngoài môi trường).
A. 736. B. 918. C. 845. D. 691.
