
LIÊN KẾT HÓA HỌC
● Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
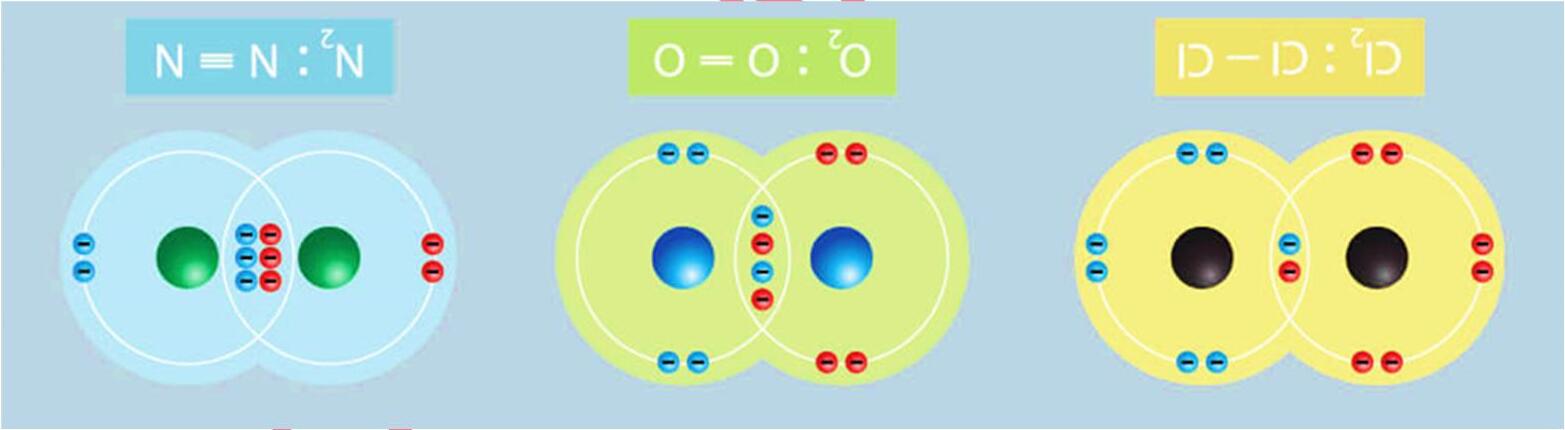
Ví dụ: Hai nguyên tử hydrogen liên kết với nhau tạo phân tử H2
● Trong liên kết hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát ngoài cùng tham gia vào quá trình tạo thành liên kết (electron hóa trị).
● Các electron hóa trị được biểu diễn bằng các dấu chấm đặt xung quanh nguyên tố.
Ví dụ: Biểu diễn các electron hóa trị của các nguyên tố thuộc chu kỳ 3

● Quy tắc octet: Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
Ví dụ: Nguyên tử Sodium nhường 1 electron để đạt cấu hình của khí hiếm Neon
Ví dụ: Nguyên tử Fluorine nhận 1 electron để đạt cấu hình của khí hiếm Neon

Ví dụ: Hai nguyên tử Fluorine góp chung electron tạo phân tử F2



LIÊN KẾT ION
● Sự hình thành ion
o Các kim loại có 1, 2 hoặc 3 electron lớp ngoài cùng có xu hướng nhường electron để tạo ion dương (cation).
o Số đơn vị điện tích của ion dương (cation) bằng số electron mà nguyên tử đã nhường.
Ví dụ: Nguyên tử Sodium nhường 1 electron để tạo ion Sodium
(mang điện dương, điện tích 1+).
o Các phi kim có 5,6 hoặc 7 electron lớp ngoài cùng có xu hướng nhận electron để tạo ion âm (Anion)
o Số đơn vị điện tích của ion âm (anion) bằng số electron mà nguyên tử đã nhận.
Ví dụ: Nguyên tử Fluorine nhận 1 electron để tạo ion Fluoride (mang điện âm, điện tích 1-).
● Các ion được sắp xếp theo một trật tự nhất định trong không gian theo kiểu mạng lưới. Các ion dương và ion âm được sắp xếp luân phiên.
● Số ion cùng dấu bao quanh một ion trái dấu phụ thuộc vào kiểu mạng lưới tinh thể, số điện tích và kích
thước của ion.
● Tính chất của hợp chất ion:
o Thường là tinh thể rắn ở điều kiện thường.
o Khó nóng chảy, khó bay hơi.
o Thường tan nhiều trong nước tạo dung dịch dẫn điện.
● Tên của hợp chất ion
Tên của hợp chất lưỡng nguyên tố được xác định khi biết tên của hai phần tử liên quan.
1. Tên của cation kim loại được gọi theo một số nguyên tắc sau
NT1. Kim loại chỉ tạo một cation có tên cùng tên của kim loại
Na (sodium) → Na+ (sodium).
NT2. Kim loại tạo thành nhiều cation với các điện tích khác nhau, thì điện tích dương được biểu thị bằng chữ số La Mã trong ngoặc đơn sau tên của kim loại:
Fe (iron) → Fe2+ iron(II) ion; Fe3+ iron(III) ion



NT3. Các cation được hình thành từ các nguyên tử phi kim có tên tận cùng bằng -ium:
NH4 + ammonium ion; H3O+ hydronium ion
● Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu.
Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình.
Ví dụ: Sự hình thành liên kết ion trong phân tử sodium chloride
2. Tên anion được gọi theo một số nguyên tắc sau
NT1. Các anion đơn nguyên tử được hình thành bằng cách thay thế phần cuối của tên nguyên tố bằng -ide: Phi kim Tên gốc Tên ion
Bromine brom- Br- bromide ion
Chlorine chlor- Cl- chloride ion
Fluorine fluor- F- fluoride ion
Iodine iod- I- iodide ion
Nitrogen nitr- N3- nitride ion
Oxygen ox- O2- oxide ion
Phosphorus phosph- P3- phosphide
Sulfur sulf- S2- sulfide
Hydrogen hydr- H- hydride ion
Một số anion đa nguyên tử cũng có tên kết thúc bằng -ide:
OH- hydroxide ion CN- cyanide ion O2 2- peroxide ion
● Tinh thể ion là tinh thể được tạo nên bởi các cation và anion.
Trang 3
NT2. Các anion đa nguyên tử chứa oxy có tên kết thúc bằng -ate hoặc -ite và được gọi là oxyanion. -ate được sử dụng cho oxyanion phổ biến nhất hoặc của một nguyên tố và -ite được sử dụng cho oxyanion có

cùng điện tích nhưng ít hơn một nguyên tử O:
NO3 - nitrate ion SO4 2- sulfate ion
NO2 - nitrite ion SO3 2- sulfite ion

Tiếp đầu ngữ được sử dụng khi oxyanion của một nguyên tố có đến bốn phần tử, như với các halogen. Tiền tố per- chỉ ra một nguyên tử O nhiều hơn oxyanion kết thúc bằng -ate; hypo- chỉ ra một nguyên tử O ít hơn
oxyanion kết thúc bằng -ite:


ClO4 - perchlorate ion (nhiều hơn 1 O hơn chlorate)
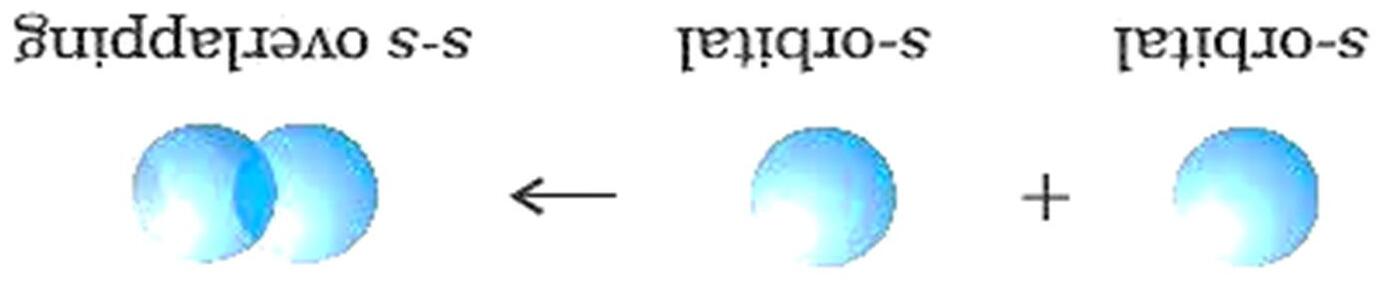
ClO3 - chlorate ion
ClO2 - chlorite ion (ít hơn 1 O so với chlorate)

ClO- hypochlorite ion (ít hơn 1 O so với chlorite)
LIÊN KẾT CỘNG HÓA TRỊ
● Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên
tử. Liên kết tạo thành từ cặp electron chung thường gặp giữa phi kim và phi kim.
o Liên kết đơn hình thành từ một cặp electron dùng chung.

o Liên kết đôi hình thành từ hai cặp electron dùng chung.
o Liên kết ba hình thành từ ba cặp electron dùng chung.

Ví dụ: Liên kết đơn, liên kết đôi, liên kết ba trong các phân tử
● Liên kết cho nhận là liên kiết mà cặp electron chung được đóng góp từ một nguyên tử
● Công thức Lewis biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron hóa trị riêng.
NĂNG LƯỢNG LIÊN KẾT
● Sự hình thành liên kết sigma và liên kết pi

o Liên kết được tạo nên từ sự xen phủ trục của 2 AO gọi là liên kết sigma (δ)
Sự xen phủ trục của hai orbital s - s
Sự xen phủ trục của hai orbital s - p
● Độ âm điện và liên kết hóa học
Trang 5
Sự xen phủ trục của hai orbital p - p

o Liên kết được tạo nên từ sự xen phủ bên của 2 AO gọi là liên kết pi (π)
Sự xen phủ trục của các orbital p - p
● Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar.
● Năng lượng liên kết cho biết độ bền của liên kết. Năng lượng liên kết càng lớn, liên kết càng bền.
LIÊN KẾT HYDROGEN VÀ TƯƠNG TÁC VAN DER WAALS
● Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (Đã liên kết với một nguyên tử khác có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
● Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
● Liên kết hydrogen tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
● Liên kết hydrogen ảnh hưởng tới tính chất vật lí của nước. Các phân tử nước có thể tập hợp với nhau tạo thành một cụm phân tử
Ví dụ: Liên kết hydrogen trong phân tử nước
Ví dụ: Các cụm phân tử nước
QUY TẮC OCTET
Giải thích sự hình thành phân tử dựa trên quy tắc octet
Bài 1: Các nguyên tử sau đây nhường hay nhận electron để đạt được cấu hình của khí hiếm gần nhất?
a) Magnesium. b) Chlorine.
Bài 2: Cho mô hình nguyên tử của một số nguyên tố. Ion do mỗi nguyên tố đó tạo nên có cấu hình electron của các khi hiếm tương ứng nào?
● Tương tác van der Waals là một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử
Ví dụ: Tương tác van der Waals
Mô hình nguyên tử sodium Mô hình nguyên tử aluminium Mô hình nguyên tử oxygen
Bài 3: Sử dụng bảng tuần hoàn và quy tắc octet để dự đoán số electron hóa trị nhường hay nhận của nguyên tử các nguyên tố sau đây trong quá trình hình thành liên kết ion. Viết sơ đồ biểu diễn quá trình nhường, nhận electron trong từng trường hợp.
a) Lithium.
b) Bất cứ nguyên tố M nào thuộc nhóm IIA.
c) Nguyên tố nằm ở ô số 15 trong bảng tuần hoàn.
d) Carbon.
Bài 4: Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Vẽ mô hình (hoặc viết số electron theo lớp) quá trình các nguyên tử nhường, nhận electron để tạo ion:
a) K (Z = 19) và F (Z = 9).
b) Mg (Z = 12) và O (Z = 8)
Bài 5: Hãy ghép mỗi nguyên tử ở cột A với nội dung được mô tả ở cột B sao cho phù hợp: Cột A Cột B
1. He (Z = 2) a. có xu hướng nhận thêm 1 electron.
2. Na (Z = 11) b. có cấu hình lớp vỏ ngoài cùng 2 electron bền vững.


3. Cl (Z = 17) c. có cấu hình lớp vỏ ngoài cùng 8 electron bền vững.

● Tương tác van der Waals cũng làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất nhưng yếu hơn so với liên kết hydrogen.
4. O (Z = 8) d. có xu hướng nhận thêm 2 electron.





5. Al (Z = 13) e. có xu hướng nhường đi 1 electron.

6. Ca (Z = 20) f. có xu hướng nhường đi 2 electron.
7. Ar (Z = 18) g. có xu hướng nhường đi 3 electron.
Bài 6: Methane là một hợp chất hóa học với công thức hóa học CH4. Methane là alkan đơn giản nhất, và là thành phần chính của khí tự nhiên. Methane là một trong những loại nguyên liệu quan trọng không thể thiếu trong quá trình sản xuất công nghiệp và sinh hoạt hàng ngày của con người.
Dựa vào quy tắc octet, hãy đề xuất công thức cấu tạo của methane. (Cho ZC = 6; ZH = 1).
Bài 7: Các quá trình nhường, nhận electron thường được biểu diễn với nguyên tử độc lập. Trong thực tế, các electron nhường đi bởi kim loại cũng chính là electron nhận vào của phi kim mà nó phản ứng. Các hợp chất hình thành như vậy gọi là hợp chất ion. Không nguyên tử nào có thể nhường electron khi không có
nguyên tử khác nhận electron. Các công thức dùng để biểu diễn hợp chất ion đại diện cho tỉ lệ kết hợp của ion dương và ion âm trong hợp chất. Tỉ lệ này được xác định bởi điện tích trên các ion, được xác định bởi
số lượng các electron nhường hoặc nhận.
Viết phương trình biểu diễn sự hình thành ion của các cặp chất sau và công thức của hợp chất ion tạo thành
trong mỗi trường hợp.
a) Na và Cl. b) Mg và F.
Cho số hiệu nguyên tử của các nguyên tố Na, Cl, Mg và F lần lượt là 11, 17, 12, 9.
Bài 8: Sodium chloride (NaCl) là muối có nhiều ứng dụng trong các ngành công nghiệp như sản xuất cao su, trong khai thác dầu khí, trong dung dịch khoan giếng khoan, …). Bên cạnh đó, trong công nghiệp thực phẩm sodium chloride là thành phần chính có trong muối ăn và còn được sử dụng để bảo quản thực phẩm do có khả năng hút ẩm. Ước tính lượng sodium chloride tiêu thụ cho ngành công nghiệp mỗi năm lên đến khoảng 200 triệu tấn - chiếm hơn 80% sản lượng muối trên toàn thế giới.
Vận dụng quy tắc octet, biểu diễn sự hình thành liên kết trong phân tử sodium chloride (NaCl) từ nguyên tử của các nguyên tố sodium và chloride.
Bài 13: Potassium chloride là hóa chất được sử dụng làm phân bón. Cho số hiệu nguyên tử của potassium và chloride lần lượt là 19 và 17. Dựa trên quy tắc octet đề nghị công thức phân tử của potassium chloride.
Bài 14: Khi hình thành liên kết H-H (H + H → H2) và ngược lại khi phá vỡ liên kết H2 → H + H thì hệ thu năng lượng hay giải phóng năng lượng? Xét về mặt năng lượng thì phân tử H2 có năng lượng lớn hơn hay
nhỏ hơn hệ hai nguyên tử hydrogen riêng rẽ? Trong hai hệ đó thì hệ nào bền hơn?
Hình 3.1. Mô hình cấu trúc phân tử sodium chloride
Bài 9: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: F2, H2, HF, CH4, NF3, KBr. (Cho số hiệu nguyên tử của F = 9, H = 1, C = 6, N = 7, K = 19 và Br = 35).
Bài 10: Cho số hiệu nguyên tử của potassium, chlorine lần lượt là 19 và 17. Nguyên tử potassium, chlorine


có xu hướng nhường hay nhận bao nhiêu electron để đạt được cấu hình bền vững của khí hiếm?
Hình 3.2. Ô nguyên tố potassium và chlorine
Bài 11: Nêu tên và công thức hoá học của một chất ở thể rắn, một chất ở thể lỏng và một chất ở thể khí (trong điều kiện thường) trong đó nguyên tử oxygen đạt được cấu hình electron bền của khí hiếm Neon.

Bài 12: Sodium bromide (NaBr) là hợp chất được sử dụng trong nhiếp ảnh, tổng hợp hữu cơ, sản xuất các loại thuốc như: thuốc an thần, thuốc ngủ, thuốc chống co giật,… …. Trong phân tử sodium bromide, các nguyên sodium và bromine đã đạt được cấu hình electron nguyên tử của khí hiếm gần nhất, xác định các khí hiếm đó. (Cho số hiệu nguyên tử của một số khí hiếm: ZHe = 2; ZNe = 10; ZAr = 18; ZKr = 36).
Sơ đồ sự tạo thành phân tử hydrogen
Bài 15: Hai hợp chất A và B đều được tạo nên từ hai nguyên tố nitrogen và hydrogen. Biết:
● Trong hợp chất A chứa 1 nguyên tử nitrogen và x nguyên tử hydrogen.
● Trong B chứa 2 nguyên tử nitrogen và y nguyên tử hydrogen.
Giá trị x và y lớn nhất có thể là bao nhiêu? (Cho số hiệu nguyên tử của nitrogen và hydrogen lần lượt là:
7N và 1H; các hợp chất tạo ra đều thỏa mãn quy tắc bát tử).
Bài 16: Phosphine là hợp chất hóa học giữa phosphorus với hydrogen, có công thức hóa học là PH3. Đây là chất khí có khả
năng tự bốc cháy trong không khí ở nhiệt độ thường và tạo thành
khối phát sáng bay lơ lửng (hiện tượng "ma trơi"). Giải thích sự tạo
thành liên kết hóa học trong phosphine và biễu diễn phân tử phosphine theo quy tắc Octet (Cho: ZP = 15, ZH = 1).


Hiện tượng “ma trơi”
Bài 17: Trong khi xem lại các ghi chú của mình, Lan nhận thấy rằng cô ấy đã vẽ
cấu trúc (công thức Lewis) của acetaldehyde (C2H4O) trong sổ tay của mình như hình bên. Theo em công thức Lewis của acetaldehyde mà Lan đề nghị theo quy tắc octet có chính xác hay không? Giải thích? Nếu sai hãy đề nghị công thức Lewis mới mà các nguyên tử thoả mãn quy tắc octet. Biết rằng mỗi gạch (–) trong các công thức biểu diễn hai electron hoá trị chung.
Trang 9

HCC
H H
O H
:: . . HCC
H H
O H
: :
Mô hình cấu trúc mạng tinh thể sodium bromide Trang
Bài 18: Cho cấu trúc Lewis của một số hợp chất sau:
HCCH
(a) (b) (c) (d) (e)

Những nguyên tử nào trong các phân tử trên thoả mãn quy tắc octet? Biết rằng mỗi gạch (–) trong các công thức biểu diễn hai electron hoá trị chung.
Bài 19: Methane là một hợp chất hóa học với công thức hóa học CH4. Methane là alkan đơn giản nhất, và là thành phần chính của khí tự nhiên. Methane là một trong những loại nguyên liệu quan trọng không thể thiếu trong quá trình sản xuất công nghiệp và sinh hoạt hàng ngày của con người. Dựa vào quy tắc octet, hãy đề xuất công thức cấu tạo của methane. (Cho ZC = 6; ZH = 1).
Dạng 1: Sự hình thành cation và anion
Bài 1: Có ít nhất 14 nguyên tố được coi là “nguyên tố vi lượng thiết yếu” cho cơ thể người. Cụm từ “vi lượng thiết yếu” cho thấy các nguyên tố này được đưa vào cơ thể với lượng rất nhỏ nhưng lại không thể thiếu. Hai trong số các nguyên tố vi lượng thiết yếu này là chromium và zinc. Mô hình cấu tạo nguyên tử của hai nguyên tố này được cho ở hình 3.7. Viết cấu hình electron nguyên tử của Cr, Cr3+, Zn, Zn2+ .
Trang 11
Hình 3.7.a. Mô hình nguyên tử chromium Hình 3.7.b. Mô hình nguyên tử zinc
Hình 3.7. Mô hình nguyên tử của chromium và zinc.

Bài 2. Điền vào ô trống trong bảng sau: Kí hiệu 593 28 Co +
Bài 3: Cho mô hình nguyên tử của một số nguyên tố:
Hình 3.8.a. Mô hình nguyên tử magnesium






Hình 3.8.b. Mô hình nguyên tử sulfur Hình 3.8.c. Mô hình nguyên tử bromine

Hình 3.8.d. Mô hình nguyên tử nitrogen
Hình 3.8.e. Mô hình nguyên tử hydrogen
Hình 3.8.f. Mô hình nguyên tử oxygen
Hình 3.8. Mô hình nguyên tử của một số nguyên tố Dựa vào mô hình cấu tạo nguyên tử ở hình 3.8, hoàn thành thông tin trong bảng sau. Mg2+ S2- Br- NH4+ NO3 - SO32Số proton
Số electron

Bài 4: Magnesium là một khoáng chất tuyệt vời cho cơ thể, tham gia vào quá trình sản xuất năng lượng, sự co cơ, hoạt động của hệ thần kinh và duy trì xương chắc khỏe. Vì vậy, việc bổ sung magnesium mỗi ngày là cần thiết đối với cơ thể. Viết cấu hình electron nguyên tử magnesium và cation magnesium, phương trình tạo thành cation magnesium (Cho ZMg = 12).
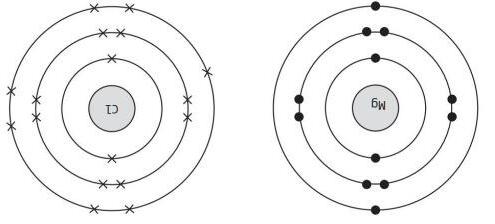
Hình 3.10. Mô hình cấu tạo nguyên tử của Magnesium và Chlorine
Mô tả cách các nguyên tử magnesium và nguyên tử chlorine tạo thành ion.
Bài 2: Cho X, Y, Z, T là những nguyên tố có số hiệu nguyên tử lần lượt là 8, 11, 20, 17.
a. Viết cấu hình electron nguyên tử các nguyên tố X, Y, Z, T.
b. Viết công thức hợp chất tạo thành và xác định liên kết hóa học giữa các cặp chất:
● X và Y
● X và Z
● Y và T
● Z và T.
Bài 3: Hình dưới đây biểu diễn quá trình tạo thành liên kết ion trong phân tử sodium chloride. Hãy viết các bước để minh họa cho hình ảnh em quan sát được.
Hình 3.9. Nguyên tố magnesium

Bài 5: Cho các ion sau: 17Cl; 20Ca2+; 8O2-; 13Al3+; 3Li+; 9F-. Viết cấu hình electron của mỗi ion trên.

Cấu hình đã viết của mỗi ion giống với cấu hình electron của nguyên tử nào? (Cho số hiệu nguyên tử của một số khí hiếm ZHe = 2; ZNe = 10; ZAr = 18).
+ 8O: [He]2s22p4 =>: 8O2-: [Ne].
Bài 6: Hoàn thành thông tin của bảng sau:
Kí hiệu Na+ Cl-
Proton 11 13 15 17
Neutron 12 16
Electron 10 18

Điện tích
Số khối 27 35
Dạng 2: Sự hình thành liên kết ion
Bài 1: Magnesium chloride (MgCl2) là một hợp chất ion. ThSPhanHữuThành
Hình 3.11. Quá trình tạo thành liên kết ion trong phân tử sodium chloride
Bài 4: Cho các hợp chất sau: K2O, H2O, H2S, SO2, NaCl, K2S, CaF2, HCl. Hợp chất nào trong phân
tử có có chứa liên kết ion? Giải thích?
Bài 5: Điền từ thích hợp vào chỗ trống:
Bài 6: Phân loại các hợp chất ion dưới đây vào các nhóm sau: hợp chất tạo nên bởi các ion đơn nguyên tử, hợp chất tạo nên bởi các ion đa nguyên tử và hợp chất tạo nên bởi các ion đơn nguyên
tử và đa nguyên tử: NaCl, NH4NO3, Ca3(PO4)2, NH4H2PO4, K2Cr2O7, CH3COONa, CuSO4, BaBr2, AlCl3
Bài 7: Cho các hợp chất ion sau đây: KCl, NH4NO3, CuSO4, Na2CO3, Ca(OH)2, K3PO4, FeCl3, Al2(SO4)3
a) Xác định các ion cấu thành các hợp chất trên.
b) Chỉ ra các ion đơn nguyên tử và ion đa nguyên tử
Bài 8: Ghép mỗi nguyên tử ở cột A với các giá trị điện tích của ion mà nguyên tử có thể tạo thành
ở cột B:
Cột A
a. Na (Z = 11) 1. điện tích 1+
b. Cl (Z = 17) 2. điện tích 2+
Cột B
c. Ca (Z = 20) 3. điện tích 3+
d. O (Z = 8) 4. điện tích 1-
e. Al (Z = 13) 5. điện tích 2-
f. N (Z = 7) 6. điện tích 3-
Bài 9: Cho biết nguyên tử của một nguyên tố X có tổng số electron thuộc phân lớp s là 5, điện tích hạt nhân của nguyên tử nguyên tố Y là +14,418.10-19C.
a) Xác định X và Y.
b) Liên kết giữa X và Y thuộc loại liên kết gì?
Bài 10: Sắp xếp theo chiều tăng dần bán kính của các ion? Hãy giải thích.
N3-, O2-, F-, Na+, Mg2+, Al3+
Biết số hiệu nguyên tử của N, O, F, Na, Mg, Al lần lượt là 7, 8, 9, 11, 12, 13.
Bài 11: Nguyên tố A là nguyên tố phổ biến thứ ba, và là kim loại phổ biến nhất trong vỏ Trái Đất.
A chiếm khoảng 17% khối lớp rắn của Trái Đất. Nguyên tố B là là nguyên tố phổ biến nhất theo khối lượng trong vỏ Trái Đất. B liên tục được bổ sung trong bầu khí quyển của Trái đất bằng quá trình quang hợp. Nguyên tử A chỉ có 7 electron trên phân lớp p, còn nguyên tử B chỉ có 4 electron trên phân lớp p.
a) Viết công thức hoá học của hợp chất tạo bởi A và. B.
b) Hợp chất tạo bởi A và B có tính dẫn điện không? Tại sao?
c) Nêu một vài ứng dụng của hợp chất tạo bởi A và B trong thực tế cuộc sống?
Bài 12: Cho các ion sau: Na+, Mg2+, Al3+, O2-, F-, N3-. Viết phương trình biểu diễn sự hình thành
các ion trên.
Bài 13: Cho các ion sau: 35Br, 20Ca2+ , 16S2, 19K+ , 7N3, 13Al3+
a) Viết cấu hình electron của mỗi ion.
b) Mỗi cấu hình đã viết giống với cấu hình electron của nguyên tử nào?
Bài 14: Cation X+ do 5 nguyên tử của 2 nguyên tố hóa học tạo nên. Tổng số proton trong X+ là 11.


1) Xác định công thức và gọi tên cation X+
2) Viết công thức electron của ion X+. Cho biết cấu trúc hình học của ion này?
Bài 15: Vì sao ở điều kiện thường các hợp chất ion thường tồn tại ở thể rắn, cứng nhưng lại giòn và dễ vỡ?
Hình 3.12. Cấu trúc mạng tinh thể sodium chloride
Bài 16: Xác định nguyên tố X, Z và viết sơ đồ sự tạo thành liên kết trong hợp chất tạo nên từ hai nguyên tố X và Z biết rằng:
● Nguyên tử nguyên tố X chỉ có 7 electron trên phân lớp s. Thực phẩm chứa nguyên tố X làm giảm nguy cơ mắc bệnh cao huyết áp và đột quỵ.
Hình 3.13. Bổ sung chế độ dinh dưỡng giàu nguyên tố X hạn chế đột quỵ.
● Nguyên tố Z được dùng để chế tạo dược phẩm, phẩm nhuộm và là chất nhạy cảm với ánh sáng.
Nguyên tử nguyên tố Z có 17 electron trên các phân lớp p.
Bài 17: Anion X- có cấu hình electron ở phân lớp ngoài cùng là 4p6. Viết cấu hình electron của
nguyên tử nguyên tố X. Viết quá trình hình thành liên kết và giải thích bản chất liên kết hoá học giữa X và barium. (Cho ZBa = 56).
Bài 18: Viết cấu hình electron của Cl (Z = 17) và Ca (Z=20). Cho biết vị trí của Ca và Cl (chu kì, nhóm) trong bảng tuần hoàn. Liên kết giữa calcium và chlorine trong hợp chất thuộc loại liên kết gì? Vì sao? Viết sơ đồ hình thành liên kết đó.
Bài 19: Viết công thức hóa học của hợp chất ion do mỗi cặp ion tạo thành:
a) Na+ và O2-
b) K+ và N3-
c) Ca2+ và Cl.
d) Al3+ và F.
Bài 20: Viết công thức hóa học của hợp chất ion do mỗi cặp ion tạo thành:
a) NH4 + và HSO4 -
b) K+ và CO3 2-
c) Ca2+ và PO4 3.
d) NH4 + và HPO4 2-
Bài 21: Ion uranyl (UO2 2+) là dạng uranium tan trong nước phổ biến. Công thức hóa học của hợp chất ion uranyl nitrate là gì? Công thức hóa học của hợp chất ion uranyl phosphate là gì?
Bài 22: Cho các hợp chất sau: K2O, H2O, H2S, SO2, NaCl, K2S, CaF2, HCl. Hợp chất nào trong phân tử có chứa liên kết ion? Giải thích?
Bài 23: Trong chín ô trống trong ma trận dưới đây, hãy viết công thức của các hợp chất ion được tạo thành bằng cách kết hợp mỗi ion kim loại (M) với mỗi ion phi kim (X). Ma trận này bao gồm các công thức chung cho tất cả các kết hợp có thể có từ các ion có điện tích độ lớn từ một đến ba.
M+
M2+
M3+
X- X2- X3-
Bài 24: a, Viết cấu hình electron của các nguyên tử A, B biết rằng:

- Tổng số các loại hạt cơ bản trong nguyên tử A là 34 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10.
- Kí hiệu của nguyên tử B là 9 19B.
b, Liên kết trong hợp chất tạo thành từ A và B thuộc loại liên kết gì? Vì sao? Viết công thức của hợp chất tạo thành.
Bài 25: Viết phương trình hoá học và dùng sơ đồ biểu diễn sự trao đổi electron trong phản ứng
giữa:
a) Sodium và chlorine. b) Calcium và fluorine.
c) Magsenium và oxygen. d) Aluminum và oxygen.
Cho số hiệu nguyên tử của các nguyên tử: ZNa = 11; ZCl = 17; ZCa = 20; ZF = 9; ZMg = 12; ZAl = 13.
Bài 26: Mô tả sự dịch chuyển electron từ nguyên tử lithium sang nguyên tử fluorine để tạo
thành hợp chất lithium fluoride theo 2 cách.
a. Theo cấu hình electron.
b. Theo sơ đồ ký hiệu Lewis.
Bài 27: Theo nghiên cứu của Đại học Harvard vào
năm 2013, trẻ em sinh sống tại những khu vực có
nguồn nước bị nhiễm Fluorine có chỉ số IQ trung
bình sẽ thấp hơn so với những trẻ em sống tại vùng
khác. Anion F- (fluoride) có độc tính mạnh với hệ thần kinh. Với lượng tương đối thấp: 0,2 gam ion Ftrên cơ thể có trọng lượng 70 kg có thể gây tử vong.
Tuy nhiên, sự có mặt của anion fluoride lại giúp men răng chắc khỏe và chống chọi các bệnh về
Hình 3.14. Men răng được bổ sung ion fluoride sâu răng, vì vậy anion fluoride được thêm vào nước uống đóng chai với nồng độ với nồng độ 1mg ion F- trên 1L nước và bổ sung một lượng nhỏ dưới dạng muối sodium fluoride (NaF) trong kem đánh răng.
a. Viết sơ đồ mô tả sự hình thành hợp chất NaF từ nguyên tử Na (Z = 11) và F (Z = 9)?
b. Một bạn học sinh nặng khoảng 70kg sử dụng loại nước chứa ion Fvới lượng 1mg/1L để giúp men răng chắc khỏe, chống sâu răng. Sau khi đọc thông tin về độc tính của ion F-, bạn học sinh rất lo lắng. Hãy tính xem với thể tích nước mà bạn học sinh này uống một ngày là bao nhiêu lít thì ion F- có trong nước đạt đến mức có thể gây độc tính?
c. Theo hiệp hội nha khoa Hoa Kỳ, một người trưởng thành nên bổ sung 3,0 mg Fmỗi ngày dưới dạng muối sodium fluoride (NaF) để ngăn ngừa sâu răng. Lượng NaF không gây độc cho cơ thể khi ở mức 3,19.10-2 gam/ 1 kg cơ thể. Một mẫu kem đánh răng chứa 0,28% NaF, hãy tính khối lượng mẫu kem đánh răng mà một người nặng 75 kg có thể nuốt nhưng không gây độc tính với cơ thể?
Bài 28:
a) Nêu sự khác nhau cơ bản trong cấu tạo mạng tinh thể nguyên tử và tinh thể ion. Liên kết hoá học trong hai loại mạng trên thuộc loại liên kết gì?.
b) Giải thích tại sao naphtalene và iodine lại dễ thăng hoa nhưng không dẫn điện, trái lại NaCl lại rất khó thăng hoa nhưng lại dẫn điện khi ở trạng thái dung dịch hoặc trạng thái nóng chảy?
ThSPhanHữuThành Trang18

Hình 3.15. Sự thăng hoa của Iodine
Bài 29: Biểu đồ dưới đây cho biết mối quan hệ giữa năng lượng của hệ các ion trái dấu so với khoảng cách giữa chúng:
Hình 3.17. Biểu đồ thể hiện nhiệt độ nóng chảy của X, Y và Z.
Xác định các hợp chất X, Y và Z? Giải thích
Bài 31: Trong đời sống muối ăn (NaCl) và các gia vị, phụ gia C5H8NO4Na: (bột ngọt) C7H5O2Na (Chất bảo quản thực phẩm) đều có chứa ion sodium. Hiệp hội Tim mạch Hoa Kỳ khuyến cáo lượng ion sodium mỗi ngày được nạp vào cơ thể mỗi người cần thấp hơn 2300mg để bảo vệ tim mạch và thận. Nếu trung bình mỗi ngày một người dùng tổng cộng 5 gam muối ăn; 0,5 gam bột ngọt; 0,05 gam chất bảo quản thì lượng sodium tiêu thụ có vượt quá mức tiêu thụ cho phép nói trên không?

Hình 3.16. Biểu đồ mối quan hệ giữa năng lượng và khoảng cách của hệ các ion trái dấu Biểu đồ cho thấy khoảng cách giữa các ion càng gần thì năng lượng càng giảm => càng thuận lợi để hệ đạt được trạng thái năng lượng tối thiểu (trạng thái bền vững). Tuy nhiên, ở khoảng cách nhỏ quá, các ion lại đẩy nhau do hạt nhân của các ion đều mang điện tích dương. Năng lượng tối thiểu
đại diện cho độ bền liên kết và khoảng cách r0 tại mức năng lượng tối thiểu gọi là độ dài liên kết.
Bằng cách thực hiện một loạt các phép tính, người ta thấy rằng các hợp chất ion được hình thành
bởi các ion có điện tích lớn hơn sẽ tạo ra các liên kết mạnh hơn và các hợp chất ion có độ dài liên
kết ngắn hơn sẽ hình thành liên kết mạnh hơn. Sử dụng nhận định trên để dự đoán và giải thích độ
bền liên kết giữa các hợp chất ion sau: NaCl và Na2O; NaCl và NaF.


Bài 30: X, Y, Z là các hợp chất ion thuộc vào dãy sau: NaF, MgO và MgF2 (sắp xếp ngẫu nhiên không theo thứ tự). Nhiệt độ nóng chảy của các hợp chất X, Y, Z được thể hiện qua biểu đồ hình 3.
Hình 3.18. Dùng quá nhiều sodium gây ảnh hưởng tới tim mạch
LIÊN KẾT CỘNG HOÁ TR
Dạng 1: Công thức electron, công thức cấu tạo và công thức Lewis – Sự hình thành liên kết cộng hoá trị.
Bài 1: Ghép mỗi nguyên tử hoặc phân tử ở cột A với một hoặc các đặc điểm tương ứng của nó ở
cột B sao cho phù hợp:
Cột A Cột B
a. H2 1. Liên kết trong phân tử là liên kết cộng hoá trị không phân cực.
b. Ne 2. Liên kết trong phân tử là liên kết cộng hoá trị phân cực.
c. HCl 3. Là khí trơ
d. NH3 4. Phân tử không phân cực.
e. CO2 5. Phân tử phân cực.
f. CH4 6. Liên kết trong phân tử là liên kết đơn.
7. Liên kết trong phân tử là liên kết đôi.


8. Tan tốt trong nước.
9. Là chất khí ở điều kiện thường.
Bài 2: Phân cực liên kết đóng vai trò quan trọng trong việc xác định cấu trúc của protein. Sử dụng
ThSPhanHữuThành Trang20
các giá trị độ âm điện trong hình 3, sắp xếp các liên kết cộng hóa trị sau: C – H, C – N, C – O, N –
H, O – H (thường gặp trong các acid amine) theo thứ tự tăng dần độ phân cực.

K3N

Bài 4: Hoàn thành các thông tin còn thiếu trong bảng sau:
Công thức electron So sánh hiệu độ âm điện Loại liên kết
Độ âm điện giữa 2 nguyên tử

O là bằng nhau Cộng hoá trị không phân cực
Bảng 3.1. Độ âm điện của các nguyên tố trong bảng tuần hoàn
Bài 3: Cho giá trị độ âm điện của một số nguyên tố trong bảng sau:
Bảng. Độ âm điện của một số nguyên tố
Nguyên tố Độ âm điện Nguyên tố Độ âm điện
Bài 5: Viết công thức Lewis của các phân tử Cl2, H2O và CCl4
Bài 6: Methane thường được sử dụng để làm nhiên liệu trong các lò nướng, máy nước nóng, lò nung, xe ôtô do quá trình đốt cháy methane (CH4) trong oxygen tỏa ra lượng nhiệt lớn. Methane ở dạng khí nén được dùng làm nhiên liệu cho ôtô, xe máy,… do đặc tính thân thiện với môi trường.
Dựa vào giá trị độ âm điện ở bảng hoàn thành các thông tin còn thiếu trong bảng sau:
Bảng. Mối liên hệ giữa hiệu độ âm điện và liên kết hoá học
Phân tử Hiệu độ âm điện (⊗ ⊗⊗ ) Loại liên kết
HCl 0,96 Liên kết cộng hoá trị phân cực
Cl2
H2O
CaO 2,44 Liên kết ion
CaF2
Al2O3
Na2O
NaCl
H2S 0,38 Liên kết cộng hoá trị không cực
CaS
PH3

CH4
SO2


PCl5
Hình 3.19. Khí methane cháy trong không khí

Viết công thức electron, công thức cấu tạo và công thức Lewis của methane.
Bài 7: Ethene (C2H4) là một chất sinh trưởng tự nhiên, có khả năng thúc đẩy quá trình chín của nhiều loại trái cây. Bên cạnh đó, ethene cũng có nhiều ứng dụng quan trọng trong công nghiêp, những ứng dụng của ethene được đưa ra trong hình 3.20.

ThSPhanHữuThành Trang22

Hình 3.20. Một số ứng dụng của ethene
Viết công thức electron, công thức cấu tạo và công thức Lewis của ethene.
Bài 8: Vẽ sơ đồ biểu diễn sự xen phủ giữa orbital 1s của nguyên tử hydrogen với orbital 3p của nguyên tử chlorine khi hình thành liên kết xích ma trong phân tử hydrogen chloride (HCl).

Bài 9: Carbon monoxide (CO) và carbon dioxide (CO2) là sản phẩm được sinh ra trong quá trình đốt cháy nhiên liệu hóa thạch. Trong đó CO là khí

độc, có khả năng gây tử vong với hàm lượng nhỏ, CO2 là khí gây ra hiệu ứng nhà kính. Viết công thức Lewis của khí CO và CO2
Hình 3.21. Đốt than sinh ra khí CO, CO2
Bài 10: Hydrogen sulfide (H2S) là chất khí không màu, mùi trứng thối, độc. Theo tài liệu của Cơ quan Quản lí an toàn và sức khoẻ nghề nghiệp Hoa
Kì, nồng độ H2S khoảng 100ppm gây kích thích
màng phổi. Nồng độ khoảng 400 – 700 ppm, H2S gây nguy hiểm tới tính mạng chỉ trong 30 phút.
Nồng độ trên 800 ppm gây mất ý thức và nguy cơ làm tử vong ngay lập tức.

a. Viết công thức Lewis và công thức cấu tạo của H2S.
Hình 3.22. Hydrogen sulfide là khí có mùi trứng thối.
b. Em hiểu thế nào về nồng độ ppm của H2S trong không khí?
c. Một gian phòng trống (250C, 1 bar) có kích thước 3m x 4m x 6m bị nhiễm 10 gam H2S. Tính
nồng độ ppm của H2S trong gian phòng trên. Đánh giá mức độ độc hại của H2S trong trường hợp này. Cho biết 1 mol khí ở 250C và 1 bar có thể tích là 24,79 lít.

Bài 11: Hoàn thành bảng sau:
Phân tử Công thức electron Công thức Lewis Công thức cấu tạo
Chlorine
(Cl2) Cl - Cl
Bromine (Br2)
Hydrogen sulfide (H2S)



Ammonia (NH3)
Ethyne (C2H2)


Bảng 3.2. Công thức electron, công thức Lewis và công thức cấu tạo của một số phân tử
Bài 12: Nguyên tố X và nguyên tố Y có số đơn vị điện tích hạt nhân lần lượt là 9, 8.
1. Viết cấu hình electron nguyên tử của X và Y. Cho biết tính chất hóa học đặc trưng của X và Y.
2. Dự đoán liên kết hóa học có thể hình thành giữa X và Y. Viết công thức phân tử của các hợp chất tạo thành.
Bài 13: Sự có mặt của nguyên tố X và nguyên tố phosphorus trong
cơ thể người giúp cho xương, răng chắc khỏe. Nguyên tố Y có trong
nhựa PVC, chất dẻo, cao su. Hạt nhân nguyên tử X có 20 proton và nguyên tử Y có 17 electron ở lớp vỏ.
a. Viết cấu hình electron của nguyên tử X và Y.
Hình 3.23. Nguyên tố X giúp xương chắc khỏe
b. Viết công thức hợp chất hình thành giữa 2 nguyên tố X và Y. Xác định loại liên kết trong phân tử X và Y.
Bài 14: Cho mô hình cấu tạo của một số phân tử sau, hoàn thành thông tin trong bảng.
Mô hình cấu tạo Công thức Lewis Công thức cấu tạo
ThSPhanHữuThành Trang24
Hình 3.24. Mô hình cấu tạo của một số phân tử.
Bài 15: Viết công thức cấu tạo của H3PO3, H3BNF3, SO2Cl2
Bài 16: Dự đoán loại liên kết trong các phân tử sau, và sắp xếp theo thứ tự tăng dần độ phân cực của liên kết HCl, CaH2, AlBr3, CaCl2, N2.
Bài 17: Bằng hình vẽ hãy mô tả sự xen phủ của các orbital nguyên tử (AO) để tạo ra các liên kết trong phân tử H2, Cl2
Bài 18: Vẽ sơ đồ xen phủ orbital giữa 2 nguyên tử carbon để biểu diễn sự hình thành liên kết đôi trong phân tử ethylene (C2H4).
Bài 19: Bảng sau chứa thông tin về 3 hợp chất (A), (B), (C) tạo bởi 2 nguyên tố X, Y thuộc chu kì
2 của bảng tuần hoàn:
Phân tử Công thức phân tử Số cặp electron hóa trị không liên kết
(A) XaYa 8
(B) XaYa+2 14
(C) XbYa+1 10
Bảng 3.3. Thông tin về ba hợp chất A, B và C
Biết tất cả các hợp chất đều thỏa mãn quy tắc bát tử. Xác định X, Y và viết công thức cấu tạo của (A), (B), (C).
Dạng 2: Liên kết cho nhận
Bài 1: Perchloric acid được sử dụng để điều chế các muối perchlorate, chủ yếu là ammonium perchlorate - một trong những nhiên liệu quan trọng trong sản xuất tên lửa. Sự phát triển của ngành công nghiệp tên lửa đã thúc đẩy mạnh việc sản xuất perchloric acid với sản lượng hàng triệu tấn mỗi năm. Viết công thức lewis và công thức cấu tạo của perchloric acid (HClO4).
Bài 3: Giải thích sự hình thành liên kết hóa học trong phân tử NH4Cl. Cho biết trong phân tử NH4Cl có chứa các loại liên kết hóa học nào?
Hình 3.26. Phân tử ammonium chlorid





Dạng 3: Mối liên hệ giữa hiệu độ âm điện và liên kết
Bài 1: Dựa vào giá trị độ âm điện trong bảng sau, dự đoán loại liên kết (liên kết cộng hóa trị phân cực, liên kết cộng hóa trị không phân cực, liên kết ion) trong các phân tử: MgCl2, AlCl3, HBr, H2, NH3.

Hình.3.25.a. Muối ammonium perchlorate là nhiên liệu quan trọng trong sản xuất tên lửa
Hình.3.25.b. Phân tử acid perchloric
Hình 3.25. Aicd perchorate
Bài 2: Sulfuric acid (H2SO4) là hóa chất được sử dụng rất nhiều trong sản xuất phân bón, chất tẩy rửa tổng hợp, sản xuất tơ sợi hóa học, chất dẻo, sơn màu. Trình bày sự tạo thành liên kết hóa học trong phân tử sulfuric acid. (Cho ZH = 1; ZO = 8; ZS = 16).
Bảng 3.4. Bảng độ âm điện của các nguyên tố trong bảng tuần hoàn
Bài 2: Dựa vào giá trị độ âm điện của một số nguyên tố nhóm A được cho trong hình dưới đây, xác định loại liên kết trong phân tử các chất: CH4, CaCl2, HBr, NH3. Sắp xếp theo chiều tăng dần độ phân cực liên kết của các phân tử trên.

Bảng 3.5. Độ âm điện của một số nguyên tố
Bài 3: Cho các phân tử sau: Br2, H2S, CH4, NH3, C2H4, C2H2

a. Phân tử nào có liên kết cộng hóa trị không phân cực? Phân tử nào có liên kết cộng hóa trị phân
cực?
b. Phân tử nào chỉ có liên kết đơn? Phân tử nào có liên kết đôi? Phân tử nào có liên kết ba?
Bài 4:
a. Giải thích vì sao độ âm điện của nitrogen là 3,04 xấp xỉ
độ âm điện của chlorine là 3,16 nhưng ở điều kiện thường nitrogen kém hoạt động hơn nhiều so với chlorine.
b. Sodium chloride tan được trong nước hay trong dầu hỏa? Giải thích.
c. Vì sao benzene (C6H6) không tan trong nước nhưng tan tốt trong các dung môi hữu cơ như tetrachloromethane (CCl4), hexane (C6H14) …?
Hình 3.27. Benzen không tan trong nước
Bài 5: Dựa vào độ âm điện của các nguyên tố trong bảng 3.6. Hãy dự đoán loại liên kết trong các
phân tử và ion sau: HClO, KHS, HCO3Nguyên tố K H C S Cl O
Độ âm điện
Bảng 3.6. Độ âm điện của một số nguyên tố Bài 6: Dựa vào hiệu độ âm điện, hãy sắp xếp theo chiều tăng dần độ phân cực của liên kết giữa 2 nguyên tử trong phân tử các chất sau: CaO, MgO, CH4, AlN, N2, NaBr, BCl3, AlCl3. Phân tử chất nào có chứa liên kết ion? Phân tử chất nào liên kết cộng hoá trị không cực, cộng hoá trị có cực?
(Cho độ âm điện của một số nguyên tố: O = 3,5; Cl = 3,0; Br = 2,8; Na = 0,9; Mg = 1,2; Ca = 1,0;
C = 2,5; H = 2,1; Al = 1,5; N = 3; B = 2,0).
Bài 7: Bảng dưới đây cung cấp giá trị độ âm điện của một số nguyên tố
Nguyên tố Be Al P S Cl F
âm điện
Bảng 3.7. Độ âm điện của một số nguyên tố Hãy cho biết các hợp chất BeCl2, AlCl3, PCl5, SF6 có chứa loại liên kết nào?
LIÊN KẾT HYDROGEN VÀ TƯƠNG TÁC VAN DER WAALS WAALS
Dạng 1: Liên kết hydrogen
Bài 1: So sánh nhiệt độ sôi của H2O và HF. Giải thích?
Bài 2: Giải thích ngắn gọn các trường hợp sau:
a) Nhiệt độ sôi của NF3 nhỏ hơn NH3
b) Nhiệt độ nóng chảy của AlCl3 nhỏ hơn AlF3
Bài 3: Vì sao nguyên tử H của của phân tử H2O không tạo được liên kết hydrogen với nguyên tử C của phân tử CH4?

Bài 4: Một kết quả nghiên cứu mới đây cho thấy các phân tử NH3 có thể liên kết với nhau thành những cụm phân tử (NH3)n với n = 3 – 6. (Theo ACD Omega 2020, 5, 49, 31724-31729). Vì sao các phân tử NH3 có thể hình thành được cụm phân tử này?

Hình 3.28. Các cụm phân tử ammonia
Bài 5: Nhiệt độ nóng chảy và nhiệt độ sôi của hai chất HBr và HF như sau. Hãy gán công thức chất thích hợp vào các ô có dấu?
Chất Nhiệt độ nóng chảy (0C) Nhiệt độ sôi (0C) ? -86,9 -66,8 ? -83,6 19,5
Bảng 3.8. Nhiệt độ nóng chảy và nhiệt độ sôi của HF và HBr
Bài 6:
a) Liên kết hydrogen được hình thành trên cơ sở nào?
b) Đưa ra dự đoán và giải thích sự lựa chọn cho các câu hỏi dưới đây.
- Chất nào dễ hóa lỏng nhất: F2, NH3, CO2, CH4.
- Chất nào dễ tan trong nước nhất: H2, CH4, NH3.
- Chất nào có nhiêt độ sôi cao nhất: CO2, SO2, HF.
Bài 7: Giải thích tại sao:
a, Nước đá là thể rắn nhưng lại có thể nổi trên bề mặt nước lỏng?
ThSPhanHữuThành Trang28
Hình 3.29. Nước đá nổi trên bề mặt nước lỏng
b, Nên tránh ướp lạnh các lon bia, nước giải khát, … trong ngăn đá của tủ lạnh?
c, Trong quá trình chưng cất rượu, rượu bay hơi trước nước?
Bài 8: Đọc đoạn thông tin sau, trả lời các câu hỏi.
Nước (H2O) là một dung môi phân cực kì diệu của tự nhiên, có khả năng hòa tan hầu hết các chất tan. Công thức cấu tạo của nước được biểu diễn tại hình 3. Trái ngược với nước, chất béo lại là một loại dung môi không phân cực.
Hình 3.30. CTCT của nước Vitamin là một trong những dưỡng chất quan trọng cần bổ sung cho cơ thể. Mỗi loại vitamin sẽ mang tới những hiệu quả riêng cho cơ thể. Ví dụ vitamin C (C6H8O6) giúp tăng cường lưu thông mạch máu, chống oxi hóa giúp trẻ hóa làn da, vitamin E giúp quá trình tuần hoàn máu được diễn ra thuận lợi, vitamin B2 điều trị tiêu chảy, nhiễm trùng, cường giáp, vitamin B6 giúp cải thiện hệ miễn dịch.
Công thức cấu tạo của các vitamin được cho trong bảng dưới đây:
Loại vitamin Vitamin C Vitamin E Vitamin B2 Vitamin B6
Công thức cấu tạo Bảng 3.9. Công thức cấu tạo của một số loại vitamin
Dựa theo tính tan, vitamin có thể chia thành vitamin tan trong dầu và vitamin tan trong nước.
Vitamin tan trong dầu khi dư thừa sẽ được tích lũy trong cơ thể, vitamin tan trong nước khi dư thừa
sẽ thải ra ngoài qua đường tiểu làm thay đổi màu sắc của nước tiểu.
a, Vitamin X giúp điều trị tiêu chảy, nhiễm trùng, cường giáp, … X là vitamin nào?
b, Dự đoán những vitamin nào có thể tan trong nước? Giải thích.
c, Bạn Lan đã uống một loại vitamin để bồi bổ cho cơ thể. Trong đợt kiểm tra sức khỏe, mẫu nước tiểu của Lan có màu vàng. Hãy cho biết có thể Lan uống loại vitamin nào có thể đã được Lan sử dụng trong số các vitamin trên? Giải thích?
Bài 9:
a) Trong dung dịch ethanol và phenol có thể tồn tại những liên kết hydrogen khác nhau giữa các phân tử. Hãy biểu diễn các liên kết hydrogen và cho biết liên kết hydrogen trong phân tử nào bền vững hơn?


b) So sánh nhiệt độ sôi (to s) của các cặp chất sau:
1. H2O và HCl. 3. C2H5OH và CH3OCH3


2. SO2 và O2. 4. CH3COOH và HCOOCH3.
c) Giải thích tại sao khi mạch carbon tăng, độ hòa tan trong nước của alcohol và của acid lại giảm. Bài 10:
a) Liên kết hydrogen là gì?
Hình 3.31. Liên kết hydrogen trong phân tử nước
b) Cho dãy các chất sau: C2H6, C2H5Cl, C2H5NH2, CH3COOC2H5, CH3COOH, CH3CHO. Hợp chất nào tạo được liên kết hydrogen giữa các phân tử. Giải thích.
c) Dựa vào ảnh hưởng của liên kết hydrogen tới tính chất vật lí của các chất, hãy cho biết:
* C2H5 - OH, CH3COOH, CH3-CHO Chất nào có nhiệt độ sôi cao nhất?
* (C2H5)2O, C2H2-OH, CH3CO-C2H5 Chất nào dễ tan trong nước nhất?


Bài 11: Giá trị nhiệt độ sôi và phân tử khối của một số hợp chất được cho trong bảng 3.10: C2H5-Cl C2H5-OH CH3COOH CH3-COOC2H5
Nhiệt độ sôi 12,5oC 78,3oC 118oC 77,1oC
Phân tử khối 64,5 46 60 88
Bảng 3.10. Giá trị nhiệt độ sôi và phân tử khối của một số hợp chất
Giải thích tại sao
a, Phân tử khối của C2H5-OH; CH3COOH nhỏ hơn phân tử khối của C2H5Cl; CH3COOC2H5 nhưng nhiệt độ sôi lại cao hơn.
b, Nhiệt độ sôi của acid acetic CH3COOH cao hơn của ethanol C2H5-OH?


Bài 12: Hai phân tử nước có thể liên kết được với nhau. Dựa vào sự phân bố điện tích trong phân tử nước cho biết liên kết giữa hai phân tử nước có thể được hình thành qua cặp nguyên tử nào?

ThSPhanHữuThành Trang30
Hình 3.32. Cấu trúc phân tử nước
(1) O với O. (2) H với H.
(3) O với H.
Giải thích sự lựa chọn của em.
Dạng 2: Tương tác Van Der Waals
Bài 1: Tương tác Van der Waals là gì? So sánh tương tác Van der Waals trong mỗi hợp chất sau.
a. H2 và HCl. b. HBr và HF. c. Br2 và ICl.
Bài 2: Giải thích vì sao con tắc kè có thể di chuyển trên mặt kính trơn nhẵn, thẳng đứng.
Liên kết H - F H - Cl H - Br H - I
Năng lượng liên kết kJ mol-1 565 431 364 297
Từ giá trị năng lượng liên kết, so sánh độ bền liên kết trong các phân tử HF, HCl, HBr và HI.
Bài 2: Cho năng lượng liên kết của một số liên kết như ở dưới bảng:
Bảng. Năng lượng liên kết của một số loại liên kết
Liên kết Năng lượng liên kết đơn (kJ/mol) Liên kết Năng lượng liên kết bội (kJ/mol)
N – N 163 N≡N 945
N – O 222 N=O 607
O – O 142 O=O 498
Từ giá trị năng lượng liên kết, so sánh độ bền của các liên kết N – N, N – O và O – O và các phân tử N2, NO và O2.
Bài 3: Khi khảo sát chiều dài liên kết của các nguyên tố nhóm halogen người ta thu được dữ liệu sau:
Halogen X2 F2 Cl2 Br2 I2
Chiều dài liên kết (Å) 1,42
Bảng 3.12. Chiều dài liên kết của các đơn chất halogen
a. Giải thích sự tạo thành liên kết trong phân tử Halogen.

b. Giải thích sự biến thiên độ dài liên kết trong phân tử các nguyên tố nhóm Halogen.
c. Dự đoán nhiệt độ nóng chảy, nhiệt độ sôi của các nguyên tố nhóm halogen thay đổi như thế nào?
Tại sao?
Bài 4: Thực nghiệm cho biết các độ dài bán kính của sáu ion có cùng số electron như sau: 1,71Å; 1,16 Å; 1,19 Å; 0,68 Å; 1,26 Å; 0,85.Å. Số điện tích hạt nhân của 6 ion thỏa mãn

2 < Z <18. Hãy xác định sáu ion trên và gán giá trị bán kính cho từng ion, giải thích cho sự lựa chọn.
Bài 5: Nhận xét mối tương quan giữa độ dài liên kết và năng lượng liên kết dựa theo kết quả bảng 3.13.
Hình 3.33. Bàn chân con tắc kè bám trên bề mặt kính
Bài 3: Nêu các hiện tượng trong đời sống có xuất hiện của liên kết hydrogen, tương tác van der
Waals trong thực tiễn?
Bài 4: Ở điều kiện thường các khí hiếm tồn tại ở dạng khí đơn nguyên tử. Hãy giải thích sự biến
đổi nhiệt độ sôi của các khí hiếm từ He tới Rn theo số liệu cho dưới bảng sau:
Khí hiếm He Ne Ar Kr Xe Rn
Số hiệu nguyên tử 2 10 18 36 54 86
Nhiệt độ sôi (t0C) -269 -246 -186 -152 -108 -62
Bảng 3.11. Nhiệt độ sôi của các khí hiếm
Dạng 3: Độ dài liên kết và năng lượng liên kết
Bài 1: Cho năng lượng liên kết của một số liên kết như ở dưới bảng:
Bảng. Năng lượng liên kết của một số loại liên kết
Bảng 3.13. Độ dài và năng lượng liên kết của một số liên kết
Bài 6: Năng lượng liên kết của các hydrogen halide được liệt kê trong bảng sau:
Bảng 3.14. Năng lượng liên kết hoá học của các hydrogen halide
Sắp xếp theo chiều tăng dần độ bền liên kết trong các phân tử HF, HCl, HBr và HI.
Bài 7: Cho các phương trình sau:
H2 (gas) → 2H (gas) Eb = 432 kJ.mol-1 (1)


N2 (gas) → 2N (gas) Eb = 945 kJ.mol-1 (2)
Giải thích vì sao năng lượng liên kết trong khí nitrogen lớn hơn trong khí hydrogen?
ThSPhanHữuThành Trang32
Bài 8: Năng lượng liên kết và độ dài liên kết của các liên kết C – C, C = C, C ≡ C trong các phân
tử C2H6, C2H4 và C2H2 được cho trong bảng dưới đây:
Bảng 3.15. Năng lượng và độ dài liên kết của một số liên kết
a. Nêu mối liên hệ giữa chiều dài liên kết và năng lượng liên kết của các nguyên tử carbon trong
các hydrocarbon đã cho.
b. Giải thích vì sao giá trị năng lượng liên kết tăng theo thứ tự C – C, C = C, C ≡ C.

Bài 9: Cation X+ do 5 nguyên tử của 2 nguyên tố hóa học tạo nên. Tổng số proton trong X+ là 11.
1. Xác định công thức và gọi tên cation X+ .
2. Viết công thức electron của ion X+. Cho biết cấu trúc hình học của ion này?
B. PHẦN TRẮC NGHIỆM KHÁCH QUAN
ThSPhanHữuThành
Giải thích sự hình thành phân tử dựa trên quy tắc octet
QUY TẮC BÁT TỬ
Trong các phản ứng hóa học chỉ có các electron thuộc các lớp bên ngoài
(liên kết với hạt nhân yếu nhất) là có khả năng tham gia vào việc tạo liên
kết hóa học, những electron này được gọi là electron hóa trị.
Trong tự nhiên, người ta nhận thấy chỉ có các nguyên tử khí hiếm là tồn tại
độc lập mà không liên kết với các nguyên tử khác. Sở dĩ như vây là vì
chúng có lớp electron ngoài cùng có cấu hình ns2np6 (8 electron) bền vững
có trạng thái năng lượng thấp.
Vào năm 1916, Gilbert N. Lewis xây dựng Quy tắc octet. Quy tắc này phát

biểu như sau: "Trong các phản ứng hóa học, các nguyên tử có xu hướng
hình thành lớp vỏ bền vững như của khí hiếm”. Như vậy, trong quá trình
hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc
góp chung electron để đạt được cấu hình bền vững như của khí hiếm gần
nhất với 8 electron ở lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cùng như của helium).
Sử dụng thông tin trong bài đọc trả lời từ câu 1 tới câu 10
Câu 1: Liên kết hóa học là
A. Sự kết hợp các nguyên tử tạo thành phân tử hay tinh thể bền vững.
B. Sự kết hợp các chất tạo thành vật thể bền vững.
C. Sự kết hợp các phân tử hình thành các chất bền vững.
D. Sự kết hợp các hạt cơ bản hình thành nguyên tử bền vững.
Câu 2: Khuynh hướng nào dưới đây không xảy ra trong quá trình hình thành liên kết hóa học:
A. Chia tách electron. B. Cho nhận electron.
C. Góp chung electron. D. Dùng chung electron tự do.
Câu 3: Theo quy tắc bát tử thì nguyên tử có xu hướng đạt cấu trúc bền giống như:
A. Kim loại kiềm gần kề B. Kim loại kiềm thổ gần kề
C. Nguyên tử halogen gần kề D. Nguyên tử khí hiếm gần kề
Câu 4: Trong nguyên tử, electron hóa trị là các electron
A. Độc thân. B. Ở phân lớp ngoài cùng.
C. Ở obitan ngoài cùng. D. Tham gia tạo liên kết hóa học.
(Electron hóa trị: là những electron có khả năng tham gia vào việc hình thành liên kết hóa học. Số e hóa trị = số e ở lớp ngoài cùng cộng phân lớp sát ngoài cùng nếu phân lớp đó chưa bão hoà).

Câu 5: Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm Neon khi tham gia hình thành liên kết hoá học?
A. Hydro (Z = 1). B. Fluorine (Z = 9).

C. Chlorine (Z = 17). D. Potassium (Z = 19).
Trang33
ThSPhanHữuThành Trang34
Hình 3.34. Sơ đồ cấu tạo lớp vỏ electron của nguyên tử Neon.
Câu 6: Nguyên tử của nguyên tố nào sau đây có xu hướng nhường đi 2 electron khi hình thành liên kết hoá học?
A. Calcium (Z = 20). B. Aluminum (Z = 13).

C. Oxygen (Z = 8). D. Neon (Z = 10).
Câu 7: Nguyên tử oxygen và nguyên tử magnesium có xu hướng nhường hay nhận bao nhiêu electron để đạt được cấu hình electron bền vững của khí hiếm?
A. Nhận 2 elctron và nhường 2 electron.
B. Nhận 2 electron và nhường 1 electron.
C. Nhường 2 electron và nhận 2 electron.

D. Nhận 1 electron và nhường 2 electron.
Câu 8: Chọn phát biểu sai? Các nguyên tử liên kết với nhau thành phân tử để
A. chuyển sang trạng thái có năng lượng thấp hơn.
B. có cấu hình electron của khí hiếm.
C. có cấu hình electron lớp ngoài cùng là 2 hoặc 8.
D. chuyển sang trạng thái có mức năng lượng cao hơn.
Câu 9: Số electron hóa trị trong nguyên tử chlorine (Z = 17) là
A. 5. B. 7. C. 3. D. 1.
Câu 10: Số electron hóa trị trong nguyên tử chromium (Z = 24) là
A. 1. B. 3. C. 6. D. 4.
Câu 11: Cho biết nguyên tử Na, Mg, F lần lượt có số hiệu nguyên tử là 11, 12, 9. Các ion Na+, Mg2+, F- có
đặc điểm chung là
A. Có cùng số proton. B. Có cùng neutron.
C. Có cùng số electron. D. Không có đặc điểm gì chung.
(Theo quy tắc bát tử các nguyên tử luôn có xu hướng cho hoặc nhận e để đạt cấu hình khí hiếm gần nguyên tử đó nhất, các nguyên tử trên đều gần khí hiếm Ne với 8 e lớp ngoài cùng bão hòa bền vững).
Câu 12: Cho 2 nguyên tố Na (Z = 11); Cl (Z = 17). Cấu hình electron của Na+ và Cl- lần lượt là: Đáp án Ion Na+ Ion Cl-
A. 1. 1s2 2s2 2p6 1s2 2s2 2p6 3s2 3p6 B. 2. 1s2 2s2 2p6 3s1 1s2 2s2 2p6 3s2 3p6
C. 3. 1s2 2s2 2p6 3s2 1s2 2s2 2p6 3s2
D. 4. 1s2 2s2 2p5 1s2 2s2 2p6
Câu 13: Nguyên tố A có 2 electron hóa trị, nguyên tố B có 5 electron hóa trị. Công thức của hợp chất ion tạo

Câu 14: Cho các phân tử sau: F2, H2O, NaF, NH3, C2H4. Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình bền của khí hiếm Neon?
A. 4. B. 5. C. 6. D. 7.
Câu 15: Phân tử nào dưới đây “không tuân theo” quy tắc octet?
A. PCl5 B. CH4 C. H2S. D. NH3
Câu 16: Potassium iodide (KI) được sử dụng như một loại thuốc long đờm, giúp làm lỏng và phá vỡ chất nhầy trong đường thở, thường dùng điều trị cho các bệnh nhân hen suyễn, viêm phế quản mãn tính.
Hình 3.35. Tinh thể potassium iodide
Trong phân tử KI các nguyên tử potassium và iodine đều đã đạt được cấu hình bền của khí hiếm gần nhất. Đó lần lượt là các khí hiếm nào? (Cho 19K, 53I, 10Ne, 18Ar, 36Kr, 54Xe).
A. Neon và argon. B. Argon và xenon.
C. Krypton và argon. D. Xenon và neon.
Câu 17: Vì sao các nguyên tử (không xét các nguyên tử khí hiếm) lại thường có xu hướng liên kết với nhau thành phân tử?
A. Để mỗi nguyên tử trong phân tử đạt được cơ cấu electron ổn định, bền vững.
B. Để mỗi nguyên tử trong phân tử đều đạt được được cấu hình bền vững ở lớp ngoài cùng.
C. Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8.
D. Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất.
Câu 18: Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm neon khi tham gia hình thành liên kết hoá học?
A. Sulfur (Z = 16). B. Oxygen (Z = 8).
C. Hydrogen (Z = 1). D. Chlorine (Z = 17).
Câu 19: Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hoá học?
A. Fluorine (Z = 9). B. Oxygen (Z = 8).
C. Hydrogen (Z = 1). D. Chlorine (Z = 17).
Hình 3.36. Cấu hình electron của một số khí hiếm
Câu 20: Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Khi đó, mỗi nguyên tử I trong I2 đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe. B. Ne. C. Ar. D. Kr.
ThSPhanHữuThành Trang36
Câu 21: Trong các hợp chất, để đạt được cấu hình bền của khí hiếm gần nhất mỗi nguyên tử magnesium đã:
A. Nhường đi 2 e. B. Nhận vào 1 e.
C. Nhường đi 3 e. D. Nhận vào 2 e.
Câu 22: Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc Otet?
A. Z = 12. B. Z = 9. C. Z = 11. D. Z = 10.
Câu 23: Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen.

Dạng 1: Sự hình thành cation và anion
Câu 1: Phát biểu nào sau đây phù hợp với sơ đồ sự hình thành liên kết trong hình?
Hình 3.37. Tinh thể sodium hydride
Trong sodium hydride nguyên tử sodium (Z = 11) có cấu hình bền của khí hiếm
A. Helium(Z = 2). B. Argon(Z = 18).


C. Krypton(Z = 36). D. Neon(Z = 10).
Câu 26: Khi tham gia hình thành liên kết hóa học, các nguyên tử lithium (Z = 3) và chlorine (Z = 17) có
khuynh hướng đạt cấu hình electron bền của lần lượt các khí hiếm nào dưới đây?
A. Helium và argon. B. Helium và neon.
C. Argon và helium. D. Neon và argon.
Câu 27: Hợp chất nào sau đây là trường hợp ”ngoại lệ” của quy tắc Octet?
A. H2O. B. NO2. C. CO2. D. Cl2.
Câu 28: Phân tử nào sau đây có nguyên tử đều đạt cấu hình electron bão hòa theo quy tắc octet?
A. BeH2 B. AlCl3 C. PCl5 D. SiF4
Hình 3.38. Sơ đồ chuyển dịch electron khi hình thành liên kết giữa K và Cl
A. Nguyên tử K nhường electron, nguyên tử Cl nhận electron để trở thành các ion.
B. Nguyên tử K nhận electron, nguyên tử Cl nhường electron để trở thành các ion.
C. Nguyên tử K nhường electron, nguyên tử Cl nhường electron để trở thành các ion.
D. Nguyên tử K nhận electron, nguyên tử Cl nhận electron để trở thành các ion.
Câu 2: Phát biểu nào sau đây phù hợp với sơ đồ:
Hình 3.39. Sơ đồ chuyển dịch electron của nguyên tử magnesium
A. Cation magnesium nhận 2 electron để trở thành nguyên tử magnesium.
B. Cation magnesium nhường 2 electron để trở thành nguyên tử magnesium.
C. Nguyên tử magnesium nhận 2 electron để trở thành cation magnesium.
D. Nguyên tử magnesium nhường 2 electron để trở thành cation magnesium.
Câu 3: Chọn đáp án biểu diễn đúng cấu trúc của ô mạng tinh thể sodium chloride?.
Câu 4: Nguyên tử oxygen có cấu hình electron là: 1s22s22p4. Sau khi tạo liên kết, cấu hình ion oxide là
A. 1s22s22p2 B. 1s22s22p43s2 C. 1s22s22p6 D. 1s22s22p63s2
Câu 5: Nguyên tố calcium có số hiệu nguyên tử là 20. Khi calcium tham gia phản ứng tạo hợp chất ion thì cấu hình electron của cation là
A. 1s22s22p63s23p64s1 . B. 1s22s22p6 .
C. 1s22s22p63s23p6 D. 1s22s22p63s23p63d10
Câu 6: Làm thế nào để một ion calcium có điện tích +2 trở nên trung hòa?
ThSPhanHữuThành
Trang37
ThSPhanHữuThành Trang38
Hình 3.40. Sơ đồ sự tạo thành nguyên tử calcium từ cation calcium
A. Bằng cách nhường đi một electron. B. Bằng cách nhường hai electron.
C. Bằng cách nhận thêm một electron. D. Bằng cách nhận thêm hai electron.
Câu 7: Để đạt được cấu hình bền vững, nguyên tử bromine thường nhận thêm một electron. Phương trình nào dưới đây biểu diễn đúng quá trình trên?
A. Br → Br+ e. B. Br → Br + + e –.
C. Br + + e→ Br. D. Br + e→ Br -
Câu 8: Các ion S2-, Cl-, K+, Ca2+ đều có cấu hình là [Ne] 3s23p6. Dãy sắp xếp theo chiều giảm dần bán kính của các ion là:
A. S2- > Cl - > K+ > Ca2+ . B. K+ > Ca2+ > S2- > Cl.
C. Ca2+ > K+ > Cl- > S2- D. S2- > Cl - > Ca2+ > K+
Tài liệu phát hành từ website Tailieuchuan.vn.
Câu 9: Hai ion X+ và Y- có cùng cấu hình electron, khẳng định nào dưới đây là đúng?
A. Nguyên tử X, Y thuộc cùng 1 chu kỳ trong bảng tuần hoàn.
B. Số electron trong nguyên tử X nhiều hơn trong nguyên tử Y là 2.
C. Số proton trong nguyên tử X bằng số proton trong nguyên tử Y.
D. Nguyên tử X nhiều hơn nguyên tử Y 2 neutron.
Câu 10: Chọn định nghĩa đúng về ion. Ion là
A. Phần tử tạo bởi các hạt mang điện.
B. Phần tử mang điện tạo ra từ nguyên tử hoặc nhóm nguyên tử
C. Hạt vi mô mang điện dương hay âm.
D. Phân tử bị mất hay nhận thêm electron.
Câu 11: Khẳng định nào sai khi nói về ba ion Na+, Mg2+, F-. Cho số hiệu nguyên tử của Na, Mg và F lần lượt
là 11, 12 và 9)
A. 3 ion trên có cấu hình electron giống nhau.
B. 3 ion trên có số neutron khác nhau.
C. 3 ion trên có số electron bằng nhau.


D. 3 ion trên có số proton bằng nhau.
Câu 12: Khẳng định nào sai khi nói về ion?
A. Ion là phần tử mang điện tạo bởi nguyên tử hoặc nhóm nguyên tử.
B. Ion âm gọi là cation, ion dương gọi là anion.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử
D. Ion được hình thành khi nguyên tử nhường hay nhận electron.
Câu 13: Trong các phản ứng hoá học, nguyên tử kim loại điển hình có khuynh hướng
A. Nhận thêm electron tạo thành anion.
B. Nhận hay nhường electron phụ thuộc vào từng phản ứng cụ thể
C. Nhường bớt electron tạo thành cation.
D. Nhận hay nhường electron phụ thuộc vào từng kim loại cụ thể.
Câu 14: Trong phản ứng hoá học, nguyên tử sodium không hình thành được
A. Ion sodium. B. Cation sodium.
C. Anion sodium. D. Ion đơn nguyên tử sodium.
Câu 15: Hoàn thành nội dung sau: Xét các nguyên tử, cation và anion có cùng số electron ở lớp vỏ. “Bán kính nguyên tử. (1) bán kính cation tương ứng và. (2) bán kính anion tương ứng”.
A. (1): nhỏ hơn, (2): lớn hơn. B. (1): lớn hơn, (2): nhỏ hơn.
C. (1): lớn hơn, (2): bằng. D. (1): nhỏ hơn, (2): bằng.
Câu 16: Trong các ion sau: Fe3+, Na+, Ba2+, S2–, Pb2+, Cr3+, Ni2+, Zn2+, Ca2+, Cl–, H+, có bao nhiêu ion không
có cấu hình electron giống khí hiếm? Cho số hiệu nguyên tử của các nguyên tố lần lượt là 26, 11, 56, 16, 46, 26, 28, 30, 17, 1.
A. 5. B. 6. C. 7. D. 8.
Câu 17: Anion X– và cation M2+ (M không phải là Berium) đều có chung một cấu hình electron của khí hiếm
R. Khẳng định nào sau đây là sai?
A. Nếu M ở chu kì 3 thì X là fluorine.
B. Nếu R có n electron thì phân tử hợp chất ion đơn giản giữa X và M có 3n electron.
C. X là nguyên tố p và M là nguyên tố s.
D. Hiệu số hạt mang điện của M và số hạt mang điện của X là 4.
Dạng 2: Sự hình thành liên kết ion
Câu 1: Cho mô hình cấu tạo nguyên tử của nguyên tố X và Y như hình 3.
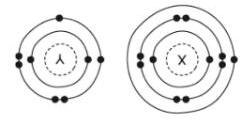
Hình 3.41. Mô hình cấu tạo nguyên tử của nguyên tố X và Y.
Nguyên tố X và Y có thể tham gia liên kết với nhau. Công thức hợp chất ion tạo thành giữa X và Y là
A. X2Y. B. X2Y2 C. X2Y4 D. XY.
Câu 2: Cho mô hình cấu tạo nguyên tử của nguyên tố X và Y như hình 3.
Hình 3.42. Mô hình cấu tạo nguyên tử của nguyên tố X và Y.
Nguyên tố X và Y có thể tham gia liên kết với nhau, tạo nên hợp chất ion. Hợp chất tạo thành có công thức là
A. X2Y.
B. X2Y2 C. X2Y4 D. XY.
Sử dụng thông tin trong đoạn văn trả lời các câu hỏi từ 3 tới 10.
MUỐI ĂN VÀ CÁC HỢP CHẤT ION
Muối ăn hay trong dân gian còn gọi đơn giản là muối (tuy rằng theo đúng thuật ngữ khoa học thì không phải muối nào cũng là muối ăn) là một khoáng chất, được con người sử dụng như một thứ gia vị cho vào thức ăn.
Đây là một chất rắn, dạng tinh thể, có màu từ trắng tới có vết của màu hồng hay xám rất nhạt, thu được từ nước biển hay các mỏ muối. Muối thu được từ nước biển có các tinh thể nhỏ hoặc lớn hơn muối mỏ.
Trong tự nhiên, muối ăn bao gồm chủ yếu là natri chloride (NaCl), nhưng cũng có một ít các khoáng chất khác (khoáng chất vi lượng). Muối ăn từ muối mỏ có thể có màu xám vì dấu vết của các khoáng chất vi lượng.
ThSPhanHữuThành Trang40
mu
i ăn có thể tạo ra muối iodine. Muối ăn (NaCl) có bổ sung thêm một lượng nhỏ KI (hoặc KIO3) nhằm cung cấp nguyên tố vi lượng iodine cho cơ thể con người. Để điều chế muối iodine, người ta thường phun dung dịch potassium iodide (KI) vào muối ăn. Thông thường cứ 1 tấn muối thì cần 60ml dung dịch KI.
Hình 3.43.a. Cánh đồng muối ở Ninh Thuận Hình 3.43.b. Sản phẩm muối ăn hàng ngày của người dân Hình 3.43. Một số hình ảnh của muối sodium chloride Ngoài vai trò phổ biến làm gia vị, muối còn có mặt trong y khoa như nước muối sinh lý. Đây là dung dịch muối sodium chloride 0,9%, gọi là “sinh lý” vì đây là dung dịch đẳng trương, có áp suất thẩm thấu tương đương với cách dịch của cơ thể (máu, nước mắt,.) trong điều kiện bình thường. Để tạo ra nước muối sinh lý, người ta hòa tan 9g muối tinh khiết với 1 lít nước cất. Tuy thành phần và cách bào chế đơn giản, nhưng để tạo ra một sản phẩm nước muối sinh lý đạt tiêu chuẩn cần phải đảm bảo rất nhiều yếu tố từ nguyên liệu muối phải đảm bảo sạch, không tạp chất, không nhiễm khuẩn, nước cất phải đạt chuẩn, dụng cụ pha chế phải đảm bảo sạch, quá trình thao tác cân đong phải chuẩn để nước muối đúng nồng độ, khu vực pha chế phải vô khuẩn,.
Câu 3: Thành phần chủ yếu của muối ăn là
A. NaCl. B. KCl. C. KI. D. KIO3.
Câu 4: Trong tự nhiên, chlorine tồn tại chủ yếu dưới dạng
A. NaCl trong nước biển và muối mỏ.
B. Khoáng vật sinvinit (KCl.NaCl).

C. Đơn chất Cl2 có trong khí thiên nhiên.
D. Khoáng vật cacnalit (KCl.MgCl2.6H2O).
Câu 5: Liên kết giữa ion Na+ và ion Cl- thuộc loại

A. Liên kết cộng hoá trị có cực. B. Liên kết ion.
C. Liên kết cộng hoá trị không cực. D. Liên kết kim loại.
Câu 6: Tìm định nghĩa sai về liên kết ion?
A. Liên kết ion được hình thành bởi lực hút tĩnh điện giữa 2 ion mang điện tích trái dấu.
B. Liên kết ion trong tinh thể NaCl là lực hút tĩnh điện giữa ion Na+ và ion Cl–
C. Liên kết ion là liên kết được hình thành do sự tương tác giữa các ion cùng dấu.
D. Liên kết ion là liên kết giữa 2 nguyên tố có hiệu số độ âm điện > 1,7.
Câu 7: Cho cấu tạo mạng tinh thể NaCl như sau
Hình 3.44. Cấu trúc mạng tinh thể NaCl
Chọn phát biểu đúng về tinh thể NaCl
A. Các ion Na+ và ion Cl– góp chung cặp electron hình thành liên kết.
B. Các nguyên tử Na và Cl góp chung cặp e hình thành liên kết.
C. Các nguyên tử Na và Cl hút nhau bằng lực hút tĩnh điện.
D. Các ion ion Na+ và ion Cl –hút nhau bằng lực hút tĩnh điện.
Câu 8: Muối iodine là muối ăn có chứa thêm lượng nhỏ iodine ở dạng?
A. I2 B. MgI2 C. CaI2 D. KI hoặc KIO3
Câu 9: Thành phần của nước muối sinh lí có chứa
A. 0,9% NaCl. B. 0,09% NaCl. C. 0,009% NaCl. D. 9% NaCl.
Câu 10: Nước muối sinh lí (có tác dụng diệt khuẩn, sát trùng trong y học) là dung dịch có nồng độ 0,9% của muối nào sau đây?
A. NaNO3. B. Na2CO3. C. NaCl. D. Na2SO4.
Câu 11: Bằng cách nào sau đây có thể pha chế được dung dịch NaCl 15%.
A. Hoà tan 15 gam NaCl vào 90 gam H2O.
B. Hoà tan 15 gam NaCl vào 100 gam H2O.
C. Hoà tan 30 gam NaCl vào 170 gam H2O.
D. Hoà tan 15 gam NaCl vào 190 gam H2O.

Câu 12: Hàng năm thế giới cần tiêu thụ khoảng 45 triệu tấn chlorine (Cl2). Nếu dùng muối ăn để điều chế chlorine thì cần bao nhiêu tấn muối (Giả thiết hiệu suất phản ứng đạt 100%)?
A. 74 triệu tấn. B. 74,15 triệu tấn. C. 74,51 triệu tấn. D. 74,14 triệu tấn.
Sử dụng thông tin trong đoạn văn trả lời các câu hỏi từ 13 tới 16
LIÊN KẾT ION
Liên kết ion, là liên kết hóa học hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Trong quá trình hình thành liên kết ion, nguyên tử kim loại điển hình (có 1, 2, 3 electron lớp ngoài cùng) dễ mất electron tạo ra ion dương (cation). Các nguyên tử phi kim điển hình (có 5, 6, 7 electron lớp ngoài cùng) dễ nhận electron để tạo ra ion âm (anion). Vì vậy liên kết ion thường được hình thành do lực hút tĩnh điện giữa các ion kim loại điển hình (cation, ví dụ Na+) và ion phi kim điển hình (anion, ví dụ Cl-). Sau khi sự nhường electron của nguyên tử nguyên tố có độ âm điện nhỏ hơn cho nguyên tử nguyên tố có độ âm điện lớn hơn xảy ra.
ThSPhanHữuThành Trang41
ThSPhanHữuThành Trang42
Hình 3.45. Qúa trình tạo liên kết ion trong phân tử NaCl
Câu 13: Bản chất của liên kết ion là
A. Sự dùng chung các electron.
B. Lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
C. Lực hút tĩnh điện giữa cation kim loại với các electron tự do.
D. Lực hút giữa các phân tử
Câu 14: Hoàn thành nội dung sau: “Các … thường tan nhiều trong nước. Khi nóng chảy và khi hoà tan trong nước, chúng dẫn điện, còn ở trạng thái rắn thì không dẫn điện”.
A. Hợp chất vô cơ. B. Hợp chất hữu cơ.
C. hợp chất ion. D. hợp chất cộng hoá trị
Câu 15: Liên kết ion được tạo thành giữa hai nguyên tử
A. Kim loại điển hình.
B. Phi kim điển hình.
C. Kim loại và phi kim.
D. Kim loại điển hình và phi kim điển hình.
Câu 16: Thông tin “Sau khi sự nhường electron của nguyên tử nguyên tố có độ âm điện nhỏ hơn cho nguyên
tử nguyên tố có độ âm điện lớn hơn xảy ra.” Cụm từ nguyên tố có độ âm điện nhỏ hơn dùng để chỉ?
A. Nguyên tố kim loại. B. Nguyên tố phi kim.
C. Nguyên tố khí hiếm. D. Chưa xác định được.
Câu 17: Liên kết hóa học trong phân tử NaCl được hình thành dựa trên
A. Hai hạt nhân nguyên tử hút electron rất mạnh.
B. Orbital của nguyên tử Na và nguyên tử Cl xen phủ lẫn nhau.
C. Mỗi nguyên tử nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
D. Lực hút tĩnh điện giữa cation sodium và anion chloride.

Câu 18: Khi một electron được thêm vào hoặc bị loại bỏ khỏi nguyên tử, nguyên tử đó sẽ trở thành một
________.
A. ion. B. liên kết.
C. không; nó vẫn là một nguyên tử. D. phân tử.
Câu 19: Khi nguyên tử sodium và nguyên tử chlorine tác dụng với nhau tạo hợp chất thì
A. Năng lượng được giải phóng và liên kết ion được hình thành.
B. Năng lượng được giải phóng và liên kết cộng hóa trị được hình thành.
C. Năng lượng được hấp thụ và liên kết ion được hình thành.
D. Năng lượng được hấp thụ và liên kết cộng hóa trị được hình thành.
Câu 20: Nguyên tử X có 20 hạt proton và nguyên tử Y có 17 hạt electron. Hợp chất hình thành giữa 2 nguyên


tố này có công thức và loại liên kết tương ứng là
A. X2Y, liên kết cộng hóa trị. B. XY2, liên kết ion.
C. XY, liên kết ion. D. X3Y2, liên kết cộng hóa trị.
Câu 21: Cấu hình electron của cặp nguyên tử nào sau đây có thể tạo liên kết ion?
A. 1s22s22p3 và 1s22s22p5 .
B. 1s22s1 và 1s22s22p5 .
C. 1s22s1 và 1s22s22p63s23p2
D. 1s22s22p1 và 1s22s22p63s23p6
Câu 22: Cặp nguyên tố nào sau đây có thể tạo thành hợp chất ion?
A. Carbon và hydrogen. B. Calcium và oxygen.
C. Oxygen và neon. D. Sodium và magsenium.
Câu 23: Theo quy tắc bát tử, một nguyên tử oxygen (Z = 8) có xu hướng
Hình 3.46. Mô hình cấu tạo nguyên tử nguyên tố Oxygen
A. nhường sáu electron để trở nên ổn định.
B. nhận thêm hai electron để trở nên bền vững.
C. mất hai electron để trở nên bền vững.
D. chia sẻ hai cặp electron với một nguyên tử khác để trở nên bền vững.
Câu 24: X là một trong những khoáng chất cần thiết đối với cơ thể; trong mỗi tế bào X chiếm tỉ lệ khoảng 0,004% khối lượng. X có vai trò hỗ trợ cho quá trình tổng hợp hemoglobin và myoglobin. Cấu hình electron của ion X2+ là 1s22s22p63s23p63d7. Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố X thuộc:
A. Chu kì 4, nhóm VIIIB. B. Chu kì 4, nhóm VIIIA.
C. Chu kì 3, nhóm VIB. D. Chu kì 4, nhóm IIA.
Câu 25: Ion berilium có điện tích +2, Ion floride có điện tích -1. Công thức hóa học tạo bởi berilium và floride là:
A. Be2F2. B. Be4F8. C. BeF2. D. Be2F.
Dạng 3: Tính chất của hợp chất ion
Câu 1: Chỉ ra nội dung sai khi nói về tính chất chung của hợp chất ion?
A. Khó nóng chảy, khó bay hơi.
B. Tồn tại dạng tinh thể, tan nhiều trong nước.
C. Trong tinh thể chứa các ion nên dẫn được điện.
D. Các hợp chất ion đều khá rắn.
Hình 3.47. Tinh thể muối ăn là một hợp chất ion
Câu 2: Hầu hết các hợp chất ion
A. Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
B. Dễ hòa tan trong các dung môi hữu cơ
C. Ở trạng thái nóng chảy không dẫn điện.
D. Tan trong nước thành dung dịch không điện li.
Câu 3: Tính chất nào sau đây không phải là tính chất của ion?
A. Chúng thường tạo thành mạng tinh thể
ThSPhanHữuThành
Trang44
B. Chúng thường là chất rắn mềm.
C. Chúng có điểm nóng chảy cao.
D. Chúng dẫn điện khi nóng chảy hoặc hòa tan trong nước.
Câu 4: Trong các phân tử hợp chất ion sau đây: CaCl2, MgO, CaO, Ba(NO3)2, Na2O, KF, Na2S, MgCl2, K2S, KCl có bao nhiêu phân tử được tạo thành bởi các ion có chung cấu hình electron của nguyên tử nguyên tố Argon?
C. Na2O, MgO, Al2O3 D. SO3, Cl2O3, Na2O. Câu 10: Cho các phân tử: NH3 (I); NaCl (II); K2S (III); CH4 (IV); MgO (V); PH3 (VI). Phân tử nào có chứa liên kết ion?

A. I, II. B. IV, V, VI. C. II, III, V. D. II, III, IV.
Câu 11: Cho cấu hình electron của hai nguyên tử ở trạng thái cơ bản như sau:1s
tử này có thể liên kết với nhau bằng loại liên kết gì để tạo thành hợp chất?
A. Liên kết cộng hóa trị có cực. B. Liên kết ion.
C. Liên kết cộng hóa trị không cực. D. Liên kết hydrogen.
Câu 12: Có 2 nguyên tố X (Z = 19); Y (X = 17) hợp chất tạo bởi X và Y có công thức và kiểu liên kết là

A. XY, liên kết ion. B. X2Y, liên kết ion.
C. XY, liên kết cộng hóa trị có cực. D. XY2, liên kết cộng hóa trị có cực.
Câu 13: Cho các nguyên tố: postassium (K), sodium (Na), calcium (Ca), aluminium (Al), fluorine (F), oxygen (O) và chlorine (Cl). Có bao nhiêu phân tử hợp chất ion tạo thành từ 2 nguyên tố trong các nguyên tố trên có cấu hình electron của cation khác cấu hình electron của anion? Cho số hiệu nguyên tử của K = 19, Na = 11, Ca = 20, Al = 13, F = 9, O = 8, Cl = 17.
Hình 3.48. Mô hình cấu tạo nguyên tử nguyên tố Argon
A. 2. B. 3. C. 4. D. 5.
Câu 5: Các hợp chất ion thường có đặc điểm chung là

A. Điểm nóng chảy cao và liên kết không định hướng.
B. Điểm nóng chảy cao và điểm sôi thấp.
C. Liên kết có hướng và điểm sôi thấp.
D. Khả năng hòa tan cao trong dung môi phân cực và không phân cực.
Câu 6: Nguyên nhân làm cho các hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi cao là gì?
A. Liên kết giữa các nguyên tử rất mạnh.
B. Một lượng nhỏ năng lượng là cần thiết để phá vỡ liên kết giữa các ion.
C. Liên kết giữa các ion rất mạnh.
D. Các hợp chất ion bao gồm một cấu trúc tinh thể khổng lồ.
Câu 7: Thông tin trên một bao bì thực phẩm có ghi: "Không có hóa chất nhân tạo". Ở bên dưới, trong các thành phần được liệt kê thấy có "muối biển" (sodium chloride có rất nhiều trong nước biển). Sodium chloride
cũng có thể điều chế nhân tạo bàng cách pha trộn hai hóa chất độc hại là dung dịch NaOH và dung dịch acid
HCl.
Phát biểu nào dưới đây là đúng?
A. Có hai loại sodium chloride, một loại nhân tạo và một loại có trong tự nhiên.
B. Muối biển luôn luôn là dạng sodium chloride tinh khiết hơn sodium chloride nhân tạo.
C. Sodium chloride nhân tạo là chất nguy hiểm vì được tạo bởi các hóa chất độc, trong khi sử dụng muối biển hoàn toàn an toàn.
D. Không có khác biệt hóa học nào giữa sodium chloride tinh khiết từ nguồn tự nhiên hoặc nhân tạo.
Câu 8: Tìm định nghĩa sai về liên kết ion:
A. Liên kết ion được hình thành bởi lực hút tĩnh điện giữa 2 ion mang điện tích trái dấu.
B. Liên kết ion trong tinh thể NaCl là lực hút tĩnh điện giữa ion Na+ và ion Cl–
C. Liên kết ion là liên kết được hình thành do sự tương tác giữa các ion cùng dấu.
D. Liên kết ion là liên kết giữa 2 nguyên tố có hiệu số độ âm điện > 1,7.
Câu 9: Trong dãy oxide sau: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7. Những oxide phân tử có chứa có liên kết ion là
A. Na2O, SiO2, P2O5 B. MgO, Al2O3, P2O5
ThSPhanHữuThành
A. 4. B. 5. C. 6. D. 7. F O C H Na 3,98 3,44 2,55 2,20 0,93
Bảng 3.16. Giá trị độ âm điện của một số nguyên tố
Hợp chất nào sau đây phân tử có chứa liên kết ion?
A. NaF. B. CO2 C. CH4 D. H2O.
Câu 14: Cấu trúc điện tử của nguyên tử Q và R được biểu diễn trong hình:
Hình 3.49. Cấu trúc lớp vỏ của nguyên tử Q và R
Nguyên tố Q và nguyên tố R có thể kết hợp với nhau tạo thành một hợp chất ion. Công thức của hợp chất được tạo thành có dạng?
A. QR7. B. Q2R4. C. QR. D. Q7R.
Câu 15: Nguyên tử nguyên tố X và Y có cấu hình electron lớp ngoài cùng lần lượt là 3s23p1 và 2s22p4. Hợp chất tạo bởi X và Y có công thức là
A. X2Y3
B. X3Y2 C. X2Y. D. XY3.
Câu 16: Liên kết trong phân tử chất nào sau đây mang nhiều tính ion nhất?
A. LiCl.
B. NaCl. C. CsCl. D. RbCl.
Câu 17: Cho các phân tử sau: LiCl, NaCl, KCl, RbCl. Hãy cho biết liên kết trong phân tử nào mang nhiều tính chất ion nhất?
A. LiCl.
Trang45
B. NaCl. C. KCl. D. RbCl.
ThSPhanHữuThành Trang46
Câu 18: Các chất trong phân tử có chứa liên kết ion là
A. KHS, Na2S, NaCl, HNO3. B. Na2SO4, K2S, KHS, NH4Cl.
C. Na2SO4, KHS, H2S, SO2. D. H2O, K2S, Na2SO3, NaHS.
Câu 19: Dãy chất nào sau đây phân tử có chứa liên kết ion?
A. NaCl, H2O, KCl, CsF. B. KF, NaCl, NH3, HCl.
C. NaCl, KCl, KF, CsF. D. CH4, SO2, NaCl, KF.
Câu 20: Trong dãy các hợp chất sau: KF, BaCl2, CH4, H2S. Chất nào là hợp chất ion?
A. Chỉ có KF. B. Chỉ có KF và BaCl2
C. Chỉ có CH4 và H2S. D. Chỉ có H2S.
Câu 21: Cấu trúc nào biểu diễn đúng cấu trúc của tinh thể sodium chloride?
Dạng 1: Công thức electron, công thức cấu tạo và công thức Lewis – Sự hình thành liên kết cộng hoá trị
Câu 1: Hình 3.50 biểu diễn sự hình thành liên kết giữa hai nguyên tử A,. B. Loại liên kết được tạo thành có tên gọi là
Hình 3.50. Sự hình thành liên kết giữa hai nguyên tử A,. B.
A. Liên kết ion. B. Liên kết hydrogen.



C. Liên kết cho nhận. D. Liên kết cộng hóa trị
Câu 2: Hình 3.51 biểu diễn sự hình thành liên kết cộng hóa trị giữa hai nguyên tử A,. B. Liên kết tạo thành có tên gọi là
Hình 3.51. Sự hình thành liên kết giữa hai nguyên tử A,. B.
A. liên kết đơn. B. liên kết đôi.
C. liên kết ba. D. liên kết pi.
Câu 3: Công thức electron của ozone là
A. OO O B. OO O C. O O O D. OO O
Câu 4: Cho mô hình cấu tạo nguyên tử của 4 nguyên tố X, Y, Z, T như hình 3.51. X Y Z T




Hình 3.52. Mô hình cấu tạo nguyên tử của một số nguyên tố
Những nguyên tố có khả năng tham gia hình thành liên kết cộng hóa trị là?
A. X và Y. B. X, Y và Z. C. X và T. D. Y, Z và T.
Câu 5: Cho cấu trúc của phân tử N2H4 như hình 3. Mỗi nguyên tử nitrogen còn mấy cặp electron chưa tham gia liên kết?



Hình 3.53. Cấu trúc của phân tử N2H4
A. 0. B. 2. C. 3. D. 1.
Câu 6: Tổng số cặp electron đã ghép đôi nhưng chưa tham gia liên kết trong phân tử HNO3 là
A. 6. B. 7. C. 8. D. 9.
Câu 7: Trong quá trình trục vớt tàu chìm ở Cần Giờ, Việt Nam vào năm 2019, 5 thợ lặn bất ngờ gặp nạn nghi do ngộ độc khí H2X từ thùng hàng container bị bung ra. Đây là chất khí độc, ở nồng độ thấp gây kích thích màng phổi, mắt, đường thở… với nồng độ lớn có thể gây tử vong. Trong nguyên tử X tổng số hạt (proton, neutron và electron) trong nguyên tử nguyên tố X là 48. Hợp chất H2X chứa loại liên kết hóa học nào sau đây?
Hình 3.55. Liên kết cộng hóa trị trong phân tử oxygen.
Câu 11: Trong phân tử nitrogen, các nguyên tử liên kết với nhau bằng liên kết
Hình 3.54. Nhiều vụ ngộ độc khí H2X đã xảy ra
A. Liên kết cộng hóa trị phân cực. B. Liên kết ion.
C. Liên kết cộng hóa trị không phân cực. D. Liên kết cho – nhận.
Câu 8: Bảng dưới đây cho thấy cấu trúc điện tử (sự phân bố electron trên các lớp vỏ) của bốn nguyên tử X,
Y, Z, W.
Nguyên tử Sự phân bố electron trên các lớp vỏ
W 2, 8, 1

X 2, 8, 4
Y 2, 8, 7
Z 2, 8, 8
Bảng 3.17. Sự phân bố electron trên lớp vỏ của một số nguyên tử.
Hai nguyên tử nguyên tố nào có thể kết hợp với nhau tạo thành hợp chất chứa liên kết cộng hoá trị?
A. W và X. B. W và Y. C. X và Y. D. X và Z.
Câu 9: Hợp chất có liên kết cộng hoá trị được gọi là
A. Hợp chất phức tạp. B. Hợp chất cộng hóa trị.
C. Hợp chất không điện li. D. Hợp chất trung hoà điện.
Câu 10: Tuỳ thuộc vào số cặp electron dùng chung tham gia tạo thành liên kết cộng hóa trị giữa 2 nguyên tử mà liên kết được gọi là
A. Liên kết phân cực, liên kết lưỡng cực, liên kết ba cực.
B. Liên kết đơn giản, liên kết phức tạp.
C. Liên kết ba, liên kết đơn, liên kết đôi.
D. Liên kết xich ma, liên kết pi, liên kết delta.
ThSPhanHữuThành
Hình 3.56. Phân tử nitrogen

A. Cộng hóa trị không phân cực. B. Ion yếu.
C. Hydrogen. D. Cộng hóa trị phân cực.
Câu 12: Phát biểu nào sau đây là đúng?
A. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa nguyên tử kim loại với phi kim.
B. Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một cặp e chung.
C. Liên kết cộng hóa trị không cực là kiên kết giữa 2 nguyên tử của các nguyên tố phi kim.
D. Liên kết cộng hóa trị phân cực trong đó cặp e chung bị lệch về phía 1 nguyên tử có độ âm điện lớn hơn.
Câu 13: Cặp nguyên tử nào dưới đây liên kết với nhau tạo hợp chất cộng hoá trị?
A. H và He. B. Na và F. C. Li và F. D. H và Cl.
Câu 14: Có bao nhiêu cặp electron không tham gia liên kết trong phân tử HF?
A. 1. B. 2. C. 3. D. 4.
Câu 15: Khi hình thành liên kết cộng hóa trị trong phân tử CO2, mô tả nào dưới đây là đúng?
Hình 3.57. Công thức cấu tạo của phân tử CO2.
A. Nguyên tử carbon góp 2 electron, nguyên tử oxygen góp 1 electron.




B. Chỉ có một nguyên tử oxygen góp chung 2 electron.
C. Nguyên tử carbon góp chung với hai nguyên tử 3 cặp electron.
D. Nguyên tử carbon góp chung với mỗi nguyên tử oxygen 2 electron.

Câu 16: Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị không cực là?
A. 2. B. 4. C. 3. D. 5.
Câu 17: Trong các sơ đồ dưới đây các gạch chéo biểu diễn kí hiệu các electron của nguyên tử oxygen, các chấm biểu diễn các electron của carbon. Sơ đồ chấm và gạch chéo nào cho thấy sự sắp xếp các electron ở lớp vỏ ngoài cùng trong phân tử của khí carbon dioxide?
A. B.
Trang49
ThSPhanHữuThành
C. . D. .
Câu 18: Liên kết cộng hóa trị là liên kết
A. Giữa các phi kim với nhau.
B. Trong đó cặp electron chung bị lệch về một nguyên tử

C. Được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
D. Được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
Câu 19: Phát biểu nào sau đây là đúng?
A. Trong liên kết cộng hóa trị, cặp electron lệch về phía nguyên tử có độ âm điện nhỏ hơn.
B. Liên kết cộng hóa trị có cực được tạo thành giữa hai nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
C. Liên kết cộng hóa trị không cực chỉ được tạo nên từ hai nguyên tử giống hệt nhau.
D. Hiệu độ âm điện giữa hai nguyên tử lớn thì phân tử phân cực yếu.
Câu 20: Liên kết hóa học trong phân tử Br2 thuộc loại liên kết
A. Cộng hoá trị không cực. B. Hydrogen.
C. Cộng hoá trị có cực. D. Ion.
Câu 21: Liên kết hoá học giữa các nguyên tử trong phân tử H2O là liên kết
A. Cộng hoá trị không phân cực. B. Hydrogen.
C. Cộng hoá trị có cực. D. Ion.
Câu 22: Liên kết hóa học giữa các nguyên tử trong phân tử HCl thuộc loại liên kết
A. Cộng hoá trị không cực. B. Hydrogen.
C. Cộng hoá trị có cực. D. Ion.
Câu 23: Liên kết hóa học giữa các nguyên tử trong phân tử NH3 thuộc loại liên kết?
A. Cộng hoá trị không cực. B. Hydrogen.
C. Cộng hoá trị có cực. D. Ion.
Câu 24: Trong phân tử ammonia (NH3), số cặp electron chung giữa nguyên tử nitrogen và các nguyên tử hydrogen là
Acid nào mạnh hơn và tại sao?
A. HOCl, vì liên kết H – O yếu hơn trong HOF vì bán kính chlorine lớn hơn fluorine.
B. HOCl, vì liên kết H – O mạnh hơn trong HOF vì chlorine có độ âm điện lớn hơn fluorine.
C. HOF, vì liên kết H – O mạnh hơn trong HOCl vì fluorine có độ âm điện lớn hơn chlorine.
D. HOF, vì liên kết H – O yếu hơn trong HOCl vì bán kính fluorine nhỏ hơn chlorine.
Câu 28: Kiểu liên kết được tạo thành giữa 2 nguyên tử bằng một hay nhiều cặp electron chung được gọi là
A. Liên kết ion. B. Liên kết cộng hoá trị
C. Liên kết kim loại. D. Liên kết hydrogen.
Câu 29: Cho phản ứng giữa hai hợp chất AB và CD cùng mô hình liên kết như sau: 2AB + CD → (E) + A2D
Hình 3.58. Mô hình mô tả cấu trúc phân tử ammonia
A. 3. B. 2. C. 1. D. 4.
Câu 25: Phát biểu nào sau đây không đúng về liên kết có trong phân tử HCl?
A. Giữa nguyên tử H và Cl có một liên kết đơn.
B. Liên kết trong phân tử hình thành bởi 1 cặp electron góp chung.
C. Cặp electron chung lệch về phía nguyên tử Cl nhiều hơn.
D. Liên kết trong phân tử hình thành bởi 1 cặp electron do nguyên tử Cl cho nguyên tử H.
Câu 26: Liên kết trong phân tử nitrogen có chứa
A. Có 1 liên kết σ và 1 liên kết π B. Có 1 liên kết ba.
C. Có 1 liên kết σ và 2 liên kết π. D. Có 2 liên kết σ và 1 liên kết π.
Câu 27: Cấu trúc của hai oxoacid được hiển thị dưới đây:
Phát biểu nào sau đây không đúng?
A. Liên kết trong hợp chất (E) là liên kết cộng hóa trị
B. Trong mô hình liên kết trên giá trị của m = 2.
C. Số cặp electron không liên kết trong B2 > D2
D. Trong hợp chất A2D có 2 cặp electron hóa trị không liên kết.
Câu 30: Liên kết σ được hình thành do
A. Sự xen phủ bên của hai orbital. B. Cặp electron dùng chung.
C. Lực hút tĩnh điện giữa hai ion. D. Sự xen phủ trục của hai orbital.
Câu 31: Hoàn thành nội dung sau: “Trong hợp chất cộng hoá trị, hoá trị của một nguyên tố được xác định bằng. của nguyên tử nguyên tố đó trong phân tử”.
A. Số electron hoá trị. B. Số electron độc thân.



C. Số electron tham gia liên kết. D. Số orbital hoá trị.
Câu 32: Số liên kết σ và π có trong phân tử C2H4 lần lượt là
A. 4 và 1. B. 2 và 0. C. 1 và 1. D. 5 và 1.
Câu 33: Liên kết π được hình thành do
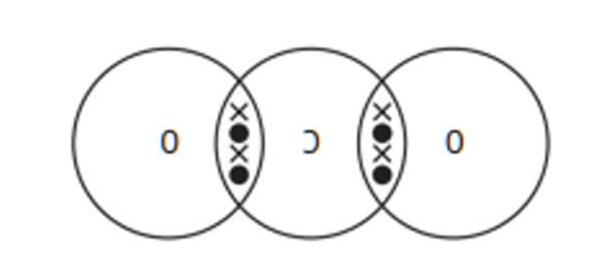
A. Sự xen phủ bên của hai orbital. B. Cặp electron dùng chung.
C. Lực hút tĩnh điện giữa hai ion. D. Sự xen phủ trục của hai orbital.
Câu 34: Liên kết hóa học trong phân tử hydrogen sulfide là liên kết
Hình 3.60. Cấu trúc phân tử hydrogen sulfide

A. Ion. B. Cộng hoá trị. C. Hydrogen. D. Cho – nhận.
Câu 35: Anion X2- có cấu hình electron phân lớp ngoài cùng là 3p6. Nguyên tố X tạo với nguyên tố hydrogen hợp chất chứa liên kết?
ThSPhanHữuThành Trang52
A. Cộng hóa trị phân cực. B. Cộng hóa trị không phân cực.
C. Cho – nhận. D. Ion.
Câu 36: Dãy chất nào sau đây có liên kết cộng hóa trị phân cực?
A. H2, H2O, CH4, NH3 B. NaCl, PH3, HBr, H2S.
C. CH4, H2O, NH3, Cl2O. D. H2O, NH3, CO2, CCl4
Câu 37: Dãy phân tử nào cho dưới đây phân tử nào đều không phân cực?
A. N2, CO2, Cl2, H2. B. N2, Cl2, H2, HCl.
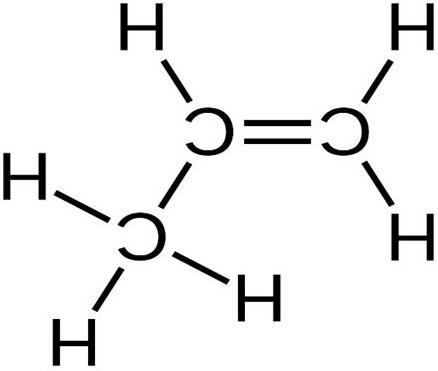
C. N2, HI, Cl2, CH4 D. Cl2, SO2, N2, F2


Câu 38: Dãy chứa các phân tử không phân cực là
A. HBr, CO2, CH4. B. Cl2, CO2, C2H2.

C. HCl, C2H2, Br2. D. NH3, Br2, C2H4.
Câu 39: X, Y, Z là những nguyên tố có số hiệu nguyên tử lần lượt là 8, 19, 16. Nếu các cặp nguyên tố X và
Y, Y và Z, X và Z tạo thành liên kết thì các cặp nào sau đây có nhiều khả năng nhất là liên kết cộng hóa trị có cực?
A. X và Y; Y và Z. B. X và Y.
C. X và Z. D. Y và Z.
Câu 40: Cấu hình electron ở lớp ngoài cùng của các nguyên tố là ns² np5. Liên kết của các nguyên tố này với nguyên tố hydrogen thuộc loại liên kết nào sau đây?
A. Liên kết cộng hóa trị không phân cực.
B. Liên kết cộng hóa trị có cực.
C. Liên kết ion.
D. Liên kết hydrogen.
Câu 41: Hợp chất nào sau đây có liên kết cộng hóa trị?
A. CaF2 B. NaCl. C. CCl4 D. KBr.
Câu 42: Trong phân tử nào chỉ tồn tại liên kết đơn?
A. N2 B. O2 C. F2 D. CO2
Câu 43: Cho các phân tử : H2; CO2; Cl2; N2; I2; C2H4; C2H2. Có bao nhiêu phân tử có liên kết ba trong phân tử ?
A. 1. B. 2. C. 3. D. 4.
Câu 44: Dãy các chất nào chỉ chứa liên kết đơn?
A. C2H4; C2H6. B. CH4;C2H6. C. C2H4; C2H2. D. CH4; C2H2.
Câu 45: Các liên kết trong phân tử nitrogen được hình thành do sự xen phủ của
Hình 3.61. Sự hình thành liên kết công hoá trị trong phân tử nitrogen
A. Các orbital s với nhau.
B. 2 orbital s và 1 orbital p với nhau.
C. 1 orbital s và 2 orbital p với nhau.
D. 3 orbital p giống nhau về hình dạng và kích thước, chỉ khác nhau về sự định hướng trong không gian.
Câu 46: Liên kết trong phân tử Hydrogen chloride (HCl) được hình thành
ThSPhanHữuThành Trang53
Hình 3.69. Sơ đồ biểu diễn liên kết trong phân tử hydrogen chloride
A. Do sự xen phủ giữa orbital p của nguyên tử H và orbital s của nguyên tử Cl.
B. Do sự xen phủ giữa orbital s của nguyên tử H và orbital s của nguyên tử Cl.

C. Do sự xen phủ giữa orbital s của nguyên tử H và orbital p của nguyên tử Cl.
D. Do sự xen phủ giữa orbital p của nguyên tử H và orbital p của nguyên tử Cl.
Câu 47: Cho chất hữu cơ A có công thức cấu tạo như sau:
Hình 3.63. Công thức cấu tạo của hợp chất hữu cơ A
Số liên kết σ trong phân tử A là
A. 6. B. 8. C. 9. D. 11.
Câu 48: Cho các phân tử sau: C2H4, C2H2, O3, N2, CO2, CH4, NH3. Có bao nhiêu phân tử có liên kết đôi và
có bao nhiêu phân tử có liên kết ba?
A. 2 và 2. B. 3 và 2. C. 3 và 1. D. 2 và 1.
Câu 49: Dãy nào sau đây gồm các chất đều có liên kết π trong phân tử?
A. C2H4, O2, N2, H2S. B. CH2, H2O, C2H4, C3H6
C. C2H4, C2H2, O2, N2. D. C3H8, CO2, SO2, O2.
Câu 50: Hình 3.64 biểu diễn công thức cấu tạo của các hợp chất X, Y.
Chọn đáp án đúng
Hình 3.64. Công thức cấu tạo của X và Y
Hợp chất X Y Loại liên kết δ π δ π
A. 4 1 8 1
B. 3 2 7 1
C. 3 2 8 1
D. 4 1 7 1
Câu 51: Số cặp electron góp chung và số cặp electron chưa liên kết của nguyên tử trung tâm trong các phân tử: CH4, CO2, NH3, P2H4, PCl5, H2S lần lượt là
ThSPhanHữuThành Trang54
A. 4 và 0; 4 và 0; 3 và 1; 4 và 2; 5 và 0; 2 và 1.
B. 4 và 1; 4 và 2; 3 và 1; 5 và 2; 5 và 0; 2 và 0.
C. 4 và 1; 4 và 2; 3 và 2; 5 và 2; 5 và 1; 2 và 2.
D. 4 và 0; 4 và 0; 3 và 1; 5 và 2; 5 và 0; 2 và 2.
Câu 52: Phosphorus và nitrogen đều thuộc vào nhóm VA trong bảng tuần hoàn. Phosphorus có thể tạo với chlorine 2 hợp chất đó là PCl3 và PCl5 trong khi nitrogen chỉ tạo với chlorine hợp chất NCl3. Lí giải nào dưới đây là đúng?
Phát biểu nào sau đây không đúng?
A. Trong WX, W mang một phần điện tích dương (δ+);.
B. Độ âm điện của Y < X < Z.

C. Hợp chất tạo thành giữa Y và W là YW4
D. Cả WX và WYZ đều tạo được liên kết hydrogen.
Câu 56: Trong phân tử NH4Cl có bao nhiêu liên kết cộng hóa trị?
Hình 3.62. Công thức cấu tạo của một số phân tử
A. Nguyên tử nitrogen có bán kính nguyên tử nhỏ hơn phosphorus.
B. Nguyên tử nitrogen có độ âm điện lớn hơn phosphorus.
C. Nguyên tử nitrogen không có trạng thái kích thích trong khi phosphorus thì có.
D. Nguyên tử nitrogen có điện tích hạt nhân bé hơn phosphorus.
Câu 53: Cho sơ đồ biểu diễn sự hình thành liên kết trong phân tử khí carbon dioxide.
Hình 3.65. Sự hình thành liên kết trong phân tử carbon dioxide



Phát biểu nào sau đây là sai?
A. Phân tử có cấu tạo góc.
B. Phân tử CO2 không phân cực.
C. Liên kết giữa nguyên tử O và C là liên kết phân cực.
D. Trong phân tử có hai liên kết đôi.
Câu 54: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s – p?
Hình 3.72. Sơ đồ thể hiện sự xen phủ s - p
A. H2. B. NH3. C. Cl2. D. HCl.





Câu 55: Hình sau mô tả cặp electron dùng chung giữa các nguyên tử trong các hợp chất WX và WYZ.
Hình 3.67. Cấu trúc phân tử NH4Cl
A. 1. B. 2. C. 3. D. 4.
Câu 57: Chất mà trong phân tử vừa có liên kết cộng hóa trị phân cực, vừa có liên kết cộng hóa trị không phân cực là
A. CO2. B. H2O. C. NH3. D. C2F6.
Câu 58: Công thức cấu tạo đúng của phân tử CO2 là
A. O ← C → O. B. O = C → O. C. O = C = O. D. O = C – O.
Câu 59: Cho hai chất hữu cơ X và Y có công thức cấu tạo như sau:
Hình 3.66. Mô hình phân tử WX và WYZ
ThSPhanHữuThành
Hình 3.68. Công thức cấu tạo của hợp chất hữu cơ X và Y
Nhận xét nào sau đây là đúng?
A. X và Y có số liên kết σ và số liên kết π bằng nhau.

B. X có số liên kết σ và số liên kết π nhiều hơn Y.
C. X có số liên kết σ nhiều hơn, nhưng số liên kết π ít hơn Y.
D. X có số liên kết σ ít hơn, nhưng số liên kết π nhiều hơn Y.
Câu 60: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p – p?
Hình 3.70. Sơ đồ thể hiện sự xen phủ p - p
A. H2 B. NH3 C. Cl2 D. HCl.
Câu 61: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s – s?
Hình 3.71. Sơ đồ thể hiện sự xen phủ s - s
A. H2 B. NH3 C. Cl2 D. HCl.
Trang55
ThSPhanHữuThành Trang56
Câu 62: Cho mô hình liên kết trong các hợp chất WX và YXZ:
Hình 3.73. Mô hình liên kết trong các phân tử WX và YXZ
Phát biểu nào sau đây là đúng?
A. Số electron hóa trị của X < Y. B. W và Y thuộc cùng một chu kì.
C. Hợp chất YX2 không phân cực. D. Độ âm điện của X < Y < Z.
Dạng 2: Liên kết cho nhận.
Câu 1: Nhóm hợp chất nào sau đây có liên kết cho – nhận?
A. NaCl, CO2 B. HCl, MgCl2 C. NH4NO3, HNO3 D. H2S, HCl.
Câu 2: Phân tử chất nào sau đây có liên kết cho – nhận?
A. H2O. B. NH3 C. H2O2 D. HNO3
Dạng 3: Mối liên hệ giữa hiệu độ âm điện và liên kết.
Câu 1: Cho độ âm điện của H = 2,2, Na = 0,93, C = 2,55 và O = 3,44. Liên kết nào dưới đây là liên kết cộng hóa trị không phân cực?
A. Na-O. B. O-H. C. Na-C. D. C-H.
Câu 2: Cho giá trị độ âm điện của một số nguyên tố sau: Na (0,93), Li (0,98), Mg (1,31), Al (1,61), P (2,19),

S (2,58), Br (2,96) và Cl (3,16). Phân tử nào trong số các phân tử dưới đây có chứa liên kết ion?
A. Na3P. B. MgS. C. AlCl3. D. LiBr.
Câu 3: Dãy chất được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử
A. HCl, Cl2, NaCl. B. NaCl, Cl2, HCl.
C. Cl2, HCl, NaCl. D. Cl2, NaCl, HCl.
Câu 4: Phân tử chất nào sau đây ít phân cực nhất?
A. HCl. B. HF. C. HI. D. HBr.
Câu 5: Độ âm điện của các phi kim giảm dần theo thứ tự F, Cl, Br, H. Lực kéo electron về phía nguyên tử
nitrogen mạnh nhất ở liên kết nào dưới đây?
A. N-H. B. N-F. C. N-Cl. D. N-Br.
Câu 6: Liên kết nào sau đây phân cực nhất? Cho biết độ âm điện tăng theo thứ tự H, C, Br, Cl, F.
A. C-H. B. C-F. C. C-Cl. D. C-Br.
Câu 7: Khả năng hoạt động của các phi kim giảm dần theo thứ tự sau: F > O > Cl. Liên kết trong phân tử nào sau đây có độ âm phân cực lớn nhất?
A. FCl. B. F2O. C. Cl2O. D. Cl2.
Câu 8: Độ âm điện của Ba và S lần lượt là 0,89 và 2,58. Trong phân tử BaS có loại liên kết nào?
A. Liên kết ion. B. Liên kết cộng hóa trị phân cực.
C. Liên kết hydrogen. D. Liên kết cộng hóa trị không phân cực.
Câu 9: Dãy chứa các phân tử được sắp xếp theo thứ tự giảm dần từ trái sang phải mức độ phân cực của liên kết hoá học trong các phân tử HX là (Biết độ âm điện của các nguyên tố như sau: H (2,2); Cl 3(,16); Br (2,96) và I (2,66)).
A. HBr, HI, HCl. B. HI, HBr, HCl.
C. HCl, HBr, HI. D. HI, HCl, HBr.
Câu 10: Hợp chất nào sau đây chứa cả liên kết ion và liên kết cộng hóa trị?
ThSPhanHữuThành
A. CH2O. B. CH4 C. Na2O. D. KOH.
Câu 11: Hợp chất nào dưới đây chứa đồng thời cả liên kết cộng hóa trị và liên kết ion?
A. MgO. B. H2SO4. C. Na2SO4. D. HCl.
Câu 12: Độ âm điện của một số nguyên tố được cho trong bảng:
Cs Ba Cl H S F Te
Chất có liên kết cộng hóa trị không phân cực là:
A. BaF2. B. CsCl. C. H2Te. D. H2S.
Câu 13: Độ âm điện của một số nguyên tố được cho trong bảng:
Cs Ba Cl H O F Te
ảng 3.18. Độ âm điện của một số nguyên tố
Chất nào trong các chất trên có liên kết ion?
A. BaF2. B. CsCl. C. H2Te. D. H2O.
Câu 12: Biết rằng độ âm điện của các nguyên tố Al, O, S, Cl lần lượt là 1,6; 3,5; 2,6 và 3. Trong các hợp chất Al2O3, Al2S3, AlCl3 chất nào là hợp chất ion?
A. Chỉ có Al2O3 và AlCl3 B. Chỉ có Al2O3
C. Chỉ có Al2O3 và Al2S3. D. Chỉ có AlCl3.
Câu 14: Hãy cho biết trong các phân tử sau đây, phân tử nào có độ phân cực của liên kết cao nhất: CaO; MgO; AlCl3; BCl3. Cho biết độ âm điện: O (3,5); Ca (1,0); Mg (1,2); Cl (3,0); Al (1,5) và B (2,8).
A. CaO. B. AlCl3 C. BCl3 D. MgO.
Câu 15: Dãy được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử là
A. HCl, Cl2, NaCl. B. NaCl, Cl2, HCl.
C. Cl2, HCl, NaCl. D. Cl2, NaCl, HCl.
Câu 16: Cho các phân tử: H2S (1), H2O (2), CaS (3), NaCl (4), NH3 (5), NF3 (6). Độ phân cực của các liên kết tăng dần theo thứ tự nào sau đây?
A. (1), (6), (5), (2), (3), (4). B. (1), (5), (6), (2), (3), ( 4).
C. (1), (3), (6), (2), (5), (4). D. (1), (4), (6), (2), (3), (5).
Câu 17: Tính phi kim của các nguyên tố giảm dần theo thứ tự F, O, Cl. Trong các phân tử sau, phân tử có liên kết phân cực nhất là
F2O. B. Cl2O. C. ClF. D.
Trang57
ThSPhanHữuThành Trang58
LIÊN KẾT HYDROGEN VÀ TƯƠNG TÁC VAN DER WAALS
Dạng 1: Liên kết hydrogen.
Câu 1: Điều nào sau đây đúng khi nói về liên kết hydrogen liên phân tử?
A. Là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H-F, H-N, H-O ở phân tử này) với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở một phân tử khác.
B. Là lực hút giữa các phân tử khác nhau.
C. Là lực hút tĩnh điện giữa các ion trái dấu.
D. Là lực hút giữa các nguyên tử trong hợp chất cộng hóa trị
Câu 2: Câu nào sau đây sai?
A. Lực van der Waals là một lực liên phân tử có mặt ở khắp mọi nơi thuộc về tương tác tĩnh điện.
B. Lực van der Waals tương đối yếu, nhưng lực van der Waals càng mạnh thì nhiệt độ nóng chảy và sôi của chất càng cao.
C. Liên kết hydrogen là lực liên phân tử bền chặt chỉ có thể tồn tại giữa các phân tử
D. Khi hình thành liên kết hydrogen thì phải chứa nguyên tử hydrogen và nguyên tử ở hai phía của nguyên tử hydrogen phải có độ âm điện mạnh và bán kính nguyên tử nhỏ.
Câu 3: Sơ đồ nào sau đây thể hiện đúng liên kết hydrogen giữa hai phân tử hydrogen fluoride (HF)

A. Hᵟ+ - Fᵟ- … Hᵟ+ - Fᵟ- B. Hᵟ+ - Fᵟ+ … Hᵟ- - Fᵟ-
C. Hᵟ- - Fᵟ+ … Hᵟ- - Fᵟ+ . D. Hᵟ+ - Fᵟ- … Hᵟ- - Fᵟ+ .
Câu 4: Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
A. CH4 B. H2O. C. PH3 D. H2S.
Câu 5: Hợp chất nào dưới đây không tạo được liên kết hydrogen liên phân tử?
A. CH3OH. B. H2O. C. NH3. D. CH4.
Câu 6: Cho các chất sau: C2H6, H2O, NH3, PF3, C2H5OH. Số chất tạo được liên kết hydrogen là
A. 2. B. 3. C. 4. D. 5.
Câu 7: Giữa nước và HF có thể tạo ra ít nhất được bao nhiêu kiểu liên kết hydrogen?
A. 2. B. 3. C. 4. D. 5.
Câu 8: Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo
được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên
nhân là do
A. Độ âm điện của chlorine nhỏ hơn của nitrogen.
B. Phân tử NH3 chứa nhiều nguyên tử hydrogen hơn phân tử HCl.
C. Tổng số nguyên tử trong phân tử NH3 nhiều hơn so với phân tử HCl.
D. Kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.
Câu 9: Các liên kết biểu diễn bằng các đường nét đứt (liên kết X) ở hình 3.74 dưới đây có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA.
Đó là loại liên kết gì?
A. Liên kết ion. B. Liên kết cộng hóa trị có cực.
C. Liên kết cộng hóa trị không cực. D. Liên kết hydrogen.
Câu 10: Hình 3.75 dưới đây biểu diễn liên kết giữa các nguyên tử trong phân tử nước với nhau.
Hình 3.74. Liên kết X trong chuỗi xoắn đôi DNA
Hình 3.75. Liên kết giữa các nguyên tử trong các phân tử nước với nhau
Dấu “…” biểu thị cho liên kết nào dưới đây?
A. Liên kết ion. B. Liên kết cộng hoá trị.
C. Liên kết hydrogen. D. Liên kết kim loại.
Câu 11: Liên kết các phân tử nước với nhau thuộc loại liên kết:
A. Liên kết hydrogen giữa các phân tử
B. Liên kết hydrogen nội phân tử.
C. Vừa liên kết hydrogen liên phân từ và cả nội phân tử.
D. Không có liên kết.
Hình 3.76. Liên kết hydrogen liên phân tử và nội phân tử
Câu 12: Mức độ liên kết hydrogen của hợp chất phụ thuộc vào:
A. Môi trường xung quanh.
B. Cấu tạo phân tử của hợp chất.
C. Dung môi hòa tan hợp chất.
D. Trạng thái vật chất của hợp chất.
Câu 13: Phân tử nào sau đây có thề tạo liên kết hydrogen?
A. Na. B. Oxi. C. Al. D. Rb.
Câu 14: Phân tử nào sau đây không có khả năng tạo liên kết hydrogen?
A. H2O. B. O-nitrophenol. C. NaCl. D. HF.

Câu 15: Hợp chất nào sau đây có nhiệt độ sôi cao nhất
A. Methane. B. Ethane. C. Ethanol. D. Đimethyl ete.
Câu 16: Nguyên tố nào sau đây ít có khả năng tham gia liên kết hidro nhất
A. O. B. F. C. S. D. N.
Câu 17: Giữa ancol ethanol, phenol, nước có 9 loại liên kết hydrogen. Loại liên kết nào bền nhất.

A. Phenol và alcohol. B. Phenol và nước.
C. Alcohol và phenol. D. Nước và alcohol.
Câu 18: Khi hai cục nước đá đè lên nhau, chúng hợp nhất với nhau để tạo thành một khối. Lực nào sau đây
có nhiệm vụ giữ chúng lại với nhau?
A. Hình thành liên kết hydrogen. B. Lực van der Waals.
C. Lực hút cộng hóa trị. D. Tương tác ion.
A. Các nguyên tử trong phân tử.
C. Các proton trong hạt nhân.
Hình 3.78. Tương tác Van der Waals
B. Các electron trong phân tử.
D. Các neutron và proton trong hạt nhân.
Câu 5: Tương tác van der Waals tồn tại giữa:
A. Ion. B. Hạt proton. C. Hạt neutron. D. Phân tử

Câu 6: Giữa các nguyên tử Ne có thể có loại liên kết nào?
A. Liên kết cộng hoá trị. B. Liên kết ion.
C. Tương tác van der Waals. D. Không có bất kì loại liên kết nào.
Câu 7: Thứ tự nào sau đây thể hiện độ mạnh giảm dần của các liên kết?
A. Liên kết ion > liên kết cộng hoá trị > liên kết hydrogen > tương tác van der Waals.
B. Liên kết ion > liên kết cộng hoá trị > tương tác van der Waals > liên kết hydrogen.
Hình 3.77. Mật độ của các phân tử nước ở trạng thái rắn và lỏng
Câu 19: Cho 4 chất: X (C2H5OH); Y (CH3CHO); Z (HCOOH); G (CH3COOH).
Nhiệt độ sôi sắp theo thứ tự tăng dần như sau:
A. Y < Z < X < G. B. Z < X < G < Y. C. X < Y < Z < G. D. Y < X < Z < G.
C. Liên kết cộng hoá trị > liên kết ion > liên kết hydrogen > tương tác van der Waals.
D. Tương tác van der Waals > liên kết hydrogen > liên kết cộng hoá trị > liên kết ion.
Câu 8: Quy tắc octet không được sử dụng khi xem xét sự hình thành của hai loại liên kết hoặc tương tác nào
sau đây?
(1) Liên kết cộng hoá trị
(2) Liên kết ion.
(3) Liên kết hydrogen
(4) Tương tác van der Waals.
Dạng 2: Tương tác Van Der Waals
Câu 1: Trong số các tính chất sau đây của chất cấu tạo từ phân tử, tính chất nào liên quan đến độ lớn của lực
van der Waals là
A. Ổn định nhiệt.
B. Điểm nóng chảy và điểm sôi.
C. Sự oxi hoá hoặc sự khử
D. Khối lượng riêng.
Câu 2: Phát biểu nào sau đây về liên kết hydro và lực van der Waals là đúng:
A. Liên kết hydrogen mạnh hơn lực van der Waals nên nó là liên kết hóa học.
B. Sự hình thành liên kết hydrogen giữa các phân tử làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
C. Điểm sôi HI > HBr > HCl > HF.
D. H2O là một hợp chất bền do sự hình thành các liên kết hydro giữa các H2O.
Câu 3: Tương tác van der Waals được hình thành do

A. Tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử
B. Tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các phân tử
C. Tương tác tĩnh điện lưỡng cực – lưỡng cực giữa nguyên tử hay phân tử
D. Lực hút tĩnh điện giữa các phân tử phân cực.
Câu 4: Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
A. (1) và (2).
B. (2) và (3). C. (3) và (4). D. (1) và (3).
Câu 9: Trong các khí hiếm sau, khí hiếm nào có nhiệt độ sôi cao nhất?
A. He. B. Ne. C. Ar. D. Kr.
Câu 10: Nhiệt độ sôi của từng chất methane, ethane, propane và butane là một trong bốn nhiệt độ sau: 00C, -
1640C, -420C và -880C. Nhiệt độ sôi -880C là của chất nào sau đây?
A. Methane. B. Ethane. C. Propane. D. Butane. BẢNG ĐÁP ÁN
Dạng 3: Độ dài liên kết và năng lượng liên kết.
Câu 1: Năng lượng liên kết được định nghĩa là
A. Năng lượng tỏa ra khi hai nguyên tử tham gia liên kết với nhau.
B. Năng lượng thu vào khi hình thành liên kết giữa hai nguyên tử.
C. Năng lượng cần cung cấp để tạo thành liên kết giữa hai nguyên tử.
D. Năng lượng cần cung cấp đủ để tách hai nguyên tử tham gia liên kết thành hai nguyên tử độc lập tồn tại ở thể khí trong điều kiện chuẩn.
Câu 4: Dựa vào giá trị năng lượng liên kết ở Bảng dưới đây:
Trang 61
Bnagr 3.19. Năng lượng liên kết trung bình của các phân tử halogen
Năng lượng liên kết đặc trưng cho độ bền của liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền và
phân tử càng khó bị phân hủy. Hãy chọn phương án đúng khi so sánh độ bền liên kết giữa Cl2, Br2 và I2
A. I2 > Br2 > Cl2 B. Br2 > Cl2 > I2
C. Cl2 > Br2 > I2. D. Cl2 > I2 > Br2.
Câu 5: Đặt độ dài liên kết N – N, N = N và N ≡ N lần lượt là I1, I2, I3. Thứ tự tăng dần độ dài liên kết là
A. I1, I2, I3 B. I1, I3, I2
C. I2, I1, I3 D. I3, I2, I1
Câu 6: Phát biểu nào sau đây đúng khi nói về độ bền của một liên kết?
A. Khi nhiều liên kết được hình thành giữa hai nguyên tử, độ bền liên kết sẽ giảm.
B. Độ bền của liên kết tăng khi độ dài của liên kết tăng.
C. Độ bền của liên kết tăng khi độ dài của liên kết giảm.
D. Độ bền của liên kết không phụ thuộc vào độ dài liên kết.
Câu 7: Phát biểu nào sau đây không liên quan gì đến năng lượng liên kết và độ dài liên kết?
A. Nhiệt độ sôi của H2O cao hơn H2S.
B. SiC có nhiệt độ nóng chảy cao hơn silicon kết tinh.
C. Tính chất hóa học của O2 dễ phản ứng hơn N2.
D. HF bền hơn HCl.
Câu 8: Dữ liệu trong bảng dưới đây là năng lượng (kJ) cần thiết để phá vỡ liên kết hóa học trong 1 mol một chất:
Cl2 Br2 I2 HCl HBr HI H2 243 193 151 431 366 298 436
Bảng 3.20. Năng lượng cần thiết để phá vỡ 1 mol các chất
(1) Chất nào sau đây có năng lượng thấp nhất
A. H2 B. Cl2 C. Br2 D. I2
(2) Trong số hợp chất HCl, HBr và HI, I2 chất _____ bền nhất khi đun nóng:
A. HCl. B. HBr. C. HI. D. I2.
Câu 9: Năng lượng liên kết của liên kết H-Cl là 431,4kJ/mol, phát biểu nào sau đây về năng lượng liên kết là
đúng?
A. Năng lượng 431,4kJ được giải phóng cho mỗi 2 mol H-Cl liên kết được tạo ra.
B. Hấp thụ 431,4kJ năng lượng trên mỗi 1 mol liên kết H-Cl bị phá vỡ.
C. Năng lượng 431,4kJ được giải phóng cho mỗi 1 mol liên kết H-Cl bị phá vỡ
D. Hấp thụ 431,4kJ năng lượng trên mỗi 1 mol liên kết H-Cl được tạo ra.
Câu 10: Dữ liệu trong bảng dưới đây là năng lượng (kJ) tiêu thụ để phá vỡ các liên kết hóa học trong 1 mol chất.
Cl2 Br2 I2 HCl HBr HI H2
243 193 151 431 366 298 436
Bảng 3.21. Năng lượng cần thiết để phá vỡ 1 mol các chất
Trả lời các câu hỏi (1) đến (3) theo dữ kiện trên:
(1) Chất nào sau đây có năng lượng thấp nhất là ________
A. H2. B. Cl2. C. Br2. D. HCl.
(2) Trong số các hiđrua sau đây, hiđrua bền nhất là _______
A. HF. B. HCl. C. HBr. D. HI.
Câu 11: Quy luật thay đổi của các tính chất vật liệu sau đây liên quan đến năng lượng liên kết của liên kết cộng hóa trị?
A. Nhiệt độ nóng chảy và nhiệt độ sôi của F2, Cl2, Br2 và I2 tăng dần.
B. Độ bền nhiệt của HF, HCl, HBr và HI giảm dần.
C. Độ cứng, nhiệt độ nóng chảy và nhiệt độ sôi của kim cương cao hơn kim cương tinh thể.
D. Nhiệt độ nóng chảy của NaF, NaCl, NaBr và NaI giảm dần theo thứ tự
Câu 12: Khẳng định nào sau đây là đúng?
A. Độ dài liên kết càng dài thì liên kết hoá học. .
B. Càng mạnh. Sự xen phủ obitan nguyên tử giữa các nguyên tử liên kết càng ít thì liên kết cộng hoá trị càng bền. .
C. Đối với phân tử dioxide, năng lượng liên kết càng lớn thì phân tử chứa liên kết càng bền.
D. Liên kết hóa học được hình thành bằng cách chia sẻ các cặp electron giữa các nguyên tử được gọi là liên kết ion.
Câu 13: Người ta biết rằng tinh thể C3N4 có thể có độ cứng lớn hơn kim cương, và các nguyên tử đều liên kết với nhau bằng liên kết đơn. Phát biểu nào sau đây về tinh thể C3N4 là đúng?
A. Tinh thể C3N4 là tinh thể phân tử
B. Trong tinh thể C3N4, độ dài liên kết của liên kết C-N dài hơn độ dài liên kết C-C trong kim cương.
C. Trong tinh thể C3N4, mỗi nguyên tử C liên kết với 4 nguyên tử N, còn mỗi nguyên tử N liên kết với 3
nguyên tử
D. Các liên hạt trong tinh thể C3N4 liên kết với nhau bằng liên kết ion hơn.
Câu 14: Kích thước của năng lượng liên kết có thể đo độ bền của liên kết hóa học. Câu nào sau đây sai?
Liên kết hoá học Si - O Si – Cl H - H H – Cl Si – Si Si - C
ng 3.22. Năng lượng liên kết của một số liên kết
A. Điểm nóng chảy của SiCl4 thấp hơn của SiC.
B. HCl bền hơn HI.
C. Năng lượng liên kết của C-C lớn hơn của Si-Si.
D. Năng lượng được hấp thụ để phá vỡ liên kết hóa học trong 1mol silicon kết tinh là 176kJ.
Câu 15: Theo dữ liệu về năng lượng liên kết (năng lượng giải phóng hoặc hấp thụ để hình thành hoặc phá vỡ 1 mol liên kết hóa học) được liệt kê trong bảng dưới đây, hãy xác định phân tử bền nhất trong số các phân tử sau?
Liên kết hoá học H - H H – Cl Cl – Cl Br – Br NL chính kJ 436 431 247 193 Bảng 3.23. Năng lượng liên kết của một số liên kết
A. HCl. B. HBr. C. H2 D. Br2
Câu 16: So sánh các công thức sau: Cl + Cl → Cl2 (tỏa nhiệt 247kJ), O + O → O2 (tỏa nhiệt 493kJ) và N + N → N2 (tỏa nhiệt 946 kJ), có thể kết luận rằng:

A. Nitrogen bền hơn oxygen và chlorine ở nhiệt độ thường.
B. Chlorine, nitrogen và oxygen là những chất khí ở nhiệt độ thường.
C. Chlorine bền hơn nitrogen và oxygen ở nhiệt độ thường.
D. Chlorine, nitrogen và oxygen có mật độ khác nhau.
BẢNG ĐÁP ÁN
A. CÂU HỎI TỰ LUẬN
Câu 1: Hoàn thành các nội dung sau:
- Liên kết hóa học ………………………………………………………………………………………………...……
- Quy tắc octet……………………………………………………………………………………….………...……….
- Ion ……………………………………………………………………………………………………………….….
- Liên kết ion ……………………………………………………………………………………………………….….
- Liên kết cộng hóa trị ………………………………………………………………………………………………...
- Liên kết cho – nhận ………………………………………………………………………………………………….
- Liên kết σ
- Liên kết π ……………………………………………………………………………………………………………
- Năng lượng liên kết ………………………………………………………………………………..…………………
- Liên kết hydrogen …………………………………………………………………………………………………...
- Tương tác van der Waals ……………………………………………………………………………
Câu 2: Điền thông tin còn thiếu vào ô trống thích hợp trong bảng sau:
KHNT Cấu hình electron ngoài cùng
Bảng 1: Vận dụng quy tắc octet
Sự phân bố electron ở lớp ngoài cùng Xu hướng khi tham gia hình thành liên kết hóa học
Nhận Nhường Góp chung
Ar K Ca Br Bảng 2: Sự hình thành ion
SỰ HÌNH THÀNH ION DƯƠNG (CATION) SỰ HÌNH THÀNH ION ÂM (ANION)
1 NaNa1e [Ne]3s[Ne]
+ →+ 2 24 O2eO [He]2s2p[Ne] +→
2 Mg [Ne]3s 25 F [He]2s2p
21 Al [Ar]3s3p 24 S [Ne]2s2p
1 Li [He]2s → 25 Cl [Ne]2s2p
2 Ca [Ar]3s → 23 N [He]2s2p
Bảng 3: Sự hình thành liên kết ion
+−
+→+→
Bảng 4: Sự hình thành liên kết cộng hóa trị
STT PHÂN TỬ SỰ HÌNH THÀNH LIÊN KẾT CỘNG HÓA TRỊ
B. HỆ THỐNG CÂU HỎI TRẮC NGHIỆM
● Cấp độ nhận biết
Câu 1: Khi tham gia liên kết, nguyên tử Na có xu hướng tạo thành ion có điện tích là
A. 2-. B. 1-. C. 2+. D. 1+.
Câu 2: Khi tham gia liên kết, nguyên tử Mg có xu hướng tạo thành ion có điện tích là
A. 2-. B. 1-. C. 2+. D. 1+.
Câu 3: Khi tham gia liên kết, nguyên tử Al có xu hướng tạo thành ion có điện tích là
A. 3-. B. 3+. C. 2+. D. 2-.
Câu 4: Khi tham gia liên kết, nguyên tử O có xu hướng tạo thành ion có điện tích là
A. 2-. B. 1-. C. 2+. D. 1+.
Câu 5: Khi tham gia liên kết, nguyên tử Cl có xu hướng tạo thành ion có điện tích là
A. 2-. B. 1-. C. 2+. D. 1+.
Câu 6: Ion Mg2+ có cấu hình eletron giống cấu hình electron của khí hiếm nào?
A. Helium. B. Neon. C. Argon. D. Krypton.
Câu 7: Hợp chất nào sau đây có liên kết ion?
A. KCl. B. HCl. C. NH3 D. H2O.
Câu 8: Hợp chất nào sau đây có liên kết ion?
Bảng 5: Công thức của một số chất STT Công thức phân tử Công thức electron Công thức Lewis Công thức cấu tạo Liên kết đơn/đôi/ba
A. HCl. B. H2 C. MgO. D. H2O.
Câu 9: Hợp chất có chứa liên kết ion là
A. NH3 B. CH3COOH. C. NH4NO3 D. HNO3
Câu 10: Hợp chất nào sau đây mà trong phân tử có liên kết ion?
A. H2SO4 B. H2S. C. NaNO3 D. HBr.
Câu 11: Hợp chất nào sau đây có liên kết cộng hóa trị?
A. HCl. B. MgO. C. NaCl. D. K2O.
Câu 12: Chất nào sau đây có liên cộng hóa trị?
A. KCl. B. CaO. C. H2 D. Na2O.
Câu 13: Chất nào sau đây có liên cộng hóa trị không phân cực?
A. HCl. B. NH3 C. Cl2 D. H2O.
Câu 14: Hợp chất nào sau đây có liên kết cộng hóa trị không phân cực?
A. LiCl. B. CF2Cl2 C. CHCl3 D. N2
Câu 15: Chất nào sau đây có liên cộng hóa trị phân cực?
A. O2 B. NH3 C. Cl2 D. H2
Câu 16: Hợp chất nào sau đây có liên kết cộng hóa trị phân cực?
A. H2. B. CHCl3. C. O2. D. N2.
Câu 17: Dựa vào hiệu độ âm điện giữa hai nguyên tố, cho biết liên kết trong phân tử nào sau đây là phân cực nhất?
A. HF B. HCl. C. HBr. D. HI.
Câu 18: Phân tử nào sau đây là phân tử không phân cực?
A. CO. B. HCl. C. CO2. D. H2O.
Câu 19: Cho dãy các chất: HCl, H2O, N2, H2, NH3, NaCl. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị không cực là
A. 2. B. 4. C. 3. D. 5.
Câu 20: Cho dãy các chất: Cl2, HCl, H2O, O2, H2, NH3. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
A. 2. B. 4. C. 3. D. 5.
Câu 21: Trong phân tử HNO3 có bao nhiêu loại liên kết?
A. 1. B. 2. C. 3. D. 4.
Câu 22: Trong phân tử nào sau đây chỉ tồn tại liên kết đơn?
A. N2 B. O2 C. F2 D. CO2
Câu 23: Trong phân tử nào sau đây chỉ tồn tại liên kết ba?
A. N2 B. H2 C. Cl2 D. CO2
Câu 24: Trong phân tử nào sau đây chỉ tồn tại liên kết đôi?
A. N2 B. O2 C. NH3 D. HCl.
Câu 25: Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
A. CH4 B. H2O. C. PH3 D. H2S.
Câu 26: Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
A. CH4 B. CO2 C. NH3 D. H2S.
Câu 27: Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
A. CH4 B. HCl. C. PH3 D. HF.
Câu 28: Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
A. H2S. B. PH3 C. HI. D. CH3OH.
Câu 29: Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
A. C2H5OH. B. PH3
C. HI. D. HBr.
Câu 30: Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?
A. CH4 B. CH3COOH. C. H3COCH3 D. PH3
Câu 31: Cho các chất sau: C2H6; H2O; NH3; PF3; C2H5OH. Số chất tạo được kiên kết hydrogen là
A. 2. B. 3. C. 4. D. 5.
Câu 32: Cho các phân tử H2O, NH3, HF, H2S, CO2, HCl. Số phân tử có thể tạo liên kết hydrogen với phân tử cùng loại là
A. 3. B. 4.
● Cấp độ thông hiểu
C. 5. D. 6.
Câu 33: Theo quy tắc octet, khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
A. kim loại kiềm gần kể
C. nguyên tử halogen gần kề
Câu 34: Liên kết hoá học là
B. kim loại kiểm thổ gần kể
D. nguyên tử khí hiếm gần kể
A. sự kết hợp của các hạt cơ bản hình thành nguyên tử bền vững
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
C. sự kết hợp của các phân tử hình thành các chất bền vững.
D. sự kết hợp của chất tạo thành vật thể bền vững.
Câu 35: Vì sao các nguyên tử lại liên kết với nhau thành phân tử?
A. Để mỗi nguyên tử trong phân tử đạt được cơ cấu hình electron bền vững.
B. Để mỗi nguyên tử trong phân tử đều đạt 8 electron ở lớp ngoài cùng.
C. Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8.
D. Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất.
Câu 36: Liên kết hóa học được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu gọi là
A. liên kết cộng hóa trị có cực.
C. liên kết cộng hóa trị không cực.
B. liên kết kim loại.
D. liên kết ion.
Câu 37: Liên kết ion là loại liên kết hoá học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
A. Cation và anion.
C. Cation và các electron tự do.
B. Các anion.
D. Electron và hạt nhân nguyên tử
Câu 38: Liên kết ion được tạo thành giữa hai nguyên tử bằng
A. một hay nhiều cặp electron dùng chung.
B. một hay nhiều cặp electron dùng chung nhưng chỉ do một nguyên tử đóng góp.
C. lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
D. một hay nhiều cặp electron dùng chung và cặp electron dùng chung bị lệch về phía nguyên tử có độ âm điện lớn hơn.
Câu 39: Liên kết ion tạo thành giữa hai nguyên tử
A. kim loại điển hình.
B. phi kim điển hình.
C. kim loại và phi kim.
D. kim loại điển hình và phi kim điển hình.
Câu 40: Chỉ ra nội dung sai khi nói về ion:
A. Ion là phần tử mang điện.
B. Ion âm gọi là cation, ion dương gọi là anion.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử
D. Ion được hình thành khi nguyên tử nhường hay nhận electron.
Câu 41: Biểu diễn sự tạo thành ion nào sau đây đúng?
A. + +→ Na1eNa . B. →+ 2 Cl2Cl2e .
C. +→ 2 2 O2e2O
D. + →+ 3 AlAl3e
Câu 42: Để đạt quy tắc octet, nguyên tử của nguyên tố potassium (Z = 19) phải nhường đi
A. 2 electron. B. 3 electron. C. 1 electron. D. 4 electron.
Câu 43: Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
A. Z=12. B. Z=9. C. Z=11. D. Z=10.
Câu 44: Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi thành liên kết hóa học?
A. Boron. B. Sodium. C. Helium. D. Fluorine.
Câu 45: Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
A. cho đi 2 electron
C. cho đi 3 electron.
B. nhận vào 1 electron
D. nhận vào 2 electron.
Câu 46: Nguyên tử oxygen (Z=8) có xu hướng nào sau đây để đạt lớp vỏ thỏa mãn quy tắc octet?
A. Nhường 6 electron.
C. Nhường 8 electron.
B. Nhận 2 electron.
D. Nhận 6 electron.
Câu 47: Nguyên tử lithium (Z=3) có xu hướng nào sau đây để đạt lớp vỏ thỏa mãn quy tắc octet?
A. Nhường 1 electron. B. Nhận 7 electron.
C. Nhường 11 electron. D. Nhận 1 electron.
Câu 48: Nguyên tử nào sau đây có thể nhận bốn electron để đạt cấu hình electron bền vững?
A. Silicon. B. Beryllium. C. Nitrogen. D. Selenium.
Câu 49: Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm neon khi tham gia hình thành liên kết hoá học?
A. Chlorine B. Sulfur. C. Oxygen. D. Hydrogen.
Câu 50: Nguyên tử của nguyên tố nào sau đây có xu hướng đặt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hoá học?
A. Fluorine. B. Oxygen. C. Hydrogen. D. Chlorine.
Câu 51: Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride, nguyên tử sodium có cấu hình electron bền của khí hiếm
A. helium. B. argon. C. krypton D. neon.
Câu 52: Nguyên tử nào sau đây không có xu hướng nhường hay nhận electron để đạt lớp vỏ thỏa mãn quy tắc octet?
A. Nitrogen. B. Oxygen. C. Sodium. D. Hydrogen.
Câu 53: Nguyên tử nào trong các nguyên tử sau đây không có xu hướng nhường electron để đạt lớp vỏ thỏa mãn quy tắc octet ?
A. Calcium. B. Magnesium. C. Potassium. D. Chlorine.
Câu 54: Khi tham gia hình thành liên kết hoá học, các nguyên tử lithium và chlorine có khuynh hướng đạt cấu hình electron bền của lần lượt các khí hiếm nào dưới đây?
A. Helium và argon. B. Helium và neon.
C. Neon và argon. D. Argon và helium.
Câu 55: Nguyên tử nitrogen (nitơ) và nguyên tử aluminium (nhôm) có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình electron bền vững?
A. Nhận 3 electron, nhường 3 electron.
B. Nhận 5 electron, nhường 5 electron.
C. Nhường 3 electron, nhận 3 electron. D. Nhường 5 electron, nhận 5 electron.

Câu 56: Cho các ion sau. Ca2+ , F- , Al3+ và N3-, O2- Số ion có cấu hình electron của khí hiếm neon là
A. 4. B. 2. C. 1. D. 3.
Câu 57: Số electron và proton trong NH4 + là
A. 11 và 11. B. 10 và 11. C. 11 và 10. D. 11 và 12.
Câu 58: Cặp nguyên tử nào sau đây không tạo được hợp chất dạng 2 XY hoặc 2XY ?
A. Na và O. B. K và S C. Ca và O. D. Ca và Cl.
Câu 59: Nhóm hợp chất nào sau đây đều là hợp chất ion?
A. H2S, Na2O. B. CH4, CO2
Câu 60: Dãy hợp chất nào sau đây có chứa liên kết ion?
A. Na2O; KCl; HCl.
C. Na2O; H2S; NaCl.
Câu 61: Dãy các phân tử đều có liên kết ion là
A. Cl2, Br2, I2. HCl.
C. BaCl2, Al2O3, KCl, Na2O.
C. CaO, NaCl. D. SO2, KCl.
B. K2O; BaCl2; CaF2
D. CO2; K2O; CaO.
B. HCl, H2S, NaCl, N2O.
D. HCl, H3PO4, H2SO4. MgO.
Câu 62: Cho các chất sau: NaCl, H2O, K2O, BaCl2, CaF2, HCl, NH4NO3. Số phân tử có liên kết ion là
A. 7. B. 5.
C. 6. D. 4.
Câu 63: Số lượng các hợp chất chứa hai loại ion có thể tạo thành từ các ion Na+, Ca2+, F–, 2 3CO là
A. 2. B. 3. C. 4. D. 5.
Câu 64: Phân tử KCl được hình thành do
A. sự kết hợp giữa hai nguyên tử K và Cl.
C. sự kết hợp giữa hai ion K- và Cl+
B. sự kết hợp giữa hai ion K+ và Cl2-
D. sự kết hợp giữa hai ion K+ và Cl-
Câu 65: Cặp nguyên tố nào sau đây có khả năng tạo thành liên kết ion trong hợp chất của chúng?
A. Nitrogen và oxygen.
C. Sulfur và oxygen.
B. Carbon và oxygen.
D. Calcium và oxygen.
Câu 66: Phát biểu nào sau đây phù hợp với sơ đồ sự hình thành liên kết dưới đây?
C. Nguyên tử K nhường electron, nguyên tử Cl nhường electron để trở thành các ion.
D. Nguyên tử K nhận electron, nguyên tử Cl nhận electron để trở thành các ion.
Câu 67: Hợp chất X có các tính chất sau: Ở thể rắn trong điều kiện thường, dễ tan trong nước tạo dung dịch dân
điện được. X là
A. sodium chloride (natri clorua). B. glucose (glucozơ).
C. sucrose (saccarozơ). D. fructose (fructozơ).
Câu 68: Điều nào dưới đây đúng khi nói về ion S2-?
A. Có chứa 18 proton.
B. Có chứa 18 electron.
C. Trung hoà về điện.
D. Được tạo thành khi nguyên tử sulfur (S) nhận vào 2 proton.
Câu 69: Tính chất nào sau đây không phải của magnesium oxide (MgO)?
A. Có nhiệt độ nóng chảy cao hơn so với NaCl.
B. Chất khí ở điều kiện thường.
C. Có cấu trúc tinh thể
D. Phân tử tạo bởi lực hút tĩnh điện giữa ion Mg2+ và O2-
Câu 70: Điều nào dưới đây không đúng khi nói về hợp chất sodium oxide (Na2O)?
A. Trong phân tử Na2O, các ion sodium và ion oxygen đều đạt cấu hình electron bền vững của khí hiếm neon.
B. Phân tử Na2O tạo bởi lực hút tĩnh điện giữa hai ion Na+ và một ion O2-
C. Là chất rắn trong điều kiện thường.
D. Không tan trong nước, chỉ tan trong dung môi không phân cực như benzene carbon tetrachloride,...
Câu 71: Tính chất nào dưới đây đúng khi nói về hợp chất ion?
A. Hợp chất ion có nhiệt độ nóng chảy thấp.
B. Hợp chất ion tan tốt trong dung môi không phân cực.
C. Hợp chất ion có cấu trúc tinh thể
D. Hợp chất ion dẫn điện ở trạng thải rắn.
Câu 72: Tính chất nào sau đây là tính chất của hợp chất ion?
A. Hợp chất ion có nhiệt độ nóng chảy thấp.
B. Hợp chất ion có nhiệt độ nóng chảy cao.
C. Hợp chất ion dễ hoá lỏng.
D. Hợp chất ion có nhiệt độ sôi không xác định.
Câu 73: Để đạt quy tắc octet, hai nguyên tử F (Z=9) đã góp chung bao nhiêu electron?
A. 2. B. 6. C. 8. D. 4.
Câu 74: Để đạt quy tắc octet, hai nguyên tử O (Z=8) đã góp chung bao nhiêu electron?
A. 2. B. 8. C. 6. D. 4.
Câu 75: Để đạt quy tắc octet, hai nguyên tử N (Z=7) đã góp chung bao nhiêu electron?
A. 2. B. 6. C. 8. D. 4.
Câu 76: Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
A. Neon và argon. B. Helium và xenon.
C. Helium và radon. D. Helium và krypton.
Câu 77: Số lượng electron tham gia hình thành liên kết đơn, đôi, ba lần lượt là
A. 1, 2 và 3. B. 2, 4 và 6. C. 1, 3 và 5. D. 2, 3 và 4.
A. Nguyên tử K nhường electron, nguyên tử Cl nhận electron để trở thành các ion.
B. Nguyên tử K nhận electron, nguyên tử Cl nhường electron để trở thành các ion.
Câu 78: Hình dưới đây biểu diễn sự hình thành liên kết giữa hai nguyên tử A, B. Loại liên kết được tạo thành có
tên gọi là
A. liên kết ion. B. liên kết hydrogen.

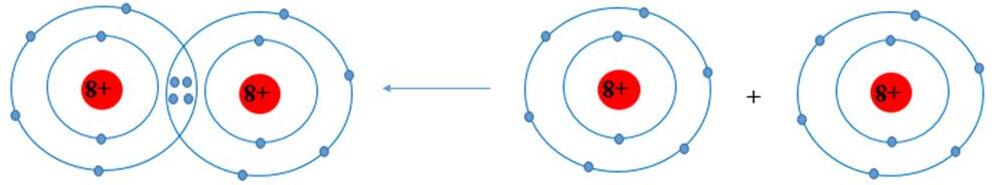
C. liên kết cho nhận. D. liên kết cộng hóa trị
Câu 79: Hình dưới đây biểu diễn sự hình thành liên kết cộng hóa trị giữa hai nguyên tử X. Liên kết tạo thành là
A. liên kết đơn. B. liên kết đôi. C. liên kết ba. D. liên kết pi.
Câu 80: Hình dưới đây mô tả quá trình hình thành phân tử chất X. Trong phân tử chất X có bao nhiêu cặp electron dùng chung?
Câu 90: Công thức nào sau đây là công thức Lewis? (1) (2) (3) (4)
A. (2) B. (1). C. (3). D. (4).
Câu 91: Cấu trúc của kim cương được biểu diễn ở hình dưới, số lượng liên kết cộng hóa trị tối đa được hình thành bởi một nguyên tử carbon trong tinh thể kim cương là
A. 1. B. 3. C. 4. D. 2.
Câu 81: Cho cấu trúc của phân tử N2H4 như hình dưới đây. Mỗi nguyên tử nitrogen còn mấy cặp electron chưa tham gia liên kết?
A. 0. B. 2. C. 3. D. 1.
Câu 82: Cho các liên kết sau: H−O, N−H, N−F, N−O. Liên kết nào là liên kết phân cực mạnh nhất?
A. H−O. B. N−H. C. N−F. D. N−O.
Câu 83: Độ âm điện của Al và Cl lần lượt bằng 1,6 và 3,0. Liên kết hóa học giữa các nguyên tử trong phân tử
AlCl3 là
A. Liên kết ion.
C. Liên kết kim loại.
B. Liên kết cộng hóa trị có cực.
D. Liên kết cộng hóa trị không cực.
Câu 84: Dãy nào sau đây gồm các chất chỉ có liên kết cộng hóa trị?
A. BaCl2, NaCl, NO2.

C. SO2, CO2, Na2O2
B. SO3, H2S, H2O.
D. CaCl2, F2O, HCl.
Câu 85: Cho các oxit: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7. Dãy các hợp chất trong phân tử chỉ gồm liên kết
cộng hoá trị là:
A. SiO2, P2O5, SO3, Cl2O7


C. Na2O, SiO2, MgO, SO3
B. SiO2, P2O5, Cl2O7, Al2O3
D. SiO2, P2O5, SO3, Al2O3
Câu 86: Cho các phân tử : H2; CO2; Cl2; N2; I2; C2H4; C2H2 Có bao nhiêu phân tử có liên kết ba trong phân tử?

A. 1. B. 2.
C. 3. D. 4.
Câu 87: Trong phân tử HF, số cặp electron dùng chung và cặp electron hoá trị riêng của nguyên tử F lần lượt là:
A. 1 và 3 B. 2 và 2. C. 3 và 1. D. 1 và 4.
Câu 88: Số lượng cặp electron dùng chung trong các phân tử H2, O2, N2, F2 lần lượt là:
A. 1, 2, 3, 4. B. 1, 2, 3, 1. C. 2, 2, 2, 2. D. 1, 2, 2, 1.
Câu 89: Phân tử chất nào sau đây có liên kết cho – nhận? A.
A. 2 B. 4. C. 6. D. 3.
Câu 92: Theo octet bát tử thì công thức cấu tạo của phân tử SO2 là
A. O – S – O. B. O = S → O. C. O = S = O. D. O ← S → O.
Câu 93: Công thức cấu tạo đúng của CO2 là
A. O = C = O. B. O = C → O. C. O = C ← O. D. O – C = O.
Câu 94: Trong nguyên tử C, những electron có khả năng tham gia hình thành liên kết cộng hoá trị thuộc phân lớp nào sau đây?
A. 1s. B. 2s. C. 2s, 2p. D. 1s, 2s, 2p.
Câu 95: Phân tử sẽ có liên kết cộng hoá trị không phân cực nếu cặp electron chung
A. ở giữa hai nguyên tử
B. lệch về một phía một nguyên tử
C. chuyển hẳn về một nguyên tử D. nhường hẳn về một nguyên tử
Câu 96: Phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung
A. ở giữa hai nguyên tử
C. chuyển hẳn về một nguyên tử
Câu 97: Hợp chất có liên kết cộng hoá trị được gọi là:
A. Hợp chất phức tạp.
C. Hợp chất không điện li.
B. lệch về một phía một nguyên tử
D. nhường hẳn về một nguyên tử
B. Hợp chất cộng hóa trị
D. Hợp chất trung hoà điện.
Câu 98: Liên kết cộng hóa trị không phân cực thường là liên kết giữa:
A. Hai kim loại giống nhau.
B. Hai phi kim giống nhau.
C. Một kim loại mạnh và một phi kim mạnh.
D. Một kim loại yếu và một phi kim yếu.
Câu 99: Tùy thuộc vào số cặp electron dùng chung tham gia tạo thành liên kết cộng hóa trị giữa 2 nguyên tử mà liên kết được gọi là:
A. liên kết phân cực, liên kết lưỡng cực, liên kết ba cực.
B. liên kết đơn giản, liên kết phức tạp.
C. liên kết đơn, liên kết đôi, liên kết ba.
D. liên kết xích ma, liên kết pi, liên kết đelta.
Câu 100: Liên kết cộng hóa trị là liên kết giữa 2 nguyên tử
A. phi kim, được tạo thành do sự góp chung electron.
B. khác nhau, được tạo thành do sự góp chung electron.
C. được tạo thành do sự góp chung một hay nhiều electron.
D. được tạo thành từ sự cho nhận electron giữa chúng.
Câu 101: Liên kết cộng hoá trị thường được hình thành giữa
A. Các nguyên tử nguyên tố kim loại với nhau.
B. Các nguyên tử nguyên tố phi kim với nhau.
C. Các nguyên tử nguyên tố kim loại với các nguyên tố phi kim.
D. Các nguyên tử khí hiếm với nhau.
Câu 102: Để đánh giá loại liên kết trong phân tử hợp chất tạo bởi kim loại và phi kim mà chưa chắc chắn là liên
k
ết ion, người ta có thể dựa vào hiệu độ âm điện. Khi hiệu độ âm điện của hai nguyên tử tham gia liên kết
Câu 115: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital như hình dưới đây?
A. H2. B. NH3. C. Cl2. D. HCl.
Câu 116: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital như hình dưới đây?
χ
1,7
∆≥ thì đó là liên kết
A. ion.
C. cộng hoá trị có cực.
B. cộng hoá trị không cực.
D. kim loại.
Câu 103: Để đánh giá loại liên kết trong phân tử hợp chất tạo bởi kim loại và phi kim mà chưa chắc chắn là liên kết ion, người ta có thể dựa vào hiệu độ âm điện. Khi hiệu độ âm điện của hai nguyên tử tham gia liên kết
0,00,4 χ <∆< thì đó là liên kết
A. ion.
B. cộng hoá trị không cực.
A. H2 B. NH3 C. Br2 D. HCl.
Câu 117: Quá trình hình thành phân tử X2 có sự xen phủ orbital như sau:
X2 không thể là chất nào sau đây?
A. H2. B. Cl2. C. Br2. D. F2.
Câu 118: Quá trình hình thành phân tử X2 có sự xen phủ orbital như sau:
C. cộng hoá trị có cực.
D. kim loại. Câu 104: Để đánh giá loại liên kết trong phân tử hợp chất tạo bởi kim loại và phi kim mà chưa chắc chắn là liên
kết ion, người ta có thể dựa vào hiệu độ âm điện. Khi hiệu độ âm điện của hai nguyên tử tham gia liên kết
0,41,7 χ ≤∆< thì đó là liên kết
A. ion.
C. cộng hoá trị có cực.
Câu 105: Nhận định sai về hợp chất cộng hóa trị là:
B. cộng hoá trị không cực.
D. kim loại.
A. Các hợp chất cộng hóa trị thường là chất rắn, chất lỏng hoặc chất khí, có nhiệt độ nóng chảy, nhiệt độ sôi
thấp.
B. Các hợp chất cộng hóa trị không cực tan tốt trong các dung môi hữu cơ
C. Các hợp chất cộng hóa trị tan tốt trong nước
D. Các hợp chất cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
Câu 106: Đa số các hợp chất cộng hóa trị có đặc điểm là:
A. Có thể hòa tan trong dung môi hữu cơ
B. Nhiệt độ nóng chảy và nhiệt độ sôi cao.
C. Có khả năng dẫn điện khi ở thể lỏng hoặc nóng chảy.
D. Khi hòa tan trong nước thành dung dịch điện li.
Câu 107: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p-p?
A. H2 B. Cl2
C. NH3 D. HCl.
Câu 108: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s-s?
A. H2 B. Cl2
C. NH3
D. HCl.
Câu 109: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s-p?
A. H2 B. Cl2
C. NH3 D. O2
Câu 110: Phân tử nào sau đây có sự xen phủ bên của một cặp orbital p?
A. H2 B. Cl2
C. N2
Câu 111: Phân tử nào sau đây có sự xen phủ bên của hai cặp orbital p?
A. H2 B. Cl2
D. O2
C. N2 D. O2
Câu 112: Liên kết trong phân tử nào dưới đây không được hình thành do sự xen phủ giữa các obital cùng loại (ví dụ cùng là obital s, hoặc cùng là obital p)?
A. Cl2 B. H2

C. NH3 D. Br2
Câu 113: Số obital của cả hai nguyên tử O tham gia xen phủ tạo liên kết trong phân tử N2 là
A. 3. B. 4.
C. 5. D. 6.
Câu 114: Số obital của cả hai nguyên tử N tham gia xen phủ tạo liên kết trong phân tử N2 là
A. 3. B. 4.
C. 5. D. 6.
!
X2 không thể là chất nào sau đây?
A. HBr. B. HF. C. Cl2 D. HCl.
Câu 119: Quá trình hình thành phân tử X2 có sự xen phủ orbital như sau:
X2 là chất nào sau đây?
A. H2 B. N2 C. Br2 D. O2
Câu 120: Liên kết σ là liên kết được hình thành do
A. sự xen phủ bên của 2 orbital.
C. lực hút tĩnh điện giữa hai ion.
Câu 121: Liên kết π là liên kết được hình thành do
A. sự xen phủ bên của 2 orbital.
C. lực hút tĩnh điện giữa hai ion.
Câu 122: Các liên kết trong phân tử oxygen gồm
A. 2 liên kết π
B. cặp electron chung.
D. sự xen phủ trục của hai orbital.
B. cặp electron chung.
D. sự xen phủ trục của hai orbital.
B. 2 liên kết σ
C. 1 liên kết σ và 1 liên kết π D. 1 liên kết σ
Câu 123: Phát biểu nào sau đây không đúng?
A. Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết.
B. Khi hình thành liên kết cộng hoá trị giữa hai nguyên tử, luôn có một liên kết σ
C. Liên kết σ bền vững hơn liên kết π
D. Có hai kiểu xen phủ hình thành liên kết là xen phủ trục và xen phủ bên.
Câu 124: Những phát biểu nào sau đây là đúng?
A. Liên kết đôi được tạo nên từ 2 liên kết σ
B. Liên kết ba được tạo nên từ 2 liên kết π và 1 liên kết σ
C. Liên kết đơn được tạo nên từ 1 liên kết π
D. Liên kết ba được tạo nên từ 1 liên kết π và 2 liên kết σ
! 12
Câu 125: Cho biết năng lượng liên kết H-I, H-Br và H-Cl lần lượt là 299 kJ/mol, 366 kJ/mol, 432 kJ/mol. Phát biểu nào sau đây là không đúng?
A. Khi đun nóng, HI bị phân huỷ (thành H2 và I2) ở nhiệt độ thấp hơn so với HBr (thành H2 và Br2).
B. Phản ứng của Cl2 với H2 xảy ra dễ hơn so với phản ứng của Br2 với H2
C. Khi đun nóng, HCl bị phân huỷ (thành H2 và Cl2) ở nhiệt độ thấp hơn so với HBr (thành H2 và Br2).
D. Độ bền liên kết: HCl > HBr > HI.
Câu 126: Dãy nào sau đây gồm các chất đều có liên kết π trong phân tử?
A. C2H4, O2, N2, H2S.
C. C2H4, C2H2, O2, N2
B. CH4, H2O, C2H4, C3H6
D. C3H8, CO2, SO2, O2
Câu 127: Dãy nào sau đây gồm các chất chỉ có liên kết σ trong phân tử?
A. C2H4, O2, N2, H2S.
C. C2H6, CH4, CO2, NH3
B. CH4, H2O, C2H6, C3H8
D. C3H8, NO2, SO2, O2
Câu 128: Trong phân tử NH4Cl có bao nhiêu liên kết cộng hóa trị?
A. 1. B. 2. C. 3. D. 4.
Câu 129: Cho biết hoá trị của một nguyên tố trong phân tử bằng tổng số liên kết σ và π mà nguyên tử nguyên tố đó tạo thành khi liên kết với các nguyên tử xung quanh. Hoá trị của N trong NH4 + là
A. 1. B. 2. C. 3. D. 4.
Câu 130: Cho chất hữu cơ X có công thức cấu tạo như sau:
Số liên kết σ trong phân tử X là
A. 6. B. 8.
C. 9. D. 11.
Câu 131: Trong dung dịch HF (nước có hòa tan HF) có thể có bao nhiêu kiểu liên kết hydrogen?
A. 2. B. 3.
C. 4. D. 5.
Câu 132: Trong dung dịch C2H5OH (nước có hòa tan C2H5OH) có thể tạo có bao nhiêu kiểu liên kết hydrogen?
A. 2. B. 3. C. 4. D. 5.
Câu 133: Chất nào trong các chất sau tồn tại ở thể lỏng trong điều kiện thường?
A. C2H5OH. B. CF4 C. CH4 D. CO2
Câu 134: Tương tác van der Waals tồn tại giữa những
A. ion. B. hạt proton. C. hạt neutron. D. phân tử

Câu 135: Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?
A. Ne. B. Xe. C. Ar. D. Kr.
Câu 136: Trong các khí hiếm sau, khí hiếm có nhiệt độ sôi cao nhất là
A. Ne. B. Xe. C. Ar. D. Kr.
Câu 137: Cho các chất sau: F2, Cl2, Br2, I2. Chất có nhiệt độ sôi cao nhất là
A. F2 B. Cl2 C. Br2 D. I2
Câu 138: Cho các chất sau: F2, Cl2, Br2, I2. Chất có nhiệt độ nóng chảy thấp nhấp là
A. F2. B. Cl2. C. Br2. D. I2.
Câu 139: Dãy các chất nào sau đây xếp theo thứ tự nhiệt độ sôi tăng dần?
A. H2O, H2S, CH4 B. H2S, CH4, H2O. C. CH4, H2O, H2S. D. CH4, H2S, H2O.
Câu 140: Quy tắc octet không được được sử dụng khi xem xét sự hình thành của hai loại liên kết hoặc tương tác nào sau đây?
(1) Liên kết cộng hoá trị. (2) Liên kết ion.
(3) Liên kết hydrogen. (4) Tương tác van der Waals.
A. (1) và (2). B. (2) và (3). C. (1) và (3). D. (3) và (4).
Câu 141: Các liên kết biểu diễn bằng các đường nét đứt có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi
DNA. Đó là loại liên kết gì?
A. Liên kết ion.
B. Liên kết cộng hoá trị có cực.
C. Liên kết cộng hoá trị không cực. D. Liên kết hydrogen.
Câu 142: Liên kết hydrogen là loại liên kết hóa học được hình thành giữa các nguyên tử nào sau đây?
A. Phi kim và hydrogen trong hai phân tử khác nhau.
B. Phi kim và hydrogen trong cùng một phân tử
C. Phi kim có độ âm điện lớn và nguyên tử hydrogen.
D. F, O, N,… có độ âm điện lớn, đồng thời có cặp electron hóa trị chưa liên kết và nguyên tử hydrogen linh động.
Câu 143: Phát biểu nào sau đây là đúng?
A. Bất kì phân tử nào có chứa nguyên tử hydrogen cũng có thể tạo liên kết hydrogen với phân tử cùng loại.
B. Liên kết hydrogen là liên kết hình thành do sự góp chung cặp electron hoá trị giữa nguyên tử hydrogen và nguyên tử có độ âm điện lớn.
C. Liên kết hydrogen là loại liên kết yếu nhất giữa các phân tử.
D. Ảnh hưởng của liên kết hydrogen tới nhiệt độ sôi và nhiệt độ nóng chảy của chất là mạnh hơn ảnh hưởng của tương tác van der Waals.
Câu 144: Điều nào sau đây đúng khi nói về liên kết hydrogen nội phân tử?
A. Là lực hút giữa các proton của nguyên tử này với các electron ở nguyên tử khác.
B. Là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H-F, H-N, H-O) ở một phân tử với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở ngay chính phân tử đó.
C. Là lực hút giữa các ion trái dấu.
D. Là lực hút giữa các phân tử có chứa nguyên tử hydrogen.
Câu 145: Điều nào sau đây đúng khi nói về liên kết hydrogen liên phân tử?
A. Là lực hút tĩnh điện giữa các nguyên tử H (thường trong các liên kết H-F, H-N, H-O ở phân tử này) với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở một phân tử khác.
B. Là lực hút giữa các phân tử khác nhau.
C. Là lực hút tính điện giữa các ion trái dấu.
D. Là lực hút giữa các nguyên tử trong một hợp chất cộng hóa trị
Câu 146: Ethanol tan vô hạn trong nước do
A. cả nước và ethanol đều là phân tử phân cực.
B. nước và ethanol có thể tạo liên kết hydrogen với nhau.
C. ethanol có thể tạo liên kết hydrogen với các phân tử ethanol khác.
D. ethanol và nước có tương tác van der Waals mạnh.
Câu 147: Amoniac là một hợp chất vô cơ có công thức phân tử NH3. Trong tự nhiên, amoniac sinh ra trong quá trình bài tiết và xác sinh vật thối rữa. Amoniac (NH3) nặng gần bằng nửa không khí. Sau khi nén và làm lạnh, nó biến thành chất lỏng giống như nước nhưng sôi ở nhiệt độ -33°C. Khi bị nén xong, NH3 dễ bay hơi. Ở điều kiện tiêu chuẩn, nó là một chất khí, không màu, có mùi khai, tan nhiều trong nước do hình thành liên kết hydro với phân tử nước. Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại số loại liên kết hydrogen là
A. 1. B. 2. C. 3. D. 4.
Câu 148: Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do
A. độ âm điện của chlorine nhỏ hơn của nitrogen.
B. phân tử NH3 chứa nhiều nguyên tử hydrogen nhỏ hơn phân tử HCl.
C. tổng số nguyên tử trong phân tử NH3 nhiều hơn so với phân tử HCl.
D. kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.
Câu 149: Nhiệt độ của từng chất methane, ethane, propane và butane là một trong bốn nhiệt độ sau: 0 oC; -164 oC; -42 oC và -88 oC. Nhiệt độ sôi –88 oC là của chất nào sau đây?
A. methane. B. propane. C. ethane. D. butane.
Câu 150: Giữa các nguyên tử He có thể có loại liên kết nào?
A. Liên kết cộng hoá trị B. Liên kết hydrogen.
C. Tương tác van der Waals. D. Không có bất kì liên kết nào.
Câu 151: Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên
A. một ion dương.
C. một lưỡng cực vĩnh viễn.
B. một ion âm.
D. một lưỡng cực tạm thời.
Câu 152: Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực
cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
A. các nguyên tử trong phân tử. B. các electron trong phân tử.

C. các proton trong hạt nhân. D. các neutron và proton trong hạt nhân.
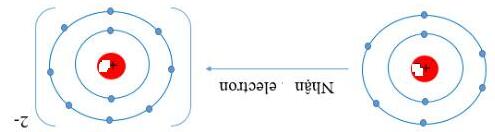
Câu 153: Tương tác van der Waals được hình thành do
A. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử.
B. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các phân tử
C. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử
D. lực hút tĩnh điện giữa các phân tử phân cực.
Câu 154: Nhóm halogen là nhóm VIIA trong bảng tuần hoàn hóa học, gồm các nguyên tố hóa học như fluorine (F), chlorine (Cl), bromine (Br), iotine (I), astatinine (At là nguyên tố phóng xạ, hiếm gặp tự nhiên trong lớp vỏ
Trái Đất), Tennessine (Ts là nguyên tố mới được phát hiện). Lớp electron ngoài cùng của nguyên tử các nguyên tố nhóm halogen đều có 7 electron, được phân thành hai phân lớp (phân lớp s có 2 electron, phân lớp p có 5 electron). Ở trạng thái đơn chất, phân tử gồm 2 nguyên tử, kí hiệu là X2, liên kết trong phân tử X2 không bền lắm. Tại sao ở nhiệt độ phòng, fluorine, chlorine là những chất khí, còn bromine là chất lỏng?
A. Do giữa các phân tử bromine có tương tác van der Waals.
B. Do độ âm điện của bromine thấp hơn fluorine, chlorine.
C. Do năng lượng liên kết của bromine lớn hơn fluorine, chlorine.
D. Do bán kính nguyên tử của bromine lớn hơn fluorine, chlorine.
Câu 155: Nếu giữa phân tử chất tan và dung môi có thể tạo thành liên kết hydrogen hoặc có tương tác van der Waals càng mạnh với nhau thì càng tan tốt vào nhau. Lí do nào sau đây là phù hợp để giải thích dầu hoả (thành phần chính là hydrocarbon) không tan trong nước?
A. Cả nước và dầu đều là các phân tử có cực.
B. Nước là phân tử phân cực và dầu là không/ít phân cực.
C. Nước là phân tử không phân cực và dầu là phân cực.
D. Cả nước và dầu đều không các phân cực.
Câu 156: Thứ tự nào sau đây thể hiện độ mạnh giảm dần của các loại liên kết?
A. Liên kết ion > liên kết cộng hoá trị > liên kết hydrogen > tương tác van der Waals.
B. Liên kết ion > liên kết cộng hoá trị > tương tác van der Waals > liên kết hydrogen.
C. Liên kết cộng hoá trị > liên kết ion > liên kết hydrogen > tương tác van der Waals.
D. Tương tác van der Waals > liên kết hydrogen > liên kết cộng hoá trị > liên kết ion.

● Cấp độ vận dụng
Câu 157: Nguyên tử có mô hình cấu tạo sau đây có xu hướng nhường hoặc nhận electron như thế nào khi hình thành liên kết hóa học?
A. Nhận 1 electron. B. Nhường 1 electron.

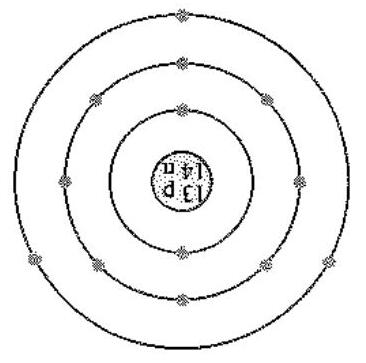
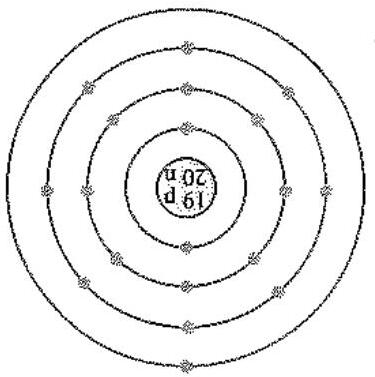
C. Nhận 7 electron. D. Nhường 2 electron.
Câu 158: Nguyên tử có mô hình cấu tạo sau sẽ có xu hướng tạo thành ion mang điện tích nào khi nó thỏa mãn quy tắc octet?
A. 3+. B. 5+. C. 3- . D. 5-.
Câu 159: Mô hình mô tả quá trình tạo liên kết hóa học sau đây phù hợp với xu hướng tạo liên kết hóa học của nguyên tử nào?
A. Aluminium. B. Nitrogen. C. Phosphorus. D. Oxygen.
Câu 160: Nguyên tử nào đã tham gia vào quá trình dưới đây?
A. Mg. B. Na. C. Ca. D. Al.
Câu 161: Nguyên tử nào đã tham gia vào quá trình dưới đây?
A. S. B. Cl. C. O. D. F.
Câu 162: Cho mô hình cấu tạo nguyên tử của nguyên tố X và Y như hình dưới đây:
Nguyên tố X và Y có thể tham gia liên kết với nhau, tạo nên hợp chất ion. Hợp chất tạo thành có công thức là
A. X2Y. B. X2Y2 C. X2Y4 D. XY.
Câu 163: Nếu xét nguyên tử X có 3 electron hóa trị và nguyên tử Y có 6 electron hóa trị thì công thức của hợp chất ion đơn giản nhất tạo bởi X và Y là
A. XY2. B. X2Y3. C. X2Y2. D. X3Y2.
Câu 164: Có hai nguyên tố X (Z = 19) và Y (X = 17). Hợp chất tạo bởi X và Y có công thức và kiểu liên kết là:
A. XY, liên kết ion. B. X2Y, liên kết ion.
C. XY, liên kết cộng hóa trị có cực. D. XY2, liên kết cộng hóa trị có cực.
Câu 165: Nguyên tử X có 12 proton, nguyên tử Y có 9 proton. Hợp chất tạo bởi X và Y có công thức và kiểu liên
kết là:
A. X2Y với liên kết cộng hoá trị B. XY2 với liên kết ion.
C. XY với liên kết cho nhận.
D. X2Y3 với liên kết cộng hoá trị
Câu 166: Nguyên tử nguyên tố X có cấu hình electron 1s22s22p63s2, nguyên tử nguyên tố Y có cấu hình electron


1s22s22p5. Liên kết hóa học giữa 2 nguyên tử X và Y thuộc loại liên kết
A. cho – nhận. B. kim loại. C. cộng hóa trị D. ion.
Câu 167: X có cấu hình electron ở phân lớp ngoài cùng là 4s1. Y có 11 electron ở phân lớp p. Phát biểu nào sau đây đúng?

A. X là phi kim, Y là kim loại. B. Liên kết giữa X và Y là liên kết ion.
C. Hợp chất tạo bởi X và Y là X2Y. D. X tạo được anion, Y tạo được cation.
Câu 168: Những tính chất nào sau đây là tính chất điển hình của hợp chất ion?
(a) Tồn tại ở thể khí trong điều kiện thường.
(b) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(c) Thường tồn tại ở thể rắn trong điều kiện thường.
(d) Có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
(e) Tan trong nước tạo thành dung dịch dẫn điện.
A. 2. B. 3. C. 4. D. 5.
Câu 169: Những đặc điểm nào sau đây là đúng khi nói về hợp chất tạo thành giữa Na+ và O2–?
(a) Là hợp chất ion.
(b) Có công thức hóa học là NaO.
(c) Trong điều kiện thường, tồn tại ở thể rắn.
(d) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(e) Lực tương tác giữa Na+ và O2– là lực tĩnh điện.
A. 2. B. 3. C. 4. D. 5.
Câu 170: Cho các phát biểu sau:
(a) Khi nguyên tử nhường hay nhận electron sẽ trở thành phần tử mang điện gọi là ion.
(b) Nguyên tử kim loại có khuynh hướng nhường electron để trở thành ion dương (cation)
(c) Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
(d) Nguyên tử phi kim có khuynh hướng nhận electron để trở thành ion âm (anion)
(e) Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm.
Số phát biểu đúng là:
A. 2. B. 5. C. 4. D. 3.
Câu 171: Cấu trúc ô mạng tinh thể sodium chloride nào dưới đây đúng?
(1) (2) (3) (4)
A. (1). B. (2). C. (3). D. (4).
Câu 172: Cho hai nguyên tố X (Z=1), Y (Z=17). Công thức hợp chất tạo thành từ nguyên tố X, Y và kiểu liên kết trong phân tử là
A. XY: liên kết cộng hóa trị. B. X2Y: liên kết ion.
C. X2Y3 : liên kết cộng hóa trị D. XY2: liên kết ion.
Câu 173: X, Y là những nguyên tố có số đơn vị điện tích hạt nhân lần lượt là 6, 17. Công thức và liên kết hợp chất tạo thành từ X và Y là:
A. XY và liên kết cộng hóa trị B. X4Y và liên kết ion.
C. XY2 và liên kết ion. D. XY4 và liên kết cộng hóa trị
Câu 174: X, Y, Z là những nguyên tố có số hiệu nguyên tử lần lượt là 8, 19, 16. Nếu các cặp nguyên tố X và Y, Y và Z, X và Z tạo thành liên kết thì các cặp nào sau đây có nhiều khả năng nhất là liên kết cộng hóa trị có cực?
A. X và Y; Y và Z. B. X và Y. C. X và Z. D. Y và Z
Câu 175: Hình dưới đây mô tả quá trình hình thành phân tử chất X. Khối lượng phân tử (amu) của chất X là
A. 64. B. 48. C. 28. D. 44.
Câu 176: Cho các phân tử sau. Cl2, H2O, NaF và CH4. Có bao nhiều nguyên tử trong các phân tử trên đạt cấu hình electron bền của khi hiếm neon?
A. 3. B. 2. C. 5. D. 4.
Câu 177: Có bao nhiêu cặp electron không tham gia liên kết trong phân tử HF?
A. 1. B. 2. C. 3. D. 4.
Câu 178: Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là
A. 2. B. 3. C. 4. D. 5.
Câu 179: Phân tử nào sau đây chứa nhiều cặp electron đã ghép đôi nhưng chưa tham gia liên kết nhất?
A. H2 B. HCl C. CO2 D. N2
Câu 180: Tổng số cặp electron đã ghép đôi nhưng chưa tham gia liên kết trong phân tử HNO3 là
A. 7. B. 7. C. 8. D. 9.
Câu 181: Quy tắc octet không đúng với phân tử chất nào sau đây?
A. H2O. B. NO2 C. CO2 D. Cl2

Câu 182: Quy tắc octet không đúng với phân tử chất nào sau đây?
A. H2O. B. NH3 C. HCl D. BF3
Câu 183: Phần tử nào sau đây có các nguyên tử đều đã đạt cấu hình electron bão hòa theo quy tắc octet?
A. BeH2 B. BH3 C. PCl5 D. SiF4
Câu 184: Cho các phát biểu nào sau:
(a) Các nguyên tử liên kết với nhau theo xu hướng tạo hệ bền vững hơn.
(b) Các nguyên tử liên kết với nhau theo xu hướng tạo hệ có năng lượng thấp hơn.
(c) Các nguyên tử liên kết với nhau theo xu hướng tạo lớp vỏ electron được octet.
(d) Các nguyên tử liên kết với nhau theo xu hướng tạo hệ có năng lượng cao hơn.
(e) Các nguyên tử nguyên tố phi kim chỉ liên kết với các nguyên tử nguyên tố kim loại.
Số phát biểu đúng là
A. 1. B. 2. C. 4. D. 3.
Câu 185: Cho những phát biểu sau về phân tử H2O?
(a) Ở điều kiện thường, H2O ở trạng thái rắn.
(b) Liên kết giữa H và O là liên kết cộng hoá trị phân cực.
(c) Liên kết giữa H và O có cặp electron lệch về phía nguyên tử O.
(d) Phân tử H2O chỉ có liên kết đơn.
(e) Nguyên tử O còn hai cặp electron hoá trị riêng.
Số phát biểu đúng là
A. 1. B. 2.
C. 4.
D. 3.
Câu 186: Chọn số phát biểu sai:
(a) Liên kết cộng hóa trị thường được hình thành giữa hai phi kim.
(b) Theo quy tắc Octet, công thức cấu tạo của phân từ HNO3 có 2 liên kết cho nhận.
(c) Các liên kết đôi và liên kết ba thường sẽ ngắn hơn và bền hơn so với liên kết đơn tương ứng.
(d) Electron lớp ngoài cùng hay còn được gọi là electron hóa trị

(e) Theo quy tắc Octet, công thức cấu tạo của phân từ H2SO4 có 2 liên kết cho nhận.
A. 1 B. 4 C. 2 D. 3
Câu 187: Số liên kết σ và π có trong phân tử C2H2 lần lượt là
A. 2 và 3. B. 3 và 1. C. 2 và 2. D. 3 và 2.
Câu 188: Số liên kết σ và π có trong phân tử C2H4 lần lượt là
A. 4 và 0. B. 2 và 0. C. 1 và 1. D. 5 và 1.
Câu 189: Số liên kết π và liên kết σ trong phân tử C3H6 là
A. 1 và 7. B. 2 và 5. C. 1 và 8. D. 2 và 6.
Câu 190: Nguyên tố X có số hiệu nguyên tử là 6. Nguyên tố Y có số hiệu nguyên tử là 8. Công thức hoá học của hợp chất giữa X và Y có thể là
A. XY2 B. X2Y. C. XY3 D. X3Y.
Câu 191: Anion X2- có cấu hình electron phân lớp ngoài cùng là 3p6. Nguyên tố X tạo với nguyên tố hydrogen hợp chất chứa liên kết?
A. Cộng hóa trị phân cực.
B. Cộng hóa trị không phân cực.
C. Cho – nhận. D. Ion.
Câu 192: Độ âm điện của một số nguyên tố được cho trong bảng:
Cs Ba Cl H S F Te
Chất có liên kết cộng hóa trị không phân cực là
A. BaF2. B. CsCl. C. H2Te. D. H2S.
Câu 193: Bảng dưới đây cho thấy cấu trúc điện tử (sự phân bố electron trên các lớp vỏ) của bốn nguyên tử X, Y, Z,
W.
Nguyên tử Sự phân bố electron trên các lớp vỏ
W 2/8/1 X 2/8/4
Y 2/8/7
Z 2/8/8
Hai nguyên tử nguyên tố nào có thể kết hợp với nhau tạo thành hợp chất chứa liên kết cộng hoá trị?
A. W và X. B. W và Y. C. X và Y. D. X và Z.
Câu 194: Cho mô hình cấu tạo nguyên tử của 4 nguyên tố X, Y, Z, T như hình dưới đây:
Câu 195: Cho sơ đồ biểu diễn sự hình thành liên kết trong phân tử khí carbon dioxide.
Những nguyên tố có khả năng tham gia hình thành liên kết cộng hóa trị là?
A. X và Y. B. X, Y và Z. C. X và T. D. Y, Z và T.
Phát biểu nào sau đây là sai?
A. Phân tử có cấu tạo góc.
B. Phân tử CO2 không phân cực.
C. Liên kết giữa nguyên tử O và C là liên kết phân cực.
D. Trong phân tử có hai liên kết đôi.
Câu 196: Năng lượng liên kết (Eb) đặc trung cho điều gì?
A. Độ bền liên kết. B. Độ dài liên kết.
C. Tính chất liên kết.
D. Loại liên kết.
Câu 197: Ghép nối thông tin ở hai cột A và B sao cho phù hợp với nhau:
Cột A Cột B
1. Liên kết đơn a. Metan
2. Liên kết đôi b. Nitrogen
3. Liên kết ba c. Acid nitric

4. Liên kết cho nhận d. Ethene
A. 1-a; 2-c; 3-d. B. 1-a; 3-b; 4-c. C. 2-a; 3-b; 4-c. D. 1-b; 2-d; 4-c.
Câu 198: Cho những phát biểu sau về phân tử CO2:
(a) Liên kết giữa hai nguyên tử C và O là liên kết cộng hoá trị không phân cực.
(b) Liên kết giữa hai nguyên tử C và O là liên kết cộng hoá trị phân cực.
(c) Phân tử CO2 có 4 cặp electron dùng chung.
(d) Trong phân tử CO2 có 3 liên kết σ và 1 liên kết π
(e) Trong phân tử CO2 có 2 liên kết σ và 2 liên kết π Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 199: Số phát biểu sai khi nói về liên kết cộng hóa trị là:
(a) Năng lượng liên kết đặc trưng cho độ bền liên kết đó trong phân tử
(b) Liên kết cộng hóa trị được biểu diễn bằng mũi tên (→) từ nguyên tử cho sang nguyên tử nhận.
(c) Đối với các phân tử nhiều nguyên tử, tổng năng lượng liên kết trong phân tử bằng năng lượng cần cung cấp để phá vỡ 1 mol phân tử đó ở thể khí thành các nguyên tử của nó.
(d) Hiệu độ âm điện cho biết độ bền của liên kết còn cho biết trong phân tử đó cặp electron dùng chung sẽ lệch về nguyên tử nào.
(e) Công thức electron biểu diễn tất cả các electron dùng chung và riêng của mỗi nguyên tử theo quy tắc Octet.
A. 2. B. 3. C. 1. D. 4.
Câu 200: Cho những phát biểu sau, số phát biểu đúng là
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hoá trị.
(b) HF có tính axit yếu hơn HCl.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Rượu etylic (C2H5OH) có nhiệt độ sôi lớn hơn so với nước.
(e) H2O có nhiệt độ sôi nhỏ hơn H2S. A. 2. B. 3. C. 4. D. 5.
!
C. PHÂN DẠNG BÀI TẬP, VÍ DỤ MINH HỌA VÀ BÀI TẬP VẬN DỤNG
1. XÁC ĐỊNH KIỂU LIÊN KẾT TRONG PHÂN TỬ KHI BIẾT THÔNG TIN VỀ CÁC HẠT CƠ BẢN
Ví dụ 1: Tổng số hạt cơ bản trong nguyên tử của nguyên tố M, X lần lượt là 58 và 52. Hợp chất MX có tổng số hạt proton trong một phân tử là 36. Liên kết trong phân tử MX thuộc loại liên kết: Đáp số: M là K, X là Cl; KCl có chứa liên kết ion.
Ví dụ 2: Nguyên tử nguyên tố A có số hạt mang điện trong hạt nhân là 16, nguyên tử nguyên tố B có tổng số hạt mang điện là 16. Viết công thức: phân tử, electron, Lewis, cấu tạo của hợp chất tạo bởi A và B.
Đáp số: SO2, SO3.
Ví dụ 3: Hợp chất khí với hydrogen của nguyên tố X là RH4. Trong oxide cao nhất của X chiếm 53,3% về khối lượng oxygen. Viết công thức electron, Lewis, công thức cấu tạo của oxide cao nhất của X và hợp chất của X với
H2
Đáp số: R là Si; oxide cao nhất là SiO2; hợp chất với H2 là SiH4
Ví dụ 4: Hợp chất X có công thức là A2B có tổng số hạt (p, n, e) là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. Nguyên tử nguyên tố A có số proton nhiều hơn so với nguyên tử nguyên tố B là 3. Viết
công thức phân tử, công thức cấu tạo của X.
Đáp số: X là Na2O.
Ví dụ 5: Hợp chất X có công thức phân tử là AB2. X có tổng số hạt proton, neutron, electron là 66, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22, số hạt mang điện của B nhiều hơn của A là 20. Viết công thức phân tử, công thức cấu tạo, công thức Lewis của X.
Ví dụ 6: Hai nguyên tố M và X tạo thành hợp chất có công thức là M2X. Cho biết:
- Tổng số proton trong hợp chất bằng 46.
- Trong hạt nhân của M có n - p = 1, trong hạt nhân của X có n’ = p’.
- Trong hợp chất M2X, nguyên tố X chiếm khối lượng.
a. Hãy cho biết tên các nguyên tố M, X.
Đáp số: X là CO2
b. Liên kết trong hợp chất M2X là liên kết gì? Tại sao? Viết sơ đồ hình thành liên kết trong hợp chất đó.
Đáp án: M là K; X là O; b. K2O là liên kết ion.
Câu 6: R là nguyên tố thuộc phân nhóm chính, có hóa trị trong oxide cao nhất gấp 3 lần hóa trị trong hợp chất với hyđrogen. Trong oxide cao nhất của R, nguyên tố oxygen chiếm 60% về khối lượng. Công thức hydroxide cao nhất của R là
A. H2SO3 B. H3PO4 C. H2SO4 D. HClO4
Câu 7: Trong tự nhiên, H2X là một khí độc, có mùi trứng thôi đồng nó còn được sản sinh trong các hầm kín hay khí núi lửa hoặc từ các chất protein bị thối rữa. H2X được dùng sản xuất nước nặng tại một số nhà máy điện hạt nhân. Trong hợp chất H2X thì nguyên tố hydrogen chiếm 5,88% về khối lượng. Nguyên tố R là
A. S (M=32). B. C (M=12). C. P (M=31). D. Cl (M=35,5).
Câu 8: M thuộc nhóm IIA, X thuộc nhóm VIA. Trong oxide cao nhất M chiếm 71,43% khối lượng, còn X chiếm 40% khối lượng. Liên kết giữa X và M trong hợp chất thuộc loại liên kết nào sau đây?
A. Liên kết ion. B. Liên kết cộng hoá trị có cực.
C. Liên kết cho nhận D. Liên kết cộng hoá trị không cực.
Câu 9: Hợp chất M tạo bởi hai nguyên tố X và Y trong đó X, Y có số oxi hóa cao nhất trong các oxide là +nO, +mO và có số oxi hóa âm trong các hợp chất với hiđro là –nH, –mH và thoả mãn điều kiện : On = H n ; Om = H3m
Biết X có số oxi hoá cao nhất trong M, công thức phân tử của M là công thức nào sau đây?
A. XY2. B. X2Y. C. XY. D. X2Y3.
Câu 10: Nguyên tử X có có tổng số hạt cơ bản là 60 và thuộc nhóm IIA. Nguyên tử Y có tổng số hạt cơ bản là 52 và thuộc nhóm VIIA. Tổng số hạt mang điện trong phân tử hợp chất tạo bởi X và Y là
A. 74. B. 114. C. 108. D. 76.
Câu 11: Một phân tử 3XY có tổng các hạt proton, electron, neutron bằng 196. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 60, số hạt mang điện của X ít hơn số hạt mang điện của Y trong phân tử là 76. XY3 là công thức nào sau đây?
A. SO3 B. AlCl3 C. BF3 D. NH3
2. XÁC ĐỊNH TÊN GỌI, CÔNG THỨC, LƯỢNG CHẤT DỰA VÀO PHẢN ỨNG HÓA HỌC
Ví dụ 1: Cho 6,05 gam hỗn hợp X gồm Fe và Zn phản ứng hoàn toàn với dung dịch HCl loãng (dư), thu được 0,1 mol khí H2. Xác định khối lượng của Fe trong 6,05 gam X.
Đáp số: 2,08 gam.
Bài tập vận dụng
Câu 1: Nguyên tử nguyên tố X có 5 electron nằm trong các phân lớp s, nguyên tử nguyên tố Y có 11 electron nằm trong các phân lớp p. Hợp chất M tạo bởi X và Y. Hợp chất M chứa liên kết?
A. Cộng hóa trị phân cực.
C. Liên kết cho – nhận.
B. Cộng hóa trị không phân cực.
D. Liên kết ion
Câu 2: Nguyên tử nguyên tố X có mức năng lượng cao nhất ở phân lớp 3p. Nguyên tử nguyên tố Y cũng có mức năng lượng ở phân lớp 3p và có tổng số electron ở lớp ngoài cùng là 1. Biết số hạt mang điện dương trong hạt nhân
nguyên tử nguyên tố Y nhiều hơn trong nguyên tố X là 3 hạt. Xác định loại liên kết trong hợp chất của X và Y?
A. Liên kết cộng hóa trị phân cực. B. Liên kết ion.
C. Liên kết cộng hóa trị không phân cực. D. Liên kết cho – nhận.
Câu 3: Trong hợp chất ion XY (X là kim loại, Y là phi kim), số electron của cation bằng số electron của anion và tổng số electron trong XY là 20. Biết trong mọi hợp chất, Y chỉ có một mức oxi hóa duy nhất. Công thức XY là
A. NaF. B. AlN. C. MgO. D. LiF.
Câu 4: Nguyên tử X có tổng số hạt cơ bản là 28 và thuộc nhóm VIIA. Nguyên tử Y có tổng số hạt cơ bản là 34 và thuộc nhóm IA. Tổng số hạt mang điện trong phân tử hợp chất tạo bởi X và Y là
A. 56. B. 24
C. 40. D. 76.
Câu 5: Trong quá trình trục vớt tàu chìm ở Cần Giờ, Việt Nam vào năm 2019, 5 thợ lặn bất ngờ gặp nạn nghi do ngộ độc khí H2X từ thùng hàng container bị bung ra. Đây là chất khí độc, ở nồng độ thấp gây kích thích màng phổi, mắt, đường thở,… với nồng độ lớn có thể gây tử vong. Trong nguyên tử X tổng số hạt (proton, neutron và electron) trong nguyên tử nguyên tố X là 48. Hợp chất H2X chứa loại liên kết hóa học nào sau đây?
A. Liên kết cộng hóa trị phân cực B. Liên kết ion.
Ví dụ 2: Cho 855 gam dung dịch Ba(OH)2 10% vào 200 gam dung dịch H2SO4 thu được kết tủa và dung dịch X. Để trung hoà dung dịch X người ta phải dùng 125 ml dung dịch NaOH 25% (D = 1,28 gam/ml). Xác định nồng độ phần trăm của dung dịch H2SO4
Đáp số: 49%.
Ví dụ 3: Cho 100 ml dung dịch NaOH 4M tác dụng với 100 ml dung dịch H3PO4 aM, thu được 25,95 gam hai muối. Xác định giá trị của a.
Đáp số: a = 1,75.
Ví dụ 4: Đốt cháy hoàn toàn 5,8 gam hỗn hợp gồm Zn và Mg trong không khí, thu được 7,8 gam hỗn hợp oxide X. Hòa tan hết X trong dung dịch HCl 1M. Xác định thể tích dung dịch axit hòa tan hết được X.
Đáp số: 250 ml.
Ví dụ 5: Hoà tan hoàn toàn 8,45 gam một kim loại hoá trị II bằng dung dịch HCl. Cô cạn dung dịch sau phản ứng được 17,68 gam muối khan. Xác định kim loại đã dùng.
Đáp số: Zn.
Ví dụ 6: Cho 7,2 gam kim loại M, có hoá trị không đổi trong hợp chất, phản ứng hoàn toàn với hỗn hợp khí X gồm Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn Y và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (đktc). Xác
định kim loại M.
Bài tập vận dụng
Đáp số: Mg.
Câu 1: Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít hiđro (đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 9,52.
B. 7,25.
C. Liên kết cộng hóa trị không phân cực. D. Liên kết cho – nhận. !
!
C. 8,98. D. 10,27.
Câu 2: Hoà tan 7,8 gam hỗn hợp bột Al và Mg trong dung dịch HCl dư. Sau phản ứng khối lượng dung dịch tăng thêm 7,0 gam so với dung dịch HCl ban đầu. Khối lượng Al và Mg trong hỗn hợp đầu là
A. 5,8 gam và 3,6 gam. B. 1,2 gam và 2,4 gam.
C. 5,4 gam và 2,4 gam. D. 2,7 gam và 1,2 gam.
Câu 3: Để hòa tan hết 31,05 gam hỗn hợp oxide gồm FeO và ZnO thì cần vừa đủ V lít dung dịch H2SO4 2M. Cô
cạn dung dịch sau phản ứng thu được 63,05 gam muối khan. Giá trị của V là
A. 0,2 B. 0,15. C. 0,75. D. 1,5.
Câu 4: Hòa tan 12,2 gam hỗn hợp MgO và Al2O3 vào dung dịch HCl 20%, thu được 31,45 gam hỗn hợp muối. Mặt khác, để trung hòa lượng axit dư cần dùng 20 ml dung dịch NaOH 2M. Khối lượng dung dịch HCl ban đầu là
A. 27,01 gam. B. 108,04 gam. C. 135,05 gam. D. 54,02 gam.
Câu 5: Cho hỗn hợp X gồm 31,75 gam FeCl2 và 24,375 gam FeCl3 tác dụng với dung dịch NaOH dư và để ngoài không khí đến khối lượng không đổi. Khối lượng kết tủa thu được là
A. 30,8 gam. B. 45 gam. C. 42,8 gam D. 27,8 gam.
Câu 6: Hoà tan 17 gam hỗn hợp NaOH, KOH, Ca(OH)2 vào nước được 500 gam dung dịch X. Để trung hoà 50 gam dung dịch X cần dùng 40 gam dung dịch HCl 3,65%. Cô cạn dung dịch sau khi trung hoà thu được khối lượng muối khan là
A. 3,16 gam. B. 2,44 gam. C. 1,58 gam. D. 1,22 gam.
Câu 7: Dung dịch X chứa axit HCl a mol/l và HNO3 b mol/l. Để trung hoà 20 ml dung dịch X cần dùng 300 ml dung dịch NaOH 0,1M. Mặt khác, lấy 20 ml dung dịch X cho tác dụng với dung dịch AgNO3 dư thấy tạo thành
2,87 gam kết tủa. Giá trị của a, b lần lượt là
A. 1,0 và 0,5. B. 1,0 và 1,5. C. 0,5 và 1,7. D. 2,0 và 1,0.
Câu 8: Hòa tan hết 22,75 gam một muối sắt clorua vào nước, thu được dung dịch X. Cho từ từ dung dịch AgNO3
đến dư vào dung dịch X, thu được kết tủa màu trắng. Lọc kết tủa, sấy khô và cân thì có khối lượng là 60,27 gam.
Khối lượng phân tử của muối sắt clorua là
A. 162,5 B. 160. C. 127. D. 208.
Câu 9: Cho 4,5 gam hỗn hợp M gồm Na, Ca và Mg tác dụng hết với O2 dư, thu được 6,9 gam hỗn hợp Y gồm các oxide. Cho Y phản ứng vừa đủ với V lít dung dịch HCl 1M. Giá trị của V là
A. 0,15. B. 0,12. C. 0,60. D. 0,30.
Câu 10: Nung nóng 100 gam hỗn hợp NaHCO3 và Na2CO3 đến khối lượng không đổi, thu được 69 gam hỗn hợp rắn. Phần trăm khối lượng của NaHCO3 trong hỗn hợp là
A. 80%. B. 70%. C. 80,66%. D. 84%.
Câu 11: Cho 19 gam hỗn hợp Na2CO3 và NaHCO3 tác dụng với dung dịch HCl dư, sinh ra 4,48 lít khí (đktc). Khối
lượng mỗi muối trong hỗn hợp ban đầu là
A. 10,6 gam và 8,4 gam.
C. 10,5 gam và 8,5 gam.
B. 16 gam và 3 gam.
D. 16 gam và 4,8 gam.
Câu 12: Người ta cần dùng 7,84 lít CO (đktc) để khử hoàn toàn 20 gam hỗn hợp CuO và Fe2O3 ở nhiệt độ cao.
Phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu là
A. 50% và 50%. B. 20% và 80%.
C. 57% và 43%. D. 65% và 35%.
Câu 13: Đốt cháy hoàn toàn m gam cacbon trong V lít khí oxi dư (đktc), thu được hỗn hợp khí X có tỉ khối đối với oxi là 1,25. Thành phần phần trăm theo thể tích của CO2 trong hỗn hợp X là
A. 75,00 %. B. 66,67 %. C. 33,33 %. D. 25,00 %.
Câu 14: Cho 16,8 lít CO2 (đktc) hấp thụ hoàn toàn vào 600 ml dung dịch NaOH 2M, thu được dung dịch X. Nếu cho một lượng dư dung dịch BaCl2 vào dung dịch X thì thu được lượng kết tủa là
A. 19,7 gam. B. 88,65 gam. C. 118,2 gam. D. 147,75 gam.
Câu 15: Một tinh thể muối ngậm nước có dạng Na2CO3.xH2O, biết thành phần phần trăm của Na2CO3 trong muối ngậm nước là 37,063%. Công thức phân tử của tinh thế muối ngậm nước là
A. Na2CO3.10H2O
C. Na2CO3.7H2O.
B. Na2CO3.5H2O.
D. Na2CO3.8H2O.
Câu 16: Nung nóng 14,7 gam một bazơ X trong chén sứ đến khối lượng không đổi, thu được 12 gam một oxide.
Công thức của bazơ X là
A. Zn(OH)2 B. Al(OH)3 C. Cu(OH)2 D. Mg(OH)2
Câu 17: Cho a gam một base X vào dung dịch HCl loãng dư, cô cạn dung dịch, thu được 3,25 gam muối clorua khan. Mặt khác, đem nung nóng a gam X đến khối lượng không đổi, thu được 1,6 gam oxide kim loại. Công thức phân tử của bazơ X là
A. Fe(OH)3. B. Ba(OH)2. C. Zn(OH)2. D. Al(OH)3.
Câu 18: X là kim loại thuộc nhóm IIA. Cho 10,4 gam hỗn hợp gồm kim loại X và Fe tác dụng với lượng dư dung dịch HCl, sinh ra 6,72 lít khí H2 (đktc). Mặt khác, khi cho 3,6 gam X tác dụng với lượng dư dung dịch H2SO4 loãng, ththể tích khí hydrogen sinh ra chưa đến 4,48 lít (đktc). Kim loại X là
A. Ca. B. Be. C. Mg D. Ba.
Câu 19: Nguyên tố X là phi kim thuộc nhóm A trong bảng tuần hoàn. Tỉ lệ giữa phần trăm nguyên tố X trong oxide cao nhất và phần trăm X trong hợp chất khí với hydrogen bằng 0,6995. Khi cho 5,85 gam kim loại M tác dụng với phi kim X, thu được 24,9 gam muối MX. Muối MX được trộn một lượng nhỏ vào muối ăn để ngừa bệnh bứu cổ. Nguyên tố X và M lần lượt là A. I và Na. B. Cl và K. C. Cl và Na. D. I và K. Câu 20: X và Y là các nguyên tố thuộc nhóm A, đều tạo hợp chất với hydrogen có dạng RH (R là kí hiệu của nguyên tố X hoặc Y). Gọi P và Q lần lượt là hydroxide ứng với hóa trị cao nhất của X và Y. Trong Q, Y chiếm 35,323% khối lượng. Trung hòa hoàn toàn 50 gam dung dịch P 16,8% cần 150 ml dung dịch Q 1M. Cô cạn dung dịch thu được sau phản ứng trung hòa được m gam chất rắn. Giá trị m là
A. 20,775. B. 35,5. C. 25,55. D. 30,725.
