ĐỀ THI VÀO LỚP 10 HÓA HỌC CHUYÊN
vectorstock com/24597468

Ths Nguyễn Thanh Tú
eBook Collection
ĐỀ THI VÀO LỚP 10 HÓA HỌC CHUYÊN NĂM 2022
CÁC TRƯỜNG THPT CHUYÊN TRÊN CẢ NƯỚC
(Đăk Lăk; Đăk Nông; Điện Biên; Đồng Nai; Đồng Tháp; Gia Lai; Hà Giang; Hà Nam; Hà Nội - ĐHSP; Hà Nội – ĐH KHTN; Hà Nội – Sở GD&ĐT; Hà Tĩnh; Hải Dương; Hải Phòng; Hòa Bình)
WORD VERSION | 2023 EDITION
ORDER NOW / CHUYỂN GIAO QUA EMAIL
TAILIEUCHUANTHAMKHAO@GMAIL.COM
Tài liệu chuẩn tham khảo Phát triển kênh bởi Ths Nguyễn Thanh Tú
Đơn vị tài trợ / phát hành / chia sẻ học thuật : Nguyen Thanh Tu Group
Hỗ trợ trực tuyến
Fb www.facebook.com/DayKemQuyNhon
Mobi/Zalo 0905779594
ĐỀ THI VÀO LỚP 10 CHUYÊN HÓA HÓA CÁC TRƯỜNG THPT
CHUYÊN TRÊN CẢ NƯỚC VÀ LỜI GIẢI CHI TIẾT #
Tài liệu tham khảo cực kì bổ ích cho các em thí sinh ôn thi vào lớp 10 chuyên Hóa học trên cả nước cũng như thi học sinh giỏi lớp 9 cấp tỉnh.
Trong bản word có 15 đề chuyên Hóa:
1- Đăk Lăk;
2- Đăk Nông;
3- Điện Biên;
4- Đồng Nai;
5- Đồng Tháp;
6- Gia Lai;
7- Hà Giang;
8- Hà Nam;
9- Hà Nội - ĐHSP;
10- Hà Nội – ĐH KHTN;
11- Hà Nội – Sở GD&ĐT;
12- Hà Tĩnh;
13- Hải Dương;
14- Hải Phòng;
15- Hòa Bình.
SỞ GIÁO DỤC VÀ ĐÀO TẠO ĐĂK LĂK KÌ THI TUY
ĐỀ CHÍNH THỨC (Đề thi có 02 trang)
MÔN: HÓA HỌC - CHUYÊN
Thời gian làm bài: 150 phút, không kể thời gian phát đề
Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; O = 16; Na = 23; Mg = 24; Al = 27; Ca = 40;

Fe = 56; Cu = 64; Zn = 65; Br = 80; Sr = 88; Ba = 137.
Các thể tích khí đều đo ở điều kiện tiêu chuẩn; giả thiết các khí sinh ra không tan trong nước.
Câu 1. (2,0 điểm)
1. Viết các phương trình hóa học của các phản ứng xảy ra khi:
a. Sục từ từ khí CO2 đến dư vào dung dịch nước vôi trong.
b. Cho KHCO3 rắn vào dung dịch H2SO4 đặc dư.
c. Cho oxit Fe3O4 tác dụng với dung dịch HCl dư.
d. Đốt cháy than gỗ
2. Hoàn thành các sơ đồ phản ứng sau đây:
(X1) + H2SO4 → (X2) + SO2↑ + H2O (1)
(X3) + KOH → (X2) + (X4) (2)
(X5) + KOH → (X2) + (X6) + H2O (3)
Biết M(X1) = M(X3) = M(X5) = 120 g/mol.

Câu 2. (1,5 điểm)
1. Hình vẽ sau đây mô tả thí nghiệm điều chế khí Cl2 trong phòng thí nghiệm:
A B
a. Hãy chọn các hóa chất A, B, D, E phù hợp và viết phương trình hóa học điều chế khí Cl2
b. Cho biết vai trò của bình (1), bình (2) trong quá trình điều chế trên.
2. Trình bày phương pháp hóa học để làm sạch khí CO2 có lẫn tạp chất SO2. Câu 3 (2,0 điểm)
1. Nung hỗn hợp X gồm a gam Al và 24 gam Fe2O3 trong điều kiện không có không khí, sau phản ứng thu được hỗn hợp chất rắn Y. Cho Y tác dụng với 500 ml dung dịch NaOH bM thu được 6,72 lít khí H2, chất rắn không tan Z và dung dịch T gồm 2 chất tan có cùng nồng độ mol. Biết các phản ứng xảy ra hoàn toàn. Tìm giá trị của a và b.
2. Etilen và các chất tương tự etilen có chứa 1 liên kết đôi trong phân tử nên dễ tham gia phản ứng cộng. Phản ứng cộng với brom, liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử etilen đã kết hợp thêm một phân tử brom:
n khí P (có công thức phân tử C4H8, chứa liên kết đôi tương tự etilen) đi qua dung dịch brom màu da cam, sau phản ứng thấy dung dịch brom bị mất màu và thu được sản phẩm hữu cơ Q (C4H8Br2).
Viết công thức cấu tạo có thể có của Q.
Câu 4 (2,5 điểm)
1. Cho G, I và K là các hợp chất no, mạch hở có công thức đơn giản nhất là C2H3O2. Biết các chất trên chỉ chứa nhóm chức phản ứng được với dung dịch NaOH (đun nóng).
a. Xác định công thức phân tử của G, I, K.
b. Viết công thức cấu tạo có thể có của G, I và K. Biết G, I và K tham gia các phản ứng theo
đúng tỉ lệ mol như sau:
(G) + 2NaHCO3 → (G1) + 2CO2↑ + 2H2O
(I) + 2NaOH → (I1) + 2CH3OH
(K) + 2NaOH → (I1) + (K1) + H2O
2. Hỗn hợp T gồm 2 chất hữu cơ U (RCOOH) và V (R’(OH)2), trong đó R, R’ là các gốc
hiđrocacbon mạch hở. Lấy 0,05 mol hỗn hợp T tác dụng với Na dư thấy giải phóng 0,896 lít khí.
Mặt khác, đốt cháy hoàn toàn 0,25 mol hỗn hợp T, sau phản ứng thu được 15,68 lít CO2 và 13,5 gam H2O. Tìm công thức phân tử và viết công thức cấu tạo của U và V.
Câu 5 (2,0 điểm)
1. Khoáng chất X có công thức dạng MCO3.M(OH)2.nH2O (M là kim loại có hóa trị không đổi, n là số nguyên và n ≤ 10). Nung 19,2 gam X đến khối lượng không đổi thu được 8,0 gam chất rắn MO và hỗn hợp Y (gồm khí và hơi).
a. Xác định công thức của khoáng chất X.
b. Dẫn toàn bộ hỗn hợp Y vào 100 ml dung dịch Z gồm NaOH 1M và Ba(OH)2 0,3M đến khi phản ứng hoàn toàn thu được m1 gam kết tủa, khối lượng dung dịch tăng lên so với ban đầu là m2
gam. Tính m1, m2
2. Dẫn hỗn hợp khí A gồm 2 hidrocacbon mạch hở N (CnH2n+2) và M (CmH2m+2-2k) vào bình đựng

250 ml dung dịch Br2 1M, chỉ xảy ra phản ứng:
CmH2m+2-2k + kBr2 → CmH2m+2-2kBr2k
Sau phản ứng hoàn toàn thấy khối lượng bình brom tăng lên 7,0 gam, đồng thời có 14,6 gam khí
thoát ra khỏi bình. Đốt cháy hoàn toàn khí thoát ra thu được 21,952 lít CO2.
a. Xác định công thức phân tử của N và M.
b. Tính thành phần phần trăm về thể tích của các khí trong hỗn hợp A. ---------Hết---------
Ghi chú: Thí sinh không được sử dụng tài liệu. Cán bộ coi thi không giải thích gì thêm.
Họ và tên thí sinh: ……………………………. Số báo danh: ……………………………………
Chữ kí cán bộ coi thi 1: ………………………. Chữ kí cán bộ coi thi 2: …………………………
SỞ GIÁO DỤC VÀ ĐÀO TẠO
ĐĂK LĂK HDC KÌ THI TUYỂN SINH VÀO LỚP 10 THPT
ĐỀ CHÍNH THỨC (Đề thi có 02 trang)
NĂM HỌC 2022 – 2023
MÔN: HÓA HỌC - CHUYÊN
Thời gian làm bài: 150 phút, không kể thời gian phát đề
Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; O = 16; Na = 23; Mg = 24; Al = 27; Ca = 40;
Fe = 56; Cu = 64; Zn = 65; Br = 80; Sr = 88; Ba = 137.
Các thể tích khí đều đo ở điều kiện tiêu chuẩn; giả thiết các khí sinh ra không tan trong nước.
Câu 1. (2,0 điểm)
1. Viết các phương trình hóa học của các phản ứng xảy ra khi:
a. Sục từ từ khí CO2 đến dư vào dung dịch nước vôi trong.
b. Cho KHCO3 rắn vào dung dịch H2SO4 đặc dư.
c. Cho oxit Fe3O4 tác dụng với dung dịch HCl dư
d. Đốt cháy than gỗ.
2. Hoàn thành các sơ đồ phản ứng sau đây: (X1) + H2SO4 → (X2) + SO2↑ + H2O (1) (X3) + KOH → (X2) + (X4) (2) (X5) + KOH → (X2) + (X6) + H2O (3)
Biết M(X1) = M(X3) = M(X5) = 120 g/mol.
Lời giải
1.1.
a. CO2 + Ca(OH)2 → CaCO3↓ + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
b. 2KHCO3 + H2SO4 → K2SO4 + 2H2O + 2CO2↑
c. Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
d. C + O2 o → CO2
1.2.
X1: KHSO3; X3: MgSO4; X5: NaHSO4; X2: K2SO4; X4: Mg(OH)2; X6: Na2SO4
2KHSO3 + H2SO4 → K2SO4 + 2SO2↑ + 2H2O
MgSO4 + 2KOH → K2SO4 + Mg(OH)2
2NaHSO4 + 2KOH → K2SO4 + Na2SO4 + 2H2O
Câu 2. (1,5 điểm)
1. Hình vẽ sau đây mô tả thí nghiệm điều chế khí Cl2 trong phòng thí nghiệm:
A B
E
vai trò của bình (1), bình (2) trong quá trình điều chế trên.
Lời giải
a. A: dung dịch HCl đặc.
B: MnO2, KMnO4, K2Cr2O7, CaOCl2, …
D: dung dịch NaCl bão hòa.
E: dung dịch H2SO4 đặc.
PTHH: MnO2 + 4HCl đặc o → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl đặc ot → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
K2Cr2O7 + 14HCl đặc ot → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
b. Vai trò của bình 1 (dung dịch NaCl bão hòa): để giữ lại hơi HCl trong hỗn hợp khí và hơi thoát ra
từ bình cầu.
Vai trò của bình 2 (dung dịch H2SO4 đặc): để giữ lại hơi nước.
2. Trình bày phương pháp hóa học để làm sạch khí CO2 có lẫn tạp chất SO2.
Lời giải
Cho hỗn hợp khí đi qua dung dịch brom dư, SO2 bị giữ lại theo phương trình: SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Khí CO2 không phản ứng thoát ra.
Câu 3 (2,0 điểm)
2. Etilen và các chất tương tự etilen có chứa 1 liên kết đôi trong phân tử nên dễ tham gia phản ứng
cộng. Phản ứng cộng với brom, liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử etilen đã
kết hợp thêm một phân tử brom:
Dẫn khí P (có công thức phân tử C4H8, chứa liên kết đôi tương tự etilen) đi qua dung dịch brom màu da cam, sau phản ứng thấy dung dịch brom bị mất màu và thu được sản phẩm hữu cơ Q (C4H8Br2).
Viết công thức cấu tạo có thể có của Q.
Lời giải
Có 3 CTCT có thể có của Q: CH2=CH-CH2-CH3
CH3-CH=CH-CH3
CH2=C(CH3)2
Câu 4 (2,5 điểm)
1. Cho G, I và K là các hợp chất no, mạch hở có công thức đơn giản nhất là C2H3O2. Biết các chất trên chỉ chứa nhóm chức phản ứng được với dung dịch NaOH (đun nóng).
a. Xác định công thức phân tử của G, I, K.
b. Viết công thức cấu tạo có thể có của G, I và K. Biết G, I và K tham gia các phản ứng theo
đúng tỉ lệ mol như sau:
1. Nung hỗn hợp X gồm a gam Al và 24 gam Fe
2O3 trong điều kiện không có không khí, sau phản ứng thu được hỗn hợp chất rắn Y. Cho Y tác dụng với 500 ml dung dịch NaOH bM thu được 6,72 lít
khí H2, chất rắn không tan Z và dung dịch T gồm 2 chất tan có cùng nồng độ mol. Biết các phản ứng xảy ra hoàn toàn. Tìm giá trị của a và b.
Lời giải
PTHH: 2Al + Fe2O3 o → Al2O3 + 2Fe
Chất rắn Y: Al2O3, Fe và Al dư
Al2O3 + 2NaOH → 2NaAlO2 + H2O
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Chất rắn không tan Z: Fe.
Dung dịch T: NaAlO2, NaOH dư
Ta có: 23FeO 24 n0,15 mol
160 == → nAl phản ứng = 0,3 mol
2H 6,72 n0,3mol 22,4 == → nAl dư = 0,2 mol
Số mol Al ban đầu là: 0,3 + 0,2 = 0,5 mol → mAl = 0,5.27 = 13,5 gam → a = 13,5

Bảo toàn nguyên tố Al: 2 NaAlOAl n n 0,5 mol ==
Dung dịch T gồm 2 chất tan có cùng nồng độ mol tức có cùng số mol nên nNaOH dư = 0,5 mol
Bảo toàn nguyên tố Na: nNaOH phản ứng = nAl ban đầu = 0,5 mol
Số mol NaOH ban đầu là: 0,5 + 0,5 = 1,0 mol
Nồng độ NaOH là 1 2M 0,5 = → b = 2
(G) + 2NaHCO3 → (G1) + 2CO2↑ + 2H2O
(I) + 2NaOH → (I1) + 2CH3OH
(K) + 2NaOH → (I1) + (K1) + H2O
a. Gọi công thức của G, I, K là: (C2H3O2)n
Lời giải
Độ bất bão hòa của G, I, K là: 2C+2-H4n+2-3nn+2
Do G, I, K là hợp chất no chỉ chứa các nhóm chức phản ứng được với NaOH nên n+2 n n=2 2
CTPT của G, I, K là C4H6O4.
b. G + 2NaHCO3 → (G1) + 2CO2↑ + 2H2O nên G là axit 2 chức.
(I) + 2NaOH → (I1) + 2CH3OH nên I là este 2 chức của axit hai chức với CH3OH.
(K) + 2NaOH → (I1) + (K1) + H2O nên K là hợp chất tạp chức axit và este.
COOH │ CH-CH3 │ COOH
COOCH3 │ COOCH3
COOC2H5
COOH
CTCT của G: CTCT của I: CTCT của K: COOH │ CH2 │ CH2 │ COOH
H
n hợp T gồm 2 chất hữu cơ U (RCOOH) và V (R’(OH)2), trong đó R, R’ là các gốc hiđrocacbon mạch hở. Lấy 0,05 mol hỗn hợp T tác dụng với Na dư thấy giải phóng 0,896 lít khí.
Mặt khác, đốt cháy hoàn toàn 0,25 mol hỗn hợp T, sau phản ứng thu được 15,68 lít CO2 và 13,5
gam H2O. Tìm công thức phân tử và viết công thức cấu tạo của U và V.
Lời giải
Gọi x và y lần lượt là số mol của U và V trong 0,05 mol hỗn hợp T.
PTHH: RCOOH + Na → RCOONa + 1 2 H2
R’(OH)2 + 2Na → R’(ONa)2 + H2
CO2 + 2NaOH → Na2CO3 + H2O
Ban đầu: 0,02 0,1
Phản ứng: 0,02 0,02 0,02
Sau: 0 0,08 0,02
m1 gam kết tủa gồm 0,03 mol BaCO3 → m1 = 0,03.197 = 5,91 gam
Khối lượng dung dịch tăng lên so với ban đầu là: m2 = 223 COHOBaCOm m - m = 0,05.44 + 0,5.18 - 5,91 = 5,29 gam +
2. Dẫn hỗn hợp khí A gồm 2 hidrocacbon mạch hở N (CnH2n+2) và M (CmH2m+2-2k) vào bình đựng
Ta có hệ phương trình: 0,05 0,02 0,03 0,04 2
xy x x y y
+= = → = +=
Trong 0,25 mol hỗn hợp T có 0,1 mol RCOOH và 0,15 mol R’(OH)2.
Khi đốt cháy 22 COHOn0,7 mol; n 0,75 mol ==
Gọi n và m lần lượt là số nguyên tử Cacbon trong U và V.
Bảo toàn nguyên tố C: 0,1n + 0,15m = 0,7 → 2n + 3m = 14 → Chọn n = 4 và m = 2
Vì 22 HOCOnn > nên ancol V là no → V là C2H6O2 hay C2H4(OH)2.
Bảo toàn nguyên tố H → số nguyên tử H trong U là: 0,75.2-0,15.6 6 0,1 =
CTPT của U là: C4H6O2.
CTCT của U là: CH2=CH-CH2-COOH CH3-CH=CH-COOH
CH2=C(CH3)-COOH
Câu 5 (2,0 điểm)
1. Khoáng chất X có công thức dạng MCO3.M(OH)2.nH2O (M là kim loại có hóa trị không đổi, n là số nguyên và n ≤ 10). Nung 19,2 gam X đến khối lượng không đổi thu được 8,0 gam chất rắn MO và hỗn hợp Y (gồm khí và hơi).
a. Xác định công thức của khoáng chất X.
b. Dẫn toàn bộ hỗn hợp Y vào 100 ml dung dịch Z gồm NaOH 1M và Ba(OH)2 0,3M đến khi phản ứng hoàn toàn thu được m1 gam kết tủa, khối lượng dung dịch tăng lên so với ban đầu là m2 gam. Tính m1, m2.
Lời giải
a. PTHH: MCO3.M(OH)2.nH2O ot → 2MO + CO2 + (n + 1)H2O
Ta có: 19,28 .2 2M+94+18nM+16 =
Biện luận ta được n = 9 và M = 64 (Cu) thỏa mãn.
Công thức của khoáng chất X là: CuCO3.Cu(OH)2.9H2O
b. Hỗn hợp Y gồm 0,05 mol CO2 và 0,5 mol H2O(h)
Theo giả thiết, 2NaOHBa(OH)n0,1 mol; n 0,03 mol ==
CO2 + Ba(OH)2 → BaCO3 + H2O
Ban đầu: 0,05 0,03
Phản ứng: 0,03 0,03 0,03
Sau: 0,02 0 0,03
250 ml dung dịch Br2 1M, chỉ xảy ra phản ứng:
CmH2m+2-2k + kBr2 → CmH2m+2-2kBr2k
Sau phản ứng hoàn toàn thấy khối lượng bình brom tăng lên 7,0 gam, đồng thời có 14,6 gam khí thoát ra khỏi bình. Đốt cháy hoàn toàn khí thoát ra thu được 21,952 lít CO2.
a. Xác định công thức phân tử của N và M.
b. Tính thành phần phần trăm về thể tích của các khí trong hỗn hợp A.
Lời giải
Theo giả thiết 22 BrCOn0,25 mol; n 0,98 mol ==
Xét phản ứng: CmH2m+2-2k + kBr2 → CmH2m+2-2kBr2k
0,25
k ← 0,25 mol
Vì khối lượng bình brom tăng 7,0 gam chính là khối
lượng của M phản ứng nên ta có 0,25(14m+2-2k)7 14m+2=30k k =→
Chọn k = 1 và m = 2 → CTPT của M là C2H4.
Hỗn hợp khí thoát ra gồm RH CnH2n+2 (N): x mol và C2H4 (M) dư: y mol
Ta có hệ: (142)2814,6 20,98 nxy nxy ++= += → x = 0,44 → 0,44n + 2y = 0,98
Nếu n = 1 (CH4) → y = 0,27
4 24 CH CH 0,44 %V= .100%61,97%%V38,03% 0,270,44 =→= +
Nếu n = 2 (C2H6) → y = 0,05
26 24 CH CH 0,44 %V= .100%89,8%%V10,2% 0,050,44 =→= + ---------Hết---------
ĐĂK NÔNG (Đề thi gồm có 2 trang)
Bài 1 (2 điểm):
KỲ THI TUYỂN SINH 10 THPT
NĂM HỌC 2022 – 2023
Môn: HÓA HỌC (CHUYÊN 10)
Thời gian làm bài 150 phút không kể thời gian giao đề
1. Hãy thực hiện những chuyển đổi hóa học sau bằng cách viết những phương trình hóa học, ghi rõ
điều kiện phản ứng (nếu có):
FeS2 (1) → SO2 (2) → SO3 (3) → H2SO4 (4) → H2 (5) → Cu (6) → CuCl2 (7) → BaCl2
(8)
→ Ba(NO3)2
2. Hãy nêu và giải thích bằng phương trình phản ứng các hiện tượng xảy ra trong từng thí nghiệm sau:
a. Đưa bình đựng hỗn hợp khí CH4 và Cl2 ra ánh sáng. Sau một thời gian, cho nước vào bình lắc nhẹ và thêm vào một mẩu giấy quỳ tím.
b. Dẫn khí C2H4 qua bình đựng dung dịch brom màu da cam.
c. Cho mẩu Na vào ống nghiệm đựng rượu etylic.
d. Cho lá đồng vào ống nghiệm đựng dung dịch CH3COOH.
Bài 2 (2 điểm):
1. Từ muối ăn, đá vôi, nước, các thiết bị và điều kiện thí nghiệm cần thiết. Hãy viết phương trình hóa
học của phản ứng điều chế:
a. Khí H2.
b. Canxi oxit.
c. Canxi hiđroxit.
d. Nước Gia – ven (dung dịch hỗn hợp hai muối NaCl và NaClO).
2. Có năm dung dịch: HCl, CH3COOH, glucozơ (C6H12O6); NaNO3; (CH3COO)2Ca. Hãy trình bày cách nhận biết các dung dịch trên.
Bài 3 (2 điểm):
1. Cho 4,32 gam một kim loại M chưa rõ hóa trị tác dụng với 120 gam dung dịch HCl 14,6% thu được dung dịch A và V lít khí ở điều kiện tiêu chuẩn. Để trung hòa lượng axit dư trong A cần vừa đủ 120 ml dung dịch KOH 1,0M. Xác định M và V.
2. Đốt cháy hoàn toàn 11,16 gam hợp chất hữu cơ A thu được 31,68 gam CO2; 7,56 gam H2O và 1,344 lít N2 (ở điều kiện tiêu chuẩn). Tỉ khối hơi của A so với khí oxi nhỏ hơn 3. Xác định công thức phân tử của A.
Bài 4 (2 điểm):
1. Khử hoàn toàn một oxit sắt X ở nhiệt độ cao cần vừa đủ V lít CO (ở điều kiện tiêu chuẩn), sau phản ứng thu được 0,84 gam Fe và 0,02 mol khí CO2
a. Tìm công thức của X và giá trị V.
b. Hỗn hợp Y gồm X, FeO và Ag (trong đó nguyên tố oxi chiếm 19,2% theo khối lượng). Cho m gam Y tác dụng với 1500 ml dung dịch HCl 3M (dư), thu được dung dịch Z và còn lại 0,248m gam chất rắn
không tan. Cho dung dịch Z tác dụng với dung dịch NaOH dư thu được k
khí đến khối lượng không đổi thu được 100 gam chất rắn khan. Tính m và phần trăm khối lượng từng chất
trong hỗn hợp Y.
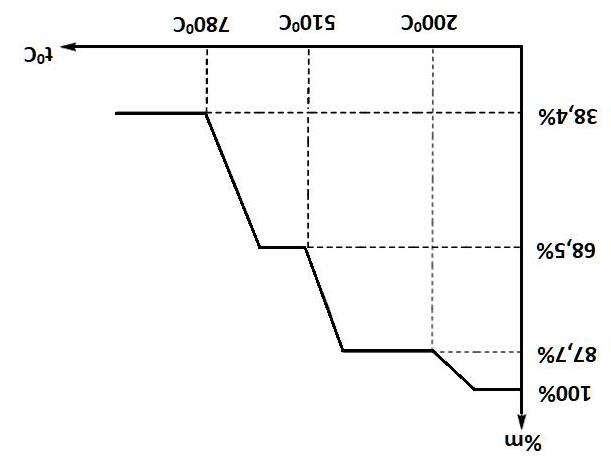
2. Khi dẫn từ từ đến dư khí CO2 vào dung dịch Ca(OH)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Hãy tính x và y.
Bài 5 (2 điểm):
1. Cho hỗn hợp X gồm 0,15 mol C2H4 và 0,2 mol H2
a. Tính tỉ khối của hỗn hợp X so với H2.
b. Dẫn hỗn hợp X qua bột Ni nung nóng (hiệu suất phản ứng đạt 50%) thu được hỗn hợp Y. Tính phần trăm thể tích của các khí trong hỗn hợp Y. Biết khi đun nóng hỗn hợp X có bột Ni thì xảy ra phản ứng:
C2H4 + H2 oNi,t → C2H6.
2. Hỗn hợp A gồm axit cacboxylic no, đơn chức, mạch hở (CnH2n + 1COOH; n ≥ 0) và ancol no, hai chức, mạch hở (CmH2m(OH)2; m ≥ 2). Đốt cháy hoàn toàn 48,4 gam hỗn hợp A cần dùng 49,28 lít khí O2 (ở

điều kiện tiêu chuẩn) sau phản ứng thu được 79,2 gam khí CO2.
a. Xác định công thức hai chất trong A.
b. Nếu thêm vào hỗn hợp A một ít H2SO4 đặc làm xúc tác, rồi đun nóng hỗn hợp này, sau phản ứng người ta thu được 13,44 gam một este có công thức (CnH2n+1COO)2CmH2m. Tính hiệu suất phản ứng tạo thành este này.
Hết
Thí sinh được phép sử dụng bảng tuần hoàn các nguyên tố hóa học, không được sử dụng tài liệu. Cán bộ coi thi không giải thích gì thêm.
Họ và tên thí sinh: …………………………………………. Số báo danh: …………
GIÁO DỤC VÀ ĐÀO TẠO (Đề thi gồm có 2 trang)
Bài 1 (2 điểm):
KỲ THI TUYỂN SINH 10 THPT
NĂM HỌC 2022 – 2023
Môn: HÓA HỌC (CHUYÊN 10)
Thời gian làm bài 150 phút không kể thời gian giao đề
1. Hãy thực hiện những chuyển đổi hóa học sau bằng cách viết những phương trình hóa học, ghi rõ
điều kiện phản ứng (nếu có):
FeS2 (1) → SO2 (2) → SO3 (3)
→ H2SO4 (4) → H2 (5) → Cu (6) → CuCl2 (7) → BaCl2 (8)
→ Ba(NO3)2
2. Hãy nêu và giải thích bằng phương trình phản ứng các hiện tượng xảy ra trong từng thí nghiệm
HCl (↑) + H2O → HCl (dd). Dung dịch HCl làm quỳ tím chuyển sang màu đỏ
b.
Hiện tượng: Dung dịch brom nhạt dần đến mất màu.
Giải thích: C2H4 + Br2 → C2H4Br2
c.
Hiện tượng: Mẩu Na tan dần, có khí thoát ra.
Giải thích: 2Na + 2C2H5OH → 2C2H5ONa + H2 (↑)
d.
Hiện tượng: Không có hiện tượng gì xảy ra.
Giải thích: Cu đứng sau (H) trong dãy hoạt động hóa học nên không tác dụng với CH3COOH.
Bài 2 (2 điểm):
sau:
a. Đưa bình đựng hỗn hợp khí CH4 và Cl2 ra ánh sáng. Sau một thời gian, cho nước vào bình lắc nhẹ và thêm vào một mẩu giấy quỳ tím.
b. Dẫn khí C2H4 qua bình đựng dung dịch brom màu da cam.
c. Cho mẩu Na vào ống nghiệm đựng rượu etylic.
d. Cho lá đồng vào ống nghiệm đựng dung dịch CH3COOH.
GIẢI:
1. Các phương trình hóa học trong chuyển đổi:
(1) 4FeS2 + 11O2 o t → 2Fe2O3 + 8SO2 ↑
(2) 2SO2 + O2 o 25t,VO → ← 2SO3
(3) SO3 + H2O → H2SO4
(4) H2SO4 (loãng) + Fe → FeSO4 + H2 ↑
(5) H2 + CuO o t → Cu + H2O
(6) Cu + Cl2 o t → CuCl2
(7) CuCl2 + Ba(OH)2 → Cu(OH)2↓ + BaCl2
(8) BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
2. Các hiện tượng xảy ra tại mỗi trường hợp và giải thích:
a.
Hiện tượng:
+ Đưa bình đựng hỗn hợp khí CH4 và Cl2 ra ánh sáng sau một thời gian hỗn hợp mất màu.
+ Sau một thời gian, cho nước vào bình lắc nhẹ và thêm vào một mẩu giấy quỳ tím thấy quỳ tím chuyển sang màu đỏ.
Giải thích bằng phương trình hóa học:
CH4 + Cl2 as → CH3Cl + HCl (↑)
1. Từ muối ăn, đá vôi, nước, các thiết bị và điều kiện thí nghiệm cần thiết. Hãy viết phương trình hóa
học của phản ứng điều chế:
a. Khí H2.
b. Canxi oxit.
c. Canxi hiđroxit.
d. Nước Gia – ven (dung dịch hỗn hợp hai muối NaCl và NaClO).
2. Có năm dung dịch: HCl, CH3COOH, glucozơ (C6H12O6); NaNO3; (CH3COO)2Ca. Hãy trình bày cách nhận biết các dung dịch trên.
GIẢI:
1. Các phương trình hóa học:
a. Điều chế khí H2:
2NaCl + 2H2O
ñieänphaândungdòchcoùmaøngngaên 2NaOH + Cl2 (↑) + H2 (↑)
b. Điều chế canxi oxit:
CaCO3 o t → CaO + CO2 (↑)
c. Điều chế canxi hiđroxit:
CaCO3 o t → CaO + CO2 (↑)
CaO + H2O → Ca(OH)2
d. Điều chế nước Gia – ven:
2NaCl + 2H2O → ñieänphaândungdòch 2NaOH + Cl2 (↑) + H2 (↑)
Cl2 + 2NaOH → NaCl + NaClO + H2O
2. Nhận biết 5 dung dịch: HCl, CH3COOH, glucozơ (C6H12O6); NaNO3; (CH3COO)2Ca.
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng bột kim loại Fe:
+ Bột sắt tan dần, có khí thoát ra → nhóm I: HCl, CH3COOH.
Fe + 2HCl → FeCl2 + H2 (↑)
Fe + 2CH3COOH → (CH3COO)2Fe + H2 (↑)
+ Không có hiện tượng gì → nhóm II: glucozơ (C6H12O6); NaNO3; (CH3COO)2Ca.
- Nhận biết nhóm I: Sử dụng dung dịch AgNO3
+ Xuất hiện kết tủa trắng → HCl
AgNO3 + HCl → AgCl (↓) + HNO3
+ Không hiện tượng → CH3COOH.
- Nhận biết nhóm II: Sử dụng Cu(OH)2
+ Cu(OH)2 tan, tạo phức xanh đặc trưng → glucozơ (C6H12O6)
2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu (phức đồng – glucozơ) + 2H2O
+ Không có hiện tượng: NaNO3; (CH3COO)2Ca.
- Tiếp tục sử dụng Na2CO3:
+ Xuất hiện kết tủa trắng → (CH3COO)2Ca:
(CH3COO)2Ca + Na2CO3 → 2CH3COONa + CaCO3↓
+ Không hiện tượng: NaNO3
Dán nhãn các lọ
Bài 3 (2 điểm):
1. Cho 4,32 gam một kim loại M chưa rõ hóa trị tác dụng với 120 gam dung dịch HCl 14,6% thu
được dung dịch A và V lít khí ở điều kiện tiêu chuẩn. Để trung hòa lượng axit dư trong A cần vừa đủ 120 ml
dung dịch KOH 1,0M. Xác định M và V.
2. Đốt cháy hoàn toàn 11,16 gam hợp chất hữu cơ A thu được 31,68 gam CO2; 7,56 gam H2O và
1,344 lít N2 (ở điều kiện tiêu chuẩn). Tỉ khối hơi của A so với khí oxi nhỏ hơn 3. Xác định công thức phân tử của A.
GIẢI:
1. Theo bài ra ta có:
HCl 120.14,6 n0,48mol 100.36,5 == ; nKOH = 0,12.1 = 0,12 mol
Phản ứng trung hòa axit dư: HCl + KOH → KCl + H2O
⇒ nHCl dư = nKOH = 0,12 mol
⇒ nHCl phản ứng = 0,48 – 0,12 = 0,36 mol
Bảo toàn nguyên tố H có:
2 HHCl 11 n.n.0,360,18mol 22 ===
⇒ V = 0,18. 22,4 = 4,032 lít.
Đặt kim loại M có hóa trị là n. Ta có:
2M + 2nHCl → MCln + nH2
Theo bài ra: M 4,32 n M = ;
Theo PTHH: 2MH 20,36 n.n nn ==
Vậy M 4,320,36 nM12n Mn == =
⇒ n = 2; M = 24 thỏa mãn, kim loại cần tìm là Mg.
2.
Ta có:
2 2 2
CO C HOH N N
== = == = == =
31,68 n0,72moln0,72mol 44 7,56 n0,42moln0,84mol 18 1,344 n0,06moln0,12mol 22,4
Đốt cháy hoàn toàn A thu được CO2, H2O, N2 vậy trong A có C, H, N và có thể có O.
Lại có: mC + mH + mN = 0,72.12 + 0,84 + 0,12.14 = 11,16 ⇒ trong A không có O.
Đặt công thức của A có dạng: CxHyNz, ta có:
x : y : z = nC : nH : nN = 0,72 : 0,84 : 0,12 = 6 : 7 : 1
⇒ Công thức thực nghiệm của A: (C6H7N)n
T
ỉ khối hơi của A so với khí oxi nhỏ hơn 3 ⇒ (12.6 + 7 + 14)n < 3.32
⇒ n < 1,03. Vậy n = 1 thỏa mãn.
Công thức phân tử của A là: C6H7N.
Bài 4 (2 điểm):
1. Khử hoàn toàn một oxit sắt X ở nhiệt độ cao cần vừa đủ V lít CO (ở điều kiện tiêu chuẩn), sau
phản ứng thu được 0,84 gam Fe và 0,02 mol khí CO2
a. Tìm công thức của X và giá trị V.
b. Hỗn hợp Y gồm X, FeO và Ag (trong đó nguyên tố oxi chiếm 19,2% theo khối lượng). Cho m gam Y tác dụng với 1500 ml dung dịch HCl 3M (dư), thu được dung dịch Z và còn lại 0,248m gam chất rắn không tan. Cho dung dịch Z tác dụng với dung dịch NaOH dư thu được kết tủa T. Đem nung T ngoài không khí đến khối lượng không đổi thu được 100 gam chất rắn khan. Tính m và phần trăm khối lượng từng chất trong hỗn hợp Y.
2. Khi dẫn từ từ đến dư khí CO2 vào dung dịch Ca(OH)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Ag(Y) 0,248.m %m.100%24,8% m ==
Gọi số mol FeO và Fe3O4 trong Y lần lượt là a mol và b mol.
Theo khối lượng: 72a + 232b = 125 – 0,248.125 = 94 (1)
Bảo toàn nguyên tố Fe có: a + 3b = 1,25 (2)
Từ (1) và (2) giải hệ phương trình được: a = 0,5 và b = 0,25.

0,5.72 %m.100%28,8% 125 %m100%24,8%28,8%46,4%
FeO FeO
Hãy tính x và y.
1. Ta có: Fe 0,84 n0,015mol 56 ==
GIẢI:
a. Bảo toàn C có: 2COCO nn0,02mol == ⇒ V = 0,02.22,4 = 0,448 lít.
Đặt oxit sắt là FexOy ta có: 2O(oxit)CO nn0,02mol ==
x : y = nFe : nO = 0,015 : 0,02 = 3 : 4.
Vậy oxit sắt cần tìm là Fe3O4.
b. Hỗn hợp Y gồm: Fe3O4; FeO; Ag cho vào 4,5 mol HCl (dư):
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
FeO + 2HCl → FeCl2 + H2O
Chất rắn không tan là Ag.
Cho dung dịch Z tác dụng với NaOH:
HCl dư + NaOH → NaCl + H2O
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Kết tủa là Fe(OH)2 và Fe(OH)3 đem nung đến khối lượng không đổi:
4Fe(OH)2↓ + O2 o → 2Fe2O3 + 4H2O
2Fe(OH)3 o t → Fe2O3 + 3H2O
Vậy 100 gam chất rắn khan là Fe2O3
23FeO 100 n0,625mol 160 ==
Bảo toàn nguyên tố Fe có nFe(Y) = 0,625.2 = 1,25 mol.
Ta có: mY = mFe(Y) + mO(Y) + mAg(Y)
⇔=++ =
19,2 m 1,25.56 .m0,248mm125 100
Vậy m = 125 gam.
== =−−=
34
2. Dẫn từ từ đến dư CO2 vào Ca(OH)2, các phản ứng xảy ra như sau:
CO2 + Ca(OH)2 → CaCO3 (↓) + H2O (1)
CaCO3 (↓) + CO2 + H2O → Ca(HCO3)2 (2)
Tại vị trí kết tủa cực đại, phản ứng (1) vừa xong, ta có:
3max2 CaCOCO xnn0,4mol ===
Tại vị trí thu được 0,26 mol kết tủa, phản ứng (1) xảy ra hoàn toàn và phản ứng (2) vừa xảy ra một phần.
Ta có: 23maxCOCaCO yn2.n0,262.0,40,260,54mol. ==−=−=
Bài 5 (2 điểm):
1. Cho hỗn hợp X gồm 0,15 mol C2H4 và 0,2 mol H2
a. Tính tỉ khối của hỗn hợp X so với H2.
b. Dẫn hỗn hợp X qua bột Ni nung nóng (hiệu suất phản ứng đạt 50%) thu được hỗn hợp Y. Tính phần trăm thể tích của các khí trong hỗn hợp Y. Biết khi đun nóng hỗn hợp X có bột Ni thì xảy ra phản ứng:
C2H4 + H2 oNi,t → C2H6
2. Hỗn hợp A gồm axit cacboxylic no, đơn chức, mạch hở (CnH2n + 1COOH; n ≥ 0) và ancol no, hai chức, mạch hở (CmH2m(OH)2; m ≥ 2). Đốt cháy hoàn toàn 48,4 gam hỗn hợp A cần dùng 49,28 lít khí O2 (ở
điều kiện tiêu chuẩn) sau phản ứng thu được 79,2 gam khí CO2.
a. Xác định công thức hai chất trong A.
b. Nếu thêm vào hỗn hợp A một ít H2SO4 đặc làm xúc tác, rồi đun nóng hỗn hợp này, sau phản ứng người ta thu được 13,44 gam một este có công thức (CnH2n+1COO)2CmH2m. Tính hiệu suất phản ứng tạo thành este này.
GIẢI:
1.
a. Tỉ khối của hỗn hợp X so với H2:
+ == + ==
0,15.280,2.292 M 0,150,27
M46 d M7
H2 2
X X X H
nóng: +→ oNi,t 24226CH H CH
Tæleä: 1 1 1 mol
Ban ñaàu: 0,15 0,2 mol Tac
2 Sau phaûnöùng:CH 0,20,15
où: > 11 Tính theoCH
DoH50%:
=
Theo bài ra ta có:
2CHCOOH CH(OH) (CHCOO)CH 2H
Tæleä: 2 1 1 2 mol
Banñaàu:
24 24
Phaûnöùng: 0,075 0,075 0,075 mol
Sauphaûnöùng: 0,075 0,125
heát,Hdö 0,075mol
Hỗn hợp Y gồm: C2H4 0,075 mol; H2 0,125 mol và C2H6 0,075 mol
⇒ nY = 0,075 + 0,125 + 0,075 = 0,275mol.
Với các chất ở cùng điều kiện, tỉ lệ về thể tích cũng là tỉ lệ về số mol nên:
0,075 %V.100%27,27% 0,275 0,125
O
0,3 0,4 mol 0,30,4
3
Tacoù: < HtheoCHCOOH. 21
Phaûnöùng: 0,168 0,084 0,084 mol
Vậy H tạo thành este là: 0,168 H.100%56%. 0,3 ==
%V.100%45,45% 0,275
%V100%27,27%45,45%27,28%
CH H CH
== == =−−= 2.
a. Theo bài ra ta có: 2 2OCO 49,2879,2 n2,2mol;n1,8mol 22,444 ==== Áp dụng định luật bảo toàn khối lượng ta có:
ọi số mol CnH2n + 1COOH và CmH2m(OH)2 lần lượt là x và y mol.
Bảo toàn C ta có: (n + 1).x + m.y = 1,8 (1)
Bảo toàn O ta có: 2x + 2y = 2.1,8 + 2,2 – 2.2,2 = 1,4 (2)
Bảo toàn H ta có: (n + 1).x + (m + 1).y = 2,2 (3)
Từ (1); (2) và (3) ta có:
+=−= +=⇔=
n.xm.y1,8xx0,3 xy0,7y0,4
n.xm.yxy2,23n4m15
+++=+=
Do n ≥ 0 và m ≥ 2 ta có n = 1; m = 3 thoãn mãn.
Vậy axit là CH3COOH và ancol là C3H6(OH)2.
b.
Este
ĐỀ CHÍNH THỨC
(Đề thi có 02 trang)
Câu 1: (2,0 điểm)
NĂM HỌC 2022-2023
Môn: Hóa học
Thời gian làm bài: 120 phút (không kể thời gian giao đề)
Ngày thi: 02/06/2022
1. Xác định công thức hóa học của R1, R2, R3, R4, R5, R6 và viết các phương trình hoá học xảy ra, Ghi rõ điều kiện phản ứng (nếu có), cho biết:
a) R1 + O2 → R2 (R1 là khí không màu, mùi hắc)
b) R2 + H2S→ R1 + H2O
e) R2 + Br2 + H2O →HBr + R3
đ)R3 + R4 → Muối (1) + Muối (2) + H2O
e) R3 (Đặc) + R5→ R2 + R6 (khí) + H2O

2. Sơ đồ dưới đây mô tả thí nghiệm điều chế khí Cl2 trong phòng thí nghiệm.
dd HCl đặc
Chất rắn A
Bông tẩm
dd NaOH
Bình sạch để thu khí Cl2
a) Cho dung dịch BaCl2 vào dung dịch NaHCO3 sau đó đun nóng.
b) Nhỏ vài giọt dung dịch AgNO3 vào ống nghiệm đựng 1 ml dung dịch amoniac, lắc nhẹ
2 ml dung dịch glucozơ, sau đó đặt ống nghiệm vào cốc nước nóng.
3. Một mẫu quặng Bôxit chứa Al2O3 có lẫn Fe2O3 và SiO2. Em hãy trình bày cách làm để thu được
Al tinh khiết. Viết các phương trình hoá học xảy ra, ghi rõ điều kiện phản ứng nếu có.
4. Viết các công thức cấu tạo dạng thu gọn có thể có của các hợp chất hữu cơ mạch hở, trong phân tử chỉ chứa liên kết đơn sau:
a) C3H8O
b) C4 H9Cl Câu 3: (3,0 điểm)
1. Cho a gam K tác dụng với 100 ml dung dịch H2SO4 0,1M, sau khi phản ứng kết thúc thu được dung dịch X và 0,56 lít (ở đktc) khí H2. Cô cạn dung dịch X thu được m gam chất rắn khan. Tìm giá trị của a và m.
2. Đốt cháy hoàn toàn một chất hữu cơ A chứa C, H, O, N (MA < 78) thu được CO2, H2O và N2. Biết rằng số mol H2O bằng 1,75 lần số mol CO2, tổng số mol CO2 và H2O bằng 2 lần số mol O3 tham gia phản ứng. Xác định công thức phân tử của A.
3. Cho X và Y là các dung dịch HCl có nồng độ mol/lít khác nhau. Lấy V1 lít X trộn với V2 lít Y thu được 0,2 lít dung dịch Z.
a) Tính nồng độ mol/lít của dung dịch Z biết rằng V1 lít X phản ứng với dung dịch AgNO3 dư thì thu
được 4,305 gam kết tủa, V2 lít Y phản ứng vừa đủ với 20 gam dung dịch NaOH 4%.
b) Tính nồng độ mol/lít của dung dịch X và Y, biết rằng lượng H2 thu được khi cho 0,1 lít X phản
ứng hết với Fe ít hơn lượng H2 thu được khi cho 0,1 lít Y phản ứng hết với Fe là 224 ml (ở đktc).
Câu 4: (2,5 điểm)
dd NaCl Bão hoà
dd H2SO4 đặc
a) Cho biết chất rắn A trong bình cầu có thể là chất nào? Viết một phương trình hoá học của phản
ứng xảy ra trong bình cầu.
b) Giải thích tác dụng của các bình đựng dung dịch NaCl bão hòa, dung dịch H2SO4 đặc và nút bông tâm dung dịch NaOH.
3. Có các chất: C2H5OH, CH3COOH, CH3COOC2H5
a) Trong điều kiện thích hợp, những chất nào trong các chất trên tác dụng được với dung dịch NaOH?
Viết phương trình hoá học xảy ra.
b) Bằng phương pháp hoá học hãy nhận biết các chất trên, viết phương trình hoá học minh họa.
Câu 2: (2,5 điểm)
1. Giải thích các hiện tượng thực tế sau:
a) Khi nâu canh cua thấy nôi lên các mảng gạch cua.
b) Đoạn mía đề ngoài không khí lâu ngày, ở hai đầu đoạn mía thường có mùi của rượu etylic.
2. Nêu hiện tượng và viết phương trình hoá học xảy khi tiến hành các thí nghiệm sau:
1. Cho 37,95 gam hỗn hợp bột X gồm BaCO3 và RCO3 (R có hoá trị không đổi) vào cốc chứa m gam dung dịch H2SO4 loãng nồng độ 9,8%. Khuấy đều hỗn hợp cho đến khi phản ứng kết thúc thì thu được dung dịch Y, chất rắn Z và 2,8 lít (ở đktc) khí CO2. Cô cạn dung dịch Y thu được 6,0 gam muối khan, còn nung chất rắn Z đến khối lượng không đổi thu được 30,95 gam chất rắn T và khí CO2.
a) Tìm m và khối lượng chất rắn Z.
b) Xác định kim loại R, biết trong X số mol của BaCO3 gấp 1,5 lần số mol RCO3
2. Hỗn hợp A gồm CH4, C2H4, C3H4 (CH=C−CH3). Khi cho 6,4 gam hỗn hợp A vào bình đựng dung dịch Br2 (dư) thì có tối đa 0,2 mol Br2 tham gia phản ứng. Mặc khác, đốt cháy hoàn toàn 0,5 mol hỗn hợp A cần dùng vừa đủ V lít (ở đktc) khí O2 sau phản ứng thu được nước và m gam CO2. Tìm giá trị của m và V.
Cho biết các nguyên tử khối của: H= 1; C = 12; N= 14; O = 16; Na = 23; Mg = 24; Al = 27; S=32;
Cl = 35,5; K= 39; Ca= 40 Fe=56; Cu= 64; Zn = 65; Br = 80; Ag = 108; Ba= 137.
Ghi chú:
- Thí sinh không được phép sử dụng bảng tuần hoàn các nguyên tố hoá học.
- Giám thị không giải thích gì thêm.
ĐỀ CHÍNH THỨC
(Đề thi có 02 trang)
Câu 1: (2,0 điểm)
NĂM HỌC 2022-2023
Môn: Hóa học
Thời gian làm bài: 120 phút (không kể thời gian giao đề)
Ngày thi: 02/06/2022
1. Xác định công thức hóa học của R1, R2, R3, R4, R5, R6 và viết các phương trình hoá học xảy ra, Ghi rõ điều kiện phản ứng (nếu có), cho biết:
a) R1 + O2 → R2 (R1 là khí không màu, mùi hắc)
b) R2 + H2S→ R1 + H2O
e) R2 + Br2 + H2O →HBr + R3
đ)R3 + R4 → Muối (1) + Muối (2) + H2O
e) R3 (Đặc) + R5→ R2 + R6 (khí) + H2O
2. Sơ đồ dưới đây mô tả thí nghiệm điều chế khí Cl2 trong phòng thí nghiệm.
dd HCl đặc
Chất rắn A
e) SO2 + Br2 + H2O →2HBr + H2SO4
đ) 4H2SO4 + Fe3O4→ Fe2(SO4)3 + FeSO4 + 4H2O
e) H2SO4 (Đặc) + C → SO2 + CO2 (khí) + H2O

2)
a. A là MnO2 hoặc KMnO4
MnO2 + 2HCl MnCl2 + Cl2 + H2O
2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 + 8H2O
b. 2 bình đựng NaCl bão hoà và bình H2SO4 đặc dùng để rửa và làm khô khí.
- Bình đựng NaCl bão hoà dùng để giữ lại HCl
- Bình dung dịch H2SO4 đặc để làm khô khí, do H2SO4 đặc có tính hút ẩm.
- Nút bông tâm dung dịch NaOH đề tránh HCl thoát ra khỏi bình thu khí.
3)
a) Các chất tác dụng với NaOH là: CH3COOH, CH3COOC2H5
CH3COOH + NaOH → CH3COONa + H2O
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
Bông tẩm dd NaOH
Bình sạch để thu khí Cl2
b)
Chất thử C2H5OH CH3COOH CH3COOC2H5
Quỳ tím - ĐỏNa ↑ -
C2H5OH + Na→C2H5ONa + H2↑
dd NaCl Bão hoà
dd H2SO4 đặc
a) Cho biết chất rắn A trong bình cầu có thể là chất nào? Viết một phương trình hoá học của phản
ứng xảy ra trong bình cầu.
b) Giải thích tác dụng của các bình đựng dung dịch NaCl bão hòa, dung dịch H2SO4 đặc và nút bông tâm dung dịch NaOH.
3. Có các chất: C2H5OH, CH3COOH, CH3COOC2H5
a) Trong điều kiện thích hợp, những chất nào trong các chất trên tác dụng được với dung dịch NaOH? Viết phương trình hoá học xảy ra.
b) Bằng phương pháp hoá học hãy nhận biết các chất trên, viết phương trình hoá học minh họa.
Giải
1)
R1: S; R2:SO2 R3: H2SO4; R4: Fe3O4
a) S + O2 SO2 (R1 là khí không màu, mùi hắc)
b) SO2 + 2H2S→ 3S↓ +2 H2O
5:C R6: CO2
Câu 2: (2,5 điểm)
1. Giải thích các hiện tượng thực tế sau:
a) Khi nấu canh cua thấy nổi lên các mảng gạch cua.
b) Đoạn mía đề ngoài không khí lâu ngày, ở hai đầu đoạn mía thường có mùi của rượu etylic.
2. Nêu hiện tượng và viết phương trình hoá học xảy khi tiến hành các thí nghiệm sau:
a) Cho dung dịch BaCl2 vào dung dịch NaHCO3 sau đó đun nóng.
b) Nhỏ vài giọt dung dịch AgNO3 vào ống nghiệm đựng 1 ml dung dịch amoniac, lắc nhẹ. Thêm tiếp 2 ml dung dịch glucozơ, sau đó đặt ống nghiệm vào cốc nước nóng.
3. Một mẫu quặng Bôxit chứa Al2O3 có lẫn Fe2O3 và SiO2. Em hãy trình bày cách làm để thu được Al tinh khiết. Viết các phương trình hoá học xảy ra, ghi rõ điều kiện phản ứng nếu có.
4. Viết các công thức cấu tạo dạng thu gọn có thể có của các hợp chất hữu cơ mạch hở, trong phân tử chỉ chứa liên kết đơn sau:
a) C3H8O
b) C4 H9Cl
Giải
1)
a) Khi nấu canh cua thấy nổi lên các mảng gạch cua là do hiện tượng động tụ Protein (thịt cua là protein)
b) Khi để ngọn mía lâu ngày trong không khí, ở đầu đoạn mía thường có mùi rượu etylic vì đoạn đầu cây mía tiếp xúc trực tiếp với không khí, trong không khí có thể có một số vi khuẩn giúp phân hủy dần
saccarozơ thành glucozơ, sau đó lên men glucozơ thành rượu etylic.
Do vậy lâu ngày đoạn đầu mía thường có mùi chua của rượu etylic.
C12H22O11 + H2Okk→C6H12O6 + C6H12O6 Glucozơ fructozơ
C6H12O6 2C2H5OH+2CO2
glucozơ
2)
a) Cho dung dịch BaCl2 vào dung dịch NaHCO3 sau đó đun nóng. Xuất hiện kết tủa và sủi bọt khí
BaCl2 + 2NaHCO3 2NaCl + BaCO3 + CO2 ↑+ H2O
b) Khi thêm NH3, xuất hiện kết tủa trắng đục, sau đó kết tủa tan khi NH3 dư, tạo dung dịch trong suốt.
Nhỏ glucozo và đưa ống nghiệm vào cốc nước nóng, sau 1 thời gian, xuất hiện lớp kim loại trắng bạc bám
trên bề mặt ống nghiệm (Ag).
PTHH:
CH2OH(CHOH)4CHO+2AgNO3+3NH3+H2O 0 → CH2OH(CHOH)4COONH4+2Ag↓+2NH4NO3

Hay: C6H12O6 + Ag2O 0 3 NH,t → C6H12O7 + 2Ag
Nghiền nhỏ quặng và sau đó cho vào dung dịch NaOH loãng dư
- Lọc bỏ rắn không tan gồm có: Fe2O3 và SiO2
- Tan chỉ có Al2O3
Al2O3 + 2NaOH loãng dư → 2NaAlO2 + H2O
+ Sục lượng dư khí CO2 vào dung dịch thu được
NaAlO2 + CO2 + 2H2O→Al(OH)3↓ + NaHCO3
+ Lọc và tách lấy kết tủa, sau đó đem nung ngoài không khí
2Al(OH)3 0t → Al2O3 + 3H2O
+ Lấy rắn thu được đem điện phân nóng chảy => thu được Al.
2Al2O3 ®iÖn ph©n nãng ch¶y → 4Al +3 O2 4)
* Công thức cấu tạo của C3H8O
CH3-CH2-CH2-OH Propan–1–ol
CH3-CH(OH)-CH3 Propan–2–ol
C2H5-O-CH3 Etylmetyl ete
* Công thức cấu tạo của C4H9Cl
CH3– CH2– CH2– CH2Cl: 1 – clobutan
CH3– CH2– CHCl – CH3: 2 – clobutan
Câu 3: (3,0 điểm)
1. Cho a gam K tác dụng với 100 ml dung dịch H2SO4 0,1M, sau khi phản ứng kết thúc thu
được dung dịch X và 0,56 lít (ở đktc) khí H2. Cô cạn dung dịch X thu được m gam chất rắn khan.
Tìm giá trị của a và m.
2. Đốt cháy hoàn toàn một chất hữu cơ A chứa C, H, O, N (MA < 78) thu được CO2, H2O và N2. Biết rằng số mol H2O bằng 1,75 lần số mol CO2, tổng số mol CO2 và H2O bằng 2 lần số mol O2 tham gia phản ứng. Xác định công thức phân tử của A.
3. Cho X và Y là các dung dịch HCl có nồng độ mol/lít khác nhau. Lấy V1 lít X trộn với V2 lít Y thu được 0,2 lít dung dịch Z.
a) Tính nồng độ mol/lít của dung dịch Z biết rằng V1 lít X phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa, V2 lít Y phản ứng vừa đủ với 20 gam dung dịch NaOH 4%.
b) Tính nồng độ mol/lít của dung dịch X và Y, biết rằng lượng H2 thu được khi cho 0,1 lít X phản ứng hết với Fe ít hơn lượng H2 thu được khi cho 0,1 lít Y phản ứng hết với Fe là 224 ml (ở đktc).
Giải
1) 242 HSOH n0,01mol;n0,025mol ==
2K + H2SO4 → K2SO4 + H2 0,02 0,01 0,01 0,01 2K + 2H2O → 2KOH + H2 0,03 0,03 0,015 mol
Dung dịch cô cạn có: KOH 0,03 mol; K2SO4: 0,01 mol
→ a = 0,05.39 = 1,95 gam
→ m = 0,03.56 + 174.0,01= 3,42 gam.
2) Gọi công thức của A là CxHyOzNt
CxHyOzNt + yz x 42
Theo bài ra ta có:
a xa y 2 a z 2 a
22 HOCOn1,75n = y 2 a =1,75.ax → 2y=7x
222 HOCOO nn2.n += xa + y 2 a = yz x 42 +− 2a → z= x
Thay vào A ta có x7xxt 2 CHON → MA = 33,5x + 14t < 78
Nghiệm hợp lý là: x =2 =; t=1→ C2H7O2N
3)
Gọi V1 lít X có HCl a mol/l + V2 lít Y có HCl b mol/l→ 0,2 lít Z: HCl
Có V1 + V2 = 0,1 (lít)
- V1 lít X có HCl a mol/l có: nHCl = a.V1 (mol)
- V2 lít Y có HCl b mol/l có: nHCl = b.V2 (mol)
→ 0,2 lít Z: HCl có nHCl = 0,1V1 + 0,1V2
a)
* V lít X phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa. n↓= 0,03 (mol)
HCl + AgNO3 → AgCl + HNO3 0,03 0,03 (mol)
Có: a.V1 = 0,03 (V1= 0,03 a )
* V2 lít Y phản ứng vừa đủ với 20 gam dung dịch NaOH 4% →mNaOH = 0,8 mol
HCl + NaOH→NaCl + H2O 0,8 0,8 (mol)
HCln = 0,8 mol = V2.b (V2= 0,8 b )→ nHCl = 0,1V1 + 0,1V2 = 0,03 + 0,8 = 0,83 (mol)
Z M n C V == 4,15 M
b)
Gọi a,b là nồng độ của 2 dung dịch. Số mol HCl có trong 100ml mỗi dung dung dịch là:
n(HCl X) = 0,1a mol và n(HCl Y) = 0,1b mol
Fe + 2HCl→FeCl2 + H2
0,1a 0,05a
Fe + 2HCl→FeCl2 + H2
0,1b 0,05b
Lượng H2 thoát ra từ 2 dung dịch chênh nhau 0,224 lít:
0,05a 0,05b = ± 0,01→ a b = ± 0,2
Thể tích dung dịch Z: V(Z) = V1+V2 = 0,03 a + 0,8 b =0,2 lít→ 0,8a + 0,03b = 0,2a.b
* TH1:a = b + 0,2
→0,8a + 0,03b = 0,2a.b → 0,2b2 – 0,79b -0,16 = 0
→b=4,14 (nhận) và b = -0,19(loại)→ a=4,34(M)
* TH2: b = a + 0,2
→0,8a + 0,03b = 0,2a.b → 0,2b2 – 0,79b -0,006 = 0
⇒a=3,96 hoặc a = -7,58 (loại) ⇒b = 4,16(M)
Vậy nồng độ mol của 2dung dich X,Y lần lượt là 4,34M và 0,414M hoặc 3,96M và 4,16M Câu 4: (2,5 điểm)
1. Cho 37,95 gam hỗn hợp bột X gồm BaCO3 và RCO3 (R có hoá trị không đổi) vào cốc chứa m gam dung dịch H2SO4 loãng nồng độ 9,8%. Khuấy đều hỗn hợp cho đến khi phản ứng kết thúc thì thu được dung dịch Y, chất rắn Z và 2,8 lít (ở đktc) khí CO2. Cô cạn dung dịch Y thu được 6,0 gam muối khan, còn nung chất rắn Z đến khối lượng không đổi thu được 30,95 gam chất rắn T và khí CO2.
a) Tìm m và khối lượng chất rắn Z.
b) Xác định kim loại R, biết trong X số mol của BaCO3 gấp 1,5 lần số mol RCO3.
2. Hỗn hợp A gồm CH4, C2H4, C3H4 (CH=C−CH3). Khi cho 6,4 gam hỗn hợp A vào bình
đựng dung dịch Br2 (dư) thì có tối đa 0,2 mol Br2 tham gia phản ứng. Mặc khác, đốt cháy hoàn toàn 0,5 mol hỗn hợp A cần dùng vừa đủ V lít (ở đktc) khí O2 sau phản ứng thu được nước và m gam
CO2. Tìm giá trị của m và V.
Giải
1) do chất rắn Z đến khối lượng không đổi thu được 30,95 gam chất rắn T và khí CO2. Nên trong Z chứa BaCO3 nên H2SO4 hết.
Gọi số mol của BaCO3 là a mol và RCO3 là b mol; số mol của các chất trong Z lần lượt là BaCO3 x mol,
RCO3 y mol
Ta có:
37,95 g X BaCO3 amol
RCO3 bmol + H2SO4 9,8%→
BaCO3 xmol
BaSO4 (a x)mol
RCO3 ymol
0,125 mol CO2 0,125 mol H2O
- Bảo toàn C ta có: + + = +
0 →
60 g Y: RSO4 (b-y) mol Z
30,95 g T BaO BaSO4 RO
CO2 (a + b -0,125) mol
hay a+b=x + y +0,125 → a+b-(x + y)=0,125 (1)
+ = (a+b-0,125) mol
toàn S ta có = + hay =b-y+a-x (2)
- Từ (1) và (2) ta có = 0,125 (mol)
a) = 98.0,125 = 12,25 g
m = .100 = = 125 g
b) Theo bài X số mol của BaCO3 gấp 1,5 lần số mol RCO3 nên ta có: a =1,5b (3)
- Bảo toàn H có = = 0,125 (mol)→ = 0,125.18 = 2,25 g
- Bảo Toàn khối lượng có: mx + = mY + mT + + +
Hay: 37,95 + 12,25 = 6 + 30,95 + 2COm + 0,125.44 + 2,25
→ = 5,5 g→ 2COn = 0,125 = a+b-0,125→ a+b=0,25 (4)
- Giải Từ (3) và (4) có a = 0,15; b=0,1
- theo bài mx= 197a+(R+60)b=37,95→ R= 24 là Mg
2) gọi số mol của CH4, C2H4, C3H4 lần lượt là x, y, z mol
-Theo bài: 6,4 gan A x 4 24 34
SỞ GIÁO DỤC VÀ ĐÀO TẠO
TỈNH ĐỒNG NAI KỲ THI TUYỂN SINH VÀO
ĐỀ CHÍNH THỨC
NĂM HỌC 2022 - 2023
LỚP
MÔN THI: HÓA HỌC (Chuyên)
Thời gian làm bài: 150 phút (không kể thời gian phát đề) (Đề thi có 03 trang, gồm 05 câu)
Cho biết nguyên tử khối của các nguyên tố: Ca = 40; Fe = 56; Na = 23; Cl = 35,5; Mg = 24; Cu = 64; Zn = 65; H = 1; C = 12; O = 16.

(Thí sinh không được sử dụng bảng hệ thống tuần hoàn các nguyên tố Hóa học)
Câu 1 (1,75 điểm)
1.1. Cố định cacbon là một công nghệ
mấu chốt cho vấn đề giảm thiểu lượng khí thải
nhà kính. Một trong những công nghệ cố định cacbon tiềm năng chính là vòng lặp Canxi.
Công nghệ này giữ cacbon thông qua chu trình giữa canxi cacbonat và canxi oxit. Canxi
cacbonat được sử dụng trong chu trình này
thường bắt nguồn từ đá vôi. Cacbon đioxit sau
đó có thể được lưu trữ dưới lòng đất hoặc sử
+ 0,2 mol Br2→ mA = 16x+ 28y + 40z=6,4 gam
CHmol CHymol CHzmol
→ 2Brn = y + 2z = 0,2 mol
- Khi đốt cháy số mol của các chất trong A: CH4, C2H4, C3H4 lần lượt là ax, ay, az mol
CHmol CHaymol CHzmol
4 24 34
+ Bảo toàn C có
+ Bảo toàn H có
+ H2O
dụng, chẳng hạn như trong quy trình sản xuất nhiên liệu tổng hợp. Trong vòng lặp Canxi, cacbon đioxit được cố định từ khí thải. Xem sơ đồ chu trình ở hình 1.
a. Viết phương trình phản ứng chính trong buồng Cacbonat hóa và lò nung vôi.
b. Lưu huỳnh đioxit là một trong những chất có trong khí thải từ quá trình đốt cháy nhiên liệu chứa tạp chất hiđrosunfua. Trong buồng Cacbonat hóa xảy ra phản ứng của lưu huỳnh đioxit với canxi cacbonat và khí oxi tạo ra chất rắn X. Lượng chất rắn X tích lũy tăng dần theo thời gian và làm giảm hiệu suất của toàn bộ quá trình cố định cacbon.
- Viết phương trình phản ứng tạo thành
lưu huỳnh đioxit từ phản ứng đốt cháy hiđrosunfua.
- Viết phương trình phản ứng tạo thành chất rắn X trong buồng Cacbonat hóa.
2COn = ax + 2ay + 3az = (ax+ay+az) + (ay+2az) = 0,5 + a.0,2 (mol)
2 HOn = 4ax + 4ay + 4az = 4.0,5=2 mol→ 2 HOm = 2.18=36 g

+ Bảo toàn O có 2. 2On =2. 2COn + 2 HOn = (1,5 +0,2a) mol
+ Bảo toàn khối lượng có: mA + 2Om = 2COm + 2 HOm hay 6,4a + 32(1,5+0,2a)=44(0,5+0,2a)+36
→a = 2,5
→ 2COn = 0,5 + a.0,2 = 1 mol→ = 44 gam→
2On =(1,5 +0,2a)= 2 mol→ V= 2.22,4=44,8 lít
Hết
c. Cố định cacbon từ không khí là một quá trình bắt cacbon đioxit trong không khí. Tuy nhiên quá trình này lại khá đắt đỏ và tốn kém. Xem sơ đồ chu trình ở hình 2.
- Viết phương trình phản ứng trong buồng tiếp xúc không khí, buồng tạo hạt và buồng tôi.
1.2. Nấm men là chất xúc tác cho phản ứng lên men rượu etylic trong điều kiện không có khí oxi. Quá trình lên men là một quá trình tỏa nhiệt.
a. Viết phương trình lên men rượu etylic từ đường glucozơ.
b. Liệt kê các sản phẩm có thể tạo thành (trừ rượu etylic) nếu quá trình lên men trên được thực hiện trong điều kiện có mặt khí oxi.
c. Từ 250 gam glucozơ, thực hiện quá trình lên men rượu trong phòng thí nghiệm. Kết quả nghiên
cứu nhận thấy:
• Tốc độ phản ứng tăng lên và dung dịch trở
nên đặc và ấm hơn.
• Sau một thời gian từ ngày thứ 10 phản ứng hầu như dừng lại dù trong dung dịch vẫn còn glucozơ
- Giải thích các hiện tượng thí nghiệm trên và tính hiệu suất quá trình lên men tại ngày thứ 10.
Câu 2 (1,75 điểm)
Một mẫu giấm có nồng độ axit axetic khoảng 5%, để xác định nồng độ chính xác cần tiến hành các bước thí nghiệm:
Bước 1: Pha loãng 10,00 mL mẫu giấm trên bằng nước cất, thu được 100,00 mL dung dịch X
Bước 2: Lấy 10,00 mL dung dịch X cho vào bình tam giác (dung dịch 100 mL) và thêm từ từ dung dịch NaOH đã biết trước nồng độ (đựng trong buret dung dịch 25 mL) đến khi phản ứng vừa hết với lượng axit axetic thì ghi thể tích dung dịch NaOH đã dùng.

a. Viết phương trình phản ứng xảy ra ở bước 2.
b. Trong phòng thí nghiệm có các dung dịch NaOH với nồng độ như
sau: NaOH 0,10M; NaOH 0,02M. Để thực hiện thí nghiệm trên, dung dịch NaOH 0,10M được lựa chọn. Chỉ ra lí do cho sự lựa chọn
c. Thí nghiệm trên được lặp lại 3 lần và thể tích dung dịch NaOH 0,10M được ghi trong bảng sau:
Lần 1 Lần 2 Lần 3
VNaOH (mL) 8,50 8,45 8,55
Tính nồng độ phần trăm của dung dịch axit axetic trong mẫu giấm trên.
Biết khối lượng riêng của mẫu giấm đo được là D = 1,05 g/mL.
Câu 3 (2,0 điểm)
3.1. Hòa tan hết 24,00 gam CaCO3 (thành phần chính của đá vôi) bằng một lượng vừa đủ dung dịch HCl thu
được dung dịch Y. Thêm tiếp vào dung dịch Y lượng dư dung dịch Na2CO3 để kết tủa toàn bộ muối canxi trong Y thành 35,04 gam Y1 có công thức CaC2O4 .nH2O.
a. Viết các phương trình phản ứng xảy ra trong quy trình trên.
b. Xác định giá trị n.
3.2. Để xác định độ tinh khiết của một mẫu chất người ta thường dùng phương pháp phân tích nhiệt.
Khi một chất rắn có khối lượng m1 bị đun nóng, thu
được một chất rắn mới có khối lượng m2 và chất
khí hoặc hơi.
Đồ thị phân tích nhiệt cho biết sự biến đổi
khối lượng của chất rắn theo nhiệt độ, trục tung
biểu thị phần trăm khối lượng của chất rắn còn lại
so với khối lượng ban đầu (%m = 2 1
hoành biểu thị nhiệt độ nung.
m m .100%), trục
Đồ thị phân tích nhiệt (hình bên) của quá trình nhiệt phân một lượng kết tủa Y1 trong môi trường trơ cho thấy ba giai đoạn phản ứng có kèm thay đổi khối lượng các chất rắn:
(1) Y1 0 → Y2 + Y3
(2) Y2 0 → Y4 + Y5
(3) Y4 0t → Y6 + Y7
Biết Y2, Y4 và Y6 là chất rắn, Y3, Y5 và Y7 là chất khí hoặc hơi và tỉ lệ mol các chất đều là 1: 1: 1. Dựa vào
đồ thị phân tích nhiệt, xác định công thức phân tử của các chất Y2, Y3, Y4, Y5, Y6 và Y7.
3.3. Để xác định hàm lượng canxi cacbonat trong một mẫu đá vôi (giả thiết chỉ chứa CaCO3 và tạp chất trơ), người ta tiến hành theo quy trình sau: Lấy 0,566 gam đá vôi tiến hành một chuỗi các phản ứng như câu
3.1. để thu được kết tủa Y1. Tiếp theo nung Y1 ở 2000C đến khối lượng không đổi, thu được 0,672 gam chất rắn Y2 duy nhất. Xác định phần trăm khối lượng CaCO3 có trong mẫu đá vôi trên.
Câu 4 (2,25 điểm)
Hiđrocacbon Z ở thể khí. Đốt cháy hoàn toàn V (lít) Z trong khí oxi dư thu được 4V (lít) khí cacbonic và 5V (lít) hơi nước. Biết các khí và hơi đều đo cùng một điều kiện nhiệt độ và áp suất.
a. Tìm công thức phân tử của Z
b. Viết công thức cấu tạo có thể có của Z
c. Bậc của nguyên tử cacbon trong phân tử Z được tính bằng tổng số liên kết của nó với các nguyên tử cacbon khác. Xác định công thức cấu tạo đúng của Z, biết trong Z có 2 loại nguyên tử C khác bậc nhau với tỉ lệ là 1:1.
d. Tiến hành dẫn khí Z và khí Cl2 vào ống nghiệm rồi đun nóng để xảy ra phản ứng thế clo (tương tự phản
ứng của metan với khí clo: CH4 + Cl2 → CH3Cl + HCl). Biết tỉ lệ mol phản ứng của Z và Cl2 là 1:1. Viết phương trình phản ứng xảy ra và cho biết phản ứng trên thu được tối đa bao nhiêu dẫn xuất hiđrocacbon chứa một nguyên tử clo.
e. Về mặt lí thuyết người ta thấy rằng “Nguyên tử hiđro liên kết với nguyên tử cacbon bậc cao dễ bị thay thế hơn nguyên tử hiđro liên kết với nguyên tử cacbon bậc thấp”. Từ lí thuyết trên hãy xác định sản phẩm hữu
cơ chủ yếu (sản phẩm chính) ở câu d.
f. Để tính % các sản phẩm thế người ta có thể sử dụng công thức:
% Sản phẩm thế H của C bậc i = ii
r.n .100% r.nr.nr.n ++
IIIIIIIIIIII
Trong đó ri là số lượng nguyên tử H cùng loại gắn với C bậc I và ni là khả năng phản ứng của những H đó. Biết rằng trong phản ứng với clo khả năng phản ứng của nguyên tử H (n ) gắn với cacbon bậc I là 1, cacbon bậc II là 4,3 và cacbon bậc III là 7. Tính % các sản phẩm hữu cơ tạo ra ở câu d và kiểm chứng lại sản phẩm chính ở câu e.
Câu 5 (2,25 điểm)
5.1. Một nguyên tử khi lớp vỏ bị mất (hoặc nhận thêm) một hay nhiều electron thì gọi là ion. Trong nguyên tử kim loại A có tổng ba loại hạt cơ bản (proton, nơtron, electron) là 80. Khi lớp vỏ của A mất đi 3 electron thì tạo thành ion A’. Biết rằng trong ion A’ có số hạt mang điện nhiều hơn số hạt không mang điện là 21. Xác định kim loại A. Cho số hiệu nguyên tử Z (là số proton) của một số nguyên tố: Cu (Z = 29), Ca (Z = 20), Mg (Z = 12), Zn (Z = 30), Cr (Z = 24), Al (Z = 13), Fe (Z = 26).
t0, (1)
(4) (2) (3)
Chân không (7) (8)
Biết Q, B, M đều là các hợp chất của kim loại A. Viết các phương trình phản ứng thực hiện chuỗi chuyển hóa trên.

5.3. Hòa tan hoàn toàn 37,90 gam hỗn hợp X gồm A, Q, A(OH)3, ACO3 (phần trăm khối lượng nguyên tố O trong X là 29,55%) bằng lượng vừa đủ dung dịch HCl 36,86%. Kết thúc phản ứng thu được dung dịch Y chứa một chất tan duy nhất M đồng thời thoát ra 4,60 gam hỗn hợp khí Z, tỉ khối hơi của Z so với khí hiđro là 11,50. Khi làm lạnh dung dịch Y đến 100C thấy tách ra 39,80 gam muối K. Biết độ tan của M ở nhiệt độ 100C là 62,40. Xác định công thức muối K.
--------------------HẾT--------------------
Họ và tên thí sinh: ............................................................. Số báo danh: ........................
Chữ kí của giám thị 1: ...............................................
Cán bộ coi thi không giải thích gì thêm.
SỞ GIÁO DỤC VÀ ĐÀO TẠO
TỈNH ĐỒNG NAI
HD CHÍNH THỨC
Câu 1 (1,75 điểm)
MÔN THI: HÓA HỌC (Chuyên)
Thời gian làm bài: 150 phút (không kể thời gian phát đề)
1.1. Cố định cacbon là một công nghệ mấu chốt cho vấn đề giảm thiểu lượng khí thải nhà kính.
Một trong những công nghệ cố định cacbon tiềm năng
chính là vòng lặp Canxi. Công nghệ này giữ cacbon
thông qua chu trình giữa canxi cacbonat và canxi oxit.
Canxi cacbonat được sử dụng trong chu trình này
thường bắt nguồn từ đá vôi. Cacbon đioxit sau đó có
thể được lưu trữ dưới lòng đất hoặc sử dụng, chẳng

h
ạn như trong quy trình sản xuất nhiên liệu tổng hợp.
Trong vòng lặp Canxi, cacbon đioxit được cố định từ khí thải. Xem sơ đồ chu trình ở hình 1.
a. Viết phương trình phản ứng chính trong buồng Cacbonat hóa và lò nung vôi.
b. Lưu huỳnh đioxit là một trong những chất có trong khí thải từ quá trình đốt cháy nhiên liệu chứa tạp chất hiđrosunfua. Trong buồng Cacbonat hóa xảy ra phản ứng của lưu huỳnh đioxit với canxi cacbonat và khí oxi tạo ra chất rắn X. Lượng chất rắn X tích lũy tăng dần theo thời gian và làm giảm hiệu suất của toàn bộ quá trình cố định cacbon.
- Viết phương trình phản ứng tạo thành lưu huỳnh đioxit từ phản ứng đốt cháy hiđrosunfua.
- Viết phương trình phản ứng tạo thành chất rắn X trong buồng Cacbonat hóa.
c. Cố định cacbon từ không khí là một quá trình bắt cacbon đioxit trong không khí. Tuy nhiên quá trình này lại khá đắt đỏ và
tốn kém. Xem sơ đồ chu trình ở hình 2.
- Viết phương trình phản ứng trong buồng tiếp xúc không khí, buồng tạo hạt và buồng tôi.
1.2. Nấm men là chất xúc tác cho phản ứng lên men rượu etylic trong điều kiện không có khí oxi.
Quá trình lên men là một quá trình tỏa nhiệt.
b. Liệt kê các sản phẩm có thể tạo thành (trừ rượu etylic) nếu quá trình lên men trên được thực hiện
trong điều kiện có mặt khí oxi.
a. Viết phương trình lên men rượu etylic từ đường glucozơ. 2 (mol)
c. Từ 250 gam glucozơ, thực hiện quá trình lên men rượu trong phòng thí nghiệm. Kết quả nghiên
cứu nhận thấy:
• Tốc độ phản ứng tăng lên và dung dịch trở
nên đặc và ấm hơn.
• Sau một thời gian từ ngày thứ 10 phản
ứng hầu như dừng lại dù trong dung dịch vẫn còn
glucozơ.
R−îu etylic (mol)
- Giải thích các hiện tượng thí nghiệm trên và tính hiệu suất quá trình lên men tại ngày thứ 10. Hướng dẫn giải: 1.1.
a. Phương trình phản ứng chính:
- Trong buồng Cacbonat hóa: CaO + CO2 → CaCO3
- Trong lò nung vôi:
0 1000C 32 CaCOCaOCO →+
Phương trình phản ứng:
- Tạo thành lưu huỳnh đioxit từ phản ứng đốt cháy hiđrosunfua: 0 tC 2222 2HS3O2HS2SO +→+
- Tạo thành chất rắn X trong buồng Cacbonat hóa: 0 tC 32242 2CaSO2SOO2CaSO2CO ++→+ cao (X)
c. Phương trình phản ứng:
- Trong buồng tiếp xúc không khí: CO2 + KOH → K2CO3 + H2O
- Trong buồng tạo hạt: K2CO3 + Ca(OH)2 → CaCO3 ↓ + H2O
- Trong buồng tôi: CaO + H2O → Ca(OH)2
1.2.
a. Phương trình lên men rượu etylic từ đường glucozơ: 0 6126252 3035C CHO2CHOH2CO →+ menröôïu
b. Nếu quá trình lên men có mặt khí oxi sản phẩm tạo thành là CO2, H2O, ATP.
c. * Giải thích các hiện tượng thí nghiệm:
- Tốc độ phản ứng tăng lên là vì: men đã tạo ra enzim làm chất xúc tác cho phản ứng.
- Dung dịch trở nên đặc vì khí CO2 đã thoát ra làm giảm khối lượng dung dịch, do vậy nồng độ chất tan tăng lên.
Còn dung dịch ấm hơn vì đặc điểm của phản ứng này là tỏa nhiệt, khi tốc độ tăng thì nhiệt tỏa ra cũng nhiều hơn, làm dung dịch ấm lên.
- Sau một thời gian từ ngày thứ 10 phản ứng hầu như dừng lại dù trong dung dịch vẫn còn glucozơ, đó là do men xúc tác chết dần vì ngộ độc bởi sản phẩm tạo ra của quá trình, ví dụ etanol với nồng độ cao ức chế sinh trưởng của men, đồng thời nhiệt độ tăng cũng làm giảm khả năng hoạt động của nấm men.
* Tính hiệu suất quá trình lên men tại ngày thứ 10:
Từ phương trình lên men rượu etylic từ đường glucozơ: 0 6126252 3035C CHO2CHOH2CO →+ menröôïu
6126 CHO( n1(mol) = phaûnöùng) 180.1 H100%72% 250 =×=
Câu 2 (1,75 điểm)
Một mẫu giấm có nồng độ axit axetic khoảng 5%, để xác định nồng độ chính xác cần tiến hành các bước thí nghiệm:
Bước 1: Pha loãng 10,00 mL mẫu giấm trên bằng nước cất, thu được 100,00 mL dung dịch X.
Bước 2: Lấy 10,00 mL dung dịch X cho vào bình tam giác (dung dịch 100 mL) và thêm từ từ dung dịch NaOH đã biết trước nồng độ (đựng trong buret dung dịch 25 mL) đến khi phản ứng vừa hết với lượng axit axetic thì ghi thể tích dung dịch NaOH đã dùng.
a. Viết phương trình phản ứng xảy ra ở bước 2.
b. Trong phòng thí nghiệm có các dung dịch NaOH với nồng độ như
sau: NaOH 0,10M; NaOH 0,02M. Để thực hiện thí nghiệm trên, dung dịch NaOH 0,10M được lựa chọn. Chỉ ra lí do cho sự lựa chọn đó.
c. Thí nghiệm trên được lặp lại 3 lần và thể tích dung dịch NaOH 0,10M được ghi trong bảng sau:
Lần 1 Lần 2 Lần 3
VNaOH (mL) 8,50 8,45 8,55
Tính nồng độ phần trăm của dung dịch axit axetic trong mẫu giấm trên.
Biết khối lượng riêng của mẫu giấm đo được là D = 1,05 g/mL.
Hướng dẫn giải:
a. Phương trình phản ứng xảy ra ở bước 2: CH3COOH + NaOH → CH3COONa + H2O
b. Trong phòng thí nghiệm để thực hiện thí nghiệm xác định nồng độ chính xác mẫu giấm có nồng độ axit axetic khoảng 5%, người ta chọn dung dịch NaOH 0,10M; vì lí do:
- Ta có nồng độ mol/lít của mẫu giấm là:
CM (mẫu giấm) = 10.D.C%10.1,05.5 0,875M M60 =≈
- Nồng độ của axit axetic trong dung dịch X là:
CM (dung dịch X) = 0,875.10 0,0875M 100 ≈
- Trong 10 ml dung dịch X có số mol CH3COOH là:
4 CHCOOH n10,08750,018,7510(mol) =×=×
3
Như vậy nếu dùng 25 ml dung dịch NaOH 0,02 M thì nNaOH (25 ml) = 0,025 × 0,02 = 5.10-4 (mol)
Ta thấy: 3 NaOH(25ml)CHCOOHX) nn < (10mldungdòch NaOH quá ít để chuẩn độ dung dịch X.
Vì vậy người ta chọn dung dịch NaOH 0,1 M.
c. NaOH(TB) 8,58,458,55 V8,5ml) 3 ++ == (
Từ phương trình hóa học câu a, 3
34 NaOH()CHCOOH nn8,5.100,18,5.10(mol) <=×= phaûn öùng

4 MCHCOOH/dd) 3 8,5.10 C0,085M 10.10 === ( X
3
3 MCHCOOH/) 0,085.100 C0,85M 10 == (maãu
M CHCOOH/) C.M 0,8560 C%4,875% 10.D101,05 × === × (maãu Câu 3 (2,0 điểm)
3
3.1. Hòa tan hết 24,00 gam CaCO3 (thành phần chính của đá vôi) bằng một lượng vừa đủ dung dịch HCl thu
được dung dịch Y. Thêm tiếp vào dung dịch Y lượng dư dung dịch Na2CO3 để kết tủa toàn bộ muối canxi trong Y thành 35,04 gam Y1 có công thức CaC2O4 .nH2O.
a. Viết các phương trình phản ứng xảy ra trong quy trình trên.
b. Xác định giá trị n.
3.2. Để xác định độ tinh khiết của một mẫu chất
người ta thường dùng phương pháp phân tích nhiệt.
Khi một chất rắn có khối lượng m1 bị đun nóng, thu
được một chất rắn mới có khối lượng m2 và chất
khí hoặc hơi.
Đồ thị phân tích nhiệt cho biết sự biến đổi
khối lượng của chất rắn theo nhiệt độ, trục tung
biểu thị phần trăm khối lượng của chất rắn còn lại
so với khối lượng ban đầu (%m = 2 1
hoành biểu thị nhiệt độ nung.
m m .100%), trục
Đồ thị phân tích nhiệt (hình bên) của quá trình nhiệt phân một lượng kết tủa Y1 trong môi trường trơ
cho thấy ba giai đoạn phản ứng có kèm thay đổi khối lượng các chất rắn:
(1) Y1 0 → Y2 + Y3
(2) Y2 0 → Y4 + Y5
(3) Y4 0t → Y6 + Y7
Biết Y2, Y4 và Y6 là chất rắn, Y3, Y5 và Y7 là chất khí hoặc hơi và tỉ lệ mol các chất đều là 1: 1: 1. Dựa vào
đồ thị phân tích nhiệt, xác định công thức phân tử của các chất Y2, Y3, Y4, Y5, Y6 và Y7.
3.3. Để xác định hàm lượng canxi cacbonat trong một mẫu đá vôi (giả thiết chỉ chứa CaCO3 và tạp chất trơ), người ta tiến hành theo quy trình sau: Lấy 0,566 gam đá vôi tiến hành một chuỗi các phản ứng như câu 3.1. để thu được kết tủa Y1. Tiếp theo nung Y1 ở 2000C đến khối lượng không đổi, thu được 0,672 gam
chất rắn Y2 duy nhất. Xác định phần trăm khối lượng CaCO3 có trong mẫu đá vôi trên.
Hướng dẫn giải:
3.1.
a. Các phương trình phản ứng xảy ra trong quy trình trên:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
Dung dịch Y chứa CaCl2
CaCl2 + Na2C2O4 → CaC2O4↓ + 2NaCl (1)
Y1: CaC2O4.nH2O
CaC2O4 + nH2O → CaC2O4.nH2O (2)
b. Xác định giá trị n:
Từ phương trình (1), (2) ta có: 3242 CaCOCaCO.nHO 2435,04 nnn1 10012818n =⇔= = +
Vậy công thức phân tử Y1 là CaC2O4.H2O.
3.2.
- Xét giai đoạn 1 (00C - 2000C): Đây là quá trình làm khan kết tủa:
CaC2O4.H2O 0t → CaC2O4 + H2O↑
b. Viết công thức cấu tạo có thể có của Z
c. Bậc của nguyên tử cacbon trong phân tử Z được tính bằng tổng số liên kết của nó với các nguyên tử
cacbon khác. Xác định công thức cấu tạo đúng của Z, biết trong Z có 2 loại nguyên tử C khác bậc nhau với tỉ lệ là 1:1.
d. Tiến hành dẫn khí Z và khí Cl2 vào ống nghiệm rồi đun nóng để xảy ra phản ứng thế clo (tương tự phản ứng của metan với khí clo: CH4 + Cl2 → CH3Cl + HCl). Biết tỉ lệ mol phản ứng của Z và Cl2 là 1:1. Viết phương trình phản ứng xảy ra và cho biết phản ứng trên thu được tối đa bao nhiêu dẫn xuất hiđrocacbon chứa một nguyên tử clo.
e. Về mặt lí thuyết người ta thấy rằng “Nguyên tử hiđro liên kết với nguyên tử cacbon bậc cao dễ bị thay thế hơn nguyên tử hiđro liên kết với nguyên tử cacbon bậc thấp”. Từ lí thuyết trên hãy xác định sản phẩm hữu
cơ chủ yếu (sản phẩm chính) ở câu d.
f. Để tính % các sản phẩm thế người ta có thể sử dụng công thức:
% Sản phẩm thế H của C bậc i = ii IIIIIIIIIIII
r.n .100% r.nr.nr.n ++
Trong đó ri là số lượng nguyên tử H cùng loại gắn với C bậc I và ni là khả năng phản ứng của những
H đó. Biết rằng trong phản ứng với clo khả năng phản ứng của nguyên tử H (n ) gắn với cacbon bậc I là 1, cacbon bậc II là 4,3 và cacbon bậc III là 7. Tính % các sản phẩm hữu cơ tạo ra ở câu d và kiểm chứng lại sản phẩm chính ở câu e.
Hướng dẫn giải:
a. Tìm công thức phân tử của Z:
Các khí và hơi đều đo cùng một điều kiện nhiệt độ và áp suất nên tỉ lệ thể tích cũng là tỉ lệ số mol
22 ZCOHOZC/ZH/Z n:n:n1:4:5n:n:n1:4:10 = =
→%mrắn còn = 24
m 128 .100%.100%87,7% m146 =≈
CaCO Y
1
Y2: CaC2O4; Y3: H2O - Xét giai đoạn 2 (2000C - 5100C): CaC2O4 0 → CaCO3 + CO↑
Cứ 1 mol Z có 4 mol C và 10 mol H công thức phân tử của Z là C4H10
b. Viết công thức cấu tạo có thể có của Z:
→%mrắn còn = 3 1
m 100 .100%.100%68,5% m146 =≈
CaCO Y
Y4: CaCO3; Y5: CO - Xét giai đoạn 3 (5100C - 7800C):
CaCO3 0 → CaO + CO2↑
→%mrắn còn =
m 56 .100%.100%38,4% m146 =≈
CaO Y
1
Y6: CaO; Y7: CO2
3.3.
CaCO3 0 → CaO + CO2↑
0,672
c. Xác định công thức cấu tạo đúng của Z, biết trong Z có 2 loại nguyên tử C khác bậc nhau với tỉ lệ là 1:1?
- Xét công thức cấu tạo (I):
Số nguyên tử C (I):C (II) = 2:2 = 1:1 (thỏa mãn)
- Xét công thức cấu tạo (II):
Số nguyên tử C (I):C (III) = 3:1 (loại)
Vậy công thức cấu tạo đúng của Z là:
d. Tiến hành dẫn khí Z và khí Cl2 vào ống nghiệm rồi đun nóng để xảy ra phản ứng thế clo:
0 3223232 C 1:12 2 ClHCl(III) CHCHCHCHClCHCHCHCH −−−+−→+
0 3223232 tC 1:13 HCl(IV) CHCHCHCHClCHCHCHClCH → −−−+−+
Vậy phản ứng của Z với khí Cl2 thu được tối đa 2 dẫn xuất monoclo.
24 33 CaCOCaCOCaCO
n0,005376(mol)nm1000,0053760,525(gam) 128 ===
=×=
3CaCO 0,525 %m100%92,76%. 0,566
Câu 4 (2,25 điểm)
Hiđrocacbon Z ở thể khí. Đốt cháy hoàn toàn V (lít) Z trong khí oxi dư thu được 4V (lít) khí
cacbonic và 5V (lít) hơi nước. Biết các khí và hơi đều đo cùng một điều kiện nhiệt độ và áp suất.
a. Tìm công thức phân tử của Z.
e. Xét công thức cấu tạo (III): nguyên tử Cl liên kết với C (I) còn công thức cấu tạo (IV) nguyên tử Cl liên
kết với C (II) (IV) là sản phẩm chính.
f. Để tính % các sản phẩm thế người ta có thể sử dụng công thức:
% Sản phẩm thế H của C bậc i = ii
r.n .100% r.nr.nr.n ++
IIIIIIIIIIII
Trong đó ri là số lượng nguyên tử H cùng loại gắn với C bậc I và ni là khả năng phản ứng của những H đó.
Biết rằng trong phản ứng với clo khả năng phản ứng của nguyên tử H (ni) gắn với cacbon bậc I là 1, cacbon
bậc II là 4,3 và cacbon bậc III là 7. Tính % các sản phẩm hữu cơ tạo ra ở câu d và kiểm chứng lại sản phẩm
chính ở câu e.
• Gọi ki là % sản phẩm thế H của C bậc i.
C4H10 chỉ có 2 loại bậc cacbon là C (I) và C (II)
(A)
(3) 2Fe + 3Cl2 0t → 2FeCl3 (B)
(4) Fe(OH)3 + 3HCl → FeCl3 + H2O
(5) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
3124,307 × = ×+×+×
kI (C4H10) = 31 .100%25,86%
3222 l CHCHCHCH C (III) chiếm 25,86%.
(6) 2FeCl3 + Cl2 → 3FeCl2 (M)
(7) Fe + 2HCl → FeCl2 + H2↑
(8) FeO + 2HCl → FeCl2 + H2O
(9) FeCO3 + 2HCl → FeC2 + CO2↑ + H2O
kII (C4H10) = 24,3 .100%74,14%
3124,307 × = ×+×+×
3 32 C H HCHCHClC (IV) chiếm 74,14%.
• Kiểm chứng câu c:
% (III) < % (IV) (25,86% < 74,14%) (IV) là sản phẩm chính câu e đúng.
Câu 5 (2,25 điểm)
5.1. Một nguyên tử khi lớp vỏ bị mất (hoặc nhận thêm) một hay nhiều electron thì gọi là ion. Trong nguyên tử kim loại A có tổng ba loại hạt cơ bản (proton, nơtron, electron) là 80. Khi lớp vỏ của A mất đi 3 electron thì tạo thành ion A’. Biết rằng trong ion A’ có số hạt mang điện nhiều hơn số hạt không mang điện là 21. Xác định kim loại A. Cho số hiệu nguyên tử Z (là số proton) của một số nguyên tố: Cu (Z = 29), Ca (Z = 20), Mg (Z = 12), Zn (Z = 30), Cr (Z = 24), Al (Z = 13), Fe (Z = 26).
5.2. Cho chuỗi chuyển hóa sau:
5.3.
- Hỗn hợp X gồm: Fe, FeO, Fe(OH)3, FeCO3 có khối lượng 37,90 gam; với phần trăm khối lượng nguyên
tố O trong X là 29,55%
mO = 37,9029,5511,2(gam) 100 × = nO = 11,2 0,7 (mol) 16 =
- Khi cho X tác dụng với dung dịch HCl vừa đủ, thu được dung dịch Y chứa chất tan duy nhất chính là FeCl2
còn hỗn hợp khí Z chính là CO2 và H2.
2 Z/HZZ 4,60 d11,5M23n0,2(mol) 23 =→=→==
Gọi số mol của CO2 và H2 lần lượt là a, b ta có: nZ = a + b = 0,2 (1)
mZ = 44a + 2b = 4,6 (2)
Giải hệ a = b = 0,1 (mol).
Chân không (9)
t0, (1) (5) (4) (2) (3) (6) + HCl
Cách 1: Quy đổi hỗn hợp X thành hỗn hợp gồm: Fe (x mol); O (y mol); H2O (z mol); CO2 (0,1 mol)
Khi đó: mhỗn hợp X = 56x + 16y + 18z + 0,1×44 = 37,90 (1)
(7) (8)
ACO3 Q A B A(OH)3 M
Biết Q, B, M đều là các hợp chất của kim loại A. Viết các phương trình phản ứng thực hiện chuỗi chuyển hóa trên.
5.3. Hòa tan hoàn toàn 37,90 gam hỗn hợp X gồm A, Q, A(OH)3, ACO3 (phần trăm khối lượng nguyên tố O trong X là 29,55%) bằng lượng vừa đủ dung dịch HCl 36,86%. Kết thúc phản ứng thu được dung dịch Y chứa một chất tan duy nhất M đồng thời thoát ra 4,60 gam hỗn hợp khí Z, tỉ khối hơi của Z so với khí hiđro là 11,50. Khi làm lạnh dung dịch Y đến 100C thấy tách ra 39,80 gam muối K. Biết độ tan của M ở nhiệt độ 100C là 62,40. Xác định công thức muối K. Hướng dẫn giải: 5.1.
- Trong nguyên tử kim loại A có tổng ba loại hạt cơ bản (proton, nơtron, electron) là 80:
2Z + N = 80 (1)
- Khi lớp vỏ của A mất đi 3 electron thì tạo thành ion A’ mà A’ có số hạt mang điện nhiều hơn số hạt không mang điện là 21 nên:
(2Z - 3) - N = 21 (2)
Giải hệ (1), và (2) ta có: Z = 26, N = 28 A là Fe.
5.2. Viết các phương trình phản ứng thực hiện chuỗi chuyển hóa:
Chân không t0, (1)
(1) FeCO3 FeO + CO2 (Q)
(2) FeO + CO 0t → Fe + CO2↑
Bảo toàn electron ta có: Fe → Fe2+ + 2e; O + 2e → O-2; 2H+ + 2e → H2 x 2x y 2y 0,2 0,1 (mol)
2H 2n2y0,2xy0,1 ) 2x 2y (2 =+ =+ =+
Khối lượng nguyên tố O trong X là: y + z + 0,1×2 = 0,7 y + z = 0,5 (3)
Giải hệ (1), (2), (3) x = 0,45 (mol); y = 0,35 (mol); z = 0,15 (mol).
* Xác định công thức muối K:
Bảo toàn nguyên tố Fe: 2 FeCl/Fe/X Y nn0,45(mol) == dd
Bảo toàn nguyên tố Cl: 2HClFeCl n2n20,450,9(mol) ==×= mHCl = 0,9×36,5 = 32,85 (gam)
mdung dịch HCl = 32,85100 89,121 (gam) 36,86 × =
Bảo toàn khối lượng: mX + mdung dịch HCl = mdung dịch Y + mkhí
mdung dịch Y = 37,9 + 89,121 - 4,6 = 122,421 (gam)
- Khi cho 122,421 (gam) dung dịch Y (0,45 mol FeCl2, H2O) làm lạnh đến 100C thu được 39,8 gam muối K: FeCl2.nH2O
Dung dịch sau khi làm lạnh là dung dịch bão hòa với:
2FeCl S62,4 C%100%100%38,42%. S10062,4100 =×=×= ++
Bảo toàn khối lượng: 2 FeClddYK mmm122,42139,882,621(gam) =−=−= baõo hoøa dd
2 2FeClFeCl 82,621.38,42 31,743 m122,42139,831,743(gam)n0,25(mol) 100 127 ==−= ==
toàn nguyên tố Fe: 22 Fe(K)FeCl/FeCl/dd Y nnn0,450,250,2(mol) =−=−= baõohoøa dd
MK = 127 + 18n = 39,8 199(gam/mol)n4 0,2 = =
Vậy công thức muối K là FeCl2.4H2O.
Cách 2: Chuyển hỗn hợp X thành hỗn hợp X’ (gồm Fe, H, C, O) tương đương, trong đó:
2CCO nn0,1(mol) == ; nO = 0,7 (mol)
Ta có sơ đồ sau:
37,9 gam X’ (Fe, H, C, O) + dung dịch HCl 36,86% → dung dịch Y (FeCl2 + H2O) + 4,6 gam hỗn hợp Z (CO2, H2)
Đặt số mol của Fe và H trong X là a và b, ta có:
56a + 1b + 0,1.12 + 11,2 = 37,9 56a + b = 25,5 (1)
Áp dụng bảo toàn nguyên tố đối với từng nguyên tố sau:
+ Oxi: ( ) ( ) 22 2 OHOCOHOn =n +2n =0,7 mol n =0,7–2.0,1=0,5 mol
+ Hidro: () () 2 HOHHCl1trong X’ 11 n =.n +.n 22 () ()HCl1HCl1 1b1b0,5=n + n =0,5–2222 ⇔ Mặt khác: () 22H HC n=y=0,1 1 .n 2 =
+ Clo: () () 2 FeClHCl1HCl2 b a 2 =0,5- n +0 1 , n1 1 =n+ 1 2a 2 22 b , ⇔ = + (2)
Từ (1) và (2) ta có: 56a + b = 25,5a = 0,45 2a + b = 1,2b =0,3
2 HClFeCl(dd HCl) 0,936,5100 n =2n =20,45=0,9(mol) m = =89,121(gam)
Bảo toàn khối lượng: mX + m(dd HCl) = m(dd Y) + mZ m(dd Y) = 37,9 + 89,121 – 4,6 = 122,421 (g)

Gọi Y’ là dung dịch bão hòa thu được sau khi làm lạnh dung dịch Y đến 100C để tách ra 39,8 gam tinh thể muối hidrat K (FeCl2.nH2O).
Ta có:
FeCl(K)FeCl(Y') HO(K)HO(Y')
m + m = 0,45.127 = 57,15 m +m =122,421-57,15=65,271
Đối với dung dịch bão hòa Y’ thì:
m57,15 - m
0
Môn thi: HÓA HỌC
Thời gian làm bài: 120 phút
Cho biết nguyên tử khối của các nguyên tố: H = 1; O = 16; C = 12; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; K =39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137.
Câu 1. (2,0 điểm)
1. Cho sơ đồ chuyển hóa sau:
→
→
→ M
Xác
định công thức hóa học của các hợp chất hữu cơ: X, Y, Z, T, R, M.
2. Có hai hợp chất hữu cơ A, B đều chứa các nguyên tố C, H, O và có tỉ kh
- A tác dụng được CaCO3 sinh ra khí không màu, nặng hơn không khí.
Xác định công thức của A, B và viết phương trình hóa học xảy ra.
3. Viết PTHH xảy ra theo sơ đồ phản ứng sau:
Fe + Cl2 (dư) 0 t → A
Fe + HCl → B + C
Cu + A (dung dịch) 0 t → B + D
B + E → F + NaCl
F + O2 + G → H
H 0 t → M + G
Câu 2. (2,0 điểm)
1. Nêu hiện tượng và viết phương trình hóa học trong các trường hợp sau:
a. Cho dung dịch glucozơ vào dung dịch AgNO3/NH3 rồi đun nóng.
b. Cho một mẫu canxi cacbua (thành phần chính của đất đèn) vào nước.
2. Cho các chất: metan, axetilen, etilen được kí hiệu ngẫu nhiên X, Y, Z. Tiến hành thí nghiệm như hình vẽ dưới đây.
FeCl(Y') FeCl(K) 10C FeCl
2 2
m65,271 - (39,8 - m) ⇔
x100 = Sx100 = 62,4
2
HO(Y') FeCl(K)
2 2
Giải ra được 2 FeCl(K)n = 25,4 (g)
Từ đó suy ra:
V
==
Xác định X, Y, Z. Viết phương trình hóa học của X với dung dịch AgNO3/NH3.
3. Cho A, B, R, T là những hợp chất vô cơ. Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho a mol dung dịch A tác dụng vừa đủ với dung dịch B, thu được x gam kết tủa trắng, khí không màu và dung dịch K2SO4.
- Thí nghiệm 2: Cho a mol dung dịch A tác dụng với lượng dư dung dịch R, thu được y gam kết tủa trắng.
- Thí nghiệm 3: Cho a mol dung dịch A tác dụng vừa đủ với a mol dung dịch NaOH, thu được z gam kết tủa trắng và dung dịch T. Hợp chất T kém bền với nhiệt, có ứng dụng trong y học làm thuốc chữa đau dạ dày.
Biết x + z – y = 133a gam. Xác định công thức hóa học của A, B, R, T. Câu 3. (2,0 điểm)
1. Tại sao khi đốt kim loại Al, Zn,…thì khối lượng tăng lên, còn khi đốt bông, vải sợi thì khối lượng lại giảm.
2. Khi nấu nước giếng ở một số vùng thường có lớp cặn ở dưới đáy ấm. Cho biết thành phần chính của lớp cặn và cách làm sạch lớp cặn ở đáy ấm.
Giấm ăn là loại gia vị phổ biến trong các hộ gia đình, dùng tạo độ chua, khử mùi tanh của cá,…Tiến hành lên men giấm 1380 ml rượu etylic 80. Xác định nồng độ phần trăm của axit axetic trong dung dịch giấm ăn. Biết hiệu suất quá trình lên men đạt 32%, khối lượng riêng của rượu etylic
là 0,8 g/ml, của nước bằng 1 g/ml.
Câu 4. (2,0 điểm)
1. Hỗn hợp X gồm Na, Ba và Al. Cho 3,45 gam X vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 1,792 lít khí H2 (đo ở đktc). Mặt khác, hòa tan 0,18 mol X bằng dung dịch NaOH dư, thu được 4,928 lít khí H2 (đo ở đktc).
a. Viết phương trình hóa học xảy ra.
b. Tính thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp X.
2. Đốt cháy hoàn toàn x mol hỗn hợp E gồm: CH4, C2H2, C2H4, C3H6 thu được 19,04 lit CO2 (đo ở đktc) và 13,5gam H2O. Mặt khác, x mol E phản ứng tối đa với 0,55 mol dung dịch Br2. Tính giá trị của x.
Câu 5. (2,0 điểm)
1. Cho m gam Fe vào dung dịch Cu(NO3)2 đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X gồm hai kim loại. Cho toàn bộ X vào 0,95 mol H2SO4 đặc, nóng dư thu được dung dịch Y và 0,45 mol SO2. Cho toàn bộ dung dịch Y tác dụng với dung dịch Ba(OH)2 dư thu được kết tủa Z. Nung toàn bộ Z đến khối lượng không đổi thu được 144,5 gam rắn T. Tính giá trị m.
2. Đốt cháy hoàn toàn 18,9 gam hỗn hợp gồm một axit cacboxylic R (CnH2n+1COOH) và một ancol (rượu) T (CmH2m+1OH) thu được 15,68 lít khí CO2 (đo ở đktc) và 15,3 gam H2O.
a. Xác định công thức của R và T
b. Thực hiện phản ứng este hóa giữa R và T thu được hỗn hợp Q. Cho toàn bộ Q tác dụng với Na dư thu được 2,8 lít khí H2 (đo ở đktc). Tính hiệu suất phản ứng este hóa. ……….Hết……………………………
SỞ GIÁO DỤC VÀ ĐÀO TẠO
HDC
KỲ THI TUYỂN SINH VÀO
NĂM HỌC 2022 – 2023
HỌC
Câu 1. (2,0 điểm)
bột 2 0 HO axitt + → X − men rîu → Y men giÊm → Z NaOH + → T 0 NaOHCaO + → R 2 ¸¸ Cl nhsng →M Xác đị
nh
thức hóa h
- A tác dụng được CaCO3 sinh ra khí không màu, nặng hơn không khí.
- B tác dụng với Na nhưng không tác dụng với dung dịch NaOH.
Xác định công thức của A, B và viết phương trình hóa học xảy ra.
3. Viết PTHH xảy ra theo sơ đồ phản ứng sau:
Fe + Cl2 (dư) 0 t → A
Fe + HCl → B + C
Cu + A (dung dịch) 0 t → B + D
B + E → F + NaCl
F + O2 + G → H
H 0 t → M + G
GIẢI
ỉ kh
1. Các chất hữu cơ là: X là C6H12O6, Y là C2H5OH, Z là CH3COOH, T là CH3COONa,
R là CH4, M là CH3Cl.
PTHH:
(C6H10O5)n + nH2O 0 axitt → nC6H12O6
C6H12O6 00 ª 3032 lnmen → C2H5OH + CO2
C2H5OH + O2 men giÊm
→ CH3COOH + H2O
CH3COOH + NaOH →CH3COONa + H2O
CH3COONa + NaOH 0 , CaOt → CH4 + Na2CO3
CH4 + Cl2 ¸ ¸ nh sng → CH3Cl + HCl
2. Ta có: MA = MB = 23.2 = 46 (g/mol)
A tác dụng được CaCO3 sinh ra khí không màu, nặng hơn không khí nên A phải chứa nhóm –COOH A là HCOOH.
B tác dụng với Na nhưng không tác dụng với dung dịch NaOH nên B phải chứa nhóm – OH B là
C2H5OH
PTHH:
2HCOOH + CaCO3 → (HCOO)2Ca + CO2↑ + H2O
2C2H5OH + 2Na →2C2H5ONa + H2↑
3. PTHH xảy ra:
2Fe + 3Cl2 dư 0 → 2FeCl3
Fe + 2HCl → FeCl2 + H2↑
Cu + 2FeCl3 0 → CuCl2 + 2FeCl2
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
2Fe(OH)3 0 t → Fe2O3 + 3H2O
Câu 2. (2,0 điểm)
1. Nêu hiện tượng và viết phương trình hóa học trong các trường hợp sau:
a. Cho dung dịch glucozơ vào dung dịch AgNO3/NH3 rồi đun nóng.
b. Cho một mẫu canxi cacbua (thành phần chính của đất đèn) vào nước.
2. Cho các chất: metan, axetilen, etilen được kí hiệu ngẫu nhiên X, Y, Z. Tiến hành thí nghiệm như hình vẽ dưới đây.
3. Giấm ăn là loại gia vị phổ biến trong các hộ gia đình, dùng tạo độ chua, khử mùi tanh của cá,…Tiến hành lên men giấm 1380 ml rượu etylic 80. Xác định nồng độ phần trăm của axit axetic trong dung dịch giấm ăn. Biết hiệu suất quá trình lên men đạt 32%, khối lượng riêng của rượu etylic
là 0,8 g/ml, của nước bằng 1 g/ml.
GIẢI
1. Khi đốt kim loại Al, Zn,…thì khối lượng tăng lên vì khi đốt Al hoặc Zn thì xảy ra phương trình
hóa học sau:
4Al + 3O2 0 t → 2Al2O3
Áp dụng định luật bảo toàn khối lượng ta có:
msản phẩm = m kim loạ + m oxi m sản phẩm > m kim loại
Khi đốt bông, vải sợi thì khối lượng lại giảm vì khi đốt bông (vải sợi) thì xảy ra phương trình hóa học sau.
Xác định X, Y, Z. Viết phương trình hóa học của X với dung dịch AgNO3/NH3.
3. Cho A, B, R, T là những hợp chất vô cơ. Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho a mol dung dịch A tác dụng vừa đủ với dung dịch B, thu được x gam kết tủa trắng, khí không màu và dung dịch K2SO4.
- Thí nghiệm 2: Cho a mol dung dịch A tác dụng với lượng dư dung dịch R, thu được y gam kết tủa trắng.
- Thí nghiệm 3: Cho a mol dung dịch A tác dụng vừa đủ với a mol dung dịch NaOH, thu được z gam kết tủa trắng và dung dịch T. Hợp chất T kém bền với nhiệt, có ứng dụng trong y học làm thuốc chữa đau dạ dày.
Biết x + z – y = 133a gam. Xác định công thức hóa học của A, B, R, T.
GIẢI
1. Nêu hiện tượng và viết phương trình hóa học trong các trường hợp sau
a. Xuất hiện kết tủa màu sáng bạc.
PTHH:
C6H12O6 + Ag2O 33 / AgNONH
C6H12O7 + 2Ag↓
b. Có khí không màu, không mùi thoát ra.
PTHH:
CaC2 + 2H2O → Ca(OH)2 + C2H2↑
2. X là axetilen; Y là etilen; Z là metan
PTHH:
C2H2 + Ag2O 33 / AgNONH → C2Ag2↓ + H2O
3.
TN2:
2O a a a
m kết tủa = y = 197a + 100a (gam)
TN3: Ba(HCO3)2 + NaOH → BaCO3↓ + NaHCO3 + 2H2O a a a
m kết tủa = z = 197a (gam)

Ta có: x + z – y = 233a + 197a – 197a – 100a =133a (thỏa mãn)
Vậy: A là Ba(HCO3)2; B là KHSO4; R là Ca(OH)2; T là NaHCO3.
Câu 3. (2,0 điểm)
1. Tại sao khi đốt kim loại Al, Zn,…thì khối lượng tăng lên, còn khi đốt bông, vải sợi thì khối
lượng lại giảm.
2. Khi nấu nước giếng ở một số vùng thường có lớp cặn ở dưới đáy ấm. Cho biết thành phần chính của lớp cặn và cách làm sạch lớp cặn ở đáy ấm.
(C6H10O5)n + 6nO2 0 → 6nCO2 + 5nH2O (1)
Theo (1) ta có:
2222 COOCOO nnmm = >
Khí CO2 tạo ra bay ra ngoài không khí mà lượng khí CO2 lại lớn hơn lượng oxi tham gia phản ứng.
Nên khối lượng khi đốt bông, vải sợi sẽ giảm.
2. Thành phần chính của lớp cặn là: CaCO3, MgCO3.
Cách làm sạch: cho giấm ăn vào ấm và đun lên
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2↑ + H2O
2CH3COOH + MgCO3 → (CH3COO)2Mg + CO2↑ + H2O
3. Ta có:
1380.8 110,4()1380110,41269,6() 100 rîu níc VmlVml == =−=
− −
m rượu = 110,4 . 0,8 = 88,32 (g)
− 88,32 1,92() 46 rîu nmol ==
Phương trình hóa học:
C2H5OH + O2 men giÊm
→ CH3COOH + H2O
1,92 1,92 1,92 (mol)
Vì hiệu suất phản ứng đạt 32%. Nên ta có
n axit thu được = 1,92. 32% = 0,6144 (mol) m axit thu được = 0,6144 . 60 = 36,864 (g)
n oxi phản ứng = 1,92. 32% = 0,6144 (mol) m oxi = 0,6144 . 32 = 19,6608 (g)
Áp dụng định luật bảo toàn khối lượng ta có:
m dung dịch sau phản ứng = 88,32 + 1269,6 + 19,6608 = 1377,5808 (g)
36,864
%.100%2,68% 1377,5808 CHCOOH C ==
3
Câu 4. (2,0 điểm)
1. Hỗn hợp X gồm Na, Ba và Al. Cho 3,45 gam X vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 1,792 lít khí H2 (đo ở đktc). Mặt khác, hòa tan 0,18 mol X bằng dung dịch NaOH dư, thu được 4,928 lít khí H2 (đo ở đktc).
a. Viết phương trình hóa học xảy ra.
b. Tính thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp X.
2. Đốt cháy hoàn toàn x mol hỗn hợp E gồm: CH4, C2H2, C2H4, C3H6 thu được 19,04 lít CO2 (đo ở đktc) và 13,5gam H2O. Mặt khác, x mol E phản ứng tối đa với 0,55 mol dung dịch Br2. Tính giá trị của x.
a. Phương trình hóa học
2Na + 2H2O → 2NaOH + H2↑ (1)
Ba + 2H2O → Ba(OH)2 + H2↑ (2)
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ (3)
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑ (4)
b. Gọi số mol của Na, Ba, Al trong 3,45 gam X lần lượt là: x, y, z (mol)
số mol của Na, Ba, Al trong 0,18 mol X lần lượt là: kx, ky, kz (mol)
Theo đề ra ta có hệ phương trình:
23137273,45 ()0,18 xyz kxyz ++= ++= (*) 2 1 1,792 0,08() 22,4 HTN nmol == ; 2 2 4,928 0,22() 22,4 HTN nmol ==
- Xét thí nghiệm 2:
Theo (1): 2
1 0,5() 2 HNa nnkxmol ==
Theo (2): 2 () HBa nnkymol ==
Theo (3) và (4) ta có: 2
3 1,5() 2 HAl nnkzmol ==
Ta có: (0,5x + y + 1,5z)k = 0,22 (**)
- Xét thí nghiệm 1: + Nếu Al phản ứng hết: (z < x + 0,5y)
Theo (1): 2
1 0,5() 2 HNa nnxmol ==
Theo (2): 2 () HBa nnymol ==
Theo (3) và (4) ta có: 2
3 1,5() 2 HAl nnzmol ==
Ta có: 0,5x + y + 1,5z = 0,08 (***)
Kết hợp (*) (**) (***) ta có hệ phương trình sau:
Ta có: 0,06 > 0,02 + 0,005 (thỏa mãn)
Vậy nNa = 0,02 (mol) mNa = 0,02 . 23 = 0,46 (g) %mNa = 13,3%
nBa = 0,01 (mol) mBa = 0,01 . 137 = 1,37 (g) %mBa = 39,7%
%m Al = 47%.
2. Gọi số mol của CH4, C2H2, C2H4, C3H6 lần lượt là a, b, c, d.
2 2 19,0413,50,85();0,75() 22,418 CO HO nmolnmol ====
(CH4, C2H2, C2H4, C3H6 ) + O2 0 t → CO2 + H2O
Áp dụng định luật bảo toàn nguyên tố C, H ta có:
2 ()() 2230,75 HEHHO nnabcd = +++= (**)
Lấy (*) - (**) ta được: b – a = 0,1 b = 0,1 + a (CH4, C2H2, C2H4, C3H6 ) + Br2 → (CH4, C2H2Br4, C2H4Br2, C3H6Br2)
Ta có:
2 20,55 Br nbcd=++= (***)
Thay b = 0,1 + a vào (***) ta có: 0,1 + a + b + c + d =0,55
a + b + c + d = 0,45
Vậy: x = 0,45.
Câu 5. (2,0 điểm)
1. Cho m gam Fe vào dung dịch Cu(NO3)2 đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X gồm hai kim loại. Cho toàn bộ X vào 0,95 mol H2SO4 đặc, nóng, dư thu được dung dịch
Y và 0,45 mol SO2. Cho toàn bộ dung dịch Y tác dụng với dung dịch Ba(OH)2 dư thu được kết tủa Z. Nung toàn bộ Z đến khối lượng không đổi thu được 144,5 gam rắn T. Tính giá trị m.
2. Đốt cháy hoàn toàn 18,9 gam hỗn hợp gồm một axit cacboxylic R (CnH2n+1COOH) và một ancol (rượu) T (CmH2m+1OH) thu được 15,68 lít khí CO2 (đo ở đktc) và 15,3 gam H2O.
a. Xác định công thức của R và T
b. Thực hiện phản ứng este hóa giữa R và T thu được hỗn hợp Q. Cho toàn bộ Q tác dụng với
Na dư thu được 2,8 lít khí H2 (đo ở đktc). Tính hiệu suất phản ứng este hóa.
GIẢI
1.
,18 1,5 0,08
x y x +=
++=
z z x y z
++= = = =
+ ++=
Ta có: 0,039 > 0,01 + 0,0075 ( Vô lý). + Nếu Al dư: (z > x + 0,5y)
Theo (1): 2
1 0,5() 2 HNa nnxmol ==
Ta có hệ phương trình:
Phương trình hóa học:
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu (1)
X gồm 2 kim loại nên Fe dư
Gọi nFe tham gia phản ứng (1) = a (mol); n Fe dư = b (mol).
Theo (1):
nCu = nFe phản ứng = a (mol).
X gồm a mol Cu và b mol Fe.
X + H2SO4 đặc, nóng, dư
2Fe + 6H2SO4 đặc 0 t → Fe2(SO4)3 + 3SO2 + 6H2O
b 3b 0,5b 1,5b (mol)
Cu + 2H2SO4 đặc c CuSO4 + SO2 + 2H2O
a 2a a a (mol)
Theo đề ra ta có: a + 1,5b = 0,45 (*)
x ++= =
++=
()
3137273,45 ,
2 0,5 1,5 0,2
()0 2 2 4 008
,18 y yz xyz xy
= = =
x y z
0,02 0,01 0,06
24 uHSOdn = 0,95 – 0,9 = 0,05 (mol)
Y + Ba(OH)2 dư:
H2SO4 + Ba(OH)2 → BaSO4 ↓ + 2H2O
0,05 0,05 (mol)
Fe2(SO4)3 + 3Ba(OH)2 → 3BaSO4 ↓ + 2Fe(OH)3↓
0,5b 1,5b b (mol)
CuSO4 + Ba(OH)2 → BaSO4 ↓ + Cu(OH)2↓
a a a (mol)
Z: gồm 0,5 mol BaSO4; b mol Fe(OH)3; a mol Cu(OH)2
Sơ đồ:
(BaSO4; Fe(OH)3; Cu(OH)2 ) 0 t → BaSO4; Fe2O3; CuO
Áp dụng bảo toàn nguyên tố ta có:
m chất rắn = 0,5 . 233 + 80a + 80b = 144,5 (g) (**)
Từ (*) và (**) ta có: a = 0,15; b = 0,2.
Vậy m = 0,35 . 56 = 19,6 (g)
2. Ta có:
CO HO nmolnmol ====
2 2 15,6815,30,7();0,85()
22,418
Sơ đồ:
CnH2n+1COOH 2O+ → (n+1)CO2 + (n+1)H2O

CmH2m+1OH 2O+ → mCO2 + (m+1)H2O
Ta có:
mm CHOHHOCO nnnmol + =−=−=
2122 0,850,70,15()
Gọi số mol của axit là: a (mol)
Ta có hệ phương trình: (1)0,150,70,2 14462,116,20,20,150,5 anma naamnm
giá trị thỏa mãn: n = 1; m = 2. Vậy R là CH3COOH; T là C2H5OH.
b.
3 25 0,2();0,15()CHCOOHCHOH nmolnmol ==
PTHH:
CH3COOH + C2H5OH 24d HSO →
CH3COO C2H5 + H2O (1)
Ta có: 3 25 0,2()0,15()CHCOOHCHOH nmolnmol =>=
Nên hiệu suất phản ứng tính theo C2H5OH.
Gọi số mol rượu tham gia phản ứng là: a (mol)
Theo (1) ta có:
Q gồm (0,2 – a) mol CH3COOH; (0,15 –a ) mol C2H5OH; a mol CH3COO C2H5; a mol H2O
Q + Na dư:
2CH3COOH + 2Na → 2CH3COONa + H2↑ (2)
2C2H5OH + 2Na → 2C2H5ONa + H2↑ (3)
2H2O + 2Na → 2NaOH + H2↑ (4)
Theo (2), (3), (4) ta có:
0,2 – a + 0,15 – a + a = 0,25 a = 0,1.
Hiệu suất phản ứng là:
0,1 .100%66,67% 0,15 =
………………………….H
ĐỀ CHÍNH THỨC
SỞ GIÁO DỤC VÀ ĐÀO TẠO GIA LAI (Đề thi có 02 trang)
Câu 1 (2,0 điểm)
KỲ THI TUYỂN SINH VÀO LỚP 10
TRƯỜNG THPT CHUYÊN HÙNG VƯƠNG
Năm học 2022 - 2023
Môn thi: HÓA HỌC
Thời gian làm bài: 120 phút (không kể thời gian phát đề)
1.1. Cho chuỗi phản ứng sau (mỗi mũi tên ứng với một phương trình hóa học):
C2H4 (1) → C2H5OH (2) → CH3COOH (3) → CH3COOC2H5 (4) → CH3COONa (5) → CH4
Viết phương trình hóa học thực hiện chuỗi phản ứng trên (ghi rõ điều kiện nếu có).
1.2. Viết công thức phân tử của các chất ứng với các kí hiệu X1, X2, X3, X4, X5 và hoàn thành phương trình hoá học của các sơ đồ phản ứng sau:
X1 + H2O ñieän phaân dd coù maøng ngaên
X2 + X4
X2 + X3
X4 + X5
→ X2 + X3 ↑ + H2 ↑
→ BaCO3 ↓ + Na2CO3 + H2O
→ X1 + NaClO + H2O
→ BaSO4 ↓ + CO2 ↑ + H2O
Câu 2 (1,5 điểm)
2.1. Hỗn hợp X gồm MgO, Al2O3, Fe3O4, CuO. Cho khí CO dư qua X nung nóng được chất rắn
Y. Hòa tan Y vào dung dịch KOH dư được dung dịch Z và chất rắn T. Hoà tan chất rắn T vào dung dịch H2SO4 loãng dư. Cho dung dịch HCl đến dư vào dung dịch Z thấy xuất hiện kết tủa, sau đó kết tủa tan dần đến hết. Viết phương trình hóa học của các phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có), biết các phản ứng xảy ra hoàn toàn.
2.2. Hình vẽ bên là thiết bị điều chế khí Y trong phòng thí nghiệm. Khí Y có thể là khi nào trong 2 khí sau: metan, axetilen. Biết khí Y làm mất màu dung dịch brom.
- Xác định công thức cấu tạo của Y.
- Viết phương trình điều chế Y, phản ứng hóa học Y tác dụng với dung dịch brom dư Câu 3 (2,0 điểm)
3.1. Hòa tan hoàn toàn 28,4 gam hỗn hợp X gồm MgCO3 và muối cacbonat của kim loại M bằng lượng vừa đủ dung dịch HCl 7,3% thu được dung dịch Y và 6,72 lít khí CO2 (ở điều kiện tiêu chuẩn). Thêm 64,8 gam nước vào dung dịch Y được dung dịch Z. Nồng độ của MgCl2 trong dung dịch Z là 5%. Xác định công thức muối cacbonat và tính thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp X.
3.2. Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Al2O3, Al(OH)3 vào dung dịch H2SO4 loãng 20% (vừa đủ) thu được 140 gam dung dịch Y chỉ chứa muối trung hòa có nồng độ 21,375% và 2,52 lít H2 (ở điều kiện tiêu chuẩn). Viết phương trình hóa học của các phản ứng xảy ra và tính giá trị của m.
Câu 4. (1,5 điểm)
Hỗn hợp X gồm hai hiđrocacbon (CnH2n+2 với n ≥ 1; CmH2m-2 với m ≥ 2). Đốt cháy hoàn toàn hỗn hợp X cần dùng vừa đủ 12,88 lít khí O2 (ở điều kiện tiêu chuẩn) thì thu được hỗn hợp Y gồm CO2 và 6,3 gam H2O, biết thể tích khí CO2 bằng 8 3 thể tích hỗn hợp X (các khí đều đo cùng điều kiện nhiệt độ và áp suất). Dẫn toàn bộ Y nói trên vào dung dịch Ca(OH)2 dư thu được m gam kết tủa và thấy khối lượng dung dịch giảm x gam so với khối lượng dung dịch Ca(OH)2 ban đầu.
a) Xác định công thức phân tử của hai hiđrocacbon.
b) Tính m, X.
Câu 5 (3,0 điểm)
5.1. Lên men m gam glucozơ thành rượu etylic với hiệu suất phản ứng 90%. Hấp thụ toàn bộ khí
CO2 sinh ra vào dung dịch Ba(OH)2, thu được 98,5 gam kết tủa và dung dịch X. Cho từ từ dung dịch NaOH vào dung dịch X, đến khi kết tủa lớn nhất thì cần ít nhất 100 ml dung dịch NaOH 1M. Tính
giá trị của m.
5.2. Hòa tan m gam hỗn hợp X gồm FeO, Fe3O4, Fe(OH)2, FeCO3 (trong đó số mol Fe3O4 bằng
1
4 tổng số mol hỗn hợp) vào dung dịch H2SO4 đặc, nóng dư, khi phản ứng xảy ra hoàn toàn thu
được dung dịch Y chứa (m + 104,4) gam muối sunfat và 10,08 lít hỗn hợp khí Z (ở điều kiện tiêu chuẩn) gồm CO2 và SO2 (sản phẩm khử duy nhất), Z có tỉ khối so với khí hiđro bằng 86 3 . Viết ph
ương trình hóa học của các phản ứng xảy ra và tính giá trị của m.
5.3. Nhúng một thanh sắt nặng 110 gam vào 200 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,1M và AgNO3 0,1M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 111,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Tính khối lượng sắt tham gia phản ứng (biết rằng trong dung dịch không xảy ra phản ứng tạo muối Fe(NO3)3).
Cho nguyên tử khối: C=12; H=1; O=16; N=14; Na=23; K=39; Ba=137; Ca=40; Mg=24; Si=28; Al=27; Fe=56; Cu=64; Ag = 108; Cl=35,5; S=32.
----------------HẾT-----------------
- Thí sinh không được sử dụng bảng Hệ thống tuần hoàn các nguyên tố hóa học
- Cán bộ coi thi không giải thích gì thêm.
ĐÀO TẠO GIA LAI (Đề thi có 02 trang)
K
THI
NG
HD CHÍNH THỨC
Môn thi: HÓA HỌC
Thời gian làm bài: 120 phút (không kể thời gian phát đề)
ĐÁP ÁN
Câu 1. (2,0 điểm)
1.1. Cho chuỗi phản ứng sau (mỗi mũi tên ứng với một phương trình hóa học):
C2H4 (1) → C2H5OH (2) → CH3COOH (3) → CH3COOC2H5 (4) → CH3COONa (5) → CH4
Viết phương trình hóa học thực hiện chuỗi phản ứng trên (ghi rõ điều kiện nếu có).
1.2. Viết công thức phân tử của các chất ứng với các kí hiệu X1, X2, X3, X4, X5 và hoàn thành
phương trình hoá học của các sơ đồ phản ứng sau:
X1 + H2O ñieän phaân dd coù maøng ngaên
X2 + X4
X2 + X3
X4 + X5
→ X2 + X3 ↑ + H2 ↑
→ BaCO3 ↓ + Na2CO3 + H2O
→ X1 + NaClO + H2O
→ BaSO4 ↓ + CO2 ↑ + H2O GI
ẢI
(1) CH2=CH2 + H2O 0 t,axit → CH3CH2OH
(2) CH3CH2OH + O2
→
→ ← 24 ñaäm ñaëc 0 HSO t
CH3COOCH2CH3 + 3H2O
(5) CH3COONa + NaOH 0 t,CaO → CH4 + Na2CO3
1.2. Các chất X1: NaCl; X2: NaOH; X3: Cl2; X4: Ba(HCO3)2; X5: H2SO4.
→
2NaOH + Cl2 ↑ + H2 ↑

(2) 2NaOH + Ba(HCO3)2 → BaCO3 ↓ + Na2CO3 + 2H2O
(3) 2NaOH + Cl2 → NaCl + NaClO + H2O
(4) Ba(HCO3)2 + H2SO4 → BaSO4 ↓ + 2CO2 ↑ + 2H2O
Câu 2. (1,5 điểm)
2.1. Hỗn hợp X gồm MgO, Al2O3, Fe3O4, CuO. Cho khí CO dư qua X nung nóng được chất rắn Y. Hòa tan Y vào dung dịch KOH dư được dung dịch Z và chất rắn T. Hoà tan chất rắn T vào dung dịch H2SO4 loãng dư. Cho dung dịch HCl đến dư vào dung dịch Z thấy xuất hiện kết tủa, sau đó kết tủa tan dần đến hết. Viết phương trình hóa học của các phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có), biết các phản ứng xảy ra hoàn toàn.
2.2. Hình vẽ bên là thiết bị điều chế khí Y trong phòng thí nghiệm.
Khí Y có thể là khi nào trong 2 khí sau: metan, axetilen. Biết khí Y làm mất màu dung dịch brom.
- Xác định công thức cấu tạo của Y.
GIẢI
2.1. PTHH:
- Cho khí CO dư qua X gồm MgO, Al2O3, Fe3O4, CuO.
(1) Fe3O4 + 4CO 0t → 3Fe + 4CO2
(2) CuO + CO 0 → Cu+ CO2
- Chất rắn Y gồm gồm MgO, Al2O3, Fe, Cu tác dụng KOH dư được dung dịch Z và chất rắn T
(3) Al2O3 + 2KOH → 2KAlO2 + H2O
- Hòa tan T gồm MgO, Fe, Cu bằng dung dịch SO4 loãng, dư
(4) MgO + H2SO4 → MgSO4 + H2O
(5) Fe + H2SO4 → FeSO4 + H2
- Cho HCl đến dư vào dung dịch X gồm KAlO2, KOH dư
(6) KOH + HCl → KCl+ H2O
(7) KAlO2 + HCl → KCl + Al(OH)3 + H2O
(8) Al(OH)3 + HCl → AlCl3 + 2H2O
2.2.
- Vì Y làm mất màu dung dịch brom, tạo ra từ chất rắn X tác dụng với H2O, không tan trong nước
(thu bằng phương pháp dời nước) nên Y là axetilen.
- PTHH:
22 2CaC2HOCHCHCa(OH) +→≡+
222 CHCH2BrCHBrCHBr ≡+→−
Câu 3. (2,0 điểm)
3.1. Hòa tan hoàn toàn 28,4 gam hỗn hợp X gồm MgCO3 và muối cacbonat của kim loại M bằng lượng vừa đủ dung dịch HCl 7,3% thu được dung dịch Y và 6,72 lít khí CO2 (ở điều kiện tiêu chuẩn). Thêm 64,8 gam nước vào dung dịch Y được dung dịch Z. Nồng độ của MgCl2 trong dung dịch Z là 5%. Xác định công thức muối cacbonat và tính thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp X.
3.2. Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Al2O3, Al(OH)3 vào dung dịch H2SO4 loãng 20% (vừa đủ) thu được 140 gam dung dịch Y chỉ chứa muối trung hòa có nồng độ 21,375% và 2,52
lít H2 (ở điều kiện tiêu chuẩn). Viết phương trình hóa học của các phản ứng xảy ra và tính giá trị của m.
GIẢI
3.1. Hỗn hợp X gồm MgCO3 và muối cacbonat của kim loại M:
- Đặt công thức của muối là M2(CO3)a; số mol MgCO3 = x (mol); M2(CO3)a = y (mol)
m = 84x + (2M + 60a)y = 28,4 (*)
- Khi X tác dụng HCl
MgCO3 + 2HCl → MgCl2 + H2O + CO2 (1)
x → 2x x x (mol)
M2(CO3)a + 2aHCl → 2MCla + aH2O + aCO2 (2)
y → 2ay 2y ay (mol)
- Theo PTHH (1), (2) số mol CO2 = x + ay = 0,3 (**)
- Theo PTHH (1), (2) số mol HCl = 2x + 2ay = 0,6 dd HCl 0,636,5 m100300 7,3 × =×= (gam)
- Bảo toàn khối lượng: 28,4 + 300 = mdd Y + 0,3 × 44 mdd Y = 315,2 (gam)
- Khi thêm H2O vào Y: mdd Z = 315,2 + 64,8 = 380 gam
- Nồng độ của MgCl2: 95x C%1005 380 =×= (***)
- Từ (*), (**), (***):x = 0,2; ay = 0,1; M = 28a
a = 2; M = 56 (Fe); x = 0,2; y = 0,05.
- Công thức muối: FeCO3
- Thành phần % khối lượng
+
3MgCO 0,284 %m10059,15% 28,4 × =×=
+
3FeCO %m10059,1540,85% =−= .
3.2. Hòa tan hỗn hợp X gồm Al, Al2O3, Al(OH)3 vào dung dịch H2SO4 loãng
- PTHH
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (1)
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O (2)
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O (3)
- Dung dịch sau phản ứng: Al2(SO4)3 có () 243AlSO 14021,375 n0,0875 100342 × == × (mol)
- Theo PTHH: () 2 24 3 4 HAlSO SO n3n30,08750,2625 ==×= (mol)
khối lượng dung dịch H2SO4 ban đầu: 24 dd HSO 0,262598 m100128,625 20 × =×= (gam)
- Bảo toàn khối lượng: m + 128,625 = 140 + 0,1125 × 2 m = 11,6 (gam)
Câu 4. (1,5 điểm)
Hỗn hợp X gồm hai hiđrocacbon (CnH2n+2 với n ≥ 1; CmH2m-2 với m ≥ 2). Đốt cháy hoàn toàn hỗn hợp X cần dùng vừa đủ 12,88 lít khí O2 (ở điều kiện tiêu chuẩn) thì thu được hỗn hợp Y gồm CO2
và 6,3 gam H2O, biết thể tích khí CO2 bằng 8 3 thể tích hỗn hợp X (các khí đều đo cùng điều kiện nhiệt độ và áp suất). Dẫn toàn bộ Y nói trên vào dung dịch Ca(OH)2 dư thu được m gam kết tủa và thấy khối lượng dung dịch giảm x gam so với khối lượng dung dịch Ca(OH)2 ban đầu.
a) Xác định công thức phân tử của hai hiđrocacbon.
b) Tính m, x.
GIẢI
- Gọi số mol CnH2n+2 là a; CmH2m-2 là b; tính được số mol O2 = 0,575 mol; H2O = 0,35 mol
- PTHH
CnH2n+2 + 3n1 2 + O2 0 → nCO2 + (n+1)H2O (1)
a → (mol)
CmH2m-2 + 3m1 2 O2 0t → mCO2 + (m-1)H2O (2)
b → (mol)
- Theo phương trình hóa học và các dữ kiện đầu bài, ta có hệ phương trình đại số: 2
nab0,575
3na3mbab1,15
nambab0,35
3na3mb8a8b0
3na3mbab1,15
3na3mb3a3b1,05
3na3mb8a8b0
0,2 ← 0,1 (mol)
Ba(HCO3)2 + NaOH → BaCO3 + NaHCO3 + H2O (4)
0,1 ← 0,1 (mol)
- Theo PTHH: số mol CO2 = 0,7 (mol) số mol glucozơ phản ứng = 0,35 (mol)
0,35 m18070 0,9 =×= (gam).
5.2.
02a2b0,1
11a5b1,05 +=
- Số mol khí Z: Z 10,08 n0,45 22,4 == (mol); khối lượng khí Z: 86 mZ0,45225,8 3 =××= (gam).
=
a0,05 b0,1
=
ab0,45a0,15 44a64b25,8b0,3
n4;m2:CTPT CH; CH
==
Giá trị của m và x: + m = 100 × 0,4 = 40 gam + x = 40 – (44 × 0,4 + 6,3) = 16,1 (gam).
Câu 5. (3,0 điểm)
5.1. Lên men m gam glucozơ thành rượu etylic với hiệu suất phản ứng 90%. Hấp thụ toàn bộ khí CO2 sinh ra vào dung dịch Ba(OH)2, thu được 98,5 gam kết tủa và dung dịch X. Cho từ từ dung dịch NaOH vào dung dịch X, đến khi kết tủa lớn nhất thì cần ít nhất 100 ml dung dịch NaOH 1M. Tính
giá trị của m.
5.2. Hòa tan m gam hỗn hợp X gồm FeO, Fe3O4, Fe(OH)2, FeCO3 (trong đó số mol Fe3O4 bằng
1 4 tổng số mol hỗn hợp) vào dung dịch H2SO4 đặc, nóng dư, khi phản ứng xảy ra hoàn toàn thu
được dung dịch Y chứa (m + 104,4) gam muối sunfat và 10,08 lít hỗn hợp khí Z (ở điều kiện tiêu
chuẩn) gồm CO2 và SO2 (sản phẩm khử duy nhất), Z có tỉ khối so với khí hiđro bằng 86 3 . Viết phương trình hóa học của các phản ứng xảy ra và tính giá trị của m.
5.3. Nhúng một thanh sắt nặng 110 gam vào 200 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,1M và AgNO3 0,1M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 111,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Tính khối lượng sắt tham gia phản ứng (biết rằng trong dung dịch không xảy ra phản ứng tạo muối Fe(NO3)3).
GIẢI
5.1.
- Số mol BaCO3 = 98,5 197 = 0,5 (mol); số mol NaOH = 0,1 × 1 = 0,1 (mol)
- PTHH
C6H12O6 mu enröô → 2C2H5OH + 2CO2 (1)
0,35
← 0,7 (mol)
CO2 + Ba(OH)2 → BaCO3 + H2O (2)
0,5 ← 0,5 (mol)
2CO2 + Ba(OH)2 → Ba(HCO3)2 (3)
- Gọi số mol FeO, Fe3O4, Fe(OH)2 lần lượt là x, y, z (mol). Khi tác dụng với H2SO4 đặc, nóng, dư thì PTHH của phản ứng xảy ra như sau:
2FeO + 4H2SO4 (đặc) → Fe2(SO4)3 + SO2 + 4H2O (1)
x → 0,5x 0,5x (mol)
2Fe3O4 + 10H2SO4 (đặc) → 3Fe2(SO4)3 + SO2 + 10H2O (2)
y → 1,5y 0,5y (mol)
2Fe(OH)2 + 4H2SO4 (đặc) → Fe2(SO4)3 + SO2 + 6H2O (3)
z → 0,5z 0,5z (mol)
ệ phương trình
đại số
4
Vậy,giátrị củam=75,6(gam).
5.3. NhúngmộtthanhsắtvàoldungdịchhỗnhợpgồmCu(NO3)2 vàAgNO3
-Số molCu(NO3)2 =0,2× 0,1=0,02(mol);số molAgNO3 =0,2 × 0,1=0,02(mol).
-PTHH:
Fe+2AgNO3 → Fe(NO3)2 +2Ag (1) 0,01 ← 0,02 → 0,02 (mol)
Fe+Cu(NO3)2 → Fe(NO3)2 +Cu (2)
x ← x → x (mol)
- Nếu chỉ xảy ra phản ứng (1) vừa đủ thì khối lượng thanh sau phản ứng = 110 + 0,02 × 108 –0,01 × 56=111,6<111,72:Loại
- Nếu xảy ra phản ứng (1) và (2) vừa đủ thì khối lượng thanh sau phản ứng = 110 + 0,02× 108 + 0,02 × 64–0,03 × 56=111,76>111,72:Loại
đãxảyrahếtphản ứng(1)vàphản ứng(2)còndư Cu(NO3)2
-Gọisố molCu(NO3)2 phản ứng=x,
msau =110+0,02× 108+64x–(0,01+x) × 56=111,72
x=0,015
-KhốilượngFe đãphản ứng:mFe =(0,01+0,015) × 56=1,4gam.
HÀ GIANG
Năm học: 2022 – 2023
Môn thi: Hóa học (chuyên)
Cho biết nguyên tử khối của các nguyên tố: H=1; C=12; N=14; O=16; Na=23; Mg=24; P=31; S=32; Ca=40; Fe=56; Cu=64; Br=80; Ba=137.
Câu 1: (2,0 điểm)
1.1. Nêu hiện tượng và viết phương trình phản ứng trong các thí nghiệm sau:
- Sục từ từ đến dư khí CO2 vào dung dịch Ca(OH)2
- Cho mẩu Na vào dung dịch CuSO4
1.2. Một học sinh lắp dụng cụ thí nghiệm điều chế khí X tinh khiết trong phòng thí nghiệm (như hình bên dưới). Biết khí X có màu vàng lục, mùi hắc, nặng hơn không khí và rất độc.
a. Xác định khí X, chất Y. Viết một phương trình hóa
học điều chế khí X ở thí nghiệm trên.
b. Cho biết tác dụng của bình đựng dung dịch NaCl bão hòa, bình đựng dung dịch H2SO4 đặc và bông tẩm dung dịch NaOH.
c. Nếu đổi chỗ hai bình đựng dung dịch NaCl và H2SO4 đặc cho nhau có được không? Vì sao?
Câu 2: (2,0 điểm)
2.1. Hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện nếu có)
(1)(2)(3)(4)
253 AxetilenEtilenCHOHCHCOOHEtyl axetat →→→→
2.2. Ba chất hữu cơ mạch hở có công thức phân tử là C3H6, C2H4O2, C2H6O đượckí hiệu ngẫu nhiên là A, B, C. Biết rằng:
- Khi đốt cháy A, B đều thu được số mol CO2 bằng số mol H2O.

- Chất B ít tan trong nước, làm mất màu dung dịch brôm.
- Chất C tác dụng được với Na.
- Chất A tác dụng được với NaOH và Na.
Hãy lập luận để xác định các chất A, B, C. Viết công thức cấu tạo thu gọn của chúng.
Câu 3: (2,0 điểm)
3.1. Nung kim loại Cu trong không khí sau một thời gian thu được chất rắn A. Hòa tan A bằng H2SO4 đặc nóng vừa đủ thu được dung dịch B và khí C (khí C có khối lượng phân tử bằng 64). Khí C tác dụng với dung dịch KOH thu được dung dịch D D vừa tác dụng với BaCl2 vừa tác dụng với NaOH. Xác định thành phần A, B, C, D và viết tất cả các phương trình phản ứng xảy ra.
3.2. Cho m gam Na tan hoàn toàn trong 400 ml dung dịch HCl 2M. Kết thúc phản ứng thu được dung dịch
X. Dung dịch X tác dụng vừa đủ với 200 ml dung dịch NaHCO3 1M. Tính giá trị của m.
Câu 4: (2,0 điểm)
4.1.Trộn V1 dung dịch HCl 0,6M với V2 lít dung dịch NaOH 0,4M thu được 0,6 lít dung dịch A. Dung
dịch A tác dụng vừa đủ với 1,02 gam Al2O3.Tính giá trị V1, V2.
4.2. Chia 24,0 gam hỗn hợp X gồm Fe và kim loại M có hóa trị II thành ba phần bằng nhau:
- Phần 1: Hòa tan hoàn toàn trong dung dịch HCl loãng, dư thu dược 4,48 lít khí.
- Phần 2: Cho tác dụng vừa đủ với 5,6 lít khí Cl2
a. Xác định M.
b. Lấy phần 3 hòa tan hoàn toàn trong dung dịch H2SO4 đặc nóng, sau khi kết thúc thu được dung dịch Y
và 4,928 lít khí SO2 (sản phẩm khử duy nhất). Hỏi khi cô cạn dung dịch Y thu được bao nhiêu gam chất rắn. Biết thể tích các khí đo ở đktc.
Câu 5: (2,0 điểm)
5.1. Cồn 750 được khuyến cáo sử dụng để sát trùng, phòng chống dịch Covid-19 lây lan. Em hãy trình bày
cách pha chế 1,0 lít cồn 750 từ lượng cồn 960 và nước tinh khiết.
5.2. Hỗn hợp X gồm 2 hi đrocacbon mạch hở A và B. A là đồng đẳng của etilen có công thức tổng quát là
CnH2n và B là đồng đẳng của axetilen có công thức tổng quát là CmH2m-2
a. Để phản ứng với 6,72 lít hỗn hợp X thì cần tối đa 400 ml dung dịch Br2 1M. Tính phần trăm theo thể
tích của mỗi chất trong hỗn hợp X, biết các khí đo ở đktc.
b. Đốt cháy hoàn toàn m gam hỗn hợp X trên rồi hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch
Ca(OH)2 thu được 40,0 gam kết tủa và khối lượng bình tăng 35,4 gam so với ban đầu. Lọc bỏ kết tủa rồi
thêm lượng dư dung dịch Ba(OH)2 vào bình, sau phản ứng thu thêm 29,7 gam kết tủa.
Xác định công thức cấu tạo của 2 hiđrocacbon A, B trong hỗn hợp X và giá trị của m.
SỞ GIÁO DỤC VÀ ĐÀO TẠO HÀ GIANG
Năm học: 2022 – 2023
Môn thi: Hóa học (chuyên)
Cho biết nguyên tử khối của các nguyên tố: H=1; C=12; N=14; O=16; Na=23; Mg=24; P=31; S=32; Ca=40; Fe=56; Cu=64; Br=80; Ba=137.
Câu 1: (2,0 điểm)
1.1. Nêu hiện tượng và viết phương trình phản ứng trong các thí nghiệm sau:
- Sục từ từ đến dư khí CO2 vào dung dịch Ca(OH)2.
- Cho mẩu Na vào dung dịch CuSO4.
1.2. Một học sinh lắp dụng cụ thí nghiệm điều chế khí X tinh khiết trong phòng thí nghiệm (như hình bên dưới). Biết khí X có màu vàng lục, mùi hắc, nặng hơn không khí và rất độc.
a. Xác định khí X, chất Y. Viết một phương trình hóa
học điều chế khí X ở thí nghiệm trên.
b. Cho biết tác dụng của bình đựng dung dịch NaCl bão hòa, bình đựng dung dịch H2SO4 đặc và bông tẩm dung dịch NaOH.
c. Nếu đổi chỗ hai bình đựng dung dịch NaCl và H2SO4 đặc cho nhau có được không? Vì sao?
Hướng dẫn giải
1.1
- Dung dịch vẩn đục sau đó chuyển thành trong suốt:
CO2 + Ca(OH)2 → CaCO3 + H2O
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Mẩu Na tan dần, có bọt khí thoát ra và xuất hiện kết tủa màu xanh:
2Na + 2H2O → 2NaOH + H2
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2

1.2
a. Chất X là khí Clo, chất Y là MnO2 hoặc KMnO4, KClO3, K2Cr2O7….
MnO2 + 4HCl → 0 MnCl2 + Cl2 + 2H2O
b. Vai trò của
+ Dung dịch NaCl: hấp thụ khí HCl
+ Dung dịch H2SO4 đặc: Hấp thụ hơi nước.
+ Bông tẩm dung dịch NaOH: Hấp thụ khí Cl2 khi đầy bình, tránh Cl2 thoát ra ngoài môi trường.
c. Không thể đổi chỗ 2 bình đựng dung dịch NaCl và H2SO4 đặc vì như thế sẽ không thu được khí Cl2 khô.
Câu 2: (2,0 điểm)
2.1. Hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện nếu có) (1)(2)(3)(4) 253 AxetilenEtilenCHOHCHCOOHEtyl axetat →→→→
2.2. Ba chất hữu cơ mạch hở có công thức phân tử là C3H6, C2H4O2, C2H6O đượckí hiệu ngẫu nhiên là A,
B, C. Biết rằng:
- Khi đốt cháy A, B đều thu được số mol CO2 bằng số mol H2O.
- Chất B ít tan trong nước, làm mất màu dung dịch brôm.
- Chất C tác dụng được với Na.
- Chất A tác dụng được với NaOH và Na.
Hãy lập luận để xác định các chất A, B, C. Viết công thức cấu tạo thu gọn của chúng.
B là CH3-CH=CH2
Chất C tác dụng với Na nên C là ancol: C là C2H5OH
Câu 3: (2,0 điểm)
3.1. Nung kim loại Cu trong không khí sau một thời gian thu được chất rắn A. Hòa tan A bằng H2SO4 đặc nóng vừa đủ thu được dung dịch B và khí C (khí C có khối lượng phân tử bằng 64). Khí C tác dụng với dung dịch KOH thu được dung dịch D. D vừa tác dụng với BaCl2 vừa tác dụng với NaOH. Xác định thành
phần A, B, C, D và viết tất cả các phương trình phản ứng xảy ra.
3.2. Cho m gam Na tan hoàn toàn trong 400 ml dung dịch HCl 2M. Kết thúc phản ứng thu được dung dịch
X. Dung dịch X tác dụng vừa đủ với 200 ml dung dịch NaHCO3 1M. Tính giá trị của m Hướng dẫn giải
3.1
A gồm Cu, CuO; B là CuSO4; C là SO2; D gồm KHSO3 và K2SO3.
CuSO+HO
SOKOHKHSO
SO2KOHKSOHO
KSOBaClBaSO2KCl 2KHSO2NaOHNaSOKSO2HO
3.2
n0,8 mol, n0,2 mol
3HClNaHCO
Caùc phaûn öùng coù theå xaûy ra:
2Na 2HCl2NaClH (1)
2Na2HO2NaOHH (2)
Dung dòch sau phaûn öùng taùc duïng ñöôïc vôùi NaHCO neân c
TH1: HCl dö, chæ xaûy ra phaûn öùng (1)
HCl + NaHCONaClCOHO
où 2 tröôøng hôïp xaûy ra:
+OCHCOOH +HO
(4)CHCOOH +CHOH CHCOOCH +HO
Khi đốt chất A, B đều thu được số mol CO2 bằng số mol H2O nên chất A, B có số nguyên tử H gấp 2 lần nguyên tử C.
Chất A tác dụng được với Na, NaOH nên chất A là axit: A là CH3-COOH
Chất B ít tan trong nước và làm mất màu dung dịch Brom nên chất B là hiđrocacbon có liên kết đôi.
0,2 0,2 mol n0,2 molnn0,80,20,6 molmm ==
HCl döNaHCl pöN
a NaNa 3232
0,6.2313,8 gam n0,80,20,6m0,6.2313,8 gam + TH 2: HCl heát, dung dòch X chöùa NaOH, xaûy ra caû 2 phaûn öùng (1), (2) NaHCONaOHNaCOHO 0,2 0,2
→
mol n0,80,21molmm1.2323 gam
=+=→=== NaNa
Câu 4: (2,0 điểm)
4.1.Trộn V1 dung dịch HCl 0,6M với V2 lít dung dịch NaOH 0,4M thu được 0,6 lít dung dịch A. Dung dịch A tác dụng vừa đủ với 1,02 gam Al2O3.Tính giá trị V1, V2
4.2. Chia 24,0 gam hỗn hợp X gồm Fe và kim loại M có hóa trị II thành ba phần bằng nhau:
Phần 1: Hòa tan hoàn toàn trong dung dịch HCl loãng, dư thu dược 4,48 lít khí.
- Phần 2: Cho tác dụng vừa đủ với 5,6 lít khí Cl2
a. Xác định M.
b. Lấy phần 3 hòa tan hoàn toàn trong dung dịch H2SO4 đặc nóng, sau khi kết thúc thu được dung dịch Y và 4,928 lít khí SO2 (sản phẩm khử duy nhất). Hỏi khi cô cạn dung dịch Y thu được bao nhiêu gam chất rắn. Biết thể tích các khí đo ở đktc.
Hướng dẫn giải
4,928
b.Phaàn3:n0,22mol 22,4
Mg + 2HSO MgSO + SO +H O
0,1 0,1 0,1
2Fe + 3HSO Fe(SO) + 3SO +H O
0,08 0,04 0,12
Fe + Fe(SO)3FeSO
2434
0,02 0,02 0,06
MgSO:0,1
Muoáithuñöôïc FeSO:0,06(mol)
Fe(SO):0,040,020,02
m0 ++= ,1.1200,06.1520,02.40029,12gam
n0,6V mol, n0,4V mol, n0,01mol
V + V0,6
HCl + NaOH NaCl + HO
Câu 5: (2,0 điểm)
Dung dòch sau phaûn öùng hoøa tan ñöôïc AlO neân coù 2 tröôøng hôïp:
+ TH 1:HCldö
23HCl1NaOH2AlO 12 2 23 233
4.1 === = → →
5.1. Cồn 750 được khuyến cáo sử dụng để sát trùng, phòng chống dịch Covid-19 lây lan. Em hãy trình bày cách pha chế 1,0 lít cồn 750 từ lượng cồn 960 và nước tinh khiết.
6HCl + AlO 2AlCl ←
+ 3HO
5.2. Hỗn hợp X gồm 2 hi đrocacbon mạch hở A và B. A là đồng đẳng của etilen có công thức tổng quát là
0,06 0,01 mol
CnH2n và B là đồng đẳng của axetilen có công thức tổng quát là CmH2m-2
0,6V -0,4V = 0,06V0,3; V0,3 + TH 2:NaOH dö
2 1212 2322
2NaOH + AlO 2NaAlO + HO
0,02 0,01
→== → ←
→==2112
mol 0,4V -0,6V = 0,02V0,22; V0,38
4.2
a. Goïi soá mol trong moãi phaàn cuûa Fe vaø M töông öùng laø x, y Phaàn 1: Giaû söû M khoâng phaûn öùng vôùi HCl Fe + 2HCl FeCl + H
22 FeH Fe hh
2
mol m0,2.5611,2 gam > m
Vaäy M coù phaûn öùng vôùi HCl. Fe + 2HCl FeCl + H
M + 2HCl MCl + H
nxy0,2 mol 22,4
2 2Fe + 3Cl 2FeCl M + Cl MCl
molx0,1; y0,1 22,4
m0,1.560,1.M8M24 laø Magie
4 8 gam (voâ lí)
a. Để phản ứng với 6,72 lít hỗn hợp X thì cần tối đa 400 ml dung dịch Br2 1M. Tính phần trăm theo thể tích của mỗi chất trong hỗn hợp X, biết các khí đo ở đktc.
b. Đốt cháy hoàn toàn m gam hỗn hợp X trên rồi hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch
Ca(OH)2 thu được 40,0 gam kết tủa và khối lượng bình tăng 35,4 gam so với ban đầu. Lọc bỏ kết tủa rồi
thêm lượng dư dung dịch Ba(OH)2 vào bình, sau phản ứng thu thêm 29,7 gam kết tủa.
Xác định công thức cấu tạo của 2 hiđrocacbon A, B trong hỗn hợp X và giá trị của m.
Hướng dẫn giải
5.1 25 0
75 V1000.750 ml 100 100 V750.781,25ml 96 V1000781,25218,75ml
CHOH Coàn 96 Nöôùc caát
== == =−=
- Chuẩn bị dụng cụ định mức loại 1000 ml
- Dùng ống đong lấy 781,25 ml cồn 960
- Thêm từ từ nước cất rồi khuấy đều cho đủ định mức 1000 ml dung dịch. Ta được 1,0 lít cồn 750 5.2
n=0,6moln= =0,5m=m+m=0,6.12+0,5.2=8,2ga
n=0,6-0,5=0,1mol n0,2mol
0,2.n0,1.m0,62nm6n2;m2HaihiñrocacbonlaCH,CH
UBND TỈNH HÀ NAM
SỞ GIÁO DỤC VÀ ĐÀO TẠO
ĐỀ CHÍNH THỨC (Đề thi có 02 trang)
KỲ THI TUYỂN SINH LỚP 10 THPT CHUYÊN
NĂM HỌC: 2022 – 2023
Môn: Hóa học
Thời gian: 150 phút (không kể thời gian giao đề)
Câu I (1,0 điểm) Nêu hiện tượng xảy ra, viết phương trình hóa học khi cho:
1. Một mẩu kim loại Na vào dung dịch CuSO4
2. Một dây kim loại Cu vào dung dịch AgNO3.
3. Dung dịch CH3COOH vào Cu(OH)2.
4. Cho mẩu Na vào cốc đựng rượu etylic khan.
(Biết == 3 röôïuetylicNa D0,8g/ml;D0,97g/cm )

Câu II (1,0 điểm) Hãy giải thích:
1. Vì sao khi cho một sợi đây đồng đã cạo sạch vào bình cắm hoa thì hoa sẽ tươi lâu hơn?
2. Vì sao các đồ vật làm bằng nhôm khó bị ăn mòn trong không khí?
3. Vì sao khi hạ đường huyết người ta cho uống nước đường thay vì ăn các loại thức ăn khác?
4. Vì sao trên thực tế người ta không dùng nước để dập tắt các đám cháy do xăng dàu? Nêu biện pháp xử lí các đám cháy do xăng dầu?
Câu III. (1,0 điểm) Cho biết A là hỗn hợp gồm Mg và Cu, hãy viết phương trình phản ứng theo sơ
Câu IV. (1,0 điểm)
1. Quan sát hình vẽ điều chế khí X dưới đây và trả lời các câu hỏi:
a) Khí X là gì? Nêu hiện tượng và viết phương trình hóa học khi dẫn khí X vào ống nghiệm đựng dung dịch KMnO4.
b) Nêu vai trò của đá bọt trong thí nghiệm trên? Nếu khi làm thí nghiệm không có đá bọt em có thể thay bằng chất gì?
2. Trong phòng thí nghiệm giả sử chỉ có: khí CO2, bình tam giác có một vạch chia, dung dịch NaOH, pipet, đèn cồn, giá đỡ. Trình bày hai phương pháp để điều chế Na2CO3 tinh khiết. Câu V. (1,0 điểm)
1. Hỗn hợp X gồm 4 chất khí sau CO2, SO3, SO2 và H2. Trình bày phương pháp hóa học nhận biết từng khí trong hỗn hợp X. Viết các phương trình phản ứng xảy ra.
2. Một hỗn hợp X gồm các chất: K2O, KHCO3, NH4Cl, BaCl2 có số mol mỗi chất bằng nhau. Hoà tan hỗn hợp X vào nước, rồi đun nhẹ thu được khí Y, dung dịch Z và kết tủa M. Xác định các chất trong Y,
Z, M và viết phương trình phản ứng xảy .
Câu VI. (1,0 diểm)
Hòa tan hoàn toàn a gam kim loại R (hóa trị không đổi) vào dung dịch HCl được dung dịch X. Để trung
h
ỏa lượng axit còn dư trong dung dịch X cần dùng 64 gam dung dịch NaOH 12,5%. Phản ứng xong thu
được dung dịch chứa 4,68% NaCl và 13,33% RCl2. Cho tiếp lượng dư NaOH vào Y, lọc tách kết tủa
tạo thành rồi đem nung đến khối lượng không đối được 14 gam chất rắn.
1. Viết phương trình phản ứng.
2. Xác định R, tìm a và nồng độ phần trăm dung dịch HCl.
Câu VII. (1,0 diểm)
Cho hỗn hợp khí X gồm 3 hiđrocacbon A, B, C (với B, C là 2 chất kế tiếp nhau trong cùng một dãy đồng đẳng). Đốt cháy hoàn toàn 672ml hỗn hợp X rồi cho toàn bộ sản phầm cháy vào bình chứa 437,5ml dung dịch Ba(OH)2 0,08M, phản ứng xong thu được 4,925 gam kết tủa. Mặt khác, dẫn 1209,6ml hỗn hợp X qua bình chứa nước brom dư. Sau phản ứng thấy khối lượng bình brom tăng 0,468 gam và có 806,4ml hỗn hợp khí thoát ra. Biết các thể tích khí đo ở điều kiện tiêu chuẩn và các phản ứng xảy ra hoàn toàn.
1. Tìm công thức phân tử của A, B, C. Biết A, B, C thuộc trong các dãy ankan, anken, ankin.
2. Tính thành phần trăm theo thể tích các chất trong hỗn hợp X.
Câu VIII. (1,0 điểm)
Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2 thu được chất rắn
Y và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc, nóng, dư thu được 6,384 lít khí SO2 (sản phẩm khử duy nhất, ở điều kiện tiêu chuẩn). Cho dung dịch NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 8,4 gam hỗn hợp rắn. Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong ? (Biết các phản ứng xảy ra hoàn toàn).
Câu IX. (1,0 điểm)
Cho một hợp chất A có chứa các nguyên tố C, H, O và nguyên tố X. Kết quả phân tích cho thấy % khối lượng các nguyên tố C, H, O trong A lần lượt là 44,72%; 1,24%; 9,94% và còn lại là % khối lượng của
X. Trong phân tử A chứa 2 nguyên tử oxi và số nguyên tử X gấp 2 lần số nguyên tử oxi. Xác định công
thức phân tử của A.
Câu X. (1,0 diểm)
Hỗn hợp X chứa 3 este A, B, C đều mạch hở, không phân nhánh (không chứa nhóm chức khác) và
<< ABC MMM Để phản ứng với 41,24 gam X cẩn dùng 280ml dung dịch NaOH 2M (đun nóng), thu được hỗn hợp muối Y và hỗn hợp Z chứa 3 ancol no. Trộn hỗn hợp Y với vôi tôi xút (CaO, NaOH) dư, đun nóng, thu được 11,2 lít một chất khí duy nhất là metan (đo ở điều kiện tiêu chuẩn). Mặt khác, để đốt cháy 41,24 gam X cần dùng 42,784 lít O2 (đo ở điều kiện tiêu chuẩn).
1. Xác định công thức phân tử của các muối trong Y.
2. Xác định công thức phân tử của A.
3. Tính thành phần phần trăm về khối lượng của các ancol có trong hỗn hợp Z.
---HẾT---
Thí sinh không sử dụng tài liệu và bảng tuần hoàn, cán bộ coi thi không giải thích gì thêm.
Cho biết nguyên tử khối (theo đvC) của các nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; K = 39;
Al = 27; S = 32; Cl = 35,5; Ca = 40; Fe = 56; Cu = 64; Br = 80; Ag = 108; Pb = 207; I = 127; Ba = 137;
Mg = 24.
UBND TỈNH HÀ NAM
SỞ GIÁO DỤC VÀ ĐÀO TẠO
ĐỀ CHÍNH THỨC (Đề thi có 02 trang)
HDC KỲ THI TUYỂN SINH LỚP 10 THPT CHUYÊN
NĂM HỌC: 2022 – 2023
Môn: Hóa học
Thời gian: 150 phút (không kể thời gian giao đề)
Câu I (1,0 điểm) Nêu hiện tượng xảy ra, viết phương trình hóa học khi cho:
1. Một mẩu kim loại Na vào dung dịch CuSO4.
2. Một dây kim loại Cu vào dung dịch AgNO3.
3. Dung dịch CH3COOH vào Cu(OH)2
4. Cho mẩu Na vào cốc đựng rượu etylic khan. (Biết == 3 röôïuetylicNa D0,8g/ml;D0,97g/cm )
Ý Nội dung Thang điểm
Hiện tượng: Na tan dần trong dung dịch muối đồng sunfat, có kết tủa màu xanh tạo thành và có khí thoát ra.
PTHH:
2Na + 2H2O → 2NaOH + H2↑
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
0,25
2
Hiện tượng: Khi cho dây đồng vào dd AgNO3, một lúc sau ta thấy có chất rắn màu xám (Ag) bám vào dây đồng, một phần dây đồng tan vào dung dịch, dung dịch ban đầu trong suốt chuyển sang màu xanh (Đồng (II) nitrat).
PTHH: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
3 Hiện tượng: Kết tủa xanh tan dần, tạo thành dung dịch màu xanh
0,25
4
PTHH: Cu(OH)2 + 2CH3COOH → (CH3COO)2Cu + 2H2O 0,25
Hiện tượng: Mẫu Na lơ lửng trong rượu, tan dần và có bọt khí không màu thoát ra - Giải thích: Do: < röôïuNaDD , nên Na chìm trong rượu, phản ứng với rượu làm Na tan dần, khí H2 tạo ra lực đẩy làm Na lơ lửng trong rượu
PTHH: 2Na(r) + 2C2H5OH → 2C2H5ONa + H2 ↑
Câu II. (1,0 điểm) Hãy giải thích:
0,25
1. Vì sao khi cho một sợi đây đồng đã cạo sạch vào bình cắm hoa thì hoa sẽ tươi lâu hơn?
2. Vì sao các đồ vật làm bằng nhôm khó bị ăn mòn trong không khí?
3. Vì sao khi hạ đường huyết người ta cho uống nước đường thay vì ăn các loại thức ăn khác?
4. Vì sao trên thực tế người ta không dùng nước để dập tắt các đám cháy do xăng dàu? Nêu biện pháp xử lí các đám cháy do xăng dầu?
Ý Nội dung Thang điểm
1 Đồng kim loại sẽ tạo nên một số ion Cu2+ tan vào trong nước sẽ có tác dụng diệt khuẩn, làm cho các cuống hoa đỡ bị thối trong nước. Do đó đỡ làm tắc các mao quản dẫn nước lên cánh hoa nên hoa tươi hơn.
2 Trong không khí, Al tiếp xúc với khí O2, với H2O tạo ra lớp màng oxit nhôm Al2O3 mỏng nhưng rất bền vững. Lớp màng oxit nhôm bảo
0,25
0,25
vệ nhôm tiếp xúc với môi trường bên ngoài, ngăn ngừa quá trình oxi hóa khử.
Nước đường chứa đường đôi, khi cho bệnh nhân uống nhanh chóng chuyển hoá thành đường đơn trong cơ thể và được ấp thụ giúp tăng lại mức đường huyết. Các loại thức ăn khác thường chứa đường đa, tinh bột, béo, protein,.. nhiều chất khác nhau, quá trình phân giải và hấp thu sẽ rất lâu và không hiệu quả nhanh cho bệnh nhân.
Không được dùng nước để dập đám cháy gây ra do xăng dầu. Bởi vì xăng dầu nhẹ hơn nước, nếu ta dập đám cháy gây ra bởi xăng dầu bằng nước thì nước lan tỏa đến đâu xăng dầu lan tỏa đến đó khiến đám cháy còn lan rộng lớn và khó dập tắt hơn. Do đó khi ngọn lửa do xăng dầu cháy người ta hay thường dùng vải dày ướt trùm hoặc phủ cát lên ngọn lửa để cách li ngọn lửa với oxi.
0,25
Câu III. (1,0 điểm) Cho biết A là hỗn hợp gồm Mg và Cu, hãy viết phương trình phản ứng theo sơ đồ sau:
a) Khí X là gì? Nêu hiện tượng và viết phương trình hóa học khi dẫn khí X vào ống nghiệm đựng dung dịch KMnO4.
b) Nêu vai trò của đá bọt trong thí nghiệm trên? Nếu khi làm thí nghiệm không có đá bọt em có thể thay bằng chất gì?
2. Trong phòng thí nghiệm giả sử chỉ có: khí CO2, bình tam giác có một vạch chia, dung dịch NaOH, pipet, đèn cồn, giá đỡ. Trình bày hai phương pháp để điều chế Na2CO3 tinh khiết. Ý Nội dung Thang điểm
a. Khí X là C2H4. Khi dẫn khí X vào ống nghiệm đựng dung dịch KMnO4, màu tím
của KMnO4 chuyển dần sang không màu và có vẩn đục màu đen.
3C2H4 + 4H2O + 2KMnO4 → 3C2H4(OH)2 + 2MnO2↓ + 2KOH
b. Đá bọt giúp cho chất lỏng sôi êm dịu, có thể thay đá bọt bằng
0,25
mảnh thủy tinh. 0,25
Cách 1:
Sục CO2 dư vào bình đựng dung dịch NaOH:
CO2 dư + NaOH → NaHCO3
Đun nóng dung dịch thu được Na2CO3:
2NaHCO3 → ot Na2CO3 + CO2 + H2O
0,25
2
Cách 2: Lấy dung dịch NaOH vào 2 bình tam giác đến vạch chia (có cùng thể tích ⇒ cùng số mol)
Sục CO2 đến dư vào bình thứ nhất, thu được dung dịch NaHCO3.
Sau đó đổ bình 2 (dung dịch NaOH) vào dung dịch thu được ở
0,25
2, Cu(OH)2
→+ ot 22 Mg(OH)MgOHO →+ ot 22 Cu(OH)CuOHO
G: MgO, CuO.
Câu IV. (1,0 điểm)

1. Quan sát hình vẽ điều chế khí X dưới đây và trả lời các câu hỏi:
bình 1 ta sẽ thu được Na2CO3 CO2 dư + NaOH → NaHCO3
NaHCO3 + NaOH → Na2CO3 + H2O
Câu V (1,0 điểm)
1. Hỗn hợp X gồm 4 chất khí sau CO2, SO3, SO2 và H2. Trình bày phương pháp hóa học nhận biết từng khí trong hỗn hợp X. Viết các phương trình phản ứng xảy ra.
2. Một hỗn hợp X gồm các chất: K2O, KHCO3, NH4Cl, BaCl2 có số mol mỗi chất bằng nhau. Hoà tan hỗn hợp X vào nước, rồi đun nhẹ thu được khí Y, dung dịch Z và kết tủa M. Xác định các chất trong Y, Z, M và viết phương trình phản ứng xảy .
Ý Nội dung Thang điểm 1 Lấy một mẫu khí X làm thí nghiệm:
Bước 1: Dẫn hỗn hợp X qua dung dịch BaCl2 dư, nhận ra SO3 và 0,25
loại bỏ được SO3
Hiện tượng: có BaSO4↓ (màu trắng, không tan trong HCl)
PTHH: SO3 + H2O + BaCl2 → BaSO4↓ + 2HCl
Bước 2: Dẫn hỗn hợp khí sau khi đi ra khỏi bình dd BaCl2 vào dung dịch Br2 dư, nhận ra và loại bỏ khí SO2.
Hiện tượng: mất màu nâu đỏ của nước brom.
PTHH: SO2 + H2O + Br2 → H2SO4 + 2HBr
Bước 3: Dẫn hỗn hợp khí sau khi đi ra khỏi bình dung dịch brom, vào dung dịch nước vôi trong dư, nhận ra và loại bỏ CO2
Hiện tượng: dung dịch nước vôi trong hóa đục do có CaCO3↓
PTHH: CO2 + Ca(OH)2 dư → CaCO3↓ + H2O
Bước 4: Khí còn lại dẫn qua ống đựng CuO nung nóng nhận ra H2
HIện tượng có Cu màu đỏ.
PTHH: H2 + CuO → ot Cu + H2O
Xác định Y, Z, M:
Đặt số mol mỗi chất là a
PTHH: K2O + H2O → 2KOH
Mol a → 2a
KOH + KHCO3 → K2CO3 + H2O
a
→ a → a
NH4Cl + KOH → KCl + NH3 ↑+ H2O
a ← a → a
BaCl2 + K2CO3 → BaCO3 ↓ + 2KCl
a → a → a
Vậy Y là NH3; dung dịch Z là KCl; M là BaCO3.
Câu VI (1,0 điểm)
Hòa tan hoàn toàn a gam kim loại R (hóa trị không đổi) vào dung dịch HCl được dung dịch
X. Để trung hỏa lượng axit còn dư trong dung dịch X cần dùng 64 gam dung dịch NaOH
12,5%. Phản ứng xong thu được dung dịch chứa 4,68% NaCl và 13,33% RCl2. Cho tiếp lượng dư NaOH vào Y, lọc tách kết tủa tạo thành rồi đem nung đến khối lượng không đối được 14 gam chất rắn.
1. Viết phương trình phản ứng.
2. Xác định R, tìm a và nồng độ phần trăm dung dịch HCl.
Ý Nội dung Thang điểm
2R + 2xHCl → 2RClx + xH2 ↑ (1) NaOH + HCl → NaCl + H2O (2)
RClx + xNaOH → R(OH)x + xNaCl (3)
R(OH)x → ot R2Ox + H2O (4)
Gọi hóa trị R = x, số mol NaOH = 0,2 mol.
Theo phương trình, lượng NaCl = 11,7 gam. Từ 2 nồng độ suy ra:
Lượng dung dịch Y = 250 gam và lượng RClx = 33,25 gam.
Viết tiếp phương trình RClx → R(OH)x → R2Ox (14 gam).
0,25
Nhận thấy: 2RClx → R2Ox cho == −+ 2xRO 33,241414 nmol 71x16x2R16x
Suy ra: R = 12 thỏa mãn x = 2 ⇒ R = 24, là Mg.
=+−− 2 ddHClddYHddNaOHX mmmmm
Thay số == 2XH (n0,35;n0,35) ⇒ = ddHCl m178,3gam 0,25
Theo phương trình =+=≈≈ HCl n0,20,70,9(mol)32,85gam18,24% 0,25
Câu VII. (1,0 điểm)
Cho hỗn hợp khí X gồm 3 hiđrocacbon A, B, C (với B, C là 2 chất kế tiếp nhau trong cùng một dãy đồng đẳng). Đốt cháy hoàn toàn 672ml hỗn hợp X rồi cho toàn bộ sản phầm cháy vào bình chứa 437,5ml dung dịch Ba(OH)2 0,08M, phản ứng xong thu được 4,925 gam kết tủa. Mặt khác, dẫn 1209,6ml hỗn hợp X qua bình chứa nước brom dư. Sau phản ứng thấy khối lượng bình brom tăng 0,468 gam và có 806,4ml hỗn hợp khí thoát ra. Biết các thể tích khí đo ở điều kiện tiêu chuẩn và các phản ứng xảy ra hoàn toàn.
1. Tìm công thức phân tử của A, B, C. Biết A, B, C thuộc trong các dãy ankan, anken, ankin.
2. Tính thành phần trăm theo thể tích các chất trong hỗn hợp X.
Ý Nội dung Thang điểm
Khí A bị hấp thụ bởi dung dịch brom là anken hoặc ankin
⇒ == A 1,20960,8064 n0,018mol 22,4 , mà mA = 0,468 gam.
⇒ MA = 26 ⇒ A là C2H2.
Hỗn hợp khí thoát ra khỏi bình brom là 2 ankan B và C
Đặt CTTB của B và C là + n2n2 CH
Ta có: 22CHn (trong 672ml hhX) = 0,01 mol
⇒ =−= B,CtrongX n0,030,010,02mol
Sản phẩm cháy tác dụng với dung dịch Ba(OH)2 == 2 3Ba(OH)BaCO n0,035mol;n0,025mol
TH1: Chỉ tạo muối trung hòa, Ba(OH)2 dư == 23 COBaCO nn0,025mol
⇒ 0,01.2 + 0,02. n = 0,025 ⇒ n = 0,25 (loại)
TH2: Tạo 2 muối: BaCO3 (0,025 mol) và Ba(HCO3)2 (0,035 – 0,025 = 0,01 mol).
=+= 2CO n0,0250,01.20,045mol
⇒ += = 0,01.20,02.n0,045n1,25
0,25
0,25
0,25
0,25
Ta có hệ: +==
+==
=== 42622 CHCHCH %V50%;%V16,67%;%V33,33% 0,25
Câu VIII. (1,0 điểm)
Cho 9,2 gam hỗn hợp X gồm Mg và Fe vào dung dịch hỗn hợp AgNO3 và Cu(NO3)2 thu
được chất rắn Y và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc, nóng, dư thu
được 6,384 lít khí SO2 (sản phẩm khử duy nhất, ở điều kiện tiêu chuẩn). Cho dung dịch
NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu
được 8,4 gam hỗn hợp rắn. Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong X? (Biết các phản ứng xảy ra hoàn toàn).
Nội dung Thang điểm Vì =<= hhoxitX m8,4gamm9,2gam kim loại dư ⇒ 2 muối hết.
Mặt khác chất rắn thu được là hỗn hợp và Mg hoạt động hóa học mạnh hơn
Fe
⇒ Mg hết, Fe đã phản ứng một phần.
- Gọi a, b lần lượt là số mol của Mg và Fe phản ứng, c là số mol Fe dư
⇒ == = H b %m1,24%b4 322
⇒ MA = 12.12 + 4.1 + 16.2 + 4.MX = 322
⇒ MX = 35,5 ⇒ X: Cl 0,25
Vậy công thức của A là C12H4O2Cl4. 0,25
Câu X (1,0 điểm)
Hỗn hợp X chứa 3 este A, B, C đều mạch hở, không phân nhánh (không chứa nhóm chức khác) và << ABC MMM . Để phản ứng với 41,24 gam X cẩn dùng dung dịch NaOH
2M (đun nóng), thu được hỗn hợp muối Y và hỗn hợp Z chứa 3 ancol no. Trộn hỗn hợp Y
với vôi tôi xút ( CaO, NaOH) dư, đun nóng, thu được 11,2 lít một chất khí duy nhất là metan (đo ở điều kiện tiêu chuẩn). Mặt khác, để đốt cháy 41,24 gam X cần dùng 42,784 lít (đo ở điều kiện tiêu chuẩn).
1. Xác định công thức phân tử của các muối trong Y.
2. Xác định công thức phân tử của A.
3. Tính thành phần phần trăm về khối lượng của các ancol có trong hỗn hợp Z. Ý Nội dung Thang điểm
)
Khối lượng hỗn hợp X = 9,2 ⇒ 24a + 56b + 56c = 9,2
Khối lượng hỗn hợp rắn = 8,4 gam ⇒ 40a + 80b = 8,4
⇒ a = 0,15 mol
b = 0,03 mol
c = 0,07 mol == MgFe %m39,13%;%m60,87%
Câu IX. (1,0 điểm)
Cho một hợp chất A có chứa các nguyên tố C, H, O và nguyên tố X. Kết quả phân tích cho thấy % khối lượng các nguyên tố C, H, O trong A lần lượt là 44,72%; 1,24%; 9,94% và còn lại là % khối lượng của X. Trong phân tử A chứa 2 nguyên tử oxi và số nguyên tử X gấp 2 lần số nguyên tử oxi. Xác định công thức phân tử của A. Nội dung Thang điểm A chứa 2O và số nguyên tử X gấp 2 lần O nên có 4 nguyên tử X. Vậy công thức của A có dạng CaHbO2X4
1
11,2 n0,5mol; 22,4 47,728 n1,9mol; 22,4
2
4
Khí duy nhất thoát ra từ phản úng vôi tôi xút và là hiđrocacbon no đơn giản nhất ⇒ X là CH4 == == ==
CH O NaOH
0,25
n0,28.20,56mol
X chứa 3 este mạch hở, không phân nhánh và Y là hỗn hợp muối tham
gia phản ứng với vôi tôi xút tạo ra CH4
Gọi x, y lần lượt là số mol của CH3COONa và CH2(COONa)2
Theo đề bài ta có: nX = x + y = 0,5 (I); =+= NaOH nx2y0,56 (II)
⇒ x = 0,44; y = 0,06
Gọi a, b lần lượt là số mol CO2, H2O khi đốt 41,24 gam X
Áp dụng ĐLBTKL: +=+ 222 XOCOHO mmmm
⇒ 44a + 18b = 41,24 + 1,91.32 (*)
BTNT với O: 2a + b = (0,44.2 + 0,06.4) + 1,91.2 (**)
Từ (*) và (**) ⇒ a = 1,68; b = 1,58 =−=−= 22 este2chöùcCOHO nnn1,681,580,1
⇒ =+= X n0,10,360,46(mol)
⇒ Số nguyên tử C trung bình của X = = 1,68 3,652 0,46
⇒ Phải có 1 este là CH3COOCH3 (0,36 mol)
0,25
CHCOONa:0,44mol CHCOOCH:0,36mol X CH(COONa):0,06mol B,C:0,01mol 3ancolno
SỞ GIÁO DỤC VÀ ĐÀO TẠO HÀ NỘI (Đề thi gồm có 2 trang)
NĂM HỌC 2022 – 2023
Môn: HÓA HỌC (CHUYÊN 10)
Thời gian làm bài 150 phút không kể thời gian giao đề
==
n 0,2 2 n0,1
n 0,14 1,4 n0,1
⇒ Trong X có chứa: 1 este 2 chức axit và 1 este 2 chức ancol
Bảo toàn khối lượng cho phản ứng xà phòng hóa ta có: +=+ XNaOHmuoáiancol mmmm
- Trường hợp 1: 2 este 2 chức là (CH3COO)2A và CH2(COOB)2 = =−= 22 32 CH(COONa)(CHCOO)A n0,06moln0,10,060,04mol
⇒ Các ancol gồm:
A(OH):0,04mol BOH:0,12mol CHOH:0,36mol
2 3
⇒ (A+34).0,04 + (B+17).0,12 + 32.0,36 = 18,68
⇒ A + 3B = 94
- Trường hợp 2: hai este đa chức là (CH3COO)2A: 0,04 mol và −−= 32 CHOOCCHCOOB0,06mol
A(OH):0,04mol
BOH:0,06mol
CHOH:0,42mol
0,25
Câu I. Các hợp chất vô cơ (2,0 điểm)
1. Cho các chuyển hóa sau:
BaCO3 o → X + M
2NaOH + M → Y + H2O
NH3 + HCl → Z
NH3 + HNO3 → T
a) Xác định các chất X, Y, Z, T và M
b) Cho đồng thời các chất X, Y, Z, T có cùng số mol vào trong một lượng nước dư, rồi đun nhẹ thu được khí A, dung dịch B và kết tủa C. Xác định các chất có trong A, B và C. Viết các phương trình hóa học xảy ra.
2. Chia 76,8 gam hỗn hợp F gồm Mg và Fe thành hai phần bằng nhau:
- Cho phần 1 vào dung dịch HCl dư, thu được 17,92 lít H2 (đktc).
0,25
- Cho phần 2 vào 0,6 lít dung dịch Cu(NO3)2 aM, thu được dung dịch G và b gam chất rắn H. Cho dung dịch G vào dung dịch NaOH dư, lọc lấy kết tủa rồi nung đến khối lượng không đổi, thu được 40 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Tính các giá trị a và b.
Câu II. Nhôm và hợp chất của nhôm (2,0 điểm)
Nhôm là kim loại màu trắng bạc, mềm, dễ kéo sợi, dát mỏng, dẫn điện và dẫn nhiệt tốt. Nhôm có thể được dát thành giấy nhôm dùng để gói thực phẩm. Nhôm và hợp kim của nhôm có đặc tính nhẹ, bền với không khí và nước, được dùng làm vật liệu chế tạo máy bay, ô tô, tên lửa, tàu vũ trụ, các vật dụng với cuộc sống, ….
1. Mùa hè năm ngoái, bạn Tuấn được bố mẹ cho về quê ngoại thăm ông, bà. Bà ngoại Tuấn hay ăn trầu nên đã bảo Tuấn đi xin ít vôi tôi của hàng xóm, Tuấn đã lấy một cái ca bằng nhôm để đựng vôi tôi. Mấy hôm sau, khi bà ngoại Tuấn mang vôi ra ăn trầu thì thấy ca bị thủng và vôi bị chảy hết ra ngoài. Em hãy giúp Tuấn giải thích tại sao ca bằng nhôm đựng vôi tôi lại bị thủng?
⇒ 2A + 3B = 143
⇒ Cặp giá trị phù hợp là A = 28 (-C2H4-) và B = 29 (C2H5-)
%m13,276% %m71,949% %m14,775%
=
0,25 ----HẾT----
2. Mặc dù nhôm là một kim loại khá hoạt động (chỉ sau kim loại kiềm và kiềm thổ) nhưng nhôm vẫn được dùng để chế tạo các dụng cụ nhà bếp như xoong, nồi, … Hãy giải thích ngắn gọn.
3. Dưới đây là sơ đồ chuyển hóa có sự tham gia của nhôm và hợp chất của nhôm.
Al + HCl → A + H2
A + G → D + E + H
A + B + C → D + E
A + NaOH dư → B + C + E
B + H + C → D + G
Xác định các chất A, B, C, D, E, G và H. Viết phương trình hóa học xảy ra.
4. Trong tự nhiên, nhôm có trong quặng boxit. Quặng boxit có chứa Al2O3.2H2O, tạp chất là Fe2O3, SiO2, … Để
sản xuất nhôm, người ta sẽ loại bỏ tạp chất để thu được Al2O3, sau đó tiến hành điện phân nóng chảy (đpnc) với điện cực dương (anot bằng than chì) hỗn hợp Al2O3 và criolit theo phản ứng sau:
2Al2O3 dpnc criolit → 4Al + 3O2
Biết hiệu suất quá trình điện phân là 90% và quặng boxit chứa 25% (về khối lượng) tạp chất không chứa nhôm.
a) Cho biết vai trò của criolit trong quá trình điện phân.
b) Sau một thời gian điện phân, người ta thấy cực dương bị ăn mòn và phải thay thế. Giải thích và viết phương
trình hóa học minh họa.
c) Để điều chế được 54 tấn nhôm thì cần dùng bao nhiêu tấn quặng boxit?
Câu III. Kali và vai trò của kali (2,0 điểm)
Kali là một trong số các nguyên tố hóa học quan trọng đối với cơ thể con người. Thiếu kali, cơ thể đối mặt với
nguy cơ yếu cơ, liệt cơ và rối loạn nhịp tim, … Kali đặc biệt cần thiết cho hệ thần kinh. Sự sụt giảm nồng độ
kali trong máu có thể ảnh hưởng đến khả năng tạo ra xung thần kinh của cơ thể. Kali cũng là nguyên tố rất cần
thiết cho cây trồng, đặc biệt là cho những cây ăn quả
1. Đồng vị là những nguyên tử của cùng một nguyên tố có cùng số proton, khác số nơtron. Trong tự nhiên, kali
có ba loại đồng vị là 39K (93,258%), 40K (0,012%) và 41K (6,730%).
a) Tính nguyên tử khối trung bình của kali.
b) Chuối là một trong những loại hoa quả giàu kali. Khi thi đấu, nhiều vận động viên tennis thường ăn chuối để bổ sung kịp thời lượng kali cho cơ thể. Một quả chuối nặng 150 g chứa 420 mg kali. Tính khối lượng mỗi loại đồng vị của kali trong quả chuối này.
c) Kali luôn có mặt trong máu người với một nồng độ ổn định. Một người trưởng thành nặng 70 kg có lượng máu trong cơ thể là 5 lít, có chứa lượng kali trong máu từ 0,690 – 0,986 g. Tính nồng độ kali (mmol/l) có trong máu người trưởng thành trên.
2. Cây thanh long có nguồn gốc nhiệt đới. Chúng dễ trồng trên nhiều loại đất khác nhau như đất bạc màu (Bình Thuận), đất phèn (đồng bằng sông Cửu Long), đất đỏ (Đồng Nai), … Chất lượng thanh long phụ thuộc nhiều vào phân bón. Chế độ bón giàu đạm, ít kali thường cho trái có độ ngọt kém, mau hư thối, khó bảo quản và vận chuyển. Ngược lại chế độ bón phân cân đối đạm và kali hoặc giàu kali sẽ cho trái có độ ngọt cao hơn, trái cứng chắc và lâu hư thối, dễ bảo quản, vận chuyển. Độ dinh dưỡng của một số loại phân được quy định như sau:
- Độ dinh dưỡng của phân đạm được tính bằng %m(N) có trong phân.
- Độ dinh dưỡng của phân lân được tính bằng %m(P2O5) tương ứng với lượng P có trong phân.
- Độ dinh dưỡng của phân đạm được tính bằng %m(K2O) tương ứng với lượng K có trong phân.
a) Tính độ dinh dưỡng của phân KNO3, biết loại phân này chứa 20% (về khối lượng) tạp chất không chứa kali
và nitơ
b) Bảng dưới đây hướng dẫn liều lượng trộn tỉ lệ các loại phân bón để bón cho cây thanh long.
Giai đoạn phát triển của cây Loại phân bón Thành phần
trước khi thu hoạch
Nguồn: http://chemicalsolutionstech.wordpress.com
Một bác nông dân trộn phân để bón cho thanh long như sau: Trộn 430 g KCl (phân kali) với 1312 g NaNO3 (phân đạm) và 334 g Na3PO4 (phân lân). Cho biết bác nông dân đó chuẩn bị bón phân cho cây thanh long ở giai đoạn nào?
Câu IV. Hiđrocacbon và nhiệt của phản ứng (2,0 điểm)
1. Đốt cháy hoàn toàn 4,16 gam hiđrocacbon A (mạch hở, là chất khí ở điều kiện thường và MA > 26) rồi dẫn hỗn hợp sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được 32 gam kết tủa trắng.
a) Tìm công thức phân tử và viết công thức cấu tạo của A.
b) Dẫn 1,12 lít A (đktc) vào lượng dư dung dịch AgNO3/NH3, thu được m gam kết tủa. Tính m.
2. Biến thiên entanpi của phản ứng (kí hiệu là ∆H) có thể hiểu đơn giản là nhiệt tỏa ra hoặc thu vào khi phản ứng hóa học xảy ra. Nếu phản ứng tỏa nhiệt thì ∆H có dấu âm và ngược lại, nếu phản ứng thu nhiệt thì ∆H có dấu dương.
Khi một phản ứng hóa học xảy ra, các liên kết trong chất phản ứng bị cắt đứt và liên kết mới được hình thành, tạo nên chất sản phẩm. Để tính ∆H của phản ứng, người ta dựa vào năng lượng các liên kết (Elk). Elk là năng lượng cần cung cấp để cắt đứt một liên kết thành các nguyên tử ở thể khí. Năng lượng tỏa ra khi hình thành liên
kết đó từ các nguyên tử ở thể khí cũng có giá trị bằng giá trị của Elk nhưng có dấu ngược lại. Elk của một số liên
kết được cho trong bảng sau:
Liên kết C≡C C-C C-H H-H Elk (kJ/mol) 839,0 343,3 418,4 432,0
Xét phản ứng:
Dựa vào bảng số liệu trên hãy:
C2H2 + 2H2 → C2H6 (1)
a) Tính năng lượng cần cung cấp để phá vỡ liên kết của các chất tham gia trong phản ứng (1) (lưu ý hệ số của các chất trong phương trình phản ứng).
b) Tính năng lượng tỏa ra khi hình thành các liên kết trong chất sản phẩm của phản ứng (1).
c) Từ các kết quả trên, xác định ∆H của phản ứng (1) và cho biết phản ứng (1) tỏa nhiệt hay thu nhiệt?
Câu V. Axit hữu cơ, este và tác nhân phản ứng (2,0 điểm)
1. Axit X (chỉ chứa C, H, O trong phân tử) là một hợp chất hữu cơ sinh học. Khi vận động mạnh trong một thời gian dài và cơ thể không được cung cấp đủ oxi, glucozơ trong cơ thể sẽ bị chuyển hóa thành axit X. Axit X sinh ra trong quá trình vận động là nguyên nhân chính tạo ra cảm giác mỏi ở cơ bắp. Axit X cũng có mặt trong sữa chua và dưa muối.
a) Bằng phương pháp phổ khối lượng MS, người ta xác định được phân tử khối của X là 90. Bằng các phương pháp phổ hiện đại khác như phổ hồng ngoại IR và phổ cộng hưởng từ hạt nhân NMR, người ta xác định được phân tử của X chứa các nhóm chức –OH và –COOH cùng liên kết với một nguyên tử cacbon. Xác định công thức phân tử và công thức cấu tạo của X.
b) Nêu một biện pháp đơn giản giúp vận động viên giảm cảm giác mỏi cơ do axit X bị tích tụ nhiều trong quá trình tập luyện thể thao.
c) Để axit X trong bình phản ứng, cho thêm vài giọt axit sunfuric đặc (làm xúc tác), rồi đun nóng. Sau một thời gian, thu được hỗn hợp các chất, trong đó có hợp chất hữu cơ Y. Trong phân tử Y, nguyên tố oxi chiếm 44,44% về khối lượng và phân tử khối của Y nằm trong khoảng từ 75 đến 150. Xác định công thức phân tử, công thức cấu tạo của Y. Viết phương trình hóa học của phản ứng tạo ra chất Y.
cơ.
a) Bằng phương pháp phân tích nguyên tố người ta xác định được thành phần phần trăm về khối lượng của N và
H trong Z lần lượt là 87,5% và 12,5%. Do điều kiện thí nghiệm không đầy đủ nên người ta chỉ xác định được
phân tử khối của Z nằm trong khoảng 30 đến 40. Viết công thức cấu tạo của chất Z.
b) Biết chất Z có tính khử, viết phương trình hóa học xảy ra khi cho Z phản ứng với Cl2
c) Ngoài việc thu được chất Y khi nhỏ axit sunfuric vào axit X (trong Câu V.1, ý c ở trên), người ta còn thu
được chất hữu cơ T. Quá trình hình thành và chuyển hóa T (có sử dụng tác nhân Z) thành chất hữu cơ Q như
sau:
X
SỞ GIÁO DỤC VÀ ĐÀO T
ẠO (Đề thi gồm có 2 trang)
KỲ THI TUYỂN SINH 10 THPT
NĂM HỌC 2022 – 2023
Môn: HÓA HỌC (CHUYÊN 10)
o 24
HSO,t HO → T o 324
CHOH/HSO,t HO → P 3
Z CHOH → Q
2
2
Dự đoán công thức cấu tạo của chất T, P và Q, biết trong phân tử của Q, N chiếm 32,56% về khối lượng.
-------------------- HẾT ----------------------
Thí sinh được phép sử dụng bảng tuần hoàn các nguyên tố hóa học, không được sử dụng tài liệu.
Cán bộ coi thi không giải thích gì thêm.
Họ và tên thí sinh: …………………………………………. Số báo danh: …………
Câu I. Các hợp chất vô cơ (2,0 điểm)
1. Cho các chuyển hóa sau:
BaCO3 o → X + M
2NaOH + M → Y + H2O
NH3 + HCl → Z
NH3 + HNO3 → T
a) Xác định các chất X, Y, Z, T và M
Thời gian làm bài 150 phút không kể thời gian giao đề
b) Cho đồng thời các chất X, Y, Z, T có cùng số mol vào trong một lượng nước dư, rồi đun nhẹ thu được khí A, dung dịch B và kết tủa C. Xác định các chất có trong A, B và C. Viết các phương trình hóa học xảy ra.
2. Chia 76,8 gam hỗn hợp F gồm Mg và Fe thành hai phần bằng nhau:
- Cho phần 1 vào dung dịch HCl dư, thu được 17,92 lít H2 (đktc).
- Cho phần 2 vào 0,6 lít dung dịch Cu(NO3)2 aM, thu được dung dịch G và b gam chất rắn H. Cho dung dịch G vào dung dịch NaOH dư, lọc lấy kết tủa rồi nung đến khối lượng không đổi, thu được 40 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Tính các giá trị a và b.
GIẢI:
1.
a) X: BaO, Y: Na2CO3, Z: NH4Cl, T: NH4NO3, M: CO2.
b) Đặt số mol mỗi chất là 1 mol.
BaO + H2O → Ba(OH)2
1 1 Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
1 1 2
NaOH + NH4Cl → NaCl + NH3↑ + H2O
1 1 1
NaOH + NH4NO3 → NaNO3 + NH3↑ + H2O
1 1 1
Vậy khí A là NH3, dung dịch B gồm NaCl và NaNO3, kết tủa C là BaCO3
2.
Khối lượng mỗi phần = 76,8 : 2 = 38,4 gam.
Đặt số mol trong mỗi phần của Mg là x, Fe là y. + Phần 1:
2H n0,8 = mol → x + y = 0,8 (1)
Mà 24x + 56y = 38,4 (2)
Giải (1) và (2) ta có: x = 0,2 và y = 0,6
+ Phần 2:
Giả sử rắn chỉ gồm MgO → nMgO = 1,0 mol > 0,8 loại → Cu2+ hết, Fe dư
Vậy rắn gồm
MgO (x mol) và Fe2O3 (z mol)
Mg + Cu2+ → Mg2+ + Cu
0,2 0,2 0,2 0,2
Fe + Cu2+ → Fe2+ + Cu
0,6 (0,6a – 0,2) (0,6a – 0,2) (0,6a – 0,2) (0,6a – 0,2) (0,6a – 0,2) (0,8-0,6a) 0
Mà 23MgOFeO mm40 += ↔ 40.0,2 + 160.(0,3a-0,1) = 40 → a = 1
Ta có: b = mCu + mFe (dư) = 64.0,6 + 56.0,2 = 49,6 (gam)
Câu II. Nhôm và hợp chất của nhôm (2,0 điểm)
Nhôm là kim loại màu trắng bạc, mềm, dễ kéo sợi, dát mỏng, dẫn điện và dẫn nhiệt tốt. Nhôm có thể
được dát thành giấy nhôm dùng để gói thực phẩm. Nhôm và hợp kim của nhôm có đặc tính nhẹ, bền với không khí và nước, được dùng làm vật liệu chế tạo máy bay, ô tô, tên lửa, tàu vũ trụ, các vật dụng với cuộc sống, ….
1. Mùa hè năm ngoái, bạn Tuấn được bố mẹ cho về quê ngoại thăm ông, bà. Bà ngoại Tuấn hay ăn trầu nên đã bảo Tuấn đi xin ít vôi tôi của hàng xóm, Tuấn đã lấy một cái ca bằng nhôm để đựng vôi tôi. Mấy hôm sau, khi bà ngoại Tuấn mang vôi ra ăn trầu thì thấy ca bị thủng và vôi bị chảy hết ra ngoài. Em hãy giúp Tuấn giải thích tại sao ca bằng nhôm đựng vôi tôi lại bị thủng?
2. Mặc dù nhôm là một kim loại khá hoạt động (chỉ sau kim loại kiềm và kiềm thổ) nhưng nhôm vẫn được dùng để chế tạo các dụng cụ nhà bếp như xoong, nồi, … Hãy giải thích ngắn gọn.
3. Dưới đây là sơ đồ chuyển hóa có sự tham gia của nhôm và hợp chất của nhôm.
Al + HCl → A + H2
A + G → D + E + H
A + B + C → D + E
A + NaOH dư → B + C + E
B + H + C → D + G Xác định các chất A, B, C, D, E, G và H. Viết phương trình hóa học xảy ra.
4. Trong tự nhiên, nhôm có trong quặng boxit. Quặng boxit có chứa Al2O3.2H2O, tạp chất là Fe2O3, SiO2, … Để sản xuất nhôm, người ta sẽ loại bỏ tạp chất để thu được Al2O3, sau đó tiến hành điện phân nóng chảy (đpnc) với điện cực dương (anot bằng than chì) hỗn hợp Al2O3 và criolit theo phản ứng sau:
2Al2O3 dpnc criolit → 4Al + 3O2
Biết hiệu suất quá trình điện phân là 90% và quặng boxit chứa 25% (về khối lượng) tạp chất không chứa nhôm.
a) Cho biết vai trò của criolit trong quá trình điện phân.
b) Sau một thời gian điện phân, người ta thấy cực dương bị ăn mòn và phải thay thế. Giải thích và viết phương trình hóa học minh họa.
c) Để điều chế được 54 tấn nhôm thì cần dùng bao nhiêu tấn quặng boxit?
GIẢI:
1.
Vôi tôi là Ca(OH)2
Khi đựng vôi tôi vào ca bằng nhôm xảy ra các phản ứng sau:
Al2O3 + Ca(OH)2 → Ca(AlO2)2 + H2O
2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2
Ca nhôm bị ăn mòn dần theo các PTHH ở trên nên khiến ca bị thủng.
2. Kim loại nhôm dễ dàng phản ứng với O2 trong không khí để tạo Al2O3 che phủ xung quanh bề mặt kim loại nhôm. Các vật dụng và dụng cụ nhà bếp bằng nhôm luôn được bảo vệ bởi một lớp màng oxit nhôm rất mỏng và bền, ngăn không cho nước và không khí thấm qua. Mặt khác, nhiệt độ nóng chảy của Al2O3 rất cao so với nhiệt độ ngọn lửa nên nó không bị phá hủy khi đun nấu.
A: AlCl3, B: NaAlO2, C: H2O, D: Al(OH)3, E: NaCl, G: NaHCO3 và H: CO2
2Al + 6HCl → 2AlCl3 + 3H2
AlCl3 + 3NaHCO3 → Al(OH)3 + 3NaCl + 3CO2
AlCl3 + 3NaAlO2 + 6H2O → 4Al(OH)3 + 3NaCl
AlCl3 + 4NaOH dư → NaAlO2 + 2H2O + 3NaCl
NaAlO2 + CO2 + H2O → Al(OH)3 + NaHCO3
4.
a) Vai trò của criolit trong quá trình điện phân:
+ Làm giảm nhiệt độ nóng chảy của Al2O3 → Tiết kiệm năng lượng.
+ Làm tăng độ dẫn điện của Al2O3 nóng chảy.
+ Tạo lớp ngăn cách để bảo vệ nhôm nóng chảy.
b) Trong quá trình điện phân, O2 sinh ra tại cực dương, tại đây xảy ra phản ứng ăn mòn điện cực than chì:
C + O2 → CO2.
Do đó sau một thời gian điện phân, người ta thấy cực dương bị ăn mòn và phải thay thế.
c) Ta có: Al2O3 → 2Al
102 g → 54 g
? tấn → 54 tấn
→ Khối lượng quặng boxit cần dùng là: 102.100.100 90.75 = 151,11 tấn.
Câu III. Kali và vai trò của kali (2,0 điểm)
Kali là một trong số các nguyên tố hóa học quan trọng đối với cơ thể con người. Thiếu kali, cơ thể đối mặt với nguy cơ yếu cơ, liệt cơ và rối loạn nhịp tim, … Kali đặc biệt cần thiết cho hệ thần kinh. Sự sụt giảm nồng độ kali trong máu có thể ảnh hưởng đến khả năng tạo ra xung thần kinh của cơ thể. Kali cũng là nguyên tố rất cần thiết cho cây trồng, đặc biệt là cho những cây ăn quả
1. Đồng vị là những nguyên tử của cùng một nguyên tố có cùng số proton, khác số nơtron. Trong tự nhiên, kali có ba loại đồng vị là 39K (93,258%), 40K (0,012%) và 41K (6,730%).
a) Tính nguyên tử khối trung bình của kali.
b) Chuối là một trong những loại hoa quả giàu kali. Khi thi đấu, nhiều vận động viên tennis thường ăn chuối để bổ sung kịp thời lượng kali cho cơ thể. Một quả chuối nặng 150 g chứa 420 mg kali. Tính khối lượng mỗi loại đồng vị của kali trong quả chuối này.
c) Kali luôn có mặt trong máu người với một nồng độ ổn định. Một người trưởng thành nặng 70 kg có lượng máu trong cơ thể là 5 lít, có chứa lượng kali trong máu từ 0,690 – 0,986 g. Tính nồng độ kali (mmol/l) có trong máu người trưởng thành trên.
2. Cây thanh long có nguồn gốc nhiệt đới. Chúng dễ trồng trên nhiều loại đất khác nhau như đất bạc màu (Bình Thuận), đất phèn (đồng bằng sông Cửu Long), đất đỏ (Đồng Nai), … Chất lượng thanh long phụ thuộc nhiều vào phân bón. Chế độ bón giàu đạm, ít kali thường cho trái có độ ngọt kém, mau hư thối, khó bảo quản và vận chuyển. Ngược lại chế độ bón phân cân đối đạm và kali hoặc giàu kali sẽ cho trái có độ ngọt cao hơn, trái cứng chắc và lâu hư thối, dễ bảo quản, vận chuyển. Độ dinh dưỡng của một số loại phân được quy định như sau:
- Độ dinh dưỡng của phân đạm được tính bằng %m(N) có trong phân.
- Độ dinh dưỡng của phân lân được tính bằng %m(P2O5) tương ứng với lượng P có trong phân.
- Độ dinh dưỡng của phân đạm được tính bằng %m(K2O) tương ứng với lượng K có trong phân.
a) Tính độ dinh dưỡng của phân KNO3, biết loại phân này chứa 20% (về khối lượng) tạp chất không chứa kali và nitơ
b) Bảng dưới đây hướng dẫn liều lượng trộn tỉ lệ các loại phân bón để bón cho cây thanh long.
Ngu
n: http://chemicalsolutionstech.wordpress.com
225 KONPO m:m:m271,3:216,1:144,61,88:1,50:1135:108 :72 ===
Câu IV. Hiđrocacbon và nhiệt của phản ứng (2,0 điểm)
1. Đốt cháy hoàn toàn 4,16 gam hiđrocacbon A (mạch hở, là chất khí ở điều kiện thường và MA > 26)
rồi dẫn hỗn hợp sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được 32 gam kết tủa trắng.
a) Tìm công thức phân tử và viết công thức cấu tạo của A.
b) Dẫn 1,12 lít A (đktc) vào lượng dư dung dịch AgNO3/NH3, thu được m gam kết tủa. Tính m.
2. Biến thiên entanpi của phản ứng (kí hiệu là ∆H) có thể hiểu đơn giản là nhiệt tỏa ra hoặc thu vào khi
phản ứng hóa học xảy ra. Nếu phản ứng tỏa nhiệt thì ∆H có dấu âm và ngược lại, nếu phản ứng thu
nhiệt thì ∆H có dấu dương.
Khi một phản ứng hóa học xảy ra, các liên kết trong chất phản ứng bị cắt đứt và liên kết mới được hình thành, tạo nên chất sản phẩm. Để tính ∆H của phản ứng, người ta dựa vào năng lượng các liên kết (Elk). Elk là năng lượng cần cung cấp để cắt đứt một liên kết thành các nguyên tử ở thể khí. Năng lượng tỏa ra khi hình thành liên kết đó từ các nguyên tử ở thể khí cũng có giá trị bằng giá trị của Elk nhưng có dấu ngược lại. Elk của một số liên kết được cho trong bảng sau:
M
t bác nông dân trộn phân để bón cho thanh long như sau: Trộn 430 g KCl (phân kali) với 1312 g NaNO3 (phân đạm) và 334 g Na3PO4 (phân lân). Cho biết bác nông dân đó chuẩn bị bón phân cho cây thanh long ở giai đoạn nào?
GIẢI:
1.
a) K 39.93,25840.0,01241.6,730
M 100 ++ = = 39,135
b) 39 K 42093,258 m..39390,33 39,135100 == mg
40 K 4200,012
m..400,05 39,135100 == mg
41 K 4206,73
m..4129,61 39,135100 == mg
c) Nồng độ kali trong màu người này trong khoảng từ
2.
a) Xét 100 gam phân KNO3 có 3KNO m80 = gam
→ 3KNO 80 nmol 101 = → 2 KO 180 n.mol 2101 = → 2 KO 180 %m..9437,23% 2101 ==
b)
2 KO 1430
m..94271,3 274,5 == gam
N 1312
Liên kết C≡C C-C C-H H-H
Elk (kJ/mol) 839,0 343,3 418,4 432,0 Xét phản ứng:
Dựa vào bảng số liệu trên hãy:
C2H2 + 2H2 → C2H6 (1)
a) Tính năng lượng cần cung cấp để phá vỡ liên kết của các chất tham gia trong phản ứng (1) (lưu ý hệ số của các chất trong phương trình phản ứng).
b) Tính năng lượng tỏa ra khi hình thành các liên kết trong chất sản phẩm của phản ứng (1).
c) Từ các kết quả trên, xác định ∆H của phản ứng (1) và cho biết phản ứng (1) tỏa nhiệt hay thu nhiệt?
GIẢI:
1.
a) 2CO n0,32 = mol → 2 HO 4,160,32.12 n0,16 2 ==
→nC : nH = 0,32 : 0,32 = 1 : 1
Đặt công thức của hiđrocacbon A là CxHx (MA > 26, x ≤4 và chẵn ), ta có bảng sau:
x 2 4
CTPT C2H2 C4H4
M 26 (loại) 52 (t/m)
Vậy CTPT của A là C4H4 Các CTCT có thể có của A (∆ = 3), mạch hở là CH≡C-CH=CH2 hoặc CH2=C=C=CH2.
b) Vì A có phản ứng với dung dịch AgNO3/NH3 nên CTCT của A là CH≡C-CH=CH2.
A 1,12 n0,05 22,4 == mol
→ Khối lượng kết tủa CAg≡C-CH=CH2 = 0,05.159 = 7,95 gam.
2.
m..142144,6 2164 == gam
m.14216,1 85 == gam 25PO 1334
So sánh bảng trên ta thấy, lượng phân kali và đạm bón nhiều, lân bón ít ứng với giai đoạn cây thanh
long khi có trái non đang phát triển Kiểm tra
a) Năng lượng cần cung cấp để phá vỡ liên kết của các chất tham gia trong phản ứng (1) là
Elk (đầu) = 2.418,4 + 839,0 + 2.432,0 = 2539,8 (kJ/mol)
b) Năng lượng tỏa ra khi hình thành các liên kết trong chất sản phẩm của phản ứng (1)
Elk (cuối) = 343,3 + 6.418,4 = 2853,7 (kJ/mol)
c) ∆H = Elk (đầu) - Elk (cuối) = 2539,8 – 2853,7 = - 313,9 (kJ/mol) < 0
Vậy (1) là phản ứng tỏa nhiệt, năng lượng tỏa ra của phản ứng (1) là 313,9 (kJ/mol).
Câu V. Axit hữu cơ, este và tác nhân phản ứng (2,0 điểm)
1. Axit X (chỉ chứa C, H, O trong phân tử) là một hợp chất hữu cơ sinh học. Khi vận động mạnh trong một thời gian dài và cơ thể không được cung cấp đủ oxi, glucozơ trong cơ thể sẽ bị chuyển hóa thành
axit X. Axit X sinh ra trong quá trình vận động là nguyên nhân chính tạo ra cảm giác mỏi ở cơ bắp.
Axit X cũng có mặt trong sữa chua và dưa muối.
a) Bằng phương pháp phổ khối lượng MS, người ta xác định được phân tử khối của X là 90. Bằng các phương pháp phổ hiện đại khác như phổ hồng ngoại IR và phổ cộng hưởng từ hạt nhân NMR, người ta xác định được phân tử của X chứa các nhóm chức –OH và –COOH cùng liên kết với một nguyên tử cacbon. Xác định công thức phân tử và công thức cấu tạo của X
b) Nêu một biện pháp đơn giản giúp vận động viên giảm cảm giác mỏi cơ do axit X bị tích tụ nhiều trong quá trình tập luyện thể thao.
c) Để axit X trong bình phản ứng, cho thêm vài giọt axit sunfuric đặc (làm xúc tác), rồi đun nóng. Sau một thời gian, thu được hỗn hợp các chất, trong đó có hợp chất hữu cơ Y. Trong phân tử Y, nguyên tố oxi chiếm 44,44% về khối lượng và phân tử khối của Y nằm trong khoảng từ 75 đến 150. Xác định công thức phân tử, công thức cấu tạo của Y. Viết phương trình hóa học của phản ứng tạo ra chất Y.
2. Chất Z là một tác nhân hóa học được dùng nhiều trong tổng hợp hữu cơ a) Bằng phương pháp phân tích nguyên tố người ta xác định được thành phần phần trăm về khối lượng
của N và H trong Z lần lượt là 87,5% và 12,5%. Do điều kiện thí nghiệm không đầy đủ nên người ta
chỉ xác định được phân tử khối của Z nằm trong khoảng 30 đến 40. Viết công thức cấu tạo của chất Z
b) Biết chất Z có tính khử, viết phương trình hóa học xảy ra khi cho Z phản ứng với Cl2
c) Ngoài việc thu được chất Y khi nhỏ axit sunfuric vào axit X (trong Câu V.1, ý c ở trên), người ta
còn thu được chất hữu cơ T. Quá trình hình thành và chuyển hóa T (có sử dụng tác nhân Z) thành chất hữu cơ Q như sau:
X o 24
HSO,t HO → T o 324
CHOH/HSO,t HO → P 3
Z CHOH → Q
PTHH: C3H6O3 o t → C6H8O4 + 2H2O
Kiểm tra lại: %mO = 16.4 .100% 144 = 44,44% (thỏa mãn đề bài)
Vậy CTPT của Y là C6H8O4.
CTCT của Y là
2.
a) Ta có: N : H = 87,512,5:1:2 141 =
Vì 30 < MZ < 40 nên Z chỉ có 1 hoặc 2 nguyên tử N, vì số H chẵn nên số N cũng phải chẵn
→ Z phải có 2 nguyên tử N → CTPT của Z là N2H4
CTCT của Z là NH2─NH2
b) N2H4 + Cl2 → N2 + HCl


c) CTCT của các chất:
T là CH3-CH(OH)-COOCH(CH3)COOH hoặc CH2=CH-COOCH(CH3)COOH
P là CH3-CH(OH)-COOCH(CH3)COOCH3 hoặc CH2=CH-COOCH(CH3)COOCH3
Vì trong Q có N chiếm 32,56%, mà Q phải có 2 nguyên tử N nên MQ = 86 → Q là CH2=CH-CONHNH2 ----------------------- HẾT ---------------------
2
2
Dự đoán công thức cấu tạo của chất T, P và Q, biết trong phân tử của Q, N chiếm 32,56% về khối lượng.
GIẢI:
1.
a) Vì MX = 90 nên X chỉ có thể chứa 1 nhóm –OH và 1 nhóm –COOH.
Đặt CT của X là R(OH)(COOH) → MR = 28
→CTPT phù hợp của X là: C2H4(OH)(COOH) hay C3H6O3
CTCT phù hợp: CH3-CH(OH)COOH
Hay
b) Một số biện pháp giúp hạn chế tích tụ axit lactic gây mỏi cơ:
- Uống đủ nước.
- Nghỉ ngơi giữa các buổi tập.
- Thực hiện bài tập thở.
- Làm nóng và giãn cơ để hạn chế tích tụ axit lactic.
- Bổ sung magie.
- Uống nước cam (để tạo môi trường kiềm) trước khi tập.
c) Khi có mặt axit sunfuric đặc (làm xúc tác), axit lactic sẽ thực hiện phản ứng este hóa. Dễ thấy 90.2
– 150 >18 nên sản phẩm tạo thành phải là este vòng, 2 chức.
ĐỀ CHÍNH THỨC
MÔN THI: HÓA HỌC
Thời gian làm bài: 150 phút (Không kể thời gian phát đề)
Đề thi gồm: 2 trang
Câu 1: (1,5 điểm)
1. Cho cấu tạo lớp vỏ electron của nguyên tử thuộc các nguyên tố kí hiệu X1, X2, X3, X4, X5 như sau:
1. A1 và A2 là hợp chất của Na, trong phân tử chỉ chứa hai nguyên tố và đều có hàm lượng Na là
58,97% theo khối lượng. A1 là chất khử mạnh còn A2 là chất oxi hóa mạnh. A1 phản ứng với dung
dịch KMnO4 trong H2SO4 loãng tạo nên chất rắn màu vàng nhạt B1. Phản ứng tương tự của A2 với
KMnO4 tạo nên khí không màu B2. Biết B1 và B2 là đơn chất của hai nguyên tố cùng nhóm trong
bảng tuần hoàn các nguyên tố hóa học.
a) Xác định A1, A2, B1, B2 và viết các phương trình phản ứng.
b) Tìm các chất từ C1 đến C5 và D1 đến D4 trong sơ đồ chuyển hóa sau. (Không cần viết phương trình phản ứng)
C4
Trong số các nguyên tố trên, hãy cho biết:
a) Nguyên tố nào thuộc nhóm II của bảng tuần hoàn các nguyên tố hóa học?
b) Nguyên tố nào có 13 proton ở hạt nhân nguyên tử?
c) Nguyên tố nào phản ứng với kim loại kiềm theo tỉ lệ mol 1:1?
d) Nguyên tố nào ở chu kì 4, nhóm I?
2. Viết các phương trình phản ứng xảy ra trong các thí nghiệm sau:
a) Cho dung dịch Na2CO3 vào dung dịch AlCl3, thu được kết tủa trắng và khí thoát ra.
b) Hòa tan hoàn toàn MgO trong dung dịch NH4Cl đặc thấy thoát khí mùi khai.
3. Trình bày phương pháp hóa học để làm sạch:
a) Khí CO2 có lẫn tạp chất SO2
b) Khí H2S có lẫn tạp chất HCl.
4. Tinh thể muối ngậm nước FeSO4.xH2O được điều chế bằng cách cho lượng dư muối sắt (II)
cacbonat phản ứng với dung dịch axit sunfuric loãng theo quy trình sau: Thêm từng lượng nhỏ sắt (II)
cacbonat đến dư vào dung dịch axit sunfuric loãng. Sau đó, lọc hỗn hợp phản ứng để thu lấy dung dịch.
Đun nóng dung dịch đến khi thu được dung dịch bão hòa rồi để nguội. Lọc thu lấy tinh thể chất rắn và
thấm khô bằng giấy lọc.
a) Tại sao phải dùng lượng dư sắt (II) cacbonat?
b) Hãy chỉ ra dấu hiệu cho thấy lượng sắt (II) cacbonat đã dư
c) Hãy cho biết hóa chất nào có thể thay thế sắt (II) cacbonat trong quy trình trên.
d) Biết Fe chiếm 20,14% khối lượng của FeSO4.xH2O. Hãy xác định x.
Câu II. (3,0 điểm)
A2, t0C H2O B2, xt, t0C
Ca(OH)2
C5
C2 D3 D1 0 tC → C1 C3 C4 D2 D4 Cho biết các hợp chất từ D1, D2, D3 và D4 đều có 1 nguyên tử S trong công thức hóa học và đều có hàm lượng S là 26,67% theo khối lượng.
2. Cho 12,8 gam bột lưu huỳnh phản ứng với 41,4 gam K2CO3 ở nhiệt độ cao thu được 6,72 lít khí E1 (ở đktc) và hỗn hợp rắn X chỉ gồm hai muối E2 và E3. Biết muối E2 và nguyên tố kali lần lượt chiếm 53,66% và 57,07% khối lượng của X. Muối E2 tạo nên từ hai nguyên tố. Khối lượng mol của E3 nhỏ hơn 200 g/mol. Xác định E1, E2, E3 và viết phương trình phản ứng xảy ra.
3. Thêm từ từ dung dịch Y chứa AlCl3 0,3 M và HCl 0,2 M vào 100 ml dung dịch NaOH 1,54 M. Tính thể tích dung dịch Y trong các trường hợp sau:
a) Kết tủa trắng bắt đầu xuất hiện.
b) Lượng kết tủa trắng lớn nhất.
c) Sau khi phản ứng kết thúc, thu được 1,638 gam kết tủa.
Câu III: (1,5 điểm)
Cho 0,864 gam hỗn hợp kim loại Fe và Cu tác dụng với 250 ml dung dịch A chứa đồng thời Fe(NO3)3 và AgNO3, thu được m1 gam chất rắn X và dung dịch B. Cô cạn dung dịch B rồi nung cặn rắn trong
bình kín (không có không khí) tới khối lượng không đổi, thu được 2,4 gam chất rắn Y và hỗn hợp khí
Z. Hấp thụ hoàn toàn Z vào nước tạo dung dịch C. Dung dịch này phản ứng vừa đủ với 130 ml dung dịch NaOH 0,5 M thu được hai muối với tỉ lệ mol 23:3. Biết các phản ứng xảy ra hoàn toàn.
a) Xác định phần trăm khối lượng các chất trong Y
b) Xác định m1 và nồng độ mol các chất trong A
Câu IV: (2,5 điểm)
1. Tương tự như metan, các ankan (CnH2n+2) phản ứng với khí clo khi chiếu sáng tạo ra cloankan (CnH2n+2-xClx) bằng cách thay thế nguyên tử H bằng nguyên tử Cl (gọi là phản ứng clo hóa).
a) Vẽ công thức cấu tạo của các sản phẩm có công thức phân tử C3H6Cl2 từ phản ứng clo hóa C3H8.
b) Khi clo hóa ankan G1 và G2 có cùng công thức phân tử C5H12, G1 chỉ cho một sản phẩm còn G2 cho ba sản phẩm đều có công thức phân tử C5H11Cl. Vẽ công thức cấu tạo của G1, G2 và các sản phẩm này.
2. Anken mạch hở là các hợp chất có công thức phân tử CmH2m, chứa liên kết đôi C=C trong phân tử. Dãy hợp chất này thể hiện tính chất hóa học đặc trưng tương tự etilen như phản ứng cộng Br2, phản ứng trùng hợp.
a) Quá trình “bẻ gãy” các ankan có khối lượng phân tử lớn hơn tạo thành anken và ankan có khối lượng phân tử nhỏ hơn gọi là quá trình “cracking” thường dùng trong hóa học dầu mỏ. Cracking ankan dưới đây thu được C3H8 và hai anken mạch không phân nhánh G3, G4 có cùng công thức phân tử C5H10.
CH3
H3C H2C CH2 CH CH2 CH2 CH3 cracking → C3H8 + C5H10 - Vẽ công thức cấu tạo của hai anken G3 và G4.
- Phản ứng trùng hợp giữa hai anken G3 và G4 tạo nên polime T. Vẽ các công thức cấu tạo có thể có
của đoạn mạch trong T tạo thành bởi sự liên kết một phân tử G3 và một phân tử G4 .
b) Tách loại nguyên tử H và nguyên tử Cl liên kết với hai nguyên tử C cạnh nhau trong cloankan tạo
thành anken tương ứng. Khi tiến hành tách loại H và Cl từ hợp chất G5 có công thức phân tử C7H15Cl
thì chỉ thu được duy nhất sản phẩm G6 (C7H14). Biết rằng, G5 là một sản phẩm được tạo ra bởi phản
ứng clo hóa U (C7H16). G5 và U đều chứa ba nhóm CH3 trong phân tử. Vẽ công thức cấu tạo của G5 và G6.
Câu V. (1,5 điểm) phụ gia thực phẩm để tạo hương vị và bảo quản. Axit malic chứa hai nhóm cacboxyl và một nhóm OH trong phân tử nên thể hiện tính chất hóa học của cả ancol và axit. Khi đun nóng axit malic trong ancol etylic có mặt axit sunfuric thì thu được các chất H1, H2 và H3 trong đó H1 không làm sủi bọt dung dịch Na2CO3. H2 và H3 đều chứa 44,44% khối lượng cacbon trong phân tử. Mặt khác, đun nóng axit malic trong sự có mặt của axit sunfuric thì thu được ba sản phẩm H4, H5 và H6 đều làm sủi bọt dung dịch Na2CO3. Chất H4 (có vòng 6 cạnh) chứa 55,17% khối lượng oxi trong phân tử H5 và H6 đều chứa 38,40% khối lượng cacbon trong phân tử. Vẽ công thức cấu tạo của các chất từ H1 đến H6.
Cho biết: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; K = 39; Ca = 40; Mn = 55; Fe = 56; Cu = 64; Ag = 108.
HẾT
Cán bộ coi thi không giải thích gì thêm.
ĐẠI HỌC QUỐC GIA HÀ NỘI
TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN
HD CHÍNH THỨC
Câu 1: (1,5 điểm)
TRƯỜNG THPT CHUYÊN KHTN NĂM 2022
MÔN THI: HÓA HỌC
Thời gian làm bài: 150 phút (Không kể thời gian phát đề)
1. Cho cấu tạo lớp vỏ electron của nguyên tử thuộc các nguyên tố kí hiệu X1, X2, X3, X4, X5 như

sau:
Trong số các nguyên tố trên, hãy cho biết:
a) Nguyên tố nào thuộc nhóm II của bảng tuần hoàn các nguyên tố hóa học?
b) Nguyên tố nào có 13 proton ở hạt nhân nguyên tử?
c) Nguyên tố nào phản ứng với kim loại kiềm theo tỉ lệ mol 1:1?
d) Nguyên tố nào ở chu kì 4, nhóm I?
2. Viết các phương trình phản ứng xảy ra trong các thí nghiệm sau:
a) Cho dung dịch Na2CO3 vào dung dịch AlCl3, thu được kết tủa trắng và khí thoát ra.
b) Hòa tan hoàn toàn MgO trong dung dịch NH4Cl đặc thấy thoát khí mùi khai.
3. Trình bày phương pháp hóa học để làm sạch:
a) Khí CO2 có lẫn tạp chất SO2.
b) Khí H2S có lẫn tạp chất HCl.
4. Tinh thể muối ngậm nước FeSO4.xH2O được điều chế bằng cách cho lượng dư muối sắt (II)
cacbonat phản ứng với dung dịch axit sunfuric loãng theo quy trình sau: Thêm từng lượng nhỏ sắt (II)
cacbonat đến dư vào dung dịch axit sunfuric loãng. Sau đó, lọc hỗn hợp phản ứng để thu lấy dung dịch. Đun nóng dung dịch đến khi thu được dung dịch bão hòa rồi để nguội. Lọc thu lấy tinh thể chất rắn và thấm khô bằng giấy lọc.
a) Tại sao phải dùng lượng dư sắt (II) cacbonat?
b) Hãy chỉ ra dấu hiệu cho thấy lượng sắt (II) cacbonat đã dư.
c) Hãy cho biết hóa chất nào có thể thay thế sắt (II) cacbonat trong quy trình trên.
d) Biết Fe chiếm 20,14% khối lượng của FeSO4.xH2O. Hãy xác định x. GIẢI
a) Nguyên tố thuộc nhóm II của bảng tuần hoàn các nguyên tố hóa học: X3 (vì có 2 electron ở lớp ngoài cùng)
b) Nguyên tố có 13 proton ở hạt nhân nguyên tử: X4 (vì lớp vỏ có 13 electron)
c) Nguyên tố phản ứng với kim loại kiềm theo tỉ lệ mol 1:1: X5 (vì có 7 electron lớp ngoài cùng)
d) Nguyên tố ở chu kì 4, nhóm I: X1 (vì có 1 electron ở lớp ngoài cùng)
2. Viết các phương trình phản ứng xảy ra trong các thí nghiệm sau:
a) Cho dung dịch Na2CO3 vào dung dịch AlCl3, thu được kết tủa trắng (Al(OH)3) và khí thoát ra (CO2):
3Na2CO3 + 2AlCl3 + 3H2O → 6NaCl + 2Al(OH)3↓ + 3CO2↑
b) Hòa tan hoàn toàn MgO trong dung dịch NH4Cl đặc thấy thoát khí mùi khai (NH3):
MgO + 2NH4Cl → MgCl2 + 2NH3↑ + H2O
3. Trình bày phương pháp hóa học để làm sạch:
a) Khí CO2 có lẫn tạp chất SO2:
Dẫn hỗn hợp đi qua dung dịch nước brom dư, khí SO2 có phản ứng nên bị giữ lại, còn CO2 không phản ứng nên thoát ra, thu lấy khí CO2 tinh khiết bằng phương pháp dời chỗ không khí:
SO2 + Br2 + H2O → 2HBr + H2SO4
b) Khí H2S có lẫn tạp chất HCl:
Dẫn hỗn hợp đi qua dung dịch NaHS dư, khí HCl bị giữ lại, còn H2S không phản ứng nên thoát ra, thu lấy khí H2S tinh khiết bằng phương pháp dời chỗ không khí:
NaHS + HCl → NaCl + H2S↑
4. Phương trình phản ứng xảy ra:
FeCO3 + H2SO4 → FeSO4 + CO2↑ + H2O
a) Phải dùng lượng dư sắt (II) cacbonat vì FeSO4 rất dễ tác dụng với oxi của không khí, nên sẽ không thu
được sản phẩm mong muốn:
4FeSO4 + 2H2SO4 + 2O2 → 2Fe2(SO4)3 + 2H2O
b) Dấu hiệu cho thấy lượng sắt (II) cacbonat đã dư: Khi không còn thấy bọt khí thoát ra nữa chứng tỏ
muối cacbonat đã hết.
c) Có thể thay thế sắt (II) cacbonat trong quy trình trên bằng sắt: FeSO3, FeS.
d) Xác định x:
%mFe = 56 .100% 15218.x + = 20,14% x = 7.
Vậy muối là FeSO4.7H2O.
Câu II. (3,0 điểm)
1. A1 và A2 là hợp chất của Na, trong phân tử chỉ chứa hai nguyên tố và đều có hàm lượng Na là 58,97%
theo khối lượng. A1 là chất khử mạnh còn A2 là chất oxi hóa mạnh. A1 phản ứng với dung dịch KMnO4 trong H2SO4 loãng tạo nên chất rắn màu vàng nhạt B1. Phản ứng tương tự của A2 với KMnO4 tạo nên khí
không màu B2. Biết B1 và B2 là đơn chất của hai nguyên tố cùng nhóm trong bảng tuần hoàn các nguyên
tố hóa học.
a) Xác định A1, A2, B1, B2 và viết các phương trình phản ứng.
b) Tìm các chất từ C1 đến C5 và D1 đến D4 trong sơ đồ chuyển hóa sau. (Không cần viết phương trình phản ứng)
C4
A2, t0C H2O B2, xt, t0C
Ca(OH)2
C2 D3 D1 0 tC → C1 C3 C4 D2 D4
D5
Cho biết các hợp chất từ D1, D2, D3 và D4 đều có 1 nguyên tử S trong công thức hóa học và đều có hàm
lượng S là 26,67% theo khối lượng.
2. Cho 12,8 gam bột lưu huỳnh phản ứng với 41,4 gam K2CO3 ở nhiệt độ cao thu được 6,72 lít khí E1 (ở đktc) và hỗn hợp rắn X chỉ gồm hai muối E2 và E3. Biết muối E2 và nguyên tố kali lần lượt chiếm 53,66% và 57,07% khối lượng của X. Muối E2 tạo nên từ hai nguyên tố. Khối lượng mol của E3 nhỏ hơn 200 g/mol.
Xác định E1, E2, E3 và viết phương trình phản ứng xảy ra.
3. Thêm từ từ dung dịch Y chứa AlCl3 0,3 M và HCl 0,2 M vào 100 ml dung dịch NaOH 1,54 M. Tính thể tích dung dịch Y trong các trường hợp sau:
a) Kết tủa trắng bắt đầu xuất hiện.
b) Lượng kết tủa trắng lớn nhất.
c) Sau khi phản ứng kết thúc, thu được 1,638 gam kết tủa.
GIẢI
1.
a) Xác định A1, A2, B1, B2 và viết các phương trình phản ứng:
- A1 là hợp chất của Na, trong phân tử chỉ chứa hai nguyên tố; có hàm lượng Na là 58,97% theo khối lượng; A1 là chất khử mạnh, phản ứng với dung dịch KMnO4 trong H2SO4 loãng tạo nên chất rắn màu vàng nhạt B1
A1 là Na2S; chất rắn màu vàng B1 là S.
- A2 là hợp chất của Na, trong phân tử cũng chứa hai nguyên tố và có hàm lượng Na cũng là 58,97% theo
khối lượng. A2 là chất oxi hóa mạnh, phản ứng của A2 với KMnO4 tạo nên khí không màu B2. Mà B1 và
B2 là đơn chất của hai nguyên tố cùng nhóm trong bảng tuần hoàn các nguyên tố hóa học.
A2 là Na2O2, B2 là O2.
- Các phương trình hóa học xảy ra:
5Na2S + 2KMnO4 + 8H2SO4 → 2MnSO4 + 5S + K2SO4 + 5Na2SO4 + 8H2O
5Na2O2 + 2KMnO4 + 8H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 5Na2SO4 + 8H2O
b) Tìm các chất từ C1 đến C5 và D1 đến D4 trong sơ đồ chuyển hóa:
C1 C2 C3 C4 C5
SO2 Na2SO3 SO3 H2SO4
D1 D2 D3 D4
CaSO3 KHSO3 NaHSO4 MgSO4
H2SO4
Na2O2, t0C
2.
Ca(OH)2
23 KCOS 41,412,8 n0,3mol;n0,4mol 13832 ====
12E 6,72
E1laø:n0,3mol 22,4 == CO
- Bảo toàn khối lượng ta có: mX = 12,8 + 41,4 - 0,3×44 = 41 gam
- Trong muối E2, E3 có chứa nguyên tố S
Muối E2 tạo nên từ hai nguyên tố E2 là K2S.
Vì muối E2 chiếm 53,66% khối lượng của X nên:
E2 m53,56%4121,9596gam =× =
E3 m4121,959619,0404gam = - =
=≈ ==
4S + 3K2CO3 0 tC → 2K2S + K2S2O3 + 3CO2
3. Gọi thể tích dung dịch Y cần lấy là V (lít), ta có: 3 AlClHCl n0,3V(mol);n0,2V(mol) ==
nNaOH = 0,154 (mol)
Các phản ứng hóa học có thể xảy ra:
HCl + NaOH → NaCl + H2O (1)
AlCl3 + 4NaOH → NaAlO2 + H2O + 3NaCl (2)
AlCl3 + 3NaAlO2 + 6H2O → Al(OH)3 + 3NaCl (3)
HCl + NaAlO2 + H2O → Al(OH)3 + NaCl (4)
3HCl + Al(OH)3 → AlCl3 + 3H2O (5)
Trong đó (1), (2) đồng thời; khi hết NaOH thì đến (3), (4) đồng thời; khi hết NaAlO2 thì đến (5).
a) Kết tủa trắng bắt đầu xuất hiện khi (1), (2) kết thúc
0,3V × 4 + 0,2V = 0,154 V = 0,11 (lít)
b) Lượng kết tủa trắng lớn nhất khi (3), (4) kết thúc
0,3V × 3 + 0,2V = 0,154 V = 0,14 (lít)
c) = 3Al(OH) n0,021(mol)
TH1: Chưa có (5): == 3 AlCl(3)HCl(4) n0,3y(mol);n0,2y(mol)
=× + = = 3Al(OH) n0,3y40,2y0,021(mol)y0,015
Vậy: Vdung dịch Y = 0,11 + 0,015 = 0,125 (lít).
TH2: Đã có (5): =× max = 3Al(OH) n0,01430,042(mol)
=− bò hoøa tan = 3Al(OH) n0,0420,0210,021(mol)
(5) nHCl = 0,063 (mol) V = 0,14 + 0,063 0,2 = 0,455 (lít).
Câu III: (1,5 điểm)
Cho 0,864 gam hỗn hợp kim loại Fe và Cu tác dụng với 250 ml dung dịch A chứa đồng thời Fe(NO3)3 và AgNO3, thu được m1 gam chất rắn X và dung dịch B. Cô cạn dung dịch B rồi nung cặn rắn trong bình kín (không có không khí) tới khối lượng không đổi, thu được 2,4 gam chất rắn Y và hỗn hợp khí
K(E2)S(E2) 21,9596 n0,2moln0,4mol;n0,2mol 110
2 KS
===
K(E3)S(E2)O(E3) n0,2mol;n0,2mol;n0,3mol
Công thức phân tử E3 có dạng (K2S2O3)n
Theo bài ra ME3 < 200 g/mol nên E3 có công thức phân tử là K2S2O3.
- Phương trình hóa học:
Z. Hấp thụ hoàn toàn Z vào nước tạo dung dịch C. Dung dịch này phản ứng vừa đủ với 130 ml dung dịch NaOH 0,5 M thu được hai muối với tỉ lệ mol 23:3. Biết các phản ứng xảy ra hoàn toàn.
a) Xác định phần trăm khối lượng các chất trong Y.
Fe 0,864gam250mldungdòchmgamraéndungdòch
33 1 32 Fe(NO)
B coâ caïnnungchaân khoâng
ñeán khoái löôïng khoâng ñoåi caënraén
2,4gamchaátraénY+hoãnhôïpkhíZ
* Z + H2O → dung dịch C taùc duïng vöøa ñuû 130 ml NaOH 0,5 M 2 muoái coù tæ leä mol 23:3 →
nNaOH = 0,13 × 0,5 = 0,065 (mol)
- Các phản ứng có thể xảy ra:
Fe + 2AgNO3 → 2Ag + Fe(NO3)2 (1)
Fe + 2Fe(NO3)3 → 3Fe(NO3)2 (2)
Cu + 2AgNO3 → 2Ag + Cu(NO3)2 (3)
Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + CuSO4 (4)
- Dung dịch B có thể gồm: Fe(NO3)2, Fe(NO3)3, Cu(NO3)2, AgNO3:
4Fe(NO3)2 0 tC
→ 2Fe2O3 + 8NO2 + O2 (5)
4Fe(NO3)3 0 tC
→ 2Fe2O3 + 12NO2 + 3O2 (6)
2Cu(NO3)2 0 tC → 2CuO + 4NO2 + O2 (7)
2AgNO3 0 tC → 2Ag + 2NO2 + O2 (8)
- Hỗn hợp khí Z gồm: NO2, O2:
4NO2 + O2 + 2H2O → 4HNO3 (9)
2NO2 + H2O → HNO3 + HNO2 (10)
HNO2 + NaOH → NaNO2 + H2O (11)
HNO3 + NaOH → NaNO3 + H2O (12)
- Thứ tự các phản ứng có thể xảy ra như sau:
Fe + 2AgNO3 → 2Ag + Fe(NO3)2 (1)
Fe + 2Fe(NO3)3 → 3Fe(NO3)2 (2)
Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + CuSO4 (4)
Hoặc:
Fe + 2AgNO3 → 2Ag + Fe(NO3)2 (1)
Cu + 2AgNO3 → 2Ag + Cu(NO3)2 (3)
Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + CuSO4 (4)
Trường hợp 1: Dung dịch B có Fe(NO3)2: a (mol), Cu(NO3)2: b (mol), có thể Fe(NO3)3 dư: c (mol)
Theo các phương trình (5), (6), (7): 22 NOO2 n4nNOseõluoândösauphaûnöùng(9) > 32 NaNONaNO
Goïinx(mol),ny(mol)xy0,50,130,065(mol)
Maø
x23 y3
x0,0575mol,y0,0075mol 0,05
nxy0,05750,00750,065(mol);n0,0125(mol) 4
Bảo toàn nguyên tố Nitơ: 2a + 2b + 3c = 0,065 mol (*)
Dựa vào các phương trình (5), (6), (7): 4Fe(NO
2Fe
+ 8NO2 + O2 (5)
= 2,4 (gam) (**)
nO = a 4 + 3c 4 + b 2 = 0,0125 (mol) (***)
Giải (*), (**), (***): a = 0,015, b = 0,01, c = 0,005.
+× == ×
=
(0,0150,005)160 %m.100%66,67% 22,4 %m33,33%
23FeO CuO
nCuO = b = 0,01 (mol) mCuO = 0,65 (gam) mFe (ban đầu) = 0,864 - 0,64 = 0,224 (gam)
=+−=
=−×= ==
==
0,224 nac0,016(mol) 56 n0,0650,01630,017mm1,836(gam). C0,064M;C0,068M.
33 3 33 3
Fe(NO) AgNO Ag1 M(Fe(NO)M(AgNO)
Trường hợp 2: Dung dịch B có AgNO3 dư a (mol), Fe(NO3)2: b (mol), Cu(NO3)2: c (mol), Fe(NO3)3 chưa phản ứng: d (mol)
2 2NOO abc3d na2b2c3d(mol);n(mol) 2424 =+++=+++
3 2HNOHNO na2b2c3dnab =+++>=−+
2NOO 0,05 nxy0,05750,00750,065(mol);n0,0125(mol) 4 =+=+===
2
Ta có hệ phương trình:
a2b2c3d0,065 +++=
abc3d 0,0125 2424 +++=
108a80b80c80d2,4 +++=
56a64c0,864 +=
Hệ vô nghiệm.
Trường hợp 3: Dung dịch B có Fe(NO3)2:
Ta có: 3 oxit NO n0,065(mol);m2,6(gam) == saét (III) Loại.
Trường hợp 4: Dung dịch B có Fe(NO3)2: a (mol), Cu(NO3)2: b (mol)
2a + 2b = 0,065; 80a + 80b = 2,4 vô nghiệm.
Câu IV: (2,5 điểm)
1. Tương tự như metan, các ankan (CnH2n+2) phản ứng với khí clo khi chiếu sáng tạo ra cloankan
(CnH2n+2-xClx) bằng cách thay thế nguyên tử H bằng nguyên tử Cl (gọi là phản ứng clo hóa).
a) Vẽ công thức cấu tạo của các sản phẩm có công thức phân tử C3H6Cl2 từ phản ứng clo hóa C3H8.
b) Khi clo hóa ankan G1 và G2 có cùng công thức phân tử C5H12, G1 chỉ cho một sản phẩm còn G2 cho
ba sản phẩm đều có công thức phân tử C5H11Cl. Vẽ công thức cấu tạo của G1, G2 và các sản phẩm này.
2. Anken mạch hở là các hợp chất có công thức phân tử CmH2m, chứa liên kết đôi C=C trong phân tử. Dãy hợp chất này thể hiện tính chất hóa học đặc trưng tương tự etilen như phản ứng cộng Br2, phản ứng trùng
hợp.
a) Quá trình “bẻ gãy” các ankan có khối lượng phân tử lớn hơn tạo thành anken và ankan có khối lượng
phân tử nhỏ hơn gọi là quá trình “cracking” thường dùng trong hóa học dầu mỏ. Cracking ankan dưới
đây thu được C3H8 và hai anken mạch không phân nhánh G3, G4 có cùng công thức phân tử C5H10.
CH3
H3C H2C CH2 CH CH2 CH2 CH3 cracking → C3H8 + C5H10
- Vẽ công thức cấu tạo của hai anken G3 và G4.
- Phản ứng trùng hợp giữa hai anken G3 và G4 tạo nên polime T. Vẽ các công thức cấu tạo có thể có của đoạn mạch trong T tạo thành bởi sự liên kết một phân tử G3 và một phân tử G4
b) Tách loại nguyên tử H và nguyên tử Cl liên kết với hai nguyên tử C cạnh nhau trong cloankan tạo thành anken tương ứng. Khi tiến hành tách loại H và Cl từ hợp chất G5 có công thức phân tử C7H15Cl thì
chỉ thu được duy nhất sản phẩm G6 (C7H14). Biết rằng, G5 là một sản phẩm được tạo ra bởi phản ứng clo
hóa U (C7H16). G5 và U đều chứa ba nhóm CH3 trong phân tử. Vẽ công thức cấu tạo của G5 và G6.
G1: H3CC CH3 CH3
CH3
G2: CH3 - CH2 - CH2 - CH2 - CH3 CH3 - CH2 - CH2 - CH2 - CH3 + Cl2 askt
32222 CHCHCHCHCHCl→−−−−
3223 CHCHCHCHClCH+HCl
3223 CHCHCHClCHCH
2. a)
- Công thức cấu tạo của hai anken G3 và G4: CH3 - CH2 - CH2 - CH = CH2 và CH3 - CH2 - CH = CH - CH3
- Phản ứng trùng hợp giữa hai anken G3 và G4 tạo thành polime T. Các công thức có thể có của đoạn mạch trong T tạo thành khi kết hợp một phân tử G3 và một phân tử G4:
b) G6: G5: U:
Câu V. (1,5 điểm)
Axit malic (hình bên) có trong thành phần quả xanh như táo, nho, anh đào... và được dùng làm chất phụ gia thực phẩm để tạo hương vị và bảo quản. Axit malic chứa hai nhóm cacboxyl và một nhóm OH trong phân tử nên thể hiện tính chất hóa học của cả ancol và axit. Khi đun nóng axit malic trong ancol etylic có mặt axit sunfuric thì thu được các chất H1, H2 và H3 trong đó H1 không làm sủi bọt dung dịch Na2CO3
H2 và H3 đều chứa 44,44% khối lượng cacbon trong phân tử. Mặt khác, đun nóng axit malic trong sự có
mặt của axit sunfuric thì thu được ba sản phẩm H4, H5 và H6 đều làm sủi bọt dung dịch Na2CO3. Chất
H4 (có vòng 6 cạnh) chứa 55,17% khối lượng oxi trong phân tử. H5 và H6 đều chứa 38,40% khối lượng cacbon trong phân tử. Vẽ công thức cấu tạo của các chất từ H1 đến H6.
GIẢI
- Khi đun nóng axit malic trong ancol etylic (C2H5OH) có mặt axit sunfuric thì thu được các chất H1, H2
và H3 trong đó H1 không làm sủi bọt dung dịch Na2CO3 H1 có công thức cấu tạo là:
Axit malic:
H2 và H3 đều chứa 44,44% khối lượng cacbon trong phân tử Công thức phân tử của H2, H3 là
C6H10O5.
Công thức cấu tạo H2:
Công thức cấu tạo H3:
- Đun nóng axit malic trong sự có mặt của axit sunfuric thì thu được ba sản phẩm H4, H5 và H6 đều làm
sủi bọt dung dịch Na2CO3 Trong phân tử H4, H5 và H6 chứa nhóm chức cacboxylic hoặc anhiđrit axit.
- Chất H4 (có vòng 6 cạnh) chứa 55,17% khối lượng oxi trong phân tử Công thức phân tử H4 là C8H8O8
Công thức cấu tạo H4 là:
- H5 và H6 đều chứa 38,40% khối lượng cacbon trong phân tử Công thức phân tử H5, H6 là C8H10O9
Công thức cấu tạo của H5:
Công thức cấu tạo của H6:
